Практика гистолога
|
|
|
|
Алгоритмы описания микропрепаратов
Для большей части начинающих судебно-медицинских экспертов гистологических отделений значительное затруднение вызывает описание микропрепаратов, выявленных в них патологических изменений. Для облегчения этого процесса, помощи в морфологической диагностике созданы предложенные Вашему вниманию алгоритмы описаний микропрепаратов внутренних органов с примерами описания ряда из них, приведением практической микрофотографии.
Представлены алгоритмы, фототаблицы и примеры описания микропрепаратов головного мозга, сердца, лёгких, печени, почек, селезёнки, поджелудочной железы, щитовидной железы, надпочечников, клеточной реакции в мягких тканях на повреждение, альгологического исследования (на планктон).
Авторский коллектив будет благодарен за Ваши предложения, совместное рассмотрение спорных вопросов. Пригашаем к сотрудничеству.
В специальной литературе приводятся немногочисленные схемы и алгоритмы описания микропрепаратов. Приведём отдельные из них.
А.В. Пермяков, В.И. Витер, В.Ю. Толстолуцкий. Основы судебно-медицинской гистологии: Учебное пособие. - Ижевск, 1994. - С. 9.
СХЕМА ОПИСАНИЯ МИКРОПРЕПАРАТОВ
1. Под малым увеличением микроскопа делается общий обзор препарата: определяется орган или ткань, отмечается, сохранена ли их структура или она нарушена, описывается состояние капсулы органа, паренхимы, стромы. Затем обращается внимание на состояние сосудов (их стенки, просвет, наполнение кровью, пропитывание стенки плазмой, миграция форменных элементов крови, их краевое стояние), периваскулярную ткань, наличие в ней отёка, воспалительной реакции и т.д. В ряде случаев целесообразно раздельно описывать состояние артерий вен, капилляров.
2. Для описания под большим увеличением выбираются наиболее изменённые участки тканей. Описание их производится в том же порядке, что и описание под малым увеличением. Описание их производится в том же порядке, что и описание под малым увеличением. Заостряется внимание на наличии (отсутствии) изменённой капсулы органа, состоянии сосудов в ней. Детально описываются клетки паренхимы, состояние оболочки и цитоплазмы клеток, их ядер, отношение к красителям, наличие включений в клетках, их взаимосвязь, правильность образования клетками паренхимы в тех или иных структурах.
При описании стромы обращается внимание на характер волокнистых структур, клеточный состав соединительной ткани, наличие (отсутствие) отёка, кровоизлияний, воспаления, включений (в том числе и инородных). Описываются под большим увеличением сосуды (раздельно артерии, вены, капилляры), отмечается состояние всей стенки и отдельных её слоёв, характер содержимого просвета сосуда.
При описании полого органа или кожи как под малым, так и пол большим увеличением, даётся послойная характеристика органа. Описание железистых структур начинается с характеристики клеточных элементов, входящих в состав железы. Описывается просвет железистых структур. Раздельно описываются выводные протоки, как мелкие, так и крупные, затем содержимое их просветов, состояние сосудов.
Не следует в описательной части пользоваться терминами, характеризующими диагноз.
3. По результатам описательной части подводится итог в виде выводов, заключения или диагноза.
Богомолов Д.В., Богомолова И.Н. «Алгоритм судебно-гистологического исследования» / Методические рекомендации. - Москва, 2010. - 14с.
ФГУ «РЦСМЭ Минздравсоцразвития России».
Методические рекомендации предназначены для судебно-медицинских экспертов отделов экспертизы трупов и гистологических отделений Бюро судебно-медицинской экспертизы.
Авторы сайта позволили себе отдельные моменты методических рекомендаций проиллюстрировать микрофотографией.
ВВЕДЕНИЕ
Алгоритм судебно-гистологического исследования, предназначенный для судебно-медицинских экспертов, позволяет объективизировать и значительно ускорить процесс судебно-гистологического исследования, что необходимо для качественного и полноценного решения вопросов, поставленных судебно-следственными органами перед судебно-медицинскими экспертами.
Данный алгоритм позволяет унифицировать процесс изъятия биологических материалов для судебно-гистологического исследования, приготовления гистологических препаратов их анализа, значительно ускорить выполнение судебно-гистологических исследований и обеспечить максимальную объективность результатов, достижимую на современном уровне науки.
Данный алгоритм впервые обеспечивает внедрение в экспертную практику принципов доказательной медицины и стандартизацию судебно-гистологических исследований, что является основным условием для сопоставления данных, полученных разными экспертами, оценки этих данных экспертами-танатологами, членами экспертных комиссий и представителями судебно-следственных органов, а также для проверки качества работы судебно-медицинских гистологов.
Применение алгоритма вместе с современным программно-аппаратным комплексом позволит документировать результаты исследований для нужд следственных органов, учебно-методической и научно-исследовательской работы, производить обмен информацией между судебно-медицинскими учреждениями с целью проверок и консультирования, снизить влияние токсических веществ, используемых для изготовления гистологических препаратов, на здоровье сотрудников, обеспечить экономию расходных материалов.
Алгоритм рекомендован к применению при первичном судебно-медицинском исследовании трупа с необходимостью судебно-гистологического исследования материала (для уточнения характера и давности патологического процесса, прижизненности и давности повреждений, характеристики травмирующего фактора, варианта танатогенеза, темпа умирания и др.).
Также возможно использование алгоритма при производстве дополнительных и комиссионных судебно-медицинских экспертиз, включающих первичные и повторные исследования гистологических материалов.
МАТЕРИАЛЬНО-ТЕХНИЧЕСКОЕ ОБЕСПЕЧЕНИЕ
СУДЕБНО-ГИСТОЛОГИЧЕСКОГО ИССЛЕДОВАНИЯ
(в РЦ СМЭ апробировано и используется оборудование фирмы Leica)
1. Контейнеры для фиксации биопсийного и аутопсийного (биологического) материала.
2. Тканевый процессор карусельного типа Leica TP 1020. Лёгок в управлении, обязательное требование - наличие отдельного помещения и вытяжки (возможен программируемый ночной режим работы - отсроченный старт). Тканевый процессор замкнутого типа Leica ASP 300 (200) имеет существенное достоинство по сравнению с карусельной станцией - более высокое качество проводки, не предъявляет дополнительных требований (вытяжки) для помещений; вместе с тем имеет особенность - более высокие требования к качеству реактивов (в первую очередь, чистота парафина).
3. Система заливки парафинов Leica EG 1160.
4. Санный Leica SM 2000R или ротационный Leica RM 2235 микротом с держателем для ондноразовых и многоразовых ножей в комплекте с водяными банями.
5. Микротом - криостат Leica CM 1510.
6. Аппарат для автоматической окраски гистологических срезов Leica Autostainer XL (в комплекте с нагреваемой ячейкой).
7. Микроскоп проходящего света (светлое поле, тёмное поле, фазовый контраст, поляризация, флуресценция). Окуляры 10х, объективы 5х, 10х, 20х, 40х, 100х (масляная иммерсия). Система освещения микроскопа на базе галогеновой лампы 100Вт. Микроскоп должен быть оснащен цифровой камерой высокого разрешения и программным обспечением для количественного анализа изображений. В связи с высокой насыщенностью микроскопа методами исследования, целесообразен микроскоп с возможностью автоматизированного переключения методов Leica DM 4000 или с механическим переключением Leica DM 2500. Этим же требованиям отвечают оборудование фирм Nicon, Olympus, Микром и др.
Собственно алгоритм включает в себя ряд этапов, последовательное выполнение которых гарантирует качество результата.
В процессе изъятия материала для судебно-гистологического исследования, помимо действующих нормативных документов, следует руководствоваться следующими рекомендациями.
ОТБОР И ФИКСАЦИЯ МАТЕРИАЛА
Из тканей и органов трупа изымают фрагменты размерами: толщиной до 1см, площадью не менее 1,5х1,5см. Для качественной фиксации достаточно ограничения размеров в одном измерении. Информативность исследования при малом количестве материала снижается. Стенки полых органов, плоскостных образований, кожи помещают в раствор фиксатора на картонной положке. Мелкие и маркированные объекты помещают в марлю или специальные контейнеры.
Фиксация материала осуществляется путём погружения кусочков органов и тканей в нейтральный раствор 10% формалина при комнатной температуре. Объём фиксатора не менее чем в 20 раз должен превышать объём исследуемых тканей. На поверхность фиксируемых кусочков помещают марлевую или тканевую салфетки во избежание высыхания всплывающих кусочков лёгких.
При необходимости срочного исследования проводят ускоренную фиксацию в термостате +60°С в течение 1 часа, после чего можно производить вырезку, в процессе которой материал кладут в подогретый формалин. Если вырезку решено отложить, материал сохраняют в 10% нейтральном формалине вне термостата сколь угодно долгое время. При наличии аутолиза ускоренную фиксацию проводят в термостате при темературе +37°С, продолжительность экспозиции - 1,5 - 2 часа (в зависимости от характера ткани или органа).
Частицы высохших тканей и кусочки от мумифицированных трупов, трупов в состоянии торфяного дубления или жировоска направляются на судебно-гистологическое исследование в нефиксированном виде.
При заборе материала от трупов во всех случаях необходимо изымать кусочки головного мозга, сердца, лёгкого, печени и почки. Изъятие остального материала производят в зависимости от цели исследования.
При наличии макроскопически видимых повреждений и изменений, кусочки изымают с их границы.
Изъятие кусочков органов и тканей с подозрением на кровоизлияния осуществляют исключительно при необходимости уточнения характера, определения давности и прижизненности процесса.
При изъятии более 1 кусочка мягких тканей или необходимости выявления изменений в определённых участках внутренних органов, производят из маркировку - на этикетке путём указания порядкового номера, наносимого графитовым карандашом на материале, устойчивом к действию фиксатора, который вместе с кусочком помещают в марлевую салфетку.
При отсутствии макроскопически видимых повреждений и патологических изменений внутренних органов производят отбор следующих кусочков:
- головного мозга (коры из переднецентральной извилины, подкорковых ядер из области бледного шара, поперечный срез продолговатого мозга выше олив);
- миокарда (левого желудочка и межжелудочковой перегородки (МЖП)),
- лёгких (из нижней доли и прикорневого отдела вне зоны гипостаза),
- правой доли печени (на отдалении от ворот и капсулы),
- почки (содержащий кору, пирамиды и стенку чашечки),
- надпочечников (с захватом всех слоёв),
- фрагмента щитовидной железы.
Важно учитывать предполагаемый вид смерти при изъятии материала. Например, при странгуляционной асфиксии необходимо изымать фрагмент странгуляционной борозды на всю глубину ткани вплоть до мышечной ткани с захватом прилежащих малоизменённых тканей. В случаях скоропостижной смерти помимо изменённых участков миокарда и фрагментов венечных артерий необходимо изымать фрагменты правого и левого желудочка, МЖП. При ЧМТ нужно забирать фрагменты поражённых мягких тканей, мозговых оболочек и ткани мозга единым блоком, при этом не забывая взять фрагмент пограничной с повреждением и интактной для составления адекватного суждения о природе поражения.
Сходным образом нужно изымать материал при иных повреждениях, не забывая о необходимости изъятия пограничной и интактной зон по отношению к зоне патологических изменений.
В направлении материала на судебно-гистологическое исследование указывают: перечень изъятых объектов, наименование кусочков, количество кусочков (общее и по органам), способ фиксации, цель судебно-гистологического исследования, макроскопические данные, предварительного судебно-медицинского диагноза.
Окончательная вырезка материала для гистологического исследования во избежание конфликтных ситуаций выполняется врачом - судебно-медицинским экспертом, производившим исследование трупа.
При наличии повреждений и патологических изменений в срезе должна присутствовать также визуально неизменённая ткань.
В срезах должны присутствовать все структуры исследованного органа (в срезах полых органов и полостных образований должны присутствовать все слои их стенок, в срезах кожи - все её слои и подкожная основа).
В препаратах миокарда должны преобладать продольные срезы мышечных волокон.
ИЗГОТОВЛЕНИЕ ГИСТОЛОГИЧЕСКИХ ПРЕПАРАТОВ
Изготовление срезов осуществляется путём резки блоков, залитых в парафиновые среды. Изготовление срезов методом заморозки производится исключительно при необходимости проведения окрасок, используемых только на замороженных срезах. Целлоидиновый метод заливки является предпочтительным только при исследовании костной ткани и миокарда.
Современные методики проводки позволяют получать препараты уже через несколько часов после завершения фиксации материала.
Например, ускоренную спирто - хлороформную проводку производят по следующей схеме:
Все компоненты батареи для проводки должны находиться в термостате при +60°С.
- Вырезанный материал, находящийся в растворе формалина, без промывки помещают в 1-й спирт 50° и выдерживают в термостате 20 мин.
- Материал переносят во 2-й спирт 70° и выдерживают в термостате 20мин.
- Материал переносят в 3-й спирт 80° и выдерживают в термостате 20мин.
- Материал тщательно промокают и переносят в 4-й спирт 96° и выдерживают в термостате 20мин.
- Материал переносят в смесь спирт 96° - хлороформ в соотношении 1:1 и выдерживают в термостате 20мин.
- Отжав кусочки, материал переносят в хлороформ и выдерживают в термостате 20мин.
- Материал переносят в «парафиновую кашу» (смесь парафина с хлороформом) и выдерживают в термостате 20мин.
- Материал переносят в парафин 1 и выдерживают в термостате 20мин.
- Материал переносят в парафин 2 и выдерживают в термостате 20мин.
- Материал переносят в парафин 3 и выдерживают в термостате 20мин.
- Заливка в блоки, после чего препараты изготовляют обычным способом.
Ускоренная проводка требует точного соблюдения срока переноса образцов из одного раствора в другой. Для его обеспечения целесообразно использовать автоматический процессор обработки (проводки) тканей для гистологии. Достоинством современных аппаратов являются также системы контроля вредных испарений.
Толщина парафиновых срезов не должна превышать 5-7 мк, что требует использования современных микротомов.
Авторы сайта продемонстрируют чёткую картину в тонких срезах; стёртость, размытость картины в толстых срезах, что значительно влияет на качество микрофотографии.
|
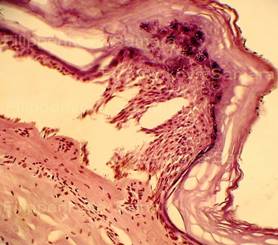
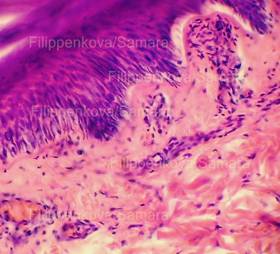
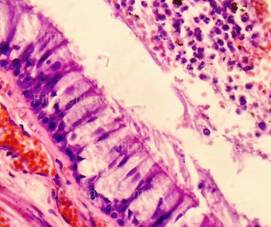
Рис. 1, 2. Кожа с тонким эпидермисом при типичной электрометке. Сотоподобные дефекты в роговом слое. Выраженное (вплоть до нитевидного) вытягивание в длину ядер клеток базального слоя эпидермиса, вертикальная и косо-вертикальная их ориентация. Очаговые расщепления, разрывы эпидермиса. Тонкие срезы равномерной толщины. Окраска: гематоксилин и эозин. Увеличение х100 и х250. |
|
|
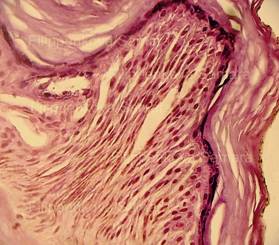
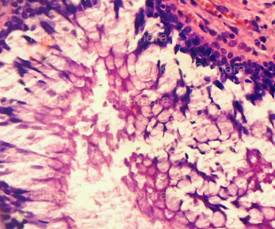
Рис. 3. Выраженное (вплоть до нитевидного) вытягивание в длину ядер клеток базального слоя эпидермиса, вертикальная и косо-вертикальная их ориентация, участки с картиной фигур в виде «частокола». Толстый срез неравномерной толщины. Окраска: гематоксилин и эозин. Увеличение х100 и х250. |
|
Обязательной является обзорная окраска гистологических срезов всех исследуемых органов и тканей гематоксилином-эозином. Дополнительно допускается использование всех описанных в литературе гистологических и гистохимических методик.
Дополнительные окраски по возможности следует назначать сразу после вырезки.
При переломах длинных трубчатых и плоских костей, размозжениях мягких тканей обязательной является окраска замороженных срезов лёгких суданом.
|
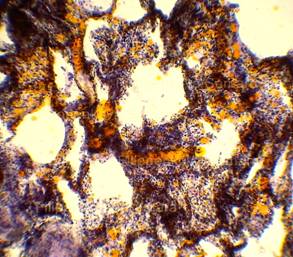
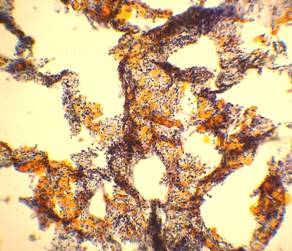
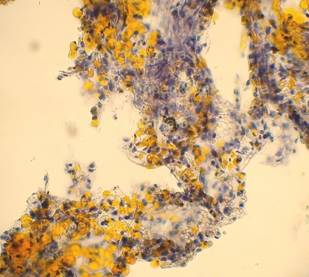
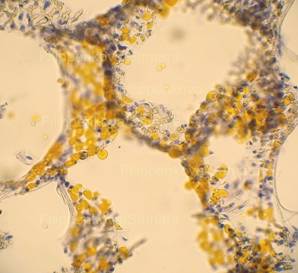
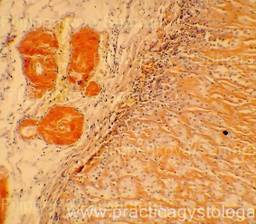
Рис. 4, 5. Выраженная жировая эмболия лёгких. Просветы большого количества капилляров межальвеолярных перегородок, артерий и вен обтурированы оранжево-жёлтыми жировыми эмболами. Сопутствует явление жирового эмболизма (в ряде капилляров мелкие жировые капли оранжево-жёлтого цвета, размерами менее 8 мкм). Окраска: судан III. Увеличение х100. Иллюстрация авторов сайта. |
|
|
Рис. 6, 7. Выраженное явление жирового эмболизма (просветы большинства межальвеолярных капилляров с наличием гомогенных жировых капель оранжево-жёлтого цвета, размерами менее 8 мкм). Окраска: судан III. Увеличение х250. Иллюстрация авторов сайта. |
|
При исследовании парадуральных гематом обязательно использование окраски по Перлсу.
При субарахноидальных кровоизлияниях сосуды мягких мозговых оболочек следует окрашивать на эластические волокна (по Вейгерту, орсеином или по иной методике).
При переживании ЧМТ и в других ситуациях, чреватых формированием респираторного дистресс-синдрома надлежит производить окраску срезов лёгких на фибрин.
ПОРЯДОК ИССЛЕДОВАНИЯ И ОПИСАНИЯ ГИСТОЛОГИЧЕСКИХ ПРЕПАРАТОВ
1. Идентификация органа (при возможности его части) или ткани, представленных в срезах. При наличии изменений, делающих идентификацию органа невозможной (аутолиз, гниение, опухолевый рост и т.д.), его определяют по общепринятым классификациям органов и тканей (например, полый орган, артерия мышечно-эластического типа, железистая ткань тубулярного строения, поперечно-полосатая мышца и т.д.).
2. Выявление и описание изменений обычного гистологического строения органа или ткани и реакции на эти изменения со стороны окружающих тканей.
Перечень нарушений гистоархитектоники, подлежащих обязательному выявлению: трупные изменения, пороки развития, патологическая незрелость органов новорожденных, опухолевый рост, массивные некрозы, гнойное расплавление, патологические разрывы и изъязвления, гранулематозные, склеротические и цирротические процессы, кисты. Признаки компрессии, механических и термических повреждений, воздействия электричества, наличие в тканях инородных тел также относят к нарушениям гистологического строения.
Специфичными для отдельных органов нарушениями гистоархитектоники являются:
- для лёгких - бронхоэктазы,
- для сердца - хаотичное расположение кардиомиоцитов, фиброз эндокарда, изменения клапанов,
- для печени - дископлексация балок и формирование септ различного типа,
- для надпочечников - атрофия или гипертрофия их коры и мозгового вещества, перестройка коры и её тип.
3. Нарушения гистоархитектоники подлежат описанию в первую очередь. При отсутствии этих нарушений подлежит описанию нормальное строение, а также состояние крови в сосудах и их кровенаполнение, состояние и изменения стенок сосудов, стромы, состояние и изменения паренхимы и её клеточных элементов.
4. При оценке кровенаполнения тканей и органов сосуды разного типа (артерии, капилляры, вены) описывают раздельно.
Например, в артериях большинстве случаев преобладает малокровие, в венах (даже при кровопотере) - полнокровие. Наиболее информативно кровенаполнение капилляров.
5. При изучении и описании сосудов во всех внутренних органах отмечают наличие патологического содержимого и состояние крови в их просветах, состояние клеток эндотелия, всех слоёв стенок и периваскулярной соединительной ткани. Если сосуды мелкие, достаточно указать наличие тех или иных дистрофий, плазматического пропитывания, некротических изменений, воспалительной инфильтрации и склроза. После описания сосудов отмечают наличие кровоизлияний (с указанием их размеров, локализации, а также чёткости контуров эритроцитов и их окраски) и отёка, который в силу механизмов своего развития также начинается периваскулярно.
Критерием формирования эритроцитарного тромба служит неразличимость контуров эритроцитов в его центре при отсутствии гемолиза в соседних сосудах. Молодой фибрин выглядит как слабо эозинофильные сетчатые массы, зрелый - как ярко эозинофильные гомогенные конгломераты.
Синдром диссеминированного внутрисосудистого свёртывания диагностируют при наличии микротромбов не менее чем в 3-х органах.
6. Исследование состояния стромы должно включать выявление её дистрофических изменений, воспалительных инфильтратов (с указанием их состава, локализации и распространенности) и склеротических процессов, а также липоматоза - разрастания жировой ткани. Выраженный липоматоз стромы сердца и поджелудочной железы при отсутствии ожирения и в сочетании с другими признаками свидетельствует о хронической алкогольной интоксикации и нарушении функции органов.
7. Анализируя состояние паренхимы, следует определять распространённость и конкретный вид дистрофических, некротических и регенерационных изменений клеток.
Согласно современной классификации, конкретный диагноз паренхиматозной дистрофии представляет собой выбор одного или нескольких следующих вариантов: жировая, гидропическая или гиалиново-капельная дистрофия (поскольку углеводные редки), а также липофусциноз и гемосидероз.
|
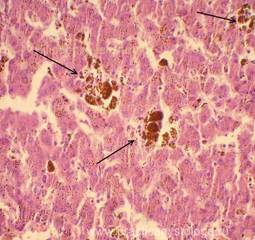
Рис. 8, 9. Выраженный диффузный гемосидероз лёгких с компактными скоплениями буро-коричневых гемосидерофагов в просветах альвеол, склерозом межальвеолярных перегородок, их круглоклеточной инфильтрацией. Окраска: гематоксилин-эозин. Увеличение х250. Иллюстрация авторов сайта.
|
|
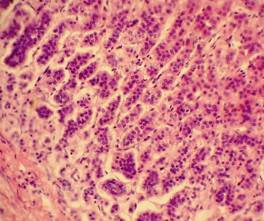
|
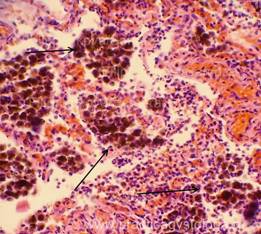
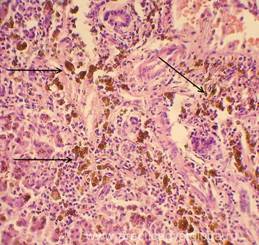
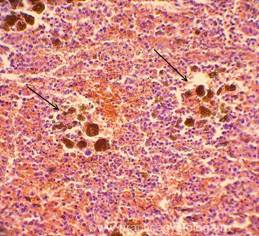
Рис. 10, 11. Печень. ВИЧ - инфицированный мужчина, 25 лет. Очагово-диффузный гемосидероз. Скопления зёрен буро-коричневого гемосидерина в толще ткани, цитоплазме макрофагов (клеток Купфера) - стрелки. Окраска: гематоксилин-эозин. Увеличение х250, х400.Иллюстрация авторов сайта.
|
|
|
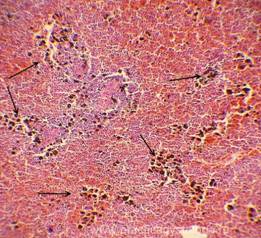
Рис. 12, 13. Гемосидероз селезёнки. Труп мужчины, 25 лет, ВИЧ - инфекция. На фоне неравномерного полнокровия красной пульпы, обеднения белой и красной пульпы лимфоцитами диффузно в ткани селезёнки расположены скопления гемосидерофагов и буро-коричневых зёрен внеклеточно расположенного гемосидерина. Окраска: гематоксилин-эозин. Увеличение х100, х250.Иллюстрация авторов сайта. |
|
Для жировой дистрофии характерны округлые вакуоли с чёткими контурами, для гидропической - неправильной формы с неровными и нечёткими очертаниями.
|
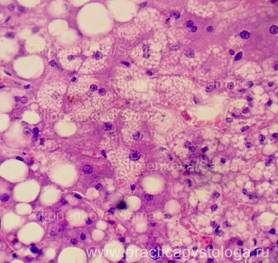
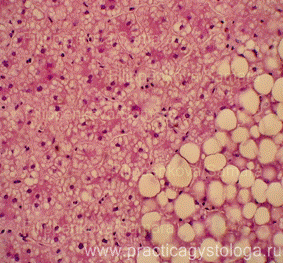
Рис. 14, 15. Печень. Сочетание мелко - и крупнокапельной жировой дистрофии, гидропической дистрофии. Окраска: гематоксилин-эозин. Увеличение х250. Иллюстрация авторов сайта. |
|
Недопустимо использовать неологизмы или ограничиваться лишь указанием группы, к которой относится наблюдаемый вид дистрофии: «паренхиматозная дистрофия», «белковая дистрофия», просто «дистрофия» без каких-либо уточнений, «повреждения кардиомиоцитов», «выраженная» или «глубокая дистрофия». Понятия «мутное набухание» и «зернистая дистрофия» исключены из классификации патологических процессов, поскольку соответствующие изменения являются проявлением трупного аутолиза.
Наличие кариолизиса, кариопикноза или кариорексиса - признак уже не дистрофии и не некробиоза, а некроза клетки или её посмертного аутолиза. Диагностика некробиоза возможна только при электронной микроскопии, поэтому употребление данного термина судебно-медицинскими гистологами неправомочно.
Дискомплексация желёз, десквамация эндотелия мелких артерий и покровного эпителия, распространённые лизис ядер, потеря чёткости контуров и обесцвечивание эритроцитов в сосудах являются признаками трупного аутолиза.
8. При описании мозга обязательной является оценка состояния мозговых оболочек, отмечают изменения нейронов, нейроглии и нейропиля. В мозге возможно развитие нескольких видов отёка: периваскулярный, перинейрональный, периаксональный и отёк белого вещества. Кроме того, периваскулярный отёк может достигать степени деструктивного, приводя к формированию микрокист. Все эти формы имеют разное значение. Так, отсутствие периваскулярного отёка - признак очень быстрой смерти, например, при механической асфиксии и электротравме.
Основные виды изменений нервных клеток традиционно называют хроматолизом, набуханием, тяжёлыми и ишемическими изменениями, сморщиванием. В настоящее время дополнительно различают, во-первых, гипо - и гиперхромное состояние нейронов (варианты нормы с различным функциональным состоянием) и, во-вторых, формы гибели нервных клеток с кариопикнозом (пикноморфные нейроны) и кариолизисом. При наличии нескольких вариантов повреждений нейронов указывают, какой (какие) из них преобладают. Например, кариолизис и кариопикноз в 50-75% крупных нейронов ретикулярной формации продолговатого мозга - признак паралича дыхательного центра как непосредственной причины смерти, а субтотальный и тотальный кариолизис - проявление трупного аутолиза.
Кроме того, используются специальные названия для глиальной реакции на повреждение нейронов - сателлитоз и нейронофагия - и для особых видов дистрофии глиоцитов и белого вещества - демиелинизация, аксональные, зернистые, глиальные ибазофильные шары.
|
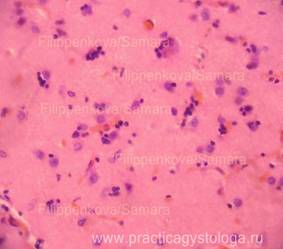
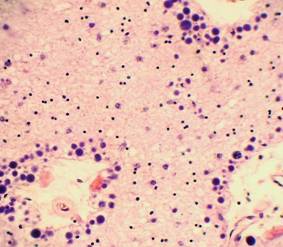
Рис. 16. Кора головного мозга с наличием карио - нейроцитолизиса. Скопления микроглии, несущей функцию фагов, вокруг погибших и погибающих нейроцитов. Окраска: гематоксилин-эозин. Увеличение х250. Иллюстрация авторов сайта. |
Рис. 17. Подкорковая область головного мозга. Мелкие сосуды с циркулярным утолщением стенок, их гомогенизацией за счёт умеренно выраженного плазматического пропитывания. Умеренное просветление периваскулярных пространств, выраженные периваскулярные «муфты» из гематоксилиновых (базофильных) шаров. Окраска: гематоксилин-эозин. Увеличение х250. Иллюстрация авторов сайта. |
9. При описании миокарда обязательна оценка состояния мышечных волокон (изменений ширины поперечников, ядер, саркоплазмы), при наличии фрагментации кардиомиоцитов - её распространённости.
Острые повреждения кардиомиоцитов классифицируются следующим образом: релаксация, контрактурные повреждения, миоцитолизис, зернистый и глыбчатый распад. Их выявление требует использования высококачественных микроскопов со светлым и тёмным поем, фазовым контрастом, интерференцией и поляризационным контрастом. Специфические виды дистрофий обнаруживаются также с помощью специальных окрасок.
|
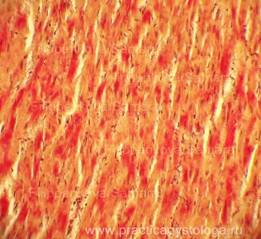
Рис. 18. На всей площади срезов обилие сливающихся друг с другом густо расположенных мелких очагов умеренной-выраженной фуксинофилии цитоплазмы кардиомиоцитов в виде небольших их участков, окрашенных в красный цвет на жёлто-зелёном фоне. Окраска: ГОФП-метод. Увеличение х250. Иллюстрация авторов сайта.
|
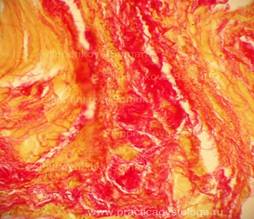
Рис. 19. Граница крупного очага выраженной фуксинофильной дегенерации миокарда в виде крупного участка миокарда, окрашенного в красный цвет на жёлто-зелёном фоне. Окраска: ГОФП-метод. Увеличение х100. Иллюстрация авторов сайта. |
|
Рис. 20. Диффузно в срезах на синем фоне расположены небольшие, средней величины и крупные группы набухших кардиомиоцитов с потерей поперечной исчерченности, пикнотичными или лизированными ядрами, в их цитоплазме очень мелкие (пылевидное ожирение), мелкие (мелкокапельное ожирение) и крупные (крупнокапельное ожирение) жировые капли оранжево-жёлтого цвета, на отдельных участках срезов полностью замещающие цитоплазму кардиомиоцитов. Окраска: судан III. Увеличение х250. Иллюстрация авторов сайта. |
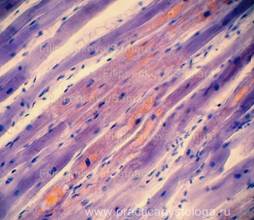
Рис. 21. Периваскулярный кардиосклероз ярко-красного цвета на буровато-жёлтом фоне. Окраска: по ван Гизону. Увеличение х250. Иллюстрация авторов сайта. |
Изменения миокарда, которые достоверно выявляются с помощью светового микроскопа при обзорных окрасках: это контрактурные повреждения второй степени (неравномерность окраски), волнообразная деформация, диссоциация и фрагментация кардиомиоцитов, а также кариолизис и липофусциноз. Последний отмечается практически у всех, но при некоторых интоксикациях (например, алкогольной) и заболеваниях он отличается особой выраженностью, которую следует отметить. Сочетание выраженного липофусциноза с атрофией паренхимы в сердце и печени - один из главных признаков смерти от лишения пищи.
|
Рис. 22-25. Липофусциноз миокарда. В цитоплазме большой части кардиомиоцитов преимущественно перинуклеарно наличие золотисто-жёлтого пигмента липофусцина (стрелки). Рис. 22, 23 - кардиомиоциты уменьшены в размерах (миокард женщины 97 лет). Рис. 24 - преобладает умеренно выраженная гипертрофия кардиомиоцитов, в верхнем правом углу - очаговая круглоклеточная (лимфоцитарная) инфильтрация. Окраска: гематоксилин-эозин. Увеличение х250 и х400. Иллюстрация авторов сайта. |
|
|
|
|
10. При изучении и описании лёгких оценивают воздушность паренхимы, наличие, локализацию и выраженность отёка, наличие в альвеолах фибрина и гиалиновых мембран, толщину межальвеолярных перегородок (чтобы не пропустить интерстициальную пневмонию или патологическую незрелость лёгких у младенцев), состояние бронхов (их просветов, стенок, эпителия).
|
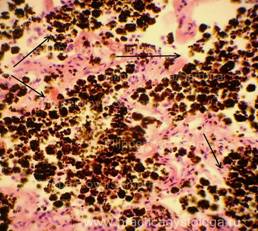
Рис. 26, 27. Картина острого гнойного эндобронхита на фоне резко выраженной гиперсекреции слизи в виде значительного набухания, просветления бокаловидных клеток. В отдельных полях зрения выброс гроздевидных скоплений слизистого секрета в просвет бронхов. Окраска: гематоксилин и эозин. Увеличение х400.Иллюстрация авторов сайта.
|
|
|
Рис. 28, 29. Межальвеолярные перегородки утолщены, с инфильтрацией макрофагами, гистиоцитами, лимфоцитами, сосуды в них полнокровны, в отдельных сосудах наличие криптококков. В просветах ряда альвеол на фоне отёчной жидкости видны скопления криптококков различной степени зрелости. Группы макрофагов с заполнением цитоплазмы криптококками. Окраска: гематоксилин и эозин. Увеличение х100, х250, х400. Иллюстрация авторов сайта.
|
|
|
|
|
|
Рис. 30, 31. Лёгкие новорожденного. Пневмопатия: дис - и ателектазы, гиалиновые мембраны. Очаговое умеренное венозно-капиллярное полнокровие. Лёгочная ткань с незначительной воздушностью за счёт преобладания частичного и полного её спадения. Межальвеолярные перегородки толстые, в ряде из них различима слабо выраженная лейкоцитарная инфильтрация. В большом количестве альвеол по ходу межальвеолярных перегородок отложения плотных эозинофильных бесструктурных масс (гиалиновые мембраны, стрелки). Бронхи с тотальной десквамацией мерцательного эпителия, просветы бронхов заполнена пластами слущенного эпителия. Окраска: гематоксилин-эозин. Увеличение х100 и х250. Стеклопрепараты предоставлены кафедрой судебной медицины Ижевской ГМА. Иллюстрация авторов сайта.
|
|
11. При изучении и описании печени обязательным является оценка состояния цитоплазмы гепатоцитов, печёночных балок, протоков. При вирусных инфекциях могут встречаться так называемые матово-стекловидные гепатоциты, а также цитоплазматические и внутриядерные включения, не классифицируемые по обычной схеме. В таких случаях следует указывать их размер, форму и цвет.
12. При описании почек обязательна оценка состояния клубочков, проксимальных канальцев, кровенаполнения коркового и мозгового слоёв по отдельности, наличия первичной мочи в капсулах клубочков. Обязательным является оценка толщины базальных мембран и общей клеточности клубочков.
|
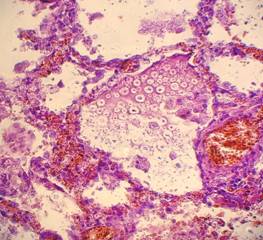
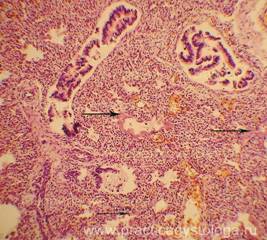
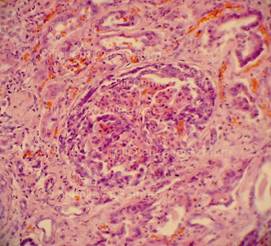
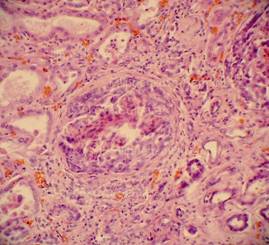
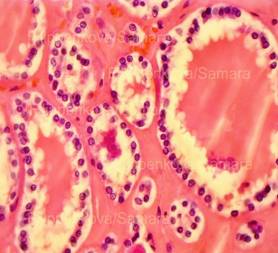
Рис. 32, 33. Почечные клубочки значительно увеличены в размерах, подкапсульное пространство практически отсутствует, сращения с почечного тельца с капсулой, пролиферация мезангиальных и эндотелиальных клеток. Очаговое выраженное капиллярно-венозное полнокровие с эритростазами, диапедезными микрогеморрагиями. Выраженный отёк, очаговая полиморфноклеточная инфильтрация стромы. Крупные группы канальцев в состоянии выраженной атрофии. Окраска: гематоксилин и эозин. Увеличение х250. Иллюстрация авторов сайта.
|
|
|
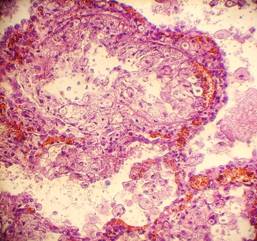
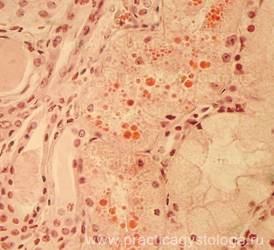
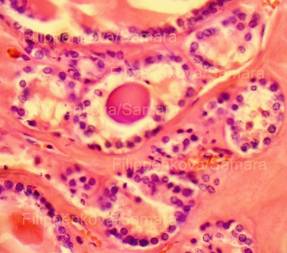
Рис. 34, 35. «Токсическая почка». Субтотальная выраженная и резко выраженная (вплоть до баллонной) гидропическая дистрофия эпителия канальцев (эпителиоциты значительно набухшие, с просветлением цитоплазмы, оттеснением ядер к базальной мембране), некроз групп эпителиоцитов. Часть канальцев с гиалиново-капельной дистрофией эпителия. Окраска: гематоксилин-эозин. Увеличение х250, х400. Стеклопрепарат предоставлен кафедрой судебной медицины Ижевской ГМА. Иллюстрация авторов сайта.
|
|
13. При описании поджелудочной железы раздельно оценивают состояние железистой ткани, эндокринного аппарата и протоков.
14. При описании эндокринных органов делается упор на их морфофунциональное состояние. В щитовидной железе определяют высоту эпителия фолликулов, наличие сосочков, яркость коллоида. В коре надпочечников наличие оптически пустых вакуолей представляет собой нормальное состояние, а снижение их количества является дистрофией, называемой делипоидизацией.
|
Рис. 36. Краевая вакуолизация коллоида (как признак усиления гормональной активности коллоида). Окраска: гематоксилин и эозин. Увеличение х250. Иллюстрация авторов сайта.
|
Рис. 37. Уплотнённый коллоид (как признак снижения гормональной активности коллоида). Окраска: гематоксилин и эозин. Увеличение х250. Иллюстрация авторов сайта. |
|
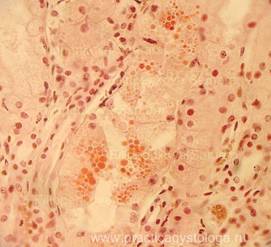
Рис. 38. Амилоидоз надпочечника. Отложение амилоида кирпично-оранжевого цвета по ходу сосудистых стенок, стромы надпочечника, в толще его капсулы. Окраска: Конго-красный. Увеличение х 100. Иллюстрация авторов сайта. |
Рис. 39. Фрагмент коркового слоя надпочечника в состоянии слабого кровенаполнения. Субтотальная выраженная делипидизация цитоплазмы адренокортикоцитов клубочковой и пучковой зон коры. Окраска: гематоксилин и эозин. Увеличение х 250. Иллюстрация авторов сайта. |
15. При изучении и описании препаратов кожи обязательным является оценка состояния всех слоёв эпидермиса, дермы, придатков кожи, сосудов дермы и подкожной клетчатки.
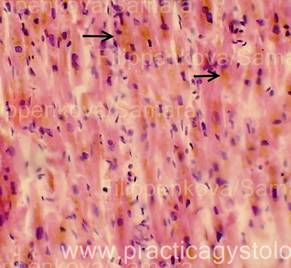
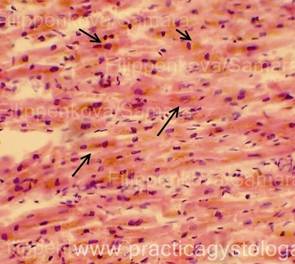
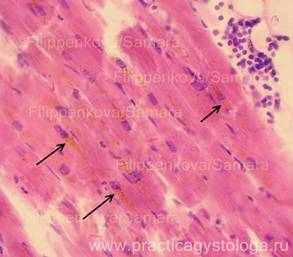
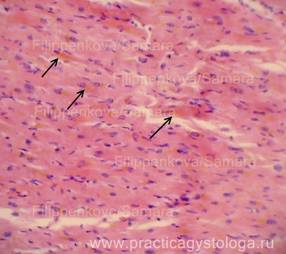
16. При изучении и описании кровоизлияний, повреждений во внутренних органах и мягких тканях описывают их расположение среди представленных структур, состояние эритроцитов, наличие и характер распределения элементов белой крови, выпадение фибрина (его цвет и оттенок - при селективной окраске), состояние сосудов микроциркуляции вокруг вен (вен и капилляров, артериол), наличие отёка, воспалительных, репаративных и других процессов.
Примечание авторов сайта.
Определение возраста фибрина по ОКГ (по Зербино Д.Д.).
Спектр окраски фибрина по методу ОКГ включает оранжевый, красный и фиолетовый цвета и переходные оттенки. Можно предположить, что фибрин, который окрашивается в желто-оранжевый цвет, является "молодым" (0-6 час). При более длительном существовании в организме фибрин приобретает красный цвет - это "зрелый" фибрин (6-24 час.) - он имеет оттенки от оранжевого-красного (6-12 - часовой фибрин) через ярко-красный (12-18 - часовой фибрин) до красно-фиолетового (18-21-часовой фибрин). «Старый» фибрин (более 24 час.) фиолетового цвета, который впоследствии переходит в серо-голубой (более 48 час). Такое деление до некоторой степени условно, так как зависит от фиксации, сроков приготовления красок, лечебных мероприятий у больного до наступления смерти. Однако оно дает возможность приблизительно указать время развития синдрома ДВС или образования тромба.
17. В целях объективизации применяют морфометрические исследования и фотоиллюстрирование с использованием аналоговых и цифровых камер, лицензированных программных продуктов анализа изображения. Кроме того, для большей наглядности в качестве иллюстраций можно использовать таблицы и диаграммы с результатами морфометрии различных гистологических структур, в том числе содержащие нормальные величины для сравнения, а также схемы, отражающие последовательность и взаимосвязь звеньев танатогенеза и влияние различных факторов на исход повреждения.
18. Оформление описательной части «Акта» («Заключения») судебно-гистологического исследования производят без использования терминов резюмирующего характера.
Оформление резюмирующей части исследования.
При наличии информации о вынесении Постановления на момент начала судебно-медицинского исследования трупа или вещественных доказательств формулируются выводы.
При отсутствии информации о вынесении Постановления резюмирующей частью акта является судебно-гистологический диагноз.
Выводы и судебно-гистологический диагноз формулируют с указанием нозологических форм и их основных проявления в патогенетической последовательности.
При отсутствии возможности формулирования резюмирующей части исследования по нозологическому и патогенетическому принципам допускается её фактографическое оформление, при котором в систематизированной последовательности приводят обнаруженные в органах и тканях изменения с указанием их локализации и выраженности.
Для облегчения интерпретации выявленных изменений и их использования для дальнейшей диагностики объединяют патогенетически связанные наборы симптомов, типичных для определённых причин и механизмов смерти, в синдромы. Примером такого подхода являются термины «синдром диссеминированного внутрисосудистого свёртывания», «стресс-синдром», «токсическая дистрофия печени», «токсический гепатит», «острый внутрисосудистый гемолиз», «геморрагический шок», «гемоглобинурийный нефроз», «геморрагический отёк лёгких» и т.д.
Выделять также синдромы острых дыхательных расстройств по типу общего или локального реактивного полнокровия, по шоковому типу (ишемия коры почек при полнокровии пирамид, неравномерное распределение крови, централизация или децентрализация кровообращения - в зависимости от фазы шока), по агональному типу (различной степени выраженности малокровие с неравнмоерным распределением крови).
При выявлении дистрофических, некротических, инфильтративных процессов в резюмирующей части акта указывают их локализацию, степень выраженности (начальные, очень слабые, слабые, умеренные, резко выраженные).
При выявлении жировой эмболии лёгких устанавливают её степень.
При установлении давности повреждений в резюмирующей части исследования указывают наличие и степень выраженности реактивных, воспалительных и репаративных процессов.