Инфекционные болезни и эпидемиология/учебник. - Покровский В.И., Пак С.Г., Брико Н.И., Данилкин Б.К. - 2-е изд., испр. и доп. - 2009. - 816 с. : ил.
|
|
|
|
ГЛАВА 3 АНТРОПОНОЗЫ
Антропонозы [от греч. anthropos + nosos - человек и болезнь] - группа инфекционных болезней, при которых единственным биологическим хозяином (резервуаром) возбудителя и источником инфекции выступает только зараженный человек. Главный признак этих болезней - узкая видовая специализация как возбудителя, так и хозяина (человека), сформировавшаяся в ходе длительной сопряженной эволюции. Следует отметить, что в настоящее время количество истинных антропонозов уменьшается. В первую очередь это связано с обнаружением других природных резервуаров микроорганизмов, ранее считавшихся возбудителями антропонозов.
Отделение группы антропонозов от прочих инфекционных болезней человека имеет большое практическое значение. Оно ориентирует медицинских работников на правильный поиск источников инфекции и определение направлений противоэпидемических мероприятий.
При антропонозах различают следующие механизмы передачи инфекции:
- фекально-оральный;
- аэрозольный;
- трансмиссивный;
- контактный.
Поскольку при антропонозах основным хозяином возбудителя бывает только человек, эта группа болезней представлена возбудителями, входящими в состав двучленных простых паразитарных систем и трехчленных простых по хозяину паразитарных систем с трансмиссивным механизмом передачи.
Антропонозы, возбудители которых входят в состав двучленных паразитарных систем, представлены в основном инфекциями ЖКТ и дыхательных путей. К ним также относят небольшое количество нозологических форм, объединенных в группу инфекций наружных покровов.
Антропонозы, возбудители которых входят в состав трехчленных паразитарных систем, представлены облигатно-трансмиссивными инфекциями. В одних случаях это простые по хозяину и переносчику (возвратный тиф), а в других - простые по хозяину и сложные по переносчику (малярия) заболевания.
Особенности механизма передачи антропонозов оказывают непосредственное влияние на механизмы развития и проявления эпидемического процесса (интенсивность поражения определенных групп населения, социально-возрастная характеристика заболевших, помесячная и погодовая заболеваемость, территориальное распределение заболеваемости и др.). Тип механизма передачи антропонозной инфекции также определяет значимость и роль тех или иных профилактических и противоэпидемических мероприятий. При некоторых антропонозах теоретически обоснована постановка задачи не только существенного снижения заболеваемости (дифтерия, коклюш, краснуха, эпидемический паротит и др.), но и полной ликвидации отдельных из них (врожденная краснуха, полиомиелит, корь и др.). Эпидемиологический надзор за антропонозами имеет свои особенности проведения, определяемые типом механизма передачи инфекции и биологическими свойствами возбудителя.
болезни с фекально-оральным механизмом передачи
Кишечные антропонозы вызываются :
- бактериями;
- вирусами;
- простейшими и гельминтами. Бактериальные инфекции включают:
- шигеллезы;
- сальмонеллезы;
- холеру;
- эшерихиозы и другие острые кишечные инфекции. Возбудителями этих заболеваний выступают энтеробактерии родов:
- Citrobacter;
- Enterobacter;
- Hafnia;
- Serratia;
- Proteus;
- Erwinia;
- Morganella;
- Prowidencia;
- Kleibsiella.
К вирусным инфекциям относят:
- ротавирусный гастроэнтерит;
- гастроэнтерит, вызываемый вирусом Норволк;
- энтеровирусные инфекции;
- полиомиелит;
- ВГА;
- ВГЕ и др.
Протозойные инфекции включают:
- амебиаз;
- лямблиоз (гиардиоз) и др.
Их возбудителями могут быть как патогенные, так и условнопатогенные микроорганизмы. Для возбудителей с кишечной локализацией характерен преимущественно фекально-оральный механизм передачи. Вместе с тем эколого-биологические особенности возбудителей и особенности взаимодействия с организмом человека определяют формы клинического течения болезни и ее эпидемиологические проявления. Выделение возбудителя из зараженного организма связано с актом дефекации. Попадая на те или иные объекты внешней среды, возбудитель часто проделывает достаточно длинный путь, меняя факторы передачи, прежде чем попасть в организм человека. Такой способ передачи носит название эстафетной. Отдельные факторы, участвующие в этом процессе передачи, разделяют на промежуточные и конечные.
Обычно выделяют 3 типа конкретно складывающихся путей передачи инфекции:
- пищевой;
- водный;
- контактно-бытовой (табл. 3-1).
Варианты пищевого и водного путей заражения весьма разнообразны и зависят от эколого-биологических свойств возбудителя (прежде всего от вирулентности и устойчивости во внешней среде) и способа его попадания в пищевые продукты и воду. При брюшном тифе и дизентерии, вызванной шигеллами Флекснера, отмечают преимущественное заражение через воду или посредством контактно-бытовой передачи. При дизентерии, вызванной шигеллами Зонне, чаще выявляют пищевой
путь передачи инфекции (главным образом с молоком и молочными продуктами). Пищевой и водный пути передачи разделяют по конечному фактору. Контактно-бытовая передача реализуется в организованных коллективах и семьях; она определяется действием санитарногигиенических факторов и соблюдением личной гигиены.
Таблица 3-1. Дифференциально-диагностические признаки вспышек острых кишечных инфекций различного происхождения
Путь передачи | Характеристика |
Водный | Предпосылки - погодные условия (дождь, паводки и др.), аварии водопровода, канализации |
Предвестники - изменение органолептических свойств, ухудшение бактериологических показателей воды | |
Признаки - связь с определенным водным источником, отсутствие заболеваний среди детей раннего возраста, полиэтиологичность вспышки, многообразие нозологических форм острых кишечных инфекций, длительный инкубационный период болезни, преобладание легких и стертых форм болезни | |
Пищевой | Предпосылки - нарушения технологии приготовления пищевых продуктов |
Предвестники - изменение органолептических свойств и ухудшение бактериологических показателей пищевых продуктов | |
Признаки - внезапность возникновения, эксплозивность течения, связь с одним предприятием общественного питания или продуктом, частое поражение всех возрастных групп, моноэтиологичность вспышки (один серовар, фаговар и биовар возбудителя), короткий инкубационный период болезни, преобладание манифестных форм болезни | |
Контактнобытовой | Предпосылки - плохие бытовые условия, низкий уровень санитарной культуры и личной гигиены |
Предвестники - появление отдельных случаев заболеваний | |
Признаки - постепенное увеличение количества больных, вялый и длительный характер вспышки, общность условий проживания, работы и т.д., частое поражение всех возрастных групп; чаще выделяют один вариант возбудителя, средняя или максимальная продолжительность инкубационного периода болезни, полиморфность клинической картины болезни |
Возбудителей заболеваний отличает относительно узкая органотропность. Так, возбудитель холеры размножается в просвете тонкой кишки, брюшного тифа - в лимфатических узлах с выходом в просвет кишечника через кровь и желчные пути, а шигеллы Флекснера - в толстой кишке. Энтеровирусы (вирусы полиомиелита, ECHO, Коксаки и др.), помимо основной локализации в кишечнике, дополнительно размножаются в верхних дыхательных путях. Все это определяет своеобразие эпидемиологии отдельных нозологических форм антропонозов с фекально-оральным механизмом передачи.
Условия и факторы, способствующие распространению этих инфекций, многообразны. Ими могут быть как невыявленные источники инфекции (бактерионосители, больные легкими формами болезни), так и множественные пути и факторы передачи заболевания. Закономерно повторяющиеся признаки позволяют выделить черты водных, пищевых и контактно-бытовых вспышек кишечных инфекций. Знание этих признаков существенно облегчает эпидемиологическую диагностику, в частности расшифровку причин возникновения вспышек. На развитие эпидемического процесса кишечных антропонозов решающее влияние оказывают конкретные социальные и природные факторы. Бытовая неблагоустроенность, нарушения водоснабжения и очистки населенных мест, низкая санитарная культура - общие факторы, способствующие реализации фекально-орального механизма передачи возбудителей. Кишечные инфекции относят к категории болезней, управляемых санитарно-гигиеническими мероприятиями.
Наибольшее значение имеет санитарный контроль за эпидемиологически значимыми объектами:
- канализационной сетью и очистными сооружениями;
- источниками водоснабжения и водопроводной сетью.
В сфере особого внимания находятся предприятия, связанные с заготовкой, хранением, приготовлением и реализацией пищевых продуктов (общественное питание, торговля), а также ДДУ и ЛПУ. Иммунопрофилактика имеет дополнительное значение; вопрос о ее проведении решают в зависимости от эпидемиологической ситуации и возможности заражения для определенных профессиональных и возрастных групп населения (брюшной тиф, холера, ВГА). С другой стороны, эффективная профилактика полиомиелита стала возможной лишь после разработки и широкого применения вакцины. Противоэпидемические мероприятия на врачебном участке предусматривают выполнение всего рекомендуемого комплекса мер в эпидемическом очаге с учетом нозологической
формы болезни и конкретных условий развития эпидемического процесса. Эпидемиологический надзор включает анализ заболеваемости с учетом санитарно-гигиенических условий обслуживаемых объектов и территорий, биологических свойств циркулирующих возбудителей, их видовой и типовой структуры. Его особенности зависят от свойств возбудителя и клинико-эпидемиологических проявлений болезни.
БРЮШНОЙ ТИФ (TYPHUS ABDOMINALIS)
Брюшной тиф - острая антропонозная генерализованная инфекция с фекально-оральным механизмом передачи. Характеризуется поражением лимфатического аппарата кишечника, мезентериальных лимфатических узлов, паренхиматозных органов, бактериемией. Клинически проявляется выраженной интоксикацией, увеличением печени и селезенки, розеолезной сыпью и энтеритом.
Краткие исторические сведения
Название болезни, введенное Гиппократом, происходит от греческого слова typhos (туман, спутанное сознание). До открытия возбудителя брюшного тифа все лихорадочные состояния обозначали этим термином. Т. Брович (1874), Н.И. Соколов (1876) и К. Эберт (1880) обнаружили брюшнотифозную палочку в пейеровых бляшках кишечника, селезенке и мезентериальных лимфатических узлах умерших людей. Чистую культуру бактерий выделил Г. Гаффки (1884).
В 1896 г. М. Грубер открыл феномен агглютинации брюшнотифозных бактерий с помощью специфических сывороток, а несколько позже Ф. Видаль применил это открытие для разработки РА в диагностических целях (реакция Видаля). Подробное описание клинической картины брюшного тифа в дальнейшем сделано И.И. Пятницким (1804), Ж. Бретано (1820-1829), М. Соколовым и Ф. Кияковским (1857), а также С.П. Боткиным (1868). Большой вклад в изучение брюшного тифа внесли российские ученые Г.А. Ивашенцев, Н.К. Розенберг, Г.Ф. Вогралик, Б.Я. Падалка, Г.П. Руднев, А.Ф. Билибин, К.В. Бунин и др.
Этиология
Возбудитель - Salmonella typhi, грамотрицательная подвижная палочка рода Salmonella семейства Enterobacteriaceae. Бактерии лучше растут на питательных средах, содержащих желчь. У S. typhi выделяют термостабильный соматический О-Аг, термолабильный жгутиковый Н-Аг,
термолабильный соматический Vi-Аг и др. Бактерии экзотоксинов не образуют. При разрушении микроорганизмов высвобождается эндотоксин, играющий основную роль в патогенезе заболевания.
В определенной степени патогенность брюшнотифозных бактерий также определяют ферменты агрессии:
- гиалуронидаза;
- фибринолизин;
- лецитиназа;
- гемолизин;
- каталаза и др.
По чувствительности к типовым бактериофагам выделяют более 100 стабильных фаговаров. Определение фаговара возбудителя - удобный маркер для выявления эпидемиологических связей между отдельными заболеваниями, выяснения источника и путей передачи возбудителя. При отсутствии возможности фаготипирования дается характеристика биохимических (ферментативных) свойств выделенных культур брюшного тифа и проводится их типирование (4 типа) по спообности ферментировать ксилозу и арабинозу. Сравниваются также антибиотикограммы штаммов возбудителя, выделенных у больных и лиц, подозреваемых в качестве источников инфекции (хронические носители и др.). В неблагоприятных условиях, например в иммунном организме, бактерии переходят в L-формы. Бактерии умеренно устойчивы во внешней среде - в почве и воде могут сохраняться до 1-5 мес, в испражнениях - до 25 дней, на белье - до 2 нед, на пищевых продуктах - от нескольких дней до недель. Несколько дольше сохраняются в молоке, мясном фарше, овощных салатах, где при температуре выше 18 °С способны размножаться. При нагревании возбудитель быстро погибает, дезинфицирующие растворы в обычных концентрациях действуют на него губительно. В последние годы отмечено появление новых фаговаров возбудителя, циркулирующего на территории России, в том числе в Москве. Если в 1993-1995 гг. доминировали фаговары А, К1, В2, то в 1997 г. преобладал фаговар 28, появились фаговары F4 и 45. Найдены антибиотико-резистентные штаммы возбудителя, способные вызывать крупные вспышки заболевания.
Эпидемиология
Резервуар и источник инфекции - это человек (больной или бактериовыделитель). Опасность больного для окружающих в разные периоды болезни неодинакова. В инкубационном периоде зараженный человек
практически неопасен. Опасность больного для окружающих увеличивается по мере развития болезни и достигает максимума на 2-3-й неделе болезни - в период выделения бактерий с испражнениями, мочой и потом. Возбудителя также можно обнаружить в грудном молоке и носоглотке. Большая часть переболевших освобождается от возбудителя в первые 1-2 нед или в ближайшие 2-3 мес реконвалесценции. Примерно 3-5% остаются носителями на длительный срок, а некоторые - на всю жизнь. Эпидемиологическая опасность хронического носителя определяется его профессией и зависит от соблюдения им правил личной гигиены. Особую опасность представляют носители, имеющие доступ к приготовлению, хранению и реализации пищевых продуктов.
Механизм передачи фекально-оральный, реализуется водным, пищевым и бытовым путями. В районах с повышенным уровнем заболеваемости распространение инфекции идет преимущественно водным путем. Последнее происходит за счет использования воды, взятой из загрязненных открытых или технических водоемов, а также из-за неудовлетворительного санитарно-технического состояния водопроводных и канализационных сооружений. В результате употребления зараженной воды возникают острые и хронические водные вспышки, способные длительно продолжаться и охватывать большие группы населения. К возникновению водных вспышек приводят аварии на водопроводных сетях и сооружениях, перепады давления и нерегулярность подачи воды, сопровождающиеся подсосом инфицированных грунтовых вод через негерметичные отрезки сетей. Из пищевых продуктов наиболее опасны молоко и молочные изделия, кремы, салаты и другие продукты, служащие благоприятной средой для размножения бактерий. Иногда заражение может произойти и через овощи, особенно при их поливе сточными водами или удобрении фекалиями. Бытовой путь передачи возможен при низкой культуре бактерионосителей или больных со стертой формой болезни. При этом происходит заражение окружающих предметов, а в последующем - заражение пищи.
Естественная восприимчивость людей
Восприимчивость к болезни высокая, перенесенное заболевание оставляет стойкий пожизненный иммунитет. Повторные заболевания крайне редки.
Основные эпидемиологические признаки
Брюшной тиф встречают на всех континентах, во всех климатических зонах. Наиболее высокий уровень заболеваемости регистрируют
в развивающихся странах. В связи с глобальным распространением брюшной тиф представляет одну из наиболее актуальных проблем практической и теоретической медицины. По данным ВОЗ, нет ни одной страны, где не были отмечены случаи заболевания. Ежегодно в мире регистрируют около 20 млн случаев брюшного тифа и около 800 000 летальных исходов. Особенно крупные эпидемии наблюдают в странах Азии, Африки и Южной Америки. Брюшной тиф остается эндемичным инфекционным заболеванием на ряде территорий РФ. При невысоком среднем показателе заболеваемости, составляющем 0,06-0,1 на 100 000 населения (2006-2007 гг.), существуют регионы, где заболеваемость существенно превышает средний показатель (Дагестан, Карачаево-Черкесия, Липецкая, Калининградская области, Приморский край). Наличие в популяции хронических бактерионосителей и отсутствие эффективных методов их санации определяют возможность спорадического и эпидемического распространения брюшного тифа практически на любой территории в любое время года. Однако эндемичность болезни чаще всего определяется активностью водного пути передачи инфекции. Необходимо различать водные вспышки как по характеру источника воды, так и по механизму его загрязнения. Нехватка воды, перебои в ее поступлении также активизируют контактно-бытовую передачу возбудителя, так как заставляют население использовать для хозяйственно-питьевых целей воду технических водопроводов, открытых водоемов, рек, арыков и т.д. Именно водный фактор обусловливает высокую заболеваемость брюшным тифом на территории Средней Азии.
В последние годы отмечена коммерческая окраска заболеваемости брюшным тифом, которая обусловлена:
- миграционными процессами;
- ростом торговых связей;
- широким распространением уличной торговли, в том числе пищевыми продуктами.
Отмечается резкое увеличение частоты импорта (заноса) инфекции с территорий эндемичных по заболеваемости стран ближнего и дальнего зарубежья, а также заражение жителей России при выезде в эти страны и в процессе миграции внутри страны.
Сезонное распределение заболеваемости характеризуется подъемами в летне-осенний период. Последнее особенно характерно для эндемичных районов, где на фоне в целом неудовлетворительного качества питьевой воды все более возрастает ее дефицит. В настоящее время фактически на всей территории страны периодические колебания в много-
летней динамике заболеваемости не выявлены. Вместе с тем на тех территориях, где еще сохраняются условия для достаточно активной циркуляции возбудителя, отмечают более или менее выраженные сезонные подъемы. Отмечено более частое формирование хронического носительства возбудителя на территориях с широким распространением описторхозной инвазии (Обь-Иртышский бассейн).
Заболеваемость жителей, проживающих в сельских районах, выше, чем жителей городов, что связано главным образом с условиями для заражения населения. Один из важных факторов - это купание в водоемах, загрязненных хозяйственно-фекальными стоками. В связи с этим самым угрожаемым возрастом становится младший и средний школьный. Среди взрослых самые высокие цифры заболеваемости регистрируют среди лиц молодого возраста (15-30 лет).
Пищевые вспышки чаще всего определяют следующие обстоятельства:
- присутствие на пищевом предприятии источника инфекции (бактерионосителя или больного стертой формой);
- санитарно-технические нарушения - отсутствие или неправильная работа коммунальных установок (водопровода, канализации);
- грубые нарушения санитарного режима на пищевом предприятии;
- нарушения технологического процесса обработки пищи (неправильная термическая обработка и т.д.).
В крупных благоустроенных городах брюшной тиф стал исключительно болезнью взрослых. Несмотря на то что в Москве на учете состоят 153 хронических носителя возбудителя брюшного тифа, 60 носителей возбудителя паратифа В и 6 - паратифа А, они почти утратили свою эпидемиологическую роль как источники инфекции (в основном это неработающие лица пенсионного возраста) и практически не влияют на распространение этой инфекции. Внутрибольничное распространение инфекции характерно для психоневрологических стационаров.
Патогенез
Инфицирующая доза возбудителя брюшного тифа, вызывающая заболевание у 25% искусственно зараженных взрослых добровольцев, в среднем составляет 105 или 100 000 микробных клеток. При попадании возбудителя через рот сальмонеллы, преодолевшие неспецифические факторы защиты полости рта и кислотный барьер желудка, проникают в
солитарные и групповые лимфатические фолликулы тонкой кишки, где первично размножаются. После размножения в последних, а также в лимфатических узлах брыжейки возбудитель проникает в кровоток, вызывая бактериемию и эндотоксинемию. На протяжении всего заболевания брюшной тиф сопровождает интоксикация (см. «Общую часть» в главе 2, раздел «Патогенетические механизмы синдрома интоксикации, формирующиеся под воздействием ЛПС-комплекса»). С током крови возбудитель диссеминирует в паренхиматозные органы (печень, селезенку, лимфатические узлы, костный мозг), формируя в них брюшнотифозные гранулемы, включающие крупные тифозные клетки со светлыми ядрами. Гранулемы составляют основу для поддержания вторичных волн бактериемии. Далее бактерии вновь попадают в кишечник, в результате чего развиваются реакции ГЗТ в ранее сенсибилизированной лимфоидной ткани кишечной стенки. Морфологически ГЗТ проявляется некрозом пейеровых бляшек и солитарных фолликулов, что приводит к формированию брюшнотифозных язв, чаще в дистальных отделах тонкой кишки.
Процесс проходит ряд последовательных стадий и определяется временными рамками.
• На 1-й неделе болезни наблюдают набухание лимфатических образований в тонкой кишке, на разрезе они серо-красного цвета и внешне напоминают вещество головного мозга (мозговидное набухание).
• На 2-й неделе развиваются некротические поражения, начинающиеся в центральных частях набухших лимфоидных образований (стадия некроза). В некоторых случаях некроз распространяется на всю толщину кишечной стенки.
• На 3-й неделе начинается отторжение некротизированных элементов лимфоидной ткани с образованием язв.
• К 4-й неделе происходит отторжение некротических масс из язв, приводящее к формированию так называемых чистых язв. В дальнейшем язвы заживают без образования рубцов. В этот период в ряде случаев содержимое кишечника удерживается от проникновения в брюшную полость только тонким слоем серозной оболочки, что обусловливает опасность прободения стенки кишки.
На фоне формирующихся иммунных реакций происходит выделение возбудителя из организма больного с испражнениями уже в начальной стадии заболевания, достигая своего максимума со 2-й недели болезни. Выделение микроорганизма может продолжаться после окончания клинических проявлений заболевания. В 3-5% случаев формируется так
называемое хроническое носительство брюшнотифозной палочки, способное длиться от нескольких месяцев до десятков лет, даже пожизненно. Патогенез бактерионосительства сложен. Существует мнение, что хроническое носительство представляет собой хроническую брюшнотифозную инфекцию. Считают, что важные факторы развития бактерионосительства - это фенотипические особенности иммунной системы, а также образование брюшнотифозной палочкой L-форм (рис. 3-1).
Клиническая картина
Инкубационный период в среднем продолжается 10-14 сут, варьируя от нескольких дней до 3 нед, в редких случаях максимально может затянуться до 60 дней. Ранее было принято считать, что брюшной тиф начинается постепенно. Однако в настоящее время более чем в 2/3 случаев наблюдают острое начало заболевания. Первую неделю клинических проявлений обозначают как начальный период болезни. Если заболевание развивается постепенно, то в течение первых 3-4 сут происходит нарастание температурной реакции, достигающей к концу этого срока 39-40 °С. Так же постепенно развивается синдром интоксикации, проявляющийся головной болью, анорексией, прогрессирующей общей слабостью, головокружением, бессонницей. При остром начале заболевания симптомы интоксикации развиваются в более сжатые сроки (1-2 дня).
При осмотре больных в 1/3 случаев обращает на себя внимание бледность кожи. У других больных лицо может быть обычной окраски или слегка гиперемированным, особенно в случае острого начала заболевания.
Характерно утолщение языка. При этом в центре он обложен налетом, а края и кончик остаются чистыми. При большой отечности языка можно наблюдать отпечатки зубов по его краям. Живот обычно вздут вследствие метеоризма, перистальтические волны кишечника замедлены. Характерны запоры, однако в начальной стадии болезни возможно послабление стула с каловыми массами в виде «горохового супа». Пальпация живота (следует проводить осторожно.) выявляет легкую болезненность в правой подвздошной области, там же можно отметить урчание и притупление перкуторного звука (симптом Падалки). Уже к 3-4-му дню заболевания у больного увеличиваются размеры печени и селезенки. При пальпации они несколько уплотнены, но безболезненны. Тоны сердца приглушены. Брадикардия в начальном периоде
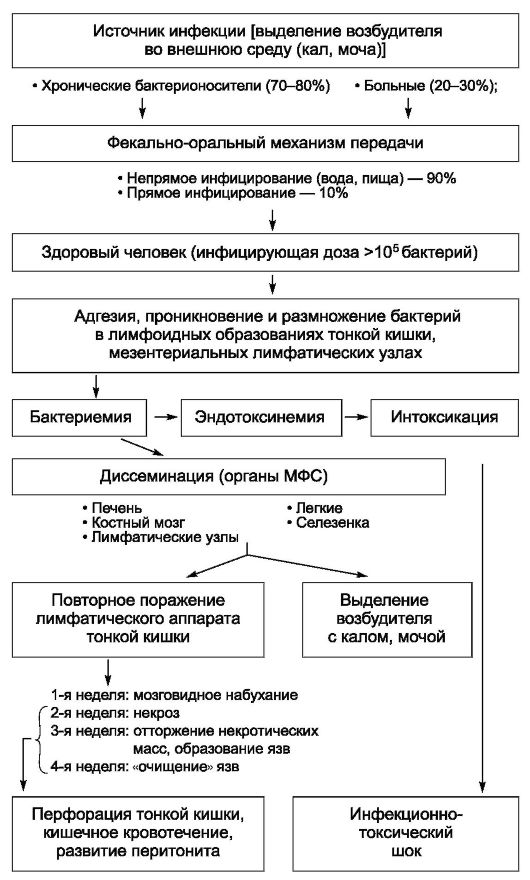 Рис. 3-1. Патогенез брюшного тифа
Рис. 3-1. Патогенез брюшного тифа
наблюдается редко, она более характерна для периода разгара болезни. Учащение пульса в начальном периоде не исключает диагноз брюшного тифа.
Период разгара приходится на конец 1-й или начало 2-й недели болезни и может продолжаться от нескольких дней до 2-3 нед. Характерно нарастание симптомов интоксикации. Температура тела остается высокой, приобретает постоянное, волнообразное или неправильное течение.
На 8-9-е сутки болезни у больных можно обнаружить брюшнотифозные розеолы (roseolae elevatae; см. рис. 1 на цветной вклейке), слегка приподнимающиеся над поверхностью кожи и располагающиеся на передней брюшной стенке и нижней части груди. Количество розеол незначительно, иногда всего 2-5 элементов. Розеолы исчезают на 3-4-й день после их появления, однако вслед за возникновением первых розеол возможны новые подсыпания. Отсутствие экзантемы не исключает диагноз брюшного тифа. Характерно развитие брадикардии, частота пульса значительно отстает от уровня температурной реакции. Тоны сердца, как правило, глухие, пульс малого наполнения, АД склонно к снижению. У больных может быть олигурия. При тяжелом течении заболевания может развиться так называемый тифозный статус с прострацией больного, резкой слабостью, адинамией, апатией, помрачением сознания, а в некоторых случаях с двигательным беспокойством. В настоящее время подобное состояние встречают достаточно редко.
Период реконвалесценции проявляется падением температуры тела (иногда по амфиболическому типу) и постепенным исчезновением признаков интоксикации. Необходимо подчеркнуть, несмотря на исчезновение симптомов интоксикации, особенно под воздействием лечебных мероприятий, временные рамки формирования язв в тонкой кишке сохраняются, поэтому остается опасность развития кишечных кровотечений и перфораций кишки.
Следует иметь в виду, что клиническая картина брюшного тифа далеко не всегда характеризуется указанным комплексом симптомов. Иногда многие из них проявляются слабо или могут полностью отсутствовать (атипичные формы). Подобные ситуации трудны для диагностики. Абортивная форма заболевания характеризуется кратковременной лихорадкой в течение всего нескольких дней и быстрым исчезновением интоксикации (амбулаторный тиф). Стертая форма брюшного тифа проявляется непродолжительным субфебрилитетом, отсутствием экзантемы и слабо выраженными симптомами интоксикации. В редких случаях заболевание может протекать в виде пневмо-, менинго-, коло- и
нефротифа. При этом течение болезни обычно тяжелое, на фоне выраженной интоксикации преобладают признаки поражения соответствующих органов и систем. Вышеперечисленные редкие, но тяжелые формы заболевания, возможно, обусловлены присоединением вторичной бактериальной флоры.
Обострения и рецидивы
В некоторых случаях заболевание может приобретать затяжной характер, обусловленный развитием обострений. Они обычно возникают на фоне уменьшения симптомов интоксикации и снижения температуры тела, впрочем, не достигающей нормальных показателей. На этом фоне вновь усиливаются все симптомы заболевания, повышается температура тела, появляются новые элементы брюшнотифозной экзантемы, увеличиваются в размерах печень и селезенка.
Рецидивы заболевания отличаются от обострений тем, что вновь развиваются симптомы интоксикации, появляются свежие розеолы, температура тела повышается до высоких цифр после уже нормализовавшейся температурной реакции и удовлетворительного самочувствия больного. У 7-9% больных рецидивы возникают на 2-3-й неделе апирексии; в некоторых случаях их можно наблюдать и на более поздних сроках. Количество рецидивов обычно не превышает 1-2, в редких случаях - 3. Как правило, рецидивы начинаются остро, в течение 1-2 дней развивается полная клиническая картина заболевания. Особенно следует подчеркнуть, что при рецидивах экзантему можно обнаружить уже на 1-е сутки. Течение рецидивов легче, а их продолжительность короче первичного заболевания.
Дифференциальная диагностика
Брюшной тиф необходимо дифференцировать от заболеваний, сопровождающихся длительной лихорадкой и развитием признаков интоксикации:
- сыпного тифа;
- малярии;
- бруцеллеза;
- пневмонии;
- сепсиса;
- туберкулеза;
- лимфогранулематоза и др.
В клинической дифференциальной диагностике брюшного тифа следует опираться на следующие симптомы:
- высокую длительную лихорадку;
- бледность лица;
- болезненность и урчание при пальпации в правой подвздошной области;
- гепатолиенальный синдром;
- брадикардию;
- увеличение в размерах языка, обложенного по центру;
- появление на 8-9-й день болезни скудной розеолезной сыпи на животе и нижней части груди;
- развитие тифозного статуса (при тяжелом течении). Постановка правильного диагноза вызывает значительные трудности, особенно при атипичных формах брюшного тифа. Поэтому каждый случай неясной лихорадки длительностью более 3 дней требует проведения соответствующих лабораторных исследований, в том числе выделения возбудителя из крови и фекалий, определения Аг возбудителя в сыворотке крови и испражнениях. Получение брюшнотифозной гемокультуры даже при минимальных клинических проявлениях заболевания - абсолютное подтверждение диагноза брюшного тифа (Билибин А.Ф.). Обнаружение брюшнотифозных палочек в каловых массах менее информативно.
Лабораторная диагностика
На высоте интоксикации у больных брюшным тифом изменения гемограммы характеризуются лейкопенией, анэозинофилией, относительным лимфоцитозом и умеренным повышением скорости оседания эритроцитов (СОЭ). На первых этапах болезни также можно наблюдать умеренный лейкоцитоз со сдвигом лейкоцитарной формулы влево. В анализе мочи можно обнаружить белок и увеличение количества эритроцитов, а также цилиндры.
Наиболее достоверный метод диагностики брюшного тифа - выделение возбудителя в крови. Для этого проводят посев 10 мл крови на 100 мл жидкой среды, содержащей желчь (10-20% желчный бульон, среда Раппопорта). Вероятность выделения гемокультуры высока (до 80%) в 1-ю неделю болезни, однако с диагностической целью исследование проводят во все периоды температурной реакции. Посевы испражнений (копрокультуру) и мочи (уринокультуру) проводят на плотные питатель-
ные среды во все периоды заболевания, при этом высеваемость возбудителя высока на 2-3-й неделе болезни. Вместе с тем необходимо помнить, что брюшнотифозную палочку из кала и мочи можно выделить не только у больных брюшным тифом, но и от бактерионосителей при различных лихорадочных состояниях.
Помимо бактериологических исследований, уже с первых дней болезни можно выявить брюшнотифозный О-Аг в испражнениях или сыворотке крови в РКА, РЛА, а также методами иммунофлюоресцентной микроскопии и ИФА.
Серологическую диагностику (РНГА в парных сыворотках с эритроцитарным брюшнотифозным О-диагностикумом) проводят с конца 1-й недели заболевания, однако минимальный диагностический титр АТ (1:200) впервые можно выявить и в более поздние сроки заболевания (на 3-й неделе болезни). РНГА с эритроцитарным брюшнотифозным Vi-диагностикумом у больных брюшным тифом имеет вспомогательное значение (минимальный диагностический титр 1:40). Чаще эту реакцию используют для отбора лиц, подозрительных на бактерионосительство. При титрах АТ 1:80 и выше этим лицам проводят многократное бактериологическое исследование.
Осложнения и исходы
Патогенетически обусловленные и опасные осложнения при брюшном тифе:
- ИТШ;
- перфорация тонкой кишки;
- кишечное кровотечение.
ИТШ развивается на фоне выраженного синдрома интоксикации. Состояние характеризуется резким снижением температуры тела, тахикардией, падением АД, олигурией или анурией, повышенным потоотделением, проявлениями нейротоксикоза.
Перфорация тонкой кишки и кишечное кровотечение чаще развиваются в конце 2-й и начале 3-й недели болезни. Вслед за перфорацией кишки у больного развивается перитонит с клиническими проявлениями, свойственными этому состоянию. Задача врача-инфекциониста - распознать перфорацию в первые часы после ее возникновения, до развития симптоматики генерализованного перитонита.
Главный сигнал перфорации - это абдоминальная боль. При перфорации брюшнотифозной язвы боль может носить самый разнообразный
характер - от незначительной и ноющей до кинжальной. При осмотре больного можно отметить небольшое напряжение брюшных мышц в области перфорации, а в некоторых случаях симптом Щеткина- Блюмберга. Однако в ряде случаев эти признаки могут отсутствовать, тогда необходимо обратить внимание на косвенные симптомы, такие как симптом гробовой тишины (отсутствие шумов перистальтики) при аускультации живота, неожиданное резкое падение температуры тела и смена брадикардии на тахикардию.
Кишечное кровотечение может быть клинически бессимптомным, в этом случае его устанавливают по наличию крови в каловых массах и уменьшению содержания гемоглобина.
Массивное кровотечение сопровождают:
- внезапное снижение температуры тела;
- возникновение чувства жажды;
- учащение пульса;
- снижение АД.
При массивном кровотечении каловые массы приобретают характер мелены. Возможно появление рвоты, рвотные массы имеют вид кофейной гущи. При одновременном развитии перфорации и кровотечения болевой синдром в большинстве случаев отсутствует.
При спорадическом уровне заболеваемости и полноценном лечении выздоровление наступает в абсолютном большинстве случаев (98-99%). Летальные исходы от осложнений регистрируют в 0,5 - 1,5%. После перенесенного заболевания в 8-10% случаев формируется острое, а в 3-5% - хроническое бактерионосительство с персистенцией Х-формы возбудителя в макрофагах.
Лечение
Во всех случаях, даже при подозрении на тифопаратифозное заболевание, больные подлежат госпитализации. Диета у больных должна носить механический и химический щадящий характер. Обычно больным назначают стол ? 4 (в инфекционном стационаре его часто обозначают как стол ? 4abt). Блюда должны быть отварными и протертыми через сито. Питание показано дробное, малыми порциями. Пищу следует запивать большим количеством жидкости.
Постельный режим у больного обусловлен необходимостью избегать напряжения мышц живота, что может спровоцировать перфорацию кишки или кровотечение. Щадящую диету и постельный режим необхо-
димо соблюдать до конца 4-й недели болезни вне зависимости от сроков исчезновения интоксикации, поскольку лишь к этому времени начинается репарация слизистой оболочки кишки. Режим активизируют постепенно - с 7-10-го дня апирексии пациенту разрешают сидеть, а с 11-го дня - ходить.
Учитывая нарастающую резистентность возбудителя к антибактериальным средствам, для этиотропного лечения брюшного тифа в настоящее время используют фторхинолоны и цефалоспорины 3-го поколения, их считают антибиотиками выбора.
Взрослым пациентам назначают один из препаратов:
- ципрофлоксацин перорально по 250-500 мг 2 раза в сутки;
- офлоксацин внутрь по 200-400 мг с интервалами в 12 ч;
- цефтриаксонР внутримышечно по 2 г в сутки. Продолжительность курсов лечения при клинической эффективности
указанных антибиотиков может быть сокращена до 5-7 сут апирексии.
При сохраненной чувствительности брюшнотифозной палочки в отдельных регионах возможно пероральное назначение традиционных антибиотиков:
- левомицетина по 0,5 г 5 раз в сутки по 2-й день с момента нормализации температуры тела (включительно), затем по 0,5 г 4 раза в сутки по 10-й день апирексии;
- ампициллина по 0,5 г 4 раза в день до 10-го дня нормальной температуры;
- азитромицина 500 мг в 1-е сутки, затем по 250 мг в сутки со 2-го по 5-й день лечения.
С целью профилактики осложнений, вызванных анаэробной флорой, при длительных курсах этиотропного лечения назначают метрагилР по 100 мг 3 раза в день.
Проводят активное дезинтоксикационное лечение (обильное питье, энтеросорбенты, внутривенное введение 5% раствора глюкозы*, коллоидных и кристаллоидных растворов, свежезамороженной плазмы). По показаниям назначают сердечно-сосудистые средства, витамины, жаропонижающие, седативные и снотворные препараты.
В ряде клиник для профилактики рецидивов и формирования бактерионосительства применяют комплексную иммуно-антибиотикотерапию: назначение этиотропных средств сочетают с инъекциями брюшнотифозных вакцин.
В случаях кишечного кровотечения больному на 12-24 ч назначают абсолютный покой в положении на спине, голод, ограниченное количе-
ство жидкости (не более 500 мл, чайными ложками). Расширение диеты возможно не ранее 2-го дня от начала кровотечения. В рацион включают мясные и рыбные бульоны, соки, кисели, желе, яйца всмятку. В случае прекращения кровотечения диету в течение 3-5 дней постепенно расширяют до стола ? 4abt. С первых часов кровотечения больному необходимо подвесить пузырь со льдом, слегка касающийся передней стенки живота. С целью остановки кровотечения применяют 5% раствор ε-аминокапроновой кислоты по 100 мл перорально и парентерально, 12,5% раствор этамзилата натрия по 2 мл 3 раза в сутки парентерально, 10% раствор кальция хлорида по 10 мл 2-3 раза в сутки внутривенно, свежезамороженную одногруппную плазму. По жизненным показаниям проводят переливание крови или эритроцитарной массы. Для профилактики повторного кровотечения назначают 1% раствор викасола* по 3 мл 2 раза в сутки внутримышечно. При диагностике перфорации кишки больной поступает под наблюдение хирурга.
Эпидемиологический надзор
Эпидемиологический надзор должен опираться на санитарный надзор, включающий санитарно-гигиенический контроль за внешней средой, санитарно-эпидемиологический режим на пищевых объектах и т.д. Он направлен на сбор информации, динамическую оценку факторов риска и условий жизни и включает наблюдение за заболеваемостью брюшным тифом с учетом преобладания тех или иных путей передачи инфекции, а также определение фаготипового пейзажа выделяемых возбудителей. Большое значение имеет систематический контроль за хроническими носителями брюшного тифа с периодическими лабораторными их обследованиями. При осуществлении эпидемиологического надзора за брюшным тифом наибольшее внимание уделяют объектам водоснабжения и молокоперерабатывающим предприятиям, а также контролю за очисткой, канализацией и обезвреживанием нечистот, борьбе с мухами. В рамках эпидемиологической диагностики проводят ретроспективный и оперативный эпидемиологический анализ. Оперативную оценку эпидемиологической ситуации осуществляют путем сравнения заболеваемости за определенный период времени на конкретной территории со среднемноголетними (нормативными) уровнями, а также с предыдущим месяцем, кварталом текущего года, в сопоставлении с соответствующими периодами предыдущего года. Основными предпосылками осложнения эпидемиологической ситуа-
ции становятся аспекты социальной жизни, способные активизировать ведущие пути передачи возбудителя (водный и пищевой).
Предвестником осложнения эпидемиологической ситуации при брюшном тифе и других кишечных инфекциях могут служить:
- ухудшение бактериологических показателей воды;
- ухудшение качества пищевых продуктов;
- изменение фаготипа и биологических свойств циркулирующего возбудителя.
Профилактические мероприятия
Профилактические мероприятия сводятся к выявлению бактерионосителей брюшнотифозной палочки и пресечению путей передачи инфекции. Наиболее результативны меры по устранению водного и пищевого путей передачи возбудителей, что обеспечивают налаживанием должного водоснабжения, канализации и хорошей работы предприятий общественного питания. Поддержание водопроводных и канализационных сооружений в надлежащем санитарно-техническом состоянии, соблюдение санитарных и противоэпидемических норм и правил при их функционировании, очистка и обеззараживание сточных вод перед их сбросом в открытые водоемы служат залогом спокойной эпидемической обстановки по брюшному тифу и другим кишечным инфекциям. Большое значение имеет санитарное просвещение населения, овладение санитарными минимумами работниками общественного питания и торговли пищевыми продуктами. С целью выявления носителей среди лиц, поступающих работать на пищевые и приравненные к ним объекты (не болевших ранее брюшным тифом), перед допуском к работе исследуют сыворотку крови в РНГА с О- и V'-эритроцитарными диагностикумами (индикаторный признак возможного хронического брюшнотифозного носительства) и проводят однократное бактериологическое исследование кала. При отрицательных результатах обследуемых лиц допускают к работе. При положительном результате бактериологического и серологического (титр Vi- АТ 1:40 и выше) исследования обследуемый как хронический носитель к работе не допускается и ставится на диспансерный учет. При отрицательном результате бактериологического исследования при положительной РПГА с V'-Аг для подтверждения полученного результата кровь вновь однократно исследуется в РПГА, предпочтительно с другой серией Vi-Аг. При повторном положительном результате серологического исследования для выявления
хронического бактерионосительства трехкратно с интервалом в 3 дня бактериологически исследуются кал и моча. При отрицательных результатах дополнительно однократно исследуется дуоденальное содержимое (желчь). При отрицательных результатах всех бактериологических исследований, но при сохраняющихся положительных результатах РПГА с V'-Аг обследуемый допускается к работе в организации по производству пищевых продуктов, их реализации и приравненные к ним организации. Однако бактериологическое обследование продолжается еще в течение 3 мес (1 раз в мес исследуются кал и моча, в конце 3-го месяца - дуоденальное содержимое). При отрицательных результатах исследований обследуемые продолжают работать. При выделении возбудителя - отстраняются от работы. Вспомогательное значение имеет иммунизация, проводимая по эпидемиологическим показаниям среди населения начиная с 3 лет в местностях, неблагополучных по брюшному тифу (уровень заболеваемости превышает 25 случаев на 100 000 населения).
Прививки проводят также при угрозе возникновения эпидемий и вспышек:
- стихийные бедствия;
- крупные аварии на водопроводных и канализационных сетях и т.п.
Плановой вакцинации подлежат:
- лица, занятые в сфере коммунального благоустройства;
- работники, обслуживающие канализационные сети, сооружения и оборудование;
- работники предприятий по санитарной очистке населенных мест, сбору, транспортированию и утилизации бытовых отходов;
- лица, работающие с живыми культурами брюшного тифа;
- работники инфекционных больниц и отделений (для больных кишечными инфекциями).
Вакцинация показана лицам, выезжающим в страны Азии, Африки и Латинской Америки, где заболеваемость брюшным тифом высока. На территории РФ зарегистрированы и разрешены к применению отечественные вакцины (брюшнотифозная спиртовая сухая и вианвак* - V'-полисахаридная жидкая вакцина), а также тифим Ви* (полисахаридная V'-вакцина, Авантис Пастер, Франция).
Брюшнотифозную спиртовую вакцину вводят двукратно в подлопаточную область. Первая доза составляет 0,5 мл, вторая - 1 мл (через
25-35 сут). Ревакцинацию проводят через 2 года в дозе 1 мл. Вакцины вианвак* и тифим Ви* вводят однократно подкожно в наружную поверхность верхней трети плеча. Разовая доза для лиц любого возраста - 0,5 мл. Ревакцинацию проводят каждые 3 года.
Мероприятия в эпидемическом очаге
Информацию о заболевшем (подозрительном) направляют из ЛПУ в учреждения, осуществляющие Госсанэпиднадзор (по телефону в течение 2 ч с момента установления диагноза). В течение 12 ч передается экстренное извещение. Каждый случай болезни (носительства) фиксируют в журнале регистрации инфекционных заболеваний. Отдельно ведется учет заболевших среди лиц без определенного места жительства, приезжих, местных жителей, не выезжавших в течение 3 нед до возникновения болезни на другие территории. Исследованию крови на гемокультуру независимо от уровня заболеваемости тифо-паратифами подлежат все лица с лихорадочным состоянием невыясненного происхождения, наблюдающимся в течение 5 дней и более.
Госпитализация больного или подозрительного на заболевание человека обязательна из-за возможности опасных для жизни осложнений:
- перфоративного перитонита;
- кишечного кровотечения.
Госпитализацию больных осуществляют в течение первых 3 ч, в сельской местности в течение 6 ч после получения экстренного извещения. Выписку больного из стационара проводят после исчезновения клинических симптомов и отрицательного трехкратного исследования кала и мочи. Первое исследование проводят спустя 5 дней после установления нормальной температуры, последующие - с пятидневным интервалом. Реконвалесцентов, получавших антибиотики, выписывают из стационара не ранее 21-го дня, а лиц, не получавших антибиотики, не ранее 14-го дня после установления нормальной температуры. Все переболевшие брюшным тифом, не относящиеся к категории работников отдельных профессий, производств и организаций, после выписки подлежат диспансерному наблюдению в течение 3 мес с медицинским осмотром и термометрией 1 раз в неделю в течение 1-го месяца и не реже 1 раза в 2 нед в последующие 2 мес. Помимо этого, в конце указанного срока они подвергаются двукратному бактериологическому с интервалом в 2 дня и однократному серологическому обследованию. При отрицательном результате переболевших снимают с диспансерного учета, при
положительном - дважды обследуют в течение года. При положительном бактериологическом исследовании их ставят на учет как хронических бактерионосителей. Переболевших из числа работников пищевых предприятий и лиц, к ним приравненных, не допускают к работе 1 мес после выписки из больницы. В течение этого времени их подвергают трехкратному бактериологическому и однократному серологическому (РПГА с Vi-Аг) обследованию. При отрицательных результатах исследования их допускают к работе, но ежемесячно двукратно бактериологически обследуют в течение последующих 3 мес. При отрицательных результатах исследований эти лица на протяжении последующих 12 мес подлежат ежеквартальному бактериологическому обследованию (фекалии и моча, однократно). В конце указанного периода проводится однократное бактериологическое исследование дуоденального содержимого (желчи) и серологическое исследование крови в РПГА с Vi-Аг. При отрицательных результатах бактериологических и серологических исследований переболевших снимают с учета. При выделении бактерий брюшного тифа через 3 мес и более после выздоровления работников пищевых предприятий и лиц, к ним приравненных, ставят на учет как хронических бактерионосителей и отстраняют от работы. При положительном результате серологического обследования его проводят повторно. При вновь положительном результате назначают дополнительное трехкратное бактериологическое исследование фекалий и мочи и однократное исследование желчи (при отрицательных результатах исследования фекалий и мочи). При отрицательных результатах всего проведенного комплекса исследований переболевших снимают с диспансерного учета. Всех хронических носителей возбудителя брюшного тифа ставят на постоянный учет в органах и учреждениях, осуществляющих государственный санитарно-эпидемиологический надзор, по установленной форме. Их обучают правилам приготовления дезинфицирующих растворов, текущей дезинфекции, правильного гигиенического поведения. Хронические бактерионосители, выявленные среди работников пищевых предприятий и лиц, к ним приравненных, к работе не допускают в течение 2 лет. По истечении этого срока они могут повторно поступать на работу, предварительно пройдя лабораторные обследования.
Работа в очаге тифо-паратифозной инфекции нацелена на выявление источника инфекции (больной легкой формой, реконвалесцент, хронический носитель), защиту лиц, общавшихся с больным, и наблюдение за ними в течение максимального инкубационного периода
(21 день) для выявления новых больных. Проживающих в очаге детей дошкольного возраста, посещавших детские учреждения, работников пищевых предприятий и лиц, приравненных к ним, обследуют бактериологически и серологически. При положительном результате их обследуют в том же порядке, как лиц, поступающих на работу на эпидемически значимые объекты. Для предохранения от заболевания брюшным тифом и паратифами лиц, общавшихся с больными или реконвалесцентами в очаге, применяют брюшнотифозный бактериофаг. Его назначают трехкратно с интервалом 3-4 дня; при этом 1-ю дозу вводят после забора материала для бактериологического обследования.
Учитывая стойкость сальмонелл во внешней среде, в очагах проводят дезинфекцию. Текущую дезинфекцию выполняют родственники в течение всего периода пребывания больного или бактерионосителя в очаге инфекции, заключительную - после госпитализации больного работники дезинфекционной службы.
ПАРАТИФ А И ПАРАТИФ B (PARATYPHUS А ET PARATYPHUS B)
Паратифы А и B - острые инфекционные заболевания с фекальнооральным механизмом передачи, сходные с брюшным тифом по патогенезу и основным клиническим проявлениям.
Этиология
Возбудители - S. paratyphi A и S. paratyphi B - грамотрицательные подвижные палочки рода Salmonella семейства Enterobacteriaceae. У бактерий выделяют О-Аг и Н-Аг, но не Vi-Аг. Их морфологические и культуральные свойства в основном аналогичны S. typhi. При посевах исследуемого материала на жидкие питательные среды учитывают способность паратифозных микроорганизмов образовывать газ. Устойчивость паратифозных бактерий во внешней среде и к действию дезинфектантов не отличается от таковой у возбудителя брюшного тифа.
Эпидемиология
Резервуар возбудителя паратифа А - больной человек и бактерионосители. Резервуар возбудителя паратифа B - человек и животные (крупный рогатый скот, свиньи, домашняя птица). Больной человек обычно
выделяет возбудителя с первых дней клинических проявлений, всего периода заболевания и реконвалесценции (2-3 нед). Носительство паратифозных бактерий формируется чаще, чем брюшнотифозных.
Механизм передачи - фекально-оральный, пути передачи - пищевой, водный, бытовой. При паратифе А преобладает водный, при паратифе B - пищевой (особенно через молоко).
Естественная восприимчивость людей
Естественная восприимчивость людей высокая. Постинфекционный иммунитет видоспецифический.
Основные эпидемиологические признаки
Паратиф B распространен повсеместно. Паратиф А встречается реже, главным образом в странах Юго-Восточной Азии и Африки. Заболевания регистрируют спорадически либо в виде ограниченных вспышек. Основные проявления эпидемического процесса такие же, как и при брюшном тифе.
Патогенез
Патогенез заболеваний аналогичен патогенезу брюшного тифа.
Клиническая картина
Клинические проявления брюшного тифа и паратифов во многом сходны. Вместе с тем при паратифе А инкубационный период короче, чем при брюшном тифе, он составляет в среднем 6-10 сут. Характерно острое гриппоподобное начало заболевания с быстрым повышением температуры тела и присутствием в начальном периоде катаральных явлений - насморка, кашля. Лицо больных гиперемировано, сосуды склер инъецированы, можно наблюдать герпетические высыпания на губах и крыльях носа. Температурная реакция не столь постоянна, как при брюшном тифе, часто принимает неправильный характер, а длительность ее меньше. На высоте заболевания возможны озноб и повышенное потоотделение. Достаточно часто экзантема появляется рано (4-7-й день болезни). Сыпь может быть розеолезной, кореподобной или петехиальной. Она обильная и располагается не только на коже живота и груди, но и конечностей. Характерны полиморфизм высыпаний и подсыпания в динамике заболевания. Чаще заболевание протекает в среднетяжелой форме, интоксикация
выражена умеренно и кратковременно. Возможны тяжелые формы с осложнениями в виде кишечных кровотечений и перфорации кишечника. Как и брюшной тиф, заболевание может принять рецидивирующее течение.
Инкубационный период при паратифе B обычно составляет 5-10 дней. Заболевание начинается остро. Характерно развитие гастроэнтерита с абдоминальными болями, тошнотой, рвотой, послаблением стула и лихорадкой неправильного типа, что можно ошибочно истолковать как начало ПТИ. Температурная реакция носит неправильный характер и относительно укорочена по времени. Экзантема может отсутствовать или появляться рано (5-6-й день болезни), быть полиморфной, располагаться не только на туловище, но и на конечностях. Чаще заболевание протекает в среднетяжелой форме, однако известны случаи тяжелого течения паратифа B с развитием менингита, менингоэнцефалита и септикопиемии.
Дифференциальная диагностика
Дифференциальная диагностика аналогична таковой при брюшном тифе. Учитывая клинические особенности начального периода паратифов, их необходимо отличать от ПТИ (паратиф В), а также от заболеваний, сопровождающихся респираторными катаральными явлениями (паратиф А).
Лабораторная диагностика
См. выше раздел «Брюшной тиф».
Осложнения и исходы
См. выше раздел «Брюшной тиф».
Лечение
См. выше раздел «Брюшной тиф».
Профилактические мероприятия
См. выше раздел «Брюшной тиф».
ШИГЕЛЛЕЗЫ (БАКТЕРИАЛЬНАЯ ДИЗЕНТЕРИЯ, DYSENTERIA)
Шигеллезы - это антропонозные инфекционные заболевания с фекально-оральным механизмом передачи. Вызываются бактериями рода Shigella, протекают в острой и хронической формах. Характеризуются проявлениями общей интоксикации с лихорадкой и признаками воспаления ЖКТ (преимущественно дистального отдела толстой кишки в виде спастического гемоколита).
Краткие исторические сведения
Клинические описания болезни впервые приведены в трудах сирийского врача Аретея Каппадокийского (I в. до н.э.) под названием кровавый, или натужный, понос и в древнерусских рукописях (утроба кровавая, мыт). В медицинской литературе XVIII-XIX вв. подчеркнута склонность заболевания к широкому распространению в виде эпидемий и пандемий. Свойства основных возбудителей дизентерии описаны в конце XIX в. (Раевский А.С., 1875; Шантемесс Д., Видаль Ф., 1888; Кубасов П.И., 1889; Григорьев А.В., 1891; Шига К., 1898), позже были открыты и описаны некоторые другие виды возбудителей заболевания.
Этиология
Возбудители - грамотрицательные неподвижные бактерии рода Shigella семейства Enterobacteriaceae. Согласно современной классификации, шигеллы разделены на 4 подгруппы (A, B, C, D) и, соответственно, на 4 вида - S. dysenteriae, S. flexneri, S. boydii, S. sonnei. Каждый из видов, кроме шигеллы Зоне, включает несколько сероваров. В подгруппе S. dysenteriae различают 16 самостоятельных сероваров (1-16), в том числе Григорьева-Шиги (S. dysenteriae 1), Штутцера-Шмитца (S. dysenteriae 2) и Ларджа-Сакса (S. dysenteriae 3-7). S. flexneri включает 8 сероваров (1-6, X и Y), в том числе Ньюкасл (S. flexneri 6). S. boydii включают 18 сероваров (1-18). S. sonnei серологически не дифференцируют. Всего насчитывают около 50 сероваров шигелл. Этиологическая роль разных шигелл неодинакова. Наибольшее значение практически во всех странах имеют шигеллы Зонне и шигеллы Флекснера - возбудители так называемых больших нозологических форм. На территории РФ также в основном доминируют поражения, вызванные этими бактериями. Неодинаково этиологическое значение и отдельных сероваров шигелл. Среди S. flexneri доминируют подсеровары 2а, 1b и серо-
вар 6, среди S. boydii - серовары 4 и 2, среди S. dysenteriae - серовары 2 и 3. Среди S. sonnei преобладают биохимические варианты Не, IIg и fe.
Все шигеллы хорошо растут на дифференциально-диагностических средах. Температурный оптимум 37 °С, бактерии Зонне могут размножаться при 10-15 °С.
Возбудителей различают по антигенной структуре, биохимической активности, патогенности и вирулентности. Основные Аг шигелл - соматический О-Аг и поверхностный К-Аг. Патогенность возбудителей определяется способностью к образованию экзотоксинов (в том числе Шига-токсина), обладающих энтеротоксической активностью, ЛПСкомплекса (эндотоксина), цитотоксинов и нейротоксинов. Наибольшую энтеро-, нейро-, цитотоксическую активность, а также гемолитические свойства проявляет Шига-токсин возбудителей подгруппы S. dysenteriae, особенно шигелла Григорьева-Шиги (S. dysenteriae 1).
Вирулентность бактерий достаточно вариабельна. Она довольно высока у шигелл Флекснера, особенно подсеротипа 2а, наименее выражена у шигелл Зонне.
Один из важнейших показателей вирулентности бактерий - белкиинвазины, обусловливающие способность возбудителей к внутриклеточному паразитированию в колоноцитах, энтероцитах (в меньшей степени) и макрофагах.
Степень биохимической активности шигелл обратно пропорциональна их вирулентности. Дефицит вирулентности у шигелл Зонне полностью компенсируют их высокая ферментативная активность, неприхотливость к составу питательных сред и скорость размножения в инфицированном субстрате. Шигеллы Зонне также отличаются выраженным антагонизмом по отношению к сапрофитной и молочнокислой микрофлоре. Они интенсивно размножаются в молоке и молочных продуктах. При этом время их сохранения превышает сроки реализации продуктов. Для накопления дозы S. sonnei, инфицирующей взрослых лиц, в молоке при комнатной температуре требуется от 8 до 24 ч. В жаркое время года эти сроки минимальны - для накопления дозы бактерий, достаточной для заражения детей, требуется всего 1-3 ч.
В процессе гибели шигелл Зонне в контаминированных продуктах накапливается термостабильный ЛПС-комплекс (эндотоксин), способный вызывать тяжелые поражения при отрицательных результатах бактериологического исследования инфицированных пищевых продуктов.
Важная особенность шигелл Зонне - их устойчивость к антибактериальным лекарственным средствам.
Устойчивость шигелл вне организма человека умеренная и неодинаковая у разных видов возбудителей. Шигеллы Зонне и Флекснера могут длительно сохраняться в воде.
При нагревании шигеллы быстро погибают:
- при 60 °С - в течение 10 мин;
- при кипячении - мгновенно.
Наименее устойчивы S. flexneri. В последние годы часто выделяют терморезистентные (способные выживать при 59 °С) штаммы шигелл Зонне и Флекснера. Дезинфектанты в обычных концентрациях действуют на шигеллы губительно.
Эпидемиология
Резервуар и источник инфекции - человек (больной острой или хронической формой дизентерии, носитель-реконвалесцент или транзиторный носитель). Наибольшую опасность представляют больные с легкой и стертой формами дизентерии, особенно работающие в пищевой промышленности и приравненные к ним лица. Из организма человека шигеллы начинают выделяться при первых симптомах болезни; продолжительность выделения - 7-10 дней и период реконвалесценции (в среднем 2-3 нед). Иногда выделение бактерий затягивается до нескольких недель или месяцев. Склонность к хронизации инфекционного процесса в наибольшей степени свойственна дизентерии Флекснера, в наименьшей - дизентерии Зонне.
Механизм передачи инфекции - фекально-оральный, пути передачи - водный, пищевой и контактно-бытовой. При дизентерии Григорьева-Шиги основным путем передачи бывает контактнобытовой, который обеспечивает передачу высоковирулентных возбудителей. При дизентерии Флекснера главный путь передачи - вода, при дизентерии Зонне - пища. Бактерии Зонне обладают биологическими преимуществами перед другими видами шигелл. Уступая им по вирулентности, они более устойчивы во внешней среде, при благоприятных условиях могут даже размножаться в молоке и молочных продуктах, что повышает их опасность. Преимущественное действие тех или иных факторов и путей передачи определяет этиологическую структуру заболевания дизентерией. В свою очередь преобладание разных путей передачи зависит от социальной среды, условий жизни населения. Ареал дизентерии Флекснера в основном соответствует территориям, где население до сих пор употребляет эпидемиологически небезопасную воду.
Естественная восприимчивость людей
Естественная восприимчивость людей высокая. Постинфекционный иммунитет нестойкий, видоспецифичный и типоспецифичный, возможны повторные заболевания, особенно при дизентерии Зонне. Иммунитет населения не служит фактором, регулирующим развитие эпидемического процесса. Вместе с тем показано, что после дизентерии Флекснера формируется постинфекционный иммунитет, способный предохранять от повторного заболевания в течение нескольких лет.
Основные эпидемиологические признаки
Бактериальную дизентерию (шигеллезы) относят к повсеместно распространенным болезням. Составляя основную часть так называемых острых кишечных инфекций (или диарейных болезней, по терминологии ВОЗ), шигеллезы - серьезная проблема здравоохранения, особенно в развивающихся странах. Широкое распространение кишечных инфекций обусловлено нищенским уровнем существования людей в антисанитарных жилищных условиях, обычаями и предрассудками, противоречащими элементарным санитарным нормам, недоброкачественным водоснабжением, неполноценным питанием на фоне крайне низкого уровня общей и санитарной культуры и медицинского обслуживания населения. Распространению кишечных инфекций способствуют также конфликтные ситуации разного рода, миграционные процессы и стихийные бедствия. Динамика заболеваемости дизентерией в последние годы характеризуется снижением, показатель заболеваемости в 2007 г. составил 22,2 на 100 000 населения (в 2005 г. - 42,7 , в 2006 г. - 25,1). Сохраняется неравномерное распределение заболеваемости по субъектам РФ, что в значительной степени зависит от социально-экономических условий жизни населения. Наиболее высокие уровни заболеваемости на 100 000 населения зарегистрированы в Ставропольском крае (73,62), Республике Алтай (80,32), Астраханской области (82,61), Республике Тыва (125,0), Чукотском автономном округе (152,1), что в 3-6 раз превышает среднероссийский показатель (22,24). Заболеваемость детей до 17 лет в 2007 г. почти в 3 раза превысила заболеваемость взрослых. Как и в предыдущие годы, более трети случаев заболеваний дизентерией приходится на возрастную группу детей 3-6 лет, в основном посещающих ДДУ, где зачастую реализуется контактно-бытовой путь передачи инфекции. Заболевания дизентерией подтверждаются бактериологически в среднем в 76% случаев, что выше по сравнению с предыдущим
периодом. В этиологической структуре возбудителей на долю шигелл Зонне приходится 54%, шигелл Флекснера - 43%.
На фоне практически повсеместного снижения заболеваемости дизентерией остается высокой вспышечная заболеваемость, как пищевого, так и водного характера, в том числе в детских организованных коллективах. В 2007 г. наиболее крупные вспышки дизентерии имели место в Ставропольском крае с числом пострадавших свыше тысячи человек, в том числе 3 вспышки, связанные с употреблением населением инфицированной продукции, выработанной на местных молокоперерабатывающих предприятиях.
Развитие эпидемического процесса дизентерии определяется активностью механизма передачи возбудителей инфекции, интенсивность которого прямо зависит от социальных (уровень санитарно-коммунального благоустройства населенных пунктов и санитарной культуры населения) и природно-климатических условий. В рамках единого фекально-орального механизма передачи активность отдельных путей (водного, бытового и пищевого) при разных видах шигеллезов различна. Согласно разработанной В.И. Покровским и Ю.П. Солодовниковым (1980) теории этиологической избирательности главных (основных) путей передачи шигеллезов, распространение дизентерии Григорьева- Шиги осуществляется главным образом контактно-бытовым путем, дизентерии Флекснера - водным, дизентерии Зонне - пищевым. С позиции теории соответствия главными становятся пути передачи, обеспечивающие не только широкое распространение, но и сохранение соответствующего возбудителя в природе как вида. Прекращение активности главного пути передачи обеспечивает затухание эпидемического процесса, неспособного постоянно поддерживаться только активностью дополнительных путей.
Характеризуя эпидемический процесс при шигеллезах, следует подчеркнуть, что эти инфекции включают большую группу самостоятельных в эпидемиологическом отношении заболеваний, в том числе так называемых больших (шигеллезы Зонне, Флекснера, Ньюкасл, Гри- горьева-Шиги) и малых (шигеллезы Бойда, Штутцера-Шмитца, Лард- жа-Сакса и др.) нозологических форм. Большие нозологические формы постоянно сохраняют широкое распространение, эпидемиологическое значение малых форм невелико. Вместе с тем следует упомянуть о том, что на протяжении последнего столетия значимость отдельных шигеллезов в патологии человека менялась. Так, в начале ХХ в., в годы Гражданской войны и интервенции, голода и плохой санитарно-бытовой
обстановки, высокая заболеваемость, тяжелые формы и летальность были связаны с распространением дизентерии Григорьева-Шиги. В 40-50-е годы до 90% заболеваний было вызвано шигеллами Флекснера, тогда как вторая половина столетия отмечена преимущественным распространением дизентерии Зонне. Указанную закономерность детерминировали биологические свойства возбудителя и социальноэкономические изменения человеческого общества на разных этапах его развития. Так, изменение социальной среды и условий жизни населения оказались главным регулятором этиологии дизентерии. В последние годы внимание вновь привлекла дизентерия Григорьева-Шиги. В мире сформировалось три крупных очага этой инфекции (Центральная Америка, Юго-Восточная Азия и Центральная Африка) и участились случаи ее завоза в другие страны. Однако для ее укоренения нужны определенные условия, имеющиеся на территории государств Средней Азии. Неконтролируемый поток мигрантов из республик СНГ делает возможным занос дизентерии Григорьева-Шиги и в Россию. Мировой опыт свидетельствует о возможности распространения шигеллезов и второстепенными путями. Так, известны крупные водные вспышки дизентерии Григорьева-Шиги, возникшие во многих развивающихся странах на протяжении конца 60-80-х годов на фоне ее глобального распространения. Однако это не меняет существа эпидемиологических закономерностей отдельных шигеллезов. По мере нормализации ситуации дизентерия Григорьева-Шиги опять получила преимущественное распространение бытовым путем.
Зависимость заболеваемости от санитарно-коммунального благоустройства сделала более распространенной дизентерию Зонне среди городского населения, особенно в ДДУ и коллективах, объединенных единым источником питания. Тем не менее шигеллез Зонне по-прежнему остается преимущественно детской инфекцией. Удельный вес детей в структуре заболеваемости составляет более 50%. Это объясняется тем, что дети больше, чем взрослые, употребляют в пищу молоко и молочные продукты. При этом чаще заболевают дети в возрасте до 3 лет. Существует мнение, что высокая заболеваемость детей, выявляемая значительно полнее, - прямое следствие широкого распространения невыявленной инфекции среди взрослого населения. Детям, более восприимчивым к инфекции по сравнению со взрослыми, для развития заболевания необходима гораздо меньшая доза возбудителя. Невыявленные больные и бактерионосители формируют массивный и достаточно постоянный резервуар возбудителя инфекции среди населения,
определяющий распространение шигеллезов как в виде спорадических случаев, так и в форме эпидемической заболеваемости. Большинство вспышек дизентерии Зонне, связанных с инфицированием молока и молочных продуктов (сметаны, творога, кефира и др.), возникает в результате их загрязнения невыявленными больными на различных этапах сбора, транспортировки, переработки и реализации этих продуктов.
Горожане болеют в 2-3 раза чаще сельских жителей. Для дизентерии характерна летне-осенняя сезонность заболевания. Природный (температурный) фактор опосредует свое воздействие через социальный, способствуя созданию в теплое время года наиболее благоприятных (термостатных) условий для накопления шигелл Зонне в загрязненных молочных продуктах. Аналогично тепло обеспечивает усиление интенсивности эпидемического процесса и при дизентерии Флекснера, опосредуя свое воздействие через главный путь передачи этой нозологической формы - водный. В жаркое время года резко увеличивается потребление воды, приводящее на фоне недоброкачественного водоснабжения населения и к активизации водного фактора, преимущественно реализующегося в виде хронических эпидемий. В последние годы на большинстве территорий РФ отмечают снижение заболеваемости дизентерией Зонне и рост - дизентерией Флекснера. В Москве на фоне выраженного снижения заболеваемости дизентерией Зонне аналогичную тенденцию в отношении дизентерии Флекснера не прослеживают уже 2-3 десятилетия. Существуют данные, что снижение заболеваемости дизентерией Зонне происходит на фоне резкого спада производства и потребления молока и молочных продуктов. Активизация эпидемического процесса при дизентерии Флекснера, очевидно, связана с изменившимися в последние годы социально-экономическими условиями жизни населения. Распространение шигеллеза Флекснера происходит преимущественно вторичным пищевым путем посредством самых разнообразных продуктов питания (действует хронический децентрализованный пищевой путь передачи, реализуемый без предварительного накопления возбудителей, отличающихся высокой вирулентностью и крайне низкой инфицирующей дозой). Высокий уровень заболеваемости и летальности в основном регистрируют среди взрослых из группы социально необеспеченного и неблагополучного населения.
В последние годы при дизентерии Зонне, как и при других кишечных антропонозах, отмечают увеличение удельного веса взрослых. Это связано с тем, что в новых социально-экономических условиях жизни значительная часть населения вынуждена приобретать наиболее деше-
вые продукты, особенно молочные, далеко не гарантированного качества - фляжное молоко, развесные творог и сметану, все еще реализуемые в городе в условиях несанкционированной уличной торговли. Кроме того, на эпидемический процесс оказывают выраженное влияние неблагоприятные социальные факторы последних лет, в том числе появление обширных контингентов асоциальных групп населения (лиц без определенного места жительства, бродяг и т.п.). Как следствие, среди больных значительно увеличился удельный вес старших возрастных групп населения, в том числе пенсионеров, на этом фоне заметно снизилась удельная значимость детского населения. Это однозначно доказывает, что среди взрослого населения указанного контингента развивается своего рода независимый эпидемический процесс, фактически не затрагивающий детей, как результат наиболее выраженного неблагоприятного социального воздействия на распространение дизентерии именно среди этого контингента взрослых. Детальное изучение эпидемического процесса и особенностей клинического течения бактериологически подтвержденной дизентерии у социально незащищенных групп населения (лиц без определенного места жительства), выполненное в Санкт-Петербурге, свидетельствует о значительной роли этих контингентов в распространении дизентерии, так как ее течение в данном случае сопровождают длительная нормализация стула и медленное бактериологическое очищение организма от возбудителя. Это связано с поздним поступлением больных в стационар, сопутствующими заболеваниями и алиментарной недостаточностью.
Патогенез
Инфицирующая доза у S. dysenteriae составляет 3-5 микробных клеток, у S. flexneri и S. Sonnei - 10-200 и 100 000-1 000 000 бактерий соответственно.
В патогенезе шигеллезной инфекции выделяют две фазы:
- тонкокишечную;
- толстокишечную.
Их выраженность проявляется клиническими особенностями вариантов течения заболевания. При заражении шигеллы преодолевают неспецифические факторы защиты ротовой полости и кислотный барьер желудка, затем прикрепляются к энтероцитам в тонкой кишке, секретируя энтеротоксины и цитотоксины. При гибели шигелл происходит выделение эндотоксина (ЛПС-комплекса), абсорбция которого
вызывает развитие синдрома интоксикации. Тонкокишечная фаза инфекции с доминированием диареи гиперсекреторного характера более выражена при пищевом пути заражения и обусловлена энтеротропным действием токсинов шигелл, накопленных в пищевых продуктах.
В тонкой и в толстой кишке взаимодействие шигелл со слизистой оболочкой проходит несколько стадий. Специфические белки наружной мембраны шигелл взаимодействуют с рецепторами плазматической мембраны эпителиоцитов, что обусловливает адгезию, а затем инвазию возбудителей в эпителиальные клетки и подслизистый слой. Происходит активное размножение бактерий в клетках кишечника. Продукция шигеллами гемолизина и цитотоксического энтеротоксина способствует развитию воспалительного процесса с накоплением ИЛ и других медиаторов воспаления. Миграция полиморфно-ядерных лейкоцитов в очаги инвазии является одной из главных причин развития в толстой кишке экссудативного воспаления (катарального или фибринознонекротического с возможным образованием эрозий и язв). При гибели возбудителей выделяется ЛПС-комплекс, катализирующий общие токсические реакции. Прогрессированию патологического процесса способствует незавершенность реакций фагоцитоза.
Наиболее тяжелую форму дизентерии вызывают шигеллы Григорь- ева-Шиги, способные прижизненно выделять термолабильный белковый экзотоксин (токсин Шиги). Гомогенные препараты токсина Шиги проявляют одновременно цитотоксическую активность, энтеротоксичность и нейротоксичность, чем и определяются низкая инфекционная (заражающая) доза этого возбудителя и тяжесть клинического течения болезни. В настоящее время известно, что шигаподобные токсины могут выделять и другие виды шигелл. В результате действия шигелл и ответных реакций макроорганизма развиваются серозный отек и деструкция слизистой оболочки толстой кишки, поражение сосудов и нервных сплетений стенки кишечника, нарушения его функциональной деятельности.
При дизентерии в патологический процесс разной степени выраженности вовлекаются все отделы ЖКТ, даже при практическом отсутствии клинических проявлений со стороны желудка или тонкого кишечника. Нейротропное и вазотропное действие токсинов шигелл приводит к микроциркуляторным нарушениям и поражению ЦНС и вегетативной нервной системы.
Дизентерия постоянно протекает с признаками дисбиоза (дисбактериоза), предшествующего или сопутствующего развитию заболевания.
В конечном итоге все это определяет развитие экссудативной диареи при гипермоторной дискинезии толстой кишки.
Патогенез затяжной и хронической дизентерии еще недостаточно изучен. В настоящее время обсуждают вопрос о роли аутоиммунных процессов в развитии этих состояний.
Им способствуют разнообразные факторы:
- предшествовавшие и сопутствующие заболевания (в первую очередь болезни ЖКТ);
- нарушения иммунологического реагирования в острый период болезни;
- дисбактериоз;
- нарушения диеты;
- употребление алкоголя;
- неполноценное лечение и др.
Механизм развития диареи при шигеллезной инфекции иллюстрирует рис. 3-2.
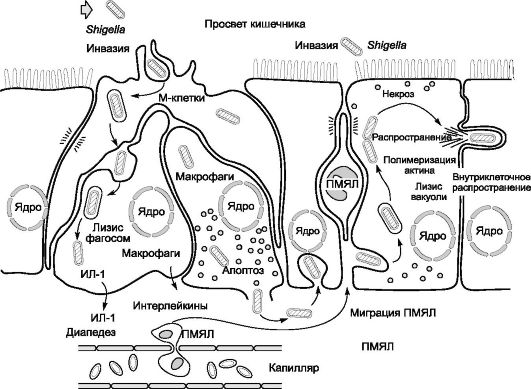 Рис. 3-2. Механизм развития диареи при шигеллезной инфекции: ИЛ - интерлейкин; ПМЯЛ - полиморфно-ядерные лейкоциты
Рис. 3-2. Механизм развития диареи при шигеллезной инфекции: ИЛ - интерлейкин; ПМЯЛ - полиморфно-ядерные лейкоциты
Клиническая картина
В соответствии с особенностями клинических проявлений и длительностью течения заболевания в настоящее время выделяют следующие формы и варианты дизентерии (Покровский В.И., Ющук Н.Д., 1994).
• Форма - острые шигеллезы.
◊ Клинические варианты - колитический, гастроэнтероколитический, гастроэнтеритический.
<8> Тяжесть течения - легкая, среднетяжелая, тяжелая. - Особенности течения - стертое, затяжное.
• Форма - хронические шигеллезы.
- Тяжесть течения - легкая, среднетяжелая, тяжелая.
<8> Особенности течения - рецидивирующее, непрерывное.
• Форма - шигеллезное бактерионосительство.
<8> Особенности течения - субклиническое, реконвалесцентное. Разнообразие форм и вариантов дизентерии связано со многими причинами:
- исходным состоянием макроорганизма;
- сроками начала и характером лечения и т.д. Определенное значение имеет и вид возбудителя, вызвавшего заболевание. Так, дизентерию, вызванную шигеллами Зонне, отличают склонность к развитию более легких и даже стертых атипичных признаков без деструктивных изменений в слизистой оболочке кишечника, кратковременное течение в виде гастроэнтеритического и гастроэнтероколитического вариантов. Для дизентерии, вызванной шигеллами Флекснера, более характерен типичный колитический вариант с интенсивным поражением слизистой оболочки толстой кишки, выраженными клиническими проявлениями, нарастанием в последние годы частоты тяжелых форм и осложнений. Дизентерия Григорьева-Шиги обычно протекает очень тяжело, склонна к развитию выраженной дегидратации, сепсиса, ИТШ.
Инкубационный период
Инкубационный период при острой форме дизентерии колеблется от 1 до 7 дней, в среднем составляет 2-3 дня.
Колитический вариант острых шигеллезов считается наиболее типичным вариантом дизентерии и чаще всего протекает как заболевание средней степени тяжести. Характерно острое начало с повышения температуры тела до 38-39 °С, сопровождающееся ознобом, головной болью,
чувством разбитости, апатией и продолжающееся в течение нескольких первых дней болезни. Быстро снижается аппетит вплоть до полной анорексии. Нередко возникает тошнота, иногда повторная рвота. Больного беспокоят режущие схваткообразные боли в животе. Сначала они носят разлитой характер, в дальнейшем локализуются в нижних отделах живота, преимущественно в левой подвздошной области. Почти одновременно появляется частый жидкий стул, сначала полужидкий, калового характера, без патологических примесей. Каловый характер испражнений быстро теряется с последующими дефекациями, стул становится скудным, с большим количеством слизи. В дальнейшем в испражнениях зачастую появляются прожилки крови, а иногда и примеси гноя. Такие испражнения обозначают термином «ректальный плевок» (см. рис. 2 на цветной вклейке). Частота дефекаций нарастает до 10 раз в сутки и более. Акт дефекации сопровождается тенезмами - мучительными тянущими болями в области прямой кишки. Нередки ложные позывы. Частота стула зависит от тяжести заболевания, но при типичном колитическом варианте дизентерии общее количество выделяемых каловых масс небольшое, что не приводит к серьезным водно-электролитным расстройствам.
При осмотре больного отмечают сухость и обложенность языка. При пальпации живота выявляют болезненность и спазм толстой кишки, особенно в ее дистальном отделе («левыш» колит). Однако в ряде случаев наибольшую интенсивность болевых ощущений отмечают в области слепой кишки («правый» колит). Изменения со стороны сердечнососудистой системы проявляются тахикардией и склонностью к артериальной гипотензии. При колоноскопии или ректороманоскопии, в последнее время редко применяемой при типичном колитическом варианте острой дизентерии, в дистальных отделах толстой кишки находят катаральный процесс или деструктивные изменения слизистой оболочки в виде эрозий и язв.
Выраженные клинические проявления заболевания обычно угасают к концу 1-й - началу 2-й недели болезни:
- нормализуется температура тела;
- медленно исчезают проявления колитического синдрома. Полное выздоровление, включая репарацию слизистой оболочки
кишечника, требует 3-4 нед.
Легкое течение колитического варианта острой дизентерии отличают кратковременный субфебрилитет, умеренные боли в животе, частота дефекаций лишь несколько раз в сутки, катаральные, реже
катарально-геморрагические изменения слизистой оболочки толстой кишки.
При тяжелом течении болезни наблюдают гипертермию с выраженными признаками интоксикации (обмороки, бред), сухость кожи и слизистых оболочек, стул в виде ректального плевка или мясных помоев до десятков раз в сутки, резкие боли в животе и мучительные тенезмы, выраженные изменения гемодинамики (стойкая тахикардия и артериальная гипотензия, глухость тонов сердца). Возможны парез кишечника, коллапс, ИТШ.
Гастроэнтероколитический вариант острой дизентерии отличают короткий (6-24 ч) инкубационный период, острое и бурное начало заболевания с повышением температуры тела, раннее появление тошноты и рвоты, боли в животе разлитого схваткообразного характера. Почти одновременно присоединяется многократный, довольно обильный жидкий стул без патологических примесей. Отмечают тахикардию и артериальную гипотензию.
Этот начальный период гастроэнтеритических проявлений и симптомов общей интоксикации непродолжительный и напоминает клиническую картину ПТИ.
В дальнейшем на 2-3-й день болезни заболевание приобретает характер энтероколита:
- прекращается рвота;
- количество выделяемых каловых масс становится скудным, в них появляется слизь, иногда с прожилками крови.
Боли в животе преимущественно локализуются в левой подвздошной области, как и при колитическом варианте дизентерии. При обследовании определяют спазм и болезненность толстой кишки.
Чем более выражен гастроэнтеритический синдром, тем демонстративнее признаки дегидратации, способной достигать II-III степени (см. главу 4, раздел «Сальмонеллезы»). Степень дегидратации обязательно учитывают при оценке тяжести течения заболевания.
Гастроэнтеритический вариант начинается остро после непродолжительного инкубационного периода (6-12 ч). Быстро развивающаяся клиническая симптоматика очень напоминает таковую при сальмонеллезе и ПТИ, что крайне затрудняет дифференциальную диагностику. Многократная рвота и частый жидкий стул могут привести к дегидратации. В дальнейшем симптомы поражения толстой кишки не развиваются (отличительный признак этого варианта дизентерии). Течение заболевания бурное, но кратковременное.
Стертое течение дизентерии в настоящее время встречают довольно часто, его трудно диагностировать клинически. Больные жалуются на чувство дискомфорта или боли в животе различного характера, которые могут быть локализованы и в нижних отделах живота (чаще слева).
Проявления диареи незначительны. Стул 1-2 раза в сутки, кашицеобразный, зачастую без патологических примесей. Болезненность и спазм сигмовидной кишки в большинстве случаев четко определяют при пальпации. Температура тела остается нормальной или повышается лишь до субфебрильных цифр. Подтверждение диагноза возможно при повторном бактериологическом обследовании, а также при колоноскопии, в большинстве случаев выявляющей катаральные изменения слизистой оболочки сигмовидной и прямой кишки.
Длительность течения острой дизентерии подвержена значительным колебаниям (от нескольких дней до 1 мес). В небольшом проценте случаев (1-5%) наблюдают затяжное течение заболевания. При этом на протяжении 1-3 мес постоянно сохраняются дисфункция кишечника в виде сменяющих друг друга состояний диареи и запоров, боли в животе разлитого характера или локализованные в нижних отделах живота. У больных ухудшается аппетит, развивается общая слабость, наблюдают потерю массы тела.
Хроническая форма дизентерии - заболевание с длительностью течения более 3 мес. В настоящее время ее наблюдают редко. Клинически может протекать в виде рецидивирующего и непрерывного вариантов.
• Рецидивирующее течение хронической дизентерии в периоды рецидивов по своей клинической картине в основном аналогично проявлениям острой формы шигеллеза. Периодически возникает выраженная дисфункция кишечника с болями в животе, спазмом и болезненностью сигмовидной кишки при пальпации, субфебрильной температурой тела. Изменения слизистой оболочки сигмовидной и прямой кишки в основном аналогичны таковым при острой форме, однако возможно чередование пораженных участков слизистой оболочки с малоизмененными или атрофированными; сосудистый рисунок усилен. Сроки наступления, длительность рецидивов и периодов ремиссии между ними, отличающихся вполне удовлетворительным самочувствием больных, подвержены значительным колебаниям.
• Непрерывное течение хронической дизентерии встречают значительно реже. Оно характеризуется развитием глубоких изменений в ЖКТ. Симптомы интоксикации слабые или отсутствуют, больных бес-
покоят боли в животе, ежедневная диарея от одного до нескольких раз в день. Стул кашицеобразный, нередко с зеленоватой окраской. Ремиссий не наблюдают. Признаки заболевания медленно, но постоянно прогрессируют, у больных снижается масса тела, появляется раздражительность, развиваются дисбактериоз и гиповитаминоз.
Шигеллезное бактерионосительство может быть субклиническим и реконвалесцентным. Кратковременное субклиническое бактерионосительство наблюдают у лиц при отсутствии клинических признаков заболевания на момент обследования и за 3 мес до него. Однако в ряде случаев при этом можно обнаружить АТ к Аг шигелл в РНГА, а также патологические изменения слизистой оболочки толстой кишки при эндоскопическом исследовании.
После клинического выздоровления возможно формирование более длительного реконвалесцентного бактерионосительства - острого, затяжного или хронического с выделением шигелл соответственно от 1 до 3 мес и более.
Дифференциальная диагностика
Острую дизентерию дифференцируют от ПТИ, сальмонеллеза, эшерихиоза, ротавирусного гастроэнтерита, амебиаза, холеры, неспецифического язвенного колита, опухолей кишечника, кишечных гельминтозов, тромбоза брыжеечных сосудов, кишечной непроходимости и других состояний. При колитическом варианте заболевания учитывают острое начало, лихорадку и другие признаки интоксикации, схваткообразные боли в животе с преимущественной локализацией в левой подвздошной области, скудный стул со слизью и прожилками крови, ложные позывы, тенезмы, уплотнение и болезненность сигмовидной кишки при пальпации. При легком течении этого варианта интоксикация выражена слабо, жидкий стул калового характера не содержит примесей крови. Гастроэнтеритический вариант клинически неотличим от такового при сальмонеллезе. При гастроэнтероколитическом варианте в динамике заболевания четко выраженными становятся признаки колита. Стертое течение острой дизентерии клинически диагностировать наиболее трудно.
Дифференциальную диагностику хронической дизентерии проводят в первую очередь с колитами и энтероколитами, онкологическими процессами в толстой кишке. При постановке диагноза оценивают данные
анамнеза с указанием на перенесенную острую дизентерию в течение последних 2 лет, постоянный или эпизодически возникающий кашицеобразный стул с патологическими примесями и болями в животе, часто спазм и болезненность сигмовидной кишки при пальпации, снижение массы тела, проявления дисбиоза и гиповитаминоза.
Лабораторная диагностика
В общем анализе крови при шигеллезах отмечают лейкоцитоз с палочкоядерным сдвигом, токсическую зернистость нейтрофилов, повышение СОЭ. Достоверно диагноз подтверждают результаты бактериологического исследования - выделение шигелл из каловых и рвотных масс, а при дизентерии Григорьева-Шиги из крови при посеве биоматериала на среды Эндо, Левина, Плоскирева, Кауфмана и др. Однако частота высеваемости шигелл в условиях различных ЛПУ остается невысокой (20-40%). Применение серологических методов лабораторной диагностики (РА, РНГА, ИФА) часто ограничено медленным нарастанием титров специфических АТ, что дает врачу лишь ретроспективный результат. В последние годы в практику широко внедряют методы экспресс-диагностики, выявляющие Аг шигелл в испражнениях, слюне и моче (РКА, РЛА, РНГА с антительным диагностикумом, ИФА), а также РСК и реакцию агрегатгемагглютинации. Для корректировки лечебных мероприятий полезно определение формы и степени дисбиоза по соотношению микроорганизмов естественной флоры кишечника. Эндоскопические исследования имеют определенное значение для постановки диагноза дизентерии, однако их применение целесообразно лишь в сложных случаях дифференциальной диагностики.
Осложнения и исходы
Осложнения острых шигеллезов в настоящее время встречают редко. При тяжелом течении дизентерии Григорьева-Шиги и Флекснера описаны случаи ИТШ, острой недостаточности коры надпочечников, тяжелого дисбактериоза, перфорации кишечника, перфоративного серозного и гнойного перитонита, пареза и инвагинации кишечника, трещин и эрозий заднего прохода, геморроя, выпадения слизистой оболочки прямой кишки, энцефалитического и гемолитико-уремического синдромов. Возможны также осложнения, обусловленные вторичной микрофлорой. В ряде случаев после перенесенных шигеллезов развиваются дисфункции кишечника (постдизентерийный колит).
Лечение
При удовлетворительных санитарно-бытовых условиях больных шигеллезами в большинстве случаев можно лечить дома. Госпитализации подлежат лица с тяжелым, затяжным и хроническим течением дизентерии, а также люди пожилого возраста, дети до 1 года, больные с тяжелыми сопутствующими заболеваниями. Госпитализацию также проводят и по эпидемиологическим показаниям.
Необходима диета с учетом индивидуальной переносимости продуктов. Больному назначают стол ? 4 до стихания острых признаков заболевания. Затем назначают диету ? 2 на 3-5 дней и в последующем стол ? 13 на срок до 4-6 нед (средние сроки морфологической репарации слизистой оболочки кишечника). В среднетяжелых и тяжелых случаях назначают полупостельный или постельный режим.
При среднетяжелом и тяжелом течении острой дизентерии назначают этиотропное лечение, его основу составляют антибактериальные препараты в средних терапевтических дозах с курсом лечения 5-7 дней. Рекомендуют фторхинолоны, цефалоспорины 3-го поколения, а также комбинированные сульфаниламиды (ко-тримоксазолР). В связи с ограниченностью применения фторхинолонов в детской практике можно использовать нитрофураны, невиграмон*, неграм* в средних возрастных дозах. Антибиотики применяют с осторожностью из-за развития дисбактериоза. В связи с этим расширены показания к назначению пробиотиков (бифидумбактерин*, бификол*, колибактерин*, лактобакте- рин* и др.) по 5-10 доз в сутки в течение 3-4 нед. Кроме того, следует учитывать нарастающую устойчивость возбудителя к левомицетину, тетрациклиновым препаратам, ко-тримоксазолуР, препаратам нитрофуранового ряда и налидиксовой кислоты (невиграмон*, неграм*).
Применение антибактериальных препаратов не показано при гастроэнтеритическом варианте заболевания из-за задержки сроков клинического выздоровления и санации, возможного развития дисбактериоза, снижения активности иммунных реакций. В случаях бактерионосительства целесообразность проведения этиотропной терапии сомнительна.
По показаниям проводят дезинтоксикационное, регидратационное и симптоматическое лечение. Назначают иммуномодуляторы (при хронических формах заболевания под контролем иммунограммы), ферментные комплексные препараты (панзинорм*, мезим-форте*, фестал* и др.), энтеросорбенты (смекта*, энтеросорб*, энтерокат-М* и др.), спазмолитики, вяжущие средства.
В период реконвалесценции у больных с выраженными воспалительными изменениями и замедленной репарацией слизистой оболочки дистального отдела толстой кишки положительный эффект оказывают лечебные микроклизмы с настоями эвкалипта, ромашки, масел шиповника и облепихи, винилина и т.д.
В случаях хронической дизентерии лечение бывает сложным и требует индивидуального подхода к каждому больному с учетом его иммунного статуса. В связи с этим лечение больных в стационаре значительно эффективнее амбулаторного. При рецидивах и обострениях процесса применяют те же средства, что и при лечении больных острой дизентерией. Вместе с тем применение антибиотиков и нитрофуранов менее эффективно, чем при острой форме. Для максимального щажения ЖКТ назначают диетотерапию. Рекомендуют физиотерапевтические процедуры, лечебные клизмы, эубиотики.
Эпидемиологический надзор
Эпидемиологический надзор включает контроль за санитарным состоянием пищевых объектов и ДДУ, соблюдением должного технологического режима при приготовлении и хранении пищевых продуктов, санитарно-коммунальным благоустройством населенных пунктов, состоянием и эксплуатацией водопроводно-канализационных сооружений и сетей, а также за динамикой заболеваемости на обслуживаемых территориях, биологическими свойствами циркулирующих возбудителей, их видовой и типовой структурой.
Профилактические мероприятия
В профилактике дизентерии решающая роль принадлежит гигиеническим и санитарно-коммунальным мероприятиям. Необходимо соблюдать санитарный режим на пищевых предприятиях и рынках, в учреждениях общественного питания, продовольственных магазинах, детских учреждениях и сооружениях водоснабжения. Большое значение имеют очистка территории населенных мест и охрана водоемов от загрязнения канализационными стоками, особенно сточными водами лечебных учреждений. Немалую роль играет соблюдение правил личной гигиены. Большое значение в профилактике шигеллезов имеет гигиеническое воспитание и пропаганда здорового образа жизни. Гигиенические навыки следует прививать детям в семье, детских учреждениях и школе.
Важно обеспечить действенную разъяснительную работу среди населения по предупреждению употребления для питья воды сомнительного качества без термической обработки и купания в загрязненных водоемах. Особое значение гигиеническое обучение имеет среди лиц определенных профессий (работники пищевых предприятий, объектов общественного питания и торговли пищевыми продуктами, водоснабжения, ДДУ и др.). При устройстве на такие места работы необходима предварительная сдача санитарных минимумов.
Лиц, поступающих на работу на пищевые и приравненные к ним предприятия и учреждения, подвергают однократному бактериологическому обследованию. При выделении возбудителей дизентерии и острых кишечных заболеваний людей не допускают к работе и направляют на лечение. Детей, вновь поступающих в ясельные группы ДДУ в период сезонного подъема заболеваемости дизентерией, принимают после однократного обследования на кишечную группу инфекций. Детей, возвращающихся в детское учреждение после любого перенесенного заболевания или длительного (5 дней и более) отсутствия, принимают по справке с указанием диагноза или причины болезни.
Мероприятия в эпидемическом очаге
Больные подлежат госпитализации по клиническим и эпидемиологическим показаниям. Если больного оставляют дома, ему назначают лечение, проводят разъяснительную работу о порядке ухода за ним и выполняют текущую дезинфекцию в квартире. Реконвалесцентов после дизентерии выписывают не ранее чем через 3 дня после нормализации стула и температуры тела при отрицательном результате контрольного однократного бактериологического исследования, проведенного не ранее чем через 2 дня после окончания лечения. Работников пищевых предприятий и лиц, приравненных к ним, выписывают после двукратного отрицательного контрольного бактериологического исследования и допускают к работе по справке врача. Детей младшего возраста, посещающих и не посещающих детские учреждения, выписывают с соблюдением тех же требований, что и для работников питания, и допускают в коллективы сразу после выздоровления. После выписки реконвалесценты должны находиться под наблюдением врача кабинета инфекционных заболеваний поликлиники. За лицами, страдающими хронической дизентерией и выделяющими возбудитель, а также бактерионосителями устанавливают диспансерное наблюдение на 3 мес с
ежемесячным осмотром и бактериологическим обследованием. Работники пищевых предприятий и лица, к ним приравненные, перенесшие острую дизентерию, подлежат диспансерному наблюдению в течение 1 мес, а перенесшие хроническую дизентерию - 3 мес с ежемесячным бактериологическим обследованием. По истечении данного срока при полном клиническом выздоровлении эти лица могут быть допущены к работе по специальности. Переболевшие дизентерией дети, посещающие ДДУ, школы-интернаты, детские оздоровительные учреждения, также подлежат наблюдению в течение 1 мес с двукратным бактериологическим обследованием и клиническим осмотром в конце этого срока.
За лицами, контактировавшими с больным дизентерией или носителем, устанавливают медицинское наблюдение в течение 7 дней. Работников пищевых предприятий и лиц, приравненных к ним, подвергают однократному бактериологическому обследованию. При положительном результате обследования их отстраняют от работы. Детей, посещающих ДДУ и проживающих в семье, где имеется больной дизентерией, допускают в детское учреждение, но за ними устанавливают медицинское наблюдение и проводят однократное бактериологическое обследование.
ЭШЕРИХИОЗЫ (ESCHERICHIOSES)
Эшерихиозы (коли-инфекции) - это острые инфекционные заболевания с фекально-оральным механизмом передачи, вызываемые диареегенными штаммами кишечной палочки. Характеризуются развитием интоксикации и преимущественным поражением ЖКТ в виде энтерита или энтероколита, в редких случаях - генерализованных форм с внекишечными проявлениями.
Краткие исторические сведения
Свое название бактерии получили в честь немецкого педиатра Т. Эшериха, впервые обнаружившего кишечную палочку (1885). Escherichia coli - постоянный обитатель кишечника здоровых людей. Способность кишечной палочки вызывать поражения ЖКТ экспериментально доказал Г.Н. Габричевский (1894). В клинико-лабораторных исследованиях данный факт подтвердили А. Адам (1933) и J. Bray
(1945).
Ф. Кауффман в 1940-х годах при помощи серологического анализа доказал различие антигенной структуры патогенных и непатогенных кишечных палочек, что легло в основу их современной микробиологической классификации. Термин «энтеропатогенная кишечная палочка» (ЭПКП) ввел E. Neter (1955).
Этиология
Возбудители - диареегенные (по определению ВОЗ) серовары вида E. coli, рода Escherichia, семейства Enterobacteriaceae. Морфологически представляют собой подвижные грамотрицательные палочки, серовары неотличимы друг от друга. Хорошо растут на обычных питательных средах, способны к образованию S- и R-форм, обладают выраженной биохимической активностью. У E. coli выделяют соматические О-Аг, определяющие серогруппу, поверхностные (капсульные) К-Аг типов А, В и L и жгутиковые типоспецифические Н-Аг. Бактерии устойчивы во внешней среде, месяцами сохраняются в почве, воде, испражнениях. Хорошо переносят высушивание, способны размножаться в пищевых продуктах, особенно в молоке. Быстро погибают при кипячении и дезинфекции.
Вид E. coli включает более 170 антигенных вариантов эшерихий. Большинство из них условно-патогенные и входят в состав микрофлоры кишечника и влагалища. Свыше 80 патогенных (диареегенных) сероваров вызывают коли-инфекцию. Некоторые серовары эшерихий обусловливают поражения урогенитального тракта (уропатогенные штаммы) и генерализованные инфекции (менингит, сепсис).
Диареегенные серовары кишечной палочки разделяют на 5 групп (табл. 3-2):
• Энтеропатогенные E. coli (ЭПКП) включают около 15 серогрупп и 29 сероваров.
• Энтероинвазивные E. coli (ЭИКП) включают около 9 серогрупп и 13 сероваров. Наибольшее значение имеют штаммы О124 и О151.
• Энтеротоксигенные E. coli ЭТКП включают 17 серогрупп и 16 сероваров.
• Энтерогеморрагические E. coli (ЭГКП) включают серогруппы О157,
026, О111, О145.
• Энтероадгезивные (энтероаггрегативные) E. coli (ЭАКП) окончательно не дифференцированы. Отличаются способностью быстро прикрепляться к кишечному эпителию.
Таблица 3-2. Классификация диареегенных E. coli
Категория Серогруппа Серовар
 * Полужирным шрифтом выделены ведущие серогруппы.
* Полужирным шрифтом выделены ведущие серогруппы.
** В материалах ВОЗ (1989) в числе ЭТКП указаны также серогруппы О71, О92, О166, О169.
Эпидемиология
Резервуар и источник инфекции - человек, больной или носитель. Большую эпидемическую опасность представляют больные; среди них наиболее опасны больные эшерихиозами, вызванными ЭПКП и ЭИКП, менее - больные эшерихиозами, обусловленными ЭТКП, ЭГКП и ЭАКП. Период контагиозности источника зависит от свойств возбудителя. При эшерихиозах, вызванных ЭТКП и ЭГКП, больной заразен только в первые дни болезни. При заболеваниях, обусловленных ЭИКП
и ЭПТК, - 1-2 нед (иногда до 3 нед). Носители выделяют возбудитель непродолжительное время, причем дети - более длительно.
Механизм передачи - фекально-оральный, пути передачи - пищевой, водный и бытовой. По данным ВОЗ, заражение ЭТКП и ЭИКП чаще происходит пищевым путем, а ЭПКП - бытовым. Среди пищевых продуктов преобладают молочные изделия (нередко творог), готовые мясные блюда, напитки (компот, квас и др.), салаты из вареных овощей. В детских коллективах, а также в больничных условиях возбудитель может распространяться через предметы ухода, игрушки, руки матерей и персонала. При энтерогеморрагических эшерихиозах заражение людей происходит при употреблении в пищу недостаточно термически обработанного мяса, а также сырого молока. Описаны вспышки заболеваний, связанные с употреблением гамбургеров. Водный путь передачи эшерихиозов наблюдают реже; опасно интенсивное загрязнение открытых водоемов в результате сброса необезвреженных хозяйственно-бытовых и сточных вод, особенно из инфекционных больниц.
Естественная восприимчивость людей
Естественная восприимчивость к эшерихиозам достаточно высокая, однако она варьирует в разных возрастных группах населения. Особенно она выражена среди новорожденных и ослабленных детей. Перенесенное заболевание оставляет нестойкий группоспецифический иммунитет.
Основные эпидемиологические признаки
Заболевание распространено повсеместно.
Эпидемиологические черты эшерихиозов, вызванных разными сероварами, могут существенно различаться.
• ЭПКП - возбудители энтероколитов у детей первого года жизни. Заболеваемость обычно регистрируют в виде вспышек в ДДУ и больницах. Возбудители передаются, как правило, контактнобытовым путем - через руки взрослых (родильниц и персонала) и различные предметы (шпатели, термометры и др.). Известны пищевые вспышки инфекции, в основном при искусственном вскармливании детей раннего возраста.
• ЭИКП - возбудители дизентериеподобных заболеваний у детей старше 1 года и взрослых. Обычно больные выделяют бактерии в течение 1 нед. Возбудитель передается через воду и пищу. Эпидемический процесс дизентериеподобных эшерихиозов про-
текает в виде групповых заболеваний и вспышек при употреблении зараженной воды и пищи. Заболевания отличает летне-осенняя сезонность; их чаще регистрируют в развивающихся странах.
• ЭТКП - возбудители холероподобных заболеваний у детей в возрасте до 2 лет и взрослых. Эти возбудители широко распространены в странах с жарким климатом и плохими санитарно-гигиеническими условиями. Чаще регистрируют спорадические, реже групповые заболевания. В РФ ЭТКП выделяют редко, чаще при расшифровке завозных случаев заболеваний, составляющих основную группу так называемой диареи путешественников. От больных бактерии выделяют 7-10 дней. Заражение происходит через воду и пищу. Контактно-бытовая передача маловероятна, так как для заражения имеет значение доза возбудителя.
• Эпидемиология эшерихиозов, вызываемых ЭГКП, изучена недостаточно. Известно, что заболевания преобладают среди детей старше 1 года и взрослых, также зарегистрированы вспышки в домах престарелых. Установлено, что природный биотоп ЭГКП О157:О7 - кишечник крупного рогатого скота.
Важное влияние на заболеваемость эшерихиозами оказывают санитарно-гигиенические условия жизни людей (благоустройство жилья, обеспеченность доброкачественной питьевой водой и пищевыми продуктами и др.). Общий признак всех форм эшерихиозов - отсутствие взаимосвязи между заболеваемостью и группами населения по профессии или роду занятий.
Патогенез
Общий признак всех диареегенных эшерихий - определенные типы фимбрий, с помощью которых осуществляется адгезия и колонизация возбудителей на слизистой оболочке кишечника. Механизмы развития заболеваний зависят от принадлежности диареегенных эшерихий к конкретным группам, которые обладают различными факторами патогенности.
ЭПКП главным образом вызывают заболевание у детей раннего возраста с поражением преимущественно тонкой кишки. Патогенез поражений обусловлен адгезией бактерий к эпителию кишечника и повреждением микроворсинок, но не инвазией в клетки. Указанные повреждения приводят к развитию синдрома мальабсорбции - основного механизма диареи при ЭПКП.
Факторы патогенности ЭТКП - пили-, или фимбриальные, факторы, облегчающие адгезию к эпителию и способствующие колонизации тонкой кишки, а также определяющие способность к токсинообразованию. Эшерихии выделяют термолабильный и термостабильный энтеротоксины. Эффект высокомолекулярного термолабильного токсина аналогичен действию токсина холерного вибриона [активация аденилатциклазной системы с образованием циклического аденозин 3 ',5 '-монофосфата (цАМФ) и циклического гуанозинмонофосфата (цГМФ)]. Эти возбудители часто становятся этиологическим фактором секреторной диареи у взрослых и детей (рис. 3-3).
 Рис. 3-3. Механизм развития диареи под воздействием энтеротоксигенных E. coli (ЭТКП)
Рис. 3-3. Механизм развития диареи под воздействием энтеротоксигенных E. coli (ЭТКП)
ЭИКП подобно шигеллам проникают и размножаются в клетках эпителия кишечника, вызывают их деструкцию и приводят к развитию эрозий слизистой оболочки с воспалительной реакцией в подслизистом
слое. Как и шигеллы, они неподвижны и часто не способны ферментировать лактозу. Анализ ДНК-гомологии показывает, что ЭИКП - это шигеллы, но из-за медицинской значимости их оставили в составе рода Escherichia. Повреждение эпителия способствует увеличению всасывания в кровь эндотоксина бактерий (рис. 3-4). ЭИКП могут продуцировать энтеротоксины, которые вызывают секреторную диарею в начальном периоде заболевания.
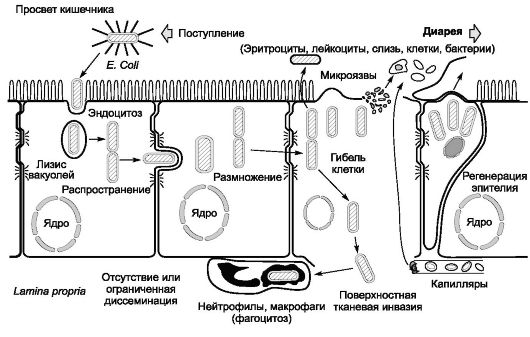 Рис. 3-4. Механизм развития диареи под воздействием энтероинвазивных E. coli (ЭИКП)
Рис. 3-4. Механизм развития диареи под воздействием энтероинвазивных E. coli (ЭИКП)
Ведущую роль в патогенезе эшерихиозов, обусловленных ЭГКП, играют шигаподобные токсины двух типов, обладающих выраженной цитотоксической активностью. Под их действием развиваются местные некротические поражения и кровоизлияния. Проникая в кровь, они усиливают токсическое действие ЛПС-комплекса, что может приводить к развитию гемолитико-уремического синдрома и полиорганной недостаточности (ДВС-синдром, ИТШ, поражение эндотелия сосудов в клубочках почек и ОПН).
ЭАКП, прикрепляясь к эпителиоцитам кишечника в виде нескольких слоев, напоминающих укладку кирпичей, стимулируют продукцию
слизи, усиливающей персистенцию бактерий и создающей барьер для проникновения антибиотиков и антибактериальных факторов макроорганизма.
Клиническая картина
Клиническая классификация эшерихиозов, предложенная Н.Д. Ющуком, Ю.Я. Венгеровым и соавт. (1999), разделяет их на следующие группы.
• По этиологическим признакам:
◊ энтеропатогенные эшерихиозы;
◊ энтеротоксигенные эшерихиозы;
◊ энтероинвазивные эшерихиозы;
◊ энтерогеморрагические эшерихиозы.
• По форме заболевания:
◊ гастроэнтеритические;
◊ энтероколитические;
◊ гастроэнтероколитические;
◊ генерализованные (коли-сепсис, менингиты, пиелонефриты, холециститы).
• По тяжести течения:
◊ легкие;
◊ средней тяжести;
◊ тяжелые.
ЭПКП 1-го класса вызывают заболевание в основном у детей раннего возраста. Инкубационный период обычно длится 2-7 дней. Основные клинические проявления:
- острое начало болезни;
- спастические абдоминальные боли;
- диарея с водянистым стулом;
- тошнота и рвота;
- выраженный синдром интоксикации с быстрой дегидратацией. Возможно развитие септического процесса.
ЭПКП 2-го класса поражают детей и взрослых. В этих случаях клиническая картина заболевания часто напоминает сальмонеллез, но в большинстве случаев заболевание протекает с субфебрильной и даже нормальной температурой.
ЭИКП вызывают дизентериеподобные эшерихиозы, клинически сходные с шигеллезами. Инкубационный период продолжается 1-3 дня, но может быть и 6-8 ч.
Заболевание начинается остро с умеренными проявлениями синдрома интоксикации:
- головной болью;
- слабостью;
- повышением температуры тела от субфебрильных до высоких показателей;
- ознобом.
Вскоре присоединяются схваткообразные боли в животе, возникает диарея, в испражнениях возможны патологические примеси - слизь и даже прожилки крови. У отдельных больных присутствуют тенезмы и ложные позывы. При пальпации живота определяют болезненность по ходу толстой кишки и часто в околопупочной области. Заболевание протекает в легкой, стертой, иногда среднетяжелой формах, длится от нескольких до 10 сут.
ЭТКП вызывают заболевания, сходные по клинической картине с сальмонеллезами, ПТИ и легкой формой холеры. Инкубационный период составляет 1-3 дня. Проявления интоксикации слабые, температура тела в большинстве случаев остается нормальной. Возникают схваткообразные боли в эпигастральной и пупочной областях, но иногда они могут отсутствовать. Нарастает тошнота, появляются повторная рвота и обильный водянистый стул. Эти признаки приводят к развитию обезвоживания. Иногда отмечают олигурию. Заболевание часто именуют диареей путешественников, возникающей у лиц, посещающих страны тропического пояса.
ЭГКП поражают преимущественно детей. Инкубационный период варьирует от 1 до 7 дней, в среднем длится 3-4 дня. Заболевание проявляется тошнотой и иногда рвотой, диареей водянистого характера. Интоксикация слабая или умеренная, повышение температуры тела отмечают лишь у трети больных. К 3-4-му дню болезни усиливаются схваткообразные боли в животе, стул учащается до 10-12 раз в сутки, водянистые испражнения приобретают вид мясных помоев за счет примеси крови, иногда значительной. Стул может быть и бескаловым кровянистым или кровянисто-гнойным (клинические проявления катарально-геморрагического или фибринозно-язвенного колита). Клиническая картина заболевания в большинстве случаев купируется самостоятельно в течение 8-10 дней. Однако у части больных с тяжелым течением (в основном у детей раннего возраста и лиц старше 60 лет) после прекращения диареи на 7-10-й день болезни может развиться гемолитико-уремический синдром. При этом состоянии характерно сочетание ОПН с гемолитической анемией и тромбоцитопенией.
Часто присоединяются церебральные нарушения:
- судороги мышц конечностей;
- мышечная ригидность;
- гемипарезы;
- сопор и кома.
ЭАКП обусловливают персистирующую диарею в развивающихся странах тропиков и медленно текущую диарею в индустриально развитых странах. Эти состояния изучены еще недостаточно.
Дифференциальная диагностика
Эшерихиозы дифференцируют от ПТИ, сальмонеллезов, шигеллезов, холеры, кампилобактериозов и вирусных гастроэнтеритов.
Из-за выраженного клинического сходства эшерихиозов, вызванных различными категориями диареегенных E. сoli, с теми или иными из перечисленных заболеваний решающее значение имеют результаты комплексного исследования:
- клинического;
- эпидемиологического;
- лабораторного.
Лабораторная диагностика
Основу составляет выделение возбудителей (посевы испражнений и рвотных масс, а при генерализованных формах - крови, ликвора, мочи, желчи). Серологические методы на практике применяют редко, поскольку они не дают достоверных диагностических результатов из-за сходства соматических О-Аг возбудителей данного заболевания и других эшерихий. Рекомендуют постановку РА с использованием аутоштамма эшерихий и парных сывороток крови. В лабораторной диагностике эшерихиозов, вызванных ЭГКП, перспективно внедрение в практику методов определения бактериальных токсинов в испражнениях больных. В тяжелых случаях в крови выявляют признаки гемолитической анемии, нарастание содержания мочевины и креатинина. Отмечают протеинурию, гематурию, лейкоцитурию.
Осложнения и исходы
В большинстве случаев эшерихиозы протекают практически без осложнений. Однако при заболеваниях, вызванных ЭГКП, возможно развитие тяжелых почечных осложнений, геморрагической пурпуры,
церебральных нарушений. В странах тропического пояса у больных на фоне полипаразитозов и белкового голодания эшерихиозы часто приобретают тяжелое течение с развитием ИТШ, дегидратации III-IV степеней, ОПН.
Исход заболеваний, как правило, благоприятный, но при развитии гемолитико-уремического синдрома летальность может достигать 5-7%.
Лечение
Госпитализацию больных проводят по клинико-эпидемиологическим показаниям. Принципы патогенетического лечения обусловлены видами возбудителей и сходны с таковыми при сальмонеллезе, шигеллезе, холере.
Назначают щадящую диету (стол ? 4, после прекращения диареи - стол ? 13). При выраженной интоксикации и дегидратации назначают полиионные кристаллоидные растворы внутрь или внутривенно (см. главу 4, раздел «Сальмонеллез»), а при отсутствии обезвоживания - коллоидные растворы (реополиглюкин, гемодез и др.).
По индивидуальным показаниям с учетом возраста больного, тяжести течения болезни, иммунодефицита в схему лечения рекомендуют добавлять нитрофураны (фуразолидон по 0,1 г 4 раза в сутки). В тяжелых случаях, вызванных ЭИКП, назначают фторхинолоны (ципрофлоксацин по 0,5 г 2 раза в сутки, пефлоксацин по 400 мг 2 раза в сутки) курсом на 5-7 дней. В случаях эшерихиозов, вызванных ЭПКП, у детей рекомендуют назначение ко-тримоксазола и антибиотиков. Для лечения генерализованных форм (сепсис, менингит, пиелонефрит, холецистит) применяют цефалоспорины 3-го поколения. При затяжном течении заболеваний показаны эубиотики и ферменты.
В настоящее время для лечения эшерихиозов, вызванных ЭГКП, внедряют антитоксическую терапию (сыворотки, экстракорпоральная сорбция АТ).
Эпидемиологический надзор
Профилактические и противоэпидемические мероприятия при эшерихиозах должны основываться на материалах постоянного наблюдения за проявлениями эпидемического процесса и данных микробиологических исследований. Особенно важна настороженность при групповых заболеваниях диареей в больничных условиях, организован-
ных коллективах детей и взрослых, где необходимо осуществлять лабораторную диагностику и устанавливать видовую принадлежность эшерихий.
Профилактические мероприятия
Профилактика эшерихиозов основана на строгом соблюдении санитарно-гигиенических требований на объектах общественного питания и водоснабжения. Учитывая ведущую роль пищевого пути передачи инфекции, чрезвычайное значение имеют меры, направленные на его прерывание. Особое внимание следует уделять предупреждению заражений и строгому соблюдению санитарно-противоэпидемического режима в ДДУ, родильных домах и больничных стационарах. Необходимо использовать индивидуальные стерильные пеленки, обрабатывать руки дезинфицирующими растворами после работы с каждым ребенком, обеззараживать посуду, пастеризовать или кипятить молоко, молочные смеси и пищевые добавки. Профилактически обследуют на эшерихиозы беременных до родов и рожениц. Необходимо прививать гигиенические навыки матерям и персоналу, ухаживающему за младенцами, а также детям более старшего возраста, в том числе в учреждениях системы общественного воспитания и обучения.
Мероприятия в эпидемическом очаге
Больных эшерихиозами госпитализируют по клиническим и эпидемиологическим показаниям. Выписывают их из стационара после клинического выздоровления и получения отрицательных результатов трехкратного бактериологического исследования кала, проведенного спустя 2 дня после окончания этиотропного лечения с интервалом 1-2 дня, после чего взрослых допускают к работе по специальности, а детей - в детские учреждения без дополнительного обследования или карантина. Прочие контингенты выписывают не ранее чем через 3 сут после нормализации стула, температуры тела и получения отрицательного результата бактериологического исследования кала.
Детей, общавшихся с больным эшерихиозом по месту жительства, допускают в детские учреждения после разобщения с больным и трехкратных отрицательных результатов бактериологического обследования. При появлении заболеваний в детских и родовспомогательных учреждениях прекращают прием поступающих детей и рожениц. Персонал, матерей и детей, общавшихся с больными, а также детей, выписанных
домой незадолго до появления заболевания, подвергают трехкратному бактериологическому обследованию. Лиц с положительным результатом исследования изолируют. Среди работников пищевых и приравненных к ним предприятий принимают те же меры, что и при шигеллезах. Дети раннего возраста и взрослые, относящиеся к декретированным группам населения (лица, занятые приготовлением, раздачей и хранением пищевых продуктов, воспитатели в ДДУ, медицинские работники и др.), подлежат диспансерному наблюдению в течение 1 мес после клинического выздоровления с бактериологическим обследованием в конце срока. В очагах эшерихиозов проводят текущую дезинфекцию.
ХОЛЕРА (CHOLERA)
Холера - острая антропонозная кишечная инфекция с фекальнооральным механизмом передачи. Для нее характерны диарея и рвота, приводящие к развитию дегидратации и деминерализации. В соответствии с Международными медико-санитарными правилами (ММСП) холеру относят к карантинным инфекциям.
Краткие исторические сведения
Холерный вибрион открыли Ф. Пачини (1853) и Э. Недзвецкий (1872). Чистую культуру выделил и подробно изучил Р. Кох (1883). Возбудитель получил название Vibrio cholerae. Холера известна с древности; до середины XIX столетия заболевание локализовалось в пределах полуострова Индостан. Активизация торговли, транспортных связей и туризма впоследствии привели к широкому распространению холеры на земном шаре в форме эпидемий и пандемий (6 пандемий с 1817 по 1926 г.). В 1905 г. Ф. Готшлих из трупа паломника на карантинной станции ЭльТор выделил новый представитель патогенных холерных вибрионов, получивший название V. cholerae биовар eltor. С 1961 г. его считают основным виновником развития седьмой пандемии холеры. В начале 1990-х годов появились сообщения о вспышках холеры в Юго-Восточной Азии, вызванных вибрионами ранее неизвестной серогруппы, обозначенных как серовар О139 (Бенгал). Бактерии серовара О139 не агглютинируют видоспецифическая О1 и типоспецифические Огава-, Инаба- и Хикошима-сыворотки. К настоящему времени эпидемии и вспышки холеры, вызванные сероваром Бенгал, зарегистрированы в Индии, Бангладеш, Пакистане, Непале, Камбодже, Таиланде, Бирме. Завозы воз-
будителя (в основном из Индии и Бангладеш) зарегистрированы в странах Америки (США), Азии (Япония, Гонконг, Кыргызстан, Узбекистан) и Европы (Великобритания, Германия, Дания, Эстония). Новый эпидемический серовар О139 завезен на юг России в 1993 г. Эксперты ВОЗ полагают, что распространение заболеваний, вызванных этим холерным вибрионом, реально создает угрожающую ситуацию, подобную той, что вызывал вибрион Эль-Тор в 1961 г.
Этиология
Вид Vibrio cholerae относится к роду Vibrio, семейству Vibrionaceae. К настоящему времени известно более 150 серологических вариантов холерных вибрионов (V. cholerae), разделенных на группы А и В. Возбудители холеры входят в группу А. Группа В включает биохимически отличные вибрионы. На основании биохимических различий возбудителей холеры разделили на V. cholerae биовар asiaticae и V. cholerae биовар eltor. По антигенной структуре они включены в серогруппу О1. О-Аг О1 группы холерных вибрионов неоднороден и включает компоненты А, В и С, разные сочетания которых присущи сероварам Огава (АВ), Инаба (АС) и Хикошима (АВС, промежуточный серовар). Это свойство используют в качестве эпидемиологического маркера для дифференцировки очагов по возбудителям, хотя иногда от одного больного можно выделить бактерии разных сероваров.
Холерные вибрионы представлены изогнутыми, очень подвижными грамотрицательными палочками с длинным жгутиком. Морфологически и культурально патогенные серовары не отличаются от непатогенных. Бактерии хорошо растут на простых слабощелочных питательных средах и быстро гибнут при рН ниже 5,5. Образуют токсичные субстанции: термостабильный липопротеиновый комплекс (эндотоксин), термолабильный экзотоксин (энтеротоксин, холероген), обусловливающий развитие основных патогенетических механизмов дегидратации и деминерализации, ряд ферментов и низкомолекулярных метаболитов. По фаголизабельности и гемолитической активности вибрионы ЭльТор разделяют на вирулентные, слабовирулентные и авирулентные. Оценка степени вирулентности V. сholerae биовар eltor необходима для решения вопроса о проведении дифференцированных противохолерных мероприятий. Установлено, что ген образования экзотоксина независимо от его экспрессии отличает потенциально патогенные (эпидемические) от свободно живущих холерных вибрионов той же серологической
группы О1. Вместе с тем в ряде случаев в естественных условиях возможен обмен генетической информацией между клиническими и свободно живущими холерными вибрионами.
Бактерии, не агглютинируемые противохолерной О-сывороткой, называют НАГ-вибрионами. Они могут вызывать сходные с холерой заболевания. Кроме стабильного эндотоксина, выделяющегося при разрушении микроорганизма, НАГ-вибрионы образуют термолабильный эндотоксин и способны вызывать холероподобные заболевания.
Вибрион Эль-Тор весьма устойчив в окружающей среде:
- в воде открытых водоемов остается жизнеспособным в течение нескольких месяцев;
- в сточных водах - до 30 ч;
- хорошо размножается в свежем молоке и на мясных продуктах. Возбудитель холеры быстро погибает при дезинфекции и кипячении,
высушивании и на солнечном свете, чувствителен к антибиотикам тетрациклиновой группы и фторхинолонам.
Эпидемиология
Резервуар и источник инфекции - больной человек или вибриононоситель (реконвалесцент, транзиторный или хронический носитель). Больной наиболее опасен в первые дни болезни. В эти дни испражнения и рвотные массы содержат наибольшее количество возбудителя. Особую эпидемическую опасность представляют больные с ярко выраженной клинической картиной заболевания, выделяющие огромное количество высоковирулентных вибрионов. Весьма опасны больные с легкими формами заболевания, поскольку их трудно выявить. Заразность реконвалесцентов по мере выздоровления уменьшается, и к 3-й неделе болезни практически все они освобождаются от возбудителя. В ряде случаев носительство возбудителя затягивается до 1 года и более. Сроки носительства у лиц с сопутствующими инфекционными и паразитарными заболеваниями более продолжительны.
Механизм передачи - фекально-оральный, реализуется через факторы бытовой передачи (загрязненные руки, предметы обихода), воду, пищевые продукты. Определенную роль играют мухи. Ведущий путь передачи - водный. Холера распространяется с большей легкостью, чем другие кишечные инфекции. Этому способствует массивное раннее выделение возбудителя с испражнениями и рвотными массами, не имеющими специфического запаха и окраски. В последние годы стало
известно, что возбудитель холеры Эль-Тор способен сохраняться и размножаться в организмах простейших, рыб, ракообразных, в синезеленых водорослях и других обитателях водоемов. На этом основании сделано заключение о сапронозном характере инфекции и возможности инфицирования при употреблении в пищу сырых или термически недостаточно обработанных ракообразных, моллюсков, рыбы.
Восприимчивость к инфекции высокая, однако большое значение имеют состояние кислотности желудка и другие факторы неспецифической резистентности макроорганизма. Наиболее подвержены заболеванию лица с пониженной кислотностью желудочного сока, страдающие анацидным гастритом, некоторыми формами анемии, глистными инвазиями и алкоголизмом. После перенесенной инфекции формируется достаточно длительный и напряженный иммунитет.
Основные эпидемиологические признаки
В настоящее время наиболее распространена холера Эль-Тор. Для нее характерны длительное носительство и большая частота стертых форм болезни. Классическая холера эндемична в Южной Азии (Индия, Бангладеш, Пакистан), холера Эль-Тор - в Юго-Восточной Азии (Индонезия, Таиланд и др.). Начиная с 1970-х годов распространение холеры Эль-Тор приняло пандемический характер, охватив и ряд территорий России. Повышенный уровень заболеваемости приходится, как правило, на теплое время года. В эндемичных регионах холера поражает преимущественно детей в возрасте до 5 лет. При эпидемической заболеваемости случаи болезни регистрируют примерно одинаково часто как среди взрослых, так и среди детей.
На территории РФ отмечают спорадические заболевания и вспышки, связанные с завозом инфекции из неблагополучных по холере стран. Такая вспышка возникла в Дагестане (1994), когда заболели более 1600 человек. Она возникла в результате заноса инфекции паломниками, возвратившимися из Саудовской Аравии. Также имел место занос холеры серовара О139 Бенгал в Ростовскую область из Индии. Вместе с тем существует точка зрения (Литвин В.Ю. и др., 1998), объясняющая происхождение холеры с позиции эндемичности ее очагов, первично связанных с природными водоемами - местами независимого от человека обитания холерных вибрионов. Согласно этой позиции пусковой механизм первичного эпидемического проявления холеры носит экологический характер и действует в водных экологических системах независимо от человека. Установлено многолетнее автономное обитание
вибриона в водной среде на фоне полного эпидемиологического благополучия. Длительная циркуляция вибриона Эль-Тор выявлена в воде прибрежных зон рек, озер, морей, в сточных водах, иловых и донных отложениях. Персистируя в водных экологических системах, холерный вибрион вступает в сложные биоценотические взаимоотношения с другими водными организмами и растениями. При этом популяция возбудителя, обладая широкими адаптивными возможностями, изменяется адекватно среде обитания. Длительность существования таких очагов зависит от эффективности санитарной охраны водоемов и качества проводимого комплекса противохолерных мероприятий, предупреждающих распространение и укоренение инфекции. Существование эндемических очагов постоянно таит угрозу возникновения эпидемических осложнений на этих территориях и возможность дальнейшего распространения инфекции.
Распространение холеры из одного региона мира в другой осуществляется различными способами. Выдвинута версия о возможности миграции холерного вибриона на днищах или в балластных слоях воды грузовых судов и иных транспортных средств. Международные миграции (туризм, экономические, военные и политические миграции) неоднократно выступали причиной завоза инфекции. В 2005 г. 52 страны информировали ВОЗ о 131 943 случаях холеры, включая 2 272 случая смертельных исходов. В 2006 г. 32 страны мира информировали ВОЗ о 151 318 зарегистрированных случаях холеры, что на 32,8% больше, чем в 2005 г. Рост заболеваемости холерой произошел в основном за счет выявленных случаев в странах Африканского континента, на долю которого приходится 98,7% мировой заболеваемости холерой. Крупные эпидемии и вспышки инфекции отмечались в Анголе (62 809 больных), Демократической Республике Конго (15 523 больных), Танзании (10 353 больных), Замбии (6 510 больных) и других странах. В странах Азии в 2006 г. наметилась тенденция снижения заболевания холерой, что связано с прекращением ее регистрации в Индонезии, Иране и Филиппинах. В странах Америки, Европы, Австралии и Океании холера регистрируется в единичных случаях и в большей части - в виде завозных случаев.
На территории РФ в течение последних 5 лет заболевания людей холерой регистрируются периодически в виде единичных завозных случаев. В 2005 г. было зарегистрировано 2 завозных случая холеры из Таджикистана в Москву и Тверскую область. От заболевших выделены эпидемические токсигенные гемолизотрицательные штаммы холерных вибрионов 01 Эль-Тор Инаба. В этом же году в г. Каменск-Шахтинский
и Каменском районе Ростовской области от 2 больных и 30 носителей были изолированы неэпидемические нетоксигенные гемолизположительные штаммы холерных вибрионов 01 Эль-Тор Огава. Эпидемическая ситуация в данном регионе связана с завозом холеры из Таджикистана с последующей контаминацией воды источника водоснабжения и реализацией водного пути распространения. В 2006 г. был зарегистрирован один завоз холеры из Индии в г. Мурманск. От больного изолирован эпидемический токсигенный холерный вибрион. В различных регионах страны ежегодно обнаруживаются холерные вибрионы в поверхностных водоемах. Подавляющее большинство штаммов неэпидемические, нетоксигенные. Однако этот факт вызывает тревогу, указывая на процесс интенсивного загрязнения поверхностных водоемов недостаточно очищенными и необеззараженными сточными водами, и имеется опасность реализации ведущего - водного пути передачи возбудителя инфекции. Прогноз для Российской Федерации, где обстановка по холере оценивается как неустойчивая, по-прежнему остается неблагоприятным в плане возможных завозов инфекции всеми видами транспорта на любую административную территорию независимо от типа ее по эпидемическим проявлениям холеры.
Подавляющее большинство завозных случаев инфекции отмечено среди лиц, занимающихся авиашоп-турами (торговые челноки), а также среди иностранных граждан, в том числе переселенцев, прибывающих из стран, неблагополучных по холере. В странах СНГ в период 2002- 2006 гг., по официальной информации только в Республике Казахстан в 2005 г. зарегистрировано 3 случая токсигенным холерным вибрионом Эль-Тор серовара Инаба. В этот же период на территории РФ наблюдалось 4 завозных случая холеры Эль-Тор серовара Инаба. На основании характеристики основных эпидемиологических аспектов холеры на современном этапе развития 7-й пандемии холеры можно считать, что прогноз по холере на ближайшие годы остается неблагоприятным. Прежде всего его определяет регистрация крупных вспышек и эпидемий практически на всех континентах, свидетельствующая о существующей реальной возможности завоза инфекции.
Патогенез
Поступление холерных вибрионов в ЖКТ не всегда приводит к развитию заболевания, поскольку большая часть возбудителей даже при массивной заражающей дозе гибнет в кислой среде желудка. При сни-
жении желудочной секреции (рН >5,5) возбудители преодолевают кислотный барьер желудка, попадают в тонкую кишку, где оседают и прикрепляются к поверхности энтероцитов (рис. 3-5). Размножение и частичная гибель вибрионов сопровождаются выделением токсических субстанций, но при этом воспалительный процесс в кишечнике не развивается. Экзотоксин холерных вибрионов (энтеротоксин, холероген) активирует аденилатциклазную систему в энтероцитах, стимулируя накопление циклических нуклеотидов. В результате происходит гиперсекреция энтероцитами солей и воды в просвет кишечника. С действием эндотоксина и частично энтеротоксина возбудителя связано усиление перистальтики кишечника. Эти механизмы объясняют возникновение и усиление диареи. Потеря жидкости и электролитов при холерной диарее и присоединяющейся позже рвоте происходит значительно интенсивнее, чем при любых других диареях. Развивается внеклеточная изотоническая дегидратация.
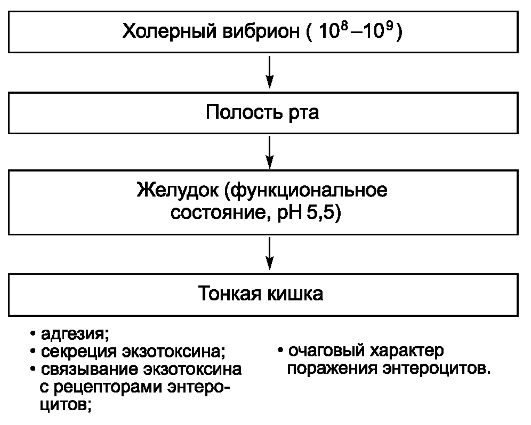 Рис. 3-5. Патогенез холеры
Рис. 3-5. Патогенез холеры
Присоединение рвоты объясняют последующим угнетением перистальтики кишечника и возникновением волн антиперистальтики под влиянием нейраминидазы возбудителя, блокирующей специфические серотониновые рецепторы.
Действие холерогена усиливается при участии других токсических компонентов вибриона - ферментов и низкомолекулярных метаболитов, а также простаноидов, усиливающих синтез цАМФ и фосфодиэстеразы.
Следует обратить внимание на то, что холерный и сальмонеллезный энтеротоксины (см. главу 4, раздел «Сальмонеллезы») запускают одинаковые механизмы дегидратации и связанные с ней последующие патогенетические нарушения.
Интенсивная дегидратация приводит к развитию:
- деминерализации;
- гиповолемии;
- гемоконцентрации;
- нарушениям микроциркуляции;
- тканевой гипоксии;
- метаболическому ацидозу.
Нарастает преренальная недостаточность функции почек (ОПН), а также недостаточность других органов.
Основные механизмы развития диареи при холере иллюстрирует рис. 3-6.
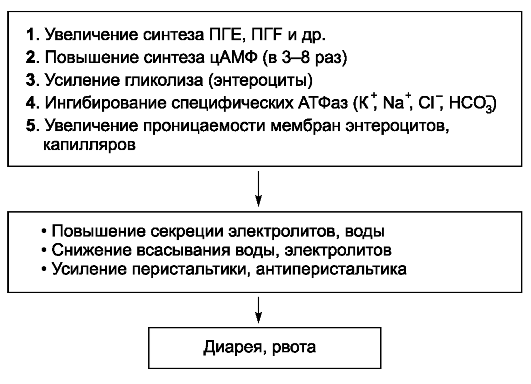 Рис. 3-6. Основные механизмы развития диареи при холере.
Рис. 3-6. Основные механизмы развития диареи при холере.
Клиническая картина
Инкубационный период при холере варьирует от нескольких часов до 5 сут. Заболевание отличает острое, часто внезапное начало в ночные или утренние часы. Первыми симптомами бывают выраженный, но безболезненный позыв к дефекации и ощущение дискомфорта в животе. Жидкий стул сначала может сохранять каловый характер. При прогрессировании заболевания частота дефекаций быстро нарастает до 10 раз в сутки и более, испражнения становятся водянистыми, бескаловыми и, в отличие от других диарейных кишечных инфекций, не имеют зловонного запаха. В связи с интенсивной секрецией жидкости в просвет тонкой кишки значительный объем испражнений сохраняется и даже увеличивается. Испражнения могут приобрести вид рисового отвара, что считают наиболее характерным признаком холеры, наблюдаемым, однако, всего лишь в 20-40% случаев. При этом испражнения выглядят как мутноватая жидкость с зеленым оттенком, содержащая белые рыхлые хлопья, напоминающие разваренный рис.
В части случаев больные ощущают дискомфорт, урчание и переливание жидкости в животе. Прогрессируют общая слабость, сухость во рту, жажда, снижается аппетит. Появление таких признаков, как оглушенность, чувство холода, звон в ушах, свидетельствует о большой потере жидкости вследствие продолжающейся диареи и присоединившейся к ней многократной рвоты.
Рвота при холере появляется позже диареи - через несколько часов или даже к концу 1-2-х суток заболевания. Она бывает обильной, повторной, возникает внезапно и не сопровождается чувством тошноты и болями в эпигастральной области. Сначала рвотные массы могут содержать остатки пищи и примесь желчи, при повторной рвоте они становятся водянистыми и в части случаев напоминают по виду рисовый отвар.
Быстрая потеря ионов Na+ и Cl- при рвоте приводит к еще большему ухудшению состояния больного. Возникают судороги клонического характера, сначала в мышцах дистальных отделов конечностей, затем они могут распространиться на мышцы брюшной стенки, спины, диафрагмы. Нарастают мышечная слабость и головокружение, больные не способны встать с постели даже для посещения туалета. Характерно полное сохранение сознания.
В отличие от обычных кишечных инфекций холере не свойственны боли в животе. Их регистрируют лишь у 20-30% больных, но и в этих случаях боли остаются умеренными и по интенсивности не соответству-
ют мощным проявлениям диарейного синдрома. Температура тела остается нормальной, а при выраженном обезвоживании с потерей солей (дегидратации III и IV степеней) развивается гипотермия. В редких случаях (у 10-20% больных) начало заболевания может сопровождаться субфебрильной температурой тела.
В случаях выраженной дегидратации и деминерализации внешний вид больного приобретает характерные черты. Кожный покров становится бледным, холодным, теряет обычный тургор. Появляется цианотичный оттенок губ и ногтевых фаланг, в дальнейшем цианоз усиливается и распространяется на дистальные отделы конечностей, а при максимальном обезвоживании (дегидратация IV степени) он принимает тотальный характер. Слизистые оболочки бывают сухими, голос становится приглушенным, хриплым, а затем пропадает (афония). Заостряются черты лица, глаза западают, появляются темные круги под глазами (симптом очков), кожа подушечек пальцев и кистей сморщивается (симптом рук прачки), живот втянут.
У больных прогрессируют тахикардия и артериальная гипотензия, уменьшается количество мочи (олигурия).
Если потеря жидкости достигает 10% массы тела больного и более, развиваются клинические признаки резкого обезвоживания (см. рис. 3 на цветной вклейке). Пульс на лучевой артерии и периферическое АД не определяются. Диарея и рвота становятся редкими, а иногда и полностью прекращаются вследствие пареза кишечника. Температура тела опускается ниже нормы (гипотермия), нарастает одышка (тахипноэ), прекращается выделение мочи (анурия). Это состояние расценивают как дегидратационный шок.
Симптомы холеры, приведенные выше, развиваются в динамике заболевания при его неуклонном прогрессировании и относятся к клиническим проявлениям различных степеней дегидратации.
Важнейшее клинико-патогенетическое звено при определении тяжести заболевания - водно-электролитные потери.
В инфекционной практике потерю жидкости условно разделяют на 4 степени (по В.И. Покровскому):
- I степень - не более 3% массы тела;
- II степень - до 6% массы тела;
- III степень - до 9% массы тела;
- IV степень - более 9-10% массы тела.
Разработаны клинические и лабораторные параметры, характеризующие каждую степень водно-электролитных потерь (табл. 3-3).
Таблица 3-3. Клинико-патогенетическая характеристика обезвоживания (по Покровскому В.И., 1986)
Клиническая характеристика | Лабораторные данные | Введение солевых растворов |
I степень (потеря массы тела до 3%) | ||
Слабость, жажда, сухость во рту (у 2/3 больных), жидкий водянистый (реже кашицеобразный) необильный стул от 3-4 до 10 раз в сутки, рвота 1-2 раза в сутки приблизительно у половины больных | Сдельный вес плазмы крови 1,021-1,023 г/ см3; Ht=40-45%, рН 7,36-7,40 | Перорально |
II степень (потеря массы тела 4-6%) | ||
Выраженная слабость, головокружение, обморочные состояния, сухость кожного покрова, слизистых оболочек, цианоз губ у 20-25% больных (реже акроцианоз). Изредка судороги мышц конечностей, тахикардия у 50% больных, возможно понижение АД до 90/60 мм рт.ст. (до 25% случаев). Водянистый стул до 10-20 раз в сутки (у 20-40% больных в виде рисового отвара), обильная рвота 5-10 раз в сутки, олигурия в отдельных случаях, нормальная температура тела | Сдельный вес плазмы 1,023-1,025 г/см3, Ht=45-50%, рН 7,33- 7,40, ВГ=2-5 ммоль/л, гипокалиемия, гипохлоремия | Внутривенно из расчета 40- 65 мл/кг массы тела; первые 15-20 мин скорость введения 80-90 мл/мин, в дальнейшем внутривенно капельно (40-60 мл/мин), а затем в количествах, равных потерям. При ненарушенной гемодинамике - внутрь |
III степень (потеря массы тела 7-9%) | ||
Выраженная слабость, адинамия, сухость слизистых оболочек, тургор кожи снижен. Черты лица заострены. Глазные яблоки западают, симптом темных очков, цианоз лица, | Сдельный вес плазмы крови 1,028-1,035 г/ см3, Ш=50-55%,декомпенсированный | Струйное введение жидкости из расчета 70-100 мл/кг со скоростью 100-130 мл/мин в течение первых 30-45 мин. Обычно за |
Окончание табл. 3-3
Клиническая характеристика | Лабораторные данные | Введение солевых растворов |
акроцианоз. Продолжительные болезненные судороги мышц конечностей, осипший слабый голос. Температура тела 36-36,5 °С, субнормальная у трети больных, АД 90/60 мм рт.ст. и ниже. Пульс до 120 в минуту, слабого наполнения. Многократный стул по типу рисового отвара, обильная рвота более 20 раз в сутки. Олигурия (у 75% больных) или анурия (в 25% случаев) | метаболический ацидоз: рН=7,30-7,36; ВГ=5-10 ммоль/л; гипокалиемия, гипохлоремия | 1-1,5 ч вводят 5-7 л раствора. Дальнейшее введение капельное, в соответствии с потерей жидкости и данными клиникофизиологических исследований |
IV степень (потеря массы тела 10% и более) | ||
Резкая слабость, иногда прострация, но сознание сохранено. Глаза запавшие, симптом темных очков, черты лица заострены. Кожа холодная на ощупь, покрыта липким потом, общий цианоз кожного покрова, тургор кожи резко снижен. Сморщивание кожи туловища и лица, симптом рук прачки. Судороги мышц конечностей и живота. Гипотермия (температура тела 35 °С и ниже). Периферическое АД резко снижено вплоть до исчезновения, отсутствие периферического пульса. Тахипноэ (частота дыхательных движений до 40-60 в минуту). Афония, анурия у всех больных. Сухость слизистых оболочек. Стул и рвота сначала обильные, многократные, но к моменту исследования могут прекратиться | Удельный вес плазмы крови 1,035-1,040 г/см3, Ht >55%, декомпенсированный метаболический ацидоз: рН <7,3, ВГ=10-18 ммоль/л; гипокалиемия до 2,5 ммоль/л, признаки геморрагического синдрома | Жидкость вводят в 2 этапа. Первый этап. Регидратация в течение 1-1,5 ч струйно из расчета 100-120 мл/кг со скоростью до 150 мл/мин. Второй этап. Коррекция капельным внутривенным вливанием в зависимости от потерь и клинико-физиологических показателей (до 3-5 сут) |
Примечание.
Ht - гематокрит.
ВГ - избыток оснований капиллярной крови. рН ' - водородный показатель.
Следует помнить, что нарастание клинических проявлений заболевания может прекратиться на любом из его этапов. В соответствии с этим течение холеры может быть стертым, легким, средней тяжести или тяжелым, что определяет степень развившейся дегидратации. При легком течении болезни частота дефекаций не превышает 2-4 раз в сутки, через несколько часов (максимум через 1-2 сут) диарея спонтанно прекращается. Тяжелые формы холеры с дегидратацией IV степени регистрируют во время вспышек заболевания не более чем в 10-12% случаев. При бурном течении инфекции развитие дегидратационного шока возможно в первые 10-12 ч.
Дифференциальная диагностика
Холеру дифференцируют от сальмонеллезов, ПТИ, шигеллезов, отравлений ядохимикатами, солями тяжелых металлов и грибами, ротавирусного гастроэнтерита, эшерихиозов.
Быстрое прогрессирование болезни и нарастание симптомов обезвоживания требуют от врача знания опорных клинических симптомов холеры для проведения дифференциальной диагностики. Следует учитывать, что острое начало заболевания проявляется императивной диареей при нормальной (иногда субфебрильной) температурной реакции и отсутствии выраженных болей в животе. Частота дефекаций быстро нарастает, испражнения становятся водянистыми, иногда приобретают вид рисового отвара, не имеют зловонного запаха. К диарее присоединяется многократная рвота.
Нарастают симптомы обезвоживания и деминерализации, клинически проявляющиеся:
- хриплым голосом (вплоть до афонии);
- заострением черт лица;
- появлением симптомов очков, рук прачки;
- олигоили анурией;
- тахикардией;
- прогрессирующей артериальной гипотензией;
- мышечными судорогами.
Лабораторная диагностика
При тяжелом течении холеры предварительный диагноз формируют на основании данных клинической картины и эпидемиологического анамнеза. Однако установление окончательного диагноза возможно
только после получения результата бактериологического исследования, требующего 36-48 ч.
Для анализа могут быть использованы:
- испражнения и рвотные массы больных;
- загрязненное ими белье;
- секционный материал (содержимое тонкой кишки и желчного пузыря).
При контрольном обследовании реконвалесцентов проводят бактериологический анализ испражнений и трех порций желчи, взятых при дуоденальном зондировании.
Медицинский работник в перчатках и клеенчатом фартуке собирает материал для исследования в чистую стерильную стеклянную посуду со щелочным 1% пептонным бульоном при помощи ватных тампонов, резиновых катетеров или стеклянных трубочек. Количество забираемого материала зависит от степени тяжести болезни (материала должно быть больше при легких формах) и варьирует в пределах 0,5-2 г. Кал для первого бактериологического анализа при исследовании на бактерионосительство берут после предварительного приема больными 25-30 г магния сульфата. Материал доставляют в лабораторию в специальном герметично закрытом биксе не позже 3 ч с момента забора, соблюдая правила транспортировки. Бактериологический метод лабораторной диагностики холеры служит решающим.
Многочисленные серологические методы диагностики (РА, РНГА с антигенными и антительными диагностикумами, вибриоцидный тест, ИФА, РКА и др.) могут иметь ориентировочное и эпидемиологическое значение, но окончательным доказательством диагноза их не считают.
При подозрении на холеру применяют ускоренные методы бактериологической диагностики:
- люминесцентно-серологический;
- иммобилизации вибрионов холерной О-сывороткой с последующей микроскопией в темном поле и др.
Анализ занимает от 15 мин до 2 ч. К методам экспресс-диагностики также можно отнести выявление Аг холерных вибрионов в исследуемом материале в РКА, РЛА и ИФА. Результаты всех перечисленных методов расценивают как ориентировочные.
Осложнения и исходы
Осложнения при холере могут быть обусловлены присоединением вторичной инфекции с развитием пневмоний, абсцессов и флегмон. Длительные внутривенные манипуляции могут вызвать пирогенные реакции, флебиты и тромбофлебиты.
К возможным осложнениям также относят:
- острое нарушение мозгового кровообращения;
- инфаркт миокарда;
- тромбоз мезентериальных сосудов.
Лечение
Как и при всех особо опасных инфекциях, больных холерой и вибриононосителей обязательно госпитализируют. На догоспитальном этапе, а также в стационаре при легком и (иногда) среднетяжелом течении болезни (дегидратации I и II степеней) для возмещения потерь жидкости и солей регидратанты назначают внутрь. С этой целью могут быть использованы глюкозо-солевые растворы цитроглюкосолан*, глюкосо- лан*, регидрон*, оралитР. Водно-электролитные потери, произошедшие у больного до начала лечения, необходимо восполнить в течение 2-4 ч. При рвоте растворы вводят через назогастральный зонд. Прием препаратов внутрь заканчивают при полном прекращении у больного диареи.
При дегидратации III-IV степени изотонические полиионные кристаллоидные растворы вводят внутривенно в объеме, равном 10% массы тела, в подогретом виде (до 38-40 °С) в течение первых 1,5-2 ч.
В течение первых 20-30 мин инфузионные растворы вводят струйно с объемной скоростью 100-200 мл/мин, а затем по 50-70 мл/мин, что обеспечивает восстановление объемов жидкостных пространств организма.
Наиболее популярны растворы квартасольр и хлосоль*. Применение растворов трисоль* и ацесоль* менее целесообразно в связи с недостаточным количеством в них ионов К+ и угрозой развития метаболического алкалоза в связи с присутствием бикарбоната натрия в растворе трисоль*. Раствор дисоль*, не содержащий ионов К+, рекомендуют применять при гиперкалиемии (табл. 3-4).
Таблица 3-4. Состав солевых растворов, применяемых для коррекции дегидратации
Название раствора | Содержание солей, г/л раствора | ||||||
Натрия хлорид | Натрия ацетат | Натрия гидрокарбо- нат | Натрия цитрат | Натрия гидроцитрат | Калия хлорид | Глюкоза | |
Трисоль* | 5,0 | - | 4,0 | - | - | 1,0 | - |
Квартасольр | 4,75 | 2,6 | 1,0 | - | - | 1,5 | - |
Дисоль* | 6,0 | 2,0 | - | - | - | - | - |
Ацесоль* | 5,0 | 2,0 | - | - | - | 1,0 | - |
Хлосоль* | 4,75 | 3,6 | - | - | - | 1,5 | - |
Глюкосолан | 3,5 | - | 2,5 | - | - | 1,5 | 20,0 |
Цитраглюкосолан* | 3,5 | - | - | - | 4,0 | 2,5 | 17,0 |
Регидрон* | 3,5 | - | - | 2,9 | - | 1,5 | 10,0 |
Учитывая возможность дальнейших потерь жидкости и электролитов с рвотными массами и испражнениями, необходимо продолжать поддерживающее регидратационное лечение капельным внутривенным введением жидкостей со скоростью 40-60 мл/мин. При этом каждые 2 ч следует определять объемы продолжающихся потерь жидкости. Если при этом не удается полностью скомпенсировать гипокалиемию, проводят дополнительную коррекцию потерь ионов К+ с учетом лабораторных показателей КЩС и электролитов, гематокрита, относительной плотности плазмы, гемограммы и др. Объем 1% раствора калия хлорида, необходимого для дополнительного внутривенного введения, определяют по следующей формуле:
Р x 1,44 x (5-X)=Y,
где Р - масса тела больного кг; 5 - нормальная концентрация калия в плазме крови, Х - концентрация калия в плазме крови (ммоль/л),.
Внутривенное введение жидкостей продолжают до клинического улучшения состояния больного, выражающегося в стойком прекращении рвоты, выраженном снижении частоты дефекаций и прогрессирующем уменьшении объема испражнений, появлении в них примеси кало-
вых масс, преобладании объема мочи над объемом испражнений. Введение регидратирующих растворов внутрь заканчивают только после полного оформления стула пациента.
Параллельно с регидратационной терапией больным назначают этиотропное лечение:
- доксициклин по 200-300 мг/сут;
- ципрофлоксацин по 250-500 мг 2 раза в сутки. Длительность курсов лечения - 5 дней.
Беременным и детям до 12 лет назначают фуразолидон по 100 мг 4 раза в сутки курсом 7-10 дней. Для лечения вибриононосителей назначают 5-дневный курс доксициклина по 0,1 г в день.
В состоянии дегидратационного шока противопоказаны прессорные амины (способствуют развитию ОПН), не показаны сердечно-сосудистые препараты и глюкокортикоиды.
Больным холерой и вибриононосителям специальной диеты не назначают.
Эпидемиологический надзор
Для предупреждения заноса инфекции из эндемичных регионов необходимо постоянно следить за уровнем и динамикой заболеваемости холерой за рубежом. Основой анализа эпидемиологической ситуации в мире служат сведения ВОЗ, рассылаемые всем входящим в нее странам. Внутри страны информацию рассылают учреждения Роспотребнадзора. Руководители центров государственного санитарно-эпидемиологического надзора в субъектах РФ, региональных центров на воздушном и водном транспорте представляют информацию о каждом случае заболевания холерой или вибриононосительства в виде донесений в Федеральный центр гигиены и эпидемиологии Роспотребнадзора. Постоянный бактериологический контроль (за открытыми водоемами) и усиленный санитарный контроль (за эпидемиологически важными объектами) позволяют оценивать эпидемиологическую ситуацию в стране и отдельных регионах, предсказывать моменты ее ухудшения. Многофакторность эпидемического процесса при холере, зависимость проявлений напрямую от природно-климатических, социальных условий жизни населения, санитарно-гигиенического состояния населенных мест затрудняют реализацию прогностических моделей эпидемии холеры. В этом плане продолжает оставаться актуальным определение эпидемического потенциала территорий на основании оценки значения
показателей, характеризующих эпидемические проявления холеры, социальных, в том числе санитарно-гигиенических условий водоснабжения и водопользования, и транспортных связей с точки зрения возможности завоза холеры. Выбор стационарных и временных точек взятия проб воды для лабораторных исследований должен быть эпидемиологически обоснованным и касаться зон санитарной охраны водозаборов и массового купания, мест, расположенных ниже сброса сточных вод, акваторий портов и организованных стоянок катеров и лодок индивидуального пользования и др. В ряде случаев показано наблюдение за иммунологическим фоном отдельных групп населения. Увеличение титров АТ в крови невакцинированных людей требует бактериологического обследования водоисточников, используемых населением для хозяйственных и питьевых нужд. Обнаружение вирулентных штаммов V. cholerae биовар eltor в объектах окружающей среды следует рассматривать как неблагоприятный прогностический признак, требующий выполнения противохолерных мероприятий в полном объеме.
Профилактические мероприятия
Основу профилактики заболеваемости холерой составляют мероприятия по улучшению социально-экономических и санитарногигиенических условий жизни населения. Такие общие санитарные меры, как обеспечение населения доброкачественной хозяйственнопитьевой водой, обезвреживание сточных вод, коммунальное благоустройство и очистка населенных мест, повышение санитарной грамотности населения, играют ключевую роль в профилактике заражения и распространения инфекции. Важно выполнение в полном объеме мер по предупреждению заноса инфекции из-за рубежа, регламентированных специальными документами (Правила по санитарной охране территории РФ). Обеспечение максимальной защиты от заноса и распространения холеры осуществляют при минимальных воздействиях на международные перевозки и торговлю. С этой целью учреждения Роспотребнадзора информируют органы здравоохранения на местах о заболеваемости холерой за рубежом и случаях появления болезни на территории страны. В РФ создано более 270 санитарно-карантинных пунктов пропуска через государственную границу в речных, морских портах, аэропортах и на автодорожных переходах. Осуществляют санитарный досмотр прибывших из-за рубежа транспортных средств, проводят бактериологическое обследование граждан, заболевших острыми кишеч-
ными инфекциями, и медицинское наблюдение в течение 5 дней за лицами, прибывшими из районов, неблагополучных по холере. На территории всей страны ежегодно проводят теоретическую и практическую подготовку по холере на семинарах (рабочих местах) руководителей учреждений здравоохранения и санитарно-эпидемиологической службы, немедицинских работников гражданской авиации, железнодорожного транспорта, речного и морского флота и других лиц.
Специфическая профилактика холеры имеет вспомогательное значение, ее проводят по эпидемиологическим показаниям начиная с 7-летнего возраста.
Мероприятия в эпидемическом очаге
Основные противоэпидемические мероприятия по локализации и ликвидации очага холеры:
- ограничительные меры и карантин;
- выявление и изоляция лиц, контактировавших с больными и носителями;
- лечение больных холерой и вибриононосителей;
- профилактическое лечение контактных лиц;
- текущая и заключительная дезинфекция.
Карантин в настоящее время признан избыточной мерой. Его вводят в исключительных случаях решением Чрезвычайной противоэпидемической комиссии. Границы очага холеры устанавливают в пределах определенной территории Центром государственного санитарноэпидемиологического надзора на основании данных о территориальном распределении больных и вибриононосителей, мест обнаружения холерных вибрионов в водных объектах, а также путей распространения и факторов передачи инфекции и утверждают территориальной СПЭК.
В карантинные мероприятия включают:
- ограничение въезда в очаг;
- запрет прямого транзита междугородного транспорта;
- 5-дневную обсервацию (изоляцию) выезжающих;
- медицинское наблюдение за ними;
- однократное бактериологическое исследование на холеру в обсерватах.
Обязательно обследуют лиц, контактировавших с больным холерой или вибриононосителем. Госпитализация больных обязательна. Выписку реконвалесцентов из стационара осуществляют после полного
клинического выздоровления, окончания курса лечения и получения отрицательных результатов контрольного бактериологического обследования, проводимого через 24-36 ч после курса этиотропного лечения 3 дня подряд. До взятия испражнений для 1-го бактериологического анализа больным дают солевое слабительное, 2 последующих анализа берут без него. Аналогично обследуют вибриононосителей после завершения санации.
Работники сферы питания и лица, к ним приравненные, перед выпиской подлежат пятикратному бактериологическому обследованию и однократному исследованию желчи.
Перенесших холеру и вибриононосительство допускают к работе сразу после выписки из стационара независимо от профессии. Переболевшие холерой находятся под медицинским наблюдением в течение 3 мес после выписки из стационара. В 1-й месяц их обследуют бактериологически 1 раз в 10 дней, в дальнейшем - 1 раз в месяц.
Лица, тесно общавшиеся с больными холерой или носителями и страдающие дисфункцией кишечника, подлежат провизорной госпитализации. Их выписывают после медицинского наблюдения в течение 5 дней, курса экстренной профилактики антибиотиками и трехкратного отрицательного бактериологического обследования. Экстренную профилактику проводят только в очагах холеры, обусловленной токсигенными холерными вибрионами серогрупп 01 и 0139. Выбор антибиотиков осуществляют после определения чувствительности к ним циркулирующих вибрионов. К препаратам 1-го порядка, которые необходимо иметь в резерве на случай выявления больного холерой, относят доксициклин, ципрофлоксацин и цефтибутен. В очаге проводят заключительную дезинфекцию с обязательной камерной обработкой вещей. Очаг считается ликвидированным после выписки последнего больного холерой (вибриононосителя) и проведения заключительной дезинфекции в стационаре.
ВИРУСНЫЕ ГЕПАТИТЫ (HEPATITES VIROSAE)
Большая группа вирусных антропонозных заболеваний, протекающих с поражением печени, имеющих различные этиологические, эпидемиологические и патогенетические характеристики, достаточно однотипные клинические проявления с исходами и последствиями, обусловленными особенностями этиопатогенеза.
ГЕПАТИТ А (HEPATITIS A)
ВГА (синонимы - болезнь Боткина, эпидемический гепатит, инфекционная желтуха) - это острая циклическая вирусная инфекция с фекально-оральным путем передачи. У большинства больных протекает в легкой форме с умеренной интоксикацией, поражением печени и нередко с желтухой, заканчивается полным выздоровлением без хронизации и вирусоносительства.
Краткие исторические сведения
Впервые представление об инфекционной природе катаральной желтухи высказано С.П. Боткиным (1888). С этого времени заболевание надолго получило название «болезнь Боткина». В 1973 г. был открыт возбудитель заболевания (С. Файнстоун) и окончательно утвержден термин «гепатит А», предложенный Ф. Мак-Коллумом еще в 1947 г.
Этиология
Возбудитель гепатита А - вирус рода Hepatovirus семейства Picornaviridae. Вирионы мелкие, просто устроенные, лишенные суперкапсида. Геном образован односпиральной РНК (рибонуклеиновая кислота). Известен только один серовар вируса, включающий в себя 9 генотипов. Генотипы обладают перекрестным иммунным действием, но отличаются географическим распространением.
Вирус относительно устойчив во внешней среде, особенно при низкой температуре. В пресной и морской воде возбудитель может сохранять патогенность до 3 мес, при кипячении инактивируется через 5 мин, при УФО погибает через 1 мин. Дезинфицирующие средства инактивируют вирус эффективно.
Эпидемиология
Резервуар и источник инфекции - человек с любыми проявлениями болезни (желтушными, безжелтушными, бессимптомными инаппарантными формами). Существенная часть заразившихся переносит болезнь в бессимптомной, а потому нерегистрируемой форме. У детей эта величина достигает 90-95%, у взрослых - 25-50%. Больной человек опасен для окружающих начиная со 2-й недели инкубационного
периода болезни. Пик выделения вируса приходится на 1-ю неделю бо лезни.
Контагиозность больного с появлением желтухи значительно уменьшается:
- в 1-ю неделю желтушного периода частота положительных находок составляет 30-50%;
- во 2-ю - 15-25%;
- позже выделение вируса наблюдают лишь у единичных больных. Хроническое носительство вируса не установлено. Описаны случаи
заражения человека от шимпанзе и некоторых других видов обезьян.
Механизм передачи - фекально-оральный. Выделение вируса происходит с фекальными массами. В 1 мл фекалий может содержаться до 108 инфекционных вирионов. Заражение людей происходит при употреблении воды и пищи, инфицированной вирусом, иногда контактнобытовым путем. Обсуждается возможность полового пути передачи инфекции, особенно в среде гомосексуалистов. В ряде стран (США, страны Европы) описаны случаи заболеваний, связанные с заражением при парентеральном введении психотропных веществ, переливании крови и ее препаратов. Роль каждого пути передачи неодинакова в разных условиях. Водный путь, как правило, приводит к вспышкам заболевания среди лиц, пользовавшихся инфицированной водой, плававших в загрязненных бассейнах и озерах. Поскольку вирус ВГА может выживать в воде от 12 нед до 10 мес, инфицирование может произойти при употреблении различных сырых моллюсков, мидий, собранных в зонах, загрязненных сточными водами.
Пищевые вспышки чаще всего связаны с контаминацией продуктов на пищевых предприятиях персоналом с легкой формой болезни, при несоблюдении правил личной гигиены. Возможно также заражение овощей и ягод (особенно клубники и земляники, салата) при их удобрении фекалиями человека. Контактно-бытовой путь передачи, как правило, имеет место в условиях ДДУ, домах ребенка и других аналогичных учреждениях, особенно в условиях их неудовлетворительного санитарного состояния.
Естественная восприимчивость людей
Естественная восприимчивость человека высокая. После перенесенной инфекции вырабатывается стойкий напряженный иммунитет. Наиболее восприимчивы дети от 2 до 14 лет. Бессимптомные формы болезни формируют менее напряженный иммунитет.
Основные эпидемиологические признаки
ВГА отличают повсеместное распространение, неравномерная интенсивность на отдельных территориях, цикличность в многолетней динамике, выраженная осенне-зимняя сезонность, преимущественное поражение детей дошкольного возраста, подростков и лиц молодого возраста.
ВГА относят к числу широко распространенных в мире кишечных инфекций. Из всех достаточно многочисленных форм вирусных гепатитов его встречают наиболее часто. ВОЗ сообщает приблизительно о 1,4 млн случаев ВГА, регистрируемых ежегодно. В среднем прямые и косвенные затраты в связи с инфекцией могут достигать 2459 долларов США на каждый случай у взрослого и 1492 долларов США - у ребенка. Затраты, связанные с вирусным гепатитом, оценивают ежегодно в мире от 1,5 до 3 млрд долларов США.
Хотя это заболевание характерно в основном для стран третьего мира с низким уровнем гигиены и санитарии, единичные случаи или вспышки заболевания ВГА можно наблюдать даже в наиболее развитых странах. Согласно оценкам, в США около 33% населения имеет серологические маркеры, свидетельствующие о перенесенной инфекции. В год отмечают 143 000 случаев инфицирования ВГА, а 75 800 протекают клинически выраженно.
В России показатель заболеваемости ВГА составил в 2006 г. 15,7, а в 2007 г. - 10,28 на 100 000 населения. В некоторых субъектах РФ показатель на 100 000 населения значительно превышает федеративный. Наибольшие показатели отмечены в Чукотском автономном округе (63,36), Республиках Дагестан (62,46), Чеченской (58,9), Тыва (45,64), Кемеровской области (39,08), Республике Карелия (38,83), Брянской (33,98), Томской (30,7), Сахалинской (20,6) областях.
Заболеваемость детей ВГА постоянно превышает показатели у взрослого населения. В 2007 г. среди детей до 14 лет зарегистрировано 5198 случаев ВГА, показатель на 100 000 данного возраста составил 24,7, в 2006 г. он составлял 28,4.
По-прежнему основной удельный вес среди заболевших детей составляют дети от 3 до 6 лет - 30,1%. Показатель на 100 000 данной возрастной группы - 29,7. В 2007 г. заболеваемость ВГА среди детей до 14 лет превышала заболеваемость среди взрослых лишь на 21,3%, в 2005 г. - в 1,7 раза. Это объясняется значительным сокращением числа детского населения, в том числе детей, посещающих ДДУ, и количества этих учреждений. Распространению ВГА способствуют серьезные недо-
статки в обеспечении населения доброкачественной питьевой водой, что приводит к возникновению водных вспышек. В 2007 г. в РФ, по данным формы ? 23-06 федерального статистического наблюдения «Сведения о вспышках инфекционных заболеваний», зарегистрировано 83 вспышки ВГА (2006 г. - 103) с числом пострадавших 1070 человек, в том числе детей до 17 лет - 867. Наибольшее число вспышек отмечалось среди населения - 39 вспышек (46,9%), в общеобразовательных учреждениях - 22 вспышки (26,5%), ДДУ - 15 вспышек (18%).
Для многолетней динамики характерны периодические (через 4-6 лет) подъемы заболеваемости. Самые последние годы характеризует очередной подъем заболеваемости. Особенностью последнего подъема стало возникновение эпидемических вспышек с пищевым путем передачи.
Отмечают летне-осеннюю сезонность заболеваемости, что отражает выраженное усиление заноса (завоза) инфекции с неблагополучных территорий с миграционными потоками населения и поставками различных пищевых продуктов низкого качества, реализуемых в условиях мелкооптовой и несанкционированной (уличной) торговли. Среди взрослых риску заражения ВГА в первую очередь подвергаются работники всех предприятий общественного питания, а также пищеблоков лечебных, детских, санаторных и других учреждений. К группе высокого риска дополнительно относят военнослужащих и лиц, выезжающих или проживающих на неблагоустроенной в санитарно-коммунальном отношении территории, использующих для хозяйственно-бытовых целей воду из открытых водоемов, а также медицинский персонал. В последние годы к группам риска стали причислять лиц с хроническими заболеваниями печени и желчевыводящих путей, гомосексуалистов и наркоманов, так как среди них описаны групповые случаи заболеваний.
Патогенез
HAV попадает в организм человека пероральным путем, проникает в клетки лимфоидного глоточного кольца, эпителиальные клетки ЖКТ, а затем в мезентериальные узлы кишечника. При накоплении вируса активизируется его первичная презентация иммунокомпетентным клеткам лимфоидной ткани. При последующей первичной виремии возбудители попадают в печень, реплицируют в гепатоцитах, затем высвобождаются в желчь (без разрушения печеночных клеток) и в кровь.
При вторичной виремии вновь происходит взаимодействие вирусных Аг с иммунокомпетентными клетками в месте входных ворот, где в
результате предшествующей сенсибилизации развиваются реакции ГЗТ. Клинически эти реакции проявляются катаральным процессом в ротоглотке и в слизистой оболочке ЖКТ, лихорадкой и диспепсическими симптомами, т.е. признаками дожелтушного периода.
Доказано, что вирус не оказывает прямого цитопатического действия на гепатоциты, лизис гепатоцитов с выбросом аминотрансфераз [алани- наминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ)] происходит в результате Т-клеточного иммунного ответа. Аг вируса (оболочечные белки) фиксируются на мембранах гепатоцитов в комплексе с человеческими лейкоцитарными Аг (HLA) главного комплекса гистосовместимости типа 1, и инфицированные клетки уничтожаются цитотоксическими Т-лимфоцитами и Т-киллерами.
При разрушении более 70% гепатоцитов возникают выраженные нарушения пигментного обмена (гипербилирубинемия), что лежит в основе развития желтушного синдрома.
Иммунный ответ при гепатите А формируется рано. Уже в конце инкубационного периода в крови больных выявляются аnti-HAVIgM. В результате быстро прекращается виремия, но возбудитель еще некоторое время выделяется с фекалиями. АпН-HAV IgG появляются в крови после исчезновения из нее вируса, что практически соответствует завершению дожелтушного периода. В результате иммунных реакций в большинстве случаев довольно быстро, в течение 2-3 нед, наступает выздоровление с полным освобождением организма от вируса. Вирусоносительство и хронические формы при ВГА не наблюдают.
Основные патоморфологические процессы в печени при ВГА:
- поражение гепатоцитов, одновременно находящихся на разных стадиях дегенеративных и некротических изменений с сохранением в основном структуры печеночных долек;
- развитие перипортальной гистиоцитарной воспалительной инфильтрации;
- миграция дегенерировавших гепатоцитов через межклеточные пространства в синусоиды, поглощение их купфферовскими клетками;
- развитие воспалительных (преимущественно лимфоцитарных) инфильтратов, повреждение желчных канальцев с отеком и застоем желчи;
- в тяжелых случаях - образование обширных участков некроза с нарушением структуры печеночных долек и минимальной выраженностью регенеративных процессов.
В дальнейшем для восстановления гепатоцитов требуется несколько недель, а для восстановления полной цитоархитектоники печени - несколько месяцев.
Сходство Аг вируса и Аг гепатоцитов определяет развитие общих аутоиммунных процессов, от интенсивности которых во многом зависит исход заболевания. У лиц с генетической предрасположенностью вследствие ВГА может развиться хронический аутоиммунный гепатит типа 1. Описаны нефротический синдром с развитием мезангиопролиферативного гломерулонефрита, артриты, васкулиты, криоглобулинемии, при этом ВГА выступал в качестве провоцирующего фактора. В очень редких случаях (0,1%) возможно развитие фульминантных форм ВГА.
Клиническая картина
Инкубационный период продолжается от2до6 нед. Интенсивность клинических проявлений значительно варьирует. В большинстве случаев, особенно часто у детей до 5 лет, заболевание протекает в инаппарантной безжелтушной форме с признаками гастроэнтерита и катаральными проявлениями со стороны верхних дыхательных путей. У взрослых ВГА обычно проходит в легкой или среднетяжелой формах, но не исключены и тяжелые варианты, и обострения.
Циклическое течение заболевания характеризуется последовательной сменой нескольких периодов:
- продромального (дожелтушного);
- разгара (возможно с желтухой);
- периода реконвалесценции.
• Дожелтушный (продромальный) период проявляется широким разнообразием симптомов, условно сгруппированных в несколько вариантов.
◊ Гриппоподобный (лихорадочный, катаральный) вариант при ВГА встречается наиболее часто. Обычно заболевание начинается остро с повышения температуры тела (от субфебрильных до высоких цифр), слабости, недомогания, мышечных болей, развития легких катаральных симптомов (заложенность носа, боли или першение в горле, покашливание). Гриппоподобная симптоматика у большинства больных сочетается с диспепсическими и астеновегетативными расстройствами различной степени выраженности.
◊ Диспепсический вариант. Катаральные признаки отсутствуют, на первый план выступают симптомы поражения ЖКТ. Больных беспокоят дискомфорт в эпигастральной области, снижение аппетита различной степени выраженности, тошнота, иногда рвота, возникающая чаще после приема пищи. Возможны тупые боли в правом подреберье, горечь во рту, отрыжка, запоры или послабление стула.
◊ Астеновегетативный вариант. Характеризуется рядом неспецифических симптомов:
<8> развитием общей слабости;
<8> потерей работоспособности;
<8> раздражительностью или безразличием;
<8> стойкой бессонницей или, наоборот, сонливостью.
◊ Клиническая симптоматика, отнесенная к различным вариантам дожелтушного периода, может сочетаться в различных комбинациях. В этих случаях говорят о смешанном варианте.
◊ ВГА может клинически проявиться сразу же с развития желтухи, в этом случае продромальные признаки отсутствуют (латентный вариант начального периода).
Начальный период продолжается от 2 до 7-10 дней. Диагностика заболевания в это время крайне затруднена. Необходимо опираться на данные эпидемиологического анамнеза (контакт с больными ВГА), выявление гепатоспленомегалии и повышение показателей аминотрансфераз.
• Период разгара у взрослых пациентов нередко протекает с развитием желтухи (от 10-30 до 50-70% случаев у лиц старше 40 лет). Начало желтушного периода необходимо считать с момента появления темной мочи. К этому моменту нормализуется температурная реакция, стихают катаральные признаки, однако диспепсические симптомы сохраняются или даже могут нарастать. Иктеричность вначале появляется на уздечке языка, мягком небе, склерах, затем на кожных покровах. Интенсивность желтухи различна, иногда она быстро прогрессирует, обычно через 3-4 дня достигая максимума. Желтуха часто приобретает шафранный оттенок. Тяжесть заболевания определяется не столько интенсивностью желтухи, сколько выраженностью синдрома интоксикации:
◊ нарастающей слабостью;
◊ адинамией;
◊ головокружением;
◊ повторной рвотой;
◊ другими диспепсическими расстройствами;
◊ степенью снижения аппетита;
◊ иногда развитием расстройств сна.
При более тяжелом течении болезни можно отметить геморрагические проявления - петехии на кожных покровах, появление кровоизлияний, особенно в местах инъекций, у части больных носовые кровотечения. Язык, как правило, обложен. Печень увеличена, чувствительна при пальпации. Степень ее увеличения может быть различной. В 30-40% случаев к этому времени обнаруживают спленомегалию. У части больных в разгар желтухи появляется обесцвеченный стул. Со стороны сердечно-сосудистой системы достаточно характерны брадикардия и тенденция к снижению АД. Желтушный период при классическом течении ВГА продолжается 2-4 нед.
• Период реконвалесценции. К этому времени происходит постепенное снижение интенсивности желтушного синдрома, уменьшение размеров печени, исчезают признаки интоксикации. Период реконвалесценции значительно продолжительнее периода желтухи, нормализация пигментного обмена и уровня аминотрансфераз наступает на протяжении от 1-3 до 4-6 мес. У 5-10% больных ВГА может приобрести более длительное течение, с малыми проявлениями или отсутствием интоксикации, небольшими цифрами билирубинемии и гиперферментемии, стойким увеличением печени. Чаще всего эти признаки связаны с развитием холестаза. В таких случаях выделение вируса из организма может продолжаться до исчезновения желтухи. Заболевание заканчивается благоприятно. Рецидивирующее течение гепатита А наблюдается очень редко. В этих случаях заболевание может продолжаться до нескольких месяцев, но всегда завершается выздоровлением. Дифференциальная диагностика
В дожелтушном периоде необходимо проводить дифференциальную диагностику с острыми респираторными и кишечными инфекциями.
Определенную помощь в дифференциальной диагностике могут оказать данные эпидемиологического анамнеза:
- контакт с желтушными больными;
- пребывание больного в районах, неблагополучных по гепатиту А. В некоторых случаях уже в продромальном периоде можно обнаружить увеличение печени, а также повышение активности аминотрансфераз.
В желтушном периоде ВГА дифференцируют с обтурационными и гемолитическими желтухами, лекарственным и токсическим гепатитом, мононуклеозом, иерсиниозом, лептоспирозом и др. Диагностике помогает определение маркеров гепатита с помощью ИФА, ПЦР, билирубина и его фракций.
Лабораторная диагностика
Лабораторные исследования приобретают особое значение для установления этиологии гепатита и оценки его тяжести.
В гемограмме необходимо учитывать лейкопению, относительный лимфоцитоз и замедление СОЭ. Интенсивность желтухи устанавливают на основании определения уровня билирубина в крови (особенно его связанной фракции). Активность аминотрансфераз (АЛТ и АСТ) при ВГА увеличивается в несколько раз, и степень ее повышения свидетельствует об интенсивности цитолиза гепатоцитов. Нарушения белоксинтетической функции печени отражают изменения показателей коллоидных проб (снижение сулемовой и повышение тимоловой проб), снижение уровня альбуминов и преальбуминов в крови, а также уменьшение показателей протромбинового индекса.
Возможно выделение вируса ВГА из фекалий, однако в широкой медицинской практике вирусологические исследования не проводят.
Для верификации диагноза используют серологические реакции - ИФА, РИА, выявляющие сывороточные anti-HAV IgM в дожелтушном периоде и их нарастание в периоде разгара болезни. Определение antiHAV IgM - единственный маркер острого периода заболевания. Аnti-HAV IgG появляются в крови после исчезновения из нее вируса. В дальнейшем anti-HAV IgM сохраняются в течение 2-6 мес, в это же время быстро нарастает титр аnti-HAVIgG, который сохраняется пожизненно, предохраняя пациента от повторного заражения.
Обнаружение в крови РНК вируса с помощью ПЦР пока не получило широкого распространения.
Осложнения
Развиваются сравнительно редко. К ним можно отнести обострения воспалительных процессов в желчных путях (холециститы, холангиты, дискинезии), а также развитие вторичных инфекций (пневмонии и др.) и аутоиммунного гепатита. Острая печеночная энцефалопатия при ВГА развивается крайне редко.
Лечение
При подтверждении диагноза ВГА лечение больного можно проводить в амбулаторных условиях. Показания к госпитализации:
- тяжелое течение заболевания;
- затяжные формы ВГА;
- тяжелые сопутствующие заболевания;
- эпидпоказания, касающиеся лиц декретированных групп. Больным назначают постельный режим на период выраженного
интоксикационного синдрома и диету. В питании исключают:
- тугоплавкие жиры;
- трудноусвояемые сорта мяса (баранина, свинина, мясо водоплавающей птицы);
- жареные блюда;
- консервы;
- маринады;
- лук;
- чеснок и пряности.
Предпочтение отдается кисломолочным продуктам и пище растительного происхождения. Дополнительно в пищевые продукты добавляют витамины С и групп В. Категорически запрещено употребление алкогольных напитков всех видов, включая пиво.
В связи с отсутствием средств этиотропного лечения проводят патогенетическое. Для снятия интоксикации в зависимости от ее степени применяют обильное питье или инфузионные растворы. Для ежедневного очищения кишечника и подавления анаэробной флоры рекомендовано назначать производные лактулозы, дозы которых подбирают индивидуально. Для купирования холестатического компонента применяют спазмолитики (дротаверин, но-шпа*, аминофиллин, эуфиллин*) и производные урсодезоксихолевой кислоты.
После выписки из стационара в течение 3-6 мес рекомендуют соблюдение диеты (стол ? 5 по Певзнеру), ограничение физических нагрузок.
Эпидемиологический надзор
Предусматривает анализ заболеваемости населения с учетом меняющихся природно-климатических и социально-бытовых факторов, прогнозирование заболеваемости и оценку качества и эффективности про-
водимых мероприятий. Широкое использование лабораторного контроля объектов окружающей среды с применением санитарнобактериологических и санитарно-вирусологических методов (определение колифагов, энтеровирусов, Аг вируса ВГА).
Профилактические мероприятия
Основные меры профилактики заражения - обеспечение населения доброкачественной водой и создание условий, гарантирующих выполнение санитарных правил, предъявляемых к заготовке, хранению, приготовлению и реализации продуктов питания. Большое значение имеет обеспечение надлежащего противоэпидемического режима в организованных детских и взрослых коллективах. Осенью (время высокого риска) мероприятия, проводимые в них, должны приобрести характер противоэпидемических. К примеру, ДДУ и школьные учреждения даже при отсутствии заболеваний следует рассматривать как потенциальные очаги ВГА.
Мероприятия следует направить:
- на активный поиск источников инфекции;
- выявление IgM в ИФА;
- усиление дезинфекционного режима;
- предметное санитарное воспитание детей и взрослых применительно к реальной опасности заражения ВГА.
В период предсезонного повышения заболеваемости эффективна иммуноглобулинопрофилактика, обеспечивающая защиту в течение 3-4 мес. Охват прививками 50-60% детей в ДДУ и 70-80% школьников обеспечивает снижение заболеваемости в этих контингентах в 2-3 раза. Детям дошкольного возраста вводят иммуноглобулин по 0,75 мл, школьникам начальных классов - по 1,5 мл, детям старшего возраста и взрослым в зависимости от массы тела - до 3 мл. Введение иммуноглобулина разрешено не более 4 раз в течение жизни с интервалом не менее 1 года.
В настоящее время в качестве средства специфической профилактики предложена вакцина против ВГА, так как введение иммуноглобулина обеспечивает быструю, но кратковременную защиту. Вакцинопрофилактика формирует активный иммунитет, сопровождающийся продолжительной циркуляцией собственных АТ. Выпускают эффективные и безвредные вакцины против ВГА для детей и взрослого населения, обеспечивающие сохранение иммунитета до 10 лет. Однако широкое распространение вакцинации против ВГА сдерживает ее сравнительно
высокая стоимость. Вместе с тем известно, что ущерб, причиняемый ВГА, значительно превышает стоимость вакцинации. Органы здравоохранения отдельных территорий, понимая ущерб, который могут причинить групповые заболевания ВГА среди военнослужащих, специалистов МЧС и других лиц высокого риска, предпринимают меры для проведения вакцинации против ВГА. Учитывая высокую поражаемость детей и тот факт, что они - основной источник инфекции для взрослых, перспективным направлением служит вакцинопрофилактика ВГА у детей младшего возраста и школьников, давно широко проводимая в США и ряде стран (Израиль, Испания, Италия). В соответствии с новым календарем прививок в России введена вакцинация против ВГА по эпидемическим показаниям начиная с 3-летнего возраста.
Определены следующие группы населения, которые могут быть вакцинированы:
- дети, проживающие на территориях с высоким уровнем заболеваемости ВГА;
- медицинские работники, воспитатели и персонал ДДУ;
- работники сферы обслуживания населения, прежде всего занятые в организациях общественного питания;
- работники по обслуживанию водопроводных и канализационных сооружений и сетей;
- лица, выезжающие в гиперэндемичные по ВГА регионы и страны;
- лица, контактные по эпидемическим показаниям. В России зарегистрированы следующие вакцины:
- гепаинвак (Россия);
- аваксим (Авентис Пастер, Франция);
- вакта (Мерк, Шарп и Доум, США);
- хаврикс 1440 и 720 (Смит Кляйн Бичем, Бельгия).
Все вакцины представляют собой инактивированные формалином вирионы ВГА, адсорбированные на гидроокиси алюминия. Их вводят внутримышечно. Гепаинвак применяют у детей с 3 лет и у взрослых. Взрослым вакцину вводят в дозе 0,5 мл в дельтовидную мышцу. Курс - 3 прививки по схеме 0, 1 и 6 мес. Детям вводят 0,25 мл в дельтовидную мышцу дважды с интервалом 1 мес. Вакцину аваксим вводят детям с 2 лет и взрослым однократно внутримышечно, ревакцинацию проводят через 6-18 мес однократно, последующие ревакцинации - каждые 10 лет. Вакцину вакта вводят начиная с 2-летнего возраста как однократную первичную дозу (детям 25 антигенных ЕД - 0,5 мл, взрослым 50 антигенных ЕД - 1 мл) с повторной дозой через 6-18 мес. Вакцину хаврикс применя-
ют как у детей начиная с 1 года, так и у взрослых. Выпускается в ампулах по 0,5 мл (720 ЕД) для детей и по 1 мл (1440 ЕД) для взрослых.
Вакцинация стимулирует развитие иммунитета через 21-28 сут. Титры АТ, хотя и ниже, чем после заболевания, обеспечивают надежную защиту от инфекции.
Мероприятия в эпидемическом очаге
Заболевших гепатитом госпитализируют по клиническим и эпидемиологическим показаниям. Изоляция больных оправдана в течение первых 2 нед болезни. Через 1 нед после появления желтухи они практически не опасны для окружающих. Выписку реконвалесцентов и допуск их на работу (в том числе работников пищевых предприятий и лиц, к ним приравненных), а также выписку и допуск детей в детские учреждения осуществляют в зависимости от состояния здоровья. Переболевших ВГА врач стационара осматривает через 1 мес после выписки. При отсутствии клинических и биохимических отклонений их снимают с учета, при остаточных признаках через 3 мес передают в кабинет инфекционных заболеваний для диспансеризации.
В очаге инфекции устанавливают медицинское наблюдение в течение 35 дней за лицами, находившимися в контакте с больным. В ДДУ в течение этого периода запрещают перевод детей и персонала в другие группы. Прием новых детей осуществляют только при разрешении эпидемиолога. Лабораторное обследование проводят в ДДУ по назначению врачей (педиатра и эпидемиолога) лицам, общавшимся с больными ВГА (определение в крови АЛТ, анти-ВГА класса IgM в крови, Аг вируса в фекалиях). Обследование также проводят при появлении в коллективе повышенной частоты случаев ОРВИ, особенно сопровождающихся увеличением печени, гепатолиенальным синдромом неясной этиологии, диспепсическими явлениями, подъемами температуры тела и др. Общавшимся с больным детям, беременным вводят иммуноглобулин в дозе 1 мл детям до 10 лет и 1,5 мл лицам старше 10 лет. В течение 2 мес со дня изоляции последнего больного ВГА в детском учреждении (группа ДДУ, класс школы) не следует проводить плановые прививки.
При возникновении в соматической детской больнице или санатории случая ВГА прекращается перевод детей из палаты в палату и другие отделения. Вновь поступающих детей рекомендуют размещать в отдельных палатах. Усиливают надзор за проведением противоэпидемических мероприятий и соблюдением санитарно-гигиенического режима.
Детей, имевших в семье контакт с ВГА, допускают в коллективы с разрешения эпидемиолога в случае перенесенного ранее ВГА, введения иммуноглобулина и установления за данными детьми регулярного наблюдения в течение 35 дней. В очаге с использованием химических дезинфекционных средств проводят текущую и заключительную дезинфекцию.
ГЕПАТИТ Е (HEPATITIS E)
ВГЕ - острая вирусная эндемическая инфекция с фекальнооральным механизмом передачи, характеризующаяся поражением печени, циклическим течением и тяжелыми проявлениями у беременных.
Краткие исторические сведения
Впервые крупная (29 000 больных) водная вспышка заболевания, известного в настоящее время как ВГЕ, наблюдалась в Индии в 1955 г. Заболевание протекало с лихорадкой, желтухой, высокой летальностью (до 25%) среди беременных. Результаты ретроспективного анализа вспышки, опубликованные в 1980 г., дали основание выделить заболевание из группы гепатитов «ни А, ни В» и обозначить его как ВГЕ. Вирус-возбудитель ВГЕ впервые идентифицирован в Москве в 1982 г. (Балаян М.С. и др.).
Этиология
Возбудитель ВГЕ - РНК-геномный вирус (HEV) 3 серотипов, относится к новому роду вирусов, названному Herpvirus. Вирионы округлой формы, лишены суперкапсида. В целом HEV менее устойчив, чем HAV. Он хорошо сохраняется при температуре ниже -20 °С, а уже при 0 °С быстро разрушается. Возбудитель чувствителен к воздействию хлорсодержащих или йодсодержащих дезинфекционных средств. Вирус не культивируется в культуре тканей, для его выделения используют заражение приматов.
Эпидемиология
Резервуар и источник инфекции - человек, больной или носитель. Период контагиозности источника точно не установлен, вероятно, он аналогичен таковому при ВГА. Вирус обнаруживают в фекалиях в
ранние сроки болезни в 15% случаев при легких и среднетяжелых формах. При тяжелом течении его обнаруживают почти у 50% больных. Доказана патогенность ВГЕ для шимпанзе, свиней и других животных.
Механизм передачи - фекально-оральный, путь передачи - преимущественно водный. Имеются данные о распространении возбудителя и контактно-бытовым путем. Предполагают возможность заражения ВГЕ при употреблении в пищу сырых моллюсков. В пользу воды как главного фактора передачи инфекции свидетельствуют низкая очаговость, возникновение массовых заболеваний, связанных с сезонами дождей и с высоким стоянием уровня грунтовых вод.
Естественная восприимчивость людей
Естественная восприимчивость людей высокая, особенно женщин в III триместр беременности. Относительно редкое поражение детей объясняют преобладанием у них стертых субклинических форм над манифестными, что затрудняет их регистрацию. Имеются достаточные основания полагать, что после перенесенного заболевания формируется напряженный иммунитет, сохраняющийся, видимо, на протяжении всей жизни переболевшего.
Основные эпидемиологические признаки
ВГЕ широко распространен в странах с тропическим и субтропическим климатом, а также в среднеазиатском регионе. ВГЕ эндемичен на территориях с крайне плохим водоснабжением населения, характеризующимся неудовлетворительным качеством воды, опасной в эпидемическом отношении, при выраженном ее дефиците (территории риска). Принято считать, что ВГЕ ежегодно заболевает около 1 млн человек, а в странах Азии на его долю приходится более половины всех случаев острого гепатита. Крупные водные вспышки (с числом заболевших 15 000-20 000) имели место в Индии, Бирме, Алжире, Непале, республиках Средней Азии бывшего СССР (Туркмения, Таджикистан, Узбекистан, Киргизия). Поскольку отдельную регистрацию ВГЕ не проводят, истинные величины заболеваемости и точный нозоареал определить очень трудно. Стойкие очаги ВГЕ существуют в Центрально-Азиатском регионе бывшего СССР, преимущественно в низменных и плоскогорных районах. Наряду с крупными вспышками регистрируют и спорадические заболевания. В Москве ВГЕ зарегистрирован у 3,6% больных вирусными гепатитами, однако все заболевшие были приезжими из республик Средней Азии.
Преимущественно водный путь заражения определяет ряд эпидемиологических особенностей ВГЕ:
- взрывообразный характер заболеваемости;
- своеобразную возрастную структуру заболевших с преимущественным поражением лиц 15-19 лет;
- незначительную очаговость в семьях;
- повторяющиеся подъемы заболеваемости в эндемичных районах с интервалом в 7-8 лет;
- резко выраженную территориальную неравномерность распространенности заболеваемости;
- сезонное повышение заболеваемости в летне-осенние месяцы.
Патогенез
Патогенез заболевания окончательно не изучен. Вирус избирательно поражает гепатоциты, предположительно вызывая лишь повышение проницаемости клеточной мембраны. Последующие, более тяжелые поражения клеток паренхимы печени обусловлены развитием иммунопатологических механизмов. Гистологические изменения в печени аналогичны таковым при ВГА, но выражены значительно интенсивнее, что может обусловить в дальнейшем развитие постнекротического фиброза.
Клиническая картина
Инкубационный период варьирует от 2 до 9 нед, в среднем продолжается около 1 мес.
Дожелтушный (продромальный) период бывает коротким, чаще длится 2-3 дня, иногда от 1 до 10 дней. Характерны лихорадка, выраженные диспепсические явления, гепатомегалия. Нередки артралгии и полиморфная экзантема.
Период разгара заболевания у взрослых чаще всего проявляется интенсивной желтухой, выраженным повышением уровней билирубина, аминотрансфераз, щелочной фосфатазы (ЩФ). У детей нередко заболевание протекает в безжелтушной и даже в субклинической форме. Длительность периода разгара чаще всего ограничивается 2-4 нед, но иногда может затягиваться и до 10-12 нед.
Дифференциальная диагностика
Затруднена в связи с тем, что клиническое течение гепатита Е в основных своих проявлениях сходно с другими вирусными гепатитами. При дифференциальной диагностике следует учитывать сведения эпиданамнеза о пребывании больного в районах, неблагополучных по данному заболеванию (тропические и субтропические регионы, среднеазиатские республики СНГ). При подозрении на гепатит Е у беременных для подтверждения диагноза необходима обязательная маркерная диагностика, поскольку у них заболевание склонно к тяжелому течению с большим количеством летальных исходов или самопроизвольных выкидышей.
Лабораторная диагностика
Основу лабораторной диагностики составляют обнаружение РНК вируса с помощью ПЦР и выявление специфических АТ. Однако следует иметь в виду, что вирусная РНК и anti-HVE IgM появляются в сыворотке крови не ранее 21-го дня и могут исчезнуть уже к 40-му дню, считая от момента заражения, но к этому времени появляются аnti-HVE IgG, сохраняющиеся впоследствии до 2 лет.
Осложнения и исходы
Хронических форм заболевания нет, в большинстве случаев происходит полное выздоровление. В 5% случаев формируется постнекротический фиброз. Летальность составляет в среднем 1-5%.
Наиболее опасен ВГЕ во II и III триместрах беременности. При этом во многих случаях течение желтушного периода скоротечно, с исходом в острую печеночную энцефалопатию. Фазы острой печеночной энцефалопатии быстро сменяют друг друга, и больные впадают в глубокую кому. Сильно выражен геморрагический синдром. Смерть плода наступает до рождения. В этой категории больных летальность колеблется в пределах 10-20%, а в некоторых случаях может достигать 40-50%.
Лечение
В неосложненных случаях аналогично таковому при ВГА. Лечение острой печеночной энцефалопатии см. в разделе «Гепатит В».
Профилактические мероприятия
Эпидемиологический надзор за ВГЕ принципиально не отличается от такового при ВГА. Необходима четкая информация о состоянии водоснабжения и качестве питьевой воды, миграционных процессах с эндемичных территорий (см. выше раздел «Гепатит А»). Особое значение уделяют обеззараживанию воды. Меры специфической профилактики не разработаны. Имеются рекомендации о введении беременным специфического иммуноглобулина.
ротавирусные инфекции
РОТАВИРУСНЫЙ ГАСТРОЭНТЕРИТ
Ротавирусный гастроэнтерит - острое антропонозное вирусное заболевание с фекально-оральным механизмом передачи, поражающее слизистые оболочки тонкой кишки и ротоглотки.
Краткие исторические сведения
Клинические проявления заболевания в виде крупных вспышек известны с конца XIX в. Возбудитель впервые выделен и описан Р. Бишопом и соавт. (1973). Во многих регионах земного шара заболеваемость ротавирусными гастроэнтеритами занимает 2-е место после заболеваемости ОРВИ.
Этиология
Возбудитель - РНК-геномный вирус рода Rotavirus семейства Reoviridae. Родовое название он получил из-за сходства вирионов (под электронным микроскопом) с маленькими колесами, имеющими толстую втулку, короткие спицы и тонкий обод (лат. rota - колесо). В составе ротавирусов обнаружено 4 основных Аг. Главный из них - групповой Аг-белок внутреннего капсида.
С учетом всех группоспецифических Аг ротавирусы делят на 7 групп (A, В, C, D, E, F, G).
Большинство ротавирусов человека и животных относят к группе А, внутри которой выделяют подгруппы (Ι, ΙΙ) и серотипы. Подгруппа ΙΙ включает до 70-80% штаммов, выделяемых от больных. Существуют
данные о возможной корреляции определенных серотипов с тяжестью диареи.
Особенность ротавирусов - это постоянная изменчивость их антигенного состава, протекающая по 2 типам:
- дрейфовому, в результате которого возникают новые штаммы;
- шифтовому, сопровождающемуся появлением новых типов вируса.
Ротавирусы устойчивы во внешней среде. На различных объектах окружающей среды они сохраняют жизнеспособность от 10-15 дней до 1 мес, в фекалиях - до 7 мес. В водопроводной воде при 20-40 °С сохраняются более 2 мес, на овощах при 4 °С - 25-30 сут.
Эпидемиология
Источник инфекции - человек (больной и вирусоноситель). Эпидемическую опасность больной представляет в течение 1-й недели болезни, затем контагиозность его постепенно уменьшается. У отдельных больных период выделения вируса может затягиваться до 20-30 дней и более. Лица без клинических проявлений болезни могут выделять возбудитель до нескольких месяцев. В очагах инфекции бессимптомных носителей ротавирусов чаще выявляют среди взрослых лиц, тогда как основную группу заболевших острым ротавирусным гастроэнтеритом составляют дети. Бессимптомные носители вируса имеют большое значение, особенно среди детей первого года жизни, чаще всего заражающихся от своих матерей. Взрослые и дети старшего возраста заражаются от больных детей, посещающих организованные детские коллективы.
Механизм передачи - фекально-оральный, пути передачи - водный, пищевой и бытовой. Наиболее важную роль играет водный путь передачи возбудителя. Заражение воды открытых водоемов может происходить при сбросе необезвреженных сточных вод. При контаминации воды центральных водопроводов возможно заражение большого количества людей. Из пищевых продуктов опасны молоко и молочные продукты, инфицируемые при переработке, хранении или реализации. Реже вирусы передаются воздушно-капельным путем. Контактно-бытовая передача возможна в семье и в условиях лечебных стационаров.
Естественная восприимчивость людей
Естественная восприимчивость к инфекции высокая. Наиболее восприимчивы дети до 3 лет. Внутрибольничное заражение часто регистрируют среди новорожденных, имеющих неблагоприятный премор-
бидный фон и находящихся на искусственном вскармливании. У них гастроэнтериты протекают преимущественно в тяжелой форме. В группу риска также входят пожилые люди и лица с сопутствующей хронической патологией. Постинфекционный иммунитет непродолжи телен.
Основные эпидемиологические признаки
Заболевание регистрируют повсеместно. В развивающихся странах ротавирусные гастроэнтериты составляют примерно половину всех диарейных заболеваний у детей. Болеют преимущественно дети в возрасте до 1 года, реже - до 6 лет. В семьях, где есть больные дети, нередко заболевают и взрослые. По данным ВОЗ, ежегодно ротавирусные гастроэнтериты становятся причиной смерти от 1 до 3 млн детей. Ротавирусная инфекция составляет около 25% случаев так называемой диареи путешественников. В тропических странах ее регистрируют круглый год с некоторым повышением заболеваемости в прохладный дождливый сезон. В странах с умеренным климатом заметно выражена сезонность с наибольшей заболеваемостью в зимние месяцы. Ротавирусный гастроэнтерит достаточно широко распространен в России (официальная регистрация введена с 1990 г.): регистрируют как спорадические заболевания, так и вспышки. Характерна высокая очаговость в организованных коллективах, особенно ДДУ. Нередко заболевание проявляется групповыми вспышками при внутрибольничном заражении в родильных домах и детских медицинских стационарах разного профиля. В родильных домах чаще болеют дети, находящиеся на искусственном вскармливании, страдающие острыми и хроническими заболеваниями, с различными видами иммунодефицита. В 2007 г. показатель заболеваемости ротавирусной инфекцией в России составил 36,56 на 100 000 населения. Наиболее высоким он был в Мурманской (130,6), Тюменской (155,7), Вологодской (187,8) областях, Агинском Бурятском (194,2) и Чукотском (247,5) автономных округах, Республике Алтай (226,4). Возрастающий удельный вес ротавирусной инфекции связан прежде всего с улучшением качества вирусологических исследований. Заболеваемость ротавирусной инфекцией регистрируется в основном среди детей до 14 лет, при этом особенно высокие показатели (свыше 700 на 100 000 населения) отмечаются у детей в возрасте до 2 лет. Все это негативно сказывается на эпидемической обстановке в детских дошкольных коллективах. В 2007 г. зарегистрировано 195 вспышек острых кишечных инфекций ротавирусной этиологии, из них 55% при-
ходится на ДДУ. Наибольшее число вспышек ротавирусной инфекции зарегистрировано в Омской (12), Тюменской (16), Вологодской (16) областях, г. Санкт-Петербурге (18) и Москве (20).
Патогенез
При поступлении в тонкую кишку вирусы проникают в дифференцированные адсорбирующие функционально активные клетки ворсинок ее проксимального отдела, где происходит репродукция возбудителей. Размножение вирусов сопровождается выраженным цитопатическим эффектом. Снижается синтез пищеварительных ферментов, в первую очередь расщепляющих углеводы. Вследствие этого нарушаются пищеварительные и всасывательные функции кишки, что клинически проявляется развитием диареи осмотического характера.
Ротавирусная инфекция приводит к морфологическим изменениям кишечного эпителия:
- укорочению микроворсинок;
- гиперплазии крипт;
- умеренной мононуклеарной инфильтрации собственной пластинки.
Циркуляция ротавирусов ограничена слизистой оболочкой тонкой кишки, однако в отдельных случаях вирусы можно обнаружить в собственной пластинке слизистой оболочки и даже регионарных лимфатических узлах. Репродукцию вирусов в отдаленных зонах и их диссеминацию наблюдают только при иммунодефицитах.
Клиническая картина
Часто заболевание развивается у детей в возрасте от 4 мес до 3 лет. Инкубационный период продолжается от 1 до 5 сут, чаще 2-3 дня. Заболевание начинается остро, с одновременным появлением тошноты, рвоты и диареи. Обычно однократная или повторная рвота прекращается уже в 1-е сутки, а при легком течении болезни ее может не быть вообще. Диарея длится до 5-7 дней.
Больного беспокоят выраженная общая слабость, плохой аппетит, тяжесть в эпигастральной области, иногда головная боль. Часто отмечают умеренные схваткообразные или постоянные боли в животе. Они могут быть диффузными или локализованными (в эпигастральной и околопупочной областях). Внезапно возникающие позывы к дефекации
носят императивный характер. При легком течении заболевания стул кашицеобразный, носит каловый характер, не чаще 5-6 раз в сутки. В случаях средней тяжести и при тяжелом течении заболевания частота дефекаций нарастает до 10-15 раз в сутки и более, стул жидкий, обильный, зловонный, пенистый, желто-зеленого или мутного белого цвета. Акт дефекации сопровождают интенсивные боли в животе. Примесь слизи и крови в испражнениях, а также тенезмы не характерны.
При осмотре больных обращают на себя внимание выраженная адинамия и слышимые на расстоянии шумы кишечной перистальтики. Язык обложен, возможны отпечатки зубов по его краям. Слизистая оболочка ротоглотки гиперемирована, отмечают зернистость и отечность язычка. Живот умеренно болезненный в эпигастральной, пупочной и правой подвздошной областях. При пальпации слепой кишки отмечают грубое урчание. Печень и селезенка не увеличены. У части больных выявляют склонность к брадикардии, приглушенность тонов сердца. Температура тела остается нормальной или повышается до субфебрильных цифр, однако при тяжелом течении болезни может быть высокой.
При тяжелых формах возможно развитие нарушений водно-солевого обмена с недостаточностью кровообращения, олигурией и даже анурией, повышением содержания азотистых веществ в крови.
Характерная черта этого заболевания, отличающая его от других кишечных инфекций, - одновременное развитие клинических проявлений со стороны верхних дыхательных путей в виде фарингита, ринофарингита или ринита. Общая продолжительность заболевания колеблется от 2 до 14 дней.
У взрослых ротавирусный гастроэнтерит обычно протекает субклинически. Манифестные формы можно наблюдать у родителей больных детей, у людей, посещавших развивающиеся страны, при иммунодефицитах, в том числе у лиц преклонного возраста.
Дифференциальная диагностика
Ротавирусные гастроэнтериты следует отличать от других острых кишечных инфекций различной этиологии. Наибольшие сложности при этом вызывают диарейные заболевания, вызываемые другими вирусами (коронавирусы, калицивирусы, астровирусы, кишечные аденовирусы, вирус Норволк и др.), клиническая картина которых еще недостаточно изучена.
• Для аденовирусной кишечной инфекции характерны более длительные инкубационный период (8-10 сут) и диарея (до 2 нед). Поражения респираторного тракта при этом развиваются редко.
• Для инфекций, вызванных вирусом Норволк и ему подобными, характерно эпидемическое распространение как среди детей, так и среди взрослых. Рвота и диарея сопровождаются более выраженным синдромом интоксикации - высокой температурой тела, миалгиями, головной болью.
Опорные клинические признаки ротавирусного гастроэнтерита - одновременное острое развитие тошноты, рвоты и диареи, которые часто сопровождаются схваткообразными болями в эпигастральной или околопупочной области, урчанием в правой подвздошной области. Одновременно развиваются симптомы поражения верхних дыхательных путей в виде фарингита, ринофарингита и ринита.
Лабораторная диагностика
Ротавирусы можно выделять из фекалий, лучше всего в первые дни болезни. Для консервации кала готовят 10% суспензию на растворе Хенкса. Пробы испражнений помещают в стерильные флаконы и транспортируют в контейнерах со льдом.
Определение Аг вируса в фекалиях и биологических жидкостях проводят с помощью РКА, РЛА, РСК, ИФА, реакций иммунопреципитации в геле и иммунофлюоресценции (РИФ). Специфические АТ в крови больного обнаруживают с помощью Аг ротавирусов, поражающих животных (телят). Серологическая диагностика носит ретроспективный характер, поскольку подтверждением диагноза считают не менее чем четырехкратное нарастание титров АТ в парных сыворотках, взятых в первые дни болезни и через 2 нед.
Лечение
Средства этиотропного лечения отсутствуют. В острый период болезни необходима диета с ограничением углеводов (сахара, фруктов, овощей) и исключением продуктов, вызывающих бродильные процессы (молока, молочных продуктов). Учитывая особенности патогенеза заболевания, желательно назначение полиферментных препаратов - абаминар, полизимар, панзинорма-форте*, панкреатина, фестала* и др. В последнее время с успехом применяют мексазу*. Благоприятно
сочетание этих препаратов с интестопаном* и нитроксолином. Показаны адсорбирующие и вяжущие средства.
Коррекцию водно-электролитных потерь и дезинтоксикационное лечение проводят по общим принципам (см. выше раздел «Холера»). Поскольку в большинстве случаев дегидратация больных слабая или умеренная, в соответствии с рекомендациями ВОЗ показано пероральное введение глюкозоэлектролитных смесей вплоть до купирования диареи.
Эпидемиологический надзор
Эпидемиологический надзор основан на внедрении системы полного учета заболеваемости среди различных контингентов населения, применении лабораторных методов диагностики и отслеживании широты циркуляции возбудителя различных серотипов. Внедрение в практику здравоохранения коммерческих средств лабораторной диагностики позволяет ввести новую стратегию надзора за эпидемиологической ситуацией, предполагающую мониторинг окружающей среды для выявления ареала распространения ротавирусов.
Профилактические мероприятия
Основу составляют общие гигиенические мероприятия, направленные на предупреждение попадания и распространения возбудителей водным, пищевым и бытовым путями.
Комплекс санитарно-гигиенических мероприятий включает:
- оздоровление окружающей среды;
- строгое соблюдение санитарных норм при водоснабжении населения, канализации;
- строгое соблюдение правил личной гигиены.
В ряде стран разрабатывают и успешно применяют вакцины, обладающие довольно высокой профилактической эффективностью.
Мероприятия в эпидемическом очаге
Больных следует изолировать на 10-15 дней. Изоляционноограничительные мероприятия в очаге важны еще и для ограничения распространения возбудителей воздушно-капельным путем. Госпитализацию проводят по клиническим и эпидемиологическим показаниям.
Инфицированные лица выделяют с фекалиями очень большое количество вирусов, обладающих умеренной устойчивостью во внешней среде, поэтому в эпидемическом очаге осуществляют текущую и заключительную дезинфекцию. Одна из действенных мер профилактики ротавирусной инфекции у новорожденных - грудное вскармливание. Дети, посещающие ДДУ, работники пищевых предприятий и лица, к ним приравненные, после перенесенного заболевания подлежат клиническому наблюдению в течение 1 мес с ежедневным контролем характера испражнений. При отсутствии клинических симптомов заболевания в конце срока наблюдения им проводят однократное исследование на вирусы (Аг). При возникновении в детских учреждениях групповых заболеваний проводят карантинные мероприятия в течение 5 дней с момента изоляции последнего больного. Медицинское наблюдение за контактными лицами проводят на протяжении 7 дней. В качестве возможного средства профилактики ротавирусной инфекции рекомендовано пероральное введение коммерческого препарата иммуноглобулин человека антиротавирусный энтеральный.
энтеровирусные инфекции
ЭНТЕРОВИРУСНЫЕ НЕПОЛИОМИЕЛИТНЫЕ ИНФЕКЦИИ
Энтеровирусные неполиомиелитные инфекции - группа острых инфекционных заболеваний, характеризующихся полиморфизмом клинических проявлений.
Краткие исторические сведения
Вирусы Коксаки впервые были выделены и изучены Д. Дэлдорфом и Д.М. Сикклзом (1948) в городке Коксаки (Нью-Йорк, США). В 1951 г. Ч. Эндрюс и почти одновременно другие исследователи в различных лабораториях США выделили вирусы, первоначально названные неклассифицированными, сиротскими (Orphan), а с 1955 г. - кишечными (Enteric) цитопатическими (Cytopathogenic) человеческими (Human) сиротскими вирусами - ECHO. Впоследствии была установлена их принадлежность к развитию многих клинических форм заболеваний у человека, круг которых постоянно расширяется.
Этиология
Согласно классификации вирусов (Международный комитет по таксономии вирусов, 2003 г.), основанной на геномных характеристиках вирусов, неполиомиелитные энтеровирусы человека представлены 4 видами (A, B, C, D), входящими в род Enterovirus, который относится к семейству Picornaviridae (от pico - малый и rna - содержащий РНК).
К каждому из 4 видов неполиомиелитных энтеровирусов человека отнесены различные серотипы (табл. 3-5).
Таблица 3-5. Таксономические виды неполиомиелитных энтеровирусов человека и входящие в виды серотипы
Вид | Число серотипов | Серотипы |
Энтеровирус человека А | 16 | Коксаки А 2-8, 10, 12, 14, 16; Энтеровирус 71, 76, 89-91 |
Энтеровирус человека В | 52 | Коксаки А 9, Коксаки В 1-6; ЕСНО 1-7, 9, 11-21, 24-27, 29-33; Энтеровирусы 69, 73-75, 77-88, 95 |
Энтеровирус человека С | 10 | Коксаки А 1, 11, 13, 15, 17-21, 24 |
Энтеровирус человека D | 3 | Энтеровирусы 68, 70, 94 |
В настоящее время определена полностью или частично нуклеотидная последовательность геномов многих энтеровирусов. Все энтеровирусы оказались сходными по общей схеме организации геномов, хотя и имеют различия по видам и серотипам.
В настоящее время энтеровирус типа 71 рассматривается как один из значимых патогенных агентов из числа энтеровирусов человека. Этот вирус характеризуется высокой нейропатогенностью, может вызывать крупные вспышки заболеваний с летальными исходами. Энтеровирус типа 71 - мелкий безоболочечный РНК-содержащий вирус - относится к семейству Picornaviridae, роду Enterovirus, виду Human Enterovirus A (HEV-A). По основным физико-химическим и биологическим характеристикам энтеровирус типа 71 практически не отличается от остальных энтеровирусов. Вирус был выделен и идентифицирован как отдельный серотип в 1970 г. во время вспышки серозного менингита в Калифорнии (США). В настоящее время показано генетическое разнообразие штаммов энтеровирусов типа 71. Различают 4 генетических линии вируса (A-D), внутри которых выделяют генотипы.
Общие свойства энтеровирусов:
- небольшие размеры (15-35 нм);
- содержат РНК;
- устойчивы к эфиру, 70% спирту, 5% лизолу, к замораживанию. Могут развиваться на различных первичных и перевиваемых культурах тканей. Прогревание при температуре 50 °С и выше, высушивание, УФО, обработка 0,3% раствором формальдегида, хлорсодержащими препаратами (0,3-0,5 г хлора на 1 л) приводит к быстрой инактивации энтеровирусов.
Вирусы обладают высокой устойчивостью к низким температурам, в фекалиях на холоде сохраняют жизнеспособность более 6 мес. Устойчивы к замораживанию и оттаиванию.
Эпидемиология
Резервуар и источник инфекции - человек, больной манифестной и инаппарантной формами заболевания, или носитель. Период контагиозности источника возбудителя - недели и даже месяцы. Наиболее интенсивное выделение возбудителя происходит в первые дни болезни. Вирусоносительство у здоровых лиц составляет от 17 до 46%. Чаще его выявляют у детей младшего возраста.
Механизм передачи - фекально-оральный, путь передачи - пищевой. Факторы передачи - преимущественно овощи, контаминированные энтеровирусами в результате применения необезвреженных сточных вод в качестве органических удобрений. Возможность выделения энтеровирусов из слизи верхних дыхательных путей свидетельствует о вероятности аэрозольного механизма передачи инфекции. Вирус может передаваться через грязные руки, игрушки и другие объекты внешней среды. Возможна вертикальная (трансплацентарная) передача энтеровирусов от больной беременной плоду. Доказано, что в 1 г фекалий больного человека может содержаться до 107-108 патогенных энтеровирусов, которые с хозяйственно-бытовыми сточными водами попадают в поверхностные водоемы. В силу высокой устойчивости к воздействию физических и химических факторов окружающей среды длительно сохраняются в воде. Поэтому они могут распространяться на значительные расстояния, загрязняя прибрежные рекреационные зоны, воду в пунктах водозабора, а также, преодолевая барьер водоподготовки, попадают в водопроводную распределительную сеть.
Естественная восприимчивость людей
Естественная восприимчивость человека высокая, о чем свидетельствует преимущественная заболеваемость детей. Перенесенное заболевание чаще всего оставляет типоспецифическую невосприимчивость, хотя не исключена и возможность развития перекрестного иммунитета к иным типам вируса.
Основные эпидемиологические признаки
Заболевание распространено повсеместно. В последние годы в мире наметилась четкая тенденция активизации энтеровирусной инфекции, о чем свидетельствуют постоянно регистрируемые в разных странах эпидемические подъемы заболеваемости и вспышки. Наиболее крупные из описанных вспышек, вызванные преимущественно вирусами ECHO 6, 13, 30, а также энтеровирусом типа 71, отмечались на Тайване, в Сингапуре, Тунисе, а также в России в Приморском крае, Калмыкии, на Украине, где преобладали вирусы Коксаки В 3, 4, 5, EСНО 6,17, 30, энтеровирус типа 70.
На протяжении последних 40 лет энтеровирус типа 71 - один из наиболее патогенных серотипов энтеровирусов.
Зарегистрировано 3 волны вспышек инфекции, вызванной энтеровирусом типа 71:
- в 1969-1978 гг. (США, Австралия, Япония, Швеция, Болгария, Венгрия);
- в 1985-1991 гг. (Гонконг, США, Бразилия, Тайвань);
- в 1996-2006 гг. (Малайзия, Сингапур, Тайвань, Канада, Австралия, Корея, Китай, Вьетнам, Япония).
Крупная вспышка энтеровирусной инфекции (HFMD - англ. рукиноги-рот-болезнь) зарегистрирована в 2008 г. среди населения Китайской Народной Республики (КНР). Число зарегистрированных случаев составило более 28 000 человек, из них 93% - дети до 4 лет. По данным вирусологических исследований материала, от заболевших в большинстве случаев идентифицируется энтеровирус типа 71, а также вирусы типов Коксаки А 16 и EСНО. В эпидемический процесс вовлечены 19 административных образований КНР, эпицентром подъема заболеваемости стал город Фуань восточной провинции Аньхой.
Эпидемический процесс энтеровирусной инфекции проявляется спорадической заболеваемостью, сезонными подъемами (в весеннеосенний период) и вспышками (в течение всего года). Около 85% случаев энтеровирусных инфекций протекает бессимптомно. Около
12-14% случаев диагностируют как легкие лихорадочные заболевания и примерно 1-3% имеют тяжелое течение, особенно у детей раннего возраста и лиц с нарушениями иммунной системы. Энтеровирусная инфекция остается малоконтролируемой в практике здравоохранения и занимает одно из ведущих мест среди инфекционных заболеваний, протекающих с поражением ЦНС. Одной из основных особенностей этих инфекций является вирусоносительство, постоянно обусловливающее возникновение спорадических форм и массовых заболеваний, которое, как и заболеваемость, наблюдается не только среди детей младшего и старшего возраста, но и среди взрослых.
В странах умеренного климата характерна сезонность с повышением заболеваемости в конце лета и начале осени. Болеют преимущественно дети и лица молодого возраста. Заболевания наблюдают в виде спорадических случаев, локальных вспышек (чаще в детских коллективах) и крупных эпидемий, поражающих целые страны. Заболевание серозным менингитом энтеровирусной этиологии отличают высокая контагиозность и очаговость. В общем количестве больных удельный вес детей составляет обычно 80-90%, достигая 50% у детей младшего возраста. Часто наблюдается внутрисемейное распространение инфекции. Вероятность вторичного инфицирования и тяжесть клинических проявлений существенно варьируют для различных энтеровирусов. До 90% и более членов семьи были заражены вирусами острого геморрагического конъюнктивита (энтеровирус типа 70 и Коксаки А 24), в то время как другие вирусы (Коксаки и ЕСНО) инфицировали только около 50-75% восприимчивых членов семьи, преимущественно детей в возрасте 5-9 лет. Особую важность имеет распространение энтеровирусных инфекций в организованных детских коллективах (детских садах, школах), когда до 50% детей могут оказаться зараженными, и в ЛПУ (внутрибольничные очаги).
По мере выполнения программы по ликвидации полиомиелита значение энтеровирусных инфекций во многих странах возрастает. Существует точка зрения, что иммунизация против полиомиелита прививает невосприимчивость и к некоторым типам неполиомиелитных энтеровирусов. В частности, доказано существование интерференции энтеровирусов, когда массовая циркуляция вакцинных штаммов вируса полиомиелита подавляла циркуляцию других энтеровирусов. Это было подтверждено при эпидемии с множественными летальными исходами в Болгарии (возбудитель - энтеровирус типа 71) и во время вспышек на Дальнем Востоке (возбудители вирусы Коксаки и ЕСНО). Массовое
применение живой аттенуированной полиомиелитной вакцины привело к изменению пейзажа выделяемых от человека энтеровирусов. В различных географических зонах циркулируют разные серотипы кишечных вирусов, поэтому иммунологическая структура населения разных местностей неодинакова. Выраженные миграционные процессы, отмеченные в последнее время, способствуют интенсивному обмену и заносу возбудителей в другие регионы мира.
В 2007 г. в России зарегистрировано 6452 случая энтеровирусных инфекций в 62 субъектах РФ, в том числе 2411 случаев энтеровирусных серозных менингитов в 49 регионах России. Показатель заболеваемости энтеровирусными инфекциями составил 4,5 на 100 000 населения, что в 1,5 раза меньше, чем в 2006 г. Отмечено также снижение на 24,9% заболеваемости энтеровирусными серозными менингитами, в 2007 г. показатель составил 1,7 на 100 000 населения. В структуре энтеровирусных инфекций 37,4% составляют энтеровирусные серозные менингиты (2006 г. - 32%). Из общего числа больных энтеровирусными инфекциями 5223 (80,9%) составляют дети в возрасте до 17 лет (показатель 19 на 100 000 населения), которые и определяют общий уровень заболеваемости. Наиболее высокие показатели, превышающие средние по стране, отмечены в Республиках Калмыкии (485,2), Бурятии (152,8), Марий Эл (58,7), Хабаровском (377,2), Пермском (30), Приморском (29,7) краях, Тамбовской (28,1), Нижегородской (87,6), Свердловской (74,9), Тюменской (42,9), Иркутской (36,4), Томской (20,8), Сахалинской (97,8) областях, Еврейской автономной области (119,2), Ханты-Мансийском (69,9), Ямало-Ненецком (62,7) автономных округах. Энтеровирусный (серозный) менингит регистрировался только в 49 субъектах РФ (2411 случаев, показатель заболеваемости на 100 000 населения 1,7). На долю детей в возрасте до 17 лет приходится 88,8% заболевших, показатель заболеваемости составляет 7,8 на 100 000 населения. В этиологической структуре больных энтеровирусными инфекциями преобладают ЕСНО и Коксаки В, однако следует отметить, что вирусологическое подтверждение находится на низком уровне - только 20% случаев подтверждено выделением энтеровируса (при менингите - 34,3%). В ряде субъектов РФ имели место эпидемические вспышки энтеровирусных серозных менингитов (Республика Бурятия, Хабаровский край, Самарская, Нижегородская, Тюменская области).
В 2007 г. в вирусологических лабораториях ФГУЗ «Центр гигиены и эпидемиологии» в субъектах РФ с диагностической целью обследовано
на энтеровирусы 8048 человек, выделено 10 046 штаммов, в том числе 662 - ЕСНО, 306 - Коксаки В, 78 - Коксаки А. Кроме того, обследовано 4297 здоровых людей, выделено 2600 штаммов энтеровирусов, в том числе 110 - ЕСНО, 135 - Коксаки В, 15 - Коксаки А. Проведены санитарно-вирусологические исследования 18 443 проб из объектов окружающей среды (в том числе 50,8% - сточная вода), выделено 745 штаммов энтеровирусов, в том числе ЕСНО - 426, Коксаки В - 311 (из них соответственно 371 и 281 из проб сточной воды), Коксаки А - 8.
Патогенез
Вирусы Коксаки и ECHO - частые обитатели кишечника здоровых людей.
Возможность развития заболевания связана с многообразными факторами:
- величиной заражающей дозы;
- вирулентностью возбудителя;
- снижением резистентности организма и т.д.
Входными воротами инфекции и местом ее первичного накопления служат слизистые оболочки ЖКТ и верхних дыхательных путей (вирусы серотипов 67 и 71), где могут развиваться местные воспалительные реакции, проявляющиеся гиперемией слизистой оболочки верхних дыхательных путей, желудочно-кишечными расстройствами. Одновременно возникает так называемая малая виремия с диссеминацией вируса в клетки ретикулоэндотелиальной системы, где происходит его размножение в течение нескольких дней. После этого энтеровирусы гематогенно диссеминируют, оседают в органах и тканях, обладая тропностью к эпителиальным клеткам кожи, мозговым оболочкам, нервной ткани и мышцам (в том числе к миокарду), что и определяет различные варианты клинической картины.
Защитные механизмы (ИФН, вируснейтрализующие АТ) препятствуют развертыванию большой виремии, вследствие чего длительность и тяжесть заболевания также значительно варьируют. Оно может протекать в виде энтерита, тяжелой острой инфекции (менингиты, менингоэнцефалиты, миокардиты), но может быть и бессимптомным процессом с длительной персистенцией возбудителя в организме. Вируснейтрализующие АТ не проникают в стенку кишечника, что может обусловить длительное реконвалесцентное выделение вируса с фекалиями.
Клиническая картина
Выраженный клинический полиморфизм энтеровирусных инфекций затрудняет создание единой и общепринятой классификации.
Согласно одной из них (О.А. Чеснокова и В.В. Фомин), выделяют следующие формы заболевания.
• Типичные формы:
◊ герпангина;
◊ эпидемическая миалгия;
◊ асептический серозный менингит;
◊ экзантема.
• Атипичные формы:
◊ инаппарантная форма;
◊ малая болезнь (летний грипп);
◊ катаральная (респираторная) форма;
◊ энцефалитическая форма;
◊ энцефаломиокардит новорожденных;
◊ полиомиелитоподобная (спинальная) форма;
◊ эпидемический геморрагический конъюнктивит;
◊ увеит;
◊ нефрит;
◊ панкреатит;
◊ микст-инфекции.
Инкубационный период длится от 2 до 7 дней. Разнообразие клинических проявлений этих инфекций настолько значительно, что на первый взгляд кажется, что они не связаны между собой единым этиологическим фактором. Наиболее общие из них - развитие интоксикации (часто с двухволновой лихорадкой), сочетание катаральных и желудочнокишечных проявлений, полиморфная экзантема.
В случаях острого начала заболевания температура тела быстро повышается до 38-40 °С и в дальнейшем сохраняется в течение нескольких дней. Заболевание нередко рецидивирует; при этом температурная кривая принимает волнообразный характер. Больных беспокоят головная боль, головокружение, недомогание и общая слабость. Часто присоединяются тошнота и рвота, возможен жидкий стул энтеритного характера.
Лицо больных гиперемировано, склеры инъецированы. Отмечают гиперемию слизистой оболочки ротоглотки, зернистость задней стенки глотки. У части больных возникает кратковременная полиморфная экзантема.
Герпангина
Начало заболевания острое, чаще внезапное. На фоне общих для энтеровирусных инфекций симптомов развивается разлитая гиперемия слизистой оболочки ротоглотки, зернистость задней стенки глотки. В течение 1-2 сут на небных дужках, язычке и миндалинах появляются красные папулы, быстро трансформирующиеся в пузырьки. На месте лопнувших пузырьков образуются эрозии с серым налетом и красным ободком (рис. 4 на цветной вклейке). Энантема имеет склонность к слиянию. Увеличиваются подчелюстные лимфатические узлы. Эрозии полностью заживают в течение последующих нескольких дней. Довольно часто отмечают сочетание герпангины с серозным менингитом.
Эпидемическая миалгия (плевродиния, борнхольмская болезнь, болезнь Сюльвеста-Финсена)
На фоне тех же общих клинических проявлений инфекции у больного появляются приступообразные боли в мышцах груди, живота, спины, конечностей, обусловленные развитием миозита. Приступы болей по силе, частоте и длительности могут быть разнообразными. При локализации болей в мышцах груди дыхание затрудняется, становится поверхностным. Боли в брюшных мышцах могут привести к постановке ошибочного диагноза, симулируя картину острого живота. Признаки миозита обычно значительно уменьшаются или полностью стихают в течение 2-3 дней, однако возможны и рецидивы заболевания.
Серозный менингит
Одна из частых и наиболее тяжелых форм энтеровирусной инфекции.
Характерно развитие менингеальной симптоматики:
- появляются сильная головная боль;
- рвота;
- ригидность мышц затылка;
- симптомы Кернига, Брудзинского и др.
Больные заторможены, нередко развивается слуховая и зрительная гиперестезия. Возможны психомоторное возбуждение и судороги. Нарушения сознания возникают редко. При исследовании ликвора обнаруживают изменения, характерные для серозных менингитов - спинномозговая жидкость прозрачная, бесцветная, отмечают ликворную гипертензию, умеренное повышение содержания белка, лимфоцитоз до нескольких десятков или сотен в 1 мм3, нормальное содержание глюкозы и хлоридов. У части больных менингеальную симптоматику не сопро-
вождают изменения ликвора (менингизм). Длительность лихорадки и менингеальных симптомов при отсутствии рецидивирования заболевания незначительна и составляет 4-7 дней.
Энтеровирусная экзантема
(бостонская экзантема, эпидемическая экзантема)
На 2-3-й день болезни на фоне лихорадочной реакции и других признаков интоксикации характерно появление экзантемы, локализованной на туловище, лице, конечностях и стопах. Она может быть пятнистой, пятнисто-папулезной, кореподобной, краснухоподобной, скарлатиноподобной или петехиальной. Длительность высыпаний не превышает 1-2 дней. Экзантема нередко сочетается с пятнистой энантемой на слизистых оболочках полости рта, фарингитом, конъюнктивитом, серозным менингитом или менингизмом.
Энтеровирусная лихорадка (летний грипп, малая болезнь)
Состояние длится 1-3 дня с легкими общими проявлениями, свойственными энтеровирусной инфекции, и без клинически выраженных поражений каких-либо органов и систем.
Катаральная (респираторная) форма проявляется у взрослых и детей гриппоподобным заболеванием с лихорадкой в течение 2-4 дней, умеренно выраженными симптомами интоксикации.
Характерны катаральные симптомы:
- сухой кашель;
- ринит с серозно-слизистыми выделениями;
- гиперемия и зернистость слизистой оболочки ротоглотки.
Энцефаломиокардит новорожденных
Энцефаломиокардит новорожденных - самая тяжелая форма энтеровирусных инфекций. На фоне двухволновой лихорадки или даже при ее отсутствии у больных развиваются сонливость, рвота, анорексия. При осмотре отмечают цианоз кожных покровов, одышку, тахикардию. Перкуторные границы сердца расширены, тоны глухие, аритмичные, появляется систолический шум. Заболевание сопровождается увеличением размеров печени, отеками. Возможно развитие судорожного синдрома и комы.
Миелит
Состояние клинически трудно отличить от паралитической формы полиомиелита, но протекает оно легче, а нарушения двигательной функции часто восстанавливаются.
Энтеровирусная диарея (вирусный гастроэнтерит)
Возникает остро, протекает с высокой или субфебрильной температурой тела, жидким стулом без патологических примесей (несколько раз в день), метеоризмом и болями в животе (больше в илеоцекальной области). Возможна повторная рвота. При осмотре больных часто одновременно выявляют катаральные изменения со стороны верхних дыхательных путей, тахикардию, иногда гепатолиенальный синдром. Заболевание длится от нескольких дней до 2 нед.
Эпидемический геморрагический конъюнктивит
Характерно внезапное возникновение болей в глазах, вскоре развиваются слезотечение и светобоязнь. Веки отечны, конъюнктива гиперемирована, отмечают множественные субконъюнктивальные кровоизлияния, обильное серозное или серозно-гнойное отделяемое. Сначала поражение бывает односторонним, затем процесс переходит на другой глаз. Не исключено участие энтеровирусов в развитии энцефалитов, миокардитов, перикардитов, лимфаденопатий, мезаденита, безжелтушных форм гепатитов и других заболеваний.
Дифференциальная диагностика
Дифференциальная диагностика представляет известные сложности, особенно при спорадических случаях заболевания, поскольку клинические проявления могут быть сходными не только с кишечными диарейными инфекциями, но и с поражениями слизистых оболочек дыхательных путей и глаз аэрогенного происхождения. В большинстве случаев клинически возможно лишь заподозрить одну из форм энтеровирусных инфекций. Решающим фактором диагностики остаются серологические
методы (РСК, РТГА).
Лабораторная диагностика
Можно провести вирусологические исследования крови, ликвора, слизи из носоглотки, испражнений, однако эти методы диагностики в практической работе непопулярны из-за сложности и длительности. Кроме того, выявление вирусов в исследуемом материале еще не может служить бесспорным доказательством их причастности к развитию клинических проявлений (вследствие частых случаев бессимптомного вирусоносительства).
Основной метод диагностики - серологический с обнаружением четырехкратного или большего нарастания титра специфических АТ в парных сыворотках, выявляемого в РСК и РТГА.
Осложнения и исходы
В подавляющем большинстве случаев энтеровирусные инфекции протекают в легких или среднетяжелых формах и заканчиваются выздоровлением. При тяжелом течении (менингиты и менингоэнцефалиты, энцефаломиокардит) могут развиться отек мозга, эпилептиформные припадки, психические расстройства, острая дыхательная недостаточность, пневмония.
Лечение
Лечение основано на применении дезинтоксикационных средств и лекарственных форм симптоматического действия. При тяжелой нейроинфекции показаны гормональные препараты, салуретики, средства, корригирующие водно-электролитное равновесие и КЩС, а в некоторых случаях - комплекс реанимационных мероприятий. Для нормализации реологических свойств крови и улучшения тонуса сосудов применяют пентоксифиллин, трентал*, винпоцетин, кавинтон*, сол- косерил*. Широко используют анальгетики, витамины, седативные средства. При развитии вторичных бактериальных осложнений необходимо антибактериальное лечение.
Эпидемиологический надзор
Эпидемиологический надзор за энтеровирусными инфекциями - это важное направление профилактики полиомиелита в постсертификационный период, осуществляемое в соответствии с нормативнометодическими документами.
Эпидемиологический надзор за энтеровирусными инфекциями представляет собой непрерывное наблюдение за эпидемическим процессом с целью:
- оценки ситуации;
- своевременного принятия управленческих решений;
- разработки и реализации санитарно-противоэпидемических (профилактических) мероприятий, обеспечивающих предупреждение возникновения и распространения энтеровирусных инфекций.
Эпидемиологический надзор за энтеровирусными инфекциями включает:
- мониторинг заболеваемости;
- наблюдение за циркуляцией энтеровирусов, включая результаты исследования проб из объектов окружающей среды и материала от больных;
- оценку эффективности проводимых санитарно-противоэпидемических (профилактических) мероприятий;
- прогнозирование эпидемиологической ситуации. Эпидемиологический надзор основан на результатах клинико-эпиде-
миологической и лабораторной диагностики заболеваний. Детальному анализу подвергают заболеваемость во время вспышек энтеровирусных инфекций. Этиологическую расшифровку заболеваний осуществляют с привлечением сотрудников научно-исследовательских учреждений соответствующего профиля. Важнейшее значение имеют:
- контроль качества пищевых продуктов по микробиологическим показателям в сети общественного питания и частном секторе торговли;
- надежность термической обработки пастеризованных продуктов;
- обработка упаковочного материала в розничной государственной и частной торговле;
- контроль за сроками реализации продукции. Предположительное заключение о вспышке инфекции, вызванной
энтеровирусом типа 71, может быть сделано на основании регистрации в данной местности в течение 7 дней не менее 10 случаев лихорадочного заболевания, сопровождающегося экзантемой на коже рук и ног и на слизистых у детей в возрасте до 6 лет, и обнаружение энтеровирусной РНК в материалах кожных элементов более чем у 50% пациентов.
Важным будет установление эпидемиологических взаимосвязей в очагах инфекции и возможного факта заноса вируса с других территорий. С этой целью проводят сравнение нуклеотидных последовательностей области генома VP 1 энтеровируса 71, идентифицированного у заболевших, контактных и в потенциальных факторах передачи, между собой, а также с соответствующими последовательностями штаммов энтеровируса 71 типа, выделенных на других территориях. Идентичность нуклеотидных последовательностей этого энтеровируса, выделенных в очаге, позволит установить источник инфекции и
возможные факторы передачи. При установлении идентичности нуклеотидных последовательностей энтеровируса типа 71 с последовательностями известных генотипов этого типа энтеровируса, циркулирующего в эндемичных районах, можно предположить факт заноса вируса.
На каждый случай энтеровирусной инфекции или подозрения на это заболевание ЛПУ немедленно представляет в филиал Центра гигиены и эпидемиологии в субъекте РФ экстренное извещение по форме ? 058/у (по телефону, электронной почте). Ответственным за полноту и своевременность представления экстренного извещения в филиал Центра гигиены и эпидемиологии в субъекте РФ будет руководитель ЛПУ. Каждый случай энтеровирусного заболевания (или подозрения на это заболевание) подлежит регистрации и учету по месту его выявления в лечебно-профилактических, детских, подростковых, оздоровительных и других учреждениях независимо от ведомственной принадлежности и форм собственности, а также в медицинских учреждениях, занимающихся частной практикой, в журнале учета инфекционных заболеваний (форма ? 060/у). ЛПУ, уточнившее, изменившее или отменившее диагноз, представляет новое извещение. Сведения из экстренных извещений вносят в журнал учета инфекционных заболеваний в учреждениях, осуществляющих государственный санитарно-эпидемиологический надзор. На каждого больного с подозрением на это заболевание оформляют карту эпидемиологического расследования случая инфекционного заболевания в установленной форме.
При возникновении групповых заболеваний (10 и более случаев в ЛПУ, 15 и более - в образовательных учреждениях, 50 и более случаев - среди населения) внеочередное донесение в установленном порядке представляют в Федеральную службу по надзору в сфере защиты прав потребителей и благополучия человека, Управление Роспотребнадзора по субъекту РФ.
Случаи заболеваний энтеровирусными инфекциями включают в отчет по форме ? 1, 2 федерального государственного статистического наблюдения Сведения об инфекционных и паразитарных заболеваниях (месячная, годовая) в соответствии с инструкцией по их составлению.
Профилактические мероприятия
Профилактика энтеровирусных (неполио) инфекций обеспечивается реализацией требований санитарного законодательства РФ.
В целях профилактики энтеровирусных инфекций необходимо выполнение санитарно-эпидемиологических требований в отношении:
- обеспечения населения качественным водоснабжением;
- содержания открытых водоемов, использующихся для рекреации и хозяйственно-питьевого водопользования;
- обеспечения населения качественным продовольствием;
- содержания объектов общественного питания и пищевой промышленности;
- содержания территории, ее благоустройства, функционирования очистных сооружений;
- обеспечения социально-бытовых условий проживания населения;
- содержания, эксплуатации, соблюдения противоэпидемического режима лечебно-профилактических, детских дошкольных, образовательных и других учреждений;
- условий воспитания и обучения;
- условий работы с возбудителями инфекционных заболеваний.
В соответствии с нормативно-методическими документами проводят плановые лабораторные (в том числе вирусологические) исследования воды (сточной, питьевой, воды открытых водоемов) по обнаружению микробного загрязнения (или его косвенных признаков), а также неполиомиелитных энтеровирусов в окружающей среде с целью определения предпосылок и предвестников эпидемического неблагополучия. В целях профилактики энтеровирусных инфекций проводят гигиеническое обучение работников отдельных профессий, производств и организаций, связанных непосредственно с процессом производства, приготовления, хранения, транспортировки и реализации пищевых продуктов, водоподготовки, обучением и воспитанием детей и подростков с занесением в индивидуальные медицинские книжки.
Выявляют больных энтеровирусными инфекциями (подозрительных на заболевание) в период формирования детских коллективов, при приеме в ДДУ, во время утренних приемов детей в ДДУ, а также раннее выявление, клиническая и лабораторная диагностика, изоляция, лечение, диспансеризация больных при всех видах медицинской помощи, эпидемиологическое расследование случаев.
Одним из направлений профилактики энтеровирусных инфекций является недопущение завоза инфекции из неблагополучных регионов, информационный обмен об эпидемической ситуации с приграничными
(соседними) территориями. С целью повышения санитарной грамотности населения проводят гигиеническое образование населения с привлечением средств массовой информации.
Мероприятия в эпидемическом очаге
В целях локализации очага энтеровирусной (неполио) инфекции осуществляют перечень мероприятий.
• Проводят активное выявление больных методом опроса, осмотра при утреннем приеме (для организованных детей), подворных (поквартирных) обходов.
• За лицами, подвергшимися риску заражения, устанавливают медицинское наблюдение сроком на 20 дней.
• При тяжелых клинических проявлениях энтеровирусных инфекций, в случае, если в число контактных лиц попадают дети до 6 лет, возможно организовать их изоляцию на период до 20 дней.
• В случае появления лиц, подозрительных на заболевание, проводят их немедленную изоляцию и госпитализацию (по необходимости). Изоляцию больных с легкими формами болезни без ясных признаков поражения нервной системы (энтеровирусная лихорадка, эпидемическая миалгия, герпетическая ангина) проводят сроком на 10 дней, после чего переболевший может быть допущен в детский организованный коллектив без дополнительного вирусологического обследования.
• Организуют отбор материала от больных и проб из объектов окружающей среды (питьевая вода, вода открытых водоемов, бассейнов) для вирусологического обследования. Объем и число проб определяет специалист-эпидемиолог, отвечающий за организацию эпидемиологического обследования очага. Для вирусологического исследования больных отбирают пробы фекалий, носоглоточных смывов, спинномозговой жидкости, секционного материала (в случае летального исхода) и крови для серологического исследования.
• Вводят ограничение (вплоть до запрещения) проведения массовых мероприятий (в первую очередь в детских организованных коллективах), купания в открытых водоемах, бассейнах.
• Приостановление занятий в начальных классах проводят по необходимости, в случае ухудшения ситуации, по согласованию с учреждениями образования.
• Проводят дезинфекционные мероприятия - заключительную и текущую дезинфекцию (препаратами, разрешенными к применению в установленном порядке и обладающими вирулицидной активностью). Для организации текущей дезинфекции экспозицию препаратов увеличивают в 2 раза.
• При необходимости вводят гиперхлорирование питьевой воды, подаваемой населению, в учреждениях (детских, ЛПУ) устанавливают питьевой режим с обязательным кипячением воды или раздачей бутилированной воды.
• Вводят усиление надзора за системой водоснабжения, организацией питания, содержания территории, соблюдением режима детских организованных коллективов и ЛПУ.
• Проводят активную разъяснительную работу среди населения.
• Организуют контроль за выпиской и установлением диспансерного наблюдения за реконвалесцентами. Выписку больного из стационара после перенесенного энтеровирусного (серозного) менингита или другой формы поражения нервной системы проводят не ранее 2 нед от начала болезни при нормализации клинических проявлений болезни, нормализации состава спинномозговой жидкости без дополнительного вирусологического обследования. Реконвалесценты энтеровирусной инфекции с поражением нервной системы, сердца, легких, печени, почек, поджелудочной железы, глаз подлежат диспансерному наблюдению у соответствующих специалистов, которые определяют программу реабилитации и срок диспансерного наблюдения. Снятие с диспансерного учета - после стойкого исчезновения остаточных признаков.
Один из методов экстренной профилактики энтеровирусной инфекции - применение аттенуированной ОПВ. Принцип действия ОПВ основан на быстром (2-3 дня) заселении кишечника у детей в возрасте от 1 года до 14 лет вакцинным полиовирусом и, как следствие, вытеснении из циркуляции других энтеровирусов. Применение ОПВ по эпидемическим показаниям проводят однократно, независимо от ранее проведенных профилактических прививок против полиомиелита. Решение о применении ОПВ по эпидемическим показаниям принимают по согласованию с Федеральной службой по надзору в сфере защиты прав потребителей и благополучия человека.
ПОЛИОМИЕЛИТ (POLIOMYELITIS)
Полиомиелит (болезнь Хайне-Медина) - острая антропонозная энтеровирусная инфекция, поражающая слизистые оболочки кишечника и носоглотки, а в ряде случаев - двигательные нейроны продолговатого мозга, моста и передних рогов спинного мозга с развитием вялых парезов и параличей.
Краткие исторические сведения
Полиомиелит был известен за несколько тысяч лет до нашей эры. Начало научному изучению полиомиелита положили У.Е. Дядьковский (1834) и Я. фон Хайне (1840). В самостоятельную нозологическую единицу полиомиелит выделил К. Хайне (1860), а классическое описание болезни сделали русский врач А.Я. Кожевников (1883) и шведский клиницист К.О. Медин (1890). Вирусную этиологию заболевания установили К. Ландштейнер и У. Поппер (1908). В 50-х годах XX столетия была разработана лабораторная диагностика заболевания. Большим успехом в ликвидации данного заболевания было получение Д. Солком в 1953 г. убитой вакцины против полиомиелита. Х. Копровски установил факт циркуляции в природе слабовирулентных штаммов вируса полиомиелита и после их аттенуирования предложил применять в качестве вакцинных (1953). Несколько позже А. Сэбин внедрил в практику живую безопасную вакцину против этого заболевания (ОПВ). В нашей стране большой вклад в резкое снижение заболеваемости полиомиелитом внесли М.П. Чумаков и А.А. Смородинцев.
Этиология
Возбудитель - РНК-геномный вирус рода Enterovirus семейства Picornaviridae. Вирус может длительно сохраняться во внешней среде: в воде - до 100 дней, в испражнениях - до 6 мес. Он устойчив к низкой температуре, этиловому спирту, но быстро погибает при кипячении и под действием УФО. Быстро инактивируется под действием обычных дезинфектантов, но в присутствии органических веществ становится устойчивым к вирулицидным воздействиям. Скорость инактивации вируса полиомиелита в природе в значительной мере зависит от конкретных условий. Инфекционность вируса полиомиелита в почве снижается на 90% каждые 20 дней зимой и 1,5 дня летом. Аналогичное 90%
снижение наблюдают в сточных водах в течение каждых 26 дней, в пресноводных водоемах - каждые 5,5 дня, в морской воде - каждые 2,5 дня.
По различиям в антигенной структуре выделяют 3 типа вируса (I-III), не дающие перекрестного иммунитета друг к другу. Наиболее частый возбудитель эпидемического полиомиелита - вирус типа 1. Он же в большей части ответствен за возникновение паралитических форм болезни. Вирус полиомиелита отличает высокая контагиозность.
Эпидемиология
Резервуар и источник инфекции - больной всеми формами полиомиелита или носитель возбудителя. Высшие приматы могут быть инфицированы в условиях эксперимента, а иногда и в природных условиях, но естественным резервуаром вируса не бывают. Количество больных легкими и стертыми формами заболевания значительно выше, чем число больных клинически выраженными формами полиомиелита. На 1 клинически выраженный случай приходится 100-200 бессимптомных форм болезни. Возбудитель обнаруживают в носоглотке через 36 ч, в испражнениях - через 72 ч после заражения. Наибольшее количество вирионов больной выделяет в 1-ю неделю болезни; затем уровень выделения снижается, хотя в испражнениях их можно обнаружить и через 1,5-2 мес. Длительное вирусоносительство отсутствует. Больной полиомиелитом полностью освобождается от вируса через 15-20 дней от начала болезни. Поскольку клинически полиомиелит проявляется лишь у 1% инфицированных лиц (или реже), выделителями вируса бывают многие здоровые дети. Инфицированный человек способен заразить всех не имеющих иммунитета людей в ближайшем окружении, особенно при плохих санитарно-гигиенических условиях.
Механизм передачи - фекально-оральный, пути передачи - пищевой, водный и бытовой. Факторами передачи могут служить пищевые продукты (чаще всего молоко), грязные руки, предметы обихода, вода (редко). Существуют эпидемиологические и экспериментальные наблюдения, свидетельствующие о распространении вируса через зараженные овощи, фрукты и ягоды. Возможен и аэрозольный механизм передачи инфекции, особенно в продромальный период болезни. После инфицирования здорового человека в глотке вирус обнаруживают в течение 1-2 нед.
Естественная восприимчивость людей
Многочисленные эпидемиологические наблюдения свидетельствуют о низкой естественной восприимчивости людей к вирусу полиомиелита. Большинство встреч с вирусом заканчивается здоровым вирусоносительством. Существенно меньший удельный вес среди заразившихся занимают случаи абортивного и непаралитического полиомиелита. И только у 0,1 - 1% заразившихся развивается паралитическая форма заболевания. Меньшую восприимчивость к полиомиелиту подростков и взрослых объясняют большой долей переболевших стертой и атипичной формами и латентной иммунизацией в связи с широким вирусоносительством. Перенесенная инфекция независимо от формы клинического течения обеспечивает стойкую и длительную типоспецифическую невосприимчивость к повторному заражению.
Основные эпидемиологические признаки
В довакцинальный период распространение болезни носило повсеместный характер. В 1988 г. Всемирная ассамблея здравоохранения поставила цель - ликвидировать эту древнейшую инфекцию. Для достижения этой цели, координации усилий стран и оказания помощи национальным службам здравоохранения свои усилия объединили ВОЗ, Ротари Интернешнл, Центр по борьбе с болезнями США и Детский фонд ООН. Если в 1988 г. (начало широкомасштабной иммунизации) число паралитических форм полиомиелита составляло 350 000, то в 2000 г. их число было менее 3 500. В странах Северной и Западной Европы полиомиелит был ликвидирован еще в середине 80-х годов. С 1991 г. случаи заболевания не регистрируют на Американском континенте. Однако в 1995 и 1996 гг. в некоторых странах - Болгарии, Албании, России (Чеченской Республике) - на фоне недостаточного внимания к профилактической иммунизации (значительного снижения удельного веса привитых детей раннего возраста) были зарегистрированы групповые случаи заболевания полиомиелитом. Заболевали в основном дети до 10-летнего возраста (60-80% составили дети в возрасте первых 4 лет жизни).
С 1997 г. на территории России не регистрируют случаи заболеваний острым паралитическим полиомиелитом, вызванным диким вирусом, а из объектов окружающей среды (сточных вод) не выделяют дикий вирус полиомиелита (последние штаммы дикого вируса полиомиелита выделены зимой 1998 г. в Москве). Это может свидетельствовать о прекращении циркуляции диких штаммов вируса среди людей. В 1999 г. зарегистрировано 12 случаев, а в 2000 г. - 11 случаев острого паралити-
ческого полиомиелита, ассоциированных с вакциной. Все случаи заболеваний вакциноассоциированным полиомиелитом были зарегистрированы среди детей в возрасте до 1 года. В 2002 г. Российская Федерация получила сертификат ВОЗ, подтверждающий ее статус страны, свободной от полиомиелита. Последний дикий полиовирус в России был выделен в декабре 1995 г. от ребенка, контактировавшего с больным полиомиелитом во время вспышки в Чеченской Республике.
Эндемичные страны, в которых продолжается передача дикого вируса полиомиелита, - Нигерия, Индия, Пакистан, Афганистан.
В 2007 г. ВОЗ сообщила о 1315 случаях полиомиелита, из них 1208 зарегистрировано в эндемичных странах, 80-90% случаев заболеваний в этих странах регистрируют у детей до 5 лет. Полиомиелит встречают как в городской, так и в сельской местности. Однако в отличие от истинных инфекций с воздушно-капельным механизмом передачи заболеваемость полиомиелитом не имеет отчетливой связи с плотностью населения. Заболеваемость полиомиелитом обычно складывается из рассеянных случаев, отдельных групповых заболеваний контактно-бытового типа в семьях и детских коллективах. Типичные водные вспышки, как при брюшном тифе, при полиомиелите крайне редки. Вполне достоверны данные о вспышках полиомиелита в связи с заражением через молоко. Эти вспышки носят взрывной характер, так как лица, потреблявшие молоко, заражаются одновременно.
Однако чем больше времени требуется на остановку передачи дикого вируса в остающихся эндемичных странах, тем больше возрастает опасность завоза дикого вируса полиомиелита в страны, свободные от него в настоящее время. В настоящее время доказана роль в возникновении вспышек полиомиелита среди населения с низким охватом иммунизацией не только диких штаммов полиовируса, но и полиовирусов вакцинного происхождения, значительно дивергировавших от вакцинного предка (ВНВП). Такие штаммы способны к продолжительной циркуляции, при определенных условиях, к восстановлению нейровирулентных свойств. В целях совершенствования мероприятий по поддержанию свободного от полиомиелита статуса РФ разработан и реализуется Национальный план действий на 2006-2008 гг. по поддержанию свободного от полиомиелита статуса РФ.
Основные мероприятия для поддержания статуса РФ как страны, свободной от полиомиелита, на современном этапе:
- сохранение уровня (не менее 95%) охвата профилактическими прививками населения с помощью плановой иммунизации и
дополнительной массовой иммунизации (Су6НДИ, операций подчистки, подчистки плюс);
- поддержание качества эпиднадзора за полиомиелитом и ОВП;
- совершенствование качества лабораторной вирусологической диагностики каждого случая заболевания полиомиелитом и
ОВП;
- проведение дополнительного надзора за циркуляцией вируса полиомиелита вирусологическим методом исследования материалов из объектов окружающей среды (сточных вод) и от детей из групп риска (детей из семей беженцев, вынужденных переселенцев, кочующих групп населения, детей домов ребенка и других закрытых детских учреждений);
- надзор за энтеровирусными инфекциями;
- безопасное лабораторное хранение дикого полиовируса (контейнмент).
Патогенез
Вирус полиомиелита может проникать через слизистые оболочки, как носоглотки, так и кишечника, после чего в течение инкубационного периода он репродуцируется и накапливается в эпителиальных клетках и регионарных лимфатических узлах. В большинстве случаев дальнейшего диссеминирования вируса в организме не происходит ввиду защитных АТ, образовавшихся в результате плановых вакцинаций. Поэтому заражение происходит значительно чаще, чем развитие заболевания.
Прорыв вируса в кровь (виремия) наступает у незначительной части зараженных. При этом с током крови возбудитель быстро разносится в различные органы и системы (печень, селезенку, легкие, лимфатические узлы и др.). Клинически эту форму заболевания рассматривают как абортивную.
В других случаях, преодолев гематоэнцефалический барьер, вирус попадает в ЦНС, распространяясь в ткани мозга, поражает клетки серого вещества передних рогов спинного мозга, ядер продолговатого мозга и моста.
• Морфологически изменения в нервной системе отличает развитие некротических и дистрофических процессов, отечности спинного мозга. Наиболее выраженные морфологические изменения выявляют в нервных клетках передних рогов спинного мозга.
• Микроскопически определяют набухание пораженных двигательных клеток, растворение тигроидных глыбок и кариопикноз.
Вследствие этих процессов развиваются вялые параличи и парезы. Поврежденные нервные клетки после окончания заболевания могут частично восстанавливаться, но, как правило, погибают. На месте погибших клеток формируется рубцовая ткань, что определяет стойкость клинических резидуальных явлений.
Клиническая картина
Продолжительность инкубационного периода варьирует в пределах месяца (чаще 9-12 дней).
В зависимости от клинических проявлений заболевания выделяют непаралитические (абортивную, менингеальную) и паралитическую формы полиомиелита.
• Абортивная форма развивается наиболее часто (более 99% случаев). Характерно острое начало с повышением температуры тела и общим недомоганием, развитием катаральных явлений в верхних дыхательных путях (кашля, насморка, гиперемии слизистой оболочки), сопровождающихся клиническими признаками гастроэнтерита (тошнотой, послаблением стула). Лихорадка сохраняется в течение 3-7 дней, однако через 2-3 сут возможен повторный подъем температуры тела. Своеобразный симптом полиомиелита - выраженное потоотделение на уровне головы и шеи. Заболевание заканчивается полным выздоровлением.
• Для менингеальной формы характерно развитие клиники серозного менингита на фоне катаральных явлений со стороны верхних дыхательных путей и гастроэнтерита. Больные жалуются на сильную головную боль, бессонницу, тошноту, иногда рвоту. Появляются симптомы Кернига, Брудзинского, ригидность затылочных мышц. При проведении люмбальной пункции наблюдают повышение давления спинномозговой жидкости. При лабораторном исследовании спинномозговой жидкости отмечают повышение содержания белка и лимфоцитоз. В части случаев возникает болезненность при пальпации по ходу нервных стволов. Иногда эта форма полиомиелита может протекать тяжело, однако исход заболевания, как правило, благоприятный.
• Паралитическая форма - наиболее опасная форма полиомиелита в плане возможных последствий. По клиническим признакам ее
разделяют на спинальный, бульбарный, понтинный и смешанный варианты.
◊ Спинальный вариант. Заболевание начинается остро, с резкого повышения температуры тела. Температурная кривая может приобретать двухволновой характер. Так же как и при двух предыдущих формах полиомиелита, развиваются катаральные и гастроэнтеритические признаки. На фоне клинических проявлений интоксикации можно наблюдать подергивания отдельных групп мышц, а в некоторых случаях - тонические и клонические мышечные судороги, локализующиеся в различных частях тела. Через 5-7 дней от начала заболевания у больных неожиданно развиваются острые односторонние или двусторонние параличи, чаще нижних конечностей. Характерно их развитие в утренние часы (утренние параличи). В некоторых случаях возможно распространение параличей на мышцы живота, спины, шеи и рук (восходящий паралич). Для параличей при полиомиелите характерны мышечная гипотония, арефлексия и атрофия мышц. Также характерно, что к моменту развития параличей происходит нормализация температурной реакции, исчезают другие признаки интоксикации. При спинальном варианте возможно изолированное поражение отдельных групп мышц, приводящее к усилению функций мышц-антагонистов. В результате этого развиваются мышечные контрактуры и деформации суставов.
◊ Бульбарный вариант отличается особенно тяжелым течением и высокой летальностью. При этом варианте возможно изолированное поражение ядер черепных нервов, а также сосудодвигательного и дыхательного центров, расположенных в продолговатом мозге. У больных можно наблюдать нарушения глотания, фонации, а также ритма дыхания. Нарастает тахикардия (или брадикардия), развивается скачущее АД (быстрое повышение, затем падение АД). Возникает психомоторное возбуждение, быстро сменяемое сопором и комой. Чаще всего при этом варианте паралитической формы заболевания наступает летальный исход в первые 2-3 дня от начала развития параличей.
◊ Понтинный вариант имеет благоприятный прогноз и характеризуется изолированным поражением ядер VII пары черепных нервов (лицевого нерва), расположенных в области моста мозга. Поражения проявляются односторонним парезом лицевых мышц с полной утратой мимических движений с одной стороны
лица, сужением глазной щели и опущением угла рта. При оскале зубов губы перетягиваются в сторону, противоположную парализованной. В отличие от неврита лицевого нерва при этом варианте полиомиелита отсутствуют болевые ощущения, слезотечение и расстройства вкуса. Восстановительный период при паралитической форме полиомиелита затягивается на несколько месяцев, а развившиеся параличи, как правило, полностью не восстанавливаются.
Резидуальный период сопровождается развитием мышечных атрофий, контрактур, костных деформаций и остеопороза.
Дифференциальная диагностика
Полиомиелит следует дифференцировать от полирадикулоневритов, энцефалитов, миелитов, менингитов, невритов лицевого нерва, ботулизма и других заболеваний, клиническая картина которых включает паралитический компонент. В начале заболевания полиомиелит отличает сочетание лихорадки (иногда двухволновой) с признаками катара верхних дыхательных путей, гастроэнтерита и характерной потливости головы. Подозрение на менингеальную форму полиомиелита возникает при появлении на этом фоне менингеальных симптомов и в части случаев болезненности по ходу нервных стволов. Для паралитической формы характерно развитие параличей через 5-7 дней от начала болезни, чаще в утренние часы (спинальный вариант), ядер и жизненно важных центров продолговатого мозга (бульбарный вариант) или изолированного поражения ядер лицевого нерва (понтинный вариант).
Лабораторная диагностика
В острый период болезни можно выделить вирус из спинномозговой жидкости, испражнений, смывов из носоглотки. Однако на практике чаще применяют РСК, РТГА и ИФА для определения уровней IgM-АТ и IgG-АТ в парных сыворотках, взятых с интервалом 3-4 нед.
Осложнения и исходы
Осложнения весьма многочисленны и патогенетически связаны с развитием парезов и параличей. Прежде всего осложнения включают расстройства дыхания, ателектазы легких, пневмонии, миокардиты.
Кроме того, в части случаев при бульбарном варианте наблюдают острое расширение желудка, желудочно-кишечные кровотечения, прободение и непроходимость кишечника.
Лечение
Показана обязательная госпитализация больных. Введение специфического иммуноглобулина в дозе 0,3-0,5 мг/кг может способствовать определенному успеху в начальный период заболевания. При паралитической форме в острый период болезни назначают постельный режим, покой, тепло на пораженную конечность. Ортопедический режим осуществляют в зависимости от места развития паралича. При поражении нижних конечностей под коленные суставы подкладывают валики, стопы упирают под углом 90° в ножной конец матраца. При поражении верхних конечностей их удерживают в слегка отведенном положении. Матрац, на котором лежит больной, должен быть твердым и ровным, на кровать под матрац подкладывают фанерный щит. Больным назначают антихолинэстеразные препараты, холиномиметики и витамины группы В. При появлении признаков нарушения внешнего дыхания следует применить ИВЛ.
После окончания острого периода необходимы физиотерапевтические процедуры, лечебная физкультура и массаж. Назначают антихолинэстеразные препараты, холиномиметики и витамины группы В.
В период остаточных признаков показано санаторно-курортное лечение.
Эпидемиологический надзор
Ликвидация полиомиелита требует хорошо функционирующей системы эпидемиологического надзора, способной осуществлять контроль над организацией прививок и качеством вакцинации, а также идентифицировать абсолютно все случаи полиомиелита. Поскольку до настоящего времени отсутствуют абсолютные критерии, обеспечивающие распознавание всех случаев полиомиелита на основании только клинических данных, ВОЗ рекомендует осуществлять эпидемиологический надзор с широким применением лабораторных исследований, концентрируя основное внимание на случаях ОВП. Эпидемиологический надзор за случаями ОВП предусматривает немедленную регистрацию всех случаев ОВП у детей в возрасте до 15 лет. Качественный эпидемиологический надзор предусматривает ежегодное выявление как минимум одного боль-
ного ОВП на 100 000 детей до 15 лет, его клиническое и двукратное вирусологическое обследование в адекватные сроки. В каждом случае следует проводить оперативное эпидемиологическое расследование с тщательным анализом всех клинических, эпидемиологических и лабораторных данных. Каждый выделенный изолят вируса полиомиелита необходимо тщательно исследовать для определения его принадлежности к диким или вакцинным штаммам. В РФ (1998) созданы Национальный центр по лабораторной диагностике полиомиелита и 5 региональных центров. В задачу центров входит вирусологическое обследование больных с ОВП на закрепленных административных территориях.
Европейское региональное бюро ВОЗ разработало и издало в качестве практического руководства документацию, представляемую страной для сертификации ликвидации полиомиелита.
Сертификацию ликвидации полиомиелита в стране осуществляет специальная комиссия ВОЗ при условии выполнения следующих требований:
- отсутствие случаев заболевания в течение 3 лет;
- полное обследование всех случаев вялого паралича (с отрицательным результатом);
- организация действенной системы эпидемиологического надзора с лабораторной базой;
- охват прививками более 90% детей;
- высокие показатели серопозитивности (более 80%). Эпидемиологический надзор за ПОЛИО/ОВП заключается в непрерывном наблюдении за эпидемическим процессом с целью оценки, своевременного принятия управленческих решений, разработки и реализации санитарно-противоэпидемических (профилактических) мероприятий, обеспечивающих предупреждение возникновения, распространения, а также в ликвидации заболеваний паралитическим полиомиелитом, вызванным диким полиовирусом.
Эпидемиологический надзор за ПОЛИО/ОВП включает:
- выявление, клиническую и вирусологическую диагностику;
- регистрацию и учет заболеваний ПОЛИО/ОВП;
- активный и систематический сбор, анализ и оценку соответствующей информации;
- текущий и ретроспективный анализ заболеваемости ПОЛИО/
ОВП;
- вирусологические исследования проб из окружающей среды (прежде всего сточной воды);
- мониторинг циркуляции полиовирусов, прочих (неполио) энтеровирусов, выделенных в пробах фекалий и из объектов окружающей среды (прежде всего сточной воды);
- идентификацию штаммов полиовирусов, прочих (неполио) энтеровирусов;
- многоуровневый надзор (контроль) за состоянием иммунизации против полиомиелита (плановый, дополнительный, по эпидемическим показаниям);
- серологический мониторинг популяционного иммунитета к полиомиелиту;
- контроль, оценку качества и эффективности санитарно-противоэпидемических (профилактических) мероприятий;
- надзор (контроль) за выполнением требований биологической безопасности работы вирусологических лабораторий;
- принятие и реализацию управленческих решений;
- прогнозирование эпидемиологической обстановки. Основные критерии качества, эффективности и чувствительности
эпидемиологического надзора за ПОЛИО/ОВП:
- выявление и регистрация случаев ПОЛИО/ОВП - не менее 1 на 100 000 детей в возрасте до 15 лет;
- своевременность выявления больных ПОЛИО/ОВП (не позднее 7 дней от начала заболевания) - не менее 90%;
- адекватность отбора проб фекалий от больных ПОЛИО/ОВП для вирусологического исследования (забор 2 проб стула не позднее 14 дней от начала заболевания) - не менее 90%;
- полнота вирусологических исследований проб фекалий от больных ПОЛИО/ОВП (2 пробы фекалий от 1 больного) в региональных центрах эпидемиологического надзора за ПОЛИО/
ОВП - не менее 100%;
- своевременность (не позднее 72 ч с момента взятия 2-й пробы фекалий) доставки проб фекалий от приоритетных (горячих) случаев ПОЛИО/ОВП в Национальный центр по лабораторной диагностике полиомиелита - не менее 90%;
- своевременность (не позднее 72 ч с момента взятия 2-й пробы фекалий) доставки проб фекалий от больных ПОЛИО/ОВП в региональный центр эпидемиологического надзора за ПОЛИО/ ОВП, Национальный центр по лабораторной диагностике полиомиелита - не менее 90%;
- удовлетворительное качество проб фекалий - не менее 90%;
- своевременность (не позднее 28 дней с момента поступления пробы) представления результатов исследований проб фекалий - не менее 90%;
- эпидемиологическое расследование случаев ПОЛИО/ОВП в течение 24 ч после регистрации - не менее 90%;
- повторный осмотр больных ПОЛИО/ОВП через 60 дней от начала болезни - не менее 90%;
- повторный осмотр и вирусологическое исследование проб фекалий больных ВАПП на 60-й и 90-й дни от начала болезни - не менее 100%;
- окончательная классификация случаев ПОЛИО/ОВП через 120 дней от начала болезни - не менее 100%;
- своевременность представления в установленные сроки и в установленном порядке ежемесячной информации о заболеваемости ПОЛИО/ОВП (в том числе нулевой) - не менее 100%;
- своевременность представления в установленные сроки и в установленном порядке копий карт эпидемиологического расследования случаев заболеваний ПОЛИО/ОВП - не менее
100%;
- полнота представления в установленные сроки и в установленном порядке изолятов полиовирусов, прочих (неполио) энтеровирусов, выделенных в пробах фекалий, из объектов окружающей среды - не менее 100%.
В России в 2007 г. было зарегистрировано 440 случаев ОВП.
По результатам экспертной оценки Комиссией по диагностике полиомиелита и ОВП окончательный диагноз ОВП подтвержден в 356 случаях, в том числе в 6 случаях установлен диагноз ВАПП. Показатель заболеваемости ОВП в 2007 г. составил 1,61 на 100 000 детей до 15 лет.
Профилактические мероприятия
Санитарно-гигиеническим мероприятиям в профилактике полиомиелита принадлежит вспомогательная роль. Решающее значение в профилактике полиомиелита имела плановая иммунизация ОПВ из вакцинных штаммов I, II и III типов вируса. Однако инактивированная вакцина не в состоянии индуцировать выработку местных секреторных иммуноглобулинов и препятствовать размножению на слизистых оболочках ротоглотки и кишечника вирусов полиомиелита. Таким образом, ИПВ создает эффективную индивидуальную защиту от болезни,
но неполную защиту от инфицированности диким вирусом полиомиелита. У привитых ИПВ дикий вирус полиомиелита может размножаться в клетках кишечника и выделяться с испражнениями.
Высокая эффективность вакцинопрофилактики полиомиелита позволила ВОЗ в 1988 г. принять решение о возможности ликвидации этой инфекции в мире. В настоящее время принятая программа глобальной ликвидации полиомиелита успешно выполняется. В России разработали и внедряют аналогичную национальную программу.
В соответствии с ней помимо плановой (рутинной) трехкратной иммунизации детей с 3-месячного возраста и последующей четырехкратной ревакцинации также проводят дни туровой (национальной) иммунизации (2 раза в год всех детей до 3 лет независимо от прививочного анамнеза), а также дополнительную массовую иммунизацию в следующих случаях:
- на территориях с охватом вакцинацией менее 95% населения;
- по эпидемиологическим показаниям (в очагах инфекции);
- при отмечающейся циркуляции вируса среди населения.
В таких случаях ВОЗ рекомендовано широко практиковать кампании подчищающей иммунизации от дома к дому.
Несмотря на то что частота вакциноассоциированного полиомиелита крайне мала и составляет приблизительно 1 случай на 1-2,5 млн привитых, в последние годы на фоне значительных успехов в выполнении программы ликвидации полиомиелита в ряде стран прививки проводят инактивированной вакциной. Большинство вакциноассоциированных случаев связано с первой вакцинацией. ОПВ рекомендована ВОЗ для применения в эндемичных по полиомиелиту регионах мира. После ликвидации полиомиелита, сертификацию которой предполагали к 2005 г., иммунизация ОПВ будет прекращена. До настоящего времени сохраняется неопределенность в вопросе о том, какой наилучший путь необходимо избрать для прекращения вакцинации против полиомиелита и что необходимо предпринять при установлении циркуляции вируса полиомиелита вакцинного происхождения в определенных эпидемиологических ситуациях. Известно, что у лиц с иммунодефицитами вакцинный вирус может выделяться на протяжении 7-10 лет. Для прекращения циркуляции вакцинных вирусов полиомиелита предлагают использовать живые энтеровирусные вакцины, приготовленные из непатогенных серотипов вирусов ЕСНО. Предполагают, что эти вакцины позволят вытеснить из циркуляции оставшиеся вакцинные вирусы и завершить процесс ликвидации полиомиелита в мире.
Большое значение имеет постоянное наблюдение за циркуляцией диких штаммов вируса среди населения, а также контроль над его выделением из объектов внешней среды. Тщательному клиническому и лабораторному расследованию подлежат все случаи ОВП. Особое внимание обращают на их этиологическую связь с вирусом полиомиелита. Возможность возвращения вируса полиомиелита в освобожденный от него мир оценивают как весьма маловероятную, однако необходимы постоянная настороженность для осуществления в случае необходимости быстрых и высококвалифицированных действий, а также предотвращение использования вируса полиомиелита в биотеррористических целях. Вспышки полиомиелита, вызванные диким вирусом полиомиелита после предполагаемой ликвидации заболевания, следует подавлять посредством массовой иммунизации гомологичной моновалентной ОПВ. Следует создать и поддерживать запасы каждого из 3 типов моновалентной ОПВ на случай возникновения вспышки полиомиелита после прекращения вакцинации. После ликвидации полиомиелита в мире (прекращения циркуляции диких полиовирусов) и окончания программ иммунизации ОПВ возникнет необходимость ее замены на ИПВ для того, чтобы исключить возможность попадания вакцинного вируса в популяцию неиммунного населения.
Разработка новых инактивированных вакцин против полиомиелита основывается на использовании аттенуированных штаммов Сэбина. В связи с возможностью длительной циркуляции вирусов вакцинного происхождения, особенно типа II, необходимо полное исключение его из трехвалентной вакцины и замена новым штаммом. На основании широких консультаций ВОЗ разработала Глобальный план действий для обеспечения безопасного лабораторного хранения диких вирусов полиомиелита. Сформулированные новые меры предосторожности предполагают, что после ликвидации полиомиелита все лаборатории, работающие с дикими вирусами, и учреждения, производящие ИПВ, должны будут проводить свою работу в соответствии с новым уровнем биологической безопасности. Задача ликвидации полиомиелита не будет завершена до тех пор, пока все потенциальные источники диких вирусов полиомиелита, включая находящиеся во всех существующих в мире лабораториях, не будут правильно и безопасно содержаться. По оценке специалистов, для ликвидации полиомиелита потребуется ежегодно затрачивать 100 млн долларов США. Окончательные выгоды от ликвидации полиомиелита, включая ежегодную экономию 1,5 млрд долла-
ров США в мире, будут достигнуты только после прекращения вакцинации против полиомиелита.
Мероприятия по профилактике полиомиелита в России проводят в рамках реализации Национального плана действий по поддержанию свободного от полиомиелита статуса РФ. Осуществлены мероприятия по развитию и совершенствованию организационных форм работы, методического и информационного обеспечения профилактики полиомиелита, энтеровирусных инфекций. Продолжается работа по поддержанию высокого уровня популяционного иммунитета к полиомиелиту. Показатель своевременности вакцинации в возрасте 12 мес в 2007 г. составил 98,3%, ревакцинации в возрасте 24 мес 97,7%, в возрасте 14 лет 98,4% (2006 г. соответственно 98,3; 97,5; 98,4%).
Мероприятия в эпидемическом очаге
При выявлении больного полиомиелитом или ОВП госпитализация его обязательна. При выявлении больного ПОЛИО/ОВП в лечебнопрофилактической и другой организации или при поступлении больного ПОЛИО/ОВП в стационар немедленно проводят (с интервалом 24-48 ч) сбор 2 проб фекалий для вирусологического исследования. При подозрении на полиомиелит (в том числе вакциноассоциированный) кроме вирусологического исследования проводят исследование парных сывороток крови. Первую сыворотку отбирают при поступлении больного в стационар, вторую - через 3 нед. При подозрении на ВАПП проводят также иммунологическое исследование. В случае летального исхода заболевания необходимо взять секционный материал в первые часы после смерти. Повторный осмотр больного ПОЛИО/ ОВП проводят через 60 дней от начала болезни, при условии если паралич не восстановился ранее, с внесением данных осмотра в соответствующую медицинскую документацию ребенка и в карту эпидемиологического расследования случая ПОЛИО/ОВП. Повторный осмотр и отбор проб фекалий для вирусологического исследования от больных ВАПП проводят на 60-й и 90-й дни от начала болезни с внесением данных осмотра и результатов вирусологических исследований в соответствующую медицинскую документацию ребенка. Окончательный диагноз в каждом случае устанавливается на основании анализа и оценки медицинской документации (история развития ребенка, история болезни, карта эпидемиологического расследования случая ПОЛИО/ОВП, результаты лабораторных исследований и др.) Комиссией по диагности-
ке полиомиелита и ОВП субъекта РФ, а также Комиссией по диагностике полиомиелита и ОВП Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека.
Изоляцию прекращают после исчезновения острых клинических симптомов болезни, но не ранее 40 дней от начала болезни. Больных легкими паралитическими формами изолируют не менее чем на 20 дней. Контактных детей в возрасте до 5 лет осматривают педиатр и невропатолог для выявления больных с признаками полиомиелита или ОВП и их госпитализации (по показаниям). Среди детей в ДДУ и школьных детских учреждениях проводят карантинно-изоляционные мероприятия в течение 20 дней с обязательным медицинским наблюдением.
Двукратное копрологическое обследование всех контактных (взятие 2 проб фекалий в течение 2 дней) в очагах полиомиелита и ОВП проводят в следующих случаях:
- при позднем (позже 14-го дня с момента появления паралича) или неполном (1 проба стула) обследовании больного полиомиелитом или ОВП;
- при определении в окружении лиц, прибывших из эндемичных по полиомиелиту территорий, беженцев, вынужденных переселенцев, мигрантов;
- однократную вакцинацию детей в возрасте до 5 лет ОПВ вне зависимости от ранее проведенных профилактических прививок против этой инфекции, но не ранее 1 мес после последней иммунизации против полиомиелита и других инфекционных заболеваний;
- забор 1-й пробы фекалий от детей в возрасте до 5 лет для вирусологического исследования.
В очаге проводят заключительную дезинфекцию.
болезни с аэрозольным механизмом передачи
Инфекции дыхательных путей разделяют:
- на бактериальные (дифтерия, коклюш, стрептококковая, менингококковая и гемофильная инфекции, туберкулез и т.д.);
- вирусные (грипп и другие ОРВИ, корь, эпидемический паротит, ветряная оспа, краснуха, герпетическая инфекция, инфекционный мононуклеоз, ЦМВ-инфекция и т.д.).
Заражение при воздушно-капельном механизме передачи происходит очень легко. Поэтому инфекционные болезни дыхательных путей относят к числу наиболее распространенных. Для отдельных нозологий характерны те или иные особенности аэрозольного механизма передачи, определяемые тропностью возбудителей в пределах слизистой оболочки дыхательных путей, наличием или отсутствием дополнительной локализации за пределами слизистой оболочки дыхательных путей, а также индивидуальными свойствами возбудителя (прежде всего вирулентностью и устойчивостью во внешней среде). Легкость и быстрота распространения возбудителей кори, краснухи и ветряной оспы при высокой восприимчивости к ним приводят к взрывному распространению инфекции в организованных детских коллективах. В то же время глубокая локализация возбудителя коклюша, поражение нижних отделов дыхательных путей обусловливают затрудненное выделение его во внешнюю среду и заражение только при тесном общении с больным (изо рта в рот). Это определяет вялый, длительный характер вспышек коклюша в детских учреждениях. Высокая устойчивость возбудителей дифтерии и туберкулеза обеспечивает им возможность распространения воздушнопылевым и другими путями (пищевым, контактно-бытовым).
Характерная особенность инфекций дыхательных путей - преимущественное поражение детей младшего возраста, особенно посещающих организованные коллективы. Легкость заражения аэрозольным путем обусловливает детский характер большинства инфекций, помесячную (сезонность) и погодовую (периодичность) неравномерность заболеваемости и другие эпидемиологические черты. Инфекционноиммунологические взаимоотношения популяций в паразитарной системе определяют основные закономерности развития эпидемического процесса при аэрозольных антропонозах. Для ряда нозологий показано, что меняющаяся под влиянием циркулирующего возбудителя иммунологическая структура коллектива оказывает воздействие на биологические свойства возбудителя, прежде всего на его вирулентность. В условиях естественного развития эпидемического процесса длительность сформировавшегося постинфекционного иммунитета, а также демографические факторы, например рождаемость и миграция населения, приводящие к накоплению неиммунной прослойки среди населения и снижению уровня коллективного иммунитета, определяют интервал между подъемами заболеваемости.
Значительное количество больных легкими формами, широко распространенное здоровое или постинфекционное носительство возбу-
дителя, позднее обращение за медицинской помощью и заразность больных уже в инкубационный период создают затруднения в проведении своевременных лечебно-ограничительных мероприятий по отношению к источникам инфекции. Эффективных мер воздействия на чрезвычайно легко реализующийся аэрозольный механизм передачи инфекций также до сих пор нет. В связи с этим основной и надежной возможностью воздействия на эпидемический процесс инфекций дыхательных путей служит вакцинация населения. Эффективность иммунопрофилактики доказана многолетним мировым опытом. Под ее влиянием произошли изменения эпидемиологических черт болезней (изменились возрастная структура заболевших, сезонность, периодичность, очаговость и т.д.). Вместе с тем ослабление внимания к проведению вакцинации вызывает резкое ухудшение эпидемиологической ситуации и рост заболеваемости многими инфекционными болезнями, управляемыми средствами иммунопрофилактики. В связи с этим Российская Федерация пережила эпидемию дифтерии, крупную вспышку полиомиелита, также повысилась заболеваемость корью, коклюшем, эпидемическим паротитом. Наряду с отмеченным до настоящего времени существуют болезни (скарлатина, ОРВИ и др.), для которых нет средств активной иммунопрофилактики. Эти заболевания до сих пор относят к категории неуправляемых инфекционных болезней. Проявления эпидемического процесса этих инфекций во многом такие же, как и несколько десятилетий назад. В осуществлении эпидемиологического надзора за инфекциями дыхательных путей большое значение имеет слежение за иммунологической структурой населения, качеством иммунопрофилактики и биологическими свойствами циркулирующего возбудителя.
ДИФТЕРИЯ (DIPHTHERIA)
Дифтерия - острая антропонозная бактериальная инфекция с общетоксическими явлениями и фибринозным воспалением в месте входных ворот возбудителя.
Краткие исторические сведения
Заболевание известно со времен глубокой древности, о нем упоминают в своих трудах Гиппократ, Гомер, Гален.
На протяжении многих веков неоднократно менялось название болезни:
- смертельная язва глотки;
- сирийская болезнь;
- петля палача;
- злокачественная ангина;
- круп.
В XIX в. П. Бретонно, а позже его ученик А. Труссо представили классическое описание болезни, выделив ее как самостоятельную нозологическую форму под названием «дифтерит», а затем «дифтерия» (греч. Diphthera - пленка, перепонка).
Э. Клебс (1883) обнаружил возбудитель в пленках из ротоглотки, через год Ф. Леффлер выделил его в чистой культуре. Спустя несколько лет был выделен специфический дифтерийный токсин (Э. Ру и А. Йерсен, 1888), обнаружен антитоксин в крови больного и получена антитоксическая противодифтерийная сыворотка (Э. Ру, Э. Беринг, Ш. Китазато, Я.Ю. Бардах, 1892-1894). Ее применение позволило снизить летальность от дифтерии в 5-10 раз. Г. Рамон (1923) разработал противодифтерийный анатоксин. В результате проводимой иммунопрофилактики заболеваемость дифтерией резко снизилась; во многих странах она даже была ликвидирована.
В России с конца 70-х годов и особенно в 90-х годах XX столетия на фоне снижения коллективного антитоксического иммунитета, прежде всего у взрослого населения, увеличилась заболеваемость дифтерией. Эту ситуацию обусловили дефекты вакцинации и ревакцинации, смена биоваров возбудителя на более вирулентные и ухудшение социальноэкономических условий жизни населения.
Этиология
Возбудитель дифтерии - грамположительная неподвижная палочковидная бактерия Corynebacterium diphtheriae. Бактерии имеют булавовидные утолщения на концах (греч. coryne - булава). При делении клетки расходятся под углом друг к другу, что обусловливает характерное расположение их в виде растопыренных пальцев, иероглифов, латинских букв V, Y, L, паркета и т.д. Бактерии образуют волютин, зерна которого располагаются на полюсах клетки и выявляются при окрашивании. По Нейссеру бактерии окрашиваются в коричнево-желтый цвет с синими утолщенными концами. Выделяют 2 основных биовара возбудителя
(gravis и mitis), а также ряд промежуточных (intermedius, minimus и др.). Бактерии прихотливы и растут на сывороточных и кровяных средах. Наибольшее распространение получили среды с теллуритом (например, среда Клауберга II), так как возбудитель резистентен к высокой концентрации теллурита калия или натрия, ингибирующей рост контаминирующей микрофлоры. Основной фактор патогенности - дифтерийный экзотоксин, относимый к сильнодействующим бактериальным ядам. Он уступает лишь ботулиническому и столбнячному токсинам. Способность к токсинообразованию проявляют лишь лизогенные штаммы возбудителя, инфицированные бактериофагом, несущим ген tox, кодирующий структуру токсина. Нетоксигенные штаммы возбудителя не способны вызывать болезнь. Адгезивность, т.е. способность прикрепляться к слизистым оболочкам организма и размножаться, определяет вирулентность штамма. Возбудитель долго сохраняется во внешней среде (на поверхности предметов и в пыли - до 2 мес). Под воздействием 10% раствора перекиси водорода погибает через 3 мин, при обработке 1% раствором сулемы, 5% раствором фенола, 50-60° этиловым спиртом - через 1 мин. Устойчив к низкой температуре, при нагревании до 60 °С гибнет через 10 мин. Инактивирующее действие оказывают также УФ-лучи, хлорсодержащие препараты, лизол и другие дезинфицирующие средства.
Эпидемиология
Резервуар и источник инфекции - больной человек или носитель токсигенных штаммов. Наибольшая роль в распространении инфекции принадлежит больным дифтерией ротоглотки, особенно со стертой и атипичными формами болезни. Реконвалесценты выделяют возбудитель в течение 15-20 сут (иногда до 3 мес). Большую опасность для окружающих представляют бактерионосители, выделяющие возбудитель из носоглотки. В различных группах частота длительного носительства варьирует от 13 до 29%. Непрерывность эпидемического процесса обеспечивает длительное носительство даже без регистрируемой заболеваемости.
Механизм передачи - аэрозольный, путь передачи - воздушнокапельный. Иногда факторами передачи могут стать загрязненные руки и объекты внешней среды (предметы обихода, игрушки, посуда, белье и др.). Дифтерия кожи, глаз и половых органов возникает при переносе возбудителя через контаминированные руки. Также известны пищевые вспышки дифтерии, обусловленные размножением возбудителя в молоке, кондитерских кремах и др.
Естественная восприимчивость людей
Естественная восприимчивость людей высокая и определяется антитоксическим иммунитетом. Содержание в крови 0,03 АЕ/мл специфических АТ обеспечивает защиту от заболевания, но не препятствует формированию носительства патогенных возбудителей. Дифтерийные антитоксические АТ, передающиеся трансплацентарно, защищают новорожденных от заболевания в течение 1-го полугодия жизни. У переболевших дифтерией или правильно привитых людей вырабатывается антитоксический иммунитет, его уровень - надежный критерий защищенности от этой инфекции.
Основные эпидемиологические признаки
Дифтерию как заболевание, зависящее от привитости населения, по мнению специалистов ВОЗ, можно успешно контролировать. В Европе широкие программы иммунизации были начаты в 1940-х годах, и заболеваемость дифтерией быстро снизилась до единичных случаев во многих странах. Значительное снижение иммунной прослойки всегда сопровождает рост заболеваемости дифтерией. Это произошло в РФ в начале 90-х годов, когда на фоне резкого снижения коллективного иммунитета был отмечен небывалый подъем заболеваемости, прежде всего взрослых людей. Вслед за повышением заболеваемости взрослых в эпидемический процесс оказались вовлеченными и дети, не имевшие антитоксического иммунитета, часто в результате необоснованных отводов от прививок. Миграция населения в последние годы также способствовала широкому распространению возбудителя. Периодические (в многолетней динамике) и осенне-зимние (внутригодовые) подъемы заболеваемости также наблюдают при дефектах вакцинопрофилактики. В этих условиях заболеваемость может сдвигаться с детского на более старший возраст с преимущественным поражением лиц угрожаемых профессий (работники транспорта, торговли, сферы обслуживания, медицинские работники, педагоги и др.). Резкое ухудшение эпидемиологической обстановки сопровождают более тяжелое течение болезни и увеличение летальности. Подъем заболеваемости дифтерией совпал с увеличением широты циркуляции биоваров gravis и intermedius. Показатели заболеваемости дифтерией в 2007 г. составили 0,06 на 100 000 населения, что в 2 раза ниже уровня заболеваемости в 2006 г. (0,12 на 100 000 населения). В числе заболевших дети до 17 лет составляют 31,8%. Показатели заболеваемости детей дифтерией в 2007 г. снизились в 2 раза и составили
0,11 против 0,24 на 100 000 детей в 2006 г. Заболевания детей дифтерией в 2007 г. не регистрировались в 50 субъектах Российской Федерации. Показатели своевременной вакцинации значительно повысились, все субъекты Российской Федерации превысили 95%-й уровень своевременности охвата вакцинацией детей в возрасте 12 мес и ревакцинацией в 24 мес. В последние годы снижение заболеваемости дифтерией в целом по России не сопровождается адекватным уменьшением смертности при этой инфекции. Несмотря на положительную динамику в ряде субъектов отмечают групповые заболевания, тяжелые формы и летальные исходы. Наиболее крупные очаги дифтерии зарегистрированы в Челябинской, Свердловской и Новгородской областях.
Планомерное снижение заболеваемости дифтерией продолжается благодаря неуклонному увеличению охвата населения прививками.
Среди заболевших по-прежнему преобладают взрослые. Среди привитых дифтерия протекает легко и не сопровождается осложнениями. Занос инфекции в соматический стационар возможен при госпитализации больного стертой или атипичной формой дифтерии, а также носителя токсигенного возбудителя.
Патогенез
Основные входные ворота инфекции - слизистые оболочки ротоглотки, реже - носа и гортани, еще реже - конъюнктива, уши, половые органы, кожа (рис. 3-7). Размножение возбудителя происходит в области входных ворот. Токсигенные штаммы бактерий выделяют экзотоксин и ферменты, провоцируя формирование очага воспаления. Местное действие дифтерийного токсина выражается в коагуляционном некрозе эпителия, развитии гиперемии сосудов и стаза крови в капиллярах, повышении проницаемости сосудистых стенок. Экссудат, содержащий фибриноген, лейкоциты, макрофаги и нередко эритроциты, выходит за пределы сосудистого русла. На поверхности слизистой оболочки в результате контакта с тромбопластином некротизированной ткани фибриноген превращается в фибрин. Фибриновая пленка прочно фиксируется на многослойном эпителии зева и глотки, но легко снимается со слизистой оболочки, покрытой однослойным эпителием, в гортани, трахее и бронхах. Вместе с тем при легком течении заболевания воспалительные изменения могут быть ограничены лишь простым катаральным процессом без формирования фибринозных налетов.
 Рис. 3-7. Патогенез
дифтерии: ОДН - острая дыхательная недостаточность; ССН -
сердечно-сосудистая недостаточность; НН - надпочечниковая
недостаточность
Рис. 3-7. Патогенез
дифтерии: ОДН - острая дыхательная недостаточность; ССН -
сердечно-сосудистая недостаточность; НН - надпочечниковая
недостаточность
Нейраминидаза возбудителя значительно потенцирует действие экзотоксина. Основную его часть составляет гистотоксин, блокирующий синтез белка в клетках и инактивирующий фермент трансферазу, ответственную за образование полипептидной связи.
Дифтерийный экзотоксин распространяется по лимфатическим и кровеносным сосудам, обусловливая развитие интоксикации, регионарного лимфаденита и отека окружающих тканей. Токсин не только повышает порозность эндотелия кровеносных сосудов, но и вызывает парез лимфатических сосудов, что становится причиной формирования отека. В тяжелых случаях отек нёбного язычка, нёбных дужек и миндалин резко суживает вход в глотку, развивается отек шейной клетчатки, степень которого соответствует тяжести болезни. Токсинемия приводит к развитию микроциркуляторных нарушений и воспалительно-дегенеративных процессов в различных органах и системах - сердечно-сосудистой и нервной системах, почках, надпочечниках.
Связывание токсина со специфическими рецепторами клеток проходит в виде двух фаз - обратимой и необратимой.
• В обратимую фазу клетки сохраняют свою жизнеспособность, а токсин может быть нейтрализован антитоксическими АТ.
• В необратимую фазу АТ уже не могут нейтрализовать токсин и не препятствуют реализации его цитопатогенной активности.
В результате развиваются общетоксические реакции и признаки сенсибилизации. В патогенезе поздних осложнений со стороны нервной системы определенную роль могут играть аутоиммунные механизмы.
Антитоксический иммунитет, развивающийся после перенесенной дифтерии, не всегда защищает от возможности повторного заболевания. Антитоксические АТ оказывают защитный эффект в титрах не менее
1:40.
Клиническая картина
Инкубационный период длится от 2 до 10 дней.
Клиническая классификация дифтерии, принятая в РФ, подразделяет заболевание на следующие формы и варианты течения.
• Дифтерия ротоглотки:
◊ дифтерия ротоглотки, локализованная с катаральным, островчатым и пленчатым вариантами;
◊ дифтерия ротоглотки распространенная;
◊ дифтерия ротоглотки субтоксическая;
◊ дифтерия ротоглотки токсическая (I, II и III степеней);
◊ дифтерия ротоглотки гипертоксическая.
• Дифтерийный круп:
◊ дифтерия гортани (дифтерийный круп локализованный);
◊ дифтерия гортани и трахеи (круп распространенный);
◊ дифтерия гортани, трахеи и бронхов (нисходящий круп).
• Дифтерия носа.
• Дифтерия половых органов.
• Дифтерия глаз.
• Дифтерия кожи.
• Комбинированные формы с одновременным поражением нескольких органов.
Дифтерия ротоглотки
Дифтерия ротоглотки составляет 90-95% всех случаев заболевания у детей и взрослых; у 70-75% пациентов она протекает в локализованной форме.
• Локализованная форма дифтерии ротоглотки начинается остро, повышенная температура тела от субфебрильной до высокой сохраняется 2-3 дня.
Интоксикация умеренная:
- головная боль;
- недомогание;
- снижение аппетита;
- бледность кожи;
- тахикардия.
При снижении температуры тела местные проявления в области входных ворот сохраняются и даже могут нарастать. Интенсивность болей в горле при глотании соответствует характеру изменений в ротоглотке, где отмечают неяркую застойную разлитую гиперемию, умеренный отек миндалин, мягкого нёба и дужек. Налеты локализуются только на миндалинах и не выходят за их границы, располагаются отдельными островками или в виде пленки (островчатый или пленчатый варианты). Фибринозные налеты в первые часы болезни выглядят как желеобразная масса, затем - как тонкая паутинообразная пленка, однако уже на 2-е сутки болезни они становятся плотными, гладкими, сероватого цвета с перламутровым блеском, снимаются с трудом, при их снятии шпателем слизистая оболочка кровоточит. На следующий день на месте удаленной пленки появляется новая. Снятая фибринозная пленка, помещенная в воду,
не распадается и тонет. При локализованной форме дифтерии типичные фибринозные налеты наблюдают не более чем у 1/3 взрослых больных, в остальных случаях, а также в более поздние сроки (3-5-й день) болезни налеты разрыхлены и снимаются легко, кровоточивость слизистой оболочки при их снятии не выражена. Регионарные и подчелюстные лимфатические узлы умеренно увеличены и чувствительны при пальпации. Процесс на миндалинах и реакция регионарных лимфатических узлов могут быть несимметричными или односторонними.
Катаральный вариант локализованной дифтерии ротоглотки регистрируют редко, он сопровождается минимальными общими и местными симптомами. При нормальной или кратковременной субфебрильной температуре тела и слабых проявлениях интоксикации возникают неприятные ощущения в горле при глотании, небольшая гиперемия слизистой оболочки ротоглотки, отечность миндалин. Диагноз дифтерии в таких случаях можно поставить только с учетом данных анамнеза, эпидемической ситуации и результатов лабораторного обследования.
Течение локализованной дифтерии ротоглотки, как правило, доброкачественное. После нормализации температуры тела уменьшается и затем исчезает боль в горле, тогда как налеты на миндалинах могут сохраняться 6-8 дней. Однако при отсутствии лечения локализованная форма дифтерии ротоглотки может прогрессировать и переходить в другие, более тяжелые формы.
• Распространенную форму дифтерии ротоглотки встречают сравнительно редко (3-11%). Она отличается от локализованной формы распространением налетов за пределы миндалин на любые участки слизистой оболочки ротоглотки (см. рис. 5 на цветной вклейке). Симптомы общей интоксикации, отек миндалин, болезненность подчелюстных лимфатических узлов обычно более выражены, чем при локализованной форме. Отека подкожной клетчатки шеи не бывает.
• При субтоксической форме дифтерииротоглотки отмечают признаки интоксикации, выраженные боли при глотании и иногда в области шеи. Миндалины багрово-цианотичного цвета с налетом, носящим локализованный характер или незначительно распространяющимся на небные дужки и язычок. Отек миндалин, дужек, язычка и мягкого нёба умеренный. Отмечают увеличение, болезненность и плотность регионарных лимфатических узлов. Отличительная особенность этой формы - локальный отек подкожной клетчатки над регионарными лимфатическими узлами, часто односторонний.
• Токсическую форму дифтерии ротоглотки (I, II, III степени) в настоящее время встречают достаточно часто (около 20% общего количества больных), особенно у взрослых. Она может развиться из нелеченой локализованной или распространенной формы, но в большинстве случаев возникает сразу и бурно прогрессирует. Температура тела высокая (39-41 °С) уже с первых часов заболевания. Отмечают головную боль, слабость, сильные боли в горле, иногда в шее и животе. Могут возникнуть рвота, болевой тризм жевательных мышц, эйфория, возбуждение, бред, делирий. Кожные покровы бледные (при токсической дифтерии III степени возможна гиперемия лица). Диффузная гиперемия и выраженный отек слизистой оболочки ротоглотки, при токсической дифтерии II и III степеней полностью закрывающий просвет зева, предшествуют появлению фибринозных налетов. Образующиеся налеты быстро распространяются на все отделы ротоглотки. В дальнейшем фибриновые пленки становятся толще и грубее, держатся до 2 нед и более. Процесс часто носит односторонний характер. Регионарные лимфатические узлы увеличиваются рано и значительно, становятся плотными, болезненными, развивается периаденит. Местные проявления при токсической дифтерии ротоглотки отличаются от всех других форм заболевания безболезненным тестоватым отеком подкожной клетчатки шеи, достигающего ее середины при токсической дифтерии I степени, ключицы - при II степени. При III степени отек спускается ниже ключицы, может распространяться на лицо, заднюю поверхность шеи, спину и быстро прогрессирует. Выражен общетоксический синдром, отмечают цианоз губ, тахикардию, снижение АД. При снижении температуры тела симптомы остаются выраженными. Изо рта больных исходит специфический приторно-гнилостный запах, голос приобретает гнусавый оттенок. Токсическая дифтерия ротоглотки часто сочетается с поражениями гортани и носа. Такие комбинированные формы отличает тяжелое течение, они трудно поддаются лечению.
• Типертоксическая форма дифтерии ротоглотки - самое тяжёлое проявление дифтерии. Чаще развивается у больных с неблагоприятным преморбидным фоном (алкоголизм, сахарный диабет, хронический гепатит и др.). Температура тела с ознобом быстро нарастает до высоких цифр, интоксикация резко выражена (слабость, головная боль, рвота, головокружение, признаки энцефалопатии). Отмечают прогрессирующие расстройства гемодинамики -
тахикардию, слабый пульс, снижение АД, бледность, акроцианоз. Возникают кожные кровоизлияния, органные кровотечения, пропитывание кровью фибринозных налетов, что отражает развитие ДВС-синдрома. В клинической картине доминируют признаки быстро развивающегося ИТШ, способного вызвать смерть больного уже на 1-2-е сут заболевания.
Дифтерийный круп
Выделяют локализованную (дифтерия гортани) и распространенную (с одновременным поражением гортани, трахеи и даже бронхов) формы. Распространенная форма чаще сочетается с дифтерией ротоглотки, носа. В последнее время эту форму дифтерии довольно часто встречают у взрослых больных. Клинически круп проявляется в виде 3 последовательно развивающихся стадий (дисфонической, стенотической и асфиксической) при умеренно выраженных признаках интоксикации.
• Ведущие симптомы дисфонической стадии - грубый лающий кашель и нарастающая осиплость голоса. У детей она продолжается 1-3 дня, у взрослых - до 7 сут.
• В стенотическую стадию (продолжается от нескольких часов до 3 сут) голос становится афоничным, кашель - беззвучным. Больной бледен, беспокоен, дыхание шумное, с удлиненным вдохом и втягиванием уступчивых участков грудной клетки. Нарастание признаков затруднения дыхания, цианоза, тахикардии рассматривают как показания к интубации или трахеостомии, предотвращающей переход дифтерийного крупа в асфиксическую стадию.
• В асфиксическую стадию дыхание становится частым и поверхностным, затем - аритмичным. Нарастает цианоз, пульс становится нитевидным, АД падает. В дальнейшем нарушается сознание, появляются судороги, наступает смерть от асфиксии.
В силу анатомических особенностей гортани у взрослых развитие дифтерийного крупа занимает большее время, чем у детей, втяжение уступчивых мест грудной клетки может отсутствовать. В части случаев единственными признаками этой формы заболевания становятся осиплость голоса и чувство нехватки воздуха. Обращают на себя внимание бледность кожных покровов, ослабление проведения дыхания, тахикардия, снижение напряжения кислорода при исследовании КЩС. Безусловную помощь в постановке диагноза оказывает ларингоскопическое (в некоторых случаях и бронхоскопическое) исследование, выявляющее гиперемию и отек гортани, пленки в области голосовых связок, поражение трахеи и бронхов.
Дифтерия носа
Характерны незначительная интоксикация, затруднение носового дыхания, серозно-гнойные или сукровичные выделения (катаральный вариант). Слизистая оболочка носа гиперемирована, отечна, с эрозиями, язвочками или фибринозными наложениями в виде легко снимающихся клочьев (пленчатый вариант). На коже около носа появляются раздражение, мокнутие и корочки. Дифтерия носа обычно развивается в сочетании с поражением ротоглотки и (или) гортани, иногда глаз.
Дифтерия глаз
Может протекать в катаральном, пленчатом и токсическом вариантах.
• При катаральном варианте отмечают воспаление конъюнктивы (чаще одностороннее) с необильными выделениями. Температура тела нормальная или субфебрильная. Симптомы интоксикации и регионарный лимфаденит отсутствуют.
• При пленчатом варианте на фоне субфебрильной температуры тела и слабых общетоксических признаков формируется фибриновая пленка на гиперемированной конъюнктиве, нарастает отек век, появляются серозно-гнойные выделения. Процесс сначала бывает односторонним, но через несколько дней может перейти и на другой глаз.
• Токсическая дифтерия глаз имеет острое начало, отличается быстрым развитием симптомов интоксикации, отека век, обильным сукровично-гнойным секретом, раздражением и мокнутием кожи вокруг глаза. Отек распространяется, захватывая различные области подкожной клетчатки лица. Пленчатый конъюнктивит часто сопровождают поражения других отделов глаза, вплоть до панофтальмии, а также регионарный лимфаденит.
Дифтерия уха, половых органов (анально-генитальная), кожи
Эти состояния встречают редко. Обычно они развиваются в сочетании с дифтерией зева или носа. Общие черты этих форм:
- отек;
- гиперемия;
- инфильтрация;
- фибринозный налет в области поражения;
- регионарный лимфаденит.
При дифтерии половых органов у мужчин процесс локализуется в области крайней плоти. У женщин он может стать распространенным и
захватывать половые губы, влагалище, промежность и область заднего прохода, сопровождаться серозно-кровянистыми выделениями из влагалища, затрудненным и болезненным мочеиспусканием.
Дифтерия кожи развивается в области ран, опрелостей, экземы, грибковых поражений с трещинами кожи, где формируется налет грязно-серого цвета с серозно-гнойным отделяемым. Общетоксические признаки при этом незначительны, однако местный процесс регрессирует медленно (до 1 мес и более).
Развитию этих форм способствуют травматизация участков слизистых оболочек или кожи, занос возбудителей руками.
У лиц, перенесших дифтерию или никогда ею не болевших, можно наблюдать бессимптомное носительство, длительность которого значительно варьирует. Формированию носительства способствуют сопутствующие хронические заболевания носоглотки. Антитоксический иммунитет не препятствует развитию носительства.
Дифференциальная диагностика
Локализованную и распространенную дифтерию ротоглотки дифференцируют с ангинами различной этиологии (кокковыми, ангиной Симановского-Венсана-Плаута, сифилитической, туляремийной и др.), инфекционным мононуклеозом, синдромом Бехчета, стоматитами. Ее отличают умеренная интоксикация, бледность кожи, неяркая гиперемия ротоглотки, медленный регресс проявлений ангины при снижении температуры тела. При пленчатом варианте значительно облегчает диагностику фибринозный характер налетов. Наиболее труден для дифференциальной диагностики островчатый вариант дифтерии ротоглотки, зачастую клинически не отличимый от ангин кокковой этиологии.
При постановке диагноза токсической дифтерии ротоглотки необходимо проводить дифференциальную диагностику с паратонзиллярным абсцессом, некротическими ангинами при заболеваниях крови, кандидозом, химическими и термическими ожогами полости рта. Для токсической дифтерии ротоглотки характерны быстро распространяющиеся фибринозные налеты, отек слизистой оболочки ротоглотки и подкожной клетчатки шеи, выраженные и быстро прогрессирующие проявления интоксикации.
Дифтерийный круп дифференцируют от ложного крупа при кори, ОРВИ и других заболеваниях.
Круп часто сочетается с дифтерией ротоглотки или носа, клинически проявляется в виде трех последовательно развивающихся стадий:
- дисфонической;
- стенотической;
- асфиксической при умеренно выраженных признаках интоксикации.
Лабораторная диагностика
В гемограмме при локализованной форме дифтерии отмечают умеренный, а при токсических формах - высокий лейкоцитоз, нейтрофилию со сдвигом лейкоцитарной формулы влево, нарастание СОЭ, прогрессирующую тромбоцитопению.
Основу лабораторной диагностики составляют бактериологические исследования:
- выделение возбудителя из очага воспаления;
- определение его типа и токсигенности.
Материал отбирают стерильными ватными тампонами, сухими или смоченными 5% раствором глицерина. При хранении и транспортировке тампоны предохраняют от охлаждения и высыхания. Материал должен быть посеян не позднее 2-4 ч после взятия. У больных ангиной, бывших в контакте с больными дифтерией, а также у лиц с типичными клиническими проявлениями дифтерии диагноз ставят даже при отрицательном результате бактериологического исследования.
Вспомогательное значение имеет определение титров антитоксических АТ в парных сыворотках при постановке РНГА. Токсинообразование выявляют, используя РНГА с антительным эритроцитарным диагностикумом. Для выявления дифтерийного токсина предложено использовать ПЦР.
Осложнения и исходы
К патогенетически обусловленным осложнениям дифтерии относят:
- ИТШ;
- миокардиты;
- моно- и полиневриты, включая поражения черепных и периферических нервов;
- полирадикулоневропатию;
- поражения надпочечников;
- токсический нефроз.
Частота их развития при локализованной форме дифтерии ротоглотки составляет 5-20%, при более тяжелых формах она значительно возрастает:
- при субтоксической дифтерии - до 50% случаев;
- при различных степенях токсической дифтерии - от 70 до 100%. Время развития осложнений, считая от начала заболевания, зависит прежде всего от клинической формы дифтерии и степени тяжести процесса. Тяжелый миокардит, представляющий собой наиболее частое осложнение токсической дифтерии, возникает рано - в конце 1-й или начале 2-й недели заболевания. Среднетяжелые и легкие миокардиты выявляют позже, на 2-3-й неделе. Токсический нефроз как частое осложнение только токсической дифтерии выявляют по результатам анализов мочи уже в острый период болезни. Проявления невритов и полирадикулоневропатии могут возникнуть как на фоне клинических проявлений заболевания, так и через 2-3 мес после выздоровления.
Лечение
Все больные дифтерией или с подозрением на нее подлежат госпитализации. Сроки пребывания больных в стационаре и длительность постельного режима зависят от формы и тяжести заболевания. Основным в лечении дифтерии считают введение антитоксической противодифтерийной сыворотки. Она нейтрализует токсин, циркулирующий в крови, следовательно, оказывает наибольший эффект при раннем применении. При подозрении на токсическую форму дифтерии или дифтерийный круп сыворотку вводят немедленно, в остальных случаях возможно выжидание при постоянном наблюдении за больным в стационаре. У больных с локализованной формой дифтерии позже 4-го дня болезни сыворотку стараются не применять, что, по современным данным, значительно сокращает возможность развития отдаленных осложнений заболевания. Положительные результаты кожной пробы (пробы Шика) - противопоказание к введению сыворотки лишь при локализованных формах, во всех остальных случаях в данной ситуации сыворотку необходимо вводить под прикрытием антигистаминных препаратов и глюкокортикоидов.
Дозы сыворотки при дифтерии у взрослых в зависимости от формы и тяжести заболевания определяет действующая инструкция Министерства здравоохранения РФ «Дифтерия у взрослых» (1995) (табл. 3-6).
Противодифтерийную сыворотку можно вводить как внутримышечно (чаще), так и внутривенно. Повторные введения сыворотки возможны при продолжающейся интоксикации. В настоящее время дозы сыворотки пересматривают как в сторону увеличения, так и в сторону уменьшения, в зависимости от формы дифтерии.
Таблица 3-6. Дозы противодифтерийной сыворотки при различных клинических формах дифтерии
Форма дифтерии Доза сыворотки, тыс. МЕ
Локализованная форма дифтерии ротоглотки, носа, половых органов, глаз, кожи и др. | 15-30 внутримышечно |
Распространенная дифтерия ротоглотки | 30-40 внутримышечно |
Субтоксическая дифтерия ротоглотки | 50-60 внутримышечно |
Токсическая дифтерия ротоглотки: ν I степень тяжести | 60-80 внутримышечно |
ν II степень тяжести | 80-100 внутримышечно и внутривенно |
ν III степень тяжести | 100-120 внутримышечно и внутривенно |
ν гипертоксическая | 120-150 внутримышечно и внутривенно |
Круп локализованный | 15-20 внутримышечно |
Круп распространенный и нисходящий | 30-40 внутримышечно |
Проводят дезинтоксикационное лечение кристаллоидными и коллоидными растворами внутривенно (полиионные растворы, глюкозокалиевая смесь с добавлением инсулина, реополиглюкин, свежезамороженная плазма). В тяжелых случаях к вводимым растворам добавляют глюкокортикоиды (преднизолон в дозе 2-5 мг/кг). Одновременно указанные капельные вливания способствуют коррекции гемодинамических нарушений. Применяют десенсибилизирующие препараты, витамины (аскорбиновую кислоту, витамины группы В и др.).
Токсическая дифтерия II и III степеней, гипертоксическая форма и тяжелые комбинированные формы заболевания - показания к проведению плазмафереза. Разрабатывают новые эффективные пути детоксикации, такие как гемосорбция, аффинная сорбция, иммуносорбция.
При субтоксической и токсических формах рекомендовано назначение антибиотиков в средних терапевтических дозах, оказывающих этиотропное воздействие на сопутствующую кокковую флору:
- пенициллина;
- эритромицина;
- ампициллина;
- ампиокса;
- препаратов тетрациклинового ряда и цефалоспоринов.
При дифтерии гортани необходимы частые проветривания палаты, теплое питье, паровые ингаляции с ромашкой, содой, эвкалиптом, гидрокортизоном (125 мг на ингаляцию). Больным назначают эуфиллин, салуретики, антигистаминные средства, при нарастании признаков стеноза - преднизолон внутривенно по 2-5 мг/кг в сутки. При гипоксии применяют увлажненный кислород через носовой катетер, удаляют пленки с помощью электроотсоса.
Показание к хирургическому вмешательству - прогрессирование признаков дыхательной недостаточности: тахипноэ более 40 в минуту, цианоз, тахикардия, двигательное беспокойство, гипоксемия, гиперкапния, респираторный ацидоз. В этом случае при локализованном крупе проводят интубацию трахеи, при распространенном, нисходящем крупе и комбинации крупа с тяжелыми формами дифтерии - трахеостомию с последующей ИВЛ.
При возникновении признаков ИТШ больного переводят в реанимационное отделение. Наряду с активным введением внутривенных инфузий растворов увеличивают дозу преднизолона до 5-20 мг/кг. Кроме того, показаны допамин (200-400 мг в 400 мл 10% раствора глюкозы внутривенно капельно со скоростью 5-8 мг/кг в минуту), трентал (2 мг/кг внутривенно капельно в 50 мл 10% раствора глюкозы), трасилол или контрикал (до 2000-5000 ЕД/кг в сутки внутривенно капельно), салуретики, изадрин.
Для санации бактериовыделителей применяют клиндамицин по 150 мг 4 раза в день, бензилпенициллин-новокаиновую соль по 600 000 ЕД 2 раза в день внутримышечно, а также цефалотин и цефалеандол парентерально в средних терапевтических дозах. Длительность курса 7 дней. Целесообразно одновременное лечение хронической патологии ЛОР-органов.
Эпидемиологический надзор
Эпидемиологический надзор предполагает сбор информации, на основе которой могут быть приняты соответствующие меры профилактики.
Он включает в себя:
- наблюдение за заболеваемостью и охватом вакцинацией;
- изучение иммунологической структуры населения;
- наблюдение за циркуляцией возбудителя среди населения, его биологическими свойствами и антигенной структурой.
Большое значение имеют эпидемиологический анализ и оценка эффективности проведенных мероприятий, прогнозирование интенсивности эпидемического процесса дифтерии на конкретной территории.
Профилактические мероприятия
Вакцинопрофилактика остается основным способом контроля дифтерии. Схема иммунизации детей предусматривает иммунизацию вакциной АКДС начиная с 3 мес жизни (вакцинируют троекратно с интервалом 30-40 дней). Ревакцинацию проводят через 9-12 мес после законченной вакцинации. Для ревакцинации в 6-7, 11-12 и 16-17 лет применяют АДС-М. В отдельных случаях, например при противопоказаниях к коклюшному компоненту АКДС, АДС-М применяют и для вакцинации. В современной эпидемиологической ситуации особую значимость приобрела иммунизация взрослых.
Среди взрослых в первую очередь прививают лиц из групп повышенного риска:
- лиц, проживающих в общежитии;
- работников сферы обслуживания;
- медицинских работников;
- студентов;
- преподавателей;
- персонал школ, средних и высших специальных заведений;
- работников ДДУ и др.
Для прививок взрослых применяют АДС-М в форме плановой иммунизации каждые 10 лет до 56 лет включительно. Лица, переболевшие дифтерией, также подлежат прививкам. Заболевание дифтерией любой формы у непривитых детей и подростков расценивают как первую вакцинацию, у получивших до заболевания одну прививку - как вторую вакцинацию. Дальнейшие прививки проводят согласно действующему календарю прививок. Дети и подростки, привитые против дифтерии (получившие законченную вакцинацию, одну или несколько ревакцинаций) и переболевшие легкой формой дифтерии без осложнений, не подлежат дополнительной прививке после заболевания. Очередную возрастную ревакцинацию им проводят в соответствии с интервалами, предусмотренными действующим календарем прививок.
Дети и подростки, привитые против дифтерии (получившие законченную вакцинацию, одну или несколько ревакцинаций) и перенесшие токсические формы дифтерии, должны быть привиты препаратом в зависимости от возраста и состояния здоровья - однократно в дозе 0,5 мл, но не ранее чем через 6 мес после перенесенного заболевания. Взрослые, ранее привитые (получившие не менее одной прививки) и переболевшие дифтерией в легкой форме, дополнительной вакцинации против дифтерии не подлежат. При перенесении ими токсической формы дифтерии их следует иммунизировать против дифтерии, но не ранее чем через 6 мес после перенесенного заболевания. Их ревакцинацию следует проводить через 10 лет. Лица с неизвестным прививочным анамнезом подлежат серологическому обследованию на антитоксические АТ. При отсутствии защитного титра антитоксинов (более 1:20) они подлежат вакцинации.
Эффективность вакцинации против дифтерии зависит как от качества вакцинных препаратов, так и от охвата прививками восприимчивого к данной инфекции населения. В принятой ВОЗ РПИ указано, что только 95%-й охват прививками гарантирует эффективность вакцинации.
Распространение дифтерии предупреждают путем раннего выявления, изоляции и лечения больных и носителей токсигенных дифтерийных палочек. Большое профилактическое значение имеет активное выявление больных дифтерией, предусматривающее ежегодный плановый осмотр детей и подростков при формировании организованных коллективов. В целях раннего выявления дифтерии участковый врач (врач-педиатр, врач-терапевт) обязан активно наблюдать за больными ангиной с патологическими наложениями на миндалинах в течение 3 дней от первичного обращения с обязательным проведением бактериологического обследования на дифтерию в течение 1-х суток.
Мероприятия в эпидемическом очаге
Больные дифтерией подлежат госпитализации, причем при задержке госпитализации им экстренно вводят 5000 МЕ противодифтерийной сыворотки. Больные с тяжелыми формами ангины, больные из детских учреждений с постоянным пребыванием детей (домов ребенка, детских домов и др.), общежитий, проживающие в неблагоприятных бытовых условиях, лица, относящиеся к контингентам риска заболевания дифтерией (медицинские работники, работники ДДУ, оздоровительных и образовательных учреждений, работники торговли, общественного
питания, транспорта), должны быть госпитализированы с провизорной целью. Госпитализации также подлежат больные ангиной с налетами или крупом из очага дифтерии.
Выписка из больницы разрешена после клинического выздоровления и получения двукратного отрицательного результата бактериологического исследования слизи из зева и носа на возбудителя дифтерии, проведенного с двухдневными интервалами, и не ранее чем через 3 дня после отмены антибиотикотерапии. Выписку носителя токсигенных дифтерийных палочек осуществляют после получения двукратного отрицательного результата бактериологического обследования. После выписки из стационара больных и носителей токсигенных дифтерийных палочек сразу допускают к работе, учебе и в детские учреждения с постоянным пребыванием детей без дополнительного бактериологического обследования. Если носитель токсигенных дифтерийных палочек продолжает выделять возбудитель, несмотря на проведение двух курсов санации антибиотиками, его допускают на работу, учебу и в ДДУ. В этих коллективах все лица, ранее не привитые против дифтерии, должны получить прививку согласно действующей схеме иммунизации. В данный коллектив вновь принимают только привитых против дифтерии лиц.
Реконвалесценты дифтерии и носители дифтерийных палочек подлежат диспансерному наблюдению в течение 3 мес после выписки из стационара. Диспансеризацию осуществляют участковый терапевт и врач кабинета инфекционных заболеваний в поликлинике по месту жительства.
Врач, установивший диагноз, немедленно отправляет экстренное извещение в Центр гигиены и эпидемиологии. При изоляции источника инфекции проводят влажную уборку с применением дезинфицирующих средств, заключительную дезинфекцию игрушек, постельных принадлежностей, белья. Бактериологическое обследование общавшихся с больным лиц проводят однократно. Серологическому обследованию в очагах дифтерийной инфекции подлежат только лица, имевшие непосредственный контакт с больным или носителем токсигенных штаммов C. dyphtheriae, при отсутствии документального подтверждения факта проведения им прививок против дифтерии. Медицинское наблюдение за ними (включая осмотр отоларинголога) продолжают в течение 7 дней. Выявленных больных и носителей токсигенных дифтерийных палочек госпитализируют. Носители нетоксигенных штаммов не подлежат лечению антимикробными препаратами, им показаны консультация отоларинголога, выявление и лечение патологических процессов в носоглот-
ке. В очаге инфекции следует привить не привитых против дифтерии лиц, а также детей и подростков, у которых наступил срок очередной вакцинации или ревакцинации. Среди взрослых вакцинации подлежат лица, у которых, согласно медицинской документации, после последней прививки прошло 10 лет и более, а также лица с низкими титрами АТ (менее 1:20), что определяют при проведении РПГА.
КОКЛЮШ (PERTUSSIS)
Коклюш - острая антропонозная бактериальная инфекция, сопровождающаяся катаральными изменениями в верхних дыхательных путях и приступообразным спазматическим кашлем.
Краткие исторические сведения
Эпидемии коклюша описаны в XVI-XVIII вв. во Франции, Англии, Голландии. Возбудитель заболевания впервые выделен и изучен Ж. Борде и О. Жангу (1906), позднее он получил название палочки Борде-Жангу.
В России изучение заболевания связано с именами Н.Ф. Филатова, С.Ф. Хотовицкого, М.Г. Данилевича, С.Д. Носова и других известных ученых. В 1957 г. создана убитая вакцина против коклюша.
Этиология
Возбудитель - аэробная неподвижная грамотрицательная бактерия Bordetella pertussis. В мазках располагается в виде беспорядочных скоплений палочек овоидной формы. Бактерия прихотлива, и ее культивируют на специальных средах (картофельно-глицериновом агаре, казеиновоугольном агаре и др.). На плотных средах образует небольшие сероватые блестящие колонии, напоминающие капельки ртути или жемчужины. Обладает сложной антигенной структурой. Три основных серовара возбудителя коклюша различают по вирулентности. Возбудитель образует термолабильный дерматонекротоксин, трахеальный цитотоксин и термостабильный эндотоксин. Бактерии не очень устойчивы во внешней среде и погибают под действием прямого солнечного света через 1 ч, при температуре 56 °С - в течение 15-30 мин. Быстро погибают под воздействием дезинфицирующих веществ. В сухом остатке мокроты сохраняются в течение нескольких часов.
Эпидемиология
Резервуар и источник инфекции - больной человек, представляющий опасность с конца инкубационного периода. Максимально контагиозен больной с момента развития клинических проявлений болезни. В катаральный период с начала первых клинических проявлений, а также на 1-й неделе спазматического кашля 90-100% больных выделяют возбудитель. На 2-й неделе спазматического кашля возбудитель выделяют 60-70% пациентов, на 3-й неделе - 30-35%. В дальнейшем частота выделения возбудителя не превышает 10%. Большинство больных коклюшем теряют контагиозность через 5-6 нед от начала заболевания. Большую опасность, особенно в организованных детских коллективах, представляют невыявленные больные со стертой формой болезни. Носительство возбудителя кратковременно и не имеет существенного эпидемиологического значения.
Механизм передачи - аэрозольный, путь передачи - воздушнокапельный. Выраженное катаральное воспаление слизистых оболочек у больного коклюшем, обильное отделение секрета и сильный кашель обеспечивают массивное выделение возбудителя во внешнюю среду. В связи с глубокой локализацией патологического процесса в дыхательных путях и крупнодисперсным характером выделяемого аэрозоля передача возбудителя возможна только при тесном общении с больным. Заражение происходит на расстоянии не более 2 м от источника инфекции. В силу нестойкости возбудителя во внешней среде передача через предметы обихода не происходит.
Естественная восприимчивость людей
Восприимчивость к инфекции высокая. Обычно первые встречи с возбудителем происходят в детском возрасте, что и определяет детский характер заболевания. Коклюшем болеют не только дети первых месяцев жизни, но и новорожденные. Трансплацентарный иммунитет не обеспечивает защиту от заболевания. Иммунитет после перенесения коклюша стойкий, пожизненный. Повторные заболевания обычно наблюдают у лиц пожилого возраста.
Основные эпидемиологические признаки
Заболевание распространено повсеместно. Характерны периодические подъемы и спады с интервалом в 3-4 года. При этом уровень очередного подъема зависит от продолжительности промежутка времени после предшествующего подъема - чем длиннее этот интервал, тем выше уровень очередного подъема. В довакцинальный период около
80% заболевших составляли дети в возрасте до 5 лет (преимущественно до 1 года). Характерна высокая очаговость, особенно в ДДУ. Показатель вторичной пораженности составляет около 90%. Для коклюша характерен некоторый рост заболеваемости в осенне-зимний период. Количество заболевших в городе в 4-5 раз выше, чем в сельской местности. После введения плановой вакцинопрофилактики заболеваемость коклюшем претерпела существенные изменения, однако в последние годы отмечен рост заболеваемости. В 1999 и 2000 гг. заболеваемость коклюшем составила в России 15,3 и 20,2 на 100 000 населения. В 2007 г. заболеваемость коклюшем в Российской Федерации оставалась на уровне 2006 г. и составила 5,7 на 100 000 населения. В то же время уровень заболеваемости детей в 2007 г. по сравнению с 2006 г. увеличился на 2,5% и составил соответственно 27,7 против 27,04 на 100 000 детей.
Большую часть заболевших составляют невакцинированные дети. Среди вакцинированных детей болезнь протекает в стертой, малосимптомной форме, что приводит к невыявлению значительной части больных. Отмечен также сдвиг заболеваемости к старшему возрасту. Характерно вялое, длительное течение эпидемического процесса. Вспышка в детских учреждениях развивается медленно. От больного заражаются несколько детей, затем идет передача по цепочке (примерно 2-3 заболевания через каждые 5 - 10 дней). При отсутствии надлежащих противоэпидемических мер вспышка может продолжаться несколько месяцев, пока не будет исчерпана неиммунная прослойка в данном коллективе. Занос возбудителя в медицинские учреждения может привести к формированию внутрибольничной вспышки коклюша, особенно если имеются непривитые лица.
Патогенез
Попадая на слизистую оболочку дыхательных путей, возбудитель колонизирует клетки цилиндрического реснитчатого эпителия гортани, трахеи и бронхов. Трахеальный цитотоксин и термолабильный дерматонекротоксин, выделяемые бактериями, стимулируют развитие воспалительного процесса. Действие токсинов определяет катаральную стадию развития заболевания. На всем протяжении заболевания бактерии колонизируют только поверхность эпителия воздухоносных путей, не проникая в клетки и не диссеминируя с кровотоком.
Выделяющийся после гибели бактерий термостабильный токсин (коклюшный токсин) вызывает развитие спазматического кашля. Кроме
пароксизмального кашля, с ним связывают лимфоцитоз, гипогликемию и повышенную чувствительность к гистамину. Снижение порога чувствительности к гистамину сохраняется значительно дольше, чем присутствие возбудителя на слизистой оболочке, что может служить объяснением развития бронхоспазма в течение многих недель спазматического периода, когда высеять возбудитель уже невозможно. Кашлевой рефлекс постепенно закрепляется в дыхательном центре продолговатого мозга, приступы кашля возникают чаще и становятся сильнее, они могут быть спровоцированы различными неспецифическими раздражителями (болью, прикосновением, звуком и др.). При этом нарушается ритм дыхания, что влечет за собой расстройство газообмена. Происходят расстройства гемодинамики и повышение проницаемости сосудов, что приводит к появлению геморрагических симптомов, а также признаков гипоксии и ацидоза. Застойный очаг возбуждения в дыхательном центре может распространяться на соседние центры продолговатого мозга, например сосудистый, рвотный. В клинической картине заболевания в таких случаях проявляются рвота в конце приступа кашля, повышение АД, спазмы сосудов, иногда у детей могут возникать клонические и тонические судороги.
Коклюшный токсин совместно с аденилатциклазой возбудителя снижает активность факторов неспецифической защиты организма, в частности вызывает незавершенность фагоцитоза, что может способствовать присоединению вторичной микробной флоры, а также развитию длительного носительства и распространению возбудителя.
Патоморфологические изменения при коклюше обычно выражены мало и неспецифичны, однако при развитии осложнений они могут быть многочисленными и носить разнообразный характер. В легких можно наблюдать признаки гемо- и лимфостаза, возможны пневмония, формирование участков эмфиземы, бронхоэктазов и ателектазов. В головном мозге (на него, по некоторым данным, коклюшный токсин может оказывать непосредственное воздействие) отмечают расширение сосудов, возможны кровоизлияния и развитие атрофических изменений в коре с клиническими проявлениями энцефалопатии и эпилептиформных припадков.
Клиническая картина
Инкубационный период варьирует в пределах 3-14 дней, в большинстве случаев он длится около 1 нед.
В течение заболевания отмечают последовательную смену трех периодов.
• Катаральный период развивается постепенно, проявляется умеренно выраженными катаральными изменениями в виде сухого кашля и насморка (у детей довольно обильного) с вязким слизистым отделяемым. Температура тела может оставаться нормальной, но чаще повышается до субфебрильных величин. Самочувствие и общее состояние больного остаются удовлетворительными. Постепенно кашель усиливается, становится упорным. Уже в конце этого периода он может проявляться в виде приступов, особенно в ночное время. У больных развиваются раздражительность, беспокойство. Катаральный период длится от нескольких дней до 2 нед, у взрослых он более продолжительный, чем у детей.
• Период спазматического кашля (судорожный период) развивается постепенно. Кашель становится приступообразным и возникает чаще, приобретает судорожный характер. Довольно часто больные предчувствуют наступление приступа кашля. У них возникают першение в горле, чувство давления в груди, беспокойство. Приступ начинается с нескольких кашлевых толчков на протяжении 1-го выдоха. При вдохе возникает свистящий звук (реприз) вследствие спастического сужения голосовой щели. В течение 1-го приступа кашлевые толчки и репризы чередуются и могут повторяться несколько раз. Во время приступа у больного набухают шейные вены, лицо становится одутловатым, гиперемированным, нередко цианотичным, на лице появляется выражение испуга, рот раскрыт, язык максимально высовывается (см. рис. 7 на цветной вклейке). Приступ нередко заканчивается рвотными движениями с выделением вязкой слизи. Количество приступов в течение суток и длительность каждого из них прямо пропорциональны тяжести заболевания. Приступы судорожного кашля возникают в любое время суток, но чаще всего - в ночное время и под утро. В результате повторных приступов лицо больного становится одутловатым, веки припухшими, могут появиться кровоизлияния на конъюнктиве глаз, мелкие кровоизлияния на коже и слизистых оболочках. Вне приступов кашля общее состояние больных почти не нарушается. Температура тела в период спазматического кашля становится нормальной у большинства больных, выраженная лихорадка всегда привлекает внимание врача, указывая на возможность развития осложнений. При осмотре больных часто выслушивают сухие
хрипы в легких, иногда определяют расширение перкуторных границ сердца, повышение АД. Судорожный период продолжается 3-4 нед и более, количество приступов постепенно уменьшается, интенсивность их ослабевает.
• Для периода разрешения характерно снижение частоты приступов кашля. Он становится слабее и теряет специфический спазматический характер. Легче отделяется слизистая мокрота. Ведущие признаки заболевания постепенно исчезают, но кашель, слабость, раздражительность и повышенная возбудимость больных сохраняются еще в течение длительного времени (до нескольких месяцев).
Наряду с типичным клиническим течением, характерным для большинства больных, известны стертые и абортивные формы коклюша.
• При стертой форме спазматический кашель выражен слабо, хотя и отличается длительностью, упорством, навязчивостью, трудно поддается лечению. Репризы и рвоту, как правило, не выявляют, осложнения встречают редко. Такой тип течения чаще наблюдают у привитых детей и взрослых.
• При абортивной форме отмечают типичное течение катарального периода, вслед за которым пароксизмы судорожного кашля продолжаются не более 1-2 дней или вообще отсутствуют.
• Субклиническую форму выявляют лишь в очагах коклюша при бактериологическом и серологическом обследовании контактных лиц.
Дифференциальная диагностика
Коклюш дифференцируют от острых респираторных вирусных заболеваний, бронхитов, пневмоний, а также стриктур бронхов различной этиологии, бронхиальной астмы, инородных тел в бронхах. Основу дифференциальной диагностики составляет характерный для коклюша судорожный приступообразный кашель с чередованием кашлевых толчков и репризов, чаще возникающий в ночное время или под утро на фоне нормальной температуры тела.
Лабораторная диагностика
При коклюше в крови отмечают выраженный лейкоцитоз и лимфоцитоз. В период катаральных проявлений и в начале периода спазматического кашля проводят посевы слизи со слизистой оболочки верхних дыхательных путей на питательные среды (среду Борде-Жангу) с целью
выделения возбудителя. Материал забирают или тампоном, или непосредственно при кашле сразу на питательную среду (кашлевые пластинки). Процент высеваемости не превышает 15-25%. Можно применять серологические методы исследования (РА, РСК, РНГА), однако следует учитывать, что положительные результаты этих реакций проявляются не всегда и не ранее 2-й недели спазматического периода. Разработаны экспресс-методы диагностики коклюша:
- РНИФ (реакция непрямой иммунофлюоресценции);
- РЛА;
- ПЦР.
Осложнения и исходы
Возможно развитие разнообразных осложнений:
- пневмонии;
- бронхиты;
- плевриты;
- эмфизема легких;
- гнойный отит.
В особо тяжелых случаях возможны (редко) пневмоторакс, ателектаз легких, кровоизлияния в мозг и другие органы, разрывы мышц живота и барабанных перепонок, выпадение прямой кишки и др. В детском возрасте частым осложнением бывает развитие ложного крупа, у детей раннего возраста последствием коклюша может быть бронхоэктатическая болезнь.
Прогноз в целом благоприятен. Летальные исходы наблюдают крайне редко у лиц пожилого возраста.
Лечение
Лечение преимущественно амбулаторное. Эффективно способствуют снижению частоты и облегчению приступов кашля свежий увлажненный воздух (частое проветривание помещения), полноценное питание с частыми приемами пищи малыми порциями, уменьшение воздействия внешних раздражителей (слуховых, зрительных, тактильных). При нормальной температуре тела полезны прогулки на свежем воздухе (зимой при температуре не ниже минус 5 °С). Рекомендуют назначение антигистаминных средств с седативным эффектом и транквилизаторов (детям - пипольфен в возрастных дозировках, взрослым - пипольфен, седуксен, реланиум, сибазон).
Антибиотики (ампициллин, левомицетин, аминогликозиды, макролиды в средних терапевтических дозах) эффективны при их применении в катаральный период и в начале периода приступов кашля. Противокашлевые препараты малоэффективны. Для улучшения бронхиальной проходимости, а также для понижения венозного давления в малом круге кровообращения в лечении коклюша используют эуфиллин* внутрь или парентерально. При тяжелом коклюше с выраженной гипоксией показаны оксигенотерапия, гидрокортизон в суточной дозе 5-7 мг/кг или преднизолон по 2 мг/кг в сутки на протяжении 2-3 дней с последующим постепенным снижением доз. При развитии энцефалопатии с судорожным синдромом может потребоваться перевод пациентов в отделение реанимации.
В катаральный период и в начале спазматического периода предложено применять антитоксический противококлюшный иммуноглобулин в дозе 2 мл, однако проведенные исследования не подтвердили его эффективность.
Эпидемиологический надзор
В эпидемиологической практике целесообразно использовать следующие составляющие эпидемиологического надзора:
- мониторинг заболеваемости;
- охват прививками;
- слежение за иммунологической структурой населения и свойствами циркулирующего возбудителя коклюша;
- анализ и прогноз эпидемиологической ситуации;
- оценка эффективности проводимых мероприятий.
В силу широкого распространения легких форм болезни большое значение имеют разработка и применение методов серологического контроля за привитостью и изучение свойств циркулирующего возбудителя. Анализ заболеваемости детей различных возрастных групп и взрослых позволяет изучить причины роста заболеваемости коклюшем на определенных территориях. Рост доли манифестных форм коклюша свидетельствует об увеличении непривитых контингентов.
Профилактические мероприятия
Плановую вакцинопрофилактику осуществляют с трехмесячного возраста вакциной АКДС, делая 3 прививки внутримышечно с интервалом 1,5 мес в дозе 0,5 мл. Ревакцинацию осуществляют через 1,5-2 года
после законченной вакцинации однократно внутримышечно в дозе 0,5 мл. Дети старше 3 лет прививкам против коклюша не подлежат. В последние годы за рубежом широко применяют бесклеточную коклюшную вакцину, рекомендованную для 3-го или 4-го введения. Препарат лишен бактериального эндотоксина, определяющего реактогенность коклюшной вакцины. Эффективность иммунизации против коклюша достигает 70-80%. В Великобритании, ФРГ и Японии в 1970-е годы - в период снижения охвата прививками (с 80 до 30%) детского населения - наблюдали подъем заболеваемости коклюшем и частоты его осложнений. Эти показатели быстро снизились после восстановления уровня охвата иммунопрофилактикой.
Важная профилактическая мера - раннее выявление больных с помощью двукратного бактериологического обследования детей, а также взрослых, работающих в родильных домах, детских больницах, санаториях, ДДУ и школах, при кашле в течение 5-7 дней и более.
Мероприятия в эпидемическом очаге
Госпитализацию больного осуществляют по клиническим и эпидемиологическим показаниям. Дети, посещающие ДДУ, и взрослые из декретированных групп подлежат изоляции на 25 дней от начала заболевания. Дети, посещающие ДДУ и общавшиеся с больным коклюшем, подлежат двукратному бактериологическому обследованию и разобщению на 14 дней с момента изоляции больного или последнего дня контакта. В ДДУ бактериологическое исследование проводят двукратно (исследованию подлежат дети и персонал). При положительном результате его повторяют с интервалом 7-14 дней до получения отрицательного результата. В школах бактериологические исследования по эпидемиологическим показаниям не проводят. В школах, школах-интернатах, детских садах и домах, дошкольных группах яслей-садов изоляции на 25 дней подлежит только первый заболевший (ребенок, взрослый). В очаге проводят текущую дезинфекцию с влажной уборкой и проветриванием. Экстренную профилактику проводят нормальным иммуноглобулином. Его вводят всем детям первого года жизни, а также не привитым и не болевшим коклюшем детям в возрасте от 1 до 6 лет. γ-Глобулин вводят независимо от сроков, прошедших со дня общения с больным, в разовой дозе 3 мл.
ПАРАКОКЛЮШ
Паракоклюш - самостоятельная нозологическая форма, встречаемая значительно реже коклюша.
Этиология
Возбудитель - Bordetella parapertussis, морфологически схожа с возбудителем коклюша, отличается меньшей требовательностью к питательным средам, формой колоний (сероватые с приподнятым центром) и антигенной структурой.
Эпидемиология
Эпидемиология и патогенез коклюша и паракоклюша схожи.
Клиническая картина
Инкубационный период составляет 1-2 нед. Заболевание в целом совпадает по основным проявлениям с клинической картиной легкой формы коклюша. Проявляется трахеобронхитом с упорным кашлем, трудно поддающимся лечению, на фоне нормальной температуры тела и удовлетворительного самочувствия больных. Изредка (у 10-15% больных) можно наблюдать приступы спазматического кашля. Перекрестного иммунитета паракоклюш и коклюш не дают.
Лабораторная диагностика
В лабораторной диагностике паракоклюша используют те же методы, что и при коклюше, но с постановкой серологических реакций с паракоклюшным Аг.
Осложнения
Осложнения развиваются редко.
Лечение
Различий в лечении коклюша и паракоклюша нет.
МЕНИНГОКОККОВАЯ ИНФЕКЦИЯ
Антропонозное острое инфекционное заболевание, протекающее в виде назофарингита, менингококцемии, гнойного менингита, а также других редко встречающихся клинических форм.
Краткие исторические сведения
Первые клинические описания менингококкового менингита сделаны в XVII в. Т. Уиллисом (Виллизием) и Т. Сиднэмом. В самостоятельную нозологическую форму эпидемический цереброспинальный менингит был выделен в 1805 г. (эпидемия в Швейцарии). Однако это заболевание было известно еще в глубокой древности, с V в. до н.э.
Возбудитель заболевания открыл А. Вексельбаум (1887). В 1889 г. У. Ослер выделил возбудитель из крови, что послужило основанием и доказательством того, что менингококк вызывает не только менингит, но и другие клинические формы заболевания - от назофарингита до сепсиса. Революционную роль в лечении больных менингитом сыграли сульфаниламидные препараты и антибиотики, применение которых резко снизило летальность при генерализованных формах заболевания. В 50-60-х годах XX столетия В.И. Покровский разработал методы лечения менингококковой инфекции с помощью массивных доз пенициллина, вводимых внутримышечно, что избавило больных от мучительных ежедневных процедур эндолюмбального введения антибиотиков.
Этиология
Возбудитель - неподвижная грамотрицательная бактерия Neisseria meningitidis. Для возбудителя характерна морфологическая изменчивость; в типичных случаях в препаратах он выглядит как диплококк, располагающийся в виде кофейных зерен. Менингококки растут на питательных средах, содержащих нативные белки (кровь, сыворотки и др.), склонны к образованию L-форм. На основании группоспецифических Аг бактерии разделяют на серологические группы (A, B, C, D, N, X, Y, Z, W-135 и др.), но только 3 из них - А, В и С - ответственны за развитие более чем 90% генерализованных форм менингококковой инфекции. Штаммы серогруппы А вызывают эпидемические вспышки, В, С и Y - спорадические случаи заболевания. Однако в последние годы отмечены вспышки и эпидемии, обусловленные возбудителями этих
серогрупп. Основной фактор агрессии возбудителя - ЛПС-комплекс (эндотоксин). По составу белков наружной мембраны, идентифицируемых антисыворотками, серогруппы В и С подразделяют на серотипы. К настоящему времени известно более 20 серотипов менингококка, из них типы 2, 4, 15 и 16 оценены как маркеры вирулентности. Определение серогрупповой принадлежности возбудителя, выделяемого от носителей и больных, имеет важное эпидемиологическое значение.
Возбудитель малоустойчив к воздействию факторов внешней среды: вне организма быстро погибает при высыхании, охлаждении ниже 22 °С, при 55 °С погибает через 5 мин. Под действием 0,01% раствора хлорамина, 1% раствора фенола и 0,1% раствора перекиси водорода инактивируется через 2-3 мин.
Эпидемиология
Резервуар и источник инфекции - человек с генерализованной формой, острым назофарингитом, а также здоровый носитель. Животные не восприимчивы к менингококкам. Носительство менингококков распространено довольно широко и подвержено колебаниям. Соотношение между больными и носителями непостоянно (по разным данным, от 1:2000 до 1:50 000). В периоды спорадической заболеваемости 1-3% населения бывают носителями менингококка, в эпидемических очагах - до 20-30%. Длительность носительства составляет 2-3 нед. Более длительное носительство связано с хроническими воспалительными поражениями носоглотки. Больные генерализованной формой менингококковой инфекции - источники заведомо вирулентных штаммов возбудителя, но в связи с их малочисленностью и быстрой госпитализацией из-за тяжелого состояния их эпидемиологическая роль невелика. Роль здоровых носителей менингококков как источников инфекции, безусловно, меньше, чем больных, но в силу их массовости именно носители имеют большое значение в распространении заболевания и поддержании эпидемического процесса. Важную роль в качестве источников инфекции играют также больные менингококковым назофарингитом.
Механизм передачи - аэрозольный. Возбудитель передается с капельками слизи при кашле, чихании, разговоре. Вследствие нестойкости менингококка во внешней среде и его локализации на слизистой оболочке задней стенки носоглотки он передается при достаточно тесном и длительном общении. В отличие от других инфекций дыхательных путей
распространение эпидемии менингококковой инфекции на различные территории происходит медленно. Заражению способствуют:
- скученность;
- длительное общение, особенно в спальных помещениях;
- нарушения режима температуры, проветривания и влажности.
Естественная восприимчивость людей
Естественная восприимчивость людей высокая, но исход заражения определяют как свойства возбудителя (вирулентность), так и резистентность макроорганизма. Как уже отмечалось, генерализация процесса происходит у весьма незначительного количества инфицированных лиц. Иммунологическую структуру населения формируют заболеваемость и носительство возбудителя. После перенесенной болезни сохраняется длительный иммунитет. Повторные заболевания отмечают у лиц с врожденным дефицитом компонентов комплемента С7-С9.
Основные эпидемиологические признаки
Болезнь распространена повсеместно. Классический регион эпидемических поражений - Центральная Экваториальная Африка (начиная от Гвинейского залива), так называемый менингитный пояс. Занос возбудителя на территории, где заболевание ранее не регистрировали (например, регионы Крайнего Севера), приводит к преобладанию генерализованных форм, охватывающих все возрастные группы.
Менингококковой инфекции присущи все черты эпидемиологии инфекций с воздушно-капельным механизмом передачи:
- периодичность;
- сезонность;
- определенное возрастное распределение;
- очаговость.
Широко распространенное носительство возбудителя и низкая частота заболеваний с клинически выраженными формами определяют основные эпидемиологические проявления инфекции. Периодические подъемы заболеваемости происходят через 10-12 лет; их определяет смена этиологической значимости бактерий разных серогрупп. По мнению исследователей, пороговыми, характеризующими переход от спорадической заболеваемости к эпидемической, становятся показатели 1,8-2 на 100 000 населения. В настоящее время на территории России после длительного периода эпидемической заболеваемости (с 1969 г.) ее уровень приближается к спорадической (в 1999 и 2000 гг. она составила
2,6 и 2,7 на 100 000 населения). В 2007 г. в Российской Федерации зарегистрирован 2671 случай заболевания менингококковой инфекцией против 3007 случаев в 2006 г. Показатели заболеваемости менингококковой инфекцией снизились по сравнению с 2006 г. на 10,9% и составили 1,87 против 2,1 на 100 000 населения. Из общего числа случаев заболеваний менингококковой инфекцией 84% (2246) приходится на генерализованные формы. Высокие уровни заболеваемости (более 3 на 100 000 населения) зарегистрированы в Астраханской области (6,2), Республике Алтай (3,9), Свердловской (3,45), Тюменской (3,34), Новосибирской (3,4), Мурманской (3,1) областях.
На территории РФ преимущественно циркулируют менингококки серогруппы В.
Летальность при генерализованных формах менингококковой инфекции составляет до 10% и более.
Заболевание поражает преимущественно городское население. Менингококковую инфекцию регистрируют во всех возрастных группах - от первых дней жизни до преклонного возраста. Тем не менее это типичная детская инфекция. Дети до 5 лет составляют более 70% всех больных. Самые высокие показатели заболеваемости сохраняются у детей до 1 года. В период подъема заболеваемости в эпидемический процесс вовлекаются, кроме детей младшего возраста, старшие дети, подростки и взрослые. Возрастная динамика заболеваемости и носительства менингококков находится в обратно пропорциональной зависимости. У детей младшего возраста уровень носительства низкий (до 0,5%), а уровень заболеваемости самый высокий. По мере увеличения возраста заболеваемость снижается, а частота носительства увеличивается.
Менингококковая инфекция имеет низкую очаговость - до 95% составляют очаги с одним заболеванием. Вспышки могут возникать в организованных коллективах детей и взрослых, что в значительной мере обусловлено социальными факторами (период обучения, проживание в общежитии, служба в армии и т.д.). Эти же обстоятельства объясняют факт преобладания среди заболевших лиц мужского пола. В странах с умеренным климатом в межэпидемический период характерна зимне-весенняя сезонность заболеваемости с максимумом в феврале-марте. Во время эпидемических подъемов пик заболеваемости смещается на март-май, причем в крупных городах в сентябре во время формирования детских коллективов наблюдают небольшой подъем заболеваемости.
Патогенез
Попадание бактерий на слизистую оболочку носоглотки (рис. 3-8) в большинстве случаев не ведет к выраженным морфологическим изменениям в этой области, а также к каким-либо клиническим проявлениям. Этот процесс условно называют «здоровое носительство».
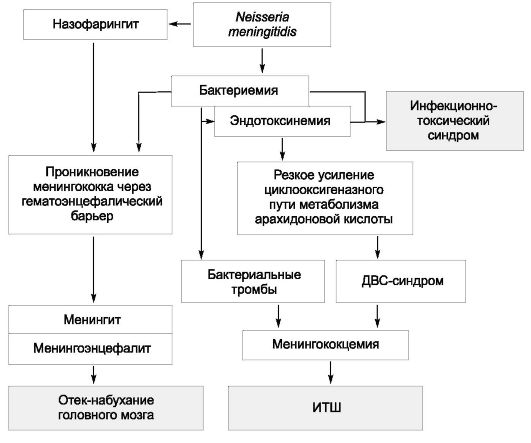 Рис. 3-8. Патогенез менингококковой инфекции
Рис. 3-8. Патогенез менингококковой инфекции
В других случаях возбудитель вызывает катаральные изменения в месте его внедрения (в носоглотке). Вследствие проникновения в кровь ЛПС-комплекса менингококка у больных возможны легкие проявления синдрома интоксикации, длящиеся в среднем не более 2-3 дней. Это состояние классифицируют как острый менингококковый назофарингит. В редких случаях интоксикация может быть выраженной, проявляться значительным повышением температуры тела и проникновени-
ем бактерий в кровоток, что расценивают как переходный вариант от локализованной формы заболевания к генерализованной.
У части больных возможен прорыв менингококка через защитные барьеры, в результате чего развиваются выраженная бактериемия и интоксикация, связанная с массовым выделением ЛПС-комплекса при распаде возбудителей. Генерализации менингококковой инфекции способствуют другие патогенные микроорганизмы - вирус гриппа, ВПГ, грамположительные кокки. С кровотоком менингококки диссеминируют в различные органы и системы. В местах оседания возбудителя формируются очаги гнойного воспаления. Развивается сепсис, известный как менингококцемия. Массивная бактериемия и высокая концентрация ЛПС-комплексов угнетают фагоцитарную активность нейтрофилов, что, с одной стороны, обусловливает незавершенность фагоцитоза, а с другой - облегчает транспортировку нейтрофилами бактерий по организму. Накопление ЛПС-комплекса ведет к активации макрофагов и усиленному синтезу провоспалительных цитокинов (прежде всего ФНО и ИЛ-Ιβ). Под воздействием ЛПС-комплекса резко интенсифицируется циклооксигеназный путь метаболизма арахидоновой кислоты и образуется повышенное количество простаноидов. Высокая активность тромбоксана А2 ведет к массивной агрегации тромбоцитов и к нарушениям реологических свойств крови, развитию ДВС-синдрома, тромбообразованию в мелких капиллярах и расстройствам микроциркуляторных механизмов. Угнетается тканевое дыхание, развивается клеточная гипоксия, что приводит к функциональным нарушениям в жизненно важных органах (мозге, сердечно-сосудистой системе, печени, почках и др.). Эндотоксинемия, сопровождающаяся повреждением эндотелия сосудов и нарушением реологических свойств крови, приводит к развитию множественных кровоизлияний (в слизистых оболочках, коже, надпочечниках).
Развиваются нарушения центральной гемодинамики, шунтирование крови в малом круге кровообращения; при этом тканевая гипоксия усиливается. Наибольшую опасность представляют расстройства системы управления жизненно важными функциями организма, что расценивают как ИТШ (рис. 3-9).
Возможно проникновение менингококков из крови в мягкую и паутинную мозговые оболочки путем преодоления гематоэнцефалического барьера. Не исключена возможность поступления возбудителя в субарахноидальное пространство периневрально через отверстия решетчатой кости. В субарахноидальном пространстве развивается гнойное
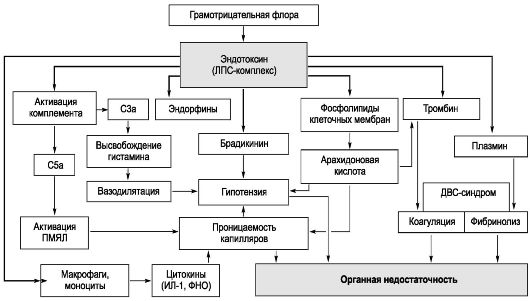 Рис. 3-9. Патогенез
инфекционно-токсического шока (ИТШ): ПМЯЛ - полиморфно-ядерные
лейкоциты; ИЛ - интерлейкин; ФНО - фактор некроза опухоли.
Рис. 3-9. Патогенез
инфекционно-токсического шока (ИТШ): ПМЯЛ - полиморфно-ядерные
лейкоциты; ИЛ - интерлейкин; ФНО - фактор некроза опухоли.
воспаление, периваскулярно распространяющееся на вещество мозга, сосудистое сплетение желудочков мозга, влагалища черепных нервов, оболочки спинного мозга. Воспалительный процесс вызывает чрезмерное образование спинномозговой жидкости, ведущее к внутричерепной гипертензии.
Вследствие нарушения микроциркуляции в головном мозге повышается проницаемость гематоэнцефалического барьера, развивается гипоксия мозга, нарастает гидрофильность нейтрофилов и глиальных клеток. Наблюдают повышенное поступление жидкости в клетки мозга, что ведет к их набуханию. Как следствие набухания возможно ущемление ствола мозга в большом затылочном отверстии с развитием соответствующей клинической симптоматики.
В патогенезе генерализованных форм менингококковой инфекции помимо бактериемии и интоксикации существенную роль играет развитие ГЗТ. Состояние выражается в накоплении циркулирующих иммунных комплексов (ЦИК), обусловливающих клиническую картину миокардитов, перикардитов, артритов.
Клиническая картина
В соответствии с общепринятой клинической классификацией менингококковой инфекции выделяют следующие ее формы.
• Первично-локализованные формы:
◊ менингококковыделительство;
◊ острый назофарингит;
◊ пневмония.
• Гематогенно-генерализованные формы:
◊ менингококцемия: <8> типичная;
<8> молниеносная; <8> хроническая;
◊ менингит;
◊ менингоэнцефалит;
◊ смешанная форма (менингококцемия и менингит);
◊ редкие формы (эндокардит, артрит, иридоциклит). Выделителей менингококка обычно обнаруживают при массовом
обследовании в очаге менингококковой инфекции, а также случайно при взятии мазков со слизистой оболочки носоглотки. Клинически выявить носителей невозможно из-за отсутствия каких-либо симптомов.
Острый назофаринтит
Среди всех клинических форм менингококковой инфекции наиболее часто встречают острый назофарингит. Клиническая расшифровка менингококкового назофарингита чрезвычайно затруднена из-за сходства симптоматики с назофарингитами другой этиологии.
Инкубационный период при этой форме варьирует в пределах 1-10 дней, но чаще составляет 3-5 сут. Обычно заболевание начинается остро, больные жалуются на кашель, першение и боли в горле, заложенность носа и насморк со слизисто-гнойным отделяемым. Катаральные проявления сопровождают головная боль и повышение температуры тела от субфебрильных до высоких величин. В некоторых случаях возможны боли в суставах.
Лицо больного обычно бледное, при осмотре выявляют гиперемию миндалин, мягкого нёба и дужек. Достаточно характерны гиперемия и зернистость задней стенки глотки, покрытой слизисто-гнойным отделяемым. В некоторых случаях пальпируют несколько увеличенные и болезненные подчелюстные лимфатические узлы. Характерна тахикардия.
Заболевание продолжается не более 1-3 дней, хотя иногда гиперплазия фолликулов может сохраняться 1-2 нед. В подавляющем большинстве случаев заболевание заканчивается полным выздоровлением.
Однако следует обратить внимание, что иногда эта форма может приобретать достаточно тяжелое течение с развитием выраженного синдрома интоксикации:
- резкой головной болью;
- выраженной температурной реакцией;
- кратковременной менингеальной симптоматикой;
- мимолетными геморрагическими высыпаниями на коже.
Менингококковая пневмония
Менингококковую пневмонию встречают крайне редко. Она может быть очаговой или долевой, обычно с тяжелым течением. Этиологическая диагностика возможна только при обнаружении возбудителя в мокроте.
Менингококцемия (менингококковый сепсис)
В большинстве случаев менингококцемия отличается тяжелым течением и развивается после предшествовавшего назофарингита, иногда - на фоне полного здоровья. Острое начало заболевания проявляется ознобом и повышением температуры тела, достигающей за несколько
часов 40-41 °С, головной болью, неукротимой рвотой, болями в мышцах спины и конечностей.
При осмотре больного отмечают бледность лица с цианотичным оттенком, одышку, тахикардию. Выражена склонность к значительному снижению АД, иногда вплоть до коллапса. Очень рано развивается олигурия или анурия, в моче повышается количество белка, лейкоцитов и эритроцитов, также появляются цилиндры. В крови нарастают показатели креатинина и мочевины.
Опорный клинический признак, наводящий на мысль о менингококцемии, - экзантема (см. рис. 8 на цветной вклейке). Она обычно появляется в 1-е сутки заболевания (в течение 5-15 ч от начала болезни), реже высыпания образуются на 2-е сут. Сыпь чаще располагается на ягодицах, нижних конечностях, в подмышечных впадинах, на верхних веках и имеет тенденцию к слиянию. Типичные геморрагические элементы различной величины имеют неправильные очертания звездчатого характера, плотные на ощупь. Чем больше выражены бактериемия и интоксикация, тем многочисленнее и крупнее элементы сыпи. В этих случаях экзантема может принять генерализованный характер, располагаясь на любом участке тела. Крупные элементы сыпи подвергаются некрозу. При их обратном развитии могут образовываться язвенно-некротические поверхности на ушных раковинах, кончике носа, дистальных отделах конечностей.
Геморрагический синдром при менингококцемии проявляется кровоизлияниями на конъюнктивах, склерах и слизистой оболочке ротоглотки. При более тяжелом течении развиваются носовые, желудочные, почечные и маточные кровотечения.
Уже на ранних сроках болезни могут появиться признаки поражения суставов. При этом в первые дни заболевания обычно возникают поражения мелких суставов кисти, а на 2-й неделе болезни - крупных суставов. Суставная жидкость может носить серозно-гнойный характер, однако выделить из нее возбудитель, как правило, не удается. В более тяжелых и запущенных случаях экссудат носит гнойный характер, в нем обнаруживают менингококки.
Отличительная черта менингококцемии, позволяющая проводить клиническую дифференциальную диагностику с другими септическими состояниями, - отсутствие гепатолиенального синдрома.
Тяжелое проявление менингококцемии, нередко с летальным исходом, - молниеносная форма, характеризующаяся развитием ИТШ уже в первые часы заболевания.
Хроническое течение менингококцемии наблюдают редко. Характерны длительная интермиттирующая лихорадка, полиморфные высыпания на коже, артриты и полиартриты, развитие гепатолиенального синдрома.
Менингококковый менингит
Менингококковый менингит, так же как и менингококцемия, чаще развивается после клинических проявлений назофарингита. Заболевание начинается остро с подъема температуры тела до высоких значений и развития общемозговых симптомов - резкой мучительной головной боли, часто неукротимой рвоты без тошноты, не связанной с приемом пищи.
При осмотре больных отмечают их возбуждение, эйфорию, в части случаев уже в первые часы заболевания наступает расстройство сознания. Характерна гиперемия лица, нередки герпетические высыпания на губах. Отмечают гиперестезию (тактильную, слуховую и зрительную), возможны мышечные судороги. Выражены тахикардия, артериальная гипотензия, задержка мочеотделения.
В тяжелых случаях заболевания больной принимает характерную вынужденную позу. Он лежит на боку с запрокинутой головой и притянутыми к животу ногами, согнутыми в тазобедренных и коленных суставах (положение взведенного курка). Эту симптоматику, довольно часто встречавшуюся до эры антибиотикотерапии, в настоящее время наблюдают лишь в запущенных случаях.
Рано, уже в 1-е сутки болезни, появляются тоническое напряжение мышц и мышечные контрактуры - ригидность затылочных мышц и длинных мышц спины, симптомы Кернига, Брудзинского и др. Для детей грудного возраста указанные менингеальные симптомы нетипичны, можно наблюдать лишь выбухание и напряжение большого родничка, а также симптомы подвешивания и треножника. Отмечают повышение сухожильных рефлексов, расширение рефлексогенных зон. Нередко менингеальные симптомы сочетаются с признаками поражения черепных нервов.
Наиболее тяжелое течение менингококкового менингита наблюдают при молниеносном варианте с набуханием и отеком головного мозга, а также при синдромах церебральной гипотензии и эпендиматита (вентрикулита).
При молниеносном течении менингита уже с первых часов заболевания можно наблюдать развитие отека и набухания головного мозга с возможным вклинением головного мозга в большое затылочное отверстие. Клиническое описание этого состояния приведено в разделе «Осложнения».
У детей младшего возраста менингит может сопровождаться синдромом церебральной гипотензии. У взрослых данное состояние в редких слу-
чаях бывает результатом усиленной дегидратации либо проведения лечебных мероприятий. Уже с самого начала заболевания наблюдают быстрое нарастание признаков токсикоза и эксикоза, ступора, усиление рвоты, судорог. Наблюдают снижение рефлексов, мышечную гипотонию. У детей до года можно обнаружить западение большого родничка. Трудности диагностики в этих случаях связаны с тем, что при развитии синдрома церебральной гипотензии, как правило, не выражена менингеальная симптоматика. При люмбальной пункции давление ликвора резко снижено, он вытекает редкими каплями и имеет гнойный характер.
При распространении воспалительного процесса на эпендиму может возникнуть синдром эпендиматита. Клинически он проявляется неукротимой рвотой, мышечными судорогами и тотальной ригидностью мышц. Больные принимают вынужденную позу с вытянутыми ногами, перекрещенными в стопах, и вытянутыми, сжатыми в кулаки руками. Наблюдают расстройства психики, сонливость. Температура тела чаще нормальная. При прогрессировании эпендиматита развиваются кахексия и гидроцефалия. Больные чаще погибают на фоне расстройств дыхания и сердечно-сосудистой деятельности.
Менингококковый менингоэнцефалит
Понятие «менингококковый менингит» весьма условно, поскольку вследствие тесной анатомической связи между оболочками и веществом мозга воспалительный процесс часто переходит на мозговую ткань. При менингоэнцефалите в клинической картине заболевания обычно отмечают быстрое нарастание психических нарушений, сонливость, развитие стойких параличей и парезов. Менингеальная симптоматика при этом может быть выражена довольно слабо. Определяют характерные для поражения вещества мозга патологические рефлексы - Бабинского, Оппенгейма, Россолимо, Гордона и др.
Смешанная форма
К генерализованным формам относится и смешанная форма (менингококцемия в сочетании с менингитом). Клинически она характеризуется сочетанием симптоматики этих двух состояний.
Дифференциальная диагностика
Менингококковый назофарингит имеет сходные клинические признаки с поражениями носоглотки другой этиологии. В этих случаях дифференциальная диагностика невозможна без бактериологического обследования.
Менингококковый сепсис дифференцируют с сепсисом другой этиологии, а также гриппом, лептоспирозом, ПТИ, геморрагическими лихорадками, сыпным тифом, геморрагическим васкулитом, токсикоаллергическим медикаментозным дерматитом. Опорные клинические признаки, наводящие на мысль о менингококцемии, - характерная экзантема и отсутствие гепатолиенального синдрома.
Менингококковый менингит следует отличать от других заболеваний и состояний с менингеальным синдромом:
- менингизма;
- туберкулезного менингита;
- менингитов вирусного и бактериального происхождения;
- острого нарушения мозгового кровообращения;
- субарахноидального кровоизлияния;
- эндогенных и экзогенных интоксикаций;
- коматозных состояний (кома диабетическая, печеночная, уремическая).
Для окончательной дифференциальной диагностики необходима поясничная пункция с исследованием полученной жидкости.
Лабораторная диагностика
Используют бактериологический (с выделением и идентификацией возбудителя) и серологический [с выявлением специфических Аг в жидкостях организма (ликворе, крови и др.) или АТ в сыворотке крови] методы. Изменения гемограммы при назофарингитах незначительны.
Вместе с тем при генерализованных формах менингококковой инфекции с большим постоянством наблюдают:
- высокий лейкоцитоз;
- нейтрофилию с большим количеством юных форм;
- увеличение СОЭ.
Менингококковый назофарингит подтверждают высевом и идентификацией менингококка из полости носа и ротоглотки. При генерализованных формах делают посевы крови и спинномозговой жидкости на питательные среды, содержащие человеческий белок. Возможна прямая микроскопия спинномозговой жидкости с обнаружением в ней внутриклеточно расположенных диплококков.
При менингеальном синдроме основным исследованием с целью дифференциальной диагностики становится спинномозговая пункция, проводимая с согласия больного или его родственников. Данные лабо-
Таблица 3-7. Основные показатели цереброспинальной жидкости в норме, при менингизме, различных формах менингита и субарахноидальном кровоизлиянии (Покровский В.И.)
Показатели | Норма | Патология | |||
Менингизм | Менингиты | Субарахноидальное кровоизлияние | |||
серозные вирусные | гнойные бактериальные | ||||
Цвет, прозрачность | Бесцветная, прозрачная | Бесцветная, прозрачная | Бесцветная, прозрачная или опалесцирующая | Мутная | Кровянистая, со 2-го дня болезни - ксантохромная |
Цитоз, х109/л | До 0,01 | До 0,01 | 0,2-6,0 | 1,0-5,0 | В первые дни болезни определить невозможно из-за большого количества эритроцитов; с 5-7-го дня болезни - 0,015- 0,1, преобладают лимфоциты |
Цитограмма | - | - | - | - | - |
Лимфоциты | 80-85 | 80-85 | 80-100 | 0,6 | - |
Нейтрофилы | 3-5 | 3-5 | 0-20 | 40-100 | - |
Белок, г/л | 0,25-0,33 | 0,16-0,45 | 0,16-1,0 | 0,66-16,0 | 0,66-16,0 |
Осадочные реакции (Панди, Нонне-Апельта) | Отрицательные | Отрицательные | Слабоположительные | Положительные | Положительные |
Фибриновая пленка | Отсутствует | Отсутствует | Наблюдается в 3-5% случаев | Постоянная, грубая, чаще в виде осадка | Наблюдается редко |
Глюкоза | 1/2 от концентрации в крови (2,5- 3 ммоль/л) | Норма | Норма | Снижена | Норма или повышена |
раторного анализа ликвора при менингококковом менингите и сходных с ним клинических состояниях приведены в табл. 3-7.
В случаях менингококкового (гнойного) менингита спинномозговая жидкость мутная, цитоз достигает нескольких тысяч в 1 мкл со значительным преобладанием клеток нейтрофильного ряда.
Определяют высокое содержание белка, положительные осадочные пробы, сниженное количество глюкозы. В ряде случаев в пробирке с жидкостью образуется грубая пленка на поверхности жидкости или дне пробирки.
Методы иммунологической диагностики (выявление Аг менингококков в ИФА, РЛА и АТ к ним с помощью РНГА) имеют вспомогательное значение - их применяют для определения серотипа возбудителя.
Осложнения и исходы
Инфекционно-токсический шок
Наиболее тяжелое и опасное осложнение, развивающееся при генерализованных формах менингококковой инфекции, - ИТШ.
В соответствии с классификацией В.И. Покровского (1976) выделяют 3 степени шока, клинические признаки которых представлены в табл. 3-8.
Таблица 3-8. Менингококковая инфекция: инфекционно-токсический шок
Признак | Степень шока | ||
I (компенсированная) | II (субкомпенсированная) | III (декомпенсированная) | |
Начало болезни | Бурное, острое | ||
Состояние больного | Тяжелое | Очень тяжелое | Крайне тяжелое |
Кожный покров | Бледность, акроцианоз | Бледность, акроцианоз, гиперестезия | Тотальный цианоз, гипотермия, анестезия |
Сыпь | Множественная плотная геморрагическая, мелкая, расположенная на коже и конъюнктивах, быстро увеличивающаяся в размерах | Множественная плотная геморрагическая, крупная с некрозами, расположенная на коже и конъюнктивах | Множественные крупные геморрагическинекротические элементы на коже и конъюнктивах |
Окончание табл. 3-8
Признак | Степень шока | ||
I (компенсированная) | II (субкомпенсированная) | III (декомпенсированная) | |
Температура тела | Повышена или понижена | Нормальная | Понижена |
Мышечные и суставные боли | Выражены | Отступают на задний план | Отступают на задний план |
Одышка Умеренная Выраженная Выраженная | |||
Пульс | Тахикардия | Тахикардия, пульс слабого наполнения | Пульс нитевидный или не определяется |
АД | Нормальное или несколько повышено | Снижено: 80/60- 60/20 мм рт.ст. | 50/0 мм рт.ст. |
Диурез | Снижен | Олигурия или анурия | Анурия |
Состояние психики | Психомоторное возбуждение | Психомоторная заторможенность, бред, галлюцинации | Прострация при отеке мозга, судороги |
рН и водноэлектро- литный баланс | Компенсированный метаболический ацидоз и гипокалиемия | Декомпенсированный метаболический ацидоз, гипокалиемия, гипоксемия | Декомпенсированный метаболический ацидоз, гипокалиемия, гипоксемия |
Примечание.
Нарушения взаимоотношений свертывающей и противосвертывающей систем; ЛПС-комплекс менингококков приводит к ИТШ, редко - к развитию ДВСсиндрома
• Шок I степени (компенсированный). Общее состояние тяжелое, но сознание ясное. Отмечают возбуждение, двигательное беспокойство. Больные жалуются на боли в мышцах, животе, суставах. Бледность кожных покровов, цианоз губ и акроцианоз, гиперестезия. Умеренная одышка, тахикардия. АД в пределах нормы или повышено. Диурез снижен.
• Шок II степени (субкомпенсированный). Больной перестает предъявлять жалобы, развиваются заторможенность, безразличие, эйфория. Нарастают бледность, гиперестезия, цианоз становится разлитым. Температура тела снижается до нормальной. Пульс слабый, усиливается тахикардия, тоны сердца глухие, значительно снижается АД (80-60 мм рт.ст.). Олигурия или анурия.
• Шок III степени (декомпенсированный). Сознание может быть сохранено, но возможны бред и галлюцинации. При отеке мозга - потеря сознания, судороги. Тотальный цианоз, гипотермия, анестезия. Глубокий коллапс: пульс на лучевой артерии отсутствует или нитевидный, АД может не определяться. Анурия.
Синдром острого отека и набухания мозга
При развитии синдрома острого отека и набухания мозга сначала появляются признаки межклеточной гипергидратации (отека мозга). Нарастает головная боль, отмечают нарушения сознания, двигательное беспокойство, судороги, расстройства дыхания и сердечно-сосудистой деятельности, временную артериальную гипертензию, повышение давления ликвора, рвоту, непроизвольное мочеиспускание. При прогрессировании состояния с внутриклеточным накоплением жидкости (набуханием мозга) отмечают гиперемию лица, цианоз, патологические рефлексы, сужение зрачков и вялость их реакции на свет, снижение частоты сердечных сокращений, нарушения сердечного ритма. Четкая клиническая граница между симптоматикой отека и признаками набухания мозга отсутствует.
При возможном смещении мозга вдоль церебральной оси развивается синдром вклинения миндалин мозжечка в большое затылочное отверстие со сдавлением продолговатого мозга. Состояние проявляется нарастанием цианоза, мышечными судорогами, угасанием корнеальных рефлексов, развитием гемипарезов, брадикардией или тахикардией, лабильностью АД со склонностью его к снижению. Возникают нарушения ритма дыхания, а затем его остановка. Через несколько минут прекращается работа сердца.
Острая почечная недостаточность
К осложнениям менингококковой инфекции также относят ОПН. Наблюдают стойкую олигурию или анурию (даже после восстановления АД), вновь появляются тошнота и рвота, возможен жидкий стул. Кожные покровы приобретают бледно-серый оттенок, становятся сухими на ощупь. Нарастают одышка и тахикардия. В крови определяют повы-
шенную концентрацию азотистых веществ. Повышается содержание белка в моче, в осадке выявляют большое количество эритроцитов, лейкоцитов, цилиндров.
Другие осложнения
Течение заболевания могут осложнять:
- острая сердечно-сосудистая недостаточность;
- острая надпочечниковая недостаточность (синдром Уотер- хауса-Фридерихсена ).
Лечение
При назофарингитах, подтвержденных высевом менингококка со слизистой оболочки ротоглотки, назначают перорально левомицетин или рифампицин в средних терапевтических дозах в течение 4-5 сут, а также полоскание горла дезинфицирующими растворами. При повторном выделении возбудителя рекомендуют кварцевание (тубускварц).
Больные с генерализованными формами менингококковой инфекции подлежат госпитализации вследствие тяжести состояния и быстроты прогрессирования симптоматики. На догоспитальном этапе больным менингококковым менингитом рекомендовано ввести 1-ю дозу антибиотика, анальгетики и лазикс внутривенно или внутримышечно (в случае отсутствия признаков дегидратации и частой рвоты). При состоянии, осложненном ИТШ или отеком-набуханием мозга, во время транспортировки больного в стационар целесообразно по показаниям использовать противосудорожные средства, проводить оксигенотерапию, начать внутривенное введение реополиглюкина, инфузионных кристаллоидных растворов с добавлением преднизолона в дозе до 5 мг/кг.
Наиболее эффективным антибактериальным средством при менингококковом менингите остается бензилпенициллин. Для преодоления гематоэнцефалического барьера и создания достаточной концентрации антибиотика в спинномозговой жидкости назначают массивные дозы: суточное количество антибиотика назначают из расчета 200 000- 400 000 ЕД/кг при 6-кратном внутримышечном введении. Внутривенно антибиотик вводят каждые 2 ч, при этом его суточная доза должна быть увеличена на 1/3.
Эффективными этиотропными препаратами признаны ампициллин в суточной дозе 200-400 мг/кг и цефалоспорины III поколения (цеф-
триаксон, цефтриаксим) в максимальных дозах. Эти антибиотики рекомендуют использовать при неясной этиологии менингита.
Растворимую форму левомицетина (левомицетин-сукцинат) в дозе 10-50 мг/кг в сутки достаточно широко применяют при менингококцемии и в случаях ИТШ в силу бактериостатического действия препарата. Однако в последнее время отмечают рост резистентности возбудителя к этому лекарственному средству. Альтернативные антимикробные препараты при генерализованных формах менингококковой инфекции - ампициллин (по 200-400 мг/кг в сутки) и фторхинолоны.
Показатели эффективности лечения менингококкового менингита - нормализация температуры тела и улучшение состояния больного, наступающие через 1-4 дня с момента начала лечения. На 5-6-е сутки лечения необходим контроль спинномозговой жидкости. Основной критерий, дающий основание для прекращения антибиотикотерапии, - снижение цитоза до 100 в 1 мкл ликвора с преобладанием лимфоцитов (70% и более). Содержание белка в ликворе может оставаться увеличенным. При менингоэнцефалите лечение пролонгируют еще на 3-4 дня.
Одновременно с этиотропным проводят интенсивное патогенетическое лечение в виде внутривенных инфузий:
- глюкозы;
- кристаллоидных полиионных растворов;
- макромолекулярных коллоидных растворов. Регидратацию следует сопровождать форсированным диурезом, для
чего применяют салуретики - фуросемид, диакарб, урегит в течение 5-6 дней. По показаниям назначают анальгетики, снотворные и седативные препараты.
В случае осложнения менингококковой инфекции ИТШ лечение больного проводят в отделении реанимации. Назначают левомицетинсукцинат (см. выше), внутривенно преднизолон в дозе 5-10 мг/кг, раствор бикарбоната натрия (с целью коррекции ацидоза), свежезамороженную плазму, альбумин или реополиглюкин, а затем - внутривенные инфузии полиионных изотонических растворов и поляризующей смеси. Показана оксигенотерапия, при выраженной дыхательной недостаточности - ИВЛ. Эффективны плазмаферез и ультрафильтрация плазмы.
При остром отеке-набухании мозга антибактериальное лечение комбинируют с форсированным диурезом (салуретики, 10-20% раствор альбумина) с последующим введением полиионных растворов. Приме-
нение гипертонических растворов глюкозы, мочевины и маннитола противопоказано в связи с возможным развитием синдрома отдачи при диффузии этих препаратов через гематоэнцефалический барьер. Назначают глюкокортикоиды (дексаметазон в дозе 0,25-0,5 мг/кг в сутки), ингаляции 30% кислородно-воздушной смеси. Показания к применению ИВЛ:
- коматозное состояние;
- судороги;
- дыхательная недостаточность.
Широкое распространение получили препараты, улучшающие микроциркуляцию (трентал), а также противосудорожные средства, антиоксиданты и антигипоксанты.
При острой надпочечниковой недостаточности внутривенно вводят глюкокортикоиды в дозах, необходимых для поддержания АД.
Эпидемиологический надзор
Эпидемиологический надзор включает не только наблюдение за заболеваемостью и летальностью в различных социально-возрастных группах населения, но и изучение факторов, способствующих распространению инфекции (иммунологической структуры населения, биологических свойств и антигенной структуры возбудителя, социальных и природных факторов). Большое значение имеют эпидемиологический анализ и оценка эффективности проведенных мероприятий, прогнозирование интенсивности эпидемического процесса менингококковой инфекции на конкретной территории.
Для краткосрочного (на 2-3 года) прогнозирования эпидемиологической ситуации могут быть использованы следующие признаки подъема заболеваемости:
- общий рост заболеваемости по сравнению с предшествующим периодом;
- преимущественное выделение из крови и ликвора больных одной (ведущей) серогруппы менингококка (А, В, С и др.);
- рост заболеваемости среди подростков и взрослых;
- появление очагов с множественными случаями генерализованных форм менингококковой инфекции в круглосуточных группах ДДУ и коллективах юношей;
- увеличение уровня носительства менингококка одной из ведущих серогрупп;
- увеличение удельного веса лиц, в сыворотках крови которых противоменингококковые АТ определяются в титре 1:40 и выше по сравнению с предыдущими 2-3 годами (как отражение активизации циркуляции менингококка).
Профилактические мероприятия
Вялое развитие эпидемического процесса, значение скученности и длительности общения в распространении инфекции требуют соблюдения общего санитарно-гигиенического режима в организованных коллективах детей и взрослых. В период сезонного подъема заболеваемости целесообразно ограничение культурных и спортивных мероприятий. Важные профилактические меры - выявление, санация больных и носителей менингококков.
Показанием к профилактической иммунизации служит выявление очевидных признаков эпидемиологического неблагополучия, увеличение заболеваемости городских жителей в 2 раза по сравнению с предыдущим годом или при резком подъеме заболеваемости свыше 20 на 100 000 населения. При угрозе эпидемического подъема менингококковой инфекции вакцинопрофилактике в первую очередь подлежат:
- дети от 1,5 года до 8 лет включительно;
- учащиеся первых курсов средних и высших учебных заведений;
- лица, прибывшие с разных территорий Российской Федерации, стран ближнего и дальнего зарубежья и объединенные совместным пребыванием в общежитиях.
При резком подъеме заболеваемости (свыше 20 на 100 000 населения) проводится массовая вакцинация всего населения с охватом не менее 85%. Повторную вакцинацию проводят не чаще 1 раза в 3 года. Специфическую профилактику проводят менингококковой вакциной (моно- и дивакциной), содержащей полисахаридные Ag менингококков А и С. Она вызывает нарастание АТ и защиту от болезни с 5-го дня после однократного введения, а через 2 нед иммунитет достигает максимального уровня и сохраняется в течение 2 лет. Вакцина против менингита В представляет собой очищенные белковые Ag, выделенные из менингококка группы В, соединенные со специфическим полисахаридом менингококка группы С. Эффективность 2-кратной прививки вакциной В составляет 83-98%. Применение той или иной вакцины оправдано только после предварительного определения серогрупповой принадлежности циркулирующего штамма возбудителя. Детям до
1,5 года с целью экстренной профилактики менингококковой инфекции проводят химиопрофилактические мероприятия с использованием рифампицина, азитромицина, спирамицина.
Мероприятия в эпидемическом очаге
Госпитализации подлежат все больные с генерализованной формой инфекции. Лица с бактериологически подтвержденными назофарингитами также нуждаются в госпитализации по эпидемиологическим показаниям. Изоляция на дому допустима при отсутствии в семье детей дошкольного возраста и взрослых, работающих в ДДУ. Выписку реконвалесцентов из стационара проводят только после клинического выздоровления и отрицательного бактериологического исследования слизи из носоглотки, проведенного не ранее 3 дней после окончания лечения. Переболевших допускают в ДДУ, школы, школы-интернаты, общежития после одного отрицательного результата бактериологического исследования, проведенного не ранее 5 дней после выписки из стационара или выздоровления больного назофарингитом, оставшегося на дому. Переболевшие генерализованными формами менингококковой инфекции должны находиться на диспансерном наблюдении у врачаневропатолога в течение 2-3 лет с периодичностью осмотров 1 раз в 3 мес в течение первого года, в последующем - 2 раза в год.
Все лица, общавшиеся с больными, подлежат медицинскому наблюдению в течение 10 дней. Особое внимание уделяют выявлению лиц с хроническими и острыми воспалительными признаками в носоглотке. Обследование на носительство проводят дифференцированно. В ДДУ двукратно обследуют детей, бывших в общении с больными, и весь обслуживающий персонал, в школах - учащихся и преподавателей классов, где отмечены случаи заболевания. В школах-интернатах с круглосуточным пребыванием детей обследованию подлежит как персонал, так и ученики, общавшиеся с больным в классе и спальных помещениях. В средних и высших учебных заведениях обследуют учащихся и преподавателей на 1-м курсе, на старших курсах - общавшихся с больным в учебной группе и общежитии. В других организованных коллективах обследуют лиц, живущих в общежитии, в домашних очагах - всех общавшихся с больным. Выявленным носителям и больным назофарингитом проводят санацию антибиотиками (рифампицин, азитромицин, спирамицин) в течение 4 дней амбулаторно или в стационаре. Неустойчивость возбудителя во внешней среде не требует дезинфекции в очаге.
ГРИПП (GRIPPUS)
Грипп - острая респираторная антропонозная инфекция, вызываемая вирусами типов А, В и С, протекающая с развитием интоксикации и поражением эпителия слизистой оболочки верхних дыхательных путей, чаще трахеи. Заболевание склонно к быстрому и глобальному распространению.
Краткие исторические сведения
Впервые заболевание описано Э. Паскье (1403). С этого времени зарегистрировано 18 пандемий гриппа, преобладающая часть которых зарождалась на Азиатском континенте. Вирусная этиология заболевания (вирус гриппа типа А) установлена в 1931 - 1936 гг. (В. Смит, К. Эндрюс, П. Лейдлоу, А.А. Смородинцев, Л.А. Зильбер). Позднее Т. Френсис и Т. Меджилл выделили вирус гриппа типа В (1940), а Р. Тейлор - вирус типа С (1947).
Этиология
Возбудитель - РНК-геномный вирус рода Influenzavirus семейства Orthomyxoviridae. Известно 3 типа вирусов - А, В, С. Тип вируса определяет набор внутренних Аг, проявляющих слабую иммуногенность. Вирусы гриппа типа А поражают человека, некоторые виды животных (лошадей, свиней и др.) и птиц. Вирусы гриппа типов В и С патогенны только для людей.
Поверхностные Аг вирусов гриппа - гемагглютинин и нейраминидаза. Они играют важную роль в формировании иммунного ответа организма при гриппе и позволяют разделить вирус гриппа типа А на подтипы H1N1, H3N2 и др. Вирус типа А обладает наиболее выраженными вирулентными свойствами и склонен к эпидемическому распространению.
Из трех известных типов вирус гриппа А выступает наиболее патогенным и инфицирует разнообразные виды животных, включая свиней, лошадей, морских млекопитающих и птиц, периодически вызывая пандемии в человеческой популяции. Дальнейшее разделение вируса гриппа А на субтипы основано на антигенных свойствах 2 поверхностных гликопротеинов - гемагглютинина (Н) и нейраминидазы (N). В настоящее время известны 16 вариантов гемагглютининов (H1-H16) и
9 вариантов нейраминидаз (N1-N9). Только вирусы гриппа А вызывают инфекции птиц. Все известные на сегодняшний день комбинации из гемагглютининов (H1-H16) и нейраминидаз (N1-N9) гриппа были изолированы от птиц. Вирусы гриппа А, инфицирующие домашнюю птицу, могут быть разделены на 2 группы на основе их патогенности. Высоковирулентные вирусы вызывают «птичью чуму» - высокопатогенный птичий грипп (highlypathogenic avian influenza - HPAI), при которой смертность достигает 100%. Эти вирусы ограничены Н5, Н7 и Н9 субтипами, хотя не все штаммы этих субтипов вызывают HPAI. Все другие субтипы вируса, вызывающие более слабую форму респираторного заболевания, обозначаются как низкопатогенный птичий грипп ( LPAI). Впервые вирус высокопатогенного птичьего гриппа субтипа H5N1 был выделен от цыпленка в 1959 г. в Шотландии.
Особенность вирусов гриппа - их способность к антигенной изменчивости. Она может реализовываться путем дрейфа (частичная изменчивость антигенных детерминант) или шифта (полное замещение фрагмента генома, кодирующего синтез гемагглютинина или нейраминидазы). Наиболее часто дрейф происходит у вируса гриппа типа А, но встречается и у типа В. Антигенный шифт - это специфическая особенность вируса гриппа типа А, приводящая к появлению его новых подтипов. Высокая изменчивость вирусов гриппа объясняет непредсказуемость эпидемий заболевания. Вирус типа С менее изменчив и вызывает лишь небольшие эпидемические вспышки.
Вирус гриппа может сохраняться при температуре 4 °С в течение 2-3 нед, прогревание при температуре 50-60 °С вызывает инактивацию вируса в течение нескольких минут, дезинфектанты быстро инактивируют вирус (рис. 3-10).
Эпидемиология
Резервуар и источник инфекции - человек с явными и стертыми формами болезни. Эпидемиологическую опасность больного человека определяют количество вирусов в отделяемом верхних дыхательных путей и выраженность катарального синдрома. Контагиозность максимальна в первые 5-6 дней болезни. Длительное выделение вируса наблюдают у немногих больных с тяжелым или осложненным течением заболевания. Эпидемиологическое значение скрытого вирусоносительства при гриппе не доказано. Вирус серотипа А выделен также от свиней, лошадей и птиц. Основные носители вируса гриппа птиц в природе - дикие птицы
 Рис. 3-10. Схематическая структура вируса гриппа
Рис. 3-10. Схематическая структура вируса гриппа
околоводного комплекса (в основном представители отряда гусеобразных, ржанкообразных, чайкообразных и аистообразных). Зарегистрировано более 100 видов птиц из 15 отрядов, спонтанно зараженных этой инфекцией. Из домашних птиц основная роль в качестве носителей вируса H5N1 принадлежит уткам и гусям, которые зачастую сами не болеют или переносят инфекцию в легкой форме, но выделяют вирус в окружающую среду в большом количестве. Возможность спорадического заражения человека вирусом гриппа животных неоднократно четко документировали в отношении вируса гриппа свиней в США и во время локальной вспышки, вызванной птичьим вирусом гриппа А (Н5Ш) в Гонконге в 1997 г. В настоящее время существует предположение о роли перелетных птиц в эпидемическом процессе гриппа. Возможно, что при эпизоотии гриппа среди птиц, реже млекопитающих (свиней, лошадей и др.) формируются новые антигенные варианты вируса, поражающие затем человека.
Механизм передачи - аэрозольный, путь передачи - воздушнокапельный. Вирус выделяется с каплями слюны, слизи и мокроты при дыхании, разговоре, плаче, кашле и чихании. Сохранение вируса грип-
па в воздушной среде зависит от степени дисперсности аэрозоля, содержащего вирусные частицы, а также от воздействия на него света, влаги и нагревания. Не исключена возможность инфицирования бытовым путем через инфицированные предметы обихода. Основной путь передачи птичьего гриппа в природе - фекально-оральный. Вирусы в организме птиц локализуются в верхних дыхательных путях и кишечнике. Большое количество вирусов содержится в фекалиях инфицированных птиц, сохраняясь там до 3 мес. У птиц зарегистрирована также трансовариальная передача вирусов (птенцы вылупляются из яиц уже больными). Есть предположение о возможности трансмиссивного пути передачи вируса эктопаразитами птиц (комарами, пухоедами).
Естественная восприимчивость людей
Естественная восприимчивость людей высокая, но имеет индивидуальные колебания; восприимчивость к новым серотипам возбудителя особенно выражена. Материнские противогриппозные АТ выявляют у детей, находящихся на естественном вскармливании, до 9-10-го месяца, а у находящихся на искусственном - только до 2-3 мес. Однако они не в состоянии предохранить от заболевания. При вспышках гриппа в родильных домах новорожденные заболевают чаще и болеют тяжелее, чем их матери. Постинфекционный иммунитет при гриппе, вызванном вирусом типа А, длится 1-3 года, а вирусом типа В - 3-4 года. Формирующаяся клеточная иммунологическая память, особенно после повторного контакта с тем или иным подтипом вируса гриппа, сохраняется длительное время.
Основные эпидемиологические признаки
Болезнь распространена повсеместно и проявляется в виде вспышек и эпидемий, охватывающих значительную часть восприимчивого населения, что представляет серьезную социальную и медицинскую проблему. На долю гриппа и ОРВИ приходится 90-95% всех заболеваний инфекционной природы. Периодически (через каждые 2-3 года) возникают пандемии гриппа, связанные с формированием новых антигенных вариантов вируса. Главным образом это касается вируса гриппа А. Эпидемии гриппа В распространяются медленнее и поражают не более 25% населения. Грипп С регистрируют как спорадические случаи. Заболевания регистрируют в течение всего года, они значительно учащаются в осенне-зимний период, чему способствуют скученность населения и влияние климатических факторов. За последнее десятилетие в РФ ежегодно регистрируют от 27,3 до 41,2 млн заболевших этими инфекциями.
В 2007 г. в стране зарегистрировано более 27,68 млн случаев ОРВИ (2006 г. - 2,708 млн) и более 504 тыс. случаев гриппа (2006 г. - 503,8 тыс.). В 2007 г. ОРВИ переболело более 18,7 млн детей до 17 лет, что составляет 67,7% общего числа зарегистрированных случаев ОРВИ. Гриппом переболело соответственно 266,7 тыс. детей, или 52,9%. Заболеваемость детей до 17 лет ОРВИ возросла с 64 924,2 на 100 тыс. детей в 2006 г. до 68 225,8 в 2006 г. Уровень заболеваемости детей гриппом снизился на 4,4% с 1015,3 на 100 тыс. детей в 2006 г. до 970,9 в 2007 г. Введение вакцинации детей в детских дошкольных учреждениях, школах способствовало снижению распространения гриппа. Число детей в возрасте до 17 лет, вакцинированных против гриппа, возросло с 7995 тыс. в 2005 г. до 11678 тыс. в 2007 г. В 2007 г. в рамках приоритетного национального проекта в России привито против гриппа 25 081 904 человек (98,7% численности подлежащих). Кроме этого, за счет других источников финансирования вакцинировано еще 6 134 326 чел. Во всех субъектах Российской Федерации охват прививками против гриппа в рамках национального проекта составил 99-100%. Общий охват составил 21,91% численности населения страны (31 216 230 человек).
Смертность от самого гриппа невелика, однако смертность от гриппа, других ОРВИ и острой пневмонии, являющейся самым частым и опасным постгриппозным осложнением, у детей до 1 года составляет 30% общей смертности и 90% смертности от инфекционных болезней, а у детей до 2 лет - 15% общей смертности. Следует иметь в виду, что грипп отягощает течение хронических заболеваний, приводя к так называемым дополнительным соматическим заболеваниям и смертности населения, достигающей наибольших показателей по сердечно-сосудистым заболеваниям, нарушениям кровообращения мозга и поражениям легких. Экономические потери от гриппа составляют миллиарды рублей только за одну эпидемию. По данным ВОЗ, при ежегодных эпидемиях гриппа заболевает от 5 до 10% взрослых, от 20 до 30% детей, смертность составляет от 250 тыс. до 500 тыс. человек и экономический ущерб от 1 до 6 млн долларов США (на 100 тыс. населения).
Быстрому распространению гриппа способствуют короткий инкубационный период, аэрогенный путь передачи, высокая восприимчивость людей к гриппу, а также социальные условия жизни населения, в первую очередь характер современных транспортных средств, обеспечивающих быстрое передвижение населения и тесный контакт не только между соседними странами, но и между континентами. За последние 120 лет пандемии гриппа зарегистрированы в 1889, 1918, 1957 и 1968 гг.
В зависимости от места первичного распространения эпидемические варианты вируса гриппа получают обычно названия соответствующей географической территории или страны. Интенсификация механизма передачи возбудителя приводит к росту заболеваемости, увеличению частоты и тяжести эпидемий, увеличению частоты антигенных изменений вирусов гриппа и одновременной циркуляции нескольких антигенных вариантов. Происходит интенсивное проэпидемичивание населения и нарастание вследствие этого коллективного иммунитета, а при гриппе А за счет одновременной циркуляции разных сероподтипов вирусов и их вариантов - повышение качества иммунитета. Когда коллективный иммунитет достигает достаточно высокого уровня, интенсивность эпидемического процесса снижается.
С 1997 г. отмечают эпизоотии среди диких и домашних птиц, вызванных высокопатогенными вирусами гриппа А субтипа H5N1, способными вызывать также тяжелые заболевания среди людей с высокой летальностью. В последние годы происходит расширение ареала вируса гриппа птиц, увеличение видового спектра носителей, повышение вирулентности циркулирующих штаммов. Способность выживать в окружающей среде в течение длительного времени, особенно при низких температурах, обусловливает расширение ареала распространения вируса и необходимость проведения мероприятий по мониторингу на обширных территориях Российской Федерации.
Случаи передачи вируса гриппа А субтипа H5N1 от человека к человеку не зарегистрированы, хотя семейные очаги заболеваний отмечались неоднократно. Однако совместная циркуляция штаммов вирусов человеческого птичьего гриппа повышает вероятность события реассортации и возникновения пандемичного варианта вируса гриппа. По официальной информации ВОЗ, в 15 странах мира (Вьетнам, Китай, Индонезия, Камбоджа, Таиланд, Турция, Ирак, Азербайджан, Египет, Джибути, Нигерия, Лаос, Мьянмар, Бангладеш и Пакистан) общее количество подтвержденных случаев гриппа среди людей с
2003 г. достигло 399, из них в 252 случаях зарегистрирован летальный исход. В 2009 г., по данным ВОЗ, зарегистрировано 3 случая птичьего гриппа среди людей в Китае, в том числе 2 с летальным исходом, и 1 случай в Египте.
Устойчивые природные очаги гриппа птиц находятся в странах ЮгоВосточной Азии, где вирус инфекции способен циркулировать круглогодично в популяциях местных и зимующих перелетных птиц, скапливающихся на водоемах. Мигрирующие с юга на север дикие птицы,
совершающие дальние перемещения на места постоянных гнездовий (чайки, кулики, аистообразные и воробьиные), заносят вирус на водоемы, где происходит заражение оседлых видов.
В настоящее время на территории России, Китая, Монголии, Казахстана, Азербайджана, Украины, Турции, Египта, Ирака, Румынии и других стран Евразии вдоль пролетных трасс мигрирующих птиц сформировались и функционируют заносные природные очаги, откуда возможна дальнейшая экспансия гриппа птиц субтипа H5N1 на территорию России и сопредельных государств.
Патогенез
После аэрогенного попадания на слизистые оболочки проводящих дыхательных путей (гортани, трахеи и бронхов) вирус гриппа, отличающийся эпителиотропностью, размножается в клетках однослойного многорядного эпителия (рис. 3-11). Под действием нейраминидазы вируса оголяются базальные клеточные мембраны, развиваются признаки дегенерации в цитоплазме и ядрах пораженных эпителиоцитов, заканчивающейся некрозом и отторжением клеток. Эти процессы облегчают накопление различных бактерий в слизистой оболочке носоглотки и бронхов и способствуют присоединению вторичных бактериальных инфекций, усиливающих воспалительные и аллергические реакции. Воспалительные изменения слизистой оболочки развиваются по типу сухого катара без выраженных продуктивных реакций. Воспаление активизируется вследствие макрофагальных процессов, направленных на локализацию и уничтожение вируса, но сопровождающихся гибелью макрофагов. Факторы внешней среды (например, переохлаждение) способствуют нарушению функций обкладочных (слизистых и бокаловидных) клеток.
Вирус быстро репродуцируется, что объясняет непродолжительность инкубационного периода при гриппе.
Поражение легочных альвеол не характерно для гриппа, чаще его наблюдают у детей вследствие возрастных особенностей строения органов дыхания (короткие гортань и трахея), пожилых людей и лиц с иммунодефицитными состояниями. Разрушение базальных мембран альвеол лежит в основе возможного развития тромбогеморрагического синдрома (геморрагического отека легких).
На уровне слизистой оболочки дыхательных путей включаются процессы, препятствующие дальнейшему распространению вируса:
 Рис. 3-11. Патогенез гриппа
Рис. 3-11. Патогенез гриппа
- синтез ИФН инфицированными клетками;
- накопление секреторных IgA и неспецифических термолабильных В-ингибиторов.
Борьбе макроорганизма с возбудителем способствует лихорадочная реакция, повышающая активность синтеза АТ и ИФН, а также Т-киллеров, уничтожающих пораженные вирусом клетки.
Преодолевая указанные защитные барьеры, вирус проникает в кровь. Виремия начинается еще в инкубационный период и длится от нескольких дней до 2 нед. Вирус не обладает собственными токсинами, поэтому интоксикация при гриппе обусловлена в первую очередь накоплением эндогенных биологически активных веществ (ПГЕ2, серотонина, гистамина). Воздействие гемагглютинина вируса проявляется поражением эритроцитов, активизацией внутрисосудистого тромбообразования с развитием ДВС-синдрома.
Синдром интоксикации, токсико-аллергические реакции, воздействие гемагглютинина возбудителя и накопление биологически активных веществ при распаде клеток приводят к нарушениям реологических свойств крови, а в некоторых случаях - к развитию ИТШ.
Возможно гематогенное проникновение вирусов в различные органы и системы:
- сердце;
- почки;
- мышцы;
- ЦНС.
Расстройства микроциркуляции, а также электролитного баланса и КЩС в этих органах могут лежать в основе развития отека мозга и легких, дистрофических изменений в миокарде. Нарушения церебральной гемодинамики с признаками отека в различных отделах ткани мозга ведут к расстройствам деятельности ЦНС, вегетативной нервной системы и опосредованным нарушениям других систем организма (сердечнососудистой, эндокринной и т.д.).
Клиническая картина
Инкубационный период короткий - от нескольких часов до 3 дней. Заболевание может протекать в виде легких, среднетяжелых и тяжелых вариантов неосложненной формы либо приобретать осложненное течение.
В клинической картине неосложненного гриппа выделяют 3 ведущих синдрома.
• Интоксикационный синдром - основной и характеризуется острым началом заболевания, быстрым (в течение нескольких часов) повышением температуры тела от субфебрильной до 40 °С и выше, сопровождающимся ознобом. Больные жалуются на головную боль, преимущественно в лобно-орбитальной области, выраженную общую слабость, разбитость и недомогание. Нередко отмечают миалгии, развивающиеся вследствие нарушений микроциркуляции и обменных процессов в мышцах, а также артралгии и головокружение. Также возможны обморочные состояния и судорожный синдром (чаще у детей). Интенсивность головной боли варьирует от умеренной (у пожилых лиц часто диффузной) до резкой, сочетающейся с бессонницей, галлюцинациями, многократной рвотой. Лихорадка достигает максимума через 1 сут от начала заболевания и исчезает не позднее 5-го дня болезни. Иногда она носит двухволновой характер. Развиваются гиперемия лица и конъюнктив, склерит, возможно обсыпание губ в результате активации герпетической инфекции. Кожный покров горячий, сухой на ощупь. В результате диффузного поражения миокарда и его гипоксии тоны сердца становятся приглушенными, иногда прослушивается систолический шум на верхушке сердца. Возникает тахикардия или нормокардия (иногда брадикардия). Наблюдают склонность к артериальной гипотензии.
• Катаральный синдром развивается несколько позже, в ряде случаев он выражен слабо или отсутствует. Присоединяются жалобы на
• сухость, першение в горле и болезненность в носоглотке, заложенность носа. Отмечают застойную гиперемию, сухость, набухание и отек слизистой оболочки носоглотки. Носовое дыхание затруднено; в первые дни болезни отделяемое скудное или вообще отсутствует, в последующем появляются серозные, слизистые или сукровичные выделения из носа. Характерны ларинготрахеит и бронхит, проявляющиеся саднением и болью за грудиной, учащением дыхания, сухим кашлем, нарастающим по интенсивности. Во время кашля возможны рвота и сильные мышечные боли в верхних отделах живота и подреберьях. Геморрагический синдром проявляется лишь в 5-10% случаев. На фоне гиперемированной, с цианотичным оттенком, зернистой слизистой оболочки ротоглотки возможны точечные кровоизлияния. В некоторых случаях отмечают носовые кровотечения. Возможны тяжелые проявления этого синдрома при развитии острого геморрагического отека легких. Клинические проявления со стороны органов брюшной полости и мочеполовой системы не свойственны гриппу или носят рефлекторный характер. У детей раннего возраста как следствие интоксикации и микроциркуляторных нарушений возможны расстройства кишечника. Понятие «кишечный грипп» несостоятельно. У взрослых больных диарея возможна при обострениях сопутствующих хронических заболеваний ЖКТ. Развитие гепатолиенального синдрома при гриппе не наблюдают.
Длительность заболевания обычно не превышает 3-5 дней, хотя выраженная астения может сохраняться значительно дольше.
Грипп может протекать в атипичной, более легкой форме, а также сочетаться с другими вирусными инфекциями, вызванными аденовирусами, энтеровирусами, парамиксовирусами, РС-вирусом (у детей) и др. В таких случаях диагностика гриппа только на основании клинической симптоматики оказывается затруднительной.
Дифференциальная диагностика
Грипп дифференцируют со многими заболеваниями, протекающими с лихорадочным синдромом, и прежде всего с другими острыми респираторными инфекциями.
При этом принимают во внимание характерные клинические проявления гриппа:
- быстрое (в течение нескольких часов) повышение температуры тела с ознобом, миалгиями, артралгиями и гиперестезиями;
- преимущественно лобно-орбитальную локализацию головной боли;
- гиперемию лица и склерит;
- заложенность носа и отсутствие насморка в первые дни болезни;
- короткий (не более 3-5 дней) лихорадочный период.
Лабораторная диагностика
Возможно вирусологическое выделение вируса из отделяемого носоглотки, бронхов и трахеи, однако на практике его не проводят. Экспрессдиагностику выполняют с помощью РНИФ, а также ИФА, выявляющего Аг вируса в мазках, взятых со слизистой оболочки нижних носовых раковин. Ретроспективную серологическую диагностику проводят с помощью РТГА, РСК, РНГА, ИФА. Реакции ставят с парными сыворотками, взятыми на 4-5-й день болезни и через 5-7 сут после этого. Диагностическим считается нарастание титров АТ не менее чем в 4 раза. Применяют метод ПЦР.
Осложнения и исходы
Осложнения гриппа многочисленны и могут быть разделены на 2 категории:
- ранние, патогенетически обусловленные;
- вызванные присоединившейся вторичной бактериальной флорой .
Тяжелые и осложненные формы могут возникать у всех людей, но особенно характерны для детей, а также пожилых лиц, страдающих хроническими заболеваниями легких и сердечно-сосудистой системы.
Ранним, но очень редким осложнением при тяжелом течении гриппа на фоне резкой интоксикации может стать острый геморрагический отек легких. Он характеризуется быстро нарастающей одышкой, цианозом, кровянистой, иногда пенистой мокротой, отсутствием или незначительной выраженностью притупления перкуторного звука над легкими, очагами затемнения на рентгенограмме. Дыхательная недостаточность, гипоксическая кома и одновременно развивающийся коллапс ведут к летальному исходу.
Патогенетически обусловленными осложнениями гриппа также могут быть:
- ИТШ;
- серозные менингиты;
- арахноидиты;
- менингоэнцефалиты;
- энцефалопатии;
- отек мозга.
Среди осложнений, связанных со вторичной бактериальной флорой, наиболее частыми бывают пневмонии. В начальный период гриппа их считают вирусно-бактериальными (стафилококковые или стрептококковые пневмонии на фоне выраженной гриппозной интоксикации). Они отличаются деструктивным характером и могут провоцировать кровотечения, отек легких, развитие ИТШ. В конце 1-й или начале 2-й недели болезни развиваются бактериальные постгриппозные пневмонии интерстициального или очагового характера, у пожилых лиц могут принимать сливной псевдолобарный характер.
Кроме того, грипп может быть осложнен синуситом или отитом (в основном у детей), бронхитом, миозитом, пиелоциститом, реже пиелонефритом иммунокомплексного генеза, миокардитом и перикардитом, септическими состояниями (криптогенным сепсисом).
Часто наблюдают обострения ранее имевшихся у больного хронических заболеваний - сахарного диабета, бронхиальной астмы и др.; в основе патогенеза некоторых из них лежат проявления ДВС-синдрома при гриппе. В период эпидемий учащаются случаи инсультов и инфарктов миокарда, острой дыхательной и сердечно-сосудистой недостаточности. У беременных может возникнуть угроза прерывания беременности.
Лечение
Госпитализацию больных проводят по клиническим и эпидемиологическим показаниям:
- в случаях тяжелого и (или) осложненного гриппа;
- при гриппе средней тяжести у больных с неблагоприятным преморбидным фоном;
- при заболеваниях в общежитиях, школах-интернатах, детских домах.
В остальных случаях лечение проводят на дому.
Необходимо обеспечить больному постельный режим в течение всего лихорадочного периода, полноценное питание и обильное питье (чай, соки, молоко, отвары шиповника и липового цвета).
Как средство этиотропного лечения при гриппе А назначают ремантадин:
- в 1-й день по 100 мг 3 раза в сутки,
- во 2-й и 3-й дни - по 100 мг 2 раза в сутки.
Ремантадин противопоказан детям до 14 лет, беременным, лицам с острыми или обострившимися хроническими заболеваниями печени и почек. Может быть применен озельтамивир (тамифлю*), обладающий антинейраминидазной активностью (по 75 мг 2 раза в сутки курсом 5 дней). Оба препарата эффективны при их назначении не позднее первых 2 дней болезни.
Антибактериальные препараты (антибиотики широкого спектра действия) при гриппе назначают лицам пожилого возраста с хроническими заболеваниями дыхательной системы, а также больным с иммунодефицитами. Во всех остальных случаях легкого и среднетяжелого неосложненного гриппа они не показаны.
Патогенетическое лечение включает назначение аскорбиновой кислоты, рутина, глюконата кальция, антигистаминных препаратов в обычных терапевтических дозах. Жаропонижающие средства рекомендуют лишь при повышении температуры тела более 38,5 °С, применение ацетилсалициловой кислоты в этих случаях требует осторожности из-за возможности развития астматического компонента, а также синдрома Рея у детей.
Тяжелые формы гриппа требуют расширения патогенетического лечения. Для дезинтоксикации применяют внутривенные капельные инфузии реополиглюкина в дозе 200-400 мл, поляризующих смесей (1 - 1,5 л). К вводимому раствору добавляют 2,4% раствор эуфиллина (5-10 мл), 5% раствор аскорбиновой кислоты (10-15 мл), 1% раствор димедрола (1 мл), 40 мг фуросемида. При начинающемся отеке мозга или легких дозу фуросемида увеличивают до 40-60 мг, внутривенно вводят преднизолон (300 мг/сут и более). Дозы препаратов зависят от выраженности отека мозга или легких, степени ИТШ. При сердечной недостаточности назначают 10% раствор сульфокамфокаина, панангин, кокарбоксилазу.
Одновременно следует проводить оксигенотерапию, коррекцию нарушений КЩС, следить за проходимостью дыхательных путей, проводить аспирацию мокроты и слизи.
Эпидемиологический надзор
Решающие моменты, необходимые для своевременного проведения противоэпидемических мероприятий:
- систематическое слежение за антигенной структурой циркулирующих возбудителей;
- быстрое обнаружение новых вариантов вируса;
- оперативная оценка эпидемиологической ситуации;
- контроль за иммунологической характеристикой населения, причем с обязательным учетом возрастных особенностей иммунитета населения против актуальных штаммов вирусов гриппа;
- сбор информации о птичьих вирусах гриппа, особенно выделяемых в Юго-Восточной Азии;
- краткосрочное и долгосрочное прогнозирование ее развития. Надзор за гриппом осуществляют на международном и национальном уровнях. ВОЗ разрабатывает (предлагает) программу по эпидемиологическому надзору и борьбе с гриппом, включающую систему постоянного клинико-эпидемиологического надзора, оценку ущерба здоровью населения и экономике общества, внедрение широкой вакцинации и постоянную готовность к борьбе с возникающими эпидемиями. О начале эпидемии гриппа судят по превышению регистрируемых показателей расчетного эпидемического порога. Слежение за циркулирующими штаммами вируса с применением современных методов молекулярной биологии позволяет корректировать состав вакцин против гриппа и модифицировать диагностические тестовые системы.
Прогноз эпидемиологической и эпизоотологической ситуации по гриппу птиц на территории Российской Федерации составляется научно-методическим центром по референс-диагностике и изучению высокопатогенных штаммов вируса гриппа - НМЦГ (ФГУН ГНЦ ВБ «Вектор» Роспотребнадзора). Прогноз составляется на основе предоставляемых в НМЦГ заключений об эпидемиологической и эпизоотологической обстановке по гриппу птиц в России (1-2 раза в год), подготовленных Центром экологии и эпидемиологии гриппа - ЦЭЭГ (ГУ «НИИ вирусологии им. Д.И. Ивановского» РАМН) и Федеральным центром по гриппу - ФЦГ (ГУ «НИИ гриппа РАМН»). Эти заключения формируются на основе представляемой в адрес ЦЭЭГ и ФЦГ информации от курируемых ими соответствующих учреждений (противочумные станции и опорные базы, определенные Приказом Роспотребнадзора от 31.03.2005 г. ? 373). Сформулированный обобщенный прогноз
и заключения об эпидемиологической и эпизоотологической обстановке в России направляются в Федеральную службу по надзору в сфере защиты прав потребителей и благополучия человека. Данные прогноза эпидемиологической и эпизоотологической ситуации по гриппу птиц на территории Российской Федерации передаются в ВОЗ, на информационный сайт НМЦГ, в Национальные центры по гриппу стран СНГ и в учреждения-разработчики (ЦЭЭГ и ФЦГ) после согласования с Федеральной службой по надзору в сфере защиты прав потребителей и благополучия человека. Необходимость проведения мониторинга за гриппом птиц определяется реальной опасностью заносов возбудителя этого заболевания перелётными птицами и формирования очагов инфекции во многих регионах Российской Федерации, а также возникновения эпизоотий среди домашних птиц и потенциальная способность вируса гриппа птиц вызывать заражение человека.
Профилактические мероприятия
Вакцинопрофилактике против гриппа в предэпидемический период в первую очередь, подлежат:
- лица старше 60 лет;
- лица, страдающие хроническими соматическими заболеваниями;
- часто болеющие острыми респираторными вирусными заболеваниями;
- дети дошкольного возраста;
- школьники;
- медицинские работники;
- работники сферы обслуживания, транспорта, учебных заведений;
- воинские контингенты.
Для специфической профилактики гриппа используют живые, инактивированные, расщепленные и субъединичные гриппозные вакцины отечественного и зарубежного производства, приготовленные из эпидемически актуальных штаммов вируса A(HINI), A(H3N2) и В, зарегистрированные на территории Российской Федерации в установленном порядке в соответствии с инструкциями по их применению.
Массовая иммунопрофилактика существенно снижает заболеваемость гриппом, особенно при совпадении антигенной структуры вакцинного и дикого вирусов гриппа. Для этих целей применяют живые инактивированные цельновирионные, субъединичные и сплит-вакцины (табл. 3-9).
Таблица 3-9. Перечень выпускаемых гриппозных вакцин и схемы их примене-
ния для различных групп населения
Препараты, разрешенные к применению | Группы населения | Кратность прививки | Способ введения | Доза, мл |
Вакцина гриппозная аллантоисная живая для интраназального применения | Дети с 3 лет и старше, подростки и взрослые | Однократно | Интраназально | 0,5 |
Вакцина гриппозная инактивированная элюатноцентрифужная жидкая (ИГВ) | Дети с 7 лет, взрослые с 18 лет | Двукратно | Интрана- зально Подкожно | 0,5 |
Вакцина гриппозная инактивированная | Взрослые с 18 лет | Однократно | Подкожно | 0,5 |
Вакцина гриппозная тривалентная полимерсубъединичная гриппол | Дети с 6 мес | Однократно | Подкожно | 0,5 |
В негосударственных медицинских учреждениях для иммунизации населения на коммерческой основе предлагают следующие вакцины, зарегистрированные в установленном порядке:
- ваксигрипп (Франция);
- бегривак (Германия);
- флюорикс (Бельгия);
- инфлювак (Голландия);
- агриппал S1 (Италия).
Вышеперечисленные препараты - расщепленные (или сплит-вакцины) либо субъединичные вакцины 3-го поколения, прошедшие проверку установленным путем в ГИСК им. Л.А. Тарасевича и разрешенные к применению Министерством здравоохранения России.
Существуют специальные варианты вакцин для иммунизации детей.
Также особое внимание уделяют группам повышенного риска:
- лицам преклонного возраста;
- страдающим хроническими соматическими заболеваниями;
- часто болеющим ОРВИ;
- детям дошкольного возраста;
- лицам с высоким риском заражения гриппом (медицинский персонал, работники сферы бытового обслуживания, транспорта, учебных заведений, воинский контингент, школьники и пр.).
Прививки против гриппа проводят ежегодно осенью (октябрь- ноябрь) в предэпидемический по гриппу период. Живые гриппозные вакцины воспроизводят в организме ослабленную естественную инфекцию, стимулируют гуморальную и клеточную системы иммунитета, создают более широкий спектр невосприимчивости, более экономичны по стоимости. Детей в возрасте от 3 до 14 лет иммунизируют детским вариантом живой вакцины интраназально двукратно с интервалом 25-30 дней. Взрослых и детей в возрасте 7 лет и старше иммунизируют интраназально однократно. Препараты слабо реактогенны. У части привитых могут развиться незначительные катаральные проявления. Повышение температуры тела выше 37,5 °С в первые 3 сут допустимо не более чем у 2% привитых. Иммунитет кратковременный, что требует ежегодного проведения прививок.
Инактивированные гриппозные вакцины формируют преимущественно гуморальный иммунитет, обеспечивающий защиту от гриппа, и имеют меньшее число противопоказаний, что делает возможным их применение не только для практически здоровых людей, но и среди лиц старше 65 лет и индивидуумов, страдающих различными хроническими заболеваниями. Вакцину вводят парентерально однократно с помощью одноразовых шприцев.
Гриппозная полимер-субъединичная вакцина гриппол формирует в организме специфический иммунитет против гриппа и повышает неспецифическую резистентность организма к другим инфекциям за счет присутствия в препарате водорастворимого полимерного иммуномодулятора полиоксидония, обладающего широким спектром иммунофармакологического действия. Вакцину вводят однократно в объеме 0,5 мл в верхнюю треть наружной поверхности плеча на несколько сантиметров ниже плечевого сустава одноразовым шприцем.
На период эпидемии вводят ограничительные меры для уменьшения общения людей, отменяют массовые мероприятия, продлевают школьные каникулы, запрещают посещение больных в стационарах, а также ограничивают визиты заболевших в поликлиники и аптеки путем единовременной выдачи больничных листов на 5 дней. Показана высокая эффективность профилактики гриппа дибазолом.
Неспецифическая профилактика гриппа и острых респираторных вирусных инфекций
Неспецифическая профилактика гриппа включает:
- экстренную профилактику, проводимую в начале эпидемической вспышки, с применением противовирусных химиопрепаратов, интерферонов и быстродействующих индукторов эндогенного интерферона, обладающих немедленным эффектом;
- сезонную профилактику, проводимую в предэпидемический период, с применением иммунокорригирующих препаратов курсами разной продолжительности;
- санитарно-гигиенические и оздоровительные мероприятия. Неспецифическая профилактика предусматривает применение как
общих, так и специальных средств и методов.
Специальные средства и методы целесообразно разделить на 2 группы:
- препараты и процедуры, способствующие нормализации функций иммунной системы организма, повышающие его неспецифическую резистентность к инфекционным агентам (витанам*, кармолис*, имудон*, рибомунил*, анаферон*, афлубин* и др.);
- противовирусные препараты, воздействующие на возбудителей гриппа и ОРВИ (арбидол*, альгирем*, тамифлю*, циклоферин*, амиксин*, кагоцел* и др.).
Препараты 1-й группы назначают для коррекции иммунного статуса у людей, находящихся в состоянии вторичного иммунодефицита. Этот многочисленный контингент взрослых и детей составляет, по некоторым оценкам, до 50% населения. Без специальных иммунологических исследований к нему можно отнести почти безошибочно всех людей с хроническими заболеваниями, а также тех, кто часто болеет ОРВИ.
Неспецифическая сезонная иммунокоррекция в период эпидемии гриппа или локальных вспышек других ОРВИ дополняется экстренной (по эпидемическим показаниям) профилактикой с помощью противовирусных препаратов. Сезонную и экстренную профилактику проводят на фоне комплекса обоснованных санитарно-противоэпидемических (профилактических), базисных мероприятий.
Сезонная иммунокорригирующая профилактика гриппа и острых респираторных вирусных инфекций
Иммунокорригирующие препараты рекомендовано применять курсами. Во-первых, они показаны для повышения неспецифической резистентности у людей с подозрением на иммунодефицитное состояние в
период сезонных подъемов ОРВИ, включая эпидемии гриппа. Во-вторых, их применяют для реабилитации переболевших гриппом и ОРВИ лицам с подозрением на иммунодефицитное состояние, с признаками астенического синдрома и осложнениями. При этом контингенты населения, проживающие на экологически неблагоприятных территориях, рассматривают как приоритетные. Для этих целей применяют витамины, адаптогены растительного происхождения, аналоги препаратов вилочковой железы, индукторы ИФН и др. Витамины
Широко следует применять витамины С, А и группы В в возрастных дозировках. Оптимальное соотношение указанных витаминов содержат препараты гексавит, ревит, декамевит и ундевит. Их рекомендовано принимать в возрастных дозировках 2-3 раза в день после еды курсом 20-30 сут (табл. 3-10). В ДДУ в холодный сезон года рекомендовано принимать сироп из плодов шиповника по 1 чайной ложке в день.
Базисные оздоровительные и санитарно-противоэпидемические (профилактические) мероприятия
Закаливающие процедуры относят к мероприятиям, повышающим сопротивляемость организма к гриппу и ОРВИ.
Выбор метода закаливания обусловлен местными условиями, а эффективность связана с соблюдением основных принципов закаливания:
- постепенность увеличения закаливающих воздействий;
- систематичность;
- учет индивидуальных особенностей организма;
- проведение их на фоне положительных эмоций;
- многофакторность (использование нескольких физических агентов);
- полиградационность (тренировки к слабым и сильным, быстрым и замедленным раздражителям).
Постоянных противопоказаний для проведения закаливания нет. К местным методам закаливания относят:
- полоскание горла прохладной водой;
- хождение босиком по полу;
- сон в холодный период года с открытыми окнами, фрамугами и т.д.
К общим методам относят:
- ванны;
- душ;
- бассейн и др.
Арсенал закаливающих процедур широк. Для детей без ограничений можно применять следующие процедуры.
• Прогулки на открытом воздухе 2 раза в день общей продолжительностью не менее 4 чв соответствующей одежде в любую погоду.
• Воздушные ванны с утренней гимнастикой продолжительностью 10-15 мин при температуре 18-20 °С.
• Дневной сон на свежем воздухе или в хорошо проветренном помещении при температуре 14-15 °С.
• Умывание водой температуры 14-16 °С, при этом дети моют шею, верхнюю часть груди, руки до плеч.
• Контрастное обливание стоп по схеме:
0 для здоровых детей до 3 лет - 38-22-38-22 °С;
0 для здоровых детей старше 3 лет - 38-18-38-18 °С;
0 для ослабленных детей - 38-28-38 °С.
• Пребывание на солнце в летнее время может быть дополнено хождением босиком по хорошо очищенному грунту. Для достижения оптимального эффекта целесообразно применение комбинированных воздействий воздуха и воды при различной силе действующего фактора и его экспозиции.
Профилактическое УФО детей в ДДУ и школах проводят передвижными облучателями типа ОЭР, оснащенными эритемными люминесцентными лампами ЛЭ-30 или облучателями маячного типа (ОКВ или ОКМ) с лампами ДРТ-1000 и ДРТ-375 соответственно.
В течение осенне-зимнего периода детям рекомендовано получить 2 курса облучения по одной из схем:
- ежедневное облучение в течение месяца (октября или ноября - в зависимости от широты местности), повторный курс через 2 мес после завершения 1-го курса (январь-февраль);
- облучение через день в течение 2 мес (октябрь-ноябрь) с 2-месячным перерывом и повторным курсом в феврале- марте.
Процедуры начинают с 1/4 биодозы. В процессе облучения ежедневную дозу доводят до 2 биодоз, повышая ее через каждые 2 сеанса на 1/4 биодозы. Облучение ослабленных детей начинают с 1/8-1/10 биодозы и доводят до 1/2-3/4 дозы. Для детей 3-6 лет осуществляют групповое облучение, для детей ясельного возраста - индивидуальное.
Профилактическое УФО рабочих промышленных предприятий осуществляют в фотариях или непосредственно на рабочих местах с помощью люминесцентных ламп, вмонтированных в систему общего освещения.
Мероприятия в эпидемическом очаге
Больных изолируют дома или в стационаре (по клиническим и эпидемиологическим показаниям). В очаге инфекции систематически проводят влажную уборку с 0,2% раствором хлорамина, облучение воздуха бактерицидными лампами, помещение часто проветривают. Обслуживающие больных лица должны носить маски, состоящие из 4-6 слоев марли, и применять интраназально 0,25-5% оксолиновую мазь 2-3 раза в день. Дополнительно для индивидуальной профилактики показан прием ремантадина по 0,05 г 2 раза в сутки, лейкоцитарного ИФН 2 раза в сутки, введение противогриппозного иммуноглобулина. Диспансерное наблюдение за переболевшим осуществляют в случае перенесения осложненной формы гриппа. Сроки диспансеризации определяет состояние здоровья реконвалесцента и составляет не менее 3-6 нед.
Экстренная химиопрофилактика
В организационном отношении этот вид профилактики следует разделить на внутриочаговую и внеочаговую.
Внутриочаговая профилактика
Ее проводят среди людей, находящихся в непосредственном контакте с больными в семьях, квартирах, комнатах общежития, больничных палатах, т.е. в эпидемических очагах. Продолжительность очаговой профилактики может варьировать от 2 дней (при немедленном прекращении контакта с источником инфекции) до 5-7 сут (больной не изолирован, и контакт с ним в очаге не прекращен).
Внеочаговая профилактика
Ее проводят среди определенных, заранее намеченных групп населения или отдельных лиц, в основном не привитых против гриппа; из них в первую очередь - среди лиц с высоким риском неблагоприятных исходов заболевания. Обычно это хронические больные (дети и взрослые), пожилые, часто и длительно болеющие люди, у которых чаще развиваются осложнения и возможен летальный исход. Плановая профи-
лактика рекомендована лицам с повышенным риском заражения вирусом гриппа (медицинским работникам, работникам пассажирского транспорта, торговли, общественного питания и коммунального хозяйства). В экстренной защите нуждаются коллективы интернатного типа с тесным размещением контингента, учебные и производственные коллективы с высокой плотностью рабочих мест, если этот контингент оказался непривитым.
В массовой практике для борьбы с гриппом применяют противовирусные химиопрепараты (ремантадин, арбидол, оксолиновая мазь и
ИФН).
• Эффективное и доступное средство экстренной профилактики гриппа у взрослых - это ремантадин, который обладает выраженным профилактическим действием в отношении всех известных вариантов вируса гриппа типа А. Экстренную профилактику гриппа ремантадином проводят в период эпидемии гриппа. Прием препарата начинают при появлении первых больных гриппом в семье (внутриочаговая профилактика) или коллективе (внеочаговая профилактика). В первом случае ремантадин (по 1-2 таблетки в день) принимают все взрослые члены семьи (с учетом противопоказаний) в течение 2-7 дней, при внеочаговой профилактике - в течение 20 сут. В период эпидемии гриппа ремантадин применяют для раннего лечения больных взрослых и детей (с 7 лет). Лечебное действие ремантадина проявляется при назначении препарата с первых часов заболевания.
• Арбидол - отечественный противовирусный химиопрепарат с выраженной противовирусной активностью в отношении вирусов гриппа А и В. Кроме того, он стимулирует синтез ИФН и реакции клеточного иммунитета, повышает устойчивость к инфекциям. В профилактических целях арбидол назначают при контакте с больными гриппом по 0,2 гв день перорально (до еды) курсом 10-14 дней, в период эпидемии гриппа и сезонного роста заболеваемости ОРВИ - по 0,1 г 1 раз в день через каждые 3-4 дня курсом на 3 нед. Арбидол не следует назначать больным с сопутствующими заболеваниями сердечно-сосудистой системы, печени и почек.
• 25% оксолиновая мазь предназначена для самостоятельного интраназального применения, не имеет противопоказаний, рекомендована для экстренной профилактики заболевания в период эпидемии гриппа.
• Человеческий лейкоцитарный ИФН применяют преимущественно для экстренной защиты детей дошкольного возраста от заболеваний
гриппом и другими ОРВИ в коллективах, где есть опасность быстрого распространения указанных заболеваний. ИФН обладает профилактической активностью против большинства респираторных вирусов. С профилактической целью применяют интраназально с помощью распылителей по 0,25 мл или по 5 капель в каждый носовой ход 2 раза в сутки с интервалом не менее 6 ч. Профилактические курсы рекомендовано проводить в первые 7-10 дней пребывания ребенка в коллективе при контакте с больными в семье или детском учреждении.
Пандемический грипп H1N1 Калифорния/04/2009
В марте 2009 г. около Мехико возникла эпизоотия гриппа свиней, от которых был выделен вирус гриппа A/H1N1. Этот вирус оказался способным инфицировать людей и передаваться от зараженных лиц контактным людям сначала в Мехико, а уже в апреле 2009 г. распространился в США и Канаду, а затем и в другие страны различных континентов. В связи с этим ВОЗ в июне 2009 г. объявила о пандемии гриппа, вызванной вирусом гриппа свиней H1N1, и штамм этого вируса получил название H1N1 Калифорния/04/2009 по месту и времени выделения этого вируса от заболевшего человека. Этот штамм является тройным реассортантом и содержит гены, кодирующие гемагглютин и белки NP и NS, характерные для классического штамма вируса гриппа свиней, гены, кодирующие нейраминидазу и белок М - от евроазиатской линии вируса гриппа свиней, гены, кодирующие белки PB2 и PA - от вируса гриппа птиц, и ген, кодирующий белок PB1 - от вируса гриппа. Возможность возникновения тройных реассортантов вирусов гриппа свиней связана с важной особенностью рецепторной области клеток этих животных. Рецепторная область клеток эпителия трахеи свиней имеет по крайней мере 2 различных рецепторных участка, которые могут распознаваться не только вирусами гриппа птиц, но и вирусами гриппа человека.
Новый вирус гриппа А (H1N1) на сегодняшний день существует одновременно с уже имевшимися вирусами гриппа. Вспышка заболевания новым гриппом не отменяет возможности развития эпидемии обычного сезонного гриппа. По состоянию на октябрь 2009 г. 195 стран сообщили о подтвержденных случаях заболевания человека пандемическим гриппом (H1N1) - 2009. Несмотря на то что большинство случаев заболевания, вызванных пандемическим вирусом (H1N1) - 2009, представляли собой ограниченные неосложненные заболевания слабой или
умеренной тяжести, были зарегистрированы случаи острых осложнений, в том числе с летальным исходом.
Пандемический вирус гриппа (H1N1) - 2009 отличается по своей патогенности от сезонного гриппа двумя основными аспектами.
• Во-первых, поскольку у большинства людей имеется незначительный или вовсе отсутствует предшествующий иммунитет к этому вирусу, эта инфекция воздействовала на более широкий возрастной диапазон, особенно детей и молодых людей.
• Во-вторых, этот вирус может инфицировать нижние дыхательные пути и вызывать быстро прогрессирующую пневмонию, особенно у детей и взрослых молодого и среднего возраста.
В целом от 7 до 10% всех госпитализированных пациентов составляют беременные женщины на II или III триместре беременности. По сравнению со всем населением вероятность того, что беременным потребуется медицинский уход в палате интенсивной терапии, в 10 раз выше.
Наибольшая заболеваемость пандемическим вирусом (H1N1) - 2009 наблюдалась среди детей и молодых взрослых. Симптомы заболевания гриппом А/H1N1 сходны с симптомами сезонного гриппа (рекомендации ВОЗ от 1 мая 2009 г.). Был описан широкий клинический спектр болезни в диапазоне от заболевания верхних дыхательных путей средней тяжести и без высокой температуры, фебрильного гриппоподобного заболевания (ГПЗ) до тяжелых или даже летальных осложнений, включая быстро прогрессирующую пневмонию. Наиболее часто отмечаемые симптомы включают кашель, высокую температуру, боль в горле, мышечную боль, недомогание и головную боль. У некоторых пациентов наблюдались желудочно-кишечные симптомы [тошнота, рвота и (или) диарея].
Факторы риска тяжелого заболевания в результате инфицирования пандемическим вирусом (H1N1) - 2009 зарегистрированные до настоящего времени, признаны аналогичными тем факторам риска, которые были выявлены для осложнений в результате сезонного гриппа.
Они включают следующие группы:
- дети грудного и раннего возраста, особенно дети младше 2 лет;
- беременные женщины;
- лица любого возраста с хронической болезнью легких (например, с астмой, ХОЗЛ);
- лица любого возраста с хронической болезнью сердца (например, с застойной сердечной недостаточностью);
- лица с нарушениями обмена веществ (например, с диабетом);
- лица с хроническим заболеванием почек, хроническим гепатитом, некоторыми неврологическими состояниями (включая нервно-мышечные, нейрокогнитивные расстройства и эпилепсию), гемоглобинопатиями или иммунодепрессией, вызванными либо иммунодепрессивными состояниями, такими, как ВИЧ-инфекция, либо вторичными состояниями, такими, как иммуносупрессивное лекарственное лечение или наличие злокачественных образований;
- дети, получающие длительную аспириновую терапию;
- лица в возрасте 65 лет и старше.
Более высокий риск острых осложнений в результате инфицирования пандемическим вирусом (H1N1) - 2009 также зарегистрирован среди людей, страдающих ожирением (особенно тех, которые страдают болезненным ожирением), а также среди малоимущих групп населения и коренных народностей.
Неосложненный грипп
• Симптомы ГПЗ включают: 0 высокую температуру;
0 кашель;
0 боль в горле;
0 ринорею;
0 головную боль;
0 мышечную боль и недомогание;
0 отсутствие затрудненного дыхания и диспноэ.
• У пациентов могут наблюдаться некоторые или все из этих симптомов.
• Могут также присутствовать желудочно-кишечные симптомы, такие, как диарея и (или) рвота, особенно у детей, но без признаков дегидратации.
Осложненный или тяжелый грипп
• Присутствие клинических признаков [например, затрудненное дыхание (диспноэ), тахипноэ, гипоксия] и (или) рентгонологических признаков заболевания нижних дыхательных путей (например, пневмония), поражение ЦНС (например, энцефалопатия, энцефалит), острая дегидратация или присутствие вторичных осложнений, таких как почечная недостаточность, мультиорганная недостаточность и септический шок. Другие осложнения могут включать рабдомиолиз и миокардит.
• Обострение основной хронической болезни, включая астму, ХОЗЛ, хронический гепатит и почечную недостаточность, диабет или сердечно-сосудистые заболевания.
• Любое другое состояние или клинические признаки, требующие помещения в больницу для ведения.
• Любые признаки прогрессирования болезни, описанные ниже.
Признаки и симптомы прогрессирующей болезни
У больных первоначально неосложненным гриппом может развиться более тяжелая болезнь. Прогрессирование может быть быстрым (в течение 24 ч). Ниже приведены некоторые из показателей прогрессирования, которые могут потребовать неотложного пересмотра методов ведения больного.
• Симптомы и признаки, свидетельствующие о недостатке кислорода или сердечно-легочной недостаточности:
0 одышка (при нагрузке или в спокойном состоянии), затрудненное дыхание, посинение, кровь в мокроте или окрашенная мокрота, боль в груди и низкое кровяное давление;
0 у детей - учащенное или затрудненное дыхание;
0 гипоксия по показаниям пульсоксиметра.
• Симптомы и признаки, свидетельствующие об осложнениях со стороны ЦНС:
0 измененное психическое состояние, потеря сознания, сонливость или трудности с пробуждением и повторяющиеся или постоянные конвульсии (эпилептические припадки), спутанность сознания, сильная слабость или паралич.
• Данные об устойчивой репликации вируса или инвазивной вторичной бактериальной инфекции, полученные на основе лабораторного тестирования или клинических признаков (например, стойкая высокая температура и другие симптомы, продолжающиеся более 3 дней).
• Сильная дегидратация, проявляющаяся в понижении активности, головокружении, уменьшении мочевыделения и заторможенности.
• В тяжелых случаях заболевания наиболее распространена первичная вирусная пневмония, которая часто приводит к смертельному исходу. В 30% случаев со смертельным исходом были диагностированы вторичные бактериальные инфекции. Самыми распространенными причинами смерти были дыхательная недостаточность и рефрактерный шок. В тяжелых случаях заболевания ухудшение состояния пациентов происходит обычно через 3-5 дней после
появления симптомов заболевания. Ухудшение состояния идет быстрыми темпами - у многих пациентов в течение 24 ч развивается дыхательная недостаточность, требующая их немедленного помещения в палату интенсивной терапии. Большинству госпитализированных пациентов требуется немедленная респираторная поддержка с механической вентиляцией.
Диагностика
• Наиболее своевременное и точное подтверждение этой инфекции обеспечивается с помощью полимеразной цепной реакции с обратной транскриптазой (ОТ-ПЦР).
• Если известно, что вирусы гриппа циркулируют в группе местного населения, больные с признаками неосложненного гриппа могут диагностироваться на основе клинических и эпидемиологических данных. Ни при каких обстоятельствах диагностическое тестирование гриппа не должно откладывать начало осуществления противоэпидемических мер или начало противовирусного лечения, если на основании клинических и эпидемиологических признаков предлагается пандемический грипп, вызванный вирусом (H1N1) - 2009.
Антивирусная терапия
Вирус пандемического гриппа (H1N1) - 2009 в настоящее время подвержен воздействию ингибиторов нейраминидазы (НАИ) осельтамивира и занамивира, однако устойчив к ингибиторам М2 амантадину или римантадину.
В связи с тем что беременные женщины являются группой повышенного риска по развитию осложнений, угрожающих жизни, им показано назначение противовирусных препаратов при лечении инфекции, вызываемой новым гриппом типа А (H1N1). В соответствии с рекомендациями ВОЗ лечение антиретровирусным препаратом осельтамивиром беременных женщин следует начинать как можно раньше после появления симптомов, не дожидаясь результатов лабораторных тестов, поскольку осельтамивир наиболее эффективен в течение первых 48 ч заболевания.
Лечение беременных с тяжелым или прогрессирующим течением заболевания необходимо начинать и в более поздние сроки. При отсутствии осельтамивира или невозможности его применения по какойлибо причине можно использовать занамивир. При назначении указанных противовирусных препаратов кормящим женщинам вопрос о продолжении грудного вскармливания решается индивидуально, с учетом тяжести состояния матери.
Профилактика
Специфическая профилактика гриппа осуществляется с использованием разработанных инактивированных субъединичных и живых аттенуированных вакцин. Для неспецифической профилактики гриппа H1N1 рекомендованы:
- кагоцел;
- арбидол;
- интерферон a-2b в комбинации с интерфероном γ.
ПАРАГРИПП (INFECTIO PARAGRIPPOSA)
Парагрипп - антропонозное острое вирусное заболевание, поражающее верхние дыхательные пути (особенно гортань) и протекающее с умеренно выраженной интоксикацией.
Краткие исторические сведения
Впервые вирус парагриппа выделил Н. Курода (1952) в японском городе Сендай. Первоначально возбудитель получил название «вирус гриппа D Сендай». Впоследствии Р. Чэнок (1954, 1957) выделил новые вирусы, подобно вирусу Сендай имевшие сходство с вирусами гриппа. В 1959 г. вирусы получили название парагриппозных.
Этиология
Возбудитель - РНК-геномный вирус рода Paramyxovirus семейства Paramyxoviridae. По структуре Аг выделяют 4 типа вируса; подтипы 1, 2 и 3 родственны между собой. Набор Аг достаточно стабилен. Вирусы парагриппа хорошо размножаются в живых тканевых культурах, обладают гемадсорбирующими и гемагглютинирующими свойствами, проявляют тропность к эпителию дыхательных путей. Вирусы нестойки во внешней среде, при комнатной температуре сохраняются не более 4 ч, полная их инактивация происходит после прогревания в течение 30 мин при 50 °С.
Эпидемиология
Резервуар и источник инфекции - больной с клинически выраженной или стертой формой болезни. Наибольшую эпидемическую опасность больные представляют в первые 2-3 дня болезни, но выделение возбудителя происходит в среднем в течение 7-10 сут.
Механизм передачи - аэрозольный, фактор передачи - воздушная среда.
Естественная восприимчивость людей
Естественная восприимчивость людей высокая. Постинфекционный иммунитет несовершенен и непродолжителен. Вируснейтрализующие, комплементсвязывающие и антигемагглютинирующие АТ, образовавшиеся в ходе инфекционного процесса, не защищают от возможности нового заражения парагриппом, но облегчают течение повторного заболевания. Пассивный иммунитет у новорожденных сохраняется до 6 мес, в случае заражения заболевание у них протекает легче.
Основные эпидемиологические признаки
Парагрипп широко распространен, особенно среди военнослужащих и детей. Вирусы типов 1, 2 и 3 распространены повсеместно и могут вызывать заболевания в любое время года, хотя в целом отмечают осенне-зимнюю сезонность. Вирусы парагриппа обусловливают до 20% ОРВИ у взрослых, до 30% - у детей. Регистрируют как спорадические случаи, так и эпидемические вспышки. Заболеванию подвержены все возрастные группы, но чаще болеют дети, особенно в возрасте до 1 года.
Патогенез
Вирусы аэрогенно попадают на слизистые оболочки верхних дыхательных путей и проникают в эпителиальные клетки носа, гортани и трахеи, где происходит их репродукция. Следствием этого становятся разрушение эпителия слизистой оболочки и воспалительная реакция, сопровождающаяся гиперемией и отечностью слизистой оболочки. Особенно часто вирус локализуется в гортани, где наблюдают максимальную выраженность воспалительных реакций. Это может привести к развитию ложного крупа, особенно у детей раннего возраста. Воспалительный процесс в респираторном тракте развивается медленно.
Из мест первичной локализации и размножения возбудители могут проникать в кровь, но виремия при парагриппе неинтенсивная и кратковременная, ее сопровождают умеренные признаки интоксикации.
Медленное развитие воспалительного процесса и умеренно выраженная интоксикация обусловливают основные клинические отличия парагриппа - меньшую тяжесть заболевания, чем при гриппе, но его большую длительность.
Клиническая картина
Инкубационный период варьирует от 2 до 7 дней, что зависит от типа вируса. В большинстве случаев характерно постепенное развитие заболевания со слабыми проявлениями интоксикации. Возникают нерезкая головная боль, недомогание, познабливание, небольшая ломота в мышцах. В типичных случаях температура тела остается субфебрильной, хотя возможны резкие кратковременные подъемы до высоких цифр или высокая лихорадка с самого начала заболевания.
Уже с первых часов болезни возникают признаки поражения респираторного тракта:
- заложенность носа;
- обильная ринорея с серозным отделяемым;
- сухой, нередко лающий кашель;
- саднение и першение в гортани;
- осиплость голоса.
При осмотре больного выявляют неяркую гиперемию и в части случаев отечность слизистых оболочек носа, задней стенки глотки, отечность и зернистость мягкого нёба. Со стороны других органов и систем существенных расстройств не наблюдают. Однако у детей раннего возраста, а также у взрослых, страдающих хроническими заболеваниями органов дыхания, процесс часто и быстро распространяется на нижние отделы дыхательных путей с развитием клинической картины бронхита.
Тяжесть болезни зависит от возраста и преморбидного фона больного. У взрослых заболевание протекает легче, чем у детей. Описаны и тяжелые формы заболевания с выраженной интоксикацией, галлюцинациями, менингизмом.
Иногда течение парагриппа затягивается до 2-3 нед; после него часто остается астенический синдром.
Дифференциальная диагностика
Заболевание следует отличать от гриппа и других ОРВИ. При этом учитывают постепенное начало парагриппа со слабыми (реже умеренными) проявлениями интоксикации, развитие признаков поражения дыхательных путей уже с первых часов болезни, обильную ринорею с серозным отделяемым, сухой, нередко лающий кашель.
Лабораторная диагностика
Существенных изменений в гемограмме при парагриппе не наблюдают. Применение сложных вирусологических исследований для диагностики парагриппа ограничено. Возможно выявление специфических сывороточных АТ в РТГА и РСК с парными сыворотками, а также применение РИФ для выявления вирусных Аг в клетках эпителия дыхательных путей.
Осложнения и исходы
У детей первых лет жизни наиболее опасное осложнение - ложный круп. Он развивается вследствие быстро прогрессирующего отека слизистой оболочки, рефлекторного спазма мышц гортани и накопления секрета в ее просвете. Ложный круп обычно начинается внезапно, чаще ночью. Ребенок просыпается от приступа кашля, испуган, беспокоен, мечется в постели. Появляются затрудненное дыхание, цианоз носогубного треугольника, хриплый или сипловатый голос, нарастает тахикардия.
У взрослых осложнениями заболевания могут стать вторичные бактериальные пневмонии. Как правило, они носят очаговый характер, но, несмотря на это, могут быть затяжными. Возможно развитие синуситов, отитов, ангин.
Лечение
Специфическое лечение не разработано, обсуждают вопрос о возможности применения ремантадина в начальных стадиях заболевания. Лечебные мероприятия ограничивают симптоматическими средствами.
При развитии ложного крупа применяют тепловые процедуры - горячие общие (38 °С, 7-10 мин) или ножные ванны, грелки к ногам, больному дают теплое питье (чай, молоко с содой), ставят горчичники на область гортани и грудную клетку. Показаны внутримышечное введение антигистаминных и седативных препаратов (например, пипольфена и др.), паровые ингаляции с содой или эфедрином. Признаки крупа при парагриппе обычно быстро ослабевают, но иногда могут повторяться. При отсутствии эффекта от вышеуказанного лечения применяют глюкокортикоиды.
Профилактические мероприятия
Проводят мероприятия, аналогичные таковым при гриппе. Средства активной иммунопрофилактики не разработаны.
АДЕНОВИРУСНАЯ ИНФЕКЦИЯ
Аденовирусная инфекция - острая антропонозная вирусная инфекция, поражающая слизистые оболочки верхних дыхательных путей, глаз, кишечника, лимфоидную ткань и протекающая с умеренно выраженной интоксикацией.
Краткие исторические сведения
Аденовирусы человека впервые выделил У. Роу (1953) из миндалин и аденоидов детей, а затем у больных ОРВИ и атипичной пневмонией с признаками конъюнктивита (Huebner R., Hilleman M., Trentin J. и др., 1954). В опытах на животных доказана онкогенная активность аденовирусов (Trentin J. и др., Huebner R. и др., 1962).
Этиология
Возбудители - ДНК-геномные вирусы рода Mastadenovirus семейства Adenoviridae. В настоящее время известно около 100 сероваров вирусов, более 40 из них выделено у людей. Серовары аденовирусов резко различаются по эпидемиологическим характеристикам. Серовары 1, 2 и 5 вызывают поражения дыхательных путей и кишечника у маленьких детей с длительной персистенцией в миндалинах и аденоидах, серовары 4, 7, 14 и 21 - ОРВИ у взрослых. Серовар 3 обусловливает развитие острой фарингоконъюнктивальной лихорадки у детей старшего возраста и взрослых, несколько сероваров вызывают эпидемический кератоконъюнктивит. Вспышки заболеваний чаще бывают обусловлены типами 3, 4, 7, 14 и 21.
По способности агглютинировать эритроциты аденовирусы разделяют на 4 подгруппы (I-IV). Аденовирусы устойчивы во внешней среде, сохраняются до 2 нед при комнатной температуре, но погибают от воздействия УФ-лучей и хлорсодержащих препаратов. Хорошо переносят замораживание. В воде при 4 °С сохраняют жизнеспособность 2 года.
Эпидемиология
Резервуар и источник инфекции - человек, больной или носитель. Возбудитель выделяется из организма с секретом верхних дыхательных путей до 25-го дня болезни и более 1,5 мес - с фекалиями.
Механизм передачи инфекции - аэрозольный (с капельками слюны и слизи), также возможен и фекально-оральный (алиментарный) путь заражения. В отдельных случаях передача возбудителя осуществляется через контаминированные предметы внешней среды. Возможно внутриутробное инфицирование плода.
Естественная восприимчивость людей
Естественная восприимчивость людей высокая. Перенесенное заболевание оставляет типоспецифический иммунитет, возможны повторные заболевания.
Основные эпидемиологические признаки
Аденовирусная инфекция распространена повсеместно, составляет 5-10% всех вирусных болезней. Заболеваемость регистрируют в течение всего года с подъемом в холодное время. Аденовирусные заболевания наблюдают как в виде спорадических случаев, так и в виде эпидемических вспышек. Характер эпидемического процесса во многом определяется серологическими типами аденовирусов. Эпидемические типы вирусов (особенно 14 и 21) обусловливают большие вспышки заболеваний среди взрослых и детей. Аденовирусный геморрагический конъюнктивит чаще возникает при инфицировании вирусом типов 3, 4 и 7. Развитие случаев конъюнктивита связано с перенесенной респираторной аденовирусной инфекцией или с результатом заражения вирусом через воду в плавательных бассейнах или открытых водоемах. Чаще болеют дети раннего возраста и военнослужащие. Особенно высока заболеваемость во вновь сформированных коллективах детей и взрослых (в первые 2-3 мес). Болезнь протекает по типу ОРВИ. В отдельных случаях возможно внутрибольничное инфицирование при проведении различных лечебных манипуляций. Заболевание у новорожденных и детей раннего возраста протекает по типу кератоконъюнктивита или поражения нижних отделов дыхательных путей. К редким аденовирусным поражениям относят менингоэнцефалиты и геморрагические циститы, чаще выявляемые у детей старшего возраста.
ОРВИ, включая грипп, составляют комплекс сопряженных инфекций, поэтому процесс распространения этих инфекций - единая сбалансиро-
ванная система. В настоящее время известно около 170 видов возбудителей, вызывающих гриппоподобные заболевания, причем даже в период эпидемии на долю гриппа приходится не более 25-27% всех ОРВИ. Например, эпидемический подъем в 1998-1999 гг. в Москве был обусловлен в основном заболеваемостью взрослого населения, удельный вес взрослых составил 60% и этиологически был связан с циркуляцией многочисленных возбудителей ОРВИ негриппозной этиологии (аденовирусов, возбудителей РС-инфекции, парагриппа типов 1 и 3), что подтверждено результатами вирусологических и серологических исследований.
Патогенез
При аэрозольном заражении возбудитель проникает в организм человека через слизистые оболочки верхних дыхательных путей и распространяется по бронхам в их нижние отделы. Входными воротами инфекции могут быть слизистые оболочки глаз, а также кишечника, куда вирус попадает при заглатывании слизи из верхних дыхательных путей. Вирус локализуется в клетках эпителия дыхательных путей и тонкой кишки, где происходит его размножение. В очагах поражения развивается воспалительная реакция, сопровождаемая расширением капилляров слизистой оболочки, гиперплазией подслизистой ткани с инфильтрацией мононуклеарными лейкоцитами и иногда кровоизлияниями в ней, что клинически проявляется ангиной, фарингитом, конъюнктивитом (часто пленчатого характера), диареей. Иногда развивается кератоконъюнктивит с помутнением роговицы и нарушением зрения. Лимфогенным путем возбудитель проникает в регионарные лимфатические узлы, где происходят гиперплазия лимфоидной ткани и накопление вируса в течение инкубационного периода заболевания. В клинической картине эти механизмы обусловливают развитие периферической лимфаденопатии и мезаденита.
В результате подавления активности макрофагов и повышения проницаемости тканей в дальнейшем развивается виремия с диссеминацией возбудителя по различным органам и системам. В этот период вирус проникает в клетки эндотелия сосудов, повреждая их. При этом часто возникает интоксикация. Фиксация вируса макрофагами в печени и селезенке сопровождается развитием изменений в этих органах с увеличением их размеров (гепатолиенальный синдром). Виремия и репродукция возбудителя в клетках эпителия и лимфоидной ткани могут быть длительными.
Клиническая картина
Длительность инкубационного периода варьирует от 1 дня до 2 нед, чаще составляя 5-8 сут.
Заболевание начинается остро с развития слабых или умеренных признаков интоксикации:
- озноба или познабливания;
- несильной и непостоянной головной боли;
- миалгий и артралгий;
- вялости;
- адинамии;
- снижения аппетита.
Со 2-3-го дня болезни начинает повышаться температура тела, чаще она остается субфебрильной в течение 5-7 дней, лишь иногда достигая 38-39 °С.
В редких случаях возможны боли в эпигастральной области и диарея.
Одновременно развиваются симптомы поражения верхних дыхательных путей. В отличие от гриппа рано появляется умеренная заложенность носа с обильным серозным, а позже - серозно-гнойным отделяемым. Возможны боли в горле и кашель. Через 2-3 дня от начала заболевания больные начинают жаловаться на боли в глазах и обильное слезотечение.
При осмотре больных можно отметить гиперемию лица, инъекцию склер, иногда папулезную сыпь на коже. Часто развивается конъюнктивит с гиперемией конъюнктивы и слизистым, но не гнойным отделяемым. У детей первых лет жизни и изредка у взрослых больных на конъюнктиве могут появиться пленчатые образования, нарастает отек век. Возможно поражение роговицы с образованием инфильтратов. При сочетании с катаральным, гнойным или пленчатым конъюнктивитом обычно процесс сначала носит односторонний характер. Инфильтраты на роговице рассасываются медленно, в течение 1-2 мес.
Конъюнктивит может сочетаться с проявлениями фарингита (фарингоконъюнктивальная лихорадка).
Слизистая оболочка мягкого нёба и задней стенки глотки незначительно воспалена, может быть зернистой и отечной. Фолликулы задней стенки глотки гипертрофированы. Миндалины увеличены, разрыхлены, иногда покрыты легко снимающимися рыхлыми беловатыми налетами разнообразной формы и размеров. Отмечают увеличение и болезненность при пальпации подчелюстных, нередко шейных и даже подмышечных лимфатических узлов.
Если воспалительный процесс дыхательных путей принимает нисходящий характер, возможно развитие ларингита и бронхита. Ларингит у больных аденовирусной инфекцией наблюдают редко. Он проявляется резким лающим кашлем, усилением болей в горле, охриплостью голоса. В случаях бронхита кашель становится более стойким, в легких выслушивают жесткое дыхание и рассеянные сухие хрипы в разных отделах.
Период катаральных проявлений иногда может осложниться аденовирусной пневмонией. Она возникает через 3-5 дней от начала заболевания, у детей до 2-3 лет может начаться внезапно. При этом нарастает температура тела, лихорадка принимает неправильный характер и продолжается длительно (2-3 нед). Кашель становится сильнее, прогрессирует общая слабость, возникает одышка. Губы принимают цианотичный оттенок. При ходьбе одышка нарастает, появляется испарина на лбу, усиливается цианоз губ. По рентгенологическим признакам пневмония может быть мелкоочаговой или сливной.
У детей раннего возраста в тяжелых случаях вирусной пневмонии возможны пятнисто-папулезная сыпь, энцефалит, очаги некроза в легких, коже и головном мозге.
Патологические изменения со стороны сердечно-сосудистой системы развиваются лишь при редких тяжелых формах заболевания. Характерны приглушение тонов сердца и мягкий систолический шум на его верхушке.
Поражения различных отделов дыхательных путей могут сочетаться с нарушениями со стороны ЖКТ. Возникают боли в животе и дисфункция кишечника (диарея особенно характерна для детей младшего возраста). Увеличиваются печень и селезенка.
Аденовирусная инфекция чаще поражает детей и лиц среднего возраста. Заболевание в среднем продолжается от нескольких дней до 1 нед, но при длительной задержке вируса в организме возможно рецидивирующее течение, при этом инфекция затягивается на 2-3 нед.
По преобладанию тех или иных симптомов и их сочетанию выделяют несколько форм болезни:
- ОРВИ;
- ринофарингит;
- ринофаринготонзиллит;
- ринофарингобронхит;
- фарингоконъюнктивит (фарингоконъюнктивальная лихорадка);
- конъюнктивит и кератоконъюнктивит;
- пневмония и др.
Дифференциальная диагностика
В зависимости от клинической формы аденовирусной инфекции проводят дифференциальную диагностику с гриппом, группой ОРВИ, конъюнктивитами и кератоконъюнктивитами различной этиологии (в том числе дифтерийной), пневмониями, туберкулезом.
Для аденовирусной инфекции характерны слабые или умеренные признаки интоксикации и полиморфизм клинических проявлений в динамике заболевания:
- симптомы поражения дыхательных путей (фарингит, ларингит, бронхит);
- глаз (конъюнктивит, ирит);
- регионарная или распространенная лимфаденопатия;
- иногда экзантема;
- нарушения со стороны ЖКТ;
- гепатолиенальный синдром.
Лабораторная диагностика
Гемограмма при аденовирусных инфекциях не имеет существенных изменений, за исключением некоторого повышения СОЭ. Вирусологические исследования, основанные на выделении вируса из носоглоточных смывов, отделяемого глаз при конъюнктивитах (реже из испражнений), сложны и длительны, в широкой практике их не применяют. Обнаружение сывороточных АТ проводят с помощью группоспецифичной РСК и типоспецифичных РТГА и РН (реакция нейтрализации). При постановке этих реакций с парными сыворотками, взятыми в острый период заболевания и период реконвалесценции, диагностически значимым считают нарастание титров АТ не менее чем в 4 раза. Применяют также ИФА с групповым Аг. Для ориентировочной экспресс-диагностики можно использовать РИФ и метод иммунной электронной микроскопии.
Осложнения и исходы
Наиболее типичны отиты и гнойные синуситы, обструкция евстахиевой трубы у детей вследствие длительной гипертрофии лимфоидной ткани в глотке, ларингоспазм (ложный круп), вторичные бактериальные пневмонии, поражения почек. Прогноз заболевания обычно благоприятный.
Лечение
При неосложненном течении заболевания обычно ограничиваются проведением местных мероприятий - назначают глазные капли (0,05% раствор дезоксирибонуклеазы или 20-30% раствор сульфацила натрия). При гнойном или пленчатом конъюнктивите и кератоконъюнктивите (исключая случаи с изъязвлениями роговицы!) за веко закладывают 1% гидрокортизоновую или преднизолоновую мазь. Рекомендованы витамины, антигистаминные препараты, симптоматические средства.
Тяжело протекающая аденовирусная инфекция требует усиления дезинтоксикационного лечения с внутривенным введением полиионных кристаллоидных и коллоидных растворов. Этиотропные препараты (антибиотики широкого спектра действия) назначают при осложнениях, вызванных вторичной бактериальной флорой, а также лицам преклонного возраста, страдающим хроническими заболеваниями дыхательной системы, и больным с проявлениями иммуносупрессии.
Эпидемиологический надзор
Эпидемиологический надзор включает в себя анализ заболеваемости различными клиническими формами аденовирусной инфекции, слежение за типовой структурой возбудителя.
Профилактические мероприятия
В ряде стран для профилактики во взрослых организованных коллективах применяют живую вакцину из аденовирусов. В РФ иммунопрофилактика не разработана. Широкое использование живых вакцин ограничивает сложившееся мнение о способности аденовирусов вызывать злокачественные трансформации клеток у человека. Рекомендованы общие санитарно-противоэпидемические (профилактические) мероприятия, хлорирование воды в плавательных бассейнах. В предэпидемический период рекомендовано ограничить общение, ослабленным детям ясельного возраста, подвергшимся риску заражения, показано введение специфического иммуноглобулина и лейкоцитарного ИФН.
Мероприятия в эпидемическом очаге
Госпитализацию больных осуществляют по клиническим показаниям. В очаге инфекции рекомендовано проведение влажной уборки и обеззараживание белья и посуды замачиванием в 0,2-0,3% растворе
хлорамина. В детских коллективах проводят разобщение на 10 дней после изоляции больного. В целях индивидуальной защиты лицам из окружения больного показано ношение марлевых повязок. Диспансерное наблюдение за переболевшими не регламентировано.
РЕСПИРАТОРНО-СИНЦИТИАЛЬНАЯ ВИРУСНАЯ ИНФЕКЦИЯ
РС-инфекция - острое антропонозное вирусное заболевание с преимущественным поражением нижних отделов дыхательных путей.
Краткие исторические сведения
Возбудитель заболевания впервые выделил Д. Моррис от обезьян шимпанзе во время эпизоотии ринита (1956). Первоначально возбудитель был назван вирусом насморка обезьян. Несколько позже Р. Чэнок и соавт. выделили сходный вирус у детей, больных бронхиолитом и пневмонией (1957). Свое современное название вирус получил благодаря способности вызывать образование синцитиальных полей в клетках тканевых культур.
Этиология
Возбудитель - РНК-геномный вирус рода Pneumovirus семейства Paramyxoviridae. Вирус имеет поверхностный А-Аг, вызывающий синтез нейтрализующих АТ, и нуклеокапсидный В-Аг, индуцирующий образование комплементсвязывающих АТ. Вирус обусловливает образование синцития, или псевдогигантских клеток, in vitro и in vivo. Вирионы инактивируются при 55 °С в течение 5 мин, при 37 °С - в течение 24 ч. Возбудитель переносит однократное замораживание при -70 °С. Вирус полностью разрушается при рН 3, а также при медленном замораживании. Чувствителен к действию эфира, кислот и детергентов.
Эпидемиология
Резервуар и источник инфекции - человек (больной или носитель). Вирус начинает выделяться из носоглотки больных за 1-2 дня до начала клинических проявлений и присутствует до 3-6-х суток клинически выраженного заболевания. Выражено реконвалесцентное и здоровое носительство.
Механизм передачи возбудителя - аэрозольный, фактор передачи - воздух.
Естественная восприимчивость людей
Естественная восприимчивость людей высокая, особенно у детей. Постинфекционный иммунитет нестоек. Возможны повторные заболевания через несколько лет.
Основные эпидемиологические признаки
РС-инфекция распространена повсеместно, ее регистрируют круглый год с наибольшим подъемом заболеваемости в зимние и весенние месяцы. В межэпидемический период отмечают спорадические случаи заболеваний. Чаще РС-инфекцию наблюдают у детей раннего возраста (до 1 года), хотя к ней восприимчивы также и взрослые. При заносе инфекции в детские учреждения заболевают практически все дети в возрасте до 1 года. Эпидемии отличает высокая интенсивность, в большинстве случаев они продолжаются 3-5 мес. Описаны внутрибольничные вспышки в детских стационарах.
Патогенез
При аэрогенном поступлении в организм человека РС-вирус внедряется в эпителиальные клетки слизистой оболочки верхних дыхательных путей, в том числе носоглотки, провоцируя развитие воспалительного процесса. Вместе с тем, особенно у детей младшего возраста, наиболее характерно поражение нижних дыхательных путей с распространением процесса на трахею, бронхи и особенно бронхиолы и альвеолы. Вследствие репродукции вируса происходят некроз эпителиальных клеток бронхов и бронхиол, лимфоидная перибронхиальная инфильтрация. При прогрессировании воспаления с выраженным аллергическим компонентом образуются многоклеточные выросты эпителия, в просвет альвеол выделяется мононуклеарный экссудат, что приводит к обтурации дыхательных путей, заполнению альвеол, развитию ателектазов и эмфиземы.
Клиническая картина
Инкубационный период варьирует от нескольких дней до 1 нед. Заболевание развивается постепенно.
В зависимости от преимущественного поражения тех или иных отделов дыхательной системы выделяют несколько клинических вариантов РС-инфекции:
ν назофарингит;
ν бронхит и бронхиолит;
ν пневмонию.
• У взрослых и детей старшего возраста обычно развивается назофарингит, клинически не отличимый от аналогичных состояний при других ОРВИ. На фоне субфебрильной температуры тела отмечают незначительные проявления общей интоксикации - познабливание, умеренную головную боль, слабость, несильную миалгию. У больных появляются заложенность носа с необильными серозными выделениями, чувство першения в носоглотке, чиханье, сухой кашель. При осмотре больных отмечают слабую или умеренную гиперемию слизистой оболочки носовых ходов и задней стенки глотки, инъекцию сосудов склер, иногда увеличение шейных и подчелюстных лимфатических узлов. Нередко через несколько дней наступает выздоровление.
• Развитие патологических процессов в нижних отделах дыхательных путей более характерно для детей младшего возраста, но возможно и у взрослых. С 3-4-го дня болезни состояние больного ухудшается. Нарастает температура тела, достигая иногда высоких цифр, постепенно усиливается кашель - сначала сухой, а затем со слизистой мокротой. Появляется чувство тяжести в груди, иногда возникает одышка экспираторного типа. Кашель могут сопровождать симптомы удушья. При осмотре больных можно отметить конъюнктивит, инъекцию склер, иногда цианоз губ. Слизистая оболочка носа, ротоглотки и задней стенки глотки умеренно гиперемирована, с небольшой зернистостью. В легких выслушивают жесткое дыхание, большое количество сухих хрипов в различных отделах. Эта симптоматика соответствует картине острого бронхита.
• Пневмония может развиваться в первые дни РС-инфекции даже при отсутствии выраженных признаков интоксикации и нормальной температуре тела. В этом случае пневмонию рассматривают как следствие репродукции РС-вируса. Ее отличает быстрое нарастание дыхательной недостаточности. В течение нескольких часов усиливаются общая слабость и одышка. При развитии астматического синдрома, характерного для РС-инфекции, особенно у детей младшего возраста, одышка может приобрести экспираторный характер (с удлиненным свистящим выдохом). Кожный покров становится бледным, возникает цианоз губ и ногтевых фаланг. Нарастает тахикардия. При перкуссии легких можно выявить чередующиеся участки притупления и коробочного звука, при аускультации обнаруживают диффузные сухие и влажные разнокалиберные хрипы.
Рентгенологически можно выявить усиление легочного рисунка, участки эмфиземы и ателектазы. Развитие пневмонии в более поздние сроки РС-инфекции может быть связано с активацией собственной бактериальной флоры; в этом случае ее расценивают как осложнение. Пневмония чаще поражает нижние доли легких и по характеру может быть различной:
◊ интерстициальной;
◊ очаговой;
◊ сегментарной.
Дифференциальная диагностика
РС-инфекцию следует отличать от других ОРВИ, гриппа и пневмоний различной этиологии. Заболевание развивается постепенно. Назофарингит, бронхит и бронхиолит как клинические варианты РС-инфекции практически не отличимы от аналогичных состояний при других ОРВИ. Раннюю вирусную пневмонию отличает быстрое нарастание признаков дыхательной недостаточности, развитие астматического синдрома, характерного для РС-инфекции.
Лабораторная диагностика
Вирусологические исследования в клинической практике применяют редко (выделение вируса из носоглоточных смывов, выявление его Аг в эпителии респираторного тракта с помощью РИФ). При постановке РН и других серологических реакций, применяемых при диагностике ОРВИ (РСК, РТГА и др.), ретроспективно диагноз подтверждают нарастанием титра АТ.
Осложнения и исходы
Осложнения связаны с активацией собственной бактериальной флоры. Наиболее частые из них - пневмония и отит. У детей опасно развитие ложного крупа. Прогноз заболевания обычно благоприятный. При развитии пневмонии у детей грудного возраста прогноз может быть неблагоприятным.
Лечение
Неосложненные случаи лечат на дому, применяя симптоматические средства. При невозможности быстрого определения этиологии пнев-
монии (не исключено присоединение вторичной бактериальной флоры) применяют антибиотики и сульфаниламидные препараты. Астматический синдром купируют парентеральным введением эфедрина, эуфиллина, антигистаминных препаратов, в тяжелых случаях - глюкокортикоидов.
Профилактические мероприятия
Аналогичны таковым при гриппе. Специфическая профилактика не разработана.
РИНОВИРУСНАЯ ИНФЕКЦИЯ
Острое антропонозное вирусное заболевание с избирательным поражением слизистой оболочки носа.
Краткие исторические сведения
Впервые вирусная этиология так называемого заразного насморка установлена И. Фостером (1914), однако возбудитель выделен Ч. Эндрюсом лишь в 1953 г. Позднее Д. Тирелл (1960) выделил целую группу вирусов с аналогичным цитопатическим эффектом, получившую название риновирусов.
Этиология
Возбудители - РНК-геномные вирусы рода Rhinovirus семейства Picornaviridae. В настоящее время известно более 110 серотипов риновирусов, объединенных в группы Н и М. Во внешней среде вирионы нестойки, инактивируются при 50 °С в течение 10 мин, при высушивании на воздухе большая часть теряет инфекционность через несколько минут. Кроме вирусов, патогенных для человека, известны риновирусы, патогенные для крупного рогатого скота и лошадей.
Эпидемиология
Резервуар и источник инфекции - человек (больной или носитель). Больной начинает выделять возбудитель за 1 сут до проявления клинических признаков болезни и на протяжении последующих 5-9 сут. Крупный рогатый скот и лошади заражаются вирусами других серотипов, не представляющими опасности для человека.
Механизм передачи - аэрозольный, возможно заражение контактнобытовым путем через предметы обихода и руки, контаминированные незадолго до этого выделениями больного из горла и носа.
Естественная восприимчивость людей
Естественная восприимчивость людей высокая, не зависит от возраста, хотя заболевание чаще встречают у взрослых.
Основные эпидемиологические признаки
Болезнь распространена повсеместно, в умеренном климате ее регистрируют в течение всего года с подъемом заболеваемости весной и осенью. Риновирусы вызывают до 25-40% всех ОРВИ. Эпидемии обычно локальные. Болеют люди всех возрастных групп, нередко по несколько раз в год. Наиболее часто заболевание регистрируют у детей до 5 лет.
Патогенез
Вирусы проникают в организм человека через нос. Их репродукция реализуется в эпителиоцитах слизистой оболочки носа, что сопровождается дегенерацией клеток, развитием местной воспалительной реакции катарального характера с полнокровием и расширением сосудов, умеренной лимфомоноцитарной инфильтрацией, резким набуханием, отечностью слизистой оболочки и обильной секрецией. У детей воспалительный процесс может захватывать другие отделы дыхательных путей - гортань, трахею, бронхи. Установлено, что риновирусная инфекция может быть причиной развития хронических отоларингологических заболеваний.
В ходе инфекционного процесса образуются вируснейтрализующие АТ, сохраняющиеся в течение нескольких лет. Однако постинфекционный иммунитет строго типоспецифичен, поэтому возможны повторные заболевания при инфицировании возбудителем иного серовара.
Клиническая картина
Инкубационный период не превышает 7 дней, в среднем продолжаясь 1-3 дня. Острое начало заболевания проявляется заложенностью носа, сухостью и саднением в носоглотке, небольшим общим недомоганием. Развивается катаральный ринит с обильным серозным, а затем слизистым отделяемым. Может присоединиться сухой кашель. Выраженный насморк - это ведущий и постоянный синдром. Обращает внимание несоответствие выраженного ринита и слабых общетоксических
проявлений (субфебрильная или нормальная температура тела, удовлетворительное общее состояние).
При осмотре больных отмечают обильную ринорею, гиперемию и небольшой отек слизистой оболочки ротоглотки, мелкую зернистость мягкого нёба. Иногда наблюдают слезотечение, гиперемию конъюнктив, инъекцию сосудов склер. Длительность клинических проявлений обычно не превышает 1 нед, иногда может затягиваться до 10-14 дней.
Дифференциальная диагностика
Риновирусную инфекцию следует отличать от других ОРВИ. Опорные признаки риновирусной инфекции - обильная ринорея при отсутствии или слабой выраженности интоксикации.
Лабораторная диагностика
На практике обычно не применяют, хотя возможны вирусологические и серологические исследования (выделение вируса из смывов из носа, РН и РИФ). Изменения в гемограмме не характерны.
Осложнения и исходы
Осложнения встречают редко. Обычно они связаны с присоединением вторичной, чаще дремлющей, инфекции (синуситы, отиты, бронхиты, пневмонии и др.).
Лечение
Проводят симптоматическое лечение.
Профилактические мероприятия
Аналогичны таковым при гриппе. Большое количество антигенных вариантов риновируса затрудняет разработку средств активной профилактики инфекции.
КОРОНАВИРУСНАЯ ИНФЕКЦИЯ
Коронавирусная инфекция - острое вирусное заболевание с преимущественным поражением верхних дыхательных путей, чаще в виде ринита, или ЖКТ по типу гастроэнтерита.
Краткие исторические сведения
Возбудитель заболевания выделил Д. Тиррел с коллегами из носоглотки при остром рините (1965). Позднее аналогичные вирусы выделили и из испражнений при гастроэнтерите у детей Э. Каул и С. Кларк (1975).
Этиология
Возбудители - РНК-геномные вирусы рода Coronavirus семейства Coronaviridae. Зрелые вирионы окружены суперкапсидом, пронизываемым редко расположенными гликопротеиновыми шипами, состоящими из тонкой хрупкой шейки и массивной шаровидной, овальной или грушевидной головки, что придает шипам вид короны. Патогенными для человека признаны респираторные и кишечные коронавирусы. У человека доминируют респираторные коронавирусные инфекции, регистрируемые повсеместно как обычная простуда или ОРВИ. Антигенная структура вируса сложная, отличается от таковой у вирусов, патогенных для животных. Выделяют 4 антигенные группы вирусов. Антигенные компоненты локализованы в наружной короне, промежуточной мембране и внутреннем нуклеокапсиде вирионов. Вирусы неустойчивы во внешней среде, разрушаются под действием эфира, хлороформа. Мгновенно разрушаются при температуре 56 °С, а при 37 °С - за 10-15 мин. Хорошо переносят замораживание.
Эпидемиология
Резервуар и источник инфекции - больной человек. Период контагиозности больного неопределенно долгий.
Механизмы передачи - воздушно-капельный и фекально-оральный.
Естественная восприимчивость людей
Естественная восприимчивость людей высокая, к возбудителю чувствительны все возрастные группы населения. Постинфекционный иммунитет носит типоспецифический характер. Антигенная разнородность возбудителей обусловливает высокую частоту реинфекций вирусом других серологических типов.
Основные эпидемиологические признаки
Коронавирусные инфекции распространены повсеместно, составляя 4,2-9,4% всех ОРВИ. Заболеваемость имеет семейный характер. Отме-
чают спорадические случаи и эпидемические вспышки. Болеют преимущественно дети и подростки. У взрослых болезнь чаще всего протекает малосимптомно или стерто. Для респираторных поражений характерна сезонность с пиком в зимние и весенние месяцы. Описаны вспышки, протекающие лишь с симптомами поражения ЖКТ, у детей и обслуживающего персонала больниц и детских учреждений.
Патогенез
Изучен недостаточно. Входными воротами для возбудителя может быть слизистая оболочка верхних дыхательных путей. В этих случаях болезнь развивается по типу ОРВИ, у детей иногда поражение распространяется на бронхи и легкие. При реже встречающемся фекальнооральном механизме передачи заболевание проявляется в виде гастроэнтерита.
Заболевание сопровождается синтезом АТ, не защищающих, однако, от повторного заражения.
Клиническая картина
Инкубационный период ограничен 2-3 днями. При аэрогенном заражении чаще всего развивается клиническая картина, не отличимая от риновирусной инфекции (см. выше раздел «Риновирусная инфекция»).
Характерны следующие симптомы:
- недомогание;
- умеренная головная боль;
- боль при глотании, чихании;
- выраженная ринорея.
Интоксикация слабая, температура тела чаще нормальная или субфебрильная. Общая продолжительность проявлений не превышает 5-7 дней.
У детей иногда возникает симптоматика поражения нижних отделов дыхательного тракта:
- кашель;
- боли в груди при дыхании.
При осмотре можно выявить шейный лимфаденит, воспалительный процесс в гортани, сухие свистящие хрипы в легких.
Реже заболевание протекает по типу острого кратковременного гастроэнтерита без сопутствующих симптомов со стороны верхних дыхательных путей.
Дифференциальная диагностика
Коронавирусную инфекцию дифференцируют от риновирусной, реже от РС-инфекции, вирусных и бактериальных гастроэнтеритов, что по одним клиническим признакам практически невозможно.
Лабораторная диагностика
Диагноз следует подтвердить одним или несколькими лабораторными методами:
- выделением вируса;
- выявлением его Аг в клетках эпителия носа;
- определением титров специфических АТ в РН, РНГА, ИФА.
Осложнения и исходы
Осложнения обычно не характерны. Прогноз заболевания благоприятный.
Лечение
Проводят симптоматическое лечение.
Профилактические мероприятия
Включают мероприятия, аналогичные таковым при гриппе и ОРВИ. Средства специфической профилактики не разработаны.
ТЯЖЕЛЫЙ ОСТРЫЙ РЕСПИРАТОРНЫЙ СИНДРОМ
ТОРС (атипичная пневмония, SARS) - вирусная, по-видимому, антропонозная инфекция с преимущественным поражением бронхолегочной системы, в тяжелых случаях имеющая вид пневмонии с выраженной дыхательной недостаточностью.
Краткие исторические сведения
Болезнь под названием «атипичная пневмония», позднее названная также SARS (ТОРС) впервые обнаружена в южной провинции Китая - Гуандонге в ноябре 2002 г. Затем случаи заболевания были зарегистрированы в странах Юго-Восточной Азии (Китай, Гонконг, Тайвань, Син-
гапур, Вьетнам), в Северной Америке (США, Канада), единичные случаи отмечены в странах Европы, в Бразилии, Японии, Таиланде и Южной Африке. 17 марта 2003 г. ВОЗ официально объявила, что этиология ТОРС установлена на основании созданных диагностических тестов и открыт новый коронавирус.
Этиология
Возбудитель - так называемый SARS-ассоциированный коронавирус (SARS-Co V). Это первый из коронавирусов, не относящийся ни к одной из известных групп и способный вызывать тяжелое заболевание у человека. Морфологически представляет собой сходные с другими коронавирусами частицы размером от 60 до 130 нм в диаметре. Обладает относительной устойчивостью к воздействию факторов окружающей среды, в моче и фекалиях при комнатной температуре сохраняет жизнеспособность до 2-4 дней. Нагревание до 56 °С и различные дезинфектанты относительно быстро инактивируют данный вирус.
Эпидемиология
Источники инфекции - больные и реконвалесценты ТОРС. Высокая концентрация вирусной РНК (до 100 млн молекул в 1 мл) установлена в мокроте и плазме больных в острую фазу заболевания, а также в фекалиях во время поздней реконвалесценции, что способствует длительной передаче вируса от переболевших. Предварительные данные исследования назофарингеального отделяемого методом ПЦР установили, что максимальная концентрация вируса выявляется на 10-е сутки от появления респираторного синдрома и снижается до минимальных значений только к 15-м суткам. Возбудитель высоко контагиозен, индекс контагиозности по материалам вспышек заболевания достигает 50%.
Механизм передачи - воздушно-капельный и, возможно, воздушнопылевой и контактный пути. Заражение более вероятно в условиях тесного бытового (внутрисемейного) и госпитального общения. Допустима контаминация вирусом предметов в окружении больного. Отмечено много случаев заражения медицинских работников, а также лиц, навещавших больных.
Возможность распространения вируса от вируса от источника инфекции определяется многими факторами:
- выраженностью катаральных явлений (кашель, чихание, насморк);
- темепратурой;
- влажностью;
- скоростью движения воздуха.
Сочетание этих факторов определяет конкретную эпидемиологическую ситуацию. Описаны вспышки в многоквартирных домах, где люди непосредственно контактировали друг с другом. Возможно также, что распространение вирусов происходило и через вентиляционную систему. Болезнь распространяется между странами и регионами преимущественно по транспортным связям. Наибольшее значение имеет передвижение по авиалиниям. Всего в мире за время регистрации заболеваний с 11 февраля по 11 июля 2003 г. зарегистрировано 8437 больных и 813 умерших. В Китае, включая Гонконг, зарегистрировано 84% случаев и еще 8% - на острове Тайвань. В России зарегистрирован 1 завозной случай, закончившийся выздоровлением заболевшего. В 7 странах возникли вторичные случаи в результате местной передачи.
Естественная восприимчивость людей - вероятность заражения зависит от инфицирующей дозы вируса, его вирулентности и восприимчивости заразившегося. Несмотря на высокую вирулентность, восприимчивость к вирусу ТОРС невысокая, что связано с наличием у большинства людей антител к коронавирусам.
Патогенез
Патогенез ТОРС изучен недостаточно. Поражается альвеолярный эпителий, повышение проницаемости клеток приводит к нарушению водно-электролитного баланса. Развиваются недостаточность сурфактанта и легочный дистресс-синдром. Уже через 5-7 дней заболевания возникает пневмония, сначала очаговая, которая быстро превращается в сливную долевую. Коронавирусы, способные к индукции апоптоза, вызывают некроз пораженных тканей. Поражаются также макрофаги, развивается лимфопения, подавляется синтез ИФН.
Клиническая картина
Инкубационный период 2-12, чаще 2-7 дней. Начало болезни острое, с ознобом и повышением температуры до 38 °С и выше. Отмечаются головная боль, недомогание, головокружение, миалгии, иногда умеренный катаральный синдром и боли в горле. Сухой кашель наблюдают у 40% больных.
По наблюдениям в госпитале Гонконга частота начальных симптомов болезни была следующей:
- лихорадка - 100%;
- недомогание - 100%;
- озноб - 97%;
- головная боль - 84%;
- головокружение - 61%;
- миалгии - 81%;
- кашель - 39%;
- боли в горле - 23%;
- ринит - 23%.
Через 3-7 дней начинается респираторная фаза поражения нижних дыхательных путей. Усиливаются или появляются сухой непродуктивный кашель, затрудненное дыхание, нарастающая одышка, цианоз. Усиливаются гипоксия и дыхательная недостаточность, в 10-20% случаев требуется ИВЛ. Могут присоединиться тошнота и рвота, иногда жидкий стул. Температура тела у большинства пациентов стабилизируется на высоких цифрах, но иногда даже на фоне прогрессирования заболевания остается нормальной.
В некоторых случаях лихорадка принимает двухволновой характер. При осмотре больного прежде всего обращают на себя внимание гипертермия и прогрессирующая одышка. Хрипы в легких прослушиваются не всегда.
Рентгенологическое исследование легких в течение начального лихорадочного периода может не выявить каких-либо нарушений. В респираторной фазе поражение легких носит разнообразный характер. У большинства пациентов удается обнаружить несимметричные единичные фокальные образования, односторонние или множественные двусторонние интерстициальные или сливающиеся инфильтраты, захватывающие значительные участки и доли легких.
Длительность заболевания - от нескольких дней до 3-4 нед. Тяжесть заболевания варьирует от легких до тяжелейших форм с нарастающей легочной дисфункцией и летальным исходом.
Дифференциальная диагностика
Дифференциальную диагностику проводят с гриппом и другими ОРВИ, облитерирующим бронхитом, пневмониями различной этиологии.
Лабораторная диагностика
Распространенные лабораторные нарушения:
- лейкопения;
- лимфопения;
- тромбоцитопения;
- высокий уровень лактатдегидрогеназы, аспартатдегидрогеназы, креатининкиназы;
- падение протромбинового индекса.
В специализированных лабораториях используют вирусологические, электронно-микроскопические, серологические методы (ИФА, РНИФ), а также ПЦР и методы секвенирования генома.
Осложнения и исходы
Опасным осложнением при тяжелых формах заболевания считают развитие респираторного дистресс-синдрома. Летальность значительно колеблется в различных возрастных группах - от 1% у молодых людей до 50% в возрастной группе от 45 до 65 лет и старше.
Лечение
Эффективных этиотропных средств не существует. Рекомендуют противовирусные препараты (рибавирин по 8 мг/кг каждые 8 ч внутривенно) в комбинации с гидрокортизоном (по 2 мг/кг каждые 6 ч внутривенно), бронходилататоры с использованием небулайзера. Дозы препаратов и длительность курсового лечения не отработаны, клинический эффект вариабелен. Для профилактики бактериальных осложнений назначают антибиотики (макролиды, фторхинолоны).
Профилактические мероприятия
Больных госпитализируют, находившихся с ними в близком контакте лиц изолируют на 10 дней. Устанавливают строгий медицинский контроль за прибывающими из стран, где зарегистрированы заболевания атипичной пневмонией (SARS). Ограничивают миграцию населения как в страны, где зарегистрированы случаи заболевания, так и из этих стран. Проводят текущую дезинфекцию в очаге заболевания, а также обработку транспортных средств, помещений в местах скопления людей, проветривание и облучение помещений УФ-лампами.
Важнейшую роль в предупреждении распространения ТОРС играют меры индивидуальной защиты при контакте с лицами, потенциально инфицированными вирусом. Необходимо применять индивидуальные маски для персонала и пациентов, резиновые перчатки для персонала, которые не рекомендуется использовать повторно, специальные халаты и шапочки (желательно одноразового применения). Обязательно мытье рук с мылом перед и после контакта с больными. Если вода по тем или иным причинам недоступна, руки обрабатывают спиртосодержащими растворами. Все биологические выделения больного тщательно собирают и уничтожают, а предметы окружающей среды обрабатывают раствором гипохлорида натрия.
Особое место среди мер защиты от распространения эпидемии ТОРС принадлежит своевременному выявлению больных и контактных с ними лиц, а также лиц, прибывших из регионов, признанных очагами этой инфекции, с последующей изоляцией таких лиц на срок до 10 сут под медицинским контролем с ежедневной термометрией и осмотром для раннего выявления заболевших. Ведущая роль в мероприятиях по обсервации принадлежит государственным органам.
Следует помнить, что в соответствии с рекомендациями ВОЗ диагноз ТОРС может быть заподозрен у пациентов, прибывших из регионов, где документально подтверждена эпидемия данного заболевания или есть сообщение о контакте пациента с больными ТОРС, а также имеется соответствующая клиническая картина заболевания:
- острое начало с лихорадки выше 38 °С;
- кашель;
- затруднение дыхания и изменения со стороны легких (рентгенографически подтвержденная атипичная пневмония, острый респираторный дистресс-синдром).
МИКОПЛАЗМЕННАЯ РЕСПИРАТОРНАЯ ИНФЕКЦИЯ
Микоплазменная респираторная инфекция - острое антропонозное инфекционное заболевание с поражением верхних дыхательных путей и развитием пневмонии.
Краткие исторические сведения
Возбудитель заболевания впервые выделил М. Итон от больных первичными атипичными пневмониями (1944). Первоначально возбудитель отнесен к вирусам и назван агентом Итона. Позднее классифици-
рован Р. Чэноком с коллегами (1962) как Mycoplasma pneumoniae. Изучение возбудителя и вызванного им заболевания в нашей стране связано с именами известных вирусологов и клиницистов (Г.Я. Каган, С.В. Прозоровский, Р.С. Дрейзин, В.И. Покровский и др.).
Этиология
Mycoplasma pneumoniae - бактерии рода Mycoplasma семейства Mycoplasmataceae класса Mollicutes. В настоящее время известно более 80 видов микоплазм. Различные виды микоплазм выделяют из внешней среды от растений, животных и человека. Они могут быть возбудителями инфекционных заболеваний, комменсалами микроорганизмов и сапрофитами. Человек - естественный хозяин 14 видов (основные из них - M. pneumoniae, M. hominis, M. fermentans и M. genitalium). Представлены полиморфными бактериями, образующими в зависимости от условий культивирования палочковидные, кокковидные и нитевидные ветвящиеся структуры. Имеют единую антигенную структуру, антигенные вариации не свойственны. Подобно вирусам могут проходить через бактериальные фильтры, но, как и бактерии, растут на специальных бесклеточных средах.
В отличие от других микоплазм M. pneumoniae образует гемолизин и гемагглютинины, ферментирует углеводы. В составе аэрозоля в помещениях сохраняет жизнеспособность до 30 мин, при 4 °С - 37 ч, при 37 °С - 5 ч. Отсутствие клеточной стенки и свойства цитоплазматической мембраны определяют чувствительность к действию УФО и рентгеновского облучения, ультразвуку, изменению рН среды и ее температуры, а также к вибрации.
Эпидемиология
Резервуар и источник инфекции - человек (больной или носитель). Больной выделяет бактерии в среднем 7-10 дней от начала болезни, иногда несколько дольше. В неэпидемические периоды здоровое носительство встречают редко. В то же время транзиторное носительство при тесном и длительном общении с больными в очагах респираторного микоплазмоза наблюдают довольно часто.
Механизм передачи - аэрозольный. Возможно заражение воздушнопылевым, а также контактно-бытовым путем через контаминированные возбудителем руки или предметы обихода.
Естественная восприимчивость людей
Лица с различными формами иммунодефицита на фоне системных, лимфопролиферативных и соматических заболеваний, лица с синдромом Дауна и серповидноклеточной анемией чаще подвергаются микоплазменному инфицированию. Определяют наследственные факторы. Длительность постинфекционного иммунитета достигает 5-10 лет и более. Бессимптомные формы болезни сопровождаются формированием менее напряженного иммунитета.
Основные эпидемиологические признаки
Респираторный микоплазмоз - широко распространенное заболевание. Характерна периодичность подъемов заболеваемости с интервалом 2-4 года. Случаи заболевания чаще встречают в холодное время года. Среди острых респираторных заболеваний микоплазмозы составляют 5-6%, а при острых пневмониях - от 6 до 22%. Во время эпидемических вспышек доля микоплазмозов может повышаться до 50% и более. Респираторный микоплазмоз относят к малозаразным болезням. Распространяется микоплазменная инфекция довольно медленно, с постепенным вовлечением отдельных членов коллектива в эпидемический процесс. Определенное влияние на интенсивность передачи инфекции оказывают скученность, длительность и близость контактов с инфицированными лицами. Широкую распространенность возбудитель имеет в организованных коллективах. Во вновь сформированных коллективах заболевание выявляют особенно часто в течение первых 2-3 мес. M. pneumoniae может быть причиной внутрибольничного инфицирования, вплоть до возникновения вспышек пневмоний среди детей и взрослых в стационарах различного профиля. Часто встречают сочетание микоплазменной и вирусной инфекций. Формирование смешанного инфицирования происходит преимущественно за счет ассоциации M. pneumoniae с вирусами гриппа, парагриппа, аденовирусом и РС-вирусом. В настоящее время микоплазменную респираторную инфекцию принято рассматривать как ВИЧ-индикаторное заболевание.
Патогенез
Тропность возбудителя к эпителию дыхательного тракта определяет возможность поражений слизистой оболочки всех отделов дыхательных путей с развитием в них периваскулярных и перибронхиальных воспалительно-инфильтративных процессов, тромбозов артериол и венул. Выделение бактериями супероксидантов вызывает блокаду меха-
низмов мукоцилиарного клиренса, а затем и гибель эпителия воздухоносных путей. Следствие этого - развитие местных воспалительных реакций в бронхах и прилежащих тканях. Позднее происходит вовлечение в процесс альвеол, что сопровождается уплотнением их стенок. Иногда наблюдают присоединение диссеминированных поражений, протекающих с развитием артритов, менингоэнцефалитов, гемолитической анемии и кожных высыпаний.
В легочной ткани развиваются клеточные иммунные реакции, протекающие по типу ГЗТ. Они лежат в основе формирования очагов некроза эпителия с заполнением альвеол экссудатом или отечной жидкостью, преимущественно в прикорневых зонах легких.
С развитием реакций ГЗТ и депонированием иммунных комплексов в прилегающих тканях связывают возникновение артритов и кожных поражений.
В результате действия гемолизина, перекисей, а также способности M. pneumoniae вызывать синтез холодовых АТ класса IgM (выявляют приблизительно у 50% больных) возможно развитие гемолитической анемии. Последнее определяется способностью холодовых АТ перекрестно реагировать с мембранными Аг микоплазм и Ii-Аг эритроцитов (Аг 1-го класса). Внутрисосудистый гемолиз приводит к микроциркуляторным расстройствам и появлению точечных геморрагий на коже и в тканях легкого, а также геморрагических плевритов.
Клинические наблюдения и экспериментальные исследования на добровольцах и лабораторных животных показали, что микоплазменная респираторная инфекция может протекать в виде пневмонии, ларингита, ОРВИ, а также осложнять течение гриппа, аденовирусной и РС-инфекции.
Клиническая картина
Инкубационный период варьирует от нескольких дней до 1 мес. При иммунодефицитных состояниях (например, ВИЧ-инфекции) заболевание может развиться как клинически манифестная инфекция с поражением органов дыхания, вызванная ранее находившимся в организме возбудителем. Микоплазменная респираторная инфекция клинически может протекать в виде различных вариантов ОРВИ и пневмонии.
Микоплазменные острые респираторные заболевания могут проявляться в виде фарингита, ринофарингита, ларингофарингита и бронхита со свойственной этим состояниям симптоматикой.
Общетоксические симптомы у взрослых проявляются умеренно:
- субфебрильная или нормальная температура тела;
- познабливание;
- небольшая слабость;
- головная боль;
- ломота в теле;
- недомогание.
У детей токсикоз обычно более выражен. Больные жалуются на сухой кашель, иногда сильный и мучительный, а также насморк, боли в горле.
При осмотре можно отметить конъюнктивит, инъекцию сосудов склер, небольшое увеличение подчелюстных и шейных лимфатических узлов, гиперемию и иногда зернистость слизистой оболочки ротоглотки. В легких выслушивают жесткое дыхание и сухие хрипы. Выздоровление наступает через несколько дней, иногда затягиваясь до 2 нед.
Острая микоплазменная пневмония - наиболее характерная форма, развивающаяся значительно чаще, чем проявление микоплазменной инфекции в виде ОРВИ. Она может начинаться внезапно или на фоне ОРВИ микоплазменной этиологии через несколько дней от начала заболевания. Возникают озноб, миалгии и артралгии, температура тела повышается до 38-39 °С.
Сухой кашель усиливается и постепенно увлажняется, появляется слизисто-гнойная вязкая и скудная мокрота. Одышка и цианоз не характерны, нарушения со стороны сердечно-сосудистой системы не выражены. В некоторых случаях одновременно возможно развитие тошноты, рвоты и жидкого стула.
При осмотре больных отмечают бледность кожного покрова, инъекцию склер. У части больных вокруг суставов появляется полиморфная экзантема. Физикальные изменения со стороны легких отсутствуют либо проявляются в виде жесткого дыхания, рассеянных сухих хрипов в небольшом количестве, влажных мелкопузырчатых хрипов на ограниченном участке. В такой ситуации особое значение приобретает рентгенография легких, выявляющая воспалительные инфильтраты очагового, сегментарного или интерстициального характера. Рентгенологическая картина долго сохраняется после исчезновения клинических симптомов. Микоплазменная пневмония часто завершается формированием бронхоэктазов, пневмосклероза или деформирующего бронхита.
Дифференциальная диагностика
Отличить микоплазменные острые респираторные заболевания от ОРВИ только по клинической картине невозможно.
Подозрение на микоплазменную природу пневмонии складывается на основании ее специфических клинических черт:
- умеренной интоксикации;
- упорного сухого кашля;
- отсутствия симптомов легочной недостаточности;
- скудости физикальных проявлений.
Микоплазменную пневмонию дифференцируют от пневмоний иной этиологии, ку-лихорадки, орнитоза, легионеллеза, туберкулеза легких. При установлении точного этиологического диагноза микоплазмоза необходимо исследовать иммунный статус больного, а также исключить возможность ВИЧ-инфекции, поскольку респираторный микоплазмоз как оппортунистическая инфекция часто развивается на фоне иммунодефицита.
Лабораторная диагностика
Основана на микробиологическом выделении возбудителя из крови, мокроты, смывов носоглотки или на определении Аг и АТ к нему в различных биологических жидкостях, чаще всего в сыворотке крови. В гемограмме отмечают нормальное количество лейкоцитов или небольшой лейкоцитоз, а также лимфоцитоз. Возможно выделение бактерий из мокроты и носовой слизи. Основу серологической диагностики составляют РНГА, РСК, РН, а также иммунофлюоресцентная микроскопия, выявляющая Аг возбудителя в клетках носоглоточных смывов.
Осложнения и исходы
Осложнениями микоплазменной респираторной инфекции могут быть:
- экссудативный плеврит;
- миокардит;
- энцефалит и менингоэнцефалит.
Лечение
Препараты выбора для этиотропной терапии - эритромицин, азитромицин и кларитромицин. Антибиотик резерва - доксициклин. Препараты назначают в средних терапевтических дозах; длительность курса зависит от клинического эффекта.
Эпидемиологический надзор
По данным различных авторов, доля микоплазменных заболеваний среди прочих острых респираторных заболеваний колеблется от 2,1 до 14,6%, а с учетом бессимптомных и слабовыраженных форм респираторного микоплазмоза эти данные возрастают до 20-60%.
Особый интерес представляют клинико-эпидемиологические исследования с широким использованием данных как серологических, так и рентгенологических обследований больных с целью установления этиологической роли M. pneumoniae.
Профилактические мероприятия
Профилактические мероприятия аналогичны таковым при других острых респираторных заболеваниях. Больных микоплазмозом необходимо изолировать до исчезновения клинических проявлений болезни (при пневмониях - на 2-3 нед, при острых респираторных заболеваниях - на 5-7 сут). Препаратов для специфической профилактики нет.
КОРЬ (MORBILLI)
Корь - острое вирусное антропонозное заболевание с интоксикацией, катаральным поражением верхних дыхательных путей и пятнистопапулезной экзантемой.
Краткие исторические сведения
Заболевание известно со времен глубокой древности. Его подробное клиническое описание составили арабский врач Разес (IX в.), англичане Т. Сиднэм и Р. Мортон (XVII в.). С XVIII в. корь рассматривают как самостоятельную нозологию. Вирусную этиологию заболевания доказали А. Эндерсон и Д. Гольдбергер (1911). Возбудитель выделили Д. Эндерс и Т.К. Пиблс (1954). Эффективную серопрофилактику кори разработал Р. Дегквитц (1916-1920). Живую вакцину, применяемую с 1967 г. для плановой вакцинации, разработали А.А. Смородинцев и соавт. (1960).
Этиология
Возбудитель - РНК-геномный вирус рода Morbillivirus семейства Paramyxoviridae. Все известные штаммы вируса принадлежат к одному серовару. Антигенная структура сходна с возбудителями парагриппа и эпидемического паротита.
К наиболее важным Аг относят:
- гемагглютинин;
- гемолизин;
- нуклеокапсид;
- мембранный белок.
Вирус малоустойчив во внешней среде, быстро инактивируется под влиянием солнечного света, УФ-лучей, при нагревании до 50 °С. При комнатной температуре сохраняет активность около 1-2 сут, при низкой температуре - в течение нескольких недель. Оптимальная температура для сохранения вируса - от -15 до -20 °С.
Эпидемиология
Резервуар и источник инфекции - больной человек, выделяющий вирус с последних 1-2 сут инкубационного периода, в течение всего продромального периода (за 3-4 дня до появления сыпи) и в первые 4 дня высыпаний. При осложнениях, иногда сопровождающих болезнь, возможно удлинение заразного периода до 10 сут с момента появления сыпи. Здоровое носительство невозможно. Обнаружение в сыворотке крови части людей специфических противокоревых АТ, несмотря на отсутствие указания о перенесении болезни, вероятно, связано с дефектами ее диагностики.
Механизм передачи - аэрозольный, путь передачи - воздушнокапельный. В составе носоглоточной слизи вирус выделяется из организма при кашле, чихании, разговоре и даже при дыхании. С потоком воздуха может разноситься на значительное расстояние. Заражение может произойти при вдыхании воздуха в помещении, где незадолго до этого находился больной корью. Вследствие низкой устойчивости во внешней среде передача вируса контактно-бытовым путем невозможна. При заболевании беременной корью возможна реализация вертикального пути передачи инфекции.
Естественная восприимчивость людей
Естественная восприимчивость людей очень высокая, постинфекционный иммунитет пожизненный. Повторные заболевания корью крайне редки.
Основные эпидемиологические признаки
Развитие эпидемического процесса кори определяют следующие основные факторы:
- абсолютная восприимчивость людей;
- пожизненная невосприимчивость у переболевших;
- аэрозольный механизм передачи;
- слабая устойчивость вируса во внешней среде;
- интенсивность и характер общения людей.
Высокая и всеобщая восприимчивость к кори в сочетании с легкостью передачи возбудителя обусловливает ее широкое распространение в первую очередь среди детей. В довакцинальный период заболевание было распространено повсеместно и было одной из основных причин смерти детей раннего возраста. В настоящее время корь относят к числу инфекций, подлежащих ликвидации в соответствии с программой ВОЗ. В некоторых странах ее уже не регистрируют. В доиммунизационный период отмечали периодические подъемы заболеваемости с интервалом 2-4 года, высокую очаговость, зимневесеннюю сезонность и преимущественное поражение детей дошкольного возраста. Эпидемический процесс при кори зависит от уровня коллективного иммунитета, определяемого долей переболевших корью среди населения.
Массовая иммунизация внесла изменения в эпидемиологические проявления инфекции:
- увеличила интервалы между подъемами заболеваемости до 8-10 лет;
- сместила сезонность на весенне-летние месяцы;
- способствовала повзрослению инфекции.
В 2007 г. интенсивный показатель заболеваемости корью на территории России составил 0,1 на 100 000 населения. Зарегистрирован всего 161 случай кори. По сравнению с предыдущим 2006 г. заболеваемость корью в стране снизилась в 6,6 раза (2006 г. - 0,66 на 100 000 населения).
В отличие от предыдущих лет заболеваемость корью в 2007 г. была обусловлена циркуляцией нескольких генотипов (вариантов генотипов):
- D6 (группы D6a, D6b, вариант D6b «Андижан 2007»);
- D5 (2 варианта);
- D8 (2 варианта);
- H1 (2 варианта).
При этом, по данным генотипирования, 38% зарегистрированных случаев кори были связаны с импортированием. В 2008 г. зарегистрировано всего 27 случаев кори, из них 4 случая - дети до 14 лет жизни.
Патогенез
Воротами инфекции служат слизистые оболочки верхних дыхательных путей и конъюнктивы. После первичной репликации в эпителиальных клетках и регионарных лимфатических узлах возбудитель проникает в кровь, первичная виремия развивается уже в инкубационном периоде. В результате вирус диссеминирует, фиксируется в различных органах и вторично накапливается в клетках макрофагальной системы. В органах (лимфатических узлах, миндалинах, легких, кишечнике, печени и селезенке, миелоидной ткани костного мозга) развиваются небольшие воспалительные инфильтраты с пролиферацией ретикулоэндотелия и образованием многоядерных гигантских клеток. В инкубационном периоде количество вирусов в организме еще сравнительно невелико и может быть нейтрализовано введением противокоревого иммуноглобулина лицам, контактировавшим с больным корью, не позднее 5-го дня после контакта.
С появлением катаральных симптомов заболевания совпадает возникновение второй волны виремии. Максимальная концентрация вируса в крови сохраняется в течение всего катарального периода и 1-го дня высыпаний, затем резко падает. К 5-му дню высыпаний в крови появляются вируснейтрализующие АТ, а вирус уже не обнаруживают.
Обладая тропностью к эпителиальным клеткам слизистых оболочек и ЦНС, вирус в основном поражает верхние отделы дыхательных путей (иногда также бронхи и легкие), конъюнктиву, в незначительной степени - ЖКТ. Развивается воспаление с появлением гигантских клеток в лимфоидных образованиях кишечника, а также в ЦНС, вследствие чего появляется возможность развития осложнений в виде менингитов и менингоэнцефалитов. Белковые компоненты вируса и биологически активные вещества, высвобождающиеся в ответ на циркуляцию вируса, придают катаральному воспалению в пораженных органах инфекционно-аллергический характер. Специфический воспалительный очаговый процесс с аллергической реакцией, дистрофией эпителия, увеличением проницаемости сосудов, периваскулярной инфильтрацией и отеком лежит в основе формирования коревой энантемы, пятен Филатова-Коплика-Бельского на слизистой оболочке щек и губ, а позже и экзантемы.
Системное поражение лимфоидной ткани, макрофагальных элементов, отделов ЦНС (ретикулярной формации, подбугровой области и др.)
приводит к транзиторному подавлению гуморальных и клеточных иммунных реакций. Ослабление активности неспецифических и специфических факторов защиты, свойственное кори, обширные поражения слизистых оболочек респираторного тракта и ЖКТ, а также снижение витаминного обмена с дефицитом витаминов С и А составляют группу факторов, способствующих возникновению разнообразных бактериальных осложнений.
После выздоровления формируется иммунитет с пожизненным сохранением противокоревых АТ в крови. Вместе с тем считают, что вирус может длительно оставаться в организме человека и быть виновником развития медленной инфекции в форме рассеянного склероза, подострого склерозирующего панэнцефалита, а также некоторых системных заболеваний - системной красной волчанки, системной склеродермии, ревматоидного артрита.
Клиническая картина
Инкубационный период составляет в среднем 1-2 нед, при пассивной иммунизации иммуноглобулином он может удлиняться до 3-4 нед. Существующие клинические классификации выделяют типичную форму кори различных степеней тяжести и атипичную форму.
Цикличность течения заболевания в типичной форме позволяет выделить 3 последовательных периода клинических проявлений кори:
- катаральный период;
- период высыпания;
- период реконвалесценции.
• Катаральный период начинается остро. Появляются общее недомогание, головная боль, снижение аппетита, нарушения сна. Повышается температура тела, при тяжелых формах она достигает 39-40 °С. Признаки интоксикации у взрослых больных выражены значительно больше, чем у детей. С первых дней болезни отмечают насморк с обильными слизистыми, иногда слизисто-гнойными выделениями. Развивается навязчивый сухой кашель, у детей он часто становится грубым, лающим, сопровождается осиплостью голоса и (в ряде случаев) стенотическим дыханием. Одновременно развивается конъюнктивит с отечностью век, гиперемией конъюнктив, инъекцией склер и гнойным отделяемым. Нередко по утрам веки слипаются. Больного раздражает яркий свет. При осмотре больных корью детей выявляют одутловатость лица, гиперемию
слизистой оболочки ротоглотки, зернистость задней стенки глотки. У взрослых эти симптомы выражены незначительно, но наблюдают лимфаденопатию (преимущественно шейных лимфатических узлов), прослушивают жесткое дыхание и сухие хрипы в легких. У части больных отмечают непродолжительный кашицеобразный стул.
На 3-5-й день самочувствие больного несколько улучшается, снижается лихорадка. Однако через день вновь усиливаются проявления интоксикации и катарального синдрома, температура тела поднимается до высоких цифр. В этот момент на слизистой оболочке щек напротив малых коренных зубов (реже на слизистой оболочке губ и десен) можно обнаружить кардинальный клинический диагностический признак кори - пятна Филатова-Коплика- Вельского (см. рис. 9 на цветной вклейке). Они представляют собой несколько выступающие и плотно фиксированные белые пятна, окруженные тонкой каймой гиперемии (вид манной каши). У детей элементы обычно исчезают с появлением экзантемы, у взрослых могут сохраняться в течение первых ее дней. Несколько раньше пятен Филатова-Коплика-Вельского или одновременно с ними на слизистой оболочке мягкого и частично твердого нёба появляется коревая энантема в виде красных пятен неправильной формы величиной с булавочную головку. Через 1-2 сут они сливаются и теряются на общем гиперемированном фоне слизистой оболочки. В это же время при нарастании симптомов интоксикации иногда можно наблюдать диспептические признаки. В целом катаральный период продолжается 3-5 дней, у взрослых иногда затягивается до 6-8 сут.
• Период высыпания сменяет катаральный период. Характерно появление яркой пятнисто-папулезной экзантемы (см. рис. 10 на цветной вклейке), имеющей тенденцию к слиянию и образованию фигур с участками здоровой кожи между ними.
◊ В 1-й день периода высыпания элементы сыпи появляются за ушами, на волосистой части головы, затем в тот же день возникают на лице и шее, верхней части груди.
◊ На 2-й день сыпь покрывает туловище и верхнюю часть рук.
◊ На 3-е сутки элементы экзантемы выступают на нижних конечностях и дистальных отделах рук, а на лице бледнеют.
Нисходящая последовательность высыпаний характерна для кори и служит очень важным дифференциально-диагностическим признаком.
У взрослых сыпь бывает обильнее, чем у детей, она крупнопятнисто-папулезная, часто сливная, при более тяжелом течении заболевания возможно появление геморрагических элементов.
Период высыпания сопровождает усиление катаральных проявлений (насморка, кашля, слезотечения, светобоязни), максимальная выраженность лихорадки и других признаков токсикоза. При обследовании больных часто выявляют признаки трахеобронхита, умеренно выраженные тахикардию и артериальную гипотензию.
• Период реконвалесценции (период пигментации) проявляется улучшением общего состояния больных: их самочувствие становится удовлетворительным, нормализуется температура тела, постепенно исчезают катаральные симптомы. Элементы сыпи бледнеют и угасают в том же порядке, в каком они появлялись, постепенно превращаясь в светло-коричневые пятна. В последующем пигментация исчезает за 5-7 дней. После ее исчезновения можно наблюдать отрубевидное шелушение кожи, в основном на лице. Пигментация и шелушение также служат диагностически важными, хотя и ретроспективными признаками кори. В этот период отмечают снижение активности неспецифических и специфических факторов защиты (коревая анергия). Реактивность организма восстанавливается медленно, в течение нескольких последующих недель и даже месяцев сохраняется пониженная сопротивляемость к различным патогенным агентам.
• К атипичным формам относят митигированную корь. Она развивается у лиц, получивших пассивную или активную иммунизацию против кори или ранее переболевших ею. Отличается более длительным инкубационным периодом, легким течением с мало выраженной или совсем не выраженной интоксикацией, сокращенным катаральным периодом. Пятна Филатова-Коплика-Вельского чаще всего отсутствуют. Сыпь типична, но высыпание может возникнуть одновременно по всей поверхности туловища и конечностей или иметь восходящую последовательность.
• Абортивная корь также относится к атипичным формам заболевания. Начинается как типичная форма, но прерывается через 1-2 дня от начала болезни. Сыпь появляется только на лице и туловище, повышение температуры тела наблюдают обычно только в 1-й день высыпаний.
• Также встречают субклинические варианты кори, выявляемые только при серологическом исследовании парных сывороток крови.
Дифференциальная диагностика
Корь следует дифференцировать от краснухи, скарлатины, псевдотуберкулеза, аллергических (лекарственных и др.) дерматитов, энтеровирусных инфекций, сывороточной болезни и других заболеваний, сопровождающихся появлением кожных высыпаний.
Корь отличает комплекс основных клинических проявлений в катаральном периоде:
- интоксикация;
- насморк с обильными выделениями;
- навязчивый грубый, лающий кашель;
- осиплость голоса;
- выраженный конъюнктивит с отечностью век, инъекцией сосудов склер и гнойным отделяемым;
- фотофобия;
- появление кардинального клинического диагностического признака - пятен Филатова-Коплика-Вельского на 3-5-й день болезни.
Затем возникает яркая пятнисто-папулезная экзантема, имеющая тенденцию к слиянию. Очень важным дифференциально-диагностическим признаком, характерным для кори (за исключением митигированной и абортивной), является нисходящая последовательность высыпаний.
Лабораторная диагностика
В гемограмме при неосложненной кори отмечают лейкопению или нормоцитоз, сдвиг лейкоцитарной формулы влево, лимфоцитоз, появление плазматических клеток, увеличение СОЭ. У взрослых возможны нейтрофилия, лимфопения и анэозинофилия. Выделение вируса из носоглоточных смывов и постановку серологических реакций (РТГА, РСК и РН в парных сыворотках) в клинической практике применяют редко, поскольку их результаты носят ретроспективный характер.
Осложнения и исходы
Самое частое осложнение кори - это пневмония. Ларингиты и ларинготрахеобронхиты у детей младшего возраста могут вести к развитию ложного крупа. Встречают стоматиты. Менингиты, менингоэнцефалиты и полиневриты чаще наблюдают у взрослых, эти состояния обычно развиваются в периоде пигментации. Наиболее грозным, но, к счастью, редким осложнением (чаще у взрослых) бывает коревой энцефалит.
Лечение
Неосложненные формы чаще лечат на дому. Госпитализируют больных с тяжелыми и осложненными формами, а также по эпидемиологическим показаниям. Длительность постельного режима зависит от степени интоксикации и ее продолжительности. Специальной диеты не требуется. Этиотропное лечение не разработано. При интоксикации назначают большое количество жидкости. Проводят уход за полостью рта и глазами. Исключают раздражающее воздействие прямого солнечного и яркого искусственного света. Также назначают антигистаминные и симптоматические препараты. Существуют сообщения о позитивном эффекте ИФН (лейкинферона) при назначении в ранние сроки болезни взрослым больным. В некоторых случаях, при тяжелом и осложненном течении кори, назначают антибиотики. При коревом энцефалите необходимо применять большие дозы преднизолона под прикрытием антибактериальных препаратов.
Эпидемиологический надзор
В условиях спорадической заболеваемости важны активный и систематический сбор, анализ и оценка необходимой информации, постоянный обмен ею между всеми заинтересованными службами и ведомствами. Прежде всего эпидемиологический надзор включает отслеживание широты охвата прививками, иммунологический контроль привитости и защищенности детей. Ретроспективный и оперативный анализ заболеваемости направлен на выявление факторов риска заболеваемости на селения.
Один из принципов эпидемиологического надзора за корью - использование классификации случаев этой инфекции.
• Случай острого заболевания, при котором отмечен один или несколько типичных клинических признаков кори, классифицируют как подозрительный.
• Случай острого заболевания, при котором выявлены клинические признаки, отвечающие стандартному определению случая кори, и эпидемиологическая связь с другим подозрительным или подтвержденным случаем данной болезни, классифицируют как вероятный.
• Случай кори, классифицированный как подозрительный или вероятный, после лабораторного подтверждения диагноза реклассифицируют как подтвержденный.
Выборочные серологические обследования направлены на получение сведений об иммунологической структуре различных социальновозрастных групп населения. Необходимо также анализировать сведения о биологической активности отдельных серий ЖКВ. В последние годы в связи с перспективой ликвидации кори в глобальном масштабе появилась потребность осуществления вирусологического мониторинга за дикими штаммами возбудителя кори.
Профилактические мероприятия
Для активной иммунопрофилактики кори применяют ЖКВ. Ее готовят из вакцинного штамма Л-16, выращенного в культуре клеток эмбрионов японских перепелов. В РФ разрешено применение ЖКВ рувакс (Авентис-Пастер, Франция), комплексной вакцины против кори, краснухи и паротита ММР (Мерк Шарп Доум, США).
ЖКВ прививают детей, не болевших корью, с 12-15-месячного возраста. Ревакцинацию проводят так же, как и вакцинацию, однократно в 6 лет, перед поступлением в школу. Ее цель - защита детей, у которых по той или иной причине иммунитет не сформировался. Иммунизация не менее 95% детей обеспечивает хороший защитный эффект. Для контроля за состоянием иммунитета населения проводят выборочные серологические исследования. Региональный комитет ВОЗ для Европы на 48-й сессии (1998) принял в качестве целей программу «Здоровье 21», предусматривающую элиминацию кори из региона к 2007 г. или раньше. К 2010 г. элиминация заболевания должна быть зарегистрирована и сертифицирована в каждой стране.
Пассивную иммунопрофилактику проводят введением противокоревого иммуноглобулина.
Мероприятия в эпидемическом очаге
Вольного госпитализируют по клиническим и эпидемиологическим показаниям. На дому изоляцию прекращают через 4 дня после появления сыпи, а при осложнениях - через 10 дней. В организованных коллективах, где выявлены случаи заболевания корью, проводят срочную вакцинацию всем непривитым и не болевшим корью, а также лицам, у которых нет сведений о заболевании корью или вакцинации. Пассивная иммунизация (однократное введение иммуноглобулина в первые 5 дней после контакта с больным) показана детям до 3 лет, беременным, боль-
ным туберкулезом и лицам с ослабленной иммунной системой. В очаге инфекции устанавливают медицинское наблюдение за не болевшими корью с 8-го по 17-й, а для получивших иммуноглобулин - по 21-й день. Длительность разобщения детей дошкольного возраста, не болевших корью, составляет 17 и 21 день (в случае введения иммуноглобулина). Привитые и переболевшие дети разобщению не подлежат. В детских учреждениях группы следует изолировать и разместить с учетом сроков разобщения. При появлении в группе новых случаев заболевания разобщение удлиняют на срок, исчисляемый с момента изоляции последнего заболевшего. При возможности такую группу переводят на круглосуточное пребывание.
Дети и подростки с неизвестным прививочным анамнезом и не болевшие корью (или с неизвестным инфекционным анамнезом) считаются непривитыми и подлежат вакцинации. Ревакцинацию таких детей проводят либо в плановом порядке по возрасту, в соответствии с календарем прививок, либо (если ребенок старше 6 лет) позже установленных сроков, но не ранее 6 мес после первой прививки.
КРАСНУХА(RUBEOLA)
Краснуха (германская корь) - антропонозная вирусная инфекция с генерализованной лимфаденопатией и мелкопятнистой экзантемой.
Краткие исторические сведения
Клинические отличия краснухи от скарлатины и кори впервые описаны И. Вагнером (1829). С 1881 г. краснуху считают самостоятельной нозологией. Вирусная природа инфекции доказана Хиро и Тасака (1938). Возбудитель выделен П.Д. Паркманом, Е.Х. Уэллером и Ф.А. Невой (1961). Тератогенное действие установили Н.М. Грегг (1941), Р.А. Канторович и соавт. (1973), О.Г. Анджапаридзе и Т.И. Червонский
(1975).
Этиология
Возбудитель - РНК-геномный вирус рода Rubivirus семейства Togaviridae. Все известные штаммы относят к одному серотипу. Во внешней среде вирус быстро инактивируется под воздействием УФ-лучей, дезинфектантов и нагревания. При комнатной температуре
вирус сохраняется в течение нескольких часов, хорошо переносит замораживание. Он проявляет тератогенную активность.
Эпидемиология
Резервуар и источник инфекции - человек с клинически выраженной или стертой формой краснухи. Вольной выделяет вирус во внешнюю среду за 1 нед до появления сыпи и в течение 5-7 дней после появления высыпаний. Вольшое эпидемиологическое значение имеют дети с врожденной краснухой. При последней возбудитель выявляют в слизи носоглотки и моче (реже в фекалиях) на протяжении нескольких недель, иногда - до 12-20 мес.
Механизм передачи - аэрозольный, путь передачи - воздушнокапельный. Для заражения необходимо более длительное и тесное общение с больным, чем при кори и ветряной оспе. Существует вертикальный путь передачи (трансплацентарная передача вируса), особенно в первые 3 мес беременности. Руки и предметы ухода не имеют эпидемиологического значения. Исключение составляют игрушки, с помощью которых возможна передача вируса маленькими детьми изо рта в рот.
Естественная восприимчивость людей
Естественная восприимчивость к инфекции высокая. Серологические обследования свидетельствуют о большом проценте (30% и более в отдельных регионах страны) серонегативных женщин детородного возраста, особенно в возрасте 20-29 лет. Результаты серологического обследования беременных в Москве свидетельствуют о высокой восприимчивости женщин детородного возраста к вирусу краснухи, особенно в возрастной группе 20-29 лет (в разные годы выявлены от 8 до 30% серонегативных). При обследовании 1550 беременных в Москве, оказавшихся в очагах с риском заражения, выявлена 181 серонегативная женщина (11,7%), 18 из них заболели краснухой. Выборочные серологические исследования, проведенные среди детского и подросткового населения города, показали, что от 59,5 до 42,1% лиц этого возраста не защищены от краснухи. Специфические АТ к вирусу среди этой возрастной группы обнаруживали в среднем в 46,6% случаев, причем только в половине случаев в высоком титре (1:800-1:3200). Только к 16-18 годам 2/3 обследованных детей и подростков (71-72%) имели защитные титры АТ к вирусу краснухи.
Основные эпидемиологические признаки
Краснуху относят к числу инфекций, ликвидация которых возможна в ближайшем будущем, согласно программе ВОЗ. В ряде стран (США, Швеция и др.) ее выявляют на крайне низком уровне. С учетом значения для здравоохранения синдрома врожденной краснухи, 48-я сессия Регионального комитета ВОЗ для Европы (1998) включила краснуху в число инфекций, борьба с которыми будет определять цели программы «Здоровье для всех» в XXI в. К 2010 г. частота синдрома врожденной краснухи должна быть снижена до уровня менее 0,01 на 1000 новорожденных. В довакцинальный период краснуху с высокой заболеваемостью регистрировали повсеместно. В связи с отсутствием до настоящего времени программы широкой иммунизации населения в России отмечают тенденцию к росту заболеваемости. По данным ВОЗ, из всех случаев краснухи, регистрируемых в Европе, 83% приходится на страны СНГ, причем 57% из них - на Российскую Федерацию. Для краснухи характерны периодические подъемы заболеваемости:
- умеренные (каждые 3-5 лет);
- интенсивные (каждые 10-12 лет).
В последние годы отмечен сдвиг заболеваемости на более старший возраст: болеют преимущественно школьники и женщины детородного возраста. Отмечают высокую очаговость в организованных дошкольных и школьных коллективах, среди учащихся средних и высших учебных заведений. Заболеваемость существенно повышается весной и летом.
Краснуху принято считать легким заболеванием. Однако такое определение справедливо для течения этой инфекции у детей. Заболевание у взрослых характеризует тяжелое течение (нередко протекает с длительной лихорадкой, суставным синдромом, а также развитием органной патологии). Особую проблему создает врожденная краснуха. При инфицировании беременных она может вызвать серьезные осложнения и рождение ребенка с различными тяжелыми пороками развития. По данным различных авторов, риск развития врожденных пороков (органов зрения, слуха, сердечно-сосудистой системы и др.) составляет от 12 до 70%, или 10% общего числа врожденных аномалий. При инфицировании в первые 3 мес беременности инфекция плода развивается в 90% случаев. Кроме того, установлено, что при врожденной краснухе также могут развиваться поздние осложнения (панэнцефалит, сахарный диабет, тиреоидит). Неблагоприятное влияние краснушной инфекции на плод проявляется также спонтанными абортами (10-40%), мертворождением (20%) и смертью в неонатальном периоде (10-25%).
Особую тревогу вызывает устойчивый рост заболеваемости женщин детородного возраста, следствием чего становится увеличение количества случаев синдрома врожденной краснухи, проявляющегося врожденными уродствами. Число случаев синдрома врожденной краснухи составляет в среднем 0,13% всех заболеваний. По данным ВОЗ, ежегодно краснуха калечит всего около 300 000 детей. Расходы на лечение и содержание ребенка с синдромом врожденной краснухи составляют, по самым скромным оценкам, около 200 000 долларов США. Однако регистрация случаев врожденной краснухи в Российской Федерации практически не осуществляется. Заболеваемость краснухой в РФ в 2007 г. сократилась по сравнению с 2006 г. в 4,3 раза и составила 21,65 против 93,13 на 100 000 населения. Зарегистрировано 30 934 против 133 289 случаев в 2006 г. Снижение заболеваемости отмечается во всех возрастных группах, в том числе у детей до 17 лет заболеваемость снизилась с 395,5 на 100 000 детей до 91,24 в 2007 г. В структуре заболевших 81,2% приходится на детей до 17 лет, из них 83,9% составляют дети до 14 лет. Наиболее высокие показатели заболеваемости краснухой детей до 17 лет зарегистрированы в Республике Бурятии (589,7), Оренбургской (508,7), Архангельской (312,6) областях. В Москве, Санкт-Петербурге, Московской, Ярославской, Ленинградской, Челябинской, Томской областях, Республике Марий Эл заболеваемость составила от 200 до 300 на 100 000 детей. В Российской Федерации зарегистрированы 8 случаев врожденной краснухи, из них 5 - в Омской области и по 1 случаю - в СанктПетербурге, Алтайском крае и Ростовской области. Снижение заболеваемости выступает следствием проведения дополнительной иммунизации. В 2008 г. в стране зарегистрировано 8680 случаев краснухи (6,8 на 100 000 населения), из них дети до 14 лет составили 5874 случая (27,8 на 100 000 населения).
Патогенез
В связи с отсутствием экспериментальной модели для воспроизведения краснухи патогенез заболевания изучен мало. Заражение происходит через слизистые оболочки верхних дыхательных путей, возможно заражение через кожу. Вслед за этим вирус проникает в регионарные лимфатические узлы, где репродуцируется и накапливается, что сопровождается развитием лимфаденопатии. Последующая виремия с гематогенным диссеминированием по всему организму возникает еще в инкубационный период. Возбудитель, обладая тропностью к эпителию
кожных покровов и лимфатической ткани, оседает на эпителии кожи и в лимфатических узлах. Виремия обычно завершается с появлением экзантемы. В крови больных в это время уже обнаруживают вируснейтрализующие АТ. В последующем их концентрация нарастает и формирующиеся иммунные реакции приводят к элиминации возбудителя из организма и выздоровлению. После перенесенного заболевания АТ сохраняются пожизненно, что обеспечивает стойкость постинфекционного иммунитета.
При развитии краснухи у беременных в период виремии возбудитель с кровью беременной легко преодолевает плацентарный барьер и поражает плод. Одновременно вследствие вирусного поражения эндотелия кровеносных сосудов плаценты нарушается питание плода. Повреждая генетический аппарат клеток, вирус избирательно подавляет митотическую активность отдельных клеточных популяций эмбриона и, возможно, оказывает на них прямое цитопатогенное действие. Это приводит к замедлению роста и нарушению нормального формирования органов плода с последующим развитием врожденных пороков. Воздействие вируса на эмбриональные ткани в различные сроки беременности неоднозначно; оно оказывается наиболее выраженным по отношению к органам и системам, находящимся на этапе инфицирования в процессе активного формирования. Поэтому наиболее широкий диапазон пороков развития плода складывается при заражении в ранние сроки беременности.
Клиническая картина
Инкубационный период одинаков у детей и взрослых и продолжается 10-25 дней. Последующий катаральный период у детей, как правило, не выражен; в этих случаях диагноз краснухи нередко может быть установлен только после появления экзантемы. У взрослых в этот период возможны повышение температуры тела (в тяжелых случаях до высоких цифр), недомогание, головная боль, миалгии, снижение аппетита. Катаральные признаки могут выражаться в виде незначительного насморка и сухого кашля, чувства першения в горле, светобоязни и слезотечения. При осмотре у части больных обнаруживают конъюнктивит и покраснение слизистой оболочки зева. Увеличение и болезненность лимфатических узлов, особенно затылочных и заднешейных, одинаково характерны как для детей, так и для взрослых, однако этот признак встречают не у всех больных. В последующем лимфаденопатия сохраняется довольно
долго (до 2-3 нед). Продолжительность катарального периода составляет 1-3 дня.
Затем наступает период экзантемы; проявления этого главного синдрома развиваются у 75-90% больных уже в 1-й день болезни, при этом высыпания чаще наблюдают у детей. Элементы сыпи представляют собой круглые или овальные розовые или красные мелкие пятна с ровными краями (см. рис. 11 на цветной вклейке). Они располагаются на неизмененной коже и не возвышаются над ее поверхностью. У взрослых высыпания склонны к слиянию, у детей сливаются редко. Иногда появлению сыпи предшествует кожный зуд. Сначала (но не всегда) элементы сыпи появляются на лице и шее, за ушами и на волосистой части головы. Далее в течение суток они распространяются по различным участкам тела без определенной закономерности. Особенно типично расположение сыпи на спине, ягодицах и на разгибательных поверхностях верхних и нижних конечностей. На подошвах и ладонях экзантема отсутствует. В некоторых случаях одновременно с экзантемой можно отметить появление энантемы на слизистых оболочках ротовой полости в виде мелких единичных пятнышек (пятна Форхгеймера). У взрослых больных экзантема обильнее и продолжительнее, ее элементы могут сливаться, образуя эритематозные поля. Сливной характер сыпи, а также ее отсутствие у части больных (в 20-30% случаев, по данным литературы) крайне затрудняют постановку клинического диагноза.
Температура тела в период экзантемы может оставаться нормальной или слегка повышается. Отчетливо определяются увеличенные и умеренно болезненные периферические лимфатические узлы во всех областях, доступных пальпации, но особенно - затылочные, околоушные и заднешейные. Часть больных жалуются на суставные и мышечные боли. У отдельных больных отмечают диспепсические симптомы, увеличение печени и селезенки, у женщин - признаки полиартрита. Обычно проявления экзантемы длятся не более 4 дней. Сыпь может быстро угасать, исчезает она бесследно.
Течение краснухи у взрослых в целом аналогично ее проявлениям у детей. Вместе с тем у взрослых более выражена и продолжительна симптоматика катарального периода, заболевание протекает значительно тяжелее, сыпь обычно обильнее, ее элементы могут сливаться, что затрудняет дифференциальную диагностику. Проявление одного из ведущих синдромов заболевания - лимфаденопатии у взрослых происходит медленно и поэтапно. У некоторых больных этот синдром
может вообще отсутствовать. Частота клинически выраженной краснухи и бессимптомной инфекции у детей соотносится как 1:1, у взрослых - 1:2.
Дифференциальная диагностика
Краснуху дифференцируют от кори, скарлатины, экзантем аллергического генеза и энтеровирусных инфекций.
При краснухе катаральный период не выражен или выражен умеренно. Характерны увеличение и болезненность лимфатических узлов, особенно затылочных и заднешейных. Экзантема развивается в большинстве случаев уже в 1-й день болезни и быстро (в течение суток) распространяется по различным участкам тела. Особенно типично расположение сыпи на спине, ягодицах и разгибательных поверхностях верхних и нижних конечностей. У взрослых сыпь может быть сливной или отсутствовать, что крайне затрудняет постановку клинического диагно за.
У беременных, контактировавших с больным краснухой, подозрение на это заболевание должно возникать во всех случаях, когда даже минимальные клинические ее проявления развиваются в срок от 15-го до 21-го дня после контакта.
Лабораторная диагностика
В гемограмме при краснухе часто выявляют лейкопению, лимфоцитоз, повышение СОЭ. У взрослых иногда обнаруживают плазматические клетки. В целом изменения гемограммы подвержены значительным колебаниям в зависимости от возраста больных и тяжести заболевания.
Серологическую диагностику краснухи проводят с применением РТГА, РСК, ИФА и РИА в парных сыворотках с интервалом не менее 10 дней. Однако результаты представляют ценность лишь для ретроспективного подтверждения диагноза. Желательно определять концентрацию противовирусных IgM и IgG. У беременных эти исследования, а также постановку реакции бласттрансформации лимфоцитов необходимо проводить для установления инфицированности и возможности передачи вируса плоду. Первое исследование сыворотки крови беременной, контактировавшей с больным краснухой, проводят как можно раньше, но не позднее 12-го дня после контакта. В этом случае выявле-
ние АТ, преимущественно IgG, говорит о перенесенном ранее заболевании и возможности сохранения беременности. Отсутствие АТ в 1-й сыворотке и их появление в крови (преимущественно IgM) при повторном исследовании через 10-12 дней свидетельствуют об активной инфекции с опасностью поражения плода.
Осложнения и исходы
Осложнения наблюдают редко. Среди них наиболее часты:
- пневмонии;
- отиты;
- артриты;
- ангины;
- реже возникает тромбоцитопеническая пурпура.
Развитие осложнений обычно связано с присоединением вторичных бактериальных инфекций. Крайне редко (в основном у взрослых) наблюдают тяжело протекающие энцефалиты, менингоэнцефалиты и энцефаломиелиты. Краснуха у беременных не имеет специфических отличий в клинической картине и не представляет серьезной опасности для будущей матери, но плод при этом подвергается большому риску, поскольку возможно формирование разнообразных пороков его развития и внутриутробных заболеваний (катаракты, глухоты, пороков сердца, микроцефалии, гепатита, пневмонии, менингоэнцефалита, анемии и др.). Возможность рождения ребенка с синдромом врожденной краснухи при заболевании женщины на 3-4-й неделе беременности реализуется в 60% случаев, на 9-12-й неделе - в 15%, на 13-14-й неделе - в 7% случаев.
Лечение
При неосложненных формах назначают симптоматическое лечение, которое можно проводить в домашних условиях. Большинству больных активных терапевтических мероприятий не требуется. В более тяжелых случаях применяют патогенетические и симптоматические средства (см. главу 3, раздел «Корь»).
Эпидемиологический надзор
Отслеживают проявления эпидемического процесса, структуру иммунной прослойки, выявляют группы риска по эмбриопатиям (женщин детородного возраста, не имеющих АТ к вирусу краснухи).
Профилактические мероприятия
В соответствии с Приказом Министерства здравоохранения Российской Федерации ? 229 от 27.06.2001 г. вакцинация против краснухи внесена в национальный календарь обязательных прививок.
Систематическая широкомасштабная иммунизация начата с 2002 г., из года в год, с увеличеним процента охвата прививками детского и взрослого населения. В 2007 г. показатель своевременности охвата профилактическими прививками в 24 мес против краснухи составил 98,3% (2006 г. - 98,9%). Все территории Российской Федерации достигли рекомендуемого 95%-го уровня охвата вакцинацией. Показатель охвата детей ревакцинацией в 6 лет в целом по Российской Федерации составил 93,9%. Не достигнут 95%-й уровень охвата детей ревакцинацией против краснухи в 6 лет в 26 субъектах Российской Федерации. Наиболее низкие охваты ревакцинацией в 6 лет зарегистрированы в Санкт-Петербурге (62,4%), Республиках Чеченской (71,2%), Северная Осетия-Алания (81,1%), Архангельской области (81,1%), Республике Карелии (85,1%), в Костромской (87,4%), Свердловской (89,2%) областях. По итогам дополнительной иммунизации в рамках ПНП охват прививками против краснухи составил от 95 до 100% по субъектам (подлежало 6 986 988, привито 6 928 865 девушек и женщин).
Для специфической профилактики в ряде стран разработаны и успешно применяются живые вакцины, обычно включающие помимо возбудителя краснухи вирусы кори и паротита. Также существуют и моновакцины. Вакцинации подлежат дети в возрасте 15-18 мес и девочки 12-14 лет. Широкая вакцинопрофилактика позволила резко снизить заболеваемость краснухой и предупредить развитие врожденной краснухи. В США вакцинацию против краснухи проводят с 1969 г. За эти годы заболеваемость сведена к единичным случаям; врожденная краснуха практически полностью отсутствует.
В России зарегистрированы и разрешены к применению следующие зарубежные вакцины, содержащие живой аттенуированный штамм вируса Wistar RA 27/3:
- паротитно-коревая-краснушная вакцина MMR-2 (Мерк Шарп
Доум, США);
- вакцина Priorix (Смит Кляйн Бичем);
- паротитно-краснушная вакцина RUVAX;
- краснушная вакцина RUDIVAX (Авентис-Пастер, Франция).
Многолетний опыт показывает, что наиболее перспективна программа, сочетающая двукратную иммунизацию детей в возрасте 12-16 мес и 6 лет ассоциированной вакциной корь-краснуха-паротит с последующей ревакцинацией против краснухи девочек-подростков и женщин детородного возраста. Применение ассоциированной вакцины позволяет одновременно снизить количество восприимчивых к кори подростков, поскольку большинство из них в возрасте 6-7 лет не получали 2-й дозы ЖКВ. То, что с тривакциной некоторые подростки получат 3-ю дозу ЖПВ или ЖКВ, не должно вызывать опасений. Это обстоятельство также может повысить титры АТ у лиц со вторичной неэффективностью вакцинации.
Моделирование эпидемического процесса при разных схемах вакцинации показало, что вакцинация детей второго года жизни сможет подавить передачу краснухи и, следовательно, существенно снизить риск заболевания краснухой беременных только при охвате более 80% подлежащих вакцинации. Стратегическим направлением предупреждения врожденной краснухи служит вакцинация женщин детородного возраста.
Мероприятия в эпидемическом очаге
Заболевшие краснухой подлежат изоляции до 5-го дня с момента появления сыпи. В отношении общавшихся с ними лиц никаких ограничительных мероприятий не предусмотрено, карантин на группы детских учреждений не накладывают. В качестве экстренной профилактики детям и беременным, общавшимся с больным, вводят противокраснушный иммуноглобулин.
С целью профилактики вторичных случаев заболевания в очаге в течение 72 ч с момента выявления первого больного подлежат вакцинации (ревакцинации) следующие категории лиц (в возрасте от 12 мес до 35 лет) из числа общавшихся с больным:
- не болевшие краснухой ранее и не привитые против нее;
- не болевшие краснухой ранее и однократно привитые против нее (если с момента прививки прошло не более 6 мес);
- лица с неизвестным инфекционным и прививочным анамнезом в отношении краснухи.
Беременных, находящихся в I триместре беременности, изолируют от больного на 10 дней от начала заболевания (временный переезд на другую квартиру, перевод на другую работу из детского коллектива и др.) и проводят их серологическое обследование в динамике:
- 1-ю пробу берут в первые дни контакта, но не позднее 10-го дня;
- 2-ю пробу - через 2 нед после установления контакта.
При заболевании женщин в первые 3 мес беременности рекомендуют прервать ее. Диспансерное наблюдение осуществляют за детьми с врожденной формой инфекции. Наблюдение включает регулярные серологические и вирусологические исследования. Заключительную дезинфекцию в очаге не проводят.
ЭПИДЕМИЧЕСКИЙ ПАРОТИТ
(PAROTITIS EPIDEMICA)
Эпидемический паротит - острое вирусное заболевание с аэрозольным механизмом передачи, сопровождающееся интоксикацией и поражением железистых органов, преимущественно слюнных желез, а также нервной системы.
Краткие исторические сведения
Заболевание впервые описано еще Гиппократом и выделено им в самостоятельную нозологическую форму. Частые поражения ЦНС и орхит при эпидемическом паротите отмечены Гамильтоном (1790).
Вирус паротита из крови больного впервые выделил Л. Килэм (1949), из ткани яичек при их биопсии - Б. Бьерват (1973). Фундаментальные исследования в области этого заболевания проведены отечественными учеными И.В. Троицким, Н.Ф. Филатовым, А.Д. Романовым, А.А. Смородинцевым и др.
Этиология
Возбудитель - РНК-геномный вирус рода Paramyxovirus семейства Paramyxoviridae. Все известные штаммы принадлежат к одному серотипу. У вирусов выделяют V-Аг и S-Аг. Вирус патогенен только для человека, хотя существуют подтвержденные случаи заболевания собак, заразившихся от хозяев. Возможно экспериментальное заражение вирусом обезьян. Выделяется со слюной и мочой, его можно обнаружить в крови, цереброспинальной жидкости, мозге, грудном молоке и др.
Вирус нестоек, во внешней среде быстро инактивируется под действием:
- высокой температуры;
- УФ-лучей;
- дезинфицирующих растворов;
- при высушивании.
При низкой температуре вирус может сохранять жизнеспособность до 1 года.
Эпидемиология
Резервуар и источник инфекции - человек с манифестной или субклинической формой паротита. Больной становится заразным за 1-2 дня до появления клинических симптомов и выделяет вирус первые 5-7 дней болезни. Важную эпидемиологическую роль играют больные не только с типичными, но и со стертыми и бессимптомными формами заболевания, составляющими 25-50% всех случаев инфекции.
Механизм передачи - аэрозольный, путь передачи - воздушнокапельный, хотя нельзя полностью исключить возможность передачи возбудителя через предметы (игрушки, посуду и т.д.), загрязненные слюной больного незадолго до контакта со здоровым. Возможна и трансплацентарная передача возбудителя.
Естественная восприимчивость людей
Естественная восприимчивость людей высокая. Дети до 1 года болеют нечасто вследствие редких контактов с больными и материнских АТ. Постинфекционный иммунитет длительный и стойкий.
Основные эпидемиологические признаки
Болезнь распространена повсеместно. Отмечают периодические подъемы заболеваемости с интервалом 7-8 лет. В довакцинальный период заболеваемость регистрировали преимущественно среди детей раннего возраста (3-6 лет). В последние годы отмечен, как и при кори, сдвиг заболеваемости на более старшие возрастные группы населения (5-15 лет). Лица мужского пола болеют паротитом чаще, чем женщины. Эпидемические вспышки можно наблюдать в любое время года, но чаще всего повышение заболеваемости приходится на осень и зиму, т.е. в период скученности детей и подростков в закрытых помещениях.
Выборочные серологические обследования показали, что 33,9-42,9% взрослого населения восприимчиво к возбудителю. В разных возраст-
ных группах удельный вес серонегативных лиц варьирует в среднем от 25,6% среди привитых детей 3 лет до 33,1% среди 30-40-летних людей. Среди взрослого населения повышенную заболеваемость регистрируют в закрытых и полузакрытых коллективах (казармы, общежития и т.д.). Заболеваемость среди новобранцев всегда выше, чем среди старослужащих. Для эпидемического паротита характерна выраженная очаговость - почти в четверти детских учреждений регистрируют очаги с 15 случаями заболевания и более. В детских учреждениях вспышки протекают длительно, заболеваемость волнообразная из-за большой продолжительности инкубационного периода и невыявления части больных со стертой клинической картиной. Снижение заболеваемости эпидемическим паротитом в последние годы на большинстве территорий страны обусловлено повышением охвата прививками детей до года. В 2000 г. заболеваемость в России составила 26,4, в 1999 г. - 45,6 на 100 000 населения. В Москве эти показатели соответственно составили 16,6 и 45,4. Показатели заболеваемости эпидемическим паротитом снизились в 2007 г. по сравнению с 2006 г. на 21,2% и составили 1,3 против 1,65 на 100 000 населения. Из общего числа заболевших 70,5% составляют дети до 17 лет включительно. По сравнению с 2006 г. заболеваемость эпидемическим паротитом в 2007 г. у детей снизилась на 19,9%. Зарегистрировано 1308 случаев (4,76 на 100 000 детей) против 1694 (5,94), зарегистрированных в 2006 г. Наиболее высокие уровни заболеваемости 10 и более на 100 000 детей зарегистрированы в Чеченской Республике (30,6), Еврейской автономной области (29,2), Санкт-Петербурге (16,9), Владимирской (13,4), Московской (12,8), Смоленской (12,7) областях, Москве (12,8), Республике Северной Осетии-Алании (12,6).
Патогенез
Воротами инфекции служат слизистые оболочки верхних дыхательных путей и, возможно, ротовой полости, а также конъюнктива. После репродукции возбудителя в клетках слизистых оболочек развивается виремия. Гематогенная диссеминация и тропность вируса к интерстициальной ткани железистых органов приводят к его осаждению в слюнных железах, яичках, поджелудочной железе, нервной системе. В указанных органах и тканях вирус также репродуцируется, следствием чего становятся воспалительные реакции в них (прежде всего паротит; также возможны орхит, панкреатит, серозный менингит и менингоэнцефалит). Морфологические изменения и клиническая манифестация
процесса в первую очередь касаются слюнных желез, наиболее близко находящихся к входным воротам инфекции и располагающих наиболее благоприятными условиями для репликации вируса. Развиваются отек, лимфогистиоцитарная инфильтрация соединительной ткани, обтурация канальцев, иногда кровоизлияния и (весьма редко) некроз железистого эпителия. Поскольку в других железистых органах возбудитель находит менее благоприятные условия для репродукции, их поражение развивается не всегда и отстает по времени на несколько дней от начала клинических проявлений паротита. Следствием возможных тяжелых осложнений со стороны яичек и поджелудочной железы может быть атрофия этих органов. Иногда развиваются острый гломерулонефрит, серозное воспаление щитовидной и вилочковой желез.
Установлено, что в поражениях ЦНС, периферической нервной системы и поджелудочной железы играют определенную роль иммунные механизмы: уменьшение количества Т-клеток, слабый первичный иммунный ответ с низким титром IgM, снижение содержания IgA и IgG.
В механизмах нейтрализации вируса существенная роль принадлежит вирулицидным АТ, подавляющим активность вируса и его проникновение в клетки.
Клиническая картина
Инкубационный период варьирует от нескольких дней до 1 мес, чаще он продолжается 18-20 дней.
У детей достаточно редко вслед за ним может развиться короткий (1-3 дня) продромальный период, проявляющийся познабливанием, головной болью, болями в мышцах и суставах, сухостью во рту, неприятными ощущениями в области околоушных слюнных желез. Чаще заболевание начинается остро с озноба и повышения температуры тела от субфебрильных до высоких цифр. Лихорадка сохраняется не более 1 нед. Однако нередки случаи заболевания, протекающие с нормальной температурой тела.
Лихорадку сопровождают:
- головная боль;
- общая слабость;
- недомогание;
- бессонница.
Основное проявление паротита - воспаление околоушных, а также возможно подчелюстных и подъязычных слюнных желез. В проекции этих желез появляется припухлость, болезненная при пальпации (больше в центре), имеющая тестообразную консистенцию. При выраженном увеличении околоушной слюнной железы лицо больного приобретает грушевидную форму, мочка уха с пораженной стороны приподнимается. Кожа в области припухлости натянута, лоснится, с трудом собирается в складки, цвет ее обычно не изменен. Чаще процесс бывает двусторонним, захватывающим через 1-2 дня околоушную железу и на противоположной стороне, но возможны и односторонние поражения (см. рис. 12 на цветной вклейке). Больного беспокоят чувство напряжения и боли в околоушной области, особенно ночью. При сдавлении опухолью евстахиевой трубы могут появиться шум и боли в ушах. При надавливании позади мочки уха появляется выраженная болезненность (симптом Филатова). Этот симптом - наиболее важный и ранний признак паротита. Слизистая оболочка вокруг отверстия стенонова протока гиперемирована и отечна (симптом Мурсу). Часто отмечают гиперемию зева. В некоторых случаях больной не может из-за боли пережевывать пищу, а в еще более тяжелых случаях развивается функциональный тризм жевательной мускулатуры. Возможны уменьшение слюноотделения и сухость во рту, снижение слуха. Боли продолжаются 3-4 дня, иногда иррадиируют к уху или шее, а к концу недели постепенно затихают. Приблизительно к этому времени или на несколько дней позже исчезает отечность в проекции слюнных желез. При эпидемическом паротите регионарную лимфаденопатию, как правило, не отмечают.
У взрослых продромальный период отмечают чаще, для него характерны более выраженные клинические проявления. Помимо общетоксических, в этот период возможны катаральные и диспептические проявления. Острая фаза заболевания бывает более тяжелой. Значительно чаще, чем у детей, наблюдают поражения (возможно изолированные) подчелюстных и подъязычных слюнных желез. При субмаксиллите слюнная железа имеет тестоватую консистенцию и слегка болезненна, вытянута по ходу нижней челюсти, что распознают при наклоне головы назад и в сторону. Отек подкожной клетчатки вокруг железы иногда распространяется на шею. Сублингвит проявляется припухлостью в подбородочной области такого же характера, болями под языком, особенно при его высовывании, локальной гиперемией и отечностью слизистой оболочки. Припухлость в проекции слюнных желез у взрослых сохраняется дольше (2 нед и более).
Дифференциальная диагностика
Заболевание следует отличать от гнойных воспалительных заболеваний околоушных желез, их увеличения при обтурации стенонова протока слюнным камнем, паратонзиллярном абсцессе, инфекционном мононуклеозе, а также при дифтерии, сопровождающейся отеком подкожной клетчатки (токсическая форма).
Для эпидемического паротита характерно острое начало с озноба, повышения температуры тела и других признаков интоксикации, появление болезненной (больше в центре) тестообразной припухлости в проекции околоушных, реже подчелюстных или подъязычных слюнных желез с чувством напряжения и боли. Поражение чаще носит двусторонний характер. Наиболее важные и ранние признаки паротита - появление выраженной болезненности при надавливании позади мочки уха (симптом Филатова), гиперемия и отек слизистой оболочки вокруг отверстия стенонова протока (симптом Мурсу).
Лабораторная диагностика
Изменения гемограммы при эпидемическом паротите незначительны и малоинформативны. В широкой клинической практике специфические лабораторные тесты не применяют, поскольку они дают ретроспективные результаты. В диагностически трудных случаях можно применять ИФА, РСК, РТГА, РН в парных сыворотках (при заболевании происходит нарастание титров в 4 раза и более). Более значимым в ранние сроки заболевания можно считать раздельное определение АТ к V-Аг и S-Аг возбудителя. Высокие титры АТ к S-Аг вируса в острый период заболевания служат подтверждением диагноза.
Вспомогательное значение имеет определение активности амилазы и диастазы в крови и моче.
Осложнения и исходы
Острая фаза эпидемического паротита протекает благоприятно, но возможны серьезные осложнения в более поздние сроки. К ним относят:
- серозный менингит;
- менингоэнцефалит (в редких случаях);
- орхит и эпидидимит;
- оофорит;
- острый панкреатит.
Существует мнение о том, что указанные осложнения служат типичными проявлениями более тяжелых форм основного заболевания, поскольку они, так же как и паротит, связаны с тропностью возбудителя к железистой ткани и нервной системе.
Лечение
При неосложненных формах лечение амбулаторное. Больных обычно госпитализируют по эпидемиологическим показаниям или в случаях возникновения осложнений. Средства этиотропного лечения отсутствуют. Постельный режим рекомендуют в лихорадочный период независимо от тяжести заболевания. В первые дни болезни больным дают преимущественно жидкую или полужидкую пищу.
Особое значение приобретает уход за полостью рта:
- частое питье;
- полоскание кипяченой водой или 2% раствором соды;
- тщательная чистка зубов.
На область околоушных желез применяют сухое тепло (сухие согревающие компрессы, облучение лампой соллюкс), назначают местные физиотерапевтические процедуры в виде УФО, УВЧ-терапии, диатермии. При выраженном токсикозе проводят дезинтоксикационное лечение с назначением небольших доз глюкокортикоидов (под врачебным контролем). В некоторых клиниках получены положительные результаты после применения ИФН (лейкинферона) в ранние сроки заболевания.
При развитии орхита кроме постельного режима рекомендуют применять суспензории местно в первые 3-4 дня - холод, а в последующие дни - тепло. Также проводят раннее лечение средними дозами глюкокортикоидов.
Эпидемиологический надзор
Эпидемиологический надзор включает изучение основных характеристик эпидемического процесса инфекции, выявление среди населения групп риска на основании показателей состояния здоровья детей и серологических показателей. Поскольку вакцинация - главное направление в борьбе с паротитом, особое внимание следует уделять контролю за охватом прививками детей раннего возраста, дальнейшему совершенствованию календаря и схемы прививок. В эпидемиологической прак-
тике могут быть применены такие критерии, как рост числа манифестно протекающих форм инфекции, что, несомненно, свидетельствует об увеличении контингентов непривитых. С другой стороны, низкие показатели заболеваемости паротитом в сочетании с высокими титрами антигемагглютининов в сыворотках крови обследуемых детей и подростков свидетельствуют о широком распространении стертых и инаппарантно протекающих случаев заболевания, остающихся недиагностированными. Необходимо проводить серологический скрининг беременных с целью определения групп риска в отношении заболевания эпидемическим паротитом среди новорожденных детей.
Профилактические мероприятия
Для специфической профилактики применяют ЖПВ из аттенуированного штамма вируса паротита Л-3, выращенного на культуре клеток эмбрионов японских перепелов. Профилактические прививки проводят в плановом порядке детям в возрасте 12 мес, не болевшим паротитом, с последующей ревакцинацией в 6 лет ассоциированной вакциной против кори, паротита и краснухи. Эффективность вакцинации против паротита достаточно высока, она способствует резкому уменьшению заболеваемости паротитом и снижению количества осложнений (менингитов, орхитов, панкреатитов). Оправдана вакцинация и ревакцинация подростков и взрослых по результатам серологических обследований. В 2007 г. вакцинировано против эпидемического паротита 1 514 075 детей (2006 г. - 1 479 361), ревакцинировано - 1 596 399 (2006 г. - 1 658 787). Показатель своевременности охвата профилактическими прививками против эпидемического паротита в 24 мес в 2007 г. составил 98,7% (2006 г. - 98,6%). В большинстве субъектов Российской Федерации достигнут рекомендуемый 95%-й уровень охвата вакцинацией против эпидемического паротита в возрасте 6 лет, кроме Чеченской Республики и Республики Северной Осетии, где эти показатели составили 78,1 и 73,1% соответственно.
Мероприятия в эпидемическом очаге
Противоэпидемическую работу в очаге начинают с изоляции больных. Госпитализации подлежат больные с тяжелыми формами и из организованных закрытых коллективов, общежитий. Чаще больного
изолируют дома до исчезновения клинических признаков, но не менее чем на 9 дней. Помещение, где содержится больной, часто проветривают, проводят влажную уборку, больному выделяют отдельную посуду, белье, игрушки и др. Дети до 10 лет, не болевшие эпидемическим паротитом, подлежат разобщению на 21 день с момента контакта с больным. В связи с длительной инкубацией и контагиозностью только в последние дни этого периода лица, общавшиеся с больным, могут посещать детские коллективы в первые 10 дней инкубационного периода, но с 11-го по 21-й день подлежат разобщению. При отсутствии противопоказаний к вакцинации ранее не привитым детям следует ввести ЖПВ. Экстренную вакцинопрофилактику также можно проводить по результатам серологического скрининга. Для этого используют моноили ассоциированные живые вакцины с паротитным компонентом, зарегистрированные на территории России. Применение нормального иммуноглобулина человека с целью экстренной профилактики контактных в очагах эпидемического паротита в настоящее время недостаточно эффективно из-за низкого содержания АТ к вирусу паротита в донорской плазме, из которой приготовлен этот препарат. Переболевших можно допускать в коллектив после клинического выздоровления даже при появлении в детском учреждении повторных заболеваний. Диспансерное наблюдение за переболевшими не регламентировано. Однако существуют рекомендации о необходимости наблюдения в течение 2 лет за перенесшими паротитный серозный менингит или менингоэнцефалит в связи с возможностью отклонений в неврологическом или психическом статусе.
ГЕРПЕТИЧЕСКАЯ ИНФЕКЦИЯ
Герпетическая инфекция включает вирусные заболевания, вызываемые широко распространенными представителями семейства Herpesviridae, насчитывающего более 80 представителей. Вирусы имеют сходную структуру и ряд общих Аг. На основании особенностей структуры генома, репродукции и действия на клетки вирусы герпеса разделяют на подсемейства:
- Alphaherpesvirinae;
- Betaherpesvirinae;
- Gammaherpesvirinae.
Поражения у человека вызывает 8 видов (табл. 3-11).
Таблица 3-11. Представители семейства Herpesviridae, вызывающие поражения у человека
Подсемейство | Род | Типы | Нозологические формы |
Alphaherpesvirinae | Simhlexvirus | ВПГ-1и ВПГ-2 | Простой герпес |
Varicellovirus | Varicella-zoster вирус (вирус герпеса человека типа 3) | Ветряная оспа, опоясывающий лишай | |
Betaherpesvirinae | Cytomegalovirus | ЦМВ (вирус герпеса человека типа 5) | ЦМВ-инфекция |
Roseolovirus | Вирусы герпеса человека типов 6А, 6В и 7 | Синдромы внезапной экзантемы и хронической усталости (предположительно) | |
- | Неклассифицированные вирусы | Вирус герпеса человека типа 8 | Саркома Капоши (предположительно) |
Gammaherpesvirinae | Lymphocryptovirus | Вирус Эпстайна- Барр (вирус герпеса человека типа 4) | Инфекционный мононуклеоз |
ПРОСТОЙ ГЕРПЕС (HERPES SIMPLEX)
Простой герпес - антропонозное вирусное заболевание с появлением болезненных пузырьков на коже, слизистых оболочках или роговице, склонное к генерализации с развитием энцефалитов и пневмоний. Заболевание входит в группу ВИЧ-ассоциированных инфекций.
Краткие исторические сведения
Название заболеванию дал Геродот (около 100 г. до н.э.) от греч. herpes - ползучая кожная язва. Возбудитель заболевания обнаружил
И. Грютнер (1912).
Этиология
Возбудители - ДНК-геномные вирусы рода Simplexvirus, разделяемые на типы 1 и 2 (ВПГ-1 и ВПГ-2). Вирусы быстро размножаются в клетках, способны пожизненно сохраняться в латентной форме в нервных ганглиях и вызывать поражения кожи и слизистых оболочек различной локализации. Вирионы быстро инактивируются под действием нагревания, УФ-лучей, но длительно сохраняются при низкой температуре, устойчивы к действию ультразвука, повторного замораживания и оттаивания. Чувствительны к действию эфира, фенола и формальдегида.
Эпидемиология
Резервуар и источник инфекции - человек (больной или носитель). Возбудитель может выделяться очень долго.
Механизм передачи ВПГ-1 - аэрозольный, основной путь передачи - воздушно-капельный, реже контактный (через игрушки, предметы обихода, загрязненные слюной). ВПГ-2 обычно передается половым путем, также возможна трансплацентарная передача вируса и заражение во время родов (до 85% заражений). В связи с тем что при генерализации процесса имеет место вирусемия, возможен трансфузионый и парентеральный пути передачи.
Естественная восприимчивость людей
Естественная восприимчивость людей высокая, однако чаще наблюдают бессимптомное носительство вируса или малосимптомные формы болезни. Различные провоцирующие факторы (переохлаждение, стресс, травма, сопутствующие заболевания, лечение глюкокортикоидами и иммунодепрессантами, радиоактивное облучение, различные иммунодефицитные состояния) способствуют постоянному увеличению количества инфицированных и переходу инфекции из латентного состояния в манифестное. Отмечена конституциональная предрасположенность к герпетической инфекции, выражающаяся в постоянных рецидивах.
Основные эпидемиологические признаки
Заболевание распространено повсеместно. Возбудители или их Аг обнаруживают у 80-90%, а АТ - практически у 100% взрослых лиц, у 10-20% из которых отмечают клинические проявления. По данным ВОЗ, заболевания, вызываемые ВПГ, занимают 2-е место (15,8%) после гриппа и ОРВИ (35,8%) как причина смерти от вирусных инфекций. Прослеживается тенденция к неуклонному росту заболеваемости насе-
ления герпетической инфекцией, чему способствует все большее распространение иммуносупрессий и иммунодефицитов. Для клинических проявлений характерен подъем в осенне-зимний период. Отмечена способность возбудителей (обычно ВПГ-2) к вертикальной передаче с развитием нарушений развития плода, наиболее выраженных при первичном инфицировании беременных, особенно в первые 20 нед беременности.
Патогенез
В организм человека возбудитель проникает через поврежденные кожные покровы или слизистые оболочки. Репродукция вируса сопровождается гибелью эпителиоцитов, что проявляется образованием везикул, а потом - эрозий и корочек. Поступление вируса в лимфатические узлы, а затем в кровь обеспечивает его диссеминирование по различным органам и тканям. Большое значение имеет возможность распространения возбудителя по афферентным и вегетативным нервным волокнам, что приводит к его локализации в регионарных нервных ганглиях, где вирус сохраняется пожизненно, не вызывая гибели нейронов. Активной репликации вируса в ганглиях не происходит, поскольку нейроны подавляют активность вирусного генома. В этих условиях развивается латентная вирусная инфекция. В большинстве случаев ВПГ-1 циркулирует в шейных, а ВПГ-2 - в поясничных ганглиях.
Рецидивы заболевания с характерными высыпаниями на коже и слизистых оболочках обусловлены реактивацией вируса. Они чаще развиваются на фоне иммуносупрессии, возникающей под влиянием инфекций, травм, УФО и других разнообразных экзогенных и эндогенных факторов. В связи с этим в настоящее время рецидивирующий простой герпес рассматривают как ВИЧ-индикаторное состояние, что требует дополнительного обследования больного на Аг ВИЧ и АТ к ним.
У лиц с тяжелым иммунодефицитом и новорожденных, как правило, развивается генерализованная инфекция с выраженной виремией и образованием очагов некроза в ЦНС, печени, надпочечниках, селезенке, легких, пищеводе, почках и костном мозге. Воспалительная перифокальная реакция при этом отсутствует.
Клиническая картина
Проявления инфекции, вызванной ВПГ, разнообразны, однако их общепринятая клиническая классификация не разработана.
Отдельные исследователи (Казанцев А.П., 1980, Ющук Н.Д., Венгеров Ю.Я., 1999) предлагают разделять их с учетом следующих критериев.
• По времени инфицирования:
◊ врожденная;
◊ приобретенная (первичная и рецидивирующая) герпетическая инфекция.
• По локализации:
◊ поражения кожи;
◊ слизистых оболочек;
◊ глаз;
◊ нервной системы;
◊ внутренних органов.
• По распространенности:
◊ локализованные;
◊ распространенные;
◊ генерализованные поражения.
Врожденная герпетическая инфекция
Существуют данные о том, что поражение плода в различные периоды беременности и при родовой деятельности может привести к формированию пороков его развития или смерти.
Первичная приобретенная инфекция
В большинстве случаев (до 80% и более) протекает бессимптомно, особенно при позднем инфицировании.
При ее клинических проявлениях встречают следующие варианты.
• Первичный герпетический гингивостоматит с фарингитом - наиболее частая форма инфекции при заражении ВПГ-1 в раннем детском возрасте. Заболевание начинается остро, проявляется высокой лихорадкой с ознобом и выраженными признаками токсикоза, болями в горле, эритемой и отеком глотки. Везикулы с серозным содержимым и венчиком гиперемии появляются на слизистой оболочке рта и глотки, захватывая области мягкого и твердого нёба, нёбных дужек и миндалин, щек, языка, дна полости рта, губ. Они быстро увеличиваются в количестве и изъязвляются, образуя болезненные эрозии, затрудняющие прием пищи. Наблюдают кровоточивость слизистой оболочки, гиперсаливацию и зловонное дыхание. Одновременно увеличиваются и становятся болезненными нижнечелюстные, подбородочные и шейные лимфатические узлы. Заживление эрозий идет медленно, в течение 1-2 нед.
• Первичный генитальный герпес - один из частых вариантов инфекции, вызванной ВПГ-2. В большинстве случаев протекает бессимптомно с длительным сохранением вируса в мочеполовой системе (у мужчин) или канале шейки матки (у женщин). Описание клинических проявлений генитального герпеса представлено ниже [см. ниже подраздел «Рецидивирующий (возвратный) генитальный герпес»].
• Первичный герпетический кератоконъюнктивит протекает в виде одностороннего конъюнктивита с регионарной лимфаденопатией, реже древовидного кератита, который в части случаев вызывает пятнистое помутнение роговицы. Основной возбудитель - ВПГ-1.
Рецидивирующий герпес
Рецидивирующий герпес (возвратные заболевания) развивается при реактивации вирусной инфекции и может проявляться в различных вариантах.
• Рецидивирующий герпес кожи - частая форма рецидивирующего герпеса. Проявляется возникновением везикулярных элементов с типичной локализацией вокруг рта или на крыльях носа (см. рис. 13 на цветной вклейке). Реже везикулы появляются на других участках кожи - в области гениталий, на веках, руках, туловище, ягодицах. Появлению везикул предшествуют жжение, зуд, гиперемия и локальное уплотнение кожи. Элементы содержат серозную жидкость, впоследствии мутнеющую, окружены тонким венчиком гиперемии. На фоне сформировавшихся везикул возможно подсыпание новых элементов. После вскрытия везикул и их подсыхания образовавшиеся корочки отпадают без формирования рубцов. Общее самочувствие больного остается удовлетворительным.
• У лиц с иммунодефицитом развивается тяжелая генерализованная форма герпетической инфекции с распространенными высыпаниями, выраженными общетоксическими проявлениями, полиаденопатией, гепатолиенальным синдромом. В части случаев наблюдают диспепсические расстройства, судороги. Высыпания носят диссеминированный характер и распространяются на кожу, слизистые оболочки рта, глотки и пищевода. Заболевание склонно к затяжному течению, его длительность зависит от распространенности поражений и колеблется от нескольких дней до 2-3 нед. Наиболее тяжело герпетические инфекции протекают при СПИДе. Развиваются
упорный прогрессирующий эзофагит, тяжелые проявления колита, язвы перианальной области, пневмония, неврологические расстройства. Генерализованный герпес у лиц с иммунодефицитом может закончиться смертью пациента.
• Герпетическая экзема - один из вариантов генерализованного герпеса. Он возникает у детей, страдающих экземой или нейродермитом. Проявляется выраженной интоксикацией, диффузной сыпью, похожей на сифилитическую, быстрым появлением обильных везикулярных элементов на верхней части туловища, шее, голове, местным отеком, лимфаденопатией. Везикулы могут иметь пупкообразное вдавление, в дальнейшем они превращаются в геморрагические корочки или пустулы. При сливном характере сыпи после отпадения корочек формируются рубцы.
• Герпес губ. Провоцирующими моментами могут быть избыточная инсоляция, лихорадка, травма, менструация, стресс. До появления везикул возникают боль, жжение, зуд, а через 6-48 ч поверхность красной каймы губ изъязвляется, покрывается корочкой. Весь процесс продолжается 1-2 нед.
• Глазной рецидивирующий герпес - тяжелая инфекция, чаще вызываемая ВПГ-1. Проявляется в виде поверхностного или глубокого кератита, иридоциклита и кератоиридоциклита, блефарита или кератоконъюнктивита, сопровождается образованием древовидных язв роговицы, уменьшением роговичной чувствительности, снижением остроты зрения. Реже наблюдают поражения задних отделов глаза (увеит, хориоретинит). Склонность глазного герпеса к рецидивированию и разнообразие патологических проявлений часто становятся причиной развития слепоты.
• Рецидивирующий (возвратный) генитальный герпес.
◊ У мужчин проявляется везикулярными высыпаниями на внутреннем листке крайней плоти, в бороздке, на головке и теле полового члена. Процесс может распространяться на уретру и мочевой пузырь. Возникают жжение, болезненность при мочеиспускании и половом акте. Развивается регионарная паховая лимфаденопатия.
◊ У женщин высыпания локализуются на клиторе, малых и больших половых губах, во влагалище и промежности, на бедрах. Морфологически элементы могут быть представлены эритематозными папулами, везикулами, при клинически выраженных формах - эрозиями и мокнущими язвами. Беспокоят зуд и жже-
ние в области половых органов и промежности, боли при мочеиспускании. Иногда боли возникают в низу живота, поясничной и крестцовой областях. Генитальный герпес может протекать бессимптомно или в виде вульвовагинитов, сальпингитов, уретритов, эндометритов. Заболевание способствует развитию патологии беременности и родов. Общетоксические признаки при генитальном герпесе выражены нерезко (недомогание, познабливание, субфебрильная температура тела). У части больных возникает паховый или бедренный лимфаденит. При тяжелом течении генитального герпеса развиваются эрозивноязвенные поражения, гиперемия кожи, отек подкожной клетчатки, лихорадка с выраженными признаками интоксикации. Рецидивы генитального герпеса обычно бывают частыми, однако возможны длительные ремиссии и даже спонтанное выздоровление. Частые рецидивы заболевания способствуют развитию онкологических процессов (рак предстательной железы, шейки матки).
• Поражения ЦНС могут развиться при первичном, но чаще возникают при рецидивирующем герпесе. Состояния могут быть вызваны как ВПГ-1, так и ВПГ-2. Клинически чаще проявляются энцефалитами и менингоэнцефалитами с тяжелым течением и высокой летальностью; также возможно развитие более легкого по течению серозного менингита. В случае выздоровления нередко остаются тяжелые последствия:
◊ деменция;
◊ стойкие параличи и парезы.
• Поражения внутренних органов обычно сочетаются с другими проявлениями герпетической инфекции. Известны герпетические пневмонии, гепатиты, панкреатиты, поражения почек.
Дифференциальная диагностика
Заболевания следует отличать от опоясывающего лишая, ветряной оспы, везикулезных дерматозов, гингивостоматита иной этиологии, язв половых органов.
При подозрении на простой герпес прежде всего необходимо учитывать наиболее общие черты, свойственные разнообразным формам инфекции:
- болезненные везикулы с венчиком гиперемии и серозным содержимым на коже, слизистых оболочках или роговице;
- лихорадка;
- другие признаки интоксикации;
- регионарный лимфаденит.
Появлению везикул предшествуют жжение, зуд, гиперемия, эритема и отек слизистых оболочек, локальное уплотнение кожи. Типична локализация везикулезных элементов вокруг рта или на крыльях носа.
Распространенность высыпаний с выраженными общетоксическими проявлениями, полиаденопатией, гепатолиенальным синдромом, разнообразными органными поражениями, включая ЦНС, свидетельствуют о развитии генерализованной формы герпетической инфекции.
Рецидивирующий простой герпес и генерализованную форму герпетической инфекции рассматривают как ВИЧ-индикаторное состояние, что требует дополнительного обследования больного на АГ ВИЧ и АТ к ним.
Лабораторная диагностика
Вирусологическая диагностика включает исследование содержимого:
- везикул;
- соскобов с эрозий;
- смывов из носоглотки;
- крови;
- спинномозговой жидкости;
- мочи;
- слюны;
- спермы;
- биоптатов мозга (при летальных исходах).
Вирус выращивают в культуре тканей или на куриных эмбрионах. По современным данным, выделение культуры вируса герпеса не дает представления об активности процесса.
Возможно исследование при помощи РНИФ мазков-отпечатков с очагов поражений с обнаружением в них гигантских многоядерных клеток с тельцами включений Коудри типа А. В ряде случаев ставят РСК, РН, ИФА в парных сыворотках; при этом нарастание титра IgM в 4 раза и более говорит о первичной герпетической инфекции, а IgG - о рецидивирующей. В настоящее время все большее распространение находит ПЦР (исследование крови, спинномозговой жидкости при герпетическом энцефалите).
Лечение
Его проводят с учетом клинической формы и тяжести болезни, локализации и распространенности поражений. Рекомендовано назначать ацикловир (виролекс, зовиракс) по 200 мг 5 раз в день курсом 5-10 дней при первичном герпесе или другие противовирусные препараты (валацикловир, фамцикловир). При рецидивирующем герпесе лечение ацикловиром проводят в течение 1 года: в указанных выше дозах препарат назначают курсом на 8 нед, затем его дозу снижают до 200 мг 4 раза в день. При поражениях ЦНС и генерализованных висцеральных формах ацикловир следует как можно раньше начать вводить внутривенно по 15-30 мг/кг в сутки в течение 10 дней.
При локализованных формах можно ограничиться местным лечением - холодными компрессами с жидкостью Бурова, кремом зовиракс (5% ацикловир) или другими мазями, обладающими противовирусной активностью. В случае присоединения вторичной инфекции назначают мазь с неомицином. Мази, содержащие глюкокортикоиды, противопоказаны.
При часто рецидивирующих формах герпеса в стадии ремиссии рекомендуют иммуномодуляторы (тималин, Т-активин, пентоксил и др.), растительные адаптогены (настойки женьшеня, китайского лимонника, элеутерококка, аралии и т.д.), специфический иммуноглобулин, а также вакцинотерапию по специальным схемам.
Эпидемиологический надзор
Сводится к учету заболевших, анализу заболеваемости с выявлением факторов риска, скринингу беременных и информационному обеспечению профилактических и противоэпидемических мероприятий.
Профилактические мероприятия
Для предупреждения воздушно-капельного распространения инфекции рекомендован тот же комплекс мероприятий, что и при ОРВИ. Профилактику генитального герпеса осуществляют способами, аналогичными таковым для предупреждения ЗППП. Для профилактики рецидивов рекомендовано внутрикожное введение инактивированной герпетической вакцины. В ряде случаев высокоэффективно применение иммуномодуляторов и противогерпетического иммуноглобулина.
Мероприятия в эпидемическом очаге
Мероприятия в очаге инфекции не регламентированы.
ВЕТРЯНАЯ ОСПА (VARICELLA)
Ветряная оспа - антропонозная острая вирусная инфекция, сопровождающаяся интоксикацией и поражением эпителия кожи и слизистых оболочек в виде макулопапулезно-везикулезной сыпи.
Краткие исторические сведения
Заболевание описано итальянским врачом и анатомом Г. Видусом (Видиусом) в середине XVI в. Название varicella, отличающее заболевание от натуральной оспы (variola), впервые ввел немецкий врач О. Фогель (1772). После эпидемии 1868-1874 гг. болезнь стали считать отдельной нозологической формой. Возбудитель выявил бразильский врач Э. Арагао (1911), обнаруживший в содержимом пузырьков элементарные тельца вируса (тельца Арагао). Вирус выделен из них в 40-х годах ХХ в.
Этиология
Возбудитель - ДНК-геномный вирус, классифицируемый как вирус герпеса человека типа 3, включенный в состав рода Varicellovirus подсемейства Alphaherpesviridae. Репродуцируется только в организме человека.
Во внешней среде вирус малоустойчив, быстро инактивируется под воздействием:
- солнечного света;
- нагревания;
- УФ-лучей.
Эпидемиология
Резервуар и источник инфекции - больной человек, представляющий опасность в последние 10 дней инкубационного периода и первые 5-7 сут с момента появления сыпи.
Механизм передачи - аэрозольный, путь передачи - воздушнокапельный. Больной выделяет огромное количество вирионов при кашле, разговоре и чихании. Возбудитель может переноситься с током воздуха на большие расстояния (в соседние комнаты, квартиры, с одного этажа на другой и т.д.). Однако из-за малой устойчивости вируса во внешней среде передача возбудителя через различные предметы и вещи, а также через третьих лиц маловероятна. Возможна трансплацентарная передача вируса от беременной плоду.
Естественная восприимчивость людей
Естественная восприимчивость людей высокая. Ветряная оспа оставляет стойкий пожизненный иммунитет. Устойчивость новорожденных обусловливают АТ, полученные от матери; они циркулируют несколько месяцев.
Основные эпидемиологические признаки
Заболевание распространено повсеместно, заболеваемость высокая. В России в 1999 г. она составила в среднем 353,2 человека на 100 000 населения. В 2007 г. - 600,2, в том числе среди детей до 14 лет - 3667 на 100 000 населения.
Особенности эпидемического процесса при ветряной оспе определяют 2 главных фактора:
- воздушно-капельный механизм передачи инфекции;
- всеобщая восприимчивость населения.
Часто заболевание отмечают среди детей, посещающих ДДУ и первые классы школ. К 15 годам около 70-90% населения успевают переболеть. Заболеваемость среди городского населения почти в 2 раза превышает таковую среди сельских жителей. Для инфекции характерна выраженная осенне-зимняя сезонность. Заболеваемость в период сезонных подъемов составляет приблизительно 70-80% общего числа больных. Характерная черта эпидемического процесса ветряной оспы - отсутствие выраженных периодических подъемов и спадов заболеваемости, что может быть объяснено почти абсолютной переболеваемостью всех восприимчивых к этой инфекции детей и отсутствием возможности накопления значительного количества неиммунных лиц.
Патогенез
В организм человека вирус проникает через верхние дыхательные пути, фиксируется на клетках слизистой оболочки, где и происходит его первичное накопление. В дальнейшем возбудитель поступает в регионарные отделы лимфатической системы, а в конце инкубационного периода проникает в кровь. Виремия проявляется лихорадкой, обусловленной накоплением в крови токсичных метаболитов репродукции вируса и развитием аллергических реакций. Возбудитель диссеминирует по всему организму; его последующую локализацию определяет тропность к эпителию кожных покровов и слизистых оболочек. Репродукция вируса в эпителии кожи сопровождается вакуолизацией, баллонной дистрофией и дальнейшей гибелью клеток. В образовавшихся полостях
накапливается серозный экссудат, вследствие чего образуются однокамерные везикулы. При подсыхании везикул на их месте возникают корочки, после которых восстанавливается поврежденный эпидермис. Подобный процесс может развиваться и на слизистых оболочках с быстрым образованием эрозий.
В патогенезе заболевания большое значение имеют нарушения клеточных иммунных реакций. На фоне угнетения системы Т-лимфоцитов у лиц с нарушениями иммунного статуса развиваются тяжелые формы ветряной оспы.
В связи с развитием анергии при ветряной оспе увеличивается восприимчивость к другим инфекциям, обостряются хронические процессы.
После перенесенного заболевания формируется стойкий иммунитет, однако при резком снижении его напряженности у взрослых, переболевших в детстве ветряной оспой, при повторном инфицировании возможно повторное развитие заболевания. Вирус может пожизненно оставаться в организме в латентном состоянии, локализуясь в нервных ганглиях. Механизмы сохранения вируса и возможной последующей его активизации с проявлениями заболевания в виде опоясывающего лишая изучены недостаточно.
Клиническая картина
Инкубационный период варьирует в пределах 1-3 нед. Продромальный период у детей в большинстве случаев отсутствует или выражен незначительно. Характерными являются следующие симптомы:
- недомогание;
- повышенная возбудимость;
- головная боль;
- плаксивость;
- снижение аппетита.
У взрослых этот период нередко протекает с повышением температуры тела, недомоганием, головной болью, анорексией; возможны тошнота и рвота.
Выраженная клиническая картина развивается только с момента появления сыпи. В это время нарастает интоксикация, повышается температура тела. У взрослых сыпь появляется позже, чем у детей, интоксикация более выражена, а лихорадка часто достигает высоких цифр и в дальнейшем сохраняется значительно дольше. Температурная кривая не имеет характерных отличий.
Экзантема может появляться на любых участках тела и распространяться беспорядочно. Сначала на коже образуются мелкие красные пятна, превращающиеся в течение несколько часов в папулы, а затем в везикулы (см. рис. 14 на цветной вклейке). Пузырьки не имеют центрального пупкообразного вдавления, содержат прозрачную жидкость, однокамерные, при прокалывании спадаются. Так же быстро на месте везикул образуются корочки. Появление новых высыпаний и трансформация отдельных элементов происходят одновременно, вследствие чего на одном участке кожи можно видеть разные стадии развития высыпаний:
- пятна;
- папулы;
- везикулы;
- корочки.
Везикулезные элементы могут нагнаиваться, превращаясь в пустулы. При этом общее состояние больных ухудшается, поражения кожи становятся более глубокими, в центре некоторых пустул образуются небольшие западения (оспины), после отпадения корочек могут оставаться рубцы. У взрослых сыпь обильнее и продолжительнее, чем у детей, отторжение корочек происходит значительно позже, а трансформацию везикул в пустулы наблюдают у абсолютного большинства больных.
Сыпь локализуется чаще всего на волосистой части головы, лице, шее, туловище и конечностях, исключая поверхности ладоней и подошв. Количество элементов может быть различным, от единичных до множественных. На протяжении нескольких дней (от 3 до 8 сут) возможны подсыпания с новыми волнами повышенной температуры тела. Одновременно с прекращением подсыпаний интоксикация исчезает.
На слизистых оболочках ротовой полости, иногда гортани, половых органов и на конъюнктиве могут появляться красные пятна, быстро мацерирующиеся и превращающиеся в афты.
Энантему и сопровождающую ее лимфаденопатию у взрослых больных встречают значительно чаще по сравнению с детьми.
Исход заболевания, особенно у детей, благоприятный. Однако тяжесть заболевания значительно варьирует. Наряду с типичными случаями ветряной оспы возможны стертые формы, протекающие без лихорадки и других проявлений интоксикации, со скудной экзантемой.
Тяжелые формы болезни.
• Буллезная форма развивается у взрослых с тяжелыми сопутствующими заболеваниями. На коже образуются крупные дряблые пузыри, а затем вяло заживающие язвы.
• Геморрагическая форма развивается у больных с проявлениями геморрагического диатеза. Отличается появлением везикул с кровянистым содержимым, кровоизлияний на коже, носовых кровотечений, гематурии.
• Гангренозная форма развивается у ослабленных больных, может протекать с быстрым увеличением везикул в размерах и геморрагической трансформацией их содержимого, а после подсыхания везикул - с образованием корок черного цвета с воспалительным ободком.
Дифференциальная диагностика
Заболевание следует отличать от стрептодермии. Дифференциальная диагностика с вариолоидом потеряла актуальность из-за ликвидации натуральной оспы.
При выраженной клинической картине ветряной оспы лихорадка, другие признаки интоксикации и экзантема проявляются практически одновременно.
На одном участке кожи можно видеть разные стадии последовательной трансформации элементов сыпи:
- мелкие красные пятна;
- папулы;
- однокамерные везикулы без пупкообразного вдавления с прозрачным содержимым;
- корочки.
Сыпь локализуется чаще всего на волосистой части головы, лице, шее, туловище и конечностях, исключая поверхности ладоней и подошв. Возможны подсыпания с новыми волнами повышенной температуры тела и энантема на слизистой оболочке рта (иногда гортани, половых органов и на конъюнктиве) в виде красных пятен, быстро мацерирующихся и превращающихся в афты.
Лабораторная диагностика
Гемограмма при ветряной оспе неспецифична; часто наблюдают увеличение СОЭ. Специфические лабораторные исследования включают обнаружение вируса при световой микроскопии содержимого везикул после окраски серебрением, а также постановку серологических реакций (РСК, РТГА) в парных сыворотках крови. Они довольно сложны, дают ретроспективный результат, и их применяют крайне редко в связи с типичной клинической картиной заболевания.
Осложнения и исходы
Иммуносупрессивное действие вируса облегчает возможность развития различных гнойных осложнений:
- стоматитов;
- кератитов;
- конъюнктивитов;
- паротитов и др.
Значительно реже наблюдают энцефалиты и менингоэнцефалиты, сепсис. Осложнения, как правило, встречают у взрослых больных.
Лечение
Лечение обычно проводят в домашних условиях. Средства этиотропного лечения отсутствуют. При выраженной интоксикации с обильными пустулезными высыпаниями рекомендуют назначать антибактериальные средства. В последнее время появились сообщения о положительном эффекте противовирусных препаратов (ацикловира, видарабина) у лиц с нарушениями иммунного статуса, а также лейкинферона (препарата ИФН нового поколения), при назначении которого в ранние сроки болезни укорачивается лихорадочный период, быстрее прекращаются подсыпания, реже развиваются осложнения.
Лечебные мероприятия в основном направлены на уход за кожей и слизистыми оболочками. Для более быстрого подсыхания пузырьков и предотвращения вторичной инфекции элементы сыпи на коже смазывают 1% водными растворами метиленового синего или бриллиантового зеленого, концентрированным раствором перманганата калия. Применяют 0,1% водный раствор этакридина лактата или жидкость Кастеллани. Афтозные образования обрабатывают 3% раствором перекиси водорода или 0,1% раствором этакридина лактата. Выраженный зуд можно облегчить смазыванием кожи глицерином, обтираниями водой с уксусом или спиртом.
Назначают антигистаминные средства. При тяжелом течении, особенно у ослабленных и пожилых лиц, рекомендовано назначать специфический иммуноглобулин.
Эпидемиологический надзор
Включает учет и регистрацию заболевших, анализ эпидемиологических проявлений инфекции и проведение выборочного серологического скрининга населения.
Профилактические мероприятия
Сводятся, главным образом, к недопущению заноса инфекции в детские учреждения и больницы, своевременному выявлению и изоляции первых заболевших. Разработана живая аттенуированная вакцина против ветряной оспы, но плановую иммунизацию в РФ не проводят. За рубежом созданы аналогичные вакцины, применяемые в противоэпидемической практике.
Мероприятия в эпидемическом очаге
Больного изолируют на дому на 9 сут с момента начала заболевания. В ДДУ общавшихся с больным детей разобщают на 21 день. Если день общения с источником инфекции установлен точно, разобщение проводят с 11-го по 21-й день инкубационного периода. При появлении повторных случаев в ДДУ разобщение не проводят. Из-за малой устойчивости возбудителя заключительную дезинфекцию в очагах ветряной оспы не проводят. Ослабленным детям, не болевшим ветряной оспой, внутримышечно вводят 1,5-3 мл иммуноглобулина, полученного из сыворотки крови реконвалесцентов. Диспансерное наблюдение за переболевшими не регламентировано.
ОПОЯСЫВАЮЩИЙ ГЕРПЕС (HERPES ZOSTER)
Опоясывающий герпес (опоясывающий лишай) - вирусная инфекция человека, поражающая кожные покровы и нервную систему, имеющая общую этиологию и тесную патогенетическую связь с ветряной оспой.
Согласно современным представлениям опоясывающий герпес относят к инфекционным заболеваниям в силу вирусной природы, контагиозности больных, развития при нем типичной клинической триады:
- общих инфекционных симптомов;
- характерной экзантемы;
- разнообразных неврологических нарушений с поражениями ЦНС и периферической нервной системы.
Краткие исторические сведения
См. выше раздел «Ветряная оспа».
Этиология
Возбудитель заболевания - вирус семейства Herpesviridae (см. раздел «Ветряная оспа»), вызывающий опоясывающий лишай и ветряную оспу. Как и многие другие представители семейства Herpesviridae, вирус нестоек во внешней среде: быстро гибнет при нагревании, под воздействием УФ-лучей и дезинфицирующих средств. Возбудитель способен долго сохраняться при низкой температуре и выдерживать повторное замораживание.
Эпидемиология
Опоясывающий герпес встречают в виде спорадических случаев. Заболеваемость повышается в холодное время года. Заболевают преимущественно лица старшего возраста, ранее перенесшие ветряную оспу. Индекс заболеваемости составляет 12-15 на 100 000 населения. У небольшой части больных герпес возникает повторно. Контагиозность больных с опоясывающим герпесом доказана еще в 1888 г., когда были описаны случаи заболевания ветряной оспой детей, контактировавших с больными опоясывающим герпесом. В дальнейшем накоплено много наблюдений, свидетельствующих о том, что у детей, ранее не болевших и контактировавших с больным опоясывающим лишаем, развивается типичная ветряная оспа.
Патогенез
Опоясывающий герпес развивается как вторичная эндогенная инфекция у лиц, перенесших ветряную оспу в клинически выраженной или латентной форме. Ее основная причина - реактивация возбудителя после его длительной (от нескольких месяцев до десятков лет) латентной персистенции в организме, вероятнее всего в спинальных ганглиях и ганглиях черепных нервов. Патогенез латентной инфекции и лабораторные методы ее выявления пока не изучены.
Принято считать, что реактивация вируса и развитие клинических проявлений в виде опоясывающего герпеса происходят при ослаблении иммунитета (прежде всего клеточного) и могут быть спровоцированы различными факторами:
- стрессовыми состояниями;
- физическими травмами;
- переохлаждением;
- инфекционными заболеваниями и т.д.
Риск возникновения опоясывающего лишая значительно возрастает у лиц пожилого и преклонного возраста, а также у больных, страдающих онкологическими и гематологическими заболеваниями, получающих гормональную, лучевую и химиотерапию.
В основе патолого-анатомической картины заболевания лежат воспалительные изменения в спинальных ганглиях и связанных с ними участках кожных покровов, иногда также в задних и передних рогах серого вещества, задних и передних корешках спинного мозга и мягких мозговых оболочках.
Клиническая картина
Начальный период заболевания может проявляться продромальными признаками:
- головной болью;
- недомоганием;
- субфебрильной температурой тела;
- познабливанием;
- диспептическими расстройствами.
Одновременно могут возникать боли, жжение и зуд, а также покалывание и парестезии по ходу периферических нервных стволов в зоне будущих высыпаний. Интенсивность этих субъективных локальных признаков различна у отдельных больных. Продолжительность начального периода варьирует от 1 до 3-4 сут, у взрослых его наблюдают чаще и он обычно длиннее, чем у детей.
В большинстве случаев заболевание начинается остро. Температура тела может повышаться до 38-39 °С. Подъем температуры сопровождают общетоксические реакции (головная боль, недомогание, познабливание). В это же время в зоне иннервации одного или нескольких спинальных ганглиев появляются кожные высыпания с характерными для них болевыми и другими субъективными ощущениями.
Сначала экзантема имеет вид ограниченных розовых пятен величиной 2-5 мм, однако в тот же или на следующий день на их фоне образуются мелкие, тесно сгруппированные везикулы с прозрачным серозным содержимым, расположенные на гиперемированном и отечном основании. В большинстве случаев экзантему сопровождают увеличение и болезненность регионарных лимфатических узлов. У детей часто выявляют признаки катара верхних дыхательных путей.
Экзантема локализуется соответственно проекции того или иного чувствительного нерва.
Чаще всего поражение бывает односторонним:
- по ходу межреберных нервов (см. рис. 15 на цветной вклейке);
- ветвей тройничного нерва на лице;
- реже по ходу нервов конечностей.
В ряде случаев наблюдают поражение кожи в области гениталий. В динамике заболевания с промежутками в несколько дней могут появляться новые пятна с развитием на их фоне везикулярных элементов. Через несколько дней эритематозный фон, на котором располагаются везикулы, бледнеет, их содержимое становится мутным. В дальнейшем везикулы подсыхают, образуются корочки, отпадающие к концу 3-й недели заболевания, оставляя легкую пигментацию.
Повышенная температура тела держится несколько дней, симптомы токсикоза исчезают с ее нормализацией.
Генерализованная форма
Иногда через несколько дней после возникновения локализованной экзантемы единичные или множественные везикулы появляются на всех участках кожи и даже на слизистых оболочках, что нередко ошибочно расценивают как присоединение к опоясывающему герпесу ветряной оспы. При генерализованном характере экзантемы, а также в тех случаях, когда локализованный герпес не проходит в течение 2-3 нед, следует подозревать иммунодефицит или развитие злокачественных новообразований.
Абортивная форма
Для этой формы характерны быстрое исчезновение эритематознопапулезной сыпи и отсутствие везикул.
Буллезная форма
Везикулы сливаются в крупные пузыри, содержимое которых может стать геморрагическим (геморрагическая форма). В отдельных случаях множественные везикулы, тесно прилегающие друг к другу, образуют очаг поражения сливного характера в виде сплошной ленты; при его подсыхании образуется сплошной темный струп (некротическая форма).
Тяжесть заболевания часто непосредственно связана с локализацией экзантемы. Случаи с расположением высыпаний в области иннервации надглазничного, лобного и носоресничного нервов отличают интенсивные невралгические боли, гиперемия и отек кожи, поражение век, а иногда и роговицы.
Длительность клинических проявлений опоясывающего герпеса при абортивной форме составляет в среднем несколько дней, при остром течении - 2-3 нед, при затяжном - более 1 мес.
Боли в области экзантемы при опоясывающем лишае имеют выраженный вегетативный характер:
- жгучие;
- приступообразные;
- усиливаются в ночные часы;
- сопровождаются выраженными эмоциональными реакциями. Часто наблюдают локальные парестезии и расстройства кожной чувствительности. Возможны корешковые парезы лицевого и глазодвигательных нервов, конечностей, брюшных мышц, сфинктера мочевого пузыря.
Заболевание может протекать с развитием серозного менингита. Воспалительные изменения в ликворе не всегда сопровождаются выраженной менингеальной симптоматикой. В редких случаях в острый период наблюдают энцефалит и менингоэнцефалит. Описаны случаи полирадикулоневропатии и острой миелопатии.
За первым эпизодом опоясывающего лишая обычно следует стойкая ремиссия. Рецидивирование заболевания наблюдают не более чем в нескольких процентах случаев.
Большинство больных выздоравливают без остаточных признаков, однако невралгические боли могут сохраняться долго, в течение нескольких месяцев и даже лет.
Дифференциальная диагностика
В продромальный период в зависимости от локализации пораженного нерва дифференциальную диагностику проводят с плевритом, невралгией тройничного нерва, аппендицитом, почечной коликой, желчнокаменной болезнью. При появлении высыпаний дифференцируют с простым герпесом, ветряной оспой, рожистым воспалением (при буллезной форме опоясывающего герпеса), поражениями кожи при онкологических и гематологических заболеваниях, сахарном диабете и ВИЧинфекции.
Опоясывающий герпес отличает типичная клиническая триада:
- общеинфекционные симптомы;
- характерная экзантема (чаще односторонняя);
- боль в области экзантемы.
Боли в области экзантемы жгучие, приступообразные, усиливаются в ночные часы. В динамике с промежутками в несколько дней могут появляться новые высыпания.
Лабораторная диагностика
В широкой практике не проводят.
Лечение
В качестве этиотропного средства рекомендован ацикловир (зовиракс, виролекс) - избирательный ингибитор синтеза вирусной ДНК. Эффективность специфического лечения более выражена при его начале в первые 3-4 дня заболевания. Ацикловир применяют внутривенно капельно (суточную дозу 15-30 мг/кг разделяют на 3 вливания с интервалом 8 ч, разовые дозы вводят в 150 мл изотонического раствора натрия хлорида) или назначают в таблетках по 800 мг (для взрослых) 5 раз в сутки. Курс лечения составляет 5 дней.
В качестве средств патогенетического лечения у взрослых применяют курантил внутрь по 25-50 мг 3 раза в день курсом 5-7 дней (тормозит агрегацию тромбоцитов) в сочетании с дегидратирующим средством - фуросемидом. Внутримышечное введение гомологичного иммуноглобулина активирует иммуногенез. Иммуноглобулин вводят по 1-2 дозы 2-3 раза в сутки ежедневно или через день. Также назначают иммуномодулятор левамизол по 100-150 мг в день курсом 3-4 дня. Активно применяют симптоматические средства - анальгетики, трициклические антидепрессанты (амитриптилин), седативные и снотворные препараты.
В случаях выраженной интоксикации проводят дезинтоксикационное лечение в сочетании с форсированным диурезом по общепринятым правилам.
Местно для обработки везикул применяют раствор бриллиантового зеленого. Корочки смазывают 5% дерматоловой мазью. При вялотекущих процессах можно применять метациловую мазь или солкосерил.
В случаях активации вторичной бактериальной флоры показаны антибиотики.
Профилактические мероприятия
Профилактических и противоэпидемических мероприятий в очаге не проводят.
ИНФЕКЦИОННЫЙ МОНОНУКЛЕОЗ (MONONUCLEOSIS INFECTIOSA)
Инфекционный мононуклеоз - острое антропонозное вирусное инфекционное заболевание с лихорадкой, поражением ротоглотки, лимфатических узлов, печени, селезенки и специфическими изменениями гемограммы.
Краткие исторические сведения
Клинические проявления заболевания впервые описаны Н.Ф. Филатовым (болезнь Филатова, 1885) и Е. Пфайффером (1889). Изменения гемограммы изучены многими исследователями (Бернс Й., 1909; Тайди Г. и др., 1923; Шварц Е., 1929; и др.). В соответствии с этими характерными изменениями американские ученые T. Спрэнт и Ф. Эванс назвали заболевание инфекционным мононуклеозом. Возбудитель впервые выделили английский патолог М.А. Эпстайн и канадский вирусолог И. Барр из клеток лимфомы Беркитта (1964). Позднее вирус получил название вируса Эпстайна-Барр.
Этиология
Возбудитель - ДНК-геномный вирус рода Lymphocryptovirus подсемейства Gammaherpesvirinae семейства Herpesviridae. Вирус способен реплицироваться, в том числе в В-лимфоцитах. В отличие от других вирусов герпеса он не вызывает гибели клеток, а, напротив, активирует их пролиферацию.
Вирионы включают специфические Аг:
- капсидный (VCA);
- ядерный (EBNA);
- ранний (EA);
- мембранный (MA).
Каждый из них образуется в определенной последовательности и индуцирует синтез соответствующих АТ. В крови больных инфекционным мононуклеозом сначала появляются АТ к капсидному Аг, позднее вырабатываются АТ к ЕА и MA. Возбудитель малоустойчив во внешней среде и быстро гибнет при высыхании, под действием высокой температуры и дезинфектантов.
Инфекционный мононуклеоз - только одна из форм инфекции вирусом Эпстайна-Барр, который также вызывает лимфому Беркитта и носоглоточную карциному. Его роль в патогенезе ряда других патологических состояний недостаточно изучена.
Эпидемиология
Резервуар и источник инфекции - человек с манифестной или стертой формой болезни, а также носитель возбудителя. Инфицированные лица выделяют вирус с последних дней инкубации и на протяжении 6-18 мес после первичной инфекции. В смывах из ротоглотки у 15-25% серопозитивных здоровых людей также обнаруживают вирус. Эпидемический процесс поддерживают лица, ранее перенесшие инфекцию и на протяжении долгого времени выделяющие возбудитель со слюной.
Механизм передачи - аэрозольный, путь передачи - воздушнокапельный. Очень часто вирус выделяется со слюной, поэтому возможно заражение контактным путем (при поцелуях, половым путем, через руки, игрушки и предметы обихода). Возможна передача инфекции при переливаниях крови, а также во время родов.
Естественная восприимчивость людей
Естественная восприимчивость людей высокая, однако преобладают легкие и стертые формы болезни. О врожденном пассивном иммунитете может свидетельствовать крайне низкая заболеваемость детей первого года жизни. Иммунодефицитные состояния способствуют генерализации инфекции.
Основные эпидемиологические признаки
Заболевание распространено повсеместно. В основном регистрируют спорадические случаи, иногда - небольшие вспышки. Полиморфность клинической картины, довольно частые сложности диагностики болезни дают основания полагать, что уровень официально регистрируемой заболеваемости в РФ (6-7 на 100 000 населения) не отражает истинной широты распространения инфекции. Наиболее часто заболевают подростки, у девочек максимальную заболеваемость регистрируют в 14-16 лет, у мальчиков - в 16-18 лет. Поэтому иногда инфекционный мононуклеоз также называют болезнью студентов. Лица старше 40 лет болеют редко, но у ВИЧ-инфицированных реактивация латентной инфекции возможна в любом возрасте. При заражении в раннем дет-
ском возрасте первичная инфекция протекает в виде респираторного заболевания, в более старших возрастах - бессимптомно. К 30-35 годам у большинства людей в крови выявляют АТ к вирусу инфекционного мононуклеоза, поэтому клинически выраженные формы редко встречают среди взрослых. Заболевания регистрируют на протяжении всего года, несколько реже - в летние месяцы. Заражению способствуют скученность, пользование общим бельем, посудой, тесные бытовые контакты.
Патогенез
Проникновение вируса в верхние отделы дыхательных путей приводит к поражению эпителия и лимфоидной ткани рото- и носоглотки. Отмечают отек слизистой оболочки, увеличение миндалин и регионарных лимфатических узлов. При последующей виремии возбудитель внедряется в В-лимфоциты, находясь в их цитоплазме, он диссеминирует по всему организму. Распространение вируса приводит к системной гиперплазии лимфоидной и ретикулярной тканей, в связи с чем в периферической крови появляются атипичные мононуклеары. Развиваются лимфаденопатия, отек слизистой оболочки носовых раковин и ротоглотки, увеличиваются печень и селезенка. Гистологически выявляют гиперплазию лимфоретикулярной ткани во всех органах, лимфоцитарную перипортальную инфильтрацию печени с незначительными дистрофическими изменениями гепатоцитов.
Репликация вируса в В-лимфоцитах стимулирует их активную пролиферацию и дифференцировку в плазмоциты. Последние секретируют иммуноглобулины низкой специфичности. Одновременно в острый период заболевания нарастают количество и активность Т-лимфоцитов. Т-супрессоры сдерживают пролиферацию и дифференцировку В-лимфоцитов. Цитотоксические Т-лимфоциты уничтожают инфицированные вирусом клетки, распознавая мембранные вирус-индуцированные Аг. Однако вирус остается в организме и персистирует в нем в течение всей последующей жизни, обусловливая хроническое течение заболевания с реактивацией инфекции при снижении иммунитета.
Выраженность иммунологических реакций при инфекционном мононуклеозе позволяет считать его болезнью иммунной системы, поэтому его относят к группе заболеваний ВИЧ-ассоциированного комплекса.
Клиническая картина
Инкубационный период варьирует от 5 дней до 1,5 мес. Возможен продромальный период, не имеющий специфической симптоматики.
В этих случаях заболевание развивается постепенно, в течение нескольких дней наблюдают:
- субфебрильную температуру тела;
- недомогание;
- слабость;
- повышенную утомляемость;
- катаральные признаки в верхних дыхательных путях (заложенность носа, гиперемию слизистой оболочки ротоглотки, увеличение и гиперемию миндалин).
При остром начале заболевания температура тела быстро поднимается до высоких цифр. Больные жалуются на головную боль, боли в горле при глотании, озноб, усиленное потоотделение, ломоту в теле. В дальнейшем температурная кривая может быть различной. Длительность лихорадки варьирует от нескольких дней до 1 мес и более.
К концу 1-й недели заболевания развивается период разгара болезни.
Характерно появление всех основных клинических синдромов:
- общетоксических признаков;
- ангины;
- лимфаденопатии;
- гепатолиенального синдрома.
Самочувствие больного ухудшается, отмечают высокую температуру тела, озноб, головную боль и ломоту в теле. Могут появиться заложенность носа с затруднением носового дыхания, гнусавость голоса. Поражения зева проявляются нарастанием боли в горле, развитием ангины в катаральной, язвенно-некротической, фолликулярной или пленчатой форме. Гиперемия слизистой оболочки выражена нерезко, на миндалинах появляются рыхлые желтоватые легко снимающиеся налеты. В некоторых случаях налеты могут напоминать дифтерийные. На слизистой оболочке мягкого нёба возможно появление геморрагических элементов, задняя стенка глотки резко гиперемированная, разрыхленная, зернистая, с гиперплазированными фолликулами (см. рис. 16 на цветной вклейке).
С первых же дней развивается лимфаденопатия. Увеличенные лимфатические узлы можно обнаружить во всех доступных пальпации областях. Характерна симметричность их поражения. Наиболее часто при мононуклеозе увеличиваются затылочные, подчелюстные и особенно заднешей-
ные лимфатические узлы с обеих сторон по ходу грудино-ключичнососцевидных мышц. Лимфатические узлы уплотнены, подвижны, при пальпации безболезненны или болезненны незначительно. Их размеры варьируют от горошины до грецкого ореха. Подкожная клетчатка вокруг лимфатических узлов в некоторых случаях может быть отечной.
У большинства больных в период разгара заболевания отмечают увеличение печени и селезенки.
В некоторых случаях развивается желтушный синдром:
- усиливаются диспепсические симптомы (снижение аппетита, тошнота);
- темнеет моча;
- появляется иктеричность склер и кожи;
- в сыворотке крови нарастает содержание билирубина и повышается активность аминотрансфераз.
Иногда появляется экзантема пятнисто-папулезного характера. Она не имеет определенной локализации, не сопровождается зудом и быстро исчезает без лечения, не оставляя изменений на коже.
Вслед за периодом разгара заболевания, продолжающимся в среднем 2-3 нед, наступает период реконвалесценции. Самочувствие больного улучшается, нормализуется температура тела, постепенно исчезают ангина и гепатолиенальный синдром. В дальнейшем нормализуются размеры лимфатических узлов. Длительность периода реконвалесценции индивидуальна, иногда субфебрильная температура тела и лимфаденопатия сохраняются в течение нескольких недель. Заболевание может протекать длительно, со сменой периодов обострений и ремиссий, из-за чего его общая продолжительность может затягиваться до 1,5 года.
Клинические проявления инфекционного мононуклеоза у взрослых больных отличаются рядом особенностей. Заболевание часто начинается с постепенного развития продромальных признаков, лихорадка часто сохраняется более 2 нед, выраженность лимфаденопатии и гиперплазии миндалин меньше, чем у детей. Вместе с тем у взрослых чаще наблюдают проявления заболевания, связанные с вовлечением в процесс печени и развитием желтушного синдрома.
Дифференциальная диагностика
Заболевание следует отличать от лимфогранулематоза и лимфолейкоза, ангин кокковой и иной этиологии, дифтерии ротоглотки, а также вирусных гепатитов, псевдотуберкулеза, краснухи, токсоплазмоза, хла-
мидийных пневмоний и орнитоза, некоторых форм аденовирусной инфекции, ЦМВ-инфекции, первичных проявлений ВИЧ-инфекции.
Инфекционный мононуклеоз отличает сочетание основных 5 клинических синдромов:
- общетоксических признаков;
- двусторонней ангины;
- полиаденопатии (особенно с поражением лимфатических узлов по ходу грудино-ключично-сосцевидных мышц с обеих сторон);
- гепатолиенального синдрома;
- специфических изменений гемограммы.
В некоторых случаях возможны желтуха и (или) экзантема пятнистопапулезного характера.
Лабораторная диагностика
Характерный признак - изменения клеточного состава крови. В гемограмме выявляют умеренный лейкоцитоз, относительную нейтропению со сдвигом лейкоцитарной формулы влево, значительное увеличение количества лимфоцитов и моноцитов (суммарно более 60%). В крови присутствуют атипичные мононуклеары - клетки с широкой базофильной цитоплазмой, имеющие различную форму. Их присутствие в крови определило современное название болезни. Диагностическое значение имеет увеличение количества атипичных мононуклеаров с широкой цитоплазмой не менее чем до 10-12%, хотя число этих клеток может достигать 80-90%. Следует заметить, что отсутствие атипичных мононуклеаров при характерных клинических проявлениях заболевания не противоречит предполагаемому диагнозу, поскольку их появление в периферической крови может задерживаться до конца 2-3-й недели болезни.
В период реконвалесценции количество нейтрофилов, лимфоцитов и моноцитов постепенно нормализуется, однако довольно часто длительно сохраняются атипичные мононуклеары (см. рис. 17 на цветной вклейке).
Вирусологические методы диагностики (выделение вируса из ротоглотки) на практике не применяют. Методом ПЦР можно выявлять вирусную ДНК в цельной крови и сыворотке.
Разработаны серологические методы определения АТ различных классов к капсидным (VCA) Аг. Сывороточные IgM к VCA-Аг можно обнаружить уже в инкубационный период. В дальнейшем их выявляют у всех больных (это служит достоверным подтверждением диагноза).
Исчезают IgM к VCA-Аг лишь через 2-3 мес после выздоровления. После перенесенного заболевания пожизненно сохраняются IgG к VCA-Аг.
При отсутствии возможности определения анти-VCA-IgM до сих пор применяют серологические методы обнаружения гетерофильных АТ. Они образуются в результате поликлональной активации В-лимфоцитов. Наиболее популярны реакция Пауля-Буннеля с эритроцитами барана (диагностический титр 1:32) и более чувствительная реакция Гоффа- Бауэра с эритроцитами лошади. Недостаточная специфичность реакций снижает их диагностическую ценность.
Всем больным с инфекционным мононуклеозом или при подозрении на него нужно проводить троекратное (в острый период, затем через 3 и 6 мес) лабораторное обследование на АТ к Аг ВИЧ, поскольку в стадии первичных проявлений ВИЧ-инфекции также возможен мононуклеозоподобный синдром.
Осложнения и исходы
Самое частое осложнение - присоединение бактериальных инфекций, вызванных золотистым стафилококком, стрептококками и др. Также возможны менингоэнцефалит, обструкция верхних отделов респираторного тракта увеличенными миндалинами. В редких случаях отмечают двустороннюю интерстициальную инфильтрацию легких с тяжелой гипоксией, тяжелый гепатит (у детей), тромбоцитопению, разрывы селезенки. В большинстве случаев прогноз заболевания благоприятный.
Лечение
Больных легкими и среднетяжелыми формами инфекционного мононуклеоза можно лечить на дому. Необходимость постельного режима определяется выраженностью интоксикации. В случаях заболевания с проявлениями гепатита рекомендуют диету (стол ? 5).
Специфическое лечение не разработано. Проводят дезинтоксикационное, десенсибилизирующее, симптоматическое и общеукрепляющее лечение, полоскания ротоглотки растворами антисептиков. Антибиотики при отсутствии бактериальных осложнений не назначают. При гипертоксическом течении заболевания, а также при угрозе асфиксии, обусловленной отеком глотки и выраженным увеличением миндалин, назначают короткий курс лечения глюкокортикоидами (преднизолон внутрь в суточной дозе 1-1,5 мг/кг в течение 3-4 дней).
Эпидемиологический надзор
Основные мероприятия направлены на совершенствование выявления и регистрации больных, включают проведение анализа заболеваемости с учетом клинических форм и эпидемиологических проявлений инфекции.
Профилактические мероприятия
Общие меры профилактики аналогичны таковым при ОРВИ. Меры специфической профилактики не разработаны. Неспецифическую профилактику осуществляют повышением общей и иммунологической резистентности организма.
Мероприятия в эпидемическом очаге
Больных госпитализируют по клиническим показаниям. За лицами, общавшимися с больным, устанавливают медицинское наблюдение в течение 20 дней с последнего дня контакта. Для экстренной профилактики инфекции детям, общавшимся с больным, можно вводить специфический иммуноглобулин. Учитывая возможность передачи инфекции через контаминированные предметы внешней среды, большое значение имеет влажная уборка с применением дезинфицирующих средств. Предметы личной гигиены (носовые платки и др.) подлежат дезинфекции.
ЦИТОМЕГАЛОВИРУСНАЯ ИНФЕКЦИЯ
ЦМВ-инфекция - антропонозная оппортунистическая инфекция, у иммунокомпетентных лиц протекает обычно в латентной или легкой форме. Представляет опасность при различных иммунодефицитных состояниях и беременности (вследствие риска внутриутробного заражения плода).
Краткие исторические сведения
Еще в 1882 г. немецкий патологоанатом Х. Рибберт обнаружил в почечных канальцах мертворожденного ребенка своеобразные гигантские клетки с включениями в ядре. Впоследствии они получили назва-
ние цитомегалических клеток (Гудпасчер Э., Тэлбот Ф., 1921). Позднее Л. Смит и У. Роу (1956) выделили вирус, вызывающий заболевание с развитием характерной цитомегалии. Он был назван ЦМВ, а само заболевание - ЦМВ-инфекцией.
Этиология
Возбудитель - ДНК-геномный вирус рода Cytomegalovirus подсемейства Betaherpesvirinae семейства Herpesviridae. Известно 3 штамма вируса:
- Davis;
- AD-169;
- Kerr.
Медленная репродукция вируса в клетке возможна без ее повреждения. Вирус инактивируется при нагревании и замораживании, хорошо сохраняется при комнатной температуре. При 90 °С сохраняется длительное время, сравнительно стабилен при рН 5-9 и быстро разрушается при рН 3.
Эпидемиология
Резервуар и источник инфекции - человек с острой или латентной формой заболевания.
Вирус может находиться в различных биологических средах:
- слюне;
- отделяемом носоглотки;
- слезах;
- моче;
- испражнениях;
- семенной жидкости;
- секрете шейки матки.
Механизмы передачи многообразны, пути передачи - воздушнокапельный, контактный (прямой и опосредованный - через предметы обихода) и трансплацентарный. Возможно заражение половым путем, при пересадке внутренних органов (почек или сердца) и переливании крови инфицированного донора. Интранатальное заражение ребенка наблюдают гораздо чаще трансплацентарного. Наиболее опасно для плода инфицирование матери в I триместр беременности. В подобных ситуациях велика частота нарушений внутриутробного развития.
Естественная восприимчивость людей
Естественная восприимчивость людей высокая, но широко распространена латентная инфекция. Клинические проявления инфекции, относимой к оппортунистическим заболеваниям, возможны в условиях первичного или вторичного иммунодефицита.
Основные эпидемиологические признаки
Болезнь регистрируют повсеместно, о ее широком распространении свидетельствуют противовирусные АТ, выявляемые у 50-80% взрослых. Многообразие путей заражения ЦМВ и полиморфность клинической картины определяют эпидемиологическую и социальную значимость ЦМВ-инфекции. Это заболевание играет важную роль в трансплантологии, гемотрансфузиологии, перинатальной патологии, может быть причиной недоношенности, мертворождений, врожденных дефектов развития. У взрослых ЦМВ-инфекцию встречают как сопутствующее заболевание при различных иммунодефицитных состояниях. Продолжающееся загрязнение окружающей среды, применение цитостатиков и иммунодепрессантов способствуют росту частоты ЦМВ-инфекции. Развитие тяжелой ЦМВИ описано у онкогематологических больных, пациентов, страдающих пневмоцистной пневмонией, туберкулезом, лучевой болезнью, ожоговой травмой, у лиц, находящихся на длительном глюкокортикостероидном лечении, перенесших различные стрессовые ситуации. В последние годы особенно актуальным стало ее обострение у ВИЧ-инфицированных. Манифестная ЦМВИ занимает одно из первых мест в структуре оппортунистических заболеваний у ВИЧ-инфицированных пациентов и наблюдается у 20-40% больных СПИДом, не получающих антиретровирусное лечение. У беременных с латентной ЦМВ-инфекцией поражение плода происходит далеко не всегда. Вероятность внутриутробного заражения значительно выше при первичном инфицировании женщины во время беременности. Сезонных или профессиональных особенностей заболеваемости не выявлено.
Патогенез
При различных путях передачи воротами инфекции могут быть слизистые оболочки верхних дыхательных путей, ЖКТ или половых органов. Вирус проникает в кровь. Кратковременная виремия быстро завершается локализацией возбудителя при внедрении в лейкоциты и мононуклеарные фагоциты, где происходит его репликация. Инфицированные клетки увеличиваются в размерах (цитомегалия), приобрета-
ют типичную морфологию с ядерными включениями, представляющими собой скопления вируса. Образование цитомегалических клеток сопровождается интерстициальной лимфогистиоцитарной инфильтрацией, развитием узелковых инфильтратов, кальцификатов и фиброза в различных органах, железистоподобных структур в головном мозге (см. рис. 18 на цветной вклейке).
Вирус способен длительно и латентно персистировать в органах, богатых лимфоидной тканью, будучи защищенным от воздействия АТ и ИФН. В то же время он может подавлять клеточный иммунитет прямым воздействием на Т-лимфоциты. При различных иммунодефицитных состояниях (в раннем детском возрасте, при беременности, применении цитостатиков и иммунодепрессантов, ВИЧ-инфекции) и при нарушениях клеточного иммунитета, дополнительно усугубленных прямым воздействием вируса, возможны реактивация возбудителя и его гематогенная генерализация с поражением практически всех органов и систем. При этом большое значение имеет эпителиотропность вируса. Она особенно выражена по отношению к эпителию слюнных желез, под воздействием вируса превращающегося в цитомегалические клетки.
Активную ЦМВ-инфекцию рассматривают как индикатор дефектов клеточного иммунитета, она включена в группу ВИЧ-ассоциированных состояний.
Клиническая картина
Среди разнообразных вариантов течения ЦМВ-инфекции преобладают субклинические формы и латентное вирусоносительство. Клинически выраженной инфекция становится в условиях иммунодефицита. Единая клиническая классификация ЦМВ-инфекции не разработана. В соответствии с одной из классификаций (Казанцев А.П., Попова Н.И., 1980) выделяют врожденную ЦМВ-инфекцию в острой и хронической формах и приобретенную ЦМВ-инфекцию в латентной, острой мононуклеозной или генерализованной формах.
Врожденная цитомегаловирусная инфекция
В большинстве случаев клинически не проявляется на ранних этапах жизни ребенка, однако на более поздних стадиях его развития выявляют разнообразную патологию:
- глухоту;
- хориоретинит с атрофией зрительных нервов;
- снижение интеллекта;
- нарушения речи.
Вместе с тем в 10-15% случаев при врожденной ЦМВ-инфекции развивается так называемый явный ЦМВ-синдром. Его проявления зависят от сроков заражения плода во время беременности.
• Острая врожденная ЦМВ-инфекция.
◊ На ранних сроках беременности приводит к внутриутробной гибели плода или рождению ребенка с разнообразными пороками развития:
<8> микроцефалией;
<8> микро- и макрогирией;
<8> гипоплазией легких;
<8> атрезией пищевода;
<8> аномалиями строения почек;
<8> дефектами межпредсердной и межжелудочковой перегородок; <8> сужением легочного ствола и аорты и т.д.
◊ При заражении плода в поздние сроки беременности пороки развития не формируются, однако у новорожденных с первых дней жизни выявляют признаки разнообразных заболеваний:
<8> геморрагический синдром; <8> гемолитическую анемию;
<8> желтухи различного генеза (вследствие врожденного гепатита, цирроза печени, атрезии желчных путей).
◊ Возможны разнообразные клинические проявления, свидетельствующие о поражении различных органов и систем:
<8> интерстициальная пневмония; <8> энтериты; <8> колиты;
® поликистоз поджелудочной железы; <8> нефрит;
® менингоэнцефалит; ® гидроцефалия.
◊ Острая врожденная ЦМВ-инфекция при развитии явного ЦМВсиндрома имеет склонность к генерализации, тяжелому течению с присоединением вторичных инфекций. Часто неизбежен летальный исход в течение первых недель жизни ребенка.
• Для хронической врожденной ЦМВ-инфекции характерны:
◊ микрогирия;
◊ гидроцефалия;
◊ микроцефалия;
◊ помутнение хрусталика и стекловидного тела.
Приобретенная цитомегаловирусная инфекция
• У взрослых и детей старшего возраста в большинстве случаев протекает латентно в виде бессимптомного носительства или субклинической формы с хроническим течением.
• Острая форма приобретенной ЦМВ-инфекции часто может не иметь четкой клинической симптоматики, иногда по основным клиническим проявлениям сходна с гриппом, инфекционным мононуклеозом или вирусным гепатитом.
• У взрослых с иммунодефицитными состояниями различной выраженности (от физиологической иммуносупрессии при беременности до ВИЧ-инфекции), а также у детей до 3 лет реактивация ЦМВ проявляется в виде генерализованной формы с разнообразными поражениями органов и систем. В процесс могут быть вовлечены ЦНС, легкие, печень, почки, ЖКТ, мочеполовая система и т.д. Часто диагностируют гепатит, интерстициальную пневмонию, энтероколиты, воспалительные процессы различных отделов половых органов (чаще у женщин), энцефалиты. При полиорганных поражениях заболевание отличает тяжелое течение, оно может принимать черты сепсиса. Исход часто неблагоприятный.
Любые проявления ЦМВ-инфекции рассматривают как индикаторные в отношении ВИЧ-инфекции. В этом случае необходимо обследование больного на АТ к ВИЧ.
Дифференциальная диагностика
Довольно затруднительна из-за отсутствия или разнообразия клинических проявлений.
Лабораторная диагностика
Наиболее простые методы исследования - цитоскопия слюны и мочи, а также материала, полученного при биопсии и аутопсии для выявления специфических цитомегалических клеток. В исследуемых образцах с помощью ПЦР можно выявить вирусную ДНК (в настоящее время расценивают как наиболее достоверный диагностический тест).
Серологические методы (ИФА, РИА, РИФ и иммуноблоттинг) направлены на выявление АТ различных классов. При первичной ЦМВинфекции обнаруживают IgM, при реактивации процесса - одновременно IgM и IgG. Поскольку при врожденной ЦМВ-инфекции титры
IgM быстро снижаются, уже на втором году жизни ребенка они могут отсутствовать.
Вирусологические методы (изоляция вируса на культуре фибробластов человека, определение Аг вируса в исследуемом материале с помощью моноклональных АТ) в клинической практике не получили распространения из-за сложности.
Осложнения и исходы
Осложнения разнообразны и зависят от клинических вариантов течения заболевания.
Лечение
Лечение представляет определенные трудности, так как ИФН и многие противовирусные средства (ацикловир, видарабин, виразол) оказались неэффективными, а в некоторых случаях их применение вызывает парадоксальные реакции. Ганцикловир замедляет развитие ЦМВретинита, но мало результативен при поражениях легких, мозга, органов ЖКТ. Определенные перспективы имеет препарат фоскарнет. Возможно применение анти-ЦМВ гипериммунного человеческого иммуноглобулина. Для лечения женщин с отягощенным акушерским анамнезом предложено назначать иммуномодуляторы (левамизол, Т-активин).
Эпидемиологический надзор
Направлен на оценку широты распространенности инфекции среди населения, выявление групп и факторов риска инфицирования.
Профилактические мероприятия
Специфическая профилактика не разработана. При переливании крови следует использовать кровь здоровых доноров, не содержащую АТ к ЦМВ, то же относится и к пересадке внутренних органов. Показано применение с профилактической целью специфического гипериммунного иммуноглобулина в группах риска (реципиентам костного мозга, сердца, почек и печени; больным, получающим цитостатические препараты, беременным). В профилактике врожденной инфекции большое значение имеет предупреждение контактов беременных с больными, строгое соблюдение противоэпидемического режима в родовспомогательных учреждениях. Дети, родившиеся от матерей с ЦМВинфекцией и не имеющие признаков инфицирования, не подлежат
грудному вскармливанию. В случае рождения ребенка с ЦМВ-инфекцией повторную беременность можно рекомендовать не ранее чем через 2 года.
Мероприятия в эпидемическом очаге
Не регламентированы.
НАТУРАЛЬНАЯ ОСПА
(VARIOLA VERA)
Натуральная оспа - вирусный антропоноз с аэрозольным механизмом передачи возбудителя, относящийся к группе особо опасных инфекций и протекающий с интоксикацией, лихорадкой и появлением своеобразных папулезно-везикулезно-пустулезных высыпаний на коже и слизистых оболочках.
Краткие исторические сведения
Палеонтологические находки и письменные памятники свидетельствуют о том, что оспа была известна жителям Древнего Египта, Индии и Китая. Первый официально задокументированный случай оспы датируется 1157 г. до н.э. (смерть египетского фараона Рамзеса V). Первый китайский трактат об оспе относится к 1122 г. до н.э. В VII в. н.э. оспу завозят из Египта в страны Южной Европы морским путем. Заболевание получает дальнейшее распространение в период крестовых походов и к XVI в. становится эпидемичной в странах Восточного полушария. Во 2-й половине XVI в. испанские и английские колонизаторы завозят оспу на американский континент, в результате чего только в одной Мексике от заболевания погибло 3 млн ацтеков. В последующем оспа получила повсеместное распространение и до начала 30-х годов XX в. оставалась глобальной инфекцией.
Эпидемии оспы, периодически повторяющиеся через каждые 3-7 лет, наносили огромный ущерб здоровью и хозяйственной деятельности населения всех стран. В периоды войн эпидемии оспы часто возникали в армиях и приводили к резкому ослаблению боеспособности войск, а нередко - и к срыву военных кампаний. В XVII-XVIII вв. в Европе ежегодно болели оспой в среднем около 10 млн человек, из которых около 1,5 млн умирали. В ходе крупных эпидемий оспы летальность
достигала 25-40%. Способность к быстрому распространению, тяжелое течение заболевания и высокая летальность выдвинули оспу в группу самых грозных инфекций.
Оспа перед началом программы ее ликвидации была распространена в странах Азии, Африки и Южной Америки. Особенно ухудшилась ситуация в мире после Второй мировой войны. В 1958 г. было зарегистировано 2,6 млн случаев в 13 странах, что, по мнению специалистов, составляло лишь до 50% истинной заболеваемости, в среднем с 20%-й летальностью. В XIX - начале ХХ в. оспа была эндемична в России. С 1796 г., вскоре после открытия Э. Дженнером предохранительного действия прививок вирусом коровьей оспы, оспопрививание стало применяться в России. Однако организация прививочной кампании была плохой. В 1919 г. был издан декрет об обязательном оспопрививании, все расходы по которому брало на себя государство. К 1937 г. заболеваемость оспой в СССР была полностью ликвидирована. Однако заносы болезни из эндемичных территорий соседних государств и из Индии продолжались до 1960 г. без возникновения вспышек. Опыт борьбы с оспой в СССР был использован при разработке программы ликвидации оспы в мире. В 1958 г. на 11-й сессии Генеральной Ассамблеи ВОЗ глава делегации СССР, директор Института вирусологии им. Д.И. Ивановского академик В.М. Жданов предложил принять программу ликвидации оспы в мире; правомерность такой постановки вопроса на тот момент основывалась на эффективности вакцины и отсутствии сведений о природных очагах вируса или генитически близких вирусов. Более 1,5 млрд доз вакцины были безвозмездно переданы нашей страной для реализации этой беспрецедентной программы. Многие отечественные эпидемиологи и вирусологи приняли участие в ее реализации. Программа ВОЗ под руководством американского эпидемиолога Д. Гендерсона, включавшая массовую вакцинацию, мониторинг и сдерживание вспышек, привела к блестящим результатам: 26 октября 1977 г. в Сомали зарегистрирован последний случай заболевания. 8 мая 1980 г. ВОЗ на 33-й сессии Генеральной Ассамблеи провозгласила победу над оспой и рекомендовала прекратить производство вакцины и вакцинацию населения.
Этиология
Возбудитель натуральной оспы - Orthopoxvirus variola из рода Orthopoxvirus, подсемейства Chordopoxviridae, семейства Poxviridae - относится к группе вирусов оспы животных (грызунов, обезьян, кроли-
ков, коров). Он открыт в 1906 г. в Германии Э. Пашеном. Вирус содержит РНК, имеет размеры 200-300 мкм, размножается в цитоплазме клеток. Оспенный вирус весьма устойчив во внешней среде, хорошо переносит высушивание и низкие температуры: при лиофилизации и замораживании жизнеспособность вируса сохраняется в течение нескольких лет. В оспенных корочках при комнатной температуре он может сохраняться до года, в каплях мокроты и слизи - до 3 мес. В высушенном виде даже при нагревании до 100 °С вирус гибнет только через 5-10 мин. Фенол и эфир воздействуют на него слабо. Быстро убивает вирус 1% раствор формальдегида, 3% раствор хлорамина разрушает его в течение 3 ч.
Эпидемиология
Резервуар и источник инфекции - больной человек, как правило, с острой манифестной формой заболевания. Больной выделяет вирус в течение всего периода высыпаний, особенно активно в первые 8-10 сут. Средняя продолжительность заразного периода составляет 40 дней от начала заболевания. Для этой инфекции не характерны хронические формы заболевания, здоровое и реконвалесцентное носительство возбудителя. Больные легкими формами болезни выделяют вирус в небольшом количестве и непродолжительное время.
Характер контагиозности источников инфекции определяет локализацию возбудителя в организме больного:
- основная локализация - слизистые оболочки дыхательных путей и зева (ротовой полости, носоглотки, трахеи, бронхов и бронхиол);
- дополнительная локализация - в коже.
Механизм передачи инфекции определяется прежде всего локализацией вируса на слизистых оболочках дыхательных путей. Этой локализации соответствует аэрозольный механизм передачи. Вирус из элементов энантемы выходит в воздух в каплях слизи и воспалительного экссудата - при кашле, чихании, стоне, разговоре, выдохе. Образуется капельная фаза аэрозоля. При этой фазе заражаются люди, находящиеся в одном помещении с больным. По мере подсыхания капли превращаются в ядрышки. Ядрышковая фаза аэрозоля легко перемещается с конвекционными потоками воздуха в коридор, помещения соседние или расположенные этажом выше - через открытые окна и форточки, особенно при функционировании системы отопления, через вентиля-
ционные трубы многоэтажных зданий. Так возникали госпитальные вспышки в лечебных учреждениях, куда первые больные госпитализировались с ошибочным диагнозом.
Естественная восприимчивость людей
К оспе восприимчиво подавляющее большинство неиммунных людей. Прослойка естественно резистентных к оспе лиц не превышает 12% (в среднем 5-7%). У остальных степень восприимчивости различна. Часть больных (от 12 до 40%) погибает. У переболевших вырабатывается напряженный постинфекционный иммунитет, сохраняющийся не менее 10 лет.
Основные эпидемиологические признаки
В 50-е годы XX в. оспа ежегодно регистрировалась в 47-83 странах. В 60-70-е годы последние форпосты оспы сохранялись в странах Азии и Африки. Наиболее опасные в эпидемическом отношении очаги сохранялись на азиатском континенте, где была распространена так называемая черная оспа, от которой погибал каждый четвертый больной. И в европейские страны чаще всего оспа заносилась именно из стран Азии (Индии, Цейлона, Бангладеш, Пакистана и др.).
В странах Африки в целом оспа у больных протекала клинически легче и заканчивалась летальным исходом в 10-12% случаев. Исследователи объясняли это тем, что в Африке кроме черной оспы была широко распространена и так называемая белая оспа - алястрим, характеризовавшаяся более легким течением. Для эндемичной оспы были характерны цикличность (эпидемии через каждые 3-7 лет), сезонность, преимущественная заболеваемость детских коллективов.
Завозная оспа не имела таких четких эпидемиологических характеристик. Очаги завозной оспы возникали в странах, уже освободившихся от нее, в любое время года (в зависимости от времени завоза). Размеры возникавших очагов зависели от сроков постановки правильного диагноза первому больному, прибывшему из эндемичной по оспе страны. Поскольку первые больные оспой оказывались часто госпитализированными с ошибочным диагнозом, то и очаги групповых заболеваний формировались преимущественно как госпитальные вспышки. По мере развития авиации в послевоенные годы в завозе оспы возрастала роль воздушного транспорта.
После 1973 г. завоз оспы в страны Европы прекратился. Большинство случаев завоза оспы приходилось на периоды с декабря по апрель, т.е. периоды сезонного подъема заболеваемости в странах Азии. На 1
завозной случай заболевания в среднем приходилось 2-5 случаев повторных заболеваний (местных). Большое значение имела настороженность врачей общей сети по отношению к оспе в тех случаях, когда за медицинской помощью обращался больной, недавно прибывший из стран Азии или Африки. В случаях неправильной или поздней диагностики из числа заразившихся от первого больного заболевали давно привитые (более 7-10 лет тому назад) и непривитые. У привитых заболевания протекали с летальным исходом.
Дополнительная локализация возбудителя оспы в клетках эпидермиса играет существенную роль в длительном сохранении вируса вне организма человека (в нательном и постельном белье, постельных принадлежностях и одежде больного, на предметах, которыми он пользовался и на которых возбудитель фиксируется с выделениями из элементов кожной сыпи). При переборке и сортировке необеззараженных вещей (белья, одежды и предметов, которыми пользовался больной), при их вытряхивании или дальнейшем использовании образуется вторичный аэрозоль, приводящий к заражению воздушно-пылевым путем. Оспа обладает высокой потенциальной способностью к распространению в многоэтажных зданиях, лечебных учреждениях, казармах, общежитиях, школах.
Патогенез
При заражении человека вирус проникает через слизистые оболочки и изредка через поврежденные кожные покровы в лимфатические узлы, где происходят его репродукция и первичное накопление в элементах системы мононуклеарных фагоцитов. Затем наступает виремия, совпадающая с началом клинических проявлений заболевания. От своих зоонозных предков вирус оспы унаследовал тропизм к тканям эктодермального происхождения. В процессе виремии возбудитель депонируется в клетках многослойного плоского эпителия кожи (нередко и роговицы) и слизистых оболочек, прежде всего дыхательных путей, где начинает размножаться, провоцируя развитие отека, воспалительной инфильтрации, баллонирующей и ретикулярной дегенерации, в результате чего формируются элементы энантемы и экзантемы. Массовое изъязвление (вскрытие) пустулезных элементов энантемы наблюдают в конце 1-й недели от начала заболевания, их заживление (эпителизацию без рубцевания) - в середине 2-й недели болезни. Массовое вскрытие пустул на коже происходит с 11-12-го дня болезни с последующим формированием рубцов.
В результате гематогенной диссеминации и паренхиматозной диффузии вируса в патологический процесс токсико-дегенеративного и дистрофического характера вовлекаются паренхиматозные органы (печень, селезенка, почки, сердечная мышца), а также ЦНС, развивается выраженная интоксикация.
В результате перенесенного заболевания формируется стойкий иммунитет. Однако у лиц с группой крови А(П) антигенное родство вируса натуральной оспы с эритроцитами человека обусловливает слабое формирование иммунитета и высокую летальность.
Клиническая картина
Инкубационный период составляет 9-14 дней, изредка удлиняясь до 22 дней.
В течение болезни выделяют 4 периода:
- продромальный, или предвестников (2-4 дня);
- высыпания (4-5-е сутки);
- нагноения (7-10-е сутки);
- реконвалесценции (20-30-е сутки).
Продромальный период характеризуется внезапным повышением температуры тела, интоксикацией, болями в поясничной области, миалгиями. Иногда появляется кореподобная или скарлатиноподобная сыпь, локализующаяся в области бедренного треугольника (треугольник Симона) или грудных треугольников. К концу продромального периода температура тела снижается.
Период высыпания начинается с появления на коже лица и слизистых оболочках оспенной сыпи. Элементы сыпи вначале имеют вид мелких пятен розового цвета, которые быстро превращаются в папулы. Спустя 2-3 сут формируются везикулы - многокамерные пузырьки с пупковидным втяжением в центре, окруженные зоной гиперемии. Они располагаются на лице, конечностях и туловище. Наибольшую концентрацию оспенных элементов наблюдают на лице и конечностях. Эти высыпания обнаруживают также на ладонях и подошвах, что характерно для натуральной оспы. На одном участке сыпь всегда мономорфна (отличие от ветряной оспы). На фоне развития оспенной сыпи вновь постепенно повышается температура тела и нарастает интоксикация(см. рис. 19 на цветной вклейке).
Период нагноения наступает к концу 1-й началу 2-й недели болезни. Происходит резкий подъем температуры тела, состояние больного зна-
чительно ухудшается. Оспенные элементы нагнаиваются, становятся болезненными и теряют многокамерность. К началу 3-й недели болезни пустулы вскрываются и на их месте образуются корочки черного цвета. У больного появляется нестерпимый зуд.
Период реконвалесценции начинается с 4-5-й недели болезни. Температура тела нормализуется, состояние больного постепенно улучшается. В этот период происходят массовое отпадение корочек и интенсивное шелушение. На местах бывших оспенных элементов образуются рубцы, которые бывают достаточно глубокими и придают коже ря бой вид.
Тяжелое течение оспы обусловливают сливная форма, пустулезногеморрагическая (черная оспа) и оспенная пурпура. При среднетяжелом течении заболевания обычно наблюдают рассеянную оспу, а при легком - вариолоид, оспу без сыпи и повышения температуры тела. Вариолоид чаще всего протекает у лиц, привитых против оспы. Элементы экзантемы необильные, пустулы и рубцы не образуются.
Дифференциальная диагностика
Натуральную оспу в разгар заболевания прежде всего необходимо дифференцировать от ветряной оспы. При последней области ладоней и подошв не поражаются элементами сыпи, а на отдельных участках кожи можно видеть одновременно элементы сыпи от пятна до везикул и корочек. При ветряной оспе пузырьки однокамерные, легко спадаются при прокалывании.
В начальный период натуральной оспы проводят дифференциальную диагностику с корью и скарлатиной. Необходимо сосредоточить внимание на типичном для натуральной оспы расположении продромальной сыпи (треугольник Симона, грудные треугольники).
Лабораторная диагностика
Проводят вирусоскопическое (электронная микроскопия), вирусологическое и серологическое (микропреципитация в агаре, ИФА) исследование содержимого пузырьков, отделяемого пустул и корочек.
Осложнения и исходы
Наиболее частое осложнение оспы - ИТШ.
Лечение
Назначают противовирусные препараты (метисазон по 0,6 г 2 раза в день курсом 5-6 сут), противооспенный иммуноглобулин 3-6 мл внутримышечно. Пораженные участки кожи и слизистых оболочек обрабатывают антисептиками. Учитывая гнойную инфекцию, больным назначают антибиотики широкого спектра действия (полусинтетические пенициллины, макролиды, цефалоспорины). Проводят активное дезинтоксикационное лечение с применением инфузионных растворов и в некоторых случаях глюкокортикоидов и других средств борьбы с синдромом интоксикации.
ОСПА ОБЕЗЬЯН (VARIOLA VIMUS)
Оспа обезьян - острое зоонозное природно-очаговое вирусное заболевание, протекающее с интоксикацией, лихорадкой и развитием высыпаний папулезно-везикулезно-пустулезного характера на коже и слизистых оболочках.
Краткие исторические сведения
Заболевание у обезьян Азии и Африки известно с 1958 г. Первый случай обезьяньей оспы у человека зарегистрирован 1 сентября 1970 г. в Конго. В 1975 г. в регионах Западной и Центральной Африки выявлено 55 случаев заболевания у людей, подтвержденных вирусологическими исследованиями, с 1980 по 1986 г. - 349 случаев с летальностью 11% (15% у детей до 5 лет).
Этиология
Возбудитель - вирус из семейства Poxviridae, подсемейства поксвирусов позвоночных Chordopoxviridae, рода Orthopoxvirus. Впервые выделен от больных обезьян в 1958 г. Содержит РНК, имеет выраженное сходство с другими вирусами группы оспы, отличаясь от них некоторыми культуральными свойствами. Антигенная структура возбудителя близка к вирусу натуральной оспы.
Эпидемиология
Источники инфекции - обезьяны. Антитела к вирусу обнаружены у 14 видов обезьян. Дальнейшие исследования показали активное участие в циркуляции вируса грызунов, прежде всего белок. Выявлено широкое
распространение в дождевых лесах экваториального климатического пояса в Африке заболеваний людей, вызванных вирусом оспы обезьян со смертностью 4-33%, в среднем 9,8%, и возможностью 2-8 пассажей среди людей у 30-70% пациентов с клиническими симптомами. В Конго, Нигерии, Либерии, Сьерра-Леоне, Кот-д'Ивуаре и других странах заболевание зарегистрировано у людей, не привитых против натуральной оспы и заразившихся от обезьян. В странах Центральной и Западной Африки проблема заболеваемости постоянно нарастает, что связывают с потерей иммунитета к натуральной оспе в связи с прекращением прививок. Вместе с тем считают, что вакцины против натуральной оспы защищают от оспы обезьян менее чем в 70%.
Основные пути передачи инфекции человеку - воздушно-капельный и воздушно-пылевой. Отлов диких грызунов и поедание их мяса, не подвергнутого термической обработке, обусловливает заражение людей вирусом. Доказана внутрисемейная передача инфекции. Случаи передачи обезьяньей оспы от человека человеку учащаются. Болеют жители деревень, расположенных в дождевых лесах, имеющие контакт с животными, более 90% заболевших - дети до 15 лет. В 2003 г. появилось первое сообщение о десятках случаев заболевания людей в США в штатах Иллинойс, Индиана, Канзас, Миссури, Огайо, Висконсин. Клиническая картина была легче, чем в Африке. Большинство из заболевших имели прямой контакт с луговыми собачками или собаками прерий, распространёнными в США в качестве декоративных животных. Перед продажей их держали вместе с импортированными из Африки грызунами и циветтами, многие из которых погибли.
Такая ситуация диктует необходимость четкой системы эпидемиологического надзора, способной обеспечить наиболее раннее распознавание первых случаев заболеваний с лабораторной верификацией диагноза, оперативное оповещение о них, немедленное развертывание противоэпидемических мероприятий. Большое значение имеет поддержание стратегического запаса вакцины в распоряжении ВОЗ в Женеве на случай чрезвычайных обстоятельств после подтверждения какоголибо случая оспы.
Патогенез
Изучен недостаточно. Учитывая антигенное сходство возбудителей оспы обезьян и натуральной оспы, а также общие клинические черты вызванных ими заболеваний, предполагают общие закономерности и в их патогенезе.
Клиническая картина
Инкубационный период составляет в среднем 2 нед. Продромальный период
Заболевание начинается остро и проявляется повышением температуры тела с ознобом, головной болью, миалгиями, иногда головокружением и рвотой на фоне высокой лихорадки. Иногда на 2-й день болезни появляется и затем быстро исчезает продромальная сыпь. Длительность продромального периода - 2-3 дня.
Период высыпания
На 3-4-й день болезни температура тела снижается до субфебрильной, одновременно на коже головы (прежде всего на лице) и на слизистых оболочках появляются необильные элементы сыпи. Экзантема быстро распространяется на кисти рук, а затем - на туловище и нижние конечности, поражая ладони и подошвы. Распространение экзантемы имеет центробежный характер - на туловище элементов меньше, чем на лице и конечностях.
Элементы сыпи последовательно проходят следующие этапы развития:
- пятна;
- папулы;
- многокамерные везикулы;
- пустулы;
- корочки;
- рубцы.
На одном участке кожи сыпь всегда мономорфна.
Период нагноения
При формировании пустул вновь повышается температура тела, нередко до 39-40 °С, состояние больных значительно ухудшается, развиваются тахикардия, артериальная гипотензия, одышка, сильный зуд. Возможны диарея, лимфаденит (чаще шейный и паховый).
Период реконвалесценции
С 9-10-го дня болезни начинается подсыхание пустул и формирование корочек. Постепенно улучшается состояние больного. Отпадение корочек продолжается в течение 3-4 нед, образование рубцов на месте отпавших корочек выражено значительно меньше, чем при натуральной оспе.
В целом оспа обезьян протекает легче натуральной, экзантема менее обильная. При легком течении болезни состояние больных остается удовлетворительным.
Дифференциальная диагностика
Аналогична таковой при натуральной оспе. При постановке диагноза прежде всего принимают во внимание данные эпидемиологического анамнеза и характерные клинические проявления болезни.
Лабораторная диагностика
Базируется на использовании вирусологических и в меньшей степени серологических методов исследования.
Осложнения и исходы
При тяжелом течении заболевания возможно развитие ИТШ.
Лечение
См. выше раздел «Натуральная оспа».
СТРЕПТОКОККОВЫЕ ИНФЕКЦИИ
Стрептококковые инфекции продолжают оставаться в числе острых проблем здравоохранения во всех странах мира. Трудно найти раздел медицины, в котором нет заболеваний, вызванных стрептококками.
Стрептококковые инфекции - группа преимущественно антропонозных заболеваний, вызываемых стрептококками различных серогрупп и характеризующихся поражением верхних дыхательных путей, кожного покрова и развитием постстрептококковых аутоиммунных (ревматизм, гломерулонефрит) и токсико-септических (некротический фасциит, миозит, синдром токсического шока, метатонзиллярный и паратонзиллярный абсцессы и др.) осложнений.
Этиология
Возбудители - неподвижные факультативно-анаэробные грамположительные кокки рода Streptococcus семейства Streptococcaceae. Род включает 38 видов, разделяемых по особенностям метаболизма, культурально-биохимическим свойствам и антигенной структуре. Деление клеток происходит только в одной плоскости, вследствие чего они располагаются парами (диплококки) или образуют цепочки разной длины. Некоторые виды имеют капсулу. Растут в интервале температур
25-45 °С, температурный оптимум - 35-37 °С. На плотных средах образуют колонии диаметром 1-2 мм. На средах с кровью колонии некоторых видов окружены зоной гемолиза. Признаки, отличающие все стрептококки, - отрицательные бензидиновый и каталазный тесты.
Стрептококки достаточно устойчивы во внешней среде. Хорошо переносят высушивание и могут сохраняться месяцами в высохших гное и мокроте. В течение 30 мин выдерживают нагревание до 60 °С. Под действием дезинфицирующих веществ погибают в течение 15 мин.
По структуре группоспецифических полисахаридных Аг (субстанция С) клеточной стенки стрептококки разделяют на 17 серологических групп, обозначаемых латинскими буквами (А-О). Внутри групп стрептококки разделяют на серовары по специфичности белковых М-Аг, Р-Аг и Т-Аг.
Стрептококки группы А имеют первостепенное, доминирующее значение в патологии человека. Большинство известных изолятов принадлежит к виду S. pyogenes, поэтому оба названия часто рассматривают как синонимы.
Облигатные паразиты человека имеют широкий спектр супер-Аг:
- эритрогенные токсины А, В, С и D;
- экзотоксин F (митогенный фактор);
- стрептококковый супер-Аг (SSA);
- эритрогенные токсины SpeX, SpeG, SpeH, SpeJ, SpeZ, SmeZ-2. Все эти супер-Аг могут взаимодействовать с Аг главного комплекса
гистосовместимости 2-го класса, экспрессированными на поверхности Аг-представляющих клеток, и вариабельными участками β-цепи (νβ-рецепторами) Т-лимфоцитов, вызывая их пролиферацию и тем самым приводя к мощному выбросу цитокинов, особенно таких как ФНО и γ-ИФН. Эта гиперпродукция оказывает системное воздействие на организм и приводит к разрушительным последствиям. Кроме того, стрептококк группы А способен выделять многие другие биологически активные экстрацеллюлярные вещества, такие как стрептолизины О и S, стрептокиназа, гиалуронидаза, ДНКаза В, стрептодорназа, липопротеиназа, С5а-пептидаза и др.
Клеточная стенка стрептококка включает капсулу, белковый, полисахаридный (группоспецифический Аг) и мукопротеидный слои. Важный компонент стрептококков группы А - белок М, напоминающий по структуре фимбрии грамотрицательных бактерий. Белок М - основной фактор вирулентности и типоспецифический Аг. АТ к нему обеспечивают длительную невосприимчивость к повторному заражению,
однако по структуре белка М выделяют более 110 серотипов, что значительно снижает эффективность гуморальных защитных реакций. Белок М ингибирует фагоцитарные реакции, непосредственно воздействуя на фагоциты либо маскируя рецепторы для компонентов комплемента и опсонинов, адсорбируя на своей поверхности фибриноген, фибрин и продукты его деградации. Белок также проявляет свойства супер-Аг, вызывая поликлональную активацию лимфоцитов и образование АТ с низким аффинитетом. Подобные свойства играют существенную роль в нарушении толерантности к тканевым изо-Аг и развитии аутоиммунной патологии.
Свойствами типоспецифических Аг обладают также Т-белок клеточной стенки и липопротеиназа (фермент, гидролизующий липидсодержащие компоненты крови млекопитающих). Стрептококки разных М-вариантов могут иметь один и тот же Т-тип или комплекс Т-типов. Распределение же серотипов липопротеиназы точно соответствует определенным М-типам, но этот фермент продуцируют около 40% штаммов. АТ к Т-белку и липопротеиназе защитными свойствами не обладают.
Капсула состоит из гиалуроновой кислоты и служит одним из факторов вирулентности. Она защищает бактерии от антимикробного потенциала фагоцитов и облегчает адгезию к эпителию. Капсула образована гиалуроновой кислотой, аналогичной входящей в состав соединительной ткани. Соответственно, капсула проявляет минимальную иммуногенную активность и не распознается как чужеродный агент. Бактерии способны самостоятельно разрушать капсулу при инвазии в ткани за счет синтеза гиалуронидазы.
Третий по значимости фактор патогенности - С5а-пептидаза, подавляющая активность фагоцитов. Фермент расщепляет и инактивирует С5а-компонент комплемента, выступающий мощным хемоаттрактантом.
Стрептококки группы А продуцируют различные токсины. Стрептолизин О проявляет гемолитическую активность в анаэробных условиях. Титры АТ к нему имеют прогностическое значение. Стрептолизин S проявляет гемолитическую активность в анаэробных условиях и вызывает поверхностный гемолиз на кровяных средах.
Оба гемолизина разрушают не только эритроциты, но и другие клетки :
- стрептолизин О повреждает кардиомиоциты;
- стрептолизин S - фагоциты, поглотившие бактерии.
Кардиогепатический токсин синтезируют некоторые штаммы стрептококков группы А. Он вызывает поражения миокарда и диафрагмы, а также образование гигантоклеточных гранулем в печени.
Подавляющую часть изолятов стрептококков группы В составляет S. agalactiae. В последние годы бактерии приобретают все большее медицинское значение. Стрептококки группы В обычно колонизируют носоглотку, ЖКТ и влагалище. Серологически стрептококки группы В разделяют на серовары Ia, Ib, Ic, II и III. Бактерии сероваров Ia и III тропны к тканям ЦНС и дыхательных путей, часто вызывают менингиты у новорожденных.
Среди прочих видов важное медицинское значение имеют пневмококки (S. pneumoniae), вызывающие большинство случаев внебольничных пневмоний у человека. Бактерии не содержат группового Аг и серологически неоднородны - по структуре капсульных Аг выделяют 84 серовара.
Эпидемиология
Резервуар и источник инфекции - больные различными клиническими формами острых стрептококковых заболеваний и носители патогенных стрептококков. Наибольшее эпидемиологическое значение имеют больные с локализацией очагов в верхних дыхательных путях (при скарлатине, ангине).
Такие больные обладают высокой контагиозностью, а выделяемые ими бактерии содержат основные факторы вирулентности:
- капсулу;
- белок М.
Заражение восприимчивых лиц от указанных больных наиболее часто заканчивается развитием у них манифестной инфекции. Лица с локализацией очагов вне дыхательных путей (со стрептококковыми пиодермитами, отитами, мастоидитами, остеомиелитами и т.д.) имеют меньшее эпидемиологическое значение в связи с менее активным выделением возбудителя из организма.
Продолжительность заразного периода у больных острой стрептококковой инфекцией зависит в основном от способа лечения. Рациональное лечение больных скарлатиной и ангиной с применением антибиотиков пенициллинового ряда, к которым стрептококки очень чувствительны, приводит к быстрому освобождению организма реконвалесцентов от возбудителя (в течение 1,5-2 сут). Применение же пре-
паратов, к которым стрептококки группы А полностью или частично потеряли чувствительность (сульфаниламидов, тетрациклинов), приводит к реконвалесцентному носительству у 40-60% переболевших.
Резервуар возбудителя сохраняется за счет длительного носительства стрептококков (до 1 года и более). Присутствие в коллективе 15-20% лиц с длительным носительством определяет практически постоянную циркуляцию стрептококка среди людей. Считают, что носительство опасно для окружающих при величине микробного очага более 103 колониеобразующих единиц (КОЕ) на тампон. Уровень такого носительства значителен - около 50% здоровых носителей стрептококков группы А. Среди культур возбудителя, выделенных от носителей, вирулентные штаммы встречают в несколько раз реже, чем среди штаммов, выделенных от больных. Частота носительства в глотке стрептококков групп В, С и G значительно уступает частоте носительства стрептококков группы А. Для стрептококков группы В типично носительство бактерий во влагалище и прямой кишке. Уровень такого носительства среди женщин варьирует в пределах 4,5-30%. Локализация возбудителя в организме во многом определяет пути его выведения.
Механизм передачи инфекции - в основном аэрозольный, путь передачи - воздушно-капельный. Обычно заражение происходит при длительном тесном общении с больным или носителем. Возможны алиментарный (пищевой) и контактный (через загрязненные руки и предметы обихода) пути инфицирования людей.
Возбудитель чаще всего выделяется во внешнюю среду при экспираторных актах (кашель, чихание, активный разговор). Заражение происходит при вдохе образующегося воздушно-капельного аэрозоля. Возможна передача и через капельно-ядрышковую фазу аэрозоля. Скученность людей в помещениях, длительное тесное общение - это условия, благоприятствующие заражению. В организованных коллективах с круглосуточным пребыванием детей и взрослых воздушно-капельный путь передачи возбудителя наиболее эффективен в спальных помещениях, игровых комнатах, местах длительного пребывания членов коллектива. При этом следует учитывать, что на расстоянии более 3 м этот путь передачи практически не реализуется.
Дополнительные факторы, способствующие передаче возбудителя:
- низкая температура;
- высокая влажность воздуха в помещении.
В этих условиях капельная фаза аэрозоля сохраняется дольше (в ней бактерии длительно сохраняют жизнеспособность).
В передаче стрептококков определенное значение имеют бытовой и алиментарный пути заражения. Факторами передачи возбудителя в первом случае становятся грязные руки и предметы ухода, во втором - инфицированная пища. Стрептококки группы А, попадая в определенные пищевые продукты, способны размножаться и длительно находиться в них в вирулентном состоянии. Известны вспышки ангин или фарингитов при употреблении молока, компотов, сливочного масла, салатов из вареных яиц, омаров, моллюсков, бутербродов с яйцами, ветчиной и др.
Риску развития гнойных осложнений стрептококкового генеза подвергаются раненые, обожженные, больные в послеоперационном периоде, а также роженицы и новорожденные. Инфекция может развиться и эндогенным путем.
Стрептококки группы В, вызывающие урогенитальные инфекции, могут передаваться половым путем. Что касается патологии неонатального периода, то здесь в качестве факторов передачи выступают инфицированные околоплодные воды. Возможно инфицирование и при прохождении плода через родовые пути (до 50%). Горизонтальную (между отдельными индивидуумами) передачу наблюдают значительно реже.
Естественная восприимчивость людей
Естественная восприимчивость людей высокая. В последние годы получены данные о связи между группами крови системы АВ0, HLA-Аг и алло-Аг В-лимфоцитов D 8/17 и заболеваниями ревматизмом, а также скарлатиной и ангиной.
Противострептококковый иммунитет носит антитоксический и антимикробный характер. Наряду с этим имеет место сенсибилизация организма по типу ГЗТ, с которой связан патогенез многих постстрептококковых осложнений. Иммунитет у перенесших стрептококковую инфекцию типоспецифический и не препятствует повторному заболеванию при инфицировании другим сероваром возбудителя. Защитными свойствами обладают АТ к белку М, обнаруживаемые почти у всех больных на 2-5-й неделе болезни; они сохраняются длительное время (10-30 лет). М-АТ довольно часто обнаруживают в крови новорожденных, однако к 5 мес жизни их уже не определяют.
Основные эпидемиологические признаки
Стрептококковые инфекции распространены повсеместно. В районах умеренного и холодного климата они проявляются преимущественно в форме глоточных и респираторных форм заболеваний, составляя
5-15 случаев на 100 человек в год. В южных районах с субтропическим и тропическим климатом ведущее значение приобретают кожные поражения (стрептодермия, импетиго); их частота среди детей в определенные сезоны может достигать 20% и более. Небольшие травмы, укусы насекомых и несоблюдение правил гигиены кожи предрасполагают к их развитию.
Как ВБИ поражения актуальны для родовспомогательных учреждений, детских, хирургических, отоларингологических и глазных отделений. Заражение происходит как эндогенным, так и экзогенным (от персонала и больных - носителей стрептококков) путями, чаще всего при осуществлении инвазивных лечебно-диагностических манипуляций.
Периодическая цикличность - одна из характерных особенностей течения эпидемического процесса при стрептококковых инфекциях. Помимо хорошо известной цикличности с интервалом в 2-4 года, отмечена периодичность с интервалом в 40-50 лет и более. Особенность этой волнообразности - появление и исчезновение особо тяжелых клинических форм. В 20-40-е годы ХХ в. болезни стрептококковой этиологии были не только широко распространены, но и отличались тяжестью течения. Часто скарлатину и тонзиллофарингит осложняли гнойносептические (отиты, менингиты, сепсис) и иммунопатологические (ревматизм, гломерулонефрит) процессы. Тяжелые генерализованные формы инфекции, сопровождавшиеся глубокими поражениями мягких тканей, обозначали термином «стрептококковая гангрена». В 50-е годы наметилась тенденция к снижению их количества и вплоть до 1985- 1987 гг. стрептококковые инфекции не составляли значимой проблемы для здравоохранения. Летальность от скарлатины за этот период снизилась до нуля. Патогенные стрептококки группы А почти не вызывали генерализованных процессов с септическим синдромом и, как правило, заболевание носило токсико-инфекционный (скарлатина относительно легкого течения) или локальный (ангины, фарингиты, флегмоны, стрептодермии и т.п.) характер.
С середины 80-х годов во многих странах отмечен рост заболеваемости стрептококковой инфекцией, совпавший с изменениями в нозологической структуре болезней, вызываемых S. pyogenes. Так, после очередного затишья во многих странах мира вновь стали регистрировать групповые случаи тяжелых генерализованных форм, часто заканчивающихся летально (синдром токсического шока, септицемия, некротический миозит, фасцит, септицемия и др.). В Англии и Уэльсе в 1994- 1997 гг. зарегистрировано 1913 случаев тяжелых инфекций, вызванных
стрептококками группы А. Из них 76% составили бактериемии, 9% - синдром токсического шока, 8% - септические артриты, 6% - некротизирующие фасциты, 5% - пневмонии. При этом 518 заболевших (27%) погибли. S. pyogenes серотипа М1 вызвал 50% заболеваний. В США ежегодно регистрируют 10 000-15 000 случаев инвазивных стрептококковых инфекций. Из них 5-19% (500-1500 случаев) составляет некротический фасциит.
За последние годы также отмечен рост заболеваемости ревматизмом, зарегистрированы даже вспышки этого заболевания. В последние годы в Индии заболеваемость составляет 2-11 (в среднем 6) на 1000 населения. Ежегодно болезнь поражает 2-3 млн человек. Важно отметить, что эту тенденцию наблюдают как в развивающихся, так и в развитых странах, в том числе и в США, где вспышки ревматизма отмечены в средних слоях населения и воинских коллективах.
Оценочное число тяжелых случаев (распространенность) заболеваний, связанных со стрептококком группы А, по данным ВОЗ, составило в 2005 г. 18,1 млн случаев. Из них ревматизм - 15 600 000 случаев, Число новых случаев (инцидентность, заболеваемость) - 1,8 млн случаев. Из них ревматизм сердца - 282 000 случаев, острый постстрептококковый гломерулонефрит - 472 000 случаев, инвазивные (генерализованные) формы - 663 000 случаев. Число фарингитов в год - 616 млн случаев, пиодермий (стрептодермий) - 111 млн случаев. Оценочное число смертей от СГА инфекции - 517 000 случаев в год, из них ревматизм - 233 000 случаев, гломерулонефрит - 5000, инвазивные формы - 163 000 случаев.
Широкое применение лабораторных методов исследования позволило установить, что возврат инвазивных стрептококковых заболеваний связан со сменой циркулирующих в популяциях серотипов возбудителя: вместо М-серотипов 2, 4, 12, 22 и 49 появились ревматогенные и токсигенные серотипы 1, 3, 5, 6, 18, 24 и 28. Соответственно, возросла заболеваемость ревматической лихорадкой и токсикоинфекциями (токсическим тонзиллофарингитом, скарлатиной и синдромом токсического шока).
Естественно, что за этот период времени должен был снизиться и уровень специфического иммунитета людей в отношении указанных серотипов стрептококков группы А. Современные формы стрептококковой инфекции могли возникнуть в результате данного иммунологического сдвига и формирования клонов возбудителя с выраженной вирулентностью.
В России, как и в других странах, в конце 80-х - начале 90-х годов отмечено преобладание серотипов возбудителя, причастных к возникновению тяжелых генерализованных форм инфекции. В настоящее время в России ежегодно регистрируют 6-8 млн случаев респираторных стрептококковых инфекций. На ревматические болезни приходится 14-15% всех хронических заболеваний. Ежегодные экономические потери от этих болезней - более 65 млн дней нетрудоспособности. В России число официально в течение года учтенных случаев активного ревматизма составляет в среднем 7000-8000 (0,54 на 10 000 населения), а число хронических ревматических болезней сердца - 460 000- 550 000 (35 на 10 000 населения). В 1998 г. заболеваемость активным ревматизмом среди взрослых составила в России 19,3 случая, а среди детей - 16,7 случая на 100 000 населения. Показатель временной утраты трудоспособности составил 0,1 случая и 2,4 дня на 100 работающих, частота первичного выхода на инвалидность по причине ревматизма - 0,87 на 10 000 работающих. Пороки клапанов сердца регистрируют ежегодно более чем у 230 000 взрослых больных и 8300 больных подросткового и детского возрастов.
По ориентировочным расчетам ежегодно в Москве регистрируют более 35 000 случаев заболеваний скарлатиной и ревматизмом. Если к этой цифре добавить все случаи заболевания рожей, большую часть (70-90%) заболеваний ангиной, пятую-шестую часть острыми нефритами и гломерулонефритами, десятую часть болезнями кожи и подкожной клетчатки и, наконец, 10-15% случаев ОРВИ, то общая совокупность случаев, вызванных стрептококками группы А, составит величину, приближающуюся к 1 млн.
Ежегодно от рассматриваемой патологии в Москве умирают более 1200 человек. Основной контингент умерших - дети (скарлатина, острый нефрит и гломерулонефрит, ОРВИ) и лица пожилого возраста (активный ревматизм, острый нефрит и гломерулонефрит, болезни кожи, рожа, ОРВИ).
Экономический ущерб, наносимый стрептококковыми инфекциями, примерно в 10 раз выше, чем от вирусных гепатитов. Среди изучаемых стрептококкозов наиболее экономически значима ангина (57,6%), далее следуют острые респираторные заболевания стрептококковой этиологии (30,3%), рожа (9,1%), скарлатина и активный ревматизм (1,2%), затем острые нефриты (0,7%).
На сезонную заболеваемость приходится 50-80% заболеваний первичной стрептококковой инфекцией, зарегистрированных в году.
Помесячная заболеваемость респираторной стрептококковой инфекцией имеет выраженную осенне-зимне-весеннюю сезонность. Месяцы минимальной заболеваемости - июль-август, максимальная заболеваемость приходится на ноябрь-декабрь и март-апрель. Сезонный уровень заболеваемости в основном определяют дети, посещающие ДДУ. На сроки наступления сезонного повышения заболеваемости решающее влияние оказывают время формирования или обновления организованных коллективов и их численность. В зависимости от перечисленных факторов увеличение заболеваемости стрептококковой инфекцией можно отметить через 11-15 дней после создания коллектива (крупные центры отдыха детей, воинские коллективы и т.д.). Максимума заболеваемость достигает приблизительно через 30-35 сут. В ДДУ подъем заболеваемости обычно начинается через 4-5 нед с максимумом заболеваемости на 7-8-й неделе с момента их формирования. В организованных коллективах, обновляемых 1 раз в год, наблюдают однократный сезонный рост инфекций. При двукратном обновлении отмечают двукратные сезонные подъемы заболеваемости. Это наиболее демонстративно показано на воинских коллективах. Первый максимум заболеваемости, связанный с весенним призывом, наблюдают в июне-июле, второй, обусловленный осенним призывом, - в декабре- январе. В коллективах с небольшой численностью или малой долей поступающих при обновлении лиц сезонные подъемы могут вообще не проявляться.
В развитии эпидемического процесса респираторных стрептококковых инфекций характерна связь случаев скарлатины с предшествующими им заболеваниями ангиной и другими респираторными проявлениями стрептококковой инфекции, возникающими в ДДУ, особенно вскоре после их формирования. Эта эпидемиологическая закономерность - своеобразный маркер развития эпидемического процесса. Своевременно регистрируемые изменения частоты тех или иных клинических форм респираторных стрептококковых инфекций могут служить предвестником подъема заболеваемости. При этом необходимо учитывать, что появление в организованном коллективе заболеваний скарлатиной может быть признаком эпидемиологического неблагополучия по респираторной стрептококковой инфекции. Очаги скарлатины, как правило, имеют внутреннюю природу формирования. Занос возбудителей отмечают редко. В подобных ситуациях правильнее говорить о выносе вирулентного возбудителя из организованных коллективов в семьи и другие организованные коллективы.
Патогенез
Чаще всего заболевания развиваются после попадания стрептококков на слизистые оболочки зева и носоглотки. Содержащаяся в клеточной стенке липотейхоевая кислота, М- и F-белки способствуют адгезии возбудителя к поверхности миндалин или другим лимфоидным клеткам. Белок М обеспечивает устойчивость бактерий к антимикробному потенциалу фагоцитов, связывает фибриноген, фибрин и продукты его деградации. Размножение стрептококков сопровождается выделением токсинов, вызывающих воспалительную реакцию тканей миндалин. При поступлении стрептококков по лимфатическим путям в лимфатические узлы развивается регионарный (углочелюстной) лимфаденит. Токсические компоненты, проникая в кровь, обусловливают генерализованное расширение мелких сосудов, клинически выражающееся гиперемией и образованием точечной сыпи. Аллергический компонент, ведущий к нарушению проницаемости сосудов, можно считать причиной развития гломерулонефритов, артритов, эндокардитов и т.д. Септический компонент проявляется накоплением возбудителя в различных органах и системах, развитием гнойных и некротических процессов в них. Общие перекрестно реагирующие антигенные детерминанты у стрептококков группы А (белок М, нетипоспецифические белки, А-полисахарид и др.) и сарколемма миофибрилл сердца и тканей почек определяют развитие аутоиммунных процессов, приводящих к ревматизму и гломерулонефриту. Молекулярная мимикрия - ведущий патогенетический фактор реализации стрептококковой инфекции при этих заболеваниях. АТ к Аг стрептококков реагируют с аутоантигенами хозяина. С другой стороны, белок М и эритрогенный токсин проявляют свойства супер-Аг, вызывают пролиферацию Т-клеток, активируя тем самым каскад компонентов эффекторного звена иммунной системы, выброс медиаторов с цитотоксическими свойствами - ИЛ, ФНО и γ-ИФН. Инфильтрация лимфоцитов и локальное действие цитокинов играют важную роль в патогенезе инвазивных стрептококковых инфекций (при целлюлитах, некротических фасциитах, септических поражениях кожи, поражениях внутренних органов). Критическую роль в патогенезе инвазивной стрептококковой инфекции отводят ФНО. В патогенезе инвазивных стрептококковых инфекций может быть задействован и ЛПС-комплекс собственной грамотрицательной микрофлоры благодаря синергическому взаимодействию с эритрогенным токсином
S. pyogenes. ЛПС-комплекс и в норме постоянно присутствует в организме:
- в значительном количестве - в кишечнике;
- в минимальном (порядок нанограммов) - в крови и лимфе. Значимые его количества высвобождаются под воздействием антибиотиков, повреждающих клеточную стенку, и при нарушениях барьерной функции слизистых оболочек могут попадать в кровь, вызывая эндотоксемию.
Стремительное нарастание при синдроме токсического шока клинических проявлений, характерных для эндотоксемии (гипотензии, коагулопатии, респираторного дистресс-синдрома и др.), обнаружение в ряде случаев у больных инвазивными стрептококковыми инфекциями в крови значимого количества эндотоксина и другие факты свидетельствуют в пользу данного предположения. Возможно, что, связываясь с ЛПС-комплексами в локальных участках в легко распадающиеся комплексы, эритрогенный токсин может выполнять транспортную функцию и способствовать распространению ЛПС-комплексов по организму.
Клинические формы инфекции и их проявления
Клинические проявления стрептококковых инфекций у человека многообразны и зависят от вида возбудителя, локализации патологического процесса и состояния инфицированного организма.
Болезни, вызываемые стрептококками группы А, можно разделить на первичные, вторичные и редко встречающиеся формы (рис. 3-12).
• К первичным формам относят стрептококковые поражения ЛОРорганов (ангины, фарингиты, ОРВИ, отиты и др.), кожи (импетиго, эктима), скарлатину, рожу.
• Среди вторичных форм выделены заболевания с аутоиммунным механизмом (негнойные заболевания) и заболевания, при которых аутоиммунный механизм не выявлен (токсико-септические).
◊ Вторичные формы с аутоиммунным механизмом развития - ревматизм, гломерулонефрит, васкулиты.
◊ Вторичные формы без аутоиммунного компонента - метатонзиллярный и перитонзиллярный абсцессы, некротические поражения мягких тканей, септические осложнения.
• К редким формам причислены некротические фасциит и миозит, энтерит, очаговые поражения внутренних органов, синдром токсического шока, сепсис и др.
Рис. 3-12. Клинические формы стрептококковой инфекции: а - первичные и вторичные; б - редкие; СГА - стрептококк группы
Поражения, вызванные стрептококками группы В, встречают во всех возрастных категориях, но среди них, безусловно, доминирует патология новорожденных. У 30% детей выявляют бактериемию (без конкретного очага первичного инфицирования), у 32-35% - пневмонии, у остальных - менингиты, отмечаемые у 50% больных в течение первых 24 ч жизни. Заболевания новорожденных протекают тяжело, смертность достигает 37%. У детей с поздними проявлениями наблюдают менингиты и бактериемию. Погибают 10-20% детей, а у 50% выживших регистрируют остаточные нарушения.
У родильниц стрептококки группы В вызывают послеродовые инфекции:
- эндометриты;
- поражения мочевыводящих путей;
- осложнения хирургических ран после кесарева сечения. Также для стрептококков группы В характерна способность вызывать поражения кожных покровов и мягких тканей, пневмонии, эндокардиты и менингиты у взрослых. Бактериемию наблюдают у лиц пожилого возраста, страдающих сахарным диабетом, заболеваниями периферических сосудов и злокачественными новообразованиями. Особо следует отметить стрептококковые пневмонии, развивающиеся
на фоне ОРВИ.
Стрептококки серологических групп С и G известны как возбудители зоонозов, хотя в ряде случаев они могут вызывать локальные и системные воспалительные процессы и у человека. Зеленящий стрептококк способен вызывать бактериальные эндокардиты с развитием клапанной патологии. Меньшая по значимости, но несравненно более частая патология - кариозное поражение зубов, вызываемое стрептококками биогруппы mutans (S. mutans, S. mitior, S. salivarius и др.).
Лабораторная диагностика
Постановка достоверного этиологического диагноза стрептококковых глоточных и кожных инфекций во всех случаях, кроме скарлатины, требует проведения бактериологических исследований с выделением и видовой идентификацией выделенных стрептококков. Результаты микробиологического исследования играют важную роль в выборе и назначении уже на ранних этапах заболевания наиболее эффективных методов лечения, способных предупредить тяжелые последствия банальных стрептококковых инфекций (ревматизм, острый гломерулонефрит, васкулиты), а в случаях инвазивных стрептококковых инфекций - сохранить жизнь больному. Для этих целей применяют экспресс-методы идентификации стрептококков группы А, позволяющие в течение 15-20 мин диагностировать острую стрептококковую инфекцию без предварительного выделения чистой культуры возбудителя.
Вместе с тем выделение стрептококков не всегда свидетельствует об их причастности к патологии в связи с широко распространенным здоровым носительством. Истинные инфекции, вызванные стрептококками группы А, всегда вызывают специфический иммунный ответ, что
сопровождается значительным повышением титров АТ к одному из внеклеточных стрептококковых Аг - стрептолизину О, дезоксирибонуклеазе В, гиалуронидазе или никотинамид-аденин-динуклеотидазе. При остром ревматизме и гломерулонефрите практически всегда происходит повышение титра антистрептококковых АТ уже в начале острой фазы заболевания; в период реконвалесценции титр АТ снижается. Если определять содержание АТ к трем различным Аг, в 97% случаев титр хотя бы к одному из них будет повышен (ВОЗ, 1998). Уровень АТ к каждому из внеклеточных Аг определяют с помощью Рh. В последнее время все большее развитие получают системы иммунодиагностики, основанные на определении АТ к компонентам клеточной стенки стрептококков (группоспецифическому полисахариду, липотейхоевой кислоте и др.). Определение АТ к группоспецифической детерминанте стрептококков серогруппы А существенно повышает возможности серологической диагностики и может иметь значение при прогнозировании формирования ревматических пороков сердца, а также других негнойных постстрептококковых заболеваний. Учитывая также, что у больных ревматизмом АТ к полисахариду А можно выявлять не только в крови, но и в других биологических средах, в частности в слюне, открываются перспективы применения неинвазивных методов исследования, в том числе для подтверждения диагноза ревматизма.
Наряду с определением антистрептококковых АТ выявление циркулирующих Аг (свободных или в составе иммунных комплексов) имеет большое значение при определении роли стрептококков в формировании иммунопатологических процессов. Основу современных диагностических методов составляют ИФА и применение антисывороток к дискретным Аг стрептококков группы А.
Лечение
Лечебные мероприятия направлены на предотвращение гнойных и аутоиммунных осложнений и включают применение этиотропных и патогенетических средств. Для лечения всех форм заболеваний, вызванных стрептококками группы А, обычно применяют препараты пенициллина, к которому сохраняется высокая чувствительность возбудителей. Большинство штаммов также высокочувствительно к эритромицину, азитромицину, кларитромицину, оксациллину и олеандомицину. В связи с малой чувствительностью возбудителей к тетрациклину, гентамицину и канамицину назначать эти препараты нецелесообразно.
В качестве альтернативы возможно внутримышечное введение препаратов пролонгированного действия.
Инвазивные стрептококковые инфекции отличает высокая скоротечность процессов, при этом адекватная срочная антибиотикотерапия имеет первостепенное значение. Основным приемом наряду с противошоковым и антитоксическим лечением остается сочетание массивных доз бензилпенициллина и клиндамицина. Применение только одних пенициллинов (независимо от способа их введения в организм) малоэффективно. Дело в том, что вне организма больного стрептококки сохраняют высокую чувствительность к этим антибиотикам, между тем как в организме пациента они резко снижают ее из-за недостаточной экспрессии микроорганизмом рецепторов к пенициллинам либо их экранирования сывороточными, плазменными и лимфатическими белками, обладающими высоким аффинитетом к белкам клеточной стенки микроорганизма. Более рационально сочетать пенициллин и клиндамицин, в том числе и при лечении других неинвазивных форм стрептококковых инфекций. В последние годы показано, что в лечении инвазивных форм стрептококковой инфекции эффективен нормальный полиспецифический иммуноглобулин человека, содержащий широкий спектр нейтрализующих АТ к супер-Аг стрептококков. Кроме того, разрабатывают новое направление в лечении тяжелой стрептококковой инфекции - применение пептидов, полученных из S. pyogenes, способных блокировать взаимодействие супер-Аг с клетками организма.
Эпидемиологический надзор
Программа (система) эпидемиологического надзора за стрептококковыми инфекциями включает информационно-аналитическую и диагностическую подсистемы.
• Информационно-аналитическая подсистема служит базовым разделом эпидемиологического надзора и включает учет и регистрацию различных клинических форм стрептококковой инфекции, отслеживание динамики заболеваемости, летальности и носительства.
• Диагностическая подсистема эпидемиологического надзора стрептококковой инфекции преследует цель получения реальных представлений об эпидемиологических особенностях инфекции. В основе эпидемиологической диагностики лежит выявление закономерностей распространения заболеваний во времени, территориально и среди раз-
личных возрастных и социальных групп населения, а также определение условий, порождающих заболеваемость.
Решение этой задачи эпидемиологического надзора осуществляют с помощью ретроспективного и оперативного эпидемиологического анализа. Полученные результаты служат основой адекватного планирования профилактической работы и проведения мероприятий по вмешательству в течение эпидемического процесса.
Наряду с ретроспективным эпидемиологическим анализом рекомендовано проводить ежедневную оценку эпидемиологической ситуации в организованных коллективах, анализ движения заболеваемости ОРВИ, ангинами и скарлатиной, своевременное выявление больных и клиническую диагностику заболеваний, отстранение заболевших ангиной и стрептококковыми респираторными заболеваниями от посещения детских учреждений, а также этиотропное лечение больных. Все указанные действия осуществляет медицинский состав детских учреждений.
Другая составная часть подсистемы диагностики - микробиологический мониторинг. Он включает отслеживание широты циркуляции возбудителя среди населения (уровень носительства), определение серотипового состава стрептококков группы А, а также изучение их биологических свойств, чувствительности к антибиотикам и дезинфицирующим средствам. Указанные биологические свойства могут выступать в качестве маркеров вирулентности стрептококков.
Наряду с микробиологическим мониторингом в системе эпидемиологического надзора большое значение имеет плановый и экстренный иммунологический контроль, осуществляемый в целях выявления времени и групп риска инфицирования среди населения, оперативной и ретроспективной оценки эпидемической обстановки, а также для расшифровки причин возникновения домашних очагов и вспышек стрептококковой инфекции в организованных коллективах и ЛПУ.
Сочетанное применение микробиологического и иммунологического мониторинга позволяет объективно оценивать интенсивность циркуляции стрептококков группы А среди населения и способствует прогнозированию изменения эпидемической ситуации по стрептококковой инфекции.
Основные предпосылки обострения эпидемической обстановки по стрептококковой инфекции - перемешивание, создаваемое при формировании и обновлении организованных коллективов. Предвестники обострения - рост числа носителей возбудителя, появление стертых форм стрептококковой инфекции, диагностированных как ОРВИ.
Выявление признаков активизации эпидемического процесса следует осуществлять и на основании серологических и микробиологических исследований.
Профилактические мероприятия
В последние годы достигнуты значительные успехи на пути конструирования вакцин против болезней, вызываемых стрептококками группы А. Расшифровка строения белка М и генома бактерий внушает уверенность в скором решении этого вопроса. Вместе с тем сегодня отсутствие в практике доступных способов и средств специфической профилактики в сочетании с аэрозольным механизмом передачи и множественными стертыми и бессимптомными формами инфекции существенно ограничивает возможность влияния на общую поражаемость населения стрептококковой инфекцией. В то же время указанное повышает практическую значимость противоэпидемических и иных мероприятий, осуществляемых в отношении уязвимых категорий населения - детей и взрослых в организованных коллективах, как основного реального объекта эффективного эпидемиологического воздействия.
Основу профилактики респираторных стрептококковых инфекций в организованных коллективах составляют планомерные и систематические лечебно-диагностические мероприятия. Ранняя и активная диагностика, изоляция и полноценное этиотропное лечение заболевших играют в этих условиях решающую роль. Реальность такого подхода объясняется тем, что возбудители сохраняют чувствительность к действию пенициллина и его производных. Применение препаратов группы пенициллина может предупредить групповые заболевания скарлатиной и ревматизмом, а также снизить заболеваемость ангиной и стрептококковыми острыми респираторными заболеваниями.
Для купирования вспышек респираторных стрептококковых заболеваний в организованных коллективах необходимо лечение препаратами пенициллинового ряда больных не только явными, но и скрытыми формами стрептококковой инфекции. С этой целью всем контактировавшим лицам вводят однократно внутримышечно бициллин-5 (дошкольникам - 750 000 ЕД, школьникам и взрослым - 1 500 000 ЕД) или бициллин-1 (дошкольникам - 600 000 ЕД, школьникам и взрослым - 1 200 000 ЕД). В условиях воинских контингентов, относимых к группам высокого риска по респираторной стрептококковой инфекции, экстренную профилактику наиболее целесообразно проводить непосредственно
после формирования коллективов до начала сезонного подъема заболеваемости (экстренная профилактика превентивного типа). В других коллективах, где сезонные подъемы заболеваемости относительно невысоки или не носят закономерного характера, можно применять прерывающий тип экстренной профилактики. В этом случае экстренную профилактику осуществляют в период эпидемического подъема заболеваемости с целью ликвидации сложившегося эпидемического неблагополучия.
Профилактика пенициллином - единственный возможный способ предотвратить рецидив стрептококковой инфекции и ее осложнений. Профилактика направлена на предотвращение рецидивов острых ревматических приступов. Для этого рекомендуют ежемесячные инъекции пенициллина в течение 5 лет после эпизода острого респираторного заболевания. Рецидивы постстрептококкового острого гломерулонефрита очень редки, поэтому в пенициллиновой профилактике необходимости нет.
Санитарно-противоэпидемические (профилактические) мероприятия в организованных детских и взрослых коллективах, а также в больничных условиях (уменьшение численности коллектива, его скученности, общие санитарные мероприятия, дезинфекционный режим) уменьшают вероятность реализации воздушно-капельной и контактнобытовой передачи возбудителя. Профилактику алиментарного пути заражения осуществляют по тем же направлениям, что и при истинно кишечных инфекциях.
Мероприятия в эпидемическом очаге
Решающее значение имеют меры, направленные на санацию источников инфекции (больных, реконвалесцентов, носителей), одновременно расцениваемые как меры профилактики постстрептококковых осложнений. Лечение больных препаратами пенициллинового ряда необходимо осуществлять в течение 10 дней (рекомендации ВОЗ), что обеспечивает их полную санацию как источник инфекции и предупреждает развитие постстрептококковых осложнений.
В отличие от широкого перечня болезней, вызываемых многими видами (серогруппами) стрептококков и регистрируемых в МКБ 10-го пересмотра, на государственном и отраслевом уровнях прямое указание на стрептококковую (S. pyogenes) этиологию имеется лишь при скарлатине (ф. 2), ревматизме, ревматических болезнях сердца (ф. 12). Мероприятия при ревматизме не регламентированы, мероприятия при скарлатине - см. ниже.
СКАРЛАТИНА (SCARLATINA)
Скарлатина - острое антропонозное заболевание, проявляющееся интоксикацией, поражением ротоглотки и мелкоточечной экзантемой.
Краткие исторические сведения
Клиническое описание заболевания впервые сделал итальянский анатом и врач Д. Инграссиа (1564). Русское название болезни происходит от английского scarlet fever - пурпурная лихорадка - так называли скарлатину в конце XVII в. Стрептококковая этиология скарлатины, предполагавшаяся Г.Н. Габричевским и И.Г. Савченко (1905), доказана работами В.И. Иоффе, И.И. Левина, супругов Дик, Ф. Гриффта и Р. Лэнсфилд (30-40-е годы ХХ в.). Большой вклад в изучение заболевания внесли Н.Ф. Филатов, И.Г. Савченко, А.А. Колтыпин, В.И. Молчанов и другие известные русские врачи.
Этиология
Возбудитель - стрептококк группы А (S. pyogenes), также вызывающий другие стрептококковые инфекции (ангины, хронические тонзиллиты, ревматизм, острый гломерулонефрит, стрептодермии, рожа и др.).
Эпидемиология
Резервуар и источник инфекции - человек, больной ангиной, скарлатиной и другими клиническими формами респираторной стрептококковой инфекции, а также здоровые носители стрептококков группы А. Больной наиболее опасен для окружающих в первые дни болезни. Контагиозность больного прекращается чаще всего через 3 нед от начала болезни. Носительство стрептококков группы А широко распространено среди населения (в среднем 15-20% здорового населения). Многие из носителей выделяют возбудитель на протяжении длительного периода времени (месяцы и годы).
Механизм передачи - аэрозольный, путь передачи - воздушнокапельный. Обычно заражение происходит при длительном тесном общении с больным или носителем. Возможны алиментарный (пищевой) и контактный (через загрязненные руки и предметы обихода) пути инфицирования.
Естественная восприимчивость людей
Естественная восприимчивость людей высокая. Скарлатина возникает у лиц, не имеющих антитоксического иммунитета, при их инфицировании токсигенными штаммами бактерий, выделяющих эритрогенные токсины типов А, В и С. Постинфекционный иммунитет типоспецифический. При инфицировании стрептококками группы А другого серовара возможно повторное заболевание.
Основные эпидемиологические признаки
Заболевание распространено повсеместно. Чаще его встречают в регионах с умеренным и холодным климатом. Общий уровень и динамику многолетней и помесячной заболеваемости скарлатиной в основном определяет заболеваемость детей дошкольного возраста, посещающих организованные коллективы. Ежегодно дети, посещающие детские учреждения, заболевают в 3-4 раза чаще детей, воспитывающихся дома. Наиболее резко эта разница выражена в группе детей первых 2 лет жизни (в 6-15 раз), в то время как среди детей 3-6 лет она менее заметна. Среди этих же групп отмечают наивысшие показатели здорового бактерионосительства.
Характерна связь скарлатины с предшествующими заболеваниями ангиной и другими респираторными проявлениями стрептококковой инфекции, возникающими в ДДУ, особенно вскоре после их формирования. Заболеваемость в осенне-зимне-весенний период наиболее высокая.
Одна из характерных особенностей скарлатины - периодически возникающие подъемы и спады заболеваемости. Наряду с 2-4-летними интервалами отмечают интервалы с более крупными временными промежутками (40-50 лет) с последующим существенным увеличением количества заболевших. В начале 60-х годов XVII в. Т. Сейденгам характеризовал скарлатину как «...крайне незначительное, едва заслуживающее упоминания страдание». Сделанное в то время описание клинической картины скарлатины напоминало скарлатину 2-й половины ХХ в. Однако уже через 15 лет Сиднэм столкнулся с тяжелой скарлатиной и отнес ее по признаку тяжести в один разряд с чумой. XVII и XIX вв. характеризовались сменой периодов тяжелой и легкой скарлатины. Среди известных обобщений по этому поводу можно сослаться на описание, принадлежащее Ф.Ф. Эрисману. Вот как он писал о скарлатине по литературным материалам двух столетий: «По временам наступают периоды исключительно доброкачественных или только злокачественных эпидемий скарлатины. Летальность при злокачественных эпидеми-
ях составляет 13-18%, но нередко возвышается до 25% и достигает даже 30-40%».
В силу несовершенства системы регистрации, слабо развитой и не всегда доступной населению медицинской помощи данные официальной статистики царской России не отражают истинного уровня заболеваемости скарлатиной. В отличие от прошлых веков за ХХ в. авторы книги располагают достаточно обширной информацией.
В столетнем интервале можно выделить 3 больших цикла заболеваемости.
• 1-й цикл характеризуется постепенным подъемом заболеваемости с 1891 г. (115 на 100 000 населения) примерно в течение 10 лет. В последующем приблизительно 10 лет заболеваемость держалась на высоком уровне (в пределах 220-280 на 100 000 населения), затем произошло выраженное снижение заболеваемости к 1917-1918 гг. (до 50-60 на 100 000 населения). Сколько-нибудь достоверных данных об уровне заболеваемости скарлатиной в годы Гражданской войны и интервенции не сохранилось.
• 2-й цикл пришелся на интервал между 1918-1942 гг. с пиком заболеваемости в 1930 г. (462 на 100 000 населения). В последующие 4 года зарегистрировано интенсивное снижение заболеваемости до 46 на 100 000 населения в 1933 г. По заболеваемости в эти годы скарлатина занимала 2-е или 3-е место среди остальных детских капельных инфекций, сохраняя без существенных изменений свои основные эпидемиологические черты (периодические и сезонные колебания, очаговость и др.). Начавшееся снижение уровня заболеваемости несколько приостановилось в годы войны. Однако, несмотря на тяжелую обстановку в стране, эта инфекция не приобрела эпидемического распространения. После нарастания заболеваемости в 1935-1936 гг. началось ее очередное снижение, продолжавшееся и в период Великой Отечественной войны, и в 1943 г. показатель заболеваемости скарлатиной в СССР был ниже довоенного более чем в 2 раза.
• Наиболее продолжительным был 3-й цикл, начавшийся сразу после Второй мировой войны. Заболеваемость достигла максимума в 1955 г. (531,8 на 100 000 населения). Поскольку в 1956 г. был отменен комплекс противоскарлатинозных мероприятий в очагах, можно было ожидать в последующие годы интенсификации эпидемического процесса вследствие увеличения возможностей заражения при контакте с больными, оставленными на дому, и сокраще-
ния сроков их изоляции. Данные литературы, относящейся к концу 50-60-х годов, свидетельствуют о том, что этого не произошло. И наоборот, 60-70-е годы характеризовались снижением заболеваемости с ее минимумом в 1979-1980 гг. С 1950 по 1970 г. в СССР были трижды зарегистрированы периодические подъемы заболеваемости скарлатиной (1955, 1960 и 1966 гг.), каждый последующий из них был ниже предыдущего. Одновременно со снижением общего уровня заболеваемости скарлатиной зарегистрированы изменения в характере эпидемиологических особенностей. Уменьшилась интенсивность очередных периодических подъемов, стали менее резко выраженными ежегодные сезонные нарастания заболеваемости, увеличились удельный вес и показатели заболеваемости скарлатиной в группе детей старшего школьного возраста. За последние годы достигнут минимальный уровень заболеваемости, характерный для межэпидемических лет (50-60 на 100 000 населения). Вместе с тем в самые последние годы наметилась тенденция к увеличению заболеваемости.
Патогенез
Возбудитель проникает в организм человека через слизистые оболочки зева и носоглотки, в редких случаях возможно заражение через слизистые оболочки половых органов или поврежденную кожу. В месте адгезии бактерий формируется местный воспалительно-некротический очаг. Развитие инфекционно-токсического синдрома обусловлено в первую очередь поступлением в кровоток эритрогенного токсина стрептококков (токсина Дика), а также действием пептидогликана клеточной стенки. Токсинемия приводит к генерализованному расширению мелких сосудов во всех органах, в том числе в кожном покрове и слизистых оболочках, и появлению характерной сыпи. Синтез и накопление антитоксических АТ в динамике инфекционного процесса, связывание ими токсинов в последующем обусловливают уменьшение и ликвидацию проявлений токсикоза и постепенное исчезновение сыпи. Одновременно развиваются умеренные признаки периваскулярной инфильтрации и отека дермы. Эпидермис пропитывается экссудатом, его клетки подвергаются ороговению, что в дальнейшем приводит к шелушению кожи после угасания скарлатинозной сыпи. Сохранение прочной связи между ороговевшими клетками в толстых слоях эпидермиса на ладонях и подошвах объясняет крупнопластинчатый характер шелушения в этих местах.
Компоненты клеточной стенки стрептококка (групповой А-полисахарид, пептидогликан, белок М) и внеклеточные продукты (стрептолизины, гиалуронидаза, ДНКаза и др.) обусловливают развитие реакций ГЗТ, аутоиммунных реакций, формирование и фиксацию иммунных комплексов, нарушения системы гемостаза. Во многих случаях их можно считать причиной развития гломерулонефрита, артериитов, эндокардитов и других осложнений иммунопатологического характера.
Из лимфатических образований слизистой оболочки ротоглотки возбудители по лимфатическим сосудам попадают в регионарные лимфатические узлы, где происходит их накопление, сопровождающееся развитием воспалительных реакций с очагами некроза и лейкоцитарной инфильтрации. Последующая бактериемия в некоторых случаях может привести к проникновению микроорганизмов в различные органы и системы, формированию гнойно-некротических процессов в них (гнойного лимфаденита, отита, поражений костной ткани височной области, твердой мозговой оболочки, височных синусов и т.д.).
Клиническая картина
Инкубационный период колеблется от 1 до 10 дней. Типичным считают острое начало заболевания; в некоторых случаях уже в первые часы болезни температура тела повышается до высоких цифр, что сопровождается недомоганием, головной болью, слабостью, тахикардией, иногда болями в животе. При высокой лихорадке в первые дни заболевания больные возбуждены, эйфоричны и подвижны или, наоборот, вялы, апатичны и сонливы. Вследствие выраженной интоксикации часто бывает рвота. Вместе с тем следует подчеркнуть, что при современном течении скарлатины температура тела может быть невысокой.
Возникают боли в горле при глотании. При осмотре больных наблюдают яркую разлитую гиперемию миндалин, дужек, язычка, мягкого нёба и задней стенки глотки (пылающий зев). Гиперемия значительно интенсивнее, чем при обычной катаральной ангине, она резко ограничена в месте перехода слизистой оболочки на твердое нёбо. Возможно формирование ангины фолликулярно-лакунарного характера. На увеличенных, сильно гиперемированных и разрыхленных миндалинах появляются слизисто-гнойные, иногда фибринозные и даже некротические налеты в виде отдельных мелких или (реже) более глубоких и распространенных очагов. Одновременно развивается регионарный лимфаденит, переднешейные лимфатические узлы при пальпации плотные
и болезненные. Язык, сначала обложенный серовато-белым налетом, к 4-5-му дню болезни очищается и становится ярко-красным с малиновым оттенком и гипертрофированными сосочками (малиновый язык). В тяжелых случаях скарлатины подобную малиновую окраску отмечают и на губах. К этому же времени признаки ангины начинают регрессировать, некротические налеты исчезают гораздо медленнее. Со стороны сердечно-сосудистой системы определяют тахикардию на фоне умеренного повышения АД.
Скарлатинозная экзантема появляется на 1-2-е сутки болезни, располагаясь на общем гиперемированном фоне, что является ее особенностью. Сыпь - важный диагностический признак заболевания. Сначала мелкоточечные элементы возникают на коже лица, шеи и верхней части туловища, затем сыпь быстро распространяется на сгибательные поверхности конечностей, боковые стороны груди и живота, внутреннюю поверхность бедер. Во многих случаях отчетливо выражен белый дермографизм. Очень важный признак скарлатины - сгущение сыпи в виде темнокрасных полос на кожных складках в местах естественных сгибов (см. рис. 20 на цветной вклейке), например локтевых, паховых (симптом Пастиа), а также в подмышечных ямках. Местами обильные мелкоточечные элементы могут полностью сливаться, что создает картину сплошной эритемы. На лице сыпь располагается на щеках, в меньшей степени - на лбу и висках, в то время как носогубный треугольник свободен от элементов сыпи и бледен (симптом Филатова). При надавливании на кожу ладонью сыпь в этом месте временно исчезает (симптом ладони).
В связи с повышенной ломкостью сосудов можно обнаружить мелкие точечные кровоизлияния в области суставных сгибов, а также в местах, где кожа подвергается трению или сдавлению одеждой.
Становятся положительными эндотелиальные симптомы:
- жгута (Кончаловского-Румпеля-Лееде);
- резинки.
В некоторых случаях наряду с типичной скарлатинозной сыпью могут появляться мелкие везикулы и макулопапулезные элементы. Сыпь может появляться поздно, лишь на 3-4-й день болезни, или вообще отсутствовать.
К 3-5-м суткам заболевания самочувствие больного улучшается, температура тела начинает постепенно снижаться. Сыпь бледнеет, постепенно исчезает и к концу 1-й или началу 2-й недели сменяется мелкочешуйчатым шелушением кожи (на ладонях и подошвах оно носит крупнопластинчатый характер).
Интенсивность экзантемы и сроки ее исчезновения могут быть различными. Иногда при легком течении скарлатины скудная сыпь может исчезнуть через несколько часов после появления. Выраженность шелушения кожи и его длительность прямо пропорциональны обилию предшествовавшей сыпи.
Экстрабуккальная форма
Воротами инфекции становятся места поражения кожи:
- ожоги;
- ранения;
- очаги стрептодермии и т.д.
Сыпь имеет тенденцию распространяться от места внедрения возбудителя. При этой редкой в настоящее время форме заболевания воспалительные изменения со стороны ротоглотки и шейных лимфатических узлов отсутствуют.
Стертые формы
Часто встречают у взрослых. Протекают со слабо выраженными общетоксическими симптомами, изменениями в ротоглотке катарального характера, скудной, бледной и быстро исчезающей сыпью. Вместе с тем у взрослых заболевание может иногда проходить и в тяжелой, так называемой токсико-септической форме.
Токсико-септическая форма
Развивается редко и, как правило, у взрослых лиц. Характерны бурное начало с гипертермией, быстрое развитие сосудистой недостаточности (глухие тоны сердца, падение АД, нитевидный пульс, холодные конечности), нередко возникают геморрагии на коже. В последующие дни присоединяются осложнения инфекционно-аллергического генеза (поражения сердца, суставов, почек) или септического характера (лимфадениты, некротическая ангина, отиты и др.).
Дифференциальная диагностика
Скарлатину следует отличать от кори, краснухи, псевдотуберкулеза, лекарственных дерматитов. В редких случаях развития фибринозных налетов и особенно при их выходе за пределы миндалин заболевание необходимо дифференцировать от дифтерии.
Скарлатину отличают:
- яркая разлитая гиперемия ротоглотки (пылающий зев), резко ограниченная в месте перехода слизистой оболочки на твердое нёбо;
- ярко-красный язык с малиновым оттенком и гипертрофированными сосочками (малиновый язык);
- мелкоточечные элементы сыпи на общем гиперемированном фоне;
- сгущение сыпи в виде темно-красных полос на кожных складках в местах естественных сгибов;
- отчетливо выраженный белый дермографизм;
- бледный носогубной треугольник (симптом Филатова).
При надавливании на кожу ладонью сыпь в этом месте временно исчезает (симптом ладони), положительны эндотелиальные симптомы. После исчезновения экзантемы отмечают мелкочешуйчатое шелушение кожи (на ладонях и подошвах крупнопластинчатое).
Лабораторная диагностика
Отмечают изменения гемограммы, типичные для бактериальной инфекции:
- лейкоцитоз;
- нейтрофилию со сдвигом лейкоцитарной формулы влево;
- повышение СОЭ.
Выделение возбудителя практически не проводят в связи с характерной клинической картиной заболевания и широким распространением бактерий у здоровых лиц и больных другими формами стрептококковой инфекции. Для экспресс-диагностики применяют РКА, выявляющую Аг стрептококков.
Осложнения и исходы
К наиболее частым осложнениям скарлатины относят гнойный и некротический лимфаденит, гнойный отит, а также осложнения инфекционно-аллергического генеза, чаще возникающие у взрослых больных, - диффузный гломерулонефрит, миокардит.
Лечение
В настоящее время лечение скарлатины осуществляют на дому, за исключением тяжелых и осложненных случаев. Необходимо соблюдать постельный режим в течение 7-10 дней. Антибактериальное лечение обязательно для всех больных скарлатиной, независимо от тяжести
заболевания. Этиотропным препаратом выбора остается пенициллин в суточной дозе 6 млн ЕД (для взрослых) курсом 10 сут. Альтернативные препараты - макролиды (эритромицин в дозе 250 мг 4 раза в сутки или 500 мг 2 раза в сутки) и цефалоспорины I поколения (цефазолин по 2-4 г в сутки). Курс лечения также составляет 10 дней. При противопоказаниях к указанным препаратам можно применять полусинтетические пенициллины, линкозамиды. Назначают полоскания горла раствором фурацилина (1:5000), настоями ромашки, календулы, эвкалипта. Показаны витамины и антигистаминные средства в обычных терапевтических дозах.
Эпидемиологический надзор
Принимая во внимание положение, что скарлатина признана болезнью организованных коллективов, в них необходимо осуществлять ежедневное отслеживание динамики заболеваемости ангиной и другими проявлениями респираторной стрептококковой инфекции для распознавания признаков ухудшения эпидемической ситуации и предсказания появления заболеваний скарлатиной и ревматизмом. Большое значение имеет мониторинг типовой структуры возбудителя и его биологических свойств. Известно, что популяция стрептококков группы А крайне гетерогенна и изменчива по типовой структуре и способности вызывать ревматизм, гломерулонефрит и токсико-септические формы инфекции (некротический фасциит, миозит, синдром токсического шока и др.). Подъем заболеваемости связан, как правило, со сменой ведущего серовара возбудителя (по структуре белка М).
Профилактические мероприятия
См. выше раздел «Стрептококковые инфекции».
Мероприятия в эпидемическом очаге
При скарлатине обязательной госпитализации подлежат:
- больные с тяжелыми и среднетяжелыми формами инфекции;
- больные из детских учреждений с круглосуточным пребыванием детей (дома ребенка, детские дома, школы-интернаты, санатории и т.д.);
- больные из семей, где есть дети в возрасте до 10 лет, не болевшие скарлатиной;
- любые больные при невозможности надлежащего ухода на дому;
- больные из семей, где есть лица, работающие в ДДУ, хирургических и родильных отделениях, детских больницах и поликлиниках, молочных кухнях, при невозможности их изоляции от заболевшего.
Выписку больного скарлатиной из стационара осуществляют после клинического выздоровления, но не ранее 10 дней от начала заболевания.
Порядок допуска переболевших скарлатиной и ангиной в детские учреждения:
- реконвалесцентов из числа детей, посещающих ДДУ и первые 2 класса школ, допускают в эти учреждения через 12 дней после клинического выздоровления;
- для больных скарлатиной детей из закрытых детских учреждений после выписки из стационара дополнительная 12-дневная изоляция допустима в том же закрытом детском учреждении при условии надежной изоляции реконвалесцентов;
- взрослых реконвалесцентов из группы декретированных профессий с момента клинического выздоровления на 12 дней переводят на другую работу (где они эпидемиологически не будут опасны);
- больных ангинами из очага скарлатины (детей и взрослых), выявленных на протяжении 7 дней с момента регистрации последнего случая скарлатины, не допускают в перечисленные выше учреждения в течение 22 дней со дня их заболевания (так же, как и больных скарлатиной).
При регистрации заболеваний скарлатиной в ДДУ на группу, где выявлен больной, накладывают карантин сроком на 7 дней с момента изоляции последнего больного скарлатиной. В группе в обязательном порядке проводят термометрию, осмотр зева и кожных покровов детей и персонала. При появлении у кого-либо из детей повышенной температуры тела или симптомов острого заболевания верхних дыхательных путей следует провести немедленную их изоляцию от окружающих с обязательным осмотром кожного покрова. Всех контактировавших с больными, а также лиц с хроническими воспалительными поражениями носоглотки подвергают санации томицидом в течение 5 сут (полоскание или орошение зева 4 раза в день после еды). В помещении, где находится больной стрептококковой инфекцией, проводят регулярную
текущую дезинфекцию 0,5% раствором хлорамина, посуду и белье регулярно кипятят. Заключительную дезинфекцию не проводят.
Детей, посещающих ДДУ и первые 2 класса школы, не болевших скарлатиной и общавшихся с больным скарлатиной на дому, не допускают в детское учреждение в течение 7 сут с момента последнего общения с больным. Взрослых декретированных профессий, общавшихся с больным, к работе допускают, но за ними устанавливают медицинское наблюдение в течение 7 дней для своевременного выявления возможных скарлатины и ангины.
Лиц с выявленными острыми респираторными поражениями (ангина, фарингит и др.) следует осмотреть на сыпь и отстранить от занятий, сообщив участковому врачу. Допуск их в детские учреждения осуществляют после выздоровления и предоставления справки о проведении лечения антибиотиками.
Диспансерное наблюдение за переболевшими скарлатиной и ангиной проводят в течение 1 мес после выписки из стационара. Через 7-10 дней проводят клиническое обследование и контрольные анализы мочи и крови, по показаниям - ЭКГ. При отсутствии отклонений от нормы проводят повторное обследование через 3 нед, после чего снимают с диспансерного учета. При патологии в зависимости от локализации переболевшего необходимо передать под наблюдение ревматолога или нефролога.
РОЖА (ERYSIPELAS)
Рожа - инфекционное заболевание, характеризующееся выраженной интоксикацией и появлением на коже или слизистых оболочках очагов четко отграниченного острого серозного или серозно-геморрагического воспаления. Болезнь склонна к рецидивирующему течению.
Краткие исторические сведения
Рожа известна со времен глубокой древности. В трудах античных авторов она описана под названием erysipelas (греч. erythros - красный и лат. pellis - кожа). Вопросам клиники, дифференциальной диагностики и лечения рожи посвящены работы Гиппократа, Цельсия, Галена, Абу Али ибн Сины. Во 2-й половине XIX в. Н.И. Пирогов и И. Земмельвейс описали острую и рецидивирующую рожу, а также ее осложнения (флегмона и гангрена) в хирургических госпиталях и родильных домах, считая заболевание высококонтагиозным. В 1882 г. И. Фелейзен впервые
получил чистую культуру стрептококка от больного рожей. В результате последующего изучения эпидемиологических особенностей и патогенетических механизмов, успехов химиотерапии рожи сульфаниламидами и антибиотиками представления о заболевании изменились, его стали относить к разряду спорадических малоконтагиозных инфекций. Большой вклад в изучение проблем рожи в советское время внесли Э.А. Гальперин, В.Л. Черкасов, Р.Р. Рыскинд.
Этиология
Возбудитель - стрептококк группы А (S. pyogenes), обладающий сложным набором Аг, токсинов и ферментов (см. выше раздел «Стрептококковые инфекции»).
Эпидемиология
Резервуар и источник инфекции - человек с различными формами стрептококковой инфекции (вызванной стрептококками группы А) и здоровый бактерионоситель стрептококка группы А.
Механизм передачи инфекции - аэрозольный, основной путь заражения - воздушно-капельный, но также возможно контактное заражение. Входные ворота - различные повреждения (ранения, опрелости, трещины) кожи или слизистых оболочек носа, половых органов и др. Стрептококки группы А часто колонизируют поверхность слизистых оболочек и кожный покров здоровых лиц, поэтому опасность заражения рожей велика, особенно при элементарной неопрятности.
Естественная восприимчивость людей
Возникновение заболевания определяет, вероятно, генетически обусловленная индивидуальная предрасположенность. Среди заболевших преобладают женщины. У лиц с хроническим тонзиллитом и другими стрептококковыми инфекциями рожа возникает в 5-6 раз чаще. Местные факторы, предрасполагающие к развитию рожи лица, - хронические болезни ротовой полости, кариес, болезни ЛОР-органов. Рожа грудной клетки и конечностей чаще возникает при лимфедеме, лимфовенозной недостаточности, отеках различного генеза, микозе стоп, трофических нарушениях. Посттравматические и послеоперационные рубцы предрасполагают к локализации очага в месте своего расположения. Повышение восприимчивости к роже может быть вызвано длительным приемом стероидных гормонов.
Основные эпидемиологические признаки
Рожу относят к наиболее распространенным инфекциям бактериальной природы. Официально заболевание не регистрируют, поэтому сведения о заболеваемости основаны на выборочных данных. По мнению В.Л. Черкасова (1986), заболеваемость рожей составляет в среднем 1,4-2,2 случая на 1000 населения.
Инфекция может развиваться как по экзогенному, так и по эндогенному типу. Рожа лица может быть результатом лимфогенного заноса возбудителя из первичного очага в миндалинах или внедрения стрептококка в кожу. Несмотря на достаточно широкое распространение возбудителя, заболевание наблюдают лишь в виде спорадических случаев. В отличие от других стрептококковых инфекций рожа не имеет выраженной осенне-зимней сезонности. Наибольшую заболеваемость наблюдают во 2-й половине лета и начале осени. Рожей болеют лица разных профессий. Часто страдают строители, работники горячих цехов и люди, работающие в холодных помещениях; для рабочих металлургических и коксохимических предприятий стрептококковая инфекция становится профессиональным заболеванием.
Следует отметить, что если в 1972-1982 гг. клиническую картину рожи отличало преобладание среднетяжелых и легких форм, то в следующее десятилетие отмечено значительное увеличение доли тяжелых форм болезни с развитием инфекционно-токсического и геморрагического синдромов. В последнее время (1995-1999 гг.) легкие формы составляют 1%, среднетяжелые - 81,5%, тяжелые - 17,5% всех случаев. Удельный вес больных рожей с геморрагическим синдромом достиг 90,8%. Анализ статистических материалов (официальная отчетная форма Госкомстата С-51) свидетельствует и о росте показателей смертности, связанной с рожей (0,11 на 100 000 населения - в 1970 г. и 0,4- 0,58 - в 1995-1999 гг.).
Патогенез
При экзогенном заражении (рис. 3-13) возбудитель внедряется через поврежденную кожу (ссадины, царапины, раны, опрелости, трещины), а также слизистые оболочки. При очагах хронической стрептококковой инфекции в организме с периодической реверсией L-форм стрептококка в бактериальные возможен эндогенный занос возбудителя в кожу с током крови. Размножаясь в кожных лимфатических капиллярах, стрептококк обусловливает формирование активного воспалительного или
латентного очага инфекции в дерме. В последнем случае возбудитель длительно персистирует в коже, трансформируясь во внутриклеточно паразитирующие L-формы, или гематогенным путем распространяется по органам мононуклеарно-фагоцитарной системы, где также происходит его L-трансформация. Этот процесс лежит в основе формирования стойких очагов хронической стрептококковой инфекции. Последующая реверсия возбудителя в бактериальные формы определяет возможность развития рецидивов заболевания.
 Рис. 3-13. Патогенез рожи: МФС - макрофагальная система; ИК - иммунокомплексный.
Рис. 3-13. Патогенез рожи: МФС - макрофагальная система; ИК - иммунокомплексный.
При активном размножении стрептококков в дерме их токсические продукты (экзотоксины, ферменты, компоненты клеточной стенки) проникают в кровоток. Токсинемия становится причиной развития инфекционно-токсического синдрома с высокой лихорадкой, ознобом
и другими проявлениями интоксикации. Одновременно развивается кратковременная бактериемия, однако ее роль в патогенезе заболевания окончательно не выяснена.
В коже или на слизистых оболочках (значительно реже) формируется очаг инфекционно-аллергического серозного или серозно-геморрагического воспаления.
Существенную роль в его развитии играют факторы патогенности стрептококков, оказывающие цитопатическое действие:
- Аг клеточной стенки;
- токсины;
- ферменты.
При этом структура некоторых Аг кожи человека сходна с А-полисахаридом стрептококков, что приводит к появлению у больных рожей ауто-АТ, вступающих в аутоиммунные реакции с Аг кожи. Аутоиммунопатология повышает уровень индивидуальной предрасположенности организма к воздействию Аг стрептококка. Кроме того, в дерме и сосочковом слое формируются иммунные комплексы с Аг возбудителя. Аутоиммунные и иммунные комплексы могут вызывать поражение кожи, кровеносных и лимфатических капилляров, способствовать развитию внутрисосудистого свертывания крови с нарушением целостности сосудистой стенки, активацией различных звеньев гемостаза, образованию микротромбов, формированию местного геморрагического синдрома. В результате в очаге инфекционно-аллергического воспаления с эритемой и отеком образуются геморрагии или пузыри с серозным или геморрагическим содержимым.
В патогенезе часто рецидивирующей рожи, кроме того, отмечают важные особенности:
- формирование стойкого очага стрептококковой инфекции в организме больного (L-формы);
- снижение функциональной активности нейтрофилов дермы, клеточного и гуморального иммунитета;
- формирование гиперчувствительности IV типа к возбудителю и его клеточным и внеклеточным продуктам.
В основе патогенеза рожи лежит индивидуальная предрасположенность к заболеванию. Она может быть врожденной, генетически детерминированной или приобретенной в результате разнообразных инфекций и других перенесенных заболеваний, сопровождавшихся ростом сенсибилизации организма к аллергенам стрептококка, эндоаллергенам, аллергенам других микроорганизмов (стафилококков, кишечной
палочки и др.). При индивидуальной предрасположенности организм реагирует на внедрение стрептококка в кожу формированием ГЗТ с развитием серозного или серозно-геморрагического воспаления. Развитие гнойного воспаления нехарактерно для рожи и свидетельствует о присоединении вторичной инфекции.
Развитие гнойного воспаления нехарактерно для рожи и свидетельствует о присоединении вторичной инфекции.
Важный компонент патогенеза - это снижение активности факторов, определяющих защитные реакции больного:
- неспецифических факторов защиты;
- типоспецифического гуморального и клеточного иммунитета;
- местного иммунитета кожи и слизистых оболочек.
Кроме того, в развитии заболевания определенную роль играют нейроэндокринные нарушения и дисбаланс биологически активных веществ (соотношение содержания гистамина и серотонина). Вследствие относительной недостаточности глюкокортикоидов и повышения уровня минералокортикоидов у больных рожей поддерживается местный воспалительный процесс с отечным синдромом. Гипергистаминемия способствует снижению тонуса лимфатических сосудов, усилению лимфообразования, повышению проницаемости гематоэнцефалического барьера для микробных токсинов. При снижении содержания серотонина снижается тонус сосудов, усиливаются микроциркуляторные нарушения в тканях.
Тропность стрептококков к лимфатическим сосудам обеспечивает лимфогенный путь диссеминирования с развитием лимфангитов, склерозированием лимфатических сосудов при частых повторных эпизодах рожи. В результате нарушается резорбция лимфы, формируется стойкий лимфостаз (лимфедема). Вследствие распада белка при этом происходит стимуляция фибробластов с разрастанием соединительной ткани. Формируется вторичная слоновость - фибредема (см. рис. 22 на цветной вклейке).
Морфологические изменения при роже представлены серозным или серозно-геморрагическим воспалением кожи с повышенным образованием экссудата, отеком дермы, возможной отслойкой эпидермиса с образованием пузырей. Характерны гиперемия сосудов, периваскулярная инфильтрация лимфоидными, лейкоцитарными и гистиоцитарными элементами. Наблюдают атрофию эпидермиса, дезорганизацию и фрагментацию коллагеновых волокон, набухание и гомогенизацию эндотелия в лимфатических и кровеносных сосудах.
Клиническая картина
Современная клиническая классификация рожи (В.Л. Черкасов, 1986) предусматривает выделение следующих форм болезни.
• По характеру местных проявлений:
◊ эритематозная;
◊ эритематозно-буллезная;
◊ эритематозно-геморрагическая;
◊ буллезно-геморрагическая.
• По степени интоксикации (тяжести течения):
◊ легкая;
◊ средней тяжести;
◊ тяжелая.
• По кратности течения:
◊ первичная;
◊ повторная;
◊ рецидивирующая (часто и редко, рано и поздно).
• По распространенности местных проявлений:
◊ локализованная;
◊ распространенная;
◊ блуждающая (ползучая, мигрирующая);
◊ метастатическая.
• Осложнения рожи:
◊ местные (абсцесс, флегмона, некрозы, флебит, периаденит и др.);
◊ общие (сепсис, ИТШ и др.).
• Последствия рожи:
◊ стойкий лимфостаз (лимфедема);
◊ вторичная слоновость (фибредема). Пояснения к классификации.
• К рецидивирующей роже относят случаи, возникающие в период от нескольких дней до 2 лет после предыдущего заболевания, как правило, с той же локализацией местного процесса, а также более поздние, но с прежней локализацией при частых рецидивах. При 3 и более рецидивах рожи за год целесообразно определение «часто рецидивирующая рожа».
• К повторной роже относят случаи, возникающие не ранее чем через 2 года после предыдущего заболевания, у лиц, не страдавших ранее рецидивирующей рожей, а также случаи, развившиеся в более ранние сроки, но с иной локализацией.
• Локализованными называют формы заболевания с местным очагом воспаления, локализующимся в пределах одной анатомической области, распространенными - при захвате очагом более одной анатомической области.
• Случаи заболевания с присоединением флегмоны или некроза (флегмонозная и некротическая формы рожи) рассматривают как осложнения болезни.
Инкубационный период может быть установлен лишь при посттравматической роже, в этих случаях он продолжается от нескольких часов до 3-5 дней. Более чем в 90% случаев рожа начинается остро, больные указывают не только день, но и час ее возникновения. У больных с рецидивирующим течением рожи развитию очередного рецидива заболевания часто предшествуют переохлаждение, стресс.
Начальный период характеризуется быстрым подъемом температуры тела до высоких цифр, ознобами, головной болью, ломотой в мышцах и суставах, слабостью. В тяжелых случаях заболевания возможны рвота, судороги и бред. Через несколько часов, а иногда и на 2-й день болезни на ограниченном участке кожи возникает ощущение распирания, жжения, зуда, умеренной болезненности, ослабевающей или исчезающей в покое. Боли больше всего выражены при роже волосистой части головы. Довольно часто возникают боли в области регионарных лимфатических узлов, усиливающиеся при движении. Затем появляется покраснение кожи (эритема) с отеком.
В разгар заболевания сохраняются субъективные ощущения, высокая лихорадка и другие общетоксические проявления. Из-за токсического поражения нервной системы на фоне высокой температуры тела могут развиться апатия, бессонница, рвота, при гиперпирексии - потеря сознания, бред. На пораженном участке формируется пятно яркой гиперемии с четкими неровными границами в виде языков пламени или географической карты, отеком, уплотнением кожи. Очаг горячий и слегка болезненный на ощупь. При расстройствах лимфообращения гиперемия имеет цианотичный оттенок, при трофических нарушениях дермы с лимфовенозной недостаточностью - буроватый. После надавливания пальцами на область эритемы краснота под ними исчезает на 1-2 с. Из-за растяжения эпидермиса эритема лоснится, по ее краям кожа несколько приподнята в виде периферического инфильтрационного валика.
Одновременно в большинстве случаев, особенно при первичной или повторной роже, наблюдают признаки регионарного лимфаденита: - уплотнение лимфатических узлов;
- их болезненность при пальпации;
- ограничение подвижности.
У многих больных проявляется сопутствующий лимфангит в виде узкой бледно-розовой полоски на коже, соединяющей эритему с регионарной группой лимфатических узлов.
Со стороны внутренних органов можно наблюдать приглушенность сердечных тонов, тахикардию, артериальную гипотензию. В редких случаях появляются менингеальные симптомы.
Лихорадка, различная по высоте и характеру температурной кривой, и другие проявления токсикоза обычно сохраняются 5-7 дней, а иногда и несколько дольше. При снижении температуры тела наступает период реконвалесценции. Обратное развитие местных воспалительных реакций возникает позже нормализации температуры тела и затягивается до 5-8 сут, а при геморрагических формах до 12-15 сут. Эритема бледнеет, ее границы становятся нечеткими, исчезает краевой инфильтрационный валик. Спадает отек, уменьшаются и проходят симптомы регионарного лимфаденита. После исчезновения гиперемии наблюдают мелкочешуйчатое шелушение кожи, возможна пигментация. В некоторых случаях регионарный лимфаденит и инфильтрация кожи сохраняются долго, что свидетельствует о риске раннего рецидива рожи. Длительное сохранение стойкого отека - признак формирования лимфостаза. Приведенная клиническая характеристика свойственна эритематозной роже.
Эритематозно-геморрагическая форма
В последние годы состояние встречают значительно чаще; в некоторых регионах по количеству случаев оно выходит на 1-е место среди всех форм заболевания. Основным отличием местных проявлений этой формы от эритематозной служат кровоизлияния - от петехий до обширных сливных геморрагий на фоне эритемы. Заболевание сопровождают более длительная лихорадка (10-14 дней и более) и медленное обратное развитие местных воспалительных изменений. Нередко возникают осложнения в виде некрозов кожи.
Эритематозно-буллезная форма
Характерно образование мелких пузырьков на фоне эритемы (фликтены, заметные при боковом освещении) или крупных пузырей, наполненных прозрачным серозным содержимым. Пузыри образуются на несколько часов или даже на 2-3 дня позже возникновения эритемы (вследствие отслойки эпидермиса). В динамике заболевания они само-
произвольно разрываются (или их вскрывают стерильными ножницами), серозное содержимое истекает, омертвевший эпидермис отслаивается. Мацерированная поверхность медленно эпителизируется. Образуются корочки, после отпадения которых рубцов не остается. Инфекционнотоксический синдром и регионарный лимфаденит не имеют принципиальных отличий от их проявлений при эритематозной роже.
Буллезно-геморрагическая форма (см. рис. 21 на цветной вклейке)
Принципиальное отличие от эритематозно-буллезной рожи - образование пузырей с серозно-геморрагическим и фибринозно-геморрагическим экссудатом, обусловленным глубоким повреждением капилляров. При вскрытии пузырей на мацерированной поверхности часто образуются эрозии, изъязвления. Эту форму нередко осложняют глубокие некрозы, флегмоны. После выздоровления остаются рубцы и пигментация кожи. В последние годы наблюдают увеличение геморрагических форм болезни (эритематозно-геморрагической и буллезно-геморрагической).
Наиболее частая локализация местного воспалительного очага при роже - нижние конечности, реже лицо, еще реже верхние конечности, грудная клетка (обычно при лимфостазе в области послеоперационных рубцов) и др.
Рожа, независимо от формы заболевания, имеет некоторые возрастные особенности.
• Дети болеют редко и легко.
• У лиц пожилого возраста первичная и повторная рожа обычно отличается более тяжелым течением с удлинением лихорадочного периода (иногда до 4 нед) и обострением различных сопутствующих хронических заболеваний. Регионарный лимфаденит у большинства больных отсутствует. Регресс местных проявлений у пожилых лиц идет медленно.
Заболевание склонно к рецидивирующему течению. Различают ранние (в первые 6 мес) и поздние, частые (3 раза в год и более) и редкие рецидивы. При частом рецидивировании заболевания (3-5 раз в год и более) говорят о хроническом течении болезни, обычно развивающемся на фоне сопутствующих патологий. В этих случаях довольно часто симптомы интоксикации бывают умеренными, лихорадка - короткой, эритема - неяркой и без четких границ, регионарный лимфаденит отсутствует. Кроме того, выделяют сезонные рецидивы, возникающие ежегодно на протяжении многих лет, чаще всего в летне-осенний период.
Дифференциальная диагностика
Рожу дифференцируют от многих инфекционных, хирургических, кожных и внутренних заболеваний:
- эризипелоида;
- сибирской язвы;
- абсцесса;
- флегмоны;
- панариция;
- флебитов и тромбофлебитов;
- облитерирующего эндартериита с трофическими нарушениями;
- экземы;
- дерматита;
- токсикодермии и других кожных заболеваний;
- системной красной волчанки;
- склеродермии и др.
При постановке клинического диагноза рожи принимают во внимание острое начало заболевания с лихорадкой и другими проявлениями интоксикации, чаще опережающими возникновение типичных местных признаков (в ряде случаев возникающими одновременно с ними), характерную локализацию местных воспалительных реакций (нижние конечности, лицо, реже другие области кожных покровов), развитие регионарного лимфаденита, отсутствие выраженных болей в покое.
Лабораторная диагностика
Изменения гемограммы - лейкоцитоз, умеренное повышение СОЭ. Выделение возбудителя обычно не проводят. Определенное диагностическое значение имеют определение титров антистрептолизина-О и других противострептококковых АТ, выявление Аг бактериальных и L-форм стрептококка в крови, слюне, отделяемом из буллезных элементов с помощью РКА, РЛА, ИФА, что особенно важно при прогнозировании рецидивов у реконвалесцентов. Разработана ПЦР.
Осложнения и исходы
Осложнения рожи, преимущественно местного характера, наблюдают у 5-10% больных. Заболевание нередко осложняют абсцессы, флегмоны, глубокие некрозы кожи, язвы, пустулизация, флебиты и тромбофлебиты, в редких случаях - пневмония, сепсис, ИТШ. Вследствие лимфовенозной недостаточности, прогрессирующей при каждом новом рецидиве заболевания (особенно у больных часто рецидивирующей рожей), в 10-15% случаев формируются последствия рожи (см. рис. 9 на
цветной вклейке) в виде лимфостаза (лимфедемы) и слоновости (фибредемы). При длительном течении слоновости развиваются гиперкератоз, пигментация кожи, папилломы, язвы, экзема, лимфорея.
Лечение
Возможно амбулаторное лечение больного с пероральным назначением одного из нижеперечисленных антибиотиков:
- спирамицина по 3 млн МЕ 2 раза в сутки;
- азитромицина по 0,5 г/сут, затем по 0,25 г/сут со 2-го по 5-й дни;
- рокситромицина по 0,15 г 2 раза в день;
- левофлоксацина по 0,5 г 2 раза в день;
- цефаклора по 0,5 г 3 раза в день.
Курс лечения любым препаратом (за исключением азитромицина) составляет 10 дней.
Показания к госпитализации:
- часто рецидивирующие и тяжелые формы болезни;
- тяжелые общие сопутствующие заболевания;
- старческий или детский возраст больных.
Этиотропное лечение проводят назначением пенициллинов (внутримышечно по 6-12 млн ЕД в сутки).
При тяжелом, осложненном течении рожи назначают внутримышечно курсом на 10 дней препараты резерва:
- цефалоспорины I поколения (цефазолин по 3-6 г/сут);
- клиндамицин по 1,2-2,4 г/сут.
В этих же случаях, а также при буллезно-геморрагической роже с обильным выпотом фибрина могут быть использованы схемы комбинированного лечения бензилпенициллина по 6-12 млн ЕД с гентамицином (240 мг/сут однократно внутримышечно), ципрофлоксацином (по 400 мг 2 раза в день внутривенно капельно) или клиндамицином по 1,2- 2,4 г/сут.
Часто рецидивирующая рожа - это показание к проведению двухкурсового лечения. Первый курс антибиотикотерапии (10 дней) проводят цефалоспоринами, после 2-3-дневного перерыва проводят второй курс лечения линкомицином - по 0,6 г 3 раза в день внутримышечно или по 0,5 г 3 раза в день перорально в течение 7 дней.
При выраженной инфильтрации кожи в очаге воспаления показано противовоспалительное лечение с применением нестероидных проти-
вовоспалительных препаратов. В случаях тяжелой интоксикации проводят парентеральное дезинтоксикационное лечение по общепринятым схемам. Используют сердечно-сосудистые, мочегонные, жаропонижающие и симптоматические средства, витамины А, В1 и С, рутин.
Местное лечение проводят при буллезных формах рожи с локализацией процесса на конечностях путем вскрытия пузырей и наложения часто сменяемых марлевых салфеток, смоченных растворами антисептиков (фурацилина 1:5000, этакридина лактата 1:1000, димексида, диоксидина, октанисепта и др.). Тугое бинтование недопустимо. При обширных мокнущих эрозиях перед применением салфеток с антисептиками эрозированную поверхность обрабатывают раствором марганцевокислого калия. Применение различных мазей ограничено, поскольку они часто раздражают кожу, усиливают экссудацию и замедляют репаративные процессы. Ихтиоловая мазь, бальзам Вишневского, мази с антибиотиками противопоказаны.
В остром периоде рожи назначают УФО на область очага воспаления и УВЧ на область регионарных лимфатических узлов (5-10 процедур). Для более быстрой ликвидации остаточных признаков (инфильтрации кожи, отека, регионарного лимфаденита) применяют озокерит, парафин, электрофорез лидазы и хлорида кальция, радоновые ванны, магнитотерапию и низкоинтенсивную лазеротерапию.
В ряде случаев больным рожей показано противорецидивное лечение после выписки из стационара. С целью предупреждения реверсии L-форм стрептококка в исходные бактериальные формы назначают инъекции бициллина-5 по 1,5 млн ЕД или ретарпена по 2,4 г внутримышечно с интервалами между инъекциями 3 нед. При часто рецидивирующей роже курс инъекций продолжают в течение 1-2 лет. Больным с остаточными признаками и риском рецидива после выписки из стационара инъекции проводят в течение 3-6 мес. При сезонных рецидивах противорецидивное лечение начинают за 1 мес до их обычного времени наступления и проводят в течение 3-4 мес.
Профилактические мероприятия
Необходимо следить за чистотой кожного покрова. Первичная обработка ран, трещин, лечение гнойничковых заболеваний, строгое соблюдение асептики при медицинских манипуляциях служат средствами предупреждения рожи.
Мероприятия в эпидемическом очаге
Мероприятия не регламентированы. Диспансерное наблюдение за реконвалесцентами первичной рожи проводят в кабинете инфекционных болезней поликлиники в течение 3 мес; за страдающими рецидивирующей рожей наблюдают не менее 2 лет со времени последнего рецидива.
болезни с контактным механизмом передачи
Болезни с контактным механизмом передачи (инфекции наружных покровов) включают:
- бактериальные (сифилис, гонорея и др.);
- грибковые (дерматомикозы, урогенитальный кандидоз и др.);
- вирусные (ВИЧ-инфекция, генитальный герпес, ВГВ);
- протозойные (трихомониаз);
- паразитарные (чесотка и др.) инфекции.
Большинство из них протекает хронически и сопровождается длительной персистенцией возбудителя в организме (в крови или на кожном покрове и слизистых оболочках). Пути передачи возбудителей этих разнородных заболеваний отличаются большим разнообразием. При некоторых болезнях (сифилис, гонорея, трихомониаз и др.), передаваемых преимущественно половым путем, передача возбудителей происходит при непосредственном соприкосновении и попадании возбудителя на поврежденные кожный и слизистые покровы (прямой контакт). При других болезнях (грибковые поражения, чесотка и др.) заражение происходит опосредованно - через контаминированные объекты внешней среды (одежду, белье, головные уборы, посуду и т.д.), перевязочные материалы, а также руки. Вместе с тем заражение сифилисом может произойти и через загрязненную выделениями больного посуду и другие предметы обихода. Заражение ВИЧ-инфекцией и ВГВ нередко происходит при переливании крови, пересадке органов и других инвазивных лечебно-диагностических процедурах, а также парентеральном введении психоактивных препаратов. Чрезвычайно высокая пораженность населения ЗППП и другими инфекциями наружных покровов, их широкое распространение определяют не только медицинскую, но и огромную социальную значимость этой проблемы. Их распространение в значительной степени обусловлено социальными факторами и зависит от
соблюдения населением правил личной гигиены и ведения соответствующего образа жизни, прежде всего сексуального поведения. Поэтому борьба с названными болезнями в первую очередь должна быть направлена на оздоровление быта, нравственное и гигиеническое воспитание и обучение безопасному половому поведению. Различные социальные, возрастные и другие группы населения нуждаются в дифференцированном уровне знаний и навыков, необходимых для предупреждения распространения ЗППП и индивидуальной защиты от заражения. Медицинский контроль в декретированных группах населения (работники пищевых предприятий, торговли, ДДУ, медработники), своевременное выявление, лечение и отстранение от работы больных лиц направлены на недопущение заражения соответствующих контингентов населения. Также крайне важны меры по предупреждению передачи возбудителя при переливании крови, пересадке органов и тканей и проведении лечебно-диагностических инвазивных манипуляций. Перспективно внедрение аутогемотрансфузий, когда больному переливают его же кровь, заготовленную до плановой операции. Неспецифическая профилактика включает применение одноразовых инструментов при манипуляциях, связанных с повреждением кожного покрова и слизистых оболочек, тщательную стерилизацию медицинского инструментария, а также тщательное выявление вирусных Аг у доноров. Большое значение имеет повсеместное внедрение и улучшение централизованной стерилизации изделий медицинского назначения.
Прерывание естественных путей передачи обеспечивают следующие санитарно-гигиенические меры:
- индивидуализация всех предметов личной гигиены (бритвенных приборов, зубных щеток, мочалок, расчесок и др.) и раздельное их хранение;
- соблюдение правил личной гигиены;
- предупреждение микротравм в быту и на производстве;
- для профилактики полового пути передачи инфекции - исключение случайных половых связей либо использование механических контрацептивных средств;
- предупреждение профессиональных заражений в ЛПУ - неукоснительное соблюдение правил противоэпидемического режима, особенно в гемодиализных, хирургических, лабораторных и других отделениях, где персонал часто контактирует с кровью;
- при выполнении любых парентеральных вмешательств и процедур обязательно использование резиновых перчаток.
Учитывая многообразие путей передачи и большое количество источников возбудителей, наиболее перспективное средство профилактики этих инфекций - вакцинация, однако на сегодняшний день эту меру можно широко применять лишь в отношении ВГВ.
ВИЧ-ИНФЕКЦИЯ (HIV-INFECTION)
Антропонозное вирусное заболевание, в основе патогенеза которого лежит прогрессирующее поражение иммунной системы и развитие вследствие этого вторичных оппортунистических инфекций и опухолевых процессов.
Краткие исторические сведения
В отдельную нозологическую форму заболевание выделено в 1981 г. после выявления в США большого числа молодых мужчин-гомосексуалистов, страдающих иммунодефицитом с проявлениями пневмоцистной пневмонии, саркомы Капоши. Развившийся симптомокомплекс получил название СПИД (синдром приобретенного иммунодефицита). Вскоре многочисленные случаи СПИДа были описаны среди наркоманов, сексуальных партнеров лиц, больных СПИДом, пациентов с гемофилией. Возбудитель - вирус иммунодефицита человека (ВИЧ) впервые одновременно идентифицировали Р. Галло в США и Л. Монтанье с сотрудниками в Парижском институте им. Пастера в 1983 г. В последующие годы было установлено, что развитию СПИДа предшествует многолетний малосимптомный период инфицирования ВИЧ, который медленно разрушает иммунную систему зараженного человека. Дальнейшие эпидемиологические исследования показали, что к моменту первого обнаружения СПИДа в США ВИЧ уже широко распространился в Африке и странах Карибского бассейна, а отдельные зараженные лица встречались во многих странах. В 1990-х годах инфекция вирусом иммунодефицита человека приняла характер пандемии, а в настоящее время случаи ВИЧ-инфекции зарегистрированы во всех странах земного шара.
Этиология
Возбудитель - вирус рода Lentivirus семейства Retroviridae. В настоящее время известны вирусы 2 типов - ВИЧ-1 и ВИЧ-2, различающиеся по строению генома и антигенным характеристикам. ВИЧ-1 широко
распространен, обладает выраженной изменчивостью, которая в сотни и тысячи раз превосходит изменчивость вируса гриппа. Из-за высокой скорости репликации вируса, большого количества мутаций у одного и того же больного накапливается множество близких вариантов вируса, называемых квазивидами.
В настоящее время ВИЧ-1 делят на 3 группы:
- M;
- N;
- О.
ВИЧ-1, наиболее распространенный в мире в силу своей изменчивости, имеет не менее 10 генотипов (субтипов) А, В, С, D, Е и т.д., отличающихся по аминокислотному составу друг от друга на 25-30%.
Внутри субтипа вариабельность составляет 5-20%. В России в настоящее время наиболее распространен подтип А. Встречается также подтип В и рекомбинантный подтип АВ. ВИЧ-2 был обнаружен в 1985 г. в Западной Африке.
Вирус имеет размер около 100 нм и сферическую форму, состоит из конусообразной сердцевины и двухслойной липопротеиновой оболочки, пронизанной гликопротеиновыми комплексами (шипами). Сердцевина вирусных частиц включает геном вируса, сердцевинные и матриксные белки, ферменты ревертазу и интегразу.
Геном образован двумя идентичными молекулами РНК, состоящими из структурных (gag, pol, env), регуляторных (rev, tat, nef, vpr) генов, а также генов, необходимых для созревания вирусных частиц и высвобождения их из клетки (гены vifvpu, vpt или vpx). Структурные гены кодируют синтез протеинов сердцевины, ферментов, а также гликопротеинов оболочки. Регуляторные гены руководят важными жизненными процессами вируса.
Главные сердцевинные белки вирусов р24 (ВИЧ-1) и р26 (ВИЧ-2) обладают свойствами группоспецифических Аг, гликопротеины вирусной оболочки gp41, gp120, gp160 - типоспецифических Аг. Gp120, имеющий участок специфического взаимодействия с клеточными рецепторами CD4, обеспечивает прикрепление вируса к мембранам поражаемых клеток макроорганизма, gp41 - проникновение вируса в клетки. Размножение вируса происходит главным образом в Т-лимфоцитах. После слияния вирусной оболочки с клеточной мембраной и высвобождения вирусной РНК фермент ревертаза, обладающая рибонуклеазной активностью, обеспечивает синтез ДНК на матрице РНК. Интеграза встраивает ДНК провируса в геном клетки. Сборка вирионов происходит в цитоплазме, а высвобождение вирусных частиц из клетки - путем поч-
кования. Полный жизненный цикл вируса реализуется довольно быстро, всего за 1-2 сут. За 1 день формируется до 1 млрд вирионов. Возможны генетические ошибки в процессе репродукции вируса, которые обусловливают его высокую изменчивость.
ВИЧ чувствителен к внешним воздействиям:
- УФ-излучению;
- ионизирующей радиации;
- нагреванию до 70-80 °С;
- действию спирта, эфира и других дезинфектантов (инактивируется за 5-10 мин).
Вместе с тем вирус сохраняется при комнатной температуре до 4 сут, в высохшей крови до 2 нед, в замороженной сперме несколько месяцев, а в донорской крови может сохраняться годами.
Эпидемиология
Резервуар и источник инфекции - инфицированный ВИЧ человек, во всех стадиях инфекции, пожизненно. Природный резервуар ВИЧ-2 - африканские обезьяны. Природный резервуар ВИЧ-1 не выявлен, не исключается, что это могут быть дикие шимпанзе. В лабораторных условиях ВИЧ-1 вызывает у шимпанзе и некоторых других видов обезьян клинически не выраженную инфекцию, заканчивающуюся быстрым выздоровлением. Другие животные к ВИЧ не восприимчивы.
В большом количестве вирус содержится в крови, сперме, менструальных выделениях и вагинальном секрете. Кроме того, вирус обнаруживают в женском молоке, слюне, слезной и спинномозговой жидкостях. Наибольшую эпидемиологическую опасность представляют кровь, сперма и вагинальный секрет.
Очаги воспаления или нарушение целостности слизистых оболочек половых органов (например, эрозия шейки матки) повышают вероятность передачи ВИЧ в обоих направлениях, становясь выходными или входными воротами для инфекции. Вероятность заражения при единичном половом контакте низкая, однако частота половых сношений делает этот путь наиболее активным. Бытовая передача вируса не установлена. Передача ВИЧ от матери плоду возможна при дефектах плаценты, приводящих к проникновению ВИЧ в кровоток плода, а также при травматизации родовых путей и ребенка во время родов.
Парентеральный путь также реализуется при переливании крови, эритроцитарной массы, тромбоцитов, свежей и замороженной плазмы.
Внутримышечные, подкожные инъекции и случайные уколы инфицированной иглой составляют в среднем 0,3% случаев (1 случай на 300 инъекций). Среди детей, родившихся от инфицированных матерей или вскармливавшихся ими, инфицированы 25-35%. Возможно заражение ребенка во время родов и через женское молоко.
Естественная восприимчивость людей
Естественная восприимчивость людей высокая. В последнее время рассматривают возможность существования незначительных генетически отличающихся групп населения, встречающихся особенно часто среди североевропейских народов, реже заражающихся при половых контактах. Существование этих отклонений в восприимчивости связывают с геном CCR5. Люди с гомозиготной формой гена устойчивы к ВИЧ. Последние данные показывают, что причиной невосприимчивости к заражению ВИЧ могут быть специфические IgA, обнаруживаемые на слизистых оболочках половых органов. Люди, заразившиеся в возрасте старше 35 лет, заболевают СПИДом в 2 раза быстрее, чем инфицированные в более молодом возрасте.
Средняя продолжительность жизни нелеченных инфицированных ВИЧ составляет 11-12 лет. Однако появление эффективных химиопрепаратов позволило значительно продлить жизнь ВИЧ-инфицированных. Среди заболевших преобладают лица сексуально активного возраста, главным образом мужчины, но ежегодно увеличивается процент женщин и детей. В последние годы в России доминировал парентеральный путь инфицирования (при использовании одного шприца несколькими лицами), главным образом среди наркоманов. В то же время отмечают увеличение абсолютного числа передачи при гетеросексуальных контактах, что вполне объяснимо, так как наркоманы становятся источниками инфекции для своих половых партнеров. Показатель встречаемости ВИЧ-инфекции среди необследованных доноров резко возрос (более чем в 150 раз по сравнению с периодом начала эпидемии), кроме того, очень опасны доноры, находящиеся в периоде серонегативного окна. Выявляемость ВИЧ среди беременных в последние годы также резко возросла.
Основные эпидемиологические признаки
В настоящее время мир переживает пандемию ВИЧ-инфекции. Согласно данным ЮНЭЙДС/ВОЗ, в 2007 г. в мире проживало 33,2 (30,6-36,1) млн человек с ВИЧ, 2,5 (1,8-4,1) млн человек были впервые инфицированы ВИЧ и 2,1 (1,9-2,4) млн человек умерли от СПИДа.
Характерные особенности эпидемии ВИЧ/СПИДа в настоящее время.
• За последние годы количество ВИЧ-инфицированных увеличилось во всех регионах мира, но наиболее значительный рост эпидемии отмечался в Восточной, Юго-Восточной и Центральной Азии, а также Восточной Европе.
• Среди заболевших преобладают лица сексуально активного возраста, главным образом мужчины, но ежегодно увеличивается количество инфицированных женщин и детей.
• Основную роль в развитии эпидемии по-прежнему играет поведение с высокой степенью риска:
◊ потребление инъекционных психоактивных веществ;
◊ незащищенный коммерческий секс и др.
Если в первые годы появления заболевания наибольшее число случаев было зарегистрировано в США, то теперь инфекция наиболее широко распространена среди населения стран Африки, Латинской Америки, Юго-Восточной Азии. В ряде стран Центральной и Южной Африки до 15-20% взрослого населения заражено ВИЧ. В странах Восточной Европы, в том числе и в России, в последние годы отмечают интенсивный рост инфицированности населения. Первый случай ВИЧинфекции у гражданина России был зарегистрирован в 1987 г. Спустя 20 лет (к 31 декабря 2007 г.) общее число зарегистрированных инфицированных ВИЧ среди россиян достигло 416 113 человек, что составило 0,3% всего населения страны.
Наиболее пораженными ВИЧ-инфекцией группами населения стали:
- потребители наркотиков;
- работники коммерческого секса;
- заключенные.
Количество умерших от СПИДа за 1987-2007 гг. составило 3260 человек. За последние 5 лет в стране активизировалась передача инфекции от уязвимых групп основному населению половым путем. Среди впервые выявленных в 2007 г. были инфицированы ВИЧ при гетеросексуальных контактах 34,1%, а при употреблении наркотиков - 64,5%. Доминирующим путем передачи ВИЧ-инфекции для женщин стал половой (63%), а для мужчин - парентеральный (при внутривенном введении наркотиков). У 75% инфицированных впервые ВИЧ-инфекция была выявлена в возрасте 15-30 лет. Распространенность ВИЧ-инфекции среди населения административных территорий страны носит
неоднородный характер, 47 регионов России характеризуются весьма низким уровнем распространенности ВИЧ-инфекции (менее 0,1% среди всего населения). В данных регионах проживает 33% населения страны. На 16 территориях России, в которых проживает 29% населения страны, зарегистрировано более 0,3% людей, живущих с ВИЧ, среди всего населения.
Патогенез
Многие вопросы патогенеза ВИЧ-инфекции до настоящего времени остаются малоизученными.
Известно, что основу патогенеза составляет способность вируса избирательно поражать иммунокомпетентные клетки с развитием прогрессирующего иммунодефицита. ВИЧ способен проникать в любые клетки организма человека, имеющие поверхностные CD4+ рецепторы. Вирус поражает в основном Т- и В-лимфоциты, а также некоторые клетки моноцитарного ряда (макрофаги, лейкоциты, клетки Лангерганса, дендритные клетки), клетки нервной ткани и другие, содержащие на своей поверхности CD4+ рецептор, с которым специфически взаимодействует вирусный гликопротеин gp120 ВИЧ. В качестве корецепторов выступают рецепторы хемокинов CCR5 и CXCR4. Не исключено также рН-независимое слияние вирусной оболочки с клеточной мембраной и проникновением вируса в клетку. Таким образом, вирус может поражать эпителиальные, эндотелиальные и другие клетки, не содержащие CD4+ рецептор.
Инфицированные клетки играют важную роль в распространении ВИЧ как в отдельном организме, так и между индивидуумами.
Репродукция дочерней популяции ВИЧ вызывает деструкцию и гибель зараженной клетки. Вирусы выходят в кровь и внедряются в новые функционально активные лимфоциты. Непораженные вирусом лимфоциты прилипают к пораженным, образуя симпласты и синцитий, их функциональная активность снижается под воздействием токсичных веществ, образующихся при гибели клеток. Вместе с тем известно прямое иммуносупрессивное действие вирусных белков, например трансмембранного белка gp41, ингибирующего пролиферацию лимфоцитов.
Развитие иммунодефицита идет медленно и волнообразно, в течение месяцев и лет, поскольку уменьшение количества лимфоцитов сначала компенсируется продукцией новых иммунных клеток. По мере накопления вируса в организме, поражения им все более ранних популяций клеток вплоть до первичных стволовых и истощения лимфоидной ткани
прогрессирует разрушение иммунной системы, нарастает иммунодефицит с поражением всех звеньев иммунитета.
При взаимодействии вируса с рецепторной системой макрофагов нарушается его распознавание как чужеродного Аг. Макрофаги проявляют устойчивость к цитопатическому действию ВИЧ, могут быть резервуаром для этого вируса и способствовать его диссеминации в организме, в частности проникновению через гематоэнцефалический барьер в ЦНС. На более поздних стадиях заболевания развивающиеся поражения моноцитов и макрофагов приводят к нарушению презентации Аг иммунокомпетентным клеткам и ослаблению иммунного ответа.
Противовирусные АТ, синтезируемые неинфицированными лимфоцитами, проявляют сравнительно низкий аффинитет, что обусловлено свойствами АГ вируса, подверженных выраженной изменчивости вследствие высокой частоты вирусных мутаций. АТ не способны связывать вирус внутри инфицированных клеток. На первых этапах ВИЧинфекции наблюдается интенсивная поликлональная активация В-клеток, приводящая к резкому нарастанию в крови уровней иммуноглобулинов всех классов (полииммуноглобулинопатии) и ЦИК.
Белки ВИЧ могут играть роль супер-Аг, стимулирующих развитие аутоиммунных реакций, что приводит к разрушению не инфицированных CD4+ клеток. Накопление иммунных комплексов объясняет развитие у большинства ВИЧ-инфицированных артралгий и миалгий, васкулитов, поражений почек.
Вследствие развивающегося иммунодефицита иммунная система теряет способность противодействовать не только патогенным микроорганизмам, но и условно-патогенной и даже сапрофитной флоре, ранее латентно персистировавшей в различных органах и тканях. Активизация условно-патогенных микроорганизмов и сапрофитов обусловливает возникновение оппортунистических инфекций, вероятность которых значительно возрастает при снижении количества CD4+ лимфоцитов в 1 мкл менее 200 клеток.
При ВИЧ-инфекции происходит активное размножение бластных клеток, развитие которых остановилось на первых этапах клеточной дифференцировки. Эти клетки, не достигая полного созревания и представляя собой чужеродные для организма АГ, разрушаются при нормальном функционировании иммунной системы и безудержно размножаются в условиях иммунодефицита. Указанные процессы обусловливают возникновение у больного ВИЧ-инфекцией быстро прогрессирующих болезней злокачественного роста (Т-лимфома, саркома Капоши и др.).
Клиническая картина
Многообразие проявлений заболевания на различных этапах его развития вызывает необходимость применения в практической работе клинических классификаций ВИЧ-инфекции.
Согласно Российской классификации ВИЧ-инфекции (Покровский В.И., 2006) различают следующие стадии заболевания:
- стадия 1 - инкубации;
- стадия 2 - первичных проявлений;
- стадия 3 - субклиническая;
- стадия 4 - вторичных заболеваний;
- стадия 5 - терминальная.
• Стадия 1 (инкубации) - это период от момента заражения до появле-
ния реакции организма в виде клинических проявлений острой инфекции и (или) выработки АТ. Продолжительность ее обычно составляет от 3 нед до 3 мес, но иногда может продолжаться и дольше. В этот период идет активное размножение ВИЧ, однако клинических проявлений заболевания нет и АТ к ВИЧ еще не выявляются. Диагноз ВИЧ-инфекции на данной стадии ставится на основании эпидемиологических данных и лабораторно должен подтверждаться обнаружением в сыворотке крови пациента вируса иммунодефицита человека, его Аг, нуклеиновых кислот ВИЧ.
• Стадия 2 (первичных проявлений). В этот период активная репликация ВИЧ в организме продолжается, однако проявляется уже первичный ответ организма на внедрение этого возбудителя в виде клинических проявлений и (или) выработки АТ. Стадия ранней ВИЧ-инфекции может протекать в нескольких формах.
◊ Стадия 2А (бессимптомная), когда какие-либо клинические проявления ВИЧ-инфекции или оппортунистических заболеваний, развивающихся на фоне иммунодефицита, отсутствуют. Ответ организма на внедрение ВИЧ проявляется при этом лишь выработкой АТ.
◊ Стадия 2Б (острая ВИЧ-инфекция без вторичных заболеваний)
может проявляться разнообразной клинической симптоматикой (лихорадка, высыпания [уртикарные, папулезные, петехиальные] на коже и слизистых оболочках, увеличение лимфоузлов, фарингит). Могут отмечаться увеличение печени, селезенки, появление диареи. В крови больных с острой ВИЧ-инфекцией могут обнаруживаться широкоплазменные лимфоциты (мононуклеары).
◊ Острая клиническая инфекция отмечается у 50-90% инфицированных лиц в первые 3 мес после заражения. Начало периода острой инфекции, как правило, опережает сероконверсию, т.е. появление АТ к ВИЧ. В стадии острой инфекции часто отмечается транзиторное снижение уровня CD4+ лимфоцитов.
◊ Стадия 2В (острая ВИЧ-инфекция со вторичными заболеваниями). В 10-15% случаев у больных острой ВИЧ-инфекцией на фоне снижения уровня CD4+ лимфоцитов и развившегося вследствие этого иммунодефицита появляются вторичные заболевания различной этиологии (ангина, бактериальная и пневмоцистная пневмония, кандидозы, герпетическая инфекция и др.).
◊ Продолжительность клинических проявлений острой ВИЧинфекции варьирует от нескольких дней до нескольких месяцев, однако обычно она составляет 2-3 нед. У подавляющего большинства пациентов стадия начальной ВИЧ-инфекции переходит в латентную стадию.
• Стадия 3 (субклиническая) характеризуется медленным прогрессиро-
ванием иммунодефицита, компенсируемого за счет модификации иммунного ответа и избыточного воспроизводства CD4+ лимфоцитов. В крови обнаруживаются АТ к ВИЧ. Единственным клиническим проявлением заболевания будет увеличение двух и более узлов не менее чем в двух не связанных между собой группах (не считая паховых). Лимфатические узлы обычно эластичные, безболезненные, не спаяны с окружающей тканью, кожа над ними не изменена. Длительность латентной стадии может варьировать от 2-3 до 20 лет и более, в среднем 6-7 лет. В этот период отмечается постепенное снижение уровня CD4+ лимфоцитов, в среднем со скоростью 0,05- 0,07х109/л в год.
• Стадия 4 (вторичных заболеваний). Продолжающаяся репликация ВИЧ, приводящая к гибели CD4+ клеток и истощению их популяций, развитию на фоне иммунодефицита вторичных (оппортунистических) заболеваний, инфекционных и (или) онкологических. В зависимости от тяжести вторичных заболеваний выделяют стадии 4А, 4Б, 4В. В стадии вторичных заболеваний выделяют фазы прогрессирования (на фоне отсутствия противоретровирусного лечения или на фоне противоретровирусного лечения) и ремиссии (спонтанной или на фоне противоретровирусного лечения).
◊ Стадия 4А. При ней наблюдают: <8> потерю массы тела менее 10%;
<8> грибковые, вирусные, бактериальные поражения кожи, слизистых оболочек; <8> опоясывающий лишай; <8> повторные фарингиты; <8> синуситы;
<8> повышенную утомляемость.
• Фаза прогрессирования (на фоне отсутствия противоретровирусного лечения, на фоне противоретровирусного лечения).
• Фаза ремиссии (спонтанной, после ранее проводимого противоретровирусного лечения, на фоне противоретровирусного лечения).
◊ Стадия 4Б. Отмечают:
<8> потерю массы тела более 10%;
<8> необъяснимую диарею или лихорадку более 1 мес;
<8> волосистую лейкоплакию;
<8> туберкулез легких;
<8> повторные или стойкие вирусные, бактериальные, грибковые, протозойные поражения внутренних органов;
<8> повторный или диссеминированный опоясывающий лишай;
<8> локализованную саркому Капоши (см. рис. 23 на цветной вклейке);
<8> прогрессирующую общую слабость.
• Фазы (см. раздел «4А»).
◊ Стадия 4В. Отмечают: <8> кахексию;
<8> генерализованные бактериальные, вирусные, грибковые, про-
тозойные и паразитарные заболевания; <8> пневмоцистную пневмонию; <8> кандидоз пищевода, бронхов, легких; <8> внелегочный туберкулез; ® атипичные микобактериозы; ® диссеминированную саркому Капоши; <8> поражение ЦНС различной этиологии.
• Фазы (см. раздел «4А»).
• Стадия 5 (терминальная). В этой стадии имеющиеся у больных различные заболевания приобретают необратимый характер.
Клинически СПИД (по классификации В.И. Покровского стадия 4 - стадия вторичных заболеваний) может манифестировать угрожающими жизни оппортунистическими инфекциями и (или) злокачественными новообразованиями без предшествующих клинических симптомов
инфекции ВИЧ. Но зачастую клинике СПИДа предшествует комплекс симптомов, получивших название СПИД-ассоциированного комплекса.
Под СПИД-ассоциированным комплексом подразумевают комплекс постоянных симптомов, развивающихся у носителей ВИЧ, не имеющих присущих развернутой стадии СПИДа оппортунистических инфекций и злокачественных новообразований.
Эти клинические и лабораторные симптомы включают в себя:
- генерализованную лимфоаденопатию;
- похудание;
- перемежающуюся лихорадку;
- утомляемость;
- хроническую диарею;
- лейкопению;
- анемию;
- иммуноопосредованную тромбоцитопению и (или) панцитопению;
- кандидоз ротовой полости;
- иногда присоединение синдрома истощения (похудание на 10% и более).
Особенности клиники ВИЧ-инфекции у детей
Частым клиническим проявлением ВИЧ-инфекции у детей бывает задержка темпов психомоторного и физического развития.
У детей чаще, чем у взрослых, встречаются рецидивирующие бактериальные инфекции, а также интерстициальные лимфоидные пневмониты и гиперплазия пульмональных лимфоузлов, энцефалопатия. Часто встречается тромбоцитопения, клинически проявляющаяся геморрагическим синдромом, который может быть причиной смерти детей. Нередко развивается анемия.
ВИЧ-инфекция у детей, рожденных от ВИЧ-инфицированных матерей, характеризуется быстро прогрессирующим течением. У детей, зараженных в возрасте старше 1 года, заболевание, как правило, развивается более медленно.
Дифференциальная диагностика
Главным клиническим признаком ВИЧ-инфекции является увеличение лимфатических узлов нескольких групп, встречающееся у 60-80% зараженных во всех периодах болезни, а на ранних стадиях заболевания - это единственный симптом. Поэтому дифференцировать
ВИЧ-инфекцию приходится со всеми заболеваниями, протекающими с увеличением лимфоузлов.
Выделяют следующие клинические признаки-индикаторы, позволяющие заподозрить ВИЧ-инфекцию:
- похудание на 10% массы тела и более в течение нескольких месяцев без видимых причин;
- стойкая беспричинная лихорадка в течение 1 мес и более;
- беспричинная диарея в течение 1 мес и более;
- беспричинное увеличение более чем 2 групп лимфатических узлов (исключая паховые) на протяжении более 2 мес;
- постоянное и необъяснимое ночное потоотделение;
- быстрая утомляемость, заставляющая все больше времени проводить лежа;
- анемия, лейкопения, тромбоцитопения, панцитопения. Кроме того, следует подумать о ВИЧ-инфекции при выявлении:
- пневмоцистной пневмонии;
- хронических интерстициальных пневмоний с лимфоидной инфильтрацией (у детей младше 13 лет);
- гистологически подтвержденной саркомы Капоши (см. рис. 23 на цветной вклейке) у лиц моложе 60 лет;
- бронхиального или легочного кандидоза;
- криптоспоридиоза кишечника;
- диссеминированного гистоплазмоза;
- криптококкового менингоэнцефалита;
- токсоплазмоза мозга;
- ЦМВ-хориоретинита;
- злокачественных лимфом.
Их проявления позволяют предполагать ВИЧ-инфекцию, но они могут развиваться и при других иммунодефицитных состояниях:
- после лучевой терапии;
- длительного применения глюкокортикостероидов.
Список СПИД-индикаторных инфекций и опухолей постоянно расширяется.
Лабораторная диагностика
Выделение вируса на практике не проводят. В практической работе более популярны методы определения АТ к ВИЧ в сыворотке или плазме крови. Первоначально АТ выявляют методом ИФА, при положитель-
ном результате ИФА сыворотку крови исследуют методом иммуноблоттинга (Western Blot). Он позволяет разделить специфические АТ к различным белкам ВИЧ с их идентификацией. При выявлении АТ по крайней мере к 2 из 3 поверхностных белков вируса p41, p120, p160 ставится окончательный диагноз.
Отрицательный результат иммуноблоттинга при клинических и эпидемиологических подозрениях на ВИЧ-инфекцию не отвергает возможность данного заболевания и требует повторения лабораторного исследования. Это объясняется, как уже говорилось, тем, что в инкубационном периоде заболевания АТ еще нет, а в терминальной стадии, вследствие истощения иммунной системы, они уже перестают вырабатываться. Выявление АТ у новорожденных, родившихся от ВИЧ-инфицированных матерей, может быть результатом пассивного трансплацентарного иммунитета и не будет показателем инфекции в течение 18 мес жизни ребенка (период персистенции материнских АТ).
Наиболее перспективна ПЦР, позволяющая на всех стадиях болезни обнаружить частицы РНК вируса или провирусной ДНК.
При установлении диагноза ВИЧ-инфекции проводят многократное исследование иммунного статуса в динамике и вирусную нагрузку для контроля за прогрессированием болезни и эффективностью лечения.
Лечение
Радикальные методы лечения ВИЧ-инфекции до настоящего времени не разработаны. Антиретровирусное лечение проводится с целью снижения вирусной нагрузки, вследствие чего частично восстанавливается иммунитет и снижается заболеваемость оппортунистическими инфекциями.
В мировой практике для подавления репродукции вируса применяют комбинации противовирусных препаратов 3 групп:
- нуклеозидные ингибиторы обратной транскриптазы, замещающие нормальные, необходимые для размножения вируса нуклеотиды на инертные, что приводит к ингибированию дальнейшего воспроизводства генома вируса;
- ненуклеозидные ингибиторы обратной транскриптазы;
- ингибиторы протеазы.
Показания к началу противоретровирусного лечения:
- уровень вирусной нагрузки более 100 000 копий РНК-ВИЧ;
- число CD4+ лимфоцитов ниже 350 в 1 мкл;
- клинические симптомы (см. клиническую классификацию);
- синцитий-образующий штамм ВИЧ.
Учитывая высокую мутационную способность ВИЧ, в настоящее время рекомендуют комбинированные схемы лечения, включающие препараты различных групп. Монотерапия недопустима.
Названия конкретных антиретровирусных препаратов, их описание, дозы и курсы лечения определяются национальными программами и приводятся в специальных руководствах. При использовании препаратов необходимо учитывать степень развития их отрицательных побочных эффектов.
Кроме того, проводят интенсивное лечение имеющихся у больного оппортунистических инфекций, что требует применения разнообразных этиотропных средств. Назначение цитостатиков при опухолях усугубляет иммунодефицит. Иммуностимулирующая терапия не показана, так как способствует более быстрому прогрессированию заболевания.
Важным условием эффективности лечения является приверженность больного к лечению, заключающаяся в постоянном регулярном приеме антивирусных препаратов.
Диета пациентов с ВИЧ-инфекцией должна быть высококалорийной, насыщенной белками и витаминами. При выраженной хронической диарее необходимо ограничивать потребление пищи, содержащей растительные волокна, лактозу, кофеин, жир, зачастую назначать дополнительное питание, в том числе парентеральное введение питательных смесей, проводить коррекцию водно-электролитных нарушений.
Эпидемиологический надзор
Информация о заражении ВИЧ, необратимость и фатальный прогноз вызывают у инфицированного тяжелые эмоциональные реакции, вплоть до суицида. Поэтому создание охранительного режима будет важнейшей терапевтической мерой. Консультирование и психологическая поддержка ВИЧ-инфицированных, так же как и назначение лекарственного лечения, осуществляется с их добровольного согласия.
Включает в себя:
- выявление заразившихся;
- обязательную регистрацию и учет ВИЧ-инфицированных, числа обследованных;
- определение причины (путь) инфицирования.
Вся информация накапливается на федеральном уровне и подлежит анализу по полу, возрасту, социальному положению, территории заражения, факторам риска, путям заражения. В результате идентифицируют группы риска, территории риска, причины и условия заражения, пути распространения инфекции. Полученную информацию в виде бюллетеней или аналитических обзоров доводят до сведения всех заинтересованных лиц и рассылают по регионам.
Для эпидемиологического надзора за ВИЧ-инфекцией на территории РФ функционируют:
- Федеральный научно-методический центр по профилактике и борьбе с ВИЧ;
- региональные и территориальные центры;
- диагностические лаборатории;
- кабинеты анонимного обследования.
В настоящее время в России функционирует более 100 территориальных центров по профилактике и борьбе со СПИДом и более 1000 лабораторий диагностики ВИЧ-инфекции. Центры СПИД в соответствии с возложенными на эти организации функциональными обязанностями обеспечивают осуществление всего комплекса мероприятий по противодействию эпидемии ВИЧ-инфекции в регионах страны и оказывают бесплатную комплексную помощь пациентам с ВИЧ. Эпидемиологический надзор за ВИЧ-инфекцией характеризуется единой регистрацией всех случаев ВИЧ-инфекции и всех обследований на ВИЧ, массовым добровольным тестированием населения на ВИЧ и проведением эпидемиологического расследования каждого случая ВИЧ-инфекции.
При осуществлении эпидемиологического надзора используется дополнительная информация, повышающая его достоверность:
- данные поведенческого надзора;
- надзора за БППП;
- парентеральными гепатитами, туберкулезом;
- данные о состоянии репродуктивного здоровья населения и мониторинга за циркуляцией резистентных к антиретровирусным препаратам вариантов возбудителя.
Начиная с 1990 г. ежегодно 15-17% населения России (20-24 млн человек) обследуют на ВИЧ. Максимальное количество впервые выявленных случаев ВИЧ-инфекции в России (88 000 человек) было зарегистрировано в 2001 г. Начиная с 2003 г. ежегодное количество вновь выявляемых случаев ВИЧ-инфекции в значительной мере стабилизировалось и составляет в среднем около 35-40 000 в год.
Профилактические мероприятия
ВОЗ выделяет 4 основных направления деятельности, направленной на борьбу с эпидемией ВИЧ-инфекции и ее последствиями.
• Предупреждение половой передачи ВИЧ, включающее:
◊ обучение безопасному половому поведению;
◊ распространение презервативов;
◊ лечение других ЗППП;
◊ обучение поведению, направленному на сознательное лечение этих болезней.
• Предупреждение передачи ВИЧ через кровь путем снабжения безопасными препаратами, приготовленными из крови.
• Предупреждение перинатальной передачи ВИЧ методами распространения информации о предупреждении передачи ВИЧ путем обеспечения медицинской помощи, включая консультирование женщин, инфицированных ВИЧ, и проведение химиопрофилактики.
• Организация медицинской помощи и социальной поддержки больным ВИЧ-инфекцией, их семьям и окружающим.
Передачу ВИЧ половым путем можно прервать обучением населения безопасному половому поведению, а внутрибольничную передачу инфекции - соблюдением противоэпидемического режима.
Профилактика включает:
- правильное половое воспитание населения;
- профилактику беспорядочных половых связей;
- пропаганду безопасного секса (использование презервативов). Особое направление - профилактическая работа среди лиц, употребляющих наркотики инъекционным путем (ПИН). Поскольку предупредить ВИЧ-инфицирование ПИН легче, чем избавить их от наркозависимости, нужно разъяснять способы профилактики заражения при парентеральном введении наркотиков. Снижение масштабов наркомании и проституции также входит в систему профилактики ВИЧ-инфекции.
В 1990 г. в России создана специализированная сеть учреждений, включающая территориальные, региональные и городские центры по профилактике и борьбе со СПИДом. Центры обеспечивают регистрацию, учет и расследование случаев ВИЧ-инфекции по месту жительства для выявления источников заражения и возможных контактов, диагностику, лечение, диспансеризацию ВИЧ-инфицированных, контроль
за качеством работы лабораторий, осуществляющих скрининг на ВИЧ-инфекцию, проведение профилактической работы с различными группами риска. Создание центров позволило обеспечить сохранение врачебной тайны и конфиденциальности в работе с ВИЧ-инфицированными и больными СПИДом. Принятый в 1995 г. Закон РФ «О предупреждении распространения в РФ заболевания, вызываемого вирусом иммунодефицита человека (ВИЧ-инфекция)» обеспечивает правовую основу мероприятий по борьбе с этим заболеванием и регулирует отношения больного, лечебного учреждения и общества.
В течение последних 2 лет в России достигнут существенный прогресс в области борьбы с эпидемией ВИЧ-инфекции и ее последствиями. На уровне президента и председателя Правительства РФ были приняты важные политические и экономические решения, позволившие провести существенные изменения в организации работы по противодействию эпидемии ВИЧ-инфекции. В 2006 г. под председательством президента России прошло заседание Президиума Госсовета РФ «О неотложных мерах по борьбе с распространением ВИЧ-инфекции в РФ». Президентом была поставлена задача снизить до минимума темпы распространения СПИДа в России и привлечь к просветительской работе по профилактике СПИДа бизнес, политические партии и гражданское общество. Ключевые изменения в области поддержки и осуществления комплекса мер по противодействию эпидемии ВИЧ-инфекции произошли в стране благодаря началу реализации приоритетного национального проекта в сфере здравоохранения по направлению «Профилактика ВИЧ-инфекции, гепатитов В и С, выявление и лечение больных ВИЧ» в 2006-2007 гг.
Для предупреждения передачи ВИЧ через кровь проводят обследование доноров крови, спермы, органов. Для предупреждения заражения детей подлежат обследованию на ВИЧ беременные. Пациентов с ЗППП, гомосексуалистов, наркоманов, проституток обследуют в основном в целях эпиднадзора.
Иностранные граждане, прибывающие в РФ более чем на 3 мес, предъявляют сертификаты обследования на ВИЧ-инфекцию при оформлении въездной визы.
Противоэпидемический режим в стационарах такой же, как при ВГВ, и включает в себя обеспечение безопасности медицинских манипуляций, донорской крови, медицинских иммунобиологических препаратов, биологических жидкостей, органов и тканей. Профилактика ВИЧ-инфицирования медицинского персонала сводится главным обра-
зом к соблюдению правил работы с режущими и колющими инструментами. В случае попадания инфицированной ВИЧ крови необходимо обработать кожу 70% спиртом, обмыть водой с мылом и повторно обработать 70% спиртом. В качестве превентивной меры рекомендован прием азидотимидина* в течение 1 мес. Подвергшийся угрозе заражения находится под наблюдением специалиста в течение 1 года. Средства активной профилактики до сих пор не разработаны.
Беременным ВИЧ-инфицированным назначают прием противоретровирусных препаратов в последние месяцы беременности и в родах в целях предотвращения рождения ВИЧ-инфицированного ребенка. Детям, рожденным от ВИЧ-инфицированных матерей, в первые дни жизни также назначают прием противоретровирусных средств, их сразу же переводят на искусственное вскармливание. Этот комплекс мероприятий позволяет снизить риск рождения инфицированного ребенка с
25-50 до 3-8%.
Мероприятия в эпидемическом очаге
При выявлении ВИЧ-инфицированного лица с ним проводят на конфиденциальной основе собеседование (консультирование), во время которого разъясняют ему причины инфицирования, последствия для здоровья, возможность лечения. Акцентируют внимание на способах предотвращения заражения окружающих, сообщают о возможности уголовного наказания за распространение ВИЧ. При сборе эпидемиологического анамнеза выясняют возможные факторы риска заражения. Предпринимают попытки выявить половых партнеров и партнеров по внутривенному введению наркотиков. С выявленными партнерами, независимо от того, инфицированы они или нет, проводят беседу о способах предотвращения заражения ВИЧ - это важнейшее противоэпидемическое мероприятие в очаге ВИЧ-инфекции. После этого партнерам предлагают на добровольной основе пройти обследование, которое может быть повторено с учетом того, что АТ могут появляться в течение года со времени последнего эпидемиологически значимого контакта с ВИЧ-инфицированным. При подозрении на внутрибольничное заражение проводят эпидемиологическое расследование в медицинских учреждениях. Все данные о ВИЧинфицированных и их партнерах рассматривают как врачебную тайну, за ее разглашение предусмотрена ответственность медицинских работников.
ГЕПАТИТ В (HEPATITIS B)
ВГВ - антропонозная вирусная инфекция из условной группы парентеральных гепатитов, характеризующаяся иммунологически опосредованным поражением гепатоцитов и протекающая в различных клинических формах - от латентной до хронической.
Краткие исторические сведения
Длительное время ВГВ называли сывороточным, парентеральным, ятрогенным, посттрансфузионным, шприцевым. Это подчеркивало парентеральный путь передачи возбудителя через поврежденные кожный покров и слизистые оболочки (в отличие от вируса ВГА, передающегося фекально-орально).
В 1963 г. Б. Бламберг впервые выделил из крови австралийских аборигенов особый австралийский Аг, который впоследствии стали считать маркером сывороточного гепатита. Позднее Д. Дейн (1970) впервые выделил из сыворотки крови больных новый вирус и идентифицировал его как возбудитель сывороточного гепатита. Термин «гепатит В» утвержден Научной группой экспертов ВОЗ в 1973 г. взамен определения «сывороточный гепатит».
Этиология
Возбудитель ВГВ - ДНК-геномный вирус (HВV) рода Orthohepadnavirus семейства Hepadnaviridae. Он представляет собой частицу сферической формы диаметром 42 нм, которая состоит из ядра (нуклеоида) и наружной оболочки. Внутри ядра находится двухцепочечная ДНК и фермент ДНК-полимераза. В состав нуклеотида входят HBcAg и HBeAg. Наружную оболочку вируса образует поверхностный Аг гепатита В - HesAg.
В геноме вируса идентифицировано 4 гена, кодирующие соответственно синтез РНК-зависимой ДНК-полимеразы (ген Р), белков оболочки вируса - HBsAg, ответственных за прикрепление вируса к гепатоциту (ген S), ядерного Аг - HBcAg (ген С) и белка, активирующего экспрессию всех генов вируса гепатита B [HBV] (ген Х). Известно 8 разновидностей генотипа HBV, в европейской популяции 90% случаев ВГВ вызвано генотипами А и D.
У вирионов выделяют 4 Аг - поверхностный (HBsAg) и 3 внутренних (HBeAg, HBcAg и HBxAg).
Поверхностный HBsAg и сердцевинный HBcAg - это основные Аг вируса. HBsAg свидетельствует о персистенции вируса в организме, которая может быть длительной. Он имеет относительно низкую иммуногенность, термостабильность и устойчивость к протеазам и детергентам.
Известно несколько подтипов HBsAg, отличающихся субдетерминантами:
- adw;
- adr;
- ayw;
- ayr.
Общей антигенной детерминантой служит α-детерминанта, поэтому поствакцинальный иммунитет будет защитным по отношению к любому субтипу вируса. В России регистрируют в основном субтипы ayw и adw. Клинические проявления болезни не зависят от субтипа вируса. HBcAg (сердцевинный, или коровый, Аг) играет важную роль в репродукции вируса. При инфекционном процессе он выявляется только в ядрах гепатоцитов. АТ против HBsAg и HBcAg появляются в течение заболевания. Повышение титра АТ против HBcAg напрямую связано с формированием противовирусных иммунных реакций.
HBeAg локализуется не только в сердцевине вируса, он циркулирует в крови в свободном виде или связан с АТ. Аг отражает высокую степень репликации вируса, в связи с чем его определяют как Аг инфекционности.
HBxAg остается менее изученным. Предположительно, он активизирует репликацию вируса и злокачественную трансформацию клеток печени.
С помощью электронной микроскопии установлено, что имеется 2 формы вируса:
- полные частицы, содержащие ДНК ВГВ;
- неполные частицы, содержащие только HBsAg без ДНК. HBV чрезвычайно устойчив во внешней среде. В условиях комнатной
температуры сохраняется в среднем в течение 1 мес, в цельной крови и ее препаратах - годами. Вирус противостоит действию практически всех дезинфицирующих средств и консервантов крови, устойчив к лиофилизации, УФО. Возбудитель инактивируется при автоклавировании (120 °С, 45 мин), стерилизации сухим жаром (180 °С, 60 мин). Частицы ВГВ чувствительны к эфиру и неионным детергентам, которые разрушают внешнюю оболочку вириона.
Эпидемиология
Источник инфекции - лица с манифестными или субклиническими формами заболевания (больные острым и хроническим гепатитами, с циррозом печени и так называемые здоровые вирусоносители). В крови больного вирус появляется задолго до проявления болезни (за 2-8 нед до повышения активности аминотрансфераз) и циркулирует в течение всего острого периода болезни, а также при хроническом носительстве, формирующемся в 5-10% случаев. По оценкам специалистов, в мире насчитывают 300-350 млн вирусоносителей, каждый из которых представляет реальную угрозу как источник возбудителя инфекции. Заразность источников инфекции определяют активность патологического процесса в печени и концентрация Аг ВГВ в крови. Инфицирующая доза составляет 0,000 000 1 мл сыворотки, содержащей ВГВ.
Выделение вируса с различными биологическими секретами (кровь, слюна, моча, желчь, слезы, грудное молоко, сперма и др.) определяет множественность путей передачи инфекции. Однако только кровь, сперма и, возможно, слюна представляют реальную эпидемиологическую опасность, так как в других жидкостях концентрация вируса очень мала. Заболевание передается главным образом парентеральным путем при переливаниях крови и кровезаменителей, при использовании медицинских инструментов без их достаточно эффективной стерилизации. Процент посттрансфузионного ВГВ в последние годы значительно уменьшился. Около 50% больных инфицируются при осуществлении различных лечебно-диагностических процедур, сопровождающихся нарушением целостности кожного покрова или слизистых оболочек (инъекции, стоматологические процедуры, гинекологическое обследование и т.д.).
Из естественных механизмов передачи реализуется контактный (половой) путь, а также передача вируса через различные контаминированные предметы обихода (бритвы, зубные щетки, полотенца и т.д.) при проникновении возбудителя в организм через микротравмы на коже и слизистых оболочках. Заражение происходит также в результате нанесения татуировки, прокола мочек ушей и других манипуляций. Половой путь передачи ВГВ реализуется при гомо- и гетеросексуальных контактах. Вирус проникает через микротравмы слизистых оболочек при половых контактах.
Контактно-бытовой путь передачи инфекции:
- внутрисемейное инфицирование;
- инфицирование в организованных коллективах детей и взрослых.
Главную опасность представляют носители ВГВ при тесном общении в этих коллективах.
Возможна также и вертикальная передача возбудителя. Обычно заражение происходит во время родов, однако инфицирование плода возможно в матке при разрыве плаценты. Опасность передачи инфекции возрастает в десятки раз, если у женщины имеется не только HBsAg, но и HBeAg. Если не проводить специальных профилактических мероприятий, ВГВ инфицируется до 90% детей, родившихся от матерейвирусоносителей.
Доля естественных путей заражения составляет 30-35% и имеет тенденцию к увеличению.
Серьезную опасность представляет распространение ВГВ в коллективах с круглосуточным пребыванием детей:
- в домах ребенка;
- детских домах;
- интернатах.
Эти дети, как правило, имеют отягощенный анамнез и часто подвергаются парентеральным лечебно-диагностическим процедурам. Угроза заражения ВГВ существует и для медицинских работников домов ребенка, осуществляющих уход за детьми.
Естественная восприимчивость людей
Естественная восприимчивость высокая. Известно, что переливание крови, содержащей HBsAg, приводит к развитию гепатита у 50-90% реципиентов, в зависимости от инфицирующей дозы. Постинфекционный иммунитет длительный, возможно, пожизненный. Повторные случаи заболеваний наблюдают исключительно редко.
Основные эпидемиологические признаки
ВГВ относят к числу повсеместно распространенных инфекционных болезней. Считается, что вирусом инфицированы около 2 млрд человек, ежегодно умирают порядка 2 млн больных. На поздних этапах заболевания возникает угроза развития опухоли и цирроза печени, особенно у лиц, инфицированных еще в детстве. В ряде стран вирус ВГВ ответственен за 80% всех случаев первичной гепатоцеллюлярной карциномы. На долю ВГВ приходится около половины всех клинических гепатитов, и смертность от острого ВГВ составляет около 1%.
Заболеваемость ВГВ связана в основном с плохими социальными и экономическими условиями жизни. Весь мир можно разделить на регионы с высокой, промежуточной и низкой эндемичностью. В России,
которую относят к регионам с относительно высоким уровнем распространенности ВГВ, в последние годы в результате проведения дополнительной иммунизации населения против гепатита В в рамках приоритетного национального проекта в сфере здравоохранения отмечается устойчивое снижение заболеваемости ВГВ. В 2007 г. показатель на 100 000 населения составил 5,28. Только за этот год в России вакцинировано против гепатита В 9 851 256 человек, в том числе детей - 2 986 666. За весь период с начала вакцинации в 1996 г. в стране иммунизировано 39 013 673 человека, или 27,3% населения.
В ряде субъектов РФ показатель заболеваемости превышает федеративный. Наибольшие показатели зарегистрированы в Агинском Бурятском автономном округе (16,07), Кемеровской (14,2), Ленинградской (9,6) областях, Республике Тыва (9,4), Иркутской области (9,4), Алтайском крае (9,2). В структуре заболевших ВГВ основной удельный вес составляют взрослые (97%). Среди детей до 17 лет в 2007 г. зарегистрирован 221 случай ВГВ, показатель на 100 000 данного возраста составил 0,8, что в 6,6 раза меньше российского показателя (5,28). Наиболее пораженными оказались подростки 15-17 лет, которые составили 57% всех заболевших детей, показатель на 100 000 - 1,96 (2006 г. - 5,06). Обращает на себя внимание высокий уровень заболеваемости среди детей до 1 года, показатель на 100 000 данного возраста 1,65, что в 2 раза выше показателя по детям по России (0,8). Остается высоким уровень носительства возбудителя ВГВ среди населения. Темпы снижения носительства значительно отстают от темпов снижения заболеваемости ВГВ. За 10 лет показатель заболеваемости ВГВ уменьшился в 7 раз - с 35,9 в 1998 г. до 5,3 в 2007 г., а показатель носительства - в 2 раза (соответственно 91,9 и 42,66). Среди здоровых носителей высокий процент невыявленных бессимптомных форм инфекции. Есть все основания полагать, что скрыто протекающий эпидемический процесс при ВГВ по своей интенсивности и темпам прироста показателей превышает манифестный.
В эпидемический процесс интенсивно вовлекается молодое трудоспособное население. Среди заболевших преобладают лица в возрасте от 15 до 30 лет, на долю которых приходится около 90% заболевших. Такой возрастной состав заболевших гепатитом обусловлен тем, что в структуре путей инфицирования доминирует наркозависимый и половой пути передачи инфекции. В 1999 г. в Москве половым путем заразилось 51,5% лиц, при внутривенном введении наркотических средств - 30,1%. Молодые люди в возрасте до 30 лет, употреблявшие наркотики,
составляют (по данным формы Госстатучета ? 2) 80% умерших от ВГВ. Значительная часть летальных исходов (до 42%) обусловлена одновременным инфицированием ВГВ, ВГС и ВГО. В настоящее время в нашей стране проблема парентеральных гепатитов, по сути, из медицинской превращается в социальную.
Среди заболевших преобладают лица, подвергавшиеся гемотрансфузиям и другим медицинским парентеральным манипуляциям. Группы риска составляют медицинские работники, в процессе своей профессиональной деятельности соприкасающиеся с кровью и ее препаратами (хирурги, стоматологи, работники гемодиализа, лабораторий и др.), а также наркоманы (особенно в последние годы) при пользовании единым шприцем и заражении друг от друга половым путем. Характерен семейный характер заболеваемости, где активно реализуются половой и контактный пути заражения. В различных регионах мира преобладают различные основные пути распространения инфекции. В высокоразвитых странах с исходно благоприятной эпидемической обстановкой более 50% новых случаев ВГВ обусловлено половым путем передачи инфекции. Подростки и молодые люди в силу их активной половой жизни составляют группу особенно высокого риска заражения ВГВ. В регионах с низкой эндемичностью большое значение в передаче вируса ВГВ имеет заражение парентеральным или чрескожным путем. В регионах с высокой эндемичностью наиболее обычным путем передачи инфекции бывает перинатальное заражение ребенка от матери. Приблизительно 5-17% беременных выступают носителями вируса ВГВ.
Патогенез
Вирус проникает в организм человека через поврежденные кожные покровы или слизистые оболочки, затем гематогенно диссеминирует в печень, где фиксируется на мембране печеночных клеток благодаря поверхностным рецепторам наружной оболочки, содержащим HBsAg. Белки, входящие в состав этого Аг, ответственны за прикрепление и проникновение вируса в гепатоциты.
Процесс репродукции в гепатоцитах обусловлен активностью ДНКполимеразы, активно участвующей в достройке неполноценной цепочки вирусной ДНК за счет Аг гистосовместимости, общих для различных клеток организма хозяина. Дочерние популяции накапливаются в поверхностной мембране гепатоцитов.
Возбудитель не оказывает прямого цитопатического действия на гепатоциты. Цитолиз печеночных клеток происходит под действием цитотоксических иммунных механизмов. Мишенями для последних являются антигенные детерминанты HBV, ассоциированные с Аг главного комплекса гистосовместимости (HLA) на поверхности гепатоцитов.
Существенную роль в патогенезе ВГВ играют иммунные комплексы, образующиеся в большом количестве в процессе распада гепатоцитов и, при избытке Аг, оседающие на эндотелии сосудов различных органов и в лимфатических узлах, обусловливая внепеченочные поражения (например, гломерулонефрит и узелковый периартериит).
Аутоиммунные реакции возникают также в ответ на воздействие фрагментов гепатоцитов (печеночно-специфический липопротеин, фрагменты мембран митохондрий и т.д.) после их гибели. Это ведет не только к элиминации указанных фрагментов, но и к повреждению здоровых печеночных клеток. Таким образом, исход острого ВГВ зависит от иммунного ответа макроорганизма, определяющего многообразие клинических форм заболевания.
Морфологические изменения характеризуются дистрофическими и некробиотическими процессами в центролобулярных и перипортальных зонах печеночной дольки с последующим развитием фиброза. Одновременно в процесс вовлекаются внутрипеченочные желчные канальцы, повреждение или смещение которых ведет к формированию холестаза.
Клиническая картина
Инкубационный период
При острой циклической форме ВГВ его длительность подвержена большим колебаниям и варьирует от 30 до 180 дней и более. Циклическое течение острого гепатита В обычно наблюдается у лиц с адекватным, сбалансированным В- и Т-клеточным иммунным ответом. При этом заболевание проявляется последовательной сменой дожелтушного, желтушного и восстановительного периодов, протекает в среднетяжелой форме и заканчивается полным выздоровлением в 90% случаев. У 10% лиц развивается хронический процесс с возможным исходом в цирроз печени. Уже в инкубационном периоде в крови у пациентов можно выявить специфические маркеры ВГВ - HBsAg и HBeAg.
Дожелтушный период
Дожелтушный период продолжается 2-7 дней. Он может протекать в тех же вариантах, что и при ВГА, но чаще встречают артралгический,
астеновегетативный и диспепсический варианты. При диспепсическом варианте выражены стойкая анорексия, постоянное чувство тошноты, периодическая рвота без каких-либо видимых причин. Следует заметить, что при гриппоподобном варианте дожелтушного периода при ВГВ катаральные признаки не характерны и только у небольшой части больных можно наблюдать повышение температуры тела. Вместе с тем больные нередко жалуются на суставные боли, при этом внешне суставы, как правило, не изменяются. Артралгии чаще бывают в ночное и утреннее время, а при движениях в суставах ненадолго исчезают. Их могут сопровождать высыпания на коже типа крапивницы. Сочетание артралгий и экзантемы обычно предвещает более тяжелое течение заболевания. В таких случаях клиническую картину дополняет повышение температуры тела, иногда до высоких цифр.
Диагностически информативны жалобы, говорящие о поражении печени:
- горечь во рту;
- чувство тяжести и тупые боли в правом подреберье. При клиническом и лабораторном исследовании отмечают:
- прогрессирующее увеличение печени при мягкой ее консистенции;
- повышение АЛТ;
- появление специфических серологических маркеров HBV- инфекции (HBsAg, HBeAg и anti-HBc-IgM).
Уже в дожелтушный период можно наблюдать головокружение, упорную сонливость и проявления геморрагического синдрома в виде кровотечений из носа и десен.
Желтушный период
Желтушный период начинается с потемнения мочи за счет выраженной билирубинурии, сочетающейся у большинства больных с ахолией стула. Самочувствие больных, как правило, не улучшается (как при ВГА), а в большинстве случаев ухудшается. Симптомы интоксикации (слабость, снижение аппетита, головные боли, нарушения сна, рвота) в желтушный период достигают наибольшей выраженности. Артралгии и экзантема исчезают, но нарастают диспепсические симптомы.
Желтуха при остром ВГВ в 65% случаев отсутствует, но при ее развитии иктеричность кожных покровов и слизистых оболочек прогрессирует медленно, достигая своего максимума за 7-10 дней. Возникает кожный зуд, нередко появляются симптомы повышенной ломкости сосудов (жгута, щипка и др.), геморрагии в виде петехий или синяков на коже.
При более тяжелом течении возникают кровоточивость десен, носовые кровотечения, а у женщин - ранний приход обильных менструаций. Моча приобретает темный цвет, у большинства пациентов кал ахоличен.
Больные обычно апатичны, испытывают головокружение, расстройства сна. Увеличенная, как правило, печень отчетливо болезненна при пальпации, достаточно мягкая по консистенции. Необходимо обратить внимание на то, что на фоне интенсивной желтухи нередко печень не увеличивается, что указывает на более тяжелое течение гепатита. В 50-60% случаев наблюдают спленомегалию. Пульс урежен, однако при более тяжелом течении можно наблюдать тахикардию. Тоны сердца приглушены, развивается небольшая артериальная гипотония. Значительно повышается активность аминотрансфераз (АСТ, АЛТ), отражающих процесс цитолиза гепатоцитов, выявляются маркеры активной фазы гепатита В (HBV-ДНК, HBcAg, HBeAg и anti-HBc-IgM).
При развитии выраженного холестаза (5-15% больных) нарастает зуд кожи, стойко держатся субфебрилитет, желтуха, темная моча и ахоличный стул, увеличенная, не уменьшающаяся в размерах печень. Повышаются и длительно сохраняются монотонные сывороточные показатели общего билирубина, ЩФ, γ-глютаминтрансферазы (ГГТ).
Течение желтушного периода длительное, затягивается от 2 до 4 нед, а иногда и до 4 мес.
Период реконвалесценции
Период реконвалесценции начинается с момента уменьшения или исчезновения комплекса диспепсических симптомов, после чего происходит медленное снижение билирубинемии. Что касается изменения размеров печени, то этот процесс иногда затягивается на несколько месяцев. При присоединении холестатического компонента заболевание приобретает торпидное течение. В связи с этим длительность периода реконвалесценции может варьировать от 1,5 мес до 1 года. Период реконвалесценции завершается появлением АТ anti-HBs, anti-HBc и anti-HBe-IgG и полной нормализацией печеночных проб.
Стертая форма
Помимо острого циклического течения заболевания, ВГВ может проявляться в виде стертой формы. Для нее характерны скудная клиническая симптоматика, но при этом высокая репликативная активность HBV, что в 5-10% случаев приводит к хронизации болезни с исходами в цирроз печени и гепатоцеллюлярную карциному.
Дифференциальная диагностика
Дифференциальную диагностику гепатита В проводят с теми же инфекциями, что и при гепатите А. В отличие от гепатита А гепатит В протекает в более тяжелой форме с выраженными симптомами интоксикации, интенсивной желтухой и нередко с геморрагическими проявлениями (подкожные кровоизлияния, носовые кровотечения). Большим подспорьем в дифференциальной диагностике являются указания на то, что больной в течение последних 6 мес переносил вмешательства с повреждением кожного покрова и слизистых оболочек или имел половые контакты с лицами, перенесшими гепатит В. Окончательный этиологический диагноз устанавливают с помощью реакций ИФА и ПЦР.
Лабораторная диагностика
Большую информативную ценность для диагностики ВГВ представляют следующие маркеры HBV-инфекции:
• HBsAg появляется в сыворотке крови перед клинической манифестацией болезни, достигает максимальной концентрации в период, близкий к развертыванию клинических симптомов и исчезает в фазе реконвалесценции;
• HBcAg обнаруживается в биоптатах печени (в ядрах гепатоцитов), но не в периферической крови, так как всегда окружен белком оболочки вируса;
• HBeAg при остром ВГВ обнаруживается в течение нескольких дней, иногда недель, косвенно указывая на HBcAg в ткани печени. Показатель высокой контагиозности, вследствие чего получил название Аг инфекционности, его обнаружение в крови имеет большое диагностическое значение, так как свидетельствует о массивном размножении вируса;
• Anti-HBc появляется в период разгара клинических симптомов ВГВ, в сочетании с anti-HBs относится к признакам постинфекционного иммунитета;
• Anti-HBc-IgM главным образом выявляют в острый период заболевания. Сохранение данного маркера более 6 мес указывает на высокую вероятность перехода ВГВ в хроническую форму (при остром гепатите обнаруживается в высоком титре, при хроническом - в низком);
• Anti-HBe обнаруживают в сыворотке крови у больных ВГВ по истечении острого периода болезни, а также у хронических бессимптомных носителей HBV;
• Anti-HBs выявляются в период реконвалесценции, вместе с anti-HBc свидетельствуют о развитии иммунитета. Изолированные anti-HBs выявляются у лиц, вакцинированных против ВГВ;
• HBV-ДНК обнаруживается методом ПЦР, приобретает все более возрастающее значение как маркер активной репликации вируса.
С помощью ИФА, РИА на высоте заболевания в сыворотке крови обнаруживают HBsAg, HBeAg, antiHBcIgM. В период ранней реконвалесценции определяют anti-HBc, anti-HBe, на стадии выздоровления - antiHBs и anti-HBc. Для верификации возбудителя все большее значение приобретает ПЦР, выявляющая вирусную ДНК, что определяет степень активности репликации вируса.
Биохимические исследования крови и изменения гемограммы приведены в разделе «Вирусный гепатит А». В динамике заболевания нужно достаточно часто повторять эти исследования для контроля за функциональной активностью печени. Особое значение в этом плане приобретает определение протромбинового индекса, уменьшение показателей которого ниже 40% говорит о тяжелом, а иногда критическом состоянии больного.
Определенные данные, свидетельствующие о нарушениях структуры печени, дает УЗИ.
Осложнения и исходы
Наиболее тяжелое и серьезное в плане прогноза осложнение - это острая печеночная энцефалопатия (печеночная кома). Она развивается при массивном цитолизе гепатоцитов и характеризуется глубоким угнетением функции печени, прогрессирующей психоневрологической симптоматикой и выраженными геморрагическими проявлениями. В своем клиническом развитии острая печеночная энцефалопатия проходит 3 последовательные стадии.
• Стадия I (прекома I). Характерны резкое ухудшение состояния больного, усиление желтухи и диспепсического синдрома (тошнота, повторная рвота), развитие геморрагических проявлений, появление печеночного запаха изо рта. Нарушаются ориентация во времени и пространстве, координация точных движений (пальценосовая и писчая пробы). Характерны замедление мышления, расстройства сна (сонливость днем и бессонница ночью), головокружение, чув-
ство провалов (ощущение падения в пропасть при закрывании глаз). Обращает на себя внимание эмоциональная неустойчивость больного - апатия, вялость, чувство тревоги, тоски, сменяющиеся возбуждением, эйфорией. Могут появиться боли в области печени, повышение температуры тела. Брадикардия или нормокардия сменяется тахикардией. У больных с портокавальной недостаточностью отмечают преходящие нарушения сознания.
• Стадия II (прекома II). Характерно глубокое нарушение сознания. Сознание часто бывает спутанным. Больные дезориентированы во времени и пространстве, эйфоричны или агрессивны. Возбуждение кратковременное и сменяется апатией. Усиливаются диспепсические симптомы (рвота), интенсивность желтухи и геморрагический синдром. Появляется тремор рук и кончика языка. Печень уменьшается в размерах (прогностически неблагоприятный признак!) и может стать недоступной для пальпации. Нарастает тахикардия, АД склонно к снижению. Может развиться отечно-асцитический синдром. Суммарная продолжительность обеих стадий прекомы - от нескольких часов до нескольких дней.
• Стадия III (кома). Отличается потерей сознания и вначале бывает неглубокой (кома I). Больные реагируют стоном на сильные раздражители (например, пальпацию печени). Глотательный и роговичный рефлексы сохранены. Появляются патологические рефлексы, непроизвольное мочеиспускание и дефекация. При глубокой коме (кома II) наступает арефлексия, утрачивается реакция на любые раздражители. Больные погибают от острой сердечно-сосудистой или полиорганной недостаточности, отека головного мозга.
Уже на начальных этапах развития острой печеночной энцефалопатии прогрессивно уменьшаются показатели протромбинового индекса, что имеет большое значение для оценки тяжести этого состояния.
Тяжелое фульминантное (молниеносное) течение ВГВ чаще отмечают у пациентов молодого возраста, особенно при микст-инфекции (сочетании ВГВ и ВГD или ВГВ и ВГС). Характерно быстрое и раннее развитие острой печеночной энцефалопатии с высоким процентом (до 90%) летальных исходов.
При острой печеночной энцефалопатии характерны присоединение вторичной инфекции с развитием сепсиса, прогрессивное ухудшение функции почек с уменьшением почечного кровотока и скорости клубочковой фильтрации, снижением концентрации натрия в моче, повышением ее плотности, уменьшением диуреза.
В большинстве случаев (свыше 90%) ВГВ завершается полным выздоровлением, с исчезновением из крови HBsAg и сохранением anti- HBs. У 5-10% больных ВГВ принимает хроническое течение.
Лечение
Больных с острым циклическим течением ВГВ госпитализируют. В легких и среднетяжелых случаях лечение аналогично таковому при ВГА. При тяжелом течении решают вопрос о назначении преднизолона по 40-60 мг в сутки внутрь. Снижение доз проводят постепенно с момента купирования симптомов интоксикации. Одновременно больным интенсифицируют дезинтоксикационное лечение (кристаллоиды и реополиглюкин* в соотношении 3:1 под контролем диуреза), проводят коррекцию нарушений водно-электролитного баланса и КЩС, при гипокалиемии назначают панангин*, аспаркам*, применяют дисахарид лактулозу* (нормазу*), спазмолитические препараты (но-шпа*, эуфил- лин*), назначают антибиотики с низкой резорбцией из кишечника (неомицин). В случаях выраженного холестаза рекомендованы препараты урсодезоксихолевой кислоты (уросан*, урсофальк*). По вопросу о целесообразности назначения глюкокортикоидов при развитии острой печеночной недостаточности нет единого мнения.
Использование гепатопротекторов при острых вирусных гепатитах ограничено, так как большинство из них направлено на активизацию микросомального аппарата гепатоцитов, который находится в состоянии субкомпенсации на фоне выраженных морфологических нарушений в архитектонике печени, в связи с чем подобная стимуляция физиологически не оправдана.
При острой печеночной энцефалопатии лечение больных обязательно проводят в условиях специализированного отделения интенсивной терапии и реанимации.
Эпидемиологический надзор
Эпидемиологический надзор за ВГВ представляет собой постоянное наблюдение за эпидемическим процессом, включая мониторинг заболеваемости, слежение за охватом иммунизацией населения, выборочный серологический контроль за состоянием иммунитета, распространением возбудителя, определение эффективности проводимых мероприятий и прогнозирование. Целью надзора за ВГВ является оценка эпидемиологической ситуации, тенденций развития эпидемического процесса для
принятия управленческих решений и разработки адекватных санитарнопротивоэпидемических (профилактических) мероприятий, направленных на снижение заболеваемости ВГВ, предупреждение формирования групповых заболеваний ВГВ, тяжелых форм и летальных исходов ВГВ.
Большое значение имеют определение доли ВГВ среди всех острых гепатитов, регистрация и учет хронических форм болезни. Анализ заболеваемости гепатитом проводят с учетом активности тех или иных путей заражения, определяющих социально-возрастную структуру заболевших. Серологический мониторинг основан на сборе информации о скрыто протекающем эпидемическом процессе ВГВ на популяционном, коллективном и индивидуальном уровнях.
Осуществляют оценку эпидемиологической эффективности вакцинации и других мер профилактики ВГВ среди различных групп населения, их социально-экономической значимости.
Профилактические мероприятия
В комплексе профилактических мероприятий первостепенное значение имеют меры, направленные на предупреждение заражений ВГВ при переливаниях крови и проведении лечебно-диагностических манипуляций. Всех доноров подвергают комплексному клинико-лабораторному обследованию на определение Аг вируса ВГВ. От донорства отстраняют лиц, перенесших ВГВ, независимо от срока давности, а также общавшихся с больными в течение последних 6 мес. К сдаче крови не допускают лиц, страдающих хроническим гепатитом (в том числе неясной этиологии) и подвергшихся за последние годы гемотрансфузии. Перспективным стало внедрение аутогемотрансфузий, когда больному переливают его же кровь, заготовленную до плановой операции. Неспецифическую профилактику ВГВ проводят путем применения одноразовых инструментов при манипуляциях, связанных с повреждением кожного покрова и слизистых оболочек, тщательной стерилизации медицинского инструментария, а также жесткого контроля по обнаружению вирусных Аг у доноров. Первостепенное значение имеют повсеместное внедрение и улучшение централизованной стерилизации изделий медицинского назначения.
Прерывание естественных путей передачи ВГВ обеспечивают санитарно-гигиенические меры:
- индивидуализация всех предметов личной гигиены и раздельное их хранение (бритвенные приборы, зубные щетки, мочалки, расчески и др.);
- выполнение правил личной гигиены;
- предупреждение микротравм в быту и на производстве.
Для профилактики полового пути передачи инфекции следует избегать случайных половых связей, использовать барьерные контрацептивные средства. Предупреждение профессиональных заражений в ЛПУ достигают путем неукоснительного соблюдения правил противоэпидемического режима, особенно в гемодиализных, хирургических, лабораторных и других отделениях, в которых персонал часто контактирует с кровью. При выполнении любых парентеральных вмешательств и процедур обязательно использование резиновых перчаток.
Учитывая многообразие путей передачи ВГВ и большое число источников инфекции, наиболее перспективное средство профилактики - это вакцинация. Именно она стала единственным средством профилактики ВГВ у новорожденных. Это первая вакцина, которая предотвращает раковое заболевание печени и снижает уровень носительства вируса в популяции. ВОЗ, обобщив многолетний опыт применения вакцины против ВГВ, рекомендует в качестве наиболее эффективной меры специфической профилактики этой инфекции введение вакцинации в национальные календари профилактических прививок вне зависимости от уровня носительства HBsAg. Сегодня есть все основания относить ВГВ к инфекциям, управляемым средствами специфической профилактики.
За последнее десятилетие массовая иммунизация позволила в ряде стран не только резко уменьшить заболеваемость ВГВ и существенно повлиять на уровень носительства в популяции, но и сделать правомерной постановку вопроса о полном искоренении в этих странах ВГВ. К 2007 г. 158 стран включили в свои программы вакцинации рутинную иммунизацию против ВГВ новорожденных и (или) подростков. В настоящее время во многих странах Европы и Америки проводят сочетанную вакцинацию против ВГВ в рамках РПИ детей. Общий охват прививками составил 65%. В соответствии с Приказом МЗ РФ (? 226/79 от 03.06.1996 г.), вакцинация против ВГВ включена в национальный календарь профилактических прививок. Специфическую профилактику ВГВ осуществляют путем применения одной из вакцин, разрешенных к использованию в РФ. Все вакцины против ВГВ взаимозаменяемы. Любую из них можно применять для завершения курса первичной иммунизации, начатой другой вакциной. Вакцину вводят внутримышечно, у детей и взрослых - в область дельтовидной мышцы, у новорожденных и маленьких детей - в переднебоковую поверхность бедра.
При сочетании с другими парентеральными вакцинами ее вводят отдельным шприцем в другой участок. Вакцины индуцируют образование специфических АТ к HBsAg. Титр anti-HBsAT, равный 10 МЕ/л, достаточен для создания невосприимчивости к ВГВ. Достижение такого уровня АТ после первичной иммунизации приводит к формированию долговременной иммунологической памяти и обеспечивает продолжительную защиту от ВГВ даже при дальнейшем падении уровня АТ. Иммунологическая память сохраняется по меньшей мере от 5 до 12 лет независимо от уровня АТ перед повторным ведением Аг. Вакцинации подлежат:
- медицинские работники из групп высокого риска заражения
ВГВ;
- выпускники медицинских вузов и техникумов;
- новорожденные, родившиеся от матерей-носителей HBsAg и женщин, переболевших ВГВ в III триместре беременности;
- дети и персонал детских домов и интернатов;
- пациенты, находящиеся в отделениях с высоким риском заражения ВГВ;
- лица, соприкасавшиеся с больными ВГВ в очагах заболевания по месту жительства.
Прививочный календарь России предусматривает проведение плановых прививок детям первого года жизни по 2 схемам (табл. 3-12).
• Для защиты детей, матери которых инфицированы вирусом ВГВ, а также в эндемичных районах (при частоте носительства HBsAg более 5%) прививки проводят в 1-й день жизни (лучше в первые 12 ч), в возрасте 1 мес и на 5-6-й месяц жизни.
• Всех остальных детей вакцинируют в 4-5 и 5-6 мес вместе с введением АКДС и ОПВ, а также в возрасте 12 мес вместе с ЖКВ, ЖПВ и краснушной вакциной.
• Старшие дети, подростки и взрослые также прививаются троекратно по схеме 0-1-6 мес, т.е. с интервалом 1 мес и затем - через 5 мес после 2-й прививки; в этом возрасте возможна и схема 0-2-4 мес.
Первая схема, т.е. вакцинация с месячным интервалом (0-1-2 мес), дает более быстрое нарастание АТ и рекомендована для экстренной профилактики (новорожденных от матерей-носителей HBsAg) и в случаях возможного заражения ВГВ при проведении оперативного вмешательства и других парентеральных манипуляций и лабораторных исследований. При этой схеме проводят ревакцинацию через 12-14 мес. При второй схеме, т.е. 2 первые инъекции с интервалом в 1 мес и 3-ю через
6 мес от начала прививок (0-1-6 мес), иммунный ответ вырабатывается медленнее, но достигается более высокий титр АТ.
В настоящее время предполагается, что длительность поствакцинального иммунитета составляет примерно 15 лет. Накопленный опыт свидетельствует, что проведение вакцинации приводит к снижению заболеваемости в 10-12 раз, а носительства HBsAg в популяции - с 9-12
до 1%.
Таблица 3-12. Схема профилактических прививок против вирусного гепатита В
Вакцинация | Схема вакцинации | |
Первая Вторая | ||
1 | Новорожденные перед прививкой БЦЖ в первые 24 ч жизни | 4-5 мес жизни ребенка, со 2-й прививкой АКДС и ОПВ |
2 | 1 мес жизни ребенка | 5-6 мес жизни ребенка, с 3-й прививкой АКДС и ОПВ |
3 | 5-6 мес жизни ребенка, с 3-й прививкой АКДС и ОПВ | 12-13 мес жизни ребенка, с вакцинацией против кори |
Ревакцинация | 7 лет | |
Все дети, родившиеся от женщин с ВГВ и ХГВ и носителей ВГВ, подлежат диспансерному наблюдению врачом-педиатром совместно с инфекционистом в детской поликлинике по месту жительства в течение первого года с биохимическим определением активности АЛТ и исследованием на HBsAg в 3, 6 и 12 мес.
Более половины всех случаев заболеваний среди медицинских работников приходится на первые 5 лет от начала работы, и основная их часть - при стаже от 1 до 5 лет. Это свидетельствует о необходимости обязательной вакцинации против ВГВ медработников до начала их профессиональной деятельности.
Вакцины против гепатита В могут применяться в целях экстренной профилактики инфекции. При случайной травме предметами, загрязненными кровью больных или носителей HBsAg, для экстренной профилактики ВГВ, а также для более эффективной профилактики инфицирования новорожденных вакцинацию проводят по схеме 0-1- 2-12 мес. Медицинским работникам после контакта с кровью больного или носителя 1-ю дозу вакцины вводят не позднее 72 ч после контакта.
В целях экстренной профилактики в ряде случаев сочетают с пассивной иммунизацией специфическим иммуноглобулином (иммуноглобулином человека против ВГВ). Протективный эффект иммуноглобулина сохраняется 1-6 нед.
Мероприятия в эпидемическом очаге
Заболевшие острой формой вирусного гепатита, а также больные хронической формой в период обострения подлежат обязательной госпитализации в инфекционную больницу или отделение, а с подозрением на это заболевание - в диагностическое отделение или боксы. Выписку реконвалесцентов и допуск их к работе (в том числе работников пищевых предприятий и лиц, к ним приравненных) или в детские учреждения осуществляют по клиническим показаниям. Переболевшие ВГВ подлежат диспансерному наблюдению сроком не менее 12 мес.
Упомянутых лиц снимают с учета при отсутствии хронического гепатита и двукратном отрицательном результате исследования на HBsAg, проведенном с интервалом 10 дней. Носителей HBsAg наблюдают в течение 2 лет. Обследование на Аг проводят сразу по выявлении, через 3 мес, а затем 2 раза в год до снятия с учета. Если Аг обнаруживают более 3 мес, то таких носителей расценивают как хронических; они подлежат наблюдению как больные хроническим гепатитом. В отношении других лиц в очаге ВГВ никаких ограничительных мер не проводят.
В очагах острого ВГВ за лицами, общавшимися с больным, устанавливается медицинское наблюдение сроком на 6 мес с момента госпитализации больного. Осмотр врачом проводится 1 раз в 2 мес с определением активности АЛТ и выявлением HBsAg, anti-HBs. Лица, у которых при первом обследовании выявлены anti-HBs в защитной концентрации, дальнейшему обследованию не подлежат. Результаты медицинского наблюдения вносят в амбулаторную карту больного. Контактные лица в очагах хронического ВГВ подлежат медицинскому осмотру и выявлению HBsAg и anti-HBs. За очагом проводят динамическое наблюдение в течение всего срока присутствия источника инфекции. Рекомендовано проведение иммунизации против ВГВ контактных лиц с больным острой или хронической формой ВГВ, носителем HBsAg, не привитых ранее или с неизвестным прививочным анамнезом.
Выделения больного и носителя, посуда, постельное и нательное белье, полотенца и т.д. подлежат обработке дезинфицирующими средствами. Экстренную профилактику проводят путем введения специфи-
ческого иммуноглобулина или вакцины (в соответствии с рекомендуемой схемой введения) при экстренных эпидемиологических ситуациях, т.е. при реальной угрозе заражения, например при случайном уколе или переливании инфицированной вирусом ВГВ крови.
ГЕПАТИТ С (HEPATITIS C)
ВГС - антропонозная вирусная инфекция из условной группы парентеральных гепатитов, характеризующаяся преимущественным поражением печени, преобладанием стертых и субклинических форм в острой фазе заболевания, выраженной склонностью к хронизации.
Краткие исторические сведения
До недавнего времени ВГС обозначался как вирусный гепатит ни А, ни В и считался одним из наиболее распространенных вирусных гепатитов. В 1989 г. M. Houghton и соавт. удалось создать тест-систему для выявления АТ к новому вирусу, а затем идентифицировать его РНК.
Этиология
Возбудитель - РНК-геномный вирус (HCV), включенный в состав рода Hepacivirus семейства Flaviviridae. Вирионы сферической формы, окружены суперкапсидом. Геном содержит однонитчатую РНК и отличается высокой мутабельностью. Замена аминокислот в гликопротеинах вируса изменяет его антигенные свойства, позволяя возбудителю противостоять нейтрализующему действию АТ. Выделяют 6 основных генотипов (1a, 1b, 2a, 2b, 3a и 4) и более чем 90 субтипов вируса. Наибольшее распространение имеют генотипы 1-3, генотип 1b считается наиболее вирулентным. Отдельные генотипы HCV различаются в преимущественном географическом распространении, например, в США преобладает генотип 1а, в Японии встречаются генотипы 1b, 2а и 2b, в Европе - генотипы 1a и 1b, на Ближнем Востоке и в Африке - генотип 4, вызывающий ВГС с хронизацией у 80-85% больных. Перекрестного иммунитета генотипы не дают.
Отличительная особенность вируса ВГС - это способность к длительной персистенции в организме, что объясняется его генетической неоднородностью, высокой изменчивостью и внепеченочной реплика-
цией HCV в недоступных для иммунного надзора местах (лимфатические узлы, селезенка, моноциты).
Поскольку вирус ВГС трудно размножается в культуре клеток, сведения о чувствительности вируса к воздействию факторов внешней среды малочисленны. Вирус чувствителен к эфиру, детергентам, действию УФО.
Эпидемиология
Резервуар и источник инфекции - больные хроническими и острыми формами болезни, протекающими как с клиническими проявлениями, так и бессимптомно. Сыворотка и плазма крови инфицированного человека заразны в течение периода, начинающегося с одной или нескольких недель до появления клинических признаков болезни, и могут содержать вирус неопределенно долгое время.
Механизм передачи аналогичен ВГВ, однако структура путей заражения имеет свои особенности. Это связано с относительно невысокой устойчивостью вируса во внешней среде и довольно большой инфицирующей дозой, необходимой для заражения. Вирус ВГС передается через зараженную кровь и в меньшей степени через другие биологические жидкости человека. РНК вируса обнаружена в слюне, моче, семенной и асцитической жидкостях.
К группам повышенного риска относят больных, которым многократно переливали кровь и ее препараты (например, факторы свертывания, плазма, альбумин, иммуноглобулины и т.д.), а также лиц, имеющих в анамнезе массивные медицинские вмешательства, пересадку органов от доноров с ВГС-положительной реакцией и многократные парентеральные манипуляции, особенно при повторном использовании нестерильных шприцев и игл. Распространенность ВГС среди наркоманов очень высока (70-90%), этот путь передачи представляет собой наибольшую опасность в распространении заболевания.
Риск передачи вируса повышают процедуры гемодиализа, нанесение татуировок, нарушение целостности кожи при инъекциях. Однако у 40-50% больных не удается выявить никаких парентеральных факторов риска, и способ передачи вируса при этих спорадических случаях остается неизвестным. Частота обнаружения АТ к вирусу ВГС среди медицинского персонала, подвергающегося опасности контакта с инфицированной кровью, не выше, чем в общей популяции. В результате проведения обязательного тестирования всех переливаемых доз консервированной
крови удалось достичь снижения количества случаев посттрансфузионного ВГС. Сохраняющийся минимальный риск связан главным образом с возможным острым периодом инфекции у донора, не диагностируемого с помощью скрининговых методов обнаружения АТ к вирусу ВГС. В то же время риск передачи ВГС с единичной случайной инъекцией, выполненной медицинским персоналом, незначителен, что объясняется низкой концентрацией вируса в небольших объемах крови.
Вертикальная передача ВГС от беременной к плоду редка, но возможна при высоких титрах вируса у матери или при сопутствующем инфицировании вирусом иммунодефицита человека. Роль половых контактов в передаче в ВГС достаточно невелика и составляет около 5-10% (при передаче ВГВ - 30%). Частота половой передачи возбудителя возрастает при сопутствующей ВИЧ-инфекции и большом количестве сексуальных партнеров. Определение идентичных генотипов ВГС в семьях подтверждает возможность (хотя и маловероятную) его бытовой передачи.
Естественная восприимчивость людей
Естественная восприимчивость высокая и в большой степени определяется инфицирующей дозой. Напряженность и длительность постинфекционного иммунитета не известны. В экспериментах на обезьянах показана возможность повторного заболевания.
Основные эпидемиологические признаки
Инфекция распространена повсеместно. По данным ВОЗ, в конце 1990-х годов около 1% населения мира было инфицировано ВГС. В Европе и Северной Америке распространенность инфекции составляет 0,5-2%, в ряде регионов Африки - 4% и выше. В России заболеваемость ВГС с начала ее регистрации (1994 г.) увеличивалась до 2002 г., когда уровень заболеваемости начал снижаться и за 6 лет достиг 3,4 на 100 000 населения против 7,1 в 2001 г. Одновременно происходило и снижение числа носителей HCV, но более медленными темпами. За 6 лет в стране накопилось около 2 млн носителей HCV. В некоторых субъектах РФ показатели заболеваемости значительно выше федеративного [Ленинградская (10), Амурская (8,5) области, Санкт-Петербург (7,8), Московская (6,9), Кемеровская (6,5) области]. Основной удельный вес в структуре заболевших острым ВГС, как и при остром ВГВ, составляют взрослые - 95,1%, на долю детей до 17 лет проходится 4,9%. Показатель на 100 000 детей составил 0,9, а среди детей до 1 года - 3,43. Еще более тяжелая ситуация сложилась с носительством HCV среди детей до 1 года.
В 2007 г. среди детей до 14 лет зарегистрировано 5855 случая носителей HCV, из них 4702 случаев - у детей до 1 года, что составляет 80,3%. Показатели на 100 000 соответственно 27,8 и 322,9. В РФ отмечается широкое распространение хронических гепатитов. За 8 лет, прошедших с момента официальной регистрации этих нозологических форм, сформировалась тенденция к неуклонному росту заболеваемости. Показатель на 100 000 населения в 2007 г. достиг 52,5 против 38,6 в 2000 г. (рост в 1,3 раза). В общей структуре хронических гепатитов основной удельный вес занимает хронический гепатит С - 70,4%, хронический гепатит В - 26,6%. В структуре заболевших хроническими гепатитами основной удельный вес составляют взрослые (97,9%), на долю детей до 17 лет приходится 2,2%.
Можно перечислить следующие факторы риска, ассоциированные с ВГС, которые во многом совпадают с ВГВ:
- переливание крови или трансплантация органов и тканей от инфицированных доноров;
- использование инъекционных наркотиков;
- гемодиализ (чем дольше его длительность, тем выше риск инфицирования);
- случайные травмы иглами и режущими предметами;
- половой и бытовой контакт с анти-ВГС позитивным лицом;
- множество половых партнеров;
- рождение от ВГС-инфицированной матери.
Основную группу заболевших составляют, как и при ВГВ, подростки и лица 20-29 лет. Число заразившихся в ЛПУ составляет 1-2% всех случаев инфекции. ВГС - одна из основных причин развития хронических диффузных заболеваний печени и гепатоцеллюлярной карциномы (первичный рак печени). Цирроз печени, обусловленный ВГС, занимает одно из основных мест в ряду показаний к трансплантации печени.
Патогенез
Прямому цитопатическому действию вируса на гепатоциты отводится незначительная роль, причем только при первичной инфекции. Основные поражения гепатоцитов, а также других различных органов и тканей при ВГС обусловлены иммунологическими реакциями, аналогичными таковым при ВГВ (см. «Патогенез вирусного гепатита В»). Доказана репликация вируса вне печени - в тканях лимфоидного и нелимфоидного происхождения.
Механизмы, лежащие в основе частого проявления заболевания в безжелтушной форме, неэффективной элиминации вируса и высокой хронизации инфекции (50-80%) изучены недостаточно. Основные причины развития этих состояний при ВГС, очевидно, в первую очередь связаны с высокой мутационной способностью части генома, ответственной за синтез поверхностных белков вируса. Быстрое изменение поверхностных пептидов возбудителя приводит к образованию соответствующих АТ, не обладающих достаточно выраженным вируснейтрализующим действием, что, в свою очередь, не позволяет полностью реализоваться клеточным звеньям иммунитета (антителозависимому и Т-клеточно опосредованному киллингу инфицированных вирусом клеток). Вместе с тем внепеченочная репликация вируса в недоступных для иммунного надзора местах (лимфатические узлы, селезенка, моноциты) обусловливает возможность его длительной персистенции в организме и высокой хронизации ВГС.
Размножение вируса в иммунокомпетентных клетках (моноцитах) приводит к нарушению их иммунологических функций.
Основные патогенетические особенности ВГС могут быть обусловлены следующими ведущими факторами:
- высокой изменчивостью возбудителя;
- постоянной неконтролируемой, в том числе внепеченочной, репликацией вируса;
- активным, но неэффективным гуморальным (а в связи с ним и клеточным) иммунным ответом.
Эти факторы способствуют образованию значительного количества перекрестно реагирующих ауто-АТ и поликлональной гаммаглобулинопатии, что реализуется в виде большого числа аутоиммунных заболеваний, ассоциируемых с персистенцией ВГС или запускаемых ВГС с последующей элиминацией вируса.
Клиническая картина
Инкубационный период составляет от 2 до 13 нед, однако в зависимости от пути передачи может удлиняться до 26 нед.
Острая инфекция протекает преимущественно в субклинической безжелтушной форме, составляющей до 95% всех случаев острого ВГС. Поздняя лабораторная диагностика острой инфекции обусловлена существованием так называемого антительного окна. При исследовании тест-системами 1-го и 2-го поколений АТ к ВГС у 61% больных выявляются лишь через несколько месяцев от начала заболевания.
При манифестной форме острого ВГС больные предъявляют жалобы:
- на слабость;
- вялость;
- тошноту;
- ухудшение аппетита;
- снижение толерантности к пищевым нагрузкам. Практически все пациенты отмечают быструю утомляемость и,
несколько реже, потерю веса. Классические признаки гепатита выражены незначительно или отсутствуют. Иногда в дожелтушном периоде возникают клинические признаки, сходные с проявлениями гепатита В (тяжесть в правом подреберье, лихорадка, артралгии, полиневропатия, диспепсические симптомы), что значительно затрудняет постановку клинического диагноза. В общем анализе крови могут выявлять лейко- и тромбоцитопению. Желтуху встречают у 5% больных, в основном у лиц с посттрансфузионным заражением. Выраженность и длительность желтухи подвержены значительным колебаниям. Заболевание склонно к обострениям, при которых вновь возникает желтушный синдром и повышается активность аминотрансфераз.
В части случаев (от 5 до 20%) может наблюдаться саморазрешение ВГС с быстрым исчезновением клинических проявлений. Вместе с тем в настоящее время описаны редко встречающиеся тяжелые формы, клинически неотличимые от таковых при ВГВ или ВГА, а также фульминантные формы ВГС (не более 1% случаев), развивающиеся преимущественно при коинфекции с HAV, HBVи HDV.
В части случаев манифестацию острой инфекции сопровождают тяжелые аутоиммунные реакции:
- апластическая анемия;
- агранулоцитоз;
- периферическая невропатия;
- гломерулонефрит и др.
Эти процессы связаны с внепеченочной репликацией вируса и могут завершиться гибелью больных до появления значимых титров АТ.
Острый ВГС обычно продолжается 6-12 мес, с крайне медленным формированием антительного иммунного ответа.
Отличительная особенность ВГС - многолетнее латентное или малосимптомное течение. В таких случаях заболевание большей частью долго остается нераспознанным и диагностируется на далекозашедших клинических стадиях, в том числе на фоне развития цирроза печени или первичной гепатоцеллюлярной карциномы.
Дифференциальная диагностика
Аналогична таковой при гепатитах А и В. При этом следует учитывать, что желтушная форма гепатита С, как правило, протекает со слабовыраженной интоксикацией. Единственно достоверным подтверждением гепатита С служат результаты маркерной диагностики. Учитывая большое количество безжелтушных форм гепатита С, необходимо проводить маркерную диагностику лиц, систематически получающих большое количество инъекций (в первую очередь лиц, употребляющих наркотики внутривенно).
Лабораторная диагностика
Возможно обнаружение вирусной РНК в ПЦР, а также сывороточных IgM-Ат различными серологическими методами. Обнаружение сывороточных IgG к Аг ВГС свидетельствует либо о ранее перенесенном заболевании, либо о продолжающейся персистенции вируса. Динамика маркеров гепатита C представлена на рис. 3-14.
 Рис. 3-14. Динамика маркеров гепатита C.
Рис. 3-14. Динамика маркеров гепатита C.
Приблизительно у одной трети пациентов с острым ВГС может оставаться нормальным уровень АЛТ даже на фоне выраженных клинических симптомов. Однако сохранение персистирующей виремии, изменения воспалительного и некротического характера в паренхиме печени с начальными проявлениями фиброза делают прогноз заболевания в таких случаях менее благоприятным.
При саморазрешении ВГС наблюдается своеобразная динамика лабораторных показателей:
- быстрая нормализация уровней аминотрансфераз;
- прогрессивное снижение титров anti-HCV;
- исчезновение на этом фоне HCV-RNA.
Осложнения и исходы
Клинически выраженный хронический гепатит развивается у 50-70% больных в среднем через 12-14 лет после перенесенного острого ВГС, медленно прогрессирующий цирроз печени в 20-50% случаев через 25-50 лет, гепатоцеллюлярная карцинома - спустя 35 лет и более после первичного инфицирования.
Лечение
В настоящее время доказана высокая эффективность противовирусного лечения острого гепатита С. Независимо от генотипа вируса применяют α-ИФН по 5 млн МЕ 1 раз в сутки в течение 4 нед, затем по 5 млн МЕ через день на протяжении 20 нед. Эффективность лечения значительно повышается при сочетании ИФН с рибавирином. Симптоматическое лечение проводят так же, как при гепатите В.
Эпидемиологический надзор
Изучение распространенности и эпидемиологических проявлений ВГС стало возможным после разработки надежных серологических методов определения инфицированности населения и введения официальной регистрации случаев заболевания. Анализ заболеваемости и носительства инфекции проводят с учетом активности тех или иных путей передачи в различных социально-возрастных группах населения.
Профилактические мероприятия
С 1994 г. в России введена обязательная регистрация всех случаев ВГС. С этого же периода начато обязательное обследование доноров на АТ к ВГС, что стало серьезным шагом на пути снижения заболеваемости посттрансфузионным ВГС. Политика здравоохранения, направленная на снижение передачи ВИЧ-инфекции, например продвижение
рекламы безопасного секса среди молодежи и применение индивидуальных шприцев и игл среди наркоманов, способствует снижению передачи ВГС в группах высокого риска. Профилактические меры по предупреждению инструментального заражения ВГС, как и мероприятия, направленные на нейтрализацию естественных путей передачи, те же, что и при ВГВ. Создание ВГС-вакцины затрудняет большое количество подтипов (более 90) и мутантных разновидностей ВГС, а также кратковременность эффекта нейтрализующих АТ.
Мероприятия в эпидемическом очаге
Аналогичны таковым при ВГВ.
ГЕПАТИТ D (HEPATITIS D)
ВГD - острая или хроническая вирусная инфекция из условной группы парентеральных гепатитов, характеризующаяся преимущественным поражением печени и протекающая в виде коинфекции или суперинфекции на фоне ВГВ. Синоним - дельта-гепатит.
Краткие исторические сведения
Возбудитель открыл М. Ризетто с сотрудниками (1977) в ядрах гепатоцитов во время необычно тяжелой вспышки сывороточного гепатита в Южной Европе. Сначала агент посчитали одним из антигенных вариантов HBV, но вскоре было доказано самостоятельное значение нового вируса, и он получил название HDV (дельта-вирус).
Этиология
Возбудитель - дефектный РНК-геномный вирус блуждающего рода Deltavirus, сателлит HBV, выделяемый только от пациентов, инфицированных ВГВ. Вирионы HDV сферической формы, геном образует однонитевая кольцевая молекула РНК и нуклеокапсидный HD-Аг (дельтаАг). Вирус не имеет собственной оболочки, внешняя оболочка генома образована значительным количеством HBsAg HBV. HDV не способен к самостоятельной репродукции. Синтез вирусных компонентов требует обязательного участия HBV, в частности HBsAg. В настоящее время выделены 3 генотипа HDV, в Европе доминирует генотип I, обусловливающий более высокую частоту цирроза печени и ГЦК.
Основной Аг ВГD устойчив к нагреванию, действию кислот, нуклеаз, гликозидаз. Денатурация белка достигается обработкой щелочами и протеазами. Многократное замораживание и оттаивание не влияет на его активность.
Эпидемиология
Резервуар и источник возбудителя - человек, больной или вирусоноситель. В распространении вируса основное значение имеют лица с хроническими формами ВГВ, одновременно инфицированные ВГD. В условиях широкой распространенности хронических форм ВГВ создаются благоприятные условия и для циркуляции возбудителя ВГD. Период контагиозности источников инфекции неопределенно долгий, однако больной наиболее опасен в острый период болезни. В экспериментальных условиях возможно заражение шимпанзе, инфицированных ВГВ.
Механизм передачи - парентеральный, с теми же особенностями, что и при ВГВ. Риск заражения особенно велик для постоянных реципиентов донорской крови или ее препаратов, для лиц, подвергающихся частым парентеральным вмешательствам, а также для наркоманов, вводящих наркотики внутривенно. Заражение чаще всего происходит в хирургических, туберкулезных отделениях, центрах гемодиализа. Возможна трансплацентарная передача ВГD от беременной плоду. Выявлено распространение ВГD в семьях, особенно среди детей, что предполагает естественный путь передачи. Высокая частота распространения инфекции среди лиц, ведущих беспорядочную половую жизнь (особенно среди мужчин-гомосексуалистов), дает основание полагать, что возможен и половой путь заражения.
Естественная восприимчивость людей
Естественная восприимчивость высокая. К ВГD восприимчивы все лица, больные ВГВ или носители ВГВ. Наиболее вероятно развитие ВГD у хронических носителей HBsAg. Особенно восприимчиво население на территориях, гиперэндемичных по ВГВ. Тяжелые формы болезни могут возникать даже у детей.
Основные эпидемиологические признаки
Аналогичны таковым при ВГВ. Около 5% носителей HBsAg в мире (приблизительно 15 млн человек) инфицированы ВГD. Эндемичными по дельта-вирусной инфекции выступают регионы с высоким распространением носительства HBsAg. На территории бывшего СССР к наиболее пораженным регионам относятся Средняя Азия, Молдова и
Казахстан. В Москве D-инфекция обнаружена у 3-4,2% носителей HBsAg и у 7,2% больных острым ВГВ. У больных с фульминантным течением гепатита этот показатель достигал 76,2%.
Патогенез
Заражение ВГD происходит только парентеральным путем и лишь при нахождении в организме человека репродуцирующегося HBV. С помощью HBsAg HDV проникает в гепатоциты, а затем самостоятельно в их ядра. С помощью РНК-зависимой ДНК-полимеразы хозяина запускается каскад биохимических реакций, в результате которых происходит синтез вирусных частиц HDV. В комплексе Гольджи происходит упаковка этих частиц в HBsAg, и вирионы высвобождаются из гепатоцитов. Патогенез повреждения гепатоцитов до конца не расшифрован. Существует мнение, что вирус обладает непосредственным цитопатическим действием на клетки печени.Вместе с тем в последнее время появляются факты, доказывающие возможность иммуноопосредованного поражения печени при ВГД.
Заболевание может проявляться в виде коинфекции (при одновременном заражении вирусами HBV и HDV) и суперинфекции (в тех случаях, когда HDVпопадает в организм человека, ранее зараженного вирусом ВГВ, т.е. больного с острым или хроническим течением ВГВ).
Патоморфологически ВГD не имеет специфических признаков, отличающих его от ВГВ, и характеризуется выраженной картиной некроза, которая преобладает над воспалительной реакцией. В гепатоцитах наблюдают массивный некроз и мелкокапельное ожирение. Взаимодействие вирусов HBV и HDV утяжеляет патологический процесс.
Клиническая картина
Инкубационный период имеет такую же продолжительность, как и при ВГВ. При коинфекции клиническое течение болезни аналогично клиническим проявлениям ВГВ, но с преобладанием тяжелых форм. В ряде случаев состояние пациентов резко ухудшается уже к концу 1-й недели заболевания. Вместе с тем при коинфекции отдаленный прогноз обычно бывает благоприятным, частота хронизации заболевания составляет около 10%.
При суперинфекции клинические проявления дожелтушного периода часто отсутствуют. Заболевание принимает бурное, тяжелое течение с выраженной недостаточностью функции печени, частым развитием
ОПЭ (до 30% случаев) и большого числа хронических форм (более 80% случаев) с быстрым формированием цирроза печени.
Дифференциальная диагностика
См. выше разделы «Гепатит А» и «Гепатит В».
Лабораторная диагностика
В лабораторной диагностике гепатита D применяют стандартный набор биохимических исследований (общий билирубин, фракции билирубина, белки и белковые фракции, АЛТ, АСТ, протромбиновый индекс), специфические серологические исследования и метод ПЦР. При острой инфекции в крови больных выявляют HD-Аг, HDV-РНК и anti-HDV-IgM. В течение нескольких ближайших месяцев появляются и нарастают специфические IgG. На разных этапах заболевания выявляют специфические маркеры гепатита В, репликация HDV подтверждается определением HDV-РНК.
Лечение
Аналогично таковому при ВГВ (см. соответствующий раздел). При доказанной репликации HBV возможно назначение нуклеозидных аналогов (ламивудин* по 100 мг в сутки, энтекавир*).
Профилактические мероприятия
Мероприятия по профилактике и борьбе с ВГО проводят аналогично таковым при ВГВ. Действия, направленные на профилактику ВГВ, предупреждают заражение и ВГО. Вакцинация групп риска против ВГВ в равной мере будет профилактической мерой и для ВГО. Среди лиц с хронической ВГВ-инфекцией крайне важно соблюдение условий, направленных на недопущение заражения ВГD. Исключительно большое значение имеет применение безопасной в эпидемиологическом отношении крови и ее препаратов, а также предотвращение инструментального заражения ВГО. Ни вакцина, ни введение иммуноглобулина не могут обеспечить предупреждение инфицирования ВГО лиц с хроническим ВГВ.
ГЕПАТИТ G (HEPATITIS G)
В литературных источниках с 1995 г. появляются сведения о новой нозологической форме вирусных гепатитов - ВГО.
Этиология
Возбудитель ВГО - РНК-геномный вирус (HGV) относится к семейству флавивирусов.
Эпидемиология
Заражение HGV происходит парентеральным и половым путем. В настоящее время установлено, что РНК HGV часто обнаруживают у лиц, которым проведены гемотрансфузии и парентеральные вмешательства. HGV встречается у 5% доноров, 50% наркоманов и лиц с алкогольным гепатитом, у 10% пациентов с хроническим гепатитом В. Кроме парентерального пути передачи инфекции, существует и вертикальный - от матери к ребенку. РНК HGV была найдена и в семенной жидкости. В группу риска по инфицированию HGV входят больные гемофилией, реципиенты органов и лица, которым проводят гемодиализ. Существующие данные свидетельствуют о повсеместном распространении HGV. Наименьшая частота обнаружения зарегистрирована в Европе и Северной Америке (у 1,4-1,5% доноров и в общей популяции), а наибольшая - в Африке (от 17 до 25%). На сегодняшний день профилактические мероприятия не разработаны.
Патогенез
Получены экспериментальные данные, свидетельствующие о том, что HGV лимфотропный и может инфицировать гепатоциты, попадая в печень с лимфоцитами. Вирус поражает в основном мелкие желчные протоки, что определяет длительный холестаз. Инфекционный процесс в большинстве случаев завершается элиминацией вируса, но возможна его длительная бессимптомная персистенция (до 16 лет). Роль вируса в развитии цирроза печени и гепатоцеллюлярного рака в настоящее время отвергается.
Клиническая картина
Инкубационный период заболевания составляет 4-6 мес. Гепатит G протекает в основном бессимптомно и крайне редко с клиническими проявлениями острого гепатита. Предположительно клинически выраженные формы гепатита G возникают только у лиц с иммунодефицитом и часто сочетаются с гепатитом В и С.
Лабораторная диагностика
Вследствие длительного холестаза при гепатите G закономерно отмечают увеличение уровня ГГТ и ЩФ. Инфицированность HGV может быть подтверждена выявлением РНК вируса в ПЦР.
Полученные данные по гепатиту G пока не позволяют рассматривать его как самостоятельное заболевание, имеющее полное право входить в МКБ-10.
ГЕПАТИТ ТТ (HEPATITIS TT)
Впервые сообщения о новом посттрансфузионном гепатите появились в 1997 г. Вначале заболевание было названо гепатит TTV - по инициалам пациента у которого он был выявлен, в дальнейшем название болезни было переименовано в гепатит ТТ.
Этиология
Возбудитель TTV - ДНК-содержащий вирус из семейства Paracicloviridae. Представители этого семейства встречаются у человека, у приматов, низших обезьян и птиц. В настоящее время известно 16 генотипов вируса гепатита ТТ (HTTV). Инфицированность ТTV устанавливают с помощью ПЦР при выявлении TTV-ДНК.
Эпидемиология
По данным различных авторов, HTTV присутствует буквально у всех людей. Новорожденные инфицируются внутриутробно или со слюной матери после рождения. Вирус размножается в костном мозге, клетках периферической крови и кишечной стенки, выделяется в окружающую среду со слюной и фекалиями.
Роль вируса в патологии человека неясна, считается, что сам по себе вирус не патогенен. Доказательства его гепатотропности и способности вызывать как острый, так и хронический гепатит пока не получены. В то же время существует предположение, что TTV может у генетически предрасположенных лиц провоцировать злокачественную трансформацию и бластогенез.
TTV распространен повсеместно, но неравномерно. Чаще всего TTV обнаруживается среди населения стран Африки (у 44-83% обследованных). Частота выявления TTV возрастает с увеличением возраста обследованных.
К группе с повышенным риском заражения TTV относят:
- наркоманов;
- проституток;
- гомосексуалистов;
- больных гемофилией;
- пациентов, находящихся на гемодиализе.
Полученные данные свидетельствуют о множественности путей передачи TTV. Наряду с парентеральным путем заражения имеются доказательства и фекально-орального механизма передачи возбудителя. Сведения о восприимчивости к TTV отсутствуют.
СТОЛБНЯК (TETANUS)
Столбняк - острое инфекционное заболевание человека и животных из группы раневых анаэробных инфекций. Характеризуется токсическим поражением нервной системы, проявляющимся в виде клоникотонических судорог скелетной мускулатуры с возможным нарушением дыхания вплоть до асфиксии.
Краткие исторические сведения
Заболевание известно с древних времен, его возникновение издавна связывали с травмами и ранениями. Название болезни и первое описание ее клинических проявлений дано Гиппократом. Столбнячную палочку впервые обнаружили Н.Д. Монастырский (1883) в трупах умерших людей, А. Николайер и Ш. Китазато (1884) в абсцессах при экспериментальном столбняке у животных. Чистую культуру возбудителя выделил японский бактериолог Ш. Китазато (1887). Позднее он получил столбнячный токсин (1890) и совместно с Э. Берингом предложил антитоксическую сыворотку для лечения столбняка. Французский иммунолог Г. Рамон разработал метод получения столбнячного анатоксина (1923-1926), применяемого до настоящего времени для профилактики заболевания.
Этиология
Возбудитель - облигатно-анаэробная грамположительная спорообразующая палочка Clostridium tetani рода Clostridium, семейства Bacillaceae.
Споры располагаются терминально, придавая бактериям вид барабанных палочек или теннисных ракеток. В почве, испражнениях и на различных предметах споры могут сохраняться годами. Выдерживают температуру 90 °С в течение 2 ч. В анаэробных условиях, при температуре 37 °С, достаточной влажности и в присутствии аэробных бактерий (например, стафилококков) споры прорастают в вегетативные формы. В странах с теплым климатом возможна вегетация спор непосредственно в почве.
Вегетативные формы столбнячной палочки имеют жгутики, подвижны. Неприхотливы к питательным средам, в культуре старше 24 ч бактерии становятся грамотрицательными. Основные Аг возбудителя - соматический О-Аг и жгутиковый Н-Аг. О-Аг общий для всех представителей вида, по структурам жгутикового Н-Аг выделяют 10 сероваров.
Все серовары образуют сильнодействующий экзотоксин, состоящий из 3 фракций:
- тетаноспазмина;
- тетанолизина (цитотоксина);
- низкомолекулярной фракции.
• Тетаноспазмин - один из самых сильных биологических ядов для человека и многих животных (лошадей, кроликов, морских свинок, мышей и др.). Представляет собой полипептид с дистанцированным механизмом действия, так как бактерии редко покидают пределы первичного очага инфицирования. В культурах тетаноспазмин появляется на 2-е сутки, достигая пика образования к 5-7-му дню.
• Тетанолизин максимально накапливается в культуре уже через 20-30 ч. Процессы его образования не связаны с синтезом тетаноспазмина.
• Низкомолекулярная фракция усиливает секрецию медиаторов в нервно-мышечных синапсах.
Вегетативные формы C. tetani погибают в течение нескольких минут при кипячении, через 30 мин - при 80 °С. Антисептики и дезинфектанты убивают возбудитель столбняка в течение 3-6 ч.
Эпидемиология
Резервуар и источник инфекции - травоядные животные, грызуны, птицы и человек, в кишечнике которых обитает возбудитель и с фекалиями выделяется во внешнюю среду. Столбнячная палочка также широко распространена в почве и других объектах внешней среды, где
она может размножаться и долго сохраняться. Таким образом, возбудитель имеет 2 взаимосвязанных и взаимообогащаемых места обитания, а следовательно, и 2 источника возбудителя - кишечник теплокровных и почву. Значимость того или иного источника в значительной мере обусловлена климатогеографическими условиями местности. Наиболее благоприятны для вегетации и сохранения микроорганизма черноземные и красноземные, богатые гумусом почвы, а также почвы, хорошо удобренные органическими веществами. Из почвы с пылью бактерии могут попадать в любые помещения (в том числе перевязочные и операционные блоки), на различные предметы и материалы, применяемые в хирургической практике (различные порошки, гипс, тальк, лечебные глину и грязь, вату и др.).
Частота носительства спор столбнячной палочки человеком варьирует от 5-7 до 40%, причем повышенную степень носительства отмечают у лиц, профессионально или в быту соприкасающихся с почвой или животными (сельскохозяйственные рабочие, конюхи, доярки, ассенизаторы, работники парников и др.). C. tetani обнаруживают в содержимом кишечника коров, свиней, овец, верблюдов, коз, кроликов, морских свинок, крыс, мышей, уток, кур и других животных с частотой 9-64%. Обсемененность помета овец достигает 25-40%, что имеет особое эпидемиологическое значение в связи с использованием тонкой кишки овец для изготовления хирургического кетгута.
Механизм передачи - контактный, возбудитель проникает через поврежденные кожный покров и слизистые оболочки (раны, ожоги, отморожения). Инфицирование пупочных ран при несоблюдении асептики при родах может стать причиной столбняка новорожденных.
Местом входных ворот возбудителя могут быть различные по характеру и локализации открытые раны:
- проколы;
- занозы;
- порезы;
- потертости;
- размозжения;
- открытые переломы;
- ожоги;
- отморожения;
- укусы;
- некрозы;
- воспалительные процессы.
При попадании в таком случае возбудителя в организм человека развивается посттравматический столбняк. Операционные раны, особенно на толстой кишке и ишемизированных конечностях, могут стать входными воротами для инфекции с последующим развитием послеоперационного столбняка. Вмешательства по поводу аборта вне медицинских учреждений могут стать причиной постабортального столбняка. Возможность передачи возбудителя от больного здоровому человеку отсутствует.
Естественная восприимчивость людей
Естественная восприимчивость людей высокая. У переболевших столбняком иммунитет к заболеванию не формируется, так как очень маленькая доза токсина, способная вызвать заболевание, недостаточна для обеспечения иммунологического ответа.
Основные эпидемиологические признаки
Заболеваемость спорадическая, в виде не связанных друг с другом случаев. Ежегодно в России регистрируют 40-60 случаев столбняка. Наиболее неблагополучное положение сложилось в Северо-Кавказском, Поволжском и Центрально-Черноземном районах. Зональное распространение инфекции обусловлено как климатогеографическими, так и социально-экономическими факторами. Сезонность заболевания весенне-летняя. Среди заболевших преобладают жители сельской местности, дети и лица пожилого возраста, в этих группах и регистрируют большинство летальных исходов. В связи с широким проведением активной иммунизации в настоящее время столбняк новорожденных не регистрируют. Постоянный резервуар инфекции в почве определяет возможность заражения в результате мелких бытовых травм. По-прежнему встречают случаи внутрибольничного заражения столбняком при операциях на конечностях, гинекологических операциях и оперативных вмешательствах на ЖКТ. Столбняк имеет глобальное распространение. Зональность территориального распространения столбняка обусловлена совокупностью климатогеографических и социальноэкономических условий. Летальность при столбняке составляет 40% и более. Проведение иммунопрофилактики столбнячной инфекции с 1960 г. радикально изменило эпидемический процесс столбняка. Так, заболеваемость столбняком в России сегодня сведена к единичным случаям, а столбняк у новорожденных с 1975 г. не встречается. В последние годы показатель заболеваемости составляет 0,033-0,6 на 100 000 населения.
Патогенез
Возбудитель в виде спор проникает в организм человека через поврежденные кожный покров и слизистые оболочки (рис. 3-15). При анаэробных условиях (глубокие колотые раны, раны с глубокими карманами или некротизацией размозженных тканей) в ранах происходят развитие и размножение вегетативных форм, сопровождающиеся выделением экзотоксина.
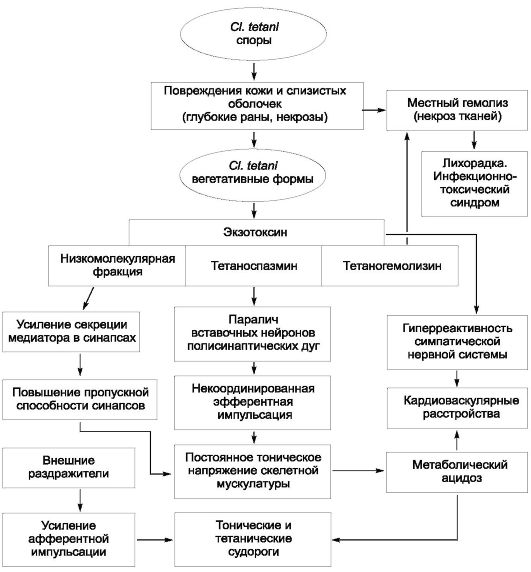 Рис. 3-15. Патогенез столбняка
Рис. 3-15. Патогенез столбняка
Тетаноспазмин, обладающий нейротропным действием, играет ведущую роль в патогенезе заболевания. Токсин фиксируется на поверхности отростков нервных клеток в области ворот инфекции, проникает в них за счет опосредованного лигандами эндоцитоза и оказывает первоначальное действие на периферические нервы, вызывая местные тетанические сокращения мышц. Далее по двигательным волокнам периферических нервов и с током крови тетаноспазмин попадает в спинной, продолговатый мозг и ретикулярную формацию ствола, где фиксируется главным образом во вставочных нейронах полисинаптических рефлекторных дуг, связываясь с синаптическими белками синаптобревином и целлюбревином. Связанный токсин не поддается нейтрализации антитоксическими АТ.
Механизм действия тетаноспазмина обусловлен подавлением высвобождения тормозных нейромедиаторов (в частности, глицина и γ-аминомасляной кислоты) в синапсах. Развивается паралич вставочных нейронов с подавлением всех видов их синаптического тормозного действия на мотонейроны. Вследствие этого усиливается постоянное нескоординированное поступление двигательных импульсов от мотонейронов к мышцам через нервно-мышечные синапсы. Пропускная способность последних повышается из-за усиления секреции ацетилхолина под действием низкомолекулярной фракции столбнячного токсина. Непрерывный поток эфферентной импульсации поддерживает постоянное тоническое напряжение скелетной мускулатуры.
Одновременно усиливается и афферентная импульсация в ответ на воздействие тактильных, слуховых, зрительных, обонятельных, вкусовых, температурных и барораздражителей. При этом периодически возникают тетанические (клонические) судороги.
Мышечное напряжение ведет к развитию метаболического ацидоза. На его фоне усиливаются как тонические, так и тетанические судороги, ухудшается сердечная деятельность, создаются предпосылки для вторичных бактериальных осложнений. Сердечно-сосудистые расстройства (тахикардия, артериальная гипертензия, аритмия, фибрилляция желудочков) усугубляются за счет развивающейся при столбняке гиперактивности симпатической нервной системы. Повышается возбудимость коры и ретикулярных структур головного мозга. Возможно поражение дыхательного и сосудодвигательного центров и ядер блуждающего нерва (бульбарный столбняк), что нередко приводит к смерти больных. Другие причины, обусловливающие летальный исход, могут быть связаны с асфиксией вследствие судорог и развитием осложнений (пневмония, сепсис).
Тетанолизин в патогенезе заболевания играет менее важную роль. Он проявляет гемолитическое, кардиотоксическое и летальное действия, вызывает развитие местных некротических поражений.
Постинфекционный иммунитет при столбняке не развивается. Специфические патолого-анатомические изменения скудны (венозный застой, мелкие кровоизлияния, в редких случаях разрывы мышц и мышечные гематомы).
Клиническая картина
Единой и общепринятой клинической классификации столбняка не существует. С учетом локализации входных ворот инфекции различают:
- раневой, травматический, постоперационный, послеродовой столбняк;
- столбняк, развившийся в результате воспалительных и деструктивных процессов;
- криптогенный столбняк (с невыясненными входными воротами).
По распространенности процесса заболевание разделяют на общий (генерализованный) и местный столбняк. Последний наблюдают редко.
Инкубационный период варьирует от нескольких дней до 1 мес, в среднем не превышая 1-2 нед. Продолжительность инкубационного периода предопределяет тяжесть течения заболевания. После короткой инкубации обычно развивается тяжелый столбняк.
Заболевание начинается остро, лишь иногда отмечают продромальные признаки в виде напряжения и подергивания мышц в месте ранения, недомогания, головной боли, потливости, раздражительности.
В начальный период столбняка в части случаев может проявиться его наиболее ранний признак - тупые тянущие боли в области входных ворот инфекции, даже в уже полностью заживших ранах.
Основные специфические симптомы, возникающие в этот период:
- тризм;
- сардоническая улыбка;
- дисфагия;
- ригидность затылочных мышц.
• Эти признаки появляются рано и почти одновременно. Тризм - напряжение и судорожное сокращение жевательных мышц, что приводит к затрудненному открыванию рта.
• Тонические судороги мимической мускулатуры выражаются в сардонической улыбке (risus sardonicus), придающей лицу больного своеобразное выражение:
◊ морщинистый лоб;
◊ суженные глазные щели;
◊ растянутые губы (см. рис. 24 на цветной вклейке);
◊ опущенные уголки рта.
• Дисфагия (затрудненное болезненное глотание) обусловлена судорожным спазмом мышц глотки. Сочетание тризма, сардонической улыбки и дисфагии характерно только для столбняка.
• Ригидность затылочных мышц, обусловленная тоническими судорогами скелетной мускулатуры, при столбняке не служит менингеальным симптомом и не сочетается с другими менингеальными знаками (симптомы Кернига, Брудзинского и др.). Длительность начального периода 1-4 дня. Быстрое усиление и прогрессирование клинических признаков свидетельствует о развитии тяжелого течения болезни.
Разгар заболевания характеризуется прежде всего распространением болезненных тонических судорог на мышцы туловища и конечностей (преимущественно нижних). Тонические судороги постоянны, расслабление мышц не происходит даже во сне. Четко обрисовываются, особенно у мужчин, контуры крупной скелетной мускулатуры. С 3-4-го дня болезни мышцы брюшной стенки становятся твердыми, как доска, ноги чаще вытянуты, движения в них ограничены. Одновременно в процесс вовлекаются межреберные мышцы и диафрагма, дыхание становится поверхностным и учащенным. Тоническое напряжение мышц промежности приводит к затруднению дефекации и мочеиспускания. По мере прогрессирования процесса гипертонус нарастает.
В результате выраженного напряжения и болезненности мышц спины при тяжелом столбняке развивается опистотонус:
- при положении больного на спине голова его запрокинута назад;
- поясничная часть тела приподнята над кроватью таким образом, что между спиной и постелью можно просунуть руку.
При распространении судорог на всю скелетную мускулатуру в меньшей степени отмечается тоническое напряжение мышц плечевого пояса и крайне редко - мышц предплечий, кистей и стоп.
На фоне постоянного тонического напряжения скелетной мускулатуры периодически с различной частотой возникают тетанические
судороги. Развитие тетанических судорог менее чем через 48 ч от момента появления первых симптомов заболевания считают крайне неблагоприятным прогностическим признаком столбняка. Продолжительность судорог вначале колеблется от нескольких секунд до минуты. Чаще всего их провоцируют различные внешние раздражители (слуховые, зрительные, тактильные и др.). В легких случаях заболевания наблюдают 1-2 приступа тетанических судорог в день, при тяжелом течении столбняка они могут повторяться до 10 раз и более в течение часа, становятся более длительными и распространенными. Приступы судорог возникают внезапно. При этом лицо больного принимает страдальческое выражение и становится цианотичным, более четко обрисовываются контуры мышц, усиливается опистотонус. Больные стонут и кричат из-за болей, стараются ухватиться руками за спинку кровати, чтобы облегчить дыхание. Повышается температура тела, кожа (особенно лица) покрывается крупными каплями пота, отмечают гиперсаливацию, тахикардию, одышку. Тоны сердца громкие, АД склонно к повышению. Судорожный синдром развивается и усиливается при сохранении ясного сознания больного, спутанное сознание и бред появляются лишь незадолго до смерти.
Период с конца 1-й недели и до 10-14-го дня болезни наиболее опасен для жизни больного. Метаболический ацидоз и резкое усиление обмена веществ обусловливают гиперпирексию, повышенное потоотделение. Затруднено выделение мокроты, поскольку кашель провоцирует тетанические судороги. Ухудшение вентиляции легких часто способствует развитию вторичных бактериальных пневмоний. Сердце расширено за счет обоих желудочков, тоны громкие. Печень и селезенка не увеличены. Глубокая интоксикация ствола мозга становится причиной угнетения и аритмии дыхания, ослабления сердечной деятельности; возможен паралич сердца. Из-за частых и длительных тетанических судорог развиваются мучительная бессонница, раздражительность, нарастает угроза асфиксии.
В случаях благоприятного исхода период реконвалесценции длительный. Постепенно ослабевающие клинические проявления заболевания сохраняются 2-4 нед, выздоровление затягивается до 1,5-2 мес.
Тяжесть течения столбняка определяется совокупностью нескольких показателей:
- длительности инкубационного периода (чем короче, тем тяжелее течение болезни);
- быстроты нарастания и степени выраженности начальных клинических признаков заболевания;
- выраженности постоянного мышечного гипертонуса;
- интенсивности, продолжительности и частоты приступов тетанических судорог;
- уровня лихорадки;
- сердечно-сосудистых и дыхательных нарушений и т.д.
◊ При легком течении заболевания инкубационный период чаще превышает 20 дней. Тризм, сардоническая улыбка и опистотонус умеренные, гипертонус периферических мышц конечностей слабый. Тетанические судороги отсутствуют или незначительны, температура тела нормальная или субфебрильная. Симптомы болезни развиваются в течение 5-6 дней.
◊ В случаях среднетяжелого течения инкубационный период составляет 15-20 дней. Основные клинические признаки заболевания нарастают за 3-4 дня. Тетанические судороги возникают несколько раз в сутки, тахикардия и потливость умеренные, температура тела субфебрильная или (реже) высокая.
◊ Тяжелая форма столбняка отличается укороченным до 7-14 дней инкубационным периодом, быстрым (за 1-2 дня) нарастанием симптомов, типичной клинической картиной с частыми и интенсивными тетаническими судорогами (несколько раз в течение часа), выраженными потливостью и тахикардией, высокой лихорадкой.
◊ Очень тяжелое течение отличают короткий (менее 1 нед) инкубационный период и молниеносное развитие заболевания. Тетанические судороги возникают несколько раз в течение 3-5 мин. Их сопровождают гиперпирексия, выраженная тахикардия и тахипноэ, цианоз, угрожающая асфиксия.
Одна из тяжелейших форм генерализованного нисходящего столбняка - головной (бульбарный) столбняк Бруннера. Он протекает с преимущественным поражением мышц лица, шеи и глотки, со спазмами глотательных и межреберных мышц, мышц голосовой щели и диафрагмы. Обычно происходит поражение дыхательного, сосудодвигательного центров и ядер блуждающего нерва. Тяжестью течения и неблагоприятным прогнозом отличаются также гинекологический столбняк и столбняк новорожденных - одна из важных причин детской смертности в развивающихся странах. Он связан с неудовлетворительными условиями оказания акушерской помощи и отсутствием программ иммунизации.
Наблюдаемый в редких случаях восходящий столбняк сначала проявляется болью, напряжением и фибриллярными подергиваниями в одной
группе мышц, в дальнейшем по мере поражения новых вышележащих отделов спинного мозга заболевание приобретает типичные черты генерализованного процесса.
Местный столбняк встречают редко. Одним из его типичных проявлений, развивающихся после ранений лица и головы, бывает лицевой паралитический столбняк Розе. Возникают тризм, ригидность затылочных мышц, сардоническая улыбка, к которым присоединяются парезы черепных нервов. Поражение обычно двустороннее, более выражено на стороне ранения. Развитие тетанических судорог у больных не происходит.
При определении прогноза столбняка большое внимание уделяют периоду между появлением первых признаков болезни (тризма и др.) и возникновением тетанических судорог. Если этот период составляет менее 48 ч, прогноз заболевания крайне неблагоприятный.
Дифференциальная диагностика
Столбняк следует отличать от истерии, эпилепсии, отравления стрихнином, тетании, менингитов, энцефалитов, миозитов и других заболеваний, протекающих с судорожным синдромом.
Диагноз столбняка ставят на основании клинических данных.
Специфические симптомы столбняка, возникающие уже в начальный его период:
- тупые тянущие боли в области раны (даже уже зажившей);
- тризм;
- сардоническая улыбка;
- дисфагия;
- ригидность затылочных мышц.
Сочетание этих симптомов характерно только для столбняка. В период разгара заболевания присоединяются болезненные тонические судороги мышц туловища и конечностей (не захватывающие кисти и стопы), а на их фоне - периодические, внезапно возникающие судороги тетанического характера, частота и продолжительность которых во многом определяет тяжесть течения инфекции.
Лабораторная диагностика
В гемограмме при сгущении крови из-за выраженного и постоянного чрезмерного потоотделения, а также при вторичных бактериальных осложнениях возможны лейкоцитоз и нейтрофилез. Бактериоскопиче-
ский и бактериологический методы могут быть использованы при исследовании биоматериала от больного или трупа, перевязочного и шовного хирургического материала, а также почвы, пыли и воздуха. Бактерии обычно обнаруживают в месте входных ворот инфекции. В тех случаях когда входные ворота неизвестны, следует тщательно осмотреть пациента для выявления ссадин, царапин, катаральных и воспалительных процессов. Особо следует обратить внимание на старые рубцы после ранений, так как возбудитель может долго в них сохраняться. В некоторых случаях исследуют слизь из носа, бронхов, глотки, налет с миндалин, а также выделения из влагалища и матки (при послеродовом или постабортальном столбняке). При бактериологическом исследовании трупов также принимают во внимание возможность генерализации инфекции. Для анализа забирают кровь (10 мл) и кусочки печени и селезенки (20-30 г). Для выделения возбудителя применяют методы, общие для получения чистых культур анаэробных бактерий.
При исследовании материала, взятого от больного или трупа, параллельно бактериологическому анализу проводят выявление столбнячного экзотоксина в биологической пробе на мышах. Для этого материал измельчают, добавляют физиологический раствор в двойном объеме, инкубируют в течение часа при комнатной температуре, фильтруют. Часть фильтрата смешивают с противостолбнячной сывороткой из расчета 0,5 мл (200 АЕ/мл) сыворотки на 1 мл экстракта и инкубируют 40 мин. Затем одной группе животных вводят экстракт без предварительной инкубации с сывороткой, а другой группе - проинкубированную смесь. При C. tetani у животных первой группы развиваются симптомы столбняка.
Отсутствие противостолбнячных АТ в сыворотке крови не может служить доказательством у больного столбняка или его отсутствия.
В случаях типичной клинической картины столбняка лабораторное исследование может не потребоваться.
Осложнения и исходы
Опасными осложнениями столбняка могут быть асфиксия на высоте тетанических приступов, отек легких. Вместе с тем существует мнение, что асфиксия и остановка сердца представляют собой не осложнения, а проявления симптомокомплекса тяжелого течения заболевания. К осложнениям также относят пневмонии и абсцессы легкого, разрывы мышц, переломы костей, компрессионные деформации позвоночника,
задержку мочеиспускания, пролежни. Нарастающая при судорогах гипоксия может способствовать развитию спазма коронарных сосудов и инфаркта миокарда, остановке сердечной деятельности. В период выздоровления возможны мышечные контрактуры и параличи III, VI и VII пар черепных нервов. Столбняк новорожденных может осложнять сепсис.
Прогноз заболевания всегда серьезный.
Лечение
Больные столбняком подлежат госпитализации в отделения интенсивной терапии и реанимации. Лечение проводят с участием анестезиолога и, нередко, хирурга. Необходимо обеспечить охранительный режим, исключающий воздействие слуховых, зрительных, тактильных и любых других раздражителей. Кормление больных осуществляют через зонд или парентерально (при парезе ЖКТ). Проводят профилактику пролежней:
- частое поворачивание больного в постели;
- разглаживание смятого постельного и нательного белья;
- чистку и периодическую смену белья. Инфицированную рану, даже зажившую, обкалывают противостолбнячной сывороткой (в дозе 1000-3000 МЕ), затем проводят тщательную ревизию и хирургическую обработку раны с широкими лампасными разрезами (для создания аэробных условий), удалением инородных тел, загрязненных и некротизированных тканей. Для предупреждения судорог все эти манипуляции лучше проводить под наркозом. В последующем при лечении ран целесообразно применять протеолитические ферменты (трипсин, химотрипсин и др.).
Для нейтрализации свободно циркулирующего столбнячного экзотоксина однократно вводят внутримышечно 50 000 МЕ (максимально разрешенная доза - 150 000 МЕ) противостолбнячной сыворотки или 1500-10 000 ЕД (средняя доза 3000 ЕД) специфического иммуноглобулина с предварительной проверкой индивидуальной чувствительности к ним. Эти препараты следует вводить в максимально ранние сроки, поскольку столбнячный токсин свободно циркулирует в крови не более 2-3 сут, а связанный токсин не инактивируется, что снижает терапевтический эффект. После введения гетерогенной противостолбнячной сыворотки необходимо наблюдать за больным в течение 1 ч из-за опасности развития анафилактического шока.
Борьбу с судорожным синдромом проводят применением седативных и наркотических, нейроплегических средств и миорелаксантов. В последнее время широко используют диазепам по 5-10 мг внутрь каждые 2-4 ч, в тяжелых случаях его вводят внутривенно по 10-20 мг каждые 3 ч. Детям препарат назначают внутривенно или внутримышечно по 0,1-0,3 мг/кг каждые 6 ч (максимально до 10-15 мг/кг в сутки). Можно применять инъекции литической смеси (по 2 мл 2,5% раствора аминазина*, 1% раствора промедола* и 1% раствора димедрола с добавлением 0,5 мл 0,05% раствора скополамина гидробромида). Также назначают седуксен*, барбитураты, натрия оксибутират, в тяжелых случаях - дроперидол, фентанил, курареподобные миорелаксанты (панкуронийР, 5-тубокураринР). При лабильности симпатической нервной системы иногда применяют α- и β-блокаторы. При расстройствах дыхания проводят интубацию или трахеотомию, миорелаксацию сочетают с ИВЛ, очищением дыхательных путей аспиратором. Больным дают увлажненный кислород. Имеются сообщения об эффективности гипербарической оксигенации.
В небольших дозах назначают слабительные средства, ставят газоотводную трубку и катетер в мочевой пузырь (при необходимости). Для профилактики пневмоний необходимы частые поворачивания больного, форсаж дыхания и кашля.
Для предупреждения и лечения бактериальных осложнений применяют антибиотики - бензилпенициллин по 2 млн ЕД внутривенно с интервалами 6 ч (детям до 200 000 ЕД/кг в сутки), тетрациклин по 500 мг 4 раза в сутки (детям до 30-40 мг/кг в сутки). Применение антибиотиков не исключает возможности развития пневмоний и других вторичных инфекций.
Борьбу с гипертермией, ацидозом, обезвоживанием и электролитными нарушениями проводят внутривенными вливаниями 4% раствора натрия бикарбоната, полиионных растворов, гемодеза*, реополиглюкина* , альбумина, плазмы.
Эпидемиологический надзор
Система эпидемиологического надзора включает:
- выявление и эпидемиологическое обследование каждого случая столбняка;
- оперативный и ретроспективный анализ заболеваемости на отдельных территориях с учетом распределения по полу, возрасту и профессиональной принадлежности;
- контроль за своевременным и качественным проведением активной иммунизации и экстренной иммунопрофилактики при травмах;
- серологический контроль за иммуноструктурой привитого населения.
Для выявления закономерностей распространения столбняка, рационального планирования профилактических мероприятий необходим углубленный эпидемиологический анализ заболеваемости и применявшихся мер профилактики. Для оценки качества медицинской помощи при травмах необходимо проводить анализ ее сроков, объема и характера. При анализе эффективности экстренной профилактики следует обращать внимание не только на ее объем, но и на сроки ее проведения (время, прошедшее после травмы и обращения за медицинской помощью). Особую актуальность в связи со случаями заболеваний у ранее привитых приобретает анализ иммунного статуса заболевших. Детальному анализу подлежат иммунизация населения против столбняка, выполнение плана прививок по отдельным возрастным, социально-профессиональным группам, включая сельское население. Иммунологический контроль - это составная часть эпидемиологического надзора за столбняком.
Он дает возможность:
- оценить защищенность различных контингентов;
- достоверно судить о привитости и качестве проведенной иммунизации, а также о длительности сохранения иммунитета;
- выявить наиболее пораженные группы населения;
- охарактеризовать территории с различной степенью риска возникновения инфекции.
Серологический контроль проводят среди разных возрастных, профессиональных и социальных групп населения в городской и сельской местности.
Индикаторные группы, свидетельствующие о состоянии противостолбнячного иммунитета:
- дети до 3 лет, получившие первичный вакцинальный комплекс;
- дети 9-10 лет, получившие 2-ю ревакцинацию против столбняка;
- подростки 16-17 лет, получившие 3-ю ревакцинацию против столбняка;
- взрослые (все возрастные группы), подлежащие ревакцинации против столбняка в плановом порядке или по эпидпоказаниям.
Серологические исследования позволяют выявить серонегативных лиц. Выявление до 10% серонегативных лиц в каждой возрастной груп-
пе свидетельствует о проведенной иммунизации населения. Если установлены более 10% серонегативных лиц, необходимо провести серологическое обследование всех людей этой возрастной группы. Выявленные серонегативные лица подлежат ревакцинации.
Профилактические мероприятия
Неспецифическая профилактика столбняка направлена:
- на предупреждение травматизма в быту и на производстве;
- исключение заражения операционных, пупочных и других ран;
- раннюю и тщательную хирургическую обработку ран. Специфическую профилактику столбняка проводят в плановом и
экстренном порядке. В соответствии с календарем прививок вакцинируют детей с 3 мес жизни троекратно по 0,5 мл вакциной АКДС с 1-й ревакцинацией через 12-18 мес и последующими ревакцинациями через каждые 10 лет ассоциированными препаратами (АДС или АДС-М) или монопрепаратами (АС-анатоксин - адсорбированный столбнячный анатоксин). После законченного курса иммунизации организм человека в течение длительного срока (около 10 лет) сохраняет способность к быстрой (в течение 2-3 дней) выработке антитоксинов в ответ на повторное введение препаратов, содержащих АС-анатоксин.
Экстренную профилактику столбняка осуществляют по схеме при любых травмах и ранах с нарушением целостности кожи и слизистых оболочек, ожогах и отморожениях II-IV степени, укусах животных, проникающих повреждениях кишечника, внебольничных абортах, родах вне медицинских учреждений, гангрене или некрозе тканей любого типа, длительно текущих абсцессах, карбункулах. Экстренная профилактика столбняка включает первичную обработку раны и одновременную специфическую иммунопрофилактику.
В зависимости от предшествующей привитости пациентов различают:
- пассивную иммунизацию;
- активно-пассивную профилактику, состоящую из одновременного введения противостолбнячной сыворотки и анатоксина;
- экстренную ревакцинацию АС-анатоксином для стимуляции иммунитета у ранее привитых лиц.
Экстренную иммунопрофилактику столбняка следует проводить как можно раньше и вплоть до 20-го дня с момента получения травмы, учитывая длительность инкубационного периода при заболевании столбняком.
Для экстренной специфической профилактики столбняка применяют препараты:
- ДДС-Л (адсорбированный дифтерийно-столбнячный анатоксин с уменьшенным содержанием Аг, содержащий в 1 мл 10 LS дифтерийного и 10 ЕС столбнячного анатоксинов);
- АС-анатоксин;
- ПСЧИ (противостолбнячный человеческий иммуноглобулин) - иммунологически активная белковая фракция, выделенная из сыворотки крови доноров, иммунизированных столбнячным анатоксином, очищенная концентрированная, реакции на введение препарата, как правило, отсутствуют;
- ПСС (противостолбнячная лошадиная сыворотка) очищенная концентрированная жидкая.
Мероприятия в эпидемическом очаге
Больного госпитализируют в специализированные (реанимационные) отделения для лечения. Диспансерное наблюдение за переболевшим осуществляют в течение 2 лет. Разобщение в отношении контактных лиц не проводят, так как больной не опасен для окружающих. Дезинфекцию в очаге не проводят.
БОЛЕЗНИ С ТРАНСМИССИВНЫМ МЕХАНИЗМОМ ПЕРЕДАЧИ
Кровяные (трансмиссивные) инфекционные болезни вызывают возбудители, первично локализующиеся, а в дальнейшем и циркулирующие в кровотоке. Среди них встречают:
- антропонозы (сыпной эпидемический тиф, болезнь Брилла- Цинссера, возвратный эпидемический тиф, малярию и др.);
- зоонозы (туляремию, чуму, клещевой энцефалит, лихорадку Денге, геморрагические лихорадки, Ку-лихорадку и др.).
Выведение возбудителя из зараженного организма происходит только с помощью кровососущих членистоногих-переносчиков:
- вшей;
- блох;
- комаров;
- москитов;
- клещей и др.
Возбудители большинства трансмиссивных болезней приспособлены к определенным переносчикам. Например, возбудителей сыпного тифа преимущественно переносит платяная вошь, возбудителей малярии - комары рода Anopheles и т.д.
Более того, в процессе эволюции сформировались определенные взаимоотношения возбудителей и переносчиков, специфический тип выделения их из организма переносчика:
- риккетсии размножаются и накапливаются в кишечнике вшей;
- возбудитель малярии проходит половой цикл развития в организме комаров и т.д.
Подобная специфичность обусловила ряд эпидемиологических особенностей трансмиссивных болезней, прежде всего неодинаковую распространенность в определенных географических регионах, определяемую ареалом обитания переносчиков. Указанное не распространяется на сыпной и возвратный тифы, которым не свойственна эндемичность, уровень их распространенности детерминирован социальными факторами. Неодинаковая активность переносчиков в разные времена года влияет на уровень инфицирования и заболеваемости населения. На активность эпидемического процесса существенное влияние оказывают социальные условия, поскольку они воздействуют непосредственно на увеличение или сокращение количества переносчиков. Борьба с педикулезом - основа профилактики сыпного и возвратного тифов. Большое значение имеют мероприятия, направленные на источник инфекции (своевременное выявление, ранняя госпитализация), а также широкое применение специфической химиопрофилактики (при малярии и др.).
МАЛЯРИЯ (MALARIA)
Малярия - протозойное трансмиссивное заболевание с чередованием лихорадочных приступов и периодов апирексии, выраженными симптомами интоксикации, увеличением печени и селезенки, анемией с возможным развитием гемолитической желтухи.
Краткие исторические сведения
Основные признаки заболевания известны еще со времен глубокой древности (древнеегипетские, китайские и индийские источники, труды Гиппократа, Геродота и Эмпедокла).
Гиппократ впервые предложил выделять 3 формы болезни:
- quotidian (ежедневные приступы);
- tertian (приступы через 1 день);
- quartan (приступы через 2 дня).
Позже древнеримский писатель Варрон (116-27 гг. до н.э.) указывал на некие мельчайшие, невидимые глазу существа в болотистых местах, проникающие с дурным воздухом (mal'aria) в организм. В самостоятельную форму малярию выделил женевский врач Т. Мортон (1696). Итальянский естествоиспытатель Д. Ланчизи подчеркивал роль стоячих водоемов в распространении болотной лихорадки (1717). Впервые возбудитель малярии в крови человека обнаружил и подробно описал французский врач А. Лаверан, работавший в Алжире (1880), принадлежность возбудителя к споровикам установил И.И. Мечников (1886), а роль комаров как переносчиков малярии окончательно установили Р. Росс (1897) и Б. Грасси (1898). Цикл развития паразита в организме человека, стадии его развития и закономерности проявления приступов были определены К. Гольджи (1889).
Первыми препаратами, примененными в Европе для лечения малярии, стали:
- настой коры хинного дерева (испанский врач-конкистадор Дель Вего Х., 1640);
- кристаллический хинин (Гизе Ф.И., 1816);
- хлорохин (Андерзаг Г., Кикут У., 1945).
Этиология
Возбудители - простейшие рода Plasmodium класса Sporozoa. Род Plasmodium разделяют на 2 подрода:
- Plasmodium;
- Laverania (табл. 3-13).
Известно более 100 видов плазмодиев, но лишь 4 из них служат основными возбудителями малярии человека:
- P. vivax;
- Р. malariae;
- Р. falciparum;
- Р. ovale.
В редких случаях заболевание человека может быть связано с заражением зоонозными видами плазмодиев, например P. knowlesi и P. cynomogli, вызывающими малярию у обезьян.
Таблица 3-13. Клинические формы малярии
Возбудитель | Клинические формы малярии (в соответствии с МКБ-10) |
Plasmodium (Laverania) falciparum | Малярия, вызванная Plasmodium falciparum (малярия-falciparum) |
Plasmodium (Plasmodium) vivax | Малярия, вызванная Plasmodium vivax (малярия-vivax) |
Plasmodium (Plasmodium) ovale | Малярия, вызванная Plasmodium ovale (малярия-ovale) |
Plasmodium (Plasmodium) malarie | Малярия, вызванная Plasmodium malaria (малярия-malariae) |
Plasmodium (Plasmodium) knowlesi | Малярия, вызванная Plasmodium knowlesi (малярия-knowlesi) |
В большинстве отечественных изданий (учебники, руководства, справочники) нередко до сих пор сохраняются прежние названия клинических форм малярии:
- тропическая малярия (малярия-falciparum);
- 3-дневная малярия (малярия- vivax);
- овале-малярия (малярия-ovale);
- 4-дневная малярия (малярия-malariae).
Выявлены существенные различия между возбудителями разных форм малярии:
- в продолжительности циклов бесполого и полового развития;
- способности заражать переносчика;
- вирулентности.
Эти факторы в значительной степени определяют видовые ареалы разных возбудителей малярии. К организму человека наиболее адаптирован P. malariae, наименее - P. falciparum. Большое практическое значение имеет постоянно растущая резистентность плазмодиев к противомалярийным препаратам во многих регионах земного шара.
Жизненный цикл малярийных плазмодиев включает бесполую (в виде тканевой и эритроцитарной шизогонии) и половую (спорогонию) фазы развития. Первая фаза проходит в организме человека (табл. 3-14), вторая - в организме женских особей различных видов комаров рода Anopheles. Спорогония продолжается в среднем 1-1,5 мес. Ее длительность зависит от температуры воздуха, при понижении температуры ниже 15 °С
спорогония прекращается. После завершения спорогонии зрелые спорозоиты скапливаются в слюнных железах самок комаров-переносчиков и при укусах ими человека попадают в кровь. Паразиты быстро достигают печени и уже через 15-30 мин внедряются в гепатоциты.
Таблица 3-14. Развитие малярийных плазмодиев в организме человека
Стадия шизогонии | Место обитания плазмодиев | Стадия развития плазмодиев |
0. Заражение | Кровь | Спорозоиты |
1. Экзоэритроцитарная (тканевая) шизогония | Печень (гепатоциты) | Образование экзоэритроцитарных мерозоитов |
2. Спячка (P. vivax, P. ovale) | Печень (гепатоциты) | Брадиспорозоиты (гипнозоиты) |
3. Эритроцитарная шизогония | Кровь (эритроциты) | Последовательное образование трофозоитов- шизонтов- эритроцитарных мерозоитов |
4. Гаметоцитогония | Кровь (эритроциты) | Гаметоциты (мужские и женские) |
Тканевая (печеночная, экзоэритроцитарная) шизогония протекает в гепатоцитах. Воспалительный процесс в печени при этом не развивается, каких-либо уловимых клинических проявлений болезни и иммунологических сдвигов не возникает. При заражении P. malariae, P. falciparum или P. Knowlesi развитие паразитов начинается сразу после их проникновения в печень. Спорозоиты P. vivax и P. ovale могут также сразу давать начало шизогонии (тахиспорозоиты) или долго (от нескольких месяцев до 2 лет и более) сохраняться в печени в неактивном состоянии (брадиспорозоиты, гипнозоиты). Последующая активизация брадиспорозоитов наступает после длительных периодов инкубации и апирексии. Продолжительность тканевой шизогонии при всех формах малярии составляет от 6-15 сут до 3 нед, но при 4-дневной малярии она может затягиваться до 6 нед. В результате тканевой шизогонии каждого вида плазмодиев образуется несколько генераций тканевых мерозоитов, обладающих различной степенью устойчивости к воздействию защитных
факторов макроорганизма (наиболее устойчивы мерозоиты P. falciparum, наименее - P. malariae). При малярии-falciparum образуется до 40 000 тканевых мерозоитов, при других формах заболевания - значительно меньше. Тканевая шизогония завершается разрушением гепатоцитов, при этом мерозоиты снова попадают в кровоток и через 15-30 мин внедряются в эритроциты. Способность тканевых мерозоитов внедряться в эритроциты и давать начало эритроцитарной шизогонии зависит от соответствия рецепторов паразитов и мембран эритроцитов.
При парентеральном заражении малярийными плазмодиями тканевая шизогония не происходит.
Эритроцитарная шизогония у P. malariae составляет 72 ч, у P. Knowlesi - 24 ч, у остальных видов плазмодиев - 48 ч. В ходе каждого цикла последовательно образуются трофозоиты, шизонты и эритроцитарные мерозоиты, часть мерозоитов превращаются в гаметоциты. Последние представляют собой незрелые мужские и женские половые клетки; их развитие в последующем завершается в желудке самки комара. Гаметоциты P. vivax, Р. malariae и Р. оvale образуются уже при первых циклах эритроцитарной шизогонии, но быстро погибают в крови, если не попадают в организм комара. Гаметоциты P. falciparum образуются лишь по окончании нескольких циклов эритроцитарной шизогонии, их можно обнаружить в крови не ранее 10-12-го дня от начала заболевания. В последующем они могут сохраняться в кровеносном русле в течение нескольких недель. Циклы эритроцитарной шизогонии заканчиваются разрушением зараженных эритроцитов, выходом мерозоитов в плазму крови, где часть из них погибает, а остальные внедряются в новые эритроциты, давая начало новым циклам шизогонии.
У P. vivax, Р. malariae и Р. ovale эритроцитарная шизогония протекает в периферической крови, где можно видеть все переходные формы развития плазмодиев. Эритроцитарная шизогония P. falciparum имеет некоторые особенности. Она проходит в капиллярах внутренних органов, где инвазированные эритроциты, содержащие взрослые трофозоиты и шизонты, большей частью адгезируются на клетках эндотелия. При неосложненном течении тропической малярии в периферической крови циркулируют лишь эритроциты, содержащие кольцевидные (юные) трофозоиты и гаметоциты, а при злокачественном течении болезни появляются также и эритроциты с промежуточными стадиями развития плазмодиев.
Эпидемиология
Основной резервуар и источник инвазии - человек (больной или паразитоноситель) и самки комаров рода Anopheles. Известны редкие случаи заражения человека зоонозными видами плазмодиев (например, P. cynomogli, вызывающим малярию у обезьян). Ранее считалось, что P. knowlesi заражаются только обезьяны, в частности макаки (Macaca fascicularis и Macaca nemestrina), живущие в тропических лесах Малайзии. В 2004 г. было показано, что этот обезьяний штамм может инфицировать и человека. В последние годы в Юго-Восточной Азии (Малайзия, Филиппины, Таиланд) отмечено значительное учащение случаев заражения людей малярией-knowlesi.
Комар заражается после сосания крови человека, содержащей зрелые гаметоциты. Последние наводняют кровь после 2-10 приступов 3- или 4-дневной малярии, а при тропической малярии - с 7-10-го дня болезни. Продолжительность этого периода составляет при тропической малярии около 1 года, несколько больше при 3-дневной и овалемалярии, десятки лет при 4-дневной малярии. В эндемичных районах основным источником инфекции бывают дети. У взрослых в результате развивающихся иммунных реакций количество циркулирующих гаметоцитов и продолжительность носительства значительно меньше. Инвазированные комары после завершения спорогонии остаются заразными от нескольких дней до 1,5 мес.
Механизм передачи - трансмиссивный. Известно более 400 видов комаров рода Anopheles. Из них 60 видов - известные переносчики, а 30 видов - основные переносчики возбудителей малярии человека.
Эпидемическую роль того или иного вида определяют несколько факторов:
- восприимчивость конкретного вида комара к определенному виду малярийного плазмодия;
- вероятность и частота нападений определенных видов комаров на человека;
- численность популяции комаров и вероятность достижения отдельными особями эпидемически опасного возраста;
- продолжительность сезона с оптимальной температурой воздуха.
Не исключена возможность заражения при переливаниях крови или применении инфицированного инструментария (шприцы, иглы). Возможна трансплацентарная или интранатальная передача возбудителя.
Естественная восприимчивость людей
Естественная восприимчивость людей всеобщая, однако существуют группы, относительно невосприимчивые к малярии. Представители негроидной расы Западной Африки генетически нечувствительны к возбудителю 3-дневной малярии, лица с дефицитом фермента глюкозо-6-фосфатдегидрогеназы резистентны к возбудителю тропической малярии. Относительной устойчивостью к паразитам тропической малярии обладают гетерозиготные носители гемоглобина S и гомозиготные лица с серповидноклеточной анемией. Постинвазионный иммунитет нестойкий, возможны реинвазии и перекрестные инвазии.
Основные эпидемиологические признаки
Малярия - природно-эндемичная болезнь, поскольку ее распространение ограничено природными факторами и она встречается только в районах с подходящими условиями для передачи. Такая ситуация обусловлена тем, что передача возбудителей малярии может осуществляться только на маляриогенных территориях, т.е. на территориях, где существуют условия, обеспечивающие возбудителям малярии возможность разрешить их основную задачу - самосохранение и распространение. Малярия - это отчасти и социальная болезнь, так как она с особой силой поражает беднейшие слои населения и приобретает характер эпидемий в годы конфликтов, войн и экономических потрясений. В настоящее время малярия распространена на территории 90 стран земного шара, половина из которых расположена в Африке.
Согласно классификации ВОЗ различают 4 степени активности эндемических очагов малярии:
- гипоэндемические (низкий или умеренный риск заражения);
- мезоэндемические (умеренный или высокий риск);
- гиперэндемические (высокий риск);
- голоэндемические (очень высокий риск).
Глобальная кампания ВОЗ по ликвидации малярии оказалась неудачной, в результате чего произошла активизация эпидемического процесса с восстановлением заболеваемости малярией на частично или полностью оздоровленных территориях. Более 2 млрд человек, или 41% населения планеты, все еще находятся под угрозой заражения, а 300- 500 млн ежегодно заболевают этой опасной болезнью. Из них 1,5- 2,7 млн - умирают.
В странах Европейского региона, столкнувшихся с возвратом малярии, наибольшее значение имеют два вида малярии:
- тропическая;
- 3-дневная.
Четырехдневная и овале-малярия имеют крайне мало шансов на укоренение в этом регионе. На территории бывшего Советского Союза активные очаги существуют в Таджикистане, Узбекистане и Азербайджане. В большинстве европейских стран (в том числе и в России) отмечают завозные случаи малярии. Ежегодно в РФ регистрируют 800-1200 случаев малярии. 80% завозных случаев составляют больные 3-дневной малярией из стран СНГ, в том числе из Азербайджана и Таджикистана (сезонные рабочие, беженцы и коммерсанты). В 2007 г. число заболеваний малярией составило 128 случаев (2006 г. - 143). Удельный вес малярии с местной передачей возбудителя в 2007 г. составил 9% (2006 г. - 7%). Местные случаи малярии (вторичные от завозных) продолжают регистрироваться в Москве и Московской области, Республике Татарстан. В большинстве завозных случаев из стран дальнего зарубежья преобладает тропическая малярия из Африки. В 2007 г. зарегистрировано 3 летальных случая от тропической малярии в Республике Татарстан, Чеченской Республике, Калининградской области. Среди завозных случаев из Азии преобладает трехдневная малярия. Наибольший завоз малярии (до 100 случаев в год) происходит преимущественно в крупные административные центры, где лишь в предместьях и дачных поселках есть условия для местной передачи малярии. Завоз малярии возможен не только больными людьми, но и зараженными переносчиками, попадающими в Россию из эндемичных стран чаще всего самолетами, реже - морскими судами и автофургонами. Возможен залет зараженных комаров из эндемичных по малярии пограничных районов.
В последние годы единичные случаи местной 3-дневной малярии отмечены в Краснодарском крае, Московской, Липецкой, Нижегородской, Самарской, Ростовской и других областях, отличающихся значительным маляриогенным потенциалом.
Условия, определяющие маляриогенность той или иной территории:
- температуры, допускающие завершение процесса спорогонии в переносчике инфекции;
- присутствие на территории комаров рода Anopheles, восприимчивых к заражению возбудителем малярии;
- способность и возможность самок комаров на данной территории доживать до эпидопасного возраста;
- необходимость и возможность для самок комаров вступать в контакт с человеком;
- заселенность территории населением, которое восприимчиво к заражению возбудителем малярии.
Распространение малярии на эндемичных территориях зональноочаговое, его определяет взаимодействие природных и социальноэкономических факторов, преобладающих на каждой конкретной территории. Хорошо прослеживается неодинаковая восприимчивость инфекции разных возрастных групп населения. В странах тропической Африки, например, риск заражения наивысший для детей в возрасте от 6 мес до 5 лет, а также для молодых беременных, особенно первородящих.
В странах Южной и Юго-Восточной Азии, а также Южной Америки к группе наибольшего риска относят молодых взрослых людей, активно занятых в хозяйственной деятельности. Угроза заражения малярией существует для иммигрантов, особенно беженцев, сезонных сельскохозяйственных рабочих. Значительно увеличились риск заражения, заболеваемость и даже смертность от малярии среди неиммунных лиц, посещающих страны, эндемичные по малярии, либо по роду своей деятельности (моряки, члены авиационных экипажей, бизнесмены и т.д.), либо с целью туризма и паломничества. Неупорядоченные перемещения больших групп людей способствуют массивному распространению лекарственно-устойчивых штаммов малярии на громадных территориях.
Патогенез
Фаза тканевой (экзоэритроцитарной) шизогонии бессимптомна, ее продолжительность соответствует большей части инкубационного периода. Инкубационный период при малярии завершается уже во время циклов эритроцитарной шизогонии, когда концентрация эритроцитарных мерозоитов, вышедших в кровяное русло из разрушенных эритроцитов, превысит так называемый пирогенный порог. Возникновение клинических проявлений заболевания в виде малярийного лихорадочного пароксизма в патофизиологическом смысле можно рассматривать как пирогенную реакцию терморегулирующего центра гипоталамуса на выход в плазму крови чужеродных белков в составе мерозоитов, продуктов их метаболизма, патологически измененных собственных белков эритроцитов. Одновременно эти же компоненты
обусловливают возможность развития аллергических и анафилактических реакций (экзантема, бронхиты с бронхообструктивным синдромом, артриты и др.). Лихорадочная реакция поддерживается вследствие повышенного синтеза эндогенных пирогенов (провоспалительных цитокинов) - ИЛ-1, ИЛ-6, ФНО-α и др.
Чем выше уровень паразитемии (количество паразитов в 1 мкл крови больного), тем обычно тяжелее протекает малярия.
В первые дни болезни при малярии-falciparum и малярии-vivax температура тела зачастую постоянно повышена, хотя ее уровень подвержен колебаниям в течение суток - приступы накладываются один на другой (период инициальной лихорадки). Указанные особенности лихорадки в начальном периоде малярии обусловлены развитием в различных партиях эритроцитов нескольких генераций плазмодия. При этом циклы эритроцитарной шизогонии у различных генераций развиваются несинхронно, т.е. не совпадают по времени ее начала, а впоследствии и окончания. В дальнейшем, по мере формирования иммунных реакций, слабоустойчивые генерации плазмодиев погибают и в эритроцитах продолжает развиваться одна, наиболее устойчивая из них. Клинически это проявляется правильным чередованием приступов лихорадки и периодов апирексии (период типичных малярийных пароксизмов).
Увеличение печени и селезенки при малярии связано с их значительным кровенаполнением, отеком, усиленным размножением клеток макрофагально-моноцитарной системы.
В крови нарастает содержание биологически активных веществ (ФНО-α, γ-ИФН, ИЛ-1 и других цитокинов) и токсических продуктов, образующихся при гибели плазмодиев, что обусловливает повышение проницаемости эндотелия кровеносных сосудов и развитие в нем дистрофических и даже некротических процессов. Вследствие этого развиваются периваскулярный отек и воспалительный застой в капиллярах.
Указанные процессы имеют наибольшую выраженность при малярии-falciparum, отличающейся медленным развитием иммунных реакций и вследствие этого прогрессирующим нарастанием уровня паразитемии. Мембраны эритроцитов, инвазированных P. falciparum, образуют отростки плазмолеммы, с помощью которых эритроциты склеиваются друг с другом и адгезируются на эндотелии сосудов, препятствуя кровотоку. Этому процессу способствуют повышение концентрации цитокинов в плазме крови, а также активизация тромбоцитарных факторов.
Поскольку при малярии-falciparum эритроцитарная шизогония протекает в капиллярах внутренних органов, нарушения органной
микроциркуляции ведут к развитию геморрагических проявлений, ДВС-синдрома, клинической симптоматики и осложнений, связанных с нарушениями функций органов:
- почек;
- печени;
- кишечника;
- костного мозга;
- плаценты и др. Нередко страдает головной мозг (церебральная форма малярии-
falciparum). В развитии церебральной формы заболевания особая роль отводится повышенному синтезу оксида азота NO клетками эндотелия сосудов головного мозга.
В известной степени тяжесть течения малярии-falciparum обусловлена и развивающейся у больных гипогликемией, усугубляющей микроциркуляторные и метаболические нарушения (метаболический ацидоз). Гипогликемия объясняется снижением глюкогенеза в печени, повышенной секрецией инсулина, а также утилизацией глюкозы плазмодиями. Следует заметить, что гиперинсулинемия может быть также следствием побочного действия хинина при лечении малярии.
Распад пораженных эритроцитов, частичный гемолиз неинвазированных эритроцитов под влиянием образующихся иммунных комплексов с избыточным содержанием Аг и С3-фракции комплемента (аутоиммунный механизм), а также угнетение эритропоэза в условиях выраженного токсикоза и накопления инвазированных эритроцитов в костном мозге ведут к развитию прогрессирующей гемолитической анемии с возможной желтухой.
При активизации иммунных реакций организма паразитемия снижается до подпорогового уровня, приступы лихорадки прекращаются (латентный период). Вместе с тем в периоде ранней реконвалесценции часто проявляется состояние выраженной анергии, обусловленное иммуносупрессивным действием малярийных паразитов в течение лихорадочных периодов заболевания. При этом возможно обострение имевшихся ранее у пациента хронических заболеваний, а также развитие тяжелых суперинфекций.
В свою очередь резкое уменьшение количества плазмодиев и, соответственно, концентрации паразитарных Аг приводит к снижению выраженности иммунных реакций. На фоне снижения содержания противомалярийных АТ увеличивается популяция паразитов, сохранившихся в эритроцитах, повышается вероятность ранних и поздних эритроцитар-
ных рецидивов заболевания. Продолжительность инвазионного процесса с сохранением паразитемии на субпирогенном или субпатентном (ниже порога обнаружения) уровне составляет от 1-1,5 года (малярия- falciparum) до десятилетий (малярия-malariae). При малярии-vivax и малярии-ovale, кроме того, возможна активизация брадиспорозоитов в печени, с чем бывает связано возникновение поздних экзоэритроцитарных рецидивов или первичных малярийных пароксизмов после длительной инкубации (табл. 3-15). Важной патогенетической особенностью малярии-malariae является возможность развития нефротического синдрома при длительной персистенции паразита в организме или при повторном заражении. Нефротический синдром обусловлен иммунными механизмами - отложением иммунных комплексов, содержащих Аг паразита, на базальной мембране почечных клубочков.
Таблица 3-15. Продолжительность малярии при однократном заражении (Беляев А.Е., Лысенко А.Я., 1992)
Формы малярии | Продолжительность инфекции | |
Обычная | Максимальная | |
Малярия-falciparum | До 1 года | До 3 лет |
Малярия-vivax и малярия-ovale | До 1,5-2 лет | До 4-5 лет |
Малярия-malariae | До 2-3 лет | Десятки лет (пожизненно) |
Примечание.
Продолжительность заболевания представлена с учетом возможности развития рецидивов и при отсутствии адекватного этиотропного лечения. Патоморфологические изменения в различных органах при малярии разнообразны. В первую очередь они связаны с нарушениями микроциркуляции и реологических свойств крови. Нередко выявляют кровоизлияния, значительные дистрофические и некробиотические процессы в миокарде, почках (с признаками острого тубулярного некроза), увеличение паренхиматозных органов с отложением в них малярийного пигмента гематомеланина. При малярии-malariae возможны признаки прогрессирующего нефроза.
Клиническая картина
• В течении заболевания различают несколько периодов, последовательно сменяющих друг друга. Инкубационный период продолжается 1-3 нед, при малярии- malariae - до 6 нед. В случаях малярии-vivax или малярии-ovale
неактивное состояние брадиспорозоитов в печени может привести к удлинению инкубационного периода до 2 лет и более.
• В продромальный период у большинства неиммунных лиц, инвазированных Р. vivax или Р. ovale, развиваются головная боль, артралгии и миалгии, слабость, снижение работоспособности. Иногда возможны небольшие боли в печени и селезенке. Продромальный период продолжается от нескольких часов до 2-3 дней. Для малярии-falciparum и малярии-malariae развитие продромального периода не характерно.
• Период инициальной лихорадки характерен для первичного заражения. Проявляется общим недомоганием, прогрессирующей слабостью, головной болью, миалгиями, артралгиями, ломотой в пояснице. Объективные данные при осмотре больного скудны (возможны умеренно выраженные катаральные признаки в ротоглотке и небольшая тахикардия). Увеличение печени и селезенки, их уплотнение и болезненность при пальпации выявляют лишь в конце этого периода. Неспецифичность и умеренная выраженность клинических признаков заболевания создают затруднения в определении причины лихорадочного состояния. Однако при сборе подробного почасового анамнеза болезни удается отметить, что повышение температуры тела в течение одного или нескольких часов сопровождается ознобом различной степени выраженности. При достижении максимального уровня лихорадки (обычно в ночное время) озноб сменяется чувством жара, усиливаются все субъективные проявления, возникшие во время озноба, развиваются сухость во рту и жажда. К утру следующего дня температура тела снижается, хотя и не достигает нормальных показателей, что сопровождается потливостью, иногда значительной. Самочувствие пациента в течение 2-го дня болезни часто бывает заметно лучше, чем в 1-й день. Продолжительность периода инициальной лихорадки составляет 3-5 дней. При малярии-falciparum инициальная лихорадка с асинхронными приступами затягивается до 1 нед и более. Для малярии-malariae данный период нехарактерен, сразу развиваются типичные малярийные пароксизмы.
• Период типичных малярийных пароксизмов. Характер и продолжительность приступов зависят от вида возбудителя. При малярии- vivax и малярии-malariae приступы наступают в дневные или (реже) утренние часы, при овале-малярии - в вечернее время, при тропической малярии - в любое время суток. Клиническая картина лихо-
радочного приступа имеет много общего при всех формах малярии и проходит 3 стадии:
◊ озноба;
◊ жара;
◊ потоотделения.
• Для стадии озноба характерны головная боль, сухость во рту, нередко боли в мышцах, костях и суставах, в поясничной области, а также в подреберьях. Быстро повышается температура тела с ознобом различной степени выраженности. Развивается тахикардия. Кожа становится бледной, сухой, отмечают цианоз губ, носа и кончиков пальцев. Длительность стадии от 30 мин до 3-4 ч.
• Для стадии жара характерны нарастание интенсивности вышеуказанных жалоб и значительное ухудшение самочувствия больного. Температура тела устанавливается на уровне 39-40 °С и выше, озноб сменяется чувством жара, присоединяются головокружение и рвота. Возможны расстройства сознания, бред, галлюцинации, судороги. Больной адинамичен или, наоборот, возбужден, беспокоен. Кожа сухая и горячая, конечности часто холодные. Лицо гиперемировано, сосуды склер инъецированы, могут быть герпетические высыпания на губах. Развиваются одышка, отчетливая тахикардия, приглушенность тонов сердца, артериальная гипотензия. Снижается диурез. При тропической малярии наряду с этим возможны экзантема, бронхоспазм, боли в животе, диарея. Стадия жара продолжается от 1 до 12 ч.
• Стадия потоотделения. Температура тела критически снижается до нормальных показателей, ее падение сопровождается потоотделением различной степени выраженности в течение 1-2 ч. Самочувствие больного улучшается, болевые ощущения значительно уменьшаются или исчезают. После приступа остаются выраженная слабость и артериальная гипотензия, обычно больные на некоторое время засыпают.
Общая продолжительность малярийного пароксизма составляет 6-12 ч, при малярии-falciparum он может затягиваться до суток и более.
Типичные малярийные пароксизмы разделяются между собой промежутками нормальной температуры тела, приступы повторяются через день, при малярии-malariae - через 2 дня. При нормальной температуре тела самочувствие больных улучшается, но сохраняется астенизация.
После нескольких приступов становятся отчетливыми другие патогномоничные для малярии клинические проявления:
- увеличение и болезненность печени и селезенки;
- гемолитическая анемия;
- нарастающая бледность кожи и слизистых оболочек;
- иногда желтуха.
Малярийные пароксизмы могут спонтанно прекратиться у нелеченных больных в течение 2-4 нед, постепенно ослабевая. Максимальное количество приступов при этом варьирует от 4-5 до 12-14.
Вторичный латентный период развивается вслед за прекращением приступов. Для него характерны нормальная температура тела и исчезновение основных клинических проявлений заболевания, однако в течение еще нескольких недель или месяцев может сохраняться субпатентная паразитемия. Субфебрильная температура тела, наблюдаемая в этот период у части больных при отсутствии плазмодиев в крови (подтвержденном лабораторными исследованиями), может быть связана с вегетативными расстройствами или присоединением вторичной инфекции.
Ранние рецидивы характерны для всех видов малярии, они могут возникнуть через 2 нед и даже 3 мес по окончании первичных малярийных пароксизмов. Рецидивы протекают с основными клиническими признаками, свойственными малярийным приступам. В то же время их отличают предвестники (познабливание, головная боль, миалгии), отсутствие инициальной лихорадки, увеличение и уплотнение печени и особенно селезенки с 1-го дня рецидива, более легкое течение приступов и их меньшее количество. По происхождению рецидивы могут быть эритроцитарными, связанными с персистенцией паразитов в эритроцитах, и экзоэритроцитарными, обусловленными активизацией гипнозоитов в печени. Эритроцитарные рецидивы возможны при всех видах малярии, экзоэритроцитарные - только при малярии-vivax или малярии-ovale.
Поздние рецидивы возникают через 6 мес и более, имеют те же клинические особенности, но иногда протекают тяжело. Они обусловлены либо нарастанием сохранившейся подпороговой или субпатентной паразитемии (что особенно характерно для малярии-malariae), либо активацией брадиспорозоитов (экзоэритроцитарные рецидивы при малярии-vivax или -ovale).
Клинические особенности различных форм малярии
Малярия-falciparum
Характерно острое начало (короткий продромальный период наблюдают лишь у иммунных лиц). Инициальная лихорадка у полуиммунных лиц продолжается до 5-7 дней, у неиммунных может затянуться до
2 нед. Очерченность периодов между приступами при первичных малярийных пароксизмах нечеткая. Во время приступов озноб и потливость выражены умеренно, длительность приступов может достигать 1 сут и более.
Характерны диспепсические симптомы:
- тошнота;
- рвота;
- диарея.
Только при этой форме малярии наряду с легкими и среднетяжелыми случаями может развиться злокачественное течение заболевания с тяжелыми осложнениями и нередко летальным исходом. Крайне неблагоприятным прогностическим признаком при малярии-falciparum является постоянная ежедневная высокая лихорадка без периодов апирексии с нарастающей в динамике головной болью.
Малярия-vivax
Протекает доброкачественно. Характерны продромальные признаки, возможен период инициальной лихорадки продолжительностью 2-6 дней. Период типичных малярийных пароксизмов отличает синхронность приступов (наступают в одно и то же время). Они протекают с выраженным, но коротким ознобом и потоотделением различной интенсивности. Анемия развивается постепенно и проявляется лишь в конце 2-й или начале 3-й недели болезни. При отсутствии лечения, несмотря на значительное количество пароксизмов, чаще всего наступает спонтанное выздоровление (см. рис.25 на цветной вклейке).
Малярия-ovale
По клиническим проявлениям напоминает малярию-vivax, но отличается относительной легкостью течения с невысокой температурой тела, умеренными спленомегалией и анемией. Лихорадочные пароксизмы возникают, как правило, в вечерние часы, их количество небольшое.
Малярия-malariae
Начинается остро в дневные часы, продромальные признаки и инициальная лихорадка не характерны. Четкие малярийные пароксизмы с длительным резким ознобом и обильным потоотделением устанавливаются сразу, продолжаются 8-12 ч, их разделяют 2-дневные промежутки апирексии. Гепатолиенальный синдром и анемия развиваются медленно. Клинические проявления в нелеченых случаях через 8-14 приступов самостоятельно купируются, но рецидивы возможны в течение несколь-
ких и даже десятков лет в связи с длительным сохранением подпороговой или субпатентной паразитемии. Коварство этой формы малярии состоит в том, что даже на фоне ярких клинических проявлений заболевания не всегда удается обнаружить плазмодии в периферической крови. Одна из особенностей заболевания - это возможность развития нефротического синдрома .
Малярия-knowlesi
В связи с репродукцией возбудителя в крови каждые 24 ч клиническая картина заболевания отличается ежедневными лихорадочными пароксизмами, быстрым нарастанием тяжести при отсутствии лечения, частым развитием осложнений. В тяжелых случаях заболевание может принять злокачественное течение, подобное малярии-falciparum с летальным исходом.
Дифференциальная диагностика
Малярию дифференцируют от других заболеваний с приступообразными повышениями температуры тела и гепатолиенальным синдромом:
- лептоспироза;
- бруцеллеза;
- сепсиса;
- висцерального лейшманиоза и др.
При первичном заражении малярией уже в период инициальной лихорадки температура тела имеет определенную стадийность в течение суток:
- повышение сопровождается ознобом;
- максимальный уровень - чувством жара;
- снижение (хотя и не до нормы) - потливостью.
На 4-5-й день болезни развивается гепатолиенальный синдром. В период типичных малярийных пароксизмов еще более характерной становится фазность приступов, проходящих последовательно стадии озноба, жара и пота. Приступы лихорадки разделены 1-дневными или 2-дневными промежутками апирексии (что при тропической малярии необязательно), становятся отчетливыми увеличение и болезненность печени и селезенки, развивается гемолитическая анемия, возможно с желтухой.
Вспомогательное значение для диагноза имеют анамнестические данные:
- пребывание в эндемичной по малярии зоне или приезд из нее в течение последних 3 лет;
- переливания крови или кровезаменителей в последние 3 мес;
- перенесенная в прошлом малярия.
Лабораторная диагностика
В гемограмме при малярии отмечают снижение уровня гемоглобина, лейкопению, лимфомоноцитоз, увеличение СОЭ. Диагноз малярии должен быть подтвержден лабораторными паразитологическими исследованиями.
Обследование на малярию показано при возникновении лихорадочных состояний в следующих случаях:
- у прибывших в течение последних 3 лет из эндемичных по малярии зон (включая страны СНГ);
- у больных, получавших переливания крови или кровезаменителей в течение последних 3 мес;
- у лиц, перенесших малярию в течение последних 3 лет;
- при лихорадке неясного генеза, сопровождающейся развитием гепатолиенального синдрома, анемии, желтухи;
- при лихорадке неясного генеза, продолжающейся более 3-5 дней.
Лабораторная диагностика включает обнаружение и идентификацию плазмодиев при микроскопическом исследовании мазков и препаратов толстой капли крови больного, окрашенных по Романовскому-Гимзе. Кровь для приготовления препаратов берут из подушечки пальца пациента на любом этапе малярийного пароксизма, даже в период апирексии. При исследовании препаратов толстой капли крови легче обнаружить возбудителя и определить уровень паразитемии, но нельзя точно установить его вид. Для этого необходимо одновременно изучать промежуточные стадии развития плазмодиев по мазку крови (см. рис. 26 на цветной вклейке). Исследование проводят как во время приступа, так и в период апирексии. Степень паразитемии (табл. 3-16) необходимо учитывать при определении тяжести заболевания, выборе метода лечения, а также для контроля над эффективностью лечения.
Серологические методы исследования (РНИФ, ИФА) применяют при эпидемиологическом обследовании населения в малярийной зоне (серологическом скрининге), а также при обследовании доноров для предупреждения трансфузионной малярии.
Таблица 3-16. Степени паразитемии при малярии
Степень паразитемии | Условное обозначение | Количество паразитов | |
В полях зрения | В 1 мкл крови | ||
IV | + | 1-10 в 100 полях | 3-50 |
III | ++ | 10-100 в 100 полях | 50-500 |
II | +++ | 1-10 в 1 поле | 500-5000 |
I | ++++ | Более 10 в 1 поле | Более 5000 |
В последние годы разработаны высокочувствительные и специфичные ориентировочные методы экспресс-диагностики малярии, основанные на выявлении в сыворотке крови биохимическими и иммуноферментными методами малярийного Аг, богатого гистидином, или лактатдегидрогеназы плазмодиев (ParaSight-F-тест, ICT-тест, pLDH-тест и др.). Для обнаружения ДНК плазмодия можно применять ПЦР, что особенно необходимо при идентификации Р. mowlesi, имеющего выраженное морфологическое сходство с P. malariae.
Осложнения и исходы
Для малярии-falciparum характерны осложнения тяжелого, злокачественного течения. К ним относят:
- церебральную форму;
- гемолитическую анемию;
- гемоглобинурийную лихорадку;
- ОПН;
- геморрагический синдром;
- ИТШ;
- коллапс;
- отек легких (респираторный дистресс-синдром);
- малярийные психозы и др.
Риск их развития резко увеличивается при паразитемии, превышающей 100 000 паразитов в 1 мкл крови.
Церебральная форма (энцефалопатия, малярийная кома) возникает в 10% всех случаев малярии-falciparum, чаще у неиммунных лиц при высокой паразитемии в результате микроциркуляторных нарушений в капиллярах мозга с токсико-аллергическим отеком мозговой ткани.
Она развивается на фоне основных синдромальных проявлений заболевания:
- гипертермии;
- гепатолиенального синдрома;
- анемии.
В мазках крови обнаруживают плазмодиев на промежуточных стадиях развития. Осложнение может развиться уже в первые дни малярии, но чаще регистрируется на 2-й неделе заболевания при отсутствии адекватного специфического лечения.
В его течении выделяют три последовательно развивающиеся стадии энцефалопатии.
• I стадия - сомноленция. Она проявляется нарастающей интенсивной головной болью, головокружением, повторной рвотой, вялостью, заторможенностью, сонливостью, реже возбуждением пациентов. Больные односложно отвечают на вопросы, дезориентированы в месте и времени, их реакции на раздражители (боль, прикосновение, звук и др.) снижены.
• II стадия - сопор. Характерны бледность кожного покрова, учащенное поверхностное дыхание, тахикардия, артериальная гипотензия. Сухожильные рефлексы оживлены, появляются патологические рефлексы, тонические и клонические судороги, менингеальные симптомы (менингизм). Возможно психомоторное возбуждение. Сознание спутанное, периодические кратковременные эпизоды бессознательного состояния (провалы сознания).
• III стадия - глубокая кома. Больной без сознания, адинамичен. Реакция на внешние раздражители отсутствует. При осмотре пациента отмечают мышечный гипертонус, артериальную гипотензию, выраженную одышку и нарушение ритма дыхания. Последовательно угасают сухожильные, брюшные, корнеальные рефлексы, развивается парез сфинктеров. В финале прекращается дыхание, а затем сердечная деятельность.
Длительность и выраженность каждой стадии могут варьировать, переход одной стадии в другую клинически не всегда четко очерчен. Летальный исход при отсутствии лечения наблюдается в 100% случаев и может наступить быстро, в течение 1-2 сут.
Гемоглобинурийная (черноводная) лихорадка развивается вследствие острого внутрисосудистого гемолиза до 20-50% всех эритроцитов, обусловленного иммуноаллергическими реакциями - образованием аутоиммунных комплексов, провоцирующих гемолиз не только инвазиро-
ванных, но и здоровых эритроцитов. Осложнение чаще развивается у лиц с дефицитом глюкозо-6-фосфатдегидрогеназы, неоднократно и длительно принимавших хинин и (или) примахин для лечения малярии. Основные клинические признаки:
- гипертермия с ознобом;
- интенсивная головная боль;
- миалгии и артралгии;
- боли в поясничной области, печени и селезенке;
- повторная рвота;
- прогрессирующая олигурия с отделением по каплям мочи черного цвета.
Быстро нарастают анемия и желтуха. Массивный гемолиз эритроцитов с гемоглобинурией приводит к нарушениям почечной микроциркуляции, в результате чего могут наступить клеточная аноксия и тубулярный некроз. В этих случаях развивается ОПН, возможен летальный исход.
Клинические проявления ИТШ, ОПН, гемолитической анемии, геморрагического синдрома описаны при изложении других нозологических форм инфекционных болезней, а также в руководствах по внутренним болезням.
Нефротический синдром - осложнение малярии-malariae. Проявляется отеками, артериальной гипертензией, протеинурией. При медленном, неуклонно прогрессирующем течении заболевания развивается почечная недостаточность.
Лечение
Больных малярией госпитализируют в инфекционные больницы (отделения). Этиотропное лечение начинают немедленно после установления клинико-эпидемиологического диагноза. При возможности перед этим следует взять кровь для паразитологического исследования. Лечение начинают с назначения гематошизонтоцидных средств c целью прекращения эритроцитарной шизогонии и купирования лихорадочных малярийных пароксизмов. Химиопрепараты применяют по соответствующим схемам. Выбор этиотропного средства проводят с учетом резистентности возбудителей в географической зоне, где произошло заражение. Для определения степени резистентности плазмодиев и оценки эффективности назначенного этиотропного лечения в процессе лечения больного рекомендованы повторные исследования уровня паразитемии, проводимые ежедневно или по крайней мере до начала и на 3-й день лечения (табл. 3-17).
Таблица 3-17. Степени химиорезистентности P. falciparum
Резистентность штамма | До лечения | 3-й день лечения | 7-й день от начала лечения | Через 1 мес |
Чувствительный штамм | + | - | - | - |
I степень | + | - | + | + |
II степень | + | +, уменьшение паразитемии более чем на 25% | + | + |
III степень | + | +, нет уменьшения паразитемии или уменьшение менее чем на 25% | + | + |
Для лечения нетяжелой и неосложненной малярии-falciparum в настоящее время применяют лекарственные препараты с учетом противопоказаний к ним:
- мефлохин (лариам*);
- галофантрин (халфан);
- хинина сульфат (или кинимакср);
- артемизининр и его производные (артесунатр, артеметерр и др.).
В связи с нарастающей резистентностью плазмодиев стали шире использовать схемы комбинированного лечения:
- артемизининр в сочетании с мефлохином;
- хинин в комбинации с доксициклином, тетрациклином или фансидаром*.
В связи с постоянно прогрессирующей резистентностью P. falciparum монотерапия такими препаратами, как хлорохин (делагил*) и другие 4-аминохинолины, фансидар*, фансимефр и метакельфинр, не рекомендована. Мефлохин в таблетках по 250 мг назначают в течение только 1 дня, по 2 таблетки 3 раза. Галофантринр в таблетках по 250 мг 3 раза с интервалом 6 ч в течение 1 дня.
При резистентности плазмодиев к указанным препаратам применяют комбинированные схемы:
- хинин и доксициклин;
- мефлохин и артемизининр.
Имеются данные по эффективному использованию в комбинированном лечении больных азитромицина и клиндамицина. При отсут-
ствии существенного снижения паразитемии на 3-й день лечения следует заменить используемый препарат на другой (из другой группы).
При так называемых доброкачественных видах малярии (малярии- vivax, малярии-ovale и малярии-malariae), а также при малярии-knowlesi применяют препараты группы 4-аминохинолинов:
- хлорохин (делагил*);
- нивахинр;
- амодиахинри др.
В случае резистентности штаммов P. vivax применяют мефлохин или хинин, как при неосложненной тропической малярии.
Хлорохин (Chloroquin diphosphat) назначают после еды по следующей схеме:
- 1,0 г препарата (0,6 г основания) в 1-й прием;
- 0,5 г (0,3 г основания) через 6 ч;
- затем - по 0,5 г (0,3 г основания) во 2-й и в 3-й дни лечения. При высокой паразитемии, а также при многократной рвоте у пациента гематошизонтоцидные препараты назначают парентерально.
Одновременно проводят патогенетическое лечение, внутривенно вводят растворы:
- 5% глюкозы;
- 0,9% натрия хлорида;
- реополиглюкина;
- антигистаминных препаратов.
Применяют также сердечно-сосудистые средства и витамины.
Для предупреждения отдаленных экзоэритроцитарных рецидивов малярии-vivax и малярии-ovale вслед за курсом лечения гематошизонтоцидными средствами или одновременно с ним назначают гистиошизонтоцидный препарат примахин, действующий на брадиспорозоиты, по 45 мг (27 мг основания) в день (3 таблетки) в течение 14 дней или 21 дня в случаях химиорезистентности штаммов к примахину. Больным с дефицитом глюкозо-6-фосфатдегидрогеназы примахин назначают по 0,75 мг/кг в сутки 1 раз в неделю на протяжении 6-8 нед. Препарат обладает и гаметоцидным действием, что учитывают при необходимости воздействия на долгоживущие гаметоциты P. falciparum. В таких случаях достаточен 3-дневный курс лечения примахином в обычных дозах - по 27 мг основания (3 таблетки) в сутки.
При осложненных и тяжелых формах заболевания (в основном тропической малярии) лечение проводят в отделениях реанимации и интенсивной терапии. После взятия мазков и исследования крови в
препаратах толстой капли начинают неотложные мероприятия. Проводят повторные (2-3 раза в сутки) медленные (в течение 4 ч) внутривенные капельные введения хинина дигидрохлорида в дозах 10-20 мг/кг (до 2,0 г в сутки) с 500 мл 5% раствора глюкозы*. С целью детоксикации, регидратации и коррекции метаболиического ацидоза назначают внутривенные капельные вливания реополиглюкина*, солевых полиионных растворов, аскорбиновой кислоты. Учитывая выраженные микроциркуляторные расстройства, общий объем инфузий не должен превышать 10-20 мл/кг. При судорогах, возбуждении, олигоанурии назначают лазикс*, маннитол, седуксен*, натрия бикарбонат, антигистаминные препараты.
В случае гемоглобинурийной лихорадки отменяют препараты, способствующие гемолизу. При выраженной анемии проводят переливания крови или эритроцитарной массы, инфузии растворов глюкозы* и хлорида натрия. При анурии показан гемодиализ.
Реконвалесцентов выписывают после окончания полного курса этиотропного лечения при 2-3 отрицательных результатах исследования крови (толстая капля). Больным, перенесшим малярию-vivax и малярию-ovale, курс лечения примахином можно проводить после выписки, в амбулаторных условиях. Целесообразно диспансерное наблюдение за переболевшими: в течение первых 2 мес еженедельно с контрольными лабораторными исследованиями, а затем - в течение 2 лет с ежеквартальными обследованиями (с апреля по сентябрь обследования ежемесячные).
Обследованию на малярию подлежат возвратившиеся из эндемичных районов в течение 3 лет после возвращения при любом повышении у них температуры тела, а также все неясные пациенты с анемией, лихорадкой невыясненного генеза и гепатолиенальным синдромом.
Эпидемиологический надзор
Система эпидемиологического надзора выполняет информационную, диагностическую, контрольную и управленческую функции.
• Информационная функция включает учет и регистрацию случаев и очагов, сбор данных о маляриогенности территории, миграции населения, оценку полученной информации, выпуск информационных писем для медицинской сети и заинтересованных ведомств (для исполнителей-эпидемиологов или паразитологов, энтомологов и их помощников).
• Диагностическая функция заключается в оперативной работе лечебно-профилактической и санитарно-эпидемиологической служб. Первая проводит выявление больных, клиническую и паразитологическую диагностику, вторая - эпидемиологическую диагностику (обследование больного и очага, наблюдение за очагом, ретроспективный и оперативный эпидемиологический анализ, изучение условий эпидемического процесса на данной территории).
• Контрольная функция, осуществляемая санитарно-эпидемиологической службой, состоит в контроле над выполнением мероприятий и оценке их эффективности, коррекции качества работы.
• Организационно-методическая (управленческая) функция предусматривает планирование мероприятий, срока и объема их проведения, расстановку исполнителей, подготовку кадров по диагностике, клинике, эпидемиологии малярии, выпуск методических указаний, памяток. Эту работу выполняет санитарно-эпидемиологическая служба совместно с ЛПУ и научно-исследовательскими учреждениями, разрабатывающими и внедряющими новые методы и средства борьбы с малярией.
Профилактические мероприятия
Малярия включена в перечень болезней, на которые распространяются Правила по санитарной охране территории, действующие на территории РФ, со всеми вытекающими из этого обстоятельствами. Каждое транспортное средство, уходящее из неблагополучной по малярии местности, должно быть свободно от комаров. Выявление источников инфекции остается одной из решающих мер в борьбе с болезнью и ее профилактике.
К контингентам, подозрительным на заболевание малярией, относят:
- лиц, проживающих в эндемичных местностях или прибывших из таких местностей, с повышением температуры тела, ознобом, недомоганием, увеличением печени и селезенки, желтушностью склер и кожных покровов, герпетическими высыпаниями, анемией;
- лиц, перенесших в течение последних 2 нед заболевание с такими симптомами.
Раннее и полное выявление больных в неблагополучных по малярии регионах возможно при регулярных подворных обходах в населенных пунктах в течение сезона передачи малярии с термометрией, опросом населения и взятием крови у подозрительных на малярию. Эти мероприятия следует сочетать с гигиеническим воспитанием населения, что способствует увеличению обращаемости и своевременному выявлению больных малярией. Всем больным проводят радикальное лечение.
Химиопрофилактику малярии разделяют на индивидуальную, сезонную и общественную.
• Личная химиопрофилактика включает прием специфических препаратов. Не предотвращая заражения малярией, она направлена на ограничение развития паразита в клетках печени или эритроцитах.
• Сезонную химиопрофилактику тиндурином в очагах проводят с момента обнаружения локальной вспышки 3-дневной малярии до окончания сезона передачи, прежде всего в условиях недостаточной эффективности противокомариных мероприятий. Она позволяет уменьшить заражаемость комаров.
• В очагах 3-дневной малярии при формировании значительной прослойки зараженных лиц, у которых возбудитель находится в латентной стадии, до начала следующего сезона проводят массовое профилактическое лечение примахином (межсезонную профилактику) всего населения.
Для защиты людей, выезжающих на неблагополучные по этой инфекции территории, рекомендуют индивидуальную химиопрофилактику: хлорохин по 0,25 г 2 раза в неделю курсом на 1 нед до выезда, во время пребывания там и в течение 4-6 нед после возвращения. Вопрос о назначении химиопрофилактики доброкачественных форм малярии решается врачом строго индивидуально, с учетом эпидемической ситуации в очаге, определяющей степень вероятности заражения, клинических особенностей пациента, доступности получения своевременной либораторной и лечебной помощи в случае заболевания. В очагах тропической малярии рекомендована индивидуальная химиопрофилактика мефлохином по 250 мг 1 раз в неделю. Она служит основным методом персональной защиты. В некоторых эндемичных районах применяют хлорохин в сочетании с прогуанилом в виде таблеток, содержащих по 200 мг прогуанила основания и по 50 мг хлорохина. Хотя химиопрофилактика не всегда предупреждает развитие болезни, она может предотвратить тяжелое течение малярии и летальный исход. Использование
других препаратов (доксициклин, хлорохин в сочетании с прогуанилом, атовакин в сочетании с прогуанилом, примахин и др.) определяет врачинфекционист с учетом эпидемической обстановки в регионе пребывания и других вышеуказанных факторов.
Снижения численности комаров-переносчиков достигают проведением гидротехнических мероприятий, противоличиночными обработками водоемов (мест выплода), обработкой жилых помещений и помещений для скота инсектицидами. Места выплода комаров уничтожают осушением болот, очисткой и углублением водоемов. Необходимо наблюдать за оросительной системой и предотвращать застой воды. Химические методы борьбы с комарами до сих пор остаются ведущими, хотя они и не всегда экологически безопасны, особенно при применении инсектицидов в водоемах. По объектам применения инсектициды подразделяют на имагоциды (против взрослых особей комаров) и ларвициды (против личинок). Для борьбы с комарами применяют фосфорорганические соединения, карбаматы и синтетические пиретроиды. Использование репеллентов, защитной одежды, сеток, пологов - составная часть комплекса профилактических мероприятий, направленных на защиту населения от нападения комаров. Защитить помещение от комаров можно с помощью установки сеток на окнах, вентиляционных отверстиях, устройства тамбуров, блокировки в дверях. Проведение мероприятий по борьбе с переносчиками на эндемичных территориях должно быть осуществлено рационально и экономически обосновано с учетом типа очага. В большинстве случаев очагом малярии бывает населенный пункт с расположенными на его территории или около него анофелогенными водоемами.
Очаги имеют различную пространственную и функциональную структуру, поэтому их подразделяют, по классификации Комитета экспертов ВОЗ, следующим образом:
- потенциальный очаг (передача возможна, но свежих случаев нет, есть только завозные);
- новый активный очаг (существует передача, появились вторичные случаи от завозных);
- активный остаточный очаг (существуют передача малярии и свежие местные случаи);
- псевдоочаг (передача невозможна по климатическим условиям или из-за отсутствия переносчика, имеются завозные случаи).
При эффективном проведении противомалярийных мероприятий происходят последовательные превращения очага из нового активного
в неактивный. Оздоровленным считают очаг, в котором местные случаи малярии отсутствуют в течение 3 лет и более после регистрации последнего больного. ВОЗ осуществляет борьбу с малярией в мире в рамках Программы «Обратить малярию вспять», принятой в 1998 г. В настоящее время для Европейского региона ВОЗ поставила новую цель - ликвидировать 3-дневную малярию к 2010 г., а тропическую - к 2015 г.
Приоритетные страны Европейского региона по малярии:
- Таджикистан;
- Турция;
- Кыргызстан;
- Азербайджан;
- Грузия.
Эпидемиологическая ситуация в этих странах продолжает оставаться напряженной.
Мероприятия в эпидемическом очаге
Лечение больного или паразитоносителя проводят в стационаре или на дому - в помещении, защищенном от залета комаров. Госпитализации подлежат больные по клиническим показаниям, беременные и дети. Реконвалесцентов выписывают после окончания полного курса этиотропного лечения при 2-3 отрицательных результатах исследования крови на малярийные плазмодии. Диспансерное наблюдение за переболевшим и паразитоносителем не регламентировано. В отношении контактных лиц разобщение не осуществляют. Дезинфекцию в очаге не проводят. Выборочную дезинсекцию проводят для уничтожения комаров в жилых помещениях, где находится больной или паразитоноситель, в соседних помещениях и хозяйственных постройках.
РИККЕТСИОЗЫ (RICKETTSIOSES)
Риккетсиозы - группа острых трансмиссивных инфекционных заболеваний, вызываемых риккетсиями. Они протекают с высокой лихорадкой, другими признаками выраженной интоксикации, поражением ткани, эндотелия кровеносных сосудов, ЦНС и внутренних органов. Для некоторых заболеваний также характерны кожные высыпания. Свое название возбудители (и, соответственно, связанная с ними группа заболеваний) получили в честь американского исследователя
Х.Т. Риккетса, впервые обнаружившего совместно с Р. Уайлдером (1909) возбудителя лихорадки Скалистых Гор (мексиканский сыпной тиф) и погибшего впоследствии при изучении этой инфекции. Основоположником современного учения о риккетсиозах выступает бразильский бактериолог Э. да Роха-Лима, впервые применивший термин «риккетсия» (1916) для обозначения возбудителя сыпного тифа в память Риккетса. В эволюционном плане риккетсии занимают промежуточное место между вирусами и бактериями, но их относят к бактериям. Риккетсии имеют ряд общих свойств.
• Их относят к облигатным внутриклеточным паразитам.
• В отличие от подавляющего большинства бактерий риккетсии не способны к росту на питательных средах.
• Их биология связана с паразитизмом у членистоногих (клещи, вши, блохи).
• Они имеют ряд особенностей в строении, размножении, биохимических, генетических и иммунобиологических характеристиках.
• Вызываемые риккетсиями заболевания (риккетсиозы) характеризуются своеобразием клиники и эпидемиологии.
• Требуют специализированных методов изучения (риккетсиологических).
Учение o риккетсиях и риккетсиозах, благодаря работам многих отечественных и зарубежных исследователей, приведено в стройную систему. Важную роль в этом отношении имеют труды академика П.Ф. Здродовского и его школы. Существенный вклад в развитие риккетсиологии в нашей стране внесла академик РАМН И.В. Тарасевич.
Ранее термин «риккетсии» в русскоязычной литературе применяли ко всем представителям порядка Rickettsiales, в настоящее время это слово применяют преимущественно к микроорганизмам, относящимся к семейству Rickettsiaceae, в ряде случаев еще более узко - к представителям рода Rickettsia.
Микроорганизмы семейства Anaplasmataceae порядка Rickettsiales эрлихии и анаплазмы известны около 100 лет как возбудители заболеваний животных, но их медицинская значимость выявлена относительно недавно. Исследования по двум наиболее распространенным нозологическим формам - моноцитарному эрлихиозу человека и гранулоцитарному анаплазмозу человека были начаты в конце 1980-х и начале 1990-х годов соответственно. B 1910 г. C. Theiler описал Anaplasma marginale - клещевой патоген крупного рогатого скота, поражающий бычьи эритроциты - возбудитель анаплазмоза крупного рогатого скота. Далее
представителями ветеринарной медицины были описаны Cowdria ruminantium - возбудитель сердечной водянки крупного рогатого скота, Ehrlichia canis, E. phagocytophila.
B 1945 г. было утверждено родовое название Ehrlichia в честь немецкого микробиолога П. Эрлиха. E. sennetsu - этиологический агент 1-го известного эрлихиоза человека (лихорадки Сеннетсу) был описан первоначально как представитель рода Rickettsia - R. sennetsu.
Открытию новых эрлихиозов человека предшествовало также описание в 1950 г. Neпrickettsia helminthoeca, в 1964 г. - Nelokommica, в 1969 г. - E. equi, в 1971 г. - E. ewingii, в 1978 г. - E. platys, в 1984 г. - E. risticii.
Существенный толчок к развитию исследований по эрлихиям связан c массовой гибелью служебных собак в американских войсках во Вьетнаме в 1968-1970 гг., вызванной Ehrlichia canis. При изучении этого вида эрлихий были выявлены его фенотипические связи с возбудителем лихорадки сеннетсу - R. sennetsu, что привело в 1984 г. к пересмотру таксономического положения этой риккетсии и включению ее в род Ehrlichia под видовым названием E. sennetsu. В настоящее время возбудитель лихорадки сеннетсу включен в род Neorickettsia под названием Neorickettsia sennetsu.
Интерес к изучению эрлихий существенно возрос, когда в США был описан 1-й случай моноцитарного эрлихиоза человека. Гранулоцитарный анаплазмоз человека впервые выявлен в 1991 г., его этиология уточнена в 1994 г.
Порядок Rickettsiales класса Proteobacteria домена Bacteria объединяет α1 протеобактерии 2 родов семейства Rickettsiaceae (рода Rickettsia и Orientia) и 4 родов вновь организованного семейства Anaplasmataceae (рода Anaplasma, Ehrlichia, Neorickettsia, Wolbachia).
Среди облигатных внутриклеточных микроорганизмов порядка Rickettsiales особое место занимают представители рода Rickettsia в связи c их эволюционным родством c митохондриями эукариот.
B составе рода традиционно выделяли две группы:
- клещевой пятнистой лихорадки;
- сыпного тифа.
Типовой вид - Rickettsia prowazekii да Rocha-Lima, риккетсия Прова-
чека (1916).
Генетические исследования позволили выделить 6 подгрупп:
- R. rickettsii;
- R. massiliae;
- R. akari;
- R. helvetica (эти 4 подгруппы соответствуют группе клещевой пятнистой лихорадки);
- R. prowazekii (соответствует группе сыпного тифа);
- R. canadensis (предковая, или ancestral, группа, предшествующая разделению риккетсий на группы клещевой пятнистой лихорадки и сыпного тифа).
Возбудитель лихорадки цуцугамуши - Orientia tsutsugamushi (ранее - Rickettsia tsutsugamushi) реквалифицирован из группы цуцугамуши рода Rickettsia в самостоятельный род Orientia. В составе этого рода предлагается выделить 9 видов. Все они вызывают 1 нозологическую форму (лихорадку цуцугамуши).
Риккетсии - грамотрицательные неподвижные микроорганизмы, не образующие спор. Они не растут на бактериальных питательных средах, их культивируют на куриных эмбрионах или культурах клеток, так как они относятся к внутриклеточным паразитам. Риккетсии нестойки к нагреванию, быстро инактивируются даже при 56 °С, при кипячении погибают моментально. Риккетсии инактивируются различными дезинфицирующими средствами - 0,5% раствором формалина в течение 30 мин, 0,5% раствором фенола. Быстро погибают под действием жирорастворителей (спирт, эфир, хлороформ). Будучи облигатными внутриклеточными паразитами, риккетсии тем не менее хорошо адаптированы к окружающим условиям. Наиболее длительно риккетсии сохраняются в высушенном состоянии и при низких температурах.
Они чувствительны к антибиотикам, проникающим внутрь инфицированных клеток:
- тетрациклинам;
- макролидам;
- азалидам и др.
Риккетсиозы встречают на всех континентах мира. Эпидемический сыпной тиф и волынская лихорадка - антропонозы, остальные риккетсиозы - зоонозы с природной очаговостью. За исключением ку-лихорадки, для всех риккетсиозов характерен трансмиссивный механизм передачи.
СЫПНОЙ ТИФ (TYPHUS EXANTEMATICUS)
Сыпной тиф (эпидемический сыпной тиф, лагерный тиф, вшивый сыпной тиф и другие синонимы) - острый антропонозный трансмиссивный риккетсиоз, характеризующийся выраженной интоксикацией
с тифозным статусом, экзантемой и энантемой, поражением сердечнососудистой (в виде системного пантромбоваскулита) и нервной систем.
Краткие исторические сведения
Впервые достоверное описание сыпного тифа сделал Дж. Фракасторо (1528) во время эпидемии в Италии. Эпидемии сыпного тифа неоднократно вызывали опустошения среди населения Земли, особенно во время различных социальных потрясений (отсюда синонимы - голодный или военный тиф). Эпидемия наибольшего масштаба зарегистрирована в России в период с 1914 по 1922 г., когда заболели более 25 млн человек и 3 млн погибли. Лишь в середине XIX в. благодаря работам Т. Мерчисона (1862), С.П. Боткина (1868) и В. Гризингера (1887) сыпной тиф был выделен в отдельную нозологическую единицу, дифференцирующую его от других тифозных поражений. В опыте по самозаражению кровью больного О.О. Мочутковским (1876) доказана инфекционная природа болезни. Д.В. Попов описал характерные гранулемы в головном мозге при сыпном тифе. Возбудитель заболевания впервые выделен от инфицированных вшей, снятых с больных сыпным тифом С. фон Провацеком (1913), поэтому по предложению бразильского исследователя Э. да Роха-Лима (1916) он назван Rickettsia prowazekii. Роль вшей в передаче инфекции доказал Ш. Николь и соавт. (1906).
Большой вклад в изучение заболевания внесли отечественные ученые А. Логвиновский, Я. Шировский, Я. Говоров, К.Н. Токаревич, Н.И. Рагоза, П.Ф. Здродовский, К.М. Лобан и др.
Этиология
Возбудитель - грамотрицательная мелкая неподвижная бактерия Rickettsia prowazekii dа Rocha-Lima рода Rickettsia семейства Rickettsiaceae.
Спор и капсул не образует, морфологически полиморфна:
- может иметь вид кокков, палочек и нитей;
- все формы сохраняют патогенность.
Основные Аг локализуются в двухслойной клеточной оболочке риккетсии:
- более поверхностный термостабильный Аг липидной природы;
- термолабильный видоспецифический белково-полисахаридный комплекс.
Rickettsia prowazekii отнесена ко 2-й группе патогенности. Факторы патогенности возбудителя:
- фимбрии и пили;
- белки клеточной стенки;
- фосфолипаза А2;
- гемолизины;
- ЛПС-комплекс, сходный по антигенной структуре с протейным. Основные методы окрашивания риккетсий:
- метод Романовского-Гимзы;
- серебрение по Морозову.
В организме человека возбудители размножаются только в цитоплазме и никогда в ядрах инфицированных клеток. Для культивирования Rickettsia prowazekii в лабораторных условиях необходимы перевиваемые культуры клеток, куриные эмбрионы, легочная ткань белых мышей.
Во внешней среде риккетсии довольно устойчивы:
- в испражнениях вшей, попадающих на одежду, сохраняют жизнеспособность и патогенность в течение 3 мес и более;
- длительно сохраняются при низких температурах и в высушенном состоянии.
При температуре 56 °С погибают за 10 мин, при 100 °С - за 30 с. Быстро инактивируются под действием хлорамина, формалина, лизола, кислот, щелочей в обычных концентрациях.
Эпидемиология
Резервуар и источник инфекции - больной человек, представляющий опасность в течение 10-21 сут:
- в последние 2 дня инкубации;
- весь лихорадочный период и первые 2-3 дня;
- иногда 7-8 дней нормальной температуры тела.
Механизм передачи - трансмиссивный, возбудитель передается через вшей, главным образом платяных и в меньшей мере головных. Вошь заражается при кровососании больного и становится заразной на 5-7-е сутки. За этот срок происходит размножение риккетсий в эпителии кишечника, где они обнаруживаются в огромном количестве. Средний срок жизни вши 40-45 дней, зараженной вши 10-14 дней. Человек заражается, втирая при расчесывании фекалии вшей в места их укусов. Возможно также заражение воздушно-пылевым путем при вдыхании высохших фекалий вшей и при их попадании на конъюнктиву.
Естественная восприимчивость людей
Естественная восприимчивость людей высокая. Постинфекционный иммунитет напряженный, длительный и поддерживается за счет персистенции риккетсии Провачека в организме переболевших сыпных тифом. Вместе с тем у последних возможны рецидивы, известные как болезнь Брилла-Цинссера.
Основные эпидемиологические признаки
В отличие от прочих риккетсиозов сыпной тиф не имеет истинных эндемических очагов, тем не менее его отличает некоторая эндемичность для стран Магриба и Юга Африки, Центральной и Южной Америки, некоторых азиатских регионов. На распространенность сыпного тифа прямо влияют социальные факторы, в частности педикулез у людей, живущих в неудовлетворительных санитарно-гигиенических условиях (скученность в жилищах или в производственных помещениях, массовая миграция, недостаточные санитарно-гигиенические навыки, отсутствие централизованного водоснабжения, бань, прачечных и др.). Эпидемический характер заболевание приобретает во время войн, голода, стихийных бедствий (засуха, наводнения и др.).
Группу риска составляют люди без определенного места жительства, работники сферы обслуживания:
- парикмахерских;
- бань;
- прачечных;
- транспорта;
- ЛПУ и др.
Для заболевания характерна зимне-весенняя сезонность (январьмарт). Отмечено формирование внутрибольничных вспышек, возникающих в результате непринятия мер по борьбе с педикулезом, несвоевременного выявления больных рецидивной формой инфекции и их изоляции.
Патогенез
После проникновения в организм человека риккетсии в течение нескольких дней размножаются в эндотелии кровеносных и лимфатических капилляров кожи в месте входных ворот. Затем происходит частичный выход возбудителей в кровоток (первичная риккетсиемия инкубационного периода), где они быстро погибают под влиянием бактерицидной системы крови или внедряются в эндотелий сосудов,
а основная масса возбудителей по лимфатическим путям достигает регионарных лимфатических узлов. Пили и белки клеточной стенки обеспечивают адгезию риккетсий на клетках-мишенях, фосфолипаза-А2 разрыхляет клеточные мембраны, способствуя их проникновению внутрь клеток. В течение инкубационного периода заболевания в эпителиальных клетках лимфатических узлов и в сосудистом эндотелии формируются множественные метастатические очаги инфекции, где продолжается размножение и накопление возбудителей, и начинают развиваться деструктивные и некробиотические процессы. За короткое время (72-96 ч) в каждой пораженной клетке возникает популяция до 1000 микроорганизмов.
В начальном периоде и в разгаре болезни при массовой гибели инфицированных эндотелиальных клеток усиливается риккетсиемия, приводящая к дальнейшей генерализации инфекции, прогрессирует токсинемия за счет выделения в сосудистое русло эндогенных пирогенов (провоспалительных цитокинов - ИЛ-1, ИЛ-6, ФНО-α и др.), а также биологически активных продуктов клеточного распада.
Развитие интоксикации приводит к изменениям реологических свойств крови, нарушениям микроциркуляции, функциональным сосудистым нарушениям во всех органах и системах:
- расширению сосудов с артериальной гипотензией;
- повышению проницаемости сосудистых стенок;
- паралитической гиперемии;
- стазу;
- тромбозам;
- возможному формированию ДВС-синдрома. Нарастают гипоксемия и метаболический ацидоз.
В кровеносных сосудах развиваются специфические патоморфологические изменения - универсальный генерализованный панваскулит. На участках погибших клеток эндотелия формируются пристеночные конусовидные тромбы в виде бородавок с ограниченными перифокальными деструктивными изменениями (бородавчатый эндоваскулит). В месте дефекта формируется клеточный инфильтрат - периваскулит (муфты). Возможно дальнейшее прогрессирование деструктивного процесса и обтурация сосуда тромбом - деструктивный тромбоваскулит. Истончается стенка сосудов, повышается ее ломкость. При нарушении целостности сосудов вокруг них развивается очаговая пролиферация полиморфно-ядерных клеток и макрофагов, в результате чего образуются сыпнотифозные гранулемы - узелки Попова-Давыдовского. Их
образованию способствует и присоединяющийся воспалительный процесс с гранулоцитарной реакцией. В результате указанных патоморфологических изменений формируется деструктивно-пролиферативный эндотромбоваскулит, представляющий патоморфологическую основу сыпного тифа (А.И. Струков).
Клинически гранулемы проявляют себя с 5-го дня болезни, после завершения их формирования во всех органах и тканях, но наиболее выраженно - в головном мозге и его оболочках, сердце, надпочечниках, коже и слизистых оболочках. Вместе с расстройствами микроциркуляции и дистрофическими изменениями в различных органах создаются специфические патоморфологические предпосылки к клиническому развитию менингитов и менингоэнцефалитов, миокардитов, патологии печени, почек, надпочечников, розеолезно-петехиальной экзантемы и энантемы в виде петехий и геморрагий.
Нарастание титров специфических АТ в ходе инфекционного процесса, активизация фагоцитоза, формирование иммунных комплексов с избытком АТ обусловливают снижение риккетсиемии и токсинемии (что клинически проявляется улучшением состояния больного, обычно после 12-го дня болезни), а в дальнейшем приводят к элиминации возбудителя. Вместе с тем в части случаев после клинического выздоровления возбудитель может длительно латентно сохраняться в мононуклеарных фагоцитах лимфатических узлов и других органов СМФ с развитием нестерильного иммунитета.
Клиническая картина
Циклическое течение болезни подразделяют на следующие периоды:
- инкубационный;
- начальный;
- разгара заболевания;
- реконвалесценции.
Инкубационный период варьирует от 6 до 25 дней, в среднем продолжается около 2 нед. Начальный период
Продолжается 4-5 дней - с момента повышения температуры тела до появления экзантемы. При этом учитывают, что вошь заражается при кровососании на теле больного человека и способна передавать инфекцию не ранее чем через 5-7 дней. Желательно установить клинический диагноз именно в эти сроки для своевременного проведения дезинсек-
ционных мероприятий и тем самым предотвратить распространение заболевания.
Сыпной тиф отличает острое начало. Продромальные признаки в виде чувства разбитости, ухудшения сна и настроения, тяжести в голове отмечают лишь у отдельных больных. Температура тела в течение суток поднимается до высоких цифр, ее повышение сопровождают головная боль, ломота в теле, чувство жара. В последующие дни температура тела сохраняется на уровне 39-40 °С, принимает постоянный характер.
Нарастают признаки интоксикации:
- мучительная головная боль;
- головокружение;
- жажда;
- упорная бессонница;
- тактильная, слуховая и зрительная гиперестезия.
В некоторых случаях возникает рвота центрального генеза. Озноб при сыпном тифе нехарактерен и проявляется иногда лишь в 1-й день болезни.
Больные некритичны к своему состоянию, эйфоричны, возбуждены, многословны при ответах на вопросы. Иногда наблюдают затемнение сознания. Кожа лица, шеи и верхней части туловища гиперемирована, сухая и горячая на ощупь, лицо одутловато, амимично, выражены инъекция склер, гиперемия конъюнктив (кроличьи глаза). Со 2-3-го дня болезни появляются эндотелиальные симптомы (щипка, симптом жгута Кончаловского-Румпеля-Лееде, симптом резинки). В это же время или к 3-4-м сут в 5-10% случаев можно заметить мелкие кровоизлияния на переходных складках конъюнктив (симптом Киари-Авцына). Вследствие повышенной ломкости сосудов при приеме твердой пищи могут возникать точечные кровоизлияния на мягком нёбе, язычке и слизистой оболочке задней стенки глотки (энантема Розенберга). Патология со стороны органов дыхания не характерна, за исключением незначительной одышки. Тоны сердца приглушены, выражена тахикардия, проявляется отчетливая тенденция к артериальной гипотензии. Язык сухой, обложен, живот может быть вздут за счет метеоризма. Печень и селезенка несколько увеличены с 4-5-го дня заболевания, безболезненны при пальпации. Наблюдается склонность к запорам, возможна олигурия. На 4-5-е сутки болезни у части больных температура тела кратковременно снижается (розенберговский врез) без улучшения состояния и самочувствия, а затем снова достигает высоких цифр. В это же время отмечают снижение АД. Уже в конце начального периода иногда можно выявить симптом
Говорова-Годелье - в ответ на просьбу показать язык пациент высовывает его с трудом, толчками, задевая кончиком языка за зубы. При высовывании может быть тремор языка и отклонение его от центральной линии. Симптом Говорова-Годелье свидетельствует о развитии бульбарных неврологических расстройств, характерных для сыпного тифа. Период разгара
Начало периода разгара обычно принято связывать с появлением экзантемы на 4-6-й день болезни. Вместе с тем разграничение периодов начального и разгара по клиническим признакам довольно условно, тем более что экзантема в ряде случаев сыпного тифа может отсутствовать (typus exantematus sine exantematae - сыпной тиф без сыпи).
В этот период сохраняется высокая, постоянная или ремиттирующая лихорадка, возможен 2-й розенберговский врез на 10-11-е сутки болезни. Сохраняются и усиливаются основные жалобы больных, мучительная головная боль приобретает пульсирующий характер. Возникают гиперестезии (тактильная, слуховая, зрительная). При появлении экзантемы сыпь возникает одномоментно, имеет розеолезно-петехиальный характер, более выражена на боковых поверхностях туловища, внутренних поверхностях конечностей и не захватывает лицо, ладони и подошвы. Количество элементов сыпи обычно значительное. Последующие подсыпания для сыпного тифа не характерны, за исключением возможного появления новых петехиальных элементов.
Прогрессируют тахикардия и артериальная гипотензия. Язык сухой, часто с темно-коричневым налетом за счет геморрагического диапедеза через трещинки на его поверхности. Отчетливо выражен гепатолиенальный синдром, часто возникают метеоризм и запоры. Изредка появляются умеренные боли в поясничной области и положительный симптом поколачивания (Пастернацкого) за счет поражения мелких сосудов почек и геморрагий в почечную капсулу. Нарастает олигурия с появлением в моче белка и цилиндров. Могут развиться атония мочевого пузыря с подавлением рефлекса на мочеиспускание вследствие токсического поражения вегетативных нервных ганглиев и развития тормозных корковых процессов в ЦНС, при этом моча выделяется каплями (парадоксальное мочеиспускание).
Усиливается бульбарная неврологическая симптоматика. Она проявляется тремором языка, его девиацией, амимией, реже дизартрией, сглаженностью носогубных складок, симптомом Говорова-Годелье. Иногда отмечают нарушения глотания, нистагм, анизокорию, вялость зрачковых реакций, снижение слуха. Могут появиться признаки менингизма
или серозного менингита с повышением количества лимфоцитов в спинномозговой жидкости, а также энцефалита - нарушения орального автоматизма, симптомы Гордона и Оппенгейма, общий тремор.
Тяжесть сыпного тифа варьирует в широких пределах. В большинстве случаев (около 70%) заболевание протекает в среднетяжелой форме. При тяжелом течении болезни в 10-15% случаев может развиться так называемый тифозный статус (status typhosus). Прогрессирует бессонница, неглубокий сон сопровождают сновидения устрашающего характера, из-за чего больные иногда боятся заснуть. Возможно развитие острой сердечно-сосудистой недостаточности.
Характерны психические нарушения (особенно у лиц, страдающих алкоголизмом или перенесших черепно-мозговую травму):
- психомоторное возбуждение;
- раздражительность;
- говорливость;
- расстройство памяти.
Часто наблюдают дезориентацию больных, возможны бред, галлюцинации, потеря сознания.
Период разгара заканчивается с нормализацией температуры тела, что обычно происходит к 13-14-му дню болезни.
Период реконвалесценции
К 13-14-му дню болезни температура обычно снижается до нормальных показателей по типу ускоренного лизиса. Уменьшаются и исчезают симптомы интоксикации, медленно регрессируют признаки поражения нервной системы; к этому времени угасает сыпь, нормализуются размеры печени и селезенки. В последующем долго, в течение 2-4 нед, сохраняются слабость и апатия, эмоциональная неустойчивость, снижение памяти, бледность кожи, функциональная лабильность сердечно-сосудистой системы. В редких случаях возможно развитие ретроградной амнезии.
Ранние рецидивы при сыпном тифе не развиваются.
Дифференциальная диагностика
В начальном периоде сыпной тиф следует отличать от гриппа, менингококковой инфекции, геморрагических лихорадок, пневмоний и других состояний, сопровождающихся лихорадкой. При установлении диагноза сыпного тифа в этот период принимают во внимание острое начало болезни с подъемом температуры тела в течение суток до высо-
ких цифр, постоянный характер лихорадки в дальнейшем, возможность розенберговских врезов на 4-5-й день болезни, выраженные признаки интоксикации. При осмотре больных отмечают эйфорию и возбуждение, гиперемию лица, шеи и верхней части туловища, одутловатость и амимичность лица, инъекцию склер, гиперемию конъюнктив. Выявляют эндотелиальные симптомы, симптом Киари-Авцына, энантему Розенберга, тахикардию, гепатолиенальный синдром.
При появлении экзантемы (наступление периода разгара) заболевание дифференцируют с брюшным тифом и паратифами, корью, лекарственной болезнью, сепсисом, сифилисом и другими лихорадочными состояниями, для которых характерны кожные высыпания. У больных сыпным тифом сохранены основные симптомы начального периода, головная боль становится мучительной, пульсирующей, температура тела остается высокой. Одномоментно появляется обильная розеолезнопетехиальная экзантема, более выраженная на боковых поверхностях туловища и внутренних поверхностях конечностей. Язык сухой, часто с темно-коричневым налетом. Выражены олигурия, протеинурия, цилиндрурия.
Нарастает бульбарная неврологическая симптоматика:
- тремор языка и его девиация;
- дизартрия, амимия;
- сглаженность носогубных складок;
- симптом Говорова-Годелье.
Могут развиться менингизм или серозный менингит, парадоксальное мочеиспускание.
Лабораторная диагностика
Изменения гемограммы при сыпном тифе умеренные:
- лейкоцитоз;
- нейтрофилез со сдвигом влево;
- повышение СОЭ.
Выделение возбудителя, как правило, не проводят из-за сложности культивирования риккетсий. Возможна постановка ИФА для обнаружения риккетсиозного Аг. Для подтверждения диагноза в основном применяют серологические методы. Наиболее быстрый ответ в первые дни болезни дает РНГА, ее титры к концу 1-й недели могут достигать 1:1000. На 2-й неделе выявляются комплементсвязывающие АТ в РСК с растворимым риккетсиозным Аг, титры реакции 1:160 и выше. Рекоменду-
ют постановку серологических реакций как с цельной сывороткой крови, так и с ее фракциями, содержащими сывороточные IgM и IgG. В те же сроки или немного раньше выявляются АТ в РНИФ или методом ИФА. Перспективны ПЦР и РНИФ с моноклональными АТ.
Осложнения и исходы
К серьезным осложнениям сыпного тифа в разгар болезни относят ИТШ с проявлениями острой сердечно-сосудистой недостаточности на фоне острой недостаточности надпочечников. Это осложнение чаще всего наступает на 4-5-й или 10-12-й день болезни. Развитие острой сердечно-сосудистой недостаточности сопровождает падение температуры тела до нормальных или субнормальных цифр (розенберговские врезы). При сыпном тифе в процессе заболевания всегда создается патоморфологическая база для развития миокардитов. Кроме того, к осложнениям заболевания относят менингиты и менингоэнцефалиты, психозы, в редких случаях тромбозы и тромбоэмболии.
Частые осложнения связаны с присоединением вторичной бактериальной флоры:
- пневмонии (чаще гипостатические);
- пиелонефриты;
- отиты;
- паротиты;
- стоматиты;
- цистит;
- тромбофлебиты;
- фурункулез.
При длительном постельном режиме могут развиться пролежни и даже гангрена дистальных отделов конечностей, к чему предрасполагают типичные для сыпного тифа поражения сосудов.
При адекватном лечении исход заболевания в большинстве случаев благоприятный, летальность не превышает 1%, но при отсутствии лечения антибиотиками она может достигать 13-14%.
Лечение
В случаях сыпного тифа или при подозрении на него необходима госпитализация больного в инфекционные отделения. При этом проводят проверку пациента на педикулез и, при необходимости, дезинсекцию. Строгий постельный режим назначают не менее чем до 5-7-го дня нормальной
температуры тела. Вставать с постели больным разрешают на 7-8-й день апирексии, ходить - еще через 2-3 сут, сначала под наблюдением медперсонала из-за опасности ортостатического коллапса. Необходимы тщательное наблюдение медперсонала, уход за больными, туалет кожи и полости рта для профилактики пролежней, стоматита, паротита. Рацион питания обычный, за исключением острых продуктов (стол ? 13).
Для этиотропного лечения применяют препараты тетрациклинового ряда (тетрациклин или окситетрациклин* в суточной дозе 1,2-1,6 г, доксициклин по 100 мг 2 раза в день) или левомицетин* по 2,0 г в сутки. Положительный эффект от применения тетрациклиновых препаратов проявляется уже через 2-3 дня лечения. Курс лечения охватывает весь лихорадочный период и первые 2 сут нормальной температуры тела.
Необходимо активное дезинтоксикационное лечение с внутривенным введением растворов и форсированным диурезом. При необходимости назначают сердечно-сосудистые, седативные и снотворные препараты, анальгетики. Показаны витамины групп С, Р, В в достаточных дозах. Для профилактики тромбозов и тромбоэмболий рекомендуют антикоагулянты (гепарин*, фенилин*, пелентан* и др.). Глюкокортикоиды (преднизолон) применяют только при тяжелом сыпном тифе с выраженной интоксикацией, ИТШ и угрозой развития коллапса из-за острой надпочечниковой недостаточности. Чрезмерное увлечение жаропонижающими средствами может способствовать развитию острой сердечно-сосудистой недостаточности.
Выписку больных осуществляют не ранее 12-го дня апирексии (период значительного клинического улучшения состояния и основной период рассасывания гранулем).
Эпидемиологический надзор
Включает своевременное выявление случаев рецидивного сыпного тифа и педикулеза среди населения. Заболеваемость сыпным тифом прямо зависит от завшивленности, поэтому контроль за санитарногигиеническими условиями в организованных коллективах и повышение общего уровня жизни обеспечивают профилактику сыпного тифа.
Профилактические мероприятия
Профилактические мероприятия включают прежде всего борьбу с педикулезом. В борьбе со вшами применяют механический (вычесывание насекомых и их яиц частым гребнем, стрижка или сбривание волос),
физический (кипячение и проглаживание горячим утюгом белья и особенно камерная дезинсекция) и химические способы. В последнем случае используют 0,15% водную эмульсию карбофоса, 5% борную мазь, перметрин, 10% водную мыльно-керосиновую эмульсию при экспозиции 20-30 и даже 40 мин (для перметрина) или наиболее доступные 3% мыло ГХЦГ, 10% мазь метилацетофоса (экспозиция этих препаратов не менее 1-2 ч). При необходимости обработку педикулоцидами повторяют через 7-10 дней. Весьма надежна камерная обработка постельных принадлежностей, одежды и белья больных. Специфическая профилактика сыпного тифа имеет вспомогательное значение и сводится к применению по эпидемиологическим показаниям убитых или живых вакцин.
При головном и платяном педикулезе в очагах сыпного тифа допускают применение (кроме детей до 4 лет) бутадиона. После его приема внутрь кровь человека становится токсичной для вшей в течение 14 дней. Взрослые принимают препарат в течение 2 сут после еды по 0,15 г 4 раза в день, дети 4-7 лет - 0,05 г, 8-10 лет - 0,08 г, старше 10 лет - 0,12 г 3 раза в сутки.
Мероприятия в эпидемическом очаге
Больные сыпным тифом подлежат госпитализации. Перед госпитализацией проводят полную санитарную обработку с дезинсекцией одежды и белья. Больные, лихорадящие более 5 дней, с подозрением на сыпной тиф подлежат двукратному серологическому обследованию. Реконвалесцентов выписывают через 12 дней после нормализации температуры тела. За лицами, бывшими в контакте с больным сыпным тифом, устанавливают медицинское наблюдение в течение 25 дней с ежедневной термометрией, считая с момента проведения санитарной обработки. Можно проводить экстренную профилактику в течение 10 дней доксициклином 1 раз в сутки по 0,2 г, рифампицином 2 раза в сутки по 0,3 г, тетрациклином 3 раза в сутки по 0,5 г. Белье, одежду, постельные принадлежности больного и лиц, общавшихся с ним, обеззараживают камерным или химическим способом. Носильные вещи можно прогладить горячим утюгом. Помещение обрабатывают 0,5% раствором хлорофоса или 0,15% эмульсией карбофоса либо 10% дустом дилора, 1% дустом неопина из расчета 10-15 г на 1 м2 обрабатываемой поверхности. Через 2 ч помещение проветривают и делают влажную уборку.
БОЛЕЗНЬ БРИЛЛА-ЦИНССЕРА
Болезнь Брилла-Цинссера (рецидивный сыпной тиф) - спорадический отдаленный эндогенный рецидив сыпного тифа в отсутствие педикулеза. Проявляется типичными симптомами сыпного тифа, но более легким течением.
Краткие исторические сведения
Случаи спорадического сыпного тифа без участия вшей-переносчиков описаны американским исследователем Н.Э. Бриллом (1910); позже Х. Цинссер и М. Кастанеда (1933) объяснили их возникновение рецидивом эпидемического сыпного тифа. В России эту форму заболевания изучали К.Н. Токаревич, П.Ф. Здродовский, Г.С. Мосинг, К.М. Лобан и др.
Этиология
См. раздел «Сыпной тиф».
Эпидемиология
Резервуар и источник инфекции - человек, переболевший 10-40 лет назад сыпным тифом. В развитии болезни отсутствует фактор инфицирования. Случаи заболевания появляются в отсутствие вшей, часто у лиц, проживающих в хороших гигиенических условиях. Болеют люди пожилого возраста, в прошлом перенесшие сыпной тиф. При завшивленности больные болезнью Брилла-Цинссера представляют опасность для окружающих. Предполагается возможность длительного (многолетнего) сохранения возбудителя в организме.
Частота заболевания зависит от числа лиц, ранее перенесших сыпной тиф, она высока там, где в прошлом отмечались вспышки этой болезни. Болезнь Брилла-Цинссера чаще регистрируют в городах. Обычно она проявляется в виде спорадических случаев. Заболевание регистрируют в любое время года.
Патогенез
Принято считать, что у части переболевших сыпным тифом риккетсии Провачека способны десятилетиями сохраняться в клетках лимфатических узлов, печени и других органов. Причины возникновения
рецидива в отдаленный период (через годы и десятилетия после первичного заболевания сыпным тифом), вероятно, связаны с развитием иммуносупрессии возрастного или иного характера.
Патогенез заболевания идентичен таковому при сыпном тифе (см. раздел «Сыпной тиф»).
Клиническая картина
Заболевание встречается преимущественно у лиц старшего возраста, последовательно проходит те же периоды, что и сыпной тиф:
- начальный;
- разгара болезни;
- реконвалесценции.
Клиническая картина болезни Брилла-Цинссера соответствует легким или среднетяжелым формам сыпного тифа. Начальный период
Наблюдают умеренные проявления лихорадки (иногда только субфебрилитет) и других признаков интоксикации - головной боли, нарушений сна. В целом лихорадочный период с постоянной или ремиттирующей температурой тела может быть укорочен до 7-8 дней.
Период разгара
Так же как при сыпном тифе, начало периода разгара связывают с появлением экзантемы на 5-6-й день болезни. Экзантема возникает значительно реже, чем при сыпном тифе, и бывает более скудной, зачастую проявляется только розеолами, сохраняющимися 1-2 дня. Симптомы повышенной ломкости сосудов слабо выражены, энантема Розенберга при болезни Брилла-Цинссера встречается редко. Гепатолиенальный синдром развивается не всегда. Нарушения со стороны сердечно-сосудистой системы у пожилых лиц довольно типичны, что в определенной степени может быть связано с возрастными особенностями пациентов.
Признаки поражения ЦНС чаще умеренные:
- головная боль;
- бессонница;
- некоторая возбужденность;
- говорливость.
Гиперестезия, менингеальные признаки, нарушения сознания не характерны. Вместе с тем нередко выявляют симптом Говорова-Годелье и другие признаки бульбарных нарушений.
Период реконвалесценции
В этом периоде могут оставаться слабость, бледность кожи, функциональная лабильность сердечно-сосудистой системы, однако эти нарушения исчезают значительно быстрее, чем при сыпном тифе.
Дифференциальная диагностика
См. раздел «Сыпной тиф».
Лабораторная диагностика
Применяют те же серологические методы, что и при сыпном тифе (РНГА, РСК). Однако при болезни Брилла-Цинссера АТ выявляют в более высоких титрах, и с первых дней болезни они представлены в основном IgG. Поскольку после сыпного тифа комплементсвязывающие АТ сохраняются в течение многих лет, у части больных болезнью Брилла-Цинссера они могут быть выявлены в низких титрах с первых дней заболевания.
Осложнения и исходы
Осложнения встречают редко (главным образом пневмонии, тромбофлебиты).
Лечение
См. раздел «Сыпной тиф».
Эпидемиологический надзор
См. раздел «Сыпной тиф».
Профилактические мероприятия
См. раздел «Сыпной тиф».
Мероприятия в эпидемическом очаге
См. раздел «Сыпной тиф».
СЕВЕРОАЗИАТСКИЙ
КЛЕЩЕВОЙ РИККЕТСИОЗ
Североазиатский клещевой риккетсиоз (синонимы: клещевой риккетсиоз, клещевая сыпнотифозная лихорадка, клещевой тиф Востока, восточный сыпной тиф, клещевой сыпной тиф Сибири, иксодориккетсиоз) - острая природно-очаговая трансмиссивная инфекция, протекающая с лихорадочной реакцией, распространенной макулопапулезной сыпью, первичным аффектом и регионарным лимфаденитом.
Краткие исторические сведения
Клинические описания болезни под названием «клещевая лихорадка Приморья» впервые представили Е.И. Милль (1936), а также Н.И. Антонов и А.Г. Найштат (1936-1937), назвавшие заболевание «дальневосточная сыпная клещевая лихорадка». В 1938-1940-х годах на Дальнем Востоке были проведены научные экспедиции Наркомздрава СССР под руководством М.К. Кронтовской и позднее Е.Н. Павловского. В эти годы выделен возбудитель из воспалительного очага на коже в месте укуса клеща и из крови больного, установлены эпидемиологические закономерности и клинические особенности инфекции.
Этиология
Возбудитель - Rickettsia sibirica рода Rickettsia семейства Rickettsiaсеае. Имеет сходство с другими риккетсиями рода Rickettsia, но отличается от них низкой вирулентностью. Обладает выраженной оболочкой, размножается в цитоплазме и ядрах пораженных клеток.
Эпидемиология
Резервуар инфекции в природных очагах болезни составляют иксодовые клещи, обитающие в степных и луговых кустарниковых зарослях, главным образом представители рода Dermacentor. Инфицированные клещи сохраняют возбудитель годами и передают его трансовариально.
Дополнительный резервуар инфекции составляют многочисленные виды грызунов:
- суслики;
- хомяки;
- бурундуки;
- полевые, лесные и домовые мыши;
- полевки и др.
Механизм передачи - трансмиссивный, реализуется при укусах и кровососании инфицированных клещей, в слюне которых содержатся риккетсии. Известны случаи заражения при попадании гемолимфы клеща или его высушенных испражнений на поврежденную кожу или слизистые оболочки.
Естественная восприимчивость людей
Естественная восприимчивость высокая. Постинфекционный иммунитет стойкий, продолжительный, случаи повторных заболеваний не зарегистрированы.
Основные эпидемиологические признаки
Заболевание отличается выраженной сезонностью, с марта по сентябрь. Максимальная заболеваемость наблюдается весной и в начале лета (период наибольшей активности клещей). Возможен 2-й осенний подъем заболеваемости, обусловленный 2-й генерацией клещей. Заболеваемость спорадическая, в некоторых природных очагах превышает 10-15 случаев на 100 000 населения, болеют преимущественно сельские жители. Ареал инфекции в РФ простирается от Урала до берегов Тихого океана, включая Алтайский край, Западную, Центральную и Восточную Сибирь, Забайкалье, Хабаровский и Приморский края. Заболевание регистрируют также в Армении, в некоторых районах Восточного и Северного Казахстана, Киргизии и Туркмении, восточной части Монголии.
Патогенез
Патогенез заболевания в целом аналогичен патогенезу сыпного тифа (см. раздел «Сыпной тиф»). В месте входных ворот инфекции возникает первичный аффект - локальная воспалительная реакция с некрозом кожи, сопровождаемая регионарным лимфаденитом. Первичная риккетсиемия приводит к поражению эндотелия сосудов. Возбудители размножаются в эндотелии кровеносных и лимфатических капилляров, а также в регионарных лимфатических узлах и после этого повторно выходят в кровь, обусловливая массивную риккетсиемию и эндотоксинемию, определяющие развитие клинических проявлений болезни. Проникновение возбудителей во внутренние органы вызывает воспалительные изменения в кровеносных и лимфатических сосудах по типу специфического доброкачественного панваскулита. При этом пролиферативные
процессы преобладают над деструктивными, что объясняет более легкое течение заболевания по сравнению с эпидемическим сыпным тифом.
Патоморфологические изменения наиболее выражены в сосудах кожи (экзантема), меньше в сосудах головного мозга и других органов. Специфические изменения органов дыхания, ЖКТ, паренхиматозных органов, мочевыделительной системы нехарактерны.
Клиническая картина
Североазиатский клещевой риккетсиоз - острая циклическая болезнь, в развитии которой выделяют периоды:
- инкубационный;
- начальный (до появления экзантемы);
- разгара (от момента высыпания до окончания лихорадки);
- реконвалесценции.
Чаще заболевание протекает в среднетяжелой форме. Инкубационный период длится в большинстве случаев 4-7 дней.
Начальный период
Заболевание начинается остро, реже в течение первых 1-3 дней наблюдают продромальные признаки в виде недомогания, головной и мышечной болей, потери аппетита. При остром начале болезни появляется озноб, в течение 1-2 дней температура тела повышается до 39-40 °С, в дальнейшем лихорадка принимает ремиттирующий, реже постоянный характер. Возникают головная боль, жар, потливость, миалгии и артралгии, прогрессирует общая слабость. Нарушаются сон и аппетит. Впоследствии эти симптомы сохраняются в течение всего лихорадочного периода.
При осмотре больного отмечают гиперемию и одутловатость лица, нередко воспалительные изменения в ротоглотке, энантему у основания язычка. В большинстве случаев выявляют наиболее постоянный и типичный признак болезни - первичный аффект, он возникает еще в конце инкубации в месте укуса клеща на открытых частях тела (волосистая часть головы, шея, плечевой пояс). Первичный аффект представляет собой плотный инфильтрат диаметром до 1-2 см, слегка болезненный при пальпации. В центре инфильтрата располагается некротическая корочка темно-коричневого цвета, по периферии - красный ободок гиперемии. Характерен сопутствующий регионарный лимфаденит, умеренно болезненные лимфатические узлы сохраняются увеличенными в течение 2-3 нед (иногда до 3 мес). Начальный период болезни продолжается 1-4 дня.
Период разгара
Начинается с появления на 2-5-й день заболевания постоянного симптома - экзантемы. У большинства больных сыпь возникает вначале на конечностях, где локализуется преимущественно на разгибательной поверхности и в окружности суставов, а затем распространяется на туловище. При обильном высыпании элементы сыпи могут быть на лице, ладонях, подошвах. Сыпь отличается полиморфизмом и имеет преимущественно розеолезно-папулезный характер. Более тяжелое течение болезни сопровождается петехиальными высыпаниями. Сохраняются гиперемия и одутловатость лица, конъюнктивит и склерит. Развиваются относительная брадикардия и артериальная гипотензия. Клинические проявления со стороны органов дыхания не характерны. Язык обложен, печень и селезенка у большинства больных увеличены. Возможны тошнота, рвота, запоры или диарея.
Ведущими в клинической картине болезни являются симптомы поражения нервной системы:
- упорная, диффузная головная боль;
- бессонница;
- боли в мышцах, пояснице.
В отличие от эпидемического сыпного тифа status typhosus и коллапсы не развиваются. Могут быть признаки менингизма. Лихорадка, достигающая 39-40 °С, обычно длится 8-10 дней (реже затягивается до 15-20 дней) и снижается литически.
Период реконвалесценции
В течение нескольких дней сыпь постепенно угасает, сохраняясь дольше всего (до 12-14-го дня болезни) в области нижних конечностей и ягодиц. У реконвалесцентов на месте отдельных элементов сыпи может длительно сохраняться буроватая пигментация.
В зависимости от выраженности интоксикационного синдрома различают стертые, легкие, средней тяжести и тяжелые формы болезни. При легкой форме лихорадочный период длится до 7 дней, температура не выше 38 °С, состояние больного удовлетворительное, умеренная сыпь, в основном розеолезная, осложнения отсутствуют. При тяжелом течении заболевания лихорадочный период продолжается до 20 дней с температурой 39-41 °С и выше, резко выражены симптомы поражения ЦНС (менингит, менингоэнцефалит, бульбарная симптоматика) и сердечно-сосудистой системы, наблюдается обильная папулезная сыпь со склонностью к геморрагическому превращению элементов.
Дифференциальная диагностика
Проводят с эпидемическим сыпным тифом, болезнью Брилла, эндемическим блошиным тифом, другими риккетсиозами из группы клещевых пятнистых лихорадок.
Ведущие клинические признаки североазиатского клещевого риккетсиоза:
- характерный первичный аффект;
- умеренные (в большинстве случаев) общетоксические проявления;
- развитие на 2-5-й день болезни полиморфной экзантемы;
- гепатолиенальный синдром;
- преимущественно доброкачественное течение болезни.
Лабораторная диагностика
В гемограмме отмечают нормоцитоз или умеренную лейкопению, эозинопению, относительный лимфоцитоз. Бактериологическая диагностика предполагает выделение чистой культуры R. sibirica из крови больного с использованием морских свинок (скротальная реакция). Серологическая диагностика осуществляется с конца 1-й недели болезни при помощи РСК с применением цельного Аг R. sibirica (диагностические титры 1:40-1:160) и РНГА, отличающейся высоким уровнем гемагглютининов (1:800-1:3200).
Осложнения и прогноз
Осложнения в виде синусита, отита, ларингита, бронхита, пневмонии встречаются редко. Рецидивы заболевания не наблюдаются, прогноз благоприятный даже при тяжелом течении болезни.
Лечение
Больных госпитализируют, назначают перорально доксициклин по 0,1 г 2 раза в день, тетрациклин по 1,2-1,6 г в сутки по 2-3-й день апирексии. Возможно применение фторхинолонов, рифампицина или эритромицина в средних терапевтических дозах курсом в 4-5 дней. Наряду с антибиотиками проводят дезинтоксикационное лечение, применяют симптоматические средства. На 8-10-й день апирексии возможна выписка реконвалесцентов из стационара.
Профилактические мероприятия
Сводятся к индивидуальной защите людей от нападения клещей с использованием защитной одежды, репеллентов, обязательному проведению само- и взаимоосмотра тела и одежды после каждого посещения мест обитания клещей, удалению присосавшихся клещей, обработке мест укуса спиртом или раствором йода.
МАРСЕЛЬСКАЯ ЛИХОРАДКА
Синонимы: средиземноморская лихорадка, инфекционная экзантема Средиземного моря, экзантемная лихорадка, тунисская лихорадка, сыпная лихорадка, болезнь Кардуччи-Ольмера и др.
Марсельская лихорадка - острый трансмиссивный природноочаговый риккетсиоз, передающийся иксодовыми клещами. Характеризуется общетоксическими проявлениями с лихорадкой, распространенной макулопапулезной экзантемой, первичным аффектом на месте укуса клеща и обычно благоприятным течением.
Краткие исторические сведения
Впервые заболевание описали Conor и Bruch в Тунисе в 1910 г. и назвали егоfievre boutonneuse. В 1928 г. Olmer впервые доказал роль собачьего клеща Rhipicephalus sanguineus в передаче возбудителя болезни. Позже марсельская лихорадка наблюдалась в Констанце (1931), Бухаресте (1946). В Крыму марсельская лихорадка впервые была изучена и описана А.Я. Алымовым (1936-1939).
Этиология
Возбудитель заболевания - Rickettsia conorii из рода Rickettsia был открыт в 1932 г. и назван в честь Конора, который вместе с Брюшем в 1910 г. опубликовал первое клиническое описание марсельской лихорадки. Как и другие риккетсии, возбудитель марсельской лихорадки грамотрицательный, не растет на питательных средах, размножается в культуре тканей, на развивающемся курином эмбрионе и при заражении лабораторных животных.
Rickettsia conorii обладает всеми свойствами, присущими другим видам риккетсий. Большое сходство он имеет с R. rickettsii, R. sibirica
(возбудитель клещевого тифа Северной Азии), а также с R. vesiculosa (возбудитель везикулезного риккетсиоза). Эти риккетсии объединены в общую подгруппу под названием Dermacentroxenus. Они характеризуются выраженным плеоморфизмом, способны размножаться не только в цитоплазме, но и в ядре клеток и вызывать у морских свинок-самцов воспаление яичек (периорхит). В антигенном отношении R. conori имеет значительное сходство с другими возбудителями группы клещевых пятнистых лихорадок.
Факторы патогенности:
- фосфолипаза А2;
- ЛПС;
- другие ng клеточной стенки;
- жгутикоподобные образования. В окружающей среде возбудитель неустойчив.
Эпидемиология
Резервуар и источники инфекции - собаки, у которых наблюдаются легкие или бессимптомные заболевания. Основной переносчик болезни - собачий клещ Rhipicephalus sanguineus, реже другие клещи - Rhipicephalus pumilo (в Астраханском регионе), R. simus, R. everbsi, Rh. аppendiculatus. Характерна трансовариальная передача риккетсий, в связи с этим клещи являются не только переносчиками, но также и резервуаром инфекции. Носителями риккетсий могут быть собаки, зайцы, шакалы, ежи, мыши.
Механизм передачи - трансмиссивный. Человеку возбудитель передается при присасывании клеща, однако возможно заражение при раздавливании и втирании в кожу инфицированных клещей.
Естественная восприимчивость людей
Естественная восприимчивость людей высокая. К марсельской лихорадке восприимчивы люди всех возрастов. Перенесенное заболевание оставляет стойкий иммунитет, повторных случаев болезни не наблюдается.
Основные эпидемиологические признаки
Заболевание проявляется чаще всего в виде спорадических случаев, поскольку собачий клещ редко нападает на человека. Сезонность марсельской лихорадки обусловлена периодом активности клещей (с мая по октябрь).
Марсельская лихорадка широко распространена в различных частях Африки, в Индии, в бассейнах Средиземного, Черного и Каспийского морей (включая приморские регионы РФ). Передача инфекции от больного человека здоровому не происходит.
Патогенез
Заражение человека происходит путем укуса инфицированных клещей или при раздавливании их с освобождением риккетсий и проникновением их в кровь через дефекты кожного покрова. Проникновение риккетсий возможно также через неповрежденную кожу и через конъюнктиву.
На месте укуса клеща на коже за 5-7 дней до появления признаков болезни возникает первичный аффект в виде некротического воспалительного участка (черное пятно). Первичный аффект до начала болезни является характерной особенностью марсельской лихорадки. Через лимфатические пути риккетсии попадают в кровь, локализуются в эндотелии кровеносных и лимфатических капилляров и венул, обусловливая развитие специфического универсального васкулита. Процесс напоминает изменения, наблюдающиеся при эпидемическом сыпном тифе, однако количество гранулем (узелков) меньше и некротические изменения менее выражены. Перенесенное заболевание оставляет стойкий иммунитет. Повторных заболеваний марсельской лихорадкой не наблюдается. Патолого-анатомические изменения при марсельской лихорадке почти не изучены.
Клиническая картина
Инкубационный период в среднем длится 5-7 дней, иногда затягиваясь до 14-16 дней. Начало болезни внезапное, больные жалуются на озноб, сильную головную боль, общую слабость, потливость, выраженные миалгии и артралгии, бессонницу. Иногда бывает рвота. Первичный аффект представляет собой вначале участок воспаления кожи около 10 мм в диаметре, затем в центральной его части появляется участок некроза диаметром 2-3 мм, покрытый темной корочкой и окруженный ободком гиперемии. Местное поражение от укуса клеща безболезненно, может быть локализовано на различных участках тела и сопровождается увеличением регионарных лимфатических узлов. Корочка на месте первичного аффекта отпадает лишь к 5-7-му дню нормальной температу-
ры, при этом образуется небольшая язвочка, которая постепенно эпителизируется в течение 7-12 дней, оставляя пигментированное пятно.
При осмотре больного отмечается гиперемия и некоторая одутловатость лица, инъекция сосудов склер и слизистых оболочек зева. Важнейшим клиническим проявлением марсельской лихорадки является экзантема, которая наблюдается у всех больных. Элементы сыпи появляются на 2-4-й день болезни сначала на груди и животе, затем в течение ближайших 48 ч распространяются на шею, лицо, конечности, почти у всех больных элементы сыпи обнаруживаются на ладонях и подошвах. Сыпь обильная, особенно на конечностях, состоит из пятен и папул, часть элементов подвергается геморрагическому превращению (особенно при тяжелом течении болезни), у некоторых больных на месте папул образуются везикулы. На ногах сыпь наиболее обильная, элементы сыпи ярче и крупнее, чем на других участках кожи. Сыпь сохраняется в течение 8-10 дней, постепенно угасает, начиная с кожи лица, и оставляет после себя пигментацию кожи, сохраняющуюся до 2-3 мес. Иногда в лихорадочном периоде наблюдают 2-ю волну высыпаний. Особых изменений со стороны внутренних органов не отмечается. Могут быть выявлены приглушенность тонов сердца, относительная брадикардия или нормокардия, небольшое снижение АД. В 30-50% случаев развивается умеренно выраженный гепатолиенальный синдром.
Обычно болезнь протекает нетяжело. Лихорадочный период продолжается 8-10 дней, температура снижается по типу ускоренного лизиса. На месте укуса клеща на коже обнаруживается язва диаметром 2-5 мм с черным некротическим центром, окруженным воспалительной зоной темно-красного цвета.
На 3-4-й день болезни развивается макулезное высыпание, которое быстро распространяется по всему телу, включая ладони, подошвы и лицо. Элементы сыпи, имеющие вначале вид мелких пятен (диаметром 2-5 мм), ясно очерченных на фоне здоровой кожи, позже превращаются в папулы - мелкие красные пуговчатые прыщевидные узелки.
Высыпание исчезает спустя некоторое время после снижения температуры.
Дифференциальная диагностика
Заболевание дифференцируют от других клещевых пятнистых лихорадок, сыпного тифа, геморрагической лихорадки Крым-Конго, тифопаратифозных заболеваний и др.
Для диагностики наибольшее значение имеет триада:
- первичный аффект (черное пятно);
- регионарный лимфаденит;
- раннее появление обильной полиморфной сыпи по всему телу, включая ладони и подошвы.
Ценными являются эпидемиологические данные:
- прибытие из эндемических очагов;
- установление контакта с собаками;
- укусы иксодовых клещей. Лабораторная диагностика Изменения гемограммы:
- лейкопения;
- относительный лимфоцитоз;
- тромбоцитопения.
Для серологической диагностики используют:
- РНИФ (диагностические титры реакции 1:32-1:64);
- РНГА (минимальный диагностический титр 1:200);
- РСК с R. eonori (диагностические титры 1:40-1:160). Разработаны ИФА и ПЦР.
Осложнения и исходы
Осложнения развиваются крайне редко и связаны в основном с активизацией вторичной микрофлоры. Прогноз заболевания благоприятный.
Лечение
Для лечения больных марсельской лихорадкой применяют антибиотики тетрациклиновой группы (доксициклин, окситетрациклин*), фторхинолоны, рифампицин в средних терапевтических дозах, дезинтоксикационные и симптоматические средства. Курс этиотропного лечения продолжают по 2-3-й день апирексии.
Профилактические мероприятия
Необходимо по возможности применять все предосторожности для предотвращения укусов клещей, уничтожать клещей, паразитирующих на собаках, и др. В случае укуса клеща возможна химиопрофилактика заболевания в виде короткого курса доксициклина. В эпидемических
очагах проводят обработку возможных мест обитания клещей пестицидами (например собак, собачьих будок), отлов бродячих собак. Меры специфической профилактики не разработаны.
АСТРАХАНСКАЯ
ПЯТНИСТАЯ ЛИХОРАДКА
Случаи заболевания регистрируют на территории Астраханской области с 1972 г.
Этиология
Возбудитель, идентифицированный ранее как Rickettsia conorii, в настоящее время расценивается как отдельный подвид Rickettsia conorii subsp. Caspiensis.
Эпидемиология
Основной резервуар и переносчик инфекции - клещ Rhipicephalus pumilo.
Основные носители риккетсий:
- зайцы;
- мыши;
- ушастые ежи;
- собаки.
Клещи сохраняют риккетсий пожизненно и передают их трансовариально.
Пути заражения - аэрогенный и трансмиссивный. Клещом поражены не только бродячие собаки, но и животные, содержащиеся на привязи. Значительная пораженность клещами выявлена у диких животных (например, у ежей, зайцев). С собак, с поверхности почвы и растений клещи могут переползать на человека.
Естественная восприимчивость
Естественная восприимчивость людей высокая.
Основные эпидемиологические признаки
Заболеваемость спорадическая, сезонность весенне-летняя (с мая по сентябрь с пиком заболеваемости в июле-августе). Чаще болеют жители
сельских районов (работа на огородах, дачах, в сельском хозяйстве), дети дошкольного и младшего школьного возраста. Заболевания выявлены в соседних с Астраханской областью регионах, в частности в Казахстане.
Клиническая картина
Клиническая картина астраханской и марсельской пятнистых лихорадок в основном идентична.
Вместе с тем при астраханской лихорадке отмечены следующие особенности:
- первичный аффект обнаруживают менее чем в 30% случаев, что может быть объяснено преобладанием аэрогенного пути заражения;
- регионарный лимфаденит встречается редко и выражен слабее;
- у большинства пациентов отмечают гиперемию слизистой оболочки ротоглотки, иногда с петехиальной энантемой;
- миалгии и артралгии носят выраженный характер.
Дифференциальная диагностика
См. «Марсельская лихорадка».
Лабораторная диагностика
В лабораторной диагностике заболевания применяют те же методы серологических исследований, что и при марсельской лихорадке. Вместе с тем для постановки РСК и РНИФ рекомендуют использовать корпускулярные Аг, полученные из Rickettsia conorii subsp. Caspiensis.
Лечение
См. «Марсельская лихорадка».
Профилактические мероприятия
См. «Марсельская лихорадка».