Внутренние болезни: учебник: в 2 т. / под ред. В.С. Моисеева, А.И. Мартынова, Н.А. Мухина. - 3-е изд., испр. и доп. - 2013. - Т.2. - 896 с.: ил.
|
|
|
|
ЧАСТЬ IV. ЗАБОЛЕВАНИЯ ОРГАНОВ ПИЩЕВАРЕНИЯ
Глава 40. ЗАБОЛЕВАНИЯ ПИЩЕВОДА
40.1. ГАСТРОЭЗОФАГЕАЛЬНАЯ РЕФЛЮКСНАЯ БОЛЕЗНЬ
Гастроэзофагеальная рефлюксная болезнь (ГЭРБ) - заболевание, обусловленное развитием воспалительных изменений в дистальном отделе пищевода и/или характерных симптомов вследствие регулярно повторяющегося заброса в пищевод желудочного и/или дуоденального содержимого.
ЭПИДЕМИОЛОГИЯ
Истинная распространенность неизвестна, что связано с большой вариабельностью клинических симптомов - от эпизодически возникающей изжоги до ярких признаков осложненного рефлюкс-эзофагита. Истинная распространенность ГЭРБ значительно выше официальных статистических данных в связи с существующими сложностями применения диагностических методов. Кроме того, менее одной трети больных ГЭРБ обращаются к врачу.
Симптомы ГЭРБ обнаруживают у 20-50% взрослого населения, а эндоскопические признаки - более чем у 7-10% лиц в популяции.
В США изжогу (основной симптом ГЭРБ) испытывают 10-20% взрослых еженедельно. Целостной эпидемиологической картины по России нет. Существуют отдельные эпидемиологические исследования, проведенные в различных регионах. В Москве, например, на частую изжогу жалуются 34% женщин и 15% мужчин.
КЛАССИФИКАЦИЯ
Согласно МКБ-10, выделяют ГЭРБ с эзофагитом и ГЭРБ без эзофагита. В клинической практике принята другая терминология:
• эндоскопически негативная рефлюксная болезнь, или неэрозивная рефлюксная болезнь;
• эндоскопически позитивная рефлюксная болезнь, или рефлюксэзофагит.
Для детализации рефлюкс-эзофагита рекомендуют классификацию, принятую на X Всемирном съезде гастроэнтерологов (Лос-Анджелес, 1994) (табл. 40-1; рис. 40-1).
Таблица 40-1. Степени тяжести рефлюкс-эзофагита
К осложнениям ГЭРБ относят:
• пептические стриктуры;
• пищеводные кровотечения;
• пищевод Бэррета.
Примерно у 60% больных диагностируют неэрозивную рефлюксную болезнь, у 30% обнаруживают рефлюкс-эзофагит и у 5% развиваются осложнения.
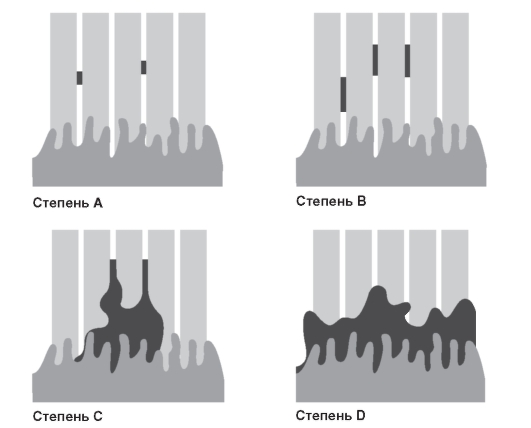
Рис. 40-1. Степени тяжести рефлюкс-эзофагита
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
К причинам развития ГЭРБ относят следующие.
• Ослабление функции антирефлюксного барьера (запирательный механизм кардиального отдела желудка).
• Уменьшение клиренса пищевода.
• Снижение устойчивости слизистой оболочки пищевода к воздействию повреждающих факторов.
• Увеличение выработки в желудке соляной кислоты, пепсина, поступление в желудок желчи.
Поскольку давление в желудке всегда выше, чем в грудной полости, существует особый механизм, предупреждающий рефлюкс желудочного содержимого, - так называемый запирательный механизм кардии. В норме рефлюкс возникает редко, на короткое время (<5 мин). Этот физиологический процесс, отмечаемый после приема пищи и характеризуемый отсутствием клинических симптомов, незначительной продолжительностью эпизодов, может быть во время сна. Нормальные показатели рН в пищеводе - 5,5-7,0.
Пищеводный рефлюкс считают патологическим, если время, в течение которого рН в пищеводе достигает 4,0 и менее, составляет 1 час в сутки или общее число гастроэзофагеальных рефлюксов в течение суток превышает 50, они развиваются днем и ночью.
К механизмам, поддерживающим состоятельность функции пищеводно-желудочного перехода (запирательный механизм кардии), относят:
• нижний пищеводный сфинктер;
• диафрагмально-пищеводную связку;
• слизистую «розетку»;
• острый угол Гиса, образующий складку Губарева;
• внутрибрюшное расположение нижнего пищеводного сфинктера;
• круговые мышечные волокна кардиального отдела желудка.
Нижний пищеводный сфинктер
Главная роль в запирательном механизме принадлежит состоянию нижнего пищеводного сфинктера. В покое у здорового человека он закрыт. В норме преходящие расслабления длятся 5-30 с и способствуют освобождению желудка от избытка проглоченного во время еды воздуха. У пациентов с ГЭРБ эти спонтанные эпизоды релаксации нижнего пищеводного сфинктера частые и длительные. Причины этого - нарушение перистальтики пищевода, быстрая и обильная еда, когда заглатывается большое количество воздуха.
Тонус нижнего пищеводного сфинктера снижают:
• продукты питания, содержащие кофеин (шоколад, кофе, чай, кокакола), цитрусовые, томаты, алкоголь, никотин и жиры;
• некоторые ЛС: холинолитики, седативные и снотворные средства, β-адреноблокаторы, блокаторы медленных кальциевых каналов, нитраты, теофиллин и другие препараты;
• поражения блуждающего нерва (вагусная нейропатия при сахарном диабете, ваготомии).
Давление в нижнем пищеводном сфинктере снижается под влиянием ряда гастроинтестинальных гормонов: глюкагона, соматостатина, холецистокинина, секретина, вазоактивного интестинального пептида, энкефалинов.
Снижение функции антирефлюксного барьера может происходить тремя путями:
• первичным снижением давления в нижнем пищеводном сфинктере;
• увеличением числа эпизодов его преходящего расслабления;
• полным или частичным разрушением сфинктера, например, при грыже пищеводного отверстия диафрагмы, склеродермии, после хирургических вмешательств, пневмокардиодилатации.
Угол Гиса
Это угол перехода одной боковой стенки пищевода в большую кривизну желудка, тогда как другая боковая стенка плавно переходит в малую кривизну. Воздушный пузырь желудка и внутрижелудочное давление способствуют тому, что складки слизистой оболочки желудка, образующие угол Гиса, плотно прилегают к правой стенке (складка Губарева), предотвращая заброс содержимого желудка в пищевод.
Снижение клиренса
Пищевод снабжен эффективным механизмом, устраняющим сдвиги рН в кислую сторону, - пищеводным клиренсом. У 50% больных ГЭРБ пищеводный клиренс снижен. При этом страдают следующие варианты клиренса пищевода:
• химический - вследствие уменьшения нейтрализующего действия бикарбонатов слюны и пищеводной слизи;
• объемный - из-за угнетения вторичной перистальтики и снижения тонуса стенки грудного отдела пищевода.
Непосредственная причина рефлюкс-эзофагита - длительный контакт желудочного или дуоденального содержимого со слизистой оболочкой пищевода.
Резистентность слизистой оболочки пищевода
Обеспечивается преэпителиальным, эпителиальным и постэпителиальным факторами.
• Повреждение эпителия начинается тогда, когда ионы водорода и пепсин или желчные кислоты преодолевают преэпителиальный защитный слой слизи и активную бикарбонатную секрецию.
• Эпителиальный фактор: особенности строения и функций клеточных мембран, межклеточных соединений, внутри- и межклеточного транспорта, создающие оптимальный рН (7,3-7,4).
• Постэпителиальный фактор: кровоснабжение слизистой оболочки пищевода, обеспечивающее адекватные трофические процессы, оптимальный кислотно-основной баланс.
КЛИНИЧЕСКАЯ КАРТИНА
Особенность ГЭРБ - отсутствие зависимости выраженности клинических симптомов (изжоги, боли, регургитации) от степени изменений
слизистой оболочки пищевода. Симптомы заболевания не позволяют дифференцировать неэрозивную рефлюксную болезнь от рефлюксэзофагита.
Все симптомы можно объединить в две группы:
• пищеводные (изжога; отрыжка кислым, горьким или пищей; срыгивание; дисфагия; одинофагия; боли за грудиной);
• внепищеводные (кашель, приступы удушья, одышка, осиплость или охриплость голоса, сухость в горле, слюнотечение, кариес, признаки анемии).
В клинической картине ведущее место занимают изжога, отрыжка кислым содержимым, возникающая при наклоне вперед и в ночное время. Второе по частоте проявление данного заболевания - загрудинная боль. Реже наблюдают дисфагию, срыгивание и одинофагию (боль при глотании).
Изжога
Своеобразное чувство жжения или тепла различной интенсивности, возникающее за грудиной (в нижней трети пищевода) или в подлопаточной области. Отмечают у 83% больных ГЭРБ. Возникает в результате продолжительного контакта кислого содержимого желудка (рН <4) со слизистой оболочкой пищевода. Выраженность изжоги не коррелирует с тяжестью эзофагита. Характерно ее усиление при погрешностях в диете, приеме газированных напитков, алкоголя, физическом напряжении, наклонах вперед и в горизонтальном положении.
Отрыжка и срыгивание пищи
На отрыжку жалуются 52% больных. Как правило, она усиливается после еды, приема газированных напитков. Срыгивание пищи, наблюдаемое у некоторых больных, возникает при физической нагрузке и положении, способствующем регургитации. Отрыжка и срыгивание характерны для заболевания с выраженными нарушениями моторной функции пищевода.
Загрудинная боль
Распространяется в межлопаточную область, шею, нижнюю челюсть, левую половину грудной клетки и может имитировать стенокардию. При дифференциальной диагностике происхождения болей важно установить, что провоцирует и что купирует боли. Для пищеводных болей характерны связь с приемом пищи, положением тела и купирование их приемом щелочных минеральных вод и антацидов.
Дисфагия
Дисфагия имеет перемежающийся характер, отмечается у 19% больных. Появление стойкой дисфагии и одновременное уменьшение изжоги свидетельствуют о развитии стриктуры пищевода. Быстро прогрессирующая дисфагия и потеря массы тела могут указывать на развитие аденокарциномы.
ДИАГНОСТИКА
Основные методы, используемые для выявления желудочнопищеводного рефлюкса:
• рентгенологическое исследование;
• эндоскопическое исследование;
• суточное мониторирование рН пищевода;
• исследование двигательной функции пищевода;
• гистологическое исследование.
Рентгенологическое исследование. При рентгеноскопии пищевода определяют попадание контрастного вещества из желудка в пищевод, обнаруживают грыжу пищеводного отверстия диафрагмы, стриктуры, признаки эзофагита (утолщение складок, изменение моторики, неровность контуров пищевода), эрозии и язвы пищевода.
Эндоскопическое исследование. Применяют для диагностики рефлюкс-эзофагита и оценки степени его тяжести (см. выше классификацию рефлюкс-эзофагита).
Хромоэндоскопия. Позволяет обнаружить мета- и диспластические изменения эпителия пищевода путем нанесения на слизистую оболочку веществ, по-разному прокрашивающих здоровые и пораженные ткани. Кроме этого можно увидеть пролапс желудочной слизистой оболочки в просвет пищевода, особенно хорошо заметный при рвотных движениях, истинное укорочение пищевода с расположением пищеводно-желудочного перехода выше диафрагмы. Оценка замыкательной функции кардии затруднена, так как она может быть открыта в ответ на введение эндоскопа или инсуффляцию воздуха.
Суточная рН-метрия пищевода. Наиболее информативный метод диагностики ГЭРБ, особенно неэрозивной рефлюксной болезни, позволяющий судить о частоте, продолжительности и выраженности рефлюкса. По сравнению с другими методами [рентгеноскопией, фиброэзофагогастродуоденоскопией (ФЭГДС), исследованием давления нижнего пищеводного сфинктера] 24-часовая рН-метрия имеет высокую чувствительность при выявлении гастроэзофагеальных рефлюксов
(88-95%). Полученная информация позволяет точно определить, в течение какого времени слизистая оболочка пищевода подвергалась воздействию соляной кислоты, оценить эффективность пищеводного клиренса, сопоставить возникновение рефлюксов с клиническими симптомами, исследовать кислотопродуцирующую функцию желудка в течение суток.
Для диагностики ГЭРБ результаты рН-метрии оценивают по общему времени, в течение которого рН имеет значение менее 4,0, по суммарному количеству рефлюксов за сутки, по числу рефлюксов продолжительностью более 5 мин и длительности наибольшего рефлюкса.
Сцинтиграфия пищевода. Для оценки эзофагеального клиренса применяют радиоактивный изотоп технеция. Задержка принятого изотопа в пищеводе более чем на 10 мин указывает на замедление эзофагеального клиренса. Исследование суточного рН и пищеводного клиренса позволяет выявить рефлюкс до развития эзофагита.
Манометрия. Позволяет выявить снижение давления нижнего пищеводного сфинктера, увеличение числа его транзиторных расслаблений, уменьшение амплитуды перистальтических сокращений стенки пищевода.
Гистологическое исследование. Гистологическое исследование биоптата слизистой оболочки пищевода применяют для исключения пищевода Бэррета и аденокарциномы пищевода. При гистологическом исследовании обнаруживают истончение и атрофию эпителия, разрастание соединительной ткани (склероз). Находят метаплазию плоского неороговевающего эпителия пищевода, приводящую к разрастанию цилиндрического эпителия кардиального или фундального типа слизистой оболочки желудка. Если же метаплазия приводит к появлению специализированного тонкокишечного цилиндрического эпителия, возникает риск озлокачествления. Специализированный цилиндрический эпителий при этом диагностируют как неполную тонкокишечную метаплазию с наличием бокаловидных клеток.
ОСЛОЖНЕНИЯ
Факторы риска развития осложнений: частое возникновение и длительное существование симптомов, выраженная стадия эрозивного эзофагита, наличие грыжи пищеводного отверстия диафрагмы. К осложнениям ГЭРБ относят язвы пищевода, кровотечения, стриктуры и пищевод Бэррета.
Пептические язвы пищевода. Наблюдают у 2-7% больных ГЭРБ, у 15% из них пептические язвы осложняются перфорацией, чаще всего в средостение.
Острые и хронические кровотечения различной степени наблюдают практически у всех пациентов с пептическими язвами пищевода, причем сильное кровотечение отмечают у половины из них.
Стриктуры. Встречают примерно у 10% больных ГЭРБ: стенозирование пищевода придает заболеванию более стойкий характер (прогрессирует дисфагия, ухудшается самочувствие, снижается масса тела). Клинические симптомы стеноза (дисфагия) возникают при сужении просвета пищевода до 2 см.
Пищевод Бэррета. См. раздел «Пищевод Бэррета».
ЛЕЧЕНИЕ
Выбор метода лечения связан с особенностями течения и причиной, вызвавшей ГЭРБ. Лечение ГЭРБ может быть терапевтическим и хирургическим.
Общие рекомендации
Больному рекомендуют определенный образ жизни и диету.
• Исключить нагрузки, повышающие внутрибрюшное давление:
- не носить тесную одежду и тугие пояса, корсеты;
- не поднимать тяжести более 8-10 кг на обе руки;
- избегать физических нагрузок, связанных с перенапряжением брюшного пресса.
• Избегать обильного приема пищи и не есть на ночь (не позже чем за 3 ч до сна). После приема пищи избегать наклонов вперед и не ложиться. Ограничить потребление продуктов, снижающих давление нижнего пищеводного сфинктера и оказывающих раздражающее действие на слизистую оболочку пищевода - продуктов, богатых жирами (цельного молока, сливок, тортов, пирожных, гусятины, утятины, свинины, баранины, жирной говядины), алкоголя, напитков, содержащих кофеин (кофе, кока-колы, крепкого чая, шоколада), цитрусовых, томатов, лука, чеснока, жареных блюд. Не принимать лекарств, вызывающих рефлюкс (седативных средств и транквилизаторов, блокаторов медленных кальциевых каналов, β-адреноблокаторов, теофиллина, простагландинов, нитратов).
• Спать с приподнятым изголовьем кровати.
• Отказаться от курения.
• Нормализовать массу тела.
Медикаментозное лечение
Сроки лечения. При неэрозивной рефлюксной болезни - 4-8 нед и не менее 8-12 нед - при рефлюкс-эзофагите с последующей поддержи-
вающей терапией в течение 6-12 мес. Медикаментозная терапия включает назначение прокинетиков, антацидов и антисекреторных средств.
Прокинетики. Повышают тонус нижнего пищеводного сфинктера, усиливают перистальтику пищевода, улучшают пищеводный клиренс. Назначают домперидон, метоклопрамид по 10 мг 3-4 раза в день за 30 мин до еды. Домперидон имеет преимущество - не проникает через гематоэнцефалический барьер и имеет меньше побочных эффектов по сравнению с метоклопрамидом. В виде монотерапии прокинетики применяют только при лечении легких форм ГЭРБ.
Антацидные и антисекреторные препараты. Цель антисекреторной терапии - уменьшить повреждающее действие кислого желудочного содержимого на слизистую оболочку пищевода при желудочно-пищеводном рефлюксе. Антациды эффективны при умеренно выраженных и нечастых симптомах. Антациды обладают цитопротективным действием и нейтрализуют соляную кислоту желудочного сока. Наиболее удобная фармацевтическая форма - гели. Обычно препараты назначают 3 раза в сутки через 40-60 мин после еды и на ночь. Каждый приступ боли и изжоги следует купировать, поскольку эти симптомы указывают на прогрессирующее повреждение слизистой оболочки пищевода.
При лечении рефлюкс-эзофагитов хорошо зарекомендовали себя препараты, содержащие натрия алгинат. Он образует пенную антацидную взвесь, плавающую на поверхности желудочного содержимого, и, попадая в пищевод в случае желудочно-пищеводного рефлюкса, дает лечебный эффект.
Блокаторы Н2-рецепторов. При рефлюкс-эзофагите широко применяют ранитидин и фамотидин, которые существенно снижают кислотность забрасываемого желудочного содержимого, что способствует купированию воспалительного и эрозивно-язвенного процесса в слизистой оболочке пищевода.
Ингибиторы протонного насоса. В настоящее время препаратами выбора считают блокаторы Н+-, К+-АТФазы (омепразол, лансопразол, пантопразол, рабепразол, эзомепразол), которые, ингибируя протонный насос, обеспечивают выраженное и продолжительное подавление желудочной секреции соляной кислоты. Эти препараты - самые сильные антисекреторные средства, отличаются особой эффективностью при пептическом эрозивно-язвенном эзофагите, обеспечивая после 4-5 нед лечения рубцевание пораженных участков в 90-96% случаев.
Хирургическое лечение
Вопрос о хирургической коррекции решают в случае длительной и/или малоэффективной медикаментозной терапии, при возникновении осложнений (стриктуры пищевода, повторных кровотечений, пищевода Бэррета). Особенно часто показания к операции возникают при сочетании ГЭРБ с грыжей пищеводного отверстия диафрагмы.
ПРОГНОЗ
При неэрозивной рефлюксной болезни и легкой степени рефлюксэзофагита прогноз в большинстве случаев благоприятный. Прогноз ухудшается при большой давности заболевания в сочетании с частыми, длительными рецидивами, при осложненных формах ГЭРБ, особенно при развитии пищевода Бэррета из-за повышенного риска развития аденокарциномы пищевода.
40.2. ПИЩЕВОД БЭРРЕТА
Пищевод Бэррета - приобретенное хроническое метапластическое состояние слизистой оболочки пищевода, при котором многослойный плоский эпителий на отдельных участках замещается однослойным цилиндрическим.
Пищевод Бэррета с кишечной метаплазией формируется примерно у 10-20% лиц, страдающих ГЭРБ. Вероятность развития аденокарциномы при пищеводе Бэррета составляет 1 случай на 200-400 пациентов в год.
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
Преобладание среди больных мужчин европеоидной расы свидетельствует в пользу генетической предрасположенности к развитию пищевода Бэррета. Замещение многослойного плоского эпителия однослойным цилиндрическим считается результатом извращения физиологической регенерации в слизистой оболочке пищевода, которая развивается под воздействием агрессивной среды при желудочнопищеводном рефлюксе.
КЛИНИЧЕСКАЯ КАРТИНА
Не отличается от таковой при ГЭРБ. В связи с этим необходимо исключение пищевода Бэррета у любого пациента с длительным (>5 лет) анамнезом ГЭРБ.
ДИАГНОСТИКА
При эндоскопическом исследовании цилиндрический эпителий имеет характерный красный цвет и бархатистый вид, что отличает его от расположенного рядом тонкого, бледного, с глянцевой поверхностью эпителия пищевода. Для подтверждения диагноза и установления степени дисплазии эпителия проводят биопсию из 4 точек по окружности пищевода (4-квадрантная биопсия) через каждые 2 см от пищеводножелудочного перехода до зубчатой линии. При отсутствии дисплазии исследование повторяют каждые 2-3 года.
ЛЕЧЕНИЕ
К методам лечения пищевода Бэррета относятся:
• лекарственная терапия ингибиторами протонного насоса в стандартной или удвоенной дозе (пожизненно);
• антирефлюксная хирургия;
• эндоскопические методы (мультиполярная электрокоагуляция метаплазированной слизистой оболочки, фотодинамическая терапия, лазерная деструкция, коагуляция аргоновой плазмой, эндоскопическая резекция слизистой оболочки).
При выявлении дисплазии низкой степени проводят ЭГДС с биопсией (4-квадрантную через каждый 1 см) один раз в 6 мес. При отсутствии прогрессирования дисплазии контрольные гистологические исследования повторяют ежегодно.
Если выявляют дисплазию высокой степени, проводят ЭГДС с биопсией (4-квадрантную через каждый 1 см) один раз в 3-6 мес и решают вопрос об эндоскопическом методе лечения или хирургическом вмешательстве.
40.3. ЭЗОФАГИТЫ
Эзофагиты - группа заболеваний, характеризующихся развитием воспалительных и деструктивных изменений слизистой оболочки пищевода, а иногда и более глубоких слоев его стенки. В зависимости от морфологической картины выделяют катаральные, эрозивные, геморрагические и некротические эзофагиты. Клиническая картина всех эзофагитов характеризуется дисфагией.
Инфекционные эзофагиты
Инфекционные эзофагиты чаще возникают у лиц с иммунодефицитами. Эзофагиты подразделяют на вирусные (чаще их вызывают вирус
простого герпеса и цитомегаловирус), бактериальные (обусловлены Mycobacterium tuberculosis и бактериями рода Lactobacillus) и грибковые (чаще вызываемые грибами рода Candida).
Вирусный эзофагит. Эзофагит, вызванный вирусом простого герпеса, часто сопровождается высыпаниями в области носогубного треугольника. Для цитомегаловирусной инфекции, помимо поражения пищевода, характерно вовлечение других внутренних органов. Эндоскопически при поражениях вирусом простого герпеса на слизистой оболочке пищевода обнаруживают типичные везикулы, на месте которых затем формируются ограниченные язвы с приподнятыми над поверхностью краями (кратерообразные язвы). При поражении цитомегаловирусом на ранних стадиях обнаруживают эрозии, затем формируются линейные серповидные язвы. Диагноз подтверждают вирусологическим и иммуногистохимическим методами, а также методом гибридизации in situ. Препаратом выбора при инфекции, вызванной вирусом простого герпеса, считают ацикловир, при цитомегаловирусной инфекции - ганцикловир.
Бактериальный эзофагит. При бактериальном эзофагите эндоскопически обнаруживают гиперемию, отек слизистой оболочки, налеты, псевдомембраны, эрозии и язвы. Для подтверждения диагноза необходимо, во-первых, обнаружить в гистологических препаратах, окрашенных по Граму, признаки бактериальной инвазии и, во-вторых, исключить наличие вирусного, грибкового или неопластического поражения пищевода. При бактериальном эзофагите используют антибактериальные средства, а также комплекс вяжущих, обволакивающих и антисекреторных лекарственных препаратов в сочетании с местными анестетиками.
Грибковый эзофагит. При грибковом эзофагите эндоскопически обнаруживают белые или желтоватые наложения на гиперемированной слизистой оболочке пищевода. При бактериологическом и гистологическом исследовании биоптатов определяют мицелиальные формы гриба. Больным, страдающим грибковым эзофагитом и иммунодефицитами, рекомендуют прием внутрь противогрибковых препаратов (кетоконазола, флуконазола).
Пациентам с гранулоцитопенией в связи с высоким риском диссеминации грибковой инфекции назначают амфотерицин В внутривенно.
Лекарственный эзофагит
Наиболее часто лекарственный эзофагит вызывают антибиотики (доксициклин, тетрациклин и др.), НПВС, хинидин, калия хлорид и т.д.
На долю этих препаратов приходится примерно 90% всех случаев лекарственного поражения пищевода.
Характерный клинический симптом - дисфагия, возникающая через несколько часов или дней после приема внутрь лекарственного препарата. Эндоскопически для лекарственных поражений пищевода характерно наличие одной или нескольких отдельно расположенных язв на неизмененной слизистой оболочке. В краях язв нередко обнаруживают частицы лекарственного препарата.
В неосложненных случаях лекарственные повреждения пищевода не требуют активного вмешательства и заживают в сроки от 3 дней до нескольких недель после прекращения приема препарата. При симптомах ГЭРБ назначают антисекреторные, вяжущие, обволакивающие ЛС, местные анестетики.
40.4. АХАЛАЗИЯ КАРДИИ
Ахалазия (от греч. а - отрицание, chalasis - «расслабление») кардии - заболевание пищевода, при котором рефлекторное расслабление нижнего пищеводного сфинктера при глотании отсутствует, а тонус и перистальтика грудного отдела пищевода нарушены.
ЭПИДЕМИОЛОГИЯ
Ахалазия кардии - достаточно редкое заболевание, распространенность которого составляет 0,001-0,002%. Большинство пациентов - люди 30-50 лет. Наиболее часто (95% случаев) наблюдают идиопатическую ахалазию кардии. У 2-5% пациентов ахалазия кардии носит семейный характер (наследуется по аутосомно-рецессивному типу).
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
Этиология заболевания неясна. Патогенез заключается в нарушении деятельности интрамурального нервного аппарата пищевода, возможно, вследствие дефицита релаксирующих медиаторов, в первую очередь - оксида азота.
КЛИНИЧЕСКАЯ КАРТИНА
Характерный симптом ахалазии кардии - дисфагия. В начале заболевания дисфагия возникает только при приеме твердой пищи, затем постепенно присоединяется дисфагия при употреблении жидкости. В некоторых случаях дисфагия носит ремиттирующий характер. Как следствие, больным требуется значительно больше времени для приема
пищи. Для того чтобы ускорить опорожнение пищевода, пациенты нередко прибегают к определенным приемам, например, выпивают залпом стакан воды.
Прогрессирующая дисфагия вызывает у большинства больных снижение массы тела. По мере нарастания дисфагии развивается регургитация, поэтому пациенты часто просыпаются ночью от кашля или удушья. Гипермоторная дискинезия пищевода, а также его переполнение приводят к развитию болей за грудиной давящего или сжимающего характера с иррадиацией в шею, нижнюю челюсть или спину.
ДИАГНОСТИКА
При рентгенологическом исследовании, проводимом натощак, выявляют следующие признаки:
• большое количество пищеводного содержимого;
• нарушение эвакуации контрастного вещества в желудок;
• умеренное или значительное (веретеноили S-образное) расширение пищевода с сужением в дистальном отделе (симптом «мышиного хвоста», «кончика морковки» или «птичьего клюва»);
• отсутствие газового пузыря желудка.
При эзофагоскопии обнаруживают расширение пищевода, застойный эзофагит, иногда с участками метаплазии эпителия (лейкоплакии). Для исключения малигнизации выполняют биопсию подозрительных участков слизистой оболочки.
Манометрически при ахалазии кардии выявляют гипертонус нижнего пищеводного сфинктера, отсутствие его рефлекторного раскрытия, а также нарушение перистальтики грудного отдела пищевода.
Дифференциальную диагностику ахалазии кардии проводят с заболеваниями, сопровождающимися дисфагией, в первую очередь, раком пищевода и кардиального отдела желудка. Большую помощь в этом оказывают рентгенологическое и эндоскопическое исследования с биопсией.
ЛЕЧЕНИЕ
Основной метод лечения ахалазии кардии - кардиодилатация (расширение кардиального отверстия желудка с помощью резинового баллона, в который под давлением нагнетается воздух или вода, вследствие чего возникает частичный разрыв мышц нижнего пищеводного сфинктера). Частота хороших результатов этого метода лечения составляет 86-100%. Эффект сохраняется на протяжении 2-8 лет и более; при возобновлении дисфагии проводят повторные курсы кардиодилатации.
В последние годы получила распространение эндоскопическая кардиомиотомия.
Нитраты пролонгированного действия и блокаторы кальциевых каналов снижают давление в области нижнего пищеводного сфинктера и улучшают опорожнение пищевода, но не являются полноценной заменой кардиодилатации. Для профилактики сопутствующего эзофагита назначают анацидные и обволакивающие средства.
Больные ахалазией кардии должны состоять на диспансерном учете у гастроэнтеролога. Им показано проведение рентгенологического и эндоскопического исследований пищевода не реже одного раза в год.
ПРОГНОЗ
Прогноз при отсутствии лечения серьезный: заболевание прогрессирует и может привести к смерти от истощения. Прогноз ухудшает высокая вероятность рака пищевода (2-7% случаев) и аспирационных пневмоний.
40.5. ОПУХОЛИ ПИЩЕВОДА Злокачественные опухоли пищевода
Заболеваемость раком пищевода в последнее время значительно возросла, его доля составляет 2% всех злокачественных опухолей и 7% всех злокачественных опухолей ЖКТ.
Мужчины болеют в 3-5 раз чаще, чем женщины. Пик заболеваемости приходится на 50-70 лет.
КЛАССИФИКАЦИЯ
Международная классификация рака пищевода соответствует принятым критериям TNM-классификации рака (Tumor - первичная опухоль, Nodulus - поражение регионарных лимфатических узлов, Metastasis - отдаленные метастазы).
Злокачественные опухоли пищевода более чем в 95% случаев представлены плоскоклеточным раком или аденокарциномой. В редких случаях обнаруживают мелкоклеточный рак, меланомы, саркомы, злокачественные лимфомы и др.
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
Причины развития рака пищевода неизвестны. Факторами риска развития плоскоклеточного рака считают:
• ахалазию кардии;
• злоупотребление алкоголем;
• курение;
• семейный тилез [наследственно-обусловленный гиперкератоз ладоней и подошв с высоким (95%) риском развития рака пищевода в возрасте старше 65 лет];
Риск развития аденокарциномы повышен при пищеводе Бэррета.
КЛИНИЧЕСКАЯ КАРТИНА
Длительное время заболевание протекает бессимптомно. На поздних стадиях развиваются характерные признаки.
• Прогрессирующая дисфагия.
• Регургитация желудочного содержимого.
• Боли за грудиной.
• Потеря массы тела.
• Охриплость голоса как следствие прорастания опухолью возвратного нерва.
• Синдром Горнера (птоз, миоз, энофтальм), возникающий при прорастании опухолью симпатического ствола.
• Икота и нарушение экскурсии диафрагмы в результате прорастания опухолью диафрагмального нерва.
• Мучительный кашель, стридорозное дыхание при прорастании опухолью трахеи и крупных бронхов.
• Пищеводно-трахеальный или пищеводно-бронхиальный свищи, вызывающие кашель при приеме пищи, а также аспирационную пневмонию.
• Кровотечения из пищевода (прожилки крови в рвотных массах, анемия, положительная реакция на скрытую кровь в кале), при разрушении опухолью стенки крупного сосуда - массивные кровотечения.
• Общие симптомы включают слабость, повышенную утомляемость, снижение работоспособности.
ДИАГНОСТИКА
Важную роль в диагностике рака пищевода играет рентгенологическое исследование. При экзофитном росте опухоли с распадом и изъязвлением выявляют дефект наполнения с неровными, изъеденными контурами. Наиболее информативный метод диагностики рака пищевода - ФЭГДС.
Диагноз необходимо подтвердить гистологически. Наибольшая точность (90-100%) обеспечивается при множественной биопсии ткани опухоли.
Эндосонография позволяет выявить опухоли размером до 3 мм и оценить состояние тканей, окружающих пищевод. Для определения распространения опухолевого процесса используют КТ и МРТ.
Дифференциальная диагностика
Ее проводят со следующими заболеваниями, характеризующимися симптомами дисфагии:
• пептическими и ожоговыми рубцовыми стриктурами пищевода;
• эзофагоспазмом;
• ахалазией кардии;
• доброкачественными опухолями и дивертикулами пищевода;
• лимфогранулематозом, лимфосаркомой (характеризуются увеличением шейных и медиастинальных лимфатических узлов);
• патологией средостения:
- опухолями средостения;
- аневризмой аорты;
- загрудинным зобом;
- экссудатом в полости перикарда.
ЛЕЧЕНИЕ
На ранних стадиях лечение включает эндоскопическую резекцию слизистой оболочки с опухолью, лазерную и фотодинамическую деструкцию поверхностной опухоли.
На более поздних стадиях при отсутствии признаков метастазирования показано радикальное оперативное вмешательство - экстирпация пищевода с лимфаденэктомией и созданием искусственного пищевода из большой кривизны желудка. При невозможности радикальной операции осуществляют паллиативные хирургические вмешательства, направленные на обеспечение питания больного: наложение обходных анастомозов, гастростомию.
Наиболее распространенный вид паллиативного хирургического вмешательства при раке средней и нижней трети пищевода в настоящее время - эндоскопическая дилатация стеноза, или реканализация опухоли. Реканализация может быть лазерной, термической, химической или с использованием стентов.
Химиотерапия при раке пищевода малоэффективна. Обычно применяют комбинацию фторурацила и цисплатина.
ПРОГНОЗ
Послеоперационная смертность в среднем составляет 6-10%. Средний показатель 5-летней выживаемости пациентов после радикальной операции на I стадии составляет около 60%, на II стадии - 30-40%, на III стадии - 10-15%, на IV стадии - 1-4%.
Доброкачественные опухоли пищевода
Доброкачественные опухоли пищевода выявляют примерно в 80 раз реже злокачественных. Из них большую часть (60-70%) составляют лейомиомы. Они чаще образуются в средней и особенно нижней трети пищевода и, как правило, протекают бессимптомно.
Доброкачественные опухоли подлежат хирургическому лечению во избежание злокачественного перерождения и возникновения осложнений (кровотечений, воспаления и т.д.).
Глава 41. ЗАБОЛЕВАНИЯ ЖЕЛУДКА И ДВЕНАДЦАТИПЕРСТНОЙ КИШКИ
41.1. ХРОНИЧЕСКИЙ ГАСТРИТ
Хронический гастрит - группа хронических заболеваний, которые морфологически характеризуются воспалительными и дистрофическими изменениями слизистой оболочки желудка.
ЭПИДЕМИОЛОГИЯ
Судить об истинной распространенности хронического гастрита сложно. Это связано, во-первых, с необходимостью его морфологической диагностики, а во-вторых, с частым малосимптомным течением заболевания. Именно поэтому далеко не все больные обращаются за медицинской помощью. По разным данным, хроническим гастритом страдают 50-80% всего взрослого населения. С возрастом его распространенность увеличивается.
КЛАССИФИКАЦИЯ
Классификация хронического гастрита представлена в табл. 41-1. Таблица 41-1. Международная классификация гастрита (1996)
Оценку степени изменений слизистой оболочки желудка проводят согласно модифицированной Сиднейской системе (пересмотр 1994 г.) с использованием визуально-аналоговой шкалы по следующим показателям:
- обсемененности Н. pylori;
- активности воспаления;
- атрофии;
- кишечной метаплазии.
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
Подавляющее большинство случаев (85-90%) хронического гастрита связано с инфицированием Helicobacter pylori (Н. pylori), этиологическая роль которого доказана и общепризнана.
Хронический неатрофический (хеликобактерный) гастрит
Патогенетическая связь между инфекцией Н. pylori и некоторыми заболеваниями гастродуоденальной зоны была обнаружена в 1983 г., когда Дж. Уоррен и Б. Маршалл из Австралии сообщили о наличии бактерий спиралевидной формы (позднее названных Н. pylori) в желудке у больных хроническим гастритом и пептической язвой. В ноябре 2005 г. за открытие и изучение роли Н. pylori Дж. Уоррен и Б. Маршалл получили Нобелевскую премию в области медицины. Н. pylori - основная причина развития хронического гастрита. Инфицирование происходит фекально-оральным и орально-оральным путем. Распространению инфекции способствуют неблагоприятные социально-экономические условия. В развитых странах Н. pylori выявляют у 30-40% населения, причем инфицирование происходит преимущественно в детском, подростковом, а также в молодом возрасте (до 20 лет). В развивающихся странах инфицированность Н. pylori значительно выше (до 90%). Из-
вестно несколько факторов вирулентности, позволяющих Н. pylori заселять организм хозяина, а затем персистировать в нем.
• Жгутики позволяют Н. pylori передвигаться в желудочном соке и слое слизи.
• Н. pylori способен прикрепляться к плазмолемме эпителиальных клеток желудка и разрушать компоненты цитоскелета этих клеток.
• Н. pylori вырабатывает уреазу и каталазу. Уреаза расщепляет мочевину, содержащуюся в желудочном соке, что повышает рН непосредственного окружения микроба и защищает его от бактерицидного действия кислой среды желудка.
• Н. pylori способен подавлять некоторые иммунные реакции, в частности фагоцитоз.
• Н. pylori вырабатывает адгезины, способствующие адгезии бактерий к эпителиальным клеткам и затрудняющие их фагоцитоз полиморфноядерными лейкоцитами.
• Выработка токсинов является важным механизмом патогенного воздействия Н. pylori. Выделены штаммы Н. pylori, имеющие гены, экспрессирующие цитотоксины (белок) - СagA (cagA Iа-фенотип), вакуолизирующий цитотоксин - VagA (vagA Ib-фенотип) или оба белка одновременно (фенотип I). Установлен мультигенный локус, «островок патогенности» - cag PAI (the cag PAthogenicity Island), который определяет вирулентность Н. pylori.
• Н. pylori запускают каскад иммунных реакций, сопровождаемых образованием в слизистой оболочке ИЛ, лизосомальных ферментов, ФНО, NO-синтетазы, что, в свою очередь, вызывает увеличение выработки иммуноглобулинов, способствует миграции лейкоцитов и поддерживает воспаление. Воспалительная реакция, развивающаяся в слизистой оболочке желудка в ответ на внедрение Н. pylori, сама по себе способствует нарушению целостности желудочного эпителия. В настоящее время в прогрессировании гастрита важную роль отводят не только вирулентности Н. pylori, но и генетическим особенностям ответа макроорганизма на инфекцию. Генетическая склонность к высокой продукции ИЛ-1β приводит к развитию хеликобактерассоциированной атрофии слизистой оболочки тела желудка, что считают фактором риска развития рака.
• У больных, инфицированных Н. pylori, повышаются концентрация гастрина (пептидного гормона, секретируемого антрального G-клетками и стимулирующего желудочную секрецию) в сыворотке крови и образование пепсиногена (вырабатывается главными
клетками фундальных желез слизистой оболочки дна желудка), что считают важными факторами риска развития хронического гастрита и язвы двенадцатиперстной кишки.
Хронический атрофический (аутоиммунный) гастрит
Этиология неизвестна. Основную роль в патогенезе играют аутоиммунные механизмы. Это подтверждает сочетание гастрита с другими аутоиммунными заболеваниями, такими как аутоиммунный тиреоидит, болезнь Аддисона-Бирмера, полигландулярная эндокринная патология, дефицит IgA и пр. Наиболее характерный признак аутоиммунного гастрита - наличие AT к париетальным клеткам и внутреннему фактору. Аутоиммунное поражение париетальных клеток слизистой оболочки желудка приводит к их гибели, атрофии фундальных желез и ахлоргидрии. Это, в свою очередь, вызывает постоянную стимуляцию G-клеток и гипергастринемию (>1000 пг/мл). Гипергастринемия приводит к гиперплазии энтерохромаффинных клеток, что может быть причиной развития карциноида примерно у 5% пациентов с аутоиммунным гастритом, риск развития аденокарциномы желудка возрастает в 3 раза. Аутоантитела к внутреннему фактору блокируют его соединение с витамином В12, что приводит к развитию витамин В12-дефицитной анемии.
Химический (реактивный) гастрит
Наиболее часто связан с рефлюксом желчи и панкреатических ферментов или длительным приемом НПВС.
• Химический гастрит часто наблюдают в культе резецированного желудка, после ваготомии, при врожденной или приобретенной недостаточности привратника, хроническом нарушении проходимости двенадцатиперстной кишки. Развитие этой формы хронического гастрита связано с попаданием в желудок содержимого двенадцатиперстной кишки (панкреатических ферментов, желчных кислот и их солей, лизолецитина), повреждающего слизистую оболочку желудка. Кроме того, в слизистой оболочке желудка повышается содержание гистамина (из-за защелачивания желудочного содержимого), что приводит к отеку и нарушению кровотока с развитием кровоизлияний и эрозий.
• Развитие хронического гастрита при длительном приеме НПВС связано с угнетением синтеза простагландинов, что приводит к снижению синтеза защитных мукополисахаридов и нарушению репаративных процессов в слизистой оболочке.
Лимфоцитарный гастрит
Этиология и патогенез этой формы неизвестны, на нее приходится 4,5% всех случаев гастритов. Существует предположение, что причиной выступает иммунная реакция на местное воздействие неустановленных Аг.
Эозинофильный гастрит
Хроническое рецидивирующее заболевание неизвестной этиологии. Наблюдают чрезвычайно редко. У части больных в анамнезе отмечают бронхиальную астму, экзему и другие болезни, связанные с атопическим фенотипом. Установлена также гиперчувствительность к пищевым белкам.
Гранулематозный гастрит
Гранулемы в желудке находят у 10% больных саркоидозом, 7% пациентов с болезнью Крона, а также при туберкулезе, микозах, инородных телах в желудке.
ПАТОМОРФОЛОГИЯ
В большинстве существующих патоморфологических классификаций выделяют 2 основные формы хронического гастрита:
• неатрофический (поверхностный), протекающий без атрофии желез;
• атрофический.
Отдельно рассматривают морфологические изменения при особых формах гастритов.
• При хроническом неатрофическом (хеликобактерном) гастрите процесс чаще локализован в антральном отделе желудка. Клетки эпителия уплощаются, границы между ними становятся нечеткими, ядра смещаются к поверхности, окрашиваются неравномерно. В клетках эпителия находят вакуоли. Воспалительные изменения проявляются субэпителиальным отеком и лейкоцитарной инфильтрацией. В дальнейшем процесс распространяется на тело желудка с развитием пангастрита, атрофические изменения начинают превалировать над воспалительными.
• Хронический атрофический (аутоиммунный) гастрит характеризуется поражением слизистой оболочки, главным образом фундального отдела и тела желудка с ранним развитием атрофии. Наиболее характерный признак хронического атрофического гастрита - гибель желез слизистой оболочки желудка. Оставши-
еся железы укорачиваются, уменьшается количество главных и обкладочных клеток. Одновременно возникают воспалительная инфильтрация, гиперплазия интрамуральной лимфоидной ткани и фиброз. На ранней стадии заболевания атрофия выражена нерезко и носит очаговый характер. На более поздней стадии атрофические изменения развиваются по всей слизистой оболочке желудка.
• При химическом (реактивном) гастрите морфологические изменения заключаются в гиперплазии эпителия желудочных ямок, отеке и пролиферации гладкомышечных клеток на фоне умеренного воспаления. Основной признак лимфоцитарного гастрита - выраженная лимфоцитарная инфильтрация эпителия слизистой оболочки желудка (количество лимфоцитов превышает 30 на 100 эпителиальных клеток). В подавляющем большинстве случаев (76%) обнаруживают пангастрит, в 18 и 6% - фундальный и антральный гастрит соответственно. Макроскопически при ФЭГДС определяют утолщенные складки, узелки, эрозии, локализующиеся в основном в теле желудка.
• Эозинофильный гастрит характеризуется выраженной инфильтрацией эозинофилами слизистой оболочки и других слоев стенки желудка, ее отеком и полнокровием. Чаще поражается антральный отдел.
• Гранулематозный гастрит характеризуется наличием в собственной пластинке слизистой оболочки эпителиоидно-клеточных гранулем, в которых иногда выявляют гигантские многоядерные клетки.
• Основной морфологический признак гигантского гипертрофического гастрита (болезни Менетрие) - гигантские складки слизистой оболочки, напоминающие извилины головного мозга. При гистологическом исследовании обнаруживают резко утолщенную за счет углубления ямок слизистую оболочку. Ямки выглядят извитыми, расширенными, в их просвете часто обнаруживают слизь. Вокруг расширенных ямок можно видеть разрастание тяжей гладких мышц. Эти изменения могут быть как очаговыми, так и диффузными. Эпителий может быть уплощен, с признаками кишечной метаплазии. Обнаруживают кисты различных размеров. Происходит абсолютное и относительное уменьшение количества главных и обкладочных клеток с замещением их слизепродуцирующими клетками, что проявляется ахилией.
КЛИНИЧЕСКАЯ КАРТИНА И ДИАГНОСТИКА
Клиническая картина хронического гастрита разнообразна и зависит от стадии заболевания, секреторной функции желудка, локализации воспалительного процесса.
• Хронический неатрофический гастрит обычно начинается в молодом возрасте. Клиническая симптоматика складывается из болевого и диспепсического синдромов:
- болевой синдром обычно напоминает таковой при язвенной болезни двенадцатиперстной кишки (боли в надчревной и околопупочной областях, возникающие натощак), но, как правило, менее выраженный. По характеру боль может быть острой, схваткообразной, или ноющей, неинтенсивной. Иногда боль возникает вскоре после еды. Боли не имеют сезонного характера, обычно возникают при погрешностях в диете и стихают при ее соблюдении;
- диспепсический синдром манифестирует изжогой, отрыжкой кислым, реже тошнотой и рвотой желудочным содержимым.
• Атрофический гастрит наблюдают преимущественно в среднем и пожилом возрасте. Он часто сочетается с витамин В12-дефицитной анемией, тиреоидитом, тиреотоксикозом, первичным гипопаратиреозом. Иногда заболевание протекает латентно. Наиболее частые симптомы - ощущение тяжести в надчревной области после еды, чувство переедания, переполнения желудка. Больных беспокоит отрыжка пищей и воздухом, неприятный привкус во рту. Аппетит снижен. Возможны метеоризм и неустойчивый стул.
• Для клинической картины реактивного гастрита характерна триада симптомов: боль в надчревной области, усиливающаяся после приема пищи; рвота с примесью желчи, приносящая облегчение; похудение.
• Наиболее частый симптом гигантского гипертрофического гастрита - боли в надчревной области различной интенсивности, по характеру чаще ноющие. Они возникают после приема пищи и сопровождаются чувством тяжести в желудке. Возможны рвота и диарея. Аппетит часто снижен, иногда вплоть до анорексии. У большинства больных наблюдают снижение массы тела (на 10-20 кг). В 25-40% случаев отмечают периферические отеки, обусловленные значительной потерей белка с желудочным соком. Возможны желудочные кровотечения из эрозий.
Лабораторные и инструментальные исследования
Рентгенологическое исследование. Рентгенологическое исследование не позволяет диагностировать основные формы хронического гастрита, но с его помощью можно исключить язвы, рак, полипоз и другие заболевания желудка, выявить двенадцатиперстно-желудочный рефлюкс, гигантский гипертрофический гастрит, хроническую непроходимость двенадцатиперстной кишки.
• Рентгенологическим признаком хронического нарушения проходимости двенадцатиперстной кишки считают задержку контрастной массы в ее просвете более 45 с, расширение просвета, наличие двенадцатиперстно-желудочного рефлюкса.
• При гигантском гипертрофическом гастрите складки слизистой оболочки резко утолщены на ограниченном участке (при локальном варианте) или по всему желудку (при диффузном варианте). Стенка желудка в зоне поражения эластична, видна перистальтика.
Фиброэзофагогастродуоденоскопия, кроме осмотра слизистой оболочки желудка и двенадцатиперстной кишки, позволяет получить биопсийный материал для морфологического и гистологического исследований с последующей точной диагностикой формы хронического гастрита. Для унификации гистологических заключений предложена визуально-аналоговая шкала. Наиболее точное представление может быть получено при изучении не менее 5 биоптатов (по 2 из антрального и фундального отделов и 1 из области угла желудка).
• Неатрофический (поверхностный) гастрит. Слизистая оболочка блестящая (иногда с налетом фибрина), отечная, гиперемированная, возможны кровоизлияния.
• Атрофический гастрит. Слизистая оболочка истончена, бледносерого цвета, с просвечивающимися кровеносными сосудами, рельеф сглажен. При умеренной атрофии более широкие участки незначительно истонченной слизистой оболочки чередуются с зонами атрофии белесоватого цвета, различной формы и небольших размеров. При резко выраженной атрофии слизистая оболочка резко истончена, местами с цианотичным оттенком, легко ранима. Складки полностью исчезают.
• Химический (реактивный) гастрит. Привратник зияет, слизистая оболочка желудка гиперемирована, отечна. В желудке значительное количество желчи. В области анастомоза могут быть обнаружены эрозии.
• Гигантский гипертрофический гастрит. В желудке обнаруживают гигантские складки, напоминающие извилины головного мозга, большое количество слизи. Слизистая оболочка легко ранима, нередко обнаруживают эрозии, кровоизлияния. При признаках кишечной метаплазии показано проведение ежегодных эндоскопических исследований с биопсией. Исследование секреторной функции желудка. Исследование секреторной функции желудка проводят методом фракционного желудочного зондирования или интрагастральной рН-метрии (табл. 41-2, 41-3) с применением парентеральных раздражителей (гистамина, пентагастрина).
Таблица 41-2. Показатели внутрижелудочной рН-метрии антрального отдела желудка
Таблица 41-3. Показатели внутрижелудочной рН-метрии тела желудка
Поэтажная манометрия. Методика заключается во введении катетера и регистрации изменений давления в верхних отделах ЖКТ. При химическом (реактивном) гастрите выявляют повышение давления в двенадцатиперстной кишке до 200-240 мм вод.ст. (в норме - 80-130 мм вод.ст.).
Выявление Helicobacter pylori. Все существующие методы выявления Н. pylori можно условно разделить на 2 группы: инвазивные и неинвазивные. ПЦР-диагностику можно осуществлять как в биоптатах слизистой оболочки желудка (инвазивно), так и в фекалиях больного (неинвазивно).
• Инвазивные методы. Подразумевают проведение ФЭГДС с биопсией слизистой оболочки желудка. Для выявления Н. pylori в полученных образцах применяют бактериологический, морфологический (цитологический, гистологический) и биохимический (уреазный тест) методы.
- Бактериологический метод. Биоптат гомогенизируют, высевают на селективную питательную среду и выращивают в микроаэрофильных условиях 37 °С. После этого проводят микроскопическую или биохимическую идентификацию вида выросших бактерий.
- Морфологическое исследование. Позволяет установить точный диагноз, особенно в сочетании с бактериологическим методом или уреазным тестом. Специфичность морфологического исследования зависит от присутствия в биоптате бактерий других видов и от количества Н. pylori:
о цитологический метод - микроскопия мазков-отпечатков биоптатов слизистой оболочки желудка, окрашенных по Романовскому-Гимзе и Граму;
о гистологический метод - «золотой стандарт» выявления Н. pylori. Биоптаты фиксируют в формалине, а затем заливают парафином. Срезы окрашивают по Романовскому-Гимзе. Н. pylori хорошо видны в гистологических препаратах, окрашенных гематоксилин-эозином или импрегнированных серебром по Уортину-Старри. Хорошие результаты дает люминесцентная микроскопия мазков, окрашенных акридиновым оранжевым. Для полноценной морфологической диагностики необходимо исследование нескольких биоптатов. Степень обсемененности оценивают количественно:
♦ 0 - бактерии в препарате отсутствуют;
♦ 1 - слабая обсемененность (до 20 микробных тел в поле зрения);
♦ 2 - умеренная обсемененность (от 20 до 50 микробных тел в поле зрения);
♦ 3 - выраженная обсемененность (>50 микробных тел в поле зрения);
◊ Иммуногистохимический метод с применением моноклональных AT и комплекса «авидин-биотин-пероксидаза» (используемые AT избирательно окрашивают только Н. pylori) высокой чувствительностью обладает.
- Биохимический метод (уреазный тест). Биоптат слизистой оболочки желудка инкубируют в жидкой или гелеобразной среде, содержащей мочевину, в присутствии индикатора. При наличии в биоптате Н. pylori образующаяся уреаза превращает мочевину в аммиак, что изменяет рН среды и, следовательно, цвет индикатора.
• Неинвазивные методы. Применяют серологические исследования (обнаружение AT к Н. pylori и др.) и дыхательный тест.
- Серологические исследования. Наиболее информативны для выявления в организме бактерий при проведении крупных эпидемиологических исследований. Клиническое применение данного теста ограничивается тем, что он не позволяет дифференцировать факт инфицирования в анамнезе от наличия Н. pylori в настоящий момент. В последнее время появились более чувствительные системы, которые с помощью иммуноферментного анализа (ИФА) позволяют подтвердить эрадикацию по снижению титра антихеликобактерных AT в сыворотке крови больных в стандартные сроки (4-6 нед). Экспресс-тесты можно использовать для удешевления процесса первичной диагностики инфекции Н. pylori, так как положительный результат теста в ясной клинической ситуации позволяет исключить дорогостоящее эндоскопическое исследование, а также использование методов непосредственной диагностики. Однако нельзя использовать экспресс-тесты для подтверждения эрадикации после лечения.
- Дыхательный тест. Наличие Н. pylori в желудке определяют по активности специфичной для данной бактерии уреазы. Пациент принимает внутрь раствор, содержащий меченную 13С или 14С мочевину. В присутствии Н. pylori фермент расщепляет мочевину, в результате чего выдыхаемый воздух содержит СО2 с меченым изотопом углерода (13С или 14С), уровень которого и определяют методом масс-спектроскопии или с помощью сцинтилляционного счетчика. Дыхательный тест позволяет эффективно диагностировать эрадикацию. В норме содержание стабилизированного изотопа 13С или 14С не превышает 1% общего количества углекислого газа в выдыхаемом воздухе. В настоящее время
дыхательный тест как неинвазивный становится основным, особенно для оценки проведенной эрадикации. - В клиническую практику входит метод определения Н. pylori с помощью полимеразной цепной реакции (ПЦР) в кале. Для подтверждения успешности эрадикационной терапии необходимо проводить контроль не ранее 4-6-й недели после завершения лечения. Диагностику эрадикации осуществляют как минимум двумя диагностическими методами:
• гистологическим или цитологическим методом обнаруживают Н. pylori;
• уреазным или дыхательным тестом определяют жизнедеятельность микроба .
Дифференциальная диагностика
Кроме хронического гастрита дополнительно выделяют так называемые функциональные расстройства желудка, дифференциальная диагностика с которыми крайне затруднительна, поскольку для этого необходима биопсия, которую при хроническом гастрите проводят довольно редко. Хронический гастрит диагностируют эндоскопически и морфологически уже в молодом возрасте, когда есть соответствующая симптоматика, выставляют диагноз хронического гастрита с синдромом функциональной диспепсии.
Хронический атрофический гастрит необходимо дифференцировать от язвенной болезни желудка со сниженной секреторной функцией, доброкачественных и злокачественных опухолей желудка. Наиболее ответственной задачей является дифференциальная диагностика с раком желудка. Трудности возникают при эндофитном росте опухоли. Для правильной диагностики используют комплексное рентгеноэндоскопическое исследование с множественной прицельной биопсией из наиболее измененных участков слизистой оболочки. В неясных случаях проводят динамическое наблюдение с повторным проведением ФЭГДС с биопсией. В некоторых неясных ситуациях эффективно эндоскопическое УЗИ.
ЛЕЧЕНИЕ
Хронический гастрит обычно лечат амбулаторно. Госпитализация показана только при выраженном обострении, при необходимости проведения сложного обследования и затруднениях в дифференциальной диагностике. Лечение зависит от типа гастрита, секреторной функции желудка, фазы заболевания и включает определенный диетический ре-
жим, фармакотерапию, физиотерапевтическое и санаторно-курортное лечение.
Диетотерапия
Питание должно быть дробным (5-6 раз в сутки), пища - не горячей. При хроническом неатрофическом гастрите исключают продукты и блюда, раздражающие слизистую оболочку желудка (соленые, копченые блюда, маринады, острые приправы и др.). При хроническом атрофическом гастрите, протекающем с секреторной недостаточностью, показана диета, предусматривающая механическое щажение в сочетании с химической стимуляцией секреторной активности желудка. С этой целью в рацион включают мясные, рыбные и овощные супы, крепкие бульоны, нежирные мясо и рыбу, овощи и фрукты, соки, кофе. Диету назначают на период обострения болезни. После наступления ремиссии больным рекомендуют полноценное питание с исключением трудноперевариваемых продуктов (жира, сметаны, сливок), а также продуктов, вызывающих брожение (цельное молоко, свежие изделия из теста, виноград и др.).
Медикаментозное лечение
Хронический неатрофический гастрит
Эрадикация Helicobacter pylori изложена в разделе «Язвенная болезнь желудка и двенадцатиперстной кишки».
Антисекреторная терапия. Выделяют 5 основных групп препаратов, влияющих на желудочную секрецию.
• Антациды (табл. 41-4) способствуют нейтрализации соляной кислоты, адсорбции пепсина. Кроме того, алюминийсодержащие антациды обладают цитопротекторным действием, повышают синтез гликопротеинов желудочной слизи, улучшают репаративные процессы. В настоящее время предпочтение отдают невсасывающимся (несистемным) антацидам. Сравнительная характеристика различных антацидов приведена в табл. 41-5. Антациды целесообразно назначать через 1-2 ч после еды 3-4 раза в сутки и перед сном.
• Неселективные м-холиноблокаторы (атропин, платифиллин, метоциния йодид) обладают незначительным антисекреторным эффектом, действие непродолжительно, нередко возникают побочные реакции (сухость во рту, тахикардия, запор, нарушение мочеиспускания, повышение внутриглазного давления и др.), поэтому в настоящее время их применяют крайне редко.
• Селективный м-холиноблокатор бускопан, в терапевтических дозах обладающий меньшим атропиноподобным эффектом, назначают внутрь по 10-20 мг 3-5 раз.
• Из блокаторов Н2-рецепторов гистамина наиболее часто применяют ранитидин (150 мг 2 раза в сутки внутрь или внутримышечно) и фамотидин (20 мг 2 раза в сутки внутрь или внутривенно). При назначении блокаторов Н2-рецепторов следует иметь в виду, что через 2-3 нед их эффективность снижается, и в этом случае надо или увеличивать дозу, или отменять препарат.
• Ингибиторы Н+-, К+-зависимой АТФазы (ингибиторы протонного насоса) - омепразол, лансопразол, пантопразол, рабепразол, эзомепразол - оказывают выраженное угнетающее действие на кислотообразующую функцию желудка. Суточная доза омепразола и эзомепразола составляет 40 мг (20 мг 2 раза в сутки или 40 мг однократно), лансопразола - 60 мг, рабепразола - 20-40 мг.
Таблица 41-4. Антациды
Таблица 41-5. Сравнительная характеристика скорости наступления и продолжительности действия эффекта антацидов
Препараты, защищающие (обволакивающие) слизистую оболочку
• Сукральфат связывает изолецитин, пепсин и желчные кислоты, повышает содержание простагландинов в стенке желудка и увеличивает выработку желудочной слизи (цитопротективное действие). Препарат назначают по 1 г 4 раза в сутки (3 раза за 1 ч до еды и перед сном). Курс лечения обычно составляет 2-3 нед.
• Висмута трикалия дицитрат по механизму действия близок к сукральфату. Кроме того, он обладает способностью угнетать жизнедеятельность Н. pylori, благодаря чему его используют в лечении этой инфекции вместе с антибиотиками и метронидазолом. Препарат назначают по 0,24 г 2 раза в сутки (утром и вечером, за 30 мин до еды). Не рекомендуют сочетать висмута трикалия дицитрат с антацидами. Препарат хорошо переносится, но для предупреждения токсического действия висмута на ЦНС и печень продолжительность курса лечения не должна превышать 8 нед. При нарушении функций почек этот препарат не применяют.
Хронический атрофический гастрит
Лекарственную терапию при этой форме проводят только в период обострения.
• Заместительная терапия секреторной недостаточности желудка (хлористоводородная кислота + пепсин, бетаин + пепсин. Препараты противопоказаны при наличии эрозий слизистой оболочки).
• Заместительная терапия при снижении экскреторной функции поджелудочной железы (ферментные препараты, например, креон♠, панцитрат♠, мезим-форте♠).
• Лечение витамин В12-дефицитной анемии (см. главу «Анемии»).
• Фитотерапия. Назначают растительные средства, оказывающие противовоспалительное действие: настой из листьев подорожника, ромашки, мяты, зверобоя, валерианы (1 столовая ложка на стакан воды) по 1/3-1/4 стакана 3-4 раза в сутки до еды в течение 3-4 нед, сок подорожника по 1 столовой ложке или подорожника большого листьев экстракт по 0,5-1,0 г 3 раза в сутки.
• Препараты, улучшающие трофику тканей и усиливающие репаративные процессы: никотиновая кислота (1% раствор внутривенно от 1 до 10 мл 10 дней или в/м 3-5 мл 20 дней), инозин по 0,2 г 3 раза в сутки за 40 мин до еды 20-30 дней, витамины В1*, В2*, фолиевая кислота.
• Блокаторы центральных и периферических дофаминовых рецепторов при болях и выраженных диспепсических явлениях (см. ниже, в подразделе «Химический (реактивный) гастрит»).
• В соответствии с рекомендациями Маастрихтского соглашения III (2005), атрофический гастрит рассматривают как показание к эрадикационной терапии (см. раздел «Язвенная болезнь желудка и двенадцатиперстной кишки»).
Химический (реактивный) гастрит
Лечение направлено на нормализацию моторики ЖКТ и связывание желчных кислот.
• Для предотвращения заброса в желудок содержимого двенадцатиперстной кишки применяют блокаторы дофаминовых рецепторов (домперидон и метоклопрамид по 10 мг 3 раза в сутки за 30 мин до еды в течение 2-3 нед), которые повышают тонус привратника и внутрижелудочное давление. Основные побочные эффекты метоклопрамида: головная боль, бессонница, слабость, импотенция, гинекомастия, экстрапирамидные расстройства. Домперидон не проникает через гематоэнцефалический барьер и практически лишен побочных действий. Итоприд (ганатон♠) - новый препарат с комбинированным механизмом действия: антагонист допаминовых рецепторов и блокатор ацетилхолинестеразы. Он оказывает противорвотное действие, усиливает пропульсивную моторику желудка и ускоряет его опорожнение.
• Для защиты слизистой оболочки желудка от желчных кислот назначают антациды (например, алюминия фосфат) в обычной суточной дозе. Гелеобразные антациды предпочтительнее, так как оказывают более быстрый эффект.
Гигантский гипертрофический гастрит
Необходимо длительное (2-3 мес) лечение. Диета высококалорийная, богатая белками (150-200 г/сут). Из ЛС применяют м-холиноблокаторы, блокаторы Н2-рецепторов или ингибиторы Н+-,K+-зависимой АТФазы. При резистентной к лечению гипопротеинемии, повторных кровотечениях рекомендуют оперативное лечение.
Физиотерапия
Физиотерапию широко применяют в комплексном лечении больных хроническим гастритом. Для купирования болевого синдрома используют электрофорез прокаина, платифиллина, парафиновые, озокеритовые и грязевые аппликации. Для стимуляции железистого аппарата при хроническом гастрите с умеренной секреторной недостаточностью применяют синусоидальные модулированные токи и дециметровые электромагнитные волны.
Санаторно-курортное лечение
Санаторно-курортное лечение показано вне стадии обострения. При неатрофическом хроническом гастрите с сохраненной и повышенной
секреторной функцией желудка показаны гидрокарбонатные минеральные воды через 2-3 ч после еды (на курортах в Боржоми, Железноводске, Джермуке, Арзни, Миргороде). При хроническом атрофическом гастрите с секреторной недостаточностью показаны хлоридные, натриевые, гидрокарбонатно-хлоридные минеральные воды за 15-20 мин до еды (на курортах в Ессентуки, Трускавце, Моршине, Старой Руссе). Минеральную воду пьют в теплом виде, без газа.
ПРОГНОЗ
При неатрофическом хроническом гастрите прогноз в целом благоприятный. Больные длительный период времени остаются трудоспособными. Заболевание не влияет на продолжительность и качество жизни больных. Возможны длительные спонтанные ремиссии. Менее благоприятный прогноз у больных с гигантским гипертрофическим гастритом и диффузным атрофическим гастритом из-за повышенного риска развития рака желудка.
41.2. ЯЗВЕННАЯ БОЛЕЗНЬ ЖЕЛУДКА И ДВЕНАДЦАТИПЕРСТНОЙ КИШКИ
Язвенная болезнь желудка и двенадцатиперстной кишки - хроническое рецидивирующее заболевание, характерный признак которого в период обострения - образование язв слизистой оболочки желудка и двенадцатиперстной кишки.
ЭПИДЕМИОЛОГИЯ
Язвенная болезнь относится к наиболее частым заболеваниям (около 5-10% взрослого населения) и занимает по распространенности 2-е место после ИБС. В России заболеваемость язвенной болезнью желудка и двенадцатиперстной кишки в 2001 г. составила 157,6 случая на 100 000 населения. Чаще болеют мужчины, преимущественно до 50 лет.
КЛАССИФИКАЦИЯ
Расширенная клиническая классификация язвенной болезни приведена в табл. 41-6.
Таблица 41-6. Классификация язвенной болезни
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
Наследственная предрасположенность занимает важнейшее место. Без определенной наследственной предрасположенности трудно представить возникновение язвенной болезни. Однако наследуется не само заболевание, а установлен ряд генетических факторов, наличие которых предрасполагает к возникновению язвенной болезни. Наследственно обусловленное увеличение массы обкладочных клеток, их гиперчувствительность к гастрину, повышение образования пепсиногена-1 и расстройство гастродуоденальной моторики способствуют повреждению слизистой оболочки желудка и двенадцатиперстной кишки. К снижению резистентности слизистой оболочки приводят дефицит фукомукопротеидов слизи и недостаточность выработки секретируемого IgА, выполняющих защитную функцию, 0(1) группа крови, неспособность секретировать агглютиногены крови АВ в желудок, врожденная неполноценность артериальной сети, снабжающей кровью слизистую оболочку желудка (преимущественно малую кривизну) и луковицу двенадцатиперстной кишки.
Реализуется наследственная предрасположенность при неблагоприятных воздействиях: психоэмоциональных стрессах, грубых погрешностях в питании, вредных привычках (курении, злоупотреблении алкоголем, избыточном потреблении кофе), при неконтролируемом приеме НПВС. Безусловно, к факторам риска следует относить инфекцию Н. pylori.
В основе патогенеза язвенной болезни лежит нарушение динамического равновесия между факторами агрессии и защиты слизистой оболочки желудка.
КЛИНИЧЕСКАЯ КАРТИНА
Клиническая картина язвенной болезни характеризуется большим полиморфизмом и зависит от локализации язвенного дефекта, его раз-
меров и глубины, секреторной функции желудка, возраста больного. Основной симптом - боли. Они, как правило, имеют четкий ритм возникновения, связь с приемом пищи, периодичность. По отношению ко времени, прошедшему после приема пищи, принято различать ранние, поздние и «голодные» боли.
• Ранние боли появляются через 0,5-1 ч после еды, постепенно нарастают по своей интенсивности, сохраняются в течение 1,5-2 ч, уменьшаются и исчезают по мере эвакуации желудочного содержимого в двенадцатиперстную кишку. Ранние боли характерны для язв тела желудка. При поражении кардиального, субкардиального и фундального отделов болевые ощущения возникают сразу после приема пищи.
• Поздние боли возникают через 1,5-2 ч после приема пищи, постепенно усиливаясь по мере эвакуации содержимого из желудка. Они характерны для язв пилорического отдела желудка и луковицы двенадцатиперстной кишки.
• «Голодные» (ночные) боли возникают через 2,5-4 ч после еды и исчезают после очередного приема пищи. Эти боли также свойственны язвам двенадцатиперстной кишки и пилорического отдела желудка.
• Сочетание ранних и поздних болей наблюдают у больных с сочетанными или множественными язвами желудка и двенадцатиперстной кишки.
Выраженность болевых ощущений (от ноющих до режущих, сверлящих болей) зависит:
- от локализации язвенного дефекта (незначительная - при язвах тела желудка и резкая - при пилорических и внелуковичных язвах);
- возраста (более интенсивная - у молодых);
- наличия осложнений.
Боли обычно купируются после приема антисекреторных препаратов. Локализация болей зависит от расположения язвенного дефекта. При язвах кардиального и субкардиального отделов боли чаще всего возникают в области мечевидного отростка грудины, при язвах тела желудка - в эпигастральной области слева от срединной линии, при язвах пилорического отдела и двенадцатиперстной кишки - справа от срединной линии. Указанная проекция болей не всегда соответствует той или иной локализации язвенного процесса. При язвах верхнего отдела желудка нередко наблюдают атипичные боли за грудиной или слева от
нее, напоминающие таковые при стенокардии. При внелуковичных язвах боли могут ощущаться в спине или правой подлопаточной области. У многих больных наблюдают иррадиацию болей:
- при высоких язвах (кардиального, субкардиального отделов) - в прекардиальную область, левую лопатку, грудной отдел позвоночника;
- при язвах луковицы двенадцатиперстной кишки (особенно задней стенки) и залуковичного отдела - в поясничную область, под правую лопатку, в межлопаточное пространство, а иногда и в правую подвздошную область.
Такое разнообразие вариантов локализации и иррадиации болей при язвенной болезни может служить причиной диагностических ошибок, становясь поводом для постановки диагноза хронического холецистита, ИБС, остеохондроза грудного и поясничного отделов позвоночника.
Иногда появление иррадиирущих болей связано с развитием осложнений.
• При пенетрации язвы в поджелудочную железу возможны упорные боли в поясничной области.
• При пенетрации язвы в печеночно-двенадцатиперстную связку боли иррадиируют в правую половину грудной клетки.
• При пенетрации в желудочно-селезеночную связку боли иррадиируют в левую половину грудной клетки.
У 24-28% больных язвенная болезнь протекает атипично: без болевого синдрома или с болями, напоминающими другое заболевание.
ДИАГНОСТИКА
Диагностика включает обнаружение язвенного дефекта, выявление Н. pylori, исследование секреторной функции желудка.
Обнаружение язвенного дефекта. Обнаружить язвенный дефект можно рентгенологическим или эндоскопическим методом.
• Характерный прямой признак язвы при рентгенологическом исследовании - симптом «ниши» - тень контрастной массы, заполнившей язвенный кратер. Силуэт язвы может быть виден в профиль (контурная «ниша») или анфас на фоне складок слизистой оболочки («рельеф-ниша»). Маленькие «ниши» рентгенологически неразличимы. Форма контурной «ниши» может быть округлой, овальной, щелевидной, линейной, остроконечной или неправильной. Контуры малых язв обычно ровные и четкие. В больших язвах очертания становятся неровными из-за развития
грануляционной ткани, скопления слизи, сгустков крови. У основания «ниши» видны маленькие выемки, соответствующие отеку и инфильтрации слизистой оболочки у краев язвы. Рельефная «ниша» имеет вид стойкого округлого или овального скопления контрастной массы на внутренней поверхности желудка или двенадцатиперстной кишки. При хронической язве рельефная «ниша» может иметь неправильную форму, неровные очертания. Иногда наблюдают конвергенцию складок слизистой оболочки к язвенному дефекту. К косвенным рентгенологическим признакам язвы относят наличие жидкости в желудке натощак, ускоренное продвижение контрастной массы в зоне язвы и регионарный спазм. В желудке и луковице спазм обычно возникает на уровне язвы, но на противоположной стороне. Там образуется втяжение контура стенки органа с ровными очертаниями - симптом «указывающего перста». Нередко наблюдают дуоденогастральный рефлюкс.
• ФЭГДС - наиболее информативный метод (язву обнаруживают в 98% случаев), позволяющий не только обнаружить язвенный дефект и контролировать его заживление, но и провести гистологическую оценку изменений слизистой оболочки желудка, исключить малигнизацию. Язва в стадии обострения чаще всего округлая. Дно язвы покрыто фибринозным налетом и окрашено чаще в желтый цвет. Слизистая оболочка вокруг язвы гиперемирована, отечна. Края язвы обычно высокие, ровные, вокруг язвы формируется воспалительный вал. Для заживающей язвы характерны уменьшение гиперемии, сглаживание воспалительного вала, язва становится менее глубокой, дно очищается и покрывается грануляциями. По результатам биопсии краев и дна язвы подтверждают процесс заживления. Изменения в виде лейкоцитарной инфильтрации сохраняются длительное время после восстановления целостности слизистой оболочки.
Выявление Helicobacter pylori. При ФЭГДС получают биоптаты слизистой оболочки желудка с последующим выявлением Н. pylori (подробнее см. в разделе «Хронический гастрит»).
Исследование секреторной функции желудка. Исследование секреторной функции желудка имеет немаловажное значение, так как уровень желудочного кислотовыделения учитывают при определении оптимальной схемы лечения.
• Из зондовых (инвазивных) методов обычно используют фракционное желудочное зондирование и зондовую рН-метрию различных отделов желудка и двенадцатиперстной кишки.
- Для стимуляции желудочной секреции оптимально использование субмаксимальных доз гистамина (0,008 мг/кг). Максимальный гистаминовый тест (0,024 мг/кг) применяют для исключения гистаминустойчивой ахлоргидрии. Побочные эффекты гистамина: чувство жара, тошнота, головокружение, затруднение дыхания, покраснение кожи, тахикардия, снижение АД. Для их предупреждения за 30 мин до начала исследования вводят 2 мл 2% раствора хлоропирамина подкожно. При наличии противопоказаний к введению гистамина применяют синтетический аналог гастрина - пентагастрин в дозе 6 мкг/кг, который практически не вызывает побочных эффектов.
- Определение рН содержимого различных отделов желудка и двенадцатиперстной кишки проводят с помощью многоканального рН-зонда. Обычные показатели рН в желудке - 1,3-1,7. У больных язвенной болезнью двенадцатиперстной кишки они обычно снижены до 0,9-1,0. Удобно использовать рН-метрию для оценки воздействия ЛС на процесс секреции соляной кислоты.
• Беззондовые (неинвазивные) методы (десмоидную пробу, ацидотест) применяют редко, поскольку они не обладают достаточной чувствительностью и дают существенные погрешности в результатах.
Дифференциальная диагностика
Дифференциальная диагностика язв желудка и двенадцатиперстной кишки представлена в табл. 41-7. Диагностика доброкачественных и малигнизированных язв желудка основана на результатах цитологического и гистологического исследований биопсийного материала.
Таблица 41-7. Дифференциальная диагностика желудочных и дуоденальных язв
Изъязвления желудка и двенадцатиперстной кишки могут быть проявлением не только язвенной болезни, но и других патологических состояний организма. В этом случае диагностируют симптоматические язвы (табл. 41-8).
Таблица 41-8. Основные виды симптоматических язв желудка
Симптоматические язвы, как правило, острые, множественные, поверхностные, протекают со стертой клинической картиной, часто осложняются кровотечениями. Они быстро заживают при устранении вызвавшей их причины (чаще всего после прекращения приема ЛС, особенно НПВС; табл. 41-9).
Таблица 41-9. Дифференциальная диагностика между пептической и симптоматическими (индуцированными приемом нестероидных противовоспалительных средств) язвами
Дифференциальная диагностика доброкачественных и малигнизированных язв желудка основывается на результатах цитологического и гистологического исследований биопсийного материала.
ЛЕЧЕНИЕ
Больных с обострением неосложненной язвенной болезни можно лечить амбулаторно. Госпитализации подлежат больные:
- с впервые выявленной язвой желудка;
- осложненным и часто рецидивирующим течением;
- выраженным болевым симптомом, не купирующимся при амбулаторном лечении;
- язвенной болезнью, развившейся на фоне тяжелых сопутствующих заболеваний.
Диетотерапия
Исключают блюда, вызывающие или усиливающие проявление заболевания (острые приправы, маринованные и копченые блюда). Питание дробное, 5-6 раз в сутки. В период обострения пищу готовят на пару.
Медикаментозное лечение
Язвенная болезнь, ассоциированная с H. pylori. Около 95% случаев язвенной болезни двенадцатиперстной кишки и 87% язвенной
болезни желудка ассоциированы с Н. pylori. В соответствии с рекомендациями Маастрихтского соглашения III (2005) лечение язвенной болезни, ассоциированной с H. pylori, подразумевает проведение эрадикационной (то есть направленной на уничтожение микроорганизмов) терапии. Современная схема эрадикационной терапии должна удовлетворять следующим требованиям:
- уничтожению Н. pylori не менее чем в 80% случаев;
- возникновению побочных эффектов, обусловливающих прекращение лечения, менее чем в 5% случаев;
- продолжительности курса терапии 10-12 дней.
В качестве терапии рекомендуют использование следующих схем.
• Трехкомпонентную схему, которая включает любой из блокаторов Н+-, К+-зависимой АТФазы (омепразол, лансопразол, рабепразол, эзомепразол) в стандартных дозах в сочетании с 2 антибактериальными препаратами - кларитромицином по 500 мг 2 раза в день и амоксициллином по 1000 мг 2 раза в день или метронидазолом по 500 мг 2 раза в день в течение как минимум 10 дней. Учитывая высокую распространенность в России штаммов H. pylori, резистентных к метронидазолу, предпочтительно сочетание кларитромицина с амоксициллином. Антисекреторные ЛС обеспечивают оптимальный уровень рН для действия антибактериальных препаратов и устраняют повреждающее действие соляной кислоты на слизистую оболочку желудка и двенадцатиперстной кишки. В качестве базисного препарата рекомендуют применять наиболее эффективные на сегодняшний день антисекреторные ЛС (блокаторы Н+-, К+-зависимой АТФазы).
• Альтернативой 3-компонентной схемы считают квадротерапию на основе препарата висмута. Она включает блокатор Н+-, К+-зависимой АТФазы в стандартной дозе 2 раза в день, висмута трикалия дицитрат по 120 мг 4 раза в день, тетрациклин по 500 мг 4 раза в день и метронидазол по 500 мг 4 раза в день. При неэффективности лечения дальнейшую тактику определяют с учетом чувствительности микроорганизмов к антибактериальным препаратам. К антибиотикам резерва относят левофлоксацин, фуразолидон, рифамицин.
При неосложненной язвенной болезни двенадцатиперстной кишки антисекреторную терапию после курса эрадикации не продолжают. При язвенной болезни желудка, а также при язвенной болезни двенадцатиперстной кишки, протекающей на фоне тяжелых сопутствующих
заболеваний или с осложнениями, рекомендуют продолжить антисекреторную терапию в течение 2-5 нед для достижения более эффективного заживления язвы.
Оценку эффективности эрадикации проводят не ранее 4-6 нед после окончания курса лечения с помощью как минимум 2 диагностических методов, причем при использовании методов непосредственного обнаружения бактерий в биоптате слизистой оболочки желудка (бактериологического, морфологического) необходимо исследование 2 образцов из тела желудка и одного - из антрального отдела. Цитологический метод для подтверждения эрадикации неприменим. Дыхательный уреазный тест с изотопом 13С и определение Н. pylori с помощью ПЦР в кале как неинвазивные признаны основными методами диагностики инфекции Н. pylori.
Неудачи при эрадикационной терапии обычно связаны с резистентностью штамма Н. pylori к используемым антибактериальным препаратам (чаще всего, производным нитроимидазола или макролидам). В таких случаях применяют схему лечения с другими ЛС; если и после этого эрадикации достичь не удается, следует определять чувствительность штамма Н. pylori ко всему спектру используемых антибиотиков. Появление бактерий в организме больного в течение года после лечения расценивают как рецидив инфекции и для его лечения применяют более эффективные схемы лечения.
Язвенная болезнь, не ассоциированная с Helicobacter pylori. Применяют все группы антисекреторных препаратов: антациды, блокаторы Н2-рецепторов, блокаторы Н+-, К+-зависимой АТФазы - в обычных дозах.
Хирургическое лечение
Абсолютные показания:
- перфорация;
- профузное кровотечение;
- стеноз, сопровождаемый выраженными эвакуаторными нарушениями;
- малигнизация. Относительные показания:
- многократные профузные желудочно-кишечные кровотечения в анамнезе;
- пенетрирующие язвы;
- язвы, резистентные к лекарственной терапии.
При выборе метода хирургического лечения предпочтение отдают органосохраняющим операциям.
ДИСПАНСЕРИЗАЦИЯ И ПРОФИЛАКТИКА
Существуют 2 подхода к профилактической лекарственной терапии обострений язвенной болезни.
• Непрерывная (в течение месяцев и даже лет) поддерживающая терапия антисекреторным препаратом в половинной дозе (например, омепразолом по 20 мг/сут). Применяют при неэффективности эрадикационной терапии, осложнениях язвенной болезни (кровотечении или перфорации), сопутствующих эрозивно-язвенном рефлюкс-эзофагите и заболеваниях, при которых необходим прием НПВС, у больных старше 60 лет с ежегодно рецидивирующим течением язвенной болезни.
• Профилактическая терапия «по требованию». Подразумевает прием антисекреторных ЛС при появлении симптомов обострения язвенной болезни - в первые 2-3 дня в полной суточной дозе, а затем в течение 2 нед - в половинной дозе. Если симптомы обострения полностью исчезают, терапию следует прекратить, в противном случае проводят ФЭГДС и другие исследования, как это предусмотрено при обострении. Этот вид терапии используют при появлении симптомов язвенной болезни после успешной эрадикации Н. pylori.
ПРОГНОЗ
Прогноз при неосложненной язвенной болезни благоприятный. При достижении эрадикации рецидивы в течение 1-го года возникают только у 6-7% больных. Ранняя диагностика и своевременное лечение предупреждают развитие осложнений и сохраняют трудоспособность больных. Прогноз ухудшается при большой давности заболевания в сочетании с частыми, длительными рецидивами, при осложненных формах язвенной болезни, особенно при злокачественном перерождении язвы.
41.3. РАК ЖЕЛУДКА
Рак желудка - злокачественная опухоль, развивающаяся из эпителия слизистой оболочки желудка. По заболеваемости и смертности в России занимает 2-е место среди злокачественных новообразований (заболеваемость составляет 40 случаев на 100 000 населения). Мужчины болеют примерно в 2 раза чаще женщин. Рак желудка редко развивается у лиц моложе 40 лет. Пик заболеваемости приходится на возраст 50-59 лет.
КЛАССИФИКАЦИЯ
Существуют различные классификации рака желудка, основанные на клинических, морфологических, эндоскопических данных. Международная TNM-классификация рака желудка (Tumor - первичная опухоль, Nodulus - поражение регионарных лимфатических узлов, Metastasis - отдаленные метастазы; табл. 41-10) базируется на определении степени распространения опухолевого процесса. В настоящее время принято отдельно выделять ранний рак желудка (небольшая, диаметром до 3 см опухоль, расположенная в пределах слизистой и подслизистой оболочек, без проникновения в мышечную оболочку стенки желудка и без метастазов, соответствует T1N0M0), характеризуемый хорошим прогнозом (после резекции желудка 5-летняя выживаемость составляет 95%). Эндоскопические классификации рака желудка см. далее, в разделе «Эндоскопическая диагностика». Патоморфологическую классификацию рака желудка см. ниже, в подразделе «Патоморфология».
Таблица 41-10. Международная TNM-классификация рака желудка (4-е изд.)
ЭТИОЛОГИЯ
Причина развития рака желудка неизвестна. Факторы, предрасполагающие к развитию рака желудка, многообразны, их разделяют на экзогенные и эндогенные.
Экзогенные факторы
• Канцерогены. Выявлена связь курения и частого употребления в пищу продуктов, содержащих различные консерванты, нитраты. Канцерогенными свойствами обладают не сами нитраты, а их производные (нитриты, нитрозамины, нитрозамиды), которые образуют нитратредуцирующие бактерии при низкой кислотности желудочного сока (рН - 5,0 и выше). Известно, что аскорбиновая кислота - антагонист этих соединений.
• Инфекция H. pylori. Рак желудка нередко развивается на фоне хронического атрофического гастрита, ассоциированного с Н. pylori. Атрофию и дисплазию, возникающих на этом фоне, считают предраковыми заболеваниями. В 1994 г. Международное агентство по исследованию рака при ВОЗ отнесло Н. pylori к канцерогенам 1-го класса для человека, т.е. канцерогенам, имеющим безусловную связь с возникновением рака желудка.
Эндогенные факторы
• Перенесенная операция по поводу язвенной болезни желудка (риск повышается примерно в 2,4 раза).
• Дисплазия эпителия высокой степени, особенно по кишечному типу (как правило, развивается при рефлюксе желчи из двенадцатиперстной кишки). Особенно опасна неполная кишечная метаплазия.
• Витамин В12-дефицитная анемия, первичные и вторичные иммунодефициты, болезнь Менетрие, аденоматозы.
• Рак желудка связан с мутациями генов р53, АРС, k-ras. Потеря гетерозиготности с большей частотой наблюдается в следующих участках хромосомы: 17р (локус гена р53), 5q (локус гена APQ) и 18q (локус гена DCQ).
ПАТОМОРФОЛОГИЯ Гистоморфология
Основные гистологические формы рака желудка приведены в табл. 41-11. Высокодифференцированные аденокарциномы обычно развиваются медленно и поздно метастазируют. Низкодифференциро-
ванные формы рака желудка более злокачественны: раньше метастазируют, хуже поддаются лечению.
Таблица 41-11. Гистологические формы рака желудка
Макроморфология
Экзофитные опухоли обычно прорастают в просвет желудка и отграничены от здоровых тканей. Такой рост отличается меньшей злокачественностью.
• Полиповидная опухоль (3-10% случаев) часто локализуется на малой кривизне и обычно имеет вид шляпки гриба, расположенной на широком основании, или полипа на длинной ножке багрового цвета с поверхностью, покрытой эрозиями, отложениями фибрина. Слизистая оболочка вокруг опухоли не изменена. Ее размеры очень вариабельны - от нескольких миллиметров до гигантской опухоли, занимающей весь просвет желудка.
• Блюдцеобразный (чашеобразный) рак - опухоль на широком основании, с распадом в центре, в виде язвы с высокими валикообразными краями, состоящими из опухолевой ткани. Дно раковой язвы неровное, покрыто грязно-серым или темно-коричневым налетом. В кратере язвы можно видеть сгустки крови и тромбированные сосуды. Опухоль резко отграничена от здоровой ткани. Если опухоль расположена на малой кривизне, она может приобретать инфильтративный рост.
• Бляшкообразный рак - редкая форма (1% случаев). Макроскопически представляет собой белесоватые или сероватые утолщения
слизистой оболочки до 1-2 см в диаметре, иногда с изъязвлениями. Эндофитные опухоли, разрастаясь, захватывают прилежащие участки стенки желудка, инфильтрируя и распространяясь по ним во все стороны.
• Язвенно-инфильтративный рак - самый частый среди эндофитных (60% случаев). Представляет собой глубокую язву с плотным бугристым дном. Размеры язвы вариабельны. Окружающие язву участки инфильтрированы опухолевой тканью, прорастающей во все слои стенки желудка и прилежащие органы. Стенка желудка утолщена, уплотнена. Вокруг опухоли слизистая оболочка атрофична, ригидна, без нормальных складок. Опухоль чаще всего локализуется в выходном отделе желудка, на малой кривизне и в субкардиальном отделе. Рано дает метастазы.
• Диффузный фиброзный рак (скирр) по частоте занимает 2-е место и составляет 25-30% всех раков желудка. Чаще локализуется в выходном отделе, циркулярно суживая его и распространяясь на весь желудок, значительно уменьшая его размеры. Стенка желудка утолщена, ригидна. Складки слизистой оболочки также утолщены, с множественными изъязвлениями. Инфильтрация может захватывать связки желудка, в результате чего он подтягивается к печени, задней брюшной стенке, поджелудочной железе и др. Часто развивается раковый лимфангиит.
• Диффузный коллоидный рак - редкий вид опухоли, распространяющийся главным образом в подслизистом слое или между слоями мышечной оболочки в виде пластов слизистых оболочек - масс, образующихся из содержащих слизь клеток. Стенка желудка значительно утолщена, на разрезе из нее вытекает слизь. Желудок может быть сильно увеличен. Примерно в 10-15% случаев бывают смешанные или переходные формы опухоли.
Метастазирование
Рак желудка метастазирует тремя путями.
• Лимфогенным - наиболее частым. Раковые клетки попадают в лимфатические сосуды при их прорастании или из межтканевых промежутков.
• Гематогенным - возможен, если опухоль прорастает в просвет кровеносных сосудов. При этом чаще всего опухолевые клетки попадают в печень.
• Имплантационным метастазированием - при прорастании опухолью серозной оболочки желудка опухолевые клетки слущиваются
с ее поверхности. Попадая в просвет брюшной полости, они могут оседать на париетальной или висцеральной брюшине. Наиболее типичные метастазы - Вирхова, Шнитцлера, Крукенберга.
КЛИНИЧЕСКАЯ КАРТИНА
Клинические признаки рака желудка неспецифичны и разнообразны (у 60% больных рак желудка обнаруживают при обследовании по поводу других заболеваний или при профилактическом осмотре). Больных обычно беспокоят беспричинный дискомфорт и боли в области эпигастрия. Снижение массы тела отмечают у 80% больных, быстрое насыщение при еде - у 65%, анорексию - у 60%. У 50% больных бывают дисфагия и рвота. Данные, выявляемые при физикальном обследовании, обычно свидетельствуют о развитой стадии заболевания. Это пальпируемая опухоль в эпигастрии, желтуха, гепатомегалия (пальпируемые узлы в печени), асцит, кахексия, метастаз Вирхова (типичное для рака желудка увеличение лимфатических узлов в надключичной области слева). При ректальном исследовании в ректовагинальной (ректовезикальной) ямке обнаруживают метастаз Шнитцлера.
В зависимости от преобладания в клинической картине тех или иных симптомов выделяют несколько клинических вариантов течения рака желудка.
• Лихорадочный вариант. Возникает при инфицировании язвенного дефекта и/или при выраженной опухолевой интоксикации. Лихорадка субфебрильная, но иногда температура тела повышается до 39-40 °С с максимальным подъемом в утренние часы, резистентна к антибиотикам.
• Отечный вариант. Отеки возникают в результате гипопротеинемии. Развивается при длительном нарушении питания.
• Желтушный вариант. Возникает при усиленном гемолизе или токсическом гепатите в результате воздействия продуктов распада опухоли, но чаще является следствием метастатического поражения печени.
• Геморрагический (анемический) вариант. Развивается при длительных скрытых кровотечениях. При метастатических поражениях костного мозга наряду с анемией может возникать лейкоцитоз с появлением миелоцитов и миелобластов в периферической крови.
• Тетанический вариант. Возникает при стенозе привратника.
• Кишечный вариант. Сопровождается запором или диареей.
Течение рака желудка зависит также от формы роста самой опухоли.
• Экзофитный рак. Прорастает в просвет желудка, дает скудную местную симптоматику. Нередко первым его проявлением бывает кровотечение.
• Эндофитный рак. В течение длительного времени больных беспокоят только нарушения общего состояния (слабость, бледность, анорексия, похудение).
По мере роста опухоли возникают симптомы, зависящие от ее локализации.
• Для рака пилорического отдела характерны признаки нарушения его проходимости: быстрая насыщаемость, ощущение полноты в эпигастрии, в последующем - рвота съеденной пищей.
• Для рака кардиального отдела характерны нарастающая дисфагия, боли за грудиной, срыгивание.
• Поражение тела желудка протекает латентно, и часто начальным проявлением заболевания бывает нарушение общего состояния: слабость, снижение аппетита, уменьшение массы тела, ощущение тяжести в эпигастральной области.
• Часто именно в антральном отделе развивается первично-язвенная форма рака желудка, которая манифестирует симптомами язвенноподобного синдрома - поздними ночными («голодными») болями.
Рентгенологическое исследование. Правильно проведенное рентгенологическое исследование позволяет предположить наличие ранней стадии рака желудка у 40% больных. Наиболее важные рентгенологические признаки раннего рака следующие:
• участки перестройки рельефа слизистой оболочки, ограниченные по площади, с утолщением и хаотичным расположением складок или стойким утолщением хотя бы одной из них;
• сглаженность складок слизистой оболочки на небольшом участке, неровности, шероховатости, зазубренности контура желудка.
На поздних стадиях для экзофитных форм рака желудка характерен симптом краевого или центрального (реже) дефекта наполнения («плюсткань»): контуры его бугристые, складки, подходящие к опухоли, обрываются у ее основания. Опухоль четко отграничена от неизмененной слизистой оболочки. Характерным симптомом блюдцеобразного рака желудка (при распаде экзофитной опухоли) считают наличие депо бария в центре дефекта наполнения («минус-ткань»).
Для эндофитного рака в связи с особенностями роста особое значение имеет изучение изменений рельефа слизистой оболочки. Характерные признаки: отсутствие складок, деформация желудка в виде циркулярного сужения выходного отдела, укорочение малой кривизны, разогнутость ее угла, уменьшение внутренних размеров желудка (на более поздних стадиях).
Эндоскопическая диагностика. Эндоскопическая диагностика наиболее информативна, поскольку позволяет получить биопсийный материал для подтверждения диагноза. Эндоскопическая классификация раннего рака желудка приведена в табл. 41-12.
• К выступающему раку относят экзофитные полиповидные новообразования размером 0,5-2 см с невыраженной или короткой ножкой, широким основанием, плоской или втянутой верхушкой. Его окраска обычно ярче окраски окружающей слизистой оболочки, что в определенной степени обусловлено кровоизлияниями и изъязвлениями. При воздействии инструментальном и биопсии возникает кровоточивость. Новообразование обычно смещается вместе со слизистой оболочкой относительно подлежащих тканей.
• Приподнятый рак представляет собой образование, возвышающееся на 3-5 мм над поверхностью слизистой оболочки в виде плато, имеющего участки некрозов и углублений. Этот подтип встречается редко (до 4% случаев). Чаще опухоли имеют углубление в центре и выбухание по краям.
• Плоский рак виден в виде уплотненного участка слизистой оболочки округлой формы, лишенного типичного рельефа слизистой оболочки, ригидного при воздействии инструментальном.
• Углубленный рак визуально характеризуется четко очерченными плоскими эрозивными полями с неровными краями, расположенными несколько ниже уровня слизистой оболочки. В очаге поражения отсутствует блеск, характерный для нормальной слизистой оболочки. В области углубления обнаруживают участки интактной слизистой оболочки в виде островков и неровных выступов.
• Вогнутый рак представляет собой дефект слизистой оболочки диаметром до 1-3 см с неоднородно утолщенными ригидными краями, выступающими над поверхностью слизистой оболочки, и неровным дном, глубина которого может быть более 5 мм.
Таблица 41-12. Эндоскопическая классификация раннего рака желудка
Визуальная диагностика ранних форм рака желудка и их дифференциальная диагностика с доброкачественными полипами и язвами очень трудны. В связи с этим необходимо применять дополнительные методы исследования (биопсию, хромогастроскопию, люминесцентную эндоскопию). Люминесцентная эндоскопия - выявление раннего рака желудка путем изучения собственной и тетрациклиновой люминесценции опухоли, определяемой при гастроскопии и в биоптатах. В зоне злокачественной опухоли и при наличии элементов рака в биоптатах снижается интенсивность собственного свечения и повышается свечение после введения тетрациклина ввиду способности опухолевых клеток накапливать его. Хромогастроскопия основана на способности слизистой оболочки активно поглощать (абсорбировать) красители в участках кишечной метаплазии и дисплазии. Окончательный диагноз раннего рака желудка возможен только на основании данных морфологического исследования множественных биопсий.
Эндоскопическая классификация развитого рака желудка приведена в табл. 41-13.
Таблица 41-13. Эндоскопическая классификация развитых форм рака желудка
Полиповидный рак. Четко отграниченная экзофитно растущая опухоль с широким основанием. Поверхность опухоли может быть гладкой, бугристой и узловатой. Нередко видны изъязвления разнообразной формы, покрытые некротическим налетом. Чаще опухоли одиночные, реже - множественные и отделены друг от друга участками непораженной слизистой оболочки.
Неинфильтративная раковая язва (блюдцеобразный рак). Имеет вид большой глубокой язвы диаметром 2-4 см, четко отграниченной от
окружающей ткани. Края язвы неровные, подрытые, в виде утолщенного вала, возвышающегося над поверхностью слизистой оболочки. На некоторых участках дно как бы наплывает на край, и он приобретает форму гребня, а вся язва - блюдца или чаши. Дно, как правило, неровное, покрыто налетом от грязно-серого до темно-коричневого цвета. Отмечается повышенная кровоточивость краев язвы, окружающая слизистая оболочка атрофична.
Инфильтративная раковая язва. Имеет нерезко выраженные края, которые в некоторых местах отсутствуют, и ее бугристое дно непосредственно переходит в окружающую слизистую оболочку. Складки слизистой оболочки вокруг язвы ригидные, широкие, невысокие, не расправляются при нагнетании воздуха, перистальтические волны не прослеживаются. Граница между краями язвы и окружающей слизистой оболочкой отсутствует. Нередко контуры язвенного кратера трудно очертить из-за грубого рельефа дна. В таких случаях инфильтративная раковая язва представляется в виде нескольких нерезко отграниченных друг от друга дефектов, расположенных на канцерозном массиве. Инфильтративная раковая язва приводит к грубой деформации желудка.
Диффузный инфильтративный рак. При подслизистом росте опухоли ее эндоскопическая диагностика трудна и основывается на косвенных признаках: на ригидности стенки органа в месте поражения, едва уловимой сглаженности рельефа и бледной окраске слизистой оболочки. При вовлечении в процесс слизистой оболочки развивается типичная эндоскопическая картина злокачественного рельефа: пораженный участок несколько выбухает, складки неподвижные, застывшие, плохо расправляются при нагнетании воздуха, снижена или отсутствует перистальтика, слизистая оболочка безжизненная, в ее окраске преобладают серые тона. Отмечают уменьшение эластичности стенки органа и сужение его полости. Даже небольшое нагнетание воздуха сопровождается его срыгиванием и болезненными ощущениями.
В случаях присоединения инфекции и развития воспаления инфильтративный рак визуально трудно дифференцировать от локальной формы поверхностного гастрита и доброкачественных изъязвлений, особенно в проксимальном отделе желудка. Об этом следует всегда помнить и проводить биопсию всех острых изъязвлений. Гистологическое и цитологическое исследования биопсийного материала играют решающую роль в установлении окончательного диагноза рака желудка и его морфологического типа.
Эндосонография. Эндосонография позволяет определить глубину инфильтрации стенки желудка.
Ультразвуковое исследование и компьютерная томография.
При УЗИ и КТ органов брюшной полости и малого таза обнаруживают метастазы в печень и метастаз Крукенберга (в яичник). Метастатическое происхождение этих образований возможно доказать лишь путем их гистологического исследования (биопсии) во время хирургического вмешательства (диагностической лапаротомии и лапароскопии). При подтверждении их злокачественной природы стадия рака желудка определяется как IV (М1).
Лабораторная диагностика. Анемию вследствие хронической кровопотери и токсического воздействия метаболитов опухоли на красный костный мозг наблюдают у 60-85% больных. В 50-90% случаев реакция на скрытую кровь в стуле положительна. Желудочное содержимое исследуют на повышение активности р-глюкуронидазы и уровень кислотности.
Дифференциальная диагностика
Рак желудка необходимо дифференцировать от язвенной болезни желудка и доброкачественных опухолей желудка (полипов и др.). Во всех случаях только прицельная гастробиопсия позволяет окончательно подтвердить диагноз рака желудка.
Язвенная болезнь желудка. Следующие признаки позволяют заподозрить рак желудка:
• неровность краев язвы с подрытостью одного и возвышением и наползанием другого края;
• неправильная форма (амебоподобная);
• зернистость слизистой оболочки вокруг язвы, утолщения слизистой оболочки;
• края язвы иногда ярко-красного цвета, напоминают по виду свежие грануляции;
• слизистая оболочка вокруг раковой язвы вялая, бледная, рыхлая, кровоточит;
• дно сравнительно плоское, неглубокое, серого цвета, зернистое;
• изъязвления краев язвы;
• основание злокачественного изъязвления ригидно, а складки слизистой оболочки конвергируют к одному из краев.
Показана множественная прицельная гастробиопсия, причем образцы ткани надо брать как из края такой язвы, так и из ее дна.
Полипы желудка. Полипозный рак желудка имеет значительные размеры (≥2 см), широкое основание, переходящее в окружающую слизистую оболочку. На верхушке такого образования могут быть эрозии, кровоизлияния, отек, некроз, т.е. признаки его разрушения. Маленькие размеры полипа, узкое основание, сочность ненарушенной слизистой оболочки обычно свидетельствуют о доброкачественном характере опухоли. Большинство из них - гиперпластические полипы. Однако следует учитывать высокую частоту малигнизации аденоматозных полипов (до 40% случаев). В связи с этим полипы на широком основании и размером более 2 см подлежат удалению с последующим исследованием их морфологии.
Другие доброкачественные опухоли (лейомиома, ксантома). Встречаются редко. Основные признаки доброкачественной опухоли - ненарушенная слизистая оболочка, перистальтика желудка сохранена, складчатость выражена, цвет слизистой оболочки не изменен (исключение: ксантома имеет выраженную желтую окраску).
ЛЕЧЕНИЕ
Характер лечения рака желудка жестко определяется стадией заболевания.
• Стадии I и II. Показана радикальная хирургическая операция. Как самостоятельные виды лечения ни химио-, ни лучевую терапию не применяют.
• Стадия III. Комбинированная или паллиативная операция в сочетании с адъювантной терапией. При неоперабельности рака желудка проводят комбинированную терапию (лучевую и химиотерапию).
• Стадия IV. Показана химиотерапия. Может быть использована лучевая терапия в случае болезненных местных метастатических поражений.
Хирургическое лечение
Единственным радикальным методом лечения остается хирургический. Химио- и лучевую терапию как самостоятельные методы применяют только при противопоказаниях к операции (например, при IV стадии рака желудка). Объем операции выбирают индивидуально, с учетом локализации, распространенности и стадии рака желудка, а также общего состояния больного.
При единичном краевом метастазе в печень или яичник нередко проводят радикальную операцию, несмотря на М1 (IV стадию). Подобные операции относят к условно радикальным.
Основные типы радикальных оперативных вмешательств
• Дистальная субтотальная резекция желудка.
• Проксимальная субтотальная резекция желудка.
• Гастрэктомия.
• Комбинированная гастрэктомия с дополнительной резекцией прорастаемого опухолью органа (поджелудочной железы, толстой кишки и т.д.), овариэктомией (при метастазе Крукенберга), резекцией печени (при единичном краевом метастазе в печень), спленэктомией (при поражении лимфатических узлов в воротах селезенки). Опухоль с желудком, комплексом лимфатических узлов и резецируемые органы удаляют единым блоком.
Радикальные операции сопровождают резекцией большого и малого сальников и расширенной лимфаденэктомией по ходу чревного ствола (С), общей печеночной (Н) и селезеночной (L) артерий, аорты (А). Это определяет объем (радикальность) и, соответственно, название операции. Например: гастрэктомия с лимфаденэктомией - HCLA.
Паллиативные операции. Направлены на восстановление проходимости ЖКТ, снижение риска желудочного кровотечения и уменьшение опухолевой интоксикации организма. Их применяют при осложнениях, вызванных неоперабельной опухолью. В последнее время для обеспечения проходимости пищевода при стенозах используют эндоскопическое введение стентов, которые препятствуют сужению просвета пищевода прорастающей опухолью. При невозможности установки стента накладывают гастростому для питания больного. Основные типы паллиативных операций:
• паллиативная резекция желудка;
• наложение гастроэнтероанастомоза;
• гастростомия.
Лучевая терапия
Лучевая терапия как самостоятельный вид лечения рака желудка малоэффективна. В некоторых случаях при раке кардиального отдела и у неоперабельных больных проводят лучевую терапию источниками высоких энергий. В одной трети случаев после облучения происходят временное уменьшение размеров опухоли и улучшение проходимости кардиальной части желудка.
Химиотерапия
Химиотерапию как самостоятельный метод лечения применяют только при неоперабельных формах рака желудка. Попытки лечения путем моноили полихимиотерапии показали определенную эффективность фторурацила и тегафура (у 18-30% больных опухоль частично регрессирует). В настоящее время наиболее часто используют полихимиотерапию по схемам FAM I, FAM II (фторурацил, доксорубицин, митомицин). Химиотерапию проводят курсами с расчетом суммарной курсовой и суточной доз (по массе или площади тела больного). Химиотерапия, как правило, сопровождается рядом побочных эффектов:
- угнетением кроветворения (миелосупрессией);
- желудочно-кишечными расстройствами (тошнотой, рвотой, грибковыми поражениями слизистых оболочек);
- токсическим поражением органов (сердца, печени, почек, легких, нервной системы);
- локальным повреждением тканей в месте введения.
При химиотерапии большое значение имеет ежедневный контроль показателей крови ввиду риска развития лейкопении, тромбоцитопении.
Параллельно назначают иммуностимулирующие препараты (молграмостим, кальция фолинат). В критических случаях прибегают к переливанию препаратов крови (лейкоцитарной массы), прямому переливанию крови. Рвота при химиотерапии, как правило, центрального генеза, поэтому целесообразно использование противорвотных средств. При тяжелом общем состоянии больного, истощении, обширных метастазах, карциноматозе брюшины, при кровотечениях из распадающейся опухоли противоопухолевые препараты не показаны.
РЕЗУЛЬТАТЫ ЛЕЧЕНИЯ И ПРОГНОЗ
Ближайшие результаты хирургического лечения зависят от объема операции и общего состояния больного. Послеоперационная летальность в среднем составляет 10-17% (табл. 41-14). Отдаленные результаты во многом зависят от стадии заболевания и гистологического строения опухоли. Неблагоприятен прогноз при низкодифференцированном раке и скирре. Рядом исследований доказано некоторое увеличение продолжительности жизни больных при применении адъювантной лучевой и химиотерапии. Средняя продолжительность жизни этой группы больных составляет 8 мес.
Таблица 41-14. Пятилетняя выживаемость при хирургическом лечении рака желудка
41.4. ФУНКЦИОНАЛЬНАЯ ДИСПЕПСИЯ
Функциональная диспепсия - симптомокомплекс, включающий чувство переполнения после еды, быструю насыщаемость, эпигастральную боль или жжение. Пациенты с одним из перечисленных симптомов (или более) при отсутствии каких-либо органических, системных или метаболических заболеваний, которыми можно было бы объяснить эти проявления, определяются как больные диспепсией. Соответствующие симптомы должны наблюдаться в течение не менее 3 последних месяцев с начала проявления не менее 6 мес перед диагностикой.
ЭПИДЕМИОЛОГИЯ
В США и Великобритании диспепсические жалобы наблюдают у 26 и 41% населения соответственно. В России распространенность функциональной диспепсии достигает 30-40%. Заболевание чаще наблюдают в молодом возрасте (17-35 лет), в 1,52 раза чаще у женщин.
КЛАССИФИКАЦИЯ
В 2006 г. Международный консенсус по функциональным гастроинтестинальным расстройствам (Рим III) предложил подразделять функциональные диспепсии на 2 подгруппы (B1a и B1b) с новыми названиями:
- постпрандиальный (индуцированный пищей) дистресс-синдром;
- эпигастральный болевой синдром.
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
Вопросы этиологии и патогенеза функциональной диспепсии остаются до конца не выясненными. Считают, что в развитии заболевания могут иметь значение следующие факторы:
- гиперсекреция соляной кислоты;
- алиментарные погрешности;
- психогенные факторы;
- нарушение моторики верхних отделов ЖКТ (пищеводно-желудочный рефлюкс, замедление эвакуации из желудка, нарушение антродуоденальной координации);
- снижение порога чувствительности стенки желудка к растяжению;
- Н. pylori.
Причиной основных симптомов функциональной диспепсии считают нарушение двигательной функции желудка и двенадцатиперстной кишки. Преобладают следующие моторно-эвакуаторные нарушения:
• гастропарез - ослабление моторики антрального отдела желудка с замедлением эвакуации содержимого. Наблюдают у 50% больных функциональной диспепсией;
• нарушение аккомодации желудка - снижение способности проксимального отдела желудка расслабляться после приема пищи под действием нарастающего давления содержимого на его стенки. При нормальной аккомодации после приема пищи происходит увеличение объема желудка без повышения внутрижелудочного давления;
• нарушение ритма перистальтики (желудочная дисритмия) - расстройство антродуоденальной координации, развитие перистальтики желудка по брадигастритическому (чаще), тахигастритическому или смешанному типу.
Существует корреляция между различными клиническими симптомами и определенными двигательными нарушениями желудка и двенадцатиперстной кишки. Например, тошнота и рвота могут быть связаны с гастропарезом, чувство переполнения в эпигастральной области - с нарушением чувствительности рецепторного аппарата желудка к растяжению, чувство раннего насыщения - с расстройством аккомодации желудка.
КЛИНИЧЕСКАЯ КАРТИНА И ДИАГНОСТИКА
Диагностические критерии постпрандиального дистресс-синдрома
Должны включать один (или оба) из нижеследующих.
• Беспокоящее чувство переполнения после еды, возникающее после приема обычного объема пищи, по крайней мере, несколько раз в неделю.
• Быстрая насыщаемость (сытость), в связи с чем невозможно съесть обычный объем пищи до конца, по меньшей мере, несколько раз в неделю.
Соответствующие симптомы должны наблюдаться в течение не менее 3 последних месяцев с началом проявлений не менее 6 мес перед диагностикой.
Подтверждающие критерии:
• могут быть вздутие в верхней части живота, или тошнота после еды, или чрезмерная отрыжка;
• эпигастральный болевой синдром может сопутствовать.
Диагностические критерии синдрома эпигастральной боли
Должны включать все из нижеследующих симптомов:
• боль или жжение, локализованные в эпигастрии, как минимум умеренной интенсивности, с частотой не менее одного раза в неделю;
• периодическую боль;
• отсутствие генерализованной боли или локализующейся в других отделах живота или грудной клетке;
• отсутствие улучшения после дефекации или отхождения газов;
• несоответствие критериям расстройств желчного пузыря и сфинктера Одди.
Соответствующие симптомы должны наблюдаться в течение не менее 3 последних месяцев с началом проявлений не менее 6 мес перед диагностикой.
Подтверждающие критерии:
• боль может быть жгучей, но без ретростернального компонента;
• боль обычно появляется или, наоборот, уменьшается после приема пищи, но может возникать и натощак.
Важную роль при дифференциальной диагностике играет выявление так называемых симптомов тревоги, к которым относят:
- дисфагию;
- лихорадку;
- немотивированное снижение массы тела;
- наличие крови в стуле;
- лейкоцитоз;
- повышение СОЭ;
- анемию.
Обнаружение хотя бы одного из этих симптомов исключает диагноз функциональной диспепсии, в таких случаях необходимо тщательное обследование пациента в целях обнаружения у него более тяжелого заболевания.
Инструментальные и лабораторные исследования
• ФЭГДС позволяет исключить органическую патологию верхних отделов ЖКТ (ГЭРБ, язвенную болезнь желудка или двенадцатиперстной кишки, рак желудка).
• УЗИ гепатобилиарной зоны позволяет обнаружить желчнокаменную болезнь, хронический панкреатит.
• Сцинтиграфия - «золотой стандарт» для определения скорости опорожнения желудка.
• Электрогастрография основывается на регистрации электрической активности желудка (отражающей сокращение его стенок) с помощью электродов, установленных в эпигастральной области. В норме частота сокращений желудка составляет приблизительно 3 волны в минуту (2,4 волны в минуту и менее - брадигастрия, 3,6-9,9 волны в минуту - тахигастрия).
• Гастродуоденальная манометрия с помощью миниатюрных датчиков, вводимых в полость антрального отдела желудка и двенадцатиперстной кишки, позволяет оценить изменение давления при сокращении стенки желудка.
• Рентгенологическое исследование позволяет выявить стеноз или дилатацию различных отделов пищеварительного тракта, замедленное опорожнение желудка, исключить органическую природу заболевания.
• Биохимические (активность ACT, АЛТ, ЩФ, ГГТП) анализы крови, исследование кала на скрытую кровь.
ЛЕЧЕНИЕ
Лечение комплексное и включает мероприятия по нормализации образа жизни, режима и характера питания, лекарственную терапию, при необходимости - психотерапевтические методы.
• По возможности устраняют физические и эмоциональные перегрузки, отрицательно влияющие на моторику ЖКТ.
• Недопустимы длительные перерывы в приеме пищи, употребление жирной и острой пищи, консервантов, маринадов, копченостей, кофе.
• Исключают курение, употребление алкоголя и газированных напитков.
Медикаментозное лечение
• При эпигастральном болевом синдроме назначают антациды и антисекреторные препараты (блокаторы Н2-рецепторов - ранитидин по 150 мг 2 раза в сутки, фамотидин по 20 мг 2 раза в сутки;
ингибиторы Н+-, К+-зависимой АТФазы - омепразол, рабепразол по 20 мг 2 раза в сутки, лансопразол по 30 мг 2 раза в сутки).
• При постпрандиальном дистресс-синдроме применяют прокинетики - домперидон, метоклопрамид.
• Учитывая, что эрадикация Н. pylori может вызвать устойчивую ремиссию только у небольшой части больных, перед ее проведением следует обсудить с пациентом пользу и риск проведения такого лечения.
• При депрессивных или ипохондрических реакциях необходима рациональная психотерапия, возможно назначение антидепрессантов.
Глава 42. ЗАБОЛЕВАНИЯ ТОНКОЙ И ТОЛСТОЙ КИШКИ
42.1. ЦЕЛИАКИЯ
Целиакия (глютеночувствительная энтеропатия) характеризуется мальабсорбцией вследствие иммуноопосредованного воспалительного повреждения слизистой оболочки тонкой кишки, пусковым фактором которого выступает потребление с пищей пшеничного глютена или родственных белков ржи или ячменя лицами с наследственной предрасположенностью к этому заболеванию.
ЭПИДЕМИОЛОГИЯ
Заболевание возникает в любом возрасте. Заболеваемость составляет 1:100-1:300. Целиакия развивается у 10% родственников первой степени родства и у 70% однояйцевых близнецов.
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
Доказана генетическая предрасположенность к целиакии: у 97% и более больных целиакией выявляют Аг HLA-DQ2 и HLA-DQ8.
Развитие проявлений заболевания зависит от поступления с пищей глютена. Аглютеновая диета приводит к клиническому улучшению, нарушение диеты - к рецидиву целиакии со всеми клиническими и морфологическими признаками.
Расщепление ферментами желудка и поджелудочной железы алкогольрастворимого компонента глютена а-глиадина ведет к образованию стабильного белка, состоящего из 33 аминокислотных остатков и обладающего иммуногенной активностью. Этот белок устойчив к ферментам щеточной каемки, что обеспечивает его всасывание в неизмененном виде. Тканевая трансглютаминаза дезаминирует белковые эпитопы. При этом положительно заряженный глютамин трансформируется в глютамат с отрицательным зарядом, что позволяет дезаминированному белку вступать в контакт с положительно заряженными структурами полостей
молекул HLA-DQ2 или HLA-DQ8.
СD4+-Т-лимфоциты опознают дезаминированные эпитопы, что вызывает повышенную продукцию цитокинов, провоцирующих иммунное повреждение с развитием атрофии слизистой оболочки тонкой кишки с выраженным укорочением ворсинок и значительным удлинением крипт, обильной инфильтрацией собственной пластинки СВ4+-Т-лимфоцитами и поверхностного эпителия СВ8+-Т-лимфоцитами. В криптах ускорено новообразование клеток, в результате на поверхности ворсинок появляются незрелые энтероциты, неспособные к выполнению своих специфических функций всасывания и мембранного пищеварения. Уменьшение всасывательной поверхности кишки из-за атрофии ворсинок и замещения зрелых энтероцитов малодифференцированными приводит к нарушению абсорбции.
Еще одним возможным механизмом, предположительно необходимым для развития как кишечных, так и системных проявлений целиакии, считают выработку аутоантител к тканевой трансглютаминазе.
КЛИНИЧЕСКАЯ КАРТИНА
Клиническая картина энтеропатии при целиакии идентична проявлениям мальабсорбции, выраженность которой четко отражает степень поражения слизистой оболочки тонкой кишки. Малосимптомное субклиническое течение заболевания наблюдают значительно чаще, чем типичную целиакию с тяжелой мальабсорбцией.
Классическая картина заболевания характеризуется вздутием живота, диареей, потерей массы тела, задержкой развития, которые появляются у новорожденных при добавлении в детский рацион каш. Дети с нелеченой целиакией отстают в росте, массе тела, половом созревании, у них могут развиваться железо- и фолиеводефицитная анемия, рахит.
У взрослых наиболее типичным проявлением болезни выступает железодефицитная анемия. Симптомы мальабсорбции могут быть спровоцированы беременностью, инфекционным гастроэнтеритом, оперативным вмешательством на брюшной полости.
Другие проявления заболевания включают В12-дефицитную анемию, остеопороз, коагулопатию, афтозный стоматит, бесплодие и выкидыши, гипертрансаминаземию, стеатоз печени, гипоспленизм, внешнесекреторную недостаточность поджелудочной железы, психические и неврологические нарушения.
Герпетиформный дерматит с наличием в коже линейных депозитов IgA в 100% случаев связан с целиакией и излечивается при соблюдении аглютеновой диеты.
При целиакии в 10 раз чаще, чем в общей популяции, развиваются аутоиммунные заболевания. Среди них сахарный диабет 1-го типа, аутоиммунный тиреоидит, болезнь Аддисона, синдром Шёгрена, СКВ, ревматоидный артрит, первичный билиарный цирроз, аутоиммунный гепатит, IgA-нефропатия, дилатационная кардиомиопатия, миокардит, фиброзирующий альвеолит, аутоиммунная периферическая невропатия, мозжечковая атаксия, эпилепсия.
Риск развития злокачественных опухолей при целиакии, в первую очередь лимфом, а также аденокарцином ЖКТ, в 100-200 раз выше, чем в общей популяции. Соблюдение аглютеновой диеты снижает риск развития аутоиммунных и онкологических заболеваний, связанных с целиакией.
ДИАГНОСТИКА
Эндоскопическую биопсию дистальных отделов двенадцатиперстной кишки с последующим гистологическим исследованием проводят при типичной картине заболевания или характерных проявлениях (например, железодефицитной анемии, остеопорозе) в группах риска (родственники 1-й степени родства, ассоциированные аутоиммунные заболевания), при положительных результатах серологических тестов, а также при эндоскопических исследованиях, назначенных по другому поводу.
Серологические тесты на целиакию позволяют обосновать показания к биопсии, провести обследование на целиакию в группах риска, оценить эффективность аглютеновой диеты, контролировать ее соблюдение. Они включают определение АТ:
- антиглиадиновых;
- антиретикулиновых;
- антиэндомизиальных;
- антитрансглютаминазных.
Тесты на антиэндомизиальные и антитрансглютаминазные AT обладают высокими чувствительностью и специфичностью, что позволяет использовать их для скрининга целиакии. Соблюдение аглютеновой диеты приводит к снижению, а затем к отрицательным результатам серологических тестов.
В сомнительных случаях показано HLA-типирование. Поскольку у большинства больных выявляют Аг HLA-DQ2 или HLA-DQ8, у лиц с отсутствием этих гаплотипов диагноз целиакии маловероятен.
Дифференциальная диагностика
Дифференциальную диагностику проводят с другими заболеваниями, вызывающими мальабсорбцию, а также с другими причинами очаговой атрофии ворсинок слизистой оболочки тонкой кишки:
- инфекционным энтеритом;
- лямблиозом;
- тропической спру;
- радиационной и ВИЧ-энтеропатией;
- синдромом избыточного роста бактерий;
- аллергией на белки молока и сои;
- гипогаммаглобулинемией;
- болезнью Уиппла;
- лимфомой.
ЛЕЧЕНИЕ
Больным пожизненно назначают строгую аглютеновую диету с исключением продуктов, содержащих пшеницу, рожь и ячмень. На начальном этапе лечения из рациона исключают также продукты, содержащие овес (они могут иметь примесь токсичных злаков), и молочные продукты (при целиакии часто развивается вторичная лактазная недостаточность). Проводят коррекцию метаболических нарушений - мероприятия, направленные на устранение белковой, витаминной недостаточности, расстройств водно-электролитного баланса.
42.2. ДИСАХАРИДАЗНАЯ НЕДОСТАТОЧНОСТЬ
Дисахаридазы - специфические гликогеназы щеточной каемки слизистой оболочки тонкой кишки, расщепляющие дисахариды до моносахаридов, что обеспечивает их всасывание.
Генетически детерминированная или возникающая вторично при повреждении слизистой оболочки тонкой кишки дисахаридазная недостаточность приводит к нарушению абсорбции дисахаридов, которые поступают в толстую кишку и катаболизируются микрофлорой с образованием жирных кислот, метана, водорода, углекислого газа. Это вызывает симптомы нарушения всасывания углеводов:
- вздутие живота;
- урчание;
- коликообразные боли;
- осмотическую диарею.
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
Лактазная недостаточность - самый распространенный вариант дефицита кишечных ферментов, проявляющийся непереносимостью молока и молочных продуктов. Более чем у 90% лиц африканского, азиатского происхождения и лишь у 5% лиц североевропейского происхождения выявляют генетически обусловленное (ген лактазы LCT в хромосоме 21) снижение активности лактазы после завершения периода грудного вскармливания. Врожденная алактазия начинает проявляться диареей уже после первого кормления грудным молоком.
Лактазная недостаточность нередко развивается вторично при заболеваниях тонкой кишки с повреждением слизистой оболочки (вирусных гастроэнтеритах, лямблиозе, целиакии, болезни Крона). В таких случаях после излечения или в период ремиссии заболевания лактазная недостаточность исчезает.
Временная непереносимость грудного молока может возникать у недоношенных детей, так как лактазная активность появляется только после 28 нед внутриутробного развития.
Редко встречают дефицит сукразы изомальтазы, обусловливающий непереносимость сахара, и дефицит трегалазы, вызывающий непереносимость грибов.
КЛИНИЧЕСКАЯ КАРТИНА
Повышенное газообразование, вздутие, боли в животе и диарея после приема молока, сахара, грибов позволяют предположить их непереносимость. Диарея носит осмотический характер и прекращается при голодании.
Широкое использование сахарозы, лактозы при приготовлении блюд часто не позволяет определить связь развития диспепсии с потреблением углеводов.
ДИАГНОСТИКА
• Ферментный анализ позволяет определить концентрацию лактазы, сукразы, изомальтазы, трегалазы в биоптате слизистой оболочки тонкой кишки.
• Положительный дыхательный водородный тест после приема лактозы, которая в норме полностью всасывается в тонкой кишке, подтверждает диагноз лактазной недостаточности.
Дифференциальная диагностика
Дифференциальную диагностику проводят с недостаточностью других дисахаридаз, аллергией на белок коровьего молока, инфекционными
гастроэнтеритами, целиакией, внешнесекреторной недостаточностью поджелудочной железы, воспалительными заболеваниями кишечника.
ЛЕЧЕНИЕ
Лечение заключается в исключении из пищевого рациона продуктов, содержащих неабсорбируемые дисахариды (молоко и жидкие молочные продукты, сахар и сахаросодержащие продукты или грибы).
42.3. БОЛЕЗНЬ УИППЛА
Болезнь Уиппла (интестинальная липодистрофия) - системное заболевание, протекающее с поражением тонкой кишки и проявляющееся синдромом мальабсорбции. Часто отмечают суставную симптоматику.
РАСПРОСТРАНЕННОСТЬ
Болезнь Уиппла - редкое заболевание (к началу XXI в. накоплены сообщения примерно о 1000 больных), чаще встречаемое у мужчин в возрасте 40-60 лет. Женщины и дети болеют в 8-10 раз реже.
ЭТИОЛОГИЯ
Возбудитель заболевания - грамположительная актиномицета Trophetyma whipplei. Ее удалось культивировать в конце XX в., когда микроорганизм был выявлен методом прямой амплификации (RT-ПЦР) участка 16S-r РНК, выделенной из тканей больного.
ПАТОМОРФОЛОГИЯ
Главный морфологический признак болезни Уиппла - инфильтрация собственного слоя слизистой оболочки тонкой кишки крупными полигональными макрофагами с пенистой цитоплазмой и ШИК-положительными включениями. Кроме того, обнаруживают жировые депозиты в слизистой оболочке кишечника и брыжеечных лимфатических узлах, а также атрофию ворсинок слизистой оболочки и расширенные лимфатические сосуды, заполненные жировыми вакуолями. При световой и электронной микроскопии в макрофагах между эпителиальными клетками слизистой оболочки и в брыжеечных лимфатических узлах выявляют палочковидные бактерии.
Макрофаги с пенистой цитоплазмой и палочковидные бактерии могут быть обнаружены в других пораженных органах (селезенке, лимфатических узлах, ЦНС, печени, сердце, легких и суставах).
КЛИНИЧЕСКАЯ КАРТИНА И ДИАГНОСТИКА
Заболевание в большинстве случаев манифестирует мальабсорбцией, диареей и снижением массы тела. К числу наиболее характерных внекишечных проявлений относят артропатию и лихорадку, которые могут возникать задолго до развития признаков энтеропатии. В половине случаев отмечают увеличение лимфатических узлов, в первую очередь брыжеечных. Возможно также поражение:
- ССС (перикардит, эндокардит, панартериит с вовлечением венечных артерий);
- органов дыхательной системы (плеврит, бронхит);
- кожи (гиперпигментация, саркоидоподобные бляшки);
- ЦНС (супрануклеарная офтальмоплегия, атаксия, судорожные припадки, симптоматика деменции);
- глаз (увеит, кератит, ретинит).
Диагноз подтверждают при исследовании биоптатов слизистой оболочки тонкой кишки. Однако кишечная симптоматика при болезни Уиппла преобладает не всегда. В таких случаях морфологическое исследование оказывается менее информативным. Диагноз помогает поставить ПЦР, позволяющая обнаружить возбудитель в гистологическом материале слизистой оболочки кишки, лимфатических узлов, синовиальных оболочек и других пораженных тканей, в периферической крови, спинномозговой жидкости.
Дифференциальная диагностика
Дифференциальную диагностику проводят с другими причинами синдрома мальабсорбции, саркоидозом, синдромом Рейтера, периодической болезнью, системными васкулитами, инфекционным эндокардитом, а также с заболеваниями, которые сопровождаются инфильтрацией собственной пластинки макрофагами (инфекцией комплексом «Mycobacterium avium-intracellulare», гистоплазмозом, макроглобулинемией).
ЛЕЧЕНИЕ
Для удаления возбудителя заболевания из организма требуется длительное (в течение 6-12 мес) лечение антибиотиками. Предпочтительны препараты, проникающие через гематоэнцефалический барьер. Чаще назначают один из следующих препаратов:
- ко-тримоксазол;
- хлорамфеникол;
- цефтриаксон.
42.4. СИНДРОМ ИЗБЫТОЧНОГО РАЗМНОЖЕНИЯ БАКТЕРИЙ В ТОНКОЙ КИШКЕ
В содержимом тонкой кишки здоровых людей присутствует небольшое количество грамположительной аэробной микрофлоры (<104 бактерий в 1 мл в тощей кишке, <105 в 1 мл в подвздошной кишке). При синдроме избыточного размножения бактерий количество бактерий в тонкой кишке увеличивается преимущественно за счет грамотрицательных микроорганизмов (Е. coli) и анаэробов (Clostridia, Bacteroides). Клинически заболевание проявляется мальабсорбцией и диареей.
ЭТИОЛОГИЯ
• Нарушение эвакуации из тонкой кишки, аномальное сообщение между тонкой и толстой кишкой:
- частичная кишечная непроходимость (стриктуры, спайки, опухоли);
- нарушение моторной функции кишки (пожилой возраст, диабетическая автономная нейропатия, системная склеродермия, амилоидоз, идиопатическая нейропатия и миопатия);
- хирургическое отключение части кишки от пассажа содержимого;
- дивертикулы тонкой кишки;
- наличие свищей между тонкой и толстой кишкой;
- резекция сфинктера подвздошно-кишечного отверстия (илеоцекального отверстия).
• Гипо- и ахлоргидрия:
- состояние после резекции желудка, ваготомии;
- атрофический гастрит;
- прием ЛС (ингибиторов H+-, К+-АТФазы и блокаторов Н2рецепторов в высоких дозах).
• Другие причины:
- хронический панкреатит;
- иммунодефицитные состояния;
- цирроз печени;
- терминальная почечная недостаточность.
ПАТОГЕНЕЗ
Бактериальное обсеменение тонкой кишки вызывает преждевременную деконъюгацию солей первичных желчных кислот. Образующиеся соли вторичных желчных кислот стимулируют секрецию воды и элек-
тролитов в просвет кишки, что приводит к развитию диареи. Снижение в просвете кишки концентрации солей конъюгированных желчных кислот обусловливает нарушение всасывания жиров и жирорастворимых витаминов, появление жира в кале (стеаторею). Бактериальные токсины и метаболиты связывают витамин В12. Бактерии также способны непосредственно повреждать энтероциты, что приводит к энтеропатии с нарушением всасывания углеводов, белков и жиров.
КЛИНИЧЕСКАЯ КАРТИНА И ДИАГНОСТИКА
У больных с синдромом избыточного размножения бактерий развиваются осмотическая диарея, стеаторея, потеря массы тела, гипоальбуминемия, В12-дефицитная анемия. Возможна также железодефицитная анемия вследствие кровопотери через поврежденную слизистую оболочку кишки. Уровень фолатов, как правило, в норме или повышен, так как микробная флора участвует в их синтезе. В тяжелых случаях развивается дефицит жирорастворимых витаминов и кальция с соответствующими клиническими синдромами.
В пользу синдрома избыточного размножения бактерий свидетельствуют перенесенные ранее операции на ЖКТ, наличие СД, системной склеродермии, ахлоргидрии, болезни Крона, кишечных свищей, дивертикулов, преклонный возраст.
Для диагностики применяют следующие лабораторно-инструментальные методы.
• Рентгенологическое исследование тонкой кишки позволяет выявить дивертикулы, стриктуры и опухоли.
• Дыхательные тесты (14С-ксилозный, водородный, с лактулозой и др.) основаны на регистрации в выдыхаемом воздухе продуктов метаболического превращения бактериями (обычно живущими в толстой кишке) принятых внутрь субстратов. Если ферментация субстратов начинается до толстой кишки, метаболиты в выдыхаемом воздухе появляются раньше, что служит доказательством избыточного размножения бактерий в тонкой кишке.
• Количественный микробный анализ содержимого тонкой кишки, полученного при ее интубации. Интубацию осуществляют эндоскопически с использованием стерильных катетеров. Если при бактериальном посеве кишечного содержимого бактериальное число составляет более 105 в 1 мл, диагноз можно считать подтвержденным. Метод сложен и редко используется в клинической практике.
ЛЕЧЕНИЕ
При возможности устраняют причину, вызвавшую избыточное размножение бактерий. Назначают антибактериальные препараты широкого спектра действия, эффективные против анаэробных бактерий. Проводят симптоматическую терапию проявлений синдрома мальабсорбции.
42.5. СИНДРОМ НАРУШЕННОГО ВСАСЫВАНИЯ
Синдромом нарушенного всасывания (мальабсорбции) называют нарушения всасывания питательных веществ, связанные с расстройствами их внутриполостного переваривания, мембранного транспорта в слизистой оболочке и оттока крови и лимфы (содержащих расщепленные компоненты) от тонкой кишки.
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
Наиболее частыми причинами мальабсорбции в настоящее время считают целиакию, избыточное бактериальное размножение в тонкой кишке и панкреатическую недостаточность.
• Расстройство внутриполостного переваривания связано с недостаточной концентрацией ферментов поджелудочной железы (например, при хроническом панкреатите, муковисцидозе, раке поджелудочной железы) или желчных кислот (при обструкции желчевыводящих путей, холестазе, резекции подвздошной кишки). Внешнесекреторная недостаточность поджелудочной железы в первую очередь вызывает нарушение всасывания жиров, тогда как недостаток желчных кислот - жирорастворимых витаминов.
• Расстройства мембранного пищеварения могут быть обусловлены уменьшением площади поверхности нормального эпителия тонкой кишки (например, при целиакии, после обширной резекции кишки - при синдроме короткой кишки) или недостатком активности ферментов щеточной каемки энтероцитов (например, при дисахаридазной недостаточности). Утрата значительной части всасывательной поверхности кишки влечет тотальную мальабсорбцию всех пищевых составляющих. Врожденные нарушения всасывания, обусловленные селективным расстройством абсорбции отдельных аминокислот, моно- и дисахаридов, витаминов и других соединений, как правило, возникают в детском возрасте.
• Расстройства всасывания, связанные с нарушением лимфооттока, развиваются при первичной или вторичной лимфангиэктазии (например, при болезни Уиппла, правожелудочковой сердечной недостаточности).
КЛИНИЧЕСКАЯ КАРТИНА
Мальабсорбция может быть парциальной или тотальной и имеет разную степень выраженности. Наиболее раннее и постоянное проявление мальабсорбции - потеря массы тела в условиях полноценного питания. Накопление в просвете кишки осмотически активных веществ приводит к развитию осмотической диареи. Объем каловых масс при мальабсорбции увеличивается (полифекалия).
• Нарушение переваривания и всасывания жиров является причиной стеатореи.
• Белковая недостаточность манифестирует потерей массы тела, гипопротеинемией и отеками.
• Нарушение всасывания витаминов и микроэлементов:
- дефицит железа, реже фолатов и витамина В12 приводит к анемии;
- гиповитаминозы характеризуются изменениями кожи, ее придатков, слизистых оболочек, парестезиями, болями в костях, склонностью к кровотечениям, нарушениями зрения;
- недостаточность кальция может приводить к парестезиям, судорогам, болям в мышцах и костях. В тяжелых случаях развивается остеопороз, приводящий к патологическим переломам костей и деформациям скелета.
Таким образом, при расспросе особое внимание следует обратить на периодическую диарею с полифекалией и стеатореей, особенно в ночные часы, снижение массы тела, боли в костях, кожные изменения. При длительном тяжелом течении синдрома мальабсорбции прогрессирует кахексия, присоединяются симптомы недостаточности желез внутренней секреции (надпочечников, половых желез), мышечная атрофия, психические нарушения.
Кроме того, при сборе анамнеза следует попытаться выяснить вероятную причину мальабсорбции.
• Важны сведения о начале заболевания в детском возрасте, отставании в физическом развитии, анемии, развитии первых симптомов заболевания у женщин в период беременности и родов, что свойственно больным целиакией.
• Наличие в анамнезе хронического панкреатита, холестаза, лучевой терапии, оперативного вмешательства на органах пищеварения может послужить ключом к выяснению причины мальабсорбции.
• Рецидивирующие очаговые инфекции считают одним из типичных признаков общей вариабельной гипогаммаглобулинемии.
Лабораторные и инструментальные исследования
При лабораторном исследовании могут быть обнаружены анемия, снижение в сыворотке крови концентрации альбумина, холестерина, железа, кальция, магния, укорочение протромбинового времени. В кале выявляют нейтральный жир (стеаторею). Диагностическое значение может иметь исследование кала на скрытую кровь и патогенных простейших.
Оценка всасывательной функции тонкой кишки. Для этого в клинической практике в основном используют косвенные методы. Они основаны на определении в крови, моче, слюне или кале содержания различных веществ, принятых внутрь. Диагностическая ценность различных косвенных методов примерно одинакова. Наиболее часто применяют пробу с D-ксилозой. После приема внутрь 5 г D-ксилозы определяют ее экскрецию в 2- и 5-часовой порциях мочи. В норме за 2 ч выделяется не менее 0,7 г ксилозы, за 5 ч - не менее 1,2 г.
Для изучения всасывания витамина В12 используют тест Шиллинга. После приема меченного 57Со витамина В12 его суточная экскреция с мочой в норме составляет не менее 10%. Показатели ниже 5% свидетельствуют о нарушении всасывания витамина В12 в тонкой кишке.
Поиск причины мальабсорбции. В настоящее время на первый план выходят методы, направленные не столько на выявление синдрома мальабсорбции, сколько на установление его причины. Рентгенография тонкой кишки позволяет обнаружить дивертикулы, лимфому, межкишечные анастомозы и др. Эндоскопическое исследование тонкой кишки с биопсией ее проксимальных отделов дает возможность диагностировать болезнь Уиппла, целиакию, лимфому, болезнь Крона. Водородный дыхательный тест с лактозой позволяет исключить лактазную недостаточность, а тест с лактулозой - синдром избыточного размножения бактерий в тонкой кишке.
ЛЕЧЕНИЕ
Больным с синдромом мальабсорбции назначают физиологически полноценную диету, содержащую повышенное количество белка. Проводят лечение основного заболевания. Коррекция метаболических
нарушений включает мероприятия, направленные на устранение белковой, витаминной недостаточности и расстройств водно-электролитного баланса. При экзокринной панкреатической недостаточности назначают ферментные препараты.
42.6. ДИАРЕЯ
Диарея - частый (>3 раз в сутки) обильный (>250 г в сутки) кашицеобразный или жидкий стул. Отличительным признаком диареи служит увеличение содержания воды в кале (>85%).
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
В основе диареи лежат многочисленные инфекционные и неинфекционные причины. Дополнительно по механизму развития различают следующие варианты диареи.
• Секреторную диарею - связана с нарушением активного транспорта воды и электролитов кишечным эпителием. Ее основные причины: энтеротоксигенная бактериальная и вирусная инфекции, прием слабительных и других ЛС (например, фенолфталеина, касторового масла, препаратов сенны), гормонопродуцирующие опухоли (випома, карциноид, мастоцитома, медуллярный рак щитовидной железы), нарушение всасывания желчных кислот.
• Осмотическую диарею - обусловлена наличием в кишечнике невсосавшихся осмотически активных веществ, задерживающих воду. Она возникает при приеме солевых слабительных (например, сульфата магния, лактулозы, сорбитола, маннитола, ксилита), а также при любом заболевании, сопровождаемом синдромом мальабсорбции.
• Диарею, связанную с нарушением двигательной активности кишки и ускорением пассажа содержимого, - возникает, например, при синдроме раздраженного кишечника, тиреотоксикозе.
• Воспалительную диарею - обусловлена поступлением в просвет кишечника экссудата, образуемого вследствие воспаления кишечной стенки. Этот вид диареи возникает при энтероинвазивной бактериальной инфекции, воспалительных заболеваниях (болезни Крона, язвенном колите) и злокачественных опухолях кишечника, приеме ЛС (например, НПВС). В большинстве случаев имеет место сочетание различных механизмов развития диареи.
КЛИНИЧЕСКАЯ КАРТИНА И ДИАГНОСТИКА
Важную роль в выяснении причин диареи играет расспрос пациента. Совокупность симптомов часто позволяет предположительно определить уровень и характер поражения кишечника.
• Тонкокишечная секреторная или осмотическая диарея характеризуется меньшей частотой и большим объемом водянистого пенистого кала без крови, слизи и лейкоцитов. Данная форма диареи может сопровождаться болями в околопупочной области и нередко приводит к обезвоживанию. Отличить осмотическую диарею от секреторной позволяют проба с голоданием (осмотическая диарея прекращается после 48-72-часового голодания) и исследование кала на содержание электролитов (при осмотической диарее определяется большая осмотическая разница).
• Толстокишечная диарея характеризуется значительной частотой и небольшим количеством кала, содержащего кровь, слизь, лейкоциты. Эта форма диареи сопровождается болями в подвздошной и крестцовой областях, тенезмами, императивными позывами на дефекацию. Потеря массы тела при диарее может быть обусловлена мальабсорбцией, воспалением, опухолью.
По продолжительности различают острую (до 2-3 нед) и хроническую (4-6 нед и более) диарею. При острой диарее в первую очередь исключают инфекционную природу заболевания.
• Энтеротоксигенная бактериальная инфекция (Vibrio cholerae, токсигенные Е. coli, Staphylococcus spp.), минимально повреждающие вирусы (Rotavirus, Norwalk), простейшие (Lamblia intestinalis, Cryptosporidium spp.), паразиты (Strongyloides stercoralis и др.) вызывают невоспалительную водянистую тонкокишечную диарею.
• Инвазивные, продуцирующие цитотоксины, микроорганизмы, повреждающие эпителий (Shigella spp., Salmonella spp., Campylobacter jejuni, Yersinia spp., инвазивные Е. coli, Entamoeba histolytica и др.), приводят к развитию дизентерии или воспалительной толстокишечной диареи с кровью, слизью, лейкоцитами в кале, лихорадкой.
• Диарея у гомосексуалистов, кроме обычных причин, предполагает необходимость исключения инфицирования такими возбудителями, как Treponema pallidum, Neisseria gonorrhoeae, Chlamydia spp., Herpes zoster, у ВИЧ-инфицированных - оппортунистической инфекции.
• Диарея у лиц, вернувшихся из путешествий, особенно в развивающиеся страны («диарея путешественников»), чаще связана с
энтеротоксигенными Е. coli, а также лямблиозом, амебиазом, тропической спру.
• Прием антибиотиков может вызывать диарею, обусловленную Clostridium difficile.
Хроническая диарея также может быть вызвана кишечной инфекцией, чаще лямблиозом, но обычно она имеет неинфекционную природу: синдром мальабсорбции, воспалительные заболевания кишечника, коллагеновый и лимфоцитарный колиты, ишемическое поражение кишечника, гормонопродуцирующие опухоли, колоректальный рак, синдром раздраженного кишечника, прием слабительных и других ЛС.
Лабораторные и инструментальные исследования
Анализ кала. При инфекционных и воспалительных заболеваниях отмечают положительную реакцию на скрытую кровь, выявляют повышенное содержание лейкоцитов. Для исключения паразитарной и бактериальной природы заболевания проводят исследование на яйца глистов, простейших, бактериологическое исследование кала.
Обнаружение стеатореи, креатореи, амилореи - свидетельство развития синдрома мальабсорбции.
Для того чтобы отличить осмотическую диарею от секреторной, исследуют кал на содержание электролитов и определяют осмотическую разницу. Последнюю рассчитывают по формуле:
Осмотическая разница = 300 (мосм/кг) - 2 х х [Na+ (мосм/кг) + K+ (мосм/кг)],
где 300 мосм/кг - нормальная осмолярность кала; 2 х [Na+ (мосм/кг) + + K+ (мосм/кг)] - осмолярность кала пациента.
При осмотической диарее выявляют большую осмотическую разницу - более 100 мосм/кг, так как диарея обусловлена невсосавшимися осмотическими веществами. При секреторной диарее осмотическая разница невелика, поскольку осмолярность кала близка к осмолярности плазмы.
Контрастные рентгенологические исследования. Проводят для исключения опухолевого процесса, дивертикулеза, болезни Крона, стриктур и т.д.
Эндоскопические методы с биопсией. Необходимы для исключения онкологических заболеваний, псевдомембранозного, лимфоцитарного, коллагенового колитов и аналогичных состояний. У больных,
длительно принимавших слабительные средства из группы антрахинонов (например, препараты сенны), обнаруживают меланоз - темную окраску слизистой оболочки кишки.
Другие методы. Заболевания, сопровождаемые мальабсорбцией, требуют различных дополнительных методов установления диагноза (см. раздел «Синдром нарушенного всасывания»).
ЛЕЧЕНИЕ
Пациентам с инфекционной диареей рекомендуют щадящую диету с исключением продуктов, усиливающих перистальтику кишечника (молока, кофе, продуктов, содержащих большое количество пищевых волокон).
При высокой лихорадке, симптомах интоксикации и обезвоживания показан ежедневный прием внутрь 2-3 л регидратационного раствора, содержащего необходимые электролиты. В тяжелых случаях проводят внутривенную регидратационную терапию.
Антибиотики назначают только при энтероинвазивных инфекциях, особенно у лиц с ослабленным иммунитетом, больных пожилого возраста, при тяжелых сопутствующих заболеваниях, больным с искусственными клапанами сердца, а также при персистирующей паразитарной инвазии. Выбор антибактериального препарата зависит от вида возбудителя. Для эмпирического лечения используют фторхинолоны (ципрофлоксацин, норфлоксацин).
Лечение неинфекционной диареи см. в соответствующих разделах.
42.7. БОЛЕЗНЬ КРОНА
Болезнь Крона - хроническое заболевание, характеризуемое гранулематозным трансмуральным воспалением с сегментарным поражением различных отделов ЖКТ.
ЭПИДЕМИОЛОГИЯ
Распространенность болезни Крона в различных странах составляет 9-199 на 100 000 населения, заболеваемость - 5-10 случаев на 100 000 населения в год. Заболевание чаще встречается в индустриально развитых странах, у городского населения. У женщин болезнь Крона развивается несколько чаще. Пик заболеваемости приходится на возраст
20-30 лет.
Изолированное поражение подвздошной кишки наблюдают в 35%, толстой кишки - в 20%, подвздошной и толстой - в 45% случаев.
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
Этиология неизвестна, к факторам риска развития заболевания принято относить наследственную предрасположенность, иммунологические нарушения и воздействие факторов внешней среды. Примерно в 20% случаев болезнь Крона обнаруживают у ближайших родственников пациента. Конкордантность у монозиготных близнецов при болезни Крона составляет 44-50%. Первый участок генома, определяющий генетическую предрасположенность к болезни Крона, названный IBD1 (Inflammatory Bowel Disease), был обнаружен в области перицентромера хромосомы 16ql2. Затем были выявлены другие участки генома, ассоциируемые с воспалительными заболеваниями кишечника в хромосомах 12q(IBD2), 6p(IBD3), 14q(IBD4), 19q(IBD5), 5q(IBD6). Было установлено, что мутации NOD2/CARD15 гена в этой области играют важную роль в развитии воспаления в ответ на бактериальные антигены, активируя ядерный фактор kB (NF-kB), который регулирует экспрессию большинства провоспалительных цитокинов. Мутации NOD2/CARD15 определяют развитие 20-27% случаев болезни Крона.
• Иммунологические нарушения: повышение местной выработки AT, сдвиг соотношения образования IgA и IgG в сторону увеличения продукции последнего, супрессия Т-лимфоцитарного звена.
• Курение повышает риск развития болезни Крона в 2 раза.
ПАТОМОРФОЛОГИЯ
Морфологический признак болезни Крона - значительное утолщение пораженной стенки кишечника в результате трансмурального воспаления. Характерна множественность участков поражения (очаговые гранулемы, глубокие извитые или линейные изъязвления), отстоящих друг от друга на большом расстоянии (сегментарность поражения). Макроскопически слизистая оболочка напоминает «булыжную мостовую»: участки нормальной слизистой оболочки сменяются изъязвлениями и гранулематозными разрастаниями. Микроскопически в зоне поражения обнаруживают отек и гиперплазию лимфатических фолликулов в подслизистой оболочке, пролиферацию ретикулоэндотелиальных и лимфоидных элементов, гранулемы, состоящие из гигантских и эпителиоидных клеток.
КЛИНИЧЕСКАЯ КАРТИНА И ДИАГНОСТИКА
Общие проявления. Для всех форм болезни Крона (независимо от локализации процесса) характерны диарея, боли в животе, снижение массы тела (часто обусловленное сопутствующей анорексией) и лихорадка в сочетании со слабостью, повышенной утомляемостью и анорексией.
• Диарея при поражении подвздошной кишки обусловлена воспалением, нарушением всасывания солей желчных кислот, повышенной секрецией ионов и воды в толстой кишке (хологенная диарея), избыточным размножением бактерий в тонкой кишке. При локализации процесса в толстой кишке диарея напоминает таковую при язвенном колите.
• Боли в животе в период обострения обычно коликообразные, локализуются в нижних отделах живота, часто усиливаются после приема пищи, что обусловлено обструктивной природой процесса.
Клиническая картина зависит от локализации процесса.
• Для тонкокишечной формы характерна боль в животе, которая напоминает аппендикулярную, не уменьшается после дефекации и усиливается после приема пищи. Синдром мальабсорбции (снижение массы тела, анемия, задержка роста у детей, гипопротеинемия, отеки) развивается редко, только при распространенном процессе в тонкой кишке или в результате ее резекции. При локализации процесса в дистальной части подвздошной кишки может развиться дефицит витамина В12. В 20-30% случаев возможны обтурационная кишечная непроходимость или кишечное кровотечение.
• Для толстокишечной формы характерны диарея до 10-12 раз в сутки с примесью крови, гноя, императивные позывы на дефекацию ночью или под утро. Боли возникают после приема пищи или перед дефекацией, усиливаются при движениях, дефекации, очистительной клизме, обычно локализуются в нижних и боковых отделах живота. Прямая кишка, в отличие от перианальной зоны (40% случаев), в патологический процесс вовлекается редко. При поражении дистальных отделов толстой кишки заболевание может проявиться симптомами острого парапроктита, развитием анальных или ректальных стенозов, приводящих к запору.
Внекишечные проявления болезни Крона. Включают следующие синдромы:
• связанные с активностью процесса - артриты, афтозный стоматит, узловатую эритему, гангренозную пиодермию, эписклерит, увеит, ирит;
• не связанные с активностью процесса - первичный склерозирующий холангит, сакроилеит, анкилозирующий спондилит. Доказана генетическая связь анкилозирующего спондилита с HLA-B27;
• связанные с мальабсорбцией вследствие поражения тонкой кишки - нефролитиаз, холецистолитиаз, анемию, нарушения свертываемости крови и т.д.
Для определения выраженности патологического процесса и тактики лечения рекомендуют использовать индекс активности болезни Крона по Бесту (табл. 42-1).
Таблица 42-1. Индекс активности болезни Крона по Бесту
Лабораторные исследования
Изменения в анализе крови неспецифичны: обычно определяют анемию, увеличение СОЭ, гипопротеинемию, электролитные нарушения, снижение концентрации фолиевой кислоты, витаминов В12 и D. При копрологическом исследовании из-за нарушения переваривания и всасывания обнаруживают стеаторею (при поражении тонкой кишки - с преобладанием жирных кислот и их солей), амилорею, креаторею.
Инструментальные исследования
Диагноз болезни Крона основывается на сочетании клинических, эндоскопических, рентгенологических и морфологических данных.
• При ФЭГДС обнаруживают поражение верхних отделов ЖКТ. Локализация процесса в желудке составляет 1-,5% всех случаев болезни Крона, причем наиболее часто наблюдают изолированное поражение антрального отдела желудка или сочетанное поражение желудка и начального отдела двенадцатиперстной кишки. Желудок часто вовлекается в процесс в терминальной стадии поражения кишечника.
• При ректороманоскопии с биопсией обнаруживают изменения в прямой кишке (вовлекается в патологический процесс в 50% случаев). Биопсию рекомендуют проводить даже при визуально неизмененной слизистой оболочке, поскольку у 20% больных при гистологическом исследовании определяют гранулемы.
• При колоноскопии оценивают слизистую оболочку всей толстой кишки и терминального отдела подвздошной кишки, определяют локализацию процесса, размеры поражения, наличие или отсутствие стриктур, можно своевременно распознать рецидив заболевания у больных, перенесших операцию, провести множественную биопсию слизистой оболочки толстой и терминального отдела подвздошной кишки. Поскольку патологический процесс начинается с подслизистой оболочки, обязательно включение этого слоя в биопсийный материал. Однако гистологическое исследование биоптатов часто не позволяет выявить патогномоничные признаки болезни Крона, поэтому для диагностики важно выявление макроскопических изменений:
- начальный период заболевания характеризуется скудными эндоскопическими данными: тусклой слизистой оболочкой, на ее фоне видны эрозии по типу афт, окруженные белесоватыми грануляциями, в просвете кишки и на стенках - гноевидная слизь;
- рельеф слизистой оболочки по типу «булыжной мостовой» выявляют в период наибольшей активности процесса. Для этой же стадии характерно образование свищей;
- с уменьшением активности процесса на месте язв или трещин образуются рубцы, что приводит к формированию стеноза.
• Рентгенологическое исследование тонкой кишки. Наиболее информативным считают введение бариевой взвеси за дуоденоеюнальную складку. Выявляют стриктуры, псевдодивертикулы,
свищи, дилатацию, деформацию купола слепой кишки, язвы различных размеров, между которыми выступают сохранившиеся участки слизистой оболочки (симптом «булыжной мостовой»), контуры пораженного сегмента кишки в виде щелевидных выступов (щелевидные изъязвления), сужение просвета кишки (симптом «шнура»), укорочение измененных отрезков кишки и др.
• Ирригоскопия не исключает рентгенологического исследования тонкой кишки, даже если при ней в результате заброса бариевой взвеси за баугиниеву заслонку удалось оценить терминальный отдел подвздошной кишки.
Другие инструментальные методы диагностики при болезни Крона применяют значительно реже.
• Селективную ангиографию брыжеечных сосудов. Наряду с изменениями интрамуральной сосудистой сети выявляют изменения брыжеечной части сосудов.
• УЗИ и КТ. Проводят преимущественно для выявления абсцессов и параректальных поражений.
• Фистулографию. Показана при наличии наружных свищей.
Дифференциальная диагностика
Необходимо исключить язвенный колит (см. раздел «Язвенный колит»), поражение ЖКТ туберкулезной этиологии, ишемический колит, болезнь Уиппла (см. раздел «Болезнь Уиппла»), дивертикулез кишечника (см. раздел «Дивертикулярная болезнь толстой кишки»), псевдомембранозный колит (см. раздел «Псевдомембранозный колит»), актиномикоз, иерсиниоз, лимфогранулематоз, первичный амилоидоз, острый аппендицит, хронический энтерит.
ОСЛОЖНЕНИЯ
• Стриктуры клинически проявляются схваткообразными болями в животе, запором, развитием частичной, реже - полной кишечной непроходимости.
• Массивные кровотечения связаны с деструктивными изменениями стенки сосудов в местах изъязвлений, манифестируют в зависимости от локализации кровотечения наличием алой крови в каловых массах, меленой, рвотой «кофейной гущей» (при поражении желудка), общими симптомами анемии.
• Образование инфильтратов, абсцессов, наружных и внутренних свищей.
• Перфорации (чаще прикрытые).
• Малигнизация и токсическая дилатация толстой кишки при болезни Крона возникают значительно реже, чем при язвенном колите, тем не менее при длительном течении болезни Крона риск развития рака и лимфомы повышается.
ЛЕЧЕНИЕ
Диетотерапия
В период обострения заболевания назначают механически и химически щадящую диету с повышенным содержанием белков, витаминов, исключением грубой растительной клетчатки, молока при его непереносимости. Калорийность пищи можно повысить за счет жидких питательных растворов, белковых препаратов, содержащих цельный белок и лишенных лактозы и растительной клетчатки, специальных рационов, включающих гидролизованный протеин, также лишенных лактозы и клетчатки. При стриктурах или повторных обструкциях следует избегать приема грубой и газообразующей пищи. При диарее необходимо увеличить количество растительной клетчатки, ограничить прием жиров.
Медикаментозное лечение
Для лечения болезни Крона применяют препараты 5-аминосалициловой кислоты (месалазин, сульфасалазин), ГК системного (преднизолон, гидрокортизон) и местного (будесонид) действия, иммунодепрессанты (азатиоприн, меркаптопурин, метотрексат), антагонисты ФНО-а (инфликсимаб), антибактериальные препараты (метронидазол, ципрофлоксацин).
• Препараты 5-аминосалициловой кислоты уменьшают активность воспалительного процесса, оказывают иммуномодулирующее действие. Месалазин применяют при болезни Крона умеренной активности любой локализации в кишечнике в дозе 4 г/сут. Поддерживающая доза месалазина после достижения клинической ремиссии составляет до 1 г/сут. При поражении нисходящего отдела ободочной кишки и прямой кишки возможно применение месалазина в клизмах по 2 г/сут в 2 введения.
• ГК применяют при выраженной активности процесса, тяжелом и среднетяжелом течении заболевания, а также при отсутствии эффекта от лечения препаратами 5-аминосалициловой кислоты.
- Доза преднизолона зависит от тяжести процесса (максимально - до 1 мг/кг в день, в среднем - 30 мг/сут). При тяжелом те-
чении болезни Крона ГК можно вводить внутривенно в высоких дозах, а при локализации процесса в прямой кишке - в клизмах 2 раза в день ежедневно. После достижения клинической ремиссии отмену ГК рекомендуют проводить очень медленно (не больше чем на 2,5-5,0 мг каждые 14 дней) с последующим переходом на поддерживающие дозы (5-15 мг/сут преднизолона) в течение нескольких месяцев и даже лет.
- Будесонид - ГК нового поколения, обладающий меньшим системным действием. Наибольшую активность препарат проявляет в терминальном отделе подвздошной кишки. Показан при болезни Крона легкой и средней степени тяжести с локализацией в подвздошной и/или восходящей кишке. Препарат назначают по 3 мг 3 раза в день, что соответствует примерно 40 мг преднизолона.
- Иммунодепрессанты применяют при длительной терапии ГК в целях уменьшения дозы последних (до 2,5-5,0 мг/сут для преднизолона), для поддержания ремиссии при хронически активном течении заболевания, при лечении наружных и внутренних свищей. Азатиоприн назначают в дозе 2,0-2,5 мг/кг в день, при его непереносимости - метотрексат в дозе 25 мг/нед внутримышечно в течение 16 нед.
• При среднетяжелом, тяжелом, резистентном течении, фистулообразующей форме процесса показано использование инфликсимаба (химерных моноклональных AT к ФНО). Курс лечения состоит из троекратного внутривенного введения препарата в дозе 5 мг/кг для достижения ремиссии с последующими введениями на 2-й и 6-й неделе, далее каждые 8 нед для поддержания ремиссии.
• Антибактериальные препараты показаны при гнойных осложнениях, развитии высокой лихорадки на фоне проводимой терапии, для профилактики рецидивов после резекции терминального отдела подвздошной кишки. Применяют полусинтетические пенициллины (обычно в течение ≤2 нед), метронидазол по 1,0-1,5 г/сут, ципрофлоксацин - по 1 г/сут.
• Симптоматическое лечение. Для купирования диареи применяют смектит диоктаэдрический. При развитии В12-дефицитной анемии показан цианокобаламин по 600 мкг внутримышечно каждые 6-8 нед. При выраженном синдроме мальабсорбции назначают жирорастворимые витамины, препараты кальция, магния, железа, цинка. Эффективность препаратов 5-аминосалициловой кислоты
оценивают на 14-21-й день лечения, ГК - на 7-21-й день, азатиоприна - через 2-3 мес. Однозначных рекомендаций по выбору препаратов для поддерживающей терапии нет. Обычно в качестве поддерживающей терапии применяют азатиоприн, меркаптопурин или препараты 5-аминосалициловой кислоты.
Хирургическое лечение
Абсолютные показания: перфорация, перитонит, токсическая дилатация, тяжелые кровотечения, острая кишечная непроходимость, обусловленная стриктурами. Относительные показания: отсутствие эффекта от комплексной лекарственной терапии, наличие хронической частичной кишечной непроходимости, поражений кожи, глаз, суставов, не поддающихся консервативному лечению.
Виды оперативных вмешательств:
• паллиативные (наложение двуствольной илеоили колостомы при крайне тяжелом состоянии больного или внутрибрюшинных инфильтратах);
• радикальные (резекция сегмента тонкой кишки, сегментарная или субтотальная резекция ободочной кишки, колэктомия, колпроктэктомия, а также пластические операции при рубцовых стриктурах малой протяженности);
• реконструктивно-восстановительные.
ПРОГНОЗ
Отдаленный прогноз болезни Крона более благоприятен при локализации процесса в толстой кишке.
42.8. ЯЗВЕННЫЙ КОЛИТ
Язвенный колит - хроническое воспалительное заболевание толстой кишки, характеризуемое язвенно-деструктивными изменениями ее слизистой оболочки.
ЭПИДЕМИОЛОГИЯ
Распространенность язвенного колита в разных странах составляет 21-268 на 100 000 населения, заболеваемость - 5-15 на 100 000 населения в год. Язвенный колит возможен во всех возрастных группах, но основной пик заболеваемости приходится на 20-40 лет. Частота заболевания у мужчин и женщин одинаковая.
КЛАССИФИКАЦИЯ
Классификация язвенного колита приведена в табл. 42-2, а определение степени тяжести заболевания - в табл. 42-3.
Таблица 42-2. Классификация язвенного колита
Таблица 42-3. Степени тяжести язвенного колита по Трулав
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
Этиология неизвестна. Предполагается наследственная предрасположенность, при которой бактерии, вирусы, особенности питания, им-
мунные реакции могут запускать воспалительный процесс. Существует наследственная предрасположенность к заболеванию (семейные случаи): среди ближайших родственников язвенный колит возникает в 10 раз чаще, чем в общей популяции. Конкордантность по язвенному колиту у монозиготных близнецов существенно ниже, чем по болезни Крона (6-14%). Существуют данные о связи заболевания с HLA-DR2 (в особенности с подтипом DRB1*1502 и с аллелями DRB1*0103 и DRB1*12).
В сыворотке больных часто обнаруживают (=70%) перинуклеарные антинейтрофильные цитоплазматические антитела (pANCA).
Риск развития язвенного колита у курящих в 2 раза меньше, чем у некурящих.
ПАТОМОРФОЛОГИЯ
Морфологически обнаруживают воспаление различных отделов толстой кишки. Обычно поражается слизистая оболочка, и лишь при тяжелых формах воспаление распространяется на глубокие слои кишечной стенки. Слизистая оболочка гиперемирована, отечна, изъязвлена. Язвы округлой формы, имеют различные размеры. Микроскопические изменения характеризуются инфильтрацией собственной пластинки эозинофилами, лимфоцитами, тучными клетками и нейтрофилами.
КЛИНИЧЕСКАЯ КАРТИНА
Для язвенного колита характерны следующие симптомы:
• диарея с примесью крови и слизи;
• боли в животе;
• тенезмы;
• лихорадка.
Возможны также снижение аппетита, тошнота и рвота, снижение массы тела, анемия, слабость, водно-электролитные нарушения различной степени. Начало заболевания может быть постепенным или острым.
• Особенно тяжело протекает фульминантная форма язвенного колита, которая почти всегда сопровождается тотальным поражением толстой кишки, развитием серьезных осложнений (токсической дилатации толстой кишки, перфорации) и в большинстве случаев требует неотложного хирургического вмешательства. Заболевание начинается бурно: в течение нескольких дней формируется выраженная клиническая картина с частотой кровянистого стула более 10 раз в сутки, снижением концентрации гемоглобина менее 60 г/л, повышением СОЭ более 30 мм/ч.
• Язвенный колит, начинающийся постепенно, клинически обычно манифестирует только ректальным кровотечением. Кровотечения чаще возникают из мелких язв толстой кишки. Если воспалительный процесс распространяется в проксимальном направлении на большую часть толстой кишки, возможно значительное кровотечение.
• У большинства больных наблюдают учащение стула (в тяжелых случаях до 20 раз в сутки). Часто при позыве на дефекацию выделяется только кровянистая слизь. В начальный период заболевания, протекающего в форме проктосигмоидита, возможен запор, преимущественно вследствие спазма сигмовидной кишки.
• Боли, обычно ноющего характера, возникают у 2/3 больных. Их локализация зависит от протяженности патологического процесса (чаще в левой половине живота). У многих больных интенсивность болей нарастает через 30-90 мин после еды. По мере развития заболевания связь между приемами пищи и болями в животе утрачивается, так как угасает гастроколитический рефлекс, при котором вслед за приемом пищи возникает усиленная перистальтика кишечника.
Внекишечные проявления язвенного колита, связанные с иммунными нарушениями, обнаруживают у 10-20% больных, чаще при тотальном поражении толстой кишки. К внекишечным проявлениям язвенного колита относят:
• первичный склерозирующий холангит (развивается в 2-7,5% случаев);
• различные поражения кожи (чаще развивается узловатая эритема), которые необходимо дифференцировать от лекарственного дерматита вследствие приема сульфасалазина;
• эписклерит, увеит, иридоциклит;
• артриты (с преимущественным поражением крупных суставов);
• анкилозирующий спондилит, саркоилеит.
Все внекишечные проявления, за исключением сакроилеита, анкилозирующего спондилита и первичного склерозирующего холангита, исчезают или уменьшаются по мере снижения активности воспаления или после колопроктэктомии.
Осложнения язвенного колита (связаны с поражением кишки): перфорация кишки, профузное кровотечение, токсическая дилатация толстой кишки, стриктуры, полипоз, малигнизация, перфорация, сепсис, тромбозы и тромбоэмболия.
ДИАГНОСТИКА
Лабораторные и инструментальные исследования
Тяжелые формы заболевания сопровождаются повышением СОЭ, лейкоцитоз выявляют редко. Часто развивается анемия. Вследствие длительной диареи развиваются гипонатриемия, гипохлоремия, гипоальбуминемия. При рентгенологическом исследовании обнаруживают типичную картину сглаженности или отсутствия гаустр (симптом «водопроводной трубы»; рис. 42-1). При колоноскопии обнаруживают отсутствие сосудистого рисунка, зернистость, гиперемию и отек слизистой оболочки, наличие контактной кровоточивости и/или эрозий и язв, множественные псевдополипы.
Дифференциальная диагностика
Язвенный колит дифференцируют от инфекционных поражений кишечника, ишемического колита, болезни Крона.
• При дифференциальной диагностике с инфекционной патологией первостепенное значение имеет микробиологическое исследование кала.
• Распознаванию ишемического колита способствуют пожилой возраст больных, характерные рентгенологические признаки (симптом «пальцевых вдавлений», псевдодивертикулы), обнаружение гемосидеринсодержащих макрофагов при гистологическом исследовании биоптатов слизистой оболочки толстой кишки.
Рис. 42-1. Рентгенологическая картина при язвенном колите
• Наибольшие трудности могут возникнуть при дифференциальной диагностике язвенного колита с болезнью Крона при локализации в толстой кишке (табл. 42-4).
Таблица 42-4. Дифференциальная диагностика неспецифического язвенного колита с болезнью Крона
ЛЕЧЕНИЕ
Диетотерапия
Диета механически щадящая с повышенным содержанием легкоусвояемых белков. Овощи и фрукты не рекомендуются. При фульминантном течении необходимо парентеральное питание.
Медикаментозное лечение
Базисными считают 2 группы препаратов: производные 5-аминосалициловой кислоты (сульфасалазин, месалазин) и ГК (системные - преднизолон, гидрокортизон и местные - будесонид).
• При легких и среднетяжелых формах средняя доза сульфасалазина и месалазина - 3-4 г/сут. После достижения эффекта дозу снижают. Поддерживающую дозу (1-2 г/сут) принимают длительно (до 2 лет). Предпочтительнее месалазин ввиду меньшего количества побочных эффектов (особенно при длительном приеме). Препараты принимают внутрь и/или применяют их местно (в свечах и микроклизмах) при проктите и проктосигмоидите.
• При тяжелом течении или отсутствии эффекта от производных 5-аминосалициловой кислоты назначают ГК - преднизолон внутрь в дозе 1 мг/кг в день. При остром течении преднизолон (в дозе до 240-360 мг/сут) или гидрокортизон (в дозе до 500 мг/сут) назначают парентерально на 5-7 дней с последующим переходом на прием внутрь. В зависимости от ответа на терапию выделяют ГК-резистентный и ГК-зависимый варианты язвенного колита:
- ГК-резистентность - отсутствие эффекта в течение 3 нед адекватной терапии (преднизолон в дозе 2 мг/кг в день);
- ГК-зависимость - необходимость непрерывной (в течение 6 мес) терапии. При этом отмечают недостаточную эффективность лечения, выраженные побочные эффекты или необходимость присоединения иммунодепрессивных препаратов.
• При резистентных формах язвенного колита используют иммунодепрессанты - метотрексат (25 мг внутримышечно 2 раза в неделю), азатиоприн (2 мг/кг в день) или меркаптопурин (50 мг/сут). Продолжительность курса обычно составляет 12 нед.
При тяжелом течении также используют циклоспорин (2-4 мг/кг массы телав сутки внутривенно в течение 1-2 нед, затем 5 мг/кг внутрь).
Эффективность инфликсимаба при язвенном колите продолжают изучать.
Хирургическое лечение
Показания к оперативному лечению:
• обоснованное клиническими признаками подозрение на перфорацию кишки;
• не поддающаяся целенаправленной комплексной терапии токсическая дилатация толстой кишки;
• профузное кишечное кровотечение;
• отсутствие эффекта от парентерального введения ГК при тяжелой форме язвенного колита в течение 5 дней;
• неэффективность комплексного консервативного лечения;
• развитие стойких стриктур с явлениями частичной непроходимости кишечника;
• рак на фоне хронического воспалительного процесса. Оперативные вмешательства могут быть:
• паллиативными (наложение илеоили колостомы);
• радикальными (сегментарная или субтотальная резекция ободочной кишки, колэктомия, колопроктэктомия);
• восстановительно-реконструктивными (наложение подвздошнопрямокишечного или подвздошно-сигмовидного анастомоза «конец в конец»).
ПРОГНОЗ
У многих больных возможны длительные ремиссии. У больных тотальным поражением кишечника при длительности заболевания более 10 лет возрастает риск развития рака толстой кишки. Прогноз всегда серьезен при развитии осложнений язвенного колита.
42.9. ДИВЕРТИКУЛЯРНАЯ БОЛЕЗНЬ ТОЛСТОЙ КИШКИ
Дивертикул - мешковидное выпячивание стенки полого органа. Различают истинные и ложные дивертикулы органов ЖКТ. При истинных (врожденных) дивертикулах выпячиваются все слои кишечной стенки, при ложных (приобретенных) - слизистая и подслизистая оболочки выпячиваются между волокнами мышечной оболочки кишки.
Дивертикулез - наличие дивертикулов кишки без развития клинических симптомов. При развитии клинических проявлений, обусловленных дивертикулами кишки, патологический процесс называют дивертикулярной болезнью.
Дивертикулит - воспаление дивертикула с возможным вовлечением близлежащих структур (перидивертикулит).
ЭПИДЕМИОЛОГИЯ
В развитых странах дивертикулез толстой кишки выявляют у 5% лиц 40 лет, у 30% - 60 лет и у 50% и более - 80 лет. У жителей развивающихся стран дивертикулы обнаруживают редко.
Для европейцев характерны дивертикулы сигмовидной кишки (85% случаев), а для жителей Азии - проксимальных отделов толстой кишки
(70-80% случаев).
У 15-30% больных дивертикулезом развивается дивертикулит, у 5-15% больных - кровотечение из дивертикула.
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
Этиология дивертикулов изучена недостаточно. По всей видимости, возникновение заболевания обусловлено сочетанием нескольких факторов, а не действием одного из них.
• Согласно наиболее распространенной грыжевой теории, причиной образования дивертикулов является слабость соединительнотканных структур кишечной стенки, возникающая по мере старения организма. Близким расположением кровеносных сосудов объясняют склонность дивертикулов к кровотечениям.
• В соответствии с сосудистой теорией, основная причина формирования дивертикулов - изменения в кишечной стенке вследствие нарушения кровообращения.
• Теория врожденной предрасположенности состоит в том, что дивертикулы возникают вследствие местного дефекта развития стенки полого органа. Существуют сообщения о семейных случаях дивертикулеза ЖКТ.
• Согласно механической (пульсионной) теории, дивертикулы формируются при повышенной активности гладкой мускулатуры кишечной стенки, из-за чего возникает повышение давления внутри кишки. Высокое давление в просвете кишки приводит к гипертрофии ее мускулатуры, развитию фиброза, потере эластичности. Под влиянием повышенного давления слизистая и подслизистая оболочки кишки выпячиваются через наиболее слабые участки мышечной оболочки (по ходу кровеносных и лимфатических сосудов, нервов) - образуются ложные (приобретенные) дивертикулы толстой кишки.
Известны факторы, способствующие прогрессированию дивертикулярной болезни толстой кишки:
• Длительная, многолетняя недостаточность пищевых волокон в рационе.
• Уменьшение объема каловых масс вследствие недостатка в еде пищевых волокон вызывает избыточную сегментацию толстой кишки, в результате чего возрастает внутрикишечное давление.
• Нарастающая с возрастом слабость кишечной стенки.
• Кишечная дискинезия, сопровождаемая повышением внутрикишечного давления и нарушением транзита кишечного содержимого.
• Задержка дефекации, заболевания аноректальной области.
Преимущественная локализация дивертикулов в сигмовидной кишке объясняется тем, что диаметр просвета этого отдела толстой кишки меньше, а давление в нем выше.
Наследственную обусловленность дивертикулов у жителей стран Азии позволяет предполагать их частое развитие в молодом возрасте и в правых отделах толстой кишки. Распространенность дивертикулеза у японцев с переходом на диету, имеющую низкое содержание пищевых волокон, резко возросла, однако преимущественно правосторонняя локализация процесса не изменилась.
Склонность к развитию дивертикулярной болезни в молодом возрасте отмечают также при врожденных и приобретенных заболеваниях, влияющих на эластичность кишечника (синдроме дисплазии соединительной ткани, системной склеродермии, сахарном диабете) и у мужчин с ожирением.
Развитие дивертикулита
Обструкция шейки дивертикула каловыми массами приводит к растяжению его полости, скоплению в ней слизистого секрета, размножению кишечной флоры, ухудшению кровоснабжения стенки кишки. Это вызывает воспаление стенки дивертикула, которое может разрешиться, приобрести хроническое течение либо привести к разрыву дивертикула.
• Микроперфорация может остаться локализованной и приводить к развитию периколита, образованию инфильтрата, абсцесса или свища.
• Перфорация приводит:
- к местным периколиту и абсцессу;
- отдаленному абсцессу (ретроперитонеальному или тазовому);
- разлитому перитониту вследствие распространения периколита или тазового абсцесса;
- каловому перитониту из-за перфорации дивертикула в свободную брюшную полость.
• После опорожнения абсцесса могут образовываться свищи между кишкой и мочевым пузырем, мочеточником, влагалищем, брюшной стенкой.
• Рецидивирование дивертикулита вызывает фиброз и в ряде случаев стриктуру с развитием непроходимости толстой кишки.
КЛАССИФИКАЦИЯ
Различают несколько клинических форм дивертикулез:
• бессимптомный;
• с клиническими проявлениями;
• с осложненным течением.
В зависимости от локализации поражения выделяют дивертикулез:
• тонкой кишки;
• толстой кишки.
КЛИНИЧЕСКАЯ КАРТИНА И ДИАГНОСТИКА
Дивертикулез тонкой кишки у большинства больных протекает бессимптомно и диагностируется случайно при эндоскопическом или рентгенологическом исследовании.
Иногда больные предъявляют неспецифические жалобы на нарушения стула, метеоризм или боли в животе.
При дивертикулезе толстой кишки могут развиваться осложнения.
• Дивертикулит возникает примерно у 25% пациентов и проявляется следующими симптомами:
- остро возникшей болью и напряжением мышц передней брюшной стенки (преимущественно в левом нижнем квадранте живота);
- при прогрессировании заболевания - повышением температуры тела, появлением озноба;
- анорексией, тошнотой, рвотой, нарушениями стула (диареей или запором);
- при распространении воспалительного процесса с дивертикула на окружающие ткани - формированием болезненного плотного малоподвижного инфильтрата в брюшной полости и кишечной непроходимостью;
- при вовлечении в процесс мочевого пузыря - возникновением дизурии.
• При перфорации дивертикула в брюшную полость развивается разлитой перитонит, в забрюшинную клетчатку или пространство между листками брыжейки - инфильтраты или абсцессы. Развитие перитонита может быть связано не только с перфорацией дивертикула, но и с абсцессами, образующимися в кишечной стенке при дивертикулите.
• Серьезное кровотечение возникает у 3-5% больных и нередко служит единственным проявлением заболевания. В 70-80% случаев кровотечение прекращается спонтанно.
• Кишечная непроходимость при дивертикулезе чаще бывает обтурационной и возникает из-за воспалительного инфильтрата, сдавливающего кишку, спаечного процесса, приводящего к деформации кишки и ее брыжейки, а в отдельных случаях - из-за спазма гладкой мускулатуры кишки.
• Внутренние или реже наружные кишечные свищи.
Лабораторные исследования
• При дивертикулите в анализах крови обычно обнаруживают сдвиг лейкоцитарной формулы влево, повышение СОЭ, а при кровотечениях - признаки железодефицитной анемии.
• Данные копрологического исследования, подтверждающие воспаление: нейтрофилы, наличие в слизи большого количества макрофагов, слущенного эпителия.
• При образовании кишечно-мочепузырного свища в моче возможно обнаружение повышенного количества лейкоцитов, эритроцитов, компонентов кишечного содержимого, микроорганизмов, специфичных для кишечника.
Инструментальные исследования
• Ирригографию считают наиболее значимым диагностическим исследованием при дивертикулезе толстой кишки. Цистоскопия и цистография показаны при подозрении на пузырно-кишечные свищи. Обзорную рентгенографию органов брюшной полости в горизонтальном и вертикальном положениях проводят при подозрении на перфорацию дивертикула и наличие свободного воздуха в брюшной полости.
• При колоноскопии выявляют характерные эндоскопические признаки дивертикулеза - наличие единичных или множественных устьев дивертикулов в стенке кишки.
• УЗИ органов брюшной полости, почек проводят для исключения патологии других органов.
• КТ показана в острой стадии заболевания для оценки состояния кишечной стенки и смежных органов.
• Ангиография может потребоваться при кровотечении из дивертикула. Возможно проведение терапевтических мероприятий посредством эмболизации кровоточащего сосуда.
• Фистулография.
Дифференциальная диагностика
Дивертикулярную болезнь кишечника необходимо дифференцировать от синдрома раздраженного кишечника, рака толстой кишки, язвенного колита, болезни Крона, гемангиом толстой кишки, ишемического или инфекционного колита, лекарственных язвенно-некротических поражений толстой кишки, различных гинекологических и урологических заболеваний, внематочной беременности.
ЛЕЧЕНИЕ
Консервативное лечение
• Наиболее важный метод лечения дивертикулеза толстой кишки - диета с высоким содержанием пищевых волокон (прием отрубей, добавок с пищевыми волокнами), которая предотвращает образование дивертикулов, оказывает лечебное действие, предотвращает развитие осложнений.
• При дивертикулите легкого течения назначают диету с низким содержанием пищевых волокон и антибиотики, спектр действия которых распространяется на аэробную грамотрицательную и анаэробную флору (например, метронидазол в комбинации с ципрофлоксацином или триметоприм с сульфаметоксазолом).
• При более серьезном течении заболевания больного следует госпитализировать в хирургический стационар. Ему назначают голод, антибиотики, действующие на грамотрицательные и аэробные микробы, парентеральную терапию водно-электролитными растворами. При отсутствии эффекта от консервативной терапии проводят хирургическое лечение.
Хирургическое лечение
Оперативное лечение необходимо при следующих ситуациях:
• при перфорации дивертикула в брюшную полость;
• кишечной непроходимости;
• профузном кровотечении;
• наличии свищей;
• рецидивирующем дивертикулите, осложненном формированием абсцессов.
ПРОГНОЗ
Прогноз в большинстве случаев благоприятный. У 33% пациентов заболевание приобретает рецидивирующий воспалительный характер. Повторные кровотечения возникают у 22-38% пациентов.
ПРОФИЛАКТИКА
Профилактика дивертикулярной болезни заключается в предупреждении запора путем соблюдения режима питания и диеты, ведения активного образа жизни, занятий ЛФК и др.
42.10. ПСЕВДОМЕМБРАНОЗНЫЙ КОЛИТ
Псевдомембранозный колит (колит, связанный с приемом антибиотиков) - острое воспалительное заболевание кишечника, вызванное Clostridium difficile и развивающееся как осложнение антибактериальной терапии.
ЭПИДЕМИОЛОГИЯ
Диарея развивается у 2-26% лиц, получавших антибиотикотерапию, у 10-30% из них причиной диареи считают С. difficile.
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
Причина псевдомембранозного колита - С. difficile - грамположительный, спорообразующий, анаэробный микроорганизм с фекальнооральным механизмом передачи. Патогенные штаммы С. difficile продуцируют эндотоксин А и цитотоксин В. Заболевание возникает только при приеме антибактериальных ЛС (в первую очередь, ампициллина, клиндамицина, цефалоспоринов III поколения), которые, подавляя нормальную кишечную микрофлору, создают условия для избыточного роста С. difficile.
КЛИНИЧЕСКАЯ КАРТИНА
Заболевание развивается во время лечения антибактериальными ЛС или после окончания антибиотикотерапии (чаще в течение первых 10 сут, реже - через 6-8 нед) и манифестирует водянистой диареей и схваткообразными болями в животе. В тяжелых случаях диарея становится очень частой, сопровождается высокой лихорадкой, обезвоживанием, гипотензией, в фекалиях появляется кровь.
При колоноскопии отличительным признаком заболевания является наличие на слизистой оболочке толстой кишки желтовато-белесоватых фибринозных наложений.
Установить диагноз позволяют следующие методы.
• Бактериологическое исследование фекалий в целях выявления С. difficile.
• ИФА на предмет обнаружения токсинов А и В в кале.
Дифференциальная диагностика
Проводят с другими диареями, вызванными приемом антибактериальных ЛС, воспалительными заболеваниями кишечника.
ЛЕЧЕНИЕ
При легком течении для купирования заболевания может быть достаточно отмены антибактериальных ЛС. В других случаях используют метронидазол или ванкомицин.
42.11. РАК ТОЛСТОЙ КИШКИ
Рак толстой кишки - злокачественная опухоль, развивающаяся из эпителия толстой кишки.
ЭПИДЕМИОЛОГИЯ
В мире рак толстой кишки занимает 3-е место в структуре заболеваемости злокачественными новообразованиями, 4-е место - в структуре смертности от них. Высокие показатели смертности от рака толстой кишки зарегистрированы в странах Северной Америки и Европы, низкие - в странах Азии и особенно Африки. В России в структуре смертности от злокачественных опухолей рак толстой кишки занимает 3-е место у мужчин (после рака легкого и рака желудка) и 2-е место среди женщин (после рака молочной железы). Заболевание наблюдают преимущественно у пожилых людей (риск развития рака толстой кишки у лиц старше 40 лет удваивается каждые 10 лет).
ЭТИОЛОГИЯ
Основные факторы риска рака толстой кишки следующие. • Увеличение в рационе количества жиров, особенно животного происхождения, и недостаток клетчатки (основная причина высокой заболеваемости раком толстой кишки в развитых странах). - Механизм действия жиров на процесс канцерогенеза в толстой кишке связан с их влиянием на метаболизм кишечной флоры и концентрацию вторичных жирных кислот, которые служат стимуляторами канцерогенеза. Кроме того, жиры стимулируют образование в толстой кишке фекапентанов - веществ, обладающих мутагенным действием. В процессе переработки жиров в кишечнике образуются фекальные стеролы, некоторые из них играют ключевую роль в пролиферации эпителия толстой кишки.
- Дефицит пищевых волокон приводит к замедлению транзита кишечного содержимого и увеличению времени контакта слизистой оболочки кишки с токсическими веществами. Кроме того, овощи и фрукты содержат вещества, которые в эксперименте угнетают развитие опухолей [естественные антиоксиданты (витамины С, Е, р-каротин, селен), витамин А, фолиевую кислоту, а также фитоэстрогены (изофлавоноиды), флавоноиды и т.д.].
• Ожирение. Риск рака толстой кишки возрастает практически линейно при увеличении индекса массы тела. При индексе массы тела более 30 кг/м2 риск развития рака толстой кишки в 1,5-2 раза выше, чем при индексе менее 23 кг/м2.
• Язвенный колит и болезнь Крона (риск развития рака толстой кишки у больных более чем в 10 раз выше, чем в общей популяции).
• Возможность наследственной передачи. Подтверждается наличием семейных полипозных синдромов и возрастанием (в 3-5 раз) риска развития колоректального рака среди родственников первой степени родства, больных карциномой или полипами.
Чаще всего аденокарцинома развивается на фоне существующих аденоматозных полипов (цепочка «полип-дисплазия-рак»). Процесс малигнизации от нормальной ткани через стадию аденомы до стадии рака продолжается примерно 3-5 лет.
КЛАССИФИКАЦИЯ
Классификация аденокарциномы толстой кишки основывается на степени дифференцировки клеток. Выделяют высоко-, низко- и недифференцированную (анапластическую) аденокарциному.
КЛИНИЧЕСКАЯ КАРТИНА
Симптомы рака толстой кишки неспецифичны и зависят от размеров и локализации опухоли. Наиболее часто опухоль расположена в левых отделах толстой кишки [прямой кишке (60%), сигмовидной кишке (20%), нисходящей ободочной кишке, селезеночном изгибе]. Реже рак толстой кишки развивается в правых отделах (слепой кишке, восходящей ободочной кишке, печеночном изгибе). Большинство пациентов обращаются к врачу в связи с изменением стула (запором, диареей либо их чередованием), выделением крови во время акта дефекации, изменением формы каловых масс.
• Запор чаще возникает при поражении левой половины толстой кишки. Чередование запора и диареи свидетельствует о значительном уменьшении просвета кишки. При левосторонней локализации возможны явления частичной кишечной непроходимости, «лентообразный» или «овечий» кал, на поверхности которого могут быть прожилки крови. Для рака прямой кишки характерны выделение крови, не смешанной с каловыми массами, гноя (при распаде опухоли); ложные позывы с выделением только крови или слизи с кровью; недержание газов и каловых масс (при вовлечении в процесс сфинктеров заднего прохода).
• Для опухолей правой половины толстой кишки характерны раннее развитие общей слабости и железодефицитной анемии, боли в правой половине живота (правой подвздошной области, правом подреберье); кишечная непроходимость развивается на поздних стадиях (обычно при локализации опухоли в области печеночного изгиба).
ДИАГНОСТИКА
• Ректальное пальцевое исследование в большинстве случаев позволяет обнаружить опухоль прямой кишки.
• Ректороманоскопия эффективна для выявления опухолей прямой и сигмовидной кишки.
• Колоноскопия позволяет обнаружить опухоль любого отдела толстой кишки и получить материал для гистологического исследования. Исследование рекомендуют проводить всем больным с кишечным кровотечением (для обнаружения его источника), полипами, с отягощенным семейным анамнезом.
• Ирригоскопия позволяет выявить такие признаки рака толстой кишки, как дефекты наполнения неправильной формы (при экзофитных опухолях), ригидность стенки кишки (при ее прорастании опухолью), сужение просвета кишки.
• УЗИ (в том числе трансректальное) и КТ брюшной полости проводят для уточнения распространенности и операбельности опухоли, а также для выявления метастазов.
ЛЕЧЕНИЕ
Хирургическое лечение может быть радикальным и паллиативным. При радикальной операции проводят резекцию кишки с одномоментным удалением регионарных лимфатических узлов и одиночных печеночных и легочных метастазов. Паллиативные операции направлены на
наложение обходных анастомозов или противоестественного заднего прохода. Тактика определяется локализацией и стадией опухоли. Оперативное лечение при необходимости дополняют лучевой и химиотерапией.
ПРОГНОЗ
Прогноз зависит от распространенности опухоли и ее гистологического типа. При высокодифференцированных опухолях прогноз более благоприятный, чем при низкодифференцированных.
42.12. СИНДРОМ РАЗДРАЖЕННОГО КИШЕЧНИКА
Синдром раздраженного кишечника - функциональное заболевание, для которого характерна устойчивая совокупность кишечных симптомов при отсутствии симптомов тревоги и органических заболеваний. В соответствии с Римскими критериями II, синдром раздраженного кишечника диагностируют при болях и/или дискомфорте в животе, которые проходят после акта дефекации, сопровождаются изменением частоты и консистенции стула и сочетаются не менее чем с двумя стойкими симптомами нарушения функции кишечника:
• изменением частоты стула (чаще 3 раз в день или реже 3 раз в неделю);
• изменением консистенции кала (жидкий, твердый);
• изменением акта дефекации;
• императивными позывами;
• чувством неполного опорожнения кишечника;
• необходимостью дополнительных усилий при дефекации;
• выделением слизи с калом;
• вздутием живота, метеоризмом;
• урчанием в животе.
Эти расстройства должны продолжаться не менее 12 нед на протяжении последних 12 мес. В патологический процесс вовлекается преимущественно толстая кишка.
ЭПИДЕМИОЛОГИЯ
Синдром раздраженного кишечника - широко распространенное заболевание. Его симптомы встречаются у 14-30% всего населения. За врачебной помощью обращается только одна треть пациентов. Женщины болеют в 2-4 раза чаще, чем мужчины. После 50 лет соотношение
мужчины/женщины выравнивается и становится близким к 1:1. Пик заболеваемости приходится на 30-40 лет, возможность развития синдрома раздраженного кишечника после 60 лет сомнительна.
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
Пусковой фактор, повлекший нарушение функций толстой кишки, удается выявить не во всех случаях.
• В развитии заболевания большое значение имеют тип личности (истерические, агрессивные реакции, депрессия, навязчивость, канцерофобия, ипохондрические проявления), психоэмоциональные стрессовые факторы, приводящие к изменению порога чувствительности висцеральных рецепторов стенки кишки и влияющие на двигательную функцию кишечника.
• Важную роль играют нарушения двигательной функции кишечника. У больных с синдромом раздраженного кишечника обнаруживают расстройства базальной двигательной функции кишечника, неадекватное ее усиление после приема пищи и нейрогуморальной стимуляции.
• У большинства больных с синдромом раздраженного кишечника определяют снижение порога болевой чувствительности кишки (висцеральную гипералгезию). Условием формирования повышенной висцеральной чувствительности могут быть предрасполагающие факторы (перенесенные кишечные инфекции, психоэмоциональный стресс и т.д.)
Нарушения моторики кишечника при синдроме раздраженного кишечника могут возникать как по гипер-, так и по гиподинамическому типу, причем они могут чередоваться. Расстройства секреторной функции проявляются повышенной секрецией воды и электролитов в просвет кишки, что обусловлено влиянием биологически активных веществ и бактериальных токсинов.
КЛИНИЧЕСКАЯ КАРТИНА
Жалобы и объективное обследование
Основные жалобы пациентов с синдромом раздраженного кишечника - боль в животе, нарушения стула и метеоризм.
• Боли в животе могут быть различного характера - от тупых, давящих, распирающих до нестерпимых схваткообразных. Обычно локализуются в боковых и/или нижних отделах живота, в левом и правом подреберьях (синдром печеночного и селезеночного углов)
с иррадиацией в соответствующие половины грудной клетки. Возникновение болей связано с приемом пищи, стрессом, физической нагрузкой. Боли уменьшаются или исчезают после акта дефекации или отхождения газов. Особенность болевого синдрома - возникновение болей в утренние или дневные часы (при активности больного) и стихание во время сна, отдыха.
• Нарушения стула могут проявляться как диареей, так и запором, а также их чередованием.
- Для синдрома раздраженного кишечника с преобладанием запоров характерно наличие фрагментированного, «овечьего» кала. Позывы к дефекации сохранены, стул может быть даже ежедневным, с отхождением 1-3 плотных комочков кала без чувства полного опорожнения кишечника.
- При диарее частота стула составляет 3-5 раз в день с выделением небольшого количества кала. Диарея может быть вызвана приемом пищи (гастроколитический рефлекс) или стрессом («медвежья болезнь»). Диарея отсутствует в ночное время и обычно возникает утром, после завтрака. Позывы на дефекацию могут носить императивный характер, что объясняется не только усилением двигательной функции кишечника, но и повышенным газообразованием. При первом акте дефекации стул может быть оформленным, при последующих - кашицеобразным или жидким. Общая масса кала в течение суток составляет не более
200 г.
• Метеоризм и вздутие живота - следствие дисбактериоза с развитием бродильных и гнилостных процессов в кишечнике.
• При объективном обследовании обнаруживают болезненность при пальпации всех отделов ободочной кишки, спазмированную плотную сигмовидную кишку, вздутую урчащую слепую кишку.
• Течение заболевания многолетнее, без прогрессирования. Выделяют 3 варианта течения синдрома раздраженного кишечника: с преобладанием болей в животе и метеоризма, с преобладанием диареи и с преобладанием запоров. Общее состояние больных обычно хорошее и не соответствует многочисленным жалобам (сочетание болей в животе и кишечных расстройств с головными болями, нарушениями сна, учащением мочеиспускания и т.д.). Характер жалоб изменчив, прослеживается связь ухудшения самочувствия с психоэмоциональными факторами. Типичным для синдрома раздраженного кишечника считают отсутствие симптомов в ночное время.
ДИАГНОСТИКА
Лабораторные и инструментальные исследования
• Общий анализ крови и биохимические показатели в пределах нормы. При исследовании кала могут быть обнаружены признаки дисбактериоза.
• При рентгенологическом исследовании (ирригоскопии) обнаруживают типичные признаки дискинезии: неравномерное наполнение и опорожнение кишечника, чередование спастически сокращенных и расширенных участков и/или избыточную секрецию жидкости в просвет кишечника.
• Эндоскопическое исследование (колоноскопию с биопсией) проводят в обязательном порядке для исключения органической патологии, так как только морфологическое исследование биоптатов слизистой оболочки кишки позволяет в конечном итоге отличить синдром раздраженного кишечника от воспалительных поражений кишечника.
• УЗИ органов брюшной полости позволяет исключить желчнокаменную болезнь, кисты и кальцинаты в поджелудочной железе, объемные образования.
• ФЭГДС с биопсией слизистой оболочки тонкой кишки проводят для исключения целиакии.
Синдром раздраженного кишечника диагностируют методом исключения. Предварительный диагноз ставят на основании Римских критериев II (Рим, 1999), а окончательный - после исключения органической патологии. Особое внимание следует обращать на так называемые симптомы тревоги, к которым относят:
• немотивированное снижение массы тела;
• дебют заболевания в пожилом возрасте;
• симптоматику в ночное время;
• рак кишечника у родственников;
• постоянные интенсивные боли в животе как единственный и ведущий симптом поражения ЖКТ;
• лихорадку;
• снижение концентрации гемоглобина;
• лейкоцитоз;
• повышение СОЭ;
• изменения в биохимическом анализе крови;
• наличие скрытой крови в кале.
При обнаружении хотя бы одного из этих симптомов диагноз синдрома раздраженного кишечника следует поставить под сомнение.
Дифференциальная диагностика
Синдром раздраженного кишечника необходимо дифференцировать от стриктур кишечника различного происхождения (в результате воспалительных заболеваний кишечника, в исходе дивертикулита, ишемического генеза и др.), новообразований толстой кишки, побочных эффектов ЛС (опиатов, блокаторов медленных кальциевых каналов, диуретиков, анестетиков, миорелаксантов, холиноблокаторов), эндокринных расстройств (гипотиреоза, гиперпаратиреоза). Кроме того, симптомы, напоминающие синдром раздраженного кишечника, возможны при физиологических состояниях у женщин (беременности, климаксе), при употреблении некоторых продуктов (алкоголя, кофе, газообразующих продуктов, жирной пищи), изменении привычного образа жизни (например, в командировке).
• У пациентов с преобладанием в клинической картине запоров необходимо исключать обструкцию толстой кишки, в первую очередь опухолевой природы. Особенно это актуально у пациентов старше 45 лет, а также у больных более молодого возраста в дебюте заболевания, при выраженных или рефрактерных к лечению симптомах или при наличии в семейном анамнезе случаев рака толстой кишки.
• При преобладании в симптоматике диарейного синдрома необходимо исключить:
- воспалительные заболевания кишечника: болезнь Крона, язвенный колит;
- инфекционные заболевания, вызванные Giardia lamblia, Entamoeba histolytica, Salmonella spp., Campylobacter spp., Yersinia spp., Clostridium difficile), паразитарные инвазии;
- побочные эффекты ЛС (антибиотиков, препаратов калия, желчных кислот и др.), злоупотребление слабительными средствами;
- синдром мальабсорбции при спру, дисахаридазной (в том числе лактазной) недостаточности;
- гипертиреоз, карциноидный синдром, медуллярный рак щитовидной железы и синдром Золлингера-Эллисона;
- другие причины диареи: постгастрэктомический синдром, энтеропатию, ассоциированную с ВИЧ-инфекцией, эндокринную опухоль ЖКТ, аллергическую гастроэнтеропатию и др.
• При преобладании в клинической картине болевого синдрома нужно исключить следующие заболевания:
- частичную обструкцию тонкой кишки;
- болезнь Крона;
- ишемический колит;
- хронический панкреатит;
- лимфому ЖКТ;
- эндометриоз (симптомы обычно ассоциированы с менструациями);
- заболевания желчевыводящих путей.
В дифференциальной диагностике ведущее значение имеют результаты колоноскопии с биопсией.
ЛЕЧЕНИЕ
Цели лечения при синдроме раздраженного кишечника: воздействие на психоэмоциональную сферу, коррекция нарушенных кишечных функций, купирование болевого синдрома. Лечение проводят в амбулаторных условиях, госпитализации подлежат больные, нуждающиеся в углубленном обследовании для уточнения диагноза.
Немедикаментозное лечение
До назначения любых ЛС необходимо проведение обширного комплекса мероприятий, направленных на модификацию диеты, устранение воздействия стрессовых факторов, информирование пациента, установление доверительных взаимоотношений между пациентом и врачом (в том числе и с психотерапевтом), психотерапевтическое воздействие с объяснением причин заболевания и возможных путей его устранения.
• Пациента следует убедить в том, что выявленные симптомы заболевания не представляют опасности для жизни и не обусловлены серьезной органической патологией. Нужно объяснить больному, что с помощью несложных психологических приемов он способен контролировать возникновение проявлений заболевания (например, не допускать чувства гнева, поскольку последний вызывает у пациентов с синдромом раздраженного кишечника спастические сокращения толстой кишки).
• В процессе расспроса и дальнейшей беседы необходимо сфокусировать внимание пациента на большей значимости именно депрессивных эмоциональных переживаний (к которым обычно пациент адаптируется и не замечает их), чем непосредственно болевых ощущений и дискомфорта в животе.
• Особенно важно выяснение провоцирующих факторов, например стрессов и психологических нарушений, и по возможности их устранение.
• Необходимы полноценный режим труда и отдыха, адекватные, но не чрезмерные физические нагрузки.
• Назначают диету с исключением некоторых продуктов. Чаще всего больные плохо переносят молоко, газированные напитки, животные жиры, капусту (в том числе цветную и брокколи), бобовые, алкоголь. Употребление газированных напитков и прием напитков через соломинку, использование жевательной резинки приводят к аэрофагии и могут провоцировать развитие симптоматики.
- Больным с запором рекомендуют потребление большого количества растительной клетчатки в виде нерафинированных продуктов, овощей и фруктов, морской капусты, хлеба с отрубями, введение в рацион пищевых волокон в виде отрубей в возрастающих дозах.
- При наличии диареи следует убедиться, что у больного нет лактазной недостаточности и он не употребляет большого количества кофеина, фруктозы, сорбитола и слабительных средств (в том числе растительного происхождения, входящих во многие биологические добавки к пище).
Медикаментозное лечение
• Болевой синдром при синдроме раздраженного кишечника, как правило, связан с повышением тонуса гладкой мускулатуры кишечника, поэтому для его купирования обычно применяют спазмолитики (дротаверин по 2 таблетки 3-4 раза в день, мебеверин по 200 мг 2 раза в день, пинаверия бромид по 50 мг 3 раза в день), в ряде случаев в сочетании с седативными ЛС.
• Для купирования диареи применяют лоперамид по 4 мг после первого жидкого стула, затем - по 2 мг после каждого жидкого стула (но не более 16 мг/сут). При приеме лоперамида частота стула должна быть не более 3 раз в сутки. При отсутствии стула или нормальном стуле в течение 12 ч лечение следует прекратить. Возможно применение адсорбентов (карбоната кальция, активированного угля, смектита диоктаэдрического).
• При запоре и неэффективности обогащения рациона растительными волокнами применяют мягкие осмотические слабительные, например, лактулозу в дозе 30-50 мл/сут либо подорожника се-
менную кожуру по 2-6 пакетиков в день. Препараты на основе сенны, фенолфталеина следует исключить, поскольку они могут вызвать усиление симптоматики. При неэффективности указанных ЛС дополнительно назначают прокинетики. • Для уменьшения выраженности метеоризма применяют симетикон по 2 капсулы 3 раза в день.
Психотерапия
Особое место занимает коррекция психопатологических нарушений. Применяют различные способы психотерапии в сочетании с антидепрессантами, транквилизаторами в зависимости от вида психопатологического синдрома. Эти препараты не уменьшают выраженности болевого синдрома, однако улучшают качество жизни. Лечение проводят совместно с психотерапевтом.
Глава 43. ЗАБОЛЕВАНИЯ ПЕЧЕНИ, ЖЕЛЧНОГО ПУЗЫРЯ И ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
43.1. ХРОНИЧЕСКИЙ ГЕПАТИТ
Термином «хронический гепатит» объединена группа заболеваний печени, которые вызваны различными причинами, характеризуются различной степенью выраженности печеночного некроза и воспаления (в инфильтрате преобладают лимфоциты и макрофаги) и протекают без улучшения в течение 6 мес и более.
ЭПИДЕМИОЛОГИЯ
Хронические гепатиты вирусной этиологии диагностируют у 5% взрослого населения.
Аутоиммунным гепатитом заболевают преимущественно женщины (соотношение мужчин и женщин - 1:3,6), чаще в возрасте 10-30 лет и в период постменопаузы.
Распространенность хронического алкогольного гепатита неизвестна.
КЛАССИФИКАЦИЯ
Классификация болезней печени и хронических гепатитов разработана Международной рабочей группой и поддержана Всемирным конгрессом гастроэнтерологов в Лос-Анджелесе (1994).
• Вирусные заболевания печени:
- острый вирусный гепатит;
- хронический вирусный гепатит;
- цирроз печени.
• Алкогольная болезнь печени:
- алкогольный стеатоз печени;
- алкогольный гепатит острый и хронический;
- алкогольный цирроз печени.
• Лекарственные поражения печени.
• Аутоиммунные заболевания печени.
• Изменения печени при нарушениях обмена веществ.
• Опухоли печени.
• Изменения печени при других заболеваниях и патологических состояниях.
Хронические гепатиты классифицируют по этиологическому признаку.
• Хронический вирусный гепатит В.
• Хронический вирусный гепатит С.
• Хронический вирусный гепатит D.
• Аутоиммунный гепатит.
• Хронический вирусный гепатит неуточненной этиологии - воспалительное заболевание печени, длящееся 6 мес и более и вызванное неизвестным вирусом.
• Хронический гепатит, не классифицируемый как вирусный или аутоиммунный, - воспалительное заболевание печени, длящееся 6 мес и более, имеющее черты вирусного и/или аутоиммунного гепатита, но при котором невозможно точно установить этиологический фактор.
• Хронический лекарственный гепатит.
• Первичный билиарный цирроз.
• Первичный склерозирующий холангит.
• Поражение печени при болезни Вильсона-Коновалова.
• Поражение печени при недостаточности а1-антитрипсина. Отсутствие алкогольного гепатита в классификации хронических
гепатитов обусловлено тем, что некоторые ученые относят хронический алкогольный гепатит к алкогольной болезни печени и не рассматривают его как хронический гепатит. Первичный билиарный цирроз, первичный склерозирующий холангит, поражение печени при болезни Вильсона-Коновалова и недостаточности а1-антитрипсина включены в понятие «хронический гепатит» в связи с тем, что морфологические изменения при этих заболеваниях сходны с таковыми при хроническом гепатите.
43.2. ХРОНИЧЕСКИЙ ВИРУСНЫЙ ГЕПАТИТ
Хронический вирусный гепатит - персистирующее воспалительное заболевание печени, вызванное вирусами гепатита и способное привести к циррозу печени и печеночно-клеточному раку.
ЭТИОЛОГИЯ
Как уже указывалось выше, наиболее часто хронический вирусный гепатит вызывается вирусами гепатитов В, С, D. Вирусы гепатита ха-
рактеризуются значительной генетической вариабельностью и способностью к мутациям, что отражается на клинической картине, течении болезни и эффективности лечения.
Участие других вирусов гепатита (TTV, SEN, HGV) и герпес-группы (Эпстайна-Барр, простого герпеса, цитомегаловируса) в развитии хронического гепатита не доказано.
ЭПИДЕМИОЛОГИЯ
Вирус гепатита В - причина хронического гепатита, который развивается у 1-5% взрослых. Ежегодно в мире от заболеваний печени, обусловленных вирусом гепатита В, умирает около 1 млн человек. Число инфицированных вирусом гепатита В лиц в мире достигает 400 млн человек. Частота инфицирования варьирует в различных регионах мира: от 0,5-2% в США и Западной Европе до 10-15% в Юго-Восточной Азии и Африке. В России инфицированность населения вирусом гепатита В составляет около 5%.
Хронический гепатит С развивается в результате инфицирования вирусом гепатита С. После попадания в организм вируса хроническая инфекция развивается в 60-80% случаев, число инфицированных лиц в мире достигает 200 млн человек. Частота инфицирования значительно колеблется (от 0,3 до 14,5%), в России она составляет 0,7-1,2%.
Вирус гепатита D - дефектный вирус, который обладает патогенностью только в сочетании с вирусом гепатита В. Поражение печени развивается:
• при коинфицировании вирусами гепатитов В и D (когда оба вируса одновременно попадают в организм);
• суперинфицировании вирусом гепатита D (когда вирус гепатита D «наслаивается» на уже существующую в организме хроническую инфекцию, вызванную вирусом гепатита В).
При коинфекции хронический гепатит D развивается в 5-10% случаев, при суперинфицировании - в 90% случаев. Число инфицированных вирусом гепатита D в мире составляет около 10-20 млн (больше на Ближнем и Дальнем Востоке, в Южной Европе).
Основной механизм передачи вирусов гепатитов В, С и D - парентеральный. Заражение происходит при переливании крови, парентеральном введении наркотических средств, татуаже, контакте с инфицированными медицинскими инструментами. Для вируса гепатита В также характерны половой и перинатальный пути инфицирования.
ПАТОГЕНЕЗ
Повреждение печени при хроническом вирусном гепатите обусловлено иммуноопосредованным лизисом инфицированных гепатоцитов, экспрессирующих вирусные Аг на своей поверхности. Сила и степень выраженности иммунного ответа зависят как от характера инфицирования (инфицирующей дозы, механизма заражения, генотипа и генетической вариабельности вируса), так и от состояния макроорганизма (от пола, возраста, этнической принадлежности, иммуногенетических особенностей организма). При хроническом вирусном гепатите вследствие неполноценности и/или дефекта, прежде всего Т-клеточного звена иммунной системы, макроорганизм не способен элиминировать вирус или контролировать его активность, что приводит к хронизации патологического процесса. Развивающееся хроническое иммунное воспаление стимулирует процессы фиброгенеза в печени и может привести к циррозу и печеночно-клеточному раку.
При хронических гепатитах С и D предполагают наличие прямого цитопатического действия вируса.
Установление факта возможной внепеченочной репликации вирусов гепатита способствовало пониманию патогенеза многосистемности поражения при хроническом вирусном гепатите. Хронический вирусный гепатит - не только инфекционное заболевание печени, но и системная вирусная инфекция. Выделяют 2 патогенетических механизма развития внепеченочных поражений при хронических вирусных гепатитах:
• иммунокомплексный - обусловливает развитие васкулитов в результате повреждающего действия циркулирующих иммунных комплексов, содержащих Аг вируса и AT к ним;
• цитотоксический - обусловлен реакциями гиперчувствительности замедленного типа.
КЛИНИЧЕСКАЯ КАРТИНА
Хронический вирусный гепатит, как правило, имеет латентное течение. Первые симптомы заболевания часто появляются спустя годы или десятилетия после инфицирования, нередко на стадии цирроза печени или печеночно-клеточного рака. Длительное время основными и единственными жалобами могут быть общая слабость и быстрая утомляемость - проявления астенического синдрома.
К другим признакам заболевания относят артралгии, отсутствие аппетита и постоянные боли в правом подреберье. Появление желтухи, асцита, кровоподтеков при незначительных травмах, продолжительных
кровотечений при мелких повреждениях кожи обычно свидетельствует о нарушении функций печени в результате развития терминальной стадии заболевания - цирроза печени.
При хроническом вирусном гепатите в 15-40% случаев наблюдают различные внепеченочные поражения. В ряде случаев внепеченочные проявления заболевания могут задолго опережать признаки поражения печени и, таким образом, затруднять диагностику болезни. При хроническом гепатите В могут развиться узелковый полиартериит и хронический гломерулонефрит, а при хроническом гепатите С - артралгии, артриты, сосудистая пурпура и мезангиокапиллярный нефрит, обусловленные смешанной криоглобулинемией. Криоглобулины - циркулирующие иммунные комплексы, которые in vitro при низкой температуре выпадают в осадок. Клинические проявления криоглобулинемии: прогрессирующая общая слабость, кожная пурпура и артралгии (триада Мельтцера) - обусловлены васкулитом мелких сосудов. В настоящее время инфекцию вируса гепатита С считают основным этиологическим фактором криоглобулинемии (до 80% случаев). При хроническом гепатите С криоглобулины обнаруживают у 30-50% больных, а у 10-20% из них развиваются клинические проявления криоглобулинемии. Наиболее тяжелое из них - мезангиокапиллярный нефрит.
В последние годы обсуждают роль вируса гепатита С в развитии опухолей, в частности, В-клеточной лимфомы. Криоглобулинемия - фактор риска развития злокачественной лимфопролиферации. Кроме того, при хроническом вирусном гепатите описано развитие сухого кератоконъюнктивита (синдрома Шёгрена), синдрома Рейно, миокардита, полимиозита, красного плоского лишая, поздней кожной порфирии и других внепеченочных проявлений.
ДИАГНОСТИКА
Лабораторные и инструментальные исследования
• Основные лабораторные изменения при хроническом вирусном гепатите связаны с развитием цитолитического синдрома. Он проявляется повышением активности печеночных ферментов (прежде всего, ACT и АЛТ) и концентрации билирубина в сыворотке крови, которые высвобождаются при некрозе гепатоцитов. У 25-35% больных хроническим гепатитом С показатели активности АЛТ и ACT могут быть нормальными. Для хронического гепатита D в 50-60% случаев характерна высокая активность аминотрансфераз в сыворотке крови (превышающая норму в 5-10 раз). Стойкая
гипербилирубинемия (за счет прямой фракции), как правило, сочетается с признаками нарушения синтетической функции печени (гипоальбуминемией, снижением активности холинэстеразы в сыворотке крови, увеличением протромбинового времени) и возникает только на стадии декомпенсированного цирроза печени.
• При хроническом вирусном гепатите повышается содержание у-глобулинов в сыворотке крови. Значимое увеличение концентрации а-фетопротеина в сыворотке крови (>100 мкг/л при норме 0-10 мкг/л) может указывать на развитие печеночно-клеточного рака.
• Лабораторные признаки криоглобулинемии включают высокий титр ревматоидного фактора, снижение комплемента (особенно концентрации С4-компонента) и обнаружение самих криоглобулинов в крови.
• Определение этиологии хронического вирусного гепатита основано на выявлении в крови Аг вируса и AT к ним методом ИФА и обнаружении генетического материала вируса (ДНК при хроническом гепатите В и РНК при хроническом гепатите С и хроническом гепатите D) в крови с помощью ПЦР.
- Сывороточные маркеры хронического гепатита В представлены ниже.
- HBSAg - основной скрининговый маркер вируса гепатита В,
сохранение его в крови более 6 мес указывает на хронизацию инфекционного процесса.
- HBEAg - маркер репликации вируса, который присутствует почти у всех ДНК-позитивных больных, за исключением лиц, инфицированных штаммами вируса гепатита В с мутациями в области рге-С/С промоутера.
- AT к HBCAg класса IgM выявляют при активной инфекции. AT
к HBCAg класса IgG обнаруживают у лиц, имевших контакт с вирусом, они могут сохраняться в течение всей жизни, свидетельствуя либо о перенесенном заболевании, либо о хронической инфекции.
- ДНК вируса гепатита В - основной показатель репликации вируса. В настоящее время выделяют 8 основных генотипов вируса гепатита В (А, В, С, D, E, F, G, Н), которые имеют различное географическое распределение и могут определять течение и прогноз болезни. Последние достижения молекулярной биологии выявили значительную подверженность ге-
нома вируса гепатита В мутациям, что связано, прежде всего, с высокой скоростью репликации вируса. Одна из наиболее распространенных мутаций генома вируса гепатита В приводит к нарушению синтеза HBEAg и развитию HBEAgнегативной формы хронического гепатита В.
- При хроническом гепатите С основное значение придают выявлению в крови AT к различным белкам вируса и его РНК, которая указывает на хроническое течение инфекции. Выделяют 6 основных генотипов вируса гепатита С и множество подтипов. Наиболее часто в России, Европе и США обнаруживают 1, 2 и 3-й генотипы. Определение генотипа необходимо проводить в целях решения вопроса о длительности и возможной эффективности лечения.
- При хроническом гепатите D в крови обнаруживают AT к Аг вируса (класса IgM) и РНК вируса гепатита D.
• Морфологическое изучение биоптата печени играет решающую роль в определении степени активности воспаления и выраженности фиброза в печени. Кроме того, в ряде случаев обнаруживают прямые тканевые признаки хронического гепатита В («матовостекловидные» гепатоциты, которые содержат HBSAg) и косвенные признаки хронического гепатита С (скопление лимфоцитов в портальных трактах по типу лимфоидных фолликулов). В настоящее время для оценки выраженности морфологических изменений используют полуколичественные (ранговые) методы определения активности процесса (индекс гистологической активности) и стадии процесса (индекс фиброза). Впервые метод предложил Р.Г. Кноделль в 1981 г. В настоящее время существует ряд подобных методик, адаптированных для хронического вирусного гепатита, в частности, шкала METAVIR (табл. 43-1, 43-2).
Таблица 43-1. Индекс гистологической активности по шкале METAVIR
Таблица 43-2. Индекс фиброза по шкале METAVIR
ЛЕЧЕНИЕ
Основу лечения хронического вирусного гепатита составляет противовирусная терапия, направленная на элиминацию вируса и подавление вызванного им воспалительного процесса, что предотвращает прогрессирование болезни до терминальных стадий - цирроза печени и его осложнений. Критерии успешного лечения:
• стойкая элиминация вируса из крови;
• нормализация активности аминотрансфераз;
• улучшение гистологической картины в печени.
Этиологией хронического вирусного гепатита определяется выбор противовирусного ЛС.
• При хроническом гепатите В показаны следующие ЛС:
- α-интерферон, обладающий преимущественно иммуностимулирующим действием, применяют в дозе 5 млн ЕД ежедневно или 10 млн ЕД 3 раза в неделю в виде внутримышечных или подкожных инъекций. При хроническом HBEAg-позитивном варианте лечение проводят в течение 4-6 мес, при HBEAgнегативном - 12 мес. Эффективность лечения составляет 1535%. Кроме того, в последние годы применяют пегилированные формы а-интерферона (пегинтерферон-а-2а в дозе 180 мкг/нед
и пегинтерферон-а-2b в дозе 1,5 мг/кг), которые вводят подкожно раз в неделю в течение 12 мес; - нуклеозидные аналоги - препараты с прямым противовирусным действием, которые подавляют репликацию вируса: ламивудин в дозе 100 мг/сут, телбивудин в дозе 600 мг/сут или энтекавир в дозе 0,5 мг/сут внутрь. Длительность лечения при HBEAg-позитивном гепатите В - до наступления сероконверсии HBEAg (исчезновения HBEAg и появления anti-HBE) и затем еще в течение 6-12 мес, при HBEAg-негативном гепатите В - длительная терапия ( ≥2-3 лет).
• При хроническом гепатите С стандартом лечения служит комбинация пролонгированной формы интерферона - пегинтерферон-а, который вводят 1 раз в неделю, и нуклеозидного аналога рибавирина, который принимают внутрь в дозе 12-15 мг/кг ежедневно. Длительность лечения при 1-м и 4-м генотипах составляет 12 мес (эффективность - 40-60%), а при 2-м и 3-м - 6 мес (эффективность достигает 70-90%).
• При хроническом гепатите D показаны высокие дозы интерферона (5-10 млн ЕД ежедневно или через день) в течение года и более. Эффективность лечения составляет менее 15%.
Лечение а-интерфероном сопровождается нежелательными явлениями (гриппоподобным синдромом, кожной сыпью, астенией, цитопенией, депрессией, аутоиммунными нарушениями), большинство из которых имеет преходящий характер и разрешается при отмене препарата. Основное нежелательное явление при приеме рибавирина - гемолиз, приводящий к развитию анемии. Беременность - абсолютное противопоказание к противовирусной терапии интерфероном и рибавирином. На фоне лечения ламивудином может развиваться устойчивость к препарату, обусловленная появлением мутантных штаммов вируса гепатита В, что приводит к рецидиву заболевания.
При синдроме холестаза в сочетании с противовирусными препаратами можно применять урсодезоксихолевую кислоту в дозе 10-15 мг/кг внутрь 2-3 раза в сутки.
ПРОГНОЗ
При хронических гепатитах В и С цирроз печени развивается у 2025% больных в течение 20-40 лет. При дополнительных факторах, повреждающих печень (коинфекциях другими вирусами, злоупотреблении алкоголем, иммуносупрессиях, стеатозах печени), частота и скорость
развития цирроза увеличиваются в 2-3 раза. При хроническом гепатите D заболевание прогрессирует значительно быстрее и цирроз печени развивается в 60-80% случаев. Вирусы гепатита наряду с алкоголем служат основными этиологическими факторами печеночно-клеточного рака. На стадии декомпенсированного цирроза печени (асцита, печеночной энцефалопатии, желудочно-кишечного кровотечения, печеночной недостаточности) 5-летняя выживаемость без трансплантации печени не превышает 15-20%. Успешная противовирусная терапия (особенно на стадии хронического гепатита) снижает риск развития цирроза печени и осложнений.
43.3. АУТОИММУННЫЙ ГЕПАТИТ
Аутоиммунный гепатит - прогрессирующее заболевание неизвестной этиологии, проявляющееся воспалением печени, наличием в крови различных аутоантител и высокой концентрации γ-глобулинов.
ЭПИДЕМИОЛОГИЯ
Заболеваемость аутоиммунным гепатитом в разных регионах мира варьирует от 1,9 до 16,9 на 100 000 населения.
Хотя заболевание регистрируют во всех возрастных группах, тем не менее наиболее высокую частоту аутоиммунного гепатита отмечают у лиц в возрасте 40-60 лет и в пубертатном периоде. Женщины болеют в 3,6 раза чаще мужчин.
ПАТОГЕНЕЗ
Основную роль отводят генетической предрасположенности, реализующейся под воздействием триггерных Аг - вирусов, ЛС и других факторов окружающей среды.
КЛАССИФИКАЦИЯ
На основании спектра аутоантител выделяют аутоиммунный гепатит:
• I типа (антиядерные AT, AT к гладкой мускулатуре);
• II типа (AT к печеночно-почечным микросомам);
• III типа (AT к растворимому печеночному АГ).
КЛИНИЧЕСКАЯ КАРТИНА
Начало заболевания может быть острым и даже фульминантным, напоминая картину острого вирусного или токсического гепатита. В 38%
случаев аутоиммунный гепатит сочетается с другими аутоиммунными заболеваниями (например, аутоиммунным тиреоидитом, язвенным колитом, болезнью Грейвса, артритами). В 25% случаев аутоиммунный гепатит длительно протекает без клинических проявлений, и его выявляют только на стадии цирроза печени.
Для аутоиммунного гепатита характерны следующие лабораторные изменения:
• повышение активности аминотрансфераз (часто больше нормы в 5-10 раз);
• обнаружение антиядерного и ревматоидного факторов и LEклеток в крови;
• гиперпротеинемия и гипергаммаглобулинемия.
При морфологическом исследовании печени наиболее характерный признак аутоиммунного гепатита - наличие в перипортальном воспалительном инфильтрате плазматических клеток (однако их обнаруживают не во всех случаях) и «ступенчатых», «мостовидных» некрозов.
ДИАГНОСТИКА
Диагностика аутоиммунного гепатита основана на исключении других заболеваний печени (прежде всего, вирусного гепатита), обнаружении гипергаммаглобулинемии (прежде всего, за счет IgG), гиперпротеинемии и различных аутоантител.
ЛЕЧЕНИЕ
Иммуносупрессия - основной метод лечения аутоиммунного гепатита.
• Монотерапию преднизолоном проводят у беременных или женщин, планирующих беременность, а также при тяжелой цитопении.
• Сочетание преднизолона и азатиоприна предпочтительно у женщин в период постменопаузы, у больных АГ, у пациентов с сахарным диабетом, эмоциональной неуравновешенностью, ожирением, акне, остеопорозом. Длительное лечение приводит к клинико-биохимической и гистологической ремиссии заболевания примерно в 65% случаев. Как правило, ремиссия развивается через 22 мес лечения, и вероятность ее наступления в течение первых 3 лет лечения постоянно возрастает. В этот период наблюдают улучшение состояния у большинства больных (в 87% случаев). Нередко необходим пожизненный прием поддерживающих доз иммунодепрессивных ЛС.
При тяжелых, резистентных к лечению иммунодепрессантами случаях аутоиммунного гепатита, а также при далеко зашедших (декомпенсированном циррозе печени) формах заболевания показана трансплантация печени.
ПРОГНОЗ
Прогноз зависит от активности аутоиммунного гепатита (по данным биохимического и морфологического исследований). При стойком повышении активности ACT в 5-10 раз и концентрации у-глобулинов в 2 раза больше нормы 3-летняя выживаемость без лечения составляет 50%, а 10-летняя -10%. Прогноз при менее высокой активности аминотрансфераз благоприятнее: 15-летняя выживаемость превышает 80%, а риск развития цирроза печени составляет менее 50%.
43.4. АЛКОГОЛЬНАЯ БОЛЕЗНЬ ПЕЧЕНИ
В структуре причин хронического диффузного поражения печени алкоголь занимает 3-е место, уступая только вирусам гепатитов В и С. Заболевания печени, обусловленные приемом алкоголя и объединенные термином «алкогольная болезнь печени», представлены ниже.
• Алкогольный стеатоз (алкогольная жировая печень).
• Алкогольный фиброз.
• Алкогольный гепатит (острый и хронический).
• Алкогольный цирроз печени.
• Печеночно-клеточный рак.
ЭПИДЕМИОЛОГИЯ
Поражения печени и других висцеральных органов возникают лишь у 10-15% лиц, злоупотребляющих алкоголем, в то время как поражение ЦНС развивается у 85-90% из них. Пациенты с висцеральными поражениями имеют ряд особенностей хронического злоупотребления алкоголем.
• Для них характерны слабая зависимость от алкоголя и хорошая переносимость больших доз алкоголя на протяжении многих лет.
• У них отсутствуют синдром похмелья и запойное пьянство.
• Их социальный статус и хорошая работоспособность сохранены, несмотря на серьезное поражение печени.
К факторам риска развития алкогольной болезни печени относят ежедневное потребление этанола в дозе 60 г/сут и более, генетически обусловленную повышенную чувствительность к алкоголю, плохое
питание, возраст, с которого возникло злоупотребление алкоголем, женский пол, скорость метаболизма этанола в печени, сопутствующие заболевания (например, туберкулез и злоупотребление ЛС), промышленные вредности и др.
ПАТОГЕНЕЗ
При алкогольной болезни печени повреждение гепатоцитов возникает из-за прямого цитопатического действия ацетальдегида - основного метаболита этанола. Ацетальдегид - химически реактогенная молекула, способная связываться с тубулином, актином (то есть с основными белками цитоскелета гепатоцита), гемоглобином, альбумином, трансферрином, коллагеном I и II типа, цитохромом Р-450. При этом образуются стабильные соединения, способные длительно сохраняться в ткани печени, несмотря на завершение метаболизма этанола. Стабильные соединения ацетальдегида с белками внеклеточного матрикса приводят к развитию фиброза, распознаются иммунной системой как Аг и запускают иммунные механизмы, участвующие в развитии алкогольного цирроза печени. Для лиц, страдающих алкогольной болезнью печени, типичен макровезикулярный стеатоз (крупнокапельное ожирение печени). Для острого алкогольного гепатита характерна лейкоцитарная инфильтрация в центролобулярной зоне (преимущественно полиморфноядерными лейкоцитами), а также портальное воспаление (вызванное мононуклеарными клетками). Обсуждается роль апоптоза гепатоцитов в развитии заболевания.
КЛИНИЧЕСКАЯ КАРТИНА И ДИАГНОСТИКА
Существуют клинические признаки и лабораторные изменения, позволяющие предположить алкогольную природу заболевания (больные зачастую отрицают факт злоупотребления алкоголем).
У лиц с алкогольными висцеропатиями при осмотре можно выявить ряд клинических симптомов: одутловатое, отечное лицо с телеангиэктазиями на щеках, носу, подбородке - симптом «долларовой бумажки», инъекция сосудов склеры и конъюнктивы («глаза кролика»), увеличение околоушных слюнных желез («лицо хомячка»), гипергидроз кожи лица и ладоней, тремор рук, век, гинекомастию, контрактуры Дюпюитрена на ладонях, яркую ладонную эритему и эритему кожи воротниковой зоны с телеангиэктазиями и полями «сосудистых звездочек» в этой области, крупные «сосудистые звездочки» на руках, ладонях, груди и спине.
Признаки хронического злоупотребления алкоголем представлены в табл. 43-3.
Таблица 43-3. Признаки хронического злоупотребления алкоголем
При ожирении и значительной гепатомегалии предположение о систематическом употреблении алкоголя становится обоснованным, особенно если есть лабораторные признаки висцеральных поражений, характерные для злоупотребления алкоголем.
Лабораторные признаки висцеральных поражений алкогольной этиологии.
• Увеличение среднего корпускулярного объема эритроцитов (макроцитоз) более 96-100 нм.
• Повышение активности ACT до 3-5 норм (ACT > АЛТ) в сыворотке крови.
• Значительное повышение уровня ГГТП в сыворотке крови.
• Высокая концентрация десиалотрансферрина в сыворотке крови (углеводдефицитного трансферрина).
• Увеличение IgA в сыворотке.
• Гиперурикемия.
Помимо клинических признаков и лабораторных маркеров, следует отметить вовлечение других органов и систем, отличное от внепеченочных поражений при вирусных и аутоиммунных поражениях печени.
Выделяют следующие (алкогольиндуцированные) поражения.
• Алкогольную болезнь печени (стеатоз, фиброз, гепатит, цирроз, печеночно-клеточный рак).
• Алкогольный панкреатит (острый и хронический).
• Эрозивный эзофагит. Высокая частота желчнокаменной болезни, язвенной болезни желудка и двенадцатиперстной кишки.
• Алкогольное поражение почек (острое и хроническое).
• Алкогольное поражение сердца.
• Связанную с алкоголем АГ.
• Алкогольную подагру.
Суждение об алкогольной природе заболевания основывается на ряде диагностических признаков.
• Указании на злоупотребление алкоголем или наличии признаков хронического злоупотребления алкоголем.
• Значительной гепатомегалии.
• Превалирующем повышении активности ACT и ГГТП над активностью АЛТ.
• Быстром улучшении клинических признаков заболевания при воздержании от приема алкоголя.
Клиническая картина алкогольной болезни печени зависит от степени морфологических изменений печеночной ткани.
Алкогольный стеатоз
Алкогольный стеатоз (жировая дистрофия печени) - самый распространенный тип поражения печени у людей, злоупотребляющих алкоголем и имеющих висцеральные поражения (отмечается в 80% случаев). Заболевание свидетельствует о злоупотреблении алкоголем (маркер). Его считают доброкачественным, поскольку при отказе от алкоголя патологические изменения в печени обратимы. Тяжелые формы алкогольного стеатоза, особенно при сохраняющемся приеме алкоголя, могут прогрессировать вплоть до развития цирроза печени.
Больные жалуются на тошноту и рвоту по утрам (обусловлены эзофагитом), дискомфорт в животе (в связи с хроническим панкреатитом). Основной клинический признак алкогольного стеатоза - гепатомега-
лия. При пальпации печень плотная и безболезненная. При лабораторных исследованиях обнаруживают лишь незначительное повышение активности ГГТП в сыворотке крови. Диагноз уточняют на основании результатов УЗИ органов брюшной полости и биопсии печени.
Острый алкогольный гепатит (алкогольный стеатогепатит)
Острый алкогольный гепатит чаще развивается на фоне алкогольного стеатоза и манифестирует быстрым развитием признаков портальной гипертензии, а в 50% случаев - желтухой, диспепсическими жалобами, лихорадкой (табл. 43-4). У части больных отмечают признаки обострения хронического алкогольного панкреатита, развитие алкогольного гломерулонефрита, поражения сердца в виде сердечной недостаточности или аритмий. При отказе от алкоголя происходит быстрая регрессия всех проявлений алкогольного гепатита.
Таблица 43-4. Клинические признаки острого алкогольного гепатита
Лабораторные признаки острого алкогольного гепатита.
• Нейтрофильный лейкоцитоз (описаны случаи лейкемоидной реакции с повышением количества лейкоцитов до 100х109/л и более).
• Умеренная анемия, макроцитоз.
• Увеличение СОЭ до 20-80 мм/ч.
• Соотношение активности АСТ/АЛТ более 2 и значительное повышение уровня ГГТП в сыворотке крови.
• Гипербилирубинемия, гиперлипидемия, снижение протромбинового индекса.
Причины летального исхода при остром алкогольном гепатите:
• печеночная кома (56% всех случаев);
• желудочно-кишечное кровотечение (31%);
• гепаторенальный синдром (28%);
• инфекции (15%).
Прогноз зависит от концентрации билирубина в сыворотке крови (прогностически неблагоприятно повышение >20 мг%), выраженности фиброзных изменений в печени, характера ответа показателя протромбинового индекса на терапию витамином К и от прекращения приема алкоголя.
Алкогольный цирроз печени
Алкогольный цирроз печени развивается у 8-25% лиц, злоупотребляющих алкоголем. Клинические симптомы заболевания неспецифичны и приведены в табл. 43-5. Часто формируются портальная гипертензия (проявляющаяся варикозным расширением вен пищевода, желудка, верхних геморроидальных вен, асцитом, спонтанным бактериальным перитонитом), печеночная энцефалопатия, коагулопатии.
Течение патологического процесса трудно прогнозировать: у отдельных больных заболевание прогрессирует, несмотря на отказ от алкоголя (в связи с участием иммунных механизмов прогрессирования), а в ряде случаев наблюдают стойкую ремиссию после прекращения приема алкоголя. Смерть больных от алкогольного цирроза печени обычно обусловлена кровотечением из варикозно расширенных вен, инфекцией или развитием гепаторенального синдрома.
Таблица 43-5. Клинические проявления алкогольного цирроза печени
ЛЕЧЕНИЕ
Основной и действенный метод лечения алкогольной болезни печени - прекращение приема алкоголя. При алкогольном стеатозе отказ от алкоголя может привести к полному обратному развитию поражения печени.
Большое значение при остром алкогольном гепатите имеет полноценное питание (30 ккал на 1 кг массы тела и содержание белка 1 г на 1 кг массы тела) в связи с сопутствующей потерей массы тела (иногда до 15-20 кг), недостатком ряда витаминов и снижением содержания глутатиона, необходимого для метаболизма ЛС и токсинов в печени.
Медикаментозное лечение
• При тяжелом течении острого алкогольного гепатита назначают преднизолон в дозе 40 мг/сут в течение 20-30 дней. ГК подавляют иммунные реакции, участвующие в развитии алкогольного гепатита, путем торможения образования цитокинов. При остром алкогольном гепатите низкой степени активности или при осложнениях (сепсисе, кровотечениях из варикозно расширенных вен пищевода, язвенном поражении ЖКТ) ГК обычно не назначают.
• Показана эффективность пентоксифиллина - неселективного ингибитора фосфодиэстеразы, ингибирующего также продукцию фактора некроза опухоли-α (ФНО-α) - ключевого провоспалительного фермента в цитоксиновом каскаде алкогольиндуцированного повреждения печени.
• При полинейропатиях в лечение включают препараты магния и витамина В .
6
• Отчетливое улучшение клинико-биохимических показателей и гистологической картины в печени отмечают при применении урсодезоксихолевой кислоты. Этот препарат оказывает противовоспалительное действие, влияет на апоптоз гепатоцитов, обладает антифибротическим и антиоксидантным эффектами, улучшает регенерацию печени. Лечение урсодезоксихолевой кислотой в дозе 15 мг/(кг×сут) в течение 4-24 нед отчетливо улучшает клиническое течение острого алкогольного гепатита (стеатогепатита) и цирроза печени (уменьшается выраженность астенического синдрома, кожного зуда, исчезают признаки цитолитического и холестатического синдромов, улучшается гистологическая картина).
ПРОГНОЗ
Алкогольный цирроз печени развивается у 8-20% лиц, интенсивно злоупотребляющих алкоголем, с висцеральными поражениями. Прогноз алкогольной болезни печени зависит от трех основных факторов.
• Прекращения злоупотребления алкоголем.
• Тяжести поражения печени.
• Наличия дополнительных факторов, повреждающих печень, среди которых наибольшее значение принадлежит инфицированию вирусами гепатитов В и С. Лекарственные и профессиональные факторы также могут играть существенную роль в прогрессировании алкогольного поражения печени.
43.5. НЕАЛКОГОЛЬНАЯ ЖИРОВАЯ БОЛЕЗНЬ ПЕЧЕНИ
Неалкогольная жировая болезнь печени - заболевание, признаком которого является жировая дистрофия печени различной степени выраженности (от стеатоза до стеатогепатита с элементами фиброза и возможным развитием цирроза печени). Неалкогольную жировую болезнь печени рассматривают как часть метаболического синдрома.
Термин «неалкогольный стеатогепатит» используют для обозначения поражения печени у лиц, не употребляющих алкоголь в гепатоток-
сичных дозах, при наличии сходных с алкогольной болезнью печени гистологических признаков (стеатоза, лейкоцитарной инфильтрации в центролобулярной зоне).
Клиническая значимость стеатоза печени и неалкогольного стеатогепатита стала очевидной после резекций печени по поводу злокачественных новообразований: больные со стеатозом печени имели высокий риск послеоперационных осложнений. Жировая дистрофия гепатоцитов стала причиной нарушения функций печени после трансплантации.
ЭПИДЕМИОЛОГИЯ
Неалкогольной жировой болезнью печени страдают от 10 до 24% населения. Среди лиц, имеющих даже сравнительно небольшой избыток массы тела (менее чем на 10% по сравнению с нормальными показателями), неалкогольный стеатогепатит обнаруживают у 3%.
ЭТИОЛОГИЯ
Выделяют первичную и вторичную неалкогольную жировую болезнь печени.
• Первичная неалкогольная жировая болезнь печени:
- ожирение;
- сахарный диабет 2-го типа;
- гиперлипидемия.
• Вторичная неалкогольная жировая болезнь печени:
- пищевые факторы (парентеральное питание, быстрое похудение, голодание, операции на органах ЖКТ, квашиоркор);
- ЛС (ГК, эстрогены, ацетилсалициловая кислота, блокаторы медленных кальциевых каналов, амиодарон, метотрексат, тамоксифен, тетрациклин, вальпроевая кислота), кокаин;
- метаболические и генетические факторы (липодистрофия, острая жировая печень беременных, болезнь накопления эфиров холестерина, болезнь Вебера-Крисчена, дислипопротеинемия);
- другие причины (воспалительные заболевания толстой кишки, дивертикулез тонкой кишки с дисбактериозом, ВИЧ-инфекция, токсическое действие органических растворителей, производных фосфора, яда грибов и др.).
При сочетании сахарного диабета 2-го типа и выраженного ожирения у всех больных выявляют стеатоз печени, у половины - стеатогепатит, а у 19% - цирроз печени. У лиц, имеющих индекс массы тела 30 кг/м2 и более, риск развития неалкогольной жировой болезни печени
возрастает в 4,6 раза. Гипертриглицеридемия по сравнению с гиперхолестеринемией значительно увеличивает риск заболевания.
ПАТОГЕНЕЗ
Один из факторов патогенеза неалкогольной жировой болезни печени - инсулинорезистентность, способствующая накоплению свободных жирных кислот в печени за счет подавления их окисления. Инсулинорезистентность повышает липолиз, приводит к нарушению углеводного обмена, гиперинсулинемии и влияет на функцию митохондрий, способствуя апоптозу гепатоцитов. Инсулинорезистентность и гиперинсулинемия приводят к накоплению триглицеридов и других липидов в гепатоцитах.
КЛИНИЧЕСКАЯ КАРТИНА И ДИАГНОСТИКА
Заболевание развивается в возрасте 40-60 лет, чаще у женщин, хотя есть сообщения об обнаружении неалкогольной жировой болезни печени у детей и лиц молодого возраста. У большинства больных заболевание протекает незаметно и в момент выявления клинически четко не проявляется. Часть больных отмечают повышенную утомляемость, неопределенную боль или ощущение тяжести в правом подреберье. У большинства пациентов при осмотре удается обнаружить несколько увеличенную безболезненную печень. На стадии цирроза печени возникают признаки портальной гипертензии.
Лабораторные исследования
• Наиболее характерным лабораторным проявлением неалкогольной жировой болезни печени служит незначительное или умеренное повышение активности ACT и/или АЛТ в сыворотке крови (повышение активности ACT, как правило, выше, однако на стадии цирроза печени это различие может нивелироваться).
• У ряда больных отмечают признаки синдрома холестаза: повышение активности ЩФ и ГГТП в сыворотке крови, но степень этого повышения меньше, чем при остром алкогольном гепатите.
• При прогрессировании болезни становятся более очевидными лабораторные признаки цирроза печени: гипоальбуминемия, гипопротромбинемия, гипербилирубинемия, тромбоцитопения.
• У части больных могут отмечаться признаки синдрома перегрузки печени железом (вследствие гетерозиготного носительства аллелей гена гемохроматоза HFE) и более тяжелое течение заболевания.
Инструментальные исследования
• При УЗИ органов брюшной полости жировая инфильтрация гепатоцитов характеризуется диффузным увеличением эхогенности ткани печени (по сравнению с эхогенностью ткани почек).
• Диффузная жировая инфильтрация печени имеет характерную картину при КТ.
Дифференциальная диагностика
Дифференциальную диагностику в первую очередь следует проводить с алкогольной болезнью печени. Последняя имеет более яркую клиническую картину и характеризуется:
• наличием признаков хронического злоупотребления алкоголем;
- выраженной гепатомегалией;
• повышением активности ACT и АЛТ в сыворотке крови в 5-7 раз, соотношением АСТ/АЛТ более 1, значительным (в 10-20 раз) повышением активности ГГТП в сыворотке крови;
- развитием макроцитоза в период обострения заболевания.
ЛЕЧЕНИЕ
У больных неалкогольной жировой болезнью печени проводят адекватную коррекцию ожирения, сахарного диабета 2-го типа и гиперлипидемии. Снижение массы тела, как правило, сопровождается улучшением показателей функций печени и уменьшением степени жировой инфильтрации органа.
Лекарственная терапия неалкогольной жировой болезни печени не разработана. Препараты, эффективно снижающие уровень липидов в крови (фибраты, статины и др.), не влияют на содержание жира в печени. Имеются данные об улучшении функций печени при приеме урсодезоксихолевой кислоты в сочетании с витамином Е.
43.6. БОЛЕЗНЬ ВИЛЬСОНА-КОНОВАЛОВА
Болезнь Вильсона-Коновалова - редкое заболевание с аутосомнорецессивным типом наследования, в основе которого лежит нарушение метаболизма меди, приводящее к избыточному накоплению ее в печени, ЦНС, почках, роговице, костях и других органах.
ЭПИДЕМИОЛОГИЯ
Заболеваемость составляет 1 на 30 000 населения, но носительство патологического гена обнаруживают значительно чаще - 1 случай
на 90 человек. Болезнь Вильсона-Коновалова чаще манифестирует в детстве, хотя иногда диагноз устанавливают только в более старшем возрасте.
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
Причина болезни Вильсона-Коновалова - мутация 3-полипептида А ТС7В Сu2+-транспортирующей АТФазы. Ген, ответственный за синтез данного полипептида, расположен в хромосоме 13. В результате мутации гена нарушается функция данного фермента, который регулирует транспорт меди внутри гепатоцита и ее экскрецию в желчь. Медь накапливается в ткани печени, вызывая повреждение и развитие жировой дистрофии, фиброза и цирроза органа. При некрозе гепатоцитов медь высвобождается в кровь и может откладываться в других органах (ЦНС, почках, роговице, костях и др.).
КЛИНИЧЕСКАЯ КАРТИНА
Клинические проявления болезни Вильсона-Коновалова обусловлены главным образом поражением печени и ЦНС и, как правило, развиваются в возрасте старше 5 лет. Выделяют преимущественно абдоминальную (поражение печени) и церебральную формы, которые в дебюте заболевания наблюдают примерно с одинаковой частотой (40-45%). Реже болезнь манифестирует поражением кроветворной системы (гемолитической анемией) и эндокринной системы (в 12% случаев). У 1% пациентов заболевание начинается с нарушения функций почек (преимущественно с повреждения канальцев в рамках синдрома Фанкони).
Проявления болезни Вильсона-Коновалова
• Печеночные нарушения:
- хронический активный гепатит;
- цирроз печени;
- фульминантная печеночная недостаточность.
• Поражения ЦНС:
- неврологические;
- психические нарушения.
• Офтальмологические признаки:
- кольцо Кайзера-Флейшера;
- помутнение хрусталика, напоминающее цветок подсолнуха.
• Другие проявления:
- гемолитическая анемия;
- эндокринные нарушения;
- поражение почек и костей.
Характер поражения печени при болезни Вильсона-Коновалова весьма разнообразен - от клинической картины острого саморазрешившегося гепатита (что может быть расценено как перенесенный вирусный гепатит) до фульминантной печеночной недостаточности с развитием желтухи, гипоальбуминемии, нарушений свертываемости крови, асцита, печеночной энцефалопатии и часто гемолиза. При отсутствии в семейном анамнезе указаний на поражение печени или ЦНС очень трудно отличить фульминантную печеночную недостаточность вследствие болезни Вильсона-Коновалова от печеночной недостаточности, вызванной другими причинами.
Чаще заболевание манифестирует на стадии декомпенсированного цирроза печени с развитием отечно-асцитического синдрома, варикозно расширенных вен пищевода.
ДИАГНОСТИКА
При классической триаде признаков [поражении печени, неврологических нарушениях и кольце Кайзера-Флейшера (отложении меди в роговице глаза)] и сниженной концентрации церулоплазмина в сыворотке крови (<1,3 ммоль/л) диагностика заболевания не вызывает затруднений. Однако у 15-25% пациентов уровень церулоплазмина в сыворотке крови нормальный, а кольцо Кайзера-Флейшера отсутствует у 50% больных с симптомами поражения печени и у 5% больных с признаками патологии ЦНС. В этих случаях для подтверждения диагноза может потребоваться определение суточной экскреции меди с мочой, которая повышена практически у всех больных.
Дифференциальная диагностика
Болезнь Вильсона-Коновалова следует исключать у всех лиц моложе 35 лет с хроническим заболеванием печени, особенно при наличии патологии печени у родственников в молодом возрасте. Дифференциальную диагностику проводят с другими заболеваниями со сходной клинической картиной, которые приводят к циррозу печени (дефицитом а1-антитрипсина, вирусным, алкогольным и особенно аутоиммунным гепатитом).
ЛЕЧЕНИЕ
Основа лечения болезни Вильсона-Коновалова - пожизненный прием пеницилламина, который образует с медью комплексные соединения и выводит ее через почки из организма. Лечение начинают с небольших доз (250-500 мг/сут), которые постепенно увеличивают до
максимальных значений (1,5-2,0 г/сут). Препарат принимают внутрь 4 раза в сутки, за 30-45 мин до еды и на ночь или через 2 ч и более после приема пищи. При достижении клинического эффекта для уменьшения риска развития нежелательных явлений (поражения почек, кожи, кроветворной системы, волчаночноподобного синдрома) дозу можно снизить до поддерживающей (500-750 мг/сут).
В качестве дополнительной терапии и при непереносимости пеницилламина применяют ЛС, содержащие цинк, которые уменьшают всасывание меди в кишечнике.
При фульминантной печеночной недостаточности и тяжелом декомпенсированном циррозе печени, резистентном к лекарственной терапии, необходима трансплантация печени.
ПРОГНОЗ
Без лечения заболевание неуклонно прогрессирует и заканчивается летальным исходом. Если лечение начато до развития тяжелых осложнений цирроза печени, возможно полное обратное развитие всех признаков заболевания. Продолжительность жизни в этом случае не уменьшается. При хорошей переносимости и соблюдении режима лечения пеницилламином возможно прекращение прогрессирования болезни даже на стадии декомпенсированного цирроза печени.
43.7. НАСЛЕДСТВЕННЫЙ ГЕМОХРОМАТОЗ
Наследственный гемохроматоз - заболевание с аутосомнорецессивным типом наследования, обусловленное повышенным всасыванием железа в кишечнике и его отложением преимущественно в паренхиме печени, сердца, поджелудочной железы и других эндокринных желез.
ЭПИДЕМИОЛОГИЯ
Заболеваемость наследственным гемохроматозом составляет 150-600 на 100 000 населения. Мужчины болеют в 2,5 раза чаще женщин.
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
Ген, ответственный за развитие наследственного гемохроматоза, локализован в хромосоме 6 (ген HFE). Различные мутации этого гена приводят к сбою в регуляции гомеостаза железа - повышается всасывание железа в кишечнике. Механизм усиления всасывания железа при
наследственном гемохроматозе неизвестен. Уменьшение всасывания происходит только тогда, когда запасы железа достигают уровня, при котором происходит повреждение тканей. Потеря крови и усиленный расход железа организмом (кровопускания, менструации и беременность) уменьшают запасы железа и задерживают развитие заболевания. После уменьшения запасов железа его всасывание в кишечнике вновь усиливается. Перегрузка железом тканей вызывает их дистрофию и воспаление, стимулирует процесс формирования фиброза.
КЛИНИЧЕСКАЯ КАРТИНА
Клинические признаки наследственного гемохроматоза выявляют, как правило, у мужчин среднего возраста. У женщин симптомы заболевания развиваются реже и в более старшем возрасте (после менопаузы), так как избыток железа у них удаляется при менструациях и беременности. К ранним неспецифичным признакам заболевания относят повышенную общую слабость, артралгии и повышение активности аминотрансфераз в крови. При прогрессировании заболевания клиническая картина зависит от локализации поражения (табл. 43-6).
Таблица 43-6. Основные клинические проявления наследственного гемохроматоза
Ниже представлены диагностические критерии наследственного гемохроматоза.
• Обнаружение признаков перегрузки организма железом:
- насыщение трансферрина железом более 50-55%;
- концентрация ферритина в сыворотке крови более 200 мкг/л у женщин и более 300 мкг/л у мужчин;
- содержание железа в ткани печени более 200 мкмоль/г.
• Генетическое подтверждение мутации гена HFE.
ЛЕЧЕНИЕ
Пациент должен обязательно соблюдать диету с ограниченным количеством продуктов, богатых железом, полностью отказаться от алкоголя, поскольку он усиливает всасывание железа. Больному рекомендуют не принимать ЛС, содержащие витамин С, который усиливает токсическое действие железа на ткани.
Кровопускания - основа лечения наследственного гемохроматоза. За одну процедуру удаляют 400-500 мл крови. Кровопускания выполняют 1-2 раза в неделю вплоть до развития легкого дефицита железа, который определяют по следующим показателям:
• концентрации гемоглобина в крови менее 110 г/л;
• уменьшению среднего корпускулярного объема эритроцитов менее 80;
• насыщению трансферрина железом менее 20%.
В дальнейшем частоту кровопусканий определяют по содержанию ферритина в сыворотке крови (≤50 мкг/л). Кровопускания проводят пожизненно, как правило, достаточно одного раза в месяц. Комплексообразующие ЛС (дефероксамин) применяют только при невозможности проведения кровопусканий.
ПРОГНОЗ
Без лечения болезнь неуклонно прогрессирует, и больные погибают от осложнений цирроза печени (кровотечения из варикозно расширенных вен пищевода, рака печени и других осложнений) или сердечной недостаточности и нарушений ритма сердца. Своевременно начатое лечение полностью устраняет все симптомы заболевания (за исключением артропатий), и продолжительность жизни у таких больных не отличается от таковой здоровых лиц.
43.8. ЛЕКАРСТВЕННЫЕ ПОРАЖЕНИЯ ПЕЧЕНИ
Применение ЛС - одна из основных причин поражения печени. По частоте она уступает лишь вирусам гепатита и алкоголю. Частота лекарственного поражения печени при приеме препарата в терапевтической дозе варьирует от 1:1000 до 1:100 000 среди лиц, принимающих препарат. При этом наблюдают достаточно тяжелые осложнения, например, до 25% случаев фульминантного гепатита вызваны ЛС.
ПАТОГЕНЕЗ
Выделяют прямое токсическое, как правило, зависимое от дозы действие ЛС или их метаболитов на клетки печени, и реакции, обуслов-
ленные идиосинкразией к ЛС, которые возникают независимо от дозы. Поражение печени может быть вызвано иммуноаллергическими (галотан, фенитоин, сульфаметоксазол) или аутоиммунными (метилдопа, нитрофурантоин, ловастатин) реакциями. По морфологическим характеристикам поражение печени может быть разнообразным.
• Некроз гепатоцитов (например, при применении изониазида, диклофенака, ловастатина, парацетамола).
• Холестаз (хлорпромазин, эстрогены, макролиды).
• Мелкокапельная жировая дистрофия гепатоцитов (нуклеозидные аналоги, тетрациклин, ацетилсалициловая, вальпроевая кислоты).
• Стеатогепатит (амиодарон, тамоксифен).
• Гранулематоз (дилтиазем, хинидин).
• Фиброзные изменения (метотрексат, препараты витамина А).
• Опухоли (пероральные контрацептивы, анаболические стероиды).
КЛИНИЧЕСКАЯ КАРТИНА
Клиническая картина поражения печени зависит от ЛС, дозы и длительности приема и варьирует от бессимптомного повышения активности печеночных ферментов (АЛТ, ACT, ГГТП и ЩФ) до фульминантного гепатита с быстрым летальным исходом. Наряду с признаками поражения печени (астенией, кожным зудом, желтухой, повышением активности печеночных ферментов) могут наблюдаться лихорадка, кожная сыпь, лимфоаденопатия и эозинофилия.
Развитие клинической картины поражения печени на фоне приема любых ЛС требует исключения лекарственного гепатита. Нормализация биохимических показателей функций печени после отмены препарата, как правило, свидетельствует в пользу лекарственного генеза поражения печени.
ЛЕЧЕНИЕ
Основа лечения лекарственного поражения печени - немедленная отмена любого из потенциально гепатотоксических препаратов.
• При холестатическом варианте поражения печени применяют урсодезоксихолевую кислоту в дозе 10-15 мг/(кг×сут).
• Иммуноаллергические реакции служат показанием к назначению преднизолона в дозе 20-30 мг/сут.
• При отравлении парацетамолом как можно быстрее вводят его антидот - ацетилцистеин.
43.9. ЦИРРОЗЫ ПЕЧЕНИ
Цирроз печени - заболевание, при котором отмечается диффузное разрастание соединительной ткани с образованием узлов-регенератов, нарушающих дольковое строение органа, развивающееся вследствие некроза гепатоцитов. Цирроз печени - анатомическое понятие. Существует 3 его основных морфологических варианта:
• мелкоузловой (узлы регенерации одинаковые по размеру - менее 3 мм в диаметре);
• крупноузловой (узлы разных размеров, чаще более 3 мм);
• смешанный.
ЭТИОЛОГИЯ
Среди основных этиологических факторов цирроза печени выделяют инфицирование вирусами гепатита, злоупотребление алкоголем, метаболические нарушения и аутоиммунные заболевания (табл. 43-7).
Таблица 43-7. Этиологические факторы цирроза печени
КЛИНИЧЕСКАЯ КАРТИНА И ТЕЧЕНИЕ
Клиническую картину и течение цирроза печени определяют, как правило, этиологические факторы и активность печеночного процесса. К ранним симптомам относят повышенную утомляемость, различные диспепсические проявления (тошноту, вздутие живота, метеоризм), увеличение селезенки, отечность лодыжек, кожные «сосудистые звездочки». При декомпенсации цирроза печени наблюдают частые носовые
кровотечения и спонтанные кровоподтеки, снижение массы тела за счет атрофии мышц, увеличение живота вследствие скопления жидкости в брюшной полости, субфебрильную температуру тела, желтушность кожных покровов, ладонную эритему, гинекомастию, ногтевые фаланги в виде «барабанных палочек» и др.
Одним из основных проявлений цирроза печени любой этиологии считают синдром портальной гипертензии, развивающийся вследствие повышения сосудистого сопротивления при сдавлении сосудов печени узлами-регенератами или воспалительными инфильтратами в центролобулярной зоне. Дополнительное значение имеют повышение кровотока в связи с гипердинамическим типом кровообращения при циррозе печени и развитие артериальной вазодилатации в органах брюшной и грудной полостей. Основные проявления портальной гипертензии - спленомегалия, варикозное расширение вен пищевода и кардии желудка, прямой кишки, увеличение диаметра портальной и селезеночной вен, в ряде случаев - пупочной вены с ее реканализацией и асцит. У 6% больных развивается правосторонний гидроторакс. Расширение вен передней брюшной стенки приводит к формированию «головы медузы». Повышенное давление в системе воротной вены приводит к развитию портальной гастроэнтероколопатии.
К осложнениям портальной гипертензии относят кровотечение из варикозно расширенных вен пищевода или желудка и развитие спонтанного бактериального перитонита.
ДИАГНОСТИКА
При лабораторном исследовании отмечают лейко- и тромбоцитопению (проявления синдрома гиперспленизма), повышение активности аминотрансфераз (ACT, как правило, выше АЛТ) и билирубина (преимущественно прямой фракции) в сыворотке крови, гипергаммаглобулинемию, при нарушении синтетической функции печени - снижение концентрации альбумина (<3,5 мг/дл), активности холинэстеразы и протромбинового индекса.
На компенсированной стадии достоверная диагностика цирроза печени возможна только при морфологическом исследовании биоптата печени, когда обнаруживают признаки нарушения долькового строения органа и узлы регенерации. При УЗИ определяют неравномерную плотность ткани и участки повышенной эхогенности, а при развитии портальной гипертензии - увеличение селезенки, расширение диаметра воротной и селезеночной вен, появление жидкости в брюшной полости.
Обнаружение признаков цирроза печени у молодых пациентов делает необходимым проведение дополнительного исследования для исключения болезни Вильсона-Коновалова, особенно если в семейном анамнезе есть случаи смерти вследствие заболеваний печени ближайших родственников в молодом возрасте, - исследование крови на содержание церулоплазмина и меди, экскреции меди с мочой, обследование у окулиста на наличие кольца Кайзера-Флейшера.
ОСЛОЖНЕНИЯ
Выделяют несколько основных осложнений цирроза печени, приводящих к летальному исходу (табл. 43-8).
Таблица 43-8. Основные осложнения цирроза печени
Гепаторенальный синдром
Гепаторенальный синдром - состояние, развивающееся у больных декомпенсированным циррозом печени, асцитом. Характеризуется быстро(I тип) или медленно- (II тип) развивающейся почечной недостаточностью (азотемией, олиг- и анурией, гипонатриемией) при отсутствии органического поражения почек. Факторы, способствующие развитию гепаторенального синдрома: эпизоды бактериальных инфекций, кровотечение из варикозно расширенных вен пищевода, парацентез с удалением большого объема асцитической жидкости, неконтролируемая массивная диуретическая терапия (форсированный диурез). При гистологическом исследовании почки обычно имеют нормальное строение, что свидетельствует о функциональной природе почечной недостаточности. Возможна пересадка таких почек и их нормальное функционирование в организме реципиента.
Печеночно-легочный синдром
Характерны функциональные изменения сосудов малого круга кровообращения (открытие легочных артериовенозных шунтов) с развитием гипоксемии у пациентов с циррозом печени, синдромом портальной гипертензии. Клинически печеночно-легочный синдром проявляется одышкой и цианозом при отсутствии данных о заболевании легких или сердца; уменьшением одышки и гипоксии в горизонтальном положении больного (платипноэ) и нарастанием гипоксемии в положении стоя (ортодеоксия).
Синдром печеночной недостаточности
Характерно нарушение детоксицирующей и синтетической функций печени. При нарушении детоксицирующей функции развивается пече-
ночная энцефалопатия - синдром, объединяющий комплекс потенциально обратимых неврологических и психоэмоциональных нарушений, возникающих в результате острых или хронических заболеваний печени и/или портосистемного шунтирования крови.
ЛЕЧЕНИЕ И ПРОГНОЗ
Терапия цирроза печени заключается в устранении этиологического фактора, профилактике и лечении его осложнений.
Для оценки прогноза больных циррозом печени разработана шкала, основанная на анализе ряда клинических и лабораторных показателей (табл. 43-9).
Таблица 43-9. Шкала градации цирроза печени по Чайлду
При компенсированном циррозе печени пятилетняя выживаемость в среднем составляет 55-75%, а при развитии первых признаков декомпенсации (осложнений цирроза) - 15-25%. Прогноз значительно лучше при возможности устранения этиологического фактора (например, при полном отказе от алкоголя при алкогольном циррозе печени, кровопускании при гемохроматозе, лечении пеницилламином при болезни Вильсона-Коновалова). На стадии декомпенсированного поражения печени радикальным лечением считают трансплантацию печени.
43.10. ПЕРВИЧНЫЙ БИЛИАРНЫЙ ЦИРРОЗ
Первичный билиарный цирроз - аутоиммунное прогрессирующее холестатическое заболевание неизвестной этиологии, характеризуемое хроническим негнойным деструктивным воспалением междольковых и септальных желчных протоков и развитием цирроза печени.
ЭПИДЕМИОЛОГИЯ
Заболеваемость первичным билиарным циррозом составляет в среднем 30-60 на 100 000 населения, заболевание существенно чаще наблюдают у женщин (соотношение женщины/мужчины - 10:1) после 40 лет.
ПАТОГЕНЕЗ
В патогенезе первичного билиарного цирроза основное значение придают генетической предрасположенности эпителия междольковых и септальных протоков к аутоиммунному воспалению под воздействием каких-либо внешних или внутренних факторов. В дальнейшем разрушение и склероз желчных протоков (синдром «исчезающих» протоков) приводят к накоплению желчных кислот и их повреждающему действию на гепатоциты.
КЛИНИЧЕСКАЯ КАРТИНА И ТЕЧЕНИЕ
Раннее клиническое проявление заболевания - прогрессирующий, мучительный кожный зуд, сочетающийся с лабораторными признаками холестаза (повышением активности ЩФ и ГГТП в сыворотке крови). В дальнейшем возможно развитие прогрессирующей общей слабости, желтушности и гиперпигментации кожных покровов, ксантом и ксантелазм.
Первичный билиарный цирроз почти в 80% случаев сочетается с аутоиммунными заболеваниями других органов, в частности, синдромом Шёгрена, склеродермией, ревматоидным артритом, дерматомиозитом , аутоиммунным тиреоидитом и почечным канальцевым ацидозом.
ДИАГНОСТИКА
Основа диагностики - обнаружение в сыворотке крови антимитохондриальных AT 2-го типа (их определяют у 95% больных первичным билиарным циррозом) и морфологических признаков гранулематозного воспаления междольковых и септальных желчных протоков.
ЛЕЧЕНИЕ
Лечение заключается в приеме урсодезоксихолиевой кислоты пожизненно в дозе 15 мг/кг. Этот препарат способствует замедлению прогрессирования заболевания (особенно на ранней стадии). Урсодезоксихолевая кислота блокирует действие эндогенных токсичных желчных кислот вследствие конкуренции за участки связывания желчных кислот в тонкой кишке и прямого защитного действия на гепатоциты. Кроме того, она снижает экспрессию Аг HLA I и II класса на гепатоцитах и клетках эпителия желчных путей. Для лечения кожного зуда применяют также фенобарбитал и рифампицин.
ПРОГНОЗ
В большинстве случаев заболевание неуклонно прогрессирует в цирроз печени. В среднем выживаемость без трансплантации печени составляет 10-12 лет от момента диагностирования заболевания; на поздних стадиях (по данным гистологического исследования ткани печени) средняя продолжительность жизни снижается до 8 лет. При повышении содержания общего билирубина в сыворотке крови до 8-10 мг/дл - до 2 лет.
43.11. ПЕЧЕНОЧНАЯ НЕДОСТАТОЧНОСТЬ
Синдром печеночной недостаточности - комплекс клинико-лабораторных проявлений, обусловленных снижением синтетической и детоксикационной функций клеток печени. Выделяют следующие варианты синдрома (в зависимости от скорости прогрессирования процесса):
• острое развитие в исходе острого или фульминантного гепатита;
• постепенное - в результате длительно текущих хронических заболеваний печени, как правило, в стадии декомпенсированного цирроза печени.
КЛИНИЧЕСКАЯ КАРТИНА И ДИАГНОСТИКА
Среди основных клинических синдромов, характеризующих тяжесть печеночной недостаточности, выделяют энцефалопатию, геморрагический синдром и прогрессирующую желтуху (табл. 43-10).
Таблица 43-10. Синдром печеночной недостаточности
Печеночная энцефалопатия
Печеночная энцефалопатия - комплекс потенциально обратимых неврологических и психоэмоциональных изменений, обусловленных нарушением детоксикационной функции печени и проникновением токсических метаболитов в системный кровоток и головной мозг. К проявлениям печеночной энцефалопатии относят инверсию сна, нарушение речи и почерка, снижение памяти. При осмотре обнаруживают тремор рук, промахивание при выполнении пальценосовой пробы, в тяжелых случаях - спутанность сознания и кому. При развитии печеночной энцефалопатии при циррозе печени удается, как правило, выявить факторы, спровоцировавшие ее развитие.
• Желудочно-кишечное кровотечение из варикозно расширенных вен пищевода или язвенных дефектов слизистой оболочки ЖКТ.
• Назначение психотропных и гепатотоксичных препаратов.
• Форсированная диуретическая терапия.
• Парацентез с удалением большого количества асцитической жидкости (без восполнения объема циркулирующей крови раствором альбумина).
• Употребление алкоголя.
• Инфекции (спонтанный бактериальный перитонит, бронхолегочные инфекции, инфекции мочевыводящих путей).
• Наложение портокавальных анастомозов.
• Избыточное употребление белков.
• Хирургические вмешательства по поводу интеркуррентных заболеваний.
• Запор (длительный).
Геморрагический синдром
Манифестирует развитием спонтанных кровоподтеков, синяков, в тяжелых случаях - желудочно-кишечных кровотечений. Обусловлен нарушением синтеза факторов свертывания в печени.
При лабораторном исследовании определяют гипоальбуминемию, снижение протромбинового индекса, гипохолинэстераземию, при прогрессировании печеночной недостаточности - снижение содержания холестерина и глюкозы.
ЛЕЧЕНИЕ
Лечение печеночной недостаточности заключается в устранении этиологического фактора, вызвавшего поражение печени. Кроме того,
проводят профилактику и лечение кровотечений (переливание свежезамороженной плазмы), инфекционных осложнений (антибиотикотерапия), печеночной энцефалопатии. При тяжелой печеночной недостаточности обсуждают возможность трансплантации печени.
43.12. ОПУХОЛИ ПЕЧЕНИ
Среди первичных злокачественных опухолей печени наиболее часто (в 95% случаев) обнаруживают печеночно-клеточный рак, значительно реже (в 1-2%) - холангиокарциному. Заболеваемость печеночно-клеточным раком варьирует в разных регионах мира от 2-3 до 100 на 100 000 населения. К факторам риска развития печеночноклеточного рака относят мужской пол, возраст старше 40 лет и курение.
ЭТИОЛОГИЯ
В настоящее время выделяют следующие этиологические факторы печеночно-клеточного рака.
• Вирусы гепатитов В и С.
• Злоупотребление алкоголем.
• Прием продуктов с высоким содержанием афлатоксина.
КЛИНИЧЕСКАЯ КАРТИНА И ДИАГНОСТИКА
Печеночно-клеточный рак, особенно у больных хроническими заболеваниями печени, развивается, как правило, на фоне цирроза печени и характеризуется прогрессирующим нарастанием общей слабости, похудением, анорексией, лихорадкой, гепатомегалией, болями в правом подреберье, эпизодами гипогликемии. К фатальным осложнениям печеночно-клеточного рака относят тромбоз портальной вены и разрыв опухолевого узла с кровотечением в брюшную полость и развитием картины острого живота.
Лабораторные и инструментальные методы исследования
В крови обнаруживают нейтрофильный лейкоцитоз, значительное повышение активности ЩФ, ГГТП и концентрации а-фетопротеина. Диагноз подтверждают с помощью УЗИ в допплеровском режиме, спиральной КТ или МРТ с контрастированием, выявляя гиперваскуляризированные очаги в печени.
ЛЕЧЕНИЕ
Эффективность как радикальных (резекция печени и ортотопическая трансплантация печени), так и консервативных (трансартериаль-
ная эмболизация и чрескожные инъекции в опухоль этанола) методов лечения неудовлетворительная и зависит от размеров опухоли.
ПРОГНОЗ
Прогноз крайне неблагоприятный: 5-летняя выживаемость не превышает 5-8%.
43.13. ХРОНИЧЕСКИЙ БЕСКАМЕННЫЙ ХОЛЕЦИСТИТ
Хронический холецистит - воспалительное заболевание стенки желчного пузыря, сочетающееся с моторно-тоническими нарушениями желчевыводящей системы, одно из наиболее распространенных заболеваний ЖКТ. Заболеваемость составляет 6-7 на 1000 населения. Встречается во всех возрастных группах, но преимущественно страдают лица среднего возраста (от 40 до 60 лет). Женщины болеют в 3-4 раза чаще, чем мужчины. Заболевание чаще отмечается в экономически развитых странах.
КЛАССИФИКАЦИЯ
Классификация хронического бескаменного холецистита приведена в табл. 43-11.
Таблица 43-11. Классификация бескаменного хронического холецистита
ЭТИОЛОГИЯ
Хронический холецистит обычно обусловлен условно патогенной микрофлорой: эшерихиями, стрептококками, стафилококками, реже - протеем, синегнойной палочкой, энтерококком. Иногда наблюдают
хронические холециститы, обусловленные патогенной бактериальной микрофлорой (шигеллами, сальмонеллами), вирусной и протозойной инфекцией. Микроорганизмы проникают в желчный пузырь гематогенным, лимфогенным и контактным (чаще всего из кишечника) путями. Причиной воспаления желчного пузыря может быть инвазия паразитов. Поражение желчных путей встречается при лямблиозе, описторхозе, фасциолезе, стронгилоидозе, аскаридозе и в ряде случаев может быть причиной частичной обструкции общего желчного протока и холангиогенного абсцесса (аскаридоза), холангита (фасциолеза), выраженной дисфункции желчных путей (лямблиоза).
Важным предрасполагающим фактором развития хронического холецистита считают нарушение оттока желчи и ее застой. Заболевание обычно возникает на фоне желчнокаменной болезни или дискинезии желчевыводящих путей (см. раздел «Дискинезии желчевыводящих путей»). С другой стороны, хронический воспалительный процесс в желчном пузыре всегда сопровождается нарушением его моторноэвакуаторной функции и способствует формированию камней.
Большое значение в формировании заболевания имеет алиментарный фактор. Нерегулярное питание с большими интервалами между приемами пищи, обильная еда на ночь с предпочтением мясных, острых, жирных блюд вызывают спазм сфинктера Одди, стаз желчи. Избыток мучных и сладких продуктов, рыбы, яиц, недостаток клетчатки вызывают снижение рН желчи и нарушение ее коллоидной стабильности.
ПАТОГЕНЕЗ
Холецистит развивается постепенно. Функциональные нарушения нервно-мышечного аппарата приводят к его гипоили атонии. Внедрение микробной флоры способствует развитию и прогрессированию воспаления слизистой оболочки желчного пузыря. При дальнейшем прогрессировании патологического процесса воспаление распространяется на подслизистый и мышечный слои стенки желчного пузыря, где развиваются инфильтраты, соединительнотканные разрастания. При переходе процесса на серозную оболочку образуются спайки с глиссоновой капсулой печени и соседними органами (желудком, двенадцатиперстной кишкой, кишечником). Это состояние обозначают как перихолецистит.
Помимо катарального воспаления может возникнуть флегмонозный или даже гангренозный процесс. В тяжелых случаях в стенке желчного пузыря образуются мелкие абсцессы, очаги некроза, изъязвления, ко-
торые могут вызвать его перфорацию или развитие эмпиемы. Гангренозная форма (развивается редко) возникает при анаэробной инфекции и приводит к гнилостной деструкции стенок желчного пузыря.
КЛИНИЧЕСКАЯ КАРТИНА
Клиническая картина хронического холецистита характеризуется длительным прогрессирующим течением с периодическими обострениями. Симптоматика заболевания обусловлена наличием воспалительного процесса в желчном пузыре и нарушением поступления желчи в двенадцатиперстную кишку из-за сопутствующей дискинезии.
Болевой синдром
Болевой синдром - основной в клинической картине хронического холецистита. Боль локализуется в правом подреберье, реже - в эпигастральной области, иррадиирует в правую лопатку, ключицу, плечо, реже - в левое подреберье.
• Возникновение боли и ее усиление обычно связаны с нарушением диеты (употреблением жирных и жареных блюд, яиц, холодных и газированных напитков, вина, пива, острых закусок), физической нагрузкой, стрессом, переохлаждением, сопутствующей инфекцией.
• Интенсивность боли зависит от степени развития и локализации воспалительного процесса, наличия и типа дискинезии. Интенсивная, приступообразная боль характерна для воспалительного процесса в шейке и протоке желчного пузыря, постоянная - для поражения тела и дна пузыря. При хроническом холецистите с гипотонической дискинезией боль менее интенсивная, но более постоянная, тянущая. Ноющая, почти не прекращающаяся боль может наблюдаться при перихолецистите. Эта боль усиливается при тряске, повороте или наклоне туловища.
• При атипичном расположении желчного пузыря боль может локализоваться в эпигастрии, у мечевидного отростка, вокруг пупка, в правой подвздошной области.
• При пальпации определяют болезненность в правом подреберье, положительные болевые симптомы холецистита:
- симптом Кера - болезненность при надавливании в проекции желчного пузыря;
- симптом Мерфи - резкое усиление болезненности при пальпации желчного пузыря на вдохе;
- симптом Грекова-Ортнера - болезненность в зоне желчного пузыря при поколачивании по реберной дуге справа;
- симптом Георгиевского-Мюсси - болезненность при надавливании на правый диафрагмальный нерв между ножками грудиноключично-сосцевидной мышцы.
Диспепсический синдром
Диспепсический синдром проявляется отрыжкой горечью или постоянным горьким привкусом во рту. Нередко больные жалуются на чувство распирания в верхней половине живота, вздутие кишечника, нарушение стула. Реже бывают тошнота, рвота горечью. При сочетании с гипо- и атонией желчного пузыря рвота уменьшает боль и чувство тяжести в правом подреберье. При гипертонической дискинезии рвота вызывает усиление боли. В рвотных массах, как правило, обнаруживают примесь желчи. Чем значительнее застойные явления, тем больше желчи обнаруживают в рвотных массах. Рвота обычно провоцируется нарушениями диеты, эмоциональными и физическими перегрузками.
Воспалительно-интоксикационный синдром
В фазе обострения холецистита характерно повышение температуры тела. Чаще лихорадка субфебрильная (характерна для катаральных воспалительных процессов), реже достигает фебрильных значений (при деструктивных формах холецистита или в связи с осложнениями). Гектическая температура тела, сопровождаемая выраженным потоотделением потливостью, сильным ознобом, всегда является следствием гнойного воспаления (эмпиемы желчного пузыря, абсцесса печени). У ослабленных больных и лиц пожилого возраста температура тела даже при гнойном холецистите может оставаться субфебрильной, а иногда даже нормальной вследствие пониженной реактивности.
Желтуха
Желтуха не характерна для хронического холецистита, однако желтушная окраска кожных покровов и слизистых оболочек может наблюдаться при затруднении оттока желчи из-за скопления слизи, эпителия или паразитов в общем желчном протоке или при развившемся холангите.
Атипичные формы хронического холецистита
Атипичные формы хронического холецистита наблюдаются у 1/3 больных.
• Кардиалгическая форма характеризуется длительными тупыми болями в области сердца, возникающими после обильной еды, нередко в положении лежа. Могут быть аритмии, чаще типа экстрасистолий. На ЭКГ - уплощение, а иногда и инверсия зубца Т.
• Для эзофагалгической формы характерна упорная изжога, сочетающаяся с тупой болью за грудиной. После обильной еды может появиться чувство «кола» за грудиной. Боль длительная. Изредка могут возникать легкие затруднения при прохождении пищи по пищеводу.
• Кишечная форма проявляется малоинтенсивной, нечетко локализованной болью по всему животу, его вздутием, склонностью к запору.
ДИАГНОСТИКА
Лабораторные исследования
В анализе крови в фазе обострения часто обнаруживают увеличение СОЭ, нейтрофильный лейкоцитоз, сдвиг лейкоцитарной формулы влево, эозинофилию. При осложненных формах в сыворотке крови могут увеличиваться уровни билирубина, холестерина, трансаминаз. О выраженности воспалительного процесса в желчном пузыре можно судить по результатам исследования желчи, полученной при дуоденальном зондировании. При воспалении желчь мутная, с хлопьями, со значительной примесью слизи, цилиндрического эпителия, клеточного детрита, хотя эти признаки и не патогномоничны для холецистита, а свидетельствуют в основном о сопутствующем дуодените. Обнаружение большого количества эозинофилов при микроскопическом исследовании желчи может косвенно указывать на паразитарную инвазию. Большое количество кристаллов холестерина, билирубината кальция свидетельствует о снижении стабильности коллоидного раствора желчи и предрасположенности к холестазу и последующему камнеобразованию. Бактериологическое исследование всех порций желчи позволяет установить этиологию воспалительного процесса и чувствительность микрофлоры к антибиотикам.
Инструментальные исследования
Чаще всего используют УЗИ и рентгенологические методы исследования.
• При рентгенологическом исследовании обнаруживают многочисленные признаки функциональных или морфологических изменений желчного пузыря или других органов пищеварения. При контрастном исследовании желчного пузыря (холецистографии, холангиографии) можно выявить нарушение концентрационной способности (при внутривенной холецистохолангиографии накопление препарата длится >90 мин), нарушение двигательной
функции (замедление опорожнения), деформацию (неровность контуров желчного пузыря) при перихолецистите. Часто обнаруживают неравномерное заполнение пузырного протока, его извитость, перегибы.
• Для изучения состояния желчевыводящих путей, поглотительновыделительной функции печени применяют радиоизотопный метод. Для более точной диагностики его проводят в сочетании с многокомпонентным фракционным дуоденальным зондированием.
• Для более детального изучения желчного пузыря и желчных протоков предложен радиорентгенохромодиагностический метод. Суть его заключается в том, что одновременно с многокомпонентным зондированием и радиоизотопным исследованием выполняют холецистографию. Сопоставление результатов позволяет судить об изменениях положения, формы, величины и структуры тени желчного пузыря.
• Основной метод диагностики холецистита - УЗИ - позволяет не только установить отсутствие конкрементов, но и оценить сократительную способность и состояние стенки желчного пузыря (о хроническом холецистите свидетельствует ее утолщение >4 мм). При хроническом холецистите часто определяют утолщение и склерозирование стенки желчного пузыря, его деформацию. УЗИ не имеет противопоказаний и может применяться во время острой фазы заболевания, при повышенной чувствительности к контрастным веществам, беременности, нарушении проходимости желчевыводящих путей.
• При повышении концентрации билирубина в сыворотке крови более 51 мкмоль/л и клинически явной желтухе для выяснения ее причин проводят эндоскопическую ретроградную панкреатикохолангиографию.
Дифференциальная диагностика
Дифференциальную диагностику проводят в первую очередь с язвенной болезнью двенадцатиперстной кишки, хроническим дуоденитом. Необходимо учитывать особенности возникновения болевого синдрома при этих заболеваниях, сезонность обострений. Решающую роль играют результаты эндоскопического исследования желудка и двенадцатиперстной кишки. Иногда бывает сложно разграничить холецистит и дискинезию желчевыводящих путей. Однако для дискинезий не характерны лихорадка, нейтрофильный лейкоцитоз и увеличение СОЭ. Уточнению диагноза помогает УЗИ в сочетании с дуоденальным зондированием.
ЛЕЧЕНИЕ
В период клинически выраженного обострения больным показана госпитализация в гастроэнтерологическое или терапевтическое отделение. При угрозе развития деструктивного холецистита, при сильном болевом синдроме, возникшем впервые, больных госпитализируют в хирургическое отделение. При легком течении заболевания лечение проводят амбулаторно.
Диета
Диета должна способствовать предупреждению застоя желчи в желчном пузыре, уменьшению воспалительных явлений. Питание дробное (5-6 раз в день), рекомендуют нежирные сорта мяса и рыбы, каши, пудинги, сырники, салаты. Разрешают некрепкий кофе, чай, фруктовые, овощные, ягодные соки после стихания обострения. Очень полезны растительные жиры (оливковое и подсолнечное масла), содержащие полиненасыщенные жирные кислоты, фосфолипиды, витамин Е. Полиненасыщенные жирные кислоты способствуют нормализации обмена холестерина, участвуют в синтезе простагландинов, разжижающих желчь, повышают сократительную способность желчного пузыря. При достаточном количестве белка и растительных жиров в диете повышается холатохолестериновый индекс и, таким образом, уменьшается литогенность желчи.
Медикаментозное лечение
Медикаментозная терапия определяется фазой заболевания, выраженностью клинических проявлений (в первую очередь, болевого и диспепсического синдромов), характером дискинезии. Проводят комплексную терапию антибактериальными, противовоспалительными, нормализующими моторику желчевыводящих путей препаратами (см. раздел «Дискинезии желчевыводящих путей»).
Антибактериальная терапия
Антибактериальную терапию назначают в случаях, когда имеются клинические и лабораторные данные, подтверждающие активность воспалительного процесса в желчном пузыре. Выбор препарата зависит от вида возбудителя, выявленного при посеве желчи, его чувствительности к антибактериальному препарату, а также способности антибактериального препарата проникать в желчь и накапливаться в ней. Продолжительность лечения антибиотиками - 7-10 дней. При необходимости после 3-дневного перерыва лечение можно повторить. Антибактериальные препараты желательно сочетать с желчегонными, обладающими в
том числе противовоспалительным действием: цикловалон по 0,1 г 3-4 раза в день перед едой, гидроксиметилникотинамид по 0,5 г 3-4 раза в день перед едой. Следует помнить, что по степени проникновения в желчь антибактериальные средства можно разделить на 3 группы:
• проникающие в желчь в очень высоких концентрациях: эритромицин (по 0,25 г 4 раза в сутки), олеандомицин (по 0,5 г 4 раза в сутки после еды), рифампицин (по 0,15 г 3 раза в сутки), ампициллин (по 0,5 г 4-6 раз в сутки внутрь или внутримышечно), оксациллин (по 0,25-0,5 г 4-6 раз в сутки внутрь или внутримышечно), ампициллин + оксациллин (по 0,5 г 4 раза в сутки внутрь или внутримышечно), окситетрациклин + эритромицин (по 0,25 г через каждые 4-6 ч), линкомицин (внутрь по 0,5 г 3 раза в сутки за 1-2 ч до еды или по 1 мл 30% раствора 3 раза в сутки внутримышечно);
• проникающие в желчь в достаточно высоких концентрациях: бензилпенициллин (внутримышечно по 500 000 ЕД 6 раз в сутки), феноксиметилпенициллин (по 0,25 г 6 раз в сутки до еды), тетрациклин (по 0,25 г 4 раза в сутки);
• проникающие в желчь в слабых концентрациях: стрептомицин, ристомицин, хлорамфеникол.
Антипаразитарная терапия
В случае обнаружения паразитарной инвазии проводят соответствующую терапию.
• При лямблиозе: метронидазол по 0,25 г 3 раза в день после еды в течение 7 дней или тинидазол в дозе 2 г однократно.
• При описторхозе, фасциолезе, клонорхозе: празиквантел (индивидуальный режим дозирования с учетом возбудителя).
• При стронгилоидозе, трихоцефалезе, анкилостомидозе: мебендазол по 100 мг 2-3 раза в день в течение 3 дней, повторный курс - через 2-4 нед, пирантел по 0,25 г 1 раз в день в течение 3 дней.
Желчегонные препараты, физиотерапевтическое лечение и минеральные воды назначают в зависимости от вида сопутствующей дискинезии (см. раздел «Дискинезии желчевыводящих путей»).
Хирургическое лечение
Хирургическое лечение показано при часто рецидивирующем течении с развитием спаечного процесса и исходом в сморщенный желчный пузырь (что приводит к выраженному нарушению его сократительной функции), отключенном желчном пузыре, развитии осложнений (водянки, эмпиемы).
ОСЛОЖНЕНИЯ
Гнойно-деструктивные изменения желчного пузыря (эмпиема, перфорация) приводят к развитию перитонита и формированию желчных свищей. Перихолецистит вызывает развитие спаек, деформации желчного пузыря и вследствие этого нарушение его функций. Возможно вовлечение в воспалительный процесс соседних органов (холангит, гепатит, панкреатит, папиллит), развитие механической желтухи, формирование водянки желчного пузыря.
ПРОГНОЗ
Прогноз при адекватном лечении обострений удовлетворительный. Трудоспособность сохранена. Необходимость в оперативном лечении возникает редко.
43.14. ДИСКИНЕЗИИ ЖЕЛЧЕВЫВОДЯЩИХ ПУТЕЙ
Дискинезии желчевыводящих путей - функциональные расстройства билиарного тракта, представляющие собой комплекс клинических симптомов, развивающихся в результате моторно-тонической дисфункции желчного пузыря, желчных протоков и сфинктеров и проявляющихся нарушениями оттока желчи из общего желчного протока и желчного пузыря в двенадцатиперстную кишку.
КЛАССИФИКАЦИЯ
Принято выделять 2 типа расстройств:
• дисфункцию желчного пузыря;
• дисфункцию сфинктера Одди.
Различают первичные и вторичные дисфункциональные расстройства.
• Первичные нарушения могут быть связаны с первичным уменьшением мышечной массы желчного пузыря или сфинктера Одди.
• Вторичные дисфункциональные нарушения наблюдают:
- при гормональных расстройствах (беременности, предменструальном синдроме, сахарном диабете, заболеваниях щитовидной и паращитовидной желез, применении гормональных препаратов);
- заболеваниях печени (остром и хроническом гепатите, циррозе печени);
- резекции желудка или кишечника;
- системных заболеваниях соединительной ткани;
- воспалительных заболеваниях кишечника;
- заболеваниях желудка и поджелудочной железы;
- холецистэктомии;
- применении ЛС, влияющих на мышечную сократимость.
По функциональному состоянию различают функциональные расстройства билиарного тракта с гиперфункцией и гипофункцией.
КЛИНИЧЕСКАЯ КАРТИНА И ДИАГНОСТИКА
Дисфункции желчного пузыря
Главный симптом дисфункции желчного пузыря - билиарный тип болевого синдрома. Болевой синдром - результат внезапного повышения давления в желчном пузыре после погрешностей в диете, психоэмоционального напряжения. Боль возникает или усиливается через 1 ч и более после приема пищи. Многие больные отмечают ощущение боли в области сердца, сердцебиение. Боль может иррадиировать в правую лопатку, плечо. Иногда приступы сопровождаются тошнотой, рвотой, нарушением функции кишечника (запором). Нередко у таких больных отмечают вазомоторный (гипотонию, сердцебиение, боли в сердце) и нейровегетативный (повышенную раздражительность, нарушение сна, повышенное потоотделение, головные боли) синдромы. Возможны функциональные изменения других органов пищеварения (пилороспазм, гипокинезия желудка, дуоденостаз, гипо- и гиперкинезия толстой кишки).
При объективном обследовании иногда отмечают болезненность в проекции желчного пузыря. Болевые симптомы, характерные для холецистита, выражены нерезко или отсутствуют, при этом не наблюдают повышения температуры тела, увеличения СОЭ, лейкоцитоза. В межприступный период иногда сохраняется чувство тяжести в правом подреберье. При пальпации живота вне периода обострения отмечается незначительная болезненность в области желчного пузыря и в подложечной области.
Дискинезия желчного пузыря с гиперфункцией характеризуется периодически возникающими приступообразными болями в правом подреберье и правой половине живота.
Для дискинезии желчного пузыря с гипофункцией характерна постоянная тупая, ноющая боль в правом подреберье без четкой иррадиации. Сильные эмоции и прием пищи усиливают болевые ощущения и чувство распирания в правом подреберье. Больные часто жалуются на снижение
аппетита, отрыжку воздухом, тошноту, горечь во рту, вздутие живота, запор (реже диарею). При пальпации обнаруживают умеренную болезненность в области желчного пузыря.
Дисфункции сфинктера Одди
Дисфункцию сфинктера Одди подразделяют на 4 типа: 3 типа билиарной дисфункции и 1 - панкреатической. К диагностическим признакам дисфункции сфинктера Одди относят приступ болей билиарного типа и 3 лабораторных или инструментальных признака во время приступа:
• повышение активности ACT и/или ЩФ в сыворотке крови в 2 раза и более при 2 определениях;
• снижение времени выведения контрастных веществ при эндоскопической ретроградной панкреатикохолангиографии более 45 мин;
• расширение общего желчного протока более 12 мм.
Первый тип характеризуется болями и всеми 3 лабораторными или инструментальными признаками; 2-й - болями и 1-2 лабораторноинструментальными признаками; 3-й - типичными болями без какихлибо объективных нарушений; 4-й - панкреатическим типом болей и повышением активности амилазы или липазы (при умеренных болях гиперферментемия может отсутствовать).
Ультразвуковое исследование
При УЗИ отмечают замедленное опорожнение желчного пузыря или увеличение его размеров. Важный объективный симптом нарушенной моторики желчного пузыря - ультразвуковой феномен сладжа (осадка), который может быть диффузным или пристеночным.
Сохраняется использование для диагностики нарушений моторной функции желчевыводящей системы фракционного дуоденального зондирования.
Дифференциальная диагностика
Дискинезии желчевыводящих путей необходимо дифференцировать от холецистита, дуоденита, панкреатита (гипотонической формой дискинезии), язвенной болезни (гипертонической формой дискинезии), аднексита. Гиперкинетическую форму дискинезии желчного пузыря необходимо также дифференцировать от приступа стенокардии, инфаркта миокарда (абдоминальной формы), кишечной непроходимости, печеночной колики.
ЛЕЧЕНИЕ
Основные цели лечения, которое проводят амбулаторно: восстановление тонуса и нормального функционирования желчного пузыря, сфинктерной системы, нормализация тока желчи по билиарным и панкреатическим протокам, синтеза желчи. При гиперфункции билиарного протока рекомендуют овощи, грубую растительную клетчатку (отруби, яблоки, капусту).
Диетотерапия
Рекомендуют режим питания с частыми приемами (5-6 раз в день) небольшого количества пищи. Из рациона исключают алкоголь, пиво, газированную воду, копченые и жареные блюда, способные вызвать спазм сфинктера Одди или желчного пузыря.
Медикаментозное лечение
Зависит от формы дискинезии желчного пузыря или сфинктера Одди. При гиперфункциональной дискинезии используют антихолинергические препараты, нитраты, миотропные спазмолитики, интестинальные гормоны (глюкагон), холеретики. Блокатор натриевых каналов мебеверин значительно уменьшает силу мышечного сокращения и оказывает выраженное спазмолитическое действие, быстро купирует симптомы гипертонических расстройств желчевыводящих путей: боли в правом подреберье, тошноту, метеоризм. Из миотропных спазмолитиков широко применяют гимекромон, оказывающий избирательное спазмолитическое действие на сфинктер Одди и сфинктер желчного пузыря, а также обладающий холеретическим действием.
При лечении гипофункции желчного пузыря используют средства, усиливающие его моторику, в том числе холеретики. К числу последних относят препараты, содержащие желчь и желчные кислоты (желчь + + чеснок + крапивы листья + активированный уголь; желчь + порошок из поджелудочной железы и слизистой оболочки тонкой кишки), синтетические препараты (лодоксамид, цикловалон), фитопрепараты (артишока листьев экстракт, бессмертника песчаного цветки) и холекинетики (оливковое масло, магния сульфат, сорбитол, шиповника плодов экстракт).
ПРОГНОЗ
Прогноз благоприятный при своевременном лечении расстройств психоэмоциональной сферы, вегетативной нервной системы и нарушений моторики желчного пузыря и сфинктера Одди. При вторичной
дискинезии возможность ее устранения зависит от лечения основного заболевания.
43.15. ЖЕЛЧНОКАМЕННАЯ БОЛЕЗНЬ
Желчнокаменная болезнь - обменное заболевание гепатобилиарной системы, обусловленное нарушением обмена холестерина и/или билирубина и характеризуемое образованием желчных камней в желчном пузыре (холецистолитиаз), общем желчном протоке (холедохолитиаз) или печеночных желчных протоках (внутрипеченочный холелитиаз). Желчнокаменная болезнь - распространенная патология. Ежегодно в мире выявляют до 1 млн больных холелитиазом. Чаще болеют люди среднего и пожилого возраста. У детей болезнь возникает в 600-1000 раз реже, чем у взрослых, хотя описаны случаи холелитиаза даже у новорожденных. Мальчики и девочки болеют одинаково часто. В зрелом возрасте у мужчин желчнокаменная болезнь встречается в 3 раза реже, чем у женщин.
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
Развитие желчнокаменной болезни связывают с сочетанным воздействием 3 факторов:
• нарушением обмена веществ;
• застоем желчи;
• воспалением.
Выделяют 3 стадии желчнокаменной болезни:
I - стадия физико-химических изменений желчи;
II - стадия камненосительства;
III - калькулезный холецистит (острый или хронический).
Основные компоненты желчи - холестерин, фосфолипиды (лецитин), соли желчных кислот (холаты), желчные пигменты (билирубин) и вода. Нарушения обмена веществ приобретенного и врожденного характера, приводящие к качественному и количественному изменению состава желчи, могут нарушать ее коллоидную устойчивость, создавая предпосылки для выпадения в осадок ее компонентов. Данные изменения состава желчи возникают при нарушении обмена липидов (холестерина и желчных кислот) и пигментов (билирубина) и приводят к образованию холестериновых, пигментных (билирубиновых) камней или камней смешанного типа.
Предпосылкой к образованию камней может быть застой желчи, так как при этом содержание холестерина и билирубина в желчи повышает-
ся в 10-20 раз. К застою приводят дискинезия желчевыводящих путей, анатомические изменения в желчевыводящей системе (перетяжки, рубцы, спайки), врожденные аномалии желчного пузыря.
Воспалительный экссудат содержит большое количество белка и солей, в том числе и ионов кальция; ядром камня может стать белок. Некоторые виды бактерий выделяют в желчь а-глюкуронидазу, превращающую растворимый конъюгированный билирубин в нерастворимый неконъюгированный, вступающий в реакцию с ионами кальция с образованием билирубината кальция, из которого формируются пигментные камни. Роль инфекции в развитии желчнокаменной болезни признается не всеми.
Факторы риска:
• ожирение (повышена экскреция холестерина с желчью);
• гиперлипидемия 4-го типа;
• нарушение рационального питания (употребление жирного мяса, яиц, масла и других продуктов, содержащих много холестерина);
• наследственная предрасположенность;
• сахарный диабет;
• прием ЛС (эстрогенов, никотиновой кислоты, которые ингибируют синтез холестерина и повышают его экскрецию в желчь за счет мобилизации из тканей);
• беременность ;
• болезнь Крона;
• резекция тонкой кишки (нарушается всасывание желчных кислот из-за уменьшения функциональной поверхности кишечника).
Различают 3 типа камней:
• холестериновые;
• пигментные;
• смешанные.
Камни могут плотно заполнять желчный пузырь. Вследствие длительного давления камня на стенку желчного пузыря возможно возникновение пролежней и перфораций.
КЛИНИЧЕСКАЯ КАРТИНА
Симптоматика желчнокаменной болезни зависит от количества камней, их размеров, расположения, активности воспалительного процесса, функционального состояния желчевыводящей системы и патологии соседних органов. В стадиях физико-химических изменений и камненосительства клинических проявлений желчнокаменной болезни
нет, и камни в желчном пузыре обнаруживают как случайную находку при обследовании по поводу других заболеваний. Основные признаки поражения внепеченочных желчных путей представлены болевым синдромом, включая желчную (печеночную) колику, диспепсическим и воспалительно-интоксикационным синдромами и желтухой.
Камни желчного пузыря, расположенные в «немой» зоне (теле и дне пузыря), не проявляют себя клинически, пока не попадут в шейку пузыря или пузырный проток или пока не присоединится воспаление. В первом случае развивается приступ желчной (печеночной) колики (острый калькулезный холецистит), во втором случае - хронический калькулезный холецистит. Желчная (печеночная) колика обусловлена попаданием конкрементов желчного пузыря в шейку пузыря или пузырный кровоток и развитием острого калькулезного холецистита.
Желчная (печеночная) колика
Развитие приступа желчной колики провоцируют прием жирной, острой, пряной, копченой пищи, физическое и эмоциональное напряжение, инфекции, работа в наклонном положении. Характерно внезапное, на фоне полного благополучия, возникновение болей в правом подреберье, иррадиирующих в правую лопатку и подлопаточную область. Возможна атипичная локализация болей - в пояснице, области сердца. Интенсивность боли различна - от слабой ноющей до сильной режущей. Болевой синдром связан с перерастяжением стенки желчного пузыря вследствие повышения внутрипузырного давления и спастического сокращения сфинктеров и в меньшей степени с раздражением камнем слизистой оболочки пузыря и протоков.
Желчная колика сопровождается диспепсическим синдромом (тяжестью в эпигастрии, метеоризмом, неустойчивым стулом, повышением температуры тела).
Диспепсический синдром
Манифестирует отрыжкой горечью или постоянным горьким привкусом во рту. Нередко больные жалуются на чувство распирания в верхней половине живота, вздутие кишечника, нарушение стула. Реже бывают тошнота, рвота горечью. При сочетании с гипо- и атонией желчного пузыря рвота уменьшает боль и чувство тяжести в правом подреберье. При гипертонической дискинезии рвота вызывает усиление боли. В рвотных массах, как правило, обнаруживают примесь желчи.
Воспалительно-интоксикационный синдром
При обострении холецистита и желчнокаменной болезни характерно повышение температуры тела. Чаще лихорадка субфебрильная, реже достигает фебрильных значений (при деструктивных формах холецистита или в связи с осложнениями). Гектическая температура тела, сопровождаемая выраженным потоотделением, сильным ознобом, - всегда следствие гнойного воспаления (эмпиемы желчного пузыря, абсцесса печени). У ослабленных больных и лиц пожилого возраста температура тела даже при гнойном холецистите может оставаться субфебрильной, а иногда даже нормальной вследствие пониженной реактивности.
При объективном обследовании обнаруживают вздутие живота, напряжение передней брюшной стенки (может отсутствовать у ослабленных и пожилых больных), болезненность в проекции желчного пузыря, положительные болевые симптомы раздраженного желчного пузыря, определяемые при пальпации (см. раздел «Хронический бескаменный холецистит»).
ДИАГНОСТИКА
Диагностика желчнокаменной болезни и обострения хронического калькулезного холецистита основывается на данных анамнеза, жалобах, данных объективного осмотра, результатах лабораторных и инструментальных исследований.
Холецистография и УЗИ желчного пузыря. Наблюдают типичную картину наличия конкрементов.
При развитии желтухи наиболее информативны УЗИ, чреспеченочная холангиография и эндоскопическая ретроградная панкреатикохолангиография. Эти методы позволяют уточнить состояние панкреатического и билиарного протоков, обнаружить конкременты, опухоли холедохопанкреатической зоны и другие причины холестаза.
При подозрении на деструктивные формы хронического калькулезного холецистита проводят лапароскопию.
Дифференциальная диагностика
Приступы желчной колики следует дифференцировать от острых болей другого происхождения (почечной колики, заболеваний кишечника, острого аппендицита). При почечной колике боли иррадиируют в паховую область, промежность, бедро, в момент приступа наблюдается поллакиурия. Хронический калькулезный холецистит часто дифференцируют от язвенной болезни двенадцатиперстной кишки, панкреатита.
В этих случаях помогают результаты эндоскопического исследования и УЗИ. Иногда дифференциальную диагностику проводят между холелитиазом и правосторонней нижнедолевой пневмонией (обычно у пожилых больных). В этом случае решающую роль играет рентгенологическое исследование легких.
ЛЕЧЕНИЕ
Желчнокаменную болезнь в настоящее время относят как к хирургической, так и к терапевтической патологии. Большинство больных обращаются за помощью к терапевтам. Лечение складывается из диетотерапии, медикаментозной терапии, методов дистанционной литотрипсии и хирургического лечения. Выбор метода лечения во многом зависит от стадии заболевания.
Диетотерапия
Рекомендуют дробное (4-6 раз в день) питание с исключением высококалорийной и богатой холестерином пищи. Исключают копчености, тугоплавкие жиры, раздражающие приправы. Рекомендуют растительные жиры. Диета должна включать большое количество растительной клетчатки с добавлением отрубей - это нормализует перистальтику кишечника, уменьшает литогенность желчи. При желчной колике необходим голод на 2-3 дня.
Медикаментозное лечение
Больным с холестериновыми конкрементами проводят лекарственное растворение камней с помощью препаратов урсодезоксихолевой и хенодезоксихолевой кислот.
Лекарственное растворение камней можно проводить, если диаметр камней - не более 10-15 мм, желчный пузырь наполнен камнями не более чем на треть, сохранены функция желчного пузыря и проходимость общего желчного и пузырного протоков. Доза хенодезоксихолевой кислоты - 15 мг/кг в день, а урсодезоксихолевую кислоту назначают в дозе 10 мг/кг в день. Лечение проводят под контролем УЗИ (1 раз в 6 мес). После растворения камней рекомендуют постоянный прием препаратов в уменьшенной дозе (1/3 суточной дозы на ночь).
Литотрипсия
Ударно-волновая литотрипсия. Дробление крупных конкрементов на мелкие фрагменты с помощью ударных волн. Принцип метода заключается в том, что вызываемые различными способами ударные
волны передаются через водяную среду и фокусируются с помощью вогнутого эллипсоидного рефлектора на теле больного в проекции желчного пузыря. Эти волны дробят желчные камни на мелкие (4-8 мм) части. Экстракорпоральную литотрипсию проводят пациентам с холестериновыми камнями при единичном конкременте диаметром не более 3 см (или не более 3 конкрементов диаметром <1 см), сохраненной сократительной функции желчного пузыря и отсутствии в анамнезе рецидивирующей лихорадки, холестаза и желтухи. За 2 нед до литотрипсии назначают препараты урсодезоксихолевой кислоты, прием которых продолжают до полного растворения фрагментов. Результат контролируют с помощью УЗИ.
Противопоказания к экстракорпоральной литотрипсии:
• большие размеры конкрементов, их кальцификация;
• непроходимость пузырного протока;
• нарушение функций желчного пузыря;
• нарушение свертываемости крови (гипокоагуляция). Чрескожно-транспеченочный холелитолиз. Метод заключается
в том, что под местной анестезией в желчный пузырь вводят тонкий катетер (через кожу и ткань печени). Через него вводят метилтрибутиловый эфир или другие вещества, растворяющие желчные холестериновые камни. Метод редко применяют ввиду его сложности.
Хирургическое лечение
Хирургическое лечение (холецистэктомию, лапароскопическую холецистэктомию) проводят:
• при осложненном течении хронического калькулезного холецистита (при развитии механической желтухи, флегмонозного или гангренозного калькулезного холецистита);
• наличии противопоказаний к растворению и дроблению камней;
• отсутствии эффекта от других методов лечения.
ОСЛОЖНЕНИЯ
Самое распространенное осложнение желчнокаменной болезни - обтурация камнем общего желчного или печеночного желчного протока с развитием механической желтухи. Длительно протекающая механическая желтуха часто сопровождается холангитом и может привести к вторичному билиарному циррозу печени. При закупорке пузырного протока может развиться водянка или эмпиема желчного пузыря. Длительное пребывание крупных конкрементов в желчном пузыре или желчных протоках приводит к образованию пролежня их стенок и перфорации
желчного пузыря с развитием желчного перитонита или образованием внутренних билиодигестивных (пузырно-кишечного и холедоходуоденального) свищей. На фоне длительного калькулезного холецистита может развиться рак желчного пузыря.
Длительное течение калькулезного холецистита осложняется хроническим панкреатитом, дисбактериозом кишечника. Склероз желчного пузыря также следует рассматривать как осложнение хронического калькулезного холецистита.
ПРОГНОЗ
Прогноз зависит от многих факторов. Лекарственное растворение камней возможно примерно в 15-20% случаев желчнокаменной болезни.
43.16. ХРОНИЧЕСКИЙ ПАНКРЕАТИТ
Хронический панкреатит - заболевание, в основе которого лежит развитие воспалительно-склеротического процесса, ведущего к прогрессирующему снижению функций внешней и внутренней секреции; происходит уплотнение паренхимы поджелудочной железы (индурация) вследствие разрастания соединительной ткани, появления фиброзных рубцов, псевдокист и кальцинатов.
ЭТИОЛОГИЯ
Алкоголь - основной этиологический фактор, особенно у мужчин. Доказано, что употребление алкоголя в суточной дозе 80-120 мл этанола на протяжении 3-10 лет приводит к развитию хронического панкреатита. Сочетание систематического употребления алкоголя с курением увеличивает риск развития хронического панкреатита. У 2540% больных (в основном у женщин) причина развития хронического панкреатита - заболевания желчевыводящей системы (дискинезии, холециститы, желчнокаменная болезнь). Среди других причин развития хронического панкреатита отмечают заболевания зоны большого дуоденального сосочка, воздействие токсических веществ (растворителей), лекарств (азатиоприна, гидрохлоротиазида, фуросемида, меркаптопурина, метилдопы, эстрогенов, сульфаниламидов, тетрациклина, НПВС), гиперлипидемия. Развитие хронического панкреатита возможно при гиперпаратиреозе, травмах поджелудочной железы.
ПАТОГЕНЕЗ
Основным патогенетическим механизмом развития хронического панкреатита считают активацию собственных ферментов (трипсиноге-
на, химотрипсиногена, проэластазы и фосфолипазы А) поджелудочной железы с последующим поражением ее ткани. Это приводит к развитию отека, коагуляционного некроза и фиброза ткани поджелудочной железы. В результате гибели ацинарных клеток и обструкции внутрипанкреатических протоков происходит внешнесекреторная недостаточность поджелудочной железы. Вследствие поражения островков Лангерганса развивается сахарный диабет.
КЛИНИЧЕСКАЯ КАРТИНА
Клиническая картина хронического панкреатита складывается из болевого и диспепсического синдромов, недостаточности экзокринной и эндокринной функций железы.
Болевой синдром
Локализация болей при хроническом панкреатите зависит от преимущественного поражения той или иной анатомической части поджелудочной железы. Боль в левом подреберье или слева от пупка возникает при поражении хвоста поджелудочной железы. При поражении тела поджелудочной железы боль локализуется в эпигастральной области. При поражении головки поджелудочной железы боль локализуется в зоне Шоффара. При тотальном поражении органа боль носит разлитой характер в виде «пояса» или «полупояса» в верхней части живота. Боль возникает или усиливается через 40-60 мин после приема пищи (особенно обильной, острой, жареной, жирной), усиливается в положении лежа на спине и ослабевает в положении сидя при небольшом наклоне туловища вперед. Возможна иррадиация болей в область сердца, левую лопатку, левое плечо (имитируют стенокардию), а иногда и в левую подвздошную область.
Диспепсический синдром характеризуется отрыжкой, изжогой, тошнотой.
Экзокринная недостаточность
Для экзокринной недостаточности поджелудочной железы характерны нарушение процессов кишечного пищеварения и всасывания, развитие избыточного размножения бактерий в тонкой кишке. В результате у больных развиваются диарея, стеаторея, метеоризм, боли в животе, отрыжка, тошнота, эпизодическая рвота, потеря аппетита, похудение, позднее присоединяются симптомы, характерные для полигиповитаминоза.
Эндокринная недостаточность
Примерно у одной трети больных обнаруживают расстройства углеводного обмена, у половины из них наблюдают клинические признаки сахарного диабета, имеющего следующие особенности течения:
• склонность к гипогликемии;
• потребность в низких дозах инсулина;
• редкое развитие кетоацидоза;
• сосудистые и другие осложнения.
При объективном обследовании отмечают сухость и шелушение кожи, глоссит, стоматит (изменения, обусловленные гиповитаминозом). Как правило, у больных имеется дефицит массы тела. На коже груди, живота, спины иногда можно обнаружить мелкие ярко-красные пятна округлой формы, размером 1-3 мм, не исчезающие при надавливании (симптом Тужилина). Пальпировать поджелудочную железу удается только при кистозных и опухолевых процессах. Локальную пальпаторную болезненность в области поджелудочной железы выявляют у половины больных в зоне Шоффара-Риве, точках Дежардена и Мейо-Робсона. Определяют положительный френикус-симптом, признаки Гротта и Кача.
ДИАГНОСТИКА
Лабораторные исследования
Используют для выявления воспалительного процесса в поджелудочной железе, оценки его активности и определения степени нарушения экзокринной и эндокринной функций органа. В общем анализе крови возможны лейкоцитоз и увеличение СОЭ. Отмечают повышение активности ферментов поджелудочной железы: амилазы, трипсина и липазы (более специфично, чем определение содержания амилазы) в сыворотке крови и моче, эластазы в крови и кале. Изменяются показатели панкреатической секреции при исследовании содержимого двенадцатиперстной кишки до и после стимуляции секретином, панкреозимином.
Выявление эндокринной недостаточности поджелудочной железы сводится к определению концентрации глюкозы в плазме крови и гликемического профиля (двугорбый тип гликемической кривой, характерный для сахарного диабета).
Инструментальные исследования
Направлены на визуализацию изменений поджелудочной железы, зоны большого сосочка двенадцатиперстной кишки, крупных желчных протоков, главного панкреатического протока.
Дифференциальная диагностика
Хронический панкреатит необходимо дифференцировать:
• от язвенной болезни желудка и двенадцатиперстной кишки;
• хронического холецистита;
• хронических энтерита и колита;
• хронического абдоминального ишемического синдрома;
• рака поджелудочной железы.
ЛЕЧЕНИЕ
В период обострения больные хроническим панкреатитом нуждаются в госпитализации, постоянном наблюдении с контролем гемодинамических и биохимических (концентрации амилазы, липазы, глюкозы) показателей. Лечение должно быть направлено на уменьшение панкреатической секреции, купирование болевого синдрома, проведение заместительной ферментной терапии и предупреждение осложнений.
Диета
При выраженных обострениях в первые 3-5 дней назначают голод (нулевая диета) и гидрокарбонатно-хлоридные воды, что приводит к уменьшению панкреатической секреции. При необходимости переходят на парентеральное питание (альбумином, протеином, глюкозой♠), что способствует уменьшению интоксикации, болевого синдрома и предупреждает развитие гиповолемического шока. Затем больного переводят на пероральное питание. Прием пищи должен быть частым, небольшими порциями. Ограничивают употребление продуктов, стимулирующих секрецию поджелудочной железы (жиров, кислых продуктов), молочных продуктов, богатых кальцием (творога, сыра).
ОСЛОЖНЕНИЯ
В период обострения хронического панкреатита могут развиться гиповолемический шок, желудочно-кишечное кровотечение, желтуха, абсцессы, сепсис. Часто хронический панкреатит осложняется псевдокистами. Длительно протекающий хронический панкреатит приводит к расширению главного панкреатического протока, изменениям соседних органов: сужению общего желчного протока, двенадцатиперстной кишки, тромбозу селезеночной вены, выпоту в плевральную, перикардиальную и брюшную полости.
ПРОГНОЗ
Строгое соблюдение диеты, отказ от употребления алкоголя, адекватность поддерживающей терапии существенно уменьшают частоту и выраженность обострений у 70-80% больных. Больные хроническим алкогольным панкреатитом живут после начала заболевания до 10 лет при полном отказе от употребления алкогольных напитков. Если же они продолжают употреблять алкоголь, половина из них умирают раньше этого срока. Стойкая и длительная ремиссия возможна лишь при регулярной поддерживающей терапии.