Урология : учебник / [С. Х. Аль-Шукри, В. Н. Ткачук] ; под ред. С. Х. Аль-Шукри и В. Н. Ткачука. - 2011. - 480 с. : ил.
|
|
|
|
Глава 11. ОПУХОЛИ МОЧЕПОЛОВЫХ ОРГАНОВ
11.1. ОПУХОЛИ ПОЧКИ
В зависимости от локализации все новообразования почки можно разделить на опухоли почечной паренхимы и опухоли почечной лоханки. По гистологическому строению выделяют доброкачественные и злокачественные опухоли. Последние встречаются значительно чаще.
В связи с клинической значимостью и особыми подходами к лечению выделяют двусторонние опухоли почек, опухоли единственной почки и вторичные (метастатические) опухолевые поражения.
Опухоли почечной паренхимы. Доброкачественные опухоли: аденома, онкоцитома, липома, ангиомиолипома, гемангиома, лимфангиома, лейомиома, юкстагломерулярно-клеточная опухоль.
Злокачественные опухоли: почечно-клеточный рак, саркома, нефробластома (опухоль Вильмса).
Опухоли почечной лоханки. Доброкачественные опухоли: папиллома, ангиома, лейомиома.
Злокачественные опухоли: переходно-клеточный рак, плоскоклеточный рак, слизисто-железистый рак, саркома.
У взрослых самой частой опухолью почки является почечно-клеточ-ный рак, а у детей - нефробластома (опухоль Вильмса).
11.1.1. Опухоли почечной паренхимы
Аденома - наиболее распространенная доброкачественная опухоль почки. Она состоит из высокодифференцированных железистых клеток и обычно не достигает больших размеров. Сама по себе аденома почки не имеет существенного клинического значения. При этом на дооперационном этапе отличить аденому почки от почечно-клеточного рака чрезвычайно трудно, поэтому выбирается тактика лечения как при злокачественном новообразовании. К другим доброкачественным опухолям почечной паренхимы относят ангиомиолипому, онкоцитому, лейомиому и юкстагломерулярно-клеточную опухоль.
Ангиомиолипома почки встречается относительно редко. Она характеризуется округлой формой, отсутствием капсулы и состоит из
жировой ткани, гладких мышц и сосудов. Ангиомиолипомы обычно бессимптомны, однако у некоторых пациентов могут проявляться болью в поясничной области и макрогематурией. Описаны случаи самопроизвольных разрывов ангиомиолипом с последующим забрю-шинным кровотечением. Предоперационная диагностика ангиомио-липом возможна с помощью УЗИ и КТ. Тактика лечения определяется размером опухоли и клинической симптоматикой. При величине новообразования менее 4сми отсутствии клинических проявлений показано наблюдение и периодическое выполнение УЗИ или КТ. При более крупных опухолях и наличии клинических симптомов выполняют резекцию почки.
Онкоцитома обычно является односторонней и одиночной, имеет капсулу и обладает весьма характерными гистологическими признаками: состоит из крупных эпителиальных клеток с эозинофильной зернистостью. Более чем у 80 % больных опухоль бессимптомна; в остальных случаях могут наблюдаться боль в поясничной области и макрогематурия. На дооперационном этапе диагностировать онкоци-тому практически невозможно, поэтому тактика лечения соответствует таковой при почечно-клеточном раке.
Юкстагломерулярно-клеточная опухоль - чрезвычайно редкое новообразование почки, имеющее, однако, большое клиническое значение. Оно определяется тем, что опухолевые клетки продуцируют ренин, и у таких больных наблюдается тяжелая артериальная гипертен-зия. На наличие ренинпродуцирующей опухоли указывает повышение концентрации ренина в крови из почечной вены. Лечение хирургическое - нефрэктомия или резекция почки. После удаления опухоли артериальное давление нормализуется.
Рак почки возникает в корковом веществе почки и развивается из эпителия проксимальных канальцев. Почечно-клеточный рак составляет примерно 3 % всех злокачественных опухолей у взрослых. Опухоль развивается обычно у людей старше 40 лет, хотя в последние годы отмечена тенденция к выявлению рака почки и в более молодом возрасте. Не отмечено различий в частоте поражения почечно-клеточным раком левой и правой почек, верхнего и нижнего полюсов почки.
Этиология. До сих пор причины развития опухолей почки изучены недостаточно. Считают, что в возникновении этого полиэтиологического заболевания могут играть роль ионизирующая радиация, гормональные, химические, иммунологические и генетические факторы. Вклад каждого из них в канцерогенез остается предметом дискуссий. Доказано, например, что курение почти в 2 раза повышает риск раз-
вития рака почки. Рак почки также чаще обнаруживают у лиц, контактирующих с асбестом.
Классификация. Морфологическое строение почечно-клеточного рака имеет несколько вариантов. Доли светлоклеточного и зернисто-кле-точного рака почки примерно одинаковы - около 25 %. Приблизительно у 2 % больных выявляют веретеноклеточный рак почки. В остальных случаях почечно-клеточный рак имеет смешанное строение.
Важная характеристика почечно-клеточного рака - степень диффе-ренцировки опухоли, имеющая существенное прогностическое значение. Выделяют следующие степени дифференцировки:
Gx - степень дифференциации не может быть определена.
G1 - высокодифференцированная опухоль.
G2 - умеренно дифференцированная опухоль.
G3 - низкодифференцированная опухоль.
G4 - недифференцированная опухоль.
Широко применяется международная классификация опухоли по системе TNM, где Т (tumor) - распространение первичной опухоли, N (nodi limphatici) - поражение регионарных лимфатических узлов, М (metastasis) - отдаленные метастазы. Эта классификация позволяет составить представление о состоянии регионарных лимфатических узлов и о наличии отдаленных метастазов.
Классификация опухолей почечной паренхимы по системе TNM (2002)
Т - первичная опухоль
Тх - размеры первичной опухоли неизвестны.
Т0 - первичная опухоль не определяется.
Т1 - опухоль до 7,0 см, ограничена почкой.
Т1а - опухоль 4 см и меньше.
Т1Ь - опухоль больше 4 см, меньше 7 см.
Т2 - опухоль больше 7,0 см, ограничена почкой.
Т3 - опухоль распространяется на крупные вены, надпочечники или околопочечные ткани, но в пределах фасции Героты.
Т3а - опухоль распространяется на надпочечники или околопочечные ткани, но в пределах фасции Героты.
Т3Ь - распространение опухоли на почечную вену, полую вену, ниже диафрагмы.
Т3с - распространение опухоли на полую вену, выше диафрагмы.
T4 - опухоль распространяется за пределы фасции Героты.
N - регионарные лимфатические узлы
Nx - состояние регионарных лимфатических узлов оценить невозможно.
N0 - нет метастазов в регионарных лимфатических узлах.
N1 - метастаз в одном лимфатическом узле.
N2 - метастазы в нескольких лимфатических узлах.
М - отдаленные метастазы
Mx - выявить отдаленные метастазы невозможно. М0 - отдаленные метастазы не определяются. М1 - имеются отдаленные метастазы.
Рак почки метастазирует гематогенно и лимфогенно. Отдаленные метастазы наблюдаются почти у половины больных с опухолью почки. Метастазами поражаются в первую очередь органы с обильным кровоснабжением, имеющие тесную связь своей венозной системы с венозной системой почки.
Самая частая локализация отдаленных метастазов - легкие, далее следуют кости, печень, мозг. Нередко отдаленные метастазы появляются через много лет после удаления первичного очага при нефрэктомии. Кроме этого факта, отмечены случаи самопроизвольного исчезновения метастазов в легкие после удаления пораженной опухолью почки.
Регионарными лимфатическими узлами являются паракавальные, парааортальные, а также расположенные в области ворот почки. Именно эти лимфатические узлы поражаются в первую очередь, поэтому при выполнении радикальной нефрэктомии обязательно нужно проводить ревизию регионарных лимфатических узлов.
Симптоматика. Клинические проявления рака почки многообразны. Их можно разделить на местные и общие. К местным симптомам относят макрогематурию, боль в поясничной области и пальпируемое образование в поясничной области. Все три симптома одновременно наблюдаются нечасто (у 10-15 % больных), и это указывает на поздние стадии опухолевого процесса.
Макрогематурию можно выявить у большинства больных с почечно-клеточным раком почки. Ее причины - прорастание опухолью чашек и лоханки, а также разрушение почечных сосудов разрастающейся опухолевой массой и разрыв форникальных вен. Кровь в моче обычно появляется, казалось бы, на фоне полного здоровья, и так же внезапно макрогематурия прекращается. По этой причине чрезвычайно важно успеть на фоне кровотечения выполнить цистоскопию и определить источник кровотечения. На поздних стадиях опухолевого процесса может наблюдаться длительная тотальная гематурия.
При обтурации мочеточника сгустками крови может нарушаться отток мочи из почки, при этом возникают боли разной интенсивности вплоть до почечной колики. Поэтому гематурию при опухоли почки называют «предболевой», в отличие, например, от «постболевой» при мочекаменной болезни.
Боль в поясничной области - второй по частоте местный симптом опухоли почки - может быть связана с растяжением фиброзной капсулы почки вследствие отека почечной ткани, прорастания ее опухолью, с натяжением почечных сосудов. Выраженность болей варьирует в широком диапазоне: от незначительной до весьма существенной на поздних стадиях опухолевого процесса.
Пальпируемое образование в поясничной области - третий местный симптом - определяется на поздних стадиях заболевания. Обычно удается прощупать опухоль, исходящую из нижнего полюса почки. При этом пальпируемый участок почки бугристый, плотный, чаще всего безболезненный. У тучных пациентов не всегда возможна пальпация даже значительно увеличенной почки. Пальпацию необходимо проводить в положениях больного на спине, на боку, стоя. Известны случаи, когда больные сами у себя через переднюю брюшную стенку прощупывали плотное образование, оказывающееся впоследствии опухолью почки.
Весьма важный симптом опухоли почки у мужчин - варикоцеле - расширение вен семенного канатика вследствие сдавления нижней полой или левой почечной вены увеличенными лимфатическими узлами или прорастающей опухолью. При этом происходит ретроградный сброс венозной крови через яичковую вену. Появление варикоцеле у пациентов среднего и старшего возрастов, как и развитие варикоцеле с правой стороны, - основание для тщательного исследования почек на предмет выявления опухоли. Возникновение варикоцеле у больных с новообразованиями почки - неблагоприятный прогностический признак, поскольку указывает на значительное распространение опухолевого процесса.
Общие симптомы рака почки весьма разнообразны. Нередко общие проявления - единственные симптомы заболевания. Однако поскольку они неспецифичны для опухоли почки, нередко поиск непосредственной их причины надолго затягивается.
Самый частый общий симптом почечно-клеточного рака - повышение температуры тела. Лихорадка чаще всего субфебрильная, постоянная и продолжительная. Повышение температуры тела связано с выделением опухолью токсичных веществ, обладающих пирогенными
свойствами. Изредка лихорадка сопровождается ознобами или достигает 38-39°С.
Примерно у 30 % больных с опухолью почки наблюдается анемия. Она не связана с кровотечением или гемолизом, цветовой показатель обычно в норме. Препараты железа чаще всего неэффективны. Причина анемии при опухоли почки - угнетающее влияние на эритро-поэз выделяемых опухолью токсичных веществ.
В редких случаях при опухолях почки наблюдается паранеопласти-ческий эритроцитоз. Увеличение количества эритроцитов в этих случаях не играет компенсаторной роли и связано с усилением выработки эритропоэтина опухолью или неизмененной почечной паренхимой вследствие гипоксии.
Весьма часто у больных с опухолью почки встречается артериальная гипертензия. Ее появление связывают с повышением продукции ренина в пораженной опухолью почке.
Примерно у 20 % больных раком почки развивается гиперкальци-емия. Ее развитие связывают с влиянием на кальциевый обмен продуктов опухолевого метаболизма.
При опухоли почки могут наблюдаться похудание, слабость, снижение аппетита, ухудшение сна, вызываемые интоксикацией продуктами опухолевого метаболизма.
Общие симптомы, хотя и не являются специфичными для опухоли почки, должны вызывать онкологическую настороженность у врача любой специальности. Длительная лихорадка, наряду с анемией, слабостью, повышением СОЭ, артериальной гипертензией и другими общими признаками, должна послужить основанием, по крайней мере, для УЗИ почек. От того, насколько рано будет диагностирована опухоль почки, зависят эффективность лечения и, в конечном счете, жизнь больного.
Диагностика. При наличии опухоли почки больших размеров ее можно пропальпировать через переднюю брюшную стенку. Опухоль будет плотная, бугристая, чаще всего безболезненная при пальпации. Обычно удается прощупать опухолевый узел в нижнем полюсе почки. При перкуссии над опухолью определяется тимпанит, поскольку перед новообразованием, расположенным в забрюшинном пространстве, располагается кишечник. Однако если опухоль имеет большие размеры, перкуторно может отмечаться тупой звук.
Лабораторные исследования имеют ограниченное значение в диагностике опухоли почки. В общем анализе мочи можно обнаружить эритроциты. Клинический анализ крови позволяет выявить анемию,
повышение СОЭ, реже полицитемию. Определенное значение имеет оценка биохимических параметров крови. У больных раком почки описаны нарушения функции печени, которые проявляются повышением активности щелочной фосфатазы, гипербилирубинемией, гипоальбу-минемией, увеличением протромбинового времени и гипергаммагло-булинемией. Эти паранеопластические проявления объединены под названием синдром Штофера - в честь ученого, впервые описавшего их в 1961 г.
Несмотря на то что при раке почки продуцируется ряд биологически активных веществ, ни одно из них не может использоваться в качестве специфического опухолевого маркера в диагностических целях. Также не имеет диагностического значения при раке почки цитологическое исследование мочи.
Ультразвуковое исследование имеет исключительное значение в диагностике опухолей почки. Это связано с доступностью и неинва-зивностью данного метода. У большинства больных с опухолью почки новообразование было впервые обнаружено именно с помощью УЗИ, зачастую проводимого в рамках диспансерного наблюдения или по поводу других заболеваний. Ультразвуковой признак опухоли почки - изменение контура почки за счет образования тканевой акустической плотности. Наличие гипоэхогенных участков в этом новообразовании свидетельствует о процессах опухолевого распада.
Рентгенологические исследования играют весьма важную роль в диагностике опухоли почки. При обзорной рентгенографии почек можно выявить изменение контура почки за счет выпячивания опухолевого образования. Необходимо учитывать, что к изменению формы почки могут привести только достаточно большие опухоли. У ряда больных злокачественные опухоли почек содержат очаги кальци-фикации, что также можно выявить на обзорной рентгенограмме. Выраженность обызвествления различна и варьирует от точечной петрификации до кальцификации всей опухолевой ткани. Установлено, что около 90 % объемных образований почки с центральной и до 20 % образований с периферической кальцификацией являются злокачественными.
Экскреторная урография позволяет обнаружить характерные для опухолевого поражения почки признаки, а также оценить функцию противоположной почки. Последнее весьма важно, поскольку основной метод лечения опухоли почки - нефрэктомия. У подавляющего большинства больных в пораженной опухолью почке отмечается вполне нормальная экскреция рентгеноконтрастного вещества, обес-
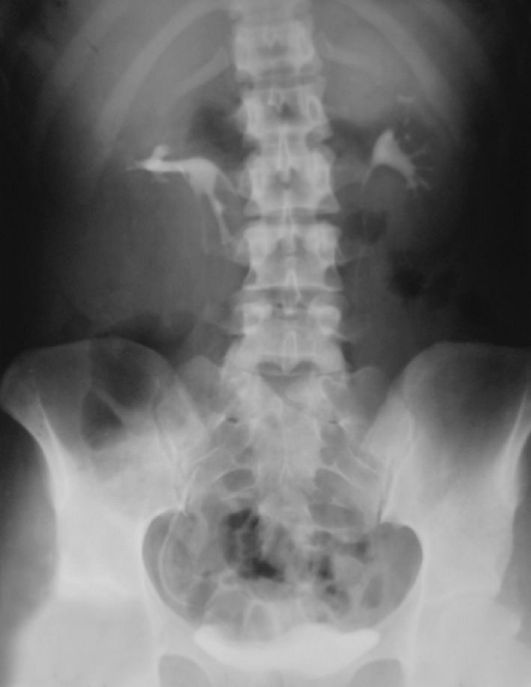
Рис. 11.1. Экскреторная урограмма. Опухоль нижнего полюса правой почки
печивающая хорошую видимость лоханки, чашек и мочеточника.
Рентгенологические симптомы опухоли почки, которые определяются на экскреторных урограммах, - дефект наполнения лоханки или чашек вплоть до полного их исчезновения (ампутации), сегментарное расширение лоханки и чашек, деформация или укорочение чашек с оттеснением их в сторону (рис. 11.1). Если опухоль располагается медиально в нижнем полюсе почки, она может сдавливать мочеточник и смещать его в сторону позвоночника.
Если на экскреторных урограммах не удается четко визуализировать чашечно-лоханочную систему почки, выполняют ретроградную пиелографию (рис. 11.2). Это исследование не должно проводиться на фоне гематурии, чтобы находящийся в лоханке или чашке сгусток крови не стал причиной дефекта наполнения и не был ошибочно интерпретирован как опухоль. Обычно ретроградную пиелографию проводят через 5-7 сут после прекращения гематурии. При ее выполнении особенно важно вводить рентгеноконтрастное вещество медленно и в объеме не более 5-6 мл. Это связано с профилактикой лоханочно-почечных рефлюксов и, следовательно, с уменьшением вероятности метастазирования.
Компьютерная томография и МРТ являются наиболее важными методами диагностики опухоли почки. Они позволяют оценить стадию рака почки
Внутривенное контрастирование существенно увеличивает информативность КТ. После контрастирования становится заметнее граница между опухолью и неизмененной почечной паренхимой. КТ позволяет не только выявить факт наличия новообразования, но и оценить его размеры, локализацию, отношение к чашечно-лоханочной системе,
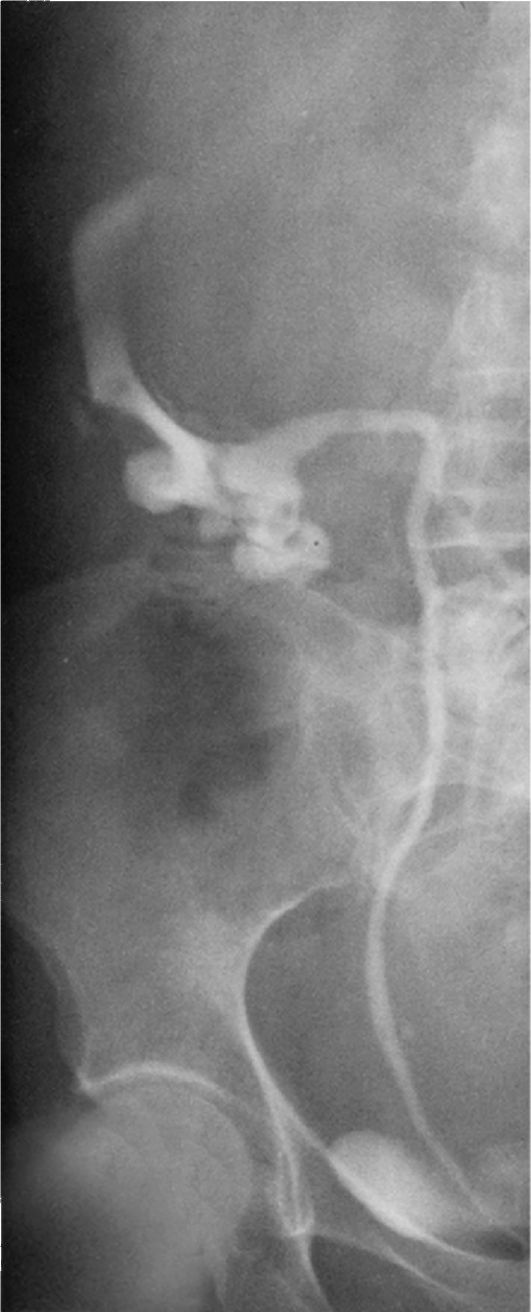
Рис. 11.2. Ретроградная уретеропиело-грамма. Опухоль верхнего полюса правой почки
окружающим органам и тканям, состояние ворот почки, околопочечной клетчатки, почечной и нижней полой вен, надпочечников, регионарных лимфатических узлов и соседних органов. С помощью КТ устанавливают стадию опухолевого процесса и определяют тактику лечения. Всем больным, у которых по данным какого-либо выполненного ранее исследования имеется подозрение на опухоль почки, показано проведение КТ.
Магнитно-резонансная томография в некоторых случаях даже более информативна, чем КТ. Так, МРТ позволяет более точно определить степень вовлечения в опухолевый процесс крупных сосудов.
Ангиография (аортография и селективная почечная ангиография ) - весьма информативный метод исследования при опухолях почки, однако в последнее время ее используют относительно редко. Это связано с широким внедрением в диагностический процесс КТ и МРТ, а также с тем, что ангиография является инва-зивным исследованием, иногда приводящим к весьма опасным осложнениям: кровотечениям, образованию ложных аневризм в месте пункции сосудов, тромбоэмболии почечных сосудов. Ангиографию при раке почки
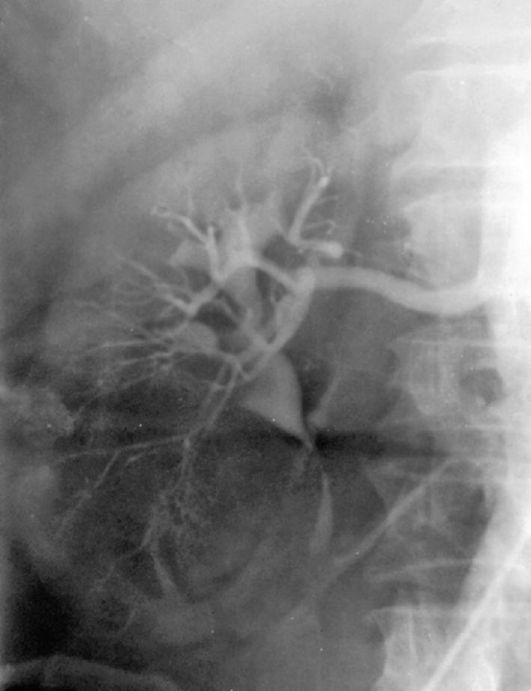
Рис. 11.3. Почечная ангиограмма. Опухоль нижнего полюса правой почки
выполняют по особым показаниям, например, при планировании органосохраняющих оперативных вмешательств при двусторонних опухолях или раке единственной почки.
Характерными ангиогра-фическими признаками опухоли почки являются расширение почечной артерии с пораженной стороны, наличие участков повышенной васкуляризации, а также изменение сосудистого рисунка (рис. 11.3). В опухолевом узле можно обнаружить истонченные, извитые, с множеством аневризмоподобных расширений кровеносные сосуды. Чрезвычайно характерный признак новообразования почки - наличие беспорядочных, разных по величине и форме скоплений рентгеноконтрастного вещества в опухолевой ткани - получил необычное название «симптом лужиц и озер».
При недостаточной информативности стандартного ангиогра-фического исследования почек выполняют фармакоангиографию. Возможность ее применения основана на том, что сосуды, расположенные в опухолевом узле и нормальной ткани, по-разному реагируют на введение вазоактивных веществ. Известно, что сосудосуживающие препараты сильнее влияют на артериолы нормальной почечной ткани, чем на сосуды опухоли, поэтому последние оказываются более заметными на фоне нормальных сосудов.
Венокавография имеет определенное значение в оценке распространенности рака почки и выборе объема оперативного вмешательства. Выявление дефекта наполнения в почечной вене и нижней полой вене указывает на прорастание опухоли в эти сосуды. Дистальнее места тромбоза нижняя полая вена будет расширена. Метастазы в парака-вальные лимфатические узлы могут проявляться дефектами наполнения вследствие сдавления нижней полой вены извне.
Радионуклидные методы исследования после появления КТ утратили свое диагностическое значение, однако иногда их выполняют для оценки функционального состояния пораженной и, что важнее, противоположной почки. На радиоизотопных нефросцинтиграммах можно увидеть отсутствие изображения части почечной паренхимы.
При обследовании пациента с опухолью почки необходимо провести исследования, направленные на выявление отдаленных метастазов. Метастазы в легкие выявляют с помощью рентгенографии и КТ легких. Костные метастазы диагностируют с помощью рентгенографии, а также сцинтиграфии костей. Метастазы в печень обнаруживают при КТ и УЗИ. Метастатические поражения мозга лучше всего выявляются по результатам МРТ.
Дифференциальная диагностика. Опухоль почки необходимо дифференцировать от ряда других почечных и непочечных заболеваний. Чаще всего проводится дифференциальный диагноз с кистой почки, гидронефрозом, поликистозом, абсцессом почки.
Кисту почки можно прощупать через переднюю брюшную стенку, однако консистенция ее будет эластичной. При УЗИ киста будет определяться как гипоэхогенное образование с четкими контурами. Также характерный вид будет иметь киста почки при КТ. Однако с учетом того, что опухоль может развиваться в кисте, при выполнении разных вмешательств по поводу кисты почки (пункции, иссечении) необходимо цитологическое исследование содержимого кисты на наличие атипичных клеток.
Почку можно пальпировать также при гидронефрозе. Однако результаты УЗИ и экскреторной урографии позволяют поставить правильный диагноз.
При поликистозе почек можно прощупать бугристые плотные почки с двух сторон. Для дифференциальной диагностики поликистоза и двусторонних опухолей почки выполняют УЗИ, КТ, а при отсутствии выраженной хронической почечной недостаточности - экскреторную урографию.
Абсцесс (карбункул) почки при УЗИ и экскреторной урографии может быть принят за опухоль почки. Для уточнения диагноза нередко выполняют почечную ангиографию и КТ.
Кроме указанных заболеваний, опухоли почек иногда приходится дифференцировать от проявлений лимфогранулематоза, неходжкинских лимфом, артериовенозных свищей, опухолей надпочечника и метастазов в почки злокачественных опухолей других органов. Указанные заболевания могут вызывать характерные для опухоли почки рентгено-
логические и ультразвуковые признаки. Поставить правильный диагноз помогают почечная ангиография, КТ и МРТ.
Лечение. Тактика лечения рака почки зависит от стадии опухолевого процесса. Оперативные методы остаются ведущими в лечении локализованных злокачественных опухолей почки. Основной оперативный метод - радикальная нефрэктомия. Во время этого вмешательства единым блоком удаляют почку вместе с околопочечной и забрюшинной жировой клетчаткой, регионарными лимфатическими узлами от диафрагмы до бифуркации аорты и места слияния общих подвздошных вен.
Выполнение радикальной нефрэктомии затруднено при прорастании опухоли в почечную и нижнюю полую вены. Частота венозной опухолевой инвазии составляет 4-10 %. При прорастании опухоли до устья почечной вены и стенки нижней полой вены выполняют краевую резекцию нижней полой вены. Необходимость удаления надпочечника при выполнении нефрэктомии возникает при больших опухолях верхнего полюса почки, а также если обнаружены метастазы в надпочечник при КТ или во время операции.
Оперативный доступ при выполнении радикальной нефрэктомии выбирают, исходя из необходимости соблюдения основного постулата онкологии - абластичности, а также минимальной травматичности и доступности объекта операции. Используют люмботомический, транс-перитонеальный и трансторакальный доступы к почке.
Уменьшения кровопотери во время нефрэктомии можно достичь за счет предоперационной эмболизации почечных артерий. Ее обычно выполняют при наличии опухоли большого размера, увеличении регионарных лимфатических узлов, прорастании опухоли в нижнюю полую вену, а также в качестве паллиативного вмешательства при кровоточащих опухолях у неоперабельных больных.
Помимо радикальной нефрэктомии, у некоторых пациентов показано выполнение органосохраняющей операции - резекции почки. Она является общепринятым методом лечения больных с опухолью единственной почки, двусторонними поражениями, а также с нарушением функции противоположной почки. В последние годы резекцию почки выполняют при небольших (до 4 см) опухолях. Во время органосохра-няющей операции необходимо выполнять морфологическое исследование ткани почки, чтобы определить границу опухолевой инвазии.
В последние годы широкое распространение получили лапароскопические радикальная нефрэктомия и резекция почки. Отдаленные результаты этих операций сопоставимы с таковыми открытых вмешательств.
При наличии местнораспространенного и метастатического рака почки радикальное удаление опухоли невозможно. В таких случаях применяют паллиативное хирургическое лечение, лучевую терапию, иммунотерапию, химиотерапию и гормональную терапию. Доля больных, у которых к моменту диагностики рака почки радикальное вмешательство невыполнимо, достигает 30 %.
Паллиативную нефрэктомию выполняют при выраженной гематурии, сильных болях, не купируемых анальгетиками, выраженных пара-неопластических проявлениях. Возможно одномоментное выполнение нефрэктомии и метастазэктомии. Подобные операции успешно выполняют при наличии метастазов в печени, легких, головном мозге.
Роль химиотерапии в лечении больных с опухолями почки незначительна. Это связано с тем, что почечно-клеточный рак является одним из наименее чувствительных к химиотерапии эпителиальных злокачественных новообразований. Резистентность к цистостатикам связана с продукцией опухолью ряда биологически активных веществ и наличием соответствующих генов. К наиболее часто назначаемым цитотоксическим препаратам относятся винбластин и 5-флуороура-цил. Однако частота частичных и полных ремиссий при назначении, например, винбластина, не превышает 10 %. Химиопрепараты обычно применяют в комбинации с иммунотерапией.
Гормональная терапия, в частности препаратами прогестерона, которую еще недавно широко применяли для лечения распространенных форм рака почки, в настоящее время из-за крайне низкой эффективности практически не используется. Частота ремиссий при назначении гормональной терапии составляет 1-2 %.
Лучевая терапия из-за радиорезистентности рака почки также не получила широкого распространения. Ее роль в лечении опухолей почки продолжает оставаться предметом дискуссий. Результаты ряда исследований показали, что лучевая терапия может быть достаточно эффективна у больных с метастазами в головной мозг, легкие и кости.
При распространенном раке почки велика роль иммунотерапии. Это связано как с низкой эффективностью химио-, гормональной и лучевой терапии, так и с особенностями самого почечно-клеточного рака.
Наиболее широкое распространение получило использование α-интерферона, интерлейкина-2 и их комбинации. Эффективными эти препараты оказываются для 15-20 % больных, у которых могут вызвать кратковременную или длительную ремиссию.
Определенные перспективы связаны с достижениями молекулярной генетики почечно-клеточного рака, которые позволяют надеяться на
скорое появление принципиально новых иммунопрепаратов для лечения больных раком почки, в частности ингибиторов ангиогенеза опухоли.
Новое перспективное направление лечения рака почки, в особенности на стадии T3, - адъювантная опухолевая вакцинация с использованием таргетных препаратов, потенциально способных улучшить безрецидивную выживаемость.
11.1.2. Опухоли почечной лоханки и мочеточника
Эпидемиология. Опухоли почечной лоханки и мочеточника встречаются относительно редко и составляют около 7-10 % всех новообразований почки.
Наличие опухолей верхних мочевых путей значительно увеличивает риск развития новообразований мочевого пузыря. Установлено, что переходно-клеточный рак мочевого пузыря развивается у 30-50 % больных раком мочеточника.
Этиология. Уротелий весьма чувствителен к разным химическим канцерогенам, находящимся в моче. Для возникновения опухоли, помимо канцерогенов, также необходимы так называемые ко-канцеро-гены, или инициаторы онкогенеза. Последние вызывают гиперплазию уротелия, что увеличивает его чувствительность к химическим канцерогенам.
Важную роль в развитии переходно-клеточного рака играет длительность контакта канцерогенов и клеток уротелия. Значение застоя мочи в возникновении рака верхних мочевых путей подтверждает чрезвычайно высокая (до 30 %) частота развития опухолей в дивертикулах мочеточников.
На сегодняшний день установлено значительное число химических веществ, являющихся канцерогенами для уротелия: бензидин, р-нафтиламин, амино-, нитро-, диаминобифенил и др. Установлена связь между количеством потребляемого с водой мышьяка и заболеваемостью переходно-клеточным раком верхних мочевых путей. Наличие химических канцерогенов объясняет также большую частоту переход-но-клеточного рака верхних мочевых путей у городских жителей по сравнению с сельскими.
Многие исследователи считают важным фактором развития опухолей верхних мочевых путей курение. Риск возникновения опухолей верхних мочевых путей напрямую зависит от числа выкуренных в день сигарет и продолжительности курения. Полагают, что у курящих в моче повышается концентрация промежуточных продуктов метабо-
лизма триптофана, имеющих структуру, подобную ортоаминофенолу, и являющихся сильными канцерогенами.
Помимо химических канцерогенов, в этиологии опухолей верхних мочевых путей играют роль и некоторые другие факторы. Установлено, что длительное нахождение в почечной лоханке конкрементов, выступающих в качестве ко-канцерогенов и вызывающих гиперплазию уротелия, повышает риск развития плоскоклеточного рака почечной лоханки.
Частота опухолей верхних мочевых путей повышается при некоторых заболеваниях. В частности балканская эндемическая нефропатия повышает риск развития новообразований мочеточника и почечной лоханки в 100 раз. Объяснений данному феномену пока нет, тем более что при этом не повышается частота опухолей мочевого пузыря и, следовательно, отсутствует специфическое влияние на весь уротелий.
Установлено, что частота развития опухолей верхних мочевых путей увеличивается у больных с артериальной гипертензией. При этом риск возникновения новообразований повышается еще в два раза при лечении таких пациентов диуретиками.
Классификация. Различают первичные и вторичные опухоли почечной лоханки и мочеточника. Под первичными понимают новообразования, исходящие непосредственно из верхних мочевых путей, тогда как вторичные опухоли представляют метастазы злокачественных новообразований других органов. Вторичные поражения верхних мочевых путей встречаются чрезвычайно редко, причем преимущественно в мочеточнике.
Опухоли почечной лоханки и мочеточника можно разделить на доброкачественные и злокачественные. Первые наблюдаются значительно реже. Из-за чрезвычайно высокого потенциала малигнизации доброкачественных эпителиальных опухолей верхних мочевых путей относиться к ним следует как к высокодифференцированному неин-вазивному раку.
При злокачественных опухолях верхних мочевых путей часто обнаруживают несколько очагов малигнизации уротелия, поэтому клинически и прогностически важно выделять единичные и множественные (мультифокальные) новообразования. Последние выявляются примерно у 20 % больных с первичным раком верхних мочевых путей. Также большое значение для определения тактики лечения имеет выявление одно-и двусторонних (билатеральных) опухолей верхних мочевых путей.
Опухоли верхних мочевых путей могут происходить из эпителиальной и мезенхимальной тканей. Частота последних крайне низ-
кая - менее 1 % всех случаев первичных опухолей почечной лоханки и мочеточника. К неэпителиальным опухолям верхних мочевых путей относятся доброкачественные фиброма, нейро-, ангиофиброма, липома, рабдомиома. Описаны единичные случаи злокачественных лейоми-осаркомы и фибросаркомы верхних мочевых путей.
Первичные опухоли верхних мочевых путей в подавляющем большинстве случаев происходят из уротелия. По гистологическому строению среди злокачественных эпителиальных новообразований выделяют переходно-клеточный, плоскоклеточный рак и аденокарцино-му. Большинство новообразований почечной лоханки и мочеточника представлено переходно-клеточным раком. Его частоту оценивают в 92-99 % всех опухолей верхних мочевых путей. Частота плоскоклеточного рака 1-8 %. Опухоли такого гистологического строения чаще обнаруживают в почечной лоханке. Аденокарциномы верхних мочевых путей встречаются исключительно редко (известно не более ста наблюдений).
Общеупотребительной и клинически важной является классификация рака по системе TNM.
К моменту установления диагноза 36-41 % злокачественных опухолей верхних мочевых путей оказываются инвазивными.
Чрезвычайно важную клиническую и прогностическую роль играет определение степени дифференцировки опухолевых клеток (соответствующей градации злокачественности).
Опухоли верхних мочевых путей также разделяют на локализованные, регионарные и метастатические.
К локализованным относятся не выходящие за пределы почечной лоханки, почки или мочеточника новообразования верхних мочевых путей при отсутствии поражения лимфатических узлов и отдаленных метастазов.
Классификация рака почечной лоханки и мочеточника по системе TNM (2002)
Т - первичная опухоль
Тх - первичная опухоль не выявлялась.
Т0 - нет доказательств наличия первичной опухоли.
Та - папиллярный неинвазивный рак.
Ή$ - карцинома in situ.
Т1 - прорастание в подслизистый слой.
Т2 - прорастание в мышечный слой.
Т3 - опухоль почечной лоханки прорастает в перипельвикальную клетчатку или паренхиму почки; опухоль мочеточника прорастает в периуретеральную клетчатку.
Т4 - опухоль прорастает в соседние органы или через почку в околопочечную клетчатку.
N - регионарные лимфатические узлы
Nx - регионарные лимфатические узлы не оценивались. N0 - отсутствие метастазов в регионарные лимфатические узлы. N1 - метастазы в один лимфатический узел размером 2 см и менее.
N2 - метастазы в один или несколько лимфатических узлов размером от 2 до 5 см.
N3 - метастазы в лимфатические узлы размером более 5 см.
М - отдаленные метастазы
Мx - отдаленные метастазы не оценивались. М0 - отсутствие отдаленных метастазов. М1 - наличие отдаленных метастазов.
При регионарной форме заболевания опухоль распространяется за пределы почечной лоханки или паренхимы почки и прорастает в перипельвикальную, периренальную или периуретеральную клетчатку, лимфатические узлы, лимфатические сосуды и соседние органы.
Признаком метастатических новообразований является распространение опухолевых клеток в отдаленные органы и ткани.
Симптоматика. Наиболее частый симптом опухолей почечной лоханки и мочеточника - гематурия. Она присутствует у 70-95 % таких больных.
Макрогематурия у 65-70 % пациентов является первым симптомом опухоли верхних мочевых путей и в большинстве случаев служит причиной обращения к врачу.
Второй по частоте симптом опухолей верхних мочевых путей - боли в поясничной области. Они встречаются у 20-50 % больных и связаны с обтурацией мочеточника или лоханочно-мочеточникового сегмента опухолевым образованием.
Значительно реже опухоли верхних мочевых путей проявляются дизурией (5-10 %) и общими симптомами, такими как похудание, снижение аппетита и субфебрилитет (5-15 %).
На поздних стадиях заболевания в 10-20 % случаев можно про-пальпировать в животе объемное образование - либо значительных размеров опухоль, либо гидронефротически измененную почку.
Диагностика. Комплекс диагностических исследований для выявления опухоли верхних мочевых путей включает физикальное обследование больного, цитологическое исследование мочи, экскреторную урографию, ретроградную уретеропиелографию, цистоскопию, уретеро-пиелоскопию, КТ и, при необходимости, почечную артериографию.
При физикальном обследовании больных с опухолями верхних мочевых путей иногда удается пропальпировать объемное образование в животе.
Цитологическое исследование мочи позволяет выявить атипичные опухолевые клетки. Относительно диагностической ценности этого исследования нет единого мнения.
Экскреторная урография является важным и обычно начальным методом обследования больных с подозрением на опухоль верхних мочевых путей.
Особенно высока ценность экскреторной урографии при опухолях почечной лоханки, поскольку почти у всех таких больных на урограм-мах обнаруживаются те или иные нарушения. Наиболее частым рентгенологическим признаком при этом является дефект наполнения, обнаруживаемый в 50-75 % случаев. Реже наблюдаются гидронефроз из-за обструкции мочеточниково-лоханочного сегмента и «немая» почка.
При новообразованиях мочеточника экскреторная урография менее информативна. Основной рентгенологический признак - дефект наполнения мочеточника.
Ретроградная уретеропиелография также является важным рентгенологическим методом исследования.
Характерные признаки опухоли мочеточника - дефект наполнения мочеточника с характерным контуром его нижнего края в виде бокала и локальное расширение мочеточника дистальнее дефекта наполнения.
Во время подготовки к ретроградной уретеропиелографии при катетеризации мочеточника можно выявить два симптома, достаточно специфичных для опухоли мочеточника.
Первый из них заключается в выделении мочи с примесью крови до и во время прохождения препятствия в мочеточнике и прекращении гематурии после его преодоления (симптом Шевассю).
Другой характерный признак опухоли мочеточника - изгиб моче-точникового катетера в расширенном пространстве дистальнее опухоли мочеточника (симптом Бергмана).
Ретроградная уретеропиелография также очень полезна при диагностике опухолей почечной лоханки (рис. 11.4). Иногда выполняют антеградную пиелографию (рис. 11.5).
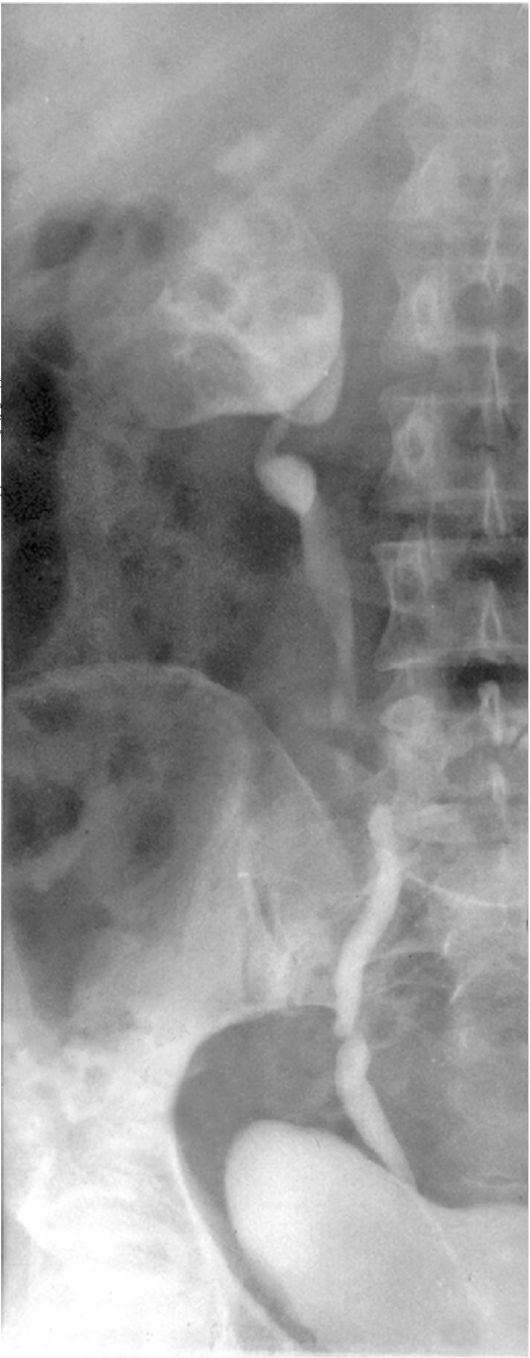
Рис. 11.4. Ретроградная уретеропиело-грамма. Опухоль почечной лоханки
Дифференциальная диагностика опухолей почечной лоханки и мочеточника, проявляющихся дефектами наполнения, проводится, в первую очередь, с рентгено-негативными камнями и сгустками крови.
Цистоскопия позволяет обнаружить пролабирующую из устья мочеточника опухоль, состояние слизистой оболочки вокруг него, а также обнаружить выделение крови из устья мочеточника.
В последние 15-20 лет уре-теропиелоскопия используется для диагностики новообразований почечной лоханки и мочеточника. Совершенствование эндоскопической техники, в частности появление гибких уретеропиелоскопов, позволило считать уретеропиело-скопию одним из наиболее ценных методов исследования при опухолях верхних мочевых путей. Помимо визуальной оценки стенки мочеточника и почечной лоханки, во время уретеропиелоскопии можно выполнить биопсию подозрительных участков для проведения морфологического исследования, а в некоторых случаях и полностью резецировать новообразование.
Диагностическая урете-ропиелоскопия не повышает риск диссеминации опухо-
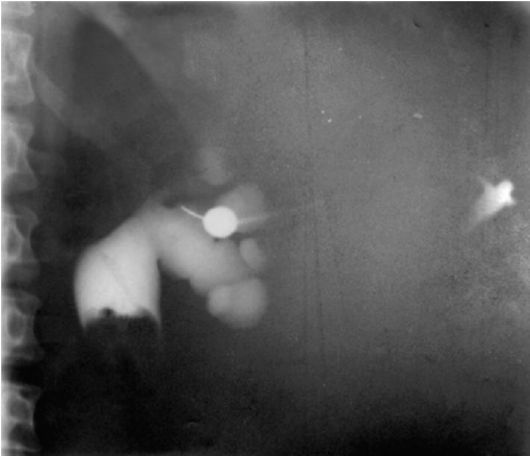
Рис. 11.5. Антеградная пиелоуретеро-грамма. Опухоль верхней трети левого мочеточника
левых клеток и не влияет на отдаленные исходы и выживаемость у пациентов с переход-но-клеточным раком верхних мочевых путей.
Компьютерная томография широко применяется для диагностики опухолей верхних мочевых путей. Она позволяет выявить прорастание переход-но-клеточного рака в почечную паренхиму, распространение опухоли за пределы почки в соседние ткани, поражение лимфатических узлов и наличие отдаленных метастазов.
Ультразвуковое исследование позволяет обнаружить инфильтрацию переходно-клеточного рака в почечную паренхиму, проявляющуюся наличием образований с пониженной эхогенностью. УЗИ играет важную роль в дифференциальной диагностике новообразований почечной лоханки и рентгенонегативных камней почки.
В последние годы появились сообщения о применении при опухолях верхних мочевых путей во время уретеропиелоскопии эндолюми-нального УЗИ.
Почечная артериография может оказаться полезной при проведении дифференциальной диагностики почечно-клеточного рака и переходно-клеточного рака, прорастающего в почечную паренхиму. Инфильтрирующие опухоли, исходящие из почечной лоханки, на арте-риограммах обычно гиповаскулярны.
Для обнаружения отдаленных метастазов используют рентгенографию грудной клетки, сцинтиграфию костей, сцинтиграфию и УЗИ печени.
Для ранней диагностики злокачественных эпителиальных новообразований верхних мочевых путей перспективным представляется выявление специфических маркеров опухолевого процесса. С этой целью предлагали определять концентрацию продуктов деградации фибриногена в моче, повышение которой наблюдается при переход-но-клеточном раке. Однако эта методика оказалась недостаточно специфичной, в связи с чем поиск более совершенных способов ранней диагностики рака верхних мочевых путей остается актуальной проблемой онкоурологии.
Лечение. Основной метод лечения опухолей верхних мочевых путей - оперативный. Помимо хирургического лечения, применяют химио- и радиотерапию, однако чувствительность опухолевых клеток к ним невелика.
Выбор тактики лечения новообразований верхних мочевых путей зависит от стадии заболевания, степени дифференцировки опухолевых клеток, локализации новообразования, множественности поражения, состояния противоположной почки, а также наличия противопоказаний к оперативному лечению.
Стандартные и общепризнанные методы лечения больных с локализованными опухолями - нефроуретерэктомия и резекция мочевого пузыря.
В послеоперационном периоде возможна адъювантная терапия, основными направлениями которой являются системная химио-, радиотерапия и топическая химио- и иммунотерапия.
Полагают, что адъювантная химиотерапия для профилактики реци-дивирования рака должна назначаться во всех случаях инвазивного рака и при низкой степени дифференцировки опухолевых клеток, в том числе после радикальных операций.
Прогноз. Переходно-клеточный рак почечной лоханки и мочеточника излечим более чем у 90 % пациентов, если он поверхностный и ограничен почечной лоханкой и мочеточником. Инвазивные опухоли, но также ограниченные почечной лоханкой и мочеточником, имеют благоприятный исход у 10-15 % больных. Опухоли, прорастающие в соседние ткани, а также метастазирующие в отдаленные органы, в настоящее время практически неизлечимы.
Наиболее важные факторы, влияющие на прогноз у больных с пере-ходно-клеточным раком верхних мочевых путей, - величина первичной опухоли, глубина инвазии, степень дифференцировки опухолевых клеток, инвазия опухоли в венозные и лимфатические сосуды, наличие отдаленных метастазов и радикальность проведенного лечения.
11.1.3. Нефробластома (опухоль Вильмса)
Эпидемиология. Нефробластома (опухоль Вильмса) - самая частая опухоль почки у детей. Развивается обычно в возрасте от 2 до 5 лет, но может поражать детей и в других возрастных группах. Частота выявления опухоли не зависит от пола и встречается с одинаковой частотой у мальчиков и девочек. Примерно у 5 % больных опухоль Вильмса двусторонняя. У взрослых нефробластома встречается чрезвычайно редко.
Этиология. В последние годы достигнуты значительные успехи в изучении причин развития опухоли Вильмса. Установлено, что развитие опухоли связано с нарушением эмбриогенеза почки. Ключевую роль в этом играют генетические нарушения. Установлено, что за возникновение опухоли Вильмса ответственны нарушения в нескольких генах - WT1, WT2 и WT3. Согласно одной из теорий развития опухоли, в процессе эмбриогенеза в зачатках почек локализуются гнезда метанефрогенной ткани, которые длительное время могут существовать в неизмененном виде. Затем они либо регрессируют, либо дают начало развитию нефробластомы.
Роль генетических факторов в развитии опухоли Вильмса также подтверждает ее частое сочетание с пороками развития других органов и систем. Установлено, что мутации в гене WT1 не только приводят к возникновению данного новообразования, но и проявляются аномалиями мочеполовых органов (гипоспадией, крипторхизмом, сращением почек), аниридией (врожденным отсутствием радужки), врожденной гемигипертрофией, синдромом Беквитта-Видеманна.
Симптоматика. Клиническая картина опухоли Вильмса зависит от стадии заболевания, наличия метастазов и возраста пациента.
На ранних стадиях клинические проявления опухоли скудные - обычно это слабость, недомогание, похудание, снижение аппетита, периодический субфебрилитет, умеренная анемия, повышение СОЭ.
На поздних стадиях опухоли Вильмса наиболее специфическим признаком является пальпируемое объемное образование в животе. Иногда оно обнаруживается непосредственно матерью или врачом при обычном профилактическом осмотре ребенка, не предъявляющего никаких жалоб и хорошо себя чувствующего. При пальпации опухоль чаще всего плотная и гладкая, реже бугристая. Она может фиксироваться к окружающим структурам и не смещаться при пальпации.
Боли не характерны, но иногда беспокоят детей с опухолью больших размеров. Причиной болей служат либо давление на окружающие органы, либо прорастание опухолью диафрагмы, печени или забрюшинной клетчатки.
Гематурия наблюдается лишь у 10-12 % больных. Нередко у детей с опухолью Вильмса отмечается артериальная гипертензия.
Метастазирование происходит гематогенно и лимфогенно. Наиболее частая локализация метастазов - легкие, затем печень, головной мозг, кости, противоположная почка. Возможно образование опухолевых тромбов в почечной и нижней полой вене.
Диагностика. При подозрении на опухоль Вильмса необходимо комплексное обследование ребенка, включающее лабораторные, рентгенологическое, радионуклидное, ультразвуковое и другие исследования.
Лабораторные исследования позволяют выявить гематурию и анемию. При метастатических поражениях печени могут наблюдаться изменения биохимических показателей.
При УЗИ почек обнаруживают объемное тканевое образование в почке, проводят дифференциальную диагностику с кистозными образованиями. УЗИ используют также для скринингового обследования детей из группы риска развития опухоли Вильмса.
КТ брюшной полости и забрюшинного пространства - один из самых точных методов выявления опухоли, поражения регионарных лимфатических узлов и окружающих органов и тканей.
МРТ позволяет наиболее точно оценить состояние нижней полой вены и правого предсердия.
Значение экскреторной урографии в диагностике опухоли Вильмса по сравнению с УЗИ, КТ и МРТ невелико. Она недостаточно информативна при дифференциальной диагностике исходящих из почки объемных образований от внепочечных, например, нейробластомы надпочечника, а также при небольшой опухоли Вильмса.
Селективную почечную ангиографию используют при невозможности подтвердить наличие опухоли другими методами, для дифференциальной диагностики внутри- и внепочечных образований, точного определения размеров опухоли и ее прорастания в окружающие ткани. Она показана также при двусторонних опухолях и опухолях аномальных, например подковообразных, почек.
Рентгенографию грудной клетки и черепа выполняют для обнаружения метастазов соответственно в легких и в костях черепа, а вено-кавографию - для выявления прорастания опухоли в нижнюю полую вену и определения положения этой вены относительно опухоли.
Радионуклидное сканирование скелета применяют для выявления метастазов опухоли в кости.
Дифференциальную диагностику необходимо проводить с простой кистой почки, гидронефрозом, поликистозом, тромбозом почечной вены. Наибольшие трудности в дооперационном периоде представляет дифференциальная диагностика опухоли Вильмса с другими новообразованиями почки, такими как фетальная мезодермальная гамартрома, ангиомиолипома и почечно-клеточный рак.
Лечение. Выбор тактики лечения опухоли Вильмса основан на оценке стадии заболевания, особенностей гистологического строения
опухоли и возраста ребенка. Главный принцип - применение комплексного лечения: хирургического, химио- и радиотерапии. Целью лечения является достижение максимального эффекта при минимальных осложнениях.
Хирургическое лечение остается основным методом лечения больных с опухолью Вильмса. При односторонней опухоли операцией выбора служит трансперитонеальная нефрэктомия, при двусторонней - двусторонняя резекция почки в пределах здоровых тканей под контролем гистологического исследования. Наличие отдаленных метастазов не является противопоказанием к удалению первичного очага.
Лучевую терапию используют как дополнение к хирургическому методу лечения. Опухоль Вильмса радиочувствительна. Однако применение лучевой терапии может способствовать задержке развития ребенка, вызвать осложнения со стороны сердечно-сосудистой системы, легких и печени. В этой связи в предоперационном периоде лучевая терапия практически полностью уступила место химиотерапии, а послеоперационную лучевую терапию используют только у детей с прогностически неблагоприятными типами опухоли.
Химиотерапия - важнейший компонент комбинированного лечения, назначается при всех стадиях болезни. Чаще всего используют такие цитостатики, как винкристин, доксорубицин, дактиноми-цин. Основные трудности при проведении химиотерапии связаны с соблюдением баланса между достижением высокой эффективности лечения и ее переносимостью ребенком, зачастую раннего возраста или новорожденным. В этой связи дозы химиопрепаратов детям в возрасте до 12 месяцев уменьшают на 50 % по сравнению с обычными дозами из-за риска развития тяжелых побочных эффектов. Уменьшение дозы цитостатиков при этом не сказывается на исходе лечения. Еще одним способом предотвращения нежелательных побочных эффектов лечения является использование пульс-терапии, т. е. кратковременного введения больших доз химиопрепаратов. Для уменьшения токсического эффекта не рекомендуют также назначать цитостатики одновременно с лучевой терапией.
Прогноз. Четырехлетняя общая выживаемость при опухоли Вильмса прогностически благоприятных гистологических типов достигает 90 %. При прогностически неблагоприятных гистологических типах опухоли, особенно фетальной рабдомиоматозной нефробластоме, этот показатель существенно ниже.
11.2. ЗАБРЮШИННЫЕ ОПУХОЛИ И ОПУХОЛИ НАДПОЧЕЧНИКА
Опухоли забрюшинного пространства. Они встречаются редко и составляют 0,15-0,2 % всех новообразований человека. Источником роста ретроперитонеальных опухолей могут служить различные мягкие ткани. Согласно гистологической классификации, выделяют 15 типов новообразований забрюшинного пространства, 70-85 % из них приходится на злокачественные опухоли, среди которых чаще встречаются липосаркомы, лейомиосаркомы, фибросаркомы и нейрогенные саркомы. Среди доброкачественных опухолей чаще встречаются опухоли нейрогенного происхождения, образования жировой ткани, а также фибромы, гемангиомы, лейомиомы и т. д.
Симптоматика опухолей забрюшинного пространства разнообразна: больные могут жаловаться на боли в поясничной области, тошноту и рвоту, запоры, отеки на ногах, расстройства мочеиспускания. Опухоли небольших размеров могут не иметь клинических проявлений, на поздних стадиях в результате давления на окружающие органы может появиться варикоцеле, расширение подкожных вен живота (по типу «головы медузы»), асцит, отеки нижних конечностей, а при распаде или нагноении опухоли - лихорадка. При этом многие пациенты отмечают увеличение живота.
Наличие опухоли забрюшинного пространства можно заподозрить при объективном обследовании: при осмотре может определяться асимметрия живота, а иногда новообразования малого таза выступают на промежности или в ягодичной области. При пальпации в проекции одной из половин живота определяется плотное образование, иногда - значительных размеров, уходящее в подреберье или достигающее малого таза.
На обзорных урограммах у ряда больных может отмечаться сглаженность контура поясничной мышцы, а в проекции опухоли - затенение с очагами обызвествления. Внутривенная урография позволяет выявить изменение положения почки, мочеточника и мочевого пузыря, а также нарушение функции почек и деформацию чашечно-лоханочного комплекса. Локализацию и размеры опухоли можно уточнить при УЗИ, однако наиболее полную информацию о расположении ретроперитоне-ального новообразования, его консистенции и связях с прилежащими забрюшинными и внутрибрюшинными структурами дают КТ или МРТ. Эти методы также позволяют провести дифференциальную диагностику опухолей забрюшинного пространства с опухолями и кистами
других органов, а также с паразитарными заболеваниями и инкапсулированными гематомами.
Если у пациентов имеются симптомы, позволяющие заподозрить вовлечение кишечника в опухолевый процесс, показано проведение исследования кишечного тракта с контрастированием барием. При клинических проявлениях сдавления нижней полой вены выполняют венокавографию. В ряде случаев окончательный диагноз удается установить лишь после оперативного вмешательства - ревизии забрюшин-ного пространства, интраоперационной биопсии опухолевой ткани и гистологического исследования.
Единственный эффективный метод лечения больных с опухолями забрюшинного пространства - хирургический, однако большие размеры новообразований и вовлечение в процесс прилежащих органов не позволяют произвести радикальное удаление в пределах здоровых тканей примерно у половины пациентов. Оперативные вмешательства требуют широкого доступа (люмболапаротомия) и могут сопровождаться значительными техническими трудностями, так как нередко возникает необходимость выполнения резекции нижней полой вены, кишечника, желудка, печени, поджелудочной железы, спленэктомии, нефрэктомии и т. д.
Прогноз у большинства больных с опухолями забрюшинного пространства неблагоприятный - пятилетняя выживаемость колеблется от 5 до 40 % и зависит от степени злокачественности новообразования, расположения и возможности радикального хирургического лечения.
Опухоли надпочечников также относят к редко встречающимся новообразованиям и по происхождению делят на две группы: новообразования коры надпочечника (альдо-, андро-, кортикостерома, корти-коэстрома, смешанные опухоли) и мозгового вещества надпочечника (исходящие из нервных клеток - ганглионеврома и симпатобластома; исходящие из хромаффинных клеток - феохромоцитома и феохромо-бластома).
Клинические проявления опухолей обусловлены повышением продукции соответствующих гормонов. Так, при альдостероме увеличение уровня альдостерона приводит к нарушению водно-электролитного обмена, что проявляется стойким повышением артериального давления, слабостью мышц, развитием судорог, парезов и параличей.
При андростероме наблюдается избыточная продукция андрогенов, приводящая к ускорению полового созревания мальчиков и развитию признаков маскулинизации у девочек и женщин - прекращению менст-
руального цикла, атрофии молочных желез и гипертрофии клитора, росту бороды и усов.
Кортикостерома вызывает повышенную секрецию кортикостерои-дов, что сопровождается комплексом клинических проявлений - синдром Кушинга. Наиболее характерные симптомы этого синдрома при опухоли надпочечника - ожирение, гипертензия, мышечная слабость, гирсутизм и нарушение углеводного обмена с развитием сахарного диабета.
Кортикоэстрома - редко встречающееся заболевание, при котором в крови значительно повышается уровень эстрогенов, что способствует феминизации и развитию половых расстройств у мужчин.
При смешанных опухолях коры надпочечников могут отмечаться все перечисленные признаки.
Ганглионеврома - не обладающее гормональной активностью новообразование мозгового слоя надпочечника, исходящее из нервной ткани, чаще всего протекает бессимптомно и случайно выявляется при исследовании (КТ) забрюшинного пространства.
Симпатобластома - злокачественная, не продуцирующая гормонов опухоль клеток симпатической нервной системы мозгового слоя надпочечника, которая до развития метастазирования может не иметь клинических проявлений.
Феохромоцитома - опухоль, которая развивается из хромаф-финных клеток мозгового вещества надпочечника и сопровождается избыточной секрецией катехоламинов (норадреналина и адреналина). Классические симптомы - головная боль, потливость и тахикардия, однако феохромоцитома может также быть представлена разнообразными неспецифическими проявлениями, такими как тремор, тошнота, одышка, утомляемость, головокружение, боли в груди и животе.
Феохромобластома по клинической картине может не отличаться от феохромоцитомы, однако для нее характерны быстрый рост и появление метастазов, которым также свойственна продукция катехо-ламинов.
Диагностика опухолей надпочечников начинается с расспроса больного и сбора анамнеза. При объективном обследовании особое внимание следует обратить на характерные для этих новообразований клинические признаки.
Лабораторная диагностика в большинстве случаев позволяет выявить гормонально-активные опухоли. Для альдостеромы типично развитие алкалоза, снижение уровня калия и хлора в крови, сопровождающееся избыточным содержанием альдостерона и калия в моче.
Уточнить диагноз позволяет определение повышенной концентрации альдостерона в надпочечниковой вене. Гормоны, продуцируемые другими опухолями коры надпочечников, также в избытке выводятся с мочой: 17-кетостероиды при андростероме, 17-кетостероиды и 17-оксикетостероиды при кортикостероме, эстрогены при кортикоэст-роме. Развитие феохромоцитомы сопровождается повышением уровня катехоламинов в крови и моче.
У большинства больных новообразования коры и мозгового вещества надпочечников можно выявить при помощи УЗИ, КТ и МРТ. Эти методы позволяют оценить размеры опухоли, ее распространение на соседние органы и нижнюю полую вену, состояние регионарных лимфатических узлов. При необходимости уточнить функциональное состояние почек выполняют экскреторную урографию, в спорных случаях и при дифференциальной диагностике возможно применение ангиографии, при которой визуализируется источник кровоснабжения объемного образования.
Ведущий метод лечения больных с опухолями надпочечников - хирургический. В зависимости от размеров новообразования применяют экстраперитонеальный, трансабдоминальный или торакофре-нолюмбальный доступы. В последние годы при опухолях диаметром менее 5 см все чаще выполняют лапароскопическую адреналэкто-мию. При планировании оперативного вмешательства требуется уделить особое внимание профилактике надпочечниковой недостаточности. Для этого, как правило, в течение нескольких дней после операции назначают кортикостероидные препараты, постепенно снижая дозу.
Прогноз. У больных с доброкачественными опухолями надпочечника прогноз благоприятный. При злокачественных опухолях прогноз в основном зависит от агрессивности новообразований и возможности проведения радикального оперативного лечения.
11.3. ОПУХОЛИ МОЧЕВОГО ПУЗЫРЯ
Опухоли мочевого пузыря в подавляющем большинстве случаев развиваются из эпителия и у 90 % пациентов представлены переход-но-клеточным раком, реже наблюдают плоскоклеточный рак (7-9 %) и аденокарциному (1-2 %). Среди неэпителиальных новообразований этого органа, на которые, по данным ВОЗ, приходится лишь 2-5 % случаев, выделяют доброкачественные опухоли (лимфомы, фибромы, липомы, невромы и т. д.) и злокачественные (саркомы).
Эпидемиология. Рак мочевого пузыря - второе по частоте злокачественное заболевание органов мочевой системы после рака предстательной железы, составляет 3-4 % всех новообразований человека. Мужчины болеют раком мочевого пузыря примерно в 3-4 раза чаще женщин, что может быть обусловлено генетическими, гормональными или анатомическими (большая предрасположенность к застою мочи в пожилом возрасте) факторами. Эти новообразования развиваются в любом возрасте, но чаще всего поражают пациентов старше 60 лет. За последние 50 лет во всем мире в 1,5 раза увеличилось число больных с впервые диагностированным раком мочевого пузыря, в настоящее время ежегодно регистрируется около 170 000 новых случаев этого заболевания.
Рак мочевого пузыря - понятие, объединяющее различные по своим биологическим свойствам новообразования, однако более 70 % случаев приходится на прогностически благоприятные поверхностные, не врастающие в мышцу мочевого пузыря высокодифференцированные опухоли. В настоящее время это заболевание рассматривают с позиций концепции «опухолевого поля», согласно которой канцерогенез - следст вие генетической нестабильности эпителиальной выстилки, уро-телия, приводящей к неопластической трансформации в различных отделах мочевых путей от почечной лоханки до мочеиспускательного канала. Этим можно объяснить случаи мультифокального поражения мочевого пузыря и высокую (до 70 %) частоту рецидивирования поверхностного рака после радикального хирургического лечения.
Этиология и патогенез. Несмотря на то, что причины возникновения опухолей изучены недостаточно полно, известны многие канцерогены, влияющие на происхождение рака мочевого пузыря. Еще в 1895 г. было установлено, что к этому заболеванию приводит контакт с анилиновыми красителями. Кроме того, доказано, что риск развития рака мочевого пузыря повышен у рабочих, занятых в производстве резины и текстиля, а также при длительном воздействии ароматических аминов.
Канцерогенез уротелиальной выстилки мочевого пузыря может быть спровоцирован факторами окружающей среды (дым, выхлопные газы автотранспорта), а также курением сигарет, которое приводит к 2-3-кратному увеличению риска развития рака мочевого пузыря. Появлению этого заболевания также способствует длительный хронический воспалительный процесс в мочевом пузыре, обусловленный наличием постоянного катетера или паразитарного заболевания (биль-гарциоз). С высоким риском развития карцином уротелия связано
применение ряда химиотерапевтических средств и режимов лучевой терапии.
Под действием канцерогенов в эпителии мочевого пузыря нарушаются механизмы контроля клеточного цикла, происходит повреждение структуры генов-супрессоров опухоли, индукция онкогенов и усиление экспрессии генов, кодирующих образование факторов роста или рецепторов к ним.
Классификация. ВОЗ рекомендована следующая гистологическая классификация опухолей мочевого пузыря.
I. Эпителиальные опухоли.
II. Неэпителиальные опухоли.
III. Смешанная группа опухолей.
IV. Метастатические опухоли и вторичные распространения.
V. Неклассифицируемые опухоли.
VI. Неопухолевые изменения эпителия.
VII. Опухолевидные поражения.
Наиболее совершенной классификацией рака мочевого пузыря является оценка его распространенности по системе TNM, предложенная Международным агентством по изучению рака.
Классификация опухолей мочевого пузыря по системе TNM (2002)
Т - первичная опухоль
Тх - недостаточно данных для оценки глубины инвазии опухоли.
Т0 - первичная опухоль отсутствует.
Тa - папиллярная неинвазивная карцинома.
Tis - карцинома in situ, плоская опухоль.
T1 - опухоль врастает в соединительную ткань подэпителиального слоя.
T2a - опухоль врастает в поверхностный слой детрузора. T2b - опухоль врастает в глубокий слой детрузора. T3a - опухоль врастает в околопузырную клетчатку микроскопически.
T3b - опухоль врастает в околопузырную клетчатку макроскопически.
T4a - опухоль врастает в предстательную железу, матку или влагалище.
T4b - опухоль врастает в стенку таза или брюшную стенку. Опухоли категории Тis, Та и Т1 относят к категории поверхностных новообразований, карциномы с большей глубиной врастания в стенку
мочевого пузыря и распространением за его пределы называют инва-зивными.
N - регионарные лимфатические узлы
Nx - недостаточно данных для оценки состояния регионарных лимфатических узлов.
N0 - нет метастазов в регионарных лимфатических узлах.
N1 - метастаз в одном регионарном лимфатическом узле, не превышающий 2 см в наибольшем измерении.
N2 - метастаз в одном регионарном лимфатическом узле, более 2 см, но не более 5 см в наибольшем измерении или множественные лимфатические узлы, ни один из которых не превышает 5 см в наибольшем измерении.
N3 - метастазы в регионарных лимфатических узлах более 5 см в наибольшем измерении.
M - отдаленные метастазы
Мх - недостаточно данных для оценки наличия отдаленных метастазов.
М0 - нет отдаленных метастазов. М1 - имеются отдаленные метастазы.
В 1973 г. ВОЗ было предложено деление опухолей уротелия по гистологической градации на уротелиальные папилломы, а также высоко-(G1), умеренно- (G2) и низкодифференцированные (G3) карциномы. C 2004 г. в дополнение к определению принадлежности новообразований к категориям G1-G3 ВОЗ рекомендует использование следующих классификационных категорий: папиллярное новообразование уротелия с низким злокачественным потенциалом, а также высоко- и низкодифференцированная папиллярная уротелиальная карцинома.
Симптоматика. Симптомы рака мочевого пузыря различны и обусловлены степенью распространения и локализацией новообразований, а также и наличием осложнений: цистита, пиелонефрита, хронической почечной недостаточности и др. Наиболее частый и ранний признак рака мочевого пузыря - гематурия, которую отмечают 60-80 % больных. Постоянно кровоточащее новообразование мочевого пузыря при любой локализации проявляется тотальной гематурией. Терминальная гематурия чаще всего наблюдается при расположении опухоли в шейке мочевого пузыря и возникает вследствие травматизации ее богатых кровеносными сосудами ворсин при сокращении мочевого пузыря в конце акта мочеиспускания. Интенсивность гематурии не всегда зависит от величины новообразования. Маленькая опухоль может
вызвать макрогематурию, сопровождающуюся тампонадой мочевого пузыря сгустками крови, что требует экстренного оперативного вмешательства, а крупные, инфильтрирующие стенку мочевого пузыря новообразования могут проявляться лишь микрогематурией.
Частота эпизодов макрогематурии значительно варьирует и после однократного проявления может не повторяться несколько месяцев или лет. Это затрудняет своевременное обнаружение заболевания. При запущенных и распадающихся опухолях мочевого пузыря гематурия обычно имеет постоянный характер, а ее интенсивность может привести к угрожающей жизни больного кровопотере.
Дизурия у больных раком мочевого пузыря также встречается достаточно часто. Ирритативные симптомы часто возникают при расположении новообразования в области треугольника Льето и наличии сопутствующей карциномы in situ. Обструктивные симптомы могут свидетельствовать о частичном перекрытии опухолью внутреннего отверстия мочеиспускательного канала или ее распространении на простатический отдел уретры у мужчин. Она может быть вызвана многими причинами: расположением опухоли в шейке мочевого пузыря, ее инфильтративным ростом, распадом и изъязвлением, наличием карциномы in situ, присоединением цистита, а также сопутствующей ДГПЖ, при которой мочеиспускание становится не только учащенным, но и затрудненным.
Выраженность дизурии значительно возрастает при присоединении инфекции мочевых путей и распаде опухоли. При этом моча может содержать гной и кусочки некротизированной опухолевой ткани, приобретает щелочную реакцию и зловонный запах.
Боли у больных раком мочевого пузыря не всегда связаны с актом мочеиспускания. Чаще всего они локализуются в надлобковой области и, как правило, свидетельствуют о значительном местном распространении злокачественного процесса с вовлечением паравезикальной клетчатки, соседних органов, стенок таза или передней брюшной стенки. Иррадиация болей в промежность, половые органы, крестец, бедро указывает на поражение нервных узлов, а боли в поясничной области обычно связаны со сдавлением опухолью устьев мочеточников с последующим развитием гидроуретеронефроза и присоединением пиелонефрита.
При атаке пиелонефрита больные раком мочевого пузыря отмечают повышение температуры тела, ознобы. Двусторонний гидронефроз и пиелонефрит приводят к постепенной утрате функционирующей почечной ткани с развитием почечной недостаточности, которая может
сопровождаться жаждой, тошнотой, сухостью во рту, потерей аппетита и другими симптомами. Хронический пиелонефрит - часто встречающееся осложнение у больных раком мочевого пузыря, занимает первое место среди причин смерти при этом заболевании.
При распространении ракового процесса на расположенные рядом органы (влагалище, прямую кишку) может происходить образование мочевых свищей с соответствующей локализацией и клинической симптоматикой.
Диагностика опухолей мочевого пузыря основана на комплексном обследовании, которое включает выяснение жалоб больного, сбор анамнеза, объективное обследование, изучение клинико-лабораторных данных, рентгенологические и радионуклидные исследования, ультразвуковое сканирование, а также цистоскопию, трансуретральную биопсию стенки мочевого пузыря с опухолью и морфологический анализ удаленной ткани.
Важно не только обнаружить опухоль мочевого пузыря, но и определить ее локализацию, глубину инвазии и степень дифференцировки, оценить состояние макроскопически неизмененных участков слизистой оболочки мочевого пузыря, а также уточнить состояние регионарных лимфатических узлов и убедиться в отсутствии или наличии метастазов. В задачи диагностики также входит исследование функционального состояния почек и уродинамики верхних и нижних мочевых путей. Кроме того, больной нуждается в обследовании, которое позволит оценить риск оперативного вмешательства.
Оценка жалоб больного и сбор анамнеза позволяют при наличии характерных симптомов заподозрить наличие рака мочевого пузыря, а также предположительно судить о длительности течения и распространенности заболевания.
Бимануальная пальпация мочевого пузыря - обязательный метод исследования при подозрении на наличие инвазивного рака. Ее выполняют под наркозом при опорожненном мочевом пузыре через прямую кишку у мужчин и влагалище у женщин, при этом другая рука врача располагается над лоном. Характерным признаком инвазивных новообразований является наличие плотного инфильтрата в области мочевого пузыря, а при местном распространении рака в паравезикальную клетчатку и органы малого таза инфильтрат становится неподвижным.
Цитологическое исследование осадка мочи у больных с подозрением на рак мочевого пузыря позволяет с высокой специфичностью (около 80 %) выявить опухолевые клетки. Чувствительность этого исследования возрастает с уменьшением степени дифференцировки новооб-
разований и приближается к 100 % у больных с карциномой in situ. Цитологическая интерпретация изменений клеток уротелия затруднена при воспалении, а также после иммуно-, химиоили лучевой терапии, поэтому в настоящее время широкое распространение получили более специфичные и не зависящие от мнения исследователя диагностические методы: BTA-тест (bladder tumor antigen); NMP-22-тест (nuclear matrix protein) и другие, основанные на иммуногистохимических реакциях. Существует также автоматизированный способ диагностики опухолей мочевого пузыря - проточная цитометрия, которая позволяет выявлять в моче характерные для новообразований клетки с полиплоидным и анеуплоидным набором ДНК. Ввиду того, что плоидность клеток отражает их пролиферативную активность, этот метод может также применяться для выявления больных с быстрорастущими карциномами мочевого пузыря, имеющими высокий риск прогрессирования и метастазирования.
Рентгенологическое обследование при подозрении на рак мочевого пузыря обычно начинают с выполнения экскреторной урографии. Этот метод дает представление о функциональной способности почек, проходимости мочевых путей, динамике опорожнения почечной лоханки и мочеточников. Примерно у 10 % больных раком мочевого пузыря встречаются переходно-клеточные опухоли верхних мочевых путей. На экскреторных урограммах они определяются в виде дефектов наполнения чашечно-лоханочного комплекса или мочеточника. При сдавле-нии интрамурального отдела мочеточника опухолевым инфильтратом можно выявить расширение мочеточника и чашечно-лоханочной системы почек (гидроуретронефроз), а иногда - отсутствие функции почки с соответствующей стороны. На нисходящих цистограммах папиллярным поверхностным опухолям соответствуют дефекты наполнения мочевого пузыря, а изменения округлости контура его стенок могут свидетельствовать о врастании инвазивного рака в детрузор (рис. 11.6).
Для выполнения ретроградной (восходящей) цистографии мочевой пузырь заполняют жидким рентгеноконтрастным веществом с помощью катетера. При этом можно получить более четкое изображение новообразования мочевого пузыря, а также выявить пузырно-моче-точниковый рефлюкс, возникающий вследствие поражения опухолью замыкательного аппарата устья мочеточника (рис. 11.7).
Компьютерная томография позволяет визуализировать распространение рака за пределы мочевого пузыря, оценить состояние регионарных лимфатических узлов и выявить наличие отдаленных метастазов. Ввиду того, что мышца детрузора и опухолевая ткань имеют сопо-
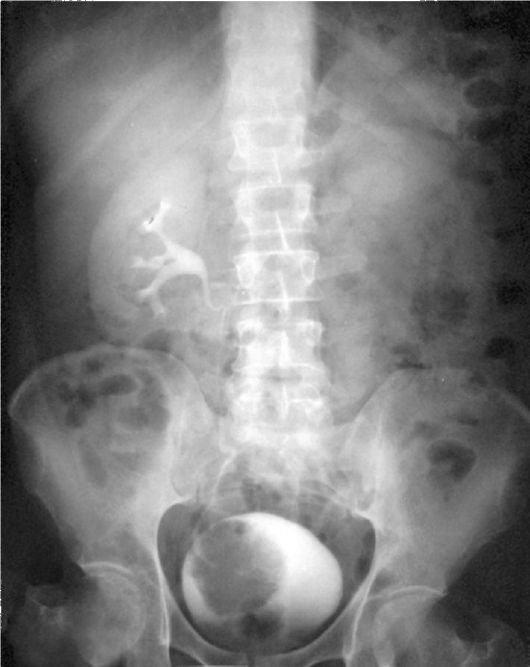
Рис. 11.6. Экскреторная урограмма с нисходящей цистограммой. Опухоль мочевого пузыря
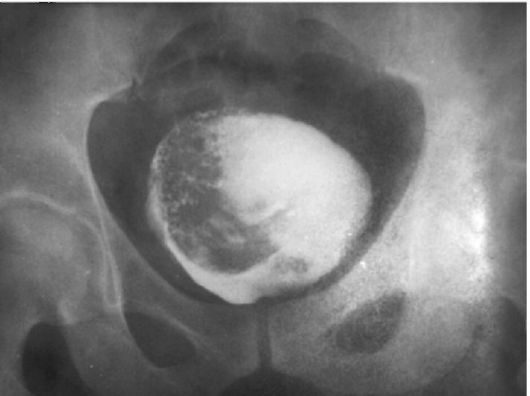
Рис. 11.7. Восходящая цистограмма. Опухоль мочевого пузыря
ставимую рентгенологическую плотность, при КТ не всегда можно различить поверхностные и инвазивные новообразования. Информативность МРТ у больных раком мочевого пузыря примерно соответствует информативности КТ. Эти исследования могут быть недостаточно точными при необходимости дифференцировать гиперплазию лимфатического узла от его опухолевого поражения, поэтому перед выполнением радикальной цистэктомии всегда выполняют биопсию лимфатических узлов с последующим гистологическим исследованием.
Ультразвуковое исследование позволяет уточнить локализацию, количество и размеры новообразований мочевого пузыря, определить расширение верхних мочевых путей, а при ректальном и внутрипу-зырном расположении датчика - визуализировать верхушку и шейку мочевого пузыря, оценить состояние соседних органов и в ряде случаев ориентировочно судить о глубине инвазии рака (рис. 11.8).
Цистоскопия с трансуретральной биопсией стенки мочевого пузыря вместе с опухолью - заключительный этап и ведущий метод диагностики у больных с подозрением на опухоль мочевого пузыря. При осмотре мочевого пузыря определяют количество новообразований, размер и локализацию, расположение по отношению к устьям мочеточни-
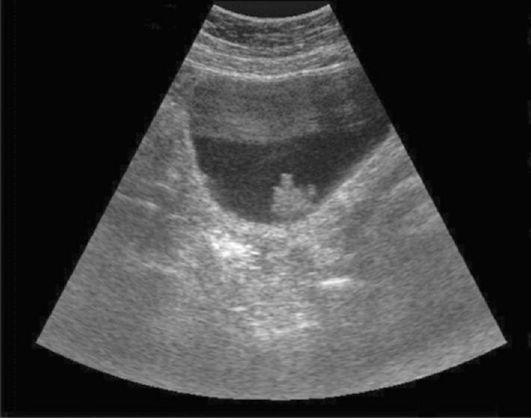
Рис. 11.8. Сонограмма мочевого пузыря. Определяется опухоль мочевого пузыря
ков, вероятный характер роста (поверхностный или инвазив-ный), а также состояние уроте-лия вокруг опухоли. Типичные поверхностные папиллярные опухоли мочевого пузыря определяются при цистоскопии в виде ворсинчатых образований на тонкой ножке с длинными прозрачными и нежными ворсинками, флотирующими в промывной жидкости и отбрасывающими тень.
Начальными признаками инфильтрации подслизистого слоя могут быть инъецированность кровеносных сосудов вокруг опухоли, утолщение ворсин и расширение основания опухоли. Если при динамическом исследовании посредством неоднократного наполнения и опорожнения мочевого пузыря обнаруживают ригидный сегмент стенки, то даже при отсутствии изменений покрывающей его слизистой оболочки следует заподозрить инфильтративный характер роста новообразования. При эндофитном росте (первично-инвазивный рак мочевого пузыря) опухоль не имеет ворсин, а основание сливается с резко измененной слизистой оболочкой мочевого пузыря. Новообразование выбухает в полость мочевого пузыря, не имеет четких видимых границ, нередко изъязвляется и покрывается фибринозным налетом. Такие опухоли следует дифференцировать с туберкулезом мочевого пузыря и интерстициальным язвенным циститом. Цистоскопия представляет собой субъективный метод исследования, при ней не всегда удается выявить мелкие и плоские опухоли мочевого пузыря.
Фотодинамическая диагностика - внутрипузырное введение предшественника протопорфирина IX - 5-аминолевулиновой кислоты, способного избирательно накапливаться в опухолевой ткани и флюоресцировать при освещении полости мочевого пузыря синим светом, позволяет повысить чувствительность цистоскопии и более точно определять границы папиллярных новообразований и плоские опухоли. Окончательный диагноз можно поставить после биопсии опухолевой ткани и последующего морфологического исследования. При поверхностных опухолях мочевого пузыря биопсию чаще всего проводят операционным цистоскопом, который позволяет выполнить ТУР опухоли
в пределах здоровых тканей. Завершают операцию удалением расположенного под опухолью участка мышечной стенки мочевого пузыря. Такой подход при подтверждении отсутствия инвазивного роста рака является радикальным методом лечения.
Дифференциальную диагностику опухоли мочевого пузыря следует проводить с хроническими воспалительными процессами в мочевом пузыре: туберкулезом, простой язвой, эндометриозом мочевого пузыря, хроническим геморрагическим циститом, гранулематозным циститом, а также с опухолеподобными поражениями. Кроме того, в мочевой пузырь могут врастать опухоли, исходящие из соседних органов. Ведущую роль в уточнении диагноза при всех перечисленных заболеваниях играет биопсия с гистологическим исследованием удаленной ткани.
Лечение. В настоящее время выбор метода лечения в основном зависит от гистологической принадлежности и степени распространения опухоли мочевого пузыря, а также от риска прогрессирования и реци-дивирования в послеоперационном периоде. Основную роль играют хирургические вмешательства, однако в последнее время их все чаще дополняют химиотерапией и иммунотерапией.
При доброкачественных новообразованиях и поверхностных формах рака мочевого пузыря применяют ТУР. Ее выполняют с помощью специального эндоскопического инструмента - операционного цистоскопа (резектоскопа), который по мочеиспускательному каналу вводят в мочевой пузырь, - и режущей петли (электрода), на которую подается электрический ток. Производят поэтапное удаление опухоли под контролем зрения. Новообразования резецируют до основания и в границах нормально выглядящей слизистой оболочки. Прорастание опухолевой ткани в мышцу мочевого пузыря или более глубокие слои свидетельствует о наличии инвазивного рака, при котором ТУР не является радикальным методом лечения. У таких пациентов следует проводить радикальную цистэктомию или лучевую терапию в комбинации с системной химиотерапией. Вероятность рецидивирования поверхностного рака мочевого пузыря после ТУР снижает противоопухолевая внутрипу-зырная химиотерапия (митомицин, адриамицицин, тиотеф и др.).
Для активации клеточных механизмов противоопухолевого иммунитета и профилактики опухолевой прогрессии применяют инстилляции вакцины БЦЖ. Внутрипузырная иммунотерапия вакциной БЦЖ также показана больным с карциномой in situ мочевого пузыря. Курс состоит из 6-8 еженедельных введений. У большинства пациентов наступает излечение, однако примерно в 30 % случаев цитологические и гистоло-
гические признаки заболевания сохраняются, что служит показанием к проведению повторного курса. Если два цикла инстилляций не дают положительного эффекта или наблюдается ранний рецидив опухоли, то необходима радикальная цистэктомия.
Для лечения больных с инвазивным раком мочевого пузыря применяются оперативные, консервативные и комбинированные методы. Если опухоль не вышла за пределы мочевого пузыря, то единственным подлинно радикальным методом лечения является радикальная цистэктомия. При этом у мужчин единым блоком удаляют мочевой пузырь, предстательную железу, семенные пузырьки и проксимальный отдел мочеиспускательного канала, а у женщин - мочевой пузырь, мочеиспускательный канал, переднюю стенку влагалища и матку с придатками. Это вмешательство также можно применять у больных с поверхностными новообразованиями - папилломатозом мочевого пузыря, рецидивными низкодифференцированными опухолями с начальными признаками инвазивного роста. Операцию начинают с иссечения регионарных лимфатических узлов и гистологического экспресс-анализа. При лимфогенном распространении опухоли и прорастании рака в кости таза или прямую кишку радикальная цист-эктомия не показана, эти пациенты нуждаются в лучевой терапии и системной химиотерапии. После радикального удаления мочевого пузыря необходимо отведение мочи. Для этого за последние 100 лет было предложено множество способов: выведение мочеточников на кожу (уретерокутанеостомия), пересадка мочеточников в сигмовидную кишку (уретеросигмоанастомоз), пересадка мочеточников в изолированный сегмент подвздошной кишки, которая противоположным концом выводится на кожу (операция Брикера), формирование из сегмента кишки гетеротопического мочевого пузыря с «сухой» кожной сто-мой, кишечная реконструкция ортотопического мочевого пузыря, при котором мочеиспускание осуществляется по уретре и др. При выборе метода деривации мочи принимают во внимание локализацию новообразования, анатомические особенности, степень риска операции и т. д. Формирование неоцистиса усложняет и удлиняет операцию, однако позволяет сохранить самостоятельное мочеиспускание по уретре, что повышает качество жизни больных в послеоперационном периоде.
Все пациенты после радикального хирургического лечения по поводу рака мочевого пузыря должны находиться под диспансерным наблюдением. Больным, перенесшим ТУР опухоли мочевого пузыря, регулярно проводят контрольные цистоскопии и цитологические исследования мочи для своевременного выявления рецидивов.
Лучевая терапия применяется при иноперабельных местнораспро-страненных опухолях, высокой степени риска хирургического вмешательства, а также при отказе больного от операции. Как правило, применяют дистанционное облучение области мочевого пузыря и регионарных лимфатических узлов гамма-аппаратами и линейными ускорителями.
Системная химиотерапия как самостоятельный метод лечения используется с паллиативной целью у больных с метастазами. Наиболее эффективны комбинации лекарственных препаратов, например MVAC (метотрексат, винбластин, адриамицин, цисплатин).
Широкое распространение в настоящее время получило комбинированное лечение больных раком мочевого пузыря, при котором оперативное вмешательство сочетается с предоперационной (неоадъювант-ной) и послеоперационной (адъювантной) лучевой и химиотерапией. Этот подход позволяет выполнить радикальное хирургическое вмешательство пациентам с распространенным опухолевым процессом.
Прогноз. По современным данным, прогноз у больных раком мочевого пузыря определяют следующие показатели: совокупность клинических признаков, характеризующих общее состояние организма (возраст, сопутствующие заболевания, функциональное состояние систем органов и т. д.); показатели, отражающие степень распространения и злокачественный потенциал новообразования (глубина инвазии и степень дифференцировки рака, наличие метастазов), а также режим и объем лечебных мероприятий. Наиболее важными прогностическими критериями служат характеристики агрессивности опухоли, однако для определения принадлежности пациента к группе высокого или низкого риска опухолевой прогрессии требуется совокупный анализ всех значимых факторов. Правильная оценка риска рецидивирования и прогрессирования рака мочевого пузыря позволяет применять адекватные лечебные мероприятия.
11.4. ОПУХОЛИ МОЧЕИСПУСКАТЕЛЬНОГО КАНАЛА
Эпидемиология. Опухоли мочеиспускательного канала составляют около 4 % всех новообразований мочеполовых органов, при этом доброкачественные опухоли встречаются чаще, чем злокачественные, наблюдаются преимущественно у женщин и обычно располагаются в области наружного отверстия и в ладьевидной ямке.
Этиология и патогенез. Причины возникновения опухолей мочеиспускательного канала изучены недостаточно полно. Установлено, что
этому способствуют хронический воспалительный процесс, стриктуры, дивертикулы и нарушение кровоснабжения в уретре, а также травмы и гормональные нарушения во время беременности и после менопаузы.
Классификация. Согласно гистологической классификации опухолей мочеиспускательного канала выделяют:
1) доброкачественные опухоли: полип, полипообразно кистозно-расширенную параили периуретральную железу, папиллому;
2) злокачественные опухоли: рак, редкие опухоли (карциноид, мела-ному).
Классификация рака мочеиспускательного канала по системе TNM является наиболее полной. У 70-85 % больных обнаруживают плоскоклеточный рак уретры, значительно реже - аденокарциному и переход-но-клеточный рак. Аденокарцинома протекает наиболее агрессивно.
Симптоматика. Клиническая картина при доброкачественных и злокачественных опухолях мочеиспускательного канала зависит от способности новообразований к инвазивному росту, их количества, локализации в мочеиспускательном канале и пола пациента.
У женщин опухоли чаще всего располагаются на задней стенке мочеиспускательного канала возле наружного отверстия.
Больные жалуются на жжение и зуд в уретре, усиливающиеся при мочеиспускании, поллакиурию, а при новообразованиях больших размеров - на затруднение мочеиспускания.
Многие пациенты испытывают боли в области уретры при половом акте и ходьбе, отмечают контактные кровотечения и кровянистые выделения из наружного отверстия, которые чаще всего являются поводом обращения к врачу.
На ранних стадиях заболевание может протекать бессимптомно, а при прорастании рака во влагалище могут развиться влагалищные кровотечения и уретровлагалищные свищи.
При прорастании опухоли мочеиспускательного канала в мочевой пузырь ведущим симптомом служит макрогематурия.
У мужчин опухоли могут располагаться в любых отделах мочеиспускательного канала, а клинические проявления зависят от локализации, размера, количества и глубины инвазии.
Больные жалуются на затруднение мочеиспускания, сужение струи мочи и разбрызгивание, примесь крови в первой порции мочи (инициальная гематурия), а при присоединении инфекции - на поллакиурию, рези при мочеиспускании и выделения из мочеиспускательного канала. При поражении заднего отдела уретры затруднение и болезненность мочеиспускания обычно выражены сильнее; кроме того, пациенты
отмечают болезненные семяизвержения, гемоспермию и спонтанные эрекции. При увеличении злокачественной опухоли появляются боли и уплотнение в промежности, могут развиться отеки мошонки и полового члена, образуются свищи.
Диагностика. Распознавание опухолей мочеиспускательного канала у женщин обычно не вызывает трудностей и заключается в осмотре, пальпации, инструментальном, цитологическом и морфологическом исследованиях. При расположении опухоли в области наружного отверстия ее можно увидеть невооруженным глазом, определить размеры, цвет, характер поверхности, наличие ножки, ширину основания. Бимануальная пальпация через переднюю стенку влагалища при опорожненном мочевом пузыре позволяет оценить местное распространение опухоли уретры. Осмотр и пальпация висячего отдела уретры у мужчин проводятся по нижней поверхности полового члена. Для оценки мембранозного и бульбозного отделов мочеиспускательного канала рекомендуется ввести указательный палец в ампулу прямой кишки и пальпировать переднюю зону промежности между большим и указательным пальцами. Следует также осмотреть паховые области и пальпировать паховые лимфатические узлы, которые у ряда больных могут быть зонами регионарного метастазирования. Если опухоль располагается вне наружного отверстия уретры, показано выполнение уретроскопии или уретрографии. Цитологическое исследование мазков-отпечатков и биопсия опухоли имеют решающее значение в диагностике.
Дифференциальная диагностика проводится с кистами, воспалительными инфильтратами и структурой уретры. Большую помощь в дифференциальной диагностике может оказать уретроскопия, которая позволяет не только осмотреть мочеиспускательный канал, но и взять материал для морфологического изучения.
Лечение. В настоящее время применяется радикальное лечение доброкачественных опухолей мочеиспускательного канала - их иссечение в пределах здоровых тканей. Опухоли небольших размеров (кондиломы уретры, мелкие папилломы) можно удалить как химиотерапев-тическими препаратами (подофиллотоксин, тио-ТЭФ и т. д.), так и хирургически. При локализации новообразований в ладьевидной ямке выполняют заднюю меатотомию и электрорезекцию. При расположении доброкачественных опухолей в заднем отделе мочеиспускательного канала производят их ТУР с помощью операционного цистоскопа (резектоскопа).
Выбор метода лечения больных раком мочеиспускательного канала зависит от локализации опухоли, ее распространенности и степени
дифференцировки раковых клеток. При поверхностных формах рака дистального отдела уретры применяется ТУР, инфильтрация кавернозных тел - показание к частичной ампутации полового члена. Значительное местное распространение рака проксимального отдела или тотальное поражение мочеиспускательного канала требует ампутации полового члена, а при вовлечении органов мошонки - эмас-куляции. Лечение всех больных должно быть комбинированным и сочетать хирургическое вмешательство с лучевой терапией и системной полихимиотерапией.
Прогноз. При доброкачественных опухолях мочеиспускательного канала прогноз благоприятный. Для рака мочеиспускательного канала характерно раннее метастазирование, поэтому прогноз зависит от своевременной диагностики, агрессивности новообразования и радикальности проведенного лечения. Общая пятилетняя выживаемость больных раком мочеиспускательного канала составляет около 30 %, она выше при локализации новообразования в передних отделах уретры (60 %), чем в заднем отделе (14 %).
11.5. ОПУХОЛИ ЯИЧКА
Эпидемиология. Опухоли яичка составляют около 1 % всех новообразований у мужчин и чаще всего возникают в возрасте 20-35 лет.
Очень редко развиваются двусторонние опухоли яичка. Однако для больных раком яичка риск возникновения опухоли во втором яичке возрастает в 2-3 раза.
Заболеваемость опухолями яичка неодинакова в разных странах, причем она различается в десятки раз. При этом повсеместно отмечается тенденция к общему увеличению частоты рака яичка. Ежегодный относительный рост заболеваемости раком яичка составляет 2 %, причем, в основном, за счет повышения частоты его развития у мужчин молодого возраста.
За последние десятилетия достигнуты большие успехи в лечении опухолей яичка. В развитых странах выживаемость таких больных возросла с 10 % в 1970-х гг. до 90 % в конце 1990-х гг.
Этиология. В основу современной теории развития рака яичка положено представление о появлении в яичках в процессе эмбриогенеза пула ненормально дифференцированных клеток. В норме полипо-тентные первичные половые клетки дифференцируются в спермоциты. Если в процессе дифференцировки происходят какие-либо сбои, эти клетки могут стать источником семиномы или эмбриональной карци-
номы. Если полипотентные клетки дифференцируются в клетки зародышевых листков, может возникнуть тератома. При дифференцировке в клетки внезародышевых органов образуется опухоль желточного мешка. В детском возрасте при отсутствии гормональной стимуляции эти ненормально дифференцированные клетки находятся в состоянии покоя. Однако в пубертатном периоде из-за резкого всплеска гормональной активности ненормальный процесс дифференцировки клеток может продолжиться. При этом возможен их неконтролируемый рост, приводящий к раку.
Нарушению процесса дифференцировки герминативных клеток и развитию рака яичка способствует ряд факторов, которые можно условно разделить на анатомические, эндокринные и внешние.
К анатомическим факторам относят, в первую очередь, криптор-хизм. При этой аномалии риск возникновения практически всех гистологических типов рака яичка повышается почти в десять раз. Опухоль чаще развивается в яичке, оставшемся в брюшной полости (в каждом 20-м случае), реже - расположенном в паховом канале (в каждом 80-м случае). Однако объяснить наличием крипторхизма возникновение всех опухолей яичка невозможно, поскольку, по разным данным, лишь у 7-10 % больных она развилась в неопустившемся яичке. Более того, иногда новообразование выявляют в нормально опустившемся яичке, не на стороне крипторхизма.
Большое значение придают эндокринным факторам развития опухолей яичка, в частности, влиянию эстрогенов на внутриутробное развитие ткани яичка. Установлено, что если во время беременности, особенно в первые два месяца, женщина принимала эстрогенные препараты, то риск развития рака яичка у сына повышается в несколько раз. Это связано с тем, что во время внутриутробного развития при повышении уровня в организме «свободного» эстрогена происходят начальные изменения, проявляющиеся ускоренной и неправильной дифференцировкой герминативных клеток-предшественников. Так как процесс опускания яичка также находится под гормональным контролем и избыток эстрогенов может его нарушить, возможно, что и учащение возникновения рака яичка при крипторхизме связано с эстрогенами. Данное предположение косвенно подтверждается тем, что при крипторхизме в противоположном опустившемся яичке риск развития опухоли в 2 раза больше, чем обычно.
Доказано, что к развитию опухоли яичка предрасполагают такие внешние факторы, как чрезмерное потребление жирной пищи, травмы яичка, вирусные поражения, а также ионизирующее излучение.
Классификация. Согласно гистологической классификации, опухоли яичка разделяют на герминативные (герминогенные) и негерминативные (негерминогенные). Первые составляют примерно 95 % всех опухолей яичка, тогда как вторые только 5 %. Герминативные опухоли развиваются из сперматогенного эпителия. К негерминативным опухолям относят опухоли, происходящие из стромы полового тяжа.
Герминативные опухоли яичка по происхождению разделяют на семиному и несеминомные опухоли.
Наиболее распространенный гистологический тип новообразований яичка - семинома, на долю которой приходится около 35 % всех герминативных опухолей. Семинома обычно развивается в возрасте 30-40 лет. Макроскопически она представляет собой сливающиеся серые узлы без четких границ. К моменту постановки диагноза около 10 % больных с семиномой уже имеют метастазы.
Несеминомные опухоли яичка относительно редко представлены в чистом виде, чаще они входят в состав смешанных опухолей. Важно определять относительную пропорцию каждого клеточного типа. Это необходимо для оценки прогноза заболевания, поскольку гистологические типы опухоли различаются по способности к метастазирова-нию, а также восприимчивости к лечению.
Эмбриональная карцинома составляет почти 20 % герминогенных новообразований, это наиболее распространенная несеминомная опухоль. Она развивается в более молодом возрасте, чем семинома. Макроскопически характерны выраженный полиморфизм клеток и нечеткие границы опухолевых узлов. К моменту диагностики треть больных уже имеют метастазы.
На долю тератомы приходится примерно 5 % всех герминогенных опухолей яичка. Она может возникать в любом возрасте, но чаще до 30 лет. У детей и юношей течение тератом обычно более доброкачественное. Опухоль представлена полостями разного размера, заполненными слизистым или студенистым содержимым. Она может содержать клетки разных зародышевых листков; в зрелой тератоме можно обнаружить производные эктодермы, энтодермы и мезодермы.
Хориокарцинома в чистом виде встречается крайне редко - менее чем у 1 % больных с опухолями яичка. Ее обнаруживают главным образом у пациентов в возрасте от 18 до 35 лет. Опухоль обычно небольшая, но крайне агрессивная и склонная к раннему метастазированию.
Опухоль желточного мешка выявляют главным образом у мальчиков в возрасте до 2 лет. Это самая распространенная герминативная опухоль яичка у детей. Характерные признаки опухоли желточного
мешка - повышение содержания в крови АФП и выявление при гистологическом исследовании телец Шиллера-Дюваля.
Смешанные герминогенные опухоли составляют 40 % герминогенных опухолей яичка. Чаще всего они представлены сочетанием тератомы и эмбриональной карциномы.
Герминативные опухоли яичек склонны к метастазированию. Риск раннего метастазирования самый низкий у тератомы, самый высокий - у хориокарциномы. Опухоли других клеточных типов занимают промежуточное положение.
К негерминативным опухолям яичка относят новообразования, развивающиеся из стромы полового тяжа. Среди них выделяют хорошо дифференцируемые, смешанные и недифференцируемые опухоли. К первым относят опухоли из клеток Лейдига, опухоли из клеток Сертоли и гонадобластому. Наиболее распространенные негерминативные опухоли яичка - опухоли из клеток Лейдига (лейдигомы); однако их частота не превышает 3 % всех новообразований яичка. Лейдигомы малигнизируются примерно в 10 % случаев. Частота других негерминативных опухолей яичка крайне низкая.
Основная и наиболее важная для практического применения классификация опухолей яичка - TNM (2002). Ее особенность - применение критерия S, характеризующего уровень сывороточных маркеров опухоли яичка.
Классификация опухолей яичка по системе TNM (2002)
Т - первичная опухоль, распространение которой устанавливается после радикальной орхиэктомии
рТх - первичная опухоль не оценивалась (если радикальная орхи-эктомия не выполнялась, используется обозначение Тх). рТ0 - нет доказательств наличия первичной опухоли. pTis - карцинома in situ.
pT1 - опухоль ограничена яичком и придатком яичка без признаков лимфатической/васкулярной инвазии.
рТ2 - опухоль ограничена яичком и придатком яичка с признаками лимфатической/васкулярной инвазии или опухоль прорастает белочную оболочку с вовлечением влагалищной оболочки яичка.
рТ3 - опухоль прорастает в семенной канатик с признаками лим-фатической/васкулярной инвазии или без них.
рТ4 - опухоль распространяется на мошонку с признаками лимфа-тической/васкулярной инвазии или без них.
N - метастазы в региональные лимфатические узлы
Nx - региональные лимфатические узлы не оценивались.
N0 - нет метастазов в региональные лимфатические узлы.
N1 - метастазы в единичные (до 5) лимфатические узлы (наибольший размер 2 см и менее).
N2 - метастазы более 2 см, но менее 5 см в единичные лимфатические узлы или в множественные лимфатические узлы (наибольший размер не более 5 см).
N3 - метастазы в лимфатические узлы (наибольший размер более 5 см).
М - отдаленные метастазы
Мх - наличие отдаленных метастазов не оценивалось. М0 - нет отдаленных метастазов. М1 - наличие отдаленных метастазов.
М1а - метастазы в легкие или в отдаленные лимфатические узлы. М1Ь - другие (кроме метастазов в легкие и в лимфатические узлы) отдаленные метастазы.
S - сывороточные маркеры опухоли яичка
Sx - исследование сывороточных маркеров не проводилось.
S0 - уровень сывороточных маркеров в норме.
S1 - ЛДГ <1,5 верхней границы нормы (N), и ЧХГ <1000 нг/мл, и АФП <1000 нг/мл.
S2 - ЛДГ (1,5-10) N, или 1000 нг/мл <ЧХГ<10 000 нг/мл, или 1000 нг/мл <АФП<10 000 нг/мл.
S3 - ЛДГ >10 N, или ЧХГ >10 000 нг/мл, или АФП >10 000 нг/мл.
Регионарными для яичка являются забрюшинные (парааортальные и паракавальные) лимфатические узлы, а если в анамнезе были какие-либо вмешательства в пахово-мошоночной области, то и паховые.
Симптоматика. Основными симптомами опухоли яичка служат увеличение и уплотнение яичка при пальпации, чувство тяжести в мошонке, отечность одной ее половины. У 70-90 % больных именно эти симптомы развиваются первыми.
Боль не является характерным клиническим симптомом рака яичка, однако может беспокоить приблизительно треть больных, у которых опухоль уже достаточно большая.
Одним из ранних симптомов опухоли яичка может быть гинекомастия. Ее развитие объясняется повышением уровня ЧХГ при некоторых герминативных формах рака (хориокарцинома). Гинекомастию при
герминогенных опухолях яичка обнаруживают в 5 % случаев, при сер-толиомах и лейдигомах - в 30-50 % случаев.
У 15 % больных первичная опухоль яичка протекает бессимптомно, и первые проявления заболевания у них связаны с метастатическим поражением. Увеличение забрюшинных лимфатических узлов чаще всего проявляется болями в животе, спине, нарушением венозного оттока из нижних конечностей вследствие сдавления нижней полой вены. При метастазах в легкие клиническая картина сходна с таковой при хроническом бронхите. Типичный симптом - кашель.
Атипичные симптомы опухоли яичка наблюдаются при эктопии яичка и крипторхизме. При этом клиническая картина может быть сходной с симптомами острой кишечной непроходимости, острого аппендицита или новообразований органов брюшной полости.
В случае первичной экстрагонадной локализации тестикулярной опухоли отмечаются своеобразные клинические проявления. При забрюшинной опухоли могут наблюдаться боли в животе и спине, нарушение венозного оттока из нижней половины тела; при локализации первичной опухоли в средостении - тяжесть и боль за грудиной, одышка, кашель.
Диагностика. Самым простым и доступным методом диагностики опухоли служит пальпация яичка. Уплотнение и увеличение его - весьма тревожный симптом. Необходимо пальпировать противоположное яичко, а также паховые и другие доступные лимфатические узлы.
При наличии водянки оболочек яичка, часто сопровождающей опухолевое поражение, пальпация яичка затруднена. В этом случае необходимо выполнение диафаноскопии. УЗИ яичка используется для дифференциальной диагностики его опухолей и других заболеваний, например эпидидимита. Точность УЗИ при опухолях яичка весьма высока и достигает 90 %.
Важную роль играет исследование сывороточных опухолевых маркеров - человеческого хорионического гонадотропина, α-фетопротеина и лактатдегидрогеназы. Повышение уровня ЧХГ выявляется у 100 % больных с хориокарциномой, у 60 % - с эмбриональной карциномой, у 25 % - с опухолями желточного мешка и только у 10 % пациентов с семиномой. Увеличение содержания АФП отмечается у 70 % больных с эмбриональной карциномой и у 75 % пациентов с опухолями желточного мешка, но отсутствует при хориокарциноме и семиноме.
Большое диагностическое значение имеет непосредственно оперативное вмешательство - радикальная паховая орхиэктомия - со срочным морфологическим исследованием. Обычная чрезмошоночная
биопсия яичка не рекомендуется, поскольку повышается риск локальной диссеменации опухолевых клеток в мошонке и их распространения в паховые лимфатические узлы.
После обнаружения первичной опухоли необходимо определить стадию процесса по наличию регионарных и отдаленных метастазов.
Наиболее точный метод выявления метастазов в забрюшинные лимфатические узлы - рентгеновская КТ. Однако необходимо учитывать, что у 25-30 % больных с опухолью яичка и отсутствием КТ-данных о поражении лимфатических узлов при морфологическом исследовании последних обнаруживаются микроскопические метастазы.
Для диагностики метастазов в забрюшинные лимфатические узлы также используются кавография и лимфангиография. При значительном увеличении забрюшинных лимфатических узлов на экскреторных урограммах можно обнаружить смещение или сдавление мочеточника.
Отдаленные метастазы чаще всего локализуются в легких. Для выявления их необходимо выполнить рентгенографию легких в двух проекциях. Однако при небольших метастазах результаты могут быть ложноотрицательными. В этих случаях показано выполнение КТ, позволяющей обнаружить метастазы диаметром до 3 мм.
Метастатическое поражение печени можно выявить на основании данных УЗИ и сцинтиграфии печени. При подозрении на наличие метастазов в мозг необходимо выполнить МРТ.
Дифференциальная диагностика опухолей яичка проводится с воспалительными заболеваниями органов мошонки, водянкой оболочек яичка, туберкулезом придатка и яичка, сперматоцеле (кистозным образованием, исходящем обычно из головки придатка яичка), гематоцеле (кровоизлиянием в оболочки яичка в результате травмы), варикоцеле.
Лечение. Тактика лечения опухолей яичка зависит от гистологического строения новообразования, стадии заболевания, наличия и поражения противоположного яичка.
Подходы к лечению семиномных и несеминомных опухолей разные. Смешанные опухоли, содержащие семиномные и несеминомные компоненты, должны рассматриваться при планировании лечения как несеминомы.
Внутриэпителиальная опухоль яичка (карцинома in situ) чаще всего обнаруживается при биопсии яичка у пациентов с высоким риском развития рака яичка, например при наличии опухоли противоположного яичка. Лечение заключается в локальной радиотерапии яичка, эффективность которой приближается к 100 %.
Тактика лечения локализованных форм опухолей яичка зависит от морфологического типа рака. Семиномы на этой стадии излечиваются более чем в 95 % случаев. Они чувствительнее к радиотерапии, чем несеминомы. Основной метод лечения семином на данной стадии - радикальная паховая орхиэктомия с последующей адъювантной (профилактической послеоперационной) радиотерапией.
Орхиэктомия выполняется из пахового доступа, поскольку при чрезмошоночном доступе резко повышается вероятность диссемина-ции опухолевых клеток. Необходимость адъювантной радиотерапии объясняется тем, что примерно 15 % больных имеют микрометастазы опухоли в забрюшинные лимфатические узлы. Это может привести к рецидиву.
При несеминомных и смешанных формах локализованного рака яичка проводится хирургическое лечение - радикальная паховая орхиэкто-мия с последующей забрюшинной лимфаденэктомией.
При наличии семиномной опухоли с поражением лимфатических узлов выполняют радикальную паховую орхиэктомию с последующей полихимиотерапией. После завершения химиотерапии большинство остаточных образований в лимфатических узлах постепенно регрессируют в течение нескольких месяцев. У больных с несеминомными и смешанными опухолями операцией выбора служит радикальная паховая орхи-эктомия с забрюшинной лимфаденэктомией; впоследствии проводится ежемесячный контроль. Пациентам, у которых сывороточные маркеры не нормализовались после удаления забрюшинных лимфатических узлов, необходимо назначать химиотерапию.
При метастатических формах семином выполняют радикальную паховую орхиэктомию с последующей полихимиотерапией. Если после комбинированной химиотерапии полного регресса метастазов не произошло, то возможны радиотерапия или их хирургическое удаление.
Несеминомные метастатические опухоли в 70 % случаев излечиваются стандартной химиотерапией. Больные с неблагоприятным исходом чаще всего имеют распространенные висцеральные метастазы. При недостаточной эффективности стандартной химиотерапии применяются интенсивные режимы химиотерапии с аутотрансплантацией костного мозга.
11.6. ОПУХОЛИ ПРИДАТКА ЯИЧКА
Эпидемиология. Опухоли придатка яичка встречаются редко и чаще всего возникают в возрасте 30-40 лет. Опухоли придатка яичка в боль-
шинстве своем доброкачественные, злокачественные обнаруживаются крайне редко. Наиболее распространенное новообразование придатка яичка - аденома, реже наблюдаются лейомиома, цистаденома. Из злокачественных опухолей придатка яичка встречается аденокарцинома.
Вторичное поражение придатка яичка происходит при инвазии рака яичка, иногда в него метастазируют опухоли другой локализации (желудок, почка, предстательная железа и др.).
Симптоматика и клиническое течение. Чаще всего доброкачественные опухоли придатка яичка длительно развиваются бессимптомно. Характерный ранний симптом - появление в области придатка плотного и, как правило, безболезненного уплотнения, которое пациенты обнаруживают самостоятельно и расценивают как повод для обращения к врачу. Заметное увеличение опухоли более характерно для злокачественных новообразований и нередко сопровождается возникновением болезненных ощущений в области придатка и развитием водянки оболочек яичка. При этом поверхность опухоли может становиться бугристой.
Диагностика и дифференциальная диагностика. Опухоли придатка яичка необходимо дифференцировать с кистозными образованиями придатка, неспецифическим и, особенно, туберкулезным эпидидимитом. Для этого используются УЗИ и МРТ, но наиболее информативен анализ опухолевой ткани, полученной посредством аспирационной биопсии или хирургического иссечения в ходе оперативного вмешательства.
Тактика лечения и прогноз у пациентов с опухолями придатка яичка в основном зависят от степени злокачественности и стадии заболевания. Ревизию придатка яичка рекомендуют производить из пахового доступа. При доброкачественных опухолях, несмотря на благоприятный прогноз, показано их хирургическое удаление, так как только оперативное вмешательство позволяет установить окончательный диагноз. В таких случаях выполняют эпидидимэктомию. При злокачественных новообразованиях операцией выбора служит орхифуникулэктомия, а при наличии показаний - забрюшинная лимфаденэктомия в сочетании с лучевой терапией и химиотерапией.
11.7. ОПУХОЛИ СЕМЕННОГО КАНАТИКА И СЕМЕННОГО ПУЗЫРЬКА
11.7.1. Опухоли семенного канатика
Новообразования семенного канатика встречаются относительно редко. Среди них преобладают доброкачественные опухоли - липо-
мы. Злокачественные новообразования развиваются примерно в 30 % случаев и имеют мезенхимальное происхождение. Чаще всего выявляют рабдомиосаркомы, реже - лейомиосаркомы, фибросаркомы и липосаркомы.
Симптоматика. Больные жалуются на чувство тяжести в мошонке и внизу живота, боли, усиливающиеся при ходьбе. Диагностировать опухоль семенного канатика при физикальном осмотре достаточно трудно. Опухоли семенного канатика проявляются как плотные неоднородные тканевые образования, которые больные чаще всего выявляют самостоятельно. Для сарком более характерно расположение в мошонке, тогда как доброкачественные опухоли обычно располагаются в паховой области.
Диагностика. Диагностика опухолей семенного канатика включает данные осмотра, пальпации, УЗИ, КТ и МРТ. Наиболее полную информацию о тканевой принадлежности опухолевых клеток получают при цитологическом исследовании материала, аспирированного посредством тонкоигольной биопсии, а окончательный диагноз может быть установлен только после оперативного лечения и гистологического исследования удаленной ткани.
Лечение хирургическое. Оперативные вмешательства выполняют из пахового доступа. Семенной канатик обычно пересекают на уровне внутреннего пахового кольца и выполняют срочное гистологическое исследование. Дальнейшая оперативная тактика зависит от степени злокачественности опухоли. При доброкачественных опухолях семенного канатика применяют органосохраняющее лечение - удаление опухоли в пределах здоровых тканей; при злокачественных - радикальную орхифуникулэктомию и при наличии показаний - лучевую терапию и химиотерапию. Для рабдомиосар-комы характерно раннее распространение по лимфатическим путям, поэтому оперативное лечение дополняют иссечением забрюшинных лимфатических узлов.
Показания к хирургическому лечению у больных с опухолями семенного канатика должны быть расширены, так как встречаются доброкачественные новообразования, содержащие включения злокачественных опухолей, и только оперативное вмешательство позволяет получить полноценный материал для их диагностики.
Прогноз зависит от степени злокачественности новообразования и возможности радикального лечения. При своевременном распознавании заболевания прогноз благоприятный.
11.7.2. Опухоли семенного пузырька
Первичные опухоли семенных пузырьков - крайне редкие новообразования. Среди них преобладают аденокарциномы. По мере инвазии в соседние органы, в частности в мочевой пузырь, эти новообразования могут быть расценены как опухоли другой локализации.
Вторичные опухоли семенных пузырьков в основном выявляют у больных распространенным раком предстательной железы, мочевого пузыря, реже - прямой кишки.
Симптоматика. Клинические проявления при первичном поражении семенного пузырька на ранних стадиях могут отсутствовать. Дальнейший рост опухоли сопровождается развитием ряда симптомов, из которых наиболее характерны расстройства мочеиспускания обструктивного типа.
При распространении опухоли на мочевой пузырь, промежность, прямую кишку могут появляться боли с иррадиацией в паховую область, задний проход, крестец, а также запоры и гематурия.
Диагностика. На ранних стадиях опухоль семенного пузырька можно определить при пальцевом ректальном исследовании в виде плотного бугристого и умеренно болезненного при пальпации образования, непосредственно прилежащего к предстательной железе. Увеличиваясь, доброкачественные опухоли обычно долго сохраняют округлую форму, тогда как злокачественные инфильтрируют предстательную железу и окружающую клетчатку, что часто делает невозможным определение локализации первичного очага.
При везикулографии можно выявить дефекты наполнения семенного пузырька на стороне поражения, однако опухолевая инфильтрация нередко препятствует введению рентгеноконтрастного препарата. Более четко визуализировать семенные пузырьки и предстательную железу позволяет УЗИ, особенно при ректальном расположении датчика. Наиболее информативными исследованиями, позволяющими оценить распространение опухоли, служат КТ и МРТ. Окончательный диагноз устанавливают после гистологического анализа биопсийного материала.
Лечение. Основной метод лечения больных с опухолями семенных пузырьков - хирургический.
При небольших доброкачественных новообразованиях возможно удаление семенного пузырька, пациентам со злокачественными опухолями проводят радикальную цистопростатэктомию.
Прогноз в основном определяется гистологическим типом опухоли, стадией и степенью ее дифференцировки, а также возможностью радикального лечения.
11.8. ОПУХОЛИ ПОЛОВОГО ЧЛЕНА
11.8.1. Доброкачественные опухоли и предраковые заболевания полового члена
Большинство опухолей полового члена имеют эпителиальное происхождение, неэпителиальные опухоли встречаются редко. Новообразования, принадлежащие к обеим группам, принято делить на доброкачественные и злокачественные, при этом некоторые доброкачественные опухоли расценивают как предраковые заболевания.
Среди доброкачественных опухолей чаще выявляют эпителиальные новообразования - папилломы, тогда как неэпителиальные (сиринго-мы, неврилемомы, ангиомиомы, фибромы, невромы, липомы, ангиомы и др.) встречаются редко. К этой группе заболеваний также относятся опухолеподобные поражения кожи полового члена - врожденные (ретенционные кисты) и приобретенные (вследствие подкожного введения масляных растворов - олеогранулемы).
К предраковым заболеваниям относят лейкоплакию, склероатро-фический лишай (крауроз полового члена), остроконечные кондиломы, опухоль Бушке-Левенштейна, болезнь Боуэна и эритроплазию Кейра. У 30-40 % больных рак полового члена развивается на фоне этих заболеваний.
При лейкоплакии на коже головки полового члена появляются уплотненные белесоватые участки, чаще всего в области наружного отверстия мочеиспускательного канала. При микроскопии выявляют акантоз, гиперкератоз и паракератоз.
Склероатрофический лишай (крауроз полового члена) - редкое заболевание, при котором выявляются ороговевающие бляшки и атрофия кожи крайней плоти и головки полового члена.
Остроконечные кондиломы проявляются одиночными или множественными ворсинчатыми разрастаниями, которые обычно располагаются на головке полового члена и крайней плоти, несколько реже - в области промежности, перианальной зоне, а также в ладьевидной ямке и просвете мочеиспускательного канала. Заболевание широко распространено. В настоящее время идентифицировано более 40 подтипов вируса папилломы человека, которые способствуют развитию
остроконечных кондилом. Отмечено, что для вирусов типов 6, 11, 42, 43 и 44 характерны новообразования больших размеров, а вирусы типов 16, 18, 31, 33, 35 и 39 часто способствуют малигнизации опухолей.
Гигантская остроконечная кондилома (опухоль Бушке- Левенштейна) также относится к заболеваниям, которые вызывает вирус папилломы человека (типы 6 и 11). Эта опухоль представляет собой ворсинчатое образование, располагающееся на головке полового члена и внутреннем листке крайней плоти. В отличие от остроконечных кондилом, оно имеет склонность к местному инвазивному росту. Для уточнения диагноза показана глубокая биопсия с участком подлежащей неизмененной ткани. Лечение в большинстве случаев заключается в частичной или тотальной пенэктомии, так как опухоль часто рецидивирует, больные нуждаются в регулярном диспансерном наблюдении.
Диагностика доброкачественных опухолей полового члена в основном строится на данных объективного обследования и гистологического исследования новообразований. Хирургическое лечение показано в большинстве случаев, так как позволяет получить материал для морфологического анализа и исключить злокачественный характер новообразования. Опухоли иссекают в пределах неизмененных подлежащих тканей, у ряда больных с рубцовыми изменениями показаны меатопластика и круговое иссечение крайней плоти. При множественных остроконечных кондиломах успешно используют местное лечение подофиллотоксином и трихлоруксусной кислотой, возможна также лазерная коагуляция.
11.8.2. Рак полового члена
Рак полового члена - редкое заболевание, в настоящее время в европейских государствах и США он составляет менее 1 % злокачественных опухолей у мужчин. В странах с жарким и влажным климатом (Африка, Южная Америка, Южная и Юго-Восточная Азия) это заболевание встречается в 10-20 раз чаще.
Обычно этот рак поражает мужчин старше 50 лет, более 95 % опухолей представлены плоскоклеточной карциномой. Предрасполагающими к его развитию факторами считают несоблюдение гигиенических норм и застой смегмы в препуциальном мешке, а также необрезанную крайнюю плоть и фимоз. Считается, что имеет значение продолжительность раздражающего воздействия смегмы, в которой могут содержаться канцерогенные вещества. Известно, что рак полового члена чрезвычайно редко встречается в странах, где мужчинам сразу после рождения
делают обрезание. Чрезвычайно важную роль в возникновении рака полового члена играют предраковые заболевания, описанные выше. Кроме того, развитию плоскоклеточной карциномы полового члена нередко предшествуют болезнь Боуэна и эритроплазия Кейра. Это сходные заболевания, представляющие собой плоскоклеточный рак in situ с поражением тела полового члена (болезнь Боуэна) или головки и шейки полового члена (эритроплазия Кейра).
Симптоматика. Плоскоклеточная карцинома полового члена в типичном случае - папиллярное или изъязвленное образование, располагающееся на головке или коже полового члена. Больные жалуются на дискомфорт и зуд в области головки полового члена, реже - рези и затруднение мочеиспускания, в некоторых случаях развивается фимоз, при котором могут быть кровянистые или гнойные выделения из пре-пуциального мешка. Характерно позднее обращение к врачу, поэтому нередко при первичном осмотре определяется опухоль больших размеров, глубоко врастающая в кавернозные тела или мочеиспускательный канал с образованием свищей. Рак полового члена, как правило, быстро распространяется местно и дает метастазы в легкие, печень, кости, головной мозг.
Диагностика на поздних стадиях обычно не представляет трудностей. При начальных проявлениях требуется проведение дифференциальной диагностики с предраковыми заболеваниями, сифилисом, туберкулезным и язвенным баланопоститом. Для уточнения стадии болезни показаны биопсия новообразования с последующим гистологическим исследованием, а также оценка состояния регионарных лимфатических узлов.
Лечение больных с небольшими поверхностными карциномами полового члена, расположенными на его головке и в дистальных отделах, заключается в парциальной пенэктомии. Половой член резецируют вместе с опухолью, отступив на 2 см в пределах здоровых тканей. При поражении проксимальных отделов полового члена используют органоуносящие операции - тотальную пенэктомию. Для уточнения состояния регионарных лимфатических узлов выполняют паховую лимфаденэктомию. У пациентов с опухолями, врастающими в мошонку или кости лонного сочленения, возможно комбинированное применение лучевой терапии, химиотерапии и расширенного хирургического вмешательства.
У некоторых больных с поверхностными формами рака полового члена можно использовать лазерную хирургию и радикальное лучевое лечение.
Профилактика рака полового члена заключается в соблюдении гигиены.
Прогноз зависит от стадии заболевания. При своевременном обращении и радикальном лечении наиболее вероятен благополучный исход.
11.9. ОПУХОЛИ ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ
11.9.1. Доброкачественная гиперплазия предстательной железы
Эпидемиология. Частота ДГПЖ значительно колеблется у мужчин в зависимости от возраста. Клинические признаки этой болезни наблюдаются у 10-15 % мужчин в возрасте 40 лет и у 80 % мужчин 75-80 лет. Проведенные в России в последние годы эпидемиологические исследования указывают на постепенное нарастание частоты ДГПЖ с 11,3 % в возрасте 40-49 лет до 81,4 % в возрасте 80 лет.
У большинства мужчин старше 50 лет наблюдаются те или иные расстройства акта мочеиспускания, т. е. симптомы, характерные для ДГПЖ. Однако причиной развития таких симптомов могут быть не только ДГПЖ, но и хронический простатит, рак предстательной железы, а также нарушение сократительной активности детрузора, нестабильность детрузора и ряд других дисфункций мочевого пузыря.
Кроме того, до недавнего времени большая часть эпидемиологических данных была получена только на основании обследований мужчин, лечившихся по поводу ДГПЖ, т. е. исследования ограничивались теми пациентами, которых клинические проявления заболевания заставили обратиться за медицинской помощью. Наиболее точные данные о частоте ДГПЖ могут быть получены при морфологическом подтверждении диагноза. При аутопсии морфологические признаки этого заболевания обнаруживаются более чем у 40 % мужчин в возрасте 45-50 лет, но только у половины из них развиваются клинические проявления болезни.
Этиология и патогенез. В работах последнего времени подчеркивается многофакторность этиологии и патогенеза ДГПЖ.
Давно известна роль мужского полового гормона тестостерона как в нормальном росте предстательной железы, так и в развитии ДГПЖ. Еще в 1884 г. Ф. И. Синицын предложил двустороннюю орхиэктомию для «радикального» лечения гипертрофии предстательной железы, а в 1940 г. К. Хаггинс (C. Huggins) и Р. Стивенс (R. Stevens) на высоком
научном уровне обосновали связь между объемом предстательной железы и гормональным статусом. С тех пор все авторы считают, что в патогенезе ДГПЖ важнейшую роль играют половые гормоны.
В последние годы было доказано, что под воздействием андро- и эстрогенов происходит активация факторов роста, усиливающих процессы пролиферации стромального и эпителиального компонентов в предстательной железе. Выделяют три группы: факторы роста фибро-бластов, эпителиальные и трансформирующие.
Изменение гормональных соотношений в организме - исходный пункт в изучении этиологии и патогенеза ДГПЖ. В настоящее время существуют различные точки зрения на патогенез этого заболевания, но основное значение все авторы придают метаболизму тестостерона в дигидротестостерон в клетках предстательной железы.
Превращение свободного тестостерона в дигидротестостерон в клетках предстательной железы регулируется воздействием фермента 5а-редуктазы. В цитоплазме клетки дигидротестостерон связывается с андрогенным белковым рецептором и формируется андроген-рецеп-торный комплекс, проникающий в клеточное ядро и активирующий ДНК, что, в свою очередь, приводит к росту и дифференциации клеток предстательной железы, т. е. возникновению ДГПЖ.
Существуют и другие точки зрения на развитие ДГПЖ. Дигидро-тестостерон не единственный фактор патогенеза этого заболевания. Имеются определенные доказательства участия в его патогенезе 5а-андростендиолов, которые совместно с эстрогенами значительно увеличивают концентрацию андрогенных рецепторов в предстательной железе.
Современные представления о развитии ДГПЖ позволяют сделать заключение о многофакторности ее патогенеза: 1) превращение тестостерона под воздействием фермента 5а-редуктазы в дигидротесто-стерон способствует пролиферации эпителия предстательной железы, т. е. железистой гиперплазии; 2) относительное повышение уровня эстрогенов приводит к пролиферации клеток стромы, т. е. к стро-мальной гиперплазии; 3) уменьшение количества 5а-андростендиола приводит к увеличению функциональной активности и количества а1-адренорецепторов предстательной железы, шейки мочевого пузыря и простатического отдела уретры, к сокращению гладкой мускулатуры этих органов, что лежит в основе развития динамического компонента и возникновения ирритативных симптомов заболевания. Кроме того, нарушение метаболических процессов в ткани предстательной железы приводит к расстройствам кровообращения в предстательной железе и
присоединению асептического воспалительного процесса. Последний сопровождается отеком предстательной железы и имеет значение для развития заболевания, так как высвобождение лимфоцитами тромбо-цитоподобного фактора роста может играть важную роль в пролиферации простатических клеток, а отек органа как механический фактор способствует усилению обструктивных симптомов болезни.
Морфогенез и патологическая анатомия. Морфологически ДГПЖ проявляется пролиферацией как железистой, так и стромальной ткани этого органа. В зависимости от соотношения тканей и преобладания одной из них различают железистую, стромальную и смешанные формы заболевания. Нередко в предстательной железе узлы разных гистологических типов сосуществуют. В зависимости от соотношения «эпителий/строма» в настоящее время классифицируют узлы гиперплазии при этом заболевании как узлы с низким содержанием эпителия (коэффициент «эпителий/строма» - Э/С <0,45), со средним содержанием эпителия (Э/С = 1,0) и с высоким содержанием эпителия (Э/С <1,8). Доказано, что чем больше объем предстательной железы при этом заболевании, тем выше показатель Э/С.
Развитие процесса гиперплазии обычно начинается из переходной (транзиторной) зоны предстательной железы. В дальнейшем развивается полицентрический рост узлов в ее ткани, при этом происходит увеличение массы и объема предстательной железы.
Установлено, что средняя масса ее в норме в препубертатном периоде составляет 1,6 г, достигая к 12 годам 4 г, а к 25 годам - 20 г. Следующий период активного увеличения предстательной железы наблюдается после 40 лет и связан с развитием доброкачественной гиперплазии. К 70 годам средняя масса предстательной железы достигает 30-60 г. ДГПЖ с массой узлов менее 25 г считается малой, от 25 до 80 г - средней, свыше 80 г - крупной, а более 250 г - гигантской.
В норме предстательная железа окружает мочеиспускательный канал в его заднем (простатическом) отделе, но не приводит к его сдавлению, и акт мочеиспускания у мужчин остается нормальным. При росте ткани предстательной железы происходит сдавление простатического отдела уретры и сужение его просвета, что препятствует нормальному оттоку мочи из мочевого пузыря и способствует развитию так называемых обструктивных симптомов заболевания, т. е. симптомов опорожнения. Одновременно появляются и другие симптомы болезни, обусловленные изменениями мышц мочевого пузыря и усилением раздражения а-рецепторов простатического отдела уретры, шейки мочевого пузыря и самой предстательной железы.
Для преодоления сопротивления в зоне инфравезикальной обструкции необходимо более высокое внутрипузырное давление, что достигается сокращением мышц пузыря с большей силой, и развивается компенсаторная гипертрофия детрузора. В дальнейшем компенсаторная гипертрофия мышц мочевого пузыря переходит в частичное их замещение соединительной тканью, и развивается атония мочевого пузыря, что способствует нарушению его опорожнения во время акта мочеиспускания. При выраженном растяжении мочевого пузыря нарушается не только его опорожнение, но и транспорт мочи по мочеточникам из-за несостоятельности антирефлюкс-ного механизма устьев мочеточников. Повышается внутрилоханочное давление и появляется застой мочи в чашечно-лоханочной системе почек. Нарушается функция почек, развивается двусторонний урете-рогидронефроз.
Клинические проявления ДГПЖ не зависят от объема этого органа напрямую. Решающее значение имеет направление роста узлов. При интравезикальном росте узлов (так называемом росте средней доли) небольших размеров железа нависает над внутренним отверстием уретры в виде клапана и может вызывать значительные затруднения мочеиспускания, тогда как железа больших размеров может длительно расти преимущественно в направлении прямой кишки без выраженных клинических проявлений.
Клиническая классификация. Еще недавно многие клиницисты подразделяли клиническое течение ДГПЖ на три стадии.
На первой стадии заболевания (компенсации) наблюдаются расстройства акта мочеиспускания при полном опорожнении мочевого пузыря. Больные отмечают вялую струю мочи, появление императивных позывов, особенно по ночам, несколько затрудненное мочеиспускание, но патологических изменений со стороны почек и верхних мочевых путей в этой стадии нет.
Вторая стадия заболевания (субкомпенсации) характеризуется значительным нарушением функции мочевого пузыря и появлением остаточной мочи. Струя мочи становится истонченной и очень вялой, после мочеиспускания больной испытывает чувство неполного опорожнения, так как часть мочи (100-200 мл и более) остается в мочевом пузыре.
Во второй стадии заболевания может наблюдаться острая задержка мочеиспускания, а из-за затруднения оттока мочи из верхних мочевых путей нарушается функция почек.
На третьей стадии болезни (декомпенсации) развивается полная атония мочевого пузыря, наблюдается парадоксальная ишурия, отме-
чаются выраженное расширение верхних мочевыводящих путей и прогрессивное нарушение функций почек.
Существуют классификации ДГПЖ, отражающие совокупность клинических проявлений по Международной системе суммарной оценки симптомов в баллах с обязательным учетом других ведущих характеристик заболевания (показателя качества жизни, максимальной скорости потока мочи, количества остаточной мочи, объема предстательной железы, показателей комплексного уродинамического обследования).
Международная система суммарной оценки симптомов при заболеваниях предстательной железы (IPSS) представляет собой анкету из семи вопросов, касающихся степени выраженности симптомов нарушенного мочеиспускания, и одного вопроса, оценивающего качество жизни (табл. 11.1). Пациент выбирает один из шести ответов в зависимости от выраженности каждого симптома. Ответ на каждый вопрос оценивается от 0 до 5. Общее количество баллов может варьировать от 0 до 35, при этом сумма от 0 до 7 свидетельствует о легкой, от 8 до 19 - об умеренной и от 20 до 35 - о тяжелой симптоматике заболевания. Индекс качества жизни определяется при ответе на последний вопрос анкеты.
Симптоматика и клиническое течение. Для клинической картины ДГПЖ наиболее характерны симптомы нарушения акта мочеиспускания.
На симптоматику и клиническое течение ДГПЖ влияют многочисленные осложнения заболевания: острая задержка мочеиспускания; гематурия; камни мочевого пузыря; пиелонефрит; цистит; уретрит; простатит; орхиэпидидимит; хроническая почечная недостаточность.
В клиническом течении ДГПЖ следует различать симптомы: 1) связанные с патологическими изменениями в нижних мочевых путях; 2) обусловленные вторичными изменениями в почках и верхних мочевыводящих путях; 3) обусловленные осложнениями заболевания. Первая группа симптомов наблюдается наиболее часто и в основном определяет клинические проявления болезни. Они связаны как со сдавлением уретры гиперплазированной тканью предстательной железы, т. е. уретральной (инфравезикальной) обструкцией, так и с состоянием детрузора и гиперактивностью а1-адренорецепторов шейки мочевого пузыря, простатического отдела уретры и предстательной железы. Именно эти симптомы чаще всего и заставляют пациента обратиться к врачу.
Таблица 11.1. Международная система суммарной оценки симптомов заболеваний предстательной железы в баллах (IPSS)
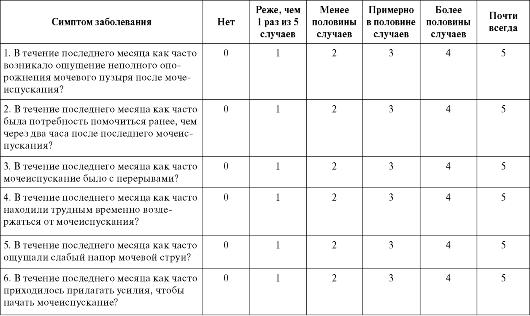
В последние годы данные симптомы ДГПЖ подразделяют на обструктивные, связанные с механическим сдавлением шейки мочевого пузыря и уретры увеличенной предстательной железой и затруднением оттока мочи из мочевого пузыря, и ирритативные, обусловленные изменениями функции детрузора, сфинктера мочевого пузыря и гиперактивностью α1-адренорецепторов шейки мочевого пузыря, простатического отдела уретры и шейки мочевого пузыря.
К обструктивным симптомам относят затрудненное мочеиспускание, вялую струю мочи, увеличение времени мочеиспускания, необходимость напрягать брюшную стенку при мочеиспускании, подтекание мочи по каплям после акта мочеиспускания, чувство неполного опорожнения мочевого пузыря, парадоксальную ишурию. Эти симптомы проявляются в момент опорожнения мочевого пузыря и могут свидетельствовать не только о наличии инфравезикальной обструкции, но и о снижении сократительной способности детрузора.
Ирритативные симптомы (ночная поллакиурия, учащенное мочеиспускание малыми порциями, болезненное мочеиспускание, императивные позывы к мочеиспусканию, неудержание мочи при позывах) проявляются вне акта мочеиспускания на этапе накопления мочи в мочевом пузыре.
Клиническая картина ДГПЖ характеризуется волнообразным течением и медленным прогрессированием, сопровождающимся выраженными изменениями во всех органах мочевой системы: мочеиспускательном канале, мочевом пузыре, мочеточниках и почках.
В мочеиспускательном канале эти изменения проявляются сдав-лением, деформацией и удлинением его простатического отдела до 4-6 см и более.
Существенные изменения развиваются в мочевом пузыре. Возникновение обструкции приводит к компенсаторной гипертрофии стенок мочевого пузыря, чтобы во время акта мочеиспускания вытолкнуть всю мочу. Дальнейшее развитие обструкции уретры и шейки мочевого пузыря за счет ДГПЖ приводит к разобщению мышечных элементов мочевого пузыря, заполнению пространств между ними соединительной тканью и появлению ложных дивертикулов. Из-за снижения тонуса мышц мочевого пузыря в его полости после мочеиспускания остается некоторое количество мочи, объем которой может колебаться от 50-80 до 250-300 см3 и даже более (остаточная моча). В конечной стадии заболевания ослабленные мышцы мочевого пузыря не в состоянии изгнать мочу, и она выделяется из наружного отверстия мочеиспускательного канала постоянно по каплям. Этот симптом
получил название парадоксальной ишурии. Парадокс заключается в том, что одновременно наблюдаются два как бы взаимоисключающих симптома: задержка и недержание мочи.
Частое осложнение ДГПЖ - полная острая задержка мочеиспускания, которая обычно связана с приемом алкоголя или пищи с большим количеством пряностей, неудовлетворенным половым возбуждением, переохлаждением, нарушением функции кишечника, несвоевременным опорожнением мочевого пузыря, стрессом. Проявляется острая задержка мочеиспускания невозможностью самостоятельного опорожнения мочевого пузыря и возникновением по мере накопления мочи мучительных позывов на мочеиспускание. У некоторых больных внезапная острая задержка мочеиспускания служит первым проявлением ДГПЖ. Механизм острой задержки мочеиспускания складывается из многих факторов: роста гиперплазированной ткани предстательной железы и сдавления шейки мочевого пузыря и простатического отдела уретры, существенного нарушения тонуса мышц мочевого пузыря, нарушения кровотока в органах малого таза с возникновением отека предстательной железы.
Другое осложнение ДГПЖ - камни мочевого пузыря, которые встречаются у 12-15 % больных. Причиной образования камней в мочевом пузыре при этом заболевании служат застой мочи в мочевом пузыре и изменение ее реакции. При камнях мочевого пузыря мочеиспускание бывает учащенным, зачастую пациент испытывает постоянные боли над лоном. Некоторые больные жалуются на прерывистую струю мочи и даже на полное прекращение мочеиспускания, которое восстанавливается при изменении положения тела.
Гематурия при ДГПЖ наблюдается у 15-20 % больных. Она может быть как макро-, так и микроскопической. Источником крови в моче наиболее часто становятся расширенные и варикозно-расширенные вены шейки мочевого пузыря. У некоторых пациентов гематурия при ДГПЖ приводит к тампонаде мочевого пузыря сгустками крови, что требует экстренного оперативного вмешательства.
Наличие выраженной обструкции простатического отдела мочеиспускательного канала и шейки мочевого пузыря за счет ДГПЖ приводит к повышению давления в мочевом пузыре, зиянию устьев мочеточников, нарушению оттока мочи из мочеточников и почек. Мочеточники расширяются, удлиняются, становятся извилистыми, возникает гидроуретер.
Вслед за мочеточниками расширяются почечная лоханка и чашки, возникает гидронефроз. Расширение полостной системы почек и мочеточников способствует присоединению инфекции, развитию пиелонефрита.
Воспалительные осложнения с характерной для них клинической картиной могут выйти на первый план по проявлениям болезни и значительно усугубить течение ДГПЖ. Нарастающее расширение почек и мочеточников и хронический пиелонефрит приводят к снижению функции почек.
Диагностика. Для своевременного выявления ДГПЖ крайне важны профилактические осмотры мужчин старше 40 лет, ибо многие пациенты даже при наличии проявлений этой болезни сами к урологу не обращаются.
Согласно рекомендациям Международного совещания по вопросам доброкачественной гиперплазии предстательной железы (Париж, 1997), для выявления этого заболевания был предложен оптимальный диагностический алгоритм, включающий обязательные, рекомендуемые, факультативные (углубленного обследования больного), а также нерекомендуемые методы исследования.
Обязательные методы исследования для первоначальной оценки состояния больного включают сбор подробного анамнеза заболевания, выяснение симптомов болезни на момент обращения пациента к врачу с количественной их оценкой по шкале IPSS, оценку качества жизни, заполнение дневника мочеиспускания, общее физикальное обследование, пальпацию предстательной железы и семенных пузырьков через ампулу прямой кишки, общий анализ мочи, оценку функционального состояния почек путем определения уровня креатинина в сыворотке крови.
При сборе анамнеза врач должен обратить внимание на длительность заболевания, время появления первых симптомов болезни, наличие крови в моче и острой задержки мочеиспускания, выполненные ранее оперативные вмешательства, особенно на мочевых и половых органах. Одновременно следует уточнить наличие у пациента сопутствующих заболеваний, особенно болезней, которые могут влиять на мочеиспускание (заболевания и травмы спинного мозга, сахарный диабет, паркинсонизм, инсульт, алкоголизм, сужение мочеиспускательного канала, хронический простатит, опухоли мочевого пузыря и других органов малого таза и др.).
При выявлении болезни врач уточняет наличие и степень выраженности в течение последнего месяца всех симптомов, приведенных в табл. 11.1, оценивая их в соответствии с IPSS.
Одновременно врач оценивает качество жизни больного с ДГПЖ вследствие расстройств мочеиспускания с определением индекса качества жизни.
Пальцевое обследование предстательной железы и семенных пузырьков через ампулу прямой кишки имеет большое значение при выявлении ДГПЖ и обязательно должно выполняться при первичном обращении больного к урологу. Это исследование дает возможность определить размеры, консистенцию и конфигурацию предстательной железы, а также отметить болезненность при пальпации этого органа при наличии хронического простатита, выявить возможные изменения семенных пузырьков и заподозрить рак предстательной железы при соответствующих изменениях этого органа. При ДГПЖ этот орган увеличен, эластичен по консистенции, междолевая бороздка сглажена, а контуры предстательной железы четко определяются.
Общий анализ мочи - обязательный метод исследования. Выявление лейкоцитурии может свидетельствовать о воспалительных заболеваниях мочеполовых органов, а обнаружение эритроцитов - о примеси крови в моче из-за варикозного расширения вен шейки, камня, опухоли мочевого пузыря и других заболеваний. Обнаружение лейкоцитурии и микрогематурии требует проведения дополнительного обследования.
Для оценки функционального состояния почек определяют уровень креатинина (или мочевины) в сыворотке крови. Известно, что у многих больных с ДГПЖ развивается хроническая почечная недостаточность, и это исследование обязательно выполняют при первичном обращении к врачу, чтобы назначить правильное лечение.
К рекомендованным методам исследования, которые имеют значительную ценность при первичном обследовании больных, относят определение уровня ПСА в крови, оценку акта мочеиспускания посредством выполнения урофлоуметрии с регистрацией максимальной скорости потока мочи и ультразвуковое определение количества остаточной мочи.
Один из важных этапов обследования пациентов с заболеваниями предстательной железы - оценка уровня ПСА в сыворотке крови. Она позволяет выявить латентно протекающий рак предстательной железы, а также определить преобладание эпителиальной или фиброзной ткани в органе при ДГПЖ, что чрезвычайно важно при выборе препарата для лечения.
При первичном обследовании больных с ДГПЖ очень важно оценить акт мочеиспускания. Для этого выполняют урофлоуметрию - простое, недорогое и безопасное исследование, основанное на определении и графической регистрации изменений объемной скорости мочеиспускания. При инфравезикальной обструкции, обусловленной ДГПЖ, снижается максимальная и средняя скорость потока мочи и
Рис. 11.9. Урофлоуграммы:
а - в норме; б - при доброкачественной гиперплазии предстательной железы
увеличивается продолжительность акта мочеиспускания, а урофлоумет-рическая кривая становится пологой и более протяженной (рис. 11.9). При выполнении урофлоуметрии больной мочится в специальный резервуар, и с помощью специального приспособления осуществляется запись акта мочеиспускания. Для оценки урофлоуметрической кривой наиболее часто используют показатель максимальной скорости потока мочи. Его значения более 15 мл/с считаются нормальными. Показатель максимальной скорости потока мочи 10-15 мл/с свидетельствует о легкой степени, 5-10 мл/с - о средней степени, а менее 5 мл/с - о тяжелой степени нарушения мочеиспускания.
При распознавании ДГПЖ важно оценить количество остаточной мочи в мочевом пузыре после акта мочеиспускания, позволяющее уточнить стадию заболевания и определить показания к медикаментозному или оперативному лечению. Количество остаточной мочи чаще всего определяют ультразвуковым методом. Одновременно при этом можно оценить размеры (объем) и форму предстательной железы, для чего выполняют УЗИ как перед актом мочеиспускания (для определения размеров и формы предстательной железы), так и сразу после него (для определения количества остаточной мочи).
Кроме определения количества остаточной мочи, УЗИ позволяет оценить контуры мочевого пузыря, его конфигурацию, объем, толщину
Рис. 11.10. Трансректальная ультрасо-нограмма больного с доброкачественной гиперплазией предстательной железы
стенки, конфигурацию шейки, наличие в мочевом пузыре камней, опухоли, дивертикулов, а также изучить размеры и конфигурацию предстательной железы. При ДГПЖ на ультразвуковых сканограм-мах определяется увеличение предстательной железы разной степени, которая в виде округлого образования с ровными контурами вдается в просвет мочевого пузыря (рис. 11.10). У некоторых больных предстательная железа приобретает
грушевидную форму за счет изолированного увеличения средней доли. Более точно оценить состояние и направление роста предстательной железы при ее доброкачественной гиперплазии можно после трансректального УЗИ.
Факультативные методы исследования, подразумевающие углубленное обследование больного с ДГПЖ, включают выполнение исследования давление-поток при специальном уродинамическом обследовании для точного установления наличия и степени выраженности обструкции, изучение состояния верхних мочевых путей с использованием ультразвука и экскреторной урографии и, изредка, цистоскопию. Цистоскопия показана при наличии гематурии в момент обследования, в анамнезе, а также при подозрении на сопутствующую опухоль мочевого пузыря. Для оценки состояния почек и верхних мочевых путей выполняют экскреторную урографию.
Иногда применяют и радионуклидные исследования: радиоизотопную ренографию, динамическую нефросцинтиграфию. Еще реже в настоящее время у больных с ДГПЖ выполняют цистографию. На цистограммах можно увидеть дефект наполнения мочевого пузыря в области его шейки, обусловленный увеличенной предстательной железой. Очень редко для распознавания ДГПЖ выполняют МРТ, так как доказана идентичность результатов этого исследования и ультразвукового трансректального сканирования.
К методам, не рекомендованным Международным согласительным комитетом при первичном обследовании больных с ДГПЖ, относят ретроградную уретрографию, профилометрию уретры, микционную
цистоуретрографию, электромиографию сфинктера уретры, полицис-тометрографию, так как они не дают полезной информации.
Дифференциальная диагностика ДГПЖ должна проводиться с рядом других заболеваний, имеющих сходную клиническую симптоматику: стриктурами уретры, склерозом и раком предстательной железы, циститом, раком, инородными телами и камнями мочевого пузыря, нестабильностью детрузора, простатитом, камнями нижней трети мочеточника.
Лечение. Тактика лечения больных с ДГПЖ зависит от степени нарушения оттока мочи из мочевого пузыря, размеров предстательной железы, выраженности ирритативных и обструктивных симптомов. Цель лечения - улучшение качества жизни пациентов и предотвращение осложнений, связанных с ДГПЖ. Все лечебные подходы можно разделить на три направления: выжидательное наблюдение, медикаментозная терапия и хирургическое лечение.
Выжидательное наблюдение применяют в случаях отсутствия инфраве-зикальной обструкции и значимого ухудшения качества жизни больных. Такие пациенты находятся под наблюдением уролога и периодически проходят контрольные обследования. При ухудшении оттока мочи или усилении симптоматики заболевания начинают активное лечение.
Медикаментозная терапия базируется на современных знаниях о патогенезе ДГПЖ. На сегодняшний день для лечения больных с ДГПЖ применяют ингибиторы 5а-редуктазы и α-адреноблокаторы по отдельности или совместно.
Ингибиторы 5а-редуктазы способствуют уменьшению активности фермента 5а-редуктазы и тем самым препятствуют образованию из тестостерона его активного метаболита дигидротестостерона. Применение ингибиторов 5а-редуктазы приводит к сокращению объема предстательной железы, уменьшая тем самым механический компонент инф-равезикальной обструкции. В настоящее время для лечения пациентов с ДГПЖ используют ингибитор 5а-редуктазы второго типа финастерид и ингибитор 5а-редуктазы первого и второго типа дутастерид в дозе 0,5 мг однократно в сутки. Показанием к их применению является умеренная или выраженная симптоматика ДГПЖ у пациентов с объемом предстательной железы более 30-40 см3. При лечении ингибиторами 5а-редуктазы уменьшение объема предстательной железы отмечено только при длительном лечении, поэтому эти препараты назначают в течение не менее шести месяцев.
Другое направление медикаментозного лечения больных ДГПЖ - назначение блокаторов а1-адренорецепторов. Эффект этих препаратов
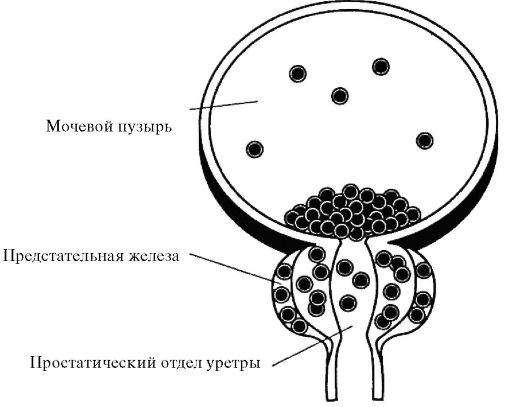
Рис. 11.11. Расположение α-адренорецепторов в мочевом пузыре, предстательной железе и простатическом отделе мочеиспускательного канала
основан на способности снижать тонус гладкой мускулатуры шейки мочевого пузыря, заднего отдела мочеиспускательного канала и предстательной железы, приводя к уменьшению динамического компонента обструкции. Установлено, что α-адренорецепторы располагаются преимущественно в области шейки мочевого пузыря, простатическом отделе мочеиспускательного канала, капсуле и строме предстательной железы (рис. 11.11).
Для лечения больных с ДГПЖ применяют или суперселективные антагонисты только α1-А-адренорецепторов (тамсулозин), или селективные антагонисты всех α1-адренорецепторов (альфузозин, докса-зозин, теразозин). Показанием к назначению α1-адреноблокаторов служит умеренная или тяжелая степень выраженности симптоматики
ДГПЖ.
На фоне лечения α1-адреноблокаторами наблюдается улучшение оттока мочи из мочевого пузыря, что проявляется уменьшением выраженности обструктивных симптомов, увеличением скорости потока мочи, снижением количества остаточной мочи. Одновременно
отмечают уменьшение интенсивности ирритативной симптоматики. Достоверного изменения объема предстательной железы при лечении а1-адреноблокаторами не зарегистрировано.
У значительного числа пациентов требуется комбинированная терапия ингибиторами 5а-редуктазы и а1-адреноблокаторами.
Для лечения ДГПЖ существует значительное число препаратов растительного происхождения. Однако эти лекарственные средства пока не могут быть рекомендованы для широкого использования у пациентов с ДГПЖ, поскольку в клинических исследованиях еще не получено доказательств их эффективности и безопасности при длительном использовании.
Оперативное лечение. Среди оперативных методов лечения больных с ДГПЖ наиболее распространены открытая аденомэктомия (проста-тэктомия) и ТУР предстательной железы.
Открытая аденомэктомия вот уже 100 лет остается наиболее радикальным способом избавления от ДГПЖ, однако показания к ней в последние 10 лет существенно изменились. В настоящее время оперативное лечение ДГПЖ считается показанным только при наличии осложнений, тогда как в начальных стадиях применяют медикаментозное лечение. Открытая аденомэктомия также показана, если при обследовании установлено, что эффекта от медикаментозной терапии ожидать нельзя.
В настоящее время для оперативного лечения больных с ДГПЖ широкое распространение получила ТУР предстательной железы. Этот метод считается «золотым стандартом» лечения ДГПЖ, что связано с его малой травматичностью и высокой эффективностью. Широкое внедрение ТУР позволило значительно расширить границы операбель-ности при ДГПЖ, в результате чего многие больные, ранее обреченные на пожизненное наличие надлобкового мочепузырного свища, могут быть с успехом прооперированы.
Преимущества ТУР перед открытой аденомэктомией: 1) отсутствие рассечения здоровых тканей при подходе к патологическому очагу; 2) достижение надежного контроля гемостаза; 3) более легкое течение послеоперационного периода и короткий койко-день; 4) возможность выполнения вмешательства у пациентов пожилого и старческого возраста с выраженной сопутствующей патологией.
Наряду с классической ТУР предстательной железы у больных с ДГПЖ, все более широкое применение находит метод трансуретральной электровапоризации предстательной железы. От классической ТУР он отличается использованием нового роликового электрода, называ-
емого вапотродом. Производится выпаривание ткани предстательной железы с одновременным подсушиванием и коагуляцией. Показания к трансуретральной электровапоризации предстательной железы те же, что и к ТУР.
Коагуляцию и выпаривание часто выполняют лазером. Лазерная вапоризация предстательной железы может выполняться контактным и бесконтактным способами, а лазерная коагуляция - контактным способом. Интерстициальная лазерная коагуляция - наименее инва-зивный метод лазерной терапии ДГПЖ с введением световода трансуретрально непосредственно в ткань предстательной железы.
Применяется и другой метод - трансуретральная игольчатая абляция предстательной железы с введением в ткань гиперплазирован-ной предстательной железы двух игольчатых электродов, соединенных с радиочастотным генератором.
Трансуретральная электроинцизия предстательной железы - одна из старейших операций в урологии. Чаще всего трансуретральную эндоскопическую инцизию предстательной железы проводят у пациентов пожилого возраста с выраженными сопутствующими заболеваниями, которым из-за высокой степени операционного риска нельзя выполнить ТУР.
11.9.2. Рак предстательной железы
Злокачественное новообразование, распространенное у мужчин старше 50 лет. В последние десятилетия во всем мире отмечается рост заболеваемости раком предстательной железы, но улучшается и диагностика ранних стадий этой болезни.
Эпидемиология. Частота заболевания раком предстательной железы неодинакова в разных странах и у представителей разных рас. Наибольшая распространенность наблюдается в странах Северной Америки и Европы, наименьшая - в Восточной Азии.
В США частота рака предстательной железы очень высока. Это заболевание занимает первое место среди злокачественных новообразований у мужчин. Рак предстательной железы составляет 29 % всех впервые диагностируемых злокачественных новообразований у мужчин и является причиной смерти от онкологических болезней в 13 % случаев. В России заболеваемость раком предстательной железы существенно ниже и составляет около 10 на 100 тыс. человек в год.
Частота клинически проявляющегося рака предстательной железы в последние годы неуклонно возрастает. При этом еще выше распро-
страненность латентного, т. е. бессимптомного, рака предстательной железы. Судить о наличии последнего можно по обнаружению микроскопических опухолей при гистологическом исследовании ткани предстательной железы.
Повышение частоты выявления рака предстательной железы в последние годы обусловлено, главным образом, обнаружением опухолевого процесса на ранних стадиях. Это связано с развитием новых методов обследования больных, в частности, с внедрением в широкую практику анализа крови на ПСА. Если раньше рак предстательной железы обнаруживали только на поздних стадиях и прогноз для больных с такими опухолями был неблагоприятный, то в настоящее время существенная доля выявляемых опухолей приходится на ранние и бессимптомные формы, при которых прогноз значительно лучше.
Этиология и патогенез. Причины развития рака предстательной железы окончательно не выяснены, однако в последние годы сделаны важные шаги для их понимания. Полагают, что в этиологии рака предстательной железы важен дисбаланс половых гормонов, потому что он развивается в период эндокринных сдвигов в организме мужчин пожилого возраста. Это заболевание относят к гормонально-зависимым. Рак предстательной железы не встречается после кастрации, тогда как при экзогенном поступлении тестостерона наблюдается резкое прогресси-рование опухоли.
Общепризнано, что возникновение рака предстательной железы связано с внутренними (генетическими) и внешними факторами, которые могут оказывать как канцерогенное, так и защитное действие. Преобладание первых приводит к развитию клинической формы рака предстательной железы, вторых - к отсутствию опухолевого роста или его приостановке в латентной стадии.
На важную роль генетических факторов указывает повышение риска развития рака предстательной железы у мужчин, ближайшие родственники которых страдали этим заболеванием. Риск развития новообразования в таких случаях возрастает в несколько раз.
Цитогенетические исследования показали наличие у больных раком предстательной железы гиперэкспрессии двух генов, один из которых локализован на хромосоме I (HPCI), а другой - на X-хромосоме (НРСХ). Они получили название «гены рака предстательной железы». Часто у больных раком предстательной железы обнаруживают также мутации других генов, локализованных на хромосомах 8р, 9р, 10pq, 16q. Важную роль в развитии и особенно в прогрессировании рака предстательной железы отводят мутациям гена р53, так называемого
гена-супрессора опухолевого роста. Доказано, что мутация гена BRG1 хромосомы 19p13 способствует трансформации простатической интра-эпителиальной неоплазии сперва в латентную, а затем и в клиническую форму рака предстательной железы.
Большое значение в развитии рака предстательной железы имеет нарушение метаболизма витамина D. Установлено, что активная форма витамина D [1,25(OH)2D3] оказывает антипролиферативное действие на клетки опухоли, а его высокое содержание в крови уменьшает риск развития рака предстательной железы. Поэтому получила широкое распространение гипотеза, согласно которой некоторые мужчины более подвержены развитию рака предстательной железы из-за врожденного снижения активности специфических рецепторов к витамину D.
Важное место в развитии и прогрессировании рака предстательной железы отводится генетическим особенностям андрогенных рецепторов. Известно, что рак предстательной железы - гормонально-зависимое заболевание, на его развитие влияют андрогены. У некоторых мужчин имеется врожденное уменьшение активности андрогенных рецепторов и их аффинитета для андрогенов.
Описанные выше особенности андрогенных рецепторов могут быть одним из объяснений расовых различий в заболеваемости раком предстательной железы. Установлено, что у жителей Юго-Восточной Азии, частота рака предстательной железы у которых минимальна, аффинитет андрогенных рецепторов ниже, чем, например, у европейцев, заболеваемость у которых весьма высокая. Частота латентной формы рака предстательной железы у представителей разных рас практически одинакова, однако андрогенная гиперстимуляция предрасполагает к прогрессиро-ванию опухолевого процесса и развитию клинических форм.
К внешним факторам, повышающим риск развития рака предстательной железы, относят ожирение, радиацию, курение, воздействие пестицидов. Большую роль играют пищевые факторы канцерогенеза, в частности высокое потребление жира животного происхождения. Кроме того, установлено, что риск развития рака предстательной железы увеличивает повышенное потребление с пищей кадмия. Предполагают, что кадмий, аккумулируясь в предстательной железе, угнетает защитную функцию гена р53.
Витамин А, содержащийся в некоторых овощах, например моркови, вызывает антиканцерогенный эффект, так как способствует нормальной дифференцировке клеток и оказывает антиоксидантное действие. Высокое потребление продуктов, богатых витамином А, уменьшает риск возникновения рака предстательной железы. Кроме витамина А,
подобное протективное действие оказывают витамины D и Е, а также микроэлемент селен.
Классификация. В настоящее время клиническую стадию заболевания определяют в соответствии с классификацией по системе TNM (2002).
Классификация рака предстательной железы по системе TNM (2002)
Т - первичная опухоль
Т1 - случайно выявленная опухоль (непальпируемая и не выявляемая при УЗИ).
Т1а - случайно выявленная опухоль (при ТУР предстательной железы), занимающая менее 5 % резецированной ткани.
Т1Ь - случайно выявленная опухоль (при ТУР предстательной железы), занимающая более 5 % резецированной ткани.
Т1с - непальпируемая опухоль предстательной железы, выявленная при биопсии под контролем трансректального УЗИ. Показание к биопсии - повышение уровня ПСА.
Т2 - опухоль ограничена предстательной железой.
Т2а - опухоль занимает не более половины одной доли.
Т2Ь - опухоль занимает более половины одной доли.
Т2с - опухоль локализована в обеих долях.
Т3 - опухоль прорастает за пределы капсулы предстательной железы. Т3а - экстракапсулярное распространение опухоли. Т3Ь - экстракапсулярное распространение с инвазией семенных пузырьков.
Т4 - опухоль фиксирована или прорастает в соседние органы. N - регионарные лимфатические узлы*
Nx - метастазы в регионарные лимфатические узлы не могут быть оценены.
N0 - нет метастазов в регионарные лимфатические узлы. N1 - метастазы в регионарные лимфатические узлы.
M - отдаленные метастазы
Мх - отдаленные метастазы не могут быть оценены.
* Тазовые лимфатические узлы ниже бифуркации общих подвздошных артерий. К ним относятся подчревные, запирательные, подвздошные (внутренние и наружные), перипро-статические, сакральные. Отдаленные лимфатические узлы находятся вне границы таза, и их поражение рассматривается как наличие отдаленных метастазов. К ним относятся аортальные (парааортальные, периаортальные, поясничные), общие подвздошные, паховые, бедренные, надключичные, шейные.
М0 - отдаленных метастазов нет. М1 - отдаленные метастазы.
М1а - метастазы в лимфатические узлы, не относящиеся к регионарным.
М1Ь - метастазы в кости.
М1с - метастазы в другие органы (прямую кишку, семенные пузырьки).
В практических целях используют деление рака предстательной железы на локализованную и распространенную формы. Последняя подразделяется на местнораспространенную и метастатическую. Очевидно, что хороших результатов при радикальном оперативном вмешательстве можно добиться только при локализованных формах рака предстательной железы.
По гистологическому строению в подавляющем большинстве случаев (более 95 %) рак предстательной железы является аденокарциномой.
В клинических и прогностических целях весьма важно устанавливать гистологические особенности роста и степень дифференцировки опухолевых клеток. Чем менее дифференцированы опухолевые клетки, тем быстрее опухоль метастазирует и хуже поддается лечению, т. е. более злокачественна. Для оценки степени дифференцирования новообразования предстательной железы на основании гистологических признаков была предложена классификация Глисона, согласно которой выделены пять степеней злокачественности (табл. 11.2).
Таблица 11.2. Характеристика степеней злокачественности новообразования предстательной железы по шкале Глисона

При гистологическом исследовании рака предстательной железы практически всегда отмечается значительное различие в степенях злокачественности опухолевых клеток из различных участков исследуемой ткани, поэтому принято указывать диапазон этих степеней у конкретного больного. На практике обычно используют так называемый показатель Глисона: сумму двух наиболее часто встречающихся степеней. Показатель Глисона <4 соответствует высокодифференцированному раку, 5-7 - умереннодифференцированному, >7 - низко- и недифференцированному. Этот показатель имеет большое клиническое и прогностическое значение.
Симптоматика. На ранних стадиях рак предстательной железы протекает бессимптомно. Клинические симптомы обычно появляются при значительном местном или метастатическом распространении опухоли.
Первыми симптомами рака предстательной железы могут быть расстройства мочеиспускания, связанные с прорастанием опухолью простатической части уретры и инфравезикальной обструкцией. Клинически это выражается сначала в учащении мочеиспускания, затем оно становится затрудненным, появляются слабость струи мочи, чувство неполного опорожнения мочевого пузыря. В редких случаях может возникать острая задержка мочеиспускания.
Боль - другое частое проявление рака предстательной железы, может быть разной интенсивности, чаще постоянной, локализующейся в промежности, крестце, головке полового члена. Иногда отмечаются макрогематурия, обусловленная венозным стазом вследствие сдавления опухолью вен шейки мочевого пузыря, и гемоспермия.
При росте опухоли в сторону прямой кишки возможно сужение ее просвета с нарушением акта дефекации, выражающимся в запорах и тенезмах.
При наличии костных метастазов могут появляться упорные и интенсивные боли - часто первый и единственный признак заболевания. Опухоль может метастазировать в легкие, печень, надпочечники. Метастазы рака предстательной железы могут возникать очень рано.
Диагностика. Диагностические мероприятия при подозрении на рак предстательной железы можно разделить на два этапа: на первом выявляют наличие рака, на втором устанавливают стадию заболевания и определяют тактику лечения.
Основные методы диагностики рака предстательной железы - пальцевое исследование предстательной железы, определение уровня ПСА, трансабдоминальное или трансректальное УЗИ и биопсия предстательной железы. Для выявления метастазов опухоли и определения стадии
заболевания проводят сцинтиграфию костей, рентгеновскую КТ, МРТ и некоторые другие исследования.
На этапе скрининга проводят УЗИ предстательной железы, пальцевое исследование предстательной железы через прямую кишку и определяют уровень ПСА. Эти процедуры должны выполняться у всех мужчин старше 45 лет, поскольку только так можно диагностировать ранние формы рака предстательной железы.
Пальцевое исследование предстательной железы через прямую кишку в течение многих десятилетий было основным в диагностике рака предстательной железы и не потеряло своего значения и в наши дни. Его преимущества - доступность и легкость выполнения. Каждый врач должен уметь оценить состояние предстательной железы при пальпации через прямую кишку и обнаружить проявления рака. Характерный признак злокачественной опухоли - пальпация отдельных или множественных плотных узлов в одной или обеих долях предстательной железы. Железа при этом бугристая и может быть чрезвычайно плотной, «каменистой». При пальцевом исследовании в редких случаях удается выявить прорастание опухоли в семенные пузырьки.
Важным диагностическим признаком при пальцевом исследовании служит несмещаемость стенки прямой кишки относительно предстательной железы, что свидетельствует об экстракапсулярной инвазии опухоли. Перечисленные признаки характерны для рака предстательной железы на стадиях Т3-4. Выявить опухоль на стадии Т1 этим методом практически невозможно. Иногда удается заподозрить рак на стадии Т2.
Таким образом, при пальцевом исследовании предстательной железы достаточно трудно обнаружить ранние стадии опухоли, что существенно снижает диагностическую ценность этого метода.
Простатический специфический антиген - маркер рака предстательной железы, обладающий большой чувствительностью и высокой специфичностью, представляет собой гликопротеин, продуцируемый только эпителиальными клетками предстательной железы. Содержание ПСА в плазме крови незначительно повышается с возрастом, а также у больных с увеличенной вследствие гиперплазии предстательной железой. Однако это повышение относительно несущественно по сравнению с возрастанием содержания ПСА при раке предстательной железы, поэтому данный показатель рассматривают как маркер рака предстательной железы. Можно рекомендовать периодическое определение уровня ПСА у всех мужчин старше 45 лет.
В норме содержание ПСА в плазме крови не превышает 4,0 нг/мл. Значения свыше 4,0 нг/мл рассматривают как подозрительные на
наличие рака предстательной железы, а выше 10 нг/мл - как диагностически значимые. Поскольку содержание ПСА в крови повышается также и после полового акта, массажа предстательной железы, любых манипуляций на нижних мочевых путях (например, уретроцисто-скопии, катетеризации мочевого пузыря), при острой задержке мочеиспускания, то для исключения ложноположительных результатов необходимо определять уровень ПСА спустя минимум пять дней после них. Повышению этого показателя могут способствовать простатит и ДГПЖ, при которых уровень ПСА обычно составляет от 4 до 10 нг/мл («серая зона»). Однако следует помнить, что у большинства пациентов с локализованными формами рака предстательной железы уровень ПСА варьирует в пределах этой «серой зоны». Достаточно часто у одного больного выявляют сочетание рака предстательной железы с ее доброкачественной гиперплазией, когда уровень ПСА также повышен. Необходимо учитывать, что некоторые препараты, длительно принимаемые больными, в частности, ингибиторы 5а-редуктазы и антиандрогены, могут способствовать снижению уровня ПСА и затруднить раннюю диагностику рака предстательной железы.
Для повышения диагностической ценности ПСА предложено несколько дополнительных методик его оценки. К ним относятся определение соотношения свободного и общего ПСА, а также расчет плотности ПСА и скорости прироста его уровня. Известно, что в крови ПСА находится в виде свободной и связанной с антихимотрипсином и а2-макроглобулином фракций. Снижение уровня свободного ПСА и соответственно, соотношения свободного и общего ПСА до значения <15 % характерно для рака предстательной железы.
Поскольку содержание ПСА зависит от размера предстательной железы, для повышения специфичности теста определяют его плотность, т. е. соотношение содержания общего ПСА к объему предстательной железы. Верхняя граница нормы данного показателя находится в пределах 0,11-0,15 нг/мл на см3. Превышение этого соотношения характерно для рака предстательной железы, на наличие которого также указывает скорость прироста содержания ПСА в плазме крови на 0,75 нг/мл в год и более.
Уровень простатической кислой фосфатазы значительно повышается при экстракапсулярном распространении опухолевого процесса и особенно при наличии костных метастазов.
Ультразвуковое исследование предстательной железы может быть выполнено трансабдоминальным или трансректальным (более предпочтительным) способом. При раке предстательной железы обнару-
живаются разной величины гипоэхогенные образования с нечеткими контурами, чаще всего локализованные в периферической зоне железы. Преимущества УЗИ - неинвазивность, возможность определения размеров опухоли и характера ее роста. Однако специфичность и чувствительность этого исследования в отношении выявления экстракапсуляр-ной инвазии и инвазии в семенные пузырьки не намного превышает результаты пальцевого исследования предстательной железы.
Выявление подозрительных на рак признаков при пальцевом исследовании предстательной железы или УЗИ, а также повышение уровня ПСА служат показаниями к биопсии предстательной железы. Согласно рекомендациям Европейской ассоциации урологов, показаниями к выполнению биопсии предстательной железы являются: повышение уровня ПСА от 4,0 до 10 нг/мл в случае ежегодного прироста уровня общего ПСА на 0,75 нг/мл и более; увеличение содержания ПСА выше 10 нг/мл; соотношение общего и свободного ПСА <15 %; отношение общего ПСА к объему предстательной железы >0,15 нг/мл на см3.
Общепринятый стандарт - выполнение трансректальной пункци-онной биопсии под ультразвуковым контролем. Необходимо забрать материал из нескольких (6-12) участков органа, т. е. выполнить муль-тифокальную биопсию. Если по каким-либо причинам трансректальная биопсия осложнена, возможна трансперинеальная биопсия под ультразвуковым наведением. Последующий морфологический анализ полученных при биопсии участков ткани предстательной железы позволяет обнаружить наличие в биопсийных столбиках раковых клеток, определить гистологическую форму рака, а также оценить степень злокачественности новообразования по Глисону (см. табл. 11.2). При подсчете показателя Глисона суммируются два показателя степени злокачественности - преобладающий и второй по частоте в данном биопсийном материале.
После морфологического подтверждения наличия рака предстательной железы необходимо установить стадию болезни.
Для определения местного распространения опухоли, выявления прорастания в соседние органы и ткани необходима рентгеновская компьютерная томография малого таза, позволяющая выявить большие опухолевые поражения предстательной железы и лимфатических узлов, а также оценить местное распространение опухоли в соседние ткани. Однако КТ далеко не всегда выявляет экстракапсулярную инвазию новообразования предстательной железы, прорастание его в семенные пузырьки.
Магнитно-резонансная томография - высокочувствительный метод определения местного и метастатического опухолевого распростране-
ния. При помощи МРТ можно с большой точностью выявить мелкие костные метастазы. Однако из-за высокой стоимости данный метод не стал рутинным в диагностике метастатических поражений костей.
Отдаленные метастазы при раке предстательной железы наиболее часто локализуются в телах позвонков, костях таза, крестце, бедренных костях, ребрах, черепе. Для выявления метастазов также используют обзорную рентгенографию и сцинтиграфию костей. На обзорной рентгенограмме при наличии метастазов рака предстательной железы выявляются образующие характерную картину, обозначаемую как «мраморные» кости, участки костной ткани. Они различаются по плотности вследствие того, что костные метастазы рака предстательной железы являются как остеокластными, так и остеобластными. Сцинтиграфия на сегодня наиболее точный метод выявления метастазов рака предстательной железы в кости.
Дополнительные методы обследования используют для поиска отдаленных метастазов других локализаций. Для обнаружения метастазов в легкие выполняют обзорную рентгенографию легких, в печень - УЗИ и сцинтиграфию печени, в мозг - МРТ.
Дифференциальная диагностика проводится в первую очередь с ДГПЖ, хроническим простатитом и склерозом предстательной железы, а также туберкулезом предстательной железы.
Лечение. При лечении рака предстательной железы применяют хирургический метод, гормоно-, радио- и химиотерапию. В некоторых случаях используют комбинированное лечение.
Хирургическое лечение проводят только на ранних стадиях рака предстательной железы - T1-2, N0, M0, у больных без тяжелых сопутствующих заболеваний с ожидаемой продолжительностью жизни не менее 10 лет. Операция выбора - радикальная простатэктомия, которая может выполняться с использованием позадилонного и промеж-ностного доступов. В последние годы предпочтение отдается радикальной лапароскопической простатэктомии. Кроме того, внедряется методика роботизированной радикальной простатэктомии, которая в будущем сможет стать основным хирургическим методом лечения больных, страдающих раком предстательной железы. Вне зависимости от выбранного способа хирургического вмешательства во всех случаях производят удаление (единым блоком) предстательной железы с капсулой, семенными пузырьками, простатической частью мочеиспускательного канала, шейкой мочевого пузыря, проксимальной частью семявыносящего протока, окружающей клетчаткой и тазовыми лимфатическими узлами. Недостаток промежностного доступа - необхо-
димость в отдельном разрезе для иссечения тазовых лимфатических узлов. При таком доступе лимфаденэктомию можно не проводить у больных с уровнем ПСА меньше 10 нг/мл и низкой суммой баллов по шкале Глисона.
При выборе оперативного метода лечения рака предстательной железы необходимо учитывать возможные осложнения радикальной простатэктомии. К ним относят недержание мочи, стриктуру анастомоза уретры, импотенцию, эректильную дисфункцию, а также интра-операционные осложнения общей анестезии.
Ведущими прогностическими факторами, определяющими исходы радикальной простатэктомии, служат стадия рака предстательной железы и степень злокачественности новообразования. Результаты вмешательства и прогноз хуже при наличии периневральной инвазии и прорастании опухолью капсулы предстательной железы и/или семенных пузырьков, при обнаружении «позитивного хирургического края» (т. е. содержащего раковые клетки) по результатам послеоперационного гистопатоморфологического исследования). Выявление «позитивного хирургического края» свидетельствует о неполном удалении злокачественного новообразования, что предрекает возникновение местного рецидива и повышает риск отдаленного метастазирования. Данный фактор имеет самостоятельную прогностическую значимость и существенно ухудшает отдаленные результаты хирургической операции. Местному рецидиву всегда предшествует так называемый биохимический рецидив - послеоперационный уровень ПСА в плазме крови превышает 0,2 нг/мл. Требуется тщательный мониторинг этого показателя для своевременного назначения курса адъювантной (послеоперационной) гормоноили лучевой терапии.
К паллиативным оперативным вмешательствам при раке предстательной железы, осложненном инфравезикальной обструкцией, относят трансуретральную электрорезекцию (туннелизацию) предстательной железы.
Радиотерапия. Используют дистанционную и контактную интер-стициальную (брахитерапия) радиотерапию. При контактной лучевой терапии радиоактивный препарат подводят непосредственно к опухоли.
Дистанционная радиотерапия служит альтернативой радикальной простатэктомии и проводится больным раком предстательной железы на стадиях Т1, Т2 и Т3 при отсутствии у них отдаленных метастазов.
К осложнениям дистанционной радиотерапии относят острый цистит, острый проктит и, реже, острый энтерит. Достаточно часто они принимают хроническое течение. В настоящее время активно иссле-
дуют возможность применения новых форм дистанционной радиотерапии. Установлена эффективность в предотвращении локальных рецидивов опухоли смешанной нейтронно-фотонной и протонной радиотерапии.
Интерстициальную брахитерапию применяют главным образом на стадиях рака предстательной железы Т1 и Т2. Однако эффективность и отдаленные результаты ее применения требуют дополнительного изучения. Особенность брахитерапии - возможность подведения к опухоли очень высоких доз излучения (120-160 Гр), что невыполнимо при дистанционной лучевой терапии.
Гормональная терапия. Поскольку рак предстательной железы является андрогензависимой опухолью, гормональные методы играют важную роль в его лечении. Гормональная терапия включает назначение эстрогенов, антиандрогенов, агонистов и антагонистов лютеинизирую-щего рилизинг-гормона гипофиза. К гормональным методам лечения относится также билатеральная орхиэктомия (энуклеация яичек).
Применение гормонального лечения может вызвать выраженные побочные эффекты, особенности которых зависят от вида терапии. Билатеральная орхиэктомия приводит к утрате либидо, импотенции и остеопорозу. Эстрогенотерапия вызывает потерю либидо, импотенцию и гинекомастию. Кроме того, эстрогены способствуют развитию инфаркта миокарда, нарушения мозгового кровообращения, эмболии легочной артерии, в связи с чем в настоящее время применяются относительно редко. Агонисты лютеинизирующего рилизинг-гормо-на, такие как лейпролид, госерелин (золадекс) и бусерелин, снижают уровень тестостерона в крови, но также вызывают потерю либидо и импотенцию. Антиандрогены (флутамид, флюцином, анандрон, андро-кур) вызывают, кроме того, диарею, тошноту и оказывают выраженное гепатотоксическое действие.
Длительное применение агонистов лютеинизирующего рилизинг-гормона и антиандрогенных препаратов в конечном итоге приводит к возникновению андрогенрефрактерных форм рака предстательной железы. Объяснение этого феномена может быть в том, что совокупность раковых клеток представляет собой гетерогенную смесь андрогензависи-мых и мутировавших андрогенрефрактерных клеток. Антиандрогенная терапия приводит к селективному угнетению роста андрогензависимой популяции клеток, способствуя экспансии андрогенрефрактерных клеток. При этом эффективность терапии резко снижается.
Химиотерапия в настоящее время является вспомогательным методом лечения больных раком предстательной железы из-за низкой
чувствительности опухоли к химиопрепаратам. Однако применение последних может быть эффективным при гормонорефрактерных формах рака предстательной железы.
Выбор метода лечения обусловлен стадией опухолевого процесса, степенью дифференцировки опухолевых клеток, а также возрастом пациента и наличием у него сопутствующих заболеваний.
В последние годы все реже прибегают к неоадъювантной (предоперационной) гормональной терапии, когда назначают комбинацию агонистов лютеинизирующего рилизинг-гормона и антиандрогена. Данная терапия стимулирует формирование рубцовой соединительной ткани в предстательной железе и парапростатической клетчатке, что повышает риск интраоперационной кровопотери и снижает вероятность радикальности хирургической операции.
Значительно реже в качестве самостоятельного метода лечения локализованных форм рака предстательной железы используют дистанционную, или интерстициальную, радиотерапию. Для больных с опухолями в стадии Т2b в таких случаях эффективно назначение адъювантной гормональной терапии, например агонистов лютеинизи-рующего рилизинг-гормона.
При местнораспространенном раке предстательной железы (Т3-4) радикальную простатэктомию не выполняют из-за ее низкой эффективности. Основными методами лечения таких больных служат дистанционная радио- и гормональная терапия.
Наличие метастазов в регионарные лимфатические узлы или отдаленных метастазов свидетельствует о распространенном раке предстательной железы. Основной метод лечения таких пациентов - гормональная терапия. Прогноз неблагоприятный, но часто достигается значительное объективное и субъективное улучшение. Если при использовании одного из видов гормональной терапии не удалось остановить про-грессирование опухоли, то, скорее всего, будут неэффективны и другие виды гормональной терапии. В таких случаях опухоль определяют как гормонрефрактерную.
Паллиативную радиотерапию используют в основном для уменьшения болей в костях при их метастатическом поражении. Применяют дистанционную радиотерапию костных метастазов, радионуклидную (89Sr) терапию при остеобластических метастазах и комбинацию этих методов.
Паллиативную ТУР (туннелизацию) выполняют для восстановления оттока мочи из мочевого пузыря.
Системная химиотерапия применяется в случаях андроген-рефрак-терного метастатического рака предстательной железы. Относительно
эффективности химиотерапии у этих больных данные расходятся. Одни авторы указывают на отсутствие улучшения выживаемости при ее применении, другие - на эффективность монотерапии винбласти-ном, комбинациями винбластина и эстрамустина фосфата, эпируби-цина и цисплатина.
Отдельно стоит выделить группу больных с рецидивным раком предстательной железы. Выбор тактики их лечения зависит от характера и интенсивности предыдущего лечения, локализации рецидива и наличия сопутствующих заболеваний.
У больных раком предстательной железы с рецидивами после гормональной терапии прогноз крайне неблагоприятный, однако даже в этой группе наблюдается некоторая гетерогенность общей выживаемости. Так, у больных с метастатическим поражением костей наихудший прогноз отмечается при повышении уровней щелочной фосфатазы и креатинина, а также коротком (менее года) периоде после окончания гормональной терапии. Уровень ПСА, определяемый в начале терапии по поводу рецидивного или гормонорефрактерного рака предстательной железы, не имеет существенного прогностического значения.
Контрольные вопросы
1. Как классифицируют опухоли почек?
2. Какие ренальные и экстраренальные симптомы рака почки вы можете перечислить?
3. С какими заболеваниями следует проводить дифференциальную диагностику опухолей почки?
4. Какие лечебные мероприятия следует выполнять при опухолях почечной паренхимы?
5. В чем заключаются особенности лечения опухолей почечной лоханки и мочеточника?
6. Какие этиологические факторы возникновения рака мочевого пузыря вам известны?
7. Как классифицируют опухоли мочевого пузыря?
8. Каковы симптоматология и диагностика опухолей мочевого пузыря?
9. Какие существуют методы лечения опухолей мочевого пузыря?
10. Каковы причины возникновения доброкачественной гиперплазии предстательной железы?
11. Какие симптомы доброкачественной гиперплазии предстательной железы вам известны?
12. Какие осложнения могут быть обусловлены доброкачественной гиперплазией предстательной железы?
13. В каких случаях показано медикаментозное лечение доброкачественной гиперплазии предстательной железы?
14. Когда прибегают к оперативному лечению доброкачественной гиперплазии предстательной железы?
15. Как классифицируют рак предстательной железы?
16. Каковы симптоматика и клиническое течение рака предстательной железы?
17. В чем заключается роль мультифокальной биопсии при диагностике рака предстательной железы?
18. Какие существуют показания и противопоказания к радикальной простатэктомии при раке предстательной железы?
19. В чем заключается медикаментозное лечение больных раком предстательной железы?