Внутренние болезни: учебник: в 2 т. / под ред. В.С. Моисеева, А.И. Мартынова, Н.А. Мухина. - 3-е изд., испр. и доп. - 2013. - Т.2. - 896 с.: ил.
|
|
|
|
ЧАСТЬ VIII. НАРУШЕНИЯ МЕТАБОЛИЗМА
Глава 63. САХАРНЫЙ ДИАБЕТ
Сахарный диабет (СД) - группа метаболических (обменных) заболеваний, характеризуемых гипергликемией, возникающей в результате дефектов секреции инсулина, эффектов инсулина или одновременного воздействия этих факторов.
ЭПИДЕМИОЛОГИЯ
Медико-социальная значимость СД обусловлена:
• его высокой распространенностью;
• сохраняющейся тенденцией к росту заболеваемости;
• хроническим течением;
• высокой инвалидизацией и смертностью больных в результате развития поздних сосудистых осложнений;
• необходимостью создания системы специализированной помощи больным.
По данным Государственного регистра больных СД, на 2008 г. в России зарегистрировано более 2,8 млн больных СД, большинство из которых (85-90%) страдают СД 2-го типа. Учитывая выраженную клиническую симптоматику и острое начало, фактическая и регистрируемая распространенность СД 1-го типа совпадают. Напротив, распространенность СД 2-го типа, регистрируемая по статистике обращений, не отражает реальной ситуации, так как фактическое число больных в 3-4 раза превышает официальные цифры. В мире в настоящее время насчитывают 285 млн больных СД. Международная федерация диабета (IDF) прогнозирует увеличение количества больных СД в 2025 г. до 380 млн человек.
КЛАССИФИКАЦИЯ
В соответствии с классификацией Всемирной организации здравоохранения (ВОЗ) (1999), выделяют следующие клинические категории.
• Сахарный диабет 1-го типа (аутоиммунный, идиопатический) - деструкция β-клеток, обычно приводящая к абсолютной инсулиновой недостаточности.
• Сахарный диабет 2-го типа (с преимущественной инсулинорезистентностью и относительной инсулиновой недостаточностью или преимущественным дефектом секреции инсулина с инсулинорезистентностью или без нее).
• Гестационный сахарный диабет (возникает во время беременности).
• Другие типы сахарного диабета:
- генетические нарушения функций β-клеток;
- генетические нарушения действия инсулина;
- болезни экзокринной части поджелудочной железы (панкреатит, травма/панкреатэктомия, опухоли, гемохроматоз, фиброкалькулезная панкреатопатия и др.);
- заболевания эндокринной системы (акромегалия, синдром Кушинга, глюкагонома, феохромоцитома, гипертиреоз, соматостатинома, альдостерома и др.);
- диабет, индуцированный приемом лекарственных средств или химических веществ (пентамидина, никотиновой кислоты, глюкокортикоидов, тиреоидных гормонов, агонистов β-адренорецепторов, тиазидных диуретиков, интерферона-α и др.).
- диабет, индуцированный инфекциями (врожденная краснуха, цитомегаловирусная инфекция и др.);
- необычные формы иммуноопосредованного диабета (синдром мышечной скованности, антиинсулиновые антитела к рецепторам);
- другие генетические синдромы, иногда ассоциированные с диабетом.
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
В развитии диабета участвуют несколько патогенетических механизмов - от аутоиммунной деструкции β-клеток поджелудочной железы с развитием абсолютного дефицита инсулина до нарушений, вызывающих развитие резистентности рецепторов периферических тканей-мишеней к действию инсулина (инсулинорезистентности). Недостаточность дей-
ствия инсулина вследствие неадекватной секреции и/или сниженного ответа на инсулин в тканях составляет основу нарушений метаболизма углеводов, жиров и белков. У одного и того же пациента нарушения секреции и действия инсулина могут сосуществовать, и неясно, какой дефект первичен.
Согласно современным представлениям, СД 1-го типа - аутоиммунное заболевание, в котором изменения гуморального и клеточного иммунитетов играют определяющую роль. Иммунокомпетентными клетками инфильтрируются островки Лангерганса, развиваются инсулит и деструкция β-клеток с абсолютной инсулиновой недостаточностью. СД 1-го типа, несмотря на острое классическое начало заболевания, характеризуется длительным скрытым периодом. Выделяют следующие стадии этого процесса:
• генетическую предрасположенность (антигены главного комплекса гистосовместимости HLA, особенно II класса);
• гипотетический триггерный фактор (вирусная инфекция, стресс, характер питания, химические факторы);
• иммунные нарушения при сохранении нормальной секреции инсулина [с определением иммунологических маркеров СД 1-го типа - аутоантител к антигенам β-клеток, инсулину, декарбоксилазе глутамовой кислоты, тирозинфосфатазам (IA2α и IA-2 β)] ;
• выраженные иммунные нарушения с прогрессирующим снижением секреции инсулина вследствие развивающегося инсулита при нормальном уровне гликемии;
• клиническую манифестацию, развивающуюся после гибели 8090% массы β-клеток;
• полную деструкцию β-клеток.
Для некоторых форм СД 1-го типа этиологические факторы не установлены. У таких пациентов, в основном африканского и азиатского происхождения, не определяются маркеры аутоиммунного поражения β-клеток. Заболевание проявляется повторными эпизодами кетоацидоза с выявлением дефицита инсулина различной степени выраженности между эпизодами. Эта форма диабета наследственная, не ассоциированная с системой HLA.
В основе СД 2-го типа лежат резистентность к инсулину и его недостаточность, чаще относительная, чем абсолютная. Первоначально инсулинорезистентность связывали с дефектом инсулиновых рецепторов, образованием антител к инсулину. Однако главной причиной ее оказа-
лись нарушения пострецепторных внутриклеточных процессов. Большинству больных СД 2-го типа свойственна избыточная масса тела, или ожирение, - основная причина развития инсулинорезистентности. Инсулинорезистентность может развиваться у лиц с нормальной массой тела, но избыточным абдоминальным отложением жира. Установлено значение гормонов и цитокинов, производимых жировыми клетками, в развитии инсулинорезистентности. Лептин действует на гипоталамус, ускоряя метаболизм глюкозы. Содержание адипонектина в крови обратно связано со степенью ожирения и резистентности к инсулину. Фактор некроза опухоли-а угнетает метаболизм глюкозы. Глюкотоксичность и липотоксичность привлекают к себе все большее внимание в качестве патогенетических факторов СД 2-го типа.
СКРИНИНГ
Скрининг для выявления СД следует проводить у всех людей 45 лет и старше, особенно при ИМТ не менее 25 кг/м2. Если СД не выявлен, обследование повторяют один раз в 3 года. Обследование для выявления СД следует проводить чаще или в более молодом возрасте у людей с избыточной массой тела и дополнительными факторами риска, к которым относят:
• низкую физическую активность;
• СД у родственников первой линии родства;
• принадлежность к этнической группе высокого риска;
• наличие у женщин в анамнезе гестационного диабета или родов ребенка массой тела более 4,1 кг;
• АГ;
• уровни ХС ЛПВП менее 0,9 ммоль/л (35 мг/дл) и/или триглицеридов более 2,82 ммоль/л (250 мг/дл);
• поликистоз яичников;
• нарушенную гликемию натощак или нарушенную толерантность к глюкозе при предыдущем исследовании;
• анамнез сердечно-сосудистых заболеваний.
Скрининг на диабет/нарушения углеводного обмена возможен по определению гликемии натощак и/или данным перорального глюкозотолерантного теста (ОГТТ). Наиболее эффективно использование неинвазивной шкалы риска в сочетании с диагностическим ОГТТ у пациентов с высоким риском развития СД. Пациентам с диагностированным сердечно-сосудистым заболеванием при отсутствии СД следует выполнять ОГТТ.
КЛИНИЧЕСКАЯ КАРТИНА
Жалобы
Основные клинические симптомы хронической гипергликемии и дефицита инсулина:
• полиурия (в том числе в ночное время);
• жажда;
• полидипсия;
• сухость во рту;
• снижение массы тела;
• слабость и утомляемость.
Кроме того, больные СД могут предъявлять жалобы на снижение остроты зрения, либидо и потенции, кожный зуд, повышенную подверженность инфекциям.
Клинические проявления и особенности течения СД зависят от его типа. Для СД 1-го типа, как правило, характерны острое начало заболевания и быстрое развитие выраженных метаболических нарушений. СД 1-го типа нередко впервые проявляется тяжелым ацидозом или диабетической комой.
СД 2-го типа характеризуется длительной доклинической бессимптомной стадией, и к моменту установления диагноза более чем у половины пациентов уже есть осложнения. У больных СД 2-го типа наряду с признаками нарушения углеводного обмена нередко отмечают ожирение или избыточную массу тела, АГ, ИБС. Причиной первого обращения к врачу могут стать проявления микро- и макроангиопатии. СД 2-го типа может быть впервые выявлен у больных с инфарктом миокарда или инсультом. Иногда первое проявление СД 2-го типа - гиперосмолярная кома. Спонтанное развитие диабетического кетоацидоза встречается редко, как правило, вследствие тяжелого интеркуррентного заболевания.
Объективное обследование
Питание при СД может быть нормальным, пониженным или повышенным. При декомпенсации кожа, губы и язык сухие, тургор подкожной жировой клетчатки снижен. При СД 1-го типа выявляется диабетический рубеоз (гиперемия щек, подбородка, лба) вследствие расширения капилляров кожи. Ксантоматоз как следствие гиперлипидемии наблюдают у больных СД 2-го типа. Возможно появление витилиго, пигментации на голенях (диабетической дермопатии, или «пигментной голени»), липоидного некробиоза кожи. При длительном и плохо компенсиро-
ванном СД выявляют трофические язвы стоп и голеней как следствие тяжелой ангиопатии и нейропатии.
Частый признак СД - кожные инфекции: фурункулез, остиофолликулит, панариции, паронихии, грибковые поражения слизистых оболочек и ногтей.
Первыми признаками СД могут быть гингивиты, альвеолярная пиорея, пародонтоз, прогрессирующий кариес.
ДИАГНОСТИКА
Сахарный диабет диагностируют при наличии любого из перечисленных критериев.
• Симптомы диабета и «случайный» уровень глюкозы в плазме крови не менее 11,1 ммоль/л (200 мг/дл). Случайное определено как любое время суток без учета времени, прошедшего после последнего приема пищи. Классические симптомы диабета включают полиурию, полидипсию и необъяснимую потерю массы тела.
• Глюкоза в плазме крови натощак - не менее 7,0 ммоль/л (126 мг/ дл). Натощак определено как отсутствие потребления калорий в течение, по крайней мере, 8 ч.
• Двухчасовая глюкоза в плазме - не менее 11,1 ммоль/л (200 мг/дл) при ОГТТ, выполненном согласно рекомендациям ВОЗ.
Диагноз СД должен быть подтвержден повторным определением гликемии в другие дни, за исключением случаев несомненной гипергликемии с выраженной декомпенсацией углеводного обмена или симптомами. ОГТТ проводят в случаях сомнительных значений гликемии для уточнения диагноза. Гликемия определяется до и через 2 ч после пероральной нагрузки глюкозой. Нагрузка глюкозой составляет для взрослых 75 г глюкозы, растворенной в 300 мл воды, для детей - 1,75 г глюкозы на 1 кг массы тела (но ≤75 г), выпитой в течение 3-5 мин.
Учитывая, что критерии нарушений углеводного обмена основываются на определении глюкозы в плазме, при выявлении гликемии другими методами следует пользоваться формулами пересчета:

Оценка уровня гликемии натощак и/или через 2 ч после ОГТТ позволяет диагностировать различные нарушения углеводного обмена: нарушенную толерантность к глюкозе и нарушенную гликемию натощак, рассматриваемые как предиабет или категории повышенного риска развития СД; сахарный диабет (табл. 63-1).
Таблица 63-1. Диагностические критерии нарушений углеводного обмена (ВОЗ, 1999)
Американская диабетологическая ассоциация, основываясь на результатах крупных эпидемиологических исследований, представленных Международным комитетом экспертов в 2009 г., предлагает использовать показатель гликозилированного гемоглобина (HbA1c) не менее 6,5% для диагностики СД. Значения HbA1c 5,7-6,4% предлагается включить в категории повышенного риска диабета (ранее - предиабет) наряду с нарушенной толерантностью к глюкозе и нарушенной гликемией натощак. HbA1c - биохимический показатель крови, отражающий среднее
содержание глюкозы в плазме крови за длительный период - до 3 мес (в отличие от измерения глюкозы в крови, которое дает представление об уровне гликемии только на момент исследования). Определение HbA1c для целей диагностики СД и предиабета следует проводить только в лабораториях с использованием соответствующих стандартизированных методов.
Наряду с гипергликемией лабораторными симптомами СД считают глюкозурию, редко - кетоновые тела в моче в небольших концентрациях. Глюкоза полностью реабсорбируется в канальцах почек при ее концентрации в плазме крови до 10 ммоль/л, при превышении этого порога глюкоза выводится с мочой.
Дифференциальная диагностика
Поскольку диагноз СД устанавливают по уровню гликемии, дифференциальную диагностику проводят между различными типами диабета (табл. 63-2). У части пациентов сложно четко определить тип СД. СД 2-го типа может дебютировать кетоацидозом, а СД 1-го типа может начинаться поздно, прогрессировать медленно, несмотря на аутоиммунную природу заболевания.
Таблица 63-2. Дифференциально-диагностические признаки сахарного диабета 1-го и 2-го типа
Структура диагноза
• Сахарный диабет, указать тип (1-й, 2-й):
- течение (легкое, средней тяжести, тяжелое);
- фаза (компенсация, субкомпенсация, декомпенсация).
• Диабетические микроангиопатии:
- ретинопатия [указать стадию на левом глазу (OS), на правом глазу (OD)];
- состояние после лазерной фотокоагуляции или оперативного лечения (в каком году);
- нефропатия (указать стадию);
- диабетическая нейропатия (указать форму);
- синдром диабетической стопы (указать форму).
• Диабетические макроангиопатии:
- ИБС (указать форму);
- сердечная недостаточность (указать функциональный класс по NYHA);
- цереброваскулярные заболевания (указать какие);
- периферическая ангиопатия (указать тип и стадию).
• Артериальная гипертензия.
• Дислипидемия (если есть).
• Сопутствующие заболевания.
Определение степени тяжести сахарного диабета
СД 2-го типа на диетотерапии без микро- и макрососудистых осложнений расценивают как СД легкой формы.
Течение средней степени тяжести устанавливают при СД 1-го и 2-го типа на сахароснижающей терапии без осложнений или при наличии начальных стадий осложнений: непролиферативной стадии диабетической ретинопатии, стадии микроальбуминурии, диабетической нефропатии, диабетической полинейропатии.
Тяжелую форму диагностируют при лабильном течении СД с частыми гипогликемиями и/или кетоацидотическими состояниями, а также при СД 1-го и 2-го типа с тяжелыми сосудистыми осложнениями: препролиферативной или пролиферативной стадиями диабетической ретинопатии, стадиями протеинурии или хронической почечной недостаточности диабетической нефропатии, синдромом диабетической стопы, автономной полинейропатией, постинфарктным кардиосклерозом, сердечной недостаточностью, перенесенным инсультом или транзиторной ишемической атакой, окклюзионным поражением нижних конечностей.
ЛЕЧЕНИЕ
Основные цели лечения больных СД: устранение симптомов заболевания, профилактика острых и хронических осложнений, снижение смертности и улучшение качества жизни. Целей лечения достигают модификацией образа жизни с помощью организации рационального питания и расширения объема физических нагрузок, сахароснижающей фармакотерапией, обучением больных и самоконтролем гликемии, ранним лечением осложнений и сопутствующих заболеваний.
Показания к госпитализации
Показаниями к госпитализации считают острые осложнения СД (тяжелый кетоацидоз или кому), прогрессирование сосудистых осложнений. Пациентов с СД 1-го типа госпитализируют в дебюте заболевания для подбора инсулинотерапии и обучения больного самоконтролю гликемии и принципам рационального питания, при ургентных состояниях (инфекциях, интоксикациях, оперативных вмешательствах). Больных СД 2-го типа также госпитализируются при выраженной декомпенсации углеводного обмена, требующей перевода на инсулинотерапию.
Обучение больных
Результаты лечения диабета в значительной степени зависят от поведения больного, выполнения им сложных контрольных и лечебных мероприятий, умения принимать решения медицинского характера (планирования приема пищи вне дома, определения количества вводимого инсулина, купирования гипогликемии и т.д.). Для освоения таких навыков и умений, способствующих достижению конкретных терапевтических целей, необходимо обучение больных. Обучающие мероприятия следует проводить силами медицинского персонала, подготовленного
в области принципов обучения больных и стратегий изменения образа их жизни (диабетологом/эндокринологом, медицинской сестрой, медицинским психологом). Терапевтическое обучение больных осуществляют от момента выявления заболевания и на всем его протяжении. Цели и задачи обучения должны быть конкретизированы в соответствии с состоянием пациента. Обучение можно проводить как в индивидуальном порядке, так и в группах больных. Для группового обучения используют специально разрабатываемые структурированные программы, адресованные конкретному контингенту больных (больным СД 1-го типа; больным СД 2-го типа на диете и пероральных препаратах; больным СД 2-го типа, получающим инсулин; детям и подросткам, больным СД, и их родственникам; беременным, больным СД). Индивидуальное обучение можно проводить с любым пациентом, желательно с детьми и беременными с СД.
Самоконтроль гликемии
Самоконтроль гликемии рассматривается как важная часть эффективного лечения СД, которая позволяет больному оценивать изменения гликемии в реальном времени. Врач использует результаты самоконтроля для оценки эффективности и безопасности терапии. Рекомендуя пациенту метод самоконтроля уровня глюкозы в крови, врач должен убедиться в том, что пациент правильно понял инструкции по проведению исследования, сможет самостоятельно его выполнять и в соответствии с полученными результатами корректировать факторы образа жизни и медикаментозное лечение. Пациентам, лечение которых осуществляется путем множественных инъекций инсулина, рекомендуют не менее чем 3-кратный ежедневный самоконтроль уровня глюкозы. Для других категорий пациентов частота самоконтроля определяется индивидуальными потребностями. Постоянное мониторирование уровня глюкозы в сочетании с интенсивной инсулинотерапией может быть средством снижения HbA1c у определенной категории пациентов - больных СД 1-го типа в возрасте не менее 25 лет. В наибольшей степени самоконтроль гликемии показан пациентам с недавно выявленным СД, склонным к частым гипогликемиям, а также лицам, мотивированным на достижение жесткого контроля уровня гликемии.
Немедикаментозное лечение
Рациональное питание. Соблюдение диеты считают необходимой составной частью лечения больного СД вне зависимости от варианта сахароснижающей терапии, направленной на нормализацию массы тела и
поддержание нормального уровня гликемии. Основные принципы рационального питания при СД 1-го типа:
• определение калорийности питания;
• исключение рафинированных углеводов;
• соблюдение регулярного приема пищи.
Суточную калорийность покрывают за счет углеводов на 55-60%, белков - на 15-20%, жиров - на 20-25%. Из повседневного рациона исключают продукты, содержащие легкоусвояемые углеводы (сахар, мед, кондитерские изделия, варенье, сладкие напитки). Потребление насыщенных жиров ограничивают до 10%; замещают насыщенные жиры моно- и полиненасыщенными в соотношении 1:1:1. Пациентам с СД 1-го типа необходимо документировать потребление (считать хлебные единицы - ХЕ) зерновых, жидких молочных продуктов, некоторых сортов овощей (картофеля, кукурузы), фруктов и ягод. Доступны таблицы содержания ХЕ в различных продуктах и ориентировочной суточной потребности в ХЕ в зависимости от массы тела и уровня физической активности пациента. Для усвоения 1 ХЕ (12 г глюкозы) требуется 1-2 ЕД инсулина.
Питание больного СД 2-го типа должно соответствовать современным рекомендациям по здоровому питанию. При избыточной массе тела необходимо добиваться ее снижения путем ограничения энергетической ценности рациона. Рекомендуют:
• существенное ограничение высокоэнергетических продуктов, богатых жирами, алкоголя, сахара и сладостей;
• употребление в меньшем количестве продуктов средней энергетической ценности, состоящих из белка и крахмала;
• употребление без ограничений низкоэнергетических продуктов (овощей, зелени, низкокалорийных напитков).
Физические нагрузки. Физическая нагрузка снижает уровень глюкозы в плазме крови и повышает чувствительность тканей к инсулину. У больных СД 2-го типа аэробная нагрузка и упражнения с сопротивлением сопровождаются снижением HbA1c на 0,66% независимо от изменения массы тела.
Режим физических нагрузок должен быть индивидуализирован с учетом возраста больного, наличия поздних осложнений СД, сопутствующих сердечно-сосудистых заболеваний. При декомпенсации заболевания (особенно в состоянии кетоацидоза) физические нагрузки противопоказаны, так как могут ухудшить состояние больного. При отсутствии противопоказаний рекомендуются нагрузки умеренной интен-
сивности, общей продолжительностью не менее 2,5 ч в неделю, не реже 3 раз в неделю (с перерывами не более 2 последовательных дней).
У больных, получающих сахароснижающие препараты, физическая нагрузка может спровоцировать гипогликемию, риск которой повышается во время выполнения физической нагрузки и в ближайшие 12-40 ч после периода длительных и тяжелых физических упражнений. Больным СД 1-го типа следует определять уровень гликемии до, во время и после физической нагрузки. При легких и умеренных физических нагрузках продолжительностью не более 1 ч требуется дополнительный прием 15 г легкоусвояемых углеводов на каждые 40 мин физической активности. При интенсивных занятиях спортом необходимо снижение дозы инсулина, действующего в период выполнения физической нагрузки и в последующие 6-12 ч, на 20-50%.
Медикаментозное лечение
Сахароснижающие лекарственные средства классифицируют по основному механизму действия.
• Инсулины.
• Лекарственные средства, повышающие секрецию инсулина (секретогоги):
- производные сульфонилмочевины (глибенкламид, гликлазид, гликвидон, глимепирид, глипизид);
- меглитиниды (натеглинид, репаглинид).
• Лекарственные средства, преимущественно повышающие чувствительность периферических тканей к инсулину (сенситайзеры):
- бигуаниды (метформин);
- тиазолидиндионы (пиоглитазон, росиглитазон).
• Лекарственные средства, нарушающие всасывание углеводов в кишечнике, - ингибиторы а-глюкозидаз (акарбоза, миглитол).
• Инкретин-миметики:
- аналоги глюкагоноподобного пептида-1 (эксенатид, лираглутид);
- ингибиторы дипептидилпептидазы типа IV (ситаглиптин, вилдаглиптин).
• Аналоги амилина (прамлинтид).
Инсулины. Инсулины классифицируют по происхождению (человеческий, свиной и бычий, аналоги человеческого инсулина) и продолжительности действия (ультракороткого действия - аспарт, глулизин, лизпро; короткого - инсулин растворимый; средней продолжительности - инсулина-цинк комбинированного суспензия, инсулин изофан;
длительного действия - гларгин, детемир, инсулина-цинк кристаллического суспензия; комбинированные (двухфазные) инсулины - инсулин растворимый/ инсулин изофан, инсулин аспарт двухфазный, лизпро двухфазный). В России разрешены только генно-инженерные инсулины человека или аналоги инсулина человека.
Важнейшим эффектом инсулина является снижение гликемии вследствие стимуляции утилизации глюкозы периферическими тканями, подавления глюконеогенеза и гликогенолиза. Препараты инсулина используют для лечения всех типов СД. В лечении СД 1-го типа инсулины играют центральную роль.
Препараты инсулина вводят подкожно, при необходимости (в ургентных ситуациях, при оперативных вмешательствах и т.д.) можно вводить внутримышечно и внутривенно. На фармакокинетику препаратов инсулина оказывают влияние доза инсулина, место инъекции, путь введения, наличие липодистрофий и липом, локальная температура, мышечная работа. Особая кинетика всасывания новых инсулинов длительного действия - гларгина и детемира - позволяет избежать пиков концентрации препарата в крови, что обеспечивает поддержание равномерной физиологичной базальной инсулинемии. Побочными эффектами инсулина являются гипогликемия, увеличение массы тела, местные реакции (липоатрофия, липогипертрофия), преходящие отеки ног, нарушение зрения после начала инсулинотерапии вследствие изменения рефракции хрусталика. Применение аналогов инсулина короткого и длительного действия, ингаляционного инсулина, выгодно отличающихся от традиционных препаратов инсулина по фармакокинетическим и фармакодинамическим свойствам, улучшает качество лечения больных СД.
Производные сульфонилмочевины (ПСМ). ПСМ обладают наиболее выраженным гипогликемическим действием среди всех сахароснижающих препаратов, снижая уровень HbA1c при монотерапии в среднем на 1,5%. На сегодняшний день в мире доступно более 20 различных ПСМ. Препараты I поколения практически не применяют, поскольку ПСМ II поколения (гликвидон, гликлазид, глибенкламид, глипизид, глимепирид) значительно превосходят их по выраженности гипогликемического действия и реже вызывают побочные эффекты.
Основной механизм действия заключается в способности связывания ПСМ со специфическими сульфонилмочевинными рецепторами р-клеток поджелудочной железы, что приводит к закрытию АТФзависимых калиевых каналов, деполяризации мембраны, входу каль-
ция внутрь клеток и как следствие- высвобождению запасов инсулина из внутриклеточных депо и выбросу инсулина в кровь. Применение ПСМ оправдано только у пациентов с сохранной функцией панкреатических β-клеток. Следует избегать назначения высоких доз ПСМ, так как постоянная гиперстимуляция β-клеток приводит к их истощению, а медикаментозно вызываемая гиперинсулинемия усиливает периферическую инсулинорезистентность, формируется резистентность к действию ПСМ.
ПСМ применяют как в монотерапии, так и в комбинации с другими сахароснижающими препаратами. Назначать 2 разных ПСМ одновременно нельзя. ПСМ назначают, начиная с минимальных доз, при необходимости дозу постепенно увеличивают с интервалом 1-2 нед, рекомендуют принимать за 30 мин до еды. Начало действия ПСМ - через 2-3 ч после приема (микронизированная форма глибенкламида - через 1 ч). Большинство препаратов принимают 1-2 раза в день. ПСМ применяют как в качестве монотерапии, так и в комбинации с другими сахароснижающими препаратами.
Противопоказаниями к назначению лекарственных препаратов, повышающих секрецию инсулина, являются СД 1-го типа, беременность и лактация, тяжелая почечная и печеночная недостаточность. Наиболее частый и серьезный побочный эффект ПСМ - гипогликемия, к которой особенно склонны пожилые больные, а также с нарушенной функцией почек. Чаще гипогликемию вызывают препараты, выводящиеся медленно и преимущественно почками, например, глибенкламид, глимепирид и гликлазид редко вызывают гипогликемию. При назначении секретагогов необходимо проводить обучение больного в отношении распознавания, купирования и профилактики гипогликемии. Стимулируя секрецию инсулина, ПСМ повышают аппетит и могут способствовать повышению массы тела, что нежелательно у больных СД с избыточным весом.
Меглитиниды. Благодаря особенностям механизма действия и фармакокинетики сахароснижающие препараты этой группы заняли отдельную нишу в лечении СД 2-го типа и получили название прандиальных регуляторов гликемии. Меглитиниды, подобно ПСМ, оказывают влияние на АТФ-зависимые калиевые каналы панкреатических β-клеток, но действуют посредством других рецепторов. Меглитиниды восстанавливают раннюю фазу секреции инсулина. Вследствие короткого периода действия не развивается длительная гиперинсулинемия. По сравнению с ПСМ меглитиниды больше снижают постпрандиальный уровень гликемии, но в меньшей степени - уровень гликемии натощак.
Меглитиниды всасываются в ЖКТ за очень короткое время, обеспечивая начало действия через несколько минут после приема, продолжительность действия - около 1 ч, их принимают непосредственно перед едой, или во время еды, или через несколько минут после еды. Имитация физиологической секреции инсулина на прием пищи при лечении препаратами этой группы позволяет пациентам более гибко подходить к соблюдению режима питания и снизить риск гипогликемии. Применение меглитинидов сопровождается сопоставимым с ПСМ риском увеличения массы тела, но гипогликемия встречается реже.
Бигуаниды. Метформин - единственный бигуанид, разрешенный к применению. Метформин, связываясь с фосфолипидами клеточных мембран, вызывает следующие эффекты:
• снижает продукцию глюкозы в печени;
• увеличивает утилизацию глюкозы периферическими тканями, снижая инсулинорезистентность;
• задерживает всасывание углеводов в тонкой кишке, способствует снижению массы тела;
• снижает концентрацию свободных жирных кислот в плазме крови, оказывает благоприятный эффект на липидный обмен.
Сахароснижающая эффективность монотерапии ПСМ и метформином сопоставима. Метформин (в отличие от ПСМ) не вызывает гипогликемии и увеличения массы тела.
Общими противопоказаниями к назначению препаратов, повышающих чувствительность периферических тканей к инсулину, считают СД 1-го типа, беременность, лактацию. Кроме того, противопоказаниями к назначению метформина служат все факторы, предрасполагающие к развитию лактат-ацидоза: нарушенные функции почек (креатинин в сыворотке более 124 мкмоль/л у женщин, 133 мкмоль/л у мужчин) и печени, сердечная недостаточность, злоупотребление алкоголем, тяжелое состояние, сопровождаемое гипоксией и/или ацидозом, оперативное вмешательство. Обычно препарат хорошо переносится. Побочные эффекты проявляются в виде желудочно-кишечных нарушений (тошноты, дискомфорта в эпигастральной области, метеоризма, диареи, металлического привкуса во рту), которых можно избежать, если начинать лечение метформином с малых доз и принимать препарат во время или после еды.
Тиазолидиндионы (глитазоны). Механизм действия тиазолидиндионов, аналогично метформину, основан на повышении чувствительности периферических тканей к инсулину. Тиазолидиндионы - высокоаф-
финные агонисты ядерных рецепторов, активируемых пролифератором пероксисом PPAR-y. PPAR-y регулируют транскрипцию генов, отвечающих за метаболизм углеводов и жиров. Снижение инсулинорезистентности на фоне терапии тиазолидиндионами происходит за счет повышения синтеза транспортеров глюкозы, увеличивается транспорт глюкозы внутрь адипоцитов и миоцитов, где активируются процессы синтеза гликогена и гликолиза.
Тиазолидиндионы противопоказаны при сердечной недостаточности III и IV функционального класса по классификации NYHA, а также при уровне АЛТ выше верхней границы нормы в 2,5 раза. Тиазолидиндионы не вызывают гипогликемию, но их применение сопровождается развитием других побочных эффектов, среди которых наибольшее значение имеют увеличение массы тела (дозо- и времязависимый эффекты), задержка жидкости в организме, отеки стоп, сердечная недостаточность. Вероятность задержки жидкости в организме возрастает при одновременном использовании тиазолидиндионов и инсулина. Данную комбинацию следует с осторожностью назначать пациентам с повышенным риском развития сердечной недостаточности.
Ингибиторы α-глюкозидаз. Механизм действия ингибиторов α-глюкозидаз связан с их действием на ферменты щеточной каемки энтероцитов. Действуя в верхних отделах тонкой кишки, эти препараты замедляют процессы ферментирования сложных углеводов и снижают скорость всасывания моносахаридов. Используя способность ингибиторов α-глюкозидаз эффективно снижать постпрандиальную гликемию, чаще всего их используют в комбинации с другими пероральными сахароснижающими препаратами. Они менее эффективны в отношении снижения гликемии по сравнению с метформином или ПСМ. Поскольку углеводы всасываются дистально, не наблюдается симптомов мальабсорбции или снижения массы тела, но увеличенное поступление полисахаридов в толстую кишку может приводить к метеоризму и диарее. Выраженность побочных эффектов можно уменьшить, если начинать лечение с небольших доз и увеличивать дозу постепенно.
Инкретин-миметики. К инкретин-миметикам, используемым в терапии СД 2-го типа, относят 2 класса препаратов:
• агонисты глюкагоноподобного пептида-1 (GLP-1) (эксенатид, лираглутид);
• ингибиторы дипептидилпептидазы IV (DPP IV) (ситаглиптин, вилдаглиптин).
Инкретины вырабатываются в кишечнике и играют основную роль в инсулиновом ответе на прием пищи. При СД 2-го типа содержание инкретинов и их эффект снижены.
• Эксенатид - синтетический аналог GLP-1, обладает глюкозозависимым стимулирующим эффектом на секрецию инсулина, подавляет постпрандиальную секрецию глюкагона, замедляет опорожнение желудка и снижает аппетит, вследствие чего снижаются уровень гликемии и масса тела. Эксенатид вводится подкожно, максимальной концентрации достигает через 2 ч, длительность действия - 10 ч. Эксенатид длительного действия находится в стадии клинических испытаний. Основной побочный эффект эксенатида - тошнота, которая на фоне длительного приема беспокоит реже.
• Ингибиторы DPP IV подавляют активность фермента, разрушающего GLP-1, увеличивая, таким образом, длительность действия эндогенного GLP-1. Эффекты ингибиторов DPP IV аналогичны таковым синтетических аналогов GLP-1, но (в отличие от последних) не вызывают снижения массы тела. Ингибиторы DPP IV являются препаратами для приема внутрь, их назначают в качестве монотерапии или в комбинации с метформином или тиазолидиндионами.
Аналоги амилина. Прамлинтид - синтетический аналог амилина - пептидного гормона, секретируемого β-клетками поджелудочной железы в ответ на прием пищи наравне с инсулином. Прамлинтид замедляет опорожнение желудка, подавляет секрецию глюкагона и снижает аппетит. Быстро всасывается при подкожном применении. Показан в качестве дополнительной терапии больным СД 1-го или 2-го типа с постпрандиальной гипергликемией и/или увеличением массы тела на фоне инсулинотерапии. Характерными побочными эффектами прамлинтида являются гипогликемия, реакции со стороны ЖКТ (тошнота, рвота, потеря аппетита). Прамлинтид не следует назначать в комбинации с ингибиторами α-глюкозидаз и препаратами, влияющими на моторику ЖКТ.
Принципы сахароснижающей терапии сахарного диабета 1-го типа
В условиях абсолютного дефицита инсулина при СД 1-го типа заместительная инсулинотерапия - единственный метод лечения. Используют базис-болюсный принцип инсулинотерапии в целях имитации физиологического выделения гормона в течение суток. Базис-болюсный режим осуществляют введением инсулина длительного действия (1-2 инъекции) в сочетании с инъекциями инсулина короткого действия перед основными приемами пищи. Базальный инсулин подавляет продукцию глюкозы в период между приемом пищи и сном, при этом же-
лательно, чтобы базальное замещение инсулина имело постоянное значение и составляло приблизительно половину суточной дозы инсулина. Прандиальное введение инсулина, или болюс, ограничивает колебания постпрандиальной гипергликемии и может составлять 10-20% общей суточной дозы инсулина на каждый прием пищи. Коррекцию дозы инсулина проводят ежедневно на основании данных концентрации глюкозы в крови в течение суток. Существующие в настоящее время виды инсулина позволяют индивидуализировать режим инсулинотерапии в зависимости от потребностей пациента.
Принципы сахароснижающей терапии сахарного диабета 2-го типа
Для большинства больных СД 2-го типа оправданным считают целевой уровень HbA1c менее 7,0%. Не выявлено преимуществ более интенсивного гликемического контроля (HbA1c <6,5%) у больных СД 2-го типа. Решение об интенсификации терапии с достижением уровня HbA1c менее 7,0% следует принимать индивидуально с учетом потенциальных преимуществ и риска для конкретного пациента. Следует учитывать такие факторы, как возраст, предшествующая длительность СД, ожидаемая продолжительность жизни, риск развития гипогликемий, наличие сердечно-сосудистой патологии, множественных сердечно-сосудистых факторов риска, выраженных микрососудистых осложнений, способность осуществлять соответствующий режиму терапии интенсивный самоконтроль гликемии. К категории больных, которым показан целевой уровень HbA1c менее 7,0% (возможно <6,5%), могут быть отнесены лица молодого и среднего возраста с впервые выявленным СД 2-го типа или небольшой длительностью СД, с высокой ожидаемой продолжительностью жизни, без микрососудистых осложнений и сердечно-сосудистых заболеваний. Напротив, менее строгий целевой уровень HbA1c может быть рекомендован больным пожилого возраста, с длительным СД 2-го типа, небольшой ожидаемой продолжительностью жизни, с тяжелыми гипогликемиями, выраженными микроили макрососудистыми осложнениями, высоким сердечно-сосудистым риском.
Выбор сахароснижающего препарата должен быть основан в первую очередь на его сахароснижающей эффективности с учетом профиля безопасности для конкретного пациента. В настоящее время не доказаны преимущества какого-либо класса препаратов или их комбинаций в отношении влияния на риск осложнений. Снижение риска осложнений определяется достижением хорошего контроля гликемии, а не специфическими дополнительными свойствами сахароснижающих препаратов (табл. 63-3). При значительном повышении уровня гликемии (HbA1c
Таблица 63-3. Характеристика сахароснижающей способности и негликемических эффектов различных видов терапии
>8,5%) рекомендуют использование классов препаратов с быстрой сахароснижающей способностью или более раннее начало комбинированной терапии.
На согласительной конференции Американской диабетологической ассоциации и Европейской ассоциации по изучению сахарного диабета в 2008 г. разработан следующий алгоритм лечения СД 2-го типа (рис. 63-1).
Терапия первого ряда предпочтительна для большинства пациентов с СД 2-го типа. При установлении диагноза СД 2-го типа первым шагом в лечении, наряду с модификацией образа жизни, считают применение метформина (поскольку в большинстве случаев только изменение образа жизни не приводит к достижению целевых показателей гликемии). При непереносимости метформина или противопоказаниях к его назначению можно использовать ПСМ.
Второй сахароснижающий препарат должен быть добавлен в течение 2-3 мес от начала терапии, если на фоне изменения образа жизни и приема метформина в максимальной дозе не достигнут целевой уро-
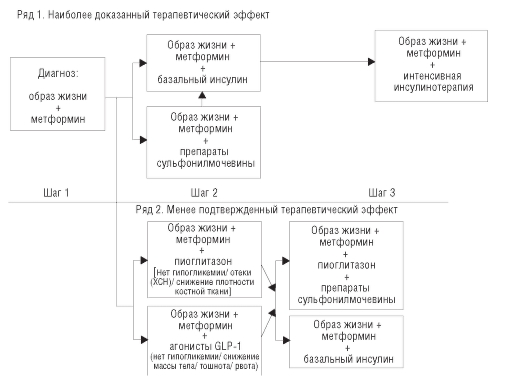
Рис. 63-1. Алгоритм коррекции гипергликемии при сахарном диабете 2-го типа
вень гликемии. В качестве препаратов второго ряда рекомендуют инсулин или ПСМ. Инсулин назначают при уровне HbA1c более 8,5% или при наличии симптомов гипергликемии, начинают инсулинотерапию с использования базального инсулина (средней продолжительности или продленного действия) однократно в сутки. Алгоритм инсулинотерапии представлен на рис. 63-2.
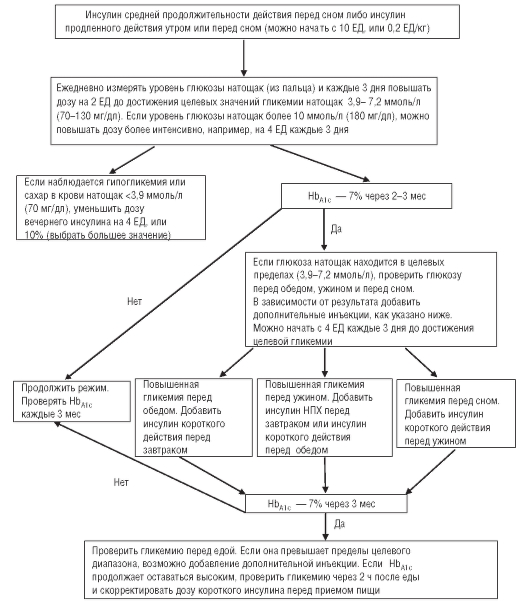
Рис. 63-2. Алгоритм инсулинотерапии у больных сахарным диабетом 2-го типа
Если при изменении образа жизни в сочетании с метформином и базальным инсулином или ПСМ не достигнут целевой уровень гликемии, следующим шагом должно быть усиление инсулинотерапии. Интенсификация инсулинотерапии заключается в добавлении инсулина короткого или ультракороткого действия перед приемами пищи для снижения постпрандиальной гликемии. С началом инсулинотерапии прием секретогогов следует прекратить. Добавление 3-го препарата внутрь возможно, если уровень HbA1c близок к целевому значению (<8,0%), однако в сравнении с инсулинотерапией этот вариант менее эффективен и дорогостоящ. Быстрые темпы интенсификации терапии оправданы лишь при явном дефиците инсулинсекреторной функции. У большинства пациентов с умеренным повышением уровня HbA1c (7,5-8,5%) при длительном периоде титрования целевой уровень гликемии может быть достигнут на терапии пероральными сахароснижающими препаратами или их комбинации с базальным инсулином.
Препараты 2-го ряда рекомендуют в клинических ситуациях, когда важен индивидуальный подход (низкий риск гипогликемий и снижение массы тела). Агонисты амилина, ингибиторы а-глюкозидазы, меглитиниды, ингибиторы DPP IV можно применять при недостаточном эффекте метформина в качестве 2-го сахароснижающего препарата, если уровень HbA1c близок к целевому (<7,5-8,0%) и экономический фактор не имеет значения для пациента.
У пациентов с неконтролируемым СД с признаками катаболизма, глюкозой в плазме крови более 13,9 ммоль/л натощак, более 16,7 ммоль/л при случайном измерении, HbA1c более 10,0%, или кетонурией, или выраженными симптомами гипергликемии (полиурией, полидипсией и снижением массы тела) препаратом выбора считают инсулин. Абсолютными показаниями к инсулинотерапии при СД 2-го типа являются диабетический кетоацидоз, диабетическая кома, необходимость большого хирургического вмешательства, декомпенсация углеводного обмена на фоне тяжелых инфекций и других острых заболеваний (инфаркта миокарда, нарушения мозгового кровообращения, острой пневмонии), беременность.
Критерии компенсации сахарного диабета
Критерии компенсации сахарного диабета перечислены в табл. 63-4.
Таблица 63-4. Критерии компенсации сахарного диабета
ОСЛОЖНЕНИЯ
Диабетические микроангиопатии
К диабетическим микроангиопатиям относятся:
• диабетическая ретинопатия;
• нейропатия;
• нефропатия.
Сосудистые нарушения могут возникать при любых формах СД. При этом продолжительность и тяжесть его течения коррелируют с выраженностью сосудистых осложнений. В их патогенезе придают значение расстройствам углеводного, жирового и белкового обмена. Предполагают 2 механизма повреждения клеток, связанных с гликемией:
• гликозилирование конечных продуктов метаболизма;
• ускорение полиолового пути обмена с последующей активацией протеинкиназы С.
Гликозилированные продукты обмена накапливаются в различных тканях и участвуют в повреждении клеток посредством активации цитокинов и комплемента, усиления синтеза фактора роста, стимуляции реакций окисления. Протеинкиназа С стимулирует высвобождение трансформирующего фактора роста-р и играет важную роль в пролиферации клеток и усилении сосудистой проницаемости. Определенное значение в развитии микроангиопатии придают изменениям микроциркуляции, дисфункции эндотелия.
Ведущим гемодинамическим фактором развития и прогрессирования диабетической нефропатии является внутриклубочковая гипертензия. Дисбаланс в регуляции тонуса приносящей и выносящей артериол клубочков - следствие активации ренин-ангиотензин-альдостероновой
системы. Полагают, что повышение гломерулярного давления усиливает фильтрацию белка и гликозилированных конечных продуктов обмена. Со временем их накопление в мезангиуме может стимулировать пролиферацию мезангиальных клеток и образование матрикса, вызывая развитие гломерулосклероза. Компенсаторная гиперфильтрация развивается в непораженных клубочках, однако в дальнейшем процесс прогрессирует.
Диабетическая ретинопатия
Диабетическая ретинопатия - микрососудистое осложнение СД с поражением сосудов сетчатки, приводящее в терминальной стадии к полной слепоте. Диабетическую ретинопатию выявляют в среднем у 40% больных СД 1-го типа, у больных СД 2-го типа - в 20% случаев уже в момент постановки диагноза. Обычно она возникает раньше нефропатии.
Согласно рекомендованной ВОЗ классификации диабетической ретинопатии, различают стадии:
• непролиферативную;
• препролиферативную;
• пролиферативную.
Непролиферативная стадия диабетической ретинопатии характеризуется расширением вен и капилляров, микроаневризмами, кровоизлияниями, экссудативными очагами, расположенными преимущественно в парамакулярной зоне. Зрение, как правило, не нарушено. Препролиферативная стадия сопровождается более выраженными изменениями: множественными кровоизлияниями, мягкими и твердыми экссудативными очагами, интраретинальными сосудистыми аномалиями. Изменения на сетчатке захватывают макулярную зону, что сопровождается снижением остроты зрения. Пролиферативная стадия характеризуется неоваскуляризацией не только по всему полю сетчатки, но и в области диска зрительного нерва, кровоизлияниями в стекловидное тело. Осложнениями этой стадии диабетической ретинопатии являются тракционная отслойка сетчатки, рубеоз радужки, вторичная глаукома.
Обязательные методы исследования, определение стадии диабетической ретинопатии осуществляет офтальмолог. Офтальмологическое исследование следует провести взрослым и детям с СД 1-го типа через 3-5 лет после начала СД, пациентам с СД 2-го типа - вскоре после установления диагноза. В последующем следует выполнять ежегодные офтальмологические исследования. «Золотым стандартом» ведения пациентов является цифровая архивация данных офтальмологического исследова-
ния (состояния глазного дна). Оптимальный контроль гликемии и АД снижает риск и/или замедляет прогрессирование ретинопатии. Эффективными методами лечения являются лазерная коагуляция сетчатки, витреэктомия (при пролиферативной стадии). Установлено, что применение ангиопротекторов при диабетической ретинопатии малоэффективно и опасно в отношении возникающих осложнений.
Наряду с ретинопатией, другими клиническими проявлениями диабетической офтальмопатии являются диабетическая катаракта, заболевания век (блефарит, халазион и т.д.), транзиторные нарушения остроты зрения при значительных колебаниях гликемии.
Диабетическая нейропатия
Диабетическая нейропатия - патогенетически связанное с СД поражение нервной системы, классифицируемое в зависимости от преимущественного вовлечения в процесс спинномозговых нервов (дистальная или периферическая диабетическая нейропатия) и/или вегетативной нервной системы (висцеральная или автономная диабетическая нейропатия) при исключении других причин их поражения.
Диабетическая нейропатия в той или иной форме развивается у подавляющего числа больных, с одинаковой частотой развивается у больных СД 1-го и 2-го типа. Основной патогенетический фактор - хроническая гипергликемия, приводящая к изменению структуры и функции нервных клеток.
При дистальной симметричной нейропатии в патологический процесс сперва вовлекаются наиболее длинные нервные волокна, поэтому первые клинические симптомы появляются в области стоп; при прогрессировании процесса симптомы возникают в проксимальных отделах. Поражение сенсорных волокон проявляется снижением или полной потерей температурной, болевой, вибрационной, тактильной чувствительности, что повышает риск травматизации стоп и развития синдрома диабетической стопы. Пациенты предъявляют жалобы на онемение, чувство покалывания, «ползания мурашек», зябкости, жжения в области стоп. Возможно развитие слабости мышц конечностей (слабость при ходьбе и невозможность удерживать предметы рукой). При поражении моторных волокон развиваются атрофия мелких мышц стопы, деформация пальцев стоп.
Разновидностью дистальной сенсорной нейропатии считают острую болевую нейропатию. Пациенты предъявляют жалобы на чувство жжения, колющие, режущие боли в области стоп и голеней. Характерны усиление болевого синдрома в покое, особенно в вечернее и ночное время,
ослабление днем, при физической нагрузке. Выявляется повышенная чувствительность к тактильным раздражителям.
Сердечно-сосудистая автономная нейропатия является наиболее изученной и клинически важной формой диабетической автономной нейропатии: нарушение вегетативной иннервации сердечно-сосудистой системы в 4 раза повышает риск желудочковых аритмий и внезапной смерти. Она проявляется тахикардией в покое, ортостатической гипотонией, снижением вариабельности сердечного ритма, в том числе отсутствием адекватного прироста ЧСС при нагрузке, отсутствием изменений ЧСС при глубоком дыхании, пробе Вальсальвы, ортостатической пробе. Часто встречается автономная диабетическая нейропатия ЖКТ (дисфагия, чувство переполнения желудка, тошнота, ночная и постпрандиальная диарея, сменяющаяся запором, недержание стула), мочеполовой системы (нарушение опорожнения мочевого пузыря, атония мочевого пузыря, эректильная дисфункция, ретроградная эякуляция). Реже автономная нейропатия проявляется нарушением зрачкового рефлекса, нарушением адаптации к темноте, бессимптомной гипогликемией, нарушением потоотделения, терморегуляции.
Диабетическая ретинопатия диагностируется на основании жалоб, данных стандартизованного клинического обследования с использованием специальных шкал количественной оценки интенсивности болевых ощущений и инструментальных методов исследования, включающих количественные сенсорные, электрофизиологические и автономные функциональные тесты. Всех пациентов при установлении диагноза, впоследствии ежегодно, необходимо обследовать на наличие дистальной симметричной нейропатии. При дистальной нейропатии необходим специальный уход за стопами для снижения риска ампутации. При выявлении пациента направляют к специалисту по диабетической стопе. Основной мерой профилактики и лечения диабетической нейропатии считают достижение и поддержание целевых значений гликемии.
Диабетическая нефропатия
Диабетическая нефропатия - специфическое поражение сосудов почек при СД, сопровождаемое формированием узелкового или диффузного гломерулосклероза, терминальная стадия которого характеризуется развитием ХПН. Выделяют следующие стадии диабетической нефропатии:
• микроальбуминурии;
• протеинурии с сохранной азотвыделительной функцией почек;
• ХПН.
В настоящее время диабетической нефропатией страдает одна треть пациентов, нуждающихся в гемодиализе. Распространенность этого осложнения зависит от длительности заболевания. В первые 3-5 лет СД 1-го типа диабетическая нефропатия развивается редко, через 20 лет - почти у 30%. При постановке диагноза СД 2-го типа у 17-30% больных обнаруживают микроальбуминурию (МАУ), у 7-10% - протеинурию, у 1% - ХПН. При СД 1-го типа стойкая протеинурия в течение 5-7 лет приводит к развитию терминальной ХПН у 80% пациентов. У больных СД 2-го типа протеинурическая стадия менее агрессивна, ХПН диагностируют реже. У больных СД 2-го типа диабетическое поражение почек накладывается на исходно имеющиеся заболевания почек, структурнофункциональные возрастные изменения, что не позволяет объективно оценить частоту развития и особенности течения диабетической нефропатии.
Стадия МАУ - единственная обратимая стадия диабетической нефропатии при своевременно назначенной терапии, характеризуется отсутствием снижения клубочковой фильтрации (СКФ). Появление протеинурии свидетельствует о склерозировании около 50% клубочков почек и необратимости этого процесса. С этой стадии диабетической нефропатии СКФ неуклонно снижается. Протеинурическая стадия с сохранной азотвыделительной функцией характеризуется прогрессированием других микро- и макрососудистых осложнений СД. Выявляют отеки стоп, голеней, регистрируют АГ. На стадии ХПН больные предъявляют жалобы на слабость, сонливость, быструю утомляемость, тошноту, рвоту. Обнаруживают выраженные отеки, стабильно повышенное АД.
Поражение почек при СД может быть обусловлено не только специфическим осложнением СД, но и рядом других заболеваний инфекционного, сосудистого, токсического генеза. В связи с этим наиболее актуален термин «хроническая болезнь почек».
У пациентов с СД 1-го типа длительностью не менее 5 лет и у всех пациентов с СД 2-го типа с момента установления диагноза следует ежегодно выполнять тест на МАУ. У всех взрослых пациентов с СД независимо от уровня экскреции альбумина с мочой, по крайней мере, ежегодно следует определять креатинин в сыворотке для оценки СКФ и определения стадии хронической болезни почек. Для профилактики нефропатии и замедления ее прогрессирования наряду с коррекцией гипергликемии необходима нормализация АД. В качестве препаратов выбора в лечении больных СД 1-го типа с МАУ рассматривают ингибиторы АПФ.
У больных СД 2-го типа с МАУ нефропротективный эффект доказан для антагонистов рецепторов к ангиотензину II.
Синдром диабетической стопы
Под синдромом диабетической стопы понимают наличие гнойнонекротического или деструктивного процесса на стопе в условиях полинейропатии и/или ангиопатии. Синдром диабетической стопы характеризуется поражением кожи и мягких тканей, костей и суставов и проявляется в виде трофических язв, кожно-суставных изменений и гнойно-некротических процессов. Среди всех терминальных осложнений СД язвенные дефекты стоп являются наиболее частыми. Синдром диабетической стопы наблюдают у 15-25% больных СД. Это осложнение - основная причина ампутаций нижних конечностей, которая приводит к ранней инвалидизации и повышению летальности больных СД.
Наиболее важными механизмами развития синдрома диабетической стопы считают дистальную сенсомоторную и автономную нейропатию. Образование язвенного дефекта происходит под воздействием внешних повреждающих факторов, среди которых наиболее часто встречается избыточное давление на определенные участки стопы с образованием зон гиперкератоза. Согласно этиопатогенетической классификации, выделяют следующие формы синдрома диабетической стопы:
• нейропатическую (до 60% случаев) - без остеоартропатии и диабетическую остеоартропатию (стопу Шарко);
• нейроишемическую (смешанную; до 35% случаев);
• ишемическую (до 5% случаев).
Клинические особенности нейропатической формы синдрома диабетической стопы:
• возникает при длительности СД 1-го типа более 10 лет;
• часто встречаются другие осложнения СД, злоупотребление алкоголем;
• часто возникают рецидивы язв стоп;
• язвы стоп безболезненные, окружены гиперкератозом, локализуются в участках наибольшего давления на стопе (подошве, пальцах);
• кожа розовая, сухая, теплая на ощупь, пульсация на артериях стоп сохранена;
• определяется нарушение вибрационной, болевой и температурной чувствительности по типу «носков» и «перчаток»;
• обнаруживают деформации пальцев и свода стопы.
Ишемическая форма синдрома диабетической стопы диагностируется у пациентов старше 45 лет, при длительности заболевания более 15 лет, другие осложнения диабета могут быть не столь выраженными, сочетается с сердечно-сосудистыми заболеваниями, курением. Язвы болезненны, кожа вокруг истончена, локализация язв - на пятке, кончиках пальцев, кожа бледная или цианотичная, холодная на ощупь, пульсация на артериях снижена или отсутствует, чувствительность может быть сохранена, костные изменения развиваются редко.
Обучение больных методам профилактики диабетической стопы существенно снижает риск ее возникновения и развития тяжелых осложнений. Условиями профилактики поражений стоп при СД считают хороший контроль заболевания, регулярный осмотр стоп (врачом - при каждом визите пациента, больным - ежедневно), знание, умение и соблюдение больным правил ухода за ногами. Исследование стоп должно включать осмотр, пальпацию, определение чувствительности с помощью камертона и монофиламента. Для выявления заболевания периферических артерий необходимо определить наличие признаков перемежающейся хромоты, оценить пульсацию тыльных артерий стоп. Учитывая, что у многих пациентов заболевание периферических артерий бессимптомно, большое значение приобретает оценка лодыжечноплечевого индекса АД.
Больные с синдромом диабетической стопы требуют активного пожизненного наблюдения в кабинете диабетической стопы и обеспечения ортопедическим пособием. В ведении пациентов с наличием или высоким риском язвенных поражений стоп следует использовать мультидисциплинарный подход. Основными целями лечения считают заживление язвенного дефекта и предотвращение ампутации стопы. Применяют обработку раневого дефекта, функциональную разгрузку конечности и антибактериальную терапию по показаниям.
Сердечно-сосудистая система при сахарном диабете
В настоящее время основная причина смерти при СД - заболевания сердечно-сосудистой системы. Поражение сердечно-сосудистой системы при СД ассоциируется, прежде всего, с АГ, ишемической болезнью сердца и хронической сердечной недостаточностью.
У больных СД существенно ускоряется развитие атеросклероза коронарных, церебральных и периферических артерий. Прогрессированию атеросклероза способствуют другие факторы риска атеросклероза (АГ, ожирение, курение), а также метаболические и другие расстройства,
характерные для СД: повышение уровня ЛПНП, снижение содержания ЛПВП, увеличение окисления и гликирования липопротеинов, уменьшение активности липопротеинлипазы, усиление агрегации и адгезии тромбоцитов, эндотелиальная дисфункция, прокоагуляция. Эти изменения в значительной степени связаны с инсулинорезистентностью и гиперинсулинемией.
Тяжелый коронарный атеросклероз при СД нередко приводит к развитию инфаркта миокарда. Следует учитывать возможность безболевого его течения вследствие поражения нервных окончаний сердца. Поражение сердца при СД может быть следствием микроангиопатии без стенозирующего коронаросклероза. Диабетическая кардиомиопатия характеризуется дилатацией камер сердца, снижением сократительной способности миокарда и развитием застойной сердечной недостаточности.
Атеросклеротическое поражение периферических артерий часто сочетается с микроангиопатией, что затрудняет проведение реконструктивных оперативных вмешательств. При этом боли в ногах по типу перемежающейся хромоты следует дифференцировать от полиневритических. Кожа на голенях и стопах обычно холодная, тонкая, бледная. Пульсация на периферических артериях ослаблена или отсутствует. Тяжелое поражение периферических артерий нередко служит причиной ампутации конечности.
Европейским обществом кардиологов и Европейской ассоциацией по изучению диабета в 2007 г. предложены показатели целевых значений гликемии, АД, липидного обмена (табл. 63-5).
Таблица 63-5. Целевые показатели терапии у больных сахарным диабетом с сердечно-сосудистыми заболеваниями
Острые осложнения
К острым, угрожающим жизни осложнениям СД относят:
• диабетический кетоацидоз;
• гиперосмолярное гипергликемическое состояние;
• лактат-ацидоз;
• гипогликемические состояния.
Диабетический кетоацидоз и кетоацидотическая кома
Диабетический кетоацидоз - острая декомпенсация СД, характеризуемая абсолютной или выраженной относительной инсулиновой недостаточностью, гипергликемией (>13,9 ммоль/л) и гиперкетонемией (>5 ммоль/л), ацетонурией, метаболическим ацидозом (pH <7,3) с раз-
личной степенью нарушения сознания или без нарушения. Пусковые факторы:
• интеркуррентные заболевания (инфекционно-воспалительные процессы, особенно мочевыводящих и дыхательных путей, инфаркт миокарда, инсульт и др.);
• хирургические вмешательства и травмы;
• беременность;
• несвоевременная диагностика СД, особенно 1-го типа;
• нарушения режима лечения;
• недостаточный контроль и самоконтроль уровня гликемии;
• длительная терапия ГК, диуретиками в больших дозах, антипсихотическими препаратами.
Диабетический кетоацидоз развивается в течение нескольких дней, реже - в течение суток с нарастанием симптомов дегидратации: полиурии, жажды, слабости, снижения работоспособности, анорексии, снижения массы тела. Впоследствии присоединяются признаки кетоза и ацидоза: тошнота, рвота, боли в животе, головные боли, нарушения сознания различной степени.
При физикальном обследовании обнаруживают сухость кожи и слизистых оболочек, снижение тургора кожи и глазных яблок, снижение мышечного тонуса, артериальную гипотензию, тахикардию. Определяются запах ацетона в выдыхаемом воздухе, одышка, при выраженном ацидозе - дыхание Куссмауля. Возможно развитие диабетического псевдоперитонита (ложного острого живота), для которого характерны абдоминальные боли, частая рвота, напряжение и болезненность брюшной стенки, уменьшение перистальтики. Эти симптомы связаны с действием кетоновых тел на ЖКТ и дегидратацией брюшины. Постепенно развивается нарушение сознания: сонливость, оглушение, сопор, кома.
Основными принципами лечения диабетического кетоацидоза считают:
• устранение дефицита инсулина и снижение гипергликемии;
• регидратацию;
• коррекцию электролитных нарушений и ацидоза;
• лечение заболеваний, которые могли служить пусковыми факторами кетоацидоза.
Гиперосмолярное гипергликемическое состояние
Гиперосмолярное гипергликемическое состояние (гиперосмолярная некетоацидотическая кома, гипергликемическое некетоацидотическое состояние) - острая декомпенсация СД с резко выраженной гипергликемией (как правило, >35 ммоль/л) и резко выраженной дегидратацией
при отсутствии кетоза и ацидоза. Гиперосмолярное гипергликемическое состояние диагностируют в 6-10 раз чаще, чем диабетический кетоацидоз. Большинство больных составляют пациенты с СД 2-го типа в возрасте 57-70 лет.
Основная причина гиперосмолярного гипергликемического состояния - выраженная относительная инсулиновая недостаточность в сочетании с обезвоживанием. Провоцирующими факторами служат:
• состояния, ведущие к дегидратации и инсулиновой недостаточности (инфекционные заболевания, особенно с лихорадкой, рвотой, диареей);
• другие острые заболевания (инфаркт миокарда, инсульт, тромбоэмболия легочной артерии, острый панкреатит, массивные кровотечения, ожоги, почечная недостаточность);
• прием больших доз диуретиков, аналогов соматостатина, симпатомиметиков, ГК;
• ограничение потребления жидкости при жажде.
Факторами риска считают также пожилой возраст и женский пол.
Гиперосмолярное гипергликемическое состояние развивается медленно, в течение нескольких дней или недель, с нарастанием полиурии, жажды, слабости, адинамии, снижением массы тела, головными болями. Полиурия сменяется олиг- и анурией. При физикальном обследовании выявляют признаки выраженной дегидратации:
• сухость кожи и слизистых оболочек;
• снижение тургора кожи;
• мягкость глазных яблок при пальпации;
• артериальную гипотензию;
• тахикардию.
Отсутствуют запах ацетона в выдыхаемом воздухе и дыхание Куссмауля. Нарушения сознания различной степени присутствуют почти у всех больных, возможен делирий. Для гиперосмолярного гипергликемического состояния характерна полиморфная неврологическая симптоматика: судороги, парезы, параличи, нистагм, вестибулярные нарушения. Неврологические нарушения нередко доминируют в клинической картине, неустойчивы и исчезают на фоне устранения гиперосмолярности. Крайне важна дифференциальная диагностика с отеком мозга, учитывая схожесть неврологической симптоматики и принципиальные различия в лечении.
При лабораторном исследовании выявляют выраженную гипергликемию, гипернатриемию при отсутствии кетонемии, нарушений кислотно-основного состояния.
Основные принципы лечения гиперосмолярного гипергликемического состояния:
• регидратация;
• снижение гиперосмолярности плазмы путем уменьшения гипернатриемии и гипергликемии;
• устранение гипоксии;
• лечение сопутствующих заболеваний, которые могли быть причиной гиперосмолярного гипергликемического состояния.
Лактат-ацидоз
Лактат-ацидоз - метаболический ацидоз с большой анионной разницей (≥10) и концентрацией молочной кислоты в крови более 4 ммоль/л. Различают лактат-ацидоз типа А (гипоксический) и типа В (связанный с повышенным образованием и сниженной утилизацией лактата). Гипоксический лактат-ацидоз может развиться при кардиогенном, эндотоксическом, гиповолемическом шоке, хронической сердечной недостаточности, асфиксии, отравлении угарным газом. Причинами лактат-ацидоза типа В являются почечная или печеночная недостаточность, тяжелая анемия, онкологические заболевания и гемобластозы, тяжелые инфекции, декомпенсированный СД, судорожные синдромы, синдром мальабсорбции, феохромоцитома, бигуаниды, кокаин, отравление парацетамолом, салицилатами, спиртами, цианидами.
При СД чаще развивается смешанный лактат-ацидоз, в большинстве случаев при наличии противопоказаний к приему метформина - состояний, которые сами способны вызвать лактат-ацидоз. Клинические проявления лактат-ацидоза напоминают декомпенсацию СД или усиление побочных эффектов метформина: тошнота, рвота, диарея, боли в животе, слабость, адинамия. Характерный признак - стойкая миалгия, обусловленная накоплением лактата, не купируемая приемом анальгетиков; ее появление возможно задолго до ухудшения общего состояния. Гиперлактатемия и ацидоз снижают сократимость миокарда и порог фибрилляции, приводя к развитию острой сердечной недостаточности и аритмиям.
При физикальном обследовании выявляют нарушения сознания различной степени, бледность и сухость кожных покровов и слизистых оболочек, артериальную гипотонию, тахикардию, дыхание Куссмауля, нарушения ритма сердца.
Основные принципы лечения сводятся к выведению из организма лактата и метформина, борьбе с шоком, ацидозом, электролитными нарушениями, а также коррекции состояний, которые могли быть причиной лактат-ацидоза.
Гипогликемия и гипогликемическая кома
Гипогликемия - снижение концентрации глюкозы в плазме менее 2,8 ммоль/л с симптомами или менее 2,2 ммоль/л вне зависимости от симптомов. Гипогликемическая кома - гипогликемия, сопровождаемая потерей сознания.
Основной причиной гипогликемии является избыток инсулина по отношению к поступлению углеводов извне (с пищей) либо из эндогенных источников (продукция глюкозы печенью) и/или при ускорении их утилизации (при мышечной работе). Различают этиологические факторы гипогликемии, связанные с сахароснижающей терапией (передозировкой или изменениями фармакокинетики инсулина, ПСМ, меглитинидов, повышенной чувствительностью к инсулину) или питанием (пропуском приема пищи или недостаточным содержанием углеводов в рационе, приемом алкоголя, незапланированными физическими нагрузками без приема углеводов до и после нагрузки). Гипогликемия часто возникает внезапно, на фоне удовлетворительного самочувствия у пациентов, получающих сахароснижающую терапию. Вероятность гипогликемии особенно велика при интенсифицированной инсулинотерапии, что требует регулярного контроля содержания глюкозы в плазме крови.
Клинические проявления гипогликемии неспецифичны, представлены нейрогенными и нейрогликопеническими симптомами. Тахикардия, тремор, бледность, беспокойство, тревожность, повышенное потоотделение, чувство голода, парестезии (нейрогенные симптомы) связаны с компенсаторной активацией вегетативной нервной системы. Слабость, повышенная утомляемость, снижение концентрации внимания, головокружение, зрительные, речевые, поведенческие нарушения, нарушения координации движений, судороги, нарушения сознания обусловлены снижением поступления в центральную нервную систему основного энергетического субстрата - глюкозы. При гипогликемической коме кожные покровы влажные, тургор нормальный, дыхание ровное, неучащенное. Решающим в диагностике считают лабораторные исследования.
Легкую гипогликемию пациент способен купировать самостоятельно приемом 1-2 ХЕ простых углеводов (4-5 кусков сахара, предпочтительно растворенного в воде или чае, или 200 мл сладкого фруктового сока/сахаросодержащего газированного напитка). После купирования гипогликемии, вызванной действием пролонгированного инсулина, рекомендуют дополнительный прием 1 ХЕ медленноусвояемых углеводов (один кусок хлеба).
При нарушении сознания (тяжелой гипогликемии) или его отсутствии (гипогликемической коме) показано медикаментозное лечение. При тяжелой гипогликемии прием углеводов внутрь противопоказан из-за риска развития аспирации. Внутривенно струйно вводят 40-100 мл 40% раствора глюкозы до полного восстановления сознания. В домашних условиях рекомендуется подкожное или внутримышечное введение глюкагона в дозе 1 мг, сознание обычно восстанавливается через 5-10 мин. Глюкагон - антагонист инсулина, усиливает распад и тормозит синтез гликогена в печени, стимулирует образование глюкозы из аминокислот, повышает уровень сахара в крови. Глюкагон неэффективен при алкогольной гипогликемии и гипогликемии, вызванной передозировкой инсулина, ПСМ или меглитинидов. При отсутствии восстановления сознания после внутривенного струйного введения 40% глюкозы начинают внутривенное капельное введение 5-10% раствора глюкозы, которое может продолжаться до нормализации уровня гликемии у пациентов пожилого возраста, при нарушении функций почек, если гипогликемическая кома вызвана передозировкой пероральных сахароснижающих препаратов пролонгированного действия.
При отсутствии возможности измерить гликемию и уточнить причину потери сознания у больного СД необходимо внутривенно ввести 40100 мл 40% раствора глюкозы, что позволит вывести пациента из комы, если гипогликемия является причиной потери сознания, и не ухудшит состояние пациента, если кома вызвана другой причиной.
При своевременном купировании легкой гипогликемии прогноз благоприятный. При тяжелой гипогликемии прогноз определяется длительностью пребывания в коме и развитием осложнений.
ПРОГНОЗ
Прогноз СД 1-го типа зависит от возраста, в котором дебютировало заболевание: чем меньше возраст, тем короче продолжительность жизни. Доказана возможность поддержания компенсации углеводного обмена в течение жизни и предупреждения развития сосудистых осложнений.
При эффективной терапии СД 2-го типа прогноз для жизни больных относительно благоприятен. При неадекватном контроле гликемии возрастает риск микро- и макрососудистых осложнений. В исследовании UKPDS установлено значение достижения контроля гликемии для профилактики сосудистых осложнений у больных СД 2-го типа. Показано, что снижение HbA1c на 1% позволяет уменьшить:
• вероятность развития всех осложнений СД на 21%, микрососудистых осложнений - на 35%, инфаркта миокарда - на 18%, инсульта - на 15%;
• смертность, связанную с СД, - на 25%;
• общую смертность - на 25%.
ПРОФИЛАКТИКА
Единственная возможность снижения заболеваемости СД 1-го типа - первичная профилактика у лиц с высоким генетическим риском в целях предупреждения развития или замедления аутоиммунной реакции против собственных р-клеток. Однако, учитывая данные многочисленных исследований, свидетельствующих об отсутствии эффективных методов профилактики СД 1-го типа, Американская диабетологическая ассоциация не рекомендует проводить скрининг для выявления групп риска развития СД 1-го типа.
Результаты контролируемых исследований свидетельствуют о возможности предотвращения или отдаления развития СД 2-го типа у пациентов высокого риска при изменении образа жизни или медикаментозной терапии определенными лекарственными средствами. Профилактику СД 2-го типа следует проводить у лиц с избыточной массой тела и предиабетом. Этой группе пациентов показана регулярная физическая активность умеренной интенсивности (≥150 мин/нед), снижение массы тела (у лиц с ожирением - на 5-7% массы тела в год). Особое внимание уделяют изменению питания - снижению потребления жиров до 25% суточной калорийности рациона, употреблению пищи, богатой клетчаткой. В качестве лекарственных средств, способных предотвратить или отсрочить развитие СД 2-го типа у лиц с нарушенной толерантностью к глюкозе, рассматривают метформин, ингибиторы а-глюкозидаз (акарбозу), тиазолидиндионы (росиглитазон). Однако в настоящее время медикаментозную профилактику СД 2-го типа не рекомендуют для широкого использования.
Глава 64. МЕТАБОЛИЧЕСКИЙ СИНДРОМ
Термин «метаболический синдром X» был введен в клиническую практику в 1988 г. В широком смысле метаболическим синдромом допустимо обозначать различные сочетания факторов риска заболеваний ССС, однако к его обязательным компонентам относят:
• инсулинорезистентность и/или сахарный диабет 2-го типа;
• абдоминальное ожирение;
• артериальную гипертензию (АГ);
• дислипидемию - увеличение концентрации липопротеинов низкой плотности (ЛПНП) и триглицеридов при сниженном содержании липопротеинов высокой плотности (ЛПВП).
При метаболическом синдроме нередко наблюдают также нарушения обмена мочевой кислоты и синдром ночного апноэ.
ЭПИДЕМИОЛОГИЯ
Актуальность проблемы метаболического синдрома определяется значительным повышением риска атеросклероза и связанных с ним сердечно-сосудистых заболеваний (ИБС, поражений цереброваскулярных и других артерий), в том числе у молодых пациентов, а также тем, что распространенность метаболического синдрома в цивилизованных странах продолжает расти. Своевременное лечение метаболического синдрома позволяет не только предупредить сердечно-сосудистые осложнения, но и уменьшить выраженность некоторых метаболических нарушений и даже предотвратить их прогрессирование.
ЭТИОЛОГИЯ
Развитие метаболического синдрома обусловлено многими причинами. По-видимому, определенную роль играют наследственные факторы. Большое значение в развитии метаболического синдрома имеют факторы окружающей среды. Ведущими причинами служат недостаточная физическая активность и избыточное употребление углеводов и животных жиров.
ПАТОГЕНЕЗ
Инициирующие факторы развития метаболического синдрома - ожирение (особенно абдоминальное) и инсулинорезистентность.
• Роль инсулинорезистентности в формировании метаболического синдрома обосновывает концепция «экономного генотипа», предложенная в 1952 г. На ранних этапах формирования общества человек был вынужден выживать в условиях постоянного дефицита пищи. Инсулинорезистентность обеспечивала определенные преимущества, поскольку позволяла длительно избегать гипогликемии, в том числе за счет снижения утилизации глюкозы скелетными мышцами и стимуляции глюконеогенеза и липогенеза. Однако в настоящее время в условиях достаточного количества пищи и снижения физической активности инсулинорезистентность перестала быть механизмом адаптации, способствуя развитию ожирения, сахарного диабета 2-го типа и атеросклероза.
- Первоначальный ответ на инсулинорезистентность - гиперинсулинемия - в течение определенного времени позволяет поддерживать нормальную концентрацию глюкозы в крови благодаря усвоению глюкозы инсулинозависимыми тканями. Однако при нарастании инсулинорезистентности секреция инсулина оказывается недостаточной для поддержания должной утилизации глюкозы и развивается вначале преходящая гипергликемия, а затем и сахарный диабет 2-го типа.
- Развитие висцерального ожирения - в определенной степени также следствие инсулинорезистентности. Под действием избыточной концентрации инсулина усиливается активность 11-р-гидроксистероиддегидрогеназы, сопровождаемая увеличением образования кортизола. Одновременно возрастает экскреция кортизола с мочой. Эффекты этого гормона реализуются в первую очередь в жировой ткани: усиливаются дифференцировка адипоцитов, внутриклеточное накопление липидов, а также происходит перераспределение жировой ткани по верхнему типу с избыточным отложением ее в области сальника и брыжейки.
• Висцеральное ожирение способствует развитию других метаболических нарушений. Чувствительность висцеральной жировой ткани к стимуляторам липолиза (катехоламинам и липопротеинлипазе) выше, чем у подкожной жировой клетчатки. В связи с этим при висцеральном ожирении возрастает поступление свободных жирных кислот в кровь, активирующих глюконеогенез и продук-
цию глюкозы печенью (в результате которой возникает гипергликемия натощак), а также стимулирующих синтез триглицеридов и ЛПНП гепатоцитами. Кроме того, нарушается печеночный клиренс липопротеинов очень низкой плотности (ЛПОНП) со снижением образования ЛПВП. Ряд составляющих метаболического синдрома (гиперинсулинемия, гипергликемия, дислипидемия) участвуют в развитии дисфункции эндотелия, представляющей собой первое звено патогенеза атеросклероза, АГ. Кроме того, под действием инсулина в почках возникает задержка ионов натрия и воды, что способствует активации симпатической нервной системы и повышению АД. Инсулинорезистентность сопровождается активацией системы «ренин-ангиотензин-альдостерон» и увеличением концентрации эндотелина-1 в крови. Избыточное образование последнего приводит к снижению продукции оксида азота эндотелием, что ведет к активации свертывающей системы крови (преимущественно звена, связанного с эндотелием).
КЛИНИЧЕСКАЯ КАРТИНА
Клиническая картина складывается из проявлений нарушений, составляющих метаболический синдром, и симптомов поражения органовмишеней, обусловленных атеросклерозом сосудов. Особенностью ИБС и цереброваскулярных заболеваний при метаболическом синдроме служит возможность развития их осложненных форм у больных молодого возраста.
Начальные формы нарушения углеводного обмена обнаруживают на основании лабораторных тестов: оценки гликемического профиля, гликемии натощак, концентрации гликозилированного гемоглобина. В последнее время особое значение придают так называемой постпрандиальной гипергликемии, которую считают достоверным маркером выраженной инсулинорезистентности и/или сахарного диабета 2-го типа. Следует подчеркнуть, что в клинической картине сахарного диабета 2-го типа в рамках метаболического синдрома на первый план реже выступают проявления собственно диабета, а ведущее значение приобретают сосудистые осложнения.
Для диагностики висцерального ожирения определяют окружность талии. При подозрении на метаболический синдром этот показатель целесообразно определять и при нормальных величинах индекса массы тела. Отложения жировой ткани в брюшной полости могут быть выявлены с помощью КТ и МРТ.
АГ формируется у молодых пациентов, причем АД может достигать высоких значений при отсутствии типичных жалоб. Характерным признаком АГ в рамках метаболического синдрома служит отсутствие ночного снижения АД или даже его повышение в это время суток. Быстро развиваются гипертрофия левого желудочка, соответствующие изменения глазного дна. Особенно неблагоприятным считают сочетание АГ с сахарным диабетом. АГ при метаболическом синдроме труднее поддается контролю, и, как правило, для нормализации АД необходима комбинация антигипертензивных препаратов.
Дислипидемия обычно проявляется увеличением содержания общего холестерина в крови с одновременным повышением концентрации ЛПНП и ЛПОНП и снижением ЛПВП. Возможно развитие изолированного повышения концентрации триглицеридов. Как правило, эти нарушения не корригируются немедикаментозными методами лечения (диетой и др.).
Нарушения обмена мочевой кислоты часто наблюдают у больных с метаболическим синдромом. Их прогностическая значимость определяется развитием уратного тубулоинтерстициального нефрита, ранними маркерами которого служат гипоизостенурия и АГ. Мочевой синдром бывает выражен минимально или вообще отсутствует. Результаты ряда исследований свидетельствуют, что нарушения обмена мочевой кислоты связаны с увеличением риска сердечно-сосудистых осложнений. У больных с метаболическим синдромом необходимо диагностировать подобные нарушения еще на стадии гиперурикозурии и по возможности полностью исключать факторы, способствующие дальнейшему развитию болезни (алкоголь, пищевые продукты, содержащие большое количество пуриновых оснований). При развитии гиперурикемии появляются типичные атаки подагрического артрита.
Синдром ночного апноэ часто беспокоит больных с метаболическим синдромом.
• Выделяют факторы риска его возникновения:
- ожирение;
- пожилой возраст;
- мужской пол;
- менопауза;
- злоупотребление алкоголем и курение;
- негроидная раса.
• Синдром проявляется храпом, регистрируемыми эпизодами апноэ, немотивированной дневной сонливостью. Сон не приносит
отдыха. Пациент обычно страдает ожирением, АГ. В анамнезе, как правило, выявляют подобные нарушения у родственников, а сам больной ранее перенес тонзиллэктомию.
• Ночное апноэ имеет ряд неблагоприятных последствий: увеличивается риск развития ИБС, инсульта, ХСН, автокатастроф, профессиональных травм.
ДИАГНОСТИКА
Диагностика метаболического синдрома основана на выявлении соответствующих клинических и лабораторных изменений.
Диагностические критерии метаболического синдрома (Комитета экспертов Всероссийского научного общества кардиологов) приведены ниже.
• Основной признак - центральный (абдоминальный) тип ожирения:
- окружность талии (ОТ) более 80 см у женщин и более 94 см у мужчин.
• Дополнительные критерии:
- артериальная гипертензия (АД >130/85 мм рт.ст);
- повышение уровня триглицеридов (>1,7 ммоль/л);
- снижение уровня ХС ЛПВП (<1,0 ммоль/л у мужчин, <1,2 ммоль/л у женщин);
- повышение уровня ХС ЛПНП более 3,0 ммоль/л;
- гипергликемия натощак (уровень глюкозы в плазме крови натощак >6,1 ммоль/л);
- нарушение толерантности к глюкозе (уровень глюкозы в плазме крови через 2 ч после нагрузки глюкозой в пределах >7,8 и ≤11,1 ммоль/л).
Наличие у пациента центрального ожирения и 2 дополнительных критериев служит основанием для диагностирования у него метаболического синдрома.
Диагностика метаболического синдрома имеет ряд особенностей.
• Важно оценивать показатели углеводного и липидного обмена в динамике.
• Необходимо проводить суточное мониторирование АД и ЭКГ, особенно в амбулаторных условиях.
• Больным с метаболическим синдромом показано количественное определение микроальбуминурии в целях раннего обнаружения поражения почек (гипертонического нефросклероза, диабетической нефропатии).
• Для выявления гипертрофии левого желудочка и сократительной дисфункции миокарда целесообразно выполнение ЭхоКГ. Диагностика неалкогольного стеатогепатита основана на данных УЗИ брюшной полости и КТ (при которой также можно оценить выраженность отложений висцеральной жировой ткани).
ЛЕЧЕНИЕ
Ведение больных с метаболическим синдромом подразумевает, прежде всего, мониторинг выявленных факторов риска. Предупреждение их неблагоприятных эффектов возможно при своевременно начатой медикаментозной терапии с обязательной коррекцией образа жизни.
Немедикаментозное лечениея
Диету больных с метаболическим синдромом составляют с учетом ограничений, рекомендуемых пациентам с нарушениями углеводного обмена. Может быть рекомендована всем пациентам гиполипидемическая диета, за основу которой может быть принята так называемая средиземноморская диета - преобладание в рационе блюд, приготовленных на растительном (особенно оливковом) масле, овощей, фруктов, замена животного мяса птицей и морской рыбой. Показано ограничение потребления поваренной соли (вплоть до полного отказа от нее), а больным, предрасположенным к нарушениям обмена мочевой кислоты, назначают диету с низким содержанием пуринов.
Больным неалкогольным стеатогепатитом показана антигиперлипидемическая диета.
Медикаментозное лечениея
Основной принцип лекарственного лечения метаболического синдрома состоит в назначении ЛС, эффективно корректирующих хотя бы один из факторов риска и, по крайней мере, нейтральных в отношении других. Существуют препараты, благоприятно влияющие сразу на несколько факторов риска (например, ЛС для лечения ожирения - орлистат одновременно уменьшает инсулинорезистентность, дислипидемию и снижает АД). Главная задача терапии метаболического синдрома - предупреждение развития и прогрессирования поражения органовмишеней, прежде всего, сердечно-сосудистых осложнений.
• Целесообразна агрессивная тактика лечения нарушений углеводного обмена, в том числе и начальных форм. При гипергликемии показано назначение стимуляторов секреции инсулина - производных сульфонилмочевины (глибенкламида, глимепирида). Для
контроля постпрандиальной гипергликемии целесообразно использование короткодействующих агонистов сульфонилмочевинных рецепторов р-клеток поджелудочной железы (натеглинида). Чувствительность периферических тканей к инсулину повышает недавно внедренный в клиническую практику класс препаратов - инсулин-сенситайзеры (тиозолидиндионы).
• Лечение ожирения проводят по общим правилам (см. главу «Ожирение»). При метаболическом синдроме показано раннее назначение препаратов, влияющих на массу тела, особенно орлистата, с учетом его благоприятного влияния на углеводный и жировой обмен и величину АД.
• В целях коррекции АД используют, как правило, комбинацию препаратов.
- К препаратам первого ряда с точки зрения их органопротективных свойств относят ингибиторы АПФ - каптоприл, эналаприл, фозиноприл, периндоприл, абсолютно показанные больным сахарным диабетом 2-го типа.
- В последние годы продемонстрированы преимущества антагонистов рецепторов ангиотензина II (лозартана, валсартана, ирбесартана, эпросартана), заключающиеся не только в их положительном влиянии на сердечно-сосудистый и почечный прогноз, но и в благоприятном влиянии на обмен мочевой кислоты (оказывает мягкое урикозурическое действие).
- С учетом выраженности активации симпатической нервной системы при метаболическом синдроме может быть показано назначение селективных агонистов I1-имидазолиновых рецепторов (рилменидина, моксонидина).
- У больных, не страдающих застойной сердечной недостаточностью, оправдано назначение блокаторов медленных кальциевых каналов групп верапамила, дилтиазема. Препараты дигидропиридиновой группы, особенно короткодействующие, не показаны из-за их неопределенного влияния на прогноз таких больных.
- В связи с возможностью усугубления нарушений липидного и углеводного обмена β-адреноблокаторы не относят к препаратам выбора для лечения АГ при метаболическом синдроме. При склонности к тахиаритмиям и/или ИБС предпочтение следует отдавать кардиоселективным представителям этой группы (бисопрололу, метопрололу). Следует избегать препаратов с внутренней симпатомиметической активностью (пиндолола).
- Для лечения АГ при метаболическом синдроме крайне нежелательно применять диуретики, поскольку существует риск усиления или провокации нарушений обмена мочевой кислоты. Эти препараты целесообразно назначать только при выраженной гипертрофии левого желудочка или хронической сердечной недостаточности (предпочтительны тиазидоподобные диуретики в сочетании с ингибиторами АПФ). Необходимо контролировать уровень урикозурии и урикемии в динамике.
- Можно использовать фиксированные комбинации ЛС, например, сочетание верапамила с трандолаприлом. Подбор препаратов для комбинированной гипотензивной терапии проводят по общим правилам.
• Больных с метаболическим синдромом, как правило, относят к группе очень высокого риска сердечно-сосудистых осложнений, в связи с чем им показано назначение статинов (симвастатина, правастатина, ловастатина), особенно при дислипидемии. При изолированной гипертриглицеридемии возможно назначение фибратов (фенофибрата). Во время приема антигиперлипидемических препаратов обязательно проводят контроль активности АЛТ, АСТ и КФК. Нежелательно назначать НПВС и антибиотики группы макролидов, употреблять грейпфрутовый сок (содержит соединения, замедляющие скорость метаболизма ЛС в печени) и алкоголь в больших количествах. Комбинация статинов с фибратами опасна с точки зрения развития миопатического синдрома.
• Помимо диетических ограничений для лечения нарушений обмена мочевой кислоты при метаболическом синдроме используют и ЛС. При стойкой гиперурикемии целесообразно назначить прием аллопуринола.
• У больных неалкогольным стеатогепатитом обратное развитие печеночного процесса наблюдают при успешном лечении ожирения и дислипидемии. При синдроме холестаза показаны препараты урсодезоксихолевой кислоты.
Хирургическое лечение
Лечение синдрома обструктивного ночного апноэ осуществляют с использованием аппаратов, создающих постоянное положительное давление в воздухоносных путях. Кроме того, используют механические устройства, фиксирующие нижнюю челюсть, язык и мягкое нёбо и тем самым препятствующие спадению голосовой щели. Наличие более
20 эпизодов апноэ в течение часа служит относительным показанием к хирургическому лечению. Наиболее распространенный способ вмешательства - увулопалатофарингеопластика почти всегда сопровождается прекращением храпа, но не приводит к полному исчезновению эпизодов апноэ.
ПРОГНОЗ
Без коррекции факторов риска прогноз при метаболическом синдроме неблагоприятен и определяется преимущественно сердечнососудистыми осложнениями, а также поражением почек (при сахарном диабете 2-го типа, выраженной АГ, высокой гиперурикемии). Ниже перечислены маркеры неблагоприятного прогноза.
• Неконтролируемая АГ.
• Гипертрофия левого желудочка и/или эхокардиографические признаки нарушения его сократимости. Любые осложненные варианты поражения органов-мишеней в анамнезе (например, инфаркт миокарда).
• Микроальбуминурия.
• Некомпенсированный сахарный диабет 2-го типа.
• Диабетическая нефропатия с протеинурией, ишемическая болезнь почек, почечная недостаточность.
• Признаки атеросклеротического поражения сосудов любой локализации, особенно диагностируемые в возрасте до 50 лет.
• Снижение скорости клубочковой фильтрации менее 60 мл/мин.
• Синдром обструктивного ночного апноэ.
Глава 65. ОЖИРЕНИЕ
Ожирение - заболевание, характеризующееся увеличением массы тела из-за избыточного количества жировой ткани. По данным ВОЗ, в 1995 г. в мире избыточную массу тела имели 200 млн взрослых. В течение последующих 5 лет их число возросло до 300 млн. Ожидается, что в ближайшие десятилетия XXI в. распространенность ожирения будет продолжать расти.
ЭТИОЛОГИЯ
У большинства больных ожирением выделить единственную причину заболевания не представляется возможным. Большое значение имеют 2 фактора:
• снижение физической активности;
• неадекватное питание.
В современном обществе продолжает снижаться физическая активность человека. В развитых странах ожирение чаще наблюдают у людей, находящихся в неблагоприятных экономических условиях. Этот факт указывает на вклад неадекватного пищевого рациона в развитие ожирения, поскольку именно эта часть населения питается наиболее дешевыми продуктами, содержащими преимущественно углеводы и небольшое количество животных белков. Вместе с тем в рационе всех слоев населения отмечают преобладание пищевых продуктов, содержащих высококалорийные рафинированные углеводы. Кроме того, постоянная реклама пищевых продуктов неизбежно сопровождается их избыточным потреблением, представляющим собой одну из самых распространенных форм реакции на психоэмоциональный стресс в развитых странах. В связи с этим эпидемия ожирения во многом обусловлена характером жизни современного человека.
Роль генетических факторов в развитии ожирения, по-видимому, существенна, хотя моногенные формы этого заболевания составляют не более 2% всех случаев. Ожирение - один из критериев диагноза некоторых наследственных эндокринопатий:
• синдрома Прадера-Вилли (сочетание мышечной гипотонии, гипогонадизма, ожирения, умственной отсталости);
• синдрома Альстрема (пигментная дегенерация сетчатки, прогрессирующее ухудшение зрения и слуха, ожирение);
• синдрома Барде-Бидля (комбинация ожирения, гипогонадизма, пигментной дегенерации сетчатки, полидактилии и умственной отсталости);
• синдрома Коэна (ожирение, мышечная гипотония, умственная отсталость, гипермобильность и деформации крупных суставов, аномалии глаз).
ПАТОГЕНЕЗ
Современные представления о патогенезе ожирения связаны с пониманием эндокринной функции жировой ткани.
Жировая ткань секретирует определенный набор биологически активных веществ, участвующих в регуляции пищевого поведения и метаболизма отдельных веществ. Избыточная секреция этих гормонов и/или резистентность к ним во многом определяют развитие неблагоприятных последствий ожирения.
• Лептин представляет собой один из основных гормонов жировой ткани. Этот гормон кодируется геном ОB, локус 7q31.3. Существует суточный ритм секреции лептина: его наибольшую концентрацию в крови отмечают в ночное время и через 2-3 ч после приема пищи. Отмечено, что выделение лептина в кровь в большей степени снижается под влиянием тестостерона, чем эстрогенов, поэтому концентрация этого гормона в крови у женщин в среднем на 40% больше, чем у мужчин. Лептин играет ключевую роль в энергетическом обмене: по содержанию этого гормона ЦНС оценивает количество жировой ткани в организме. Лептин взаимодействует со специфическими рецепторами в гипоталамусе, что приводит к подавлению нейропептидов, усиливающих аппетит, и стимуляции синтеза нескольких анорексигенных факторов.
- У больных ожирением отмечают относительное повышение концентрации лептина, которое не сопровождается развитием ожидаемого эффекта (снижением потребления пищи и увеличением затрат энергии), что может указывать на наличие резистентности к гормону.
- Гиперлептинемию особенно часто наблюдают при сочетании ожирения с инсулинорезистентностью и/или сахарным диабетом 2-го типа. По-видимому, сама по себе гиперлептинемия может приводить к развитию или нарастанию инсулинорезистентно-
сти. Среди других неблагоприятных последствий длительной гиперлептинемии особого внимания заслуживает хроническая гиперактивация симпатической нервной системы, участвующая в развитии многих осложнений ожирения, в том числе АГ.
• ФНО-α выделяется в большом количестве жировой тканью, как правило, при наличии инсулинорезистентности. Гиперсекреция ФНО-α сопровождается значительным снижением утилизации глюкозы жировой тканью. Кроме того, этот цитокин угнетает экспрессию гена липопротеинлипазы кишечника. Гиперсекреция ФНО-α, выявляемая у больных ожирением, стала основой для формирования представлений об этом заболевании как о провоспалительном состоянии. Однако эффективность АТ к ФНО-а в лечении ожирения, связанного с инсулинорезистентностью, в клинических исследованиях пока не доказана.
• ИЛ-6 - еще один медиатор воспаления, синтезируемый адипоцитами. Как и ФНО-α, ИЛ-6 тормозит активность липопротеинлипазы и усиливает термогенез. Высокая концентрация ИЛ-6 в крови пациентов с ожирением - еще один аргумент в пользу воспалительной составляющей в патогенезе ожирения. Следует подчеркнуть, что у больных ожирением выявляют повышенные концентрации маркеров системного воспаления, в том числе СРБ.
• Бурая жировая ткань - один из основных органов, участвующих в термогенезе. Именно в бурой жировой ткани происходит разобщение окисления органических веществ и синтеза АТФ, что сопровождается трансформацией энергии в тепло. Этот процесс осуществляется с помощью синтезируемых в жировой ткани митохондриальных разобщающих белков 1, 2 и 3-го типов.
- Разобщающий белок 1-го типа экспрессируется только в бурой жировой ткани, и подтверждений его участия в патогенезе ожирения не установлено.
- Экспрессия разобщающего белка 2-го типа обнаружена не только в бурой, но и в белой жировой ткани, а также в легких, печени и макрофагах. Этот пептид участвует не только собственно в термогенезе, но и в формировании воспалительного ответа и развитии лихорадки при инфекционных заболеваниях. Одна из основных локализаций разобщающего белка 2-го типа - висцеральная жировая ткань, расположенная в брюшной полости. Показано, что у больных ожирением его экспрессия существенно меньше по сравнению со здоровыми лицами. Возможно, его
недостаточность играет существенную роль в патогенезе ожирения, в том числе висцерального, из-за значительного снижения мобилизации энергетических веществ из жировой ткани. Нельзя исключать, что при ожирении могут наблюдаться мутации гена разобщающего белка 2-го типа. - Значение разобщающего белка 3-го типа в развитии ожирения не установлено. По своему химическому составу этот протеин занимает промежуточное положение между двумя другими представителями этого семейства.
• Спектр гормонов, продуцируемых жировой тканью и, возможно, участвующих в патогенезе ожирения, постоянно расширяется. Недавно у мышей был идентифицирован еще один гормон, синтезируемый адипоцитами, - резистин. Полагают, что он служит медиатором инсулинорезистентности.
Перспективы изучения гормональной функции жировой ткани связаны с возможностью детального уточнения механизмов развития ожирения и, следовательно, разработки специфических терапевтических стратегий (например, ЛС, увеличивающих чувствительность клеток к лептину, или блокаторов этого вещества).
КЛАССИФИКАЦИЯ
Существует несколько классификаций ожирения.
• Чаще всего используют классификацию ожирения ВОЗ, основанную на определении индекса массы тела - отношения массы тела (кг) к возведенному в квадрат росту (м2) (табл. 65-1).
• Предложены классификации ожирения, основанные на этиологическом и патогенетическом принципах.
• Кроме того, в клинической оценке ожирения большое значение имеет определение типа распределения жировой ткани. Висцеральное (абдоминальное) ожирение диагностируют, если величина окружности талии превосходит соответственно 94 см у мужчин и 80 см у женщин. Констатировать абдоминальное ожирение допустимо и при нормальном значении индекса массы тела. Предложенное ранее отношение окружности талии к окружности бедер в настоящее время не используют. Висцеральный тип ожирения, как правило, связан с инсулинорезистентностью, сахарным диабетом 2-го типа, АГ, дислипидемией и нарушениями обмена мочевой кислоты. У больных с висцеральным типом ожирения значительно выше риск развития заболеваний ССС и смерти от других причин.
Таблица 65-1. Классификация ожирения (ВОЗ, 1997)
В настоящее время особое значение придают абдоминальному ожирению, характеризуемому отложением гормонально-активной жировой ткани в брыжейке и на передней брюшной стенке. Его считают первым этапом развития метаболического синдрома. (см. главу «Метаболический синдром»).
Абдоминальное ожирение - прогностически наиболее неблагоприятный тип ожирения, сопряженный со значительным повышением риска развития сердечно-сосудистых осложнений, хронических заболеваний почек и некоторых злокачественных опухолей (рака тела матки, рака простаты, рака молочной железы, рака толстой кишки). Абдоминальное ожирение может быть диагностировано и при нормальном индексе массы тела.
Абдоминальное ожирение - основной диагностический критерий метаболического синдрома - диагностируют при увеличении окружности талии более 80 см у женщин и более 94 см у мужчин.
КЛИНИЧЕСКАЯ КАРТИНА
В клинической оценке больного ожирением сохраняет свое значение сбор анамнеза. Принципиально важно выяснить наличие ожирения и других метаболических нарушений (в том числе сахарного диабета 2-го типа и подагры), а также сердечно-сосудистых заболеваний у родственников пациента. Необходимо уточнить, с какого возраста у больного избыточная масса тела или ожирение, динамику заболевания в течение жизни и ее связь с образом жизни (характером питания, физической активностью, профессией).
При обследовании больного ожирением необходимо диагностировать сопутствующие сердечно-сосудистые факторы риска, в том числе
АГ, дислипидемию и нарушения углеводного обмена. Для их раннего выявления целесообразно использовать разнообразные методы мониторинга (исследование суточного профиля гликемии, суточное мониторирование АД).
Распознавание ожирения основано на оценке соответствующих антропометрических данных - индекса массы тела и окружности талии. Использование величины массы тела для диагностики ожирения некорректно и может применяться лишь для оценки эффективности проводимого лечения.
Существуют инструментальные методы определения количества жировой ткани в организме (например, рентгеновская абсорбциометрия), однако использовать их в рутинной клинической практике трудно. Для оценки количества висцерального жира применяют КТ и МРТ.
ЛЕЧЕНИЕ
Задача терапии ожирения заключается не только в снижении массы тела и поддержании ее на целевом уровне, но и в уменьшении риска осложнений, что может быть достигнуто при комплексном воздействии на все факторы риска (АГ, дислипидемию, инсулинорезистентность). В связи с тем что ожирение - одно из связующих звеньев между сердечно-сосудистыми факторами риска, сама по себе коррекция массы тела сопровождается рядом благоприятных последствий. Очевидно, что наибольшая польза может быть достигнута при нормализации индекса массы тела. Однако на практике нередко приходится рассчитывать лишь на стабилизацию или постепенное незначительное уменьшение этого показателя. В качестве первоначальной цели рекомендуют снижать массу тела примерно на 10% в течение 6 мес. Если эта цель достигнута, то можно обсуждать возможность дальнейшего снижения массы тела.
Немедикаментозное лечение
Основой лечения ожирения остаются низкокалорийная диета и физические нагрузки.
• Установлено, что снижение калорийности пищи до 800-1500 ккал/ сут приводит к уменьшению массы тела в среднем на 8% за 6 мес. Больным с умеренным ожирением (индексом массы тела <35 кг/м2) достаточно снизить калорийность рациона на 300-500 ккал/сут, в то время как в более тяжелых случаях ее необходимо снижать на 500-1000 ккал/сут. В последнем случае пациент теряет около 0,51 кг в неделю. Существуют также очень низкокалорийные диеты, когда калорийность рациона снижают до 250-800 ккал/сут. Такую
диету обычно назначают на более короткий срок, например на 3-4 мес, после чего больные переходят на низкокалорийную диету. Целесообразность такого подхода к лечению ожирения подвергается сомнению, поскольку на 1-м этапе лечения (в активную фазу) пациентам на самом деле удается добиться большего снижения массы тела, чем на фоне низкокалорийной диеты, однако последующая прибавка массы тела у них также оказывается более значительной. Следует также учитывать, что низкокалорийная диета повышает риск развития желчнокаменной болезни и может привести к развитию синдрома недостаточного питания.
• Важный компонент лечения ожирения - физическая активность, она усиливает эффект диетотерапии и сама по себе снижает риск сердечно-сосудистых осложнений. Подбирать уровень физических нагрузок следует индивидуально с учетом возраста больного, уровня его тренированности, наличия сопутствующих заболеваний. Желаемого результата можно добиться путем интенсивных, но коротких физических упражнений или, наоборот, менее интенсивных, но более продолжительных нагрузок. Всем больным ожирением рекомендуют ходьбу по 30-45 мин (или более) в сутки, по крайней мере, 5 дней в неделю. После достижения намеченной массы тела очень важно сохранять полученный эффект. С этой целью пациенты должны продолжать соблюдать диету (энергетическая ценность ее может быть увеличена) и выполнять физические упражнения, так как в противном случае масса тела вновь повышается. Критерий эффективного лечения ожирения - сохранение достигнутой массы тела или ее прибавка менее чем на 3 кг в течение 2 лет и устойчивое снижение окружности талии, по крайней мере, на 4 см.
Низкая эффективность немедикаментозного лечения ожирения, в том числе диетотерапии, связана, прежде всего, со сниженной приверженностью пациентов к этим методам. Кроме того, эффекты от использования этих методов проявляются только при их длительном применении и обычно оказываются меньше по сравнению с ожидаемыми самими больными результатами.
Медикаментозное лечение
ЛС, используемые для лечения ожирения, подразделяют на 2 основные группы:
• препараты, подавляющие аппетит и/или усиливающие чувство насыщения (аноректики);
• средства, уменьшающие абсорбцию питательных веществ в кишечнике.
Эти препараты применяют одновременно с низкокалорийной диетой и достаточной физической активностью. Большинство ЛС оказывают существенное влияние на массу тела только при продолжительном приеме.
Лекарственные средства, подавляющие аппетит. Действие аноректических ЛС основано на увеличении времени действия угнетающих аппетит нейротрансмиттеров в ЦНС.
• Препараты, влияющие на норадренергические механизмы, разрешены к использованию в большинстве стран в виде коротких (≤12 нед) курсов. Снижение массы тела при их приеме составляет от 2 до 10 кг. К побочным эффектам этих ЛС относят бессонницу, сухость слизистых оболочек, запор, тахикардию и повышение АД. При длительном применении возможно развитие привыкания и зависимости (особенно у амфетаминов, в настоящее время не рекомендуемых для лечения ожирения). Один из представителей этого класса препаратов, фенилпропаноламин, в США был изъят из продажи в связи с установленным ростом частоты геморрагического инсульта на фоне его приема у женщин. Описаны нежелательные лекарственные взаимодействия с ингибиторами моноаминоксидазы, трициклическими антидепрессантами и алкоголем. В связи с сомнительной безопасностью норадренергические агенты не относят к числу препаратов первого ряда в лечении ожирения.
• Препараты, усиливающие высвобождение серотонина или блокирующие его нейрональный захват, в настоящее время не используют для лечения ожирения. Представители этого класса применялись в конце 70-х гг. XX в., однако уже спустя первые 5 лет после начала их назначения стали появляться данные об увеличении частоты клапанных пороков сердца и первичной легочной гипертензии, развивавшихся на фоне их приема.
• Препараты с комбинированным действием (ингибиторы обратного нейронального захвата норадреналина и серотонина) не усиливают высвобождение серотонина, в связи с чем не считаются опасными с точки зрения развития поражений легочно-сосудистого русла и клапанного аппарата сердца. Сибутрамин - представитель этой группы, разрешенный для длительного применения. Уже в течение первых 6 мес приема сибутрамина возникает снижение массы тела на 5-8%. Препарат назначают в дозе 5-15 мг/сут. Самые частые
побочные эффекты, обусловливающие уменьшение дозы или отмену препарата у 5% пациентов, - АГ и тахикардия. Комбинация сибутрамина с любыми другими препаратами, действующими на ЦНС (в том числе седативными средствами и антидепрессантами), нежелательна. Препарат противопоказан при ХПН, хронических заболеваниях печени с синдромом печеночно-клеточной недостаточности, закрытоугольной форме глаукомы, тяжелой ИБС, АГ, ХСН, а также лицам, ранее злоупотреблявшим психоактивными веществами.
Препараты, уменьшающие абсорбцию питательных веществ в кишечнике. К этой группе ЛС относят селективный блокатор желудочной и панкреатической липазы - орлистат. Орлистат препятствует гидролизу пищевых жиров (триглицеридов) на свободные жирные кислоты и моноацилглицерол в просвете кишки, тем самым снижая их всасывание. Сам препарат практически не всасывается и в связи с этим не оказывает системного действия. Орлистат целесообразно принимать длительно. В течение первого года масса тела уменьшается в среднем на 9%. ЛС уменьшает выраженность прибавки массы тела после окончания терапии. Продемонстрировано благоприятное влияние орлистата на дислипидемию, АД и инсулинорезистентность. Из побочных эффектов отмечают стеаторею и диарею. Их выраженность может быть снижена при исключении из пищевого рациона животных жиров. Кроме того, у пациентов, склонных к гиповитаминозам, орлистат может провоцировать дефицит витамина D, компенсируемый назначением витаминных препаратов.
В настоящее время результаты экспериментальных и клинических исследований обосновали использование для лечения ожирения нового класса препаратов - блокаторов GB1-эндоканнабиоидных рецепторов (стимуляция их сопровождается активацией пищевого поведения и адипогенеза). Вместе с тем пока остается противоречивым влияние этих препаратов, в частности римонабанта, на долгосрочный прогноз больных.
Эффективность и безопасность прочих средств, используемых для лечения ожирения, в том числе травяных сборов, в состав которых входят растения, содержащие аналоги эфедрина, в контролируемых клинических исследованиях не изучались, в связи с чем рекомендовать их для применения в клинической практике не следует.
Продолжают изучать агонисты β3-адренорецепторов жировой ткани в лечении ожирения. При назначении этих препаратов значительно возрастает интенсивность процессов липолиза. Показано, что агонисты
β3-адренорецепторов не оказывают существенного влияния на АД, показатели углеводного и липидного обмена, однако могут вызывать тремор.
Больных ожирением следует настойчиво предостерегать от применения средств нетрадиционной медицины, в том числе восточной: как правило, они не приводят к желаемому снижению массы тела, но обусловливают развитие опасных для жизни нежелательных явлений.
В целом ожирение остается одной из актуальных проблем современной медицины. Эффективность существующих ЛС, предназначенных для снижения массы тела, ограничена. Тем не менее уже в ближайшие годы можно ожидать расширения спектра препаратов, которые могут быть использованы для лечения ожирения.
Хирургическое лечение
Продолжают развиваться хирургические методы лечения ожирения, заключающиеся в удалении (или изоляции) части тонкой кишки в целях уменьшения абсорбции питательных веществ и ускорения пассажа пищи по кишечнику. Также применяют вертикальную гастропластику с формированием так называемого малого желудка. В результате подобных операций пациенты теряют до 20-30 кг, однако отдаленные последствия их остаются неясными. Известно, что после подобных хирургических вмешательств существенно изменяется секреция желудочно-кишечных гормонов, что сопровождается развитием выраженного синдрома недостаточного питания и нередко инвалидизацией больных. В связи с этим показания к хирургическим методам лечения ожирения в настоящее время ограничены показателем индекса массы тела, превышающим нормальный более чем в 2 раза, и резистентностью ко всем другим видам лечения. Хирургические вмешательства проводят, как правило, только у молодых пациентов, социально адаптированных и не страдающих психическими заболеваниями.
ТЕЧЕНИЕ И ПРОГНОЗ
Ожирение значительно увеличивает риск опасных для жизни осложнений. У лиц с индексом массы тела более 30 кг/м2 наблюдают достоверное увеличение общей, но особенно сердечно-сосудистой смертности (в 1,5-2 раза) по сравнению с людьми с нормальной массой тела. Ожирение повышает риск осложнений во время беременности, нарушений менструального цикла, гирсутизма, депрессии и, возможно, других состояний (например, обсуждается роль ожирения в развитии бронхиальной астмы). Для оценки риска осложнений определяют индекс массы тела и окружность талии. Кроме того, следует учитывать наличие сопут-
ствующих заболеваний и других факторов риска. Сочетание нескольких факторов риска (например, курения и сахарного диабета 2-го типа) значительно повышает риск осложнений даже при умеренно выраженном ожирении. С точки зрения прогноза более неблагоприятным считают висцеральное ожирение.
Ниже перечислены заболевания, развитию которых способствует ожирение.
• В эпидемиологических исследованиях продемонстрирована положительная корреляция между избыточной массой тела и АГ. Полагают, что в основе связи между ожирением и АГ лежат избыточная задержка ионов натрия, гиперактивация симпатической нервной и ренин-ангиотензиновой систем, а также инсулинорезистентность. Частота АГ у мужчин и женщин с индексом массы тела более 30 кг/м2 достигает 30-40%.
• Ожирение (особенно абдоминальное) - один из главных факторов риска (или причина) сахарного диабета 2-го типа. На каждую единицу индекса массы тела (при индексе массы тела >22 кг/м2) относительный риск развития сахарного диабета увеличивается примерно на 25%. Следует отметить, что параллельно увеличению частоты ожирения в популяции отмечают значительное увеличение заболеваемости сахарным диабетом 2-го типа. Важную роль в развитии инсулинорезистентности и диабета 2-го типа играет сама жировая ткань, секретирующая ряд медиаторов, прямо способствующих развитию и поддерживающих инсулинорезистентность.
• Результаты многочисленных исследований в различных популяциях показали, что избыточная масса тела, ожирение и накопление висцерального жира сопровождаются повышением заболеваемости и смертности от ИБС. Увеличение риска нефатального инфаркта миокарда и смерти от ИБС отмечали как у мужчин, так и у женщин даже при умеренном увеличении индекса массы тела. В проспективных исследованиях доказано, что прибавка массы тела на 5-8 кг сопровождается увеличением риска инфаркта миокарда и смерти от ИБС на 25%. Связь между атеросклерозом коронарных артерий и ожирением в значительной мере опосредована факторами риска, с которыми часто сочетается избыточная масса тела (например, АГ и сахарным диабетом). Следует учитывать, что различные факторы риска обычно потенцируют действие друг друга, т.е. при наличии двух факторов суммарный риск может уве-
личиться не в 2, а в 4 раза и более. Большое значение в развитии атеросклероза придают нарушениям липидного спектра крови, особенно повышению концентрации ЛПНП. По данным эпидемиологических исследований, увеличение индекса массы тела с 20 до 30 кг/м2 сопровождается повышением уровня холестерина ЛПНП на 0,26-0,52 ммоль/л, что соответствует увеличению риска развития ИБС в течение 5-10 лет примерно на 10%. Кроме того, ожирение способствует повышению уровня триглицеридов и снижению ЛПВП. Все указанные изменения - доказанные факторы риска атеросклероза.
• Хроническая сердечная недостаточность часто осложняет выраженное ожирение и представляет собой основную причину смерти таких больных. По результатам Фремингемского исследования, увеличение индекса массы тела на единицу сопровождается ростом частоты ХСН на 5% у мужчин и на 7% у женщин. Наличие ожирения повышает вероятность развития клинически значимых нарушений сократимости миокарда в 2,12 раза у женщин и в 1,9 раза у мужчин. Причинами сердечной недостаточности у больных с избыточной массой тела могут быть АГ и ИБС, однако ожирение само вызывает структурные изменения сердца и нарушения его систолической и диастолической функций. В основе этих нарушений, по-видимому, лежат как первичные изменения миокарда, связанные с его жировой инфильтрацией, так и вторичные нарушения, возникающие в результате увеличения объема циркулирующей крови, сердечного выброса и активности нейрогуморальных систем.
• Как и в случае коронарного атеросклероза, важную роль в развитии инсульта у больных с избыточной массой тела играет АГ. Тем не менее результаты некоторых исследований свидетельствуют, что ожирение может быть независимым фактором риска цереброваскулярных нарушений. Следует отметить, что ожирение повышает риск ишемического, но не геморрагического инсульта.
• Увеличение массы тела сопровождается повышением риска образования камней в желчном пузыре в 2-2,5 раза.
• Ожирение значительно повышает риск развития остеоартрита, особенно у женщин. По данным исследования у близнецов (женщин среднего возраста), увеличение массы тела на 1 кг сопровождается повышением риска развития остеоартрита коленных суставов на 9-13%.
• Ожирение, особенно выраженное, может привести к развитию синдрома ночного апноэ.
• В ряде исследований продемонстрирована связь между ожирением и раком толстой кишки, предстательной железы, почек, а также молочных желез и эндометрия. Следует отметить, что риск рака молочной железы при ожирении или увеличении массы тела повышается только после менопаузы. Вероятно, это объясняется тем, что жировая ткань продуцирует эстрогены, которые вызывают повышение риска развития рака молочной железы у женщин в период постменопаузы.
Глава 66. ОСТЕОПОРОЗ
Остеопороз - системное поражение скелета, характеризуемое одновременным уменьшением количества минеральных и органических составляющих костной ткани. При этом снижаются плотность и прочность костной ткани, но ее структура, а также форма и размер костей могут определенное время оставаться неизмененными.
ЭПИДЕМИОЛОГИЯ
Остеопороз - медико-социальная проблема, поскольку распространенность связанных с ним переломов костей, приводящих к инвалидизации и иногда к смерти, растет. Наибольшее значение имеют переломы шейки бедренной кости, позвонков, костей запястья, тазовых костей, проксимального отдела плечевой кости, костей голени. Основной причиной, определяющей рост частоты переломов, связанных с остеопорозом, в развитых странах служит увеличение числа людей пожилого и старческого возраста.
• Переломы шейки бедренной кости - наиболее серьезное осложнение остеопороза, всегда требующее длительной госпитализации и применения дорогостоящих методов лечения. Риск этого вида переломов увеличивается с возрастом, что связано не только с уменьшением прочности костной ткани, но и с большой распространенностью падений в пожилом возрасте (причина почти 90% переломов этой локализации). Ожидают, что к 2050 г. распространенность переломов проксимального отдела бедренной кости увеличится более чем в 4,5 раза по сравнению с 1990 г. Около 20% пациентов с переломом шейки бедренной кости погибают в течение первого года. Непосредственными причинами смерти служат инфекционные осложнения (особенно пневмонии) и тромбоэмболия легочной артерии.
• Частота переломов позвонков также продолжает расти, хотя истинная распространенность их в связи с возможностью длительного бессимптомного течения остается неизвестной. Как правило,
под наблюдение врача попадают не более 30% всех пациентов с переломами позвонков, обусловленными остеопорозом.
ЭТИОЛОГИЯ
Остеопороз, как правило, бывает обусловлен несколькими факторами:
• особенностями питания;
• активностью некоторых гормонов, в частности эстрогенов;
• нарушениями фосфорно-кальциевого обмена.
Выделяют несколько групп причин вторичного остеопороза, возникающего при многих заболеваниях.
• Заболевания эндокринной системы:
- гипогонадизм:
о женский (гиперпролактинемия, гипоталамическая аменорея, недостаточность эндокринной функции яичников любого происхождения);
о мужской (первичный, вторичный);
- гипотиреоз;
- гиперпаратиреоз;
- дефицит соматотропного гормона.
• Прием ЛС (ГК, нефракционированный гепарин, противосудорожные препараты, цитостатики, препараты тироксина и лития, агонисты гонадотропин-рилизинг-гормона).
• Длительная иммобилизация.
• Злоупотребление алкоголем.
• Поражения костного мозга (множественная миелома, лейкозы и лимфомы, метастазы опухолей).
• Патология ЖКТ (состояние после субтотальной гастрэктомии, синдром мальабсорбции, длительно существующий синдром холестаза, дефицит лактазы).
• Заболевания соединительной ткани:
- наследственные болезни (синдром Марфана, незавершенный остеогенез, гомоцистеинурия, синдром Элерса-Данло);
- ревматоидный артрит.
• ХПН.
Существуют факторы риска переломов, обусловленных остеопорозом.
• Наибольшее значение имеют пожилой и старческий возраст, а также женский пол (в том числе преждевременная менопауза).
• Гипогонадизм - важный фактор риска остеопороза и связанных с ним переломов у женщин: у молодых - первичного или вторич-
ного характера (связанный с анорексией, хроническими заболеваниями, гиперпролактинемией, гинекологическими болезнями), у пожилых - обусловленный преждевременной менопаузой (индуцированной хирургическими вмешательствами, лучевой или химиотерапией). Не меньшее значение гипогонадизм как фактор риска переломов, обусловленных остеопорозом, имеет и у мужчин. Его причинами служат синдром Клайнфелтера, гипопитуитаризм, гиперпролактинемия и кастрация (например, оперативное вмешательство при раке предстательной железы).
• Среди факторов риска переломов, обусловленных остеопорозом, большое значение имеет прием различных ЛС, особенно ГК. Наибольшее уменьшение плотности костной ткани наблюдают в первые месяцы лечения: поражаются как кости осевого скелета, так и конечностей, однако в наибольшей степени страдают позвонки. Степень выраженности остеопороза, индуцированного ГК, существенно различается в зависимости от индивидуальных особенностей. Вместе с тем доказано, что чем больше доза ЛС, тем тяжелее остеопороз. Суточные дозы ГК, не превышающие 7,5 мг, по-видимому, не увеличивают риск остеопороза и переломов. Применение ингаляционных форм ГК также позволяет избежать развития остеопороза или, по крайней мере, уменьшить риск.
• Наличие хотя бы одного перелома, ассоциированного с остеопорозом, в анамнезе значительно повышает риск повторного перелома: вероятность перелома проксимального отдела бедренной кости почти в 2 раза выше у лиц, уже перенесших хотя бы один перелом шейки бедренной кости или позвонка. Имеются схожие данные о переломах других локализаций. Риск новых переломов особенно велик у пациентов, перенесших 2 перелома позвонков и более, так как вероятность новых переломов у них повышается в 12 раз.
• Наличие переломов, связанных с остеопорозом, у близких родственников также считают фактором риска. Риск переломов проксимального отдела бедренной кости почти в 2 раза выше у лиц, чьи родители переносили данный вид перелома.
• Длительная иммобилизация ведет к быстрому снижению минеральной плотности костной ткани и, следовательно, увеличивает риск переломов, связанных с остеопорозом.
• К факторам риска остеопороза и ассоциированных с ним переломов относят низкий индекс массы тела. Следует подчеркнуть, что в
пожилом и старческом возрасте снижение массы тела может быть обусловлено как недостаточным питанием, так и синдромом мальабсорбции различного происхождения, т.е. состояниями, сопровождающимися дефицитом ионов кальция и витамина D.
• Значение некоторых факторов риска остеопороза меняется с возрастом. Например, группа факторов, связанная с падениями (снижение остроты зрения, недостаточная двигательная активность, деменция), имеет существенно большее значение в пожилом возрасте. Кроме того, вероятность переломов, спровоцированных падением, значительно увеличивается при злоупотреблении алкоголем и приеме седативных и снотворных препаратов. У пожилых велик риск злоупотребления этими препаратами, что, в свою очередь, сопровождается заторможенностью с нарушением координации движений в ночное время.
• Из других факторов риска необходимо отметить следующие:
- курение;
- повышенную резорбцию костной ткани;
- принадлежность к европеоидной или монголоидной расе;
- нервно-мышечные заболевания.
ПАТОГЕНЕЗ
Субстратом остеопороза служит снижение минеральной плотности костной ткани. Патогенез остеопороза обусловлен двумя основными составляющими:
• ускоренной резорбцией костной ткани при недостаточном процессе костеобразования;
• значительным снижением интенсивности продукции компонентов костной ткани при неизмененной резорбции.
Считают, что эти механизмы сменяют друг друга по мере нарастания потери костной ткани. Остеопороз в трабекулярной костной ткани начинается раньше, чем в кортикальной.
В качестве ведущего фактора, индуцирующего остеопороз и способствующего его прогрессированию, рассматривают дефицит эстрогенов. Недостаток эстрогенов приводит к ускорению ремоделирования костной ткани, проявляющегося изменением ее строения (нарушением порядка упаковки трабекул). Кроме того, в условиях недостатка эстрогенов возникает существенное усиление дифференцировки и активации остеокластов.
Механизмы воздействия эстрогенов на процессы образования и лизиса костной ткани остаются не вполне ясными. Считают, что при недо-
статочности этих гормонов существенно повышается чувствительность остеобластов к факторам, способствующим трансформации их в остеокласт.
Один из основных медиаторов, препятствующих развитию остеопороза, - остеопротегенерин - представитель семейства растворимых рецепторов к ФНО-α. Активация и супрессия молекулярных медиаторов, регулирующих процессы резорбции костной ткани, происходят под действием системных факторов, например, паратиреоидного гормона, глюкокортикоидных гормонов. Преобладание медиаторов активации остеокластов и/или дефицит факторов их супрессии сопровождаются ускорением формирования остеопороза.
Снижение образования костной ткани может быть связано с уменьшением активности остеобластов, а также с дефицитом витамина D и ионов кальция (особенно при повышенной мобилизации последнего из костной ткани). Кроме того, недостаточность кальция нередко бывает связана со снижением его всасывания в кишечнике (например, при гиперпаратиреозе, синдроме мальабсорбции).
ДИАГНОСТИКА
Для оценки вероятности переломов, связанных с остеопорозом, используют величину минеральной плотности бедренной кости.
Показания к определению минеральной плотности костной ткани приведены ниже.
• Все женщины в возрасте 65 лет и старше (независимо от наличия факторов риска) и женщины моложе 65 лет в период постменопаузы, у которых есть еще хотя бы один (помимо менопаузы) фактор риска перелома, обусловленного остеопорозом.
• Женщины, у которых отмечался перелом кости в период постменопаузы.
• Женщины, у которых обсуждаются показания к терапии остеопороза, если результат может повлиять на решение.
Кроме того, проведение данного исследования оправдано:
• при рентгенологических признаках остеопении и/или деформации позвонков;
• наличии переломов в анамнезе (особенно позвонков или костей запястья), развитие которых можно связать со снижением прочности костной ткани;
• снижении роста, кифозе грудного отдела позвоночника (после рентгенологического подтверждения деформаций позвонков).
Инструментальное измерение минеральной плотности костной ткани целесообразно проводить в тех случаях, когда результаты исследования могут повлиять на тактику ведения пациентов, в частности, стать аргументом для начала лекарственной терапии. В тех случаях, когда выявлены несколько факторов риска остеопороза, учитывая высокую вероятность его развития, лечение оправдано и без специальных исследований.
Индивидуальные значения минеральной плотности костной ткани у пациента сравнивают с должными величинами данного показателя с учетом возраста и пола (индекс Z) и/или идеальными показателями у взрослых людей того же пола (индекс T). Различие в показателе, полученном у пациента, и нормальными величинами показателя выражают в виде стандартного отклонения (SD - Standart Deviation). В процентном отношении величина, равная одному стандартному отклонению, обычно не превышает 10-12%. Интерпретацию показателя минеральной плотности бедренной кости осуществляют по специальной схеме (табл. 66-1).
Таблица 66-1. Интерпретация показателя минеральной плотности костной ткани
Основной метод, используемый для определения минеральной плотности костной ткани, - двойная рентгеновская абсорбциометрия. Чувствительность и специфичность этого метода превышают 90%. Достоверность результатов двойной рентгеновской абсорбциометрии уменьшается при выраженном снижении минерализации костной ткани (остеомаляции при недостаточном питании, остеоартрите).
Для оценки состояния костной системы используют также другие методы исследования.
• УЗИ костной ткани. Метод не позволяет достоверно диагностировать остеопороз, особенно на ранних стадиях, однако позволяет
получить определенную информацию о структуре (а не только минеральной плотности) костей. В связи с этим УЗИ костной ткани рекомендуют выполнять для получения дополнительной информации в целях оценки риска перелома, особенно конкретной локализации.
• КТ. Обладает высокой информативностью в оценке состояния костей любой локализации. Однако результаты ее сложны для количественной интерпретации, поскольку способы оценки минеральной плотности костной ткани с помощью КТ пока не разработаны. КТ может быть использована для оценки результатов терапии остеопороза.
• Рентгенография костей. Несмотря на недостаточную информативность, остается скрининговым методом диагностики остеопороза. В настоящее время существуют специальные способы анализа рентгенограмм костей, позволяющие более достоверно оценить выраженность резорбции костной ткани.
• Определение концентрации тиреотропного и паратиреоидного гормонов, кортизола, уровня витамина D в сыворотке крови. В некоторых случаях назначают для уточнения происхождения остеопороза. Относительно специфичным биохимическим маркером повышенной резорбции костной ткани считают гидроксипролин.
ЛЕЧЕНИЕ
Лечение остеопороза делят на немедикаментозное и лекарственное. Некоторые немедикаментозные методы следует рекомендовать здоровым людям с целью первичной профилактики остеопороза.
Немедикаментозное лечение
Для сохранения минеральной плотности костной ткани необходимо достаточное содержание ионов кальция и витамина D в пищевом рационе.
• Рекомендованная величина потребления ионов кальция составляет 1200 мг/сут. Основным источником кальция служат молочные продукты. При недостаточном количестве кальция в пище целесообразно назначить препараты кальция.
• При наличии риска дефицита витамина D (например, у пожилых и/или лиц, страдающих хроническими заболеваниями) рекомендуемая доза в суточном рационе составляют 400-800 ME. Источники витамина D - молоко, яичные желтки, морская рыба. Этот витамин входит в состав большинства поливитаминных препаратов.
Для первичной профилактики остеопороза целесообразны регулярные физические нагрузки (ходьба, бег, танцы, теннис), способствующие увеличению мышечной силы и минеральной плотности костной ткани. Кроме того, благоприятное влияние на минеральную плотность оказывает отказ от курения.
Медикаментозное лечение
Лекарственное лечение остеопороза начинают при снижении минеральной плотности костной ткани на 2 SD и более от нормы при отсутствии факторов риска и на 1,5 SD ниже нормы при наличии факторов риска. У женщин старше 70 лет с множественными факторами риска лечение оправдано и без измерения минеральной плотности костной ткани.
• Наибольшей эффективностью в предупреждении переломов, обусловленных остеопорозом, у женщин обладает гормональная заместительная терапия с использованием эстрогенов и прогестинов. Однако длительный прием этих препаратов может сопровождаться рядом нежелательных явлений. В связи с этим назначение гормональной заместительной терапии для лечения остеопороза следует обсуждать только у пациенток с высоким риском переломов.
• Селективные модуляторы рецепторов эстрогенов (ралоксифен) тормозят резорбцию костной ткани. Показано, что эти препараты также снижают частоту рака молочной железы. Однако терапия ралоксифеном сопровождается увеличением риска тромбоэмболических осложнений, а также частоты приливов.
• Возможной альтернативой гормональной заместительной терапии служат бисфосфонаты (например, алендроновая кислота), эффективно предупреждающие остеопороз, в том числе у женщин в период постменопаузы. Лечебные дозы бисфосфонатов в 2 раза выше, чем профилактические. При приеме этих препаратов возможны нарушения работы желудочно-кишечного тракта. В настоящее время бисфосфонаты считают препаратами выбора в лечении остеопороза. Их эффективность в профилактике остеопоретических переломов была убедительно доказана в длительных плацебо-контролируемых клинических исследованиях. В клинической практике чаще всего применяют алендронат♠, который назначают внутрь 1 раз в неделю или месяц. Другой препарат этой группы - золедроновую кислоту - вводят внутривенно 1 раз в год (!).
• Риск переломов, обусловленных остеопорозом, существенно снижается при длительном применении кальцитонина. Этот препарат назначают интраназально в виде спрея раз в сутки. Синтетический кальцитонин лосося рассматривают в качестве альтернативы гормональной заместительной терапии и алендронату♠.
• Для лечения остеопороза также используют натрия фторид, кальцитриол и витамин K. Однако убедительного влияния этих препаратов на риск переломов, связанных с остеопорозом, пока не установлено. Терапию остеопороза проводят длительно, зачастую пожизненно. Наиболее действенным методом контроля эффективности лечения служит повторное определение минеральной плотности костной ткани.