Внутренние болезни: учебник: в 2 т. / под ред. В.С. Моисеева, А.И. Мартынова, Н.А. Мухина. - 3-е изд., испр. и доп. - 2013. - Т.2. - 896 с.: ил.
|
|
|
|
ЧАСТЬ VII. ЗАБОЛЕВАНИЯ ЭНДОКРИННОЙ СИСТЕМЫ
Глава 58. БОЛЕЗНИ ГИПОФИЗА И ГИПОТАЛАМО-ГИПОФИЗАРНОЙ ОБЛАСТИ
Физиология гипофиза и гипоталамуса
Гипофиз вместе с гипоталамусом осуществляют координацию большого числа жизненно важных эндокринных функций и обеспечивают связь между нервной и эндокринной системами. Гипоталамус - конечный общий путь, через который сигналы из различных отделов центральной нервной системы достигают гипофиза и регулируют, таким образом, работу периферических эндокринных желез. Гипофиз и гипоталамус контролируют рост, секрецию гормонов надпочечниками, половыми железами, щитовидной железой (ЩЖ), участвуют в выработке молока и регуляции концентрации воды в организме. Кроме того, гипоталамусу свойственны неэндокринные функции, связанные с контролем:
• аппетита;
• температуры тела;
• автономной нервной системы;
• поведенческих реакций.
Гипоталамус расположен между перекрестом зрительных нервов (спереди) и сосцевидными тельцами (сзади), сверху гипоталамус отделен от таламуса бороздой III желудочка. Основные анатомические структуры гипоталамуса - ядра и срединное возвышение. Нейроэндокринные клетки представлены в основном в ядрах гипоталамуса. Срединное возвышение - специальная область гипоталамуса, образующая дно III желудочка, продолжается вниз и формирует ножку гипофиза. Морфологически срединное возвышение представляет собой главным
образом совокупность сосудов и нервов, обеспечивающих функциональную связь между гипоталамусом и гипофизом.
Гипофиз находится в основании черепа, в полости основной кости (турецком седле), состоит из передней (аденогипофиз) и задней (нейрогипофиз) долей. Промежуточная доля у человека отсутствует. Масса гипофиза взрослого человека составляет в среднем 600 мг, несколько больше у женщин, чем у мужчин. Во время беременности масса передней доли гипофиза может увеличиваться вдвое. От мозга гипофиз отделяет вырост твердой мозговой оболочки - диафрагма турецкого седла. К турецкому седлу тесно прилегают важные сосудистые и нервные структуры: кавернозные синусы, черепные нервы и перекрест зрительных нервов. В связи с этим заболевания гипофиза, сопровождаемые его увеличением, помимо дисфункции эндокринных органов, могут вызывать нарушение полей зрения, поражение черепных нервов и распространяться в кавернозные синусы.
В нейроэндокринных клетках гипоталамуса образуются различные гормоны и пептиды. Среди них выделяют гипофизотропные гормоны:
• гормон роста-рилизинг-гормон (ГРРГ);
• соматостатин;
• гонадотропин-рилизинг-гормон;
• допамин;
• тиротропин-рилизинг-гормон (ТРГ);
• кортикотропин-рилизинг-гормон и родственные ему пептиды. Последние достигают передней доли гипофиза по сосудам срединного
возвышения и портальной сосудистой системе, расположенной в ножке гипофиза, и регулируют секрецию аденогипофизарных гормонов.
В передней доле гипофиза образуются 6 основных гормонов
(табл. 58-1):
• пролактин;
• гормон роста (ГР);
• адренокортикотропный гормон (АКТГ);
• лютеинизирующий гормон (ЛГ);
• фолликулостимулирующий гормон (ФСГ);
• тиротропин (ТТГ).
Гормоны передней доли гипофиза поступают в петрозный синус, затем - в системный кровоток, достигают периферических эндокринных желез, обеспечивая их нормальную работу. Органом-мишенью для ГР служит печень (в меньшей степени другие ткани), в которой вырабатывается инсулиноподобный фактор роста-1, обеспечивающий основные
метаболические эффекты гормона. В свою очередь, продукты периферических эндокринных желез (гормоны надпочечников, ЩЖ, половых желез), действуя по принципу отрицательной (главным образом) обратной связи, модулируют как функцию гипофиза, так и гипоталамуса. Большинству гормонов гипоталамуса и гипофиза присущ импульсный характер секреции. Изменение частоты или амплитуды секреции гормонов может характеризовать определенные патологические состояния.
Таблица 58-1. Гормоны передней доли гипофиза и их основные эффекты
Нейроэндокринные клетки супраоптического и паравентрикулярного ядер гипоталамуса, длинные отростки которых образуют заднюю долю гипофиза (нейрогипофиз), содержит вазопрессин (антидиуретический гормон - АДГ) и окситоцин. Эти нейрогипофизарные гормоны главным образом, обеспечивают сохранение воды в организме (АДГ), сокращение гладкой мускулатуры матки и секрецию молока (окситоцин).
Образования гипофиза
Образования гипофиза могут быть обнаружены на основании клинических признаков или выявлены случайно при МРТ или КТ головного мозга. Чаще всего образованием гипофиза оказывается аденома
гипофиза. Кроме того, краниофарингиома, киста кармана Ратке, арахноидные, дермоидные кисты, глиома, менингиома, инфильтративные и воспалительные процессы (гипофизит, саркоидоз, гистиоцитоз Х, инфекции) и некоторые другие патологические процессы могут вызывать структурные изменения гипофиза и феномен «образование гипофиза».
Аденомы гипофиза
Аденомы гипофиза составляют примерно 15% всех интракраниальных опухолей. Большинство аденом гипофиза - микроаденомы, размер которых не превышает 10 мм. Их обнаруживают на основании клинических симптомов (признаков гиперсекреции одного или нескольких гормонов) или случайно выявляют при визуализации гипофиза (МРТ, КТ головного мозга). Макроаденомы (опухоли размером 10 мм и более) могут не сопровождаться гормональными нарушениями, приводить к гипопитуитаризму или гиперсекреции одного или нескольких гормонов. Кроме того, макроаденомы могут вызывать визуальные дефекты (нарушение полей зрения) из-за повреждения оптической хиазмы и неврологические (головную боль, симптомы внутричерепной гипертензии и поражение черепных нервов) проявления. Опухоли гипофиза крайне редко бывают злокачественными, но могут иметь инвазивный рост. Аденомы гипофиза можно классифицировать согласно варианту представленных гормональных нарушений (табл. 58-2).
Таблица 58-2. Классификация аденом гипофиза
Пролактинома и гиперпролактинемия
Пролактинома (пролактинсекретирующая аденома) встречается чаще других и составляет 40-50% всех аденом гипофиза. Гиперпролактинемия - синдром, развивающийся вследствие различных физиологических и патологических состояний и сопровождающийся повышенной продукцией пролактина гипофизом (табл. 58-3). Уровень пролактина повышается при беременности и лактации. Сон, коитус, физическая нагрузка сопровождаются повышением пролактина. Некоторые лекарственные препараты (см. табл. 58-3) могут не только повышать пролактин, но и вызывать клинические симптомы гиперпролактинемии. Большие опухоли гипоталамо-гипофизарной области могут вызывать гиперпролактинемию за счет сдавления ножки гипофиза и снижения ингибирующего влияния допамина на секрецию пролактина (синдром ножки).
Таблица 58-3. Причины гиперпролактинемии
КЛИНИЧЕСКАЯ КАРТИНА
У женщин гиперпролактинемия приводит к нарушению менструальной функции, галакторее, нарушению фертильности (табл. 58-4). Минеральная плотность костей у женщин с гиперпролактинемией на 20-25% ниже, чем у здоровых, причем потеря костной массы коррелирует со степенью выраженности гипоэстрогенемии. Связанный с гиперпролактинемией гипогонадотропный гипогонадизм довольно рано развивается и у мужчин, однако только 1-2% мужчин с гиперпролактинемией жалуются на снижение либидо, потенции и эректильную дисфункцию. Первыми жалобами у мужчин часто бывают вызванные большими размерами опухоли нарушения полей зрения и головная боль.
Таблица 58-4. Клинические проявления гиперпролактинемии у женщин и мужчин
ДИАГНОСТИКА
Выявление повышенного уровня пролактина требует тщательного сбора анамнеза и исключение физиологических причин, лекарственных препаратов и патологических состояний, приводящих к неопухолевой гиперпролактинемии (табл. 58-5). Кроме того, следует убедиться, что причиной повышения пролактина не является макропролактин - комплекс «пролактин-иммуноглобулин», который имеет высокий молекулярный вес, низкую биологическую активность и не продуцируется пролактиномой.
После исключения неопухолевой гиперпролактинемии для подтверждения наличия образования в гипофизе выполняют МРТ. Пролактинсекретирующие опухоли диагностируют чаще у женщин, чем у мужчин. У женщин чаще обнаруживают микроаденомы, у мужчин - макроаденомы. Следует помнить, что сывороточная концентрация пролактина коррелирует с размером пролактиномы. Сочетание макроаденомы с не очень высоким уровнем пролактина свидетельствует скорее всего о
синдроме ножки гипофиза. Следует также помнить о возможности сочетания неопухолевой гиперпролактинемии и нефункционирующего или продуцирующего другие гормоны образования гипофиза.
У части больных гиперпролактинемию аденомы гипофиза не обнаруживают (либо она менее 2 мм, либо это гиперплазия лактотрофов, либо неопухолевая гиперпролактинемия)
Таблица 58-5. Основные диагностические шаги при оценке гиперпролактинемии
ЛЕЧЕНИЕ
Лечение гиперпролактинемии зависит от ее причины. Гиперпролактинемия, связанная с первичным гипотиреозом, легко устраняется адекватной заместительной терапией тиреоидными гормонами. При выявлении гиперпролактинемии, вызванной лекарственными препаратами, последние желательно отменить (заменить другими). В случае невозможности отмены лекарственных препаратов, приводящих к симптоматической гиперпролактинемии, возможно назначение агонистов допамина.
В подавляющем большинстве случаев первым шагом в лечении (табл. 58-6) пролактинсекретирующих опухолей гипофиза является назначение агонистов допамина (бромокриптина, каберголина). Агонисты допамина приводят к нормализации пролактина у 80-90% больных. У 80% больных макроаденомами удается уменьшить размер последних на 25%. Нормализация функции яичников наблюдается у 90% женщин, тестикулярная функция восстанавливается хуже, до 50% мужчин требуется заместительная терапия тестостероном.
Каберголин лучше переносится, чем бромокриптин, и имеет меньшее количество побочных эффектов. Появившиеся, однако, в литературе сообщения о связи длительного приема каберголина с клапанными поражениями сердца указывают на необходимость осторожного использования этого лекарственного средства и выполнения ЭхоКГмониторинга клапанного аппарата.
Таблица 58-6. Лечение пролактинсекретирующих опухолей гипофиза
Хирургическое лечение пролактиномы рекомендуют при отсутствии эффекта или в случае плохой переносимости медикаментов. Лучевую терапию используют крайне редко.
Акромегалия
Акромегалия - клинический синдром, вызванный длительной гиперсекрецией ГР. У детей (до закрытия зон роста) хроническая избыточная продукция ГР приводит к развитию гигантизма. Более 90% больных акромегалией имеют доброкачественную моноклональную аденому гипофиза, другие причины гиперсекреции ГР (опухоли, продуцирующие ГРРГ, эктопическая продукция ГР и ГРРГ карциноидом, опухолями поджелудочной железы, легких и других органов, наследственные синдромы) встречаются редко. До 40% ГР-продуцирующих аденом могут одновременно секретировать и пролактин (соматомаммотрофные аденомы).
КЛИНИЧЕСКАЯ КАРТИНА
Заболеваемость составляет 4-6 на 1 млн населения. Акромегалия встречается одинаково часто у мужчин и женщин. Диагностируют заболевание чаще в 40-45 лет. Клинические симптомы и метаболические нарушения при акромегалии развиваются в результате действия на органы и ткани как ГР, так и инсулиноподобного фактора роста-1. Продукция последнего в печени значительно возрастает в условиях хронической гиперсекреции ГР (табл. 58-7).
Признаками акромегалии считают изменение внешности (огрубение черт лица), увеличение акральных частей тела. Другими характерными чертами акромегалии считают гипергидроз, повышенную сальность кожи, артропатию, карпальный туннельный синдром, синдром ночного апноэ.
Таблица 58-7. Клинические проявления и метаболические нарушения при акромегалии
Длительно существующая акромегалия приводит к развитию специфической акромегалической кардиопатии, которая характеризуется:
• гипертрофией миокарда левого желудочка;
• нарушениями сердечного ритма (преимущественно желудочковыми);
• диастолической, а позднее и систолической сердечной недостаточностью .
Рано появляющиеся у больных акромегалией артериальная гипертензия и нарушения углеводного обмена способствуют быстрому прогрессированию кардиопатии.
Акромегалия связана с повышенным риском формирования полипов и рака толстой кишки. Данные о более высокой частоте злокачественных опухолей других локализаций недостоверны.
Основная причина смерти у больных акромегалией, не лечившихся или неправильно лечившихся, - сердечно-сосудистые и респираторные заболевания.
ДИАГНОСТИКА
При подозрении на акромегалию оценивают базальный уровень ГР, инсулиноподобного фактора роста-1, а также выполняют глюкозотолерантный тест и определяют уровень ГР через 1-2 ч после употребления глюкозы. Отсутствие (недостаточное) снижения ГР подтверждает акромегалию. Следует помнить о том, что у 20% больных отмечают парадоксальное повышение ГР в глюкозотолерантном тесте. Больным назначают также пролактин и для исключения гипопитуитаризма - другие гипофизарные гормоны, при необходимости оценивают резервы гипофиза. С помощью МРТ гипофиза оценивают размеры и расположение аденомы. Как правило, выполняют периметрию и при необходимости оценивают неврологический статус.
ЛЕЧЕНИЕ
Хирургическое лечение (транссфеноидальное удаление аденомы гипофиза) считают лечением выбора для большинства больных с микроаденомой и многих - макроаденомой. Успех операции зависит от опыта хирурга, размера и расположения аденомы. Излечение после операции наблюдают у 70% больных с микроаденомой и менее чем у 50% с макроаденомой. К осложнениям оперативного лечения относят:
• гипопитуитаризм (20%);
• несахарный диабет (3%);
• местные осложнения, включающие ринорею (5%).
Аналоги соматостатина (октреотид и длительнодействующие аналоги - сандостатин лар*, ланреотид) используют как дополнение к операции или лучевой терапии. В качестве первой линии терапии аналоги соматостатина применяют при противопоказаниях к оперативному лечению или невозможности его выполнения, у женщин репродуктивного возраста, когда необходимо сохранение фертильности, а также при желании больного. Парентеральное введение длительнодействующих аналогов соматостатина приводит к нормализации ГР и инсулиноподобного фактора роста-1 у 50-70% больных. Частичное уменьшение размеров опухоли наблюдают в 50% случаев. Агонисты допамина могут быть использованы в качестве дополнительного лечения, особенно при выявлении соматомаммотрофной аденомы или если больной предпочитает пероральную терапию парентеральной (табл. 58-8).
Таблица 58-8. Осложнения терапии аналогами соматостатина
Лучевая терапия показана в случае неполного удаления опухоли, резистентности или непереносимости медикаментозного лечения. ГР снижается на 50% в течение первых 2 лет, затем продолжает медленно снижаться. Нормализации ГР у 35% больных достигают в течение 10 лет, у 50-60% больных развивается гипопитуитаризм.
АКТГ-продуцирующая аденома (болезнь Кушинга)
АКТГ-продуцирующая аденома составляет 10-15% всех опухолей гипофиза и 80% всех случаев эндогенного гиперкортицизма.
КЛИНИЧЕСКАЯ КАРТИНА
АКТГ-продуцирующая аденома гипофиза встречается в 5-10 раз чаще у женщин, чем у мужчин. Поскольку клиническая симптоматика появляется довольно рано, большинство больных на момент постановки диагноза имеют микроаденому.
Хроническая неподавляемая секреция АКТГ кортикотрофной аденомой приводит к гиперплазии надпочечников и гиперпродукции кортизола. Гиперкортизолизм вызывает подавляющее большинство клинических симптомов, обнаруживаемых при болезни Кушинга (см. главу «Надпочечники»).
ДИАГНОСТИКА И ЛЕЧЕНИЕ
См. главу «Надпочечники».
ТТГ-продуцирующая аденома гипофиза
ТТГ-продуцирующая аденома гипофиза - редкая причина тиреотоксического синдрома и опухолей гипофиза. Заболевание подозревают при клинических и биохимических признаках тиреотоксикоза, но нормаль-
ном или повышенном уровне ТТГ. Для дифференциальной диагностики с синдромом резистентности к ТТГ определяют а-субъединицу гликопротеиновых гормонов (она будет повышенной при ТТГ-продуцирующей аденоме) и МРТ гипофиза. При МРТ гипофиза обнаруживают, как правило, образование кистозно-солидного строения. Хирургическая операция - первый шаг в лечении больных с ТТГ-секретирующими аденомами гипофиза. Поскольку в большинстве случаев опухоль не может быть удалена полностью, хирургическое лечение дополняют медикаментозной (аналогами соматостатина) или лучевой терапией.
Аденомы гипофиза, секретирующие гонадотропины
Гонадотрофные аденомы (аденомы, секретирующие ЛГ, ФСГ или их субъединицы) встречаются довольно часто, но диагностируют их редко и поздно, так как признаки гормональной секреции у больных, как правило, отсутствуют, а клинические симптомы появляются только при больших размерах опухоли. Визуальные нарушения (битемпоральная гемианопсия), головная боль, симптомы внутричерепной гипертензии и поражение черепных нервов могут быть первыми признаками заболевания. Наличие макроаденомы подтверждают с помощью МРТ гипофиза. Окончательный диагноз часто устанавливают после операции и гистологического исследования опухоли.
Недостаточность передней доли гипофиза (гипопитуитаризм)
Гипопитуитаризм - снижение продукции одного или нескольких гормонов передней доли гипофиза. Синдром может развиться вследствие патологии самого гипофиза или в результате поражения гипоталамуса и снижения продукции его гормонов. Дефицит гормонов гипофиза может быть врожденным, но чаще бывает приобретенным и развивается вследствие поражений гипофиза различного генеза (табл. 58-9). Изолированная недостаточность ГР или гонадотропинов обычно возникает вследствие генетических нарушений. К недостатку нескольких гипофизарных гормонов приводят опухоли, операции или облучение гипофиза, а также инфильтративные и воспалительные процессы в нем.
КЛИНИЧЕСКАЯ КАРТИНА И ДИАГНОСТИКА
Клинические проявления гипопитуитаризма зависят от того, продукция какого гормона утрачена и насколько быстро произошла эта утрата. При остром повреждении гипофиза (например, при кровоизлиянии) первой страдает продукция АКТГ и развивается надпочечниковая недостаточность. В случае хронического поражения (в частности, при медленнорастущих питуитарных аденомах) первой снижается продукция ГР и гонадотропинов. Дефицит ГР у детей приводит к задержке роста, у взрослых - к абдоминальному ожирению и некоторым метаболическим нарушениям (табл. 58-10). Дефицит гонадотропинов (вторичный гипогонадизм) сопровождается нарушением менструального цикла, фертильности, развитием остеопении у женщин и снижением сексуальной функции, нарушением фертильности у мужчин. Снижение продукции ТТГ (вторичный гипотиреоз) вызывает нарушение роста у детей и симптомы гипотиреоза у детей и взрослых. Клиническая картина вторичной надпочечниковой недостаточности сходна с таковой при первичной надпочечниковой недостаточности (ПНН). В отличие от ПНН, при дефиците АКТГ обычно сохранена продукция надпочечниками минералокортикоидов, в результате у больных не обнаруживают повышенного солевого аппетита, гиперкалиемии. Кроме того, отсутствует связанная с высоким уровнем АКТГ гиперпигментация. Дефицит пролактина приводит к недостаточной лактации (или ее отсутствию). Однако недостаточная продукция пролактина развивается крайне редко, только в случае полного разрушения передней доли гипофиза. При большинстве форм гипопитуитаризма уровень пролактина высокий (эффект ножки гипофиза). Этот эффект развивается в результате прекращения тормозящего влияния допамина на высвобождение пролактина (из-за повреждения ножки гипофиза опухолью или другим объемным процессом).
Таблица 58-9. Причины гипопитуитаризма
Таблица 58-10. Симптомы дефицита гормона роста у взрослых
При поражении задней доли гипофиза развиваются полиурия и полидипсия из-за снижения продукции АДГ. Если причиной гипопитуитаризма служит объемное поражение гипофиза, развиваются неврологические и офтальмологические симптомы. По данным эпидемиологических исследований, больные гипопитуитаризмом чаще и раньше умирают от сердечно-сосудистых заболеваний.
Гипопитуитаризм должен быть заподозрен у всех больных, перенесших операцию на гипофизе, облучение его или тяжелую травму головы. Следует также исключать гипопитуитаризм при наличии у больного гипогонадизма, бесплодия или необъяснимого гипотиреоза. При подозрении на гипопитуитаризм, наряду с определением уровня гормонов аденогипофиза (АКТГ, ГР, ТТГ, ЛГ,ФСГ, пролактина), оценивают концентрацию в сыворотке крови гормонов периферических эндокринных желез: кортизола, Т4, эстрадиола (у женщин) и тестостерона (у мужчин). Снижение концентрации гормонов периферических эндокринных желез при отсутствии повышения питуитарных гормонов с высокой вероятностью свидетельствует о наличии гипопитуитаризма. Диагноз гипопитуитаризма однако, часто требует выполнения специальных тестов, оценивающих резервы гипофиза (табл. 58-11).
Таблица 58-11. Диагностические тесты, используемые при подозрении на гипопитуитаризм
ЛЕЧЕНИЕ
Заместительная терапия гормонами периферических эндокринных желез, включающая глюкокортикоиды, тиреоидные и половые гормоны, гормон роста и при необходимости вазопрессин, высокоэффективна и относительно безопасна (табл. 58-12). Больной, получающий глюкокортикоиды, должен помнить о необходимости увеличения дозы лекарства в случае стресса, болезни и подобных состояний.
Таблица 58-12. Лечение гипопитуитаризма
Заболевания задней доли гипофиза
Задняя доля гипофиза (нейрогипофиз) формируется аксонами гипоталамических нейросекреторных клеток, клеточные тельца которых локализуются в области паравентрикулярных и супраоптических ядер гипоталамуса. Секреторными продуктами этих клеток являются АДГ (аргинин-вазопрессин) и окситоцин.
Гранулы, содержащие АДГ, мигрируют по аксонам в заднюю долю гипофиза, где хранятся и при необходимости секретируются. Некоторая часть гормона выделяется непосредственно в ЦНС, а затем - в системный кровоток. Действуя на почечные собирательные трубочки через V2-рецепторы, АДГ уменьшает экскрецию воды и концентрирует мочу. Стимуляция расположенных в сосудистой стенке V1-рецепторов приводит к вазоконстрикции. Основными стимулами секреции АДГ служат высокая осмолярность плазмы и снижение сосудистого объема. С другой стороны, избыток свободной воды и низкая осмолярность плазмы угнетают секрецию АДГ. Осмотические рецепторы, ответственные за высвобождение АДГ, локализуются в мозге.
Несахарный диабет
Несахарный диабет - заболевание, характеризуемое уменьшением секреции или действия АДГ и приводящее в результате к выделению неадекватно большого количества гипотоничной мочи.
ЭТИОЛОГИЯ
Несахарный диабет подразделяют на центральный и нефрогенный. Кроме того, среди полиурических синдромов принято выделять первичную полидипсию и гестационный несахарный диабет.
При центральном несахарном диабете специфические структуры гипоталамуса теряют способность к секреции, а иногда и синтезу АДГ в ответ на увеличение осмолярности. Как следствие, разведенный гломерулярный фильтрат не концентрируется в собирательных трубках и выделяется большое количество разведенной мочи. Сывороточная осмолярность в результате увеличивается, развиваются жажда и вторичная полидипсия. Плазменная концентрация АДГ в такой ситуации неопределяемая или неадекватно низкая по отношению к существующей осмолярности плазмы.
Нефрогенный несахарный диабет развивается в результате нечувствительности почек к действию АДГ. Разведенный гломерулярный фильтрат, как и при центральном несахарном диабете, поступает в собирательные трубки и выделяется в виде большого количества гипотоничной мочи. Механизм появления жажды и полидипсии аналогичен таковому при центральном несахарном диабете. Однако, в отличие от последнего, уровень АДГ высокий или неадекватно высокий по отношению к плазменной осмолярности.
Первичная полидипсия может быть разделена на 3 подвида:
• дипсогенную полидипсию - расстройство, в результате которого возникают сильная жажда, полидипсия. Развивающаяся в результате полиурия носит вторичный характер;
• психогенную полидипсию - не связана с усилением жажды, а полиурия, вероятно, является проявлением психоза;
• ятрогенную полидипсию - следствие рекомендаций увеличить потребления жидкости.
Гестационный несахарный диабет - редкое состояние, возникающее во время беременности, при котором наблюдают более быструю, чем в общей популяции, деструкцию АДГ.
Причины центрального несахарного диабета
В качестве причин центрального несахарного диабета рассматривают:
• инфильтративные и неопластические процессы в гипоталамогипофизарной области;
• хирургические или лучевые вмешательства на гипоталамусе и гипофизе;
• тяжелые травмы головы;
• сосудистые повреждения;
• инфекционные процессы в гипоталамо-гипофизарной области;
• идиопатический несахарный диабет.
Причины нефрогенного несахарного диабета
Нефрогенный несахарный диабет может быть:
• врожденным (генетически детерминированным);
• приобретенным;
• связанным с действием некоторых лекарств.
Врожденный нефрогенный несахарный диабет - редкая, обычно семейная форма полиурии. Приобретенный нефрогенный несахарный диабет может быть следствием инфильтративных поражений почек, инфарктов почек с новообразованием сосудов, серповидноклеточной анемии и т.д. Многие лекарственные препараты могут привести к развитию нефрогенного несахарного диабета, в частности:
• лития карбонат;
• рифампицин;
• цисплатин;
• амфотерицин В;
• аминогликозиды.
КЛИНИЧЕСКАЯ КАРТИНА
Основным клиническим проявлением несахарного диабета служит полиурия (суточное количество мочи, превышающее 3 л у взрослых и 2 л у детей). Количество мочи обычно составляет 3-6 л, однако в тяжелых случаях суточное количество может достигать 20 л, значительно нарушая качество жизни больных. Симптомы дегидратации, как правило, не развиваются, так как из-за выраженной жажды больные восполняют потерю жидкости.
ДИАГНОСТИКА
Несахарный диабет должен быть заподозрен у всех больных с выраженной полиурией (>50 мл/кг в день). Исключить более частые при-
чины полиурии, вызванной осмотическим диурезом (СД, внутривенное введение рентгеноконтрастных средств, полиурическая стадия ХПН), помогают тщательно собранный анамнез и рутинные лабораторные исследования. Если осмолярность суточной мочи выше 300 мосмол/л, полиурия, вероятно, вызвана осмотическим диурезом. При осмолярности мочи ниже 300 мосмол/л у больного подозревают несахарный диабет и устанавливают его тип.
При установлении типа несахарного диабета следует учитывать, что внезапное начало полиурии, появление ее после травмы головы, нейрохирургического вмешательства в гипоталамо-гипофизарной области обычно свидетельствуют о центральном несахарном диабете. Для нефрогенного несахарного диабета свойственны начало в детском возрасте, семейный характер заболевания.
В качестве подтверждающего несахарный диабет диагностического теста используют дегидратационный тест. Тест начинают утром, каждый час измеряют массу тела больного, наличие признаков дегидратации, оценивают осмолярность или концентрацию натрия в плазме крови, объем выделяемой мочи и ее осмолярность. Если дегидратация не сопровождается увеличением осмолярности (>300 мосмл/л) или удельного веса (>1.010) мочи, еще до того, как масса тела снизится на 5% или концентрация натрия в крови превысит верхнюю границу нормы, можно считать, что у больного тяжелый центральный или нефрогенный несахарный диабет.
Дифференциальная диагностика
Для дифференциальной диагностики указанных типов несахарного диабета используют пробу с десмопрессином (АДГ). Десмопрессин в дозе 0,03 мкг/кг вводят больному подкожно или внутривенно (или 10 мкг десмопрессина интраназально). Через 1-2 ч повторно измеряют осмолярность мочи. Увеличение осмолярности мочи более чем на 50% по сравнению со значением до пробы свидетельствует о наличии центрального несахарного диабета. Если в процессе дегидратационного теста моча концентрируется, дифференциальную диагностику проводят между неполным (парциальным) центральным несахарным диабетом, парциальным нефрогенным несахарным диабетом и первичной полидипсией. Оптимальным в этой ситуации считают измерение АДГ в начале и конце теста с дегидратацией.
ЛЕЧЕНИЕ
Неосложненный центральный несахарный диабет легко поддается заместительной терапии синтетическим аналогом АДГ - десмопресси-
ном. При интраназальном применении 10-20 мкг или подкожном введении 1-4 мг десмопрессина эффект его сохраняется около 12 ч и более.
Клиническая симптоматика нефрогенного несахарного диабета при назначении десмопрессина уменьшается, но полностью не исчезает. Для улучшения состояния больных дополнительно назначают тиазидные диуретики или амилорид одновременно с низкосолевой диетой, ингибиторы синтеза простагландинов (индометацин).
Назначение десмопрессина больным с первичной полидипсией может вызвать водную интоксикацию. Ятрогенную полидипсию можно корригировать, отменив вызвавшие ее лекарственные препараты. Не существует эффективного лечения психо- и дипсогенной полидипсии.
Синдром неадекватной секреции антидиуретического гормона
Синдром неадекватной секреции АДГ - состояние, при котором концентрация АДГ неадекватно высока по отношению к осмолярности плазмы. Гипонатриемия при этом - обязательный признак.
К постоянно высокой (неадекватно высокой) продукции АДГ могут приводить:
• злокачественные опухоли, сопровождаемые автономной продукцией АДГ (рак легкого, поджелудочной железы, яичника, лимфопролиферативные заболевания);
• инфекции (туберкулез, пневмония, абсцесс легкого, СПИД);
• поражение ЦНС (перелом черепа, субдуральная гематома, менингит, энцефалит );
• применение некоторых лекарственных средств (винкристина, карбамазепина, высоких доз окситоцина, десмопрессина, циклофосфамида, трициклических антидепрессантов).
В клинической картине синдрома неадекватной секреции АДГ доминируют слабость, сонливость, судороги, нарушение сознания вплоть до комы.
Синдром неадекватной секреции АДГ - диагноз исключения, но он должен быть заподозрен у всех больных с гипонатриемией, выделяющих мочу более гипертоничную, чем плазма крови.
Для определения причины гипонатриемии оценивают осмолярность плазмы и мочи, а также проводят дополнительные тесты (табл. 58-13).
Таблица 58-13. Критерии диагностики синдрома неадекватной секреции антидиуретического гормона
ЛЕЧЕНИЕ
Лечебная тактика зависит от тяжести и длительности симптомов гипонатриемии и водной интоксикации. При легких или умеренно выраженных симптомах больному ограничивают жидкость до 800-1000 мл/ сут.
При тяжелой водной интоксикации с осторожностью внутривенно вводят 3% раствор натрия хлорида со скоростью не более 0,05 мл/кг массы тела в 1 мин.
Гипонатриемия при хроническом персистирующем синдроме неадекватной секреции АДГ может быть скорригирована применением демеклоциклина в дозе 150-300 мг внутрь 3-4 раза в день или флудрокортизона в дозе 0,05-0,2 мг через рот дважды в день.
Глава 59. ЗАБОЛЕВАНИЯ ЩИТОВИДНОЙ ЖЕЛЕЗЫ
Анатомия и физиология щитовидной железы
Щитовидная железа (ЩЖ) расположена на передней поверхности шеи (на щитовидном хряще ниже перстневидного хряща) и состоит из двух долей, соединенных между собой перешейком. Основная структурная единица ЩЖ - фолликул, представляющий собой замкнутое пространство, образованное одним слоем фолликулярных эпителиальных клеток, в просвете которого содержится коллоид. Основными метаболическими продуктами ЩЖ служат гормоны:
• тетрайод-L-тиронин (тироксин - Т4);
• 3,5,3'-трийод-L-тиронин (трийодтиронин - Т3).
СИНТЕЗ И ВЫСВОБОЖДЕНИЕ ГОРМОНОВ ЩИТОВИДНОЙ ЖЕЛЕЗЫ
Для синтеза тиреоидных гормонов требуется аминокислота тирозин и йод. Синтез тиреоидных гормонов происходит на апикальной поверхности фолликулярных клеток, при этом йодид окисляется в йод и другие окисленные продукты и связывается фенольными кольцами тирозиновых остатков в молекуле тиреоглобулина. В результате образуются моно- и дийодтирозины. Этот процесс (органификация), так же как и следующий (конденсация), регулируется специальными ферментами - тиреоидными пероксидазами. В результате конденсации моно- и дийодтирозинов образуются гормоны ЩЖ - тетрайод-L-тиронин (тироксин - Т4) и 3,5,3-трийод-L-тиронин (трийодтиронин - Т3).
Секреция тиреоидных гормонов происходит на апикальной мембране фолликулярных клеток путем эндоцитоза (поглощения капель коллоида, содержащего тиреоглобулин). Тиреоглобулин затем подвергается гидролизу и высвобождает тиреоидные гормоны в кровь.
МЕТАБОЛИЗМ И ТРАНСПОРТ ЙОДА
Поглощение йода ЩЖ - первый обязательный шаг в синтезе тиреоидных гормонов. В крови йод находится в связанном с белком (в
основном с альбумином) состоянии. Несвязанный йод экскретируется с мочой. Активный захват йода ЩЖ из циркуляции осуществляет натриййодный транспортер (Na-I симпортер), который экспрессируется на базолатеральной мембране фолликулярной клетки ЩЖ. Транспорт йода в ЩЖ регулируется главным образом потреблением его с пищей. Низкое потребление йода увеличивает экспрессию Na-I симпортера и, соответственно, поступление йода в ЩЖ. Наоборот, высокое потребление йода с пищей и водой снижает экспрессию Na-I симпортера, и поступление йода в ЩЖ снижается. Мутация гена Na-I симпортера - редкая причина врожденного гипотиреоза. Другой йодный транспортер, пендрин, локализуется на апикальной поверхности тироцита и регулирует поступление йода в просвет фолликула. Мутация гена пендрина приводит к синдрому Пендреда (нарушению органификации йода, зобу, сенсорной глухоте).
Недостаток йода в окружающей среде приводит к развитию целого спектра заболеваний, объединенных общим названием - «йоддефицитные заболевания». Наиболее очевидное проявление йодной недостаточности - эндемический зоб. Он служит предрасполагающим фактором для развития многих заболеваний щитовидной железы, в том числе узловых заболеваний и рака щитовидной железы. Известно, что в зонах со сниженным йодным обеспечением увеличивается распространенность автономного тиреотоксикоза.
К наиболее тяжелым последствиям дефицита йода относят врожденный гипотиреоз, который приводит к необратимым нарушениям мозга у плода и новорожденного и развитию умственной отсталости.
Случаи эндемического кретинизма чаще встречаются в регионах с тяжелой йодной эндемией. В регионах со средней и легкой степенью тяжести йодной эндемии эту патологию можно встретить не часто. Однако даже небольшой дефицит йода может приводить к снижению интеллектуального потенциала населения, проживающего в зоне недостаточности йода. Средние показатели умственного развития (IQ) в регионах с выраженным йодным дефицитом ниже, чем в регионах с достаточным йодным обеспечением. Рекомендуемые суточные дозы йода составляют 150 мкг для взрослых, 90-120 мкг для детей, 200 мкг для беременных. Экскреция йода, превышающая 100 мкг/л, свидетельствует об отсутствии дефицита йода.
Гормоны ЩЖ циркулируют в крови преимущественно в связанном с белками состоянии. Доля свободного Т4 составляет приблизительно 0,02%, Т3 - 0,3%. Транспорт тиреоидных гормонов осуществляется
специфическими белками: главным образом тироксинсвязывающим глобулином, в меньшей степени тироксинсвязывающим преальбумином (транстиретином) и альбумином. Увеличение или уменьшение содержания в плазме крови транспортных белков может сопровождаться изменением концентрации общих Т4 и Т3 без нарушения функции ЩЖ (табл. 59-1). Некоторые лекарственные препараты (салицилаты, фуросемид) конкурируют с тиреоидными гормонами за связывание с белками. Хотя эти препараты могут приводить к некоторому увеличению концентрации свободных тиреоидных гормонов, у больных сохраняется эутиреоз.
Таблица 59-1. Типы нарушений функции щитовидной железы
СИНДРОМ НИЗКОГО Т3. СИНДРОМ ЭУТИРЕОИДНОЙ ПАТОЛОГИИ
Любое тяжелое заболевание может вызывать у больного изменение уровня циркулирующих в крови тиреотропного гормона (ТТГ), Т3, Т4 и приводить к неправильной диагностике нарушения функции ЩЖ. В этой связи у больных, находящихся в отделениях интенсивной терапии и/или переносящих тяжелую соматическую патологию, оценку сывороточной концентрации ТТГ, Т3 и Т4 рекомендуют только при серьезном подозрении на заболевание ЩЖ. Наиболее часто снижается сывороточная концентрация свободного и общего Т3 и сохраняются нормальными значения ТТГ, свободного и общего Т4, причем степень снижения Т3 коррелирует с тяжестью болезни. Причиной таких изменений считают нарушение периферической дейодинации Т4 с увеличением образования реверсированного Т3. У очень тяжелых больных можно обнаружить еще и снижение общего Т4 (синдром низкого Т4), связанное, по-видимому, с нарушением продукции тироксинсвязывающего глобулина. Прогноз у больных с низким Т4 неблагоприятный. Трудности с интерпретацией лабораторных тестов создают также колебания значений ТТГ (от 0,1 до 20 мМЕ/л), зависящие от стадии тяжелого соматического заболевания и проходящие после выздоровления. Механизм, лежащий в основе колебаний уровня ТТГ, окончательно не выяснен. Заместительная терапия синдрома низкого Т3 и Т4 в подавляющем большинстве случаев не требуется, показатели функции ЩЖ нормализуются по мере выздоровления больных.
ДЕЙСТВИЕ ТИРЕОИДНЫХ ГОРМОНОВ
Как известно, тиреоидные гормоны участвуют в клеточной дифференцировке и необходимы для нормального развития нервной системы и соматических тканей у плода и ребенка. У взрослых тиреоидные гормоны принимают участие во всех видах метаболизма (углеводов, белков и жиров), поддерживают нормальную функцию ЦНС, участвуют в поддержании термогенеза.
ЩЖ преимущественно вырабатывает Т4, однако метаболически активным гормоном является Т3. Несмотря на то что основным источником циркулирующего в крови Т3 служит печень, в клетках большинства других тканей также происходит образование Т3 из Т4. Часть Т4 в процессе дейодинации превращается в метаболически неактивную форму Т3, обратный или реверсированный Т3. Осуществляют это превращение дейодиназы. Дейодиназа 1-го типа обнаружена главным образом в ЩЖ, печени и почках. Дейодиназа 2-го типа отвечает за образование Т3 в
ЦНС, гипофизе, бурой жировой ткани, сердечной и скелетных мышцах, остеоцитах и в меньшей степени - в ЩЖ, печени и почках. При гипотиреозе активность дейодиназы 2-го типа увеличивается, что приводит к увеличению Т3 в мозге и передней доле гипофиза. Активность дейодиназы 2-го типа снижается при голодании, системных заболеваниях, тяжелых травмах и применении некоторых лекарственных средств (пропилтиоурацила, пропранолола, амиодарона, глюкокортикоидов). Дейодиназа 3-го типа инактивирует Т4 и Т3, являясь основным источником реверсированного Т3.
РЕГУЛЯЦИЯ ПРОДУКЦИИ ТИРЕОИДНЫХ ГОРМОНОВ
Важную роль в продукции тиреоидных гормонов играет ТТГ, секретируемый тиротрофами передней доли гипофиза. ТТГ - гликопротеин, состоящий из 2 субъединиц: α и β α-Субъединица - общая с другими гликопротеиновыми гормонами (ЛГ, ФСГ, хорионическим гонадотропином), β-субъединица отвечает за специфические эффекты ТТГ. Взаимоотношения между гипоталамусом, гипофизом и ЩЖ построены по классическому принципу отрицательной обратной связи. Гипоталамический тиротропин-рилизинг-гормон стимулирует питуитарный синтез и секрецию ТТГ, который, в свою очередь, увеличивает продукцию тиреоидных гормонов ЩЖ. Тиреоидные гормоны тормозят продукцию как тиротропин-рилизинг-гормона, так и ТТГ.
В парафолликулярных клетках ЩЖ образуется кальцитонин, принимающий участие в фосфорно-кальциевом обмене; его действие заключается в снижении (преимущественно постпищевой) гиперкальциемии.
Тиреотоксический синдром
Тиреотоксический синдром - состояние, возникающее в результате воздействия на органы и ткани избыточного количества гормонов щитовидной железы. Повышенное количество тиреоидных гормонов может вырабатываться ЩЖ при некоторых заболеваниях (болезни Грейвса, тиреоидной автономии), концентрация их в крови может быть повышена вследствие деструктивных процессов в ЩЖ (деструктивые тиреоидиты), наконец, пациент может принимать избыточное количество тироксина (ятрогенный тиреотоксикоз). Все причины тиреотоксического синдрома можно классифицировать на основании захвата йода (I123) ЩЖ (табл. 59-2). Высокий захват I123 указывает на повышенный синтез гормонов de novo, в то время как низкий свидетельствует об утечке гормонов из ЩЖ вследствие ее деструкции или о приеме тироксина.
Таблица 59-2. Причины тиреотоксического синдрома
ЭТИОЛОГИЯ
Одной из самых частых причин тиреотоксического синдрома с высоким захватом I123 в регионах с достаточным йодообеспечением считают болезнь Грейвса (базедову болезнь, болезнь Перри, диффузный токсический зоб). Заболевание относится к группе аутоиммунных, при котором вырабатываются антитела (тиреоидстимулирующие антитела) с уникальным действием, а именно: способностью связываться с рецептором для ТТГ на фолликулярных клетках, вызывать пролиферацию фолликулярных клеток, гиперплазию ЩЖ, стимулировать все этапы биосинтеза тиреоидных гормонов и приводить в результате к тиреотоксическому синдрому. При болезни Грейвса ЩЖ - не единственный орган, в котором локализуется аутоиммунный процесс. У 50% больных поражаются ретробульбарная клетчатка и глазодвигательные мышцы (инфильтративная офтальмопатия), у 5% - претибиальная область
(инфильтративная дермопатия, претибиальная микседема) и, наконец, менее чем у 1% развивается специфическая тиреоидная акропатия.
Другой частой причиной тиреотоксического синдрома с высоким захватом йода, особенно в регионах с недостаточным йодообеспечением, является автономный тиреотоксикоз (тиреоидная автономия). В основе формирования тиреоидной автономии лежит присущая ЩЖ гетерогенность фолликулярного эпителия, генетически детерминированная, по крайней мере, в ряде случаев. Известно, что соматическая мутация генарецептора для ТТГ приводит к формированию автономно функционирующих узлов ЩЖ (токсических и претоксических аденом). В результате присущей фолликулярному эпителию ЩЖ гетерогенности отдельные клетки или группы клеток, обладающие более высоким ростовым потенциалом, пролиферируют быстрее, чем их соседи, и образуют участки тиреоидной автономии, в том числе клинически явные узлы. Эти участки способны не только к автономному росту, но и к автономной (независимой от ТТГ) продукции тиреоидных гормонов. Важным фактором, способствующим формированию тиреоидной автономии, считают хронический дефицит йода.
Тиреоидиты представляют собой гетерогенную группу заболеваний ЩЖ, тиреотоксикоз при которых является преходящим и возникает в результате деструкции ЩЖ (тиреотоксикоз «утечки», с низким захватом I123). Тиреотоксический синдром может быть индуцирован интерфероном-а и интерлейкином-2, используемыми в лечении некоторых заболеваний (например, хронического гепатита, СПИДа). В этих случаях он тоже вызван деструкцией ЩЖ и утечкой тиреоидных гормонов.
Хронический аутоиммунный тиреоидит (зоб Хасимото, тиреоидит Хасимото). Как правило, у больных с хроническим аутоиммунным тиреоидитом выявляют эутиреоз или гипотиреоз. Тиреотоксический синдром в этой группе больных развивается редко и обычно вследствие деструктивных процессов в ЩЖ. Однако у больных тиреоидитом Хасимото описан и тиреотоксикоз с высоким захватом I123. По мнению специалистов клиники Мэйо, именно его следует называть Хашитоксикозом, хотя в литературе под термином «Хашитоксикоз» обычно понимают тиреоидит Хасимото с тиреотоксикозом «утечки».
Ятрогенный тиреотоксикоз - нередко (примерно в 20% случаев) развивается у больных гипотиреозом, получающих заместительную терапию тироксином, в результате передозировки последнего. Многим больным дифференцированным раком ЩЖ назначают супрессивную
терапию тироксином (то есть в дозе, вызывающей тиреотоксикоз) как часть комплексного лечения, предупреждающего рецидив заболевания.
К редким причинам тиреотоксического синдрома относят ТТГпродуцирующую аденому гипофиза (составляет <1% всех аденом гипофиза), функционирующие метастазы (пульмональные) фолликулярной карциномы ЩЖ, тератому яичника, хорионкарциному, врожденные рецепторные дефекты (синдром резистентности к ТТГ, мутация генарецептора ТТГ и т.д.).
Избыток йода, который больной может получить при введении рентгеноконтрастных средств и особенно при употреблении амиодарона, может привести к дисфункции ЩЖ и тиреотоксическому синдрому в частности. Тиреотоксикоз в этой группе больных нередко носит смешанный характер (вызванный как утечкой, так и гиперпродукцией тиреоидных гормонов).
КЛИНИЧЕСКАЯ КАРТИНА
Независимо от причины, большинство клинических симптомов тиреотоксического синдрома вызвано воздействием избытка тиреоидных гормонов на органы и ткани (табл. 59-3).
Избыток тиреоидных гормонов вызывает гиперметаболическое состояние, при котором энергии вырабатывается больше, чем используется. В результате избыточная энергия выделяется в виде тепла, и у больного появляются повышенное потоотделение, непереносимость тепла, а в редких случаях повышается температура тела. Невозможность использования энергии приводит к выраженной слабости, преимущественно мышечной.
Наиболее характерный симптом тиреотоксикоза - снижение массы тела, несмотря на хороший аппетит. В редких случаях (<2%) возможна прибавка массы тела, которую можно объяснить только тем, что больные едят больше, чем теряют.
Тиреотоксикоз приводит к нарушению памяти, внимания, эмоциональной лабильности, беспокойству, повышенной возбудимости, а в тяжелых случаях - психозу и коме. Больные тиреотоксикозом часто жалуются на тремор пальцев рук, иногда - на изменение почерка. Повышение симпатической гиперактивности и появление перечисленных выше симптомов связывают с Т3-индуцированным увеличением плотности р-адренорецепторов.
Таблица 59-3. Клинические проявления тиреотоксического синдрома
Гормоны ЩЖ оказывают существенное влияние на сердце и сосуды. Хронический избыток тиреоидных гормонов уменьшает системное сосудистое сопротивление путем непосредственного действия на гладкие мышцы сосудов. Т3 действует на сердечную мышцу через геномные (влияет на миофибриллярные белки, фосфоламбан саркоплазматического ретикулума, кальцийактивируемую АТФазу и различные мембранные транспортеры) и негеномные механизмы (нарушает работу натриевых, калиевых и кальциевых каналов). Перечисленные эффекты приводят к таким клиническим проявлениям, как увеличение ЧСС, сократимости миокарда и сердечного выброса. При физикальном обследовании у больного можно выявить увеличенное пульсовое давление, громкий I тон, систолический шум - симптомы, являющиеся атрибутом гипердинамического состояния.
Тахикардию обнаруживают практически у всех больных тиреотоксикозом. У 10% из них развивается фибрилляция предсердий. Обычно это лица с предшествующей патологией сердечно-сосудистой системы, однако описаны случаи развития фибрилляции предсердий при отсутствии таковой. Больные тиреотоксикозом могут предъявлять жалобы на впервые возникшую стенокардию или ухудшение ее течения, что связано с увеличением потребности миокарда в кислороде в условиях хронической гиперпродукции тиреоидных гормонов и возможной индукции последними спазма коронарных артерий. Застойная сердечная недостаточность развивается главным образом у больных с предшествующей патологией сердечно-сосудистой системы.
Одышка у больного тиреотоксикозом носит смешанный характер за счет развития слабости дыхательных мышц и уменьшения экскурсии легких и за счет формирования левожелудочковой недостаточности.
Действие избытка тиреоидных гормонов на желудочно-кишечный тракт приводит к более быстрой эвакуации содержимого кишечника (частому стулу).
У женщин с тиреотоксикозом обнаруживают нарушения менструального цикла, олигоменорею, расстройства овуляции. Менструальная дисфункция, вероятно, вызвана нарушением пульсаторной секреции гонадотропин-рилизинг-гормона и, как следствие, ЛГ и ФСГ в условиях хронической избыточной продукции тиреоидных гормонов. Более того, тиреоидные гормоны, увеличивая печеночную продукцию белка, связывающего половые стероиды, могут уменьшать долю свободного эстрадиола у женщин и тестостерона у мужчин, увеличивать превращение андростендиона в эстрон. Указанные метаболические нарушения
способствуют нарушению менструальной функции у женщин и эректильной - у мужчин. У 10% мужчин развивается гинекомастия и снижается либидо.
У пожилых и лиц старческого возраста симптомы тиреотоксикоза могут отличаться от классических гиперадренергических (апатического тиреотоксикоза). Снижение массы тела, фибрилляция предсердий, депрессия, деменция, выраженная слабость могут быть ведущими симптомами.
Глазные симптомы тиреотоксикоза (широкая глазная щель, ретракция верхнего века, пристальный взгляд, небольшая конъюнктивальная инъекция и т.д.) развиваются вследствие адренергической гиперстимуляции глазодвигательных мышц. Они исчезают при достижении эутиреоза. Инфильтративная офтальмопатия - специфичный для болезни Грейвса синдром - может предшествовать тиреотоксикозу, развиваться параллельно с ним, а также возникнуть после нормализации функции ЩЖ. В 10% случаев развивается эутиреоидная офтальмопатия Грейвса, которая характеризуется:
• экзофтальмом разной степени выраженности;
• периорбитальным отеком;
• поражением глазодвигательных мышц;
• в тяжелых случаях - диплопией, птозом, поражением роговицы, глазодвигательного нерва, потерей зрения.
Развитие офтальмопатии связывают с появлением при болезни Грейвса в ретробульбарных тканях антигенов, морфологически схожих с рецептором ТТГ. Тиреоидстимулирующие антитела, связываясь с антигеном, инициируют аутоиммунный процесс:
• инфильтрацию лимфоидными клетками ретробульбарной клетчатки и глазодвигательных мышц;
• индуцированную цитокинами гиперпродукцию глюкозоаминогликанов фибробластами;
• развитие отека ретробульбарной клетчатки;
• неравномерное утолщение мышц.
Другой синдром, также специфичный для болезни Грейвса, - инфильтративная дермопатия (претибильная микседема) характеризуется плотным, асимметричным, не оставляющим ямки при надавливании отеком претибиальной области. Цвет пораженного участка варьирует от розово-красного до коричневого. Вовлеченная дерма также содержит увеличенное количество гиалуроновой кислоты, хондроэтинсульфата (глюкозаминогликанов) - продуктов, активированных цитокинами фибробластов. Практически у всех больных претибиальной микседемой выявляют инфильтративную офтальмопатию.
В отдельных случаях болезни Грейвса можно обнаружить тиреоидную акропатию: концевые фаланги пальцев рук приобретают вид «барабанных палочек», развивается отек мягких тканей рук и ног. Тиреоидная акропатия встречается у 0,1-1% больных, почти всегда в присутствии офтальмопатии и дермопатии.
Болезнь Грейвса может сочетаться с другими аутоиммунными заболеваниями (СД 1-го типа, болезнью Аддисона, витилиго и т.д.).
Изменения со стороны ЩЖ зависят от причины тиреотоксического синдрома. У большинства пациентов с болезнью Грейвса обнаруживают диффузно увеличенную ЩЖ, при аускультации которой выслушивается сосудистый шум. У больных с токсической аденомой и многоузловым токсическим зобом обнаруживают в ЩЖ одиночный узел (токсическую аденому) или узлы (многоузловой токсический зоб), размер которых обычно превышает 2 см. Тиреоидиты могут не сопровождаться увеличением щЖ. Подострый болевой тиреоидит характеризуется резкой болезненностью при пальпации ЩЖ.
ДИАГНОСТИКА
При подозрении на тиреотоксикоз выполняют оценку концентрации ТТГ в сыворотке крови. За исключением ТТГ-продуцирующей питуитарной аденомы и синдрома резистентности к ТТГ он супрессирован (<0,1 мМЕ/л) во всех случаях тиреотоксического синдрома. Определение уровня тиреоидных гормонов - следующий шаг в оценке больных. На уровень общего Т4 и Т3 влияет концентрация в сыворотке крови связывающего их глобулина - тиреоидных гормонов связывающего глобулина. Уровень этого показателя повышается при инфекционном гепатите, беременности, у больных, получающих эстрогены и опиаты. Нарушать связывание тиреоидных гормонов со связывающим их глобулином могут многие лекарства:
• гепарин;
• фуросемид;
• фенитоин;
• карбамазепин;
• диазепам;
• салицилаты;
• НПВС.
В связи с этим оценку свободных тиреоидных гормонов считают предпочтительной.
Повышение сывороточной концентрации свободных Т4 и Т3 подтверждает наличие явного тиреотоксикоза. В йоддефицитных регио-
нах нередко развивается Т3-тиреотоксикоз (низкий ТТГ, нормальный уровень свободного Т4, высокий уровень свободного Т3). Нормальный уровень тиреоидных гормонов у больного с супрессированным ТТГ свидетельствует о субклиническом тиреотоксикозе.
После биохимического подтверждения тиреотоксического синдрома следует установить его причину. В некоторых случаях лежащее в основе тиреотоксикоза заболевание легко распознают клинически. В частности, наличие у больного инфильтративной офтальмопатии позволяет с уверенностью говорить о болезни Грейвса.
Измерение тиреоидстимулирующих антител высокочувствительным методом используют не только для диагностики, но и для ведения болезни Грейвса. Уровень тиреоидстимулирующих антител позволяет предсказать длительную ремиссию болезни Грейвса, инфильтративной офтальмопатии, а также развитие неонатального тиреотоксикоза. Чувствительность метода оценки тиреоидстимулирующих антител в диагностике болезни Грейвса составляет 98%.
Радиометрию ЩЖ и радиоизотопное сканирование используют в дифференциальной диагностике причин тиреотоксического синдрома. Радиометрия ЩЖ с I123 позволяет ответить на важный с точки зрения дальнейшей врачебной тактики вопрос: образуются ли гормоны ЩЖ de novo (захват I123 высокий) или они попадают в системный кровоток из ЩЖ вследствие ее деструкции (захват I123 низкий). В норме 24-часовой захват I123 колеблется в пределах 5-25% введенной дозы. Захват I123 ниже 5% считают низким, превышающий 25% - высоким. Следует обратить внимание на тот факт, что захват I123 может быть высоким в йоддефицитных регионах.
Сканирование с I123 или технецием используют для выявления автономно функционирующих узлов ЩЖ (токсической аденомы, многоузлового токсического зоба). Эти узлы активно поглощают I123 или технеций и обладают способностью к повышенной продукции тиреоидных гормонов (гиперфункционирующие узлы). Ткань ЩЖ, окружающая узел (узлы), демонстрирует снижение захвата радиофармпрепарата. Степень супрессии зависит от того, насколько сформировалась автономия. Полностью сформировавшийся автономный узел ЩЖ (токсическая аденома, например) выглядит на сканограмме как «горячий» узел с отсутствием каких-либо признаков захвата радиофармпрепарата окружающей тканью ЩЖ. Формирующаяся тиреоидная автономия обычно представлена «теплым» узлом (узлами) с неполным подавлением захвата радиофармпрепарата окружающей тканью.
Дифференциальная диагностика
В отличие от токсической аденомы или многоузлового токсического зоба, диссеминированная автономия ЩЖ не может быть выявлена с помощью сканирования. При отсутствии клинических признаков отличить диссеминированную тиреоидную автономию от болезни Грейвса можно только с помощью оценки концентрации тиреоидстимулирующих антител в сыворотке крови.
До некоторого времени роль ультразвукового исследования ЩЖ в диагностике тиреотоксического синдрома сводилась к уточнению наличия в ней узлов (в случае подозрения на автономный тиреотоксикоз) и к оценке динамики размеров ЩЖ при лечении болезни Грейвса. В последние годы в дифференциальной диагностике причин тиреотоксического синдрома широко используют цветовое допплеровское сканирование, позволяющее оценить кровоток в ЩЖ. При болезни Грейвса в ЩЖ обнаруживают повышенный кровоток (>20 мм/с), в случае деструктивного тиреоидита кровоток в ЩЖ минимальный или отсутствует.
ЛЕЧЕНИЕ
Выбор терапии тиреотоксического синдрома зависит от его причины. При тиреотоксикозе с высоким захватом I123 назначают средства, блокирующие выработку тиреоидных гормонов. Тиреотоксикоз с низким захватом I123, вызванный деструктивным тиреоидитом, проходит самостоятельно, однако для контроля тиреотоксических симптомов (особенно со стороны ССС) больным назначают р-адреноблокаторы. При ятрогенном тиреотоксикозе показана коррекция дозы тироксина, если нет необходимости сохранять супрессию ТТГ (комплексное лечение высокодифференцированных раков щитовидной железы).
Тионамиды - антитиреоидные лекарственные препараты, которые в течение многих лет используют для лечения тиреотоксикоза. Тиамазол, карбимазол (имидазолсодержащие) и пропилтиоурацил (тиоурацилсодержащий) - тионамиды, действуя на тиреоидные пероксидазы, блокируют практически все этапы биосинтеза тиреоидных гормонов, а именно: йодинацию тиреоглобулина, конденсацию йодтирозинов с образованием йодтиронинов, синтез тиреоглобулина. Пропилтиоурацил, кроме того, ингибирует конверсию Т4 в Т3 дейодиназой 1-го типа. По некоторым данным, тионамиды обладают способностью тормозить синтез тиреоидстимулирующих антител.
Тиамазол назначают в суточной дозе 30 мг в 2-3 приема, пропилтиоурацил, суточная доза которого составляет 300 мг, требует более частого
приема (4 раза в сутки). По достижении нормального значения свободного Т4 начинают медленно снижать дозу до поддерживающей, которая обычно составляет 5-15 мг тиамазола 1 раз в день и 50 мг пропилтиоурацила 2 раза в день. Побочные эффекты тионамидов включают:
• кожную аллергию (сыпь, зуд, крапивницу);
• повышение печеночных ферментов;
• артралгии;
• желудочно-кишечные расстройства;
• васкулит (в редких случаях);
• потерю вкусовой чувствительности;
• агранулоцитоз (развивается у 0,1-0,8% больных, получающих тионамиды).
Большинство авторов не рекомендуют рутинный мониторинг лейкоцитов, однако лихорадка, боли в горле или симптомы вирусной инфекции считают показанием к неотложной оценке лейкоцитов и формулы крови.
Симптомы тиреотоксикоза, особенно со стороны сердечно-сосудистой системы, лучше всего контролируются р-адреноблокаторами. Вследствие значительного увеличения кардиальных р-адренергических рецепторов, а также быстрого метаболизма лекарства в условиях тиреотоксикоза для лечения требуются большие дозы р-адреноблокаторов: более 160 мг пропранолола, 100-200 мг метопролола в день.
Другие препараты в лечении тиреотоксического синдрома
Показаниями к использованию других препаратов (препаратов йода, карбоната лития, калия перхлората, холестирамина) служат либо тяжелое течение тиреотоксикоза и тиреотоксический криз, либо непереносимость основных средств лечения.
Препараты йода используют при тяжелом течении тиреотоксикоза, развитии тиреотоксического криза. В высоких концентрациях йод блокирует высвобождение готовых гормонов из ЩЖ, уменьшает транспорт йода и его окисление в фолликулярных клетках. Обычная доза - 5 капель (до 10-12 капель) раствора Люголя* в день или 0,5-1,0 мг натрия йодида в 1 л 0,9% раствора натрия хлорида внутривенно медленно. В лечении тяжелых форм тиреотоксикоза используют также пероральные йодсодержащие рентгеноконтрастные вещества (йоподат натрия).
Ингибиторный эффект йода носит транзиторный характер, уже через 48 ч начинается процесс «ускользания» от этого эффекта. Полное «ускользание» от ингибиторного эффекта йода наблюдают через 1-2 нед.
Карбонат лития используют при развитии побочных эффектов от тионамидов. Его действие заключается в уменьшении секреции тиреоидных гормонов, торможении конденсации йодтирозинов. Для лечения тиреотоксикоза назначают по 300 мг карбоната лития каждые 8 ч. При лечении литием необходимо контролировать его концентрацию в крови во избежание токсического действия.
Холестирамин, являясь ионообменной смолой, уменьшает реабсорбцию тиреоидных гормонов из энтерогепатической циркуляции. Обычно доза составляет 4 г 4 раза в день внутрь. Комбинация холестирамина и тионамидов позволяет получить более быстрое восстановление эутиреоза. Перхлорат калия применяют в случае непереносимости тионамидов. Использование его ограничено риском развития апластической анемии (при длительном использовании) и появлением нарушений со стороны желудочно-кишечного тракта. В России в последние годы не используется. В других странах перхлорат калия применяют для лечения амиодарониндуцированного тиреотоксикоза.
Лечение болезни Грейвса обычно продолжают до 1-1,5 лет, пытаясь достичь ремиссии. В процессе лечения возможно развитие как ятрогенного гипотиреоза, так и рецидива тиреотоксикоза. Для предупреждения гипотиреоза, а также для более вероятного достижения ремиссии больному добавляют тироксин или используют схему «блокада-замещение» (30 мг тиамазола в день и тироксин в суточной дозе, достаточной для ликвидации медикаментозного гипотиреоза, обычно 100-150 мкг). Однако ни одна из предложенных схем лечения не показала преимуществ, по крайней мере, в достижении ремиссии. О наступлении ремиссии судят по стойкой нормализации ТТГ, уменьшению размеров ЩЖ в процессе лечения и исчезновению тиреоидстимулирующих антител. Отсутствие ремиссии через 1-1,5 года лечения считают показанием к хирургической операции или лечению радиоактивным йодом.
Более раннее хирургическое лечение показано больным:
• при подозрении на злокачественные узлы ЩЖ;
• тяжелой офтальмопатии;
• беременности;
• в случае неэффективности и/или непереносимости консервативной терапии.
За 10 дней до операции больному назначают раствор Люголя* для уменьшения кровенаполнения ЩЖ.
В случае автономного тиреотоксикоза по достижении эутиреоза больному рекомендуют как обязательный этап лечения хирургическую операцию или лечение радиоактивным йодом.
Радиоактивный йод активно используют в США и странах Европы в лечении болезни Грейвса и автономного тиреотоксикоза во всех возрастных группах (в США даже у детей). Лечение радиоактивным йодом приводит к абляции ЩЖ без осложнений, свойственных хирургической операции. Этот вид терапии может быть использован как начальный или при развитии рецидива. Основное осложнение терапии радиоактивным йодом - ухудшение течения офтальмопатии.
После успешного лечения у большинства больных развивается гипотиреоз, который требует заместительной терапии тироксином. В России лечение радиоактивным йодом ограничено из-за малого количества специализированных центров.
В последние годы в лечении токсической аденомы используют спиртовую деструкцию ЩЖ. Метод является простым в исполнении и дешевым, но введение спирта сопровождается довольно выраженной болезненностью. Этот метод наиболее эффективен в лечении маленьких (2-2,5 см) токсических и претоксических аденом.
Лечение инфильтративной офтальмопатии
Большинство случаев офтальмопатии не требуют медикаментозного лечения. В 3-5% случаев тяжелой офтальмопатии могут требоваться лечение глюкокортикоидами (обычно пульс-терапия, иногда в комбинации с цитостатиками), лучевая терапия на область орбит, декомпрессионная хирургия.
В лечении претибиальной микседемы используют топические глюкокортикоиды (в виде мазей, ионофореза).
Субклинический тиреотоксикоз
Субклинический тиреотоксикоз - состояние, при котором отмечают низкий уровень ТТГ в сыворотке крови и нормальные концентрации Т3 и Т4. В последнее время принято выделять 2 категории больных субклиническим тиреотоксикозом в зависимости от содержания ТТГ в крови:
• менее 0,1 мМЕ/л;
• от 0,1 до 0,4 мМЕ/л.
Самой частой причиной субклинического тиреотоксикоза считают передозировку тироксина при лечении гипотиреоза или назначение больших доз тиреоидных гормонов при комплексном лечении дифференцированного рака ЩЖ (экзогенный субклинический тиреотоксикоз). Другие причины (эндогенного субклинического тиреотоксикоза) аналогичны таковым при клинически явном тиреотоксикозе. Распространенность субклинического тиреотоксикоза в общей популяции ва-
рьирует от 0,7 до 12,4%. Прогрессия в явный тиреотоксикоз составляет 1-5% в год. Несмотря на то что, по определению, клинические симптомы тиреотоксикоза у больных субклиническим тиреотоксикозом должны отсутствовать, некоторые из них могут быть обнаружены, а именно:
• фибрилляция предсердий;
• остеопения;
• снижение массы тела;
• ухудшение качества жизни.
Причем доказано, что более низкий уровень ТТГ (<0,1 мМЕ/л) сопровождается большей частотой клинических симптомов, преимущественно фибрилляцией предсердий.
ЛЕЧЕНИЕ
Лечение зависит от возраста больных, степени супрессии ТТГ, отсутствия или наличия клинических симптомов (фибрилляции предсердий, остеопений) и его причины. При выявлении передозировки тироксина дозу последнего следует уменьшить. Больному, который получает супрессивную терапию тироксином по поводу дифференцированного рака Щж, показаны р-адреноблокаторы.
При выявлении эндогенного субклинического тиреотоксикоза у молодых повторяют определение ТТГ через 6-12 мес. При сохранении низких значений ТТГ, особенно менее 0,1 ммЕ/л, и обнаружении симптомов тиреотоксикоза назначают р-адреноблокаторы. При субклиническом тиреотоксикозе, вызванном гиперподукцией тиреоидных гормонов, возможно назначение короткого курса тионамидов (3-6 мес). В любом случае необходимо выяснить причину субклинического тиреотоксикоза, поскольку последняя может повлиять на тактику лечения (см. «Тиреотоксический синдром»). У больных старшего возраста, женщин в постменопаузе и при уровне ТТГ ниже 0,1 ммЕ/л терапию обычно начинают сразу после выявления субклинического тиреотоксикоза. Характер лечения также зависит от причины субклинического тиреотоксикоза.
Тиреотоксический криз
Тиреотоксический криз - состояние крайней выраженности симптомов тиреотоксикоза, которое может быть фатальным, если его вовремя не распознать и не начать интенсивное лечение. Тиреотоксический криз обнаруживают у менее 10% больных, госпитализированных по поводу тиреотоксикоза, однако смертность от этого серьезного осложнения составляет 20-30%.
Основная причина тиреотоксического криза - недиагностированный и нелеченый тиреотоксикоз, в качестве провоцирующих факторов выступают тяжелые заболевания (инфаркт миокарда, инсульт, тромбоэмболия легочной артерии, тяжелые инфекции), операции, поступление в организм большого количества йода (введение рентгеноконтрастных средств, прием амиодарона).
КЛИНИЧЕСКАЯ КАРТИНА
Клинические проявления тиреотоксического криза сходны с таковыми при тиреотоксикозе. Не существует достаточно надежных критериев (включая уровень гормонов ЩЖ), которые бы позволили отличить тяжелый тиреотокскикоз от тиреотоксического криза. Однако можно выделить совокупность клинических симптомов, которые с высокой вероятностью указывают на развитие тиреотоксического криза. К ним относят:
• высокую лихорадку (>40 °С);
• тяжелое поражение центральной нервной системы (психоз, кому);
• необъяснимую желтуху;
• тахикардию (>140 в минуту);
• впервые возникшую фибрилляцию предсердий;
• отек легких.
ДИАГНОСТИКА
При тиреотоксическом кризе, так же как и при тиреотоксикозе, ТТГ будет супрессирован, а свободные Т4 и Т3 - повышены. У больных, находящихся в тяжелом состоянии, уровень свободного Т3 может значительно не повышаться.
Другие лабораторные изменения, сопутствующие тиреотоксическому кризу, включают:
• гипергликемию;
• гиперкальциемию;
• повышение печеночных ферментов;
• лейкоцитоз.
По некоторым данным, больные тиреотоксическим кризом имеют риск развития надпочечниковой недостаточности.
ЛЕЧЕНИЕ
Лечение тиреотоксического криза состоит в назначении препаратов, блокирующих синтез, высвобождение и периферическую конверсию тиреоидных гормонов, симптоматической терапии и лечении сопутствующих и/или вызвавших криз заболеваний (табл. 59-4, 59-5).
Таблица S9-4. Лечение тиреотоксического криза (основная терапия)
Таблица 59-5. Лечение тиреотоксического синдрома (поддерживающая терапия)
Гипотиреоз
Гипотиреозом называют состояние, вызванное недостаточным воздействием тиреоидных гормонов на органы и ткани.
В общей популяции распространенность гипотиреоза составляет 0,5-1%. Врожденный гипотиреоз диагностируют у 1 ребенка на каждые 4000 новорожденных. У взрослых (>65 лет) - в 2-4% случаев. Субклинический гипотиреоз находят у 4,3% населения и у 15% женщин старшего возраста.
ЭТИОЛОГИЯ
Чаще других встречается первичный гипотиреоз, связанный с поражением собственно ЩЖ, обычно аутоиммунным процессом. Хронический аутоиммунный тиреоидит - основная причина первичного гипотиреоза, по крайней мере, в регионах с достаточным снабжением йодом. Первичный гипотиреоз развивается после лечения радиоактивным йодом и нередко после хирургического лечения тиреотоксикоза, вызванного болезнью Грейвса или многоузловым токсическим зобом. Тяжелый дефицит йода служит частой причиной врожденного гипотиреоза в йоддефицитных регионах, он может вызвать эндемический кретинизм у детей. Ятрогенный гипотиреоз, связанный с передозировкой тионамидов, обычно проходит после коррекции терапии. Гипотиреоз можно обнаружить у больных, получающих лучевую терапию лимфомы Ходжкина, опухолей гортани. Редкие энзиматические дефекты могут вызывать нарушение гормоногенеза и зобогенный гипотиреоз.
Вторичный гипотиреоз - результат сниженной продукции ТТГ вследствие гипопитуитаризма если в качестве причины распознается дефицит тиротропин-рилизинг гормона, гипотиреоз называют третичным. Причины гипотиреоза перечислены в табл. 59-6.
Таблица 59-6. Классификация причин гипотиреоза
КЛИНИЧЕСКАЯ КАРТИНА
Спектр клинических проявлений гипотиреоза (табл. 59-7) варьирует от слабовыраженных и неспецифических симптомов до клинически явной картины микседемы (генерализованного слизистого отека). Больные гипотиреозом часто предъявляют жалобы на плохую переносимость холода, запор, ухудшение качества и выпадение волос, снижение памяти. Небольшая прибавка массы тела, связанная со снижением метаболических процессов, может быть следствием гипотиреоза. При физикальном обследовании у больных гипотиреозом выявляют типичные изменения, вызванные слизистым отеком. Слизистый отек развивается в результате опосредованного высокой концентрацией ТТГ (и в меньшей степени - низкими концентрациями Т4 и Т3) накопления глюкозоаминогликанов в дерме и слизистых оболочках. Возможно, накопление глюкозоаминогликанов вызвано действием тиреоидстимулирующих антител (при аутоиммунном гипотиреозе). Глюкозоаминогликаны - осмотически активные вещества, они способствуют задержке воды и появлению специфического отека (слизистого отека, микседемы). К клиническим
проявлениям микседемы относят отек лица, в том числе периорбитальный. Кожа больных гипотиреозом холодная, сухая, бледная, лицо одутловатое, с периорбитальным отеком. Отек гортани голосовых связок приводит к появлению более низкого тембра голоса, осиплости, отек языка - к невнятной речи.
Снижение уровня тиреоидных гормонов у взрослых сопровождается замедлением всех интеллектуальных функций, включая речь. У больных гипотиреозом старшего возраста могут развиться деменция и психоз.
Заболевание приводит к синусовой брадикардии, синоатриальным и атриовентрикулярным блокадам. Развитие полной атриовентрикулярной блокады для гипотиреоза нехарактерно. Сердце больного гипотиреозом может быть увеличено, главным образом за счет перикардиального выпота. При эхокардиографии в некоторых случаях обнаруживают асимметричную гипертрофию межжелудочковой перегородки с обструкцией путей оттока из левого желудочка.
Плевральный выпот и даже асцит могут быть выявлены у больного гипотиреозом.
Сочетание плеврального, перикардиального выпота и асцита, характерное для тяжелого гипотиреоза, может вызвать подозрение на системное заболевание соединительной ткани.
Артралгии довольно часто встречаются при гипотиреозе, но артрит - крайне редко. Сочетание суставного синдрома с мышечными болями, мышечной слабостью и повышенной КФК может вызвать ложное подозрение на ревматическую полимиалгию или полимиозит.
У женщин репродуктивного возраста гипотиреоз вызывает ановуляторные дисфункциональные маточные кровотечения, нарушение фертильности, а в случае наступления беременности - прерывание ее на ранних сроках. У мужчин гипотиреоз может вызвать эректильную дисфункцию и снижение либидо.
Тиреоидные гормоны необходимы для адекватного кроветворения, в условиях их дефицита развивается гипопролиферативная анемия. Анемия у больного гипотиреозом может быть также гипохромной, железодефицитной вследствие связанной с гиперполименореей кровопотери. Аутоиммунный гипотиреоз может сочетаться с витамином В12-дефицитной анемией. Известно, что явный гипотиреоз обнаруживают у 11,7%, а субклинический - у 14,7% больных с витамином В12дефицитной анемией.
Некоторые сопровождающие гипотиреоз биохимические нарушения могут привести к неправильной диагностике других заболеваний. Так,
повышение КФК, в том числе МВ-фракции, иногда приводит к неправильному диагнозу не только ревматической полимиалгии, но и инфаркта миокарда. Сочетание запора, иногда очень тяжелого, с характерным для гипотиреоза повышением раково-эмбрионального антигена, может вызвать подозрение на опухоль кишечника. Гиперпролактинемия, развивающаяся при первичном гипотиреозе из-за повышения тиротропинрилизинг-гормона, иногда приводит к неправильному диагнозу пролактинсекретирующей аденомы гипофиза. Высокий уровень холестерина вызывает подозрение на первичные нарушения липидного обмена.
Таблица 59-7. Клинические проявления гипотиреоза
ДИАГНОСТИКА
При подозрении на первичный гипотиреоз следует оценить сывороточную концентрацию ТТГ. Повышенная концентрация ТТГ (>4,55,0 мМЕ/л) подтверждает наличие первичного гипотиреоза и требует определения свободного Т4. Нормальное значение этого показателя свидетельствует о наличии у больного субклинического гипотиреоза. Сниженная концентрация свободного Т4 в сыворотке крови подтверждает явный гипотиреоз (ТТГ в этих случаях, как правило, выше 10 мМЕ/л). При диагностике гипотиреоза свободный Т3 не оценивают в связи с тем, что, с одной стороны, он долго остается нормальным у таких больных, с другой - существует много состояний (синдром «низкого Т3»), при которых отмечают низкое значение этого гормона. Повышение концентрации антитиреоидных антител (лучше - антипероксидазных) в сыворотке крови указывает на этиологию гипотиреоза - аутоиммунный тиреоидит.
ЛЕЧЕНИЕ
Препаратом выбора для лечения гипотиреоза считают левотироксин натрия, средняя заместительная доза его обычно составляет 1,6-1,7 мкг/кг массы тела или 100-125 мкг/сут.
Начальная доза зависит от длительности заболевания, возраста больных, а также от наличия или отсутствия сопутствующей патологии (преимущественно сердечно-сосудистой), У молодых лечение начинают с 50 мкг левотироксина натрия в сутки, увеличивают его постепенно, прибавляя 25-50 мкг 1-2 раза в неделю. У лиц старшего возраста, больных сердечно-сосудистой патологией начальная доза левотироксина натрия составляет 25 мкг (или даже 12,5 мкг) в сутки, увеличение происходит еще медленнее, а именно на 12,5-25,0 мкг каждые 3-4 нед. Наличие у больного стенокардии не считают противопоказанием к назначению левотироксина натрия. Успешная заместительная терапия может сопровождаться улучшением переносимости физических нагрузок, уменьшением потребности в антиангинальных средствах. Следует соблюдать особую осторожность в случае, когда доза левотироксина натрия возрастет настолько, что значения ТТГ будут почти целевыми.
Мониторинг терапии осуществляют по клиническим проявлениям и уровню ТТГ. Последний оценивают через 6-8 нед после клинического улучшения и любого изменения дозы. Целевое значение ТТГ составляет 0,5-3,0 мМЕ/л. Часть больных гипотиреозом нуждаются в заместительной терапии препаратами железа для лечения нормоили гипохромной анемии. Исходно высокий при гипотиреозе уровень холестерина снижается на фоне адекватной заместительной терапии левотироксином
натрия, однако сохраняющаяся гиперхолестеринемия часто требует дополнительного назначения статинов.
Гипотиреоидная кома
Гипотиреоидная (микседематозная) кома - конечная стадия тяжелого, длительно существующего гипотиреоза. Развивается у больных старшего возраста с нелеченым гипотиреозом в холодное время года или после длительного пребывания на холоде, а также при других предрасполагающих факторах:
• пневмонии;
• остром нарушении мозгового кровообращения;
• применении некоторых лекарств.
Гипотиреоидную кому следует подозревать при наличии у больного следующих клинических и лабораторных признаков:
• типичного внешнего вида;
• брадикардии, гипотонии;
• сопора, ступора или комы;
• гипонатриемии;
• паралитической кишечной непроходимости;
• плеврального и перикардиального выпота;
• гипотермии.
ЛЕЧЕНИЕ
Лечение гипотиреоидной комы начинают немедленно (табл. 59-8). Больному назначают большие дозы левотироксина натрия (L-тироксина♠) или лиотиронина (трийодтиронина♠) внутривенно или внутрь через тонкий зонд каждые 6 ч в течение первых 2-3 дней с постепенным снижением дозы до заместительной. Одновременно назначают глюкокортикоиды. Обязательный элемент лечения - респираторная поддержка и адекватная оксигенация. Больному показаны также адекватная регидратация и лечение сопутствующей патологии.
Таблица 59-8. Врачебная тактика при подозрении на гипотиреоидную кому
Субклинический гипотиреоз
Субклинический гипотиреоз (СГ) представляет собой слабовыраженную недостаточность тиреоидных гормонов, характеризуемую повышением ТТГ и нормальным значением свободного Т4. По уровню ТТГ больных делят на 2 категории:
• со слабовыраженным повышением ТТГ (4,5-10,0 мМЕ/л);
• более выраженным (>10 мМЕ/л).
ЭТИОЛОГИЯ
Этиология субклинического гипотиреоза подобна таковой явному. Распространенность СГ в разных популяциях колеблется от 4 до 10%. Прогрессия субклинического гипотиреоза в явный в определенной степени зависит от причины недостаточной продукции тиреоидных гормонов. Риск развития явного гипотиреоза повышен у лиц старшего возраста, имеющих антитиреоидные антитела и более высокий исходный уровень ТТГ.
КЛИНИЧЕСКАЯ КАРТИНА
Вопрос о наличии клинических симптомов у больного субклиническим гипотиреозом остается спорным. По крайней мере, невозможно отличить эутиреоидного больного от больного субклиническим гипотиреозом только на основании клинических симптомов. У больных субклиническим, так же как и явным, гипотиреозом часто обнаруживают артериальную гипертензию, диастолическую дисфункцию левого желудочка, маркеры повышенного риска развития атеросклероза. Данные о развитии атерогенной дислипидемии у больных субклиническим гипотиреозом носят противоречивый характер. У женщин репродуктивного возраста даже слабовыраженное повышение ТТГ может приводить к нарушению овуляции и фертильности.
ЛЕЧЕНИЕ
Заместительную терапию левотироксином натрия (L-тироксином♠) рекомендуют не всем больным субклиническим гипотиреозом. Показанием к лечению считают:
• наличие клинических симптомов, особенно у больных с факторами риска развития сердечно-сосудистых болезней;
• беременность;
• нарушения овуляции и фертильности;
• сочетание зоба и повышенного титра антитиреоидных антител.
Небольшие дозы (25-50 мкг L-тироксина♠ в сутки) оказываются достаточными для компенсации гипотиреоза у большинства больных.
Тиреоидиты
Тиреоидиты представляют собой гетерогенную группу воспалительных заболеваний ЩЖ (табл. 59-9). Их можно разделить по течению:
• на острые;
• подострые;
• хронические.
Таблица 59-9. Классификация тиреоидитов
Острый гнойный тиреоидит
Острый гнойный тиреоидит встречается редко. Болеют чаще женщины в возрасте от 20 до 40 лет. В 50% случаев заболевание возникает на фоне зоба. Возбудителями острого тиреоидита могут быть:
• бактерии (стрептококки, золотистый стафилококк, пневмококк);
• грибы;
• паразиты;
• пневмоцисты.
КЛИНИЧЕСКАЯ КАРТИНА
Клиническая картина складывается:
• из синдрома интоксикации:
- высокая лихорадка;
- озноб;
- повышенная потливость;
• местных симптомов:
- боли в области передней поверхности шеи с иррадиацией в верхнюю челюсть, ухо;
- отек;
- гиперемия;
- повышение местной температуры;
- болезненность при пальпации.
У больного иногда обнаруживают фарингит, дисфагию.
ДИАГНОСТИКА
В клиническом анализе крови больного острым тиреоидитом обнаруживают лейкоцитоз со сдвигом формулы влево и повышение СОЭ. Захват I123, в отличие от подострого тиреоидита, - в пределах нормальных значений. Сцинтиграфия ЩЖ выявляет «холодный» очаг, УЗИ ЩЖ - гипоэхогенную зону или кисту. В некоторых случаях с диагностической и лечебной целью выполняют тонкоигольную аспирационную биопсию ЩЖ.
ЛЕЧЕНИЕ
Лечение больного острым тиреоидитом включает обязательную госпитализацию и парентеральное введение антибиотиков. При необходимости выполняют дренаж и эвакуацию содержимого.
Подострый болевой тиреоидит де Кервена
Подострый болевой тиреоидит представляет собой воспалительное заболевание ЩЖ вирусной природы. В ответ на вирусную инвазию в ЩЖ развивается аутоиммунная воспалительная реакция, морфологически представленная лимфоидной инфильтрацией, скоплением многоядерных гигантских клеток с образованием гранулем, эпителиоидными клетками, повреждением фолликулов. Заболевание описал впервые в 1904 г. де Кервен. Сегодня его обнаруживают у 5% лиц, обращающихся к врачу по поводу каких-либо проблем с ЩЖ.
КЛИНИЧЕСКАЯ КАРТИНА
Выделяют несколько стадий течения заболевания. Часто у больных обнаруживается вирусная продрома, после которой спустя некоторое время развивается первая стадия - болевая. Болевой синдром локализуется на передней поверхности шеи с иррадиацией боли в нижнюю челюсть, ухо, шею, иногда - в грудную клетку. ЩЖ при пальпации плот-
ная, измененная за счет резко болезненных участков. Из общих симптомов у больного наблюдаются слабость, высокая лихорадка. Уже на этой стадии могут появляться симптомы второй стадии - тиреотоксической. Тиреотоксикоз (явный или субклинический) возникает в результате деструкции ЩЖ и утечки тиреоидных гормонов. Тиреотоксикоз обычно нетяжелый, всегда преходящий, его симптомы можно перепутать с общими симптомами воспаления. Следующая стадия - выздоровление, однако ей может предшествовать гипотиреоидная стадия. Гипотиреоз у большинства больных также преходящий, однако в ряде случаев (5-15%) возможно развитие постоянного гипотиреоза. Подострый тиреоидит, как любая вирусная инфекция, склонен к самоизлечению. При благополучном течении подострого тиреоидита выздоровление наступает через 4-6 нед. Однако заболевание склонно к рецидивирующему течению, продолжительность его может увеличиться до 12 мес.
ДИАГНОСТИКА
Заболевание имеет типичные клинические проявления, однако требует лабораторной диагностики. В отличие от острого гнойного тиреоидита, уровень лейкоцитов в периферической крови нормальный или очень незначительно повышен, лейкоцитарная формула не изменена. Отмечают выраженное увеличение СОЭ (его значения обычно превышают 40-60). Захват I123 ЩЖ низкий. Сочетание повышенной СОЭ и низкого захвата I123 - патогномоничные для подострого тиреоидита признаки. Уровень ТТГ и гормонов ЩЖ зависит от стадии заболевания (тиреотоксическая или гипотиреоидная). При УЗИ ЩЖ находят типичные для заболевания изменения, что помогает в его диагностике.
ЛЕЧЕНИЕ
У части больных заболевание проходит самостоятельно, однако большинству требуется лечение. При нетяжелом течении назначают НПВС, однако чаще в лечении подострого болевого тиреоидита используют глюкокортикоидные гормоны - преднизолон в дозе 30-40 мг/сут. Клиническое улучшение происходит в течение 24-48 ч. Дозу преднизолона начинают уменьшать после нормализации или существенного снижения СОЭ (обычно через неделю). Признаками выздоровления считают нормализацию ТТГ и восстановление захвата I123. Клинические симптомы тиреотоксикоза контролируют с помощью р-адреноблокаторов. В некоторых случаях гипотиреоз требует заместительной терапии L-тироксином♠. Поскольку гипотиреоз во многих случаях носит тран-
зиторный характер, лечение целесообразно проводить под контролем ТТГ для своевременной отмены L-тироксина♠.
Безболевой тиреоидит
Безболевой тиреоидит - заболевание ЩЖ, проявляющееся преходящим тиреотоксическим синдромом, связанным с низким захватом I123. Заболевание описано в 2 вариантах - спорадическом и послеродовом. Его обнаруживают у 5-20% пациентов как причину тиреотоксического синдрома.
Заболевание относят к группе аутоиммунных. Оно характеризуется лимфоидной инфильтрацией ЩЖ, появлением в крови больных антипероксидазных и антитиреоглобулиновых антител. Болеют чаще женщины в возрасте 30-60 лет. Заболевание начинается с клинических проявлений тиреотоксикоза, длительность которого колеблется от нескольких недель до нескольких месяцев. После тиреотоксической стадии, как и при подостром болевом тиреоидите, может восстановиться эутиреоз или появиться преходящий гипотиреоз. Постоянный гипотиреоз развивается у 5-20% больных. ЩЖ увеличена лишь у 50%, безболезненна при пальпации.
ДИАГНОЗ
Безболевой тиреоидит встречается значительно чаще, чем распознается. Лабораторные данные включают супрессированный ТТГ и нормальный (субклинический тиреотоксикоз), или повышенный уровень тиреоидных гормонов (явный тиреотоксикоз) в тиреотоксическую стадию, или повышенный ТТГ и нормальный (субклинический гипотиреоз), или низкий (явный гипотиреоз) уровень с Т4. Захват I123 ЩЖ низкий. У многих больных в сыворотке крови обнаруживают антитиреоидные антитела (антипероксидазные и/или антитиреоглобулиновые). СОЭ и количество лейкоцитов в крови в норме.
ЛЕЧЕНИЕ
Лечение заболевания состоит в купировании симптомов тиреотоксикоза с помощью р-адреноблокаторов. При развитии гипотиреоза - заместительная терапия L-тироксином♠.
Послеродовой тиреоидит
Послеродовой тиреоидит считают вариантом безболевого с известным началом - после родов. Распространенность послеродового тиреоидита среди женщин с нормально протекающей беременностью
составляет примерно 7,5%. Пусковым механизмом послеродового тиреоидита считают прекращение связанной с беременностью длительной иммуносупрессии. Тиреотоксическую стадию, начинающуюся обычно на 8-16-й неделе после родов и длящуюся от 8 нед до 8 мес, часто не диагностируют. Заболевание обычно распознают в следующей гипотиреоидной стадии. Гипотиреоидная стадия характеризуется не только разной степенью выраженности симптомов недостатка тиреоидных гормонов, но и значительным увеличением ЩЖ. На этой же стадии у женщин выявляют высокий титр антипероксидазных антител. Длительный или даже постоянный гипотиреоз развивается у 25% женщин. Заболевание рецидивирует при последующих беременностях. Повышенный титр антитиреоидных антител, обнаруженный на ранних сроках беременности, служит предвестником развития послеродового тиреоидита.
Диагностика сводится к оценке функции ЩЖ. Радиометрию ЩЖ не рекомендуют выполнять, поскольку большинство женщин являются кормящими.
Лечение аналогично таковому при спорадическом варианте безболевого тиреоидита.
Хронический аутоиммунный тиреоидит
Хронический аутоиммунный тиреоидит - воспалительное заболевание щитовидной железы, характеризуемое инфильтрацией ее лимфоидными и плазматическими клетками и наличием той или иной степени выраженности фиброза.
Хронический аутоиммунный тиреоидит - одно из самых частых заболеваний ЩЖ аутоиммунной природы и основная причина гипотиреоза в регионах с достаточным снабжением йодом (аутоиммунный гипотиреоз). Принято выделять 2 формы заболевания:
• с зобом (зобогенный, тиреоидит Хасимото);
• без зоба (атрофический тиреоидит).
КЛИНИЧЕСКАЯ КАРТИНА
Основное клиническое проявление хронического аутоиммунного тиреоидита (по крайней мере, зобогенного варианта) - увеличенная, плотная, с нервной поверхностью, безболезненная ЩЖ. Большинство больных хроническим аутоиммунным тиреоидитом эутиреоидны, у 2050% обнаруживают гипотиреоз, у 5-10% - тиреотоксический синдром. Гипертиреоз обычно постоянный. Тиреотоксический синдром может быть результатом утечки тиреоидных гормонов из-за деструктивного тиреоидита или развиться вследствие гиперпродукции гормонов.
Хронический аутоиммунный тиреоидит, как и болезнь Грейвса, может сочетаться с другими заболеваниями аутоиммунной природы (СД 1-го типа, болезнью Аддисона, пернициозной анемией и др.).
ДИАГНОСТИКА
Выявление у больного спонтанного гипотиреоза (явного или субклинического) в регионах с достаточным снабжением йодом с высокой вероятностью свидетельствует о хроническом аутоиммунном тиреоидите.
Диагноз заболевания подтверждают с помощью определения антител к ЩЖ. Аутоантитела к тиреоглобулину находят у 60% больных хроническим аутоиммунным тиреоидитом, антимикросомальные антитела - у 95% больных. Антитела к рецептору для ТТГ имеют 10% больных зобогенным аутоиммунным тиреоидитом и 20% - атрофическим вариантом.
У 18-77% больных хроническим аутоиммунным тиреоидитом находят характерные УЗИ-признаки:
• увеличение ЩЖ;
• гипоэхогенную и неоднородную структуру.
Выявление у больного хронического аутоиммунного тиреоидита - показание к оценке функции ЩЖ.
ЛЕЧЕНИЕ
Хронический аутоиммунный тиреоидит обычно не требует лечения. Показанием к лечению считают нарушение функции ЩЖ. Показанием к хирургическому лечению служит большой зоб с синдромом сдавления органов средостения.
Тиреоидит Риделя
Фиброзный тиреоидит Риделя - крайне редкое заболевание. Этиология неизвестна. Заболевание характеризуется интенсивным фиброзом железы с инвазией фиброзных волокон через ее капсулу и фиброзом окружающих структур.
Больные предъявляют жалобы на дискомфорт в области шеи. Щитовидная железа обычно увеличена, резко уплотнена («каменистой плотности»), безболезненна при пальпации. Обычно поражены обе доли. Функция железы часто сохранена, при поражении всей железы может развиться гипотиреоз. Нередко фиброзный тиреоидит сочетается с пролиферацией фиброзной ткани вне ЩЖ и приводит к развитию медиа-
стинального и ретроперитонеального фиброза, фиброзного холангита, а также фиброза слюнных и слезных желез.
Заболевание можно заподозрить на основании клинических данных. Диагноз устанавливают на основании гистологического исследования, выполненного после хирургической декомпрессии. Тонкоигольная аспирационная биопсия ЩЖ неинформативна. Описаны спонтанные ремиссии заболевания.
Амиодарониндуцированная дисфункция щитовидной железы
Амиодарон (кордарон♠) - богатое йодом антиаритмическое лекарственное средство III класса, которое до сих пор широко используют для лечения различных нарушений сердечного ритма. Вследствие высокого содержания йода амиодарон способен оказывать комплексное воздействие на ЩЖ, которое варьирует от изменения тестов, оценивающих функцию ЩЖ (эутиреоидной гипертироксинемии), до явных нарушений ее функции. Сразу после начала терапии амиодароном повышается сывороточная концентрации Т4 и снижается уровень Т3, в основном за счет торможения периферической конверсии Т4 в Т3. Уровень ТТГ также повышается сразу после начала терапии амиодароном. Все изменения носят преходящий характер, исчезают обычно к концу 3-го месяца лечения и не являются проявлением дисфункции ЩЖ. У 14-18% лиц, получающих амиодарон, возможно развитие нарушений функции ЩЖ.
Вариант вызванного амиодароном нарушения функции ЩЖ в значительной степени зависит от йодообеспечения региона. У больных, проживающих в областях с высоким потреблением йода, чаще развивается амиодарониндуцированный гипотиреоз, а в регионах с низким потреблением йода - амиодарониндуцированный тиреотоксикоз.
Амиодарониндуцированный гипотиреоз
Амиодарониндуцированный гипотиреоз чаще обнаруживают у женщин и лиц старшего возраста. Предшествующий амиодарониндуцированный тиреотоксикоз значительно увеличивает риск амиодарониндуцированного гипотиреоза. Диагноз амиодарониндуцированного гипотиреоза, так же как и гипотиреоза другой этиологии, подтверждают с помощью стандартных лабораторных тестов. Следует помнить, что преходящее повышение ТТГ в течение первых месяцев лечения наблюдается почти у всех больных, получающих амиодарон, и не требует лечения. Принципы заместительной терапии L-тироксином* не отличаются от таковых при гипотиреозе другой этиологии.
Известны 2 типа амиодарониндуцированного тиреотоксикоза.
• Тип I развивается вследствие индуцированной йодом избыточной продукции тиреоидных гормонов ЩЖ лицами, уже имеющими какое-либо ее заболевание. Хроническое избыточное употребление йода может привести к развитию автономного тиреотоксикоза (функциональной тиреоидной автономии ЩЖ) у больных узловым зобом или сделать явной латентно протекавшую болезнь Грейвса.
• Тип II - тиреотоксикоз «утечки» - результат индукции амиодароном деструктивного тиреоидита у лиц с неизмененной ЩЖ.
Дифференциальная диагностика амиодарониндуцированного тиреотоксикоза I и II типа не представляет затруднений в тех случаях, когда причиной амиодарониндуцированного тиреотоксикоза I служит автономный тиреотоксикоз (функциональная автономия ЩЖ), и затруднен, когда в основе развития тиреотоксикоза лежит болезнь Грейвса (табл. 59-10). Затрудняет дифференциальную диагностику также наличие смешанных форм заболевания. Определенную помощь в дифференциальной диагностике амиодарониндуцированного тиреотоксикоза I и II типа может оказать оценка свободных тиреоидных гормонов. При амиодарониндуцированном тиреотоксикозе I типа, связанном с болезнью Грейвса, обнаруживают значительное повышение Т4 и Т3, в то время как при деструктивном тиреоидите Т3 значительно не повышается. Кроме того, у больных амиодарониндуцированным тиреотоксикозом I типа, связанным с болезнью Грейвса, наблюдают повышение титра антител к рецептору ТТГ.
Таблица 59-10. Отличия типов амиодарониндуцированного гипотиреоза
ЛЕЧЕНИЕ
В отличие от амиодарониндуцированного гипотиреоза, лечение амиодарониндуцированного тиреотоксикоза связано с большими трудностями. Больным амиодарониндуцированным тиреотоксикозом I типа
назначают большие дозы тионамидов (тиамазол - тирозол*, мерказолил* в дозе 40-60 мг/сут или пропилтиоурацил в дозе 600-800 мг/сут). При амиодарониндуцированном тиреотоксикозе II типа показана терапия глюкокортикоидами (дозы преднизолона варьируют от 15 до 80 мг/ сут) в течение 7-12 нед. В случае затруднений в определении типа амиодарониндуцированного тиреотоксикоза или подозрении на смешанный вариант рекомендуют комбинацию тионамидов и глюкокортикоидов. В случае неуспешного лечения некоторые авторы рекомендуют тотальную или субтотальную тиреоидэктомию.
Узловые образования щитовидной железы (узловой нетоксический зоб)
Узлом ЩЖ называют образование, которое при пальпации и/или ультразвуковом исследовании отчетливо определяется как отличное от окружающей паренхимы. Узлом в ЩЖ может проявляться любое ее заболевание, узловые образования - самая частая патология ЩЖ. По данным пальпации, распространенность узлов ЩЖ (узлового зоба) в общей популяции составляет 3-7%, по данным УЗИ - 20-76%.
ПАТОГЕНЕЗ
Развитие узловых образований в ЩЖ связывают с генетически детерминированной гетерогенностью тироцитов. Гетерогенность тироцитов проявляется различным ростовым потенциалом клеток, различной способностью к йодинации. В результате появляются клоны тироцитов, обладающие более высокой пролиферативной активностью, способные давать начало узловым образованиям. В йоддефицитных регионах большой вклад в патогенез узлов вносит дефицит йода, который, с одной стороны, усиливает продукцию ТТГ и чувствительность тироцитов к его действию, с другой - усиливает продукцию ростовых факторов (ИРФ-
1, ЭРФ и др.).
КЛИНИЧЕСКАЯ КАРТИНА
Единственным клиническим проявлением узлового зоба может быть лишь факт наличия узла ЩЖ. При очень больших размерах узла (узлов), расположении его за грудиной могут появиться симптомы сдавления органов средостения: нарушение глотания, охриплость голоса и т.д. Часть узлов ЩЖ со временем становятся автономными и вызывают тиреотоксикоз. Подавляющее число узловых образований - доброкачественные, распространенность рака среди узлов ЩЖ составляет 5-10%.
ДИАГНОСТИКА
При клинической оценке обращают внимание на факторы, увеличивающие риск злокачественности узла ЩЖ (табл. 59-11). Определяют функцию ЩЖ, выявляя тем самым гиперфункционирующие узлы, и выполняют морфологическую диагностику для исключения злокачественных узлов и подозрительных на злокачественные. В качестве первого шага оценивают концентрацию ТТГ в сыворотке крови. Если уровень ТТГ низкий (<0,5 мМЕ/л), определяют свободный Т3 и свободный Т4, если высокий (>4,5-5 мМЕ/л) - свободный Т4 и антитела к тиреоидной пероксидазе. Рутинное измерение тироглобулина не рекомендуют. Кальцитонин определяют при наличии в семейном анамнезе медуллярного рака. Сцинтиграфию выполняют при низком значении ТТГ, в йоддефицитных регионах - при пограничных значениях ТТГ.
Таблица 59-11. Факторы, увеличивающие риск злокачественности узла в щитовидной железе
УЗИ ЩЖ позволяет выявить, действительно ли в ЩЖ есть узел, уточнить его локализацию, а также определить, есть ли другие узлы.
Тонкоигольную аспирационную биопсию и цитологическое исследование полученного материала выполняют при наличии любого (негиперфункционирующего) узла, размер которого превышает 1 см.
ЛЕЧЕНИЕ
Хирургическое лечение показано при выявлении злокачественных узлов и подозрительных на злокачественные. Доброкачественные по результатам тонкоигольной аспирационной биопсии узлы наблюдают. Доброкачественные узлы оперируют, если они оказываются автономными, большими настолько, что приводят к синдрому сдавления или косметическим дефектам, а также если выявлена сопутствующая болезнь Грейвса. Рост доброкачественного узла, по некоторым данным, также считают показанием к хирургическому лечению.
Глава 60. ЗАБОЛЕВАНИЯ КОРЫ НАДПОЧЕЧНИКОВ
Физиология
Надпочечники расположены над верхними полюсами почек, в окружающей их клетчатке. И гистологически, и эмбриологически надпочечники представляют собой 2 разных органа:
• корковый слой - образован из мезенхимальной ткани;
• мозговой слой - нейроэктодермального происхождения.
В 3 зонах коркового слоя образуются основные классы стероидных гормонов.
• В наружной клубочковой зоне образуются минералокортикоиды, основной из которых - альдостерон.
• Промежуточная пучковая зона является источником кортизола и некоторых других глюкокортикоидов.
• Во внутренней сетчатой зоне продуцируются надпочечниковые андрогены, главным образом дегидроэпиандростерон и дегидроэпиандростерона сульфат (ДГЭС), андростендион и небольшое количество эстрогенов.
Меньшую часть, около 10% надпочечника, составляет мозговой слой, являющийся источником катехоламинов - адреналина и норадреналина.
Схема биосинтеза надпочечниковых стероидов представлена на рис. 60-1.
ФУНКЦИЯ ГОРМОНОВ НАДПОЧЕЧНИКОВ
Альдостерон и другие минералокортикоиды, связываясь со специфическими рецепторами в дистальных почечных канальцах, вызывают увеличение реабсорбции натрия, секреции калия и ионов водорода, что приводит к увеличению объема внеклеточной жидкости и гипокалиемии. Синтез альдостерона надпочечниками регулируется в основном гиперкалиемией и ангиотензином II. Последний под действием ренина увеличивает синтез и активность альдостеронсинтетазы в клубочковой зоне надпочечников. Продукция ренина юкстагломерулярным
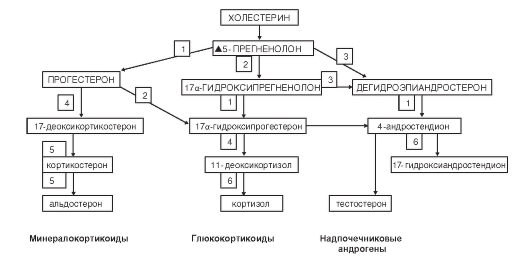
Рис. 60-1. Схема биосинтеза надпочечниковых стероидов. Ферменты, участвующие в биосинтезе надпочечниковых стероидов: 1 - 3-гидроксистероиддегидрогеназа; 2 - 17-гидроксилаза; 3 - 17,20-лиаза; 4 - 21-гидроксилаза; 5 -альдостеронсинтетаза; 6 - 11-гидроксилаза
аппаратом почек, в свою очередь, возрастает в ответ на гиповолемию, снижение плазменной концентрации натрия и повышение стимуляции симпатической нервной системы. Адренокортикотропный гормон гипофиза (АКТГ) оказывает незначительный эффект на продукцию альдостерона. Тормозят высвобождение альдостерона надпочечниками:
• высокая концентрация его в плазме;
• восстановление объема циркулирующей крови;
• нормализация артериального давления с уменьшением активности ренин-ангиотензиновой системы.
Кортизол и другие глюкокортикоиды, связываясь с экспрессируемыми многими тканями организма глюкокортикоидными рецепторами 2-го типа и их изоформами, участвуют в регуляции метаболизма углеводов, жиров, белков, кальция, процессах воспаления, оказывают влияние на иммунную систему, распределение воды в организме и поведенческие реакции. Кортизол обладает слабым минералокортикоидным эффектом, который может усиливаться в условиях хронической гиперкортизолемии. Основные эффекты глюкокортикоидов перечислены в табл. 60-1. У здоровых людей продукцию кортизола надпочечниками стимулирует АКТГ и другие продуцируемые совместно с ним пептиды в составе проопиомеланокортина. В свою очередь, высвобождение
АКТГ из гипофиза регулируется кортикотропин-рилизинг-гормоном и аргинин-вазопрессином. Кортизол по принципу отрицательной обратной связи подавляет секрецию как АКТГ, так и кортикотропинрилизинг-гормона. Важной особенностью кортизола и регулирующих его продукцию пептидов считают циркадный ритм секреции с максимальной концентрацией в плазме крови в ранние утренние часы и минимальной - к полуночи.
Таблица 60-1. Эффекты глюкокортикоидов
Дегидроэпиандростерон - основной андроген надпочечников. Из него, как и из других надпочечниковых андрогенов (андростендиона и 11-гидроксиандростендиона), в периферических тканях образуется тестостерон. Известно, что надпочечниковые андрогены принимают участие в формировании вторичных половых признаков у мужчин и женщин, другие их эффекты (особенно дегидроэпиандростерона) в настоящее время активно изучаются. Секреция надпочечниковых андрогенов и эстрогенов контролируется АКТГ.
Клетки мозгового слоя надпочечников (называемые еще хромаффинными из-за специфического коричневого цвета окрашивания солями хрома) синтезируют, хранят и высвобождают в периферическую циркуляцию адреналин и норадреналин. Если адреналин продуцируется только мозговым слоем надпочечников, то норадреналин - еще и периферическими симпатическими нервами. Катехоламины обладают широким спектром действия на сердечно-сосудистую систему (увеличивают частоту сердечных сокращений, сердечный выброс, сократимость миокарда, ускоряют проводимость, повышают артериальное давление), метаболические процессы. Допамин, предшественник норадреналина, находят в мозговом слое надпочечников и периферической нервной системе. Допамин действует как нейротрансмиттер в центральной нервной системе.
Болезни коры надпочечников
В подавляющем большинстве случаев спектр патологии надпочечников представлен нарушением функции и/или морфологическими изменениями органа. Нарушение функции, в свою очередь, проявляется в гиперпродукции обычно одного из гормонов:
• кортизола (синдром Кушинга);
• альдостерона (первичный альдостеронизм);
• тестостерона или эстрогенов (опухоли, продуцирующие половые гормоны).
При врожденной гиперплазии надпочечников наблюдают сочетание гиперандрогенемии с разной степенью снижения продукции кортизола (при некоторых вариантах) и альдостерона. Гипофункция надпочечников главным образом представлена снижением продукции кортизола (первичной надпочечниковой недостаточностью). Гипоальдостеронизм редко бывает изолированным и обычно наблюдается при сниженной продукции кортизола. Морфологические изменения коры надпочеч-
ников заключаются в наличии доброкачественных и злокачественных новообразований и различного рода гиперплазий. Нарушения функции надпочечников, как правило, сопровождаются изменениями их структуры, в то же время образования в них часто бывают нефункционирующими.
Первичная надпочечниковая недостаточность
Первичная недостаточность коры надпочечников (ПНН, болезнь Аддисона) - редкое заболевание, заболеваемость составляет 93-140 на 1 млн населения (Arlt W., 2003). Основная причина ПНН (93%) - аутоиммунная деструкция коры надпочечников. Надпочечники могут быть единственным пораженным органом или в составе аутоиммунного полигландулярного синдрома I или II типа. Чаще других встречается сочетание ПНН, сахарного диабета 1-го типа (СД 1-го типа), хронического аутоиммунного тиреоидита (иногда болезни Грейвса), которое носит название аутоиммунного полигландулярного синдрома II типа, или синдрома Шмидта. Обычно его выявляют у женщин среднего возраста. Аутоиммунный полигландулярный синдром I типа встречается редко, начинается в детстве и включает гипопаратиреоз, слизисто-кожный кандидоз и надпочечниковую недостаточность. При I типе аутоиммунного полигландулярного синдрома можно обнаружить также хронический агрессивный гепатит, алопецию, витилиго. Гипогонадизм чаще встречается при I типе аутоиммунного полигландулярного синдрома, пернициозная анемия примерно с одинаковой частотой при I и II типе.
Инфекции, приводящие к развитию ПНН, включают туберкулез и грибковое поражение (гистоплазмоз, кокцидиомикоз). Ассоциированные со СПИДом инфекции (например, цитомегаловирусная) могут быть также причиной ПНН. Лимфома надпочечников или метастазы опухолей (чаще других молочной железы, легких, почек) нечасто вызывают развитие ПНН.
Адренолейкодистрофия - связанное с Х-хромосомой заболевание (носители - женщины, болеют - мужчины). Характеризуется наряду с ПНН поражением центральной нервной системы. Поскольку ПНН может предшествовать проявлению со стороны ЦНС, следует во всех случаях идиопатической ПНН у мужчин исключать адренолейкодистрофию. Причины ПНН перечислены в табл. 60-2.
Таблица 60-2. Причины первичной надпочечниковой недостаточности
КЛИНИЧЕСКАЯ КАРТИНА
Хронические формы ПНН развиваются очень медленно и проявляются малоспецифичными симптомами (табл. 60-3): утомляемостью, слабостью, анорексией, снижением массы тела, постуральной гипото-
нией, иногда желудочно-кишечными жалобами (тошнотой, рвотой, диффузными болями в животе). Некоторые пациенты жалуются на снижение либидо, а женщины - на уменьшение количества волос в подмышечных впадинах и лобковой области. Гиперпигментация кожи (вследствие гиперпродукции проопиомеланокортина и составляющих его молекул), особенно в местах, недоступных солнцу, - важный клинический признак ПНН.
Таблица 60-3. Клинические проявления первичной надпочечниковой недостаточности
ДИАГНОСТИКА
Нормальное значение утреннего (между 6 и 8 ч утра) общего кортизола в плазме составляет от 275 до 550 нмоль/л. Утренний кортизол в крови меньше 80 (100) нмоль/л, особенно в сочетании с высоким уровнем АКТГ (>100 пкг/дл), с большой вероятностью указывает на наличие ПНН. Наоборот, уровень утреннего кортизола в плазме выше 550 нмоль/л позволяет исключить ПНН (но не всегда вторичную). Во всех остальных случаях, а также при сохранении клинического подозрения требуется проведение стимуляционного теста с АКТГ (1-24-косинтропином). Поскольку уровень общего кортизола в сыворотке значительно варьирует в разных клинических ситуациях, в некоторых случаях рекомендуют дополнительно определять суточную экскрецию свободного кортизола.
При вторичной недостаточности коры надпочечников уровень АКТГ нормальный или сниженный, клинические и лабораторные признаки дефицита минералокортикоидов отсутствуют. В тех случаях, когда причина вторичной недостаточности коры надпочечников - гипопитуитаризм, можно обнаружить клинические и лабораторные признаки дефицита других гормонов гипофиза (табл. 60-4, 60-5). Длительная супрессия АКТГ эндогенными или экзогенными глюкокортикоидами и затем внезапная или очень быстрая их отмена могут привести к развитию вторичной надпочечниковой недостаточности.
Таблица 60-4. Лабораторные показатели у больных первичной надпочечниковой недостаточностью
Таблица 60-5. Диагностические тесты для хронической надпочечниковой недостаточности
ЛЕЧЕНИЕ
Все больные надпочечниковой недостаточностью должны получать постоянную заместительную терапию гормонами надпочечников, обладающих как минимум глюко- и минералокортикоидным эффектом. Обычно назначают кортизона ацетат* в средней суточной дозе 37,5 мг
или гидрокортизон 25-30 мг/сут в 2 приема, пытаясь воспроизвести суточный ритм секреции кортизола: большую дозу рекомендуют утром, меньшую - во 2-й половине дня, не позднее 18 ч. Многие больные ПНН требуют дополнительного назначения минералокортикоидов (флудрокортизона) в дозе от 50 до 200 мкг/сут, дозу последнего наращивают до нормализации активности ренина в плазме. В некоторых случаях при вторичной надпочечниковой недостаточности в качестве монотерапии, а при первичной - вместе с минералокортикоидами возможна терапия преднизолоном в дозе 5,0-7,5 мг/сут. У больных ПНН также обнаруживают дефицит дегидроэпиандростерона, необходимость в заместительной терапии у которых активно обсуждается в последнее время.
Больные надпочечниковой недостаточностью, получающие заместительную терапию глюкокортикоидами, и их родственники должны быть предупреждены о необходимости увеличения дозы гормонов в случае стресса, лихорадки, интеркуррентных заболеваний. То же следует сделать перед хирургическим вмешательством, в том числе перед экстракцией зуба. При невозможности приема внутрь следует перейти на парентеральное введение гормонов. Больной должен при себе иметь запас лекарства, карточку, в которой указаны его заболевание и необходимая первая помощь.
Вторичная надпочечниковая недостаточность
Помимо поражения собственно коркового слоя надпочечников, гипокортицизм может быть следствием снижения продукции АКТГ гипофизом (вторичная надпочечниковая недостаточность) (табл. 606). Дефицит АКТГ может быть единственным или сочетаться с недостатком других гормонов гипофиза (гипопитуитаризмом). Надпочечниковую недостаточность называют третичной при снижении уровня кортикотропин-рилизинг-гормона в связи с поражением гипоталамуса.
Таблица 60-6. Причины вторичной надпочечниковой недостаточности
Клиническая картина вторичной надпочечниковой недостаточности схожа с первичной, за исключением отсутствия клинических и лабораторных признаков, указывающих на дефицит минералокортикоидов, - повышенного солевого аппетита, гиперкалиемии, гипонатриемии. У больных вторичной надпочечниковой недостаточностью не обнаруживают типичной гиперпигментации кожи из-за отсутствия повышения АКТГ и родственных ему пептидов. В тех случаях, когда причиной вторичной недостаточности коры надпочечников является гипопитуитаризм, можно обнаружить клинические и лабораторные признаки дефицита других гипофизарных гормонов.
Концентрация кортизола в сыворотке крови больных вторичной надпочечниковой недостаточностью аналогична таковой при ПНН (см. табл. 60-5), но уровень АКТГ нормальный или низкий. Помогает также определение альдостерона, который снижен при ПНН и обычно нормальный при вторичной надпочечниковой недостаточности. Для подтверждения диагноза часто требуется тест с инсулиновой гипогликемией (см. главу «Болезни гипофиза и гипоталамо-гипофизарной области»).
Принципы заместительной терапии глюкокортикоидами вторичной надпочечниковой недостаточности аналогичны таковым при первичной. Необходимость в минералокортикоидах обычно отсутствует. В случае гипопитуитаризма показана заместительная терапия дефицита других гормонов гипофиза (см. главу «Болезни гипофиза и гипоталамогипофизарной области»). Часто требуется лечение лежащего в основе вторичной надпочечниковой недостаточности заболевания гипофиза.
Острая надпочечниковая недостаточность
В клинической картине острой надпочечниковой недостаточности (ОНН), вызванной не столько дефицитом кортизола, сколько минералокортикоидов, доминируют гипотония и шок (табл. 60-7). В некоторых случаях на первый план выступают боли в животе или симптомы, связанные с заболеванием, приведшим к острой надпочечниковой недостаточности (сепсисом, кровоизлиянием в надпочечники). Другие симптомы, присущие хронической надпочечниковой недостаточности, также могут присутствовать (см. табл. 60-3, 60-4).
Таблица 60-7. Лабораторная оценка острой надпочечниковой недостаточности
ЛЕЧЕНИЕ
Принципы лечения острой надпочечниковой недостаточности представлены в табл. 60-8.
Таблица 60-8. Лечение острой надпочечниковой недостаточности
Изолированный дефицит альдостерона
Дефицит ренина - самая частая причина изолированного гипоальдостеронизма, который наблюдают у лиц пожилого возраста с хронической болезнью почек. Сахарный диабет, дисфункции автономной нервной системы, длительный прием индометацина или его производных способствуют развитию этого состояния. При обследовании у больных с гипоренинемическим гипоальдостеронизмом обнаруживают гиперкалиемию, гипонатриемию, слабовыраженный метаболический алкалоз. Низкий уровень альдостерона при отсутствии данных о гипокортицизме делает вполне вероятным диагноз изолированного гипоальдестеронизма. Лечение этого состояния заключается в увеличении потребления соли до 4 г в день, в отдельных случаях назначают флудрокортизон.
Синдром Кушинга
Синдром Кушинга - симптомокомлекс, возникающий в результате хронической избыточной секреции надпочечниками кортизола и воздействия его на органы и ткани. Большинство случаев синдрома Кушинга вызваны назначением при ряде заболеваний супрафизиологических доз глюкокортикоидов или хронической передозировкой препарата при лечении надпочечниковой недостаточности (экзогенный синдром Кушинга). Эндогенный синдром Кушинга, в свою очередь, делят на АКТГ-зависимый и АКТГ-независимый. АКТГ-зависимый синдром Кушинга составляет 80-85% всех случаев и вызван в основном аденомой гипофиза (болезнь Кушинга). Причина оставшихся 15-20% АКТГ-зависимого синдрома Кушинга - эктопическая секреция АКТГ карциноидными опухолями или мелкоклеточным раком легких. АКТГ-независимый синдром Кушинга обусловлен в основном опухолями коры надпочечников (аденомой или карциномой), реже - АКТГ-независимой крупноузловой адренальной гиперплазией (пищевым синдромом Кушинга), первичной пигментной мелкоузловой гиперплазией (изолированной или как часть комплекса Camey) или в рамках синдрома Олбрайта.
КЛИНИЧЕСКАЯ КАРТИНА
Клиническая картина заболевания значительно варьирует в зависимости от его длительности, а также от пола и возраста больных. Зная основные эффекты кортизола, легко перечислить клинические симптомы заболевания. Абдоминальное ожирение развивается вследствие кортизолопосредованного накопления висцерального жира преимущественно в области живота. Уменьшение объема бедер и плеч связано скорее с мышечной атрофией, нежели с уменьшением количества жира в этих областях. Следует обратить внимание на то, что для синдрома Кушинга характерно быстрое прогрессирование ожирения. Лунообразное лицо и «бычий горб» впервые описал еще Гарвей Кушинг, как следствие особенностей распределения жира. Истончение кожи, легкая ее травмируемость, а также появление и быстрое прогрессирование типичных стрий - результат катаболического эффекта кортизола. Эти симптомы с высокой вероятностью указывают на заболевание. Менструальная дисфункция может быть одним из первых симптомов заболевания у женщин, мужчин беспокоят снижение либидо и эрек-
тильная дисфункция. Нарушения функции гонад вызваны развитием гипогонадотропного гипогонадизма в условиях хронической избыточной продукции кортизола. Гирсутизм и алопеция - следствие избыточной продукции надпочечниковых андрогенов. Довольно рано у больных обнаруживают натрий- и объемзависимую артериальную гипертензию. Нарушения углеводного обмена в виде сахарного диабета или нарушенной толерантности к глюкозе развиваются в результате повышенной продукции глюкозы в печени и инсулинорезистентности. Стероидиндуцированный остеопороз развивается у 50% больных хроническим гиперкортицизмом и может приводить к бессимптомным переломам позвонков. Нефролитиаз обнаруживают у 50% больных, хотя часто он протекает бессимптомно. Проксимальная мышечная слабость может быть не только результатом катаболического действия стероидов, но и гипокалиемии. Эмоциональные нарушения, включающие депрессию и психозы, вероятно, развиваются в результате потери циркадности ритма секреции кортизола. У детей с синдромом Кушинга наблюдают замедление роста, а в некоторых случаях из-за надпочечниковой гиперандрогенемии наступает преждевременный пубертат. Основные клинические признаки синдрома Кушинга перечислены в табл. 60-9.
Таблица 60-9. Клинические признаки синдрома Кушинга
ДИАГНОСТИКА
Скрининговые и подтверждающие тесты
Первый шаг в диагностике синдрома Кушинга - отличить больных с хроническим гиперкортицизмом от здоровых, имеющих часто встречаемое сочетание абдоминального ожирения, артериальной гипертензии и сахарного диабета (или нарушения толерантности к глюкозе). В клинической практике для этого используют:
• оценку суточной экскреции свободного кортизола (СЭСК);
• ночной тест с 1 мг дексаметазона;
• малую пробу Лиддла (редко).
Наиболее специфичным из них считают оценку суточной экскреции свободного кортизола, которую выполняют как в качестве скринингового, так и подтверждающего диагноз синдрома Кушинга теста. Однако и этот тест не обладает 100% специфичностью. Он не всегда позволяет исключить так называемый ложный синдром Кушинга у лиц, страдающих депрессией и хроническим алкоголизмом. Более того, оценивая суточную экскрецию свободного кортизола, следует определить у больного уровень креатинина в сыворотке крови для оценки адекватности полученных результатов. В том случае, если суточная экскреция свободного кортизола оказалась нормальной, а клиническое подозрение сохраняется, следует повторить тест через 3-6 мес. Еще Лиддл продемонстрировал, что дексаметазон, назначенный в течение 2 дней в суточной дозе 2 мг, супрессирует продукцию АКТГ гипофизом, и соответственно, кортизола надпочечниками у здоровых людей. Позже было показано, что даже 1 мг дексаметазона, назначенный на ночь, обладает подобным эффектом. В результате появился тест с 1 мг дексаметазона, выявляющий здоровых людей с интактной системой «гипоталамус-гипофиз-надпочечники».
Преимущества теста с 1 мг дексаметазона состоят в простоте выполнения. На ночь (между 11 и 12 ч ночи) пациент принимает 1 мг дексаметазона, на следующее утро, между 8 и 9 ч, определяют общий кортизол в плазме. Концентрация кортизола ниже 138 нмоль/л (5 мг/дл) практически исключает автономную его продукцию. В последнее время в литературе появились новые значения, указывающие на адекватную супрессию кортизола: ниже 50 нмоль/л (1,8 мг/дл). В случае использования других единиц измерения кортизола можно сравнить уровень кортизола после назначения дексаметазона с базальным значением: супрессия считается адекватной, если концентрация кортизола снизилась на 50% и более по сравнению с базальной. Специфичность теста с 1 мг дексаметазона, однако, невысока: у больных с ожирением, ложным синдромом Кушинга адекватное снижение кортизола часто отсутствует. Иногда гиперсекреция кортизола бывает настолько невыраженной, что уловить ее, даже с помощью оценки суточной экскреции свободного кортизола, не удается, однако у таких пациентов нарушена циркадность ритма секреции, и подтвердить ее удается с помощью оценки концентрации кортизола в плазме в полночь, значение которой у здоровых людей обычно не превышает 50 нмоль/л (1,8 мг/дл). В качестве альтернативы, особенно у детей, может быть использована оценка кортизола в слюне.
При неинформативности пробы с 1 мг дексаметазона показаны тесты с использованием больших доз. В пробе с 2 мг дексаметазона (вариант малой пробы Лиддла) суточную экскрецию свободного кортизола оценивают до назначения дексаметазона, затем дают 0,5 мг дексаметазона каждые 6 ч в течение 2 сут, на 2-е сутки вновь оценивают суточную экскрецию свободного кортизола. Супрессия считается адекватной при снижении суточной экскреции свободного кортизола на 50% и более по сравнению с базальным значением. Также на фоне этой пробы возможна оценка кортизола в плазме утром натощак до и на 3-и сутки после приема дексаметазона. Несмотря на трудоемкость, тест обладает высокой точностью и может быть также использован как скрининговый или чаще - подтверждающий.
Комбинацию стандартного теста с 2 мг дексаметазона с введением кортикотропин-рилизинг-гормона используют для исключения ложного синдрома Кушинга.
Дифференциальная диагностика
Уровень АКТГ у больных, страдающих АКТГ-зависимым синдромом Кушинга, обычно повышен, в любом случае вследствие автоном-
ной продукции у них отсутствует вечернее снижение гормона. Значения АКТГ в полночь (или хотя бы во 2-й половине дня), превышающие 20 пг/мл, указывают на питуитарную аденому или эктопическую продукцию АКТГ. В случае гиперсекреции кортизола автономными образованиями надпочечников уровень АКТГ супрессирован, как правило, ниже 5 пг/мл. Для визуализации образования и оценки его характера больному выполняют КТ надпочечников. Однако часто значения АКТГ оказываются в диапазоне от 5 до 20 пг/мл, что возможно как при АКТГзависимом, так и АКТГ-независимом синдроме Кушинга. В таких случаях показан тест с 8 мг дексаметазона (большая проба Лиддла). Именно Лиддл продемонстрировал, что дексаметазон в дозе 8 мг способен супрессировать продукцию АКТГ питуитарной аденомой. Сегодня используют несколько вариантов большой пробы Лиддла. Так, в одном из вариантов больному назначают 8 мг дексаметазона в сутки в течение 2 дней (по 2 мг через каждые 6 ч), в другом - 8 мг в один прием на ночь. Оценивают в первом варианте суточную экскрецию свободного кортизола до назначения препарата и на 2-й день его приема, во втором - концентрацию кортизола в плазме на следующее утро. Снижение уровня кортизола в пробе на 50% и более по сравнению с базальным значением с высокой вероятностью свидетельствует о наличии у пациента АКТГ-продуцирующей питуитарной аденомы. Супрессия продукции кортизола будет недостаточной или отсутствовать у больных с эктопическим АКТГ-синдромом, так как злокачественные опухоли, как правило, резистентны к любой супрессии и у больных автономно функционирующими образованиями надпочечников, поскольку АКТГ у них уже супрессирован хронической избыточной продукцией кортизола. Для подтверждения диагноза АКТГ-продуцирующей питуитарной аденомы выполняют МРТ гипофиза. Опухоль в гипофизе обнаруживают лишь у 60% больных. В остальных случаях имеется либо очень маленькая опухоль гипофиза, либо у больного эктопический АКТГ-синдром. В большинстве подобных случаев выполняют двустороннюю катетеризацию нижнего петрозного синуса с забором крови на АКТГ (базальный и стимулированный кортикотропин-рилизинг-гормон) с обеих сторон и сравнивают со значением АКТГ в периферической крови, пытаясь уточнить локализацию поражения. Помогает в диагностике эктопического АКТГ-синдрома определение калия и бикарбоната. Более 95% больных со злокачественными опухолями, продуцирующими АКТГ, имеют гипокалиемический алкалоз.
ЛЕЧЕНИЕ
При аденоме коры надпочечников показана адреналэктомия. В связи с длительной хронической гиперпродукцией кортизола аденомой надпочечника функция второго, как правило, подавлена. Больному показана заместительная терапия глюкокортикоидами во время операции и в послеоперационный период вплоть до восстановления функции оставшегося надпочечника. Карцинома надпочечника имеет очень плохой прогноз и требует дополнительной химиотерапии (митотаном). Транссфеноидальное хирургическое вмешательство выполняют больным с питуитарной аденомой, секретирующей АКТГ. При эктопическом АКТГ-синдроме желательно найти опухоль и резецировать ее, часто таким больным показана химиоили лучевая терапия. В тех случаях, когда источник автономной продукции АКТГ не обнаружен, показана лекарственная терапия. Назначают лекарственные препараты с адренолитическими свойствами (митотан) или блокирующие стероидогенез (кетоконазол, аминоглутетимид). Что касается угнетения продукции АКТГ, сегодня нет препарата с доказанной эффективностью. Наиболее эффективной считают комбинацию аналогов соматостатина с каберголином (агонистом допамина). Появившийся недавно новый аналог соматостатина - пасиреотид, возможно, будет успешно применяться для лечения больных с АКТГ-продуцирующими питуитарными аденомами.
Первичный альдостеронизм
Первичный альдостеронизм (ПА) - группа заболеваний с неадекватно высоким, относительно независимым от ренин-ангиотензиновой системы, уровнем альдостерона и отсутствием подавления его продукции в пробе с нагрузкой натрия хлоридом. Такая неадекватно высокая продукция альдостерона приводит к поражению сердечно-сосудистой системы, подавлению активности ренина в плазме, гипертензии, задержке натрия, экскреции калия и при длительном существовании - к тяжелой гипокалиемии. Основными причинами ПА считают альдостеронпродуцирующую аденому (очень редко - карциному) и одноили двустороннюю гиперплазию надпочечников. К редким причинам относят глюкокортикоидподавляемый альдостеронизм. В последние годы появляется все больше доказательств высокой распространенности ПА. ПА выявляют у 10% лиц с артериальной гипертензией и более.
КЛИНИЧЕСКАЯ КАРТИНА
Основной клинический признак ПА - артериальная гипертензия. Гипокалиемию обнаруживают нечасто, у 9-37% больных. Известно, что примерно половина больных альдостеронпродуцирующей аденомой и 17% гиперплазией надпочечников имеют калий крови ниже 3,5 ммоль/л. Таким образом, гипокалиемия - поздний признак заболевания, а нормокалиемический альдостеронизм - нередкое явление. У больных ПА можно обнаружить также гипернатриемию, гиперволемию и связанные с гипокалиемией лабораторные и клинические признаки:
• гипокалиемический алкалоз;
• специфические изменения на ЭКГ;
• парестезии;
• мышечную слабость;
• судороги;
• преходящие параличи.
Кроме того, возможны полиурия, никтурия, нарушения углеводного обмена.
ДИАГНОСТИКА
В связи с высокой распространенностью ПА и потенциальной опасностью хронической избыточной продукции альдостерона для сердечнососудистой системы рекомендуют активно выявлять ПА в отдельных популяциях (табл. 60-10).
Таблица 60-10. Популяции больных с высоким риском первичного альдостеронизма
При подозрении на первичный альдостеронизм, помимо оценки уровня калия, пациенту определяют активность ренина в плазме крови,
концентрацию альдостерона в плазме крови и подсчитывают их соотношение (скрининговые тесты; табл. 60-11).
Таблица 60-11. Минимальное соотношение активности ренина в плазме и концентрации альдостерона в разных единицах измерения, превышение которого указывает на первичный альдостеронизм и требует выполнения подтверждающих тестов
Перед выполнением тестов необходимо проанализировать получаемую пациентом антигипертензивную терапию и по возможности изменить ее на приемлемую для выполнения тестов. Следует подчеркнуть, что антагонисты альдостерона (в частности верошпирон*) отменяют за 6 нед до выполнения диагностических тестов, другие антигипертензивные препараты - минимум за 2 нед. Для контроля артериальной гипертензии пациенту необходимо назначить препараты, оказывающие наименьшее влияние на систему «ренин-ангиотензин-альдостерон» (табл. 60-12).
Таблица 60-12. Лекарственные препараты, оказывающие минимальный эффект на активность ренина и концентрацию альдостерона в плазме и используемые во время диагностических тестов
Дифференциальная диагностика
Высокий уровень альдостерона, низкая активность ренина в плазме крови и высокое соотношение концентрации альдостерона/активности ренина в плазме крови (см. табл. 60-11) указывают на первичный альдостеронизм и требуют выполнения подтверждающих тестов. Высокий уровень альдостерона и высокая активность ренина в плазме крови характерны для вторичного альдостеронизма. Дифференциальная диагностика первичного и вторичного альдостеронизма приведена в табл. 60-13. Если альдостерон и ренин оказались низкими, следует подозревать избыток других минералокортикоидов (синдром Кушинга, синдром Лиддла). При синдроме Бартера, в отличие от ПА, обнаруживают высокую активность ренина в плазме крови и нормальное
АД.
Наиболее известный подтверждающий ПА тест - тест с нагрузкой солью. Больному внутривенно капельно вводят 2 л 0,9% раствора натрия хлорида в течение 4 ч и определяют концентрацию альдостерона в плазме крови в конце инфузии. Уровень альдостерона, превышающий 10 нг/дл, подтверждает наличие первичного альдостеронизма. Спиральную КТ надпочечников выполняют в целях уточнения подтипа ПА и выявления альдостеронпродуцирующей карциномы. Карцинома встречается очень редко, размеры ее обычно больше 4 см в диаметре, и, как правило, при КТ обнаруживают специфические признаки. Часто при КТ обнаруживают двусторонние изменения в надпочечниках, более или менее выраженные в одном из них. В этих случаях, особенно при выборе адреналэктомии как метода лечения ПА, больному показана катетеризация надпочечниковых вен с раздельным определением концентрации альдостерона. При отсутствии значительного одностороннего превышения концентрации альдостерона ПА расценивают как вызванный двусторонней гиперплазией надпочечников. У больного с ранним началом ПА (до 20 лет), имеющим семейный анамнез ПА (с началом в возрасте до 40 лет) или инсульт в молодом возрасте, исключают глюкокортикоидподавляемый альдостеронизм. У больных этим редким генетически детерминированным подтипом ПА обнаруживают повышение 18-гидроксикортизола и 18-оксикортизола. Окончательный диагноз глюкокортикоидподавляемого альдостеронизма устанавливают путем генетического тестирования.
Таблица 60-13. Дифференциальная диагностика первичного и вторичного альдостеронизма
ЛЕЧЕНИЕ
При подтверждении одностороннего поражения надпочечников (альдостеронпродуцирующей аденомы, односторонней гиперплазии надпочечников) больному рекомендуют лапароскопическую адреналэктомию. После удаления аденомы АД снижается практически у всех больных, полная ремиссия заболевания наблюдается в 50-70% случаев (у части больных, вероятно, наряду с ПА, формируется еще и эссенциальная гипертензия). В тех случаях, когда при катетеризации надпочечниковых вен и оценками альдостерона было обнаружено двустороннее поражение (гиперплазия надпочечников), рекомендуют медикаментозную терапию (антагонистами минералокортикоидов). Спиронолактон (верошпирон♠) назначают в дозе 300 мг в день, еженедельно его уменьшая (как правило до 100 мг в день), но так, чтобы АД оставалось в пределах целевых значений. Использование современного антагониста минералокортикоидов эплеренона позволяет избежать отрицательного действия спиронолактона на продукцию андрогенов. Половине больных для контроля АГ требуется дополнительное назначение антигипертензивных средств. Больным с глюкокортикоидподавляемым
альдостеронизмом рекомендуют небольшие дозы глюкокортикоидов, достаточные для нормализации АД и калия.
Врожденная гиперплазия надпочечников
Термин «врожденная гиперплазия надпочечников» включает синдромы, возникающие в результате врожденных ферментативных дефектов на пути биосинтеза кортизола (рис. 60-1). Заболевание наследуется по аутосомно-доминантному типу. Ферментативные дефекты приводят к разной степени выраженности дефицита кортизола (в некоторых случаях - и альдостерона), что, в свою очередь, сопровождается хронической гиперпродукцией АКТГ гипофизом. АКТГ вызывает гиперплазию надпочечников и увеличивает количество стероидов (главным образом, надпочечниковых андрогенов), синтез которых происходит без участия дефектных ферментов. Надпочечниковая гиперандрогенемия приводит к различной степени выраженности клинических проявлений - от тяжелого вирильного синдрома (включающего бисексуальные наружные половые органы у девочек) до незначительно выраженного гирсутизма у взрослых женщин. Клиническая картина врожденной гиперплазии надпочечников также зависит от того, какой фермент на пути биосинтеза кортизола является дефектным и насколько этот дефект (дефицит) выражен. Значительно чаще других (в 90% всех случаев) причиной врожденной гиперплазии надпочечников служит дефицит Р-450С21 (21-гидроксилазы). Классический дефицит 21-гидроксилазы представлен 2 формами: синдромом потери соли и простой вирильной формой, которые обычно выявляют у новорожденных. У взрослых женщин чаще встречается неклассический вариант дефицита 21-гидроксилазы - так называемое позднее начало, основным проявлением которого служит гирсутизм. Заболевание исключают у женщин с гирсутизмом и/или гиперандрогенемией, а также с нарушенной фертильностью. У женщин с дефицитом 21-гидроксилазы, как и у имеющих самую частую причину гиперандрогенемии и хронической ановуляции - синдром поликистозных яичников, обнаруживают повышенный уровень тестостерона, андростендиона, дегидроэпиандростерона. Специфичным признаком для врожденной гиперплазии надпочечников, вызванной дефицитом 21-гидроксилазы, считают повышение базального уровня 17-ОН-прогестерона и значительный его прирост после введения синактена*. Для подтверждения диагноза также используют генетическое исследование.
Врожденная гиперплазия надпочечников, вызванная дефицитом 11-р-гидроксилазы (Р-450с11), представлена вирильным синдромом, артериальной гипертензией, иногда - гипокалиемией).
Дефицит 11-р-гидроксилазы, 3-р-гидроксистероид-дегидрогеназы, а также дефицит 20,22-десмолазы (Р-450 scc) и люпоидная гиперплазия надпочечников встречаются крайне редко, характеризуются глубокими нарушениями синтеза гормонов надпочечников, и если выявляются, то в раннем детстве.
Лечение врожденной гиперплазии надпочечников состоит в назначении глюкокортикоидов, дозы и способ назначения которых варьируют в зависимости от возраста больных, вида врожденной гиперплазии надпочечников и цели лечения. Женщинам с дефицитом 21-гидроксилазы назначают глюкокортикоиды для индукции беременности, в случае наступления беременности продолжают их прием для предупреждения вирилизации плода женского пола. При некоторых вариантах врожденной гиперплазии надпочечников показаны заместительная терапия половыми стероидами и коррекция половых органов.
Случайно выявленные образования в надпочечниках
Случайно выявленным образованием в надпочечнике (адренальной инсиденталомой) принято называть образование больше 1 см, выявленное при визуализации области живота при отсутствии клинических и биохимических признаков патологии надпочечников. Частота выявления, по данным разных авторов, варьирует от 1,1 до 32% и зависит от используемых критериев, наличия сопутствующих заболеваний, возраста исследуемой популяции и, наконец, от интенсивности поиска. При гистологическом исследовании больше половины (52%) случайно выявленных образований оказываются аденомами, 10-14% - карциномами (первичными или вторичными, метастатическими), прочие (кисты, липомы, нейрофибромы, гранулематозные, воспалительные процессы и т.д.) встречаются реже. Обращает на себя внимание тот факт, что 10% инсиденталом надпочечников могут оказаться феохромоцитомой (в том числе нефункционирующей).
ДИАГНОСТИКА
При обследовании больного с инсиденталомой надпочечника следует ответить на 2 вопроса:
• Является ли данное образование гормонально-активным?
• Не является ли данное образование злокачественным?
Для исключения субклинического синдрома Кушинга больному выполняют пробу с 1 мг дексаметазона. ПА исключают даже при нормокалиемии путем оценки соотношения показателей концентрации альдостерона и активности ренина в плазме крови. Наконец, феохромоцитому (с помощью определения суточной экскреции катехоламинов) исключают, несмотря на нормальное АД. Оценка морфологической структуры с помощью КТ, а также быстрота роста образования позволяют заподозрить его злокачественный характер. Тонкоигольную аспирационную биопсию выполняют в случае подозрения на метастазы и при отсутствии данных о локализации первичной опухоли.
ЛЕЧЕНИЕ
Образования больших размеров (>4-6 см) удаляют в связи с высоким риском их злокачественности. Удаляют также образования надпочечников, подозрительные на злокачественные (по данным КТ) и гиперфункционирующие (по данным гормонального исследования). Во всех остальных случаях больных наблюдают, выполняют повторно КТ и оценку гормонального статуса. Увеличение размеров образования, появление признаков гиперфункции служат показанием к адреналэктомии.
Глава 61. ФЕОХРОМОЦИТОМА
Феохромоцитома - редкая опухоль, происходящая из катехоламинпродуцирующих хромаффинных клеток. Обычная локализация феохромоцитомы - мозговой слой надпочечников, однако опухоль может происходить из любого симпатического ганглия. Надпочечниковая феохромоцитома секретирует адреналин, норадреналин или оба гормона, в то время как вненадпочечниковая феохромоцитома (параганглиома) секретирует, как правило, только норадреналин. Для описания некоторых особенностей феохромоцитомы используют так называемое правило 10:
• 10% феохромоцитом - билатеральные;
• 10% - экстраадренальные;
• 10% - наследственные;
• 10% - злокачественные;
• 10% феохромоцитом встречаются у детей.
Семейная феохромоцитома обычно встречается как часть синдрома множественной эндокринной неоплазии (МЭН) и других наследственных синдромов. Множественная эндокринная неоплазия-2а включает феохромоцитому, медуллярный рак ЩЖ и гиперпаратиреоз . Множественная эндокринная неоплазия-2b - феохромоцитому, медуллярный рак ЩЖ, слизистые нейромы, утолщение корнеальных нервов, ганглионейроматоз кишечника, марфаноподобный синдром. Болезнь ГиппеляЛиндау характеризуется феохромоцитомой, ретинальными ангиомами, церебральной гемангиобластомой, эпидидимальной цистаденомой, кистами почек и поджелудочной железы, раком почки. Феохромоцитома может сопутствовать нейрофиброматозу 1-го типа и быть частью семейной параганглиомы. Генетическое тестирование показано во всех подозрительных на семейный характер случаях.
КЛИНИЧЕСКАЯ КАРТИНА
Феохромоцитома с одинаковой частотой встречается у мужчин и женщин в возрасте 30-50 лет. Основное клиническое проявление фе-
охромоцитомы - артериальная гипертензия, постоянная у половины больных, пароксизмальная - у одной трети. У оставшихся больных отмечают пароксизмы на фоне постоянно высокого АД или АД у них может быть нормальным. Тяжелые пароксизмы повышения АД могут быть спровоцированы некоторыми лекарственными препаратами (β-адреноблокаторами, отдельными анестетиками, трициклическими антидепрессантами, метоклопрамидом, глюкагоном), введением рентгеноконтрастных средств, пальпацией опухоли и даже изменением положения тела. Пароксизмы повышения АД, сопровождаемые чувством страха, сильной головной болью, повышенной потливостью и тахикардией характерны для феохромоцитомы. Кроме того, у больного, страдающего феохромоцитомой, могут быть обнаружены стенокардия, нарушения углеводного обмена, ретинопатия, гиперкальциемия, ортостатическая гипотония, кардиомегалия. Больные могут жаловаться на тошноту, рвоту, боли в животе, запор.
ДИАГНОСТИКА
Феохромоцитома должна быть заподозрена у всех больных, имеющих хотя бы один из следующих признаков: самостоятельно проходящих эпизодов необъяснимых сердцебиений, головной боли, повышенной потливости, тремора, бледности. Резистентная АГ, множественная эндокринная неоплазия, в том числе в семейном анамнезе, надпочечниковая инсиденталома, гипертензивный ответ на введение рентгеноконтрастных средств и анестезию, начало АГ в молодом возрасте (до 20 лет), идиопатическая дилатационная кардиомиопатия также требуют исключения феохромацитомы.
Диагноз устанавливают путем измерения катехоламинов: адреналина и норадреналина и/или их метаболитов - метанефрина и норметанефрина. Наиболее подходящим для диагностики феохромоцитомы тестом считают оценку суточной экскреции с мочой катехоламинов (норадреналина и адреналина) и метанефринов (чувствительность - 98%, специфичность - 98%). Если клиническое подозрение велико, следует измерить также метанефрины в плазме крови. Некоторые авторы считают возможным оценивать метанефрины в плазме крови в качестве первой линии диагностики феохромоцитомы в связи с высокой чувствительностью, простотой выполнения и относительной независимостью теста от состояний и лекарственных средств, влияющих на уровень катехоламинов. Диагностическая точность перечисленных выше тестов повышается, если оценка выполнена во время гипертензивного криза
или непосредственно после него. Тест с клонидином позволяет в некоторых случаях исключить феохромоцитому. Снижение метанефринов в плазме крови на 50% и больше по сравнению с базальным значением через 3 ч после приема 0,3 мг клонидина свидетельствует об отсутствии феохромоцитомы. Глюкагон в дозе 0,5-1,0 мг, введенный внутривенно, вызывает через 2 мин увеличение АД (>35/25 мм рт.ст.) и повышение уровня плазменных катехоламинов у нормотензивных больных феохромоцитомой. Однако тест с глюкагоном в рутинной практике не используют.
Как только диагноз феохромоцитомы подтвержден биохимически, для визуализации образования выполняют КТ или МРТ (чувствительность - >95%, специфичность - >65%). Примерно в 65% случаев опухоль локализуется в надпочечниках, в 35% - в области живота. Если опухоль в животе не обнаружена, больному выполняют сцинтиграфию с метайодбензилгуанидином, меченным I123. Этот радиофармпрепарат преимущественно накапливается в катехоламинпродуцирующих опухолях (чувствительность - 80%, специфичность - 99%). При поиске вненадпочечникой локализации опухоли также используют МРТ головы, шеи, грудной клетки, позитронно-эмиссионную томографию. Сцинтиграфия с пентетреотидом позволяет обнаружить опухоль, если она имеет соматостатиновые рецепторы.
ЛЕЧЕНИЕ
Перед операцией больному назначают а-блокаторы для контроля АГ, при развитии тахикардии возможно добавление р-адреноблокаторов (только после полной блокады а-адренорецепторов). В качестве дополнительного антигипертензивного препарата могут быть использованы блокаторы медленных кальциевых каналов. Использование атропина следует избегать при подготовке к наркозу, вместо фторотана* в качестве средства для наркоза применяют энфлуран. В большинстве случаев опухоль может быть удалена лапароскопически. Гипертонический криз, риск которого увеличивается во время общей анестезии и при любых манипуляциях с опухолью, купируют внутривенным введением нитропруссида натрия или фентоламина. Для предупреждения и лечения интраоперационной гипотонии показана адекватная регидратация. После удаления опухоли нередко развивается преходящая гипогликемия, которую купируют введением глюкозы*.
Больных, оперированных по поводу феохромоцитомы, наблюдают всю жизнь, оценивают суточную экскрецию катехоламинов ежегодно.
В случае повышения уровня катехоламинов больному выполняют КТ для обнаружения рецидива или остаточной болезни. Злокачественная феохромоцитома встречается редко при спорадическом варианте и чаще у лиц с наследственными формами опухоли.
Отличить злокачественную феохромоцитому от доброкачественной сложно даже при гистологическом исследовании, диагноз обычно устанавливают на основании клинической картины (рецидива опухоли, наличия или появления метастазов). При злокачественной феохромоцитоме 5-летняя выживаемость больных составляет менее 50%, хотя в отдельных случаях больные живут более 20 лет.
Глава 62. ЗАБОЛЕВАНИЯ ПАРАЩИТОВИДНЫХ ЖЕЛЕЗ И ДРУГИЕ ГИПО- И ГИПЕРКАЛЬЦИЕМИЧЕСКИЕ СОСТОЯНИЯ
Физиология паращитовидных желез и обмен кальция
Четыре паращитовидные железы (ПЩЖ) обычно расположены на задней поверхности щитовидной железы по одной у каждого полюса (2 - у верхних, 2 - у нижних). Они производят паратиреоидный гормон (ПТГ), который считают основным регулятором фосфорно-кальциевого обмена в синергизме с витамином D3 и кальцитонином.
Кальций. Участвует в поддержании нормального свертывания крови, ритма сердца, нервно-мышечной возбудимости, мышечного сокращения. Он необходим для поддержания почечных механизмов концентрации мочи. Кальций нужен для нормального развития плода, лактации, входит в состав костей и зубов. Концентрация ионов кальция во внеклеточной жидкости сохраняется постоянной в результате взаимодействия процессов непрерывного поступления и выхода кальция из нее. Кальций поступает в плазму вследствие его всасывания в кишечнике и резорбции кости, а покидает внеклеточную жидкость с секретом желудочно-кишечного тракта, мочой, путем отложения в костной ткани и (в небольшом количестве) с потом. Обмен кальция тесно связан с метаболизмом фосфата и магния. Фосфат служит главным компонентом кости и других тканей, он вовлечен во все метаболические процессы. Фосфат увеличивает синтез витамина D3 в почках и тормозит всасывание кальция в кишечнике. В свою очередь, увеличение содержания кальция в пище тормозит всасывание фосфата в кишечнике, уменьшает его концентрацию в плазме крови, но увеличивает реабсорбцию фосфата в почках. ПТГ и витамин D3 регулируют величину экскреции фосфата с мочой. ПТГ тормозит реабсорбцию фосфата в проксимальных канальцах почек и снижает уровень фосфата в плазме крови. Витамин D3 увеличивает всасывание фосфата в кишечнике и повышает его уровень в крови.
Паратиреоидный гормон. Одноцепочечный пептид, состоящий из 84 аминокислот. Уровень ПТГ в крови регулируется по механизму отрицательной обратной связи. На мембранах паратиреоцитов находятся рецепторы к кальцию, очень чувствительные к его концентрации в плазме. Они тесно связаны с белком 120 кДа (сцепленным с рецептором белком G). Этот белок - «цензор» уровня кальция в плазме. Даже незначительное снижение уровня кальция во внеклеточной жидкости улавливается этим белком, и в ответ увеличивается секреция ПТГ. Возбуждение рецептора высоким уровнем кальция подавляет секрецию ПТГ. Эти рецепторы присутствуют в ПЩЖ и в продуцирующих кальцитонин С-клетках щитовидной железы, а также в ряде других тканей, таких как головной мозг и почки.
Кальций, действующий через эти рецепторы, и витамин D, действующий через свои рецепторы в ядре клетки, регулируют синтез и секрецию ПТГ. При снижении поступления кальция, например, при низком содержании кальция в пище, усиливается продукция ПТГ, а при повышении - снижается.
ПТГ действует через свои рецепторы. Существуют 2 типа рецепторов
ПТГ:
• 1-й тип - общий для ПТГ и ПТГ-подобного пептида (ПТГ-ПП; Parathyroid Hormone-related Peptide - PTHrP);
• 2-го типа, на который действует только ПТГ.
Рецепторы 1-го типа обнаружены в костной ткани, почках, мышцах, а 2-го типа - в головном мозге, поджелудочной железе и ряде других тканей.
Эффекты ПТГ на костную ткань могут быть прямыми и косвенными, острыми и хроническими (табл. 62-1). Острый эффект ПТГ - изменения костной резорбции - развивается в течение нескольких минут. Хронические эффекты ПТГ (такие как влияние на пролиферацию остеобластов и остеокластов, увеличение ремоделирования кости) развиваются в течение нескольких часов после поступления гормона в кровь и сохраняются в течение многих часов после того, как его поступление закончится. Прямой эффект ПТГ оказывает влияние на остеобласты, на которых есть рецепторы к нему. Через них обеспечиваются эффекты ПТГ на формирование кости. На остеокластах, стимулирующих резорбцию кости, нет рецепторов ПТГ. ПТГ стимулирует остеокласты косвенно, через цитокины (интерлейкины-1, -2, -6) и ферменты, секретируемые остеобластами под его влиянием.
Таблица 62-1. Основные эффекты паратиреоидного гормона
Второй мишенью ПТГ являются почки (см. табл. 62-1), в которых ПТГ стимулирует реабсорбцию кальция в дистальных канальцах, синтез 1,25-дигидроксивитамина-D [l,25(OH)2D3] через активацию почечной 25(ОН)D-1-гидроксилазы и ингибирует транспорт фосфатов в проксимальных канальцах. Норма ПТГ в крови - 10-60 пг/мл (1-6 пмоль/л).
С другой стороны, баланс кальция поддерживается действием витамина D (1,25(OH)2D3) на поглощение кальция в ЖКТ. Активный витамин D3 [1,25(ОН)2D3] (D3) образуется в почках из его предшественника эргокальциферола, который поступает с пищей, или из предшественников, которые образуются в коже из холестерина под воздействием ультрафиолетовых лучей. Механизм действия витамина D3 подобен всем стероидным гормонам. Он проходит в цитоплазму клетки, где встречается со своим рецептором и вместе с ним поступает в ядро. В ядре витамин D3 активирует экспрессию ряда генов. Основными эффекторными органами витамина D3 считают кость, почки, кишечник. В кости витамин D3 оказывает прямое действие на остеобласты, в которых есть рецепторы к витамину D3. Он стимулирует созревание остеобластов из мезенхимальных клеток костного мозга и синтез ими остеокальцина, коллагена и белков, образующих матрикс (белковую основу) кости, активирует минерализацию матрикса. Также витамин D3 стимулирует образование остеокластов из клеток моноцитарного ростка костного мозга, их созревание и активность. Кроме того, витамин D3 стимулирует продукцию остеобластами интерлейкинов-1, -2 и -6, которые активируют остеокласты. Остеокласты секретируют протеолитические ферменты, которые увеличивают резорбцию кости, в ходе которой кальций высвобождается и поступает в кровоток. В почках витамин D3 увеличивает реабсорбцию фосфата в проксимальных канальцах и поддерживает нормальную реабсорбцию кальция. В кишечнике витамин D3 увеличивает всасывание кальция путем образования кальцийсвязываю-
щего белка - кальмодулина, вместе с которым кальций всасывается из кишечника во внеклеточную жидкость.
Все вышеперечисленные эффекты витамина D3 ведут к поддержанию нормального ремоделирования кости и нормального уровня кальция и фосфата в плазме крови. Витамин D3 также оказывает влияние на гемопоэтическую и иммунную системы, регулирует синтез и секрецию инсулина В-клетками островков поджелудочной железы, пролактина - лактотрофами гипофиза и ПТГ - клетками ПЩЖ. Он регулирует синтез цитокинов и секрецию интерлейкина-2 из лимфоцитов и фактора некроза опухоли из моноцитов, уменьшает пролиферацию фибробластов, лимфоцитов, тимоцитов. В норме концентрация витамина D3 [1,25(OH)2D3] в плазме крови у взрослых - 10-50 нг/дл (25-125 пмоль/л).
Кальцитонин образуется в парафолликулярных клетках (С-клетках) щитовидной железы. Это полипептидный гормон, состоящий из 32 аминокислот в виде одной цепи. Основная функция кальцитонина состоит в торможении резорбции кости. Это действие кальцитонин осуществляет через остеокласты, на которых имеются рецепторы к нему. Кроме того, кальцитонин оказывает действие на почки. Клетки проксимальных канальцев имеют рецепторы к кальцитонину, через которые он умеренно тормозит реабсорбцию фосфата и кальция и увеличивает выведение натрия с мочой. Стимулом для синтеза и секреции кальцитонина служит повышение уровня кальция в плазме крови, а снижение - тормозит его секрецию. В норме уровень кальцитонина у мужчин - 3-24 пг/л (0,887,6 пмоль/л), у женщин - 2-17 пг/л (0,58-5,0 пмоль/л).
Паратиреоидный гормоноподобный пептид. ПТГ и ПТГ-ПП аналогичны в первых 30 аминокислотах, хотя общая длина ПТГ-ПП - 144 аминокислоты, а ПТГ - только 84 аминокислоты. ПТГ-ПП синтезируется в злокачественных опухолях и вызывает значительную гиперкальциемию, так как его действие и эффекты подобны ПТГ. Как ПТГ, так и ПТГ-ПП осуществляют свое действие через рецептор ПТГ 1-го типа (рис. 62-1, см. также цв. вклейку). В норме ПТГ-ПП синтезируется в нормальных тканях, не вызывая гиперкальциемии, и его эффекты отличаются от ПТГ. В пренатальной жизни он необходим для пролиферации и минерализации хондроцитов и как регулятор транспорта кальция через плаценту. В постнатальной жизни ПТГ-ПП регулирует эпителиально-мезенхимальные связи, которые играют важную роль в развитии молочных желез и волосяных фолликулов. Полагают, что в норме ПТГ-ПП оказывает свои эффекты локально, не поступая в кровоток. Концентрация ПТГ-ПП в плазме крови - менее 1,3 ммоль/л.
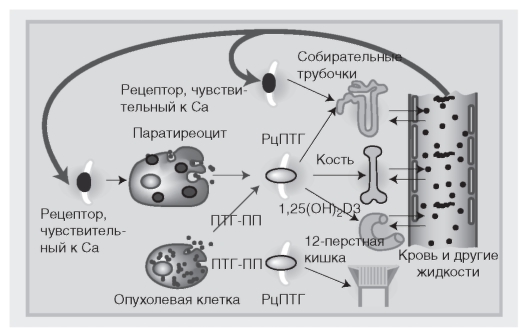
Рис. 62-1. Синтез паратиреоидного гормона (ПТГ) и паратиреоидного гормоноподобного пептида показан слева, а их целевые органы - справа. Оба действуют посредством одного рецептора (1-го типа рецептора ПТГ). Отрицательная обратная связь 1,25-дигидроксивитамина D не показана. Избыток или недостаток ПТГ могут корректироваться либо на уровне секреции ПТГ (и рецептора ПТГ), либо в целевых клетках, имеющих рецепторы ПТГ. Синими стрелками указан внеклеточный поток кальция
Гиперкальциемия
Гиперкальциемией называют повышение уровня кальция в плазме крови выше нормы - 2,1-2,6 ммоль/л (8,5-10,5 мг/дл).
Если гиперкальциемия подтверждается, необходимо установить ее причину. Существует много различных причин гиперкальциемии (табл. 62-2), но 90% случаев приходится на гиперпаратиреоз (ГПТ) и злокачественные опухоли.
Таблица 62-2. Причины гиперкальциемии
КЛИНИЧЕСКАЯ КАРТИНА
Гиперкальциемия независимо от причины может проявляться:
• повышенной утомляемостью;
• депрессией;
• сонливостью;
• когнитивным дефицитом;
• анорексией;
• тошнотой, рвотой;
• запором;
• нефролитиазом;
• увеличением частоты мочеиспускания;
• полидипсией;
• укорочением интервала Q-T на ЭКГ;
• сердечными аритмиями (у некоторых пациентов).
Связь между тяжестью гиперкальциемии и симптомами может различаться у разных пациентов. Легкая гиперкальциемия обычно протекает бессимптомно. Симптомы появляются при уровне кальция более 2,9-3 ммоль/л (11,5-12,0 мг/дл), но у некоторых пациентов, даже при таких значениях, клинические проявления отсутствуют. При уровне кальция более 3,2 ммоль/л (13 мг/дл) происходит накопление солей кальция в почках с развитием нефролитиаза, коже, сосудистой стенке, легких, сердце с образованием кальцинатов, может развиться почечная недостаточность, особенно если уровень фосфата в крови остается нормальным или повышается из-за ухудшения почечных функций. Тяжелая гиперкальциемия - уровень кальция более 3,7-4,5 ммоль/л (15-18 мг/ дл), может представлять собой опасное для жизни состояние, приводя к развитию комы и остановки сердца.
ДИАГНОСТИКА
Необходимо убедиться, что гиперкальциемия не является результатом ложноположительного лабораторного теста. Ложноположительный результат может быть следствием неправильного взятия крови, гемоконцентрации или гиперальбуминемии. Необходимо повторить анализ.
Дифференциальная диагностика
Клинические особенности и анамнез важны для дифференциальной диагностики. Бессимптомная гиперкальциемия у взрослых обычно связана с первичным ГПТ. При гиперкальциемии, вызванной злокачественными опухолями, пациента к врачу обычно приводят симптомы злокачественной опухоли, а гиперкальциемию обнаруживают во время обследования. Сбор анамнеза по диете, приему витаминов и лекарственных средств помогает диагностировать некоторые менее частые причины. Определение уровня ПТГ - основа дифференциальной диагностики (рис. 62-2; табл. 62-3).
Семейная гипокальциурическая гиперкальциемия - аутосомнодоминантное заболевание, характеризуемое инактивирующей мутацией гена кальцийсвязывающего рецептора, которая приводит к нечувствительности клеток ПЩЖ и канальцев почек к торможению кальцием.
Первичный ГПТ новорожденных - редкое и потенциально смертельное заболевание. У новорожденного значительно увеличены все ПЩЖ, очень высокий уровень ПТГ в сыворотке крови и тяжелая гиперкальциемия (уровень кальция - >4 ммоль/л). Заболевание вызывается гомозиготной инактивирующей мутацией гена кальцийсвязывающего рецептора.
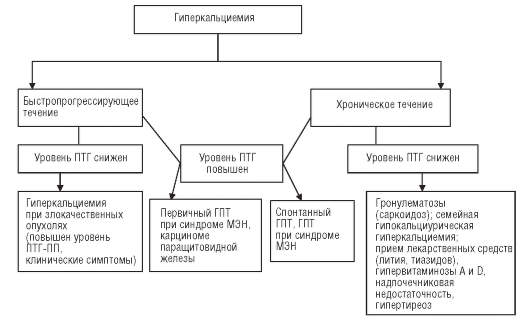
Рис. 62-2. Дифференциальная диагностика причин гиперкальциемии
Таблица 62-3. Дифференциальная диагностика гиперкальциемии с в уровнем паратиреоидного гормона
ЛЕЧЕНИЕ
Подход к лечению гиперкальциемии зависит от ее тяжести (табл. 62-4).
При умеренной гиперкальциемии - менее 3,0 ммоль/л (12 мг/дл) достаточно адекватной гидратации. Более выраженная гиперкальциемия (уровень кальция - 3,2-3,7 ммоль/л, или 13-15 мг/дл) требует более активного лечения. Еще более высокие уровни кальция опасны для жизни и требуют интенсивной терапии. При тяжелой гиперкальциемии используют комбинацию быстродействующих методов (регидратацию, кальцитонин, затем форсированный диурез) и медленных - бисфосфонатов, что позволяет снизить концентрацию кальция на 0,7-2,2 ммоль/л (3-9 мг/дл) за сутки у большинства пациентов. Этого достаточно, чтобы уменьшить острые симптомы и предотвратить смерть от гиперкальциемического криза. Вторым шагом должно быть выявление причины гиперкальциемии с подключением терапии, направленной на основное заболевание. Эффективность различных терапевтических мер зависит от причины. Для гиперкальциемии, обусловленной передозировкой витамина D, которая сопровождается резким повышением всасывания кальция в кишечнике, эффективно ограничение кальция в пище. При почечной недостаточности нарушена почечная экскреция кальция и наиболее эффективен форсированный диурез. В случае гиперкальциемии при злокачественных опухолях, вызванной усиленной костной резорбцией, эффективны бисфосфонаты и глюкокортикоиды. Они практически не влияют на уровень кальция в крови при первичном ГПТ, но эффективны при саркоидозе и интоксикации витамином D.
Гиперпаратиреоз
Гиперпаратиреоз подразделяют на первичный, вторичный и третичный.
Первичный гиперпаратиреоз
ЭТИОЛОГИЯ
Первичный гиперпаратиреоз (ГПТ) - клинико-биохимический синдром, проявляющийся нарушением кальциевого, фосфатного обмена и метаболизма кости вследствие гиперпродукции ПТГ и усиления его действия на органы и ткани. Повышение уровня ПТГ в крови обычно сопровождается гиперкальциемией и гипофосфатемией.
Таблица 62-4. Лечение тяжелой гиперкальциемии
Ежегодная заболеваемость достигает 0,2% у пациентов старше 60 лет. Пик заболеваемости приходится на возраст 30-50 лет. Около 75% пациентов со спорадическим первичным ГПТ - женщины.
В 80% случаев причина первичного гиперпаратиреоза - аденома (автономно функционирующая) одной из ПЩЖ. Они чаще всего расположены в нижних ПЩЖ, но у 6-10% пациентов паратиромы располагаются в тимусе, щитовидной железе, перикарде или позади пищевода (рис. 62-3). Аденокарцинома встречается редко (около 1% случаев). Гиперфункция нескольких ПЩЖ (гиперплазия, множественные аденомы и поликлональная гиперфункция) встречается в 20% случаев. Из них 15% приходится на гиперплазию всех четырех ПЩЖ. Примерно в 5% случаев причиной является синдром множественной эндокринной неоплазии (МЭН-1, МЭН-2а). Первичный ГПТ при МЭН-1 встречается в 90% случаев у лиц после 40 лет. Кроме синдрома МЭН, первичный ГПТ может встречаться в рамках других генетических синдромов. В ряде семей первичный ГПТ сочетается с доброкачественными опухолями челюсти (HPT-JT-синдром). Кроме того, описывают несиндромный семейный изолированный ГПТ, который может быть как проявлением «неполного» синдрома МЭН, так и самостоятельным генетически детерминированным заболеванием.
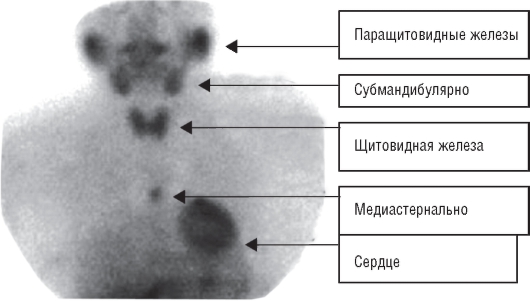
Рис. 62-3. Сцинтиграфия с технитрилом (Technetium-99m Sesta-mibi), передняя проекция шеи: возможные локализации аденомы паращитовидной железы
КЛИНИЧЕСКАЯ КАРТИНА
Включает 3 основных синдрома:
• усиление костной резорбции (поражение костей);
• гиперкальциурию (поражение почек);
• гиперкальциемию.
В классических случаях ГПТ проявляется:
• генерализованным поражением костей (фиброкистозным остеитом);
• поражением почек;
• гиперкальциемией и ее последействиями:
- нарушением психического статуса;
- нарушениями со стороны пищеварительной и нейромышечной систем.
В последние 10-20 лет 85% больных ГПТ не имеют классических проявлений, и нередко заболевание протекает бессимптомно, без поражения костей, с умеренной гиперкальциемией и выявляется случайно.
Поражение костей. Классический генерализованный фиброкистозный остеит проявляется болями в костях, переломами костей. Вследствие уменьшения минерализации кости могут быть мягкими и легко сгибаться. Сейчас наиболее частым проявлением поражения костей при ГПТ считают остеопороз. В отличие от других причин остеопороза, при ГПТ поражаются длинные трубчатые кости, меньше - трабекулярные, в частности, позвоночник. Может развиться кальциноз суставных хрящей (у 5% больных).
Поражение почек. Наиболее характерен для ГПТ нефролитиаз. Клинически это проявляется рецидивирующей почечной коликой, часто тяжелой, нередко требующей хирургического вмешательства. Камни, как правило, образуются в обеих почках, обычно оксалатные или фосфатные. Повторные эпизоды нефролитиаза или большие камни могут привести к обструкции мочевыводящих путей, инфекциям и ХПН. Могут развиться полиурия и полидипсия как следствие гиперкальциурии (осмотический диурез).
Симптомы гиперкальциемии
• Нарушение психического статуса. Гиперкальциемия оказывает токсическое действие на нервные клетки. Больные жалуются на утомляемость, снижение памяти, сонливость. Могут быть депрессии, психозы. При тяжелой гиперкальциемии может развиться атаксия, в тяжелых случаях - сопор и кома.
• Нейромышечные нарушения. Характерны мышечная слабость, проксимальная миопатия, изменяется походка («утиная походка»). Больной не может долго стоять, поднимать тяжести.
• Нарушения работы пищеварительной системы. Снижен аппетит вплоть до анорексии, тошнота, в тяжелых случаях рвота. Могут быть боли в животе, запор. Может развиться пептическая язва желудка. В редких случаях возможно развитие панкреатита - хронического или острого.
• Нарушения сердечно-сосудистой системы - брадикардия вплоть до развития асистолии, кальциноз клапанов сердца, гипертрофия ЛЖ, диастолическая дисфункция, ригидность сосудистой стенки. Повышена частота развития АГ, риск сердечно-сосудистой летальности.
• Кератиты и конъюнктивиты.
ДИАГНОСТИКА
Диагноз ставят при обнаружении высокого уровня ПТГ у пациента с гиперкальциемией. Другие биохимические показатели (магний, фосфор, хлорид и др.) малоспецифичны.
Биохимические данные. Уровень общего кальция в плазме крови - более 2,6 ммоль/л (>10,5 мг/дл), ионизированного кальция - более 1,3 ммоль/л (>5,2 мг/дл). Концентрация фосфата нормальная или ниже нормы - менее 2,5 ммоль/л (<3,5 мг/дл), характерна гиперкальциурия. В плазме крови повышается уровень маркеров костеобразования и резорбции (щелочной фосфатазы, остеокальцина, гидроксипролина в моче). Показана оценка уровня витамина D для исключения его дефицита, клиренса креатинина (по формуле MDRD).
ЭКГ. Укорочение интервала Q-T.
Рентгенологическое исследование. Наиболее раннее проявление генерализованного фиброкистозного остеита - субпериостальная резорбция кортикального слоя кости, лучше видимая при рентгенологическом исследовании фаланг. Рентгенологическое исследование десен позволяет выявить уменьшение или потерю lamina dura зубов и неспецифический, но часто встречаемый при гиперпаратиреозе периодонтоз.
Денситометрия. Количественная оценка минеральной плотности кости позволяет выявить остеопороз.
Когда диагноз ГПТ подтвержден, необходимо установить локализацию опухоли. УЗИ шеи, реже однофотонная эмиссионная КТ (или КТ/ позитронно-эмиссионная томография) используются, чтобы определить локализацию пораженной железы. Наиболее чувствительный метод - двухэтапная субтракционная сцинтиграфия с пертехнетатом и технитрилом (в англоязычной литературе - sesta-MIBI) (см. рис. 62-3).
В сложных случаях используют ангиографию с селективным забором крови из вен паращитовидных желез. Во время операции делают забор крови на ПТГ до и через 5 мин после удаления аденомы. Быстрое падение (>50%) уровня ПТГ подтверждает радикальность операции. Тяжелая гиперкальциемия в сочетании с поражением одной паращитовидной железы по данным сцинтиграфии свидетельствует о карциноме. Генетические тесты показаны при подозрении на семейные формы ГПТ (МЭН-1 - мутация в гене MENIN, МЭН-2 - мутации в протоонкогене RET).
ЛЕЧЕНИЕ
Современные методы лечения ГПТ
• Консервативное лечение.
• Традиционная хирургия.
• Малоинвазивные методы:
- одностороннее вмешательство под местной анестезией;
- эндоскопический;
- радиоуправляемый;
- этаноловая склерозирующая терапия.
Выбор метода лечения зависит от причины первичного ГПТ и его выраженности. Бессимптомный ГПТ часто лечат консервативно. Этим термином обозначают случаи, когда:
• уровень кальция в сыворотке крови повышен в пределах 1 мг/дл (0,25 ммоль/л) выше верхнего предела нормы (10,2 мг/дл);
• уровень ПТГ в 1,5-2 раза выше нормы или в норме;
• суточная экскреция кальция с мочой - до 400 мг/сут;
• нет данных за остеопороз и нефролитиаз. Показания к оперативному вмешательству
• Уровень кальция в сыворотке крови выше 11,4-12,0 мг/дл (>2,83 ммоль/л) или более чем на 0,3 ммоль/л (1 мг/дл) превышает верхний предел нормы.
• Остеопороз в любой зоне. Исследуют 3 зоны: позвоночник, бедро, лучевую кость (Т-критерий по данным денситометрии ниже -2,5 в любой зоне у мужчин старше 50 лет и женщин в климактерии или Z-критерий ниже -2,5 у женщин в период пременопаузы и мужчин моложе 50 лет).
• Нефролитиаз.
• Молодой возраст (<50 лет).
При аденоме удаляют ПЩЖ, в которой она находится. Оставшиеся железы обычно атрофированы из-за избытка кальция, и после удаления
аденомы может развиться гипокальциемия. Однако рекомендуют провести ревизию как минимум еще одной железы, чтобы убедиться в отсутствии множественной гиперплазии.
При карциноме ПЩЖ необходимы ревизия шеи, резекция с соблюдением принципов аблястики.
При гиперплазии ПЩЖ удаляют 3 железы и половину четвертой. Однако в ряде случаев, особенно при МЭН-синдроме, оставшаяся половина одной железы гиперплазируется и ГПТ персистирует. Альтернативный подход предполагает тотальную паратиреоидэктомию с последующей подсадкой части одной из ПЩЖ в ткани предплечья, откуда ее легко будет удалить в случае рецидива болезни. В последнее время все чаще используют минимально-инвазивные хирургические методы.
Снижение уровня кальция в сыворотке крови происходит в течение суток после успешной операции. В первые 3-5 дней после операции возможна транзиторная гипокальциемия. Острая послеоперационная гипокальциемия может развиться после тотальной паратиреоидэктомии.
Послеоперационное наблюдение включает контроль уровня кальция в сыворотке, креатинина и ПТГ через 6 мес в течение 1-го года и затем каждые 12 мес. Плотность кости (денситометрия) оценивают с 12-месячными интервалами. Пациентам нужно избегать дегидратации и ограничить потребление кальция (≤1000 мг в день). Консервативное лечение
При отсутствии показаний к хирургическому лечению (или при наличии противопоказаний) у пациентов с асимптоматичным ГПТ с остеопорозом используют гормональную заместительную терапию и бисфосфонаты (алендроновую кислоту - алендронат♠). Женщинам в период постменопаузы назначают заместительную терапию эстрогенами в течение года. Лечение бисфосфонатами проводят в течение 2 лет. Этот вариант терапии более безопасен, чем гормональная заместительная терапия. Эти варианты лечения повышают минеральную плотность кости, но не влияют на уровень ПТГ и кальция. Если ГПТ персистирует, ставится вопрос об оперативном лечении.
Пища, богатая фосфатом, и фосфатсодержащие антациды уменьшают всасывание кальция. Новая группа препаратов - кальций-миметики - селективно стимулируют кальцийчувствительный рецептор и подавляют продукцию ПТГ, при длительном (2 года и более) использовании происходят нормализация уровня кальция и снижение ПТГ в сыворотке крови. Не доказано их влияние на минеральную плотность кости. В процессе консервативного лечения необходим мониторинг для своевременного
пересмотра тактики. Проводят контроль уровня кальция в сыворотке крови (2 раза в год) и ежегодный контроль клубочковой фильтрации (по формуле MDRD) и денситометрии. При появлении показаний к хирургическому лечению - повышении уровня кальция более чем на 1 мг/дл выше верхней границы нормы, снижении костной плотности в любой зоне ниже -2,5, снижение клубочковой фильтрации (рассчитанной по формуле MDRD <60 мл/мин) - выполняют операцию.
Вторичный гиперпаратиреоз
Гипокальциемия независимо от причины ее возникновения стимулирует секрецию ПТГ и рост ПЩЖ. Вторичный ГПТ может развиться:
• при недостатке витамина D (рахите);
• хронической почечной недостаточности (уменьшении реабсорбции кальция в почках);
• приеме бисфосфонатов, антиконвульсантов, фуросемида;
• синдроме мальабсорбции и псевдогипопаратиреозе 1б типа.
В ответ на гипокальциемию увеличиваются секреция ПТГ и резорбция кости. В результате уровень кальция в плазме нормализуется. Это приводит к уменьшению минеральной плотности кости, остеомаляции и почечной остеодистрофии. Длительная стимуляция ПЩЖ может способствовать развитию аденомы в одной из желез или их гиперплазии. Вторичный ГПТ обычно купируют при устранении причины гипокальциемии. Однако у больных с ХПН вторичный ГПТ может сохраняться длительно и протекать более тяжело, чем у больных с другими причинами гипокальциемии.
Третичный гиперпаратиреоз
При длительной уремии может развиться ГПТ с нарушением регуляции секреции ПТГ и гиперкальциемией.
При этом происходит гиперплазия клеток паращитовидных желез с формированием автономной гиперсекреции ПТГ.
Гиперкальциемический криз
Гиперкальциемический криз - острое, опасное для жизни состояние, которое может развиться при повышении уровня общего кальция в сыворотке крови более 3,6 ммоль/л (>14 мг/дл).
Наиболее частой причиной криза считают первичный ГПТ. Реже причиной гиперкальциемического криза могут быть злокачественная
опухоль, секретирующая ПТГ-ПП, и тяжелая интоксикация витамином D.
В основе гиперкальциемического криза лежит значительное увеличение секреции ПТГ или ПТГ-ПП. Резко увеличиваются резорбция кости и мобилизация из нее кальция, увеличивается реабсорбция кальция в почке, быстро нарастает его концентрация в плазме крови.
КЛИНИЧЕСКАЯ КАРТИНА
Состояние больного тяжелое: апатия, сонливость, в дальнейшем при отсутствии лечения развиваются прострация, сопор и кома. Характерны дегидратация, анорексия, тошнота, рвота, резчайшая мышечная слабость, брадикардия, может развиться асистолия. Вначале отмечают полиурию и полидипсию, затем клубочковая фильтрация снижается и развивается олигурия.
ДИАГНОСТИКА
Лабораторные исследования. Криз развивается при уровне общего кальция в сыворотке крови более 3,6 ммоль/л (>14 мг/дл). При гипоальбуминемии количество общего кальция увеличивают на 0,8 мг/дл на каждый 1 г/дл дефицита альбумина. Нормальный уровень альбумина - 4 г/дл. Например: содержание альбумина в плазме - 3 г, а общего кальция в сыворотке крови - 14,2 мг/дл. Истинное количество общего кальция в сыворотке крови будет: 14,2+0,8=15 мг/дл.
ЛЕЧЕНИЕ
Больных с гиперкальциемическим кризом госпитализируют в отделение интенсивной терапии. Необходимо постоянное мониторирование уровня кальция, магния и калия в плазме крови. При гипомагниемии вводят препараты магния. Если больной принимает препараты дигиталиса, необходимо их отменить, так как при гиперкальциемии их эффект увеличивается.
• Регидратация. В течение одного часа вводят внутривенно от 500 до 1000 мл изотонического раствора натрия хлорида, а затем - по 200-300 мл/ч в течение суток. Необходимо измерять диурез и избегать задержки жидкости.
• Петлевые диуретики - фуросемид в дозе 800 мг/сут (по 200 мг 4 раза в день). Могут значительно снизить уровень кальция в плазме крови (1-3 мг/дл).
• Контроль уровня калия и магния в плазме крови. При низком уровне калия вводят калий в дозе 1-2 г в 10% растворе калия хлорида.
• Бисфосфонаты (см. табл. 62-4).
• Кальцитонин назначают в дозе 2-4 ЕД/кг подкожно или внутривенно каждые 6-12 ч, пока уровень кальция не снизится на 1-2 мг/дл.
• Нейтральный фосфат буфер. Снижает активность остеокластов и уровень кальция в плазме крови. Назначают на следующий день после введения пликамицина по 15 мг внутривенно ежедневно до снижения уровня кальция в крови меннее 13-12 мг/дл.
Гипокальциемия
Гипокальциемия - снижение уровня общего кальция в сыворотке крови <2 ммоль/л (<8 мг/дл), а ионизированного кальция в плазме крови - ниже 1,2 ммоль/л (<4,1 мг/дл).
Хроническая гипокальциемия менее распространена, чем гиперкальциемия. Наиболее частые причины включают хроническую почечную недостаточность, наследственный и приобретенный гипопаратиреоз, дефицит витамина D, нарушение обмена магния (табл. 62-5).
Таблица 62-5. Причины гипокальциемии
Острая гипокальциемия может развиться у пациентов в критическом состоянии (табл. 62-6) или при приеме некоторых лекарств и часто не требует лечения. Транзиторная гипокальциемия отмечена при сепсисе, ожогах, острой почечной недостаточности и массивных инфузиях цитратной крови. Почти у половины пациентов в отделении интенсивной терапии концентрация общего кальция в сыворотке крови менее 2,1 ммоль/л (8,5 мг/дл), уровень ионизированного кальция в плазме крови у большинства из них нормальный. У пациентов с сепсисом может быть снижен и уровень ионизированного кальция в плазме крови, но у большинства тяжелых пациентов основной причиной снижения концентрации кальция служит гипоальбуминемия. Алкалоз увеличивает связывание кальция белком, также делая необходимой оценку ионизированного кальция в плазме крови. Таким образом, окончательную верификацию диагноза гипокальциемии проводят по уровню ионизированного кальция в плазме крови.
Таблица 62-6. Острая гипокальциемия
Редкие причины
• Острый панкреатит.
• Переливание цитратной крови вызывает гипокальциемию путем соединения кальция с цитратом - образуется цитрат кальция.
• Остеобластные метастазы.
Гипопаратиреоз
Гипопаратиреоз - клинико-биохимический синдром недостатка паратиреоидного гормона (ПТГ), характеризуемый гипокальциемией и ее клиническими проявлениями.
ПРИЧИНЫ
• Врожденный, генетически детерминированный:
- аутоиммунный;
- семейный, или генетически обусловленный: о дефекты в молекуле ПТГ;
о дефект в регуляции секреции ПТГ;
о врожденная гипоплазия или аплазия паращитовидных желез (синдром Ди Георге и др.).
• Приобретенный:
- постхирургический: удаление или повреждение паращитовидных желез при операциях на шее (распространенность - 0,91,6% в крупных центрах);
- радиационный, последствие облучения шеи;
- инфильтративный (отложение железа, меди).
• Функциональный, вызванный недостатком или избытком магния.
ПАТОГЕНЕЗ
Недостаток ПТГ, обусловленный вышеперечисленными причинами, приводит к уменьшению активности остеокластов, резорбции кости и поступления кальция из костной ткани в кровь. Уменьшается синтез активного витамина D3 в почках, всасывание кальция в кишечнике и снижается ремоделирование кости. В почках из-за недостатка ПТГ увеличивается реабсорбция фосфата и развиваются гипокальциемия и гиперфосфатемия. Гипокальциемия ведет к уменьшению порога возбуждения нервов и мышц, повышается активность моторных и сенсорных нервов.
Наследственный (генетически детерминированный) гипопаратиреоз может встречаться изолированно, без других проявлений (идиопатический гипопаратиреоз). Чаще он протекает в сочетании с другими отклонениями, такими как врожденная гипоплазия тимуса или недостаточность других эндокринных желез: надпочечников, щитовидной железы, яичников (аутоиммунный полигландулярный синдром). В основе наследственного изолированного гипопаратиреоза лежит мутация гена рецепторов кальция на мембранах клеток паращитовидных желез - снижение чувствительности рецепторов к уровню кальция в крови и недостатку секреции ПТГ. В результате развивается гипокальциемия. Идиопатический наследственный гипопаратиреоз чаще проявляется в течение первых 10 лет жизни, но может появиться позже.
Аутоиммунный гипопаратиреоз. Может быть изолированным или входить в аутоиммунный полигландулярный синдром 1-го типа, который включает недостаточность коры надпочечников, сахарный диабет 1-го типа, иммунодефицит (недоразвитие тимуса), кожно-слизистый кандидоз, аллопецию, витилиго и перницитозную анемию. Ответственной за развитие этого синдрома является мутация гена в хромосоме 21q22,3, блокирующая кодон, обеспечивающий синтез белка - аутоиммунного регулятора. Аутоиммунный полигландулярный синдром также обычно проявляется в детском возрасте (5-9 лет). Вырабатываются антитела к клеткам паращитовидных и других эндокринных желез, входящих в аутоиммунный полигландулярный синдром (коре надпочечников, щитовидной железе, половым железам и др.), вызывающие гипофункцию органов-мишеней.
Редкие генетические синдромы
• Синдром Ди Георге (велокардиальный синдром). Встречается с частотой 1 случай на 4000-5000 рождений. Для него характерно недоразвитие жаберных дуг, приводящее к различным степеням гипоплазии ПЩЖ и тимуса, порокам развития лица и сердца, неспособности к обучению. Клинически проявляется гипопаратиреозом, иммунодефицитом, врожденными дефектами сердечно-сосудистой системы, лицевых костей черепа и других органов. Большинство пациентов умирают в раннем детстве из-за тяжелых инфекций, гипокальциемии и пороков сердца. Некоторые доживают до среднего возраста. Большинство случаев - следствие спорадических делеций в коротком плече хромосомы 22, но описана аутосомно-доминантная форма с делецией в хромосоме 22qll.2. Этот дефект хромосомы 22 называют DSG1. Позже был идентифицирован дефект (транслокация) в хромосоме 10р, который назван DSG2; фенотипически носители этих дефектов не отличаются.
• Синдром HDR. Аутосомно-доминантный дефект, приводящий к развитию гипопаратиреоза, глухоты и недоразвитию почек. Характеризуется транслокацией в хромосоме 10 (DSG2), как и при синдроме Ди Георге. Однако отличается отсутствием иммунодефицита и сердечных дефектов.
• Синдром Кеннея-Кэффи (Kenney-Caffey) включает гипопаратиреоз, низкорослость, остеосклероз и утолщение коркового слоя костей.
• Синдром Саньяда-Сакати (Sanjad-Sakati). Дефект впервые был описан у азиатов, включает нарушения роста и другие проявления
дисморфогенеза. Это аутосомно-рецессивный синдром, характеризуемый мутацией гена на хромосоме Iq42-q43.
• Синдром Кенса-Сайра (Kearns-Sayre) включает гипопаратиреоз, офтальмоплегию, пигментную ретинодистрофию и миопатию.
• Синдром MELAS включает энцефалопатию , молочный ацидоз и инсультоподобные эпизоды. Оба эти синдрома (синдромы КенсаСайра и MELAS) характеризуются мутациями или делециями в митохондриальных генах.
• Синдром Барттера сопровождается нарушениями в электролитном и кислотно-основном балансе, включая гипокальциемию и гиперкальциурию, иногда нефрокальцинозом и другими особенностями. Вовлечены несколько типов ионных каналов и транспортеров вследствие мутации хромосомы 3q13CaSRs (аутосомно-доминантной).
• Дефект в молекуле ПТГ. Описаны несколько случаев семейного гипопаратиреоза, при которых причиной была мутация в гене ПТГ, которая привела к синтезу дефектной молекулы ПТГ и снижению его концентрации.
• Дефект секреции ПТГ. Гипокальциемия и гиперкальциурия - главные особенности аутосомно-доминантого синдрома гиперкальциурической гипокальциемии, который вызван активирующей мутацией связывающего кальций рецептора в клетках паращитовидных желез и почек. Эти мутации вызывают чрезмерное торможение кальцием секреции ПТГ. Гипокальциемия обычно умеренная и бессимптомная. Лечение следует проводить осторожно, так как повышение уровня кальция в крови ведет к дальнейшему увеличению мочевой экскреции кальция и может вызвать нефрокальциноз.
КЛИНИЧЕСКАЯ КАРТИНА
Остро возникший гипопаратиреоз (например, постоперационный) может вызвать гипокальциемию с развитием парестезий, спазмов мышц (тетании). Напротив, при хроническом гипопаратиреозе гипокальциемия развивается настолько медленно, что единственным симптомом может быть снижение зрения из-за катаракты.
Типичны следующие проявления.
• Симптомы повышенной нервно-мышечной возбудимости:
- парестезии, в основном вокруг рта и в пальцах;
- тетания в виде спазма отдельных групп мышц (наиболее опасны ларингоили бронхоспазмы). Подтвердить ее наличие позволяют положительные симптомы Хвостека и Труссо:
о симптом Хвостека. Поколачивание по области выхода лицевого нерва - на 1 см кпереди и несколько ниже бугорка ушной раковины. Положительный симптом - от слабого подергивания уголка рта на стороне поколачивания до ярко выраженного сокращения всех лицевых мышц («рыбий рот»);
о симптом Труссо. В манжетку тонометра, надетую на руку пациента, нагнетают воздух до достижения отметки на 20 мм рт.ст. выше уровня систолического давления. Положительный симптом - появление карпального спазма («рука акушера»); - судороги. Описаны 2 типа судорог:
о генерализованная тетания, характеризуемая продолжительным тоническим спазмом мышц;
о эпилептиформный судорожный синдром, подобный эпилепсии.
• Гипервентиляция (нередко сопровождает судороги).
• Тахикардия, повышенная потливость, бледность кожи.
• Проявления со стороны сердца: замедление реполяризации, удлинение интервала Q-T на ЭКГ, систолическая дисфункция, может развиться кардиомегалия с рефрактерной к терапии конгестивной сердечной недостаточностью.
• Проявления со стороны ЦНС. Отложение кальция в базальных ганглиях может проявляться как истинный паркинсонизм.
• Проявления со стороны кожи и зубов. Кожа сухая, шелушащаяся. Ломкие ногти. У детей нарушается образование зубной эмали, плохой рост зубов, дефекты в корнях зубов.
• Проявления со стороны глаз - лентикулярная катаракта.
• При длительно текущем гипопаратиреозе и недостаточном лечении может развиться синдром мальабсорбции.
ДИАГНОСТИКА
Анализ медицинской и семейной истории помогает установить причину гипокальциемии. Операция на органах шеи предполагает постоперационный гипопаратиреоз. Семейная история гипокальциемии предполагает генетическую причину. Наличие других аутоиммунных эндокринопатий или кандидоза заставляет заподозрить АПС 1-го типа. Иммунодефицит и другие врожденные дефекты указывают на синдром Ди Георге.
Лабораторные исследования
Необходимо оценить уровень кальция - общего (откорректированного по уровню альбумина; см. формулу в разделе «Гиперкальциемиче-
ский криз») и ионизированного, белка, фосфора, магния, креатинина, ПТГ и витамина D.
Уровень общего кальция в сыворотке крови - менее 8 мг/дл, ионизированного кальция в плазме крови - менее 4 мг/дл, уровень фосфата в сыворотке крови - выше 5 мг/дл. В моче гипофосфатурия, гипокальциурия. Уровень ПТГ в сыворотке крови низкий - менее 1 пмоль/л.
Дифференциальная диагностика
Оценка уровня витамина D важна для исключения дефицита витамина D как причины гипокальциемии. При классическом дефиците витамина D увеличен уровень ПТГ, а уровень фосфора в крови низок или на нижней границе нормы, в отличие от гипопаратиреоза, при котором фосфор повышен. Измерения кальция, магния и креатинина в суточной моче могут также быть полезными в диагностике. Низкий уровень кальция в моче может быть как при тяжелом гипопаратиреозе, так и при дефиците витамина D. У больных с гипокальциемией вследствие мутаций во внеклеточном кальцийчувствительном рецепторе отношение кальция к креатинину в суточной моче существенно выше, чем у больных с другими типами гипопаратиреоза (в среднем 0,362 против 0,093). При выявлении дефицита магния оценивают его уровень в суточной моче. Увеличенный или даже просто поддающийся определению уровень магния предполагает его потерю почкой как причину дефицита магния, так как почка должна сохранять магний при его дефиците. Генетические исследования показаны при подозрении на генетические синдромы.
ЛЕЧЕНИЕ
Лечение включает препараты витамина D (предпочтительно кальцитриол) (табл. 62-7) в сочетании с высоким потреблением кальция с пищей или в виде препаратов (табл. 62-8). Для большинства пациентов компенсация обеспечивается витамином D в дозе 40 000-120 000 ME в сутки (1-3 мг/сут) в сочетании с употреблением 1,0-1,5 г элементарного кальция в сутки. Требуется регулярный контроль для своевременной коррекции терапии. В отличие от эупаратиреоидных пациентов (ежедневная потребность - 200 ME/сут, у пожилых пациентов - 800 ME/ сут), у пациентов с гипопаратиреозом необходима в 100 раз более высокая доза витамина D. Это связано с уменьшением преобразования витамина D в 1,25(OH)2D3 у таких больных. Более удобно использование кальцитриола по 0,5-1,0 мкг, особенно при сложностях с подбором дозы витамина D. Кальцитриол также обеспечивает быстрое развитие
эффекта (несколько дней) по сравнению с жирорастворимым витамином D, требующим несколько недель для развития эффекта.
Таблица 62-7. Основные препараты витамина D, используемые для лечения гипопаратиреоза
Таблица 62-8. Препараты кальция
Кальций и витамин D восстанавливают нормальный баланс фосфора и кальция, но не нормализуют полностью сниженную реабсорбцию кальция в почках, типичную для гипопаратиреоза. В связи с этим необходим контроль экскреции кальция с мочой, чтобы избежать гиперкальциурии на фоне терапии витамином D и кальцием. При гиперкальциурии высок риск нефролитиаза. Тиазидные диуретики при соблюдении низкосолевой диеты значительно снижают экскрецию кальция с мочой (примерно на 100 мг/сут) и могут использоваться для уменьшения гиперкальциурии.
Внутривенное назначение препаратов кальция обосновывают прежде всего тяжестью клинических проявлений. Тяжелые симптомы [например, эпилепсия, ларингоспазм, бронхоспазм, проявления со стороны сердца (застойная сердечная недостаточность) и изменение психического статуса] требуют внутривенного введения кальция, даже если его уровень в крови снижен незначительно (например, 7-8 мг/дл, или 1,75-2,0 ммоль/л).
Уровень кальция, фосфора и креатинина в крови должен контролироваться еженедельно на этапе подбора дозы и дважды в год, когда режим лечения стабилизирован. Кальций в моче и креатинин контролируют дважды в год. Цель терапии - контроль симптомов, уровня кальция в низконормальном диапазоне (около 8,0-8,5 мг/дл, или 2,0-2,12 ммоль/л), суточная экскреция кальция ниже 300 мг, фосфата кальция - ниже 55 мг. Более высокие уровни могут привести к осаждению солей фосфата кальция в мягких тканях (в почках, хрусталике и базальных ганглиях). Ежегодно - офтальмологический осмотр в щелевой лампе для контроля развития катаракты.
Трансплантация ткани паращитовидной железы и лечение паратиреоидным гормоном
Эти методы лечения малодоступны. Аллотрансплантация ПЩЖ требует иммуносупрессии, которая может быть более опасна, чем болезнь, от которой она избавляет. Иногда выполняют аутотрансплантацию ПЩЖ в предплечье. Аутотрансплантаты могут представлять собой свежую ткань ПЩЖ или ткань ПЩЖ, удаленной ранее и замороженной. Показанием к аутотрансплантации ПЩЖ считают высокую вероятность послеоперационного гипопаратиреоза. Половина трансплантаций неудачна, а после успешных операций высок риск развития рецидивов ГПТ, так как ткань ПЩЖ, используемая для трансплантата, патологически изменена.
Для лечения гипопаратиреоза можно использовать синтетический человеческий ПТГ, который вводят подкожно 1 раз в день. Увеличение мочевой экскреции кальция при этом меньше, чем при лечении кальцием и кальцитриолом. В РФ препараты синтетического ПТГ не зарегистрированы.
Псевдопсевдогипопаратиреоз
Псевдопсевдогипопаратиреоз встречается в семьях с псевдогипопаратиреозом типа 1a. Он развивается при комбинации инактивирующей мутации GNAS1 и остеодистрофии Олбрайта без резистентности к другим гормонам, которая характеризует псевдогипопаратиреоз. Гормональная устойчивость подавлена, когда видоизмененный ген GNAS1 унаследован от отца.