Медицинская микробиология, вирусология и иммунология: том 1 : учебник / Под ред. В.В. Зверева, М.Н. Бойченко, 2010.
|
|
|
|
ГЛАВА 12 ОСОБЕННОСТИ ИММУНИТЕТА ПРИ РАЗЛИЧНЫХ ЛОКАЛИЗАЦИЯХ И СОСТОЯНИЯХ
12.1. Особенности местного иммунитета
Местный иммунитет формируется в пределах кожных покровов и слизистых оболочек, непосредственно контактирующих с окружающей средой и наиболее вероятных входных ворот экзогенных антигенов, и защищает их. Факторы местного иммунитета могут действовать экстракорпорально - выходить за пределы макроорганизма на поверхность кожных покровов и выделяться или мигрировать в секрет слизистых оболочек. Концепцию местного иммунитета впервые высказал А.М. Безредка (1919).
Система местного иммунитета функционирует достаточно обособленно и имеет ряд особенностей. Между общим и местным иммунитетом существует тесная связь. Во-первых, система общего иммунитета является резервным источником факторов защиты. Во-вторых, при развитии инфекционного процесса отчетливо прослеживается переход местной иммунной реактивности в общую. В-третьих, между этими двумя системами постоянно осуществляется обмен факторами иммунитета (антитела, клоны антигенореактивных лимфоцитов и др.), что важно для распространения по всему организму иммунологической памяти (см. раздел 11.5).
12.1.1. Иммунитет кожи
Кожа выполняет функцию механической защиты - она предохраняет макроорганизм от внешних воздействий и в случае повреждения способна самостоятельно восстановить свою целостность. Она также является фактором физико-химической защиты - продукты потовых и сальных желез обладают бактерицидностью. Кроме того, в коже эффективно действует система местного иммунитета.
Внешний слой кожи, эпидермис, формируется эпителиальными клетками - кератиноцитами. В его толще встречаются дендритные клетки двух типов: клетки Лангерганса и Гринстейна. В дерме и эпидермисе локализуются лимфоциты и тучные клетки. Лимфоидная популяция представлена в основном Т2-хелперами и Т-киллерами. В дерме и эпидермисе происходит дифференцировка незрелых Т-лимфоцитов в зрелые клетки.
Кератиноциты - немигрирующие эпителиальные клетки, выполняющие в коже барьерную и иммунорегуляторную функции. Они экспрессируют MHC II класса, ко-стимулирующие молекулы CD40, 80, 86 и Fas-лиганд. Клетки синтезируют широкий спектр цитокинов: ИЛ-1, 6, 7, 8, ФНО, β-ТФР, ГМ-КСФ, α,β-ИФН и др.
Неактивированные кератиноциты обеспечивают только барьерную функцию. Повреждающие воздействия (травма, ожог, воспаление и пр.) или иммуноцитокиновая стимуляция активируют кератиноциты, и они становятся способными презентировать антиген Т-хелперам, запускать антительный иммунный ответ и подавлять местную клеточную пролиферацию иммунных лимфоцитов.
Клетки Лангерганса, или белые отростчатые эпидермоциты - мигрирующие дендритные клетки миелоидной природы. Происходят из клеток костного мозга или циркулирующих моноцитов. Продолжительность жизни около 20 сут, чувствительны к УФ-излучению. Экспрессируют на клеточной мембране MHC II класса, CD4, 40, синтезируют ИЛ-1, 12, α,β-ИФН, ГМ-КСФ, хемокины.
В дерме клетки Лангерганса способны захватывать и процессировать антиген, но не могут выполнять функции АПК, так как не экспрессируют ко-стимулирующие факторы - молекулы CD80, 86. После активации продуктами воспаления или цитокинами захватившая антиген клетка Лангерганса мигрирует с током лимфы в регионарные лимфоузлы. Там она дифференцируется в зрелую дендритную клетку - интердигитальную клетку лимфоузлов и экспрессирует недостающие молекулы CD80, 86, а также начинает синтезировать цитокины. Интердигитальная клетка теряет способность захватывать и процессировать антиген, но при этом превращается в эффективную АПК. Она активирует Т-хелперы и запускает специфический антительный иммунный ответ и формирование иммунологической памяти.
Разобщение в пространстве и времени индукции в коже специфического иммунного ответа сопрягает систему местного и общего
иммунитета, обеспечивает генерализацию защитного реагирования и формирвание иммунологической памяти. В случае инактивации клеток Лангерганса (например, УФ-облучением) функции АПК в коже начинают выполнять кератиноциты и клетки Гринстейна, однако они потенцируют иммуносупрессию - угнетение кожной иммунореактивности.
Антитела в коже не имеют большого значения, развивается преимущественно клеточный иммунный ответ. Напряженность местного иммунитета в коже, так же как и интегральное состояние клеточного звена иммунитета в целом, характеризуется кожноаллергическими пробами.
12.1.2. Иммунитет слизистых оболочек
Сами эпителиальные клетки представляют собой хороший механический барьер, препятствующий инвазии патогенов. Секрет слизистых оболочек также выполняет функции физико-химического барьера (см. раздел 9.2.1.1), а нормальная микрофлора, населяющая слизистые оболочки, - биологического, так как обеспечивают колонизационную резистентность (см. раздел 9.2.1.2). Система местного иммунитета слизистых оболочек отличается развитой лимфоидной тканью и высокой насыщенностью иммунокомпетентными клетками.
Лимфоидный состав слизистых оболочек имеет характерные особенности, обусловленные его формированием. Различают раннюю (реликтовую) и позднюю (современную) компоненты. Ранняя компонента представлена γδT и В1-лимфоцитами, которые рано отселяются в периферические лимфоидные образования прямо из костного мозга и в дальнейшем развиваются автономно от центральных органов иммунной системы. Антигенные рецепторы этих клеток отличаются относительно низкой аффинностью, но обладают достаточно широким спектром чувствительности. Это позволяет им обеспечить первую линию защиты от микробной агрессии и необходимую отсрочку для активации поздней компоненты.
Клетки поздней компоненты развиваются под контролем центральных органов иммунной системы. К их числу относятся традиционные αβT и CD5- В-лимфоциты, обладающие высокой специфичностью и аффинностью рецепторного аппарата. Эти клетки обеспечивают высокоэффективный специфический иммунный ответ и формируют вторую линию иммунной защиты в слизистых оболочках.
Наиболее ярким примером организации иммунной защиты слизистых оболочек является высокоразвитая лимфоидная система желудочно-кишечного тракта, в которой различают две функциональных зоны - индуктивную и эффекторную. Индуктивная зона сформирована лимфоидными фолликулами (в том числе аппендикса, пейеровых бляшек), состоящими из равных количеств Т- и В-лимфоцитов. В индуктивной зоне идентифицируются области преимущественного расселения Т- и В-лимфоцитов. В В-области располагается герминативный (зародышевый) центр, где размножаются и созревают В-лимфоциты, в основном IgA-продуценты. Т-популяция на 2/3 представлена Т-киллерами ина 1/3 - Т-хелперами. Обнаруживаются также макрофаги и дендритные клетки. В этой зоне осуществляются презентация и распознавание антигена, индукция иммунного реагирования, формирование клонов антигенспецифических Т-и В-лимфоцитов, дифференцировка В-лимфоцитов в IgA-продуценты.
Помощь в презентации антигена оказывают М-клетки эпителия. Они захватывают молекулы антигена в просвете органа и путем трансцитоза переносят его к АПК.
Эфферентная зона охватывает околоэпителиальную область и lamina propria. В околоэпителиальной области находятся популяция интраэпителиальных лимфоцитов, которая на 3/4 состоит из Т-киллеров, а также γδТ-лимфоцитьI. Они обеспечивают функцию иммунологического надзора за быстроразмножающимся эпителием. Антиген могут презентировать энтероциты, которые в активированном состоянии экспрессируют MHC II класса, синтезируют цитокины и хемокины (ИЛ-8). Однако энтероциты являются неклассическими АПК.
В lamina propria обнаруживается много Т- и В-лимфоцитов, макрофагов и естественных киллеров. На долю Т-лимфоцитов приходится до 60% всей лимфоидной популяции. На 2/3 это Т-хелперы, остальные клетки - Т-киллеры, в том числе γδТ-лимфоциты. Доля В-лимфоцитов составляет 40%, половина из них - это В1-клетки. Подавляющее большинство антителопродуцентов (80%) синтезирует полимерные молекулы IgA. В этой области развивается антительный ответ. Идет интенсивный биосинтез иммуноглобулинов, в основном класса A, которые действуют как в пределах самих тканей, так и в составе секрета слизистых оболочек, куда поступают в результате направленного транспорта (sIg) или диффузии.
Фагоцитирующие клетки, содержащиеся в собственной пластинке, способны совершать маятникообразные перемещения. Привлеченные хемоаттрактантами, они могут выходить через эпителий в просвет полого органа (кишки, бронха, ротовой полости и т.д.) и возвращаться обратно.
В пределах слизистых оболочек обнаруживается много тучных клеток и эозинофилов. Синтезируя вазоактивные амины (тучные клетки), токсины (эозинофилы), ферменты, иммуноцитокины, липидные медиаторы и другие биологически активные вещества, они участвуют в регуляции иммунной и воспалительной реакций в пределах ткани. В случае гиперпродукции IgE и особой генетической предрасположенности тучные клетки потенцируют развитие аллергической реакции I типа (анафилаксию).
12.1.2.1. Особенности иммунитета ротовой полости
Система иммунной защиты ротовой полости удачно сочетает разнообразные неспецифические и специфические факторы, обеспечивающие эффективную защиту от кариесогенных и иных болезнетворных микробов.
Клетки слизистой оболочки выполняют функции механического барьера. Особое значение имеет антимикробная активность слюны. В течение суток в организме взрослого человека вырабатывается до 2 л слюны - секрета с выраженной ферментативной активностью. Это не только мощный физико-химический, но и биологический барьер. Слюна содержит широкий набор веществ, обладающих выраженными бактерицидными свойствами: лизоцим, лактоферрин, лактопероксидаза, отдельные компоненты комплемента и пр. В слюне также постоянно присутствует до 200 000 фагоцитирующих клеток. В соединительнотканной строме ротовой полости также обнаруживаются клеточные элементы неспецифической резистентности: активно мигрирующие тканевые макрофаги, фибробласты, гранулоциты и тучные клетки.
Система специфической иммунной защиты ротовой полости представлена мощными миндалинами глоточного кольца, хорошо развитой системой лимфоидного дренирования в подчелюстных, подъязычных, околоушных и шейных лимфоузлах. В тканях обнаруживаются лимфоидные скопления, а в слюне - лимфоциты и широкий спектр иммуноглобулинов. Количественно доминирует IgA. Здесь его содержится заметно больше, чем в сыворотке крови. Наибольшую функциональную нагрузку несет секреторная форма
IgA (sIgA). Содержание IgM, G и E в слюне несколько меньше, чем в сыворотке крови. Снижение содержания в слюне иммуноглобулинов, особенно IgA, чревато гнойно-воспалительными или аллергическими заболеваниями слизистой оболочки ротовой полости.
12.2. Особенности иммунитета при различных состояниях
Макроорганизм имеет широкий спектр средств защиты своей целостности и поддержания гомеостаза. Однако для минимизации энергетических и пластических затрат макроорганизм для устранения конкретного антигена использует лишь наиболее эффективные механизмы и факторы защиты. Поэтому при воздействии различных по природе и свойствам антигенов иммунное реагирование макроорганизма имеет свои особенности.
12.2.1. Особенности иммунитета при бактериальных инфекциях
Иммунная реакция макроорганизма в ответ на бактериальную инфекцию в значительной степени определяется факторами патогенности микроба и в первую очередь его способностью к токсинообразованию. Различают иммунитет антибактериальный - против структурных компонентов бактериальной клетки и антитоксический - против белковых токсинов.
Основными факторами антибактериальной защиты являются антитела и фагоциты. Антитела эффективно инактивируют биологически активные молекулы бактериальной клетки (токсины, ферменты агрессии и др.), маркируют их, запускают антителозависимый бактериолиз и иммунный фагоцитоз. Фагоциты непосредственно осуществляют фагоцитоз, в том числе иммунный, антителозависимый бактериолиз и внеклеточный киллинг патогена при помощи ион-радикалов и ферментов. Важная роль в борьбе с грамположительными микробами принадлежит лизоциму, а с грамотрицательными - комплементу (альтернативный путь активации), кроме того, существенное значение имеют белки острой фазы (С-реактивный и маннозосвязывающий протеин).
Ряд бактерий, относящихся к факультативным внутриклеточным паразитам, отличается повышенной устойчивостью к действию комплемента, лизоцима и фагоцитов (незавершенный фаго-
цитоз). К их числу относятся микобактерии, йерсинии, бруцеллы, сальмонеллы и некоторые другие. В такой ситуации макроорганизм вынужден переключать нагрузку на клеточное звено иммунитета, что ведет к аллергизации организма по механизму ГЗТ. Особое значение приобретают активированные макрофаги и естественные киллеры, осуществляющие АЗКЦТ, а также γδТ-лимфоциты.
Напряженность специфического антибактериального иммунитета оценивают в серологических тестах по титру или динамике титра специфических антител, а также по состоянию клеточной иммунореактивности (например, по результатам кожно-аллергической пробы).
12.2.2. Особенности противовирусного иммунитета
Особенности иммунной защиты макроорганизма при вирусных инфекциях обусловлены двумя формами существования вируса: внеклеточной и внутриклеточной. Основными факторами, обеспечивающими противовирусный иммунитет, являются специфические антитела, Т-киллеры, естественные киллеры, интерферон и сывороточные ингибиторы вирусных частиц.
Специфические противовирусные антитела способны взаимодействовать только с внеклеточным вирусом, так как у них нет доступа внутрь живой клетки. Антитела нейтрализуют вирусные адгезины и нейраминидазы, препятствуя адсорбции вирусов на клетках-мишенях и их инфицированию. Они также связывают вирусные белки и нуклеиновые кислоты, образовавшиеся после разрушения зараженных вирусами клеток. Сформировавшиеся иммунные комплексы элиминируются путем иммунного фагоцитоза. Специфическое связывание антител с вирусными белками, экспрессированными на цитоплазматической мембране инфицированных клеток, индуцирует естественные киллеры к АЗКЦТ (см. раздел 11.3.1).
Клетки, инфицированные вирусом и приступившие к его репликации, экспрессируют вирусные белки на цитоплазматической мембране в составе молекул антигенов гистосовместимости - MHC I класса (см. раздел 10.1.4.2). Измененная структура MHC I класса этих антигенов гистосовместимости является маркером для Т-киллеров, которые распознают зараженные вирусом клетки и уничтожают их (см. раздел 11.3.2).
Мощным противовирусным свойством обладает интерферон (см. раздел 9.2.3.4). Он не действует непосредственно на внутриклеточный вирус, а связывается с рецептором на мембране клетки и подавляет в ней все биосинтетические процессы.
Сывороточные ингибиторы неспецифически связываются с вирусной частицей и нейтрализуют ее, препятствуя тем самым адсорбции вируса на клетках-мишенях.
Напряженность противовирусного иммунитета оценивают преимущественно в серологических тестах по нарастанию титра специфических антител в парных сыворотках в процессе болезни. Определяют также концентрацию интерферона в сыворотке крови.
12.2.3. Особенности противогрибкового иммунитета
Антигены грибов имеют относительно низкую иммуногенность: они практически не индуцируют антителообразование (титры специфических антител остаются низкими), но стимулируют клеточное звено иммунитета. Основными действующими факторами противогрибкового иммунитета являются активированные макрофаги, которые осуществляют АЗКЦТ грибов.
При микозах наблюдается аллергизация макроорганизма. Кожные и глубокие микозы сопровождаются, как правило, ГЗТ. Грибковые поражения слизистых оболочек дыхательных и мочеполовых путей вызывают аллергизацию по механизму ГНТ (реакция I типа). Напряженность противогрибкового иммунитета оценивается по результатам кожно-аллергических проб с грибковыми аллергенами.
12.2.4. Особенности иммунитета при протозойных инвазиях
Паразитарная инвазия сопровождается формированием в макроорганизме гуморального и клеточного иммунитета. В крови определяются специфические антитела классов M и G, которые чаще всего не обладают протективным свойством. Однако они активируют АЗКЦТ с участием макрофагов, а в случае внутриклеточного паразитирования - естественных киллеров и γδT лимфоцитов. Паразитарные инвазии соспровождаются аллергизацией макроорганизма по механизму ГЗТ.
Характер противопаразитарного иммунитета определяется биологическими особенностями паразита. Многие паразиты обладают
высокой антигенной изменчивостью, что позволяет им избегать действия факторов иммунитета. Например, каждой стадии развития малярийного плазмодия соответствуют свои специфические антигены.
Напряженность противопаразитарного иммунитета оценивается в серологических тестах по титру специфических антител и в кожно-аллергических пробах с протозойным антигеном.
12.2.5. Особенности противоглистного иммунитета
Ведущую роль в осуществлении иммунной защиты макроорганизма от глистной инвазии играют эозинофилы, которые осуществляют АЗКЦТ. Эти клетки распознают паразитов, отмеченных специфическими IgE или IgA. Активированный эозинофил выделяет путем дегрануляции ряд токсичных субстанций (ферменты, белковые токсины), губительно действующих на гельминты.
Антигены гельминта, связываясь также с рецепторными комплексами тучных клеток слизистой оболочки, вызывают их дегрануляцию. Экскретированные биологически активные соединения вызывают интенсивную перистальтику, удаляющую паразита или его останки из просвета кишки.
Эозинофилы и тучные клетки синтезируют цитокины и липидные медиаторы, потенцирующие воспалительную реакцию в месте внедрения гельминта. Глистная инвазия сопровождается аллергизацией в основном по механизму ГЗТ.
12.2.6. Трансплантационный иммунитет
Макроорганизм формирует иммунную реакцию, направленную против пересаженной в него чужеродной ткани (трансплантата). Это является основной проблемой, препятствующей успешной пересадке органов и тканей. Иммунная реакция на чужеродные клетки и ткани обусловлена тем, что в их составе содержатся генетически чужеродные для организма антигены. Эти антигены получили название трансплантационных или антигенов гистосовместимости (см. раздел 10.1.4.2). Наиболее полно они представлены на цитоплазматической мембране клеток.
Реакция отторжения не возникает в случае полной совместимости донора и реципиента по антигенам гистосовместимости - такое возможно лишь для однояйцовых близнецов. Выраженность
реакции отторжения во многом зависит от степени чужеродности, объема трансплантируемого материала и состояния иммунореактивности реципиента.
На чужеродные трансплантационные антигены организм реагирует факторами клеточного и гуморального иммунитета. Основным являются Т-киллеры и специфические антитела. Т-киллеры осуществляют АНКЦТ тканей трансплантата (реакция реципиент против трансплантата) или реципиента (реакция трансплантат против реципиента). Специфические антитела, которые образуются к антигенам трансплантата, запускают комплементили клеточноопосредованный цитолиз трансплантата.
Возможен адоптивный перенос трансплантационного иммунитета с помощью активированных лимфоцитов или со специфической антисывороткой от сенсибилизированной особи интактному макроорганизму.
Механизм иммунного отторжения пересаженных клеток и тканей имеет две фазы. В первой фазе вокруг трансплантата и сосудов наблюдается скопление иммунокомпетентных клеток (лимфоидная инфильтрация), в том числе Т-киллеров. Во второй фазе происходит деструкция клеток трансплантата Т-киллерами, активируются макрофагальное звено, естественные киллеры, специфический антителогенез. Затем возникают иммунное воспаление, тромбоз кровеносных сосудов, нарушается питание трансплантата и происходит его гибель. Разрушенные ткани утилизируются фагоцитами. Ткани трансплантата реагируют на ткани реципиента подобным же образом. Однако иммунная реакция трансплантата слабее, так как ограничена его ресурсами.
В процессе реакции отторжения формируется клон клеток иммунологической памяти. Повторная попытка пересадки тех же органов и тканей вызывает вторичный иммунный ответ, который протекает очень бурно и быстро заканчивается отторжением трансплантата.
12.2.7. Иммунитет против новообразований
Противоопухолевый иммунитет имеет свои особенности, связанные с низкой иммуногенностью раковых клеток. Эти клетки практически не отличаются от нормальных, интактных морфологических элементов собственного организма. Специфический антигенный репертуар опухолевых клеток также скуден. В число
опухольассоциированных антигенов (см. раздел 10.1.4.3) входят группа раково-эмбриональных антигенов, продукты онкогенов, некоторые вирусные антигены и гиперэкспрессируемые нормальные белки. Слабому иммунологическому распознаванию опухолевых клеток способствуют отсутствие воспалительной реакции в месте онкогенеза, их иммуносупрессивная активность - биосинтез ряда негативных цитокинов (β-ТФР и др.), а также экранирование раковых клеток противоопухолевыми антителами.
Механизм противоопухолевого иммунитета до сих пор слабо изучен. Считается, что основную роль в нем играют активированные макрофаги, определенное значение имеют также естественные киллеры. Защитная функция гуморального иммунитета во многом спорная - специфические антитела могут экранировать антигены опухолевых клеток, не вызывая их цитолиза.
В последнее время получила распространение иммунодиагностика рака, которая основана на определении в сыворотке крови раково-эмбриональных и опухольассоциированных антигенов. Так, в настоящее время удается диагностировать некоторые формы рака печени, желудка, кишечника, простаты и др.
Между состоянием иммунной защиты и развитием новообразований существует тесная связь. Злокачественные новообразования наблюдаются чаще у индивидуумов с иммунодефицитами и престарелых (в связи с понижением активности иммунной системы). Иммуносупрессивная химиотерапия также нередко сопровождается пролиферативными процессами. Поэтому в лечении опухолей нашли применение иммуномодуляторы (интерлейкины, интерфероны), а также адъюванты (мурамилдипептиды, вакцина БЦЖ и др.).
12.2.8. Иммунология беременности
Беременность напрямую сопряжена с феноменом иммунологической толерантности. В организме беременной формируется целый комплекс факторов, обеспечивающих ареактивность иммунной системы матери к гетероантигенам плода. Во-первых, синцитиотрофобласт плаценты «невидим» для рецепторов иммунокомпетентных клеток. Он не экспрессирует классические молекулы гистосовместимости, а только неполиморфные, трудно распознаваемые. Во-вторых, синцитиотрофобласт синтезирует иммуносупрессорные цитокины (ИЛ-4, 10, β-ТФР). В-третьих, в децидуальной оболочке беременной матки располагаются CD16-
CD56много естественные киллеры (см. раздел 11.3.2), которые устраняют активированные аллоантигенами плода лимфоциты путем индукции у них апоптоза.
12.3. Иммунный статус и его оценка
Иммунный статус - это совокупность всех параметров иммунной системы, с помощью которых осуществляются распознавание и элиминация из организма чужеродных субстанций антигенной природы. Изучение иммунного статуса является важной составной частью клинической иммунологии. Задачей клинической иммунологии являются диагностика, лечение и профилактика заболеваний иммунной системы. Оценка иммунного статуса проводится с целью иммунодиагностики, т.е. идентификации нарушенного звена иммунной системы, от которого зависит развитие заболевания. Выделяют 4 группы заболеваний иммунной системы: иммунодефициты, аутоиммунные, аллергические и лимфопролиферативные заболевания. Прежде всего иммунодиагностика, как и любая лабораторная диагностика, направлена на подтверждение клинического диагноза. Наибольшую значимость иммунодиагностика имеет при иммунодефицитах, которые подразделяют на первичные и вторичные. Первичные иммунодефициты являются следствием наличия в организме генетического дефекта. На основании клинической картины можно предполагать, какое звено иммунной системы поражено: фагоцитоз, гуморальный или клеточный иммунитет. Но точное установление клинического диагноза при первичных иммунодефицитах возможно только при проведении иммунодиагностики, включающей иммуногенетическое исследование. Так, поставить диагноз хронической гранулематозной болезни можно только при изучении способности лейкоцитов крови образовывать активные формы кислорода, а Х-сцепленной агаммаглобулинемии - только при определении уровня иммуноглобулинов в крови больного. При первичных иммунодефицитах иммунодиагностика имеет решающее значение в установлении клинического диагноза.
Впервые методология иммунодиагностики заболеваний иммунной системы была разработана Р.В. Петровым с соавт., опубликовавших в 1984 г. методические рекомендации «Оценка иммунного статуса человека». В соответствии с этими методическими рекомендациями все методы иммунодиагностики подразделены на те-
сты I и II уровня (табл. 12.1). Тесты I уровня направлены на идентификацию грубых поломок иммунной системы, т.е. первичных иммунодефицитов. Тесты II уровня направлены на углубленное изучение функционального состояния иммунной системы. Например, определение функционального состояния Т- и В-клеток с помощью реакции бластной трансформации с митогенами и специфическими антигенами; определение их способности синтезировать различные цитокины и др. Другими словами, к тестам II уровня можно отнести любые методы и подходы, направленные на вскрытие механизмов поломок в иммунной системе, ведущие к развитию заболевания.
Таблица 12.1. Тесты для оценки иммунного статуса
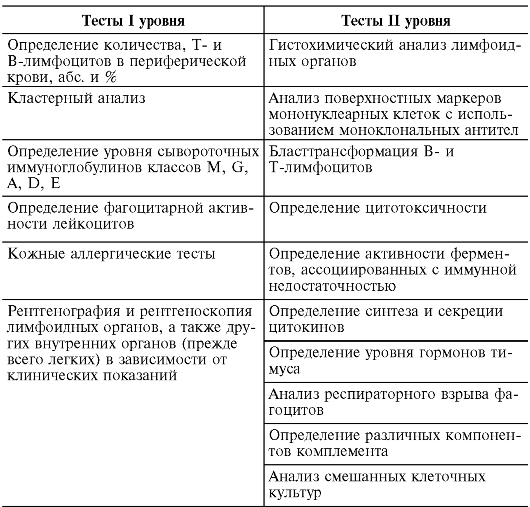 В настоящее время для оценки иммунного статуса рекомендуется следующий минимальный набор тестов (Хаитов Р.М. и
В настоящее время для оценки иммунного статуса рекомендуется следующий минимальный набор тестов (Хаитов Р.М. и
соавт., 2009):
• фагоцитоз: определение поглотительной и бактерицидной (внутриклеточной гибели поглощенных микробов) активности лейкоцитов периферической крови человека; идентификация образования лейкоцитами активных форм кислорода;
• комплемент: определение гемолитической активности сыворотки (плазмы) крови;
• иммуноглобулины: определение в сыворотке (плазме) уровня IgG, IgA, IgM и IgE;
• субпопуляции лимфоцитов: количественное и процентное содержание в периферической крови CD3+, CD4+, CD8+, CD19+ (или CD20+) лимфоцитов, а также при показаниях CD16+- и HLA-DR+ - лимфоцитов.
Минимальным набором тестов должны быть вооружены все лаборатории и центры клинической иммунологии, входящие в систему иммунологической службы Российской Федерации, а также группы клинической иммунологии при клинико-диагностических лабораториях республиканских, краевых и областных клинических больниц. С помощью минимального набора тестов можно осуществить иммунодиагностику основных первичных иммунодефицитов человека. Хотя последние встречаются относительно редко (1:100 000-150 000), в большинстве случаев они протекают достаточно тяжело и требуют безотлагательных лечебных мероприятий. Как правило, минимальный набор тестов недостаточен для выявления причин вторичной иммунной недостаточности. В этом случае требуется использовать более сложный набор тестов II уровня, который для каждого конкретного случая должен быть строго индивидуален.
12.4. Патология иммунной системы
Расстройства иммунной системы бывают двух видов: иммунная недостаточность или иммунодефициты, когда имеется дефект, т.е. отклонение в показателях одного или нескольких механизмов иммунного ответа; излишняя активация иммунных механизмов, ведущая к развитию аллергических или аутоиммунных болезней. Обособленно стоят иммунопролиферативные заболевания.
12.4.1. Иммунодефициты
Иммунодефициты - нарушения иммунного статуса, обусловленные дефектом одного или нескольких механизмов иммунного ответа.
Различают первичные (врожденные) и вторичные (приобретенные) иммунодефициты.
Клиническая картина различных иммунодефицитов сходная. Иммунодефициты не имеют характерных клинических симптомов и сопровождаются инфекционными осложнениями; гематологическими нарушениями; желудочно-кишечными расстройствами; аутоиммунными процессами; опухолями; аллергическими реакциями; врожденными пороками развития.
Диагностику иммунодефицитов проводят на основании анамнеза (частые инфекционные заболевания, опухоли, аутоиммунные процессы, аллергия и др.), клинических симптомов (оппортунистическая инфекция, аллергия, опухоли, состояние лимфоузлов, пороки развития и др.), а также результатов тестов in vitro и in vivo, морфологических исследований (гистологические исследования центральных и периферических органов иммунной системы).
12.4.1.1. Первичные врожденные иммунодефициты
Врожденные иммунодефицитные синдромы и заболевания - довольно редкое явление. Причинами врожденных иммунодефицитов могут быть удвоение хромосом, точечные мутации, дефект ферментов обмена нуклеиновых кислот, генетически обусловленные нарушения мембран, повреждения генома в эмбриональном периоде и др. Первичные иммунодефициты проявляются на ранних этапах постнатального периода и наследуются по аутосомнорецессивному типу. Первичные иммунодефициты могут проявляться недостаточностью фагоцитоза, системы комплемента, гуморального и клеточного иммунитета, комбинированной иммунной недостаточностью.
Недостаточность фагоцитоза обусловлена уменьшением числа фагоцитов или их функциональной неполноценностью. Периодическая нейтропения лежит в основе циклических нарушений гемопоэза. Этот процесс проявляется в уменьшении количества гранулоцитов и изменении количества моноцитов. Несмотря на то что нейтропении не сопутствует недостаточность гуморального или клеточного иммунитета, при ней возникает повышенная опас-
ность инфекционных заболеваний, в особенности тех, которые вызываются высоковирулентными бактериями. Функциональные дефекты фагоцитоза могут быть обусловлены нарушениями любой стадии процесса фагоцитоза.
Недостаточность комплемента встречается редко. Чаще наблюдается дефект синтеза компонентов комплемента, обусловленный наследственной недостаточностью ингибитора эстеразы С1, которая клинически проявляется ангионевротическим отеком. Низкая концентрация ингибитора эстеразы С1 допускает непрерывную частичную активацию С1 с последующим потреблением С4 и С2. При ряде заболеваний, особенно тех, которые протекают с образованием иммунных комплексов, активация комплемента приводит к его избыточному потреблению. При этом наиболее сильно уменьшается количество С1, С4, С2 и С3.
Недостаточность гуморального иммунитета проявляется дисгаммаглобулинемией и агаммаглобулинемией. Агаммаглобулинемия обусловлена нарушением синтеза иммуноглобулинов или их ускоренным распадом. При ней в крови больных отсутствуют иммуноглобулины и нарушен антитоксический и антибактериальный иммунитет, т.е. те виды иммунитета, где ведущая роль принадлежит антителам. Дисгаммаглобулинемия обусловлена селективным дефицитом одного класса или субкласса иммуноглобулинов или их комбинированным дефицитом, при этом общий уровень сывороточных иммуноглобулинов может оставаться в пределах нормы или даже повышаться за счет компенсаторного усиления синтеза иммуноглобулинов других классов. Чаще всего встречаются селективный дефицит IgG при одновременно высоком уровне IgM, дефицит IgG и IgA при высоком уровне IgM, селективный дефицит IgA. Наблюдаются дефицит отдельных субклассов иммуноглобулинов и дефект легких цепей иммуноглобулинов.
Недостаточность клеточного иммунитета обусловлена нарушением функциональной активности Т-клеток. Поскольку Т-лимфоциты участвуют в проявлении функциональной активности В-клеток, чаще встречается комбинированный иммунодефицит (повреждение Т- и В-клеточного звена), чем селективный Т-клеточный иммунодефицит. Описаны и изолированные Т-клеточные иммунодефициты, такие, как алимфоцитоз (синдром Нозелофа), синдром Ди Джорджи (врожденная аплазия тимуса и паращитовидных желез), иммунодефицит при синдроме Дауна, им-
мунодефицит при карликовом росте. У лиц с таким Т-клеточным иммунодефицитом нарушен противовирусный, противогрибковый, противоопухолевый, трансплантационный иммунитет, т.е. те виды иммунитета, где основная роль принадлежит реакциям Т-клеточного звена иммунной системы. Первыми признаками клеточного иммунодефицита являются микоз, рецидивирующие вирусные инфекции, осложнения после вакцинации живыми вакцинами (полиомиелитной, БЦЖ и др.). Лица с недостаточностью клеточного иммунитета умирают в детском, реже в подростковом возрасте от тяжелой рецидивирующей оппортунистической инфекции или злокачественных опухолей.
Комбинированные иммунодефициты развиваются при сочетании нарушений Т- и В-звеньев иммунной системы. Это наиболее тяжело протекающие иммунодефициты. Комбинированные формы встречаются чаще, чем селективные, как правило, они связаны с нарушением центральных органов иммунной системы. В зависимости от тяжести дефекта в разной мере выражена предрасположенность к инфекционным заболеваниям. При значительных расстройствах иммунитета наблюдают частые бактериальные и вирусные инфекции, микотические поражения, что в раннем возрасте приводит к смерти. Иммунный дефект на уровне стволовой клетки обусловлен рядом нарушений: дефектом стволовых клеток, блоком Т- и В-клеточной дифференцировки, первичным Т-клеточным иммунодефицитом, при котором снижение иммунорегуляторной функции приводит к развитию В-клеточного иммунодефицита. Дефект может быть обусловлен эндогенными и экзогенными факторами. Функциональные нарушения могут проявляться даже в том случае, если морфологически клетки больных не отличаются от нормальных. При комбинированных иммунодефицитах ведущая роль принадлежит дефекту Т-клеток.
12.4.1.2. Вторичные иммунодефициты
Вторичные иммунодефициты, в отличие от первичных, развиваются у лиц с нормально функционировавшей от рождения иммунной системой. Они формируются под воздействием окружающей среды на уровне фенотипа и обусловлены нарушением функции иммунной системы в результате различных заболеваний или неблагоприятных воздействий на организм. При вторичных иммунодефицитах могут поражаться Т- и В-система иммунитета, факторы неспецифической резистентности, возможны их сочета-
ния. Вторичные иммунодефициты встречаются значительно чаще, чем первичные. Вторичные иммунодефициты преходящи и поддаются иммунокоррекции, т.е. восстановлению нормальной деятельности иммунной системы.
Вторичные иммунодефициты развиваются после перенесенных инфекций (особенно вирусных) и инвазий (протозойные и гельминтозы); при ожоговой болезни, уремии, опухолях, нарушении обмена веществ и истощении, дисбиозах, тяжелых травмах и обширных хирургических операциях, особенно под общим наркозом, облучении, действии химических веществ; старении, приеме некоторых лекарств.
Иммунодефициты как первичные, так и особенно вторичные широко распространены среди людей. Они являются причиной проявления многих болезней и патологических состояний. Поэтому требуют профилактики и лечения с помощью иммунотропных препаратов.
12.4.2. Аутоиммунные болезни
Аутоиммунные болезни - болезни, ведущая роль в патогенезе которых принадлежит аутосенсибилизации.
Различают аутоиммунные реакции и аутоиммунные заболевания, в основе которых лежит взаимодействие компонентов иммунной системы с собственными здоровыми клетками и тканями. К аутоиммунным заболеваниям иногда относят болезни иммунных комплексов.
Аутоиммунные реакции наблюдаются в норме у здоровых лиц, а также при патологии. В первом случае они протекают непрерывно и их действие сводится к удалению отмирающих, стареющих, больных, модифицированных какими-либо воздействиями клеток. Они являются начальным компонентом развертывания иммунного ответа на различные антигены. Эти реакции полезны для организма и не перерастают в болезнь.
Аутоиммунные болезни встречаются реже. В основе этих патологических состояний лежат аутоиммунные реакции с забарьерными перекрестно реагирующими антигенами, образование «запретных» клонов иммунокомпетентных клеток, реагирующих с собственными нормальными тканями, генетически запрограммированная слабость иммунного ответа на конкретный антиген, недостаточность
супрессии, блокада рецепторов лимфоцитов и другие причины. Они могут быть следствием приема лекарственных препаратов.
Различают органоспецифические, неорганоспецифические и смешанные аутоиммунные заболевания. При органоспецифических болезнях аутоантитела специфичны для антигенов клеток и тканей одного органа. Обычно это забарьерные антигены, врожденная толерантность к которым отсутствует. При органонеспецифических болезнях аутоантитела реагируют со структурным элементом клеток и тканей данного или даже другого организма, имеющего перекрестные антигенные структуры. Смешанные болезни включают оба механизма.
Часто можно обнаружить нормальные аутоантитела, не вызывающие видимых симптомов заболевания. Они встречаются у совершенно здоровых людей, например ревматоидный, антинуклеарные факторы. Бывает трудно доказать, что клиническая картина заболевания представляет собой следствие аутоиммунного процесса. Обнаружение антител к аутоантигенам еще не позволяет сделать вывод о причинно-следственной связи заболевания с аутоиммунными реакциями. Для подтверждения этого необходимо выявить иммунный ответ на аутоантиген, имеющий отношение к заболеванию, идентифицировать его, пассивно перенести заболевание и спровоцировать болезнь соответствующим антигеном в эксперименте на животных. Аутоиммунные заболевания человека представлены в табл. 12.2.
Таблица 12.2. Аутоиммунные заболевания
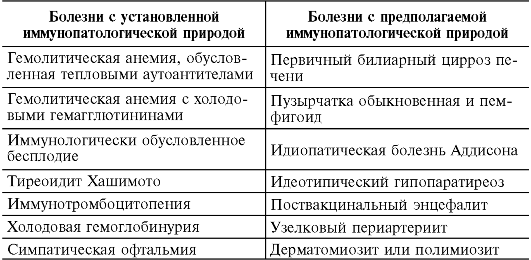 Окончание табл. 12.2
Окончание табл. 12.2
 Известно
много болезней, в патогенезе которых лежат аутоиммунные процессы,
обусловленные рядом причин, в том числе агрессивностью иммунной системы,
направленной на образование аутоантител к антигенам собственных клеток и
тканей. Эти болезни трудно поддаются лечению. Важное место среди
лечебных средств занимают иммунотропные препараты, направленные на
снижение агрессивности иммунной системы.
Известно
много болезней, в патогенезе которых лежат аутоиммунные процессы,
обусловленные рядом причин, в том числе агрессивностью иммунной системы,
направленной на образование аутоантител к антигенам собственных клеток и
тканей. Эти болезни трудно поддаются лечению. Важное место среди
лечебных средств занимают иммунотропные препараты, направленные на
снижение агрессивности иммунной системы.
12.4.3. Аллергические болезни
Организм на первичный контакт с антигеном отвечает образованием антител и сенсибилизированных лимфоцитов. При вторичном контакте антиген вступает в реакцию с антителами и сенсибилизированными лимфоцитами. Эти реакции направлены на устранение антигена, но при определенных условиях могут привести к патологическим последствиям. Заболевание возникает лишь при значительном отклонении иммунореактивности от нормы. При повышенном уровне индивидуальной реактивности на данные антигены развивается аллергия.
С клинической точки зрения важно разделение аллергических реакций на 4 типа. Различные типы аллергических реакций редко встречаются в чистом виде; как правило, они переходят одна в другую или сочетаются в ходе заболевания.
12.4.3.1. Реакции I типа (анафилактические)
Анафилаксия представляет собой иммунную реакцию, для которой необходимы специфические цитофильные антитела и клеткимишени. Она проявляется в виде местной (на коже и слизистых
оболочках) или системной (анафилактический шок) реакции. Местные анафилактические реакции в зависимости от локализации проявляются сыпью, вазомоторным насморком, бронхиальной астмой, кишечными расстройствами. Анафилактическая реакция может протекать в любом органе, поскольку тучные клетки и базофилы встречаются в организме повсеместно, поэтому для каждого вида животных характерны определенные органы, поражаемые чаще других (шок-органы). У человека чаще поражаются артериолы и бронхи. К анафилактическим реакциям человека, которые вызываются IgE, относятся приступы бронхиальной астмы, сенная лихорадка, крапивница, реакции на укусы ос и пчел. Вещества, вызывающие анафилаксию
• Ксеногенные сыворотки:
- антилимфоцитарная сыворотка;
- противостолбнячная сыворотка;
- противодифтерийная сыворотка;
- другие белковые препараты.
• Пыльца растений:
- амброзия.
• Природные яды:
- пчелиный яд;
- яд ос;
- змеиный яд.
• Лекарственные препараты:
- антибиотики (пенициллин);
- салицилаты;
- белковые гормоны;
- вакцины (коревая, гриппозная и др.).
12.4.3.2. Реакции II типа (цитотоксические)
Аллергические реакции II типа опосредованы антителами к поверхностным антигенам клетки или к вторично связанным с клеточной поверхностью антигенам. Ведущая роль принадлежит антителам, способным активировать систему комплемента (IgM, IgG1-3). Кроме комплементзависимой цитотоксичности, сюда можно также отнести антителозависимую клеточно-опосредованную цитотоксичность, не нуждающуюся в комплементе.
Антитела, принимающие участие в цитотоксических реакциях, специфичны для поверхностных АГ клеточной мембраны или вторично связанных с ней АГ. Это наблюдается при некоторых фор-
мах лекарственной аллергии, когда молекулы лекарственного препарата адсорбируются на поверхности клеток крови. Следствием этого могут быть гемолитическая анемия, лейкоцитопения, тромбоцитопения, агранулоцитоз. Наибольшее значение для клинической картины имеют те гуморальные цитотоксические реакции, которые затрагивают эритроциты. Реакция, направленная против эритроцитов другого индивида, называется изоиммунной, а реакция против собственных эритроцитов - аутоиммунной. У каждого человека в сыворотке имеется высокий титр антител к тем антигенам системы АВ0, которые отсутствуют на собственных эритроцитах. При переливании несовместимой крови эти изогемагглютинины вызывают цитотоксическую иммунную реакцию, которая сопровождается гемолизом крови. При повторных беременностях резус-положительным плодом у резус-отрицательных женщин в крови образуются антирезус-IgG, способные проходить через плаценту и, оказывая цитотоксическое действие на эритроциты плода, разрушать их. Это ведет к развитию гемолитической болезни новорожденных. При аутоиммунных гемолитических анемиях образуются аутоантитела к антигенам собственных эритроцитов, которые их разрушают при участии комплемента. Некоторые низкомолекулярные вещества, например определенные лекарственные препараты, обладая аффинностью к мембране эритроцитов, способны стать иммуногенными и вызвать образование антител с развитием гемолитической анемии. Так действует хинин, фенацетин, салицилаты, стрептомицин, пенициллин, цефалоспорины, сульфаниламиды и др. Объектом цитотоксического действия могут стать и другие форменные элементы крови (агранулоцитоз, тромбоцитопения).
12.4.3.3. Реакции III типа (иммунокомплексные)
Аллергические реакции III типа опосредованы иммунными комплексами, которые образуются при преципитации в небольшом избытке антигена. В зависимости от количества и иммуногенности антигена иногда происходит отложение образовавшихся иммунных комплексов в тканях. Биологические свойства таких комплексов обусловлены соотношением антигена и антител. Иммунные агрегаты, образовавшиеся при значительном избытке антигена, имеют малые и средние размеры и могут обладать токсическим свойством. В образовании токсичных иммунных комплексов участвуют IgM, IgG1-3, связывающие комплемент. Благодаря ак-
тивации комплемента в местах отложения иммунных комплексов происходит высвобождение биологически активных медиаторованафилотоксинов (С3а, С3b, С5а), которые, повышая проницаемость сосудов и привлекая полиморфно-ядерные лейкоциты, способствуют развитию воспаления. Фагоцитированные токсичные иммунные комплексы повреждают и разрушают гранулоциты, из которых выделяются протеолитические ферменты, разрушающие ткани организма. Симптомы, вызываемые токсичными иммунными комплексами, обусловлены повреждающим действием токсических факторов эндогенной природы, высвобождающихся при воспалении в результате активации комплемента и распада нейтрофилов.
Иммунные комплексы образуются в кровотоке, когда антиген и антитела одновременно находятся в плазме крови либо в тканях, когда антиген введен в ткань, а антитела находятся в крови и происходит их встречная взаимная диффузия. В первом случае развивается обусловленный иммунными комплексами васкулит, во втором - феномен Артюса. При аллергическом васкулите образование иммунных комплексов происходит при небольшом избытке антигена непосредственно в просвете сосуда. Местом их нахождения может стать любой кровеносный сосуд, и тогда в результате активации комплемента и лейкотаксиса происходят повреждение ткани и даже запустение сосуда. Чаще поражаются сосуды нижних конечностей и капилляры почечных клубочков. Типичный пример аллергического васкулита - гломерулонефрит. Решающее значение при данном виде патологии имеют сам факт персистенции антигена и его концентрация. Некоторые микробы (стрептококки группы А) и продукты их распада способствуют развитию хронического гломерулонефрита. Особый случай васкулита, обусловленного иммунными комплексами, - сывороточная болезнь, которая развивается через 8-10 дней после однократного введения гетерологичной сыворотки и сопровождается повышением температуры, увеличением селезенки и лимфатических узлов, лейкоцитозом и снижением активности комплемента. Симптомы сывороточной болезни возникают с появлением в кровотоке антител и сохраняются до тех пор, пока в кровотоке находится свободный антиген. Симптомы исчезают после иммунной элиминации антигена. При феномене Артюса иммунная реакция первично направлена только на чужеродный антиген, но высвобождение лизосомальных
ферментов в местах отложения иммунных комплексов приводит к вторичному повреждению тканей. Классическая реакция Артюса у человека наблюдается при воздействии некоторых ингаляционных аллергенов, особенно при регулярных повторных воздействиях. К подобным заболеваниям относится аллергический альвеолит, при котором в сыворотке больных часто обнаруживаются преципитирующие антитела к промышленным аллергенам («легкие фермера», «легкие птичника»).
12.4.3.4. Реакции IVтипа (опосредованные Т-лимфоцитами)
Некоторые антигены преимущественно стимулируют Т-лимфоциты и вызывают благодаря этому формирование клеточного иммунитета. К ним относятся антигены внутриклеточных паразитов, трансплантатов, природные и синтетические гаптены (лекарственные препараты, пищевые красители и др.). ГЗТ может вызываться практически всеми известными антигенами, наиболее ярко она проявляется на низкоиммуногенные антигены (полисахариды, низкомолекулярные пептиды). Реакцию вызывают малые дозы аллергенов, особенно при внутрикожном введении, что сопровождается сенсибилизацией Т-хелперов. Сенсибилизированные лимфоциты выделяют медиаторы, в том числе интерлейкин-2, которые активируют макрофаги и вовлекают их в процесс разрушения антигена, вызвавшего сенсибилизацию. Цитотоксичность проявляют и сами Т-лимфоциты. О роли лимфоцитов в возникновении ГЗТ свидетельствует возможность адаптивной передачи аллергии от сенсибилизированного организма несенсибилизированному с помощью введения лимфоцитов, а также подавления этой реакции антилимфоцитарной сывороткой.
Морфологическая картина при ГЗТ носит воспалительный характер, обусловленный реакцией лимфоцитов и макрофагов на образующийся комплекс антигена с сенсибилизированными лимфоцитами и проявляется через 24-48 ч. Ее типичным примером служит туберкулиновая реакция. Внутрикожное введение туберкулина сенсибилизированному индивиду вызывает покраснение и отек на месте инъекции, достигающие максимума через 24-48 ч с момента введения аллергена. Образуется плотная гиперемированная папула с некрозом в центре. Некротизированная ткань иногда отторгается, оставляя после себя изъязвление, которое медленно
заживает. Гистологически обнаруживают скопление макрофагов и лимфоцитов.
ГЗТ может вызвать введение лекарственных препаратов или контакт с некоторыми низкомолекулярными веществами. Низкомолекулярные соединения являются гаптенами, присоединившись к носителям, которыми являются собственные белки организма, они индуцируют развитие ГЗТ. Типичный пример опосредованной клетками гиперчувствительности кожи представляет контактная экзема. При встрече сенсибилизированного индивида с гаптеном происходит локальная активация Т-лимфоцитов и макрофагов. Высвобождающиеся при этом лимфокины запускают патологический процесс, который клинически проявляется экземой. Наиболее часто контактную аллергию вызывают синтетические моющие средства, соединения хрома, никеля, ртути, парафенилендиамин, ДНХБ, многие консерванты и медикаменты.
12.5. Иммунокоррекция
Иммунокоррекция - раздел клинической иммунологии, изучающий способы и методы профилактики и лечения болезней или состояний (иммунодефицитов), связанных с нарушением функции иммунной системы.
Препараты, влияющие на иммунный статус и применяемые для иммунокоррекции, называют иммуномодуляторами. К настоящему времени известны сотни иммуномодуляторов, применяемых в медицине (подробнее см. главу 14).
Цель оптимальной иммунокоррекции - направленное воздействие на способность организма к иммунному ответу, т.е. на активацию или подавление активности иммунной системы в зависимости от показаний. Например, для создания иммунитета к возбудителям инфекционных болезней иммунную систему активируют с помощью вакцин, а пассивный иммунитет создают введением сывороток или иммуноглобулинов. При аллергических состояниях и некоторых иммунопатологических процессах необходимо подавить иммунную систему, поэтому применяют иммунодепрессанты. Они же используются при трансплантации органов и тканей. Особое значение приобретает антигенспецифическая стимуляция или супрессия. Поскольку существуют определенные
ограничения по клиническому применению, основным подходом к лечению остается неспецифическая коррекция.
Общим принципом иммунокоррекции является ее проведение на фоне полноценного питания, приема витаминов, микро- и макроэлементов. Принципы иммунокоррекции:
• иммунотерапию применять только после определения состояния иммунной системы, т.е. иммунного статуса и выявления недостаточного функционирования звена иммунитета;
• иммунотерапию обязательно назначать при нарушениях иммунного статуса, сопровождающихся клиническими симптомами;
• в процессе иммунотерапии необходимо следить за состоянием иммунного статуса в динамике;
• использовать иммуномодуляторы для профилактики тех воздействий, которые могут вызвать иммунодефициты (экологические, социальные и другие факторы).
Задания для самоподготовки (самоконтроля)
A. Укажите формы иммунитета, в которых принимает участие ком-
племент:
1. Иммунитет слизистых оболочек.
2. Антитоксический.
3. Антибактериальный гуморальный.
4. Гуморальный противовирусный.
Б. Укажите формы иммунитета, в которых принимают участие Т-киллеры:
1. Трансплантационный.
2. Противоопухолевый.
3. Противовирусный.
4. Антибактериальный.
B. Укажите формы инфекций, сопровождающихся развитием ГЗТ:
1. Глистная инвазия.
2. Грибковая.
3. Вирусная.
4. Паразитарная.
5. Бактериальная.
Г. Отметьте компоненты противоглистного иммунитета:
1. IgE.
2. Т-киллер.
3. Комплемент.
4. Эозинофилы.
Д. Пациент страдает рецидивирующими вирусными инфекциями и микозом, который не поддается лечению. Врач предположил наличие у него иммунодефицита. Назовите пораженное звено иммунного ответа.