Медицинская микробиология, вирусология и иммунология: том 1 : учебник / Под ред. В.В. Зверева, М.Н. Бойченко, 2010.
|
|
|
|
ГЛАВА 11 ОСНОВНЫЕ ФОРМЫ ИММУННОГО РЕАГИРОВАНИЯ
Иммунная система осуществляет свою биологическую функцию с помощью сложного комплекса взаимосвязанных реакций. В них задействованы все ее структурные и функциональные элементы. Конкретные проявления иммунного реагирования можно подразделить на отдельные формы: антителообразование, иммунный фагоцитоз, клеточно-опосредованный киллинг, реакции гиперчувствительности, формирование иммунологической памяти или толерантности.
Все элементы иммунной системы имеют единый принцип управления и активируются практически одновременно, однако в зависимости от характера антигенного воздействия одна или несколько форм доминируют. Например, при токсинемической инфекции преимущественно активируется продукция антител, способных нейтрализовать молекулы токсина, при туберкулезной инфекции основную функциональную нагрузку выполняют факторы клеточного иммунитета.
11.1. Антитела и антителообразование
11.1.1. Природа антител
Одной из филогенетически наиболее древних форм иммунной защиты является биосинтез антител - белков, специфически реагирующих с антигенами. Антитела относятся преимущественно к γ-глобулиновой фракции белков плазмы крови, на долю которых приходится 15-25% ее белкового содержания, что составляет примерно 10-20 г/л. Поэтому антитела получили название иммуноглобулинов, и их обозначают символом Ig. Следовательно антитела - это γ-глобулины плазмы крови, способные специфически связываться с антигеном и участвовать во многих иммунных реакциях.
Антитела синтезируются В-лимфоцитами и их потомками - плазматическими клетками и в циркулирующей форме, и в виде рецепторных молекул на иммунокомпетентных клетках. Циркулирующие антитела подразделяются на сывороточные и секреторные. К антителам могут быть также отнесены белки Бенс-Джонса, которые являются фрагментами молекулы Ig (его легкая цепь) и синтезируются в избытке при миеломной болезни.
Строение и функцию антител изучали многие видные ученые: П. Эрлих (1885) предложил первую теорию гуморального иммунитета, Э. Беринг и С. Китазато (1887) получили первые антитоксические сыворотки к дифтерийному и столбнячному токсинам, А. Безредка (1923) разработал метод безопасного введения пациентам лечебных иммунных сывороток. Большая заслуга в расшифровке молекулярного строения Ig принадлежит Д. Эдельману и Р. Портеру (1959), а разгадка многообразия антител - Ф. Бернету
(1953) и С. Тонегаве (1983).
11.1.2. Молекулярное строение антител
Иммуноглобулины - это белки сыворотки крови. Они секретируются плазматическими клетками в ответ на антиген. Молекулы Ig имеют универсальное строение (рис. 11.1). Они состоят из 2 пар полипептидных цепей: двух тяжелых (550-660 аминокислотных остатков, молекулярная масса - 50 кД) и двух легких (220 аминокислотных остатков, молекулярная масса - 20-25 кД). Обозначают их как H- (от англ. heavy - тяжелый) и L- (от англ. light - легкий) цепи. Тяжелые и легкие цепи связаны между собой попарно дисульфидными связями (-S-S-). Между тяжелыми цепями также есть дисульфидная связь - это так называемый шарнирный участок. Такой тип межпептидного соединения позволяет молекуле Ig легко менять свою конформацию в зависимости от окружающих условий и состояния. Область шарнирного участка ответственна за взаимодействие с первым компонентом комплемента (С1) и его активацию по классическому пути.
Различают структурные варианты легких и тяжелых полипептидных цепей молекулы Ig. Легкие цепи бывают 2 типов: κ и λ (каппа и лямбда). Тяжелых цепей известно 5 типов: α, γ, μ, ε и δ (альфа, гамма, мю, эпсилон и дельта). Среди многообразия цепей α-типа выделяют α1- и а2-подтипы, μ-цепей - μ1 и μ2, γ-цепей - γ1-, γ2-, γ3- и γ4-подтипы.
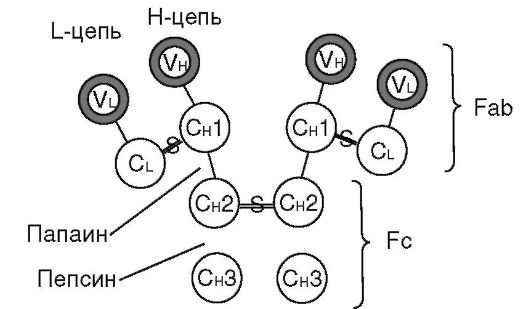 Рис. 11.1. Схема
строения молекулы иммуноглобулина класса G: V - вариабельный домен; C -
константный домен; S - дисульфидная связь шарнирного участка
Рис. 11.1. Схема
строения молекулы иммуноглобулина класса G: V - вариабельный домен; C -
константный домен; S - дисульфидная связь шарнирного участка
Вторичная структура полипептидных цепей молекулы Ig имеет доменное строение - ее отдельные участки свернуты в глобулы (домены), стабилизированные внутренней дисульфидной связью. Таких доменов в составе тяжелой цепи Ig бывает 4-5, в легкой - 2. Каждый домен состоит примерно из 110 аминокислотных остатков.
Домены различаются по постоянству аминокислотного состава. Выделяют С-домены (от англ. constant - постоянный) с относительно постоянной структурой и V-домены (от англ. variable - изменчивый) с переменной структурой. В составе легкой цепи есть по одному V- и С-домену, а в тяжелой - один V- и 3-4 С-домена. Примечательно, что не весь вариабельный домен изменчив по своему аминокислотному составу, а лишь его незначительная часть - гипервариабельная область, на долю которой приходится около 25%.
Вариабельные домены легкой и тяжелой цепей совместно образуют участок, который специфически связывается с антигеном, - антигенсвязывающий центр, или паратоп. Гипервариабельные области тяжелой и легкой цепей определяют индивидуальные особенности строения антигенсвязывающего центра для каждого клона Ig и многообразие их специфичностей.
Обработка ферментами молекулы Ig приводит к ее гидролизу на определенные фрагменты. Так, папаин разрывает молекулу выше шарнирного участка и ведет к образованию трех фрагментов (см. рис. 11.1). Два из них способны специфически связываться с антигеном. Они состоят из цельной легкой цепи и участка тяжелой (V-
и C-домен), и в их структуру входят антигенсвязывающие участки. Эти фрагменты получили название Fab (от англ. - фрагмент, связывающийся с антигеном). Третий фрагмент, способный образовывать кристаллы, получил название Fc (от англ. - фрагмент кристаллизующийся). Он ответствен за связывание с рецепторами на мембране клеток макроорганизма (Fc-рецепторы) и некоторыми микробными суперантигенами (например, белком А стафилококка). Пепсин расщепляет молекулу Ig ниже шарнирного участка и ведет к образованию 2 фрагментов: Fc и двух сочлененных Fab, или F(ab)2.
В структуре молекул Ig обнаруживают дополнительные полипептидные цепи. Так, полимерные молекулы IgM, IgA содержат J-пептид (от англ. join - соединяю), который объединяет отдельные мономеры в единое макромолекулярное образование (см. раздел 11.1.3). Молекулы секреторных Ig обладают S-пептидом (от англ. secret - секрет). Это так называемый секреторный компонент. Его молекулярная масса составляет 71 кД, он является β-глобулином и предохраняет молекулу Ig в секрете слизистых оболочек от ферментативного расщепления. Рецепторный Ig, локализующийся на цитоплазматической мембране антителопродуцирующих клеток, имеет дополнительный гидрофобный трансмембранный М-пептид (от англ. membrane - мембрана). Он прочно удерживает молекулу Ig в липидном бислое цитоплазматической мембраны и проводит рецепторный сигнал через цитоплазматическую мембрану внутрь клетки. J- и M-пептиды присоединяются к молекуле Ig в процессе ее биосинтеза. S-пептид является продуктом эпителиальной клетки - он присоединяется к J-пептиду полимерной молекулы Ig при ее транслокации через эпителиальную клетку.
11.1.3. Структурно-функциональные особенности иммуноглобулинов различных классов
В зависимости от особенностей молекулярного строения тяжелой цепи, а следовательно, наличия изотипических, или групповых, антигенных детерминант различают 5 классов или изотипов Ig (рис. 11.2). Молекулы, содержащие тяжелую цепь α-типа, относят к изотипу, или классу A (сокращенно IgA), δ-типа - IgD, ε-типа - IgE, γ-типа - IgG и μ-типа - IgM. Различают также подклассы Ig.
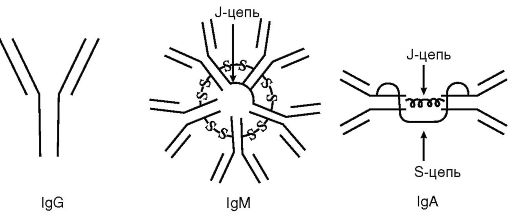 Рис. 11.2. Схема строения иммуноглобулинов различных классов (пояснение в тексте)
Рис. 11.2. Схема строения иммуноглобулинов различных классов (пояснение в тексте)
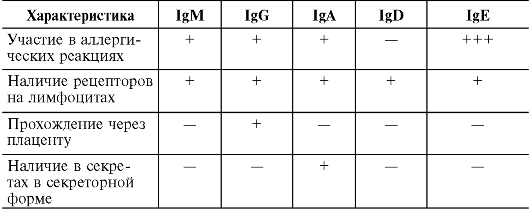
Для каждого изотипа Ig характерны свои особенности. В частности, Ig D, E и G имеют мономерное строение, IgM практически всегда является пентамером, а молекула IgA может быть моно-, ди- и тримером. Наиболее характерные черты различных изотипов Ig приведены в табл. 11.1.
Таблица 11.1. Основные характеристики иммуноглобулинов человека
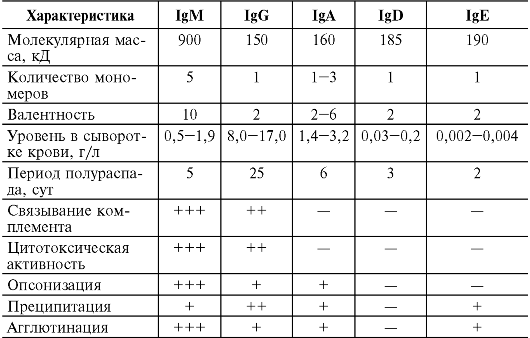 Окончание табл. 11.1
Окончание табл. 11.1
 Иммуноглобулин класса G составляет
основную массу Ig сыворотки крови, на его долю приходится 70-80% всех
циркулирующих Ig, при этом 50% содержится в тканевой жидкости. Среднее
содержание IgG в сыворотке крови здорового взрослого человека - 12 г/л,
что достигается к 7-10-летнему возрасту. Период полураспада IgG 21 день.
Иммуноглобулин класса G составляет
основную массу Ig сыворотки крови, на его долю приходится 70-80% всех
циркулирующих Ig, при этом 50% содержится в тканевой жидкости. Среднее
содержание IgG в сыворотке крови здорового взрослого человека - 12 г/л,
что достигается к 7-10-летнему возрасту. Период полураспада IgG 21 день.
IgG - мономер, имеет 2 антигенсвязывающих центра, может связать 2 молекулы антигена подряд. Молекулярная масса около 160 кД, константа седиментации 7S. Синтезируется зрелыми В-лимфоцитами (Βγ) и плазматическими клетками. Хорошо определяется в сыворотке крови на пике первичного и при вторичном иммунном ответе. Обладает высокой аффинностью (см. раздел 11.1.5).
Различают подтипы G1-G4. IgG1 и G3 связывают комплемент, причем G3 активнее. IgG4 подобно IgE обладает цитофильностью (тропностью, или сродством, к тучным клеткам и базофилам) и участвует в развитии аллергической реакции I типа (см. раздел 11.4).
Легко проходит через плацентарный барьер и обеспечивает гуморальный иммунитет новорожденного в первые 3-4 мес после рождения, в том числе обнаруживается в молоке. IgG обеспечивает нейтрализацию и маркирование антигена, осуществляет запуск комплементопосредованного цитолиза и АЗКЦТ.
Иммуноглобулин класса M - наиболее крупная молекула из всех Ig. Это пентамер, который имеет 10 антигенсвязывающих центров. Его молекулярная масса около 900 кД, константа седи-
ментации 19S. Различают подтипы М1 и М2. Тяжелые цепи молекулы IgM, в отличие от других изотипов, построены из 5 доменов. Являясь полимерной молекулой, содержит J-цепь. Период полураспада 5 дней.
На его долю приходится 5-10% всех циркулирующих Ig. Среднее содержание IgM в сыворотке крови здорового взрослого человека около 1 г/л. Этого уровня человек достигает уже к 2-4-летнему возрасту. IgM филогенетически наиболее древний иммуноглобулин. Образуется в начале первичного иммунного ответа.
Обладает высокой авидностью, наиболее эффективный активатор комплемента по классическому пути. Большая часть нормальных антител и изоагглютининов относится к IgM. Не проходит через плаценту. Обнаружение высоких титров специфических антител изотипа M в сыворотке крови новорожденного указывает на бывшую внутриутробную инфекцию или дефект плаценты. IgM обеспечивает нейтрализацию и маркирование антигена, осуществляет запуск комплементопосредованного цитолиза и АЗКЦТ. Является маркером острого инфекционного процесса.
Иммуноглобулин класса A существует в сывороточной и секреторной формах. Около 60% всех IgA содержится в секретах слизистых оболочек.
Сывороточный IgA. На его долю приходится около 10-15% всех циркулирующих Ig. В сыворотке крови здорового взрослого человека содержится около 2,5 г/л IgA, максимум достигается к 10- летнему возрасту. Период полураспада 6 дней.
IgA - мономер, имеет 2 антигенсвязывающих центра, молекулярную массу около 170 кД и константу седиментации 7S. Различают подтипы A1 и A2. Синтезируется зрелыми иммунными В-лимфоцитами (Βα) и плазматическими клетками. Хорошо определяется в сыворотке крови на пике первичного и при вторичном иммунном ответе. Обладает высокой аффинностью. Не связывает комплемент. Не проходит через плацентарный барьер. IgA обеспечивает нейтрализацию и маркирование антигена, осуществляет запуск АЗКЦТ.
Секреторный IgA (sIgA) существует в полимерной форме в виде диили тримера (4- или 6-валентный), несет 4 или 6 паратопов и содержит J- и S-пептиды. Молекулярная масса 350 кД и выше, константа седиментации 13S и выше.
Синтезируется В1-лимфоцитами, плазматическими клетками и, возможно, В1-лимфоцитами в пределах слизистых оболочек и вы-
деляется в их секреты. Объем продукции может достигать 5 г в сутки. Пул sIgA считается самым многочисленным в организме - его количество превышает суммарное содержание IgM и IgG. В сыворотке крови sIgA не обнаруживается.
Формирование четвертичной структуры молекулы sIgA происходит при ее транслокации через эпителиальную клетку. На базальной и латеральной поверхности эпителиальная клетка несет рецептор к J-цепи полимерной молекулы Ig (JR). Присоединяясь к рецептору, IgA эндоцитируется клеткой в виде везикулы и переносится к апикальной поверхности эпителиоцита, где JR подвергается ферментативному расщеплению. В результате IgA высвобождается в слизистый секрет просвета органа уже в секреторной форме, так как оставшийся прикрепленным к молекуле Ig фрагмент JR становится S-цепью.
Секреторная форма IgA - основной фактор специфического гуморального местного иммунитета слизистых оболочек желудочнокишечного и респираторного тракта, мочеполовой системы. Благодаря S-цепи он устойчив к действию протеаз. sIgA не активирует комплемент, но эффективно связывается с антигенами, нейтрализует их и препятствует адгезии микробов на эпителиальных клетках.
Иммуноглобулин класса E называют также реагином. Содержание в сыворотке крови крайне невысоко - примерно 0,00025 г/л. Молекулярная масса около 190 кД, константа седиментации примерно 8S, мономер. На его долю приходится около 0,002% всех циркулирующих Ig. Этот уровень достигается к 10-15 годам жизни.
Синтезируется зрелыми В-лимфоцитами (Βε) и плазматическими клетками преимущественно в лимфоидной ткани бронхолегочного дерева и желудочно-кишечного тракта. Не связывает комплемент. Не проходит через плацентарный барьер. Обладает выраженной цитофильностью - тропностью к тучным клеткам и базофилам. Участвует в развитии гиперчувствительности немедленного типа - реакция I типа (см. раздел 11.4).
Иммуноглобулин класса D практически полностью содержится в сыворотке крови в концентрации около 0,03 г/л (около 0,2% общего количества циркулирующих Ig). IgD имеет молекулярную массу 160 кД и константу седиментации 7S, мономер. Не связывает комплемент. Не проходит через плацентарный барьер. Экспрессируется на предшественниках В-лимфоцитов.
Рецепторные иммуноглобулины, или мембранные, локализуются на цитоплазматической мембране В-лимфоцитов и выполняют
функции их антигенспецифических рецепторов. Имеют те же изотип и специфичность, что и синтезируемые в межклеточную среду антитела. Содержат особый дополнительный M-пептид, благодаря которому молекула рецепторного Ig фиксируется в цитоплазматической мембране иммунокомпетентной клетки.
Нормальные антитела, или естественные, - совокупность Ig сыворотки крови человека различной специфичности, формирующих их базальный уровень. К ним относят изогемагглютинины - антитела к эритроцитарным антигенам групп крови (например, система АВ0), антигенам бактерий кишечной группы, кокков и некоторых вирусов. Эти антитела постоянно образуются в организме без видимой антигенной стимуляции. Отражают готовность макроорганизма к иммунному реагированию, а также свидетельствуют об отдаленном контакте с антигеном.
Моноклональные антитела. Каждый В-лимфоцит и его потомки, образовавшиеся в результате клеточного деления (т.е. клон), способны синтезировать антитела с паратопом строго определенной специфичности. Такие антитела получили название моноклональных. В естественных условиях макроорганизма получить моноклональные антитела практически невозможно, так как на одну и ту же антигенную детерминанту одновременно реагируют до 100 различных клонов В-лимфоцитов, незначительно различающихся антигенной специфичностью. Поэтому в результате иммунизации даже монодетерминантным антигеном мы всегда получаем поликлональные антитела.
Принципиально получение моноклональных антител выполнимо, если провести предварительную селекцию антителопродуцирующих клеток и их клонирование, т.е. получение необходимых клонов. Однако задача осложняется тем, что число генераций В-лимфоцитов, как и других эукариотических клеток, ограничено. Тем не менее проблема была успешно решена Д. Келлером и Ц. Мильштайном (1975). Исследователи получили гибриды иммунных В-лимфоцитов и миеломных (опухолевых) клеток, которые обладали свойствами антителопродуцента и «бессмертием» раково-трансформированной клетки. Такой вид клеток получил название гибридом. В ходе дальнейшей селекции были отобраны клоны с наивысшей продуктивностью и аффинностью специфических антител. Гибридомные моноклональные антитела нашли широкое применение при создании диагностических и лечебных иммунобиологических препаратов.
Полные и неполные антитела. Такое подразделение основано на способности образовывать в реакции агглютинации или преципитации (in vitro) хорошо различимый глазом результат. Таким свойством обладают полные антитела. К ним относятся IgМ, а также некоторые IgA и G.
Неполные антитела лишены такой способности, несмотря на то, что они специфически связываются с антигеном - их еще называют неагглютинирующими, непреципитирующими или блокирующими антителами (см. главу 13).
11.1.4. Антигенность антител
Иммуноглобулин, как и всякий белок, обладает антигенностью и выраженной иммуногенностью. В молекуле Ig различают 4 типа атигенных детерминант: видовые, изотипические, аллотипические и идиотипические. Видовые антигенные детерминанты характерны для Ig всех особей данного вида (например, кролика, собаки, человека). Они определяются строением легкой и тяжелой цепей. По этим детерминантам можно идентифицировать видовую принадлежность антител.
Изотипические антигенные детерминанты являются групповыми. Они локализуются в тяжелой цепи и служат для дифференцировки Ig на 5 изотипов (классов) и множество подклассов (см. раздел 11.1.3).
Аллотипические антигенные детерминанты являются индивидуальными, т.е. присущими конкретному организму. Они располагаются в легкой и тяжелой полипептидных цепях. На основании строения аллотипических детерминант можно различать особи внутри одного вида.
Идиотипические антигенные детерминанты отражают особенности строения антигенсвязывающего центра самой молекулы Ig. Они образованы V-доменами легкой и тяжелой цепей молекулы Ig. Обнаружение идиотипических антигенных детерминант послужило основанием для создания теории идиотип-антиидиотипической регуляции биосинтеза антител.
11.1.5. Механизм взаимодействия антитела с антигеном
В процессе взаимодействия с антигеном принимает участие антигенсвязывающий центр молекулы Ig, или паратоп, который способен связываться со строго определенной антигенной детерми-
нантой. Эта связь осуществляется за счет слабых взаимодействий (ван-дер-ваальсовы силы, водородные связи, злектростатические взаимодействия) и отличается неустойчивостью - образовавшийся иммунный комплекс (ИК) может легко диссоциировать: АГ + АТ ↔ ИК.
Продолжительность существования иммунного комплекса определяется целым рядом факторов. При этом важное значение имеют особенности антитела, антигена и условия, в которых происходит их взаимодействие. К особенностям антитела следует отнести его аффинность и авидность.
Аффинность - сила специфического взаимодействия антитела с антигеном (или энергия их связи). Аффинность определяется степенью стерического (пространственного) соответствия эпитопа и паратопа. Чем больше образуется связей между эпитопом и паратопом, тем выше будут устойчивость и продолжительность жизни образовавшегося иммунного комплекса. Иммунный комплекс, образованный низкоаффинными антителами, чрезвычайно неустойчив и имеет малую продолжительность существования.
Установлено, что в условиях макроорганизма с одной и той же антигенной детерминантой способны одновременно прореагировать и образовать иммунный комплекс около 100 различных клонов антител. Все они будут отличаться структурой антигенсвязывающего центра, специфичностью и аффинностью. Аффинность антител существенно меняется в процессе иммунного ответа в связи с селекцией наиболее специфичных клонов В-лимфоцитов. Наименее аффинными считаются нормальные антитела. По расчетам общее количество различных антигенспецифических клонов В-лимфоцитов достигает 106-107.
Другой характеристикой Ig является авидность. Под этим термином понимают прочность связывания антитела и антигена. Эта характеристика определяется аффинностью Ig и числом антигенсвязывающих центров. Наибольшей авидностью обладают антитела класса М, так как они имеют 10 антигенсвязывающих центров.
Эффективность взаимодействия антитела с антигеном существенно зависит от условий, в которых происходит реакция, прежде всего от pH среды, осмотической плотности, солевого состава и температура среды. Оптимальными для реакции антиген-антитело являются физиологические условия внутренней среды макроорганизма: близкая к нейтральной реакция среды, присутствие фос-
фат-, карбонат-, хлорид- и ацетат-ионов, осмолярность физиологического раствора (концентрация раствора 0,15 М), а также температура 36-37 °С.
11.1.6. Свойства антител
Благодаря уникальной способности специфически связываться с антигенными детерминантами антитела выполняют в организме ряд важнейших функций.
К прямым эффектам антител относится нейтрализация - связывание и блокирование паратопом иммуноглобулина активного центра биологически активной молекулы, например токсина, рецептора, лекарственного препарата и пр. Эффект имеет обратимый характер в случае распада иммунного комплекса. На этом принципе основан механизм действия антитоксических, противовирусных и многих других лечебных иммунных сывороток.
Другим прямым эффектом является энзиматическое действие антител. Благодаря реликтовой протеазной или нуклеазной активности (см. раздел 11.1.3) иммуноглобулины способны вызывать деструкцию молекулы антигена (например, расщепление отдельных пептидов или ДНК). Запуск системы комплемента по классическому пути также представляет собой результат ферментолиза.
В большинстве случаев взаимодействие антител с антигеном в организме не влечет за собой его структурную или функциональную модификацию. Прочно связываясь с эпитопом, антитела маркируют молекулу антигена - обозначают его как мишень для других факторов иммунитета (фагоцитоз, лизис).
К непрямым эффектам относятся:
• индукция комплементопосредованного лизиса чужеродных клеток (см. раздел 9.2.3.3), наилучшими свойствами обладает IgM (IgM > IgG3 > IgG1);
• запуск антителозависимой клеточно-опосредованной цитотоксичности АЗКЦТ (см. раздел 11.3.);
• индукция гиперчувствительности немедленного, или I, типа (см. раздел 11.4);
• опосредование иммунного фагоцитоза (см. раздел 11.2).
Клеточно-опосредованные эффекты иммуноглобулинов реализуются благодаря экспрессии на мембране иммунокомпетентных клеток рецепторов к Fc-фрагменту молекулы иммуноглобулина (FcR). Эти рецепторы являются трансмембранными белковыми
молекулами и различаются по специфичности к определенному изотипу тяжелой цепи молекулы Ig. Различают также высокоаффинные и низкоаффинные FcR. Первые могут взаимодействовать с интактной молекулой иммуноглобулина. В некоторых случаях она используется как ко-рецепторный фактор (базофилы, тучные клетки). Низкоаффинные FcR связываются уже с иммунным комплексом, их называют непрямыми иммунорецепторами.
Помимо эффекторных свойств, антитела являются активными регуляторами иммунореактивности. Так, Ig являются антигенспецифическими рецепторами В-лимфоцитов.
Специфическое связывание эпитопов специфическими антителами может блокировать развитие как гуморального, так и клеточного иммунного ответа. Этот эффект используется в клинической практике, например, для профилактики гемолитической болезни новорожденных в результате резус-конфликта. Антитела, специфичные к идиотипическим антигенным детерминантам Ig, могут управлять силой антительного иммунного реагирования.
11.1.7. Генетика иммуноглобулинов
Для структуры молекул Ig характерно уникальное генетическое кодирование. Методами молекулярной генетики было доказано, что структура молекулы Ig контролируется большим числом генов, которые имеют фрагментарную организацию, образуют три группы, располагаются в трех различных хромосомах и наследуются независимо.
Первая группа генов кодирует первичную структуру легкой цепи λ-типа, вторая - легкой цепи κ-типа, а третья - всех типов тяжелых цепей (α, δ, ε, γ и μ). Гены, относящиеся к каждой группе, находятся на соответствующей хромосоме в непосредственной близости друг от друга, располагаются последовательно (рис. 11.3) и разделены интронами.
Участок ДНК, кодирующий строение легкой цепи λ-типа, содержит 2 V-сегмента (контролируют структуру V-доменов) и 4 C-сегмента (контролируют структуру C-доменов). Между C- и V-сегментами располагается J-сегмент (от англ. join - соединяющий). Легкая цепь κ-типа кодируется несколькими сотнями V-сегментов ДНК, 4 J-сегментами и одним C-сегментом. Группа генов, контролирующая структуру тяжелых цепей, имеет еще более сложное строение. Наряду с V-, C- и J- сегментами ДНК
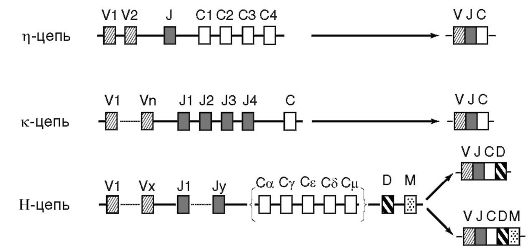 Рис. 11.3. Схема строения генов иммуноглобулинов (пояснение в тексте)
Рис. 11.3. Схема строения генов иммуноглобулинов (пояснение в тексте)
в их состав входят 20 D-сегментов (от англ. divercity - разнообразие). Кроме того, имеется M-сегмент, который кодирует биосинтез мембраноассоциированного участка молекулы рецепторного Ig.
Созревание пре-В-лимфоцитов сопровождается перестройками в их генетическом аппарате. Происходят произвольное сближение отдельных фрагментов ДНК и сборка в пределах соответствующих хромосом единых функциональных генов. Этот процесс называется сплайсинг (от англ. splicing - сращивание, состыковывание). Пропущенные участки ДНК исключаются из дальнейшего считывания. С функциональных генов в дальнейшем транскрибируется про-мРНК, а затем окончательная мРНК, кодирующая первичную аминокислотную последовательность L- и H-цепей молекулы Ig. Параллельно со сплайсингом в отдельных участках V-сегментов генов иммуноглобулинов могут происходить точечные мутации и нематричная достройка олигонуклеотидов. Эти участки ДНК получили название гипермутабельных областей.
Сплайсинг и мутационный процесс в генах Ig носят случайный характер. Они происходят в каждом лимфоците независимо друг от друга и уникальны, что в бесконечное количество раз повышает разнообразие V-доменов и в конечном счете структуры паратопов и идиотипических антигенных детерминант молекулы Ig. Поэтому в организме всегда существуют или в любой момент могут появиться В-лимфоциты, специфичные практически к любому антигену. Этот тезис составляет основу молекулярно-генетической теории
происхождения многообразия специфичностей антител, разработанной С. Тонегавой (1983).
В процессе первичного иммунного ответа размножение В-лимфоцитов также сопровождается рекомбинационными перестройками в пределах иммуноглобулиновых генов, но уже в пределах С-сегментов. Это проявляется последовательной сменой класса Ig: на ранних этапах дифференцировки В-лимфоциты синтезируют Ig классов М и D, на более поздних - классов G, A или E (редко).
11.1.8. Динамика антителопродукции
Иммунная система реагирует на появление во внутренней среде макроорганизма антигена усилением биосинтеза специфических антител. Это достигается размножением клонов антигенспецифических клеток-антителопродуцентов. При этом антиген выступает в роли как пускового, так и селектирующего фактора: преимущественно активируются клоны с наивысшей специфичностью, т.е. наибольшей аффинностью рецепторных молекул Ig. Параллельно с размножением идет процесс дифференцировки В-лимфоцитов. Наблюдаются перестройка в геноме клеток и переключение их биосинтеза с крупной высокоавидной молекулы IgM на более легкие и экономичные высокоаффинные IgG или IgA.
Антителопродукция в ответ на антигенный стимул имеет характерную динамику. Ее можно проследить на примере сывороточных Ig (рис. 11.4). Выделяют латентную (индуктивную), логарифмическую, стационарную фазы и фазу снижения. В латентную фазу антителопродукция практически не изменяется и остается на базальном уровне. В этот период происходят переработка и представление антигена иммунокомпетентным клеткам и запуск пролиферации антигенспецифических клонов клетокантителопродуцентов. Ввиду того что клетки делятся дихотомически (т.е. надвое), прирост их количества происходит в логарифмической зависимости и поэтому после первых циклов деления оно изменяется незначительно. Параллельно происходят дифференцировка пре-В-лимфоцитов в зрелые формы и плазматические клетки и переключение синтезируемых изотипов Ig. Во время логарифмической фазы наблюдается интенсивный прирост количества
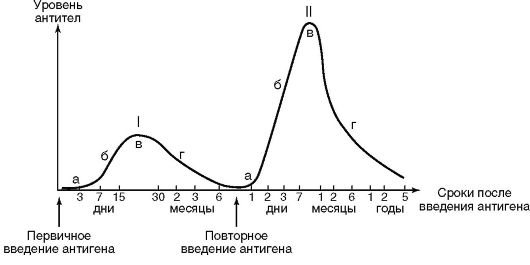 Рис. 11.4. Динамика
антителообразования при первичном (I) и вторичном (II) иммунном
ответах. Фазы антителообразования: а - латентная; б - логарифмического
роста; в - стационарная; г - снижения
Рис. 11.4. Динамика
антителообразования при первичном (I) и вторичном (II) иммунном
ответах. Фазы антителообразования: а - латентная; б - логарифмического
роста; в - стационарная; г - снижения
антигенспецифических В-лимфоцитов, что находит отражение в существенном нарастании титров специфических антител. В стационарной фазе количество специфических антител и синтезирующих их клеток достигает максимума и стабилизируется. Освобождение макроорганизма от антигена устраняет антигенный стимул, поэтому в фазе снижения наблюдается постепенное уменьшение количества клонов специфических антителопродуцентов и титров соответствующих антител.
Динамика антителообразования существенно зависит от первичности или вторичности контакта с антигеном. При первичном контакте с антигеном развивается первичный иммунный ответ. Для него характерны длительные латентная и логарифмическая (7-15 сут) фазы. Первые диагностически значимые титры специфических антител регистрируются на 10-14-е сутки от момента иммунизации. Стационарная фаза продолжается 15-30 сут, а фаза снижения - 1-6 мес.
В течение первичного иммунного ответа происходят созревание, размножение клонов и дифференцировка антигенспецифических В-лимфоцитов, а также переключение биосинтеза Ig с изотипа M на изотопы G, A или Е. В итоге первичного иммунного реагирования формируются многочисленные клоны антигенспецифических антителопродуцирующих клеток и клеток иммуноло-
гической памяти, а во внутренней среде макроорганизма в высоком титре накапливаются специфические IgG и/или IgA. Таким образом обеспечиваются активное противодействие иммунной системы внедрению в макроорганизм антигена и высокая готовность к повторной с ним встрече.
Со временем антительный ответ угасает. Элиминация антигена исключает новое стимулирование к клонообразованию, а появившиеся ранее плазматические клетки имеют короткую продолжительность жизни. Вместе с тем В-лимфоциты иммунологической памяти надолго остаются циркулировать в организме.
Повторный контакт иммунной системы с тем же антигеном ведет к формированию вторичного иммунного ответа (см. рис. 11.4). Его латентная фаза значительно укорочена, а логарифмическая фаза отличается более интенсивной динамикой прироста и более высокими титрами специфических антител. Для стационарной фазы и фазы снижения свойственна затяжная динамика (несколько месяцев или даже лет). При вторичном иммунном ответе организм сразу же в подавляющем большинстве синтезирует IgG. Это обусловлено подготовленностью иммунной системы к повторной встрече с антигеном за счет формирования иммунологической памяти (см. раздел 11.5): многочисленные клоны антигенспецифических В-лимфоцитов, оставшиеся после первичного иммунного реагирования, быстро размножаются и интенсивно включаются в процесс антителогенеза.
Для развития гуморального иммунитета слизистых оболочек характерны те же процессы и динамика антителообразования. Однако в данном случае в слизистых оболочках в подавляющем большинстве созревают и размножаются В-лимфоциты, продуцирующие полимерные молекулы IgA.
Явление интенсивного антителообразования при повторном контакте с антигеном широко используется в практических целях, например вакцинопрофилактике. Для создания и поддержания иммунитета на высоком защитном уровне схемы вакцинации предусматривают многократное введение антигена для формирования и поддержания иммунологической памяти (см. главу 14).
Этот же феномен используют при получении высокоактивных лечебных и диагностических иммунных сывороток (гипериммунных). Для этого животным или донорам производят многократные введения препаратов антигена по специальной схеме.
Динамика и интенсивность антителообразования в значительной степени зависят от иммуногенности антигена: дозы, способа и кратности его введения, а также от состояния макроорганизма. Попытка повторного введения антигена в латентной фазе может привести к иммунологическому параличу - иммунологической неотвечаемости на антиген в течение определенного периода времени.
11.1.9. Теории разнообразия антител
Для объяснения механизмов антителопродукции и разнообразия специфичности антител было предложено множество гипотез и теорий. Только немногие из них получили практическое подтверждение, большинство представляет исторический интерес.
Первую принципиально важную концепцию боковых цепей выдвинул П. Эрлих (1898). Согласно этой концепции, клетки органов и тканей имеют на своей поверхности рецепторы, способные в силу химического сродства связывать антиген и инактивировать его. Затем они отделяются с поверхности клетки и замещаются вновь синтезированными. Эта теория заложила основные представления о гуморальном иммунитете и рецепторах иммунокомпетентных клеток.
Заслуживают внимания инструктивные или матричные теории. Согласно концепциям, предложенным Ф. Брейнлем и Ф. Гауровитцем (1930), Л. Полингом (1940), антиген является матрицей, с которой штампуется молекула антител. Эти теории оказались тупиковыми в связи с открытием Д. Уотсоном и Ф. Криком (1953) механизма кодирования в ДНК генетической информации.
Ряд теорий исходил из предположения о предсуществовании в организме антител практически ко всем возможным антигенам (Ерне Н., 1955; Бернет Ф., 1959). В настоящее время наиболее обоснованной считается теория Ф. Бернета, которая получила название клонально-селекционной. Согласно данной теории, лимфоидная ткань состоит из огромного числа клонов антигенореактивных лимфоцитов, которые специализируются на выработке антител к определенным антигенам. Клоны уже предсуществуют в новорожденном организме. Попавший в организм антиген селективно (избирательно) активирует специфичный к нему клон лимфоцитов, который размножается и начинает вырабатывать специфичные к данному антигену антитела. Если доза антигена слишком велика,
то клон реагирующих на него лимфоцитов устраняется (элиминируется) из организма - так в эмбриональном периоде формируется иммунологическая толерантность (нечувствительность) к собственным антигенам.
Теория Бернета объясняет многие иммунологические реакции (антителообразование, гетерогенность антител, иммунологическую память, толерантность), однако она не способна объяснить происхождение всего многообразия специфичности антител. Бернет предположил, что в организме существует около 10 тыс. клонов специфических антителопродуцирующих клеток. Однако мир антигенов оказался на 2-3 порядка обширнее, и организм отвечает на практически любой из них, в том числе и на искусственно полученный, несуществующий в природе.
Значительную ясность в представление о разнообразии специфичности антител внес С. Тонегава (1983), который дал этому явлению генетическое обоснование. Молекулярно-генетическая теория С. Тонегавы исходит из того, что в генах иммуноглобулинов постоянно происходят мощные рекомбинационные и мутационные процессы. В результате возникает огромное количество вариантов и комбинаций генов, которые кодируют разнообразные специфичности иммуноглобулинов. Каждый клон антителопродуцирующих лимфоцитов обладает своим уникальным вариантом гена иммуноглобулина (см. раздел 11.1.7).
Следует также упомянуть теорию сетевой регуляции иммунной системы. Ее основой является выдвинутая Н. Ерне (1974) идея идиотип-антиидиотипического взаимодействия. Согласно этой теории, иммунная система представляет собой бесконечную цепь взаимодействующих антигенных идиотипов иммуноглобулинов и направленных к ним антиидиотипических антител. Введение антигена вызывает каскадную реакцию образования антител 1-го порядка. Это антитело, действуя как антиген, вызывает образование к своему идиотипу антител 2-го порядка. К идиотипу антител 2-го порядка синтезируются антитела 3-го порядка и т.д. При этом антитело каждого порядка как бы несет внутренний образ антигена, который передается эстафетно в цепи образования антиидиотипических антител. Доказательством этой теории являются обнаружение антиидиотипических антител, способных вызвать в организме иммунитет к соответствующему антигену, а также существование лимфоцитов, сенсибилизированных к антиидиотипическим анти-
телам. С помощью теории Ерне можно понять формирование иммунологичской памяти и возникновение аутоиммунных реакций. Однако она не способна объяснить много других явлений иммунитета: механизм иммунологического распознавания «свой-чужой», управления каскадом идиотип-антиидиотипических реакций и т.д. Данная теория не получила дальнейшего развития.
Выдающийся отечественный иммунолог П.Ф. Здродовский в 60-е годы XX столетия сформулировал физиологическую концепцию иммуногенеза - гипоталамо-адреналовую теорию регуляции иммунитета. Основная идея его теории сводилась к тому, что продукция антител подчиняется общим физиологическим законам. Ведущая роль в этом процессе принадлежит гормонам и нервной системе.
11.2. Иммунный фагоцитоз
Феномен иммунного фагоцитоза основан на поглощении фагоцитами (см. раздел 9.2.2) антигенов, входящих в состав иммунных комплексов. При этом антигенами могут быть как отдельные молекулы или их агрегаты, так и цельные клетки или их обломки. Для осуществления иммунного фагоцитоза необходимо участие молекул иммуноглобулинов и/или комплемента, а также рецепторов к Fc-участку молекулы иммуноглобулина и компонентам комплемента на клеточной мембране фагоцитирующей клетки. Рецепторы обеспечивают узнавание и захват фагоцитом иммунных комплексов или опсонизированных антигенов, которые потом эндоцитируются. Таким образом фагоциты участвуют в элиминации (удалении) антигенов из организма и восстановлении его гомеостаза.
11.3. Опосредованный клетками киллинг
Иммунная система располагает независимым от системы комплемента способом уничтожения чужеродных клеток. Эта форма иммунного реагирования осуществляется непосредственно клетками-киллерами и получила название «опосредованный клетками киллинг». Киллинг способны осуществлять активированные фагоциты, Т-киллеры, естественные киллеры и некоторые другие клетки. Клетки-киллеры осуществляют санацию организма от чужеродных, трансформированных или инфицированных клеток.
Механизм клеточно-опосредованного киллинга достаточно универсален. Киллеры вырабатывают ряд веществ, которые вызывают нарушение целостности клеточной мембраны (или стенки) или индуцируют апоптоз. Они осуществляют свою функцию дистантно (на расстоянии) или при непосредственном контакте. Мишенью для них являются раково-трансформированные, мутантные или зараженные вирусами клетки, грибы, простейшие, гельминты, некоторые бактерии и другие чужеродные клетки.
Способ распознавания киллерами генетической чужеродности клеток-мишеней определяется типом его антигенсвязывающего рецептора. Различают антителозависимую и антителонезависимую клеточно-опосредованную цитотоксичность.
11.3.1. Антителозависимая клеточно-опосредованная цитотоксичность
АЗКЦТ реализуется благодаря экспрессии на мембране иммунокомпетентных клеток рецепторов к Fc-фрагменту молекулы иммуноглобулина (FcR). Эти рецепторы являются трансмембранными белковыми молекулами и специфичны к определенному изотипу тяжелой цепи молекулы Ig, связанной в иммунный комплекс. Поэтому распознавание чужеродных клеток происходит при помощи FcR по антителам, которые предварительно связались с поверхностными антигенами клеток-мишеней. АЗКЦТ могут осуществлять активированные макрофаги, естественные киллеры и эозинофилы.
• Активированные макрофаги (см. раздел 9.2.2) продуцируют перекисные и NO ион-радикалы и ферменты, которые могут поражать мембрану (или стенку) клетки после ее фагоцитирования.
В АЗКЦТ принимают участие естественные килеры с фенотипом СБ16+СБ56мало. Этот фенотип естественных киллеров (кровяные ЕК) постоянно циркулирует в кровотоке и других биологических жидкостях в поиске клеток, инфицированных различными паразитами (вирусами, бактериями, простейшими) и помеченных Ig. При контакте с зараженной клеткой естественный киллер индуцирует разрушение клеток-мишеней осмотическим лизисом (перфорин) или индукцией в них апоптоза (гранзимы, гранулизин).
АЗКЦТ эозинофилов имеет узкую антигельминтную специфичность. При распознавании паразитов, уже помеченных IgA или IgE, эозинофилы выделяют путем дегрануляции антигельминтные
токсичные факторы (ферменты и белковые токсины) и синтезируют цитокины, стимулирующие клеточное звено иммунитета, и липидные медиаторы воспаления.
11.3.2. Антителонезависимая клеточно-опосредованная цитотоксичность
АНКЦТ осуществляется без участия молекулы Ig клетками лимфоидного ряда, несущими иммунорецепторы прямого распознавания. К этой группе клеток относятся Т-киллеры, естественные киллеры с фенотипом СБ16-СБ56много и Т-хелперы.
Основной клеткой, использующей этот тип механизма, является Т-киллер (αβ-тип), который при помощи TCR анализирует структуру MHC I класса на мембране клеток собственного организма и определяет его аллогенность. Контакт зрелого активированного Т-киллера с чужеродной клеткой-мишенью запускает их цитотоксические механизмы: осмотический лизис (перфорин) и индукцию апоптоза (гранзимы).
Киллинг клетки-мишени осуществляется в несколько этапов.
• Установление плотного контакта. Т-киллер прикрепляется к поверхности клетки-мишени, между клетками образуется тесный контакт, или интерфейс, с узким синаптическим пространством.
• Активация Т-киллера. TCR эффектора анализирует комплекс MHC I класса. В случае установления его чужеродности Т-киллер активируется и начинает синтезировать токсичные субстанции, которые накапливаются в гранулах. Для обеспечения строго направленного действия происходит полярное перераспределение внутриклеточных органелл киллера: гранулы, содержащие токсичные субстанции, и аппарат Гольджи перемещаются в сторону контакта.
• Экзоцитоз токсических субстанций. Содержимое гранул выделяется в узкое синаптическое пространство между клетками путем экзоцитоза.
• Токсическое воздействие. В результате воздействия перфорина в мембране клетки-мишени образуются поры, способные вызвать осмотический лизис. Через поры внутрь клетки проникают гранзимы и гранулизин, которые запускают апоптоз.
Точный механизм специфического распознавания Т-киллером мембранных антигенов клетки-мишени и направленный токси-
ческий удар предотвращают ошибочный лизис собственных нормальных клеток.
Естественные киллеры, имеющие фенотип СБ16-СБ56много, получили название тканевых, так как они не циркулируют в организме, а накапливаются в определенных зонах: портальных воротах печени, децидуальной оболочке беременной матки и других органах, содержащих забарьерные антигены. Мишенью для этих киллеров являются активированные лимфоциты, для которых характерен синтез в большом количестве Fas-рецептора. Экспрессируемый на клеточной мембране тканевых естественных киллеров Fas-лиганд связывается с Fas-рецептором и индуцирует в активированном лимфоците апоптоз. Описанный механизм цитотоксичности позволяет элиминировать из организма лимфоциты, позитивно прореагировавшие на пищевые, эмбриональные и забарьерные аллоантигены. Это позволяет избежать развития пищевой аллергии, невынашивания беременности или аутоиммунного поражения тканей.
Подобный эффект также свойствен T-киллерам и Т1-хелперам. Элиминация активированных лимфоцитов путем индукции в них апоптоза - один из эффективных путей иммунорегуляции в периферических тканях.
11.4. Реакции гиперчувствительности
В ряде случаев введение антигена в организм может индуцировать аномальную реакцию, которая имеет черты патологического процесса. Эта форма реагирования, основу которой составляют естественные физиологические механизмы, получила название аллергии (от греч. allos - иной и ergon - действие). Антигены, вызывающие аллергические реакции, получили название аллергенов, а наука, которая изучает аллергию, называется аллергологией.
Понятие «аллергия» было предложено французским ученым К. Пирке (1906). Он понимал аллергию как измененную реакцию макроорганизма на повторное введение антигена и относил к ней как гипер-, так и гипореактивность. По современному определению, аллергия - это повышенная извращенная специфическая реакция макроорганизма на повторный контакт организма с аллергеном.
Для формировании аллергии необходима предварительная сенсибилизация макроорганизма к аллергену, или аллергизация. Ее можно вызвать очень малыми, субиммунизирующими дозами ан-
тигена (например, введением морской свинке 0,000001 мл лошадиной сыворотки), которые получили название сенсибилизирующих. Повторное введение того же антигена через определенный промежуток времени вызывает аллергическую реакцию. Дозу антигена, вызывающую собственно аллергическую реакцию, называют разрешающей.
В развитии аллергической реакции выделяют три стадии: иммунологическую, патохимическую и патофизиологическую. В течение иммунологической стадии в ответ на аллерген образуются антигенчувствительные клетки, специфические антитела и иммунные комплексы. Патохимическая стадия характеризуется образованием медиаторов воспаления и биологически активных аминов, которые играют основную роль в механизме аллергических реакций. В течение патофизиологической стадии проявляется клиническая картина аллергической реакции. Как правило, клинические проявления аллергии полиморфны.
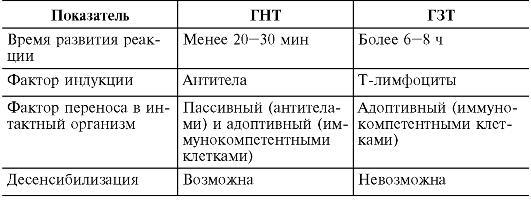
Первая классификация аллергий была предложена Р. Куком в 1947 г. В ее основу было положено время развития аллергической реакции. Была выделена гиперчувствительность немедленного типа (ГНТ) и гиперчувствительность замедленного типа (ГЗТ). Сравнение свойств ГНТ и ГЗТ представлено в табл. 11.2.
Таблица 11.2. Свойства ГНТ и ГЗТ (по Куку, 1947)
 К
ГНТ были отнесены аллергические реакции, проявляющиеся уже через 20-30
мин после повторной встречи с аллергеном, тогда как реакции ГЗТ
возникают через 6-8 ч и позже. Механизмы ГНТ связаны с выработкой
специфических антител (опосредованы В-звеном иммунитета). ГНТ можно
перенести от больного здоро-
К
ГНТ были отнесены аллергические реакции, проявляющиеся уже через 20-30
мин после повторной встречи с аллергеном, тогда как реакции ГЗТ
возникают через 6-8 ч и позже. Механизмы ГНТ связаны с выработкой
специфических антител (опосредованы В-звеном иммунитета). ГНТ можно
перенести от больного здоро-
вому введением специфических антител или клона антигенреактивных В-лимфоцитов. Возможна специфическая десенсибилизация пациента. ГЗТ опосредована клеточным звеном иммунитета. Перенос аллергизации от больного здоровому возможен только с лейкоцитарным пулом. Специфическая терапия, как правило, оказывается неэффективной.
ГНТ была описана в 1902-1905 гг. французскими учеными Ш. Рише и Ж. Портье и русским ученым Г.П. Сахаровым. Они показали, что ГНТ имеет стереотипное течение, которое может заканчиваться смертью. Она может проявляться в виде анафилаксии, атопических болезней, сывороточной болезни, феномена Артюса (см. раздел 12.4.3). Явление ГЗТ было установлено Р. Кохом (1890). Этот тип аллергии может протекать в виде контактной аллергии, реакции на кожно-аллергическую пробу, замедленной аллергии к белкам.
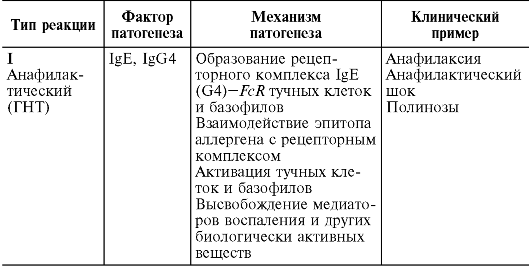
Изучение молекулярных механизмов аллергии привело к созданию Джеллом и Кумбсом в 1968 г. новой классификации. В соответствии с ней различают 4 основных типа аллергии: анафилактический (I тип), цитотоксический (II тип), иммунокомплексный (III тип) и опосредованный клетками (IV тип). Первые три типа относятся к ГНТ, четвертый к ГЗТ. Сравнительная характеристика механизмов указанных типов аллергии приведена в табл. 11.3.
Таблица 11.3. Классификация аллергических реакций по патогенезу (по Джеллу и Кумбсу, 1968)
 Окончание табл. 11.3
Окончание табл. 11.3
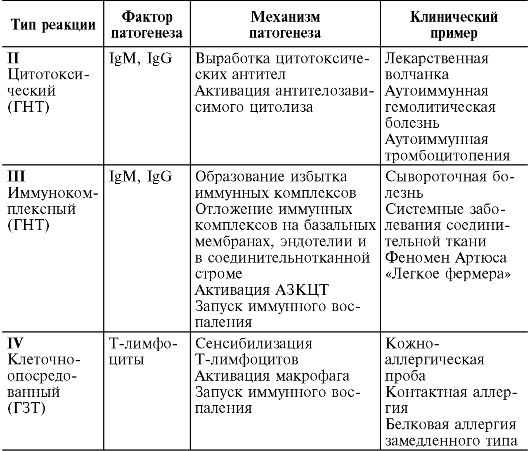
Примечание. Более подробное описание аллергических болезней см. в разделе 12.4.3.
Ведущую роль в запуске ГНТ играют антитела (IgE, G и M), а ГЗТ - лимфоидно-макрофагальная реакция.
Аллергическая реакция I типа связана с IgE и G4, названных реагинами. Они обладают цитофильностью - сродством к тучным клеткам и базофилам: соединение IgE или G4 с высокоаффинным FcR на поверхности этих клеток формирует специфический рецепторный комплекс, связывание с которым аллергена вызывает дегрануляцию базофила и тучной клетки - залповый выброс биологически активных соединений (гистамин, гепарин и др.), содержащихся в гранулах, в межклеточное пространство. Действие этих веществ практически мгновенно, но кратковременно, включает
ряд органотканевых патофизиологических реакций, связанных с сокращением гладкой мускулатуры кишечника, бронхов, мочевого пузыря и активацией секреторных, эндотелиальных и некоторых других клеток. В результате развиваются бронхоспазм, вазодилатация, отек и прочие симптомы, характерные для анафилаксии. Вырабатываемые цитокины стимулируют клеточное звено иммунитета к образованию Т2-хелперов и эозинофилогенез.
Наиболее ярко аллергическая реакция I типа проявляется клинической картиной анафилактического шока. Инъекция сыворотки крови больного аллергией I типа здоровому лицу переносит ему специфический реагин и делает на определенное время сенсибилизированным. На этом феномене основан механизм пробы Прауснитца-Кюстнера, ранее использовавшейся для диагностики аллергии: контакт тест-пациента с аллергеном вызывал у него анафилаксию.
Аллергическая реакция II типа предполагает наличие цитотоксических антител (IgG, IgM), направленных к поверхностным структурам (антигенам) соматических клеток макроорганизма. Эти антитела связываются с клеточными мембранами клеток-мишеней и запускают различные механизмы антителозависимой цитотоксичности, которая сопровождается соответствующими клиническими проявлениями. Классическим примером является гемолитическая болезнь в результате резус-конфликта или переливания иногруппной крови.
Аллергическая реакция III типа обусловлена цитотоксическим действием избыточного количества иммунных комплексов, образующихся в организме пациента в большом количестве после введения массивной дозы антигена. Чрезмерное количество циркулирующих иммунных комплексов не может быть быстро утилизировано стандартными механизмами фагоцитирующих клеток. Фиксируясь на эндотелии сосудов и клубочков почек, в других тканях, иммунные комплексы инициируют АЗКЦТ, сопровождающуюся воспалительной реакцией. Клинические проявления аллергической реакции III типа, как правило, имеют отсроченную манифестацию, иногда на срок более 7 сут. Тем не менее этот тип реакции относят к ГНТ. Реакция может проявляться как одно из осложнений применения иммунных гетерологичных сывороток с лечебно-профилактической целью (сывороточная болезнь), а также при вдыхании белковой пыли («легкое фермера»).
ГЗТ представляет собой лимфоидно-макрофагальную реакцию, которая развивается в результате активации макрофагов под влиянием лимфоцитов, сенсибилизированных к аллергену. Основу ГЗТ составляют нормальные механизмы иммунного воспаления. Активация макрофага возможна в результате контактного или цитокинового воздействия. Контактная стимуляция - результат рецептор-лигандного взаимодействия макрофага, несущего рецепторную молекулу СD40, и Т1-хелпера, экспрессирующего СD40-лиганд. В исключительных случаях эту функцию может выполнять Т2-хелпер. Цитокиновая активация макрофага осуществляется γ-ИФН, который продуцируют Т1-хелперы, Т-киллеры или естественные киллеры. Кроме того, макрофаг может быть стимулирован ЛПС (через СD14-рецепторную молекулу). Ингибиторами активации макрофага являются иммуноцитокины Т2- хелпера: ИЛ-4, 10, 13 и др. Активация макрофага резко повышает его эффективность в осуществлении АЗКЦТ и иммунного фагоцитоза, т.е. деструкции и элиминации антигена (см. также раздел 12.4.3).
Лабораторная диагностика аллергии при аллергических реакциях I типа основана на выявлении суммарных и специфических реагинов (IgE, IgG4) в сыворотке крови пациента. При аллергических реакциях II типа в сыворотке крови определяют цитотоксические антитела (антиэритроцитарные, антилейкоцитарные, антитромбоцитарные и др.). При аллергических реакциях III типа в сыворотке крови выявляют иммунные комплексы. Для обнаружения аллергических реакций IV типа применяют кожно-аллергические пробы, которые широко используют в диагностике некоторых инфекционных заболеваний, паразитозов и микозов (туберкулез, лепра, бруцеллез, туляремия и др.).
Лечение аллергии основано на десенсибилизации макроорганизма путем индукции низкодозовой иммунологической толерантности (см. раздел 11.6), а также устранения аллергена из организма плазмаферезом, гемосорбцией, введением иммунных сывороток. В тяжелых случаях применяют глюкокортикоидную терапию.
Реакции гиперчувствительности имеют также большое значение и в норме. Их механизмы лежат в основе воспаления, которое способствует локализации инфекционного агента или иного антигена в пределах определенных тканей и формированию полноценной иммунной реакции защитного характера.
Реакции гиперчувствительности следует отличать от иммунного реагирования гиперергического типа, которое может быть обусловлено как вариациями нейрогуморальной регуляции, так и некоторыми врожденными особенностями. Например, новозеландскую черную линию мышей от рождения отличает гипериммуноглобулинемия, а среди рыжеволосых людей часто наблюдается эозинофилия.
11.5. Иммунологическая память
При повторной встрече с антигеном организм в норме формирует вторичный иммунный ответ - более активную и быструю иммунную реакцию. Этот феномен получил название иммунологической памяти. Иммунологическая память имеет высокую специфичность для конкретного антигена, распространяется как на гуморальное, так и клеточное звено иммунитета, обусловлена В- и Т-лимфоцитами и длительно сохраняется годами. Иммунологическая память - надежная гарантия защиты организма от повторных антигенных интервенций.
Существует два механизма формирования иммунологической памяти. Один из них предполагает длительное сохранение антигена в организме, что поддерживает в напряжении иммунную систему. Этому имеется множество примеров: инкапсулированный возбудитель туберкулеза, персистирующие вирусы кори, полиомиелита, ветряной оспы и некоторые другие патогены. Вероятно также наличие долгоживущих дендритных АПК, способных длительно сохранять и презентировать антиген.
Другой механизм предусматривает образование специальных клеток иммунологической памяти в процессе развития в организме продуктивного иммунного ответа. Эти клетки отличаются высокой специфичностью к конкретной антигенной детерминанте и большой продолжительностью жизни (до 10 лет). Они активно рециркулируют в организме, распределяясь в тканях и органах, что обеспечивает постоянную готовность иммунной системы реагировать на повторный контакт с антигеном по вторичному типу.
Феномен иммунологической памяти широко используется в практике вакцинации людей для создания напряженного иммунитета и поддержания его дительное время на защитном уровне. Осуществляют это 2-3-кратными прививками при первичной вак-
цинации и периодическими повторными введениями вакцинного препарата - ревакцинациями (см. главу 14).
Однако феномен иммунологической памяти имеет и отрицательные стороны. Например, повторная попытка трансплантировать уже однажды отторгнутую ткань вызывает быструю и бурную реакцию - криз отторжения.
11.6. Иммунологическая толерантность
Иммунологическая толерантность - отсутствие специфического продуктивного иммунного ответа организма на антиген в связи с неспособностью его распознавания. В отличие от иммуносупрессии иммунологическая толерантность предполагает изначальную ареактивность к определенному антигену.
Собственно феномен иммунологической толерантности был открыт в 1953 г. независимо чешским ученым М. Гашеком и группой английских исследователей во главе с П. Медаваром. Гашек в опытах на куриных эмбрионах, а Медавар на новорожденных мышах показали, что организм становится нечувствительным к антигену при его введении в эмбриональном или раннем постнатальном периоде.
Иммунологическую толерантность вызывают антигены, которые получили название толерогенов. Ими могут быть практически все вещества, однако наибольшей толерогенностью обладают полисахариды.
Иммунологическая толерантность бывает врожденной и приобретенной. Примером врожденной толерантности является отсутствие реакции иммунной системы на свои собственные антигены. Приобретенную толерантность можно создать путем введения антигена в эмбриональном периоде или в первые дни после рождения индивидуума.
Иммунологическая толерантность отличается специфичностью - она направлена к строго определенным антигенам. По степени распространенности различают поливалентную и расщепленную толерантность. Поливалентная иммунологическая толерантность возникает одновременно на все антигенные детерминанты, входящие в состав конкретного антигена. Для расщепленной, или моновалентной, толерантности характерна избирательная невосприимчивость каких-то отдельных антигенных детерминант.
Степень проявления иммунологической толерантности существенно зависит от ряда свойств макроорганизма и толерогена. Так, на проявление толерантности влияют возраст и состояние иммунореактивности организма. Иммунологическую толерантность легче индуцировать в эмбриональном периоде и в первые дни после рождения, лучше всего она проявляется у животных со сниженной иммунореактивностью и с определенным генотипом.
Успешность индукции иммунологической толерантности зависит от степени чужеродности антигена для организма, его природы, дозы препарата и продолжительности воздействия антигена на организм. Наибольшей толерогенностью обладают наименее чужеродные по отношению к организму антигены, имеющие малую молекулярную массу и высокую гомогенность. Легче всего формируется толерантность на тимуснезависимые антигены, например бактериальные полисахариды.
Различают высокодозовую и низкодозовую толерантность. Высокодозовую толерантность вызывают введением больших количеств высококонцентрированного антигена. При этом наблюдается прямая зависимость между дозой вещества и производимым им эффектом. Низкодозовая толерантность, наоборот, вызывается очень малым количеством высокогомогенного молекулярного антигена. Соотношение доза-эффект в этом случае имеет обратную зависимость.
В эксперименте толерантность возникает через несколько дней, а иногда часов после введения толерогена и, как правило, проявляется в течение всего времени, пока он циркулирует в организме. Эффект ослабевает или прекращается с удалением из организма толерогена. Обычно иммунологическая толерантность наблюдается непродолжительное время - всего несколько дней. Для ее пролонгирования необходимы повторные инъекции препарата.
Механизмы толерантности многообразны и до конца не расшифрованы. Известно, что ее основу составляют нормальные процессы регуляции иммунной системы. Выделяют три наиболее вероятных причины развития иммунологической толерантности: элиминация из организма антигенспецифических клонов лимфоцитов; блокада биологической активности иммунокомпетентных клеток; быстрая нейтрализация антигена антителами.
Элиминации, или делеции, подвергаются, как правило, клоны аутореактивных Т-лимфоцитов на ранних стадиях их онтогене-
за. Активация антигенспецифического рецептора TCR незрелого лимфоцита индуцирует в нем апоптоз. Этот феномен, обеспечивающий в организме ареактивность к аутоантигенам, получил название центральной толерантности. Локальную толерантность к забарьерным антигенам обеспечивают тканевые естественные киллеры, устраняющие сенсибилизированные к этим антигенам Т-лимфоциты.
Основная роль в блокаде биологической активности иммунокомпетентных клеток принадлежит иммуноцитокинам. Воздействуя на соответствующие рецепторы, они способны вызвать ряд негативных эффектов. Например, пролиферацию Т- и В-лимфоцитов активно тормозит β-ТФР. Дифференцировку Т0-хелпера в Т1 можно заблокировать при помощи ИЛ-4, 13, а в Т2-хелпер - γ-ИФН. Биологическая активность макрофагов ингибируется продуктами Т2-хелперов (ИЛ-4, 10, 13, β-ТФР и др.).
Биосинтез в В-лимфоците и его превращение в плазмоцит подавляются свободно циркулирующими IgG. Быстрая инактивация молекул антигена антителами предотвращает их связывание с рецепторами иммунокомпетентных клеток - элиминируется специфический активирующий фактор. Возможен адоптивный перенос иммунологической толерантности интактному животному путем введения ему иммунокомпетентных клеток, взятых от донора.
Феномен иммунологической толерантности имеет большое практическое значение. Он используется для решения многих важных проблем медицины, таких, как пересадка органов и тканей, подавление аутоиммунных реакций, лечение аллергий и других патологических состояний, связанных с агрессивным поведением иммунной системы.
Толерантность можно искусственно отменить. Для этого необходимо активировать иммунную систему адъювантами, интерлейкинами или переключить направленность ее реакции иммунизацией модифицированными антигенами. Другой путь - удалить из организма толероген, сделав инъекцию специфических антител или путем иммуносорбции.
Задания для самоподготовки (самоконтроля)
A. Назовите класс Ig, который проходит через плаценту:
1. IgA.
2. IgG.
3. IgM.
4. IgE.
Б. Назовите класс Ig, который является показателем острой инфекции:
1. IgA.
2. IgG.
3. IgM.
4. IgE.
B. Назовите класс Ig, который обеспечивает местный иммунитет:
1. IgA.
2. IgG.
3. IgM.
4. IgE.
Г. Отметьте свойства, характерные для IgE:
1. Связывает комплемент.
2. Обладает цитофильностью к тучным клеткам и базофилам.
3. Участвует в развитии гиперчувствительности I типа.
4. Проходит через плаценту.
Д. Назовите класс Ig, обладающий наибольшей авидностью:
1. IgA.
2. IgG.
3. IgM.
4. IgE.
Е. Назовите клетки, обеспечивающие АЗКЦТ:
1. Кровяные ЕК.
2. Т-киллеры.
3. Эозинофилы.
4. Активированные макрофаги.
Ж. Отметьте типы гиперчувствительости, классифицированные по Джеллу и Кумбсу, в которых принимает участие комплемент:
1. I тип (анафилактичский).
2. II тип (цитотоксический).
3. III тип (иммунокомплексный).
4. IV тип (ГЗТ).
З. Назовите процесс, защищающий организм от повторных антигенных интервенций:
1. Иммунная толерантность.
2. Иммунная память.
3. Гиперчувствительность.
4. Иммунный паралич.
И. К аллергологу обратилась пациентка, у которой через 48 ч после употребления косметического крема кожа лица воспалилась и на ней появились везикулы. Этим кремом пациентка пользовалась и ранее. Врач диагностировал развитие контактной гиперчувствительности. Объясните механизм развития контактной гиперчувствительности. Назовите тип, к которому она относится.
К. Резус-отрицательной матери, беременной первой беременностью резус-положительным плодом, сразу после родов была введена антирезус-сыворотка. Объясните необходимость проведения этой врачебной манипуляции.
Л. Иммунная толерантность проявляется отсутствием специфического продуктивного иммунного ответа на антиген в связи с неспособностью его распознавания. Назовите антигены, к которым легче всего формируется толерантность.