Радиационная гигиена : учеб. для вузов / Л. А. Ильин, В. Ф. Кириллов, И. П. Коренков. - 2010. - 384 с. : ил.
|
|
|
|
ГЛАВА 4 ФУНДАМЕНТАЛЬНЫЕ ОСНОВЫ РЕГЛАМЕНТАЦИИ И ПРОГНОЗИРОВАНИЯ РАДИАЦИОННЫХ ВОЗДЕЙСТВИЙ НА ЧЕЛОВЕКА
4.1. Детерминированные и стохастические эффекты облучения
В настоящее время все биологические эффекты: и последствия действия ионизирующих излучений на человека принято разделять на два класса: детерминированные и стохастические.
Детерминированные эффекты - это клинически значимые эффекты, которые проявляются явным поражением: острой или хронической лучевой болезнью, лучевыми ожогами (так называемые местные лучевые поражения), катарактой хрусталика глаз, клинически регистрируемыми нарушениями гемопоэза, временной или постоянной стерильностью и др.
В подавляющем большинстве случаев эти эффекты возникают при кратковременном действии радиации в больших дозах и при больших мощностях. Например, при атомныгх взрывах в Хиросиме и Нагасаки поражающие дозы γ-нейтронного облучения людей (несколько грей) были реализованы в течение миллионных долей секунды.
Главной отличительной особенностью детерминированных эффектов является их пороговый характер. Иными словами, для возникновения той или иной болезни необходимо достижение неких пороговых уровней доз облучения человека, ниже которых эти эффекты клинически не проявляются. Степень тяжести детерминированных эффектов напрямую зависит от поглощенной дозы облучения: чем больше доза, тем глубже тяжесть поражения. Например, для кожных покровов порог эритемы и сухого шелу-
шения при фотонном облучении составляет примерно 3-5 Гр, гибель клеток в эпидермальном и дермальном слоях, приводящая к некрозу тканей, наступает после острого облучения в дозе около 50 Гр.
При остром кратковременном облучении могут возникать различные формы острой лучевой болезни. Так, при общем γ-облучении всего тела человека в дозе 1 Гр острая лучевая болезнь не возникает и смертельные исходы исключены, при дозах 3-5 Гр в результате повреждения стволовых клеток костного мозга 50% облученных могут погибнуть (без лечения) в течение 60 сут. При дозах 5-15 Гр, вследствие поражения клеточного пула желудочнокишечного тракта, возникает так называемая кишечная форма острой лучевой болезни и гибель возможна через 10-20 сут, а при дозах более 15 Гр (церебральная форма острой лучевой болезни) летальный исход у всех облученных наступает в течение 5 сут.
В настоящее время спектр детерминированных эффектов и зависимость их от уровней облучения человека достаточно изучены, однако еще нет окончательных суждений относительно количественных различий в порогах облучения за счет индивидуальной радиочувствительности отдельных представителей гетерогенных групп населения.
В табл. 7 приведены пороговые дозы некоторых детерминированных эффектов в наиболее радиочувствительных тканях и органах человека. Диапазон пороговых доз для различных радиочувствительных органов и тканей неодинаков. В то же время важно отметить, что пороги доз облучения для острого кратковременного радиационного воздействия и для протяженного (протрагированного) во времени облучения существенно различаются. Следова- тельно, облучение (в аналогичных суммарных дозах), растянутое во времени, повышает уровень порога. Несомненно, что эта закономерность, определяемая прежде всего процессами репарации повреждений в целостном организме, характерна и для воздействия так называемых малых доз облучения (под малыми дозами понимают уровни воздействия менее 0,2 Гр и мощности дозы менее 0,1 Гр-ч-1), особенно если учесть, что системы клеточного восстановления в организме функционируют более эффективно после облучения с малой мощностью, чем после воздействия с большой мощностью. Иными словами, при прочих равных условиях острое воздействие ионизирующего излучения всегда опаснее
хронического, длительного облучения в эквивалентньгх дозах. Так, МКРЗ подчеркивает, что «...протяженное (малая мощность дозы) и фракционированное облучение менее эффективно в отношении многих биологических последствий, включая индуцирование опухолей, чем однократные с большой мощностью дозы».
Таблица 7. Пороговые дозы для детерминированных эффектов в случае острого внешнего облучения
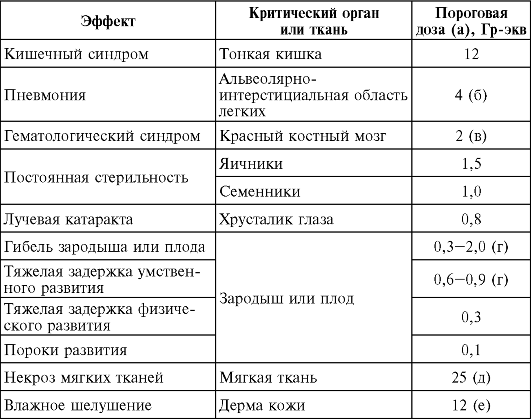
Примечания.
(а) При облучении критического органа или ткани в дозе, равной пороговой, эффект может возникнуть у 5% облученных лиц.
(б) Значение для лиц старше 40 лет; для лиц моложе 40 лет пороговое значение равно 8 Гр-экв.
(в) При отсутствии специализированной медицинской помощи. При оказании своевременной специализированной медицинской помощи пороговое значение равно 3 Гр-экв.
(г) Зависит от стадии развития зародыша или плода.
(д) При поражении области площадью более 100 см2 на глубину не менее
(е) При поражении области площадью более 100 см2 на глубину не менее
Следующий класс последствий радиационного воздействия получил название стохастических (вероятностных, случайных) эффектов, которые иногда называют отдаленными последствиями облучения. В отличие от детерминированных эффектов, для которых доказан и существует дозовый порог проявления и которые, как правило, возникают при значительных дозах облучения в основном за счет гибели большей части клеток в поврежденных органах или тканях, для стохастических последствий, по современным пред- ставлениям, не существует дозового порога. Это, в свою очередь, означает, что реализация стохастических эффектов теоретически возможна при сколь угодно малой дозе облучения, при этом вероятность их возникновения тем меньше, чем ниже доза. Вопрос о том, какова же эта вероятность, является ключевым вопросом для объективного понимания всей проблемы.
Научный комитет по действию атомной радиации ООН и МКРЗ пришли к выводу, что доказаны только два основных вида стоха- стических эффектов облучения. Первый возникает в соматических клетках и может быть причиной развития рака у облученного индивида. Второй вид, появляющийся в зародышевой ткани половых желез, может привести к наследуемым нарушениям у потомства облученных людей. Важно подчеркнуть, что если возможность индукции злокачественных опухолей у облученных людей является фактом, доказанным мировой наукой, то до настоящего времени прямых научных подтверждений генетически обусловленных эффектов облучения человека не получено. Тем не менее, располагая прямыми данными о наличии таких эффектов у других биологических объектов (растения, клеточные культуры, микроорганизмы, мелкие лабораторные животные), МКРЗ в целях исключения возможной недооценки их значимости признала необходимым включить наследственные эффекты в перечень стохастических послед- ствий облучения человека. В этом контексте необходимо обратить внимание на следующее принципиальное обстоятельство.
Многие ученые и врачи, недостаточно знакомые с современными представлениями о патогенезе стохастических эффектов об- лучения, наряду со злокачественными опухолями и генетическими дефектами к этой категории последствий облучения относят различные соматические заболевания у облученных людей, не имеющие радиационного генеза. Например, в свое время к этому классу эффектов относили так называемый синдром преждевременного
старения (преждевременной смерти). Впоследствии после тщательного анализа научной информации этот синдром был исключен из класса стохастических эффектов облучения, так как было установлено, что любое сокращение продолжительности жизни у облученных людей или экспериментальных животных связано с избыточной смертностью от вызванного излучением рака. Таким образом, при прогностических оценках последствий воздействия радиации на человека, уточнения регламентов облучения и т.п. необходимо исходить из положения о том, что стохастическими последствиями облучения являются только злокачественные опухоли (в том числе доброкачественные опухоли некоторых органов) и генетические (наследственные) дефекты у потомства облученных людей.
Поскольку детерминированные эффекты: являются в основном прерогативой клинической радиационной медицины, а стохастические последствия облучения людей служат предметом особых интересов радиационной гигиены как науки, в сферу задач которой органически входят вопросы оценки последствий и регламентации уровней облучения населения и профессионалов, ниже эта проблема обсуждается более подробно.
4.2. Концепция беспорогового действия ионизирующих излучений. Рабочая гипотеза о линейной зависимости эффекта от дозы излучения
Вопрос о биологических эффектах действия малых доз излучения, особенно проблема их количественной оценки (как, впрочем, и любых иных антропогенных факторов малой интенсивности), продолжает оставаться предметом многочисленных дискуссий и полярных мнений по поводу их опасности для человека и среды его обитания.
Вместе с тем совершенно очевидно, что регламентация облучения человека невозможна без приемлемого обоснования принципов, на базе которых строятся научные подходы к установлению подобного рода регламентов.
В зависимости от особенностей биологического действия на живые объекты всю совокупность многообразных факторов физической, химической и биологической природы, особенно при хроническом действии, можно условно разделить на две большие
группы: агенты (или факторы), обладающие порогом вредного действия (т.е. если порог вредного действия не достигнут, биологические эффекты отсутствуют), и агенты, лишенные таких свойств, т.е. у них порога вредного влияния не существует. На современном этапе к числу агентов, которым свойственен пороговый механизм действия, относят многие ксенобиотики и некоторые виды неионизирующих излучений. К факторам, обладающим беспороговым действием на живые системы, современная наука относит все виды ионизирующих излучений и некоторые токсиканты химической природы, обладающие канцерогенными и генотоксическими свойствами. Уже само определение свидетельствует о том, что в условиях длительного хронического воздействия на организм пороговых агентов в количествах, равных установленному значению порога (по концентрации, дозе и т.п.) и тем более ниже такового, как бы гарантируется исключение каких-либо вредных медикобиологических последствий у отдельных лиц, всего населения и его потомков1. Принципиально иные подходы используют при прогнозировании и регламентации негативных эффектов в случае воздействия факторов, для которых порога вредного влияния на организм не существует. В мировой науке этот принцип впервые был предложен радиобиологами в начале второй половины XX в. и относился к ионизирующим излучениям. Только в последние годы этот подход получил развитие в области химических агентов, для которых получены доказательства их канцерогенного и генотоксического действия. Концепция (точнее, рабочая гипотеза) беспорогового действия ионизирующих излучений постулирует линейную зависимость биологических эффектов от дозы облучения. Поэтому, в отличие от пороговой, беспороговая гипотеза предопределяет признание того факта, что отрицательные (но недетерминирован- ные) вредоносные биологические эффекты воздействия ионизирующего излучения - злокачественные опухоли и наследственные нарушения - теоретически возможны при сколь угодно малой дозе облучения вплоть до значений, практически не отличающихся от нуля. При этом вероятность индукции таких эффектов тем меньше, чем ниже доза облучения. Если детерминированные эффекты с высокой степенью вероятности персонифицированы и
1 Это заключение далеко не безупречно. Тем не менее, в интересах последующего изложения существа обсуждаемой в данном учебнике проблемы мы упоминаем о нем без каких-либо комментариев.
степень тяжести поражения любого облученного индивидуума или группы пострадавших будет тем больше, чем выше доза облучения, то для стохастических, вероятностных последствий облучения речь идет не о тяжести поражений, а о повышении частоты (вероятности) случаев проявления раковых заболеваний или наследственных дефектов в популяции людей и в том числе у каждого среднестатистического индивидуума. Следовательно, чем больше луче- вая нагрузка на популяцию облученных (или облучаемых людей), тем при прочих равных условиях, вероятность выхода (частоты) отдаленных последствий будет выше. Для осуществления соответствующих расчетов и оценок в радиационной защите введено специальное понятие, определяемое термином «коллективная доза облучения» (S). Она представляет собой произведение двух величин: средней эффективной индивидуальной дозы в облученной когорте и численности людей, которые подверглись облучению.
Обозначается S в человеко-зивертах (чел-Зв). Например, когорта населения численностью 1000 человек подверглась внешнему γ-облучению в средней индивидуальной дозе 0,01 Зв. Тогда S составляет 1000-0,01 = 10 чел-Зв.
Важно помнить, что вытекающая из беспороговой гипотезы линейная зависимость эффекта от дозы предопределяет равновеликий выход (число случаев) отдаленных последствий на единицу коллективной дозы. Иными словами, это означает, что если различные когорты людей получили одинаковую лучевую нагрузку (коллективную дозу), то теоретически ожидаемый абсолютный выход опухолей или наследственных дефектов будет равным независимо от численности облучаемых групп. Поясним сказанное следующим абстрактным примером.
Допустим, одна популяция численностью 1 млн человек облучена в средней эффективной индивидуальной дозе 0,001 Зв, а другая, численностью 10 000 человек в дозе 0,1 Зв. Тогда коллективные дозы облучения в обеих когортах будут равновеликими: 1-106-1-10-3 = 1-103 чел-Зв и 1-104-1-10-1 = 1-103 чел-Зв. Отсюда следует, что в соответствии с линейной зависимостью эффекта от дозы ожидаемый выход абсолютного числа, например, злокачественных опухолей, распределенных на вероятностной основе в обоих популяциях облученных людей, должен быть одинаковым. Если это действительно так, становится ясным, что вероятность (частота) выхода опухолей в популяции 1 млн человек, облученных средней индивидуальной
дозой 0,001 Зв, будет в 100 раз меньше, чем в когорте 10 000 человек, облученных дозой 0,1 Зв. Эти теоретические оценки, которые ни в коем случае нельзя абсолютизировать, позволяют, тем не менее, рассчитать вероятность заболевания радиогенным раком для каждого индивидуума из этих когорт.
Расчеты показывают, что, согласно номинальным коэффициентам вероятности стохастических эффектов, при S, равной 1-103 чел-Зв, можно ожидать выхода 60 злокачественных опухолей (излечимых или со смертельным исходом) в каждой популяции людей. Отсюда следует, что вероятность (риск) заболевания радиационно обусловленным раком в течение всей жизни у людей в когорте 1 млн человек составит 6-10-5, а во второй когорте (10 000 человек) -
6-10-3 .
Линейная зависимость эффекта от дозы, отражающая суть беспороговой концепции действия ионизирующих излучений на биологические объекты, была принята в качестве рабочей гипотезы международными научными организациями (Научный комитет по действию атомной радиации при ООН - НКДАР и МКРЗ) в основном для обоснования принципов и методов регламентации малых доз облучения. При ее обосновании исходили из теоретически корректных представлений о механизмах взаимодействия излучений с биосубстратами на молекулярном уровне, которые подтверждают принципиальную возможность беспорогового действия излучений, экспериментальных исследований на биологи- ческих моделях in vitro и на микроорганизмах, а также из одного принципиально важного априорного предположения. Суть его заключается в том, что предполагается правомерной экстраполяция (перенос) данных о канцерогенных эффектах у человека, полученных в условиях воздействия больших доз и больших мощностей доз, на малые дозы и низкие мощности доз редкоионизирующих излучений. При этом должны вводиться некоторые поправочные коэффициенты, учитывающие меньшую биологическую эффективность малых доз.
Этот подход по понятным причинам носил вынужденный характер из-за отсутствия сколько-нибудь надежных данных эпи- демиологических исследований у облученных когорт людей при действии малых доз и данных, подтверждающих наличие прямой зависимости выхода стохастических эффектов от дозы облучения. Упомянутая рабочая гипотеза, а не доказанный на человеческих
популяциях факт, будучи по сути своей консервативной, явно завышает реальный риск облучения в малых дозах и, следовательно, практически исключает возможную недооценку подобного рода последствий. В то же время линейная зависимость эффекта от дозы максимально упрощает оценку вероятности стохастических последствий для уровней доз значительно ниже порогов детерминированных эффектов. Поскольку ограничение индукции именно этих вероятностных эффектов после воздействия радиации является медико-гигиенической основой радиационной защиты и регламентации пределов дозы облучения, возникает много проблем, касающихся доказательства их существования у человека в диапазоне воздействия малых доз и низких мощностей доз редкоионизирующих излучений. Согласно теории и соответствующим расчетам, риск, точнее вероятность, проявления таких эффектов у людей в обсуждаемом диапазоне малых доз, особенно хронического облучения, - весьма редкое событие. Данным фактом объясняется то обстоятельство, что установление и подтверждение этих отдаленных последствий в эпидемиологических наблюдениях за облучаемыми когортами людей обеспечили бы получение прямых данных о риске, но они сопряжены подчас с непреодолимыми статистическими ограничениями, поскольку для выявления таких стохастических эффектов на фоне высоких уровней спонтанной заболеваемости (рак и наследственные дефекты естественного происхождения) требуются популяции, исчисляемые многими сотнями тысяч и даже миллионами людей (без учета так называемых контрольных, т.е. необлученных, групп обследуемого населения).
По мнению большинства ученых, не существует совокупности неопровержимых данных, устанавливающих рост канцерогенного риска при дозах ниже 0,5-0,2 Гр. Например, применительно к некоторым лейкозам человека, радиогенное происхождение которых четко доказано, ряд ученых предполагают наличие практического порога для их индукции в пределах доз 0,3-0,4 Гр. Тем не менее, МКРЗ, подтверждая свою позицию по поводу беспорогового действия ионизирующей радиации, отмечает: «Теоретическое рассмотрение и большинство экспериментальных и эпидемиологических данных не подтверждают идею порога в дозовой зависимости канцерогенеза для излучений с малой линейной потерей энергии. Тем не менее, на статистической основе нельзя исключить с до-
стоверностью порог для отдельных видов опухолей ни для экспериментальных систем, ни для человека. Однако если пороги и существуют, их значения для большинства видов рака у человека должны быть менее 0,2 Гр, а возможно, и еще меньше».
4.3. Проблемы эпидемиологических исследований по выявлению влияния малых доз радиации на
человека
Для разработки системы радиационной безопасности необходимо знать, как количественно изменяются с дозой вероятность стохастических эффектов и степень тяжести детерминированных эффектов.
Наиболее подходящий источник информации - это сведения, полученные непосредственно при изучении результатов воздействия излучения на человека. Кроме того, много информации о механизмах повреждения и взаимосвязи между дозой и вредными эффектами у человека можно почерпнуть из исследований на микроорганизмах, изолированных клетках, выращенных in vitro, и у животных. К сожалению, очень мало этих сведений можно применить непосредственно для целей радиационной безопасности - все они требуют серьезной проверки и интерпретации. Выводы по биологической информации, касающиеся радиационной безопасности и защиты, основываются на данных о радиационных эффектах у человека; остальные сведения используются лишь для их подкрепления.
Этим обстоятельством определяются весьма жесткие требования к организации эпидемиологических исследований и обоснованно- сти интерпретации полученных данных. Суть проблемы заключается в том, что при воздействии на людей различных факторов малой интенсивности, будь то радиация или иные агенты антропогенной природы, возникает необходимость учета и количественного анализа множества дополнительных моментов и обстоятельств, которые затрудняют, маскируют либо искажают оценку истинной картины воздействия данного фактора на здоровье обследуемой популяции людей. Студентам, врачам широкого профиля и особенно гигиенистам необходимо знать общие принципы, которы- ми следует руководствоваться при планировании подобного рода в высшей степени трудоемких проектов. Вместе с тем следует пом-
нить, что из-за различных методических ошибок либо недооценки существенной роли статистики в таких работах нередко допуска- ются серьезные ошибки и даже неверные заключения и выводы. Поскольку эта важнейшая проблема имеет непосредственное отношение к многим медицинским дисциплинам и должна изучаться особо, мы рассмотрим лишь некоторые из множества вопросов в рамках обсуждаемой здесь темы.
Прежде всего несколько общих замечаний по проблеме статистического анализа данных. Как известно, каждое исследование может иметь статистически значимый результат исключительно на вероятной основе. Необходимо количественно оценить степень, до которой случайность может отвечать за данный результат статистического анализа, отражается величиной р. При значении р менее 0,05 вероятность того, что наблюдаемый результат обусловлен случайностью, составляет менее 1 из 20 случаев (или менее 5%). Условно принимается, что значение р менее 0,05 означает статистическую значимость. Более адекватное представление о значимости полученных данных отражает так называемый доверительный интервал, который показывает диапазон разброса оценок среднего значения. Например, в одном из исследований избыточных лейкозов среди работающих в атомных центрах США, Великобритании и Канады доверительный интервал составил от 0,1 до 5,4.
Среди трудностей и недостатков многих работ в области эпидемиологии малых доз ионизирующих излучений укажем лишь на следующие:
• малый размер выборки;
• отсутствие адекватного контроля;
• недоучет посторонних воздействий, не связанных с излучением;
• неадекватная дозиметрия;
• влияние сопутствующих социальных и экономических факторов.
Существует также тенденция сообщать о позитивных находках и замалчивать те исследования, которые не дали ожидаемого результата.
Рассмотрим некоторые из трудностей подобного рода исследований более подробно.
Размер выборки
В качестве примера ниже представлены данные о размере выборки (численности обследуемых людей), необходимой для стати- стически значимого (с вероятностью 95%) определения канцерогенеза в рамках зависимости доза-эффект.
Размер выборки, необходимый для статистически значимого определения зависимости доза-эффект в канцерогенезе:
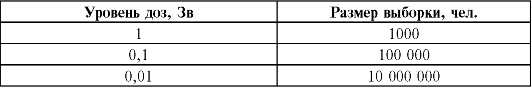
Если, например, риск индуцированного излучением рака достоверно оценен при дозе 1 Зв в группе 1000 человек, то, чтобы подтвердить риск за счет более низкой дозы 0,01 Зв при такой же степени достоверности, потребуется когорта в 10 млн человек (не считая адекватного контроля). Очевидно также, что эти расчеты необходимой численности выборки, относящейся ко всей сумме злокачественных опухолей, должны быть скорректированы, когда речь пойдет о выявлении избыточных раков конкретного вида и локализации. В данном случае, как и в только что приведенном примере, размер выборки будет определяться естественной частотой (спонтанным уровнем) данного вида рака. Пока не найдено никакого теста, позволяющего отличить радиогенный рак от опухолей тех же гистологических типов другого происхождения. Это, в свою очередь, означает, что радиогенный рак можно связать с облучением только путем тщательного статистического сравнения с количеством ожидаемых случаев в популяциях, идентичных по всем показателям, кроме воздействия дополнительной дозы облучения. Например, небольшое превышение числа случаев злокачественных опухолей, которое предположительно связывают с излучением, может считаться достоверно установленным только в том случае, если оно примерно вдвое превышает стандартное отклонение, характерное для неизбежного варьирования ожидаемого числа случаев (спонтанных опухолей) в обследуемой группе населения.
Адекватный контроль
Выбор адекватного контроля - одна из наиболее сложных проблем для грамотного планирования эпидемиологических исследо- ваний. Из самого определения следует, что контрольная популяция должна отличаться от наблюдаемой только по одному критерию - дозе дополнительного облучения. Подбор такого контроля представляет исключительные трудности, связанные не только с региональными особенностями - биогеохимическими, демографическими, этническими, социально-экономическими, краевой патологией и т.п., но и с необходимостью дополнительных затрат и привлечения значительных ресурсов. Одним из возможных подходов является подбор когорт наблюдения и контроля, которые при прочих равных условиях отличаются между собой достаточно широким диапазоном доз облучения. Такой принцип использован, например, в наблюдениях за японскими когортами населения, которые пострадали в результате атомных бомбардировок Хиросимы и Нагасаки.
Учет посторонних, не связанных с облучением, воздействий
В данном случае следует исходить из того факта, что в реальной жизни человек подвергается многим воздействиям антропогенных факторов. На фоне загрязнений химической природы большое значение имеют фактор питания, качество питьевой воды и т.п. Несмотря на наличие в популяции достаточно мощных гомеостатических механизмов, на здоровое население могут оказывать воздействие биогеохимические особенности района наблюдения (на- пример, микроэлементный состав почв, избыток или недостаток тех или иных важных био-, макро- и микроэлементов в рационе питания и т.п.). Эти факторы следует учитывать, особенно при сравнении их с контрольными районами.
Дозиметрия
При трактовке данных эпидемиологических наблюдений вопросы адекватной дозиметрии приобретают принципиальное зна- чение. К сожалению, в подавляющем большинстве исследований, особенно после крупномасштабных аварий, врачи сталкиваются со значительными неопределенностями в этой области. Как правило, в силу многих причин не удается получить необходимый массив
данных прямой индивидуальной дозиметрии людей - наиболее информативного показателя для эпидемиологических исследований. Методы реконструкции доз (ретроспективная дозиметрия) широко используются, но следует иметь в виду, что точность получаемых оценок определяется моделями расчета и качеством исходных, в том числе инструментальных, данных.
Влияние сопутствующих социально-экономических факторов
Это, пожалуй, наиболее сложный аспект проблемы. До настоящего времени и, по-видимому, в будущем влияние этих факторов на здоровье пострадавшего населения не может быть оценено строго количественно. Достаточно напомнить, что в результате аварии на ЧАЭС социальные потрясения и психоэмоциональные стрессы у людей, несомненно, оказали и продолжают оказывать отрицательное воздействие на здоровье населения. Как хорошо известно, подобного рода психосоциальные нагрузки и порождаемые ими стрессовые состояния нередко служат изначальной причиной многих заболеваний человека. Поэтому учет указанных обстоятельств при оценке общего ущерба здоровью человека в связи с радиационными авариями и попытки вычленить парциальный вклад низ- коинтенсивного радиационного фактора в заболеваемость являются исключительно трудной задачей.
В заключение напомним, что при анализе качества эпидемиологических исследований необходимо обращать внимание на организацию исследований, достаточность изучаемой выборки, протоколы наблюдений, контроль качества измерений, прецизионность аппаратуры и реактивов, наличие и точность данных об индивидуальных дозах облучения, приемлемость контрольной когорты наблюдения, учет потенциальных источников возможного искажения данных или смешения оценок.
В разных эпидемиологических исследованиях, посвященных выявлению избыточных заболеваний, таких как рак, используется целый ряд понятий или терминов для выражения их связи с облучением. К сожалению, нередко возникают затруднения, обусловленные тем, что разные авторы используют различные понятия. Наиболее часто применяют термины «относительный риск» (ОР) или «избыточный относительный риск» (ИОР). Оба они выражают риск в облученной группе людей по отношению к некоторой
необлученной популяции. [В данном контексте не смешивать с терминологией, принятой в моделях абсолютного (аддитивного) и относительного (мультипликативного) риска, используемых для прогнозов.]
Так, ОР, равный 1, означает, что риск в облученной группе такой же, как и в контрольной (необлученной). Соответственно в данном случае ИОР равен 0. Если ОР равен 2, это означает, что в облученной популяции вероятность рака вдвое больше, чем в необлученной. Следовательно, ОР, равный 2, соответствует ИОР, равному 1.
4.4. Общие представления о математических моделях зависимости доза-эффект
Для расчета канцерогенного риска у людей при малых дозах и мощностях дозы особенно важно знать изменение зависимости доза-эффект в этой области доз. Дело в том, что, как уже отмечалось, огромный объем данных, накопленных в опытах in vitro, в экспериментах на животных и в клинических наблюдениях, весьма гетерогенен и в большинстве случаев статистически недостаточно информативен. Даже при большой численности людей, переживших атомную бомбардировку в Японии, обследование которых продолжается, маловероятна возможность прямой оценки риска непосредственно по этим эмпирическим данным без использования математических моделей описания зависимости доза-эффект в диапазоне малых доз. В попытках создать наиболее адекватные подходы для анализа указанной зависимости применяют несколько математических моделей доза-эффект с целью экстраполяции эффектов от промежуточных доз к малым. Речь идет о так называемой линейной, линейно-квадратичной, квадратичной и пороговой моделях.
Ни одна из этих моделей не позволяет получить однозначно исчерпывающее заключение о характере действительной зависимости доза-эффект в обсуждаемом диапазоне доз. Так, очевидно, что линейная модель в диапазоне малых доз дает верхние оценки границы риска (это следует из математического выражения линейной модели: у = ах, где у - частота избыточных раков; а - константа; х - доза). Квадратичная модель (у = ах2) использовалась некоторыми авторами для получения набора нижних оценок риска. Вну-
три графиков зависимостей линейной и квадратичной моделей находится линейно-квадратичная модель: у = ах + Ьх2, которая, как оказалось, обеспечивает наилучшую подгонку под эмпирические данные для риска радиогенного лейкоза.
Пороговая модель, как очевидно из определения, - это такое соотношение доза-эффект, в котором та или иная доза не вызывает эффекта. На современном уровне состояния эмпирических данных, полученных в экспериментальных и эпидемиологических исследованиях для математического описания зависимости доза- эффект в диапазоне малых доз, предпочтение отдается линейной и линейно-квадратичной моделям. При анализе всех этих сведений у читателя, на первый взгляд, может закономерно возникнуть во- прос о том, насколько важна детализация указанных зависимостей в диапазоне малых и сверхмалых доз. Все эти кажущиеся несущественными детали на самом деле представляются принципиально важными для проблемы регламентации облучения человека, ибо признание наличия практического дозового порога для стохасти- ческих последствий облучения в корне может изменить всю систему оценок риска и регламентов воздействия радиации для людей.
4.5. Количественная оценка риска стохастических эффектов облучения. Модели абсолютного и относительного риска
Подходя к проблеме количественной оценки последствий облучения в малых дозах на основе рабочей гипотезы о беспоро- говом действии ионизирующих излучений, приведем следующий вывод МКРЗ: «Теоретическое рассмотрение, экспериментальные результаты, полученные на животных и других биологических организмах, и даже некоторый ограниченный опыт, накопленный в наблюдениях над человеком, позволяют предположить, что индуцирование рака при малых дозах и мощностях дозы должно быть меньше, чем наблюдаемое при больших дозах и мощностях доз». Для того чтобы количественно отразить это обстоятельство (что частично достигается путем использования математических моделей доза-эффект), МКРЗ предложила для целей радиационной защиты (регламентации пределов доз облучения) использовать коэффициент, учитывающий эффективность дозы и мощность дозы (КЭДМД). По оценкам различных ученых, КЭДМД может коле-
баться в широких пределах - от 2 до 10. МКРЗ решила для целей радиационной безопасности на современном этапе использовать значение КЭДМД, равное 2, осознавая вместе с тем, что этот выбор до некоторой степени произволен и, возможно, консервативен. Данная рекомендация может измениться, если в будущем станет известна новая, более определенная информация. Некоторые ученые считают, что использование численного значения коэффициента 2 приводит к завышению реальных рисков облучения в малых дозах в 2-5 раз.
Следующая проблема состоит в оценке числа стохастических эффектов, которые еще не появились в изучаемой группе облучен- ных людей. Для некоторых видов рака, в частности лейкемии, эта проблема разрешается, поскольку частота возникновения новых случаев заболевания убывает или же близка к ожидаемой частоте в соответствующей контрольной группе людей. Обусловлено это, в частности, относительно коротким латентным периодом реали- зации данной формы заболеваний у человека после облучения: минимальный латентный период составляет 2-3 года, а избыточный выход этих заболеваний наиболее велик в интервале 7-10 лет после облучения. Для большинства видов солидных раков, для которых характерен существенно больший минимальный латент- ный период (~10 лет), а средний латентный период достигает 20- 25 лет, избыточная смертность имеет иное распределение во времени, близкое к естественной смертности от рака того же вида.
В настоящее время для прогнозирования рисков ожидаемых канцерогенных эффектов по окончании их латентного периода и пожизненного риска этих стохастических эффектов в целом используют в основном две модели прогноза.
Это так называемая модель абсолютного (аддитивного) риска и модель относительного (мультипликативного) риска. Модель абсолютного риска основывается на положении, что риск избыточных случаев рака не зависит от естественной частоты данного вида злокачественных опухолей. Под термином «избыточный» здесь и в дальнейшем подразумевается избыток неоплазм, обусловленных облучением или связанных с ним. В модели аддитивного риска проявление избыточного риска в облученной популяции начинается спустя некоторый период после облучения и существует как постоянная величина в последующем времени. Абсолютный риск определяется как число избыточных случаев рака на человека на
единицу дозы и единицу времени. Радиогенный избыток раков здесь поделен на число облученных людей, среднее число лет на- блюдения за ними и среднюю величину дозы их облучения. Таким образом, абсолютный риск может быть выражен в виде годового или пожизненного абсолютного риска. По аддитивной модели абсолютный риск выражается как число избыточных случаев рака на 1 млн человек на 1 Зв (чел-Зв). В этой модели для определения риска возраст человека под наблюдением некритичен, если пройден (завершен) латентный период выхода опухолей. В то же время очевидно, что пожизненный абсолютный риск зависит от возраста на момент облучения.
В мультипликативной модели избыточный канцерогенный риск (по окончании латентного периода) выражается как доля, или сомножитель, величины риска спонтанного возрастноспецифического рака в данной конкретной популяции. Учет последнего обстоятельства крайне важен, так как нередко за естественную частоту рака принимают либо данные по другим регионам, либо не учитывают, например, особенности этнического состава популяций, проживающих в данном регионе. Для них, как известно, характерны различия в спонтанных уровнях. Отсюда оцененная величина избыточного риска может не соответствовать действительной картине.
Итак, модель мультипликативного (относительного) прогноза риска обязательно соотносит избыточный (радиогенный) риск со спонтанным риском злокачественных опухолей в возрастном аспекте. Например, относительный риск, оцененный по этой модели величиной 1,5, означает, что следует ожидать (прогнозировать) 50% рост риска сверх спонтанной частоты рака. Очень важно правильно трактовать обозначения и смысл величин, публикуемых в различных изданиях по этой проблеме. Относительный (мультипликативный) риск, равный 2, применительно к лейкозу с гигиенической точки зрения может показаться более значимым, чем относительный риск, равный 1,5, по отношению к раку молочной железы. (Совершенно очевидно, что для каждого конкретного человека противопоставление этих рисков бессмысленно, если у него развилась та или иная злокачественная опухоль.) С популяционных позиций оценки последствий облучения населения следует учитывать следующий факт: поскольку спонтанная частота лейкозов - крайне редкое событие, то и увеличение его в 2 раза
обусловит в целом сравнительно малое число избыточных случаев этих гемобластозов. В то же время спонтанная заболеваемость раком молочной железы характеризуется существенно более высокими цифрами, так что коэффициент относительного риска 1,5 приведет к прогнозу гораздо большего абсолютного числа избыточных раков этого органа в популяции, нежели в случае лейкоза. Какие модели используются для прогноза канцерогенных рисков? После анализа этой проблемы МКРЗ предпочла мультипликативную модель для всех солидных раков. Исключение составляют лейкозы, оценка риска которых в результате облучения больше подходит под аддитивную модель. Действительно, хорошо известно, что относительно высокая спонтанная частота лейкозов характерна для детей и пожилых людей. Поэтому если бы мультипликативная мо- дель прогноза была справедлива для всех опухолей, включая лейкозы, то риск радиогенного лейкоза у детей и пожилых людей был бы намного завышен (для лейкоза риск уменьшается с увеличением возраста на момент облучения и оказывается не связанным напрямую со спонтанной частотой).
В целом использование мультипликативной модели прогноза риска, по мнению некоторых ученых, приводит к более высоким оценкам риска, чем дает аддитивная модель. Данное различие в оценках риска может достигать коэффициента, равного 5.
В табл. 8 представлены значения соответствующих коэффициентов вероятности стохастических последствий облучения.
Таблица 8. Номинальные коэффициенты вероятности стохастических эффектов облучения, 10-2 Зв-1 (МКРЗ, 2002, Публикация 103)
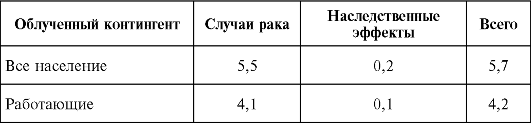
Численные значения приведенных в табл. 8 коэффициентов отнюдь не являются абсолютно точными, поскольку, как неодно- кратно подчеркивалось, они получены в результате целого ряда допущений.
Укажем на одно существенное обстоятельство, на которое в большинстве случаев не обращают внимания: число рассчитанных
с помощью этих коэффициентов событий (раки, наследуемые нарушения) - не строго фиксированная цифра, а некий диапазон цифр от нуля до максимального значения, в рамках которого находится теоретически оцениваемая величина. Поэтому крайне важно иметь в виду, что указанные коэффициенты, скорее, отражают порядок величин ожидаемых эффектов. В то же время вырванные из контекста цифры прогнозируемых ожидаемых случаев стохастиче- ских последствий облучения должны обязательно рассматриваться в сравнительном аспекте. Одним из таких сравнений в отношении, например, радиогенных злокачественных опухолей является на сопоставление их избыточности над спонтанным уровнем, «естественным фоном» этой патологии. Проведем грубый расчет. Согласно современным данным, смертность от рака составляет 200 случаев в год на 100 000 населения. Следовательно, из приведенного выше примера в когорте населения численностью 10 000 человек этот показатель составит 20 случаев в год. Примем среднюю продолжительность жизни 69 лет. За этот период по формальному расчету в данной популяции следует ожидать около 1400 случаев смерти от спонтанных злокачественных опухолей.
В нашем примере (1?103 чел-Зв) число избыточных радиогенных раков составит 55 случаев. Таким образом, в результате облучения населения численностью 1?104 человек в средней индивидуальной дозе 0,1 Зв 1?103 чел-Зв ожидаемый выход злокачественных опухолей составит порядка 0,3% по сравнению со спонтанным уровнем.
Приводим
теперь два конкретных примера оценок радиологических последствий
Чернобыльской аварии. Так, по нашим данным (1991), ожидаемая
эффективная коллективная доза общего внешнего и внутреннего облучения
(в основном за счет радиоактивного цезия) населения 9 областей России,
Украины и Белоруссии (15 617 000 человек) составила 192 000 чел-Зв.
Расчет показывает, что теоретически прогнозируемая смертность от всех
злокачественных опухолей за счет радиации Чернобыля могла увеличиться на
0,6% по сравнению со спонтанным уровнем. Согласно данным
опухолей, легко показать, что в данном случае речь идет о десятых долях процентов суммы избыточных опухолей по отношению к их спонтанному уровню.
Выявление этого сравнительно малого числа избыточных раков на фоне высокого уровня спонтанных раков, годовые колебания которого находятся в пределах нескольких процентов, представляет исключительные трудности. Во-первых, в связи со статистическими ограничениями при проведении широкомасштабных эпидемиологических наблюдений за облученными и контрольными когортами населения (подробнее см. выше) и, во-вторых, из-за отсутствия тест-систем, с помощью которых можно дифференцировать раки радиогенной природы от обычных, спонтанных (как известно, по типу и гистологическому строению они одинаковы).
Применительно к прогнозу серьезных генетических эффектов у потомков облученных людей (К = 1?10-2 Зв-1) можно привести следующие примеры. Если, скажем, каждый человек в когорте численностью 1 млн был облучен дозой 0,1 Зв, вероятность такого рода эффектов, как показывают расчеты, может проявиться среди 1000 потомков облученных у всех последующих поколений. Согласно нашим оценкам, теоретически ожидаемый выход генетических последствий среди жителей 9 областей России, Украины и Белоруссии, подвергшихся радиоактивному загрязнению в результате аварии на ЧАЭС, их прогнозируемая частота составит немногим более 100 случаев на 1 млн человек. Если учесть высокий спонтанный уровень клинически значимых наследственных заболеваний человека (50 000 врожденных аномалий развития и около 15 000 генетически обусловленных болезней на 1 млн живорожденных детей), становятся очевидными практически непреодолимые затруднения в выявлении этих теоретически возможных избыточных случаев наследственных заболеваний. Действительно, ряд ученых пришли к выводу, что «генетические последствия облучения участников ликвидации последствий аварии на ЧАЭС и эвакуированного населения тонут в высоком уровне спонтанных генетических нарушений».
МКРЗ также оценила номинальные коэффициенты «вероятности выхода раков» для отдельных органов и тканей.
Вскоре после катастрофы на 4-м энергоблоке ЧАЭС ученыммедикам стало очевидно, что одним из основных радиологических последствий аварии могут стать патологические нарушения щи-
товидной железы. В связи с высокими уровнями поступления и избирательного поглощения радиоактивного йода в щитовидной железе (особенно у детей) дозовые нагрузки на железу оказались весьма высокими (средние дозы у детей достигали десятков сГр) и во многих случаях индивидуальные дозы превышали пороги детерминированных эффектов. В то же время с учетом широкого диапазона «йодных» доз облучения больших когорт населения стало очевидным, что через несколько лет (по завершении минимального латентного периода) должна проявиться и опухолевая патология.
Благодаря своевременно организованному эпидемиологическому скринингу в России, на Украине и в Белоруссии уже спустя 3-4 года стали достоверно выявляться злокачественные опухоли щитовидной железы. В данном случае определяющую роль сыграли два фактора: крайне низкий уровень спонтанных раков щитовидной железы (особенно у детей: 1 случай на 1 млн человек в год) и высокие дозовые нагрузки на этот орган. Знание всех этих особенностей имеет принципиальное значение для планирования эпидемиологических исследований, посвященных выявлению стохастических последствий облучения у людей.
Наконец, о прогнозе облучения плода. В период начала формирования органов и тканей (3 нед после зачатия) облучение может вызвать глубокие пороки их развития. Эти эффекты, по современным данным, являются детерминированными. Их порог для человека, оцененный на основании опытов над животными, составляет 0,1 Гр. К категории детерминированных эффектов относят также тяжелую умственную отсталость у детей, облученных в утробе матери между 8 и 15 нед беременности. Эти данные, полученные всего на 13 японских детях, матери которых подверглись атомной бомбардировке, тем не менее, были тщательно изучены. Показано увеличение частоты появления детей с этой патологией, связанное с дозой облучения. При этом избыточная вероятность тяжелой умственной отсталости составила 0,4 на 1 Зв, т.е. при облучении срав- нительно большой дозой и ее большей мощности примерно у 40% живорожденных детей в последующем может развиться эта форма повреждения. При дозах порядка 0,2 Зв данная форма поражения не наблюдается (в Чернобыльской аварии такие дозы облучения плода у беременных практически не достигались.) В период после 3 нед от зачатия и до конца беременности, по-видимому, вследствие облучения могут возникать стохастические эффекты в виде увели-
чения вероятности фатальных злокачественных опухолей у живорожденных детей. Несмотря на то что данные по этой проблеме весьма неопределенны, МКРЗ, чтобы исключить любую недооценку подобного рода возможных эффектов облучения, принимает (без рекомендации численных значений) величину S, в несколько раз превышающую данный коэффициент для популяции в целом.
В табл. 9 представлены сводные данные об основных эффектах облучения человека.
Таблица 9. Основные клинические эффекты воздействия ионизирующей радиации на человека
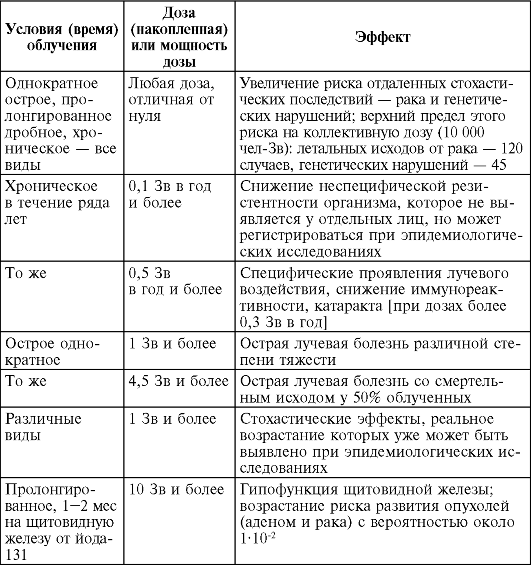
4.6. Концепция приемлемого риска
Принципиальные задачи всей системы радиационной безопасности и фундаментальные основы радиационной гигиены состоят в том, чтобы:
• предотвратить появление детерминированных эффектов путем удержания доз облучения ниже соответствующих порогов;
• использовать все разумные меры и мероприятия для того, чтобы снизить вероятность появления стохастических последствий облучения с учетом социальных и экономических факторов.
Эти важнейшие постулаты радиационной защиты и гигиены особенно очевидны в случае крупномасштабных радиационных аварий, сопровождающихся высвобождением радиоактивных материалов в окружающую среду, когда в орбиту воздействия ионизирующих излучений вовлекаются как профессиональные работники и члены аварийных бригад1, так и население, проживающее в непосредственной близости от аварийного объекта, в зоне наблюдения и за ее пределами.
В научно-практической политике вмешательства при радиационных авариях критериями недопущения уровней облучения людей, которые могут вызвать детерминированные эффекты, являются дозовые пороги таких эффектов. При этом для предотвращения соответствующих доз облучения и, следовательно, детерминированных эффектов проводимые вмешательства необязательно учитывают причиняемый экономический и социальный ущерб, так как речь идет о спасении жизни и здоровья людей. В то же время для снижения вероятности появления стохастических эффектов облучения (путем ограничения эффективных индивидуальных и коллективных доз) руководствуются иными принципами, в которых учет социально-экономических факторов обязателен. По- скольку в основе практического решения этой проблемы заложена современная философия радиационной безопасности и защиты, рассмотрим ее более подробно.
Выше неоднократно подчеркивалось, что в основе радиологических прогнозов и обоснования регламентов ионизирующего об-
1 После Чернобыльской катастрофы их стали называть ликвидаторами. Это не совсем точное определение. Последствия этой и других крупномасштабных радиационных аварий ликвидировать невозможно - их можно только ослабить, минимизировать.
лучения в диапазоне малых доз заложена рабочая гипотеза о беспороговом действии радиации. В отличие от пороговой концепции воздействия на людей многочисленных факторов антропогенной природы, когда критерием их безопасности является недопущение превышения установленного ориентировочно безопасного уровня веществ или предельно допустимой концентрации и т.п., вследствие чего, по самому определению, стохастические эффекты ис- ключаются, ситуация в области радиационной защиты принципиально иная.
Действительно, если постулируется сугубо научное положение о том, что любая доза облучения в принципе опасна (беспороговое действие), то общество и его социальные институты обязаны уста- новить и принять величину так называемого приемлемого риска (рисков) от дополнительного антропогенного радиационного воздействия на население и отдельных его членов. Иными словами, приемлемый риск есть не что иное, как своего рода компенсация потенциально возможного ущерба здоровью за те неоспоримые социальные выгоды и экономическую пользу для всего общества, которые обеспечиваются высокоэффективными, в данном случае атомными, технологиями. При этом в качестве решающей цели следует добиваться того, чтобы уменьшать риск облучения отдельных лиц и населения в целом при таких низких уровнях, какие могут быть разумно достигнуты с учетом экономических и соци- альных факторов. Этот принцип, как и в отношении других факторов нерадиационной природы, но оказывающих беспороговое действие, в нашей стране еще практически редко используется. Поэтому законодательная база, отражающая принципы регламентации вредных факторов и меры вмешательства при такого рода аварийных ситуациях, не создана.
В то же время концепция приемлемого риска принята во всех цивилизованных странах, носит достаточно универсальный харак- тер и используется во многих сферах человеческой деятельности. Действительно, следует признать, что современное общество без рисков является утопией. Все виды человеческой деятельности (или отсутствие деятельности) сопровождаются некоторым риском, хотя многие риски могут удерживаться на весьма низком уровне. Нередко для сравнительных оценок с целью доказать уровень приемлемости какого-либо неотвратимого риска (или рисков) их сопоставляют с «добровольными» рисками. Например, риск смер-
ти (или повреждений) при пользовании индивидуальным транспортом, являющийся по сути своей добровольным, сравнивают с рисками от антропогенных факторов: загрязнителями среды обитания химической и биологической природы или ионизирующими излучениями, особенно в связи с различного рода авариями на производствах, которые, как и стихийные бедствия, безусловно, относятся к категории неотвратимых рисков (подобного рода сравнения неправомерны, так как добровольные и неотвратимые риски относятся к различным философским категориям рисков).
В бывшем СССР концепция приемлемого риска была под запретом, впрочем, и само понятие технологического риска оказалось исключенным из общественной и научно-технической терминологии. К сожалению, представление о приемлемом риске активно не разделялось и многими учеными-медиками. В настоящее время понятие «приемлемый риск» постепенно входит в наш обиход. Тем не менее, эта позиция вызывает множество противоречий и кон- трастных трактовок. Многие люди, в том числе и некоторые медицинские работники, не воспринимают тот факт, что для большей части человеческой деятельности абсолютная безопасность невозможна. Поэтому применительно к излагаемой здесь теме вопрос не в том, каков безопасный уровень облучения, а в том, какой безопасный уровень достаточно безопасен.
Например, по поводу определения и установления пределов дозы облучения (в основу которых положена концепция приемлемого риска) возник целый ряд неверных представлений. Так, предел дозы широко, но ошибочно считают своего рода демаркационной линией между «безопасно» и «опасно». В то же время хорошо известно распространенное мнение, что любое радиационное воздействие всегда приводит к возникновению рака. Теперь мы знаем, что это не так, поскольку количественные данные по радиационным рискам, о которых шла речь выше, позволяют с научно обоснованных позиций оценивать эти вероятности. Важно иметь в виду, что концепция приемлемого риска служит исходной посылкой для социально-экономических оценок с целью принятия на их основе решений в интересах общественного здоровья и сохранения (улучшения) качества жизни населения.
Обоснование (установление) приемлемого уровня риска осуществляют путем взвешивания величины предотвращаемого с помощью мер вмешательства риска (в данном случае радиационного
риска) для здоровья населения и отдельных его членов с необходимыми для этого затратами общества (государства). Непременное требование при этом следующее: конечные результаты такого взвешивания (соотношения) ожидаемой пользы и наносимого вреда всегда должны быть больше единицы. Если, например, в результате радиационной аварии решается вопрос о переселении больших масс людей с загрязненных территорий на так называемые чистые или менее загрязненные, то при прочих равных условиях эта мера целесообразна или необходима лишь в том случае, если польза от этой акции, цель которой сводится к предотвращению определенной дозы облучения и, следовательно, к уменьшению конкретного уровня радиологического риска, перевешивает вред, наносимый здоровью и качеству жизни этих людей в результате переселения. Эта акция, как известно, может привести не только к нарушению привычного уклада жизни людей, но и к социальным потрясениям, психоэмоциональным стрессам и т.п. Именно из-за того, что властные структуры, некоторые политики и, к сожалению, ряд ученых, некомпетентных в данной области, игнорировали эти факторы (несмотря на предупреждения многих специалистов-медиков, хорошо знакомых с этой проблемой), социально-психологические последствия радиационной катастрофы в Чернобыле в контексте суммарного ущерба населению и обществу в целом оказались, в конечном счете, преобладающими.
Итак, общий принцип радиационной защиты состоит в том, что никакие меры не следует применять, если риск от дальнейшего облучения окажется меньше того риска, который будет следствием осуществления самой меры. Совершенно очевидно, что этот принцип в равной мере должен быть положен в основу решений в других областях технологической деятельности, будь то токсикант химической или биологической природы, к которым приложима концепция беспорогового действия. Вместе с тем упрощенный подход к подобного рода сложнейшему анализу чреват значительными социальными издержками и экономическими потерями, которые могут принести обществу и прежде всего общественному здоровью больше вреда, чем пользы.
Следует, однако, иметь в виду, что если логика такого подхода очевидна, то конкретный качественный и особенно количественный анализ многочисленных и разнообразных факторов, подлежащих учету, в ряде случаев остается, к сожалению, за границами
возможностей взвешивания пользы и ущерба. Благие, на первый взгляд, попытки предотвращения весьма низкого уровня конкрет- ного вида риска на деле могут нанести ничем не оправданный ущерб для экономики страны и, следовательно, для всего общества, так как ресурсы или затраты должны изыматься из единого общественного достояния. При этом, как это часто происходит, в результате усилий, затрачиваемых на максимальное предотвращение данного риска (на фоне их множества), может остаться без должного внимания, или, проще говоря, дискриминироваться значимость другого вида риска, объективно определяющего гораздо больший ущерб общественному здоровью и отдельному индивидууму. Отсюда очевидна необходимость общего подхода к установлению экономически и социально разумной величины оправданного реальной обстановкой конкретного вида риска. Как только что подчеркивалось, принятие решений в этих случаях без учета многочисленных обстоятельств прежде всего нравственно-этического и психологического характера крайне затруднительно, особенно без учета общественного мнения, воспринимающего различные виды рисков по-разному, неоднозначно.
Наглядный пример тому - особое отношение к опасности ионизирующей радиации в сравнении, скажем, с не менее, а в ряде случаев с более опасными, но «привычными» некоторыми химическими агентами, обладающими, как известно, более выраженным канцерогенным и генотоксическим свойством, чем ионизирующая радиация. Поэтому важно осознавать (в первую очередь, гигиенистам), что сосредоточение внимания лишь на одной из многих опасностей, стоящих перед человечеством, может вызвать излишнюю тревогу. С ионизирующим излучением надо обращаться скорее с осторожностью, нежели с боязнью, и риск от его воздействия оценивать в сравнении с другими видами риска. Из этого отнюдь не следуют какие-либо послабления в оценках и тем более игнорирование радиационной опасности. Такой подход с гигиенических позиций совершенно недопустим и категорически неприемлем.
Если бы все биологические эффекты облучения имели детерминированную природу, т.е. являлись пороговыми, то обоснование и установление дозовых пределов облучения стали бы сугубо научной задачей. Наличие стохастических (вероятностных) эффектов облучения, исходя из признания их беспороговой природы, резко усложняет процедуру обоснования пределов доз (которые
напрямую зависят от численного значения вероятности риска), так как в данном случае речь идет о выборе и согласовании величины приемлемого для общества риска. Поэтому практическую важность имеет не факт беспороговости биологического действия ионизирующих излучений (или иных антропогенных агентов, подпадающих под эту категорию), а то, насколько значима, приемлема принимаемая для общества и его членов частота стохастических последствий облучения.
Очевидно, что эта значимость должна определяться, с одной стороны, медико-биологическими и гигиеническими соображениями, многими нравственно-этическими требованиями, а с другой - экономическими и социальными аспектами. В ряде экстремальных ситуаций, прежде всего в случаях радиационных аварий, эти требования и соображения вступают в явное противоречие. Поэтому всегда следует помнить, что этот выбор базируется не столько на научных данных, сколько на некоем компромиссе, балансе раз- личных интересов.
Один из таких подходов, который принят МКРЗ, заключается в том, что для условий регламентной (безаварийной) работы атомных технологий, использования источников ионизирующего излучения уровни риски от этой деятельности должны быть не выше тех рисков, которые можно трактовать как неприемлемые в нормальных условиях трудовой деятельности, а для населения в целом - как неприемлемые в нормальных условиях жизни. Что это означает? Применительно к профессиональным работникам, с целью обоснования пределов доз облучения, рекомендовано принять годовую вероятность смерти, связанную с их профессиональной деятельностью, такой же, как и в «благополучных» отраслях промышленности. Эта вероятность, как известно, равна 10-3. Иными словами, рассчитанная годовая частота смертельных исходов (обусловленных в основном злокачественными опухолями, которые могут быть индуцированы в результате профессионального облучения) в любом случае не должна превышать частоту смертельных исходов, связанную с профессиональной деятельностью людей в тех отраслях промышленности, в которых уровень безопасности отвечает высоким требованиям. Соответственно для населения с целью обоснования предела техногенного облучения (в результате функционирования технологий, связанных с радиоактивными материалами и другими источниками излучения) была
принята величина приемлемого риска (усредненного за всю жизнь годового риска смерти) 510-5 (уровень пренебрежимо малого риска составляет 10-6).
Именно эти фундаментальные принципы легли в основу регламентации ионизирующих излучений. Подробная информация о ныне действующих в Российской Федерации регламентах облучения, в том числе об уровнях вмешательства при радиационных авариях, представлена в главе 5.
Контрольные вопросы
1. Сформулируйте понятие «детерминированный эффект биологического действия ионизирующего излучения».
2. Сформулируйте понятие «стохастический эффект биологического действия ионизирующего излучения».
3. Каковы пороги детерминированных эффектов у взрослых людей в семенниках и яичниках?
4. Каков порог детерминированного эффекта в красном костном мозге?
5. Каков порог детерминированного эффекта в хрусталике глаза?
6. Изложите сущность гипотезы беспороговой концепции эффекта биологического действия ионизирующего излучения.
7. Сформулируйте понятие «радиогенный абсолютный риск».
8. Сформулируйте понятие «радиогенный относительный риск».