Химиотерапевтические препараты. Антибиотики.Антибиотики. История химиотерапии инфекций. История терапии инфекционных болезней. Эвристический период. Проблема
лечения инфекционных заболеваний имеет такую же долгую
историю, как и изучение самих болезней. С точки зрения современного человека, первые попытки в этом направлении были наивны и примитивны, хотя некоторые из них и не были лишены здравого смысла (например, прижигание ран или изоляция больных). Опыт, накопленный тяжёлым путём проб и ошибок, вооружил знахарей знаниями целебных свойств вытяжек из трав и тканей животных, а также различных минералов, Изготовление настоев и отваров из растительного сырья было широко распространено в античном мире, их пропагандировал
Клавдий Галён (отсюда и термины «галеновы», «галеники»).

В средневековье репутацию
препаратов из лекарственного сырья значительно «подмочили» всевозможные зелья, «изыскания» алхимиков и, конечно, убеждённость в неизлечимости «кар Господних». В этой связи следует упомянуть верование в целительное действие рук «помазанников Божьих», через прикосновение царствующей особы (touche royal) проходили толпы больных. Например, Людовик XIV возложил руки на 10 000 больных, а Карл II Стюарт — на 90 000. По мере понимания врачами правильности концепции contagiiun vivum лечение болезней принимало всё более «этиотропный» характер. Основателем химиотерапии с полным правом должен считаться Парацёльс, названный А.И. Гёрценым «первым профессором химии от сотворения мира». Парацёльс не без успеха применял для лечения инфекций человека и животных различные неорганические вещества (например, соли ртути и мышьяка). После открытия Нового Света стало известно о свойствах коры дерева «кина-кина», использовавшейся индейцами для лечения малярии. Популярности этого средства способствовало чудесное излечение жены вице-короля Америки, графини Цинхон, и в Европу кора прибыла уже под названием «порошок графини» (polvo de la condesa), a позднее её имя присвоили и самому хинному дереву (Cinchona). Такую же славу снискало и другое заокеанское средство — ипекакуана, применявшееся индейцами для лечения «кровавых» поносов.
Становление химиотерапии инфекционных болезней (инфекций). Эрлих ( красители ). Производные мышьяка (сальварсан, атоксил). Теория волшебной пули. Честь разработки адекватных подходов к
лечению инфекционных болезней принадлежит нашему соотечественнику: Дмитрий Леонидович
Романовский в 1890 г. указал, что «истинна специфичность действия на самую сущность болезни, на производящего её паразита» заключается «в разрушительном действии на паразита» и для каждой ин фекции должно быть найдено «вещество, которое при введении в заболевший организм окажет наименьший вред последнему вызовет наибольшее деструктивное действие в патогенном aгeнте». История современных антимикробных средств началасьоткрытия Паулем
Эрлихом способности анилиновых
красителей убивать трипаносомы.

Производные мышьяка (сальварсан, атоксил)
Пауль Эрлих и его сотрудник Киёси Шига испытал: более 500 красителей (от бриллиантового зелёного до генциано вого фиолетового) и обнаружили один, способный защищать о гибели мышей, заражённых трипаносомами. Авторы так его и назвали — трипановый красный, но вскоре оказалось, что препарат не действует на микроорганизмы, укрывшиеся в тканях. Дальнейшие их поиски выявили трипановый синий и другие красители, обладавшие бактерицидным эффектом in vitro, но не in vivo. Д.Л. Романовский Производные мышьяка. Неудача с красителями не остановила
Эрлиха, им овладела другая идея — излечивать сифилис.
К этому времени медицина обогатилась новым противотрипаносомозным средством
атоксилом (органическое производное мышьяка). Атоксил с успехом применил Роберт Кох для лечения сонной болезни, но через несколько месяцев выяснилось страшное побочное действие препарата — дегенерация зрительного нерва.
Эрлиха это не смутило, так как атоксил эффективно применяли для лечения малокровия у кур, возбудитель которого был поразительно похож на возбудителя сифилиса. Под своим любимым девизом «не спеша и без устали» (ohne Hast, ohne Rast) Эрлих с легендарным упорством испытывал всё новые и новые производные атоксила. Успех ждал исследователя на 606-м соединении. Он назвал его
сальварсаном (спасающим), и, действительно, препарат спас жизни тысячам больным различными спирохетозами (сифилис, фрамбезия и др.).
Теория волшебной пули Основываясь на собственных результатах изучения AT, «повреждающих» микробы и их токсины, но не собственные клетки организма,
Эрлих разработал постулат о «
волшебной пуле» (die Zauberkugel) — веществе с минимальной органотропностью и максимальной паразитотропностью. Этот постулат стал основным принципом поиска новых
химиотерапевтических средств.
Антибиотики. Пастер. История антибиотиков. Мечников. Флеминг. Пенициллин. Ермольева. При изучении сибирской язвы
Пастер заметил, что заражение животного смесью возбудителя и других бактерий часто мешает развитию заболевания, что позволило ему предположить, что конкуренция между микробами может блокировать патогенные свойства возбудителя. Впервые идею о возможности применения существующего антагонизма между микробами для лечебных целей высказал И.И.
Мечников.

Позднее было показано, что такими свойствами обладают не только микробы, но и их стерилизованные продукты. Эти находки положили начало развитию двух направлений в подходе к лечению инфекций: применение стерилизованных микробных культур (чему особый толчок дало открытие и применение туберкулина Коха) и особых ингибирующих агентов, продуцируемых микробами. В последующем было установлено, что отдельные почвенные спорообразующие бактерии выделяют вещества, убивающие бактерии других видов. В 70-х годах XIX в. русские врачи В.А. Маннасёин и А.Г. Полотебнов установили бактерицидные свойства плесневых грибов и эффективность экстрактов их культур при лечении инфицированных язв и ран. Для этого направления ведущее значение имело открытие А.
Флемингом пенициллинов (1928). Следствием этой знаменитой «случайности» (в открытую чашку Петри со стафилококками нечаянно попала плесень P. notatum, образовавшая зону задержки роста) явилось получение чистого пенициллина (X. Флори и Э. Чейн, 1940) и начало новой эры в химиотерапии.
Первый
отечественный пенициллин (
крустозип) был получен З.В.
Ермольевой из P. crustosum в 1942 г. Безусловно, без предшествующих многолетних исследований, в том числе и отечественных учёных, эта «случайность» вряд ли была столь плодотворной. Более того, в 1985 г. в архивах Лионского университета была найдена диссертация рано скончавшегося студента-медика (Эрнест Августин Дюшене), за сорок лет до Флеминга подробно характеризующая открытый им препарат из плесени P. notatum, активный против многих патогенных бактерий.
Принципы терапии инфекционных болезней. Принципы химиотерапии инфекций. Принцип физиологической имитации. Критерии эффективности химиотерапии. С общих позиций основу действия любого антимикробного вещества составляет
принцип физиологической имитации, согласно которому действие любого препарата на патоген обусловлено соответствием конфигурации молекул этого вещества или его частей с конфигурацией молекул соединений, участвующих в физиологической регуляции процессов, специфичных для возбудителя. В настоящее время известны несколько десятков тысяч агентов, подавляющих жизнедеятельность возбудителей инфекционных заболеваний, но фармакологические свойства лишь нескольких сотен соединений позволяют применять их в качестве ЛС. Эффективность любого препарата опосредует сумма слагаемых, обеспечивающих его терапевтическое действие: сохранение стабильности структуры при введении в организм либо образование активного метаболита, скорость абсорбции и элиминации, способность к проникновению в ткани и биологические жидкости, избирательность действия, чувствительность микроорганизмов.

Критерии эффективности химиотерапии При оценке
эффективности антимикробных препаратов к основным критериям относят
терапевтический индекс,
достижимую концентрацию в сыворотке крови,
спектр активности.
Терапевтический индекс — частное от деления минимальной токсической дозы соединения на минимальную дозу, проявляющую антимикробную активность. Более высокие значения терапевтического индекса соответствуют большей эффективности препарата.
Достижимая концентрация в сыворотке крови зависит от массы тела пациента, дозы препарата, пути и схемы введения, а также скорости его выведения из организма. В настоящее время этот критерий не считают абсолютным, так как содержание ряда препаратов в тканях может намного превышать их концентрацию в сыворотке крови.
Спектр активности антимикробных средств. Эффекты антимикробных препаратов. Антимикробные агенты
действуют только на вегетирующие клетки, но не на споры или цисты.
Для реализации своей биологической активности
антимикробное средство должно:
• проникнуть в микробную клетку;
• связаться с соответствующей мишенью и модифицировать её;
• сохранить при этом свою структуру либо образовать активный метаболит.
Выбор препарата для химиотерапии определяет спектр его активности и чувствительность к нему микроорганизмов. Препараты со специфической активностью включают
антибактериальные,
противогрибковые,
антипротозоиные и
противовирусные препараты.
•
Препараты узкого спектра активны в отношении небольших групп микроорганизмов.
•
Препараты широкого спектра активны в отношении больших групп микроорганизмов.

Эффекты антимикробных препаратов
Антибактериальные,
противогрибковые и
антипротозойные препараты тормозят рост либо вызывают гибель микроорганизмов. Противовирусные препараты ингибируют репликацию вирусов, блокируя их адсорбцию на чувствительных клетках, высвобождение вирусного генома либо подавляя вирусспецифические синтезы. Активность химиотерапевтических препаратов выражают в единицах действия (ЕД) или в микрограммах (мкг). ,.
•
Антибактериальные препараты проявляют бактериостатическую и/или бактерицидную активность.
•
Противогрибковые препараты проявляют фунгистатическую и /или фунгицидную активность.
•
Противовирусные препараты проявляют виростатическую и/или вирулицидную активность.
Антибактериальные средства. Антибактериальные препараты. Антибиотики. Классификация антибиотиков. К
антибактериальным химиотерапевтическим средствам относят антибиотики, сульфаниламидные препараты, синтетические антибактериальные средства различного химического строения, противосифилитические и противотуберкулёзные средства.
Структуры бактериальной клетки, служащие мишенями для основных антибактериальных химиотерапевтических препаратов, представлены на рис. 9-1.
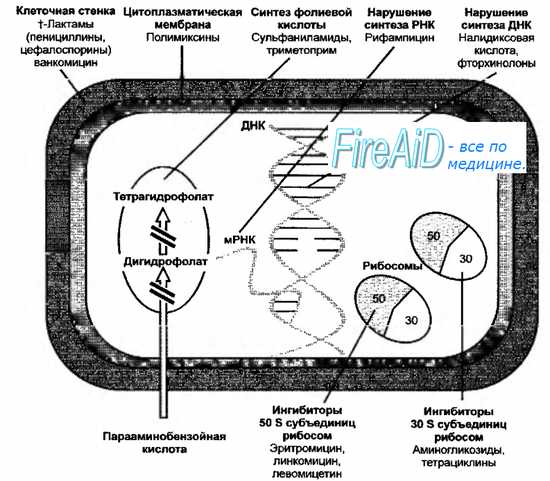 Рис. 9-1. Мишени основных химиотерапевтических препаратов в бактериальной клетке (пояснения в тексте).
Рис. 9-1. Мишени основных химиотерапевтических препаратов в бактериальной клетке (пояснения в тексте). Антибиотики Ранее было указано, что различные организмы, реализуя антагонистические взаимодействия в биоценозах, выделяют БАВ (
антибиотики, бактериоцины), подавляющие жизнедеятельность своих конкурентов.
Антибиотики [от греч. anti- против, + biosis, жизнь] — химические вещества биологического происхождения, избирательно тормозящие рост и размножение или убивающие микроорганизмы.
Классификация антибиотиков
Антибиотики классифицируют и характеризуют по их происхождению, химической структуре, механизму действия, спектру активности, частоте развития лекарственной устойчивости и т.д.
Тип продуцента антибиотика. В соответствии с типом продуцента выделяют
антибиотики, синтезируемые грибами (например, бензилпенициллин, гризеофульвин, цефалоспорины), актиномицетами (например, стрептомицин, эритромицин) и бактериями (например, полимиксины).
Способы получения антибиотиков:
•
биосинтетические (природные) антибиотики, их продуцентами выступают специальные штаммы микроорганизмов;
•
полусинтетические антибиотики, получаемые химическим соединением природного антибиотика, точнее его «ядра», с различными химическими радикалами (при этом возможно направленное создание препаратов с заданными свойствами);
•
синтетические антибиотики, источник их получения — химический синтез, возможный после определения структуры природных препаратов (например, синтетическим путём получают левомицетин). Механизм действия. Антибиотики подавляют различные процессы: синтез компонентов клеточной стенки, функции ЦПМ, синтез белка, транскрипцию и синтез нуклеиновых кислот микроорганизмов.
Механизмы формирования лекарственной устойчивости у бактерий. Ферментативная инактивация лекарственных средств ( лс ). Лактамазы. Ацетилтрансферазы, фосфорилазы, нуклеотидазы бактерий. Защиту бактерий от действия
лекарственных средств ( лс ) обеспечивает комплекс факторов, основными из которых считают ферментативную инактивацию препаратов и удаление либо маскировку рецепторов для них. Гены, кодирующие синтез продуктов, обусловливающих лекарственную устойчивость, могут быть хромосомными либо включенными в состав R-плазмид, передаваемых в бактериальной популяции.
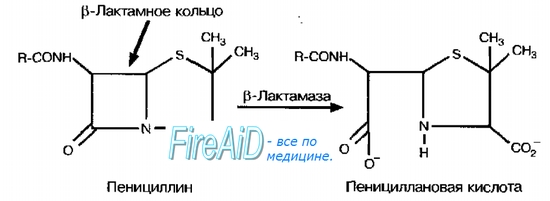
Ферментативная инактивация лекарственных средств ( лс )
Ферментативная инактивация лекарственных средств ( лс ) реализуется внеклеточно и внутриклеточно. Изменения активности ферментов связаны с мутациями генов, кодирующих их структуру, либо с увеличением образования числа копий генов, кодирующих его (амплификация).
В-Лактамазы. Механизм действия обусловлен разрушением b-лактамного кольца в молекулах антибиотиков. Стафилококки секретируют ферменты после попадания препарата в окружающую их среду, что приводит к снижению его концентрации. Для них характерна популяционная резистентность — большая доза инфекционного агента вызывает более интенсивное развитие устойчивости. Синтез ферментов кодируют индуцибельные гены, то есть b-лактамазы более интенсивно образуются в присутствии препарата. Более тонкая клеточная стенка грамотрицательных бактерий позволяет антибиотикам проникать внутрь клетки, где они взаимодействуют с b-
лактамазами в периплазматическом пространстве.
Грамотрицательные бактерии (эшерихии, синегнойная палочка) проявляют более выраженную резистентность (по сравнению с грамположительными бактериями), не зависящую от дозы инфекционного агента. По специфичности действия b-лактамазы, продуцируемые грамотрицательными бактериями, разделяют на несколько групп (взаимодействующие только с пенициллинами, или цефалоспоринами, или и с обеими группами антибиотиков). У грамотрицательных бактерий синтез b-
лактамаз происходит перманентно, вне зависимости от наличия JIC.
Ацетилтрансферазы, фосфорилазы и нуклеотидазы стрептококков, стафилококков, энтеробактерий и синегнойной палочки модифицируют аминогликозиды, препятствуя их связыванию с рибосомами (механизм действия хлорамфеникол ацетилтрансферазы, продуцируемой стафилококками и энтеробактериями аналогичен действию ацетилтрансфераз аминогликозидов). Ферменты расположены на поверхности ЦПМ и инактивируют лишь часть препарата, проникшего в клетку, так что концентрация препарата в биологических жидкостях снижается незначительно (не более чем на 0,5%).
Устойчивость микроорганизмов к препаратам. Химиорезистентность у бактерий. Устойчивость несвязанная с наследственностью возбудителей. Известно
два типа устойчивости микроорганизмов к антимикробным средствам — естественная (природная) и приобретённая.
Естественная резистентность относится к видовым признакам микроба. Она в основном связана с отсутствием мишеней на клеточной стенке либо непроницаемостью последней для определённых ЛС.
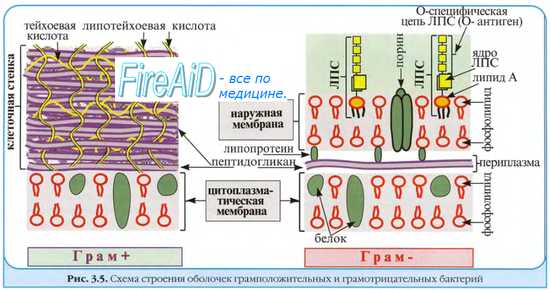
Химиорезистентность у бактерий К основным
механизмам резистентности к действию антибактериальных средств относят способность к синтезу инактивирующих ферментов и модификация мишеней, с которыми взаимодействует лекарственный препарат. Устойчивость к фармакологическим воздействиям обусловливают естественные (внутренние) и приобретённые факторы.
Устойчивость несвязанная с наследственностью возбудителей
Изменение метаболической активности клеток-мишеней. Большинство антибактериальных средств эффективно подавляет жизнедеятельность лишь активно растущих клеток. Значительная часть возбудителей, пребывая в латентной стадии, способна выживать в тканях в течение многих лет, оставаясь при этом резистентными к действию ЛС (например, микобактерии туберкулёза).
Уменьшение количества мишеней для ЛС. Проводимая химиотерапия способна уменьшать количество мишеней для действия препарата. Например, под действием пенициллинов отдельные бактерии способны трансформироваться в L-формы, лишённые клеточной стенки и поэтому резистентные к действию антибиотиков с подобным механизмом действия.
Метод серийных разведений в плотных средах для определения чувствительности к антибиотикам ( антибактериальным средствам ). Диффузионные методы. Метод дисков. Метод серийных разведений в плотных средах во многом аналогичен методу разведений в жидких средах, но определение МБК требует более сложных манипуляций. Готовят двойные серийные разведения препарата от 1:10 000 до 1:320 000, затем вносят по 1 мл каждого разведения в пробирки, содержащие по 4 мл (или 9 мл) охлаждённого до 45 °С агара. Процедуру проводят одной пипеткой с перенесением препарата от меньшей концентрации к большей.
Содержимое пробирок можно быстро внести в чашки Петри, либо пробирки «скашивают» до застывания агара. Затем агар засевают исследуемой стандартизированной тест-культурой (петлёй или специальным дозатором, засевающим чашку 36 видами различных микроорганизмов) и инкубируют 18-20 ч при 37 "С. После инкубации определяют МИК по отсутствию роста на чашках (пробирках), содержащих наименьшие концентрации препарата.
Диффузионные методы. Метод дисков.
Диффузионные методы менее точны, чем методы разведений, но более просты в исполнении и позволяют определять чувствительность к нескольким ЛС одновременно. Поэтому их чаще применяют на практике. Исходный метод. Чашки Петри заполняют питательной средой, соответствующей пищевым потребностям возбудителя, слоем в 4-5 мм.

После застывания агар подсушивают в термостате при 37 "С в течение 20 мин.
Посев тест-культуры можно осуществлять внесением в полуостывший агар, но чаще микробную взвесь наслаивают на агар. После равномерного распределения по поверхности излишки взвеси удаляют, а чашки подсушивают в термостате. В агаре пробивают лунки и в каждую вносят по 0,1 мл раствора исследуемых препаратов, после чего инкубируют 18 ч при 37 °С (срок инкубации может варьировать в зависимости от скорости роста микроорганизма).
Активность учитывают, измеряя диаметр зоны подавления роста для каждого препарата.
Метод дисков. В настоящее время вместо классического (исходного) метода повсеместно применяют
модификацию, предложенную
Кирби и
Бауэром и признанную стандартным тестом. После посева тест-культуры на агар наносят диски из фильтровальной бумаги, пропитанные различными антимикробными препаратами (используют коммерческие образцы, содержащие известные концентрации). После инкубации при 37 "С в течение времени, необходимого для роста выделенного возбудителя, проводят определение диаметра зоны торможения роста. Размеры зон, полученные в опыте, сравнивают с величинами зон задержки роста, указанными в инструкциях, прилагаемых к дискам, после чего выделенные микроорганизмы относят к чувствительным, умеренно чувствительным или резистентным.
Химиорезистентность у вирусов. Резистентность вирусов к терапии ( к лекарственным средствам ). Устойчивость вирусов к ацикловиру, ганцикловиру, зидовудину, невирапину, рибавирину. Устойчивость вирусов чаще развивается при многократном применении препаратов и передаётся последующим поколениям. Известно, что практически ко всем, заведомо немногочисленным противовирусным средствам, можно экспериментально получить устойчивые штаммы возбудителей. В основе изменения
наследственных свойств вирусов лежат два различных процесса — мутация и селекция; для каждого из них важную роль играет внешняя среда как индуктор мутаций и как селективный фактор. Принимая во внимание тот факт, что спонтанные мутации вирусов позвоночных животных возникают с частотой 10
-5-10
-6, появление природных мутантов — достаточно редкое явление, и первоочередная роль в
формировании резистентных штаммов принадлежит процессам селекции.
Выделяют
два основных пути преодоления устойчивости к химиопрепаратам: комбинированное применение препаратов с различными механизмами действия и использование ЛС, воздействующих на ранние этапы репродукции, что резко снижает вероятность проявления резистентности. В клинических условиях зарегистрированы случаи устойчивости к следующим препаратам.
Ацикловир. Выделены устойчивые штаммы герпесвирусов, малопатогенные для лиц с нормальным иммунным статусом, но представляющие серьёзную угрозу для больных с
иммунодефицитами, так как такие штаммы способны вызывать диссеминированные поражения, включая поражения ЦНС.
Механизм резистентности обусловлен отсутствием или модификациями структуры тимидин киназы; реже устойчивость опосредуют мутации генов, кодирующих структуру ДНК-полимеразу, что делает её невосприимчивой к эффектам прочих ингибиторов фермента.
 Ганцикловир
Ганцикловир. Устойчивость обусловлена снижением уровня фоефорилирования ЛС в заражённых клетках в связи с изменениями структуры вирусной фосфотрансферазы и ДНК-полимеразы.
Зидовудин. Наблюдают почти 100% резистентность штаммов ВИЧ, выделенных от пациентов, получавших препарат более 6 мес, что в некоторой степени парадоксально, так как известны случаи длительного выживания больных со СПИДом, получавших препарат более 15 мес. Устойчивость обусловлена мутациями генов, кодирующих структуру ревертазы, что приводит к снижению аффинитета фермента к ЛС, но не способности транскрибировать РНК вируса.
Невирапин. Устойчивость развивается довольно быстро, иногда через несколько недель после начала химиотерапии; основные механизмы обусловлены точечными мутациями, вызывающими изменения структуры взаимодействующего с ЛС фрагмента молекулы обратной транскриптазы.
Цитозинарабинозид и рибавирин. В отличие от прочих известных противовирусных препаратов, до настоящего времени не выявлены штаммы, резистентные к цитозинарабинозиду и рибавирину.
Побочные эффекты антибиотикотерапии. Побочные эффекты антибиотиков. Вредность антибиотиков. Токсические реакции от применения антибиотиков. Эффективность применения антимикробных препаратов различных классов ограничивают их многочисленные
побочные эффекты (
токсические и аллергические
реакции, дисбактериозы и т.д.).

Вредность антибиотиков. Токсические реакции от применения антибиотиков
Характер побочных явлений зависит от органотропности препарата, его дозировок и способов введения.
Поражения паренхимы печени от применения антибиотиков наиболее часто вызывают тетрациклины, рифампицин и левомицетин. Неграмотное применение последнего может привести к развитию своеобразного поражения, известного как синдром «серого ребёнка». Препарат метаболизирует в печени, образуя глюкурониды. При врождённой недостаточности глюкуронил трансферазы (например, при синдромах Жильбера- Майленграхта и Криглера-Найяра) левомицетин накапливается в крови в токсических концентрациях, развиваются общая слабость, рвота, появляется серый оттенок кожных покровов, боли в сердце, отёки и гепатомегалия, возможен летальный исход.
Поражения почек от применения антибиотиков нередко наблюдают при назначении амфотерицина В, связывающегося с холестерином мембран эпителия почечных канальцев. Нефротоксическое действие могут также оказать линкомицин, аминогликозиды (последние также обладают ототоксичностью вследствие влияния на VIII пару черепных нервов).
Поражения органов кроветворения от применения антибиотиков. Нарушения функций костного мозга (анемии, лейко- и тромбоцитопений, вплоть до апластического криза) относят к наиболее тяжёлым
осложнениям антибиотикотерапии. Подобные поражения способен вызывать левомицетин. В ряде случаев проявления апластической анемии возникают даже после однократного приёма препарата.
Дисбактериозы ( дисбиозы ) при антибиотикотерапии. Аллергизирующее действие антибиотиков. Иммунодепрессивные эффекты антибиотиков. Дисбактериозы (
дисбиозы) обычно развиваются после применения антибиотиков широкого спектра, подавляющих жизнь многих бактерий, в том числе и непатогенных. Б результате конкурентный баланс в микробных ценозах резко нарушается, что даёт устойчивым видам возможность колонизировать свободные участки. Этими химиорезистентными бактериями обычно являются условно-патогенные виды. Их чрезмерное размножение может приводить к развитию вторичных эндогенных инфекций. Наиболее часто наблюдают дисбактериозы кишечника, вызванные приёмом тетрациклинов внутрь. Для профилактики этого осложнения следует назначать препараты узкого спектра, контролировать вероятность избыточного роста грибов и широко использовать эубиотики.
Аллергизирующее действие антибиотиков
Применение антибиотиков может вызывать
аллергические реакции, их спектр варьирует от различных кожных высыпаний до анафилактического шока. Наиболее выраженным аллергизирующим действием обладают природные антибиотики, особенно пенициллимы. В значительной степени это связано с широким распространением грибов-продуцентов в окружающей среде и высокой сенсибилизирующей активностью их продуктов. В подобных ситуациях применение антибиотиков играет роль введения разрешающей дозы для развития аллергической реакции. Степень её проявления прямо пропорциональна степени сенсибилизации организма.
Иммунодепрессивные эффекты антибиотиков
Многие антибиотики способны снижать функциональную активность защитных факторов организма. Во многом эти свойства обусловлены цитостатическим эффектом препаратов на иммунокомпетентные клетки. Поскольку эукариотические клетки практически лишены специфичных мишеней для ЛС, это действие носит неспецифический характер и направлено на самые различные клеточные популяции. Среди применяемых антибиотиков наиболее выраженным иммунодепрессивным эффектом обладают препараты, способные подавлять функции органов кроветворения, например левомицетин. Особо следует упомянуть антибиотик циклоспорин, первоначально разработанный как противогрибковое средство, но проявивший выраженное ингибирующее действие на развитие клеточных цитотоксических реакций. Это свойство побудило использовать его при пересадках органов в качестве препарата, подавляющего отторжение трансплантата.