Лекция 12СИНДРОМДИССЕМИНИРОВАННОГО ВНУТРИСОСУДИСТОГОСВЕРТЫВАНИЯ (ДВС-СИНДРОМ)•
Синдром диссеминированного внутрисосудистого свертывания (ДВС-синдром, коагулопатия потребления, дефибринация, тромбогеморрагический синдром, внутрисосудистое микросвертывание и др.) характеризуется активацией факторов свертывания крови, которое приводит к появлению многочисленных тромбов в сосудах микроциркуляции всего организма; при этом расходование факторов свертывания и обусловленная этим активация фибринолиза обычно сопровождаются массивным кровотечением (кровоизлияниями).
Термин "ДВС-синдром" был предложен в 1950 г. американским патологом D.McKay, который при вскрытии трупа женщины, погибшей на фоне развивающейся отслойки плаценты от множественных массивных геморрагии, обнаружил многочисленные тромбы, обтурировавшие главным образом мелкие
и мельчайшие сосуды. В дальнейшем оказалось, что ДВС-синдром может развиваться при очень многих заболеваниях и состояниях.
Наиболее опасны в плане развития ДВС-синдрома следующие состояния:
▲инфекционно-септические, особенно вызванные грамотрицательными микроорганизмами, менингококкемия и стафилококковый сепсис с очаговой деструкцией легких, поражениями кожи;
▲ все виды шока — анафилактический, септический, травматический, кардиогенный, ожоговый, геморрагический; синдром длительного раздавливания и др.;
▲ трансфузии несовместимой крови, кризы гемолитических анемий, отравления гемолитическими ядами и др.;
▲ злокачественные новообразования различной локализации, особенно рак легкого, поджелудочной железы, предстательной железы и желудка;
▲ обширные травмы и травматичные хирургические вмешательства;
▲ акушерская патология; преждевременная отслойка плаценты, предлежание и разрывы плаценты, эмболия околоплодными водами, атонические маточные кровотечения, антенатальная гибель плода, плодоразрушающие операции, кесарево сечение, пузырный занос, тяжелый поздний токсикоз беременных, или гестоз, эклампсия);
▲ трансплантация органов и тканей; сосудистое и клапанное протезирование; использование аппаратов, в которых осуществляется контакт с кровью и последующее ее возвращение в организм (аппарат искусственного кровообращения — АИК, "искусственная почка");
▲сердечно-сосудистая патология: врожденные "синие" пороки сердца, крупноочаговый инфаркт миокарда, сердечная недостаточность и др.;
▲ аутоиммунные и иммунокомплексные болезни: системная красная волчанка, геморрагический васкулит Шенлейна — Геноха, острый гломерулонефрит и др.;
▲ аллергические реакции лекарственного генеза;
▲ лекарственные ятрогенные формы: лечение препаратами, вызывающими агрегацию тромбоцитов, провоцирующими свертывание крови и снижающие ее противосвертывающий и фибринолитический потенциал;
▲ отравления гемокоагулирующими змеиными ядами.
Распространенность ДВС-синдрома настолько велика, что трудно назвать область практической медицины, в которой бы он не встречался.
ПРИЧИНЫИМЕХАНИЗМЫРАЗВИТИЯПричины. Причины, "запускающие" механизм ДВС крови, неоднозначны. Они включают такие факторы, как амниотическая жидкость, гемолизат эритроцитов, эллаговая кислота, ацидоз, эндотоксины, высокомолекулярные декстраны, протеолитические ферменты, АДФ, адреналин, иммунные комплексы, некоторые липидные фракции, нарушение кровотока вследствие уменьшения сердечного выброса и артериальной вазоконстрикции, дилатации капилляров и венул, увеличения вязкости крови и многие другие.
Патогенез. Многообразие ДВС-синдрома более полно раскрывают механизмы его развития. В зависимости от особенностей патогенеза выделяют следующие виды ДВС-синдрома:
▲ с преобладанием прокоагулянтного звена гемостаза;
▲ с преобладанием сосудисто-тромбоцитарного звена гемостаза;
▲с одинаковой активностью прокоагулянтного и сосудисто-тромбоцитарного звеньев.
ДВС-синдром с преобладающей активностью прокоагулянтного звена гемостаза развивается вследствие массивного поступления в кровоток прокоагулянтов: попадание в кровеносное русло тромбопластических веществ при преждевременной отслойке нормально расположенной плаценты, внутриутробной
гибели плода, эмболии околоплодными водами, метастазирующем раке, внутрисосудистом гемолизе, обширной травме, синдроме раздавливания. При этом происходит активация прежде всего внешней системы свертывания крови (см. лекцию 9). В эксперименте этот вариант ДВС воспроизводится при инфузии тромбина, тканевого тромбопластина.
ДВС-синдром с преобладающей активностью сосудисто-тромбоцитарного звена гемостаза следует рассматривать как следствие генерализованного поражения стенок сосудов и/или первичного воздействия на тромбоциты. Он встречается при различных инфекционных (вирусные, бактериальные, риккетсиозные) заболеваниях, аутоиммунных болезнях, реакции отторжения трансплантата. Предполагают, что при инфекционных заболеваниях внутрисосудистое свертывание возникает под воздействием эндотоксинов, комплексов антиген — антитело, а также в результате непосредственного повреждения эндотелия сосудов инфекционными агентами. В эксперименте этот вариант ДВС может быть показан на модели генерализованного феномена Санарелли — Шварцмана. При этом обнажаются субэндотелиальные структуры, активирующие тромбоциты и внутреннюю систему свертывания крови через контактный фактор XII (фактор Хагемана). Последний активирует калликреин-кининовую систему, фибринолиз, систему комплемента.
ДВС-синдром с одинаковой активностью прокоагулянтного и сосудисто-тромбоцитарного звеньев (формы смешанного патогенеза) сопровождает экстракорпоральное кровообращение, ожоги, острый лейкоз, болезни крови (моноклоновые парапротеинемии, эритремии, тромбоцитемии), шок.
Способствует развитию ДВС повреждение или блокада системы мононуклеарных фагоцитов, которые в норме фагоцитируют растворимые комплексы фибрина и осуществляют равновесие активных факторов свертывания.
С х е м а 15.
ПатогенезДВС- синдрома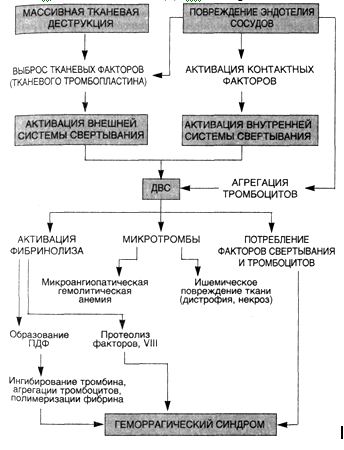
Таким образом, патогенез ДВС-синдрома сложен (схема 15): различные факторы могут либо непосредственно "запускать" ДВС (тромбопластин, большие концентрации тромбина), либо действуют через медиаторы (эндотоксин, иммунные комплексы), повреждающие эндотелий. Возникающие при этом гиперкоагуляция и тромбиногенез являются первичными процессами. Тромбин активирует противосвертывающую систему, обеспечивающую повышение защитного антикоагулянтного и фибринолитического фона. Однако массивный тромбиногенез ведет к необратимой агрегации тромбоцитов, к активации, а затем интенсивному потреблению факторов свертывания, в первую очередь VIII, V и XIII. Одновременно происходит активация фибринолитической системы с появлением в крови плазмина, способного гидролизовать или инактивировать факторы V, VIII, IX, XI. Наличие в крови активных протеиназ — тромбина и плазмина, обусловливает при ДВС как образование фибрин-мономера, так и расщепление фибриногена и фибрина с образованием продуктов деградации фибрина и фибриногена (ПДФ) — ранних продуктов X и Y
и поздних D и Е. ПДФ препятствуют полимеризации фибрин-мономеров и вызывают дисфункцию тромбоцитов. Некоторые из этих фрагментов имеют высокое сродство к фибрин-мономеру и вступают с ним в комплекс, образуя так называемые комплексы растворимого фибрина, теряющего способность к полимеризации. В то же время часть фибрин-мономеров полимеризуется, создавая затруднения кровотоку в микрососудах, вызывая гипоксию тканей. Образующийся в микрососудах фибрин захватывает тромбоциты, часть из которых уже проактивирована тромбином, коллагеном или другими индукторами и секретировала тромбо-спондин, фибронектин и другие адгезивные белки. Развиваются тромбоцитопения, реакция фибрин — эритроцит и микроангиопатическая гемолитическая анемия. Микрогемолиз приводит к выделению из эритроцитов фосфолипидов и АДФ — индукторов ДВС. В этих условиях естественные защитные механизмы противосвертывающей системы истощаются или нарушаются. Дисфункция противосвертывающих механизмов, потребление факторов свертывания, ингибиторов протеиназ, особенно антитромбина III, снижение уровня фактора XIII, нарушающее стабилизацию фибрина, тромбоцитопения и высокий уровень растворимых комплексов фибрина ведут к реализации вторичного процесса — гипокоагуляции и кровотечениям.
Клинические проявления. Неоднородность ДВС-синдрома демонстрирует и разнообразие его клинических проявлений. Наиболее известными являются геморрагические проявления. Термин "тромбогеморрагический синдром" многими рассматривается как единственный эквивалент ДВС. Однако частота случаев ДВС-синдрома, протекающих с выраженной кровопотерей, не превышает 40 %. Очень часто ведущим является гипотонический компонент. Кроме геморрагии и гипотонии, ДВС-синдром может проявляться множественной недостаточностью внутренних органов. Наиболее часто вовлекаются такие органы, как" легкие (68 %), почки (66 %), печень (50 %), селезенка (52 %). Микроциркуляторные нарушения сердца и мозга могут определять различную мозговую симптоматику и нарушения ритма. Усиленное внутрисосудистое микротромбообразование может осложняться окклюзией крупных артерий, предрасположенных к этому предшествующими изменениями (в частности, атеросклеротическими).
Как видно, ДВС-синдром — понятие неоднородное: оно отражает феномен перманентного образования в организме человека микротромбов с различной степенью участия в их формировании белков-прокоагулянтов, тромбоцитов и фибринолиза (процесс формирования микротромбов может протекать с различной скоростью, степенью выраженности и полиморфными клиническими проявлениями).
Разнообразие существующих названий ДВС-синдрома отражает стремление исследователей оттенить кажущиеся им наиболее важными стороны процесса: "тромбогеморрагический синдром", "гипофибриногенемия", "гиперкоагуляционный синдром", "коагулопатия потребления", "вторичный фибринолиз", "диссеминированная внутрисосудистая коагуляция". Наиболее широким термином, охватывающим всю гамму изменений гемостаза, является
"тромбогеморрагический синдром", однако и он не совсем точен, поскольку одновременное наличие тромбов и геморрагии наблюдается не всегда.
СТАДИИДВС-СИНДРОМАВ развитии ДВС-синдрома различают четыре стадии, каждая из которых имеет свою особую клинико-лабораторную и морфологическую характеристику.
Стадия I — гиперкоагуляция и внутрисосудистая агрегация клеток, активация других плазменных ферментных систем (например, калликреин-кининовой или системы комплемента) с развитием свертывания крови и формированием блокады микроциркуляторного русла в органах. Морфологически эта стадия характеризуется множественными микротромбами различного строения. Вариант окклюзии микроциркуляторного русла и распределение ее в органах зависят, очевидно, от этиологии, условий развития ДВС-синдрома (скорости возникновения и длительности процесса). Клинически I стадия проявляется развитием шока (при замедленном течении или умеренной тромбопластинемии часто не диагностируется).
Стадия II— коагулопатия потребления. Для нее характерны уменьшение числа тромбоцитов вследствие их агрегации, снижение содержания фибриногена, использованного на образование фибрина, расход других плазменных факторов системы регуляции агрегатного состояния крови. Эта стадия возникает на высоте гиперкоагуляции и прогрессирует до выраженной гипокоагуляции, которая проявляется кровотечениями и/или геморрагическим диатезом. Следует помнить, что эта стадия является следствием как использования факторов свертывания для образования микротромбов, так и удаления их из кровотока клетками, способными к фагоцитозу. Результаты проведенных экспериментальных исследований на ультраструктурном уровне свидетельствуют, что уже на самых ранних этапах мелкие свертки фагоцитируются клетками эндотелия сосудов и лейкоцитами. Основную роль в процессе ликвидации последствий активации системы свертывания крови играют печень и селезенка, что морфологически проявляется наличием тяжей и нитей фибрина в их синусоидах. При умеренной тромбопластинемии внутрисосудистые образования могут полностью удаляться из кровотока, и лишь наличие фибрина в фагоцитах свидетельствует о ДВС.
Стадия III— активация фибринолиза — обеспечивает полноценное восстановление проходимости сосудов микроциркуляторного русла путем лизиса микротромбов. Однако нередко активация фибринолиза принимает генерализованный характер, в результате чего лизируются не только микросвертки фибрина, но и повреждаются циркулирующие в крови факторы свертывания и фибриноген. Диагностировать морфологически III стадию довольно трудно. Высокий фибринолиз при ДВС-синдроме обусловлен появлением в крови активной протеазы — плазмина, который расщепляет фибриноген и фибрин до ранних продуктов деградации — фрагментов X и Y с высокой молекулярной массой, а затем поздних — фрагментов D и Е с меньшей молекулярной массой. Мономер фибрина легко образует растворимые комплексы как с фибриногеном, так и с продуктами распада фибриногена, теряя при этом способность полимеризоваться. Наличие растворимых комплексов мономера фибрина с продуктами распада фибриногена расценивается как свидетельство внутрисосудистого свертывания и вторичного фибринолиза. Важным светооптическим признаком этой стадии некоторые считают наличие большого количества "гиалиновых" микротромбов. Они образуются в условиях циркуляции большого количества ПДФ, что мешает образованию полноценного свертка фибрина.
Стадию IVназывают восстановительной, или стадией остаточных проявлений блокады сосудов. Для нее характерны дистрофические и некротические изменения в тканях: кортикальный некроз почек, геморрагический некроз надпочечников; некроз гипофиза, очаговый панкреонекроз, язвенный энтероколит. Клинические признаки этой стадии зависят от выраженности нарушений микроциркуляции и от степени повреждения паренхимы и стромы в том или ином органе. При благоприятном течении синдрома эта стадия завершается выздоровлением, при неблагоприятном — развитием органной недостаточности: острой легочной, почечной, печеночной, надпочечниковой.
ПАТОЛОГИЧЕСКАЯАНАТОМИЯИМОРФОГЕНЕЗМорфология и морфогенез ДВС-синдрома обусловлены рядом факторов, среди которых важную роль играют: 1) основное заболевание; 2) пусковые механизмы ДВС; 3) длительность процесса; 4) лечебные мероприятия, проводимые по поводу коагулопатии.
Независимо от сочетания этих факторов
основными морфологическими проявлениями ДВС-синдрома служат микротромбы, некрозы и кровоизлияния.Микротромбы. Состав и строение их не соответствуют структуре тромба в крупных сосудах. Описывают фибриновые, гиалиновые, глобулярные, тромбоцитарные, лейкоцитарные и эритроцитарные тромбы.
Решающая роль при диагностике ДВС отводится ф и б р и -новым микротромбам. Они представляют собой округлые или цилиндрические образования, имеющие петлистое либо волокнистое строение. Лишь изредка между нитями фибрина обнаруживаются единичные эритроциты. Значительное количество фибриновых микротромбов встречается у больных, ДВС-синдром у которых развивался постепенно, т.е. I стадия (гиперкоагуляция) была довольно длительной. Считают, что в морфогенезе чисто фибриновых тромбов происходит правильное чередование всех этапов свертывания крови, завершающееся формированием стабилизированного свертка крови.
Гиалиновые тромбы, как считают большинство исследователей, также состоят преимущественно из фибрина. Однако, как показали результаты иммуногистохимических и электронно-микроскопических исследований, в состав гиалиновых тромбов наряду с фибрином входит фибриноген. Ультраструктурно они отличаются от обычных фибриновых тромбов степенью полимеризации. Эти гомогенные округлые образования встречаются во всех отделах микроциркуляторного русла, однако преимущественно локализуются в капиллярах. Возникновение гиалиновых тромбов связывают с уплотнением фибрина при продвижении в более мелкие сосуды. Возможно также, что имеет место нарушение формирования фибринового свертка во II— III стадиях, когда происходит активация фибринолитической системы и в крови циркулируют ПДФ, мешающие нормальной полимеризации фибрина.
Глобулярные тромбы локализуются в различных отделах микроциркуляторного русла. Каркасом для их образования служат сладжированные эритроциты, на которые откладываются фибриновые массы. В ходе образования этого вида тромбов эритроциты гемолизируются, поэтому видны лишь их оболочки, которые иногда полностью разрушаются. Эритроцитарный сладж — обязательный этап в возникновении глобулярных тромбов, поэтому они обнаруживаются у большинства больных с локальными или общими нарушениями кровообращения, сопровождающимися повышением коагуляционного потенциала крови.
Тромбоцитарные (пластинчатые) тромбы — частое проявление внутрисосудистой коагуляции. Они представляют собой окрашиваемые эозином зернистые массы, среди которых обнаруживаются отдельные нити фибрина, могут включаться также единичные эритроциты и лейкоциты. Такие
тромбы нередко обтурируют даже крупные сосуды. В клинической практике их наличие патогномонично для ДВС при эмболии околоплодными водами. В эксперименте отмечено, что тромбоцитарные тромбы образуются чаще всего в месте повреждения эндотелия сосудов вследствие его травмы или токсического воздействия.
Лейкоцитарным (белым) тромбам отводится важное место среди морфологических проявлений ДВС-синдрома. Они обнаруживаются в венулах кожи при менингококкемии и лейкозах (лейкозные тромбы). Состоят преимущественно из клеток миелоидного ряда, скрепленных нитями фибрина. Чаще всего лейкоцитарные тромбы обнаруживаются в венозном конце сосудистого русла (медленный ток крови способствует их образованию).
Эритроцитарные (красные) тромбы встречаются в различных внутренних органах и на всех участках микроциркуляторного русла чаще при перитоните, шоке и некоторых других состояниях. Как и классические тромбы, состоят из фибрина, тромбоцитов и большого количества гемолизированных эритроцитов. Термин "эритроцитарный тромб" лишь подчеркивает, что основным компонентом тромба являются эритроциты.
Морфологические изменения в органах. В финале развития ДВС-синдрома возникают два типа нарушений, которые зависят от его распространенности, локализации и степени выраженности: 1) геморрагический диатез как результат коагулопатии потребления и активации фибринолиза; 2) некрозы вследствие нарушения кровотока в микроциркуляторном русле различных органов с нарушением их функции. Многообразие этиологических факторов, нозологических форм, патогенетических процессов, приводящих к развитию ДВС-синдрома, обусловили многогранность проявлений внутрисосудистой коагуляции, участие в процессе различных органов и систем.
Наиболее часто поражаются почки, легкие и надпочечники, значительно реже — печень, поджелудочная железа, желудочно-кишечный тракт, кожа, аденогипофиз, в единичных случаях признаки внутрисосудистого свертывания отмечены в миокарде, головном мозге. Особое место среди пораженных органов занимает селезенка.
Почки увеличены в размерах, набухшие, корковое вещество бледное с серо-желтым оттенком, при длительности процесса 2—3 сут нередко видны очаговые или тотальные кортикальные некрозы, окруженные зоной гиперемии и кровоизлияний. Часты субкапсулярные кровоизлияния. Определяются выраженные дистрофические изменения эпителия канальцев вплоть до развития некробиоза и некроза. В микроциркуляторном русле микро-
тромбы в капиллярах клубочков, приводящих и отводящих артериолах, сосудах мозгового вещества. Тромбы могут быть чисто фибриновыми, гиалиновыми, глобулярными, эритроцитарными или смешанными (фибрино-эритроцитарными). В ряде случаев при наличии выраженных изменений в канальцах микротромбы не обнаруживаются.
В легких при ДВС-синдроме внутрисосудистая коагуляция выражена наиболее ярко. Встречаются все варианты микротромбов, а также агрегация, сладж и агглютинация форменных элементов крови. Объясняется это тем, что легкие являются своеобразным сосудистым фильтром, который задерживает инородные частицы, встречающиеся в кровотоке и служащие триггером для запуска ДВС-синдрома — чешуйки, сыровидная смазка при эмболии околоплодными водами, капельки жира при жировой эмболии, клетки синцитиотрофобласта при преждевременной отслойке плаценты, клетки злокачественных опухолей при гематогенном метастазировании или тканевой эмболии. Все другие макро- и микроскопические признаки (резкое полнокровие, отек, скопление альвеолярных макрофагов и кровоизлияния в альвеолы), часто обнаруживаемые при ДВС-синдроме, считаются неспецифичными.
Надпочечники также являются одним из основных органов, поражаемых при ДВС ("шоковый орган"). Как правило, определяется окклюзия микроциркуляторного русла, которая приводит к выраженной дистрофии вплоть до некроза клеток коркового и мозгового вещества. Микротромбы обычно сочетаются с множественными кровоизлияниями — от точечных до обширных, захватывающих всю толщу органа и ведущих к деструкции ткани надпочечника. Часто обнаруживаются кровоизлияния в капсуле и окружающей жировой клетчатке.
В печени при ДВС обнаруживается сочетание поражения паренхимы с внутрисосудистой коагуляцией, но нередко имеет место повреждение гепатоцитов без обтурации сосудов микротромбами. Изменения гепатоцитов обычо резко выражены в центрах долек, где часто развиваются центролобулярные некрозы. Последние нередко сочетаются с кровоизлияниями, что придает органу пестрый вид. Наиболее частым проявлением ДВС в печени являются тяжи и нити фибрина, свободно лежащие в печеночных синусоидах. В центральных венах встречаются часто фибриновые тромбы. Другие виды микротромбов в сосудах печени наблюдаются редко.
Повреждение поджелудочной железы при ДВС-синдроме может варьировать от минимального до панкреонекроза. Степень повреждения железы коррелирует с выраженностью микротромбов. Выход ферментов при панкреонекрозе поддерживает процесс внутрисосудистой коагуляции и ведет к формированию новых микротромбов в железе.
В желудочно-кишечном тракте характерными проявлениями ДВС-синдрома являются кровоизлияния в слизистую оболочку, эрозии, иногда острые язвы. В микроциркуляторном русле желудка и тонкой кишки обнаруживаются резкое полнокровие, сладж и агглютинация эритроцитов; изредка выявляются чисто фибриновые и эритроцитарные микротромбы.
Кожные проявления ДВС-синдрома носят преимущественно геморрагический характер: петехиальная, мелко- и крупнопетлистая, иногда сливная геморрагическая сыпь, множественные кровоизлияния в местах инъекций, операционных разрезах. Иногда в центре высыпаний можно обнаружить очаги некроза. При гистологическом исследовании находят единичные фибриновые, лейкоцитарные и смешанные микротромбы сосудов дермы.
Для поражения аденогипофиза характерна распространенная внутрисосудистая коагуляция с образованием гиалиновых и чисто фибриновых тромбов, приводящая к дистрофии и некрозу клеток передней доли гипофиза, что у выживших больных приводит к гипофизарной недостаточности (синдром Шихена).
В миокарде проявление распространенного свертывания крови наблюдается редко. Единичные гиалиновые микротромбы обтурируют капилляры. Довольно часто обнаруживают геморрагии под эпи- и эндокардом.
В головном мозге микротромбы выявляются редко; чаще они встречаются в мягких мозговых оболочках, а также в сосудистых сплетениях и имеют характер чисто фибриновых и гиалиновых.
В селезенке морфологические признаки внутрисосудистой коагуляции имеются в мелких внутриорганных артериях и венах (гиалиновые и чисто фибриновые тромбы), синусоидах (тяжи и нити фибрина). В фолликулах определяются белковые массы, содержащие фибрин. Геморрагический синдром также находит свое отражение: постоянно обнаруживаются кровоизлияния в пульпу органа и под капсулу.
КЛАССИФИКАЦИЯКлинико-морфологические проявления ДВС-синдрома многообразны. Они определяются степенью нарушения кровотока в системе микроциркуляции отдельных органов, интенсивностью и распространенностью геморрагического синдрома.
В зависимости от распространенности выделяют генерализованные и локальные формы ДВС-синдрома.
В зависимости от скорости развития и характера течения ДВС-синдрома выделяют острую (развивается в сроки от нескольких часов до суток), подострую (развивается в течение нескольких дней или 1 нед) и хроническую (развивается в течение недель и месяцев) формы.
Острая форма ДВС-синдрома чаще имеет генерализованный характер. Развивается она в условиях быстрого поступления в кровоток тромбопластинового компонента при эмболии околоплодными водами, переливании несовместимой крови, жировой эмболии (при переломе костей), обширных хирургических операциях, укусах ядовитых змей. Острая форма сопровождается шоковым состоянием: гипотензией, острой дыхательной недостаточностью, затемнением сознания и пр. Параллельно развивается геморрагический синдром. В клинической практике наиболее часто встречаются следующие синдромы, в основе которых лежит окклюзия микроциркуляторного русла тромбами: острая дыхательная недостаточность, острая почечная недостаточность, острая надпочечниковая недостаточность, очаговая ишемическая дистрофия миокарда, нарушение мозгового кровообращения, эрозивно-язвенный гастроэнтерит, очаговый панкреонекроз.
Подострая форма ДВС-синдрома может носить локальный характер. Для нее типично более благоприятное течение. Она нередко сопутствует развитию злокачественных новообразований, лейкозов, реакции отторжения трансплантата, наблюдается при введении некоторых препаратов. Признаки повышенной кровоточивости варьируют от умеренно выраженных до минимальных. Мозаичность симптомов свидетельствует о поражении разных органов и систем. Такое состояние может продолжаться довольно долго, однако присоединение какого-либо даже небольшого экзо- или эндогенного стимула переводит синдром из подострой локальной формы в острую генерализованную. Предотвратить такой исход можно, своевременно диагностируя признаки коагулопатии потребления и определяя уровень ПДФ.
При
хронической форме ДВС-синдрома, длящейся неделями и месяцами, на первый план выступают медленно нарастающие функциональные нарушения в органах. Подобные варианты течения ДВС соответствуют клинической картине хронических воспалительных заболеваний — хронического нефрита, гепатита, панкреатита, пневмонии и др. Хронический ДВС развивается также при аутоиммунных заболеваниях, ревматических заболеваниях, миелоидных лейкозах, гигантских гемангиомах, злокачественных новообразованиях.
Прогноз. При ДВС-синдроме прогноз определяется степенью его выраженности, распространенностью и характером течения. Опыт современной медицины дает основание говорить о возможности эффективного лечения больных с острыми вариантами ДВС-синдрома, однако летальность пока составляет 50
%.