Лекция 11ТРОМБОЭМБОЛИЧЕСКИЙ СИНДРОМОсновное проявление синдрома — развитие тромбов и тромбоэмболии в артериальной части большого круга кровообращения. В литературе нередко используется еще один термин для обозначения данного синдрома — "системный тромбоз". Тромбозы и тромбоэмболии при данном синдроме сопровождаются обтурацией просветов артерий и развитием в органах инфарктов и гангрены. В связи с тем что основные морфологические и клинические проявления тромбоэмболического синдрома связаны с тремя процессами — тромбозом, тромбоэмболиями и инфарктом или гангреной, следует остановиться на характеристике этих патологических процессов.
ТРОМБОЗ•
Тромбоз (от греч. thrombosis — свертывание) — прижизненное свертывание крови в просветах сосудов или в полостях сердца. Образующийся при этом сверток крови называют
тромбом.Морфология тромба. В зависимости от внешнего вида и способа возникновения выделяют четыре основных вида тромбов: белый, или серый; красный, или коагуляционный; смешанный; гиалиновый. Кроме того, выделяют еще четыре вида тромбов, которые встречаются при определенных патологических ситуациях: марантический, опухолевый, септический и сопровождающий заболевания крови. По отношению к просвету сосудов тромбы могут быть пристеночными и обтурирующими (закупоривающими).
Белый тромб называется также серым, агглютинационным, конглютинационным, поскольку в нем преобладают агглютинированные форменные элементы крови (тромбоциты). Микроскопически в нем различают преимущественно тромбоциты, образующие многоэтажные балки, напоминающие ветвления кораллов. Они располагаются перпендикулярно к току крови, что описывал в 1892 г. L.Ascoff. Макроскопически белый тромб имеет белую или серую окраску, спаен со стенкой сосуда, поверхность его гофрированная, консистенция сухая, крошащаяся. Локализуется в артериях и полостях сердца — между трабекулярными мышцами, на створках клапанов. Образуется медленно при быстром токе крови.
Красный тромб, или коагуляционный, назван так, поскольку образуется при быстром свертывании (коагуляции) крови на фоне медленного кровотока. Красный цвет тромба обусловлен содержанием в нем большого количества эритроцитов. Микроскопически в тромботических массах доминирует фибрин, эритроциты с мелкими скоплениями тромбоцитов, но без образования балочных структур. Макроскопически этот тромб красный, рыхло спаян со стенкой сосуда, слегка гофрированный. Красный тромб обычно обтурирующий и встречается в венах.
Смешанный тромб представлен сочетанием элементов белого и красного тромба и может развиваться как в артериях, полостях сердца, так и в венах. Представлен чередованием участков белого и красного цвета. Макроскопически в смешанном тромбе выделяют три анатомические части: головку, тело (шейку), хвост. Головка тромба белого цвета (белый тромб), спаяна со стенкой сосуда, а в обтурирующих тромбах всегда направлена по току крови (в артериях в направлении от сердца, в венах — к сердцу). В пристеночных тромбах головка может иметь различное расположение по отношению к току крови. Тело тромба бело-красного цвета (смешанный тромб), рыхло связано с его хвостом красного цвета (красный тромб). Хвост растет всегда против тока крови и, отрываясь, может вызывать тромбоэмболии — венозные и артериальные. В редких случаях может происходить отрыв всего тромба.
Гиалиновые тромбы обычно множественные и локализуются в сосудах микроциркуляторной системы. Единого мнения о механизмах их образования пока не существует. Большинство авторов склоняются к мнению о том, что основу гиалинизированных тромбов составляют дезинтегрированные и некротизированные эритроциты. Гиалиновые тромбы встречаются при шоке различного генеза, ДВС-синдроме, ожогах, электротравме, обширных травмах тканей.
Марантические тромбы (от греч. marasmas — изнурение, упадок сил) встречаются у истощенных больных старческого возраста вследствие дегидратации организма и локализуются в поверхностных венах конечностей и синусах мозговой оболочки.
Опухолевые тромбы развиваются при метастазиро-вании злокачественных опухолей путем пермиации, сопровождающейся врастанием опухолевой ткани в просвет вены с последующим тромбозом на ее поверхности. Опухолевый тромб^спосо-бен расти по току крови (прогрессирующий тромб) по направлению к правому предсердию и в ряде случаев дорастать до правого желудочка и легочной артерии. Нередко при этом развивается тромбоэмболия ствола и мелких веточек легочной артерии с развитием венозной тромбоэмболии.
Септический тромб — инфицированный тромб, который обычно возникает при наличии гнойного воспалительного процесса в венах и окружающих тканях (гнойный тромбофлебит) или на створках сердечных клапанов (острый язвенный эндокардит при септикопиемии). Септические тромбы в венах закономерно обнаруживаются в септических очагах. Следует помнить, что они могут также развиться при катетеризации сосудов. И.В. Давыдовский называл септический тромб больным тромбом, так как в случае отрыва кусочков от него тромбоэмболов и циркуляции их
в кровотоке он является источником не только тромбо-, но и микробной эмболии и приводит к развитию генерализованного инфекционного заболевания, сепсиса.
Патологоанатомы на вскрытии встречаются и с такими образованиями, как
кровяные сгустки. Тромб отличается от кровяного сгустка механизмами формирования, составом и морфологическими проявлениями (макро- и микроскопическими). Тромб образуется в результате сложных цепных реакций, возникающих при взаимодействии элементов сосудистой стенки, форменных элементов (прежде всего тромбоцитов) и свертывающей системы крови. Поэтому в составе тромбов имеется большое количество тромбоцитов в сочетании с другими форменными элементами крови и фибрином. Тромб также всегда имеет связь с внутренней оболочкой сосуда. Макроскопически тромб имеет гофрированную поверхность, крошащуюся консистенцию.
В отличие от тромба при формировании кровяного сгустка задействованы только факторы свертывающей системы крови. В связи с этим кровяные сгустки в основном состоят из фибрина, белков плазмы и эритроцитов, которые преобладают среди прочих форменных элементов. Кровяные сгустки не бывают связаны со стенками сосудов. Макроскопически они имеют гладкую блестящую поверхность, эластическую консистенцию, располагаются свободно в просветах сосудов или гематом. Кровяные сгустки образуются в условиях in vitro, когда кровь собирается в пробирки. В условиях in vivo они возникают в двух ситуациях: при жизни в полости гематом; посмертно — в просветах сосудов, полостях сердца.
Значение тромбоза для организма противоречиво. С одной стороны, тромбоз необходим для остановки кровотечения при повреждении сосудов. С другой стороны, образование тромбов в просветах сосудов может стать причиной развития некроза органов (инфарктов и гангрен), а отрыв кусочков тромбов приводит к возникновению тромбоэмболических осложнений.
Структурно-функциональные основы тромбозаСтруктурно-функциональные основы тромбоза включают в себя механизмы гемостаза, представленные четырьмя тесно взаимосвязанными процессами:
▲ реакциями поврежденной сосудистой стенки;
▲ адгезией и
▲ агрегацией тромбоцитов в участке повреждения;
▲ коагуляцией крови.
Реакции поврежденной сосудистой стенки и тромбоцитов относятся к первичным гемостатическим реакциям — первичному
гемостазу. Коагуляция крови происходит вторично, поэтому называется вторичным гемостазом. Для дефекта первичного гемостаза характерно развитие кровотечения у пациента сразу же после повреждения сосуда, как это наблюдается, например, при тромбоцитемической пурпуре. При нарушениях в системе вторичного гемостаза кровотечение возникает спустя некоторое время после травмы сосуда, иногда через несколько дней, что бывает при гемофилиях.
Реакции поврежденной сосудистой стенки. Эти реакции выражаются в вазоконстрикции, возникновение которой в крупных сосудах связано с нервно-рефлекторным механизмом, а в капиллярах — с сокращением миофибрилл эндотелиальных клеток. При этом эндотелиальные клетки могут полностью обтурировать просвет таких мелких сосудов, как капилляры. Сокращение сосудистой стенки может стимулироваться вазоактивными субстанциями, высвобождающимися из адгезированных к месту повреждения тромбоцитов серотонином, адреналином, тромбоксаном А
2. Брадикинин, активирующий фактор XII, может способствовать усилению проницаемости капилляра и сдавлению его извне вышедшей жидкостью.
В реакциях поврежденной сосудистой стенки немаловажную роль выполняет также эндотелий, способный продуцировать как антитромбогенные, так и тромбогенные факторы.
Участие эндотелия в тромбогенезе АНТИТРОМБОГЕННЫЕ ФАКТОРЫ ЭНДОТЕЛИЯ
| ТРОМБОГЕННЫЕ ФАКТОРЫ ЭНДОТЕЛИЯ
|
▲ Связывающие и ингибирующие тромбин: тромбомодулин;
протеин S;
гепариноподобная субстанция
| ▲ Факторы коагуляции: тканевый фактор;
фактор V;
связывание факторов 1Ха, Ха
|
▲ Ингибиторы агрегации тромбоцитов:
простациклин;
АДФаза
| ▲ Факторы адгезии и агрегации тромбоцитов:
фактор Виллебранда;
фактор активации тромбоцитов
|
▲ Фибринолиз:
тканевый активатор плазминогена
| ▲ Ингибитор фибринолиза:
тканевый ингибитор активатора плазминогена
|
В нормальных поврежденных сосудах эндотелий обладает свойством атромбогенности. Это значит, что к нему не адгезируются тромбоциты. Кроме того, он является механическим барьером между кровью и тромбогенным субэндотелием. Эндотелий продуцирует ряд антитромбогенных факторов, основными из которых являются поверхностный белок тромбомодулин, связывающий тромбин, который затем инактивируется плазменным протеином С; протеин S — кофактор протеина С, синтезируется эндотелием; гепариноподобные молекулы, усиливающие эффект антитромбина III. Эндотелий может также ингибировать агрегацию тромбоцитов посредством выделения ингибитора АДФ и простациклина, который одновременно является мощным вазодилататором, а также усиливать фибринолиз за счет продукции активаторов плазминогена. С другой стороны, в эндотелии синтезируются различные вещества, обладающие прокоагулянтной активностью (тканевый тромбопластин, фактор V и др.), вещества, усиливающие адгезию и агрегацию тромбоцитов (фактор Виллебранда); вещества, ингибирующие фибринолиз (ингибитор активатора плазминогена). Нарушение баланса между тромбогенными и антитромбогенными факторами эндотелия в пользу тромбогенных факторов происходит при его повреждении, что способствует тромбозу.
Велико значение субэндотелия в развитии тромбоза при повреждении сосудистой стенки. Структура субэндотелия в разных участках сосудистого русла имеет свои особенности, но общим является то, что в него входят разнообразные белковые соединения, обладающие высокой тромбогенной активностью. Хотя коллаген IV типа базальных мембран и эластин стимулируют адгезию тромбоцитов, но наиболее активными в этом отношении являются фибриллярные коллагены I, III типов, которые обнажаются при глубоких повреждениях сосудов. Другой компонент экстрацеллюлярного матрикса субэндотелиального слоя сосудистой стенки — фибронектин, формирует связи с фибрином и участвует в прикреплении тромбов к сосудистой стенке.
Тромбоцитарное звено является центральным в реакциях первичного гемостаза. При электронной микроскопии в тромбоците можно выделить четыре зоны: периферическую, гель-зону, зону органелл и мембранную зону. Каждая из этих зон имеет структурно-молекулярные особенности, содержит различные цитокины и, следовательно, отличается функционально.
Периферическая зона включает гликокаликс и двухпластинчатую мембрану тромбоцита. В слое гликокаликса располагаются рецепторые белки тромбоцитов (гликопротеиды), осуществляющие взаимодействие их с компонентами поврежденной сосудистой стенки — фибронектином и фактором Виллебранда. На поверхностной мембране располагается фактор 3 тромбоцитов и
мицеллы фосфолипидов, на поверхности которых взаимодействуют факторы свертывания крови. Фосфолипиды используются также для синтеза простагландинов.
В гель-зоне располагаются гранулы (а- и плотные тельца), элементы цитоскелета и митохондрии. Плотные тельца содержат АДФ, АТФ, серотонин и ионы Са
2+, а а-гранулы — фибриноген, β-тромбоглобулин, фактор Виллебранда, фактор 4 тромбоцитов и др. Кроме того, тромбоциты содержат ферментную систему для синтеза жирных кислот и фосфолипидов, а также для метаболизирования их до арахидоновой кислоты и тромбоксана, способного вызывать агрегацию тромбоцитов.
Мембранная система формирует сеть микротрубочек и каналов, по которым осуществляется транспортировка различных веществ как внутри тромбоцита, так и между тромбоцитов и окружающей его средой.
При повреждении эндотелия тромбоциты из кровотока направляются в места повреждения, где претерпевают следующие изменения: 1) адгезию и изменение формы; 2) секретируют гранулы (дегрануляцию); 3) агрегацию (см. также лекцию 9).
Последствия повреждения сосудистой стенкиАдгезия тромбоцитов осуществляется за счет рецепторного взаимодействия с оголенными компонентами субэндотелия (прежде всего с фактором Виллебранда и коллагенами I и Ш типов) в местах повреждений, а также между собой. Начальное прикрепление и распластывание тромбоцитов регулируется фактором (белком) Виллебранда, синтезируемым эндотелием и тромбоцитами. Генетические дефекты, связанные с недостаточностью или аномалиями этого фактора, а также отсутствием на тромбоцитах рецепторов к нему, вызывают геморрагические диатезы — болезнь Виллебранда и тромбоцитодистрофию Бернара — Сулье.
Секреция гранул тромбоцитами начинается вслед за их адгезией и изменением формы. К этому моменту тромбоциты распластаны и взаимодействуют между собой и субэндотелием всей своей поверхностью. При этом в них происходят метаболические изменения, приводящие к концентрации в плотных гранулах АДФ, ионов Са
2+, серотонина, адреналина. С а-гранулами из тромбоцитов выходят фибриноген, фибронектин, тромбоцитарный фактор роста, антигепарин (тромбоцитарный фактор 4), (3-тромбоглобулин и другие белки. Секреция плотных гранул с выбросом из тромбоцитов АДФ способствует агрегации тромбоцитов. Ионы Са
2+, фибриноген участвуют в коагуляционном каскаде внутренней системы гемостаза. Выброс тромбоцитарного фактора роста определяет исход тромбоза — процессы организации, канализации и васкуляризации тромба, так как данный фактор роста является мощным митогенетическим сигналом, вызывающим пролиферацию фибробластов, гладких мышечных клеток и эндотелия. Значение β-тромбоглобулина пока не известно, но его обнаружение в крови может служить прекрасным индикатором активации тромбоцитов.
Агрегация тромбоцитов происходит при участии АДФ и тромбоксана А
2> продуцируемых активированными тромбоцитами. При этом формируются крупные
первичные гемоста-тические бляшки, которые легко могут распадаться и подвергаться обратному развитию. Однако этого не происходит, так как первичный тромб укрепляется плазменными белками коагуляци-онного каскада, который запускается благодаря выделению из тромбоцитов фактора 3 тромбоцитов, активирующего тромбин. Тромбин является мощным агонистом тромбоцитов. Тромбин вместе с синтезируемым тромбоцитами АДФ и тромбоксаном А
2 вызывает сокращение конгломерата, состоящего из тромбоцитов. Этот процесс называют ретракцией кровяного сгустка. Формируется
вторичная гемостатическая бляшка.Суммируя роль тромбоцитарного звена в тромбогенезе, следует отметить следующие моменты:
▲ тромбоциты прилипают к субэндотелиальному матриксу (коллагенам I, II типов и фактору Виллебранда) в месте повреждения сосуда;
▲ вслед за адгезией тромбоцитов происходит секреция ими различных веществ, участвующих в агрегации тромбоцитов (АДФ, тромбоксан А
2), в запуске внутренней системы гемостаза (ионы Са
2+, фактор 3 тромбоцитов, фибриноген и др.), а также выделение цитокинов, способных определять исход тромбоза;
▲ фактор 3 тромбоцитов активирует одновременно несколько факторов свертывающей системы крови и запускает внутреннюю систему гемостаза;
▲ одновременное выделение тканевого тромбопластина из поврежденных тканей запускает внешнюю систему гемостаза;
▲ под действием агонистов тромбоцитов (АДФ, тромбоксан А
2 и тромбин) происходит формирование первичной, а затем и вторичной гемостарической бляшки;
▲ формирование тромба заканчивается отложением в бляшку фибрина, образовавшегося в результате каскада каталитических реакций из фибриногена плазмы и тромбоцитов.
Система коагуляции. Эта система является третьим звеном гемостаза. Нет необходимости подробно разбирать тонкие биохимические процессы, составляющие каскад реакций, — они представлены на схеме 14.
Схема 14. Внутренняя и внешняя системы свертывания крови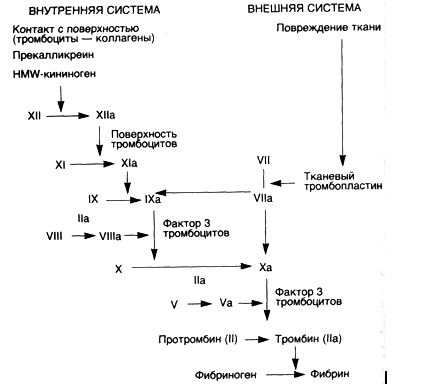
Процесс коагуляции совершается в виде каскада реакций с активацией проферментов (факторы свертывания). Этот каскад завершается образованием тромбина, который трансформирует растворимый фибриноген в нерастворимый белок фибрин. Каждый этап реакции совершается при участии фермента (активированного фактора коагуляции), субстрата (профермента) и системы кофакторов (акцелераторов). К кофакторным системам относятся фосфолипидные глобулы тромбоцитов, на поверхности которых совершаются все реакции, а также ионы Са
2+.
Противосвертывающая система. Если бы не было специальных систем, противодействующих механизмам свертывания крови, тромбоз мог бы приобрести характер цепной реакции. Так, в условиях in vitro показано, что для превращения фибриногена в фибрин в 3 л крови достаточно тромбина из 1 мл свернувшейся сыворотки. Ингибирование свертывания крови происходит с участием нескольких механизмов: снижения концентрации свертывающих факторов благодаря притоку свежей крови, прекращения поступления свертывающих факторов к месту тромбоза за счет закупорки сосуда, а также за счет увеличения в крови концентрации факторов противосвертывающей системы — ингибиторов протеаз. Антитромбин III в присутствии гепарина является основным ингибитором тромбина, хотя он также инактивирует факторы ХИа, Х1а, Ха и 1Ха. Протеин С, витамин К-зависимый плазменный белок, активируемый тромбомодулином эндотелия сосудов, оказывает ингибирующее дествие на факторы Va и Vila. Врожденная недостаточность антитромбина III и протеина С приводит к развитию предрасположенности к тромбозам. Известны также и другие ингибиторы свертывающих факторов — инактиватор С1 компонента комплемента, а
2-макро-глобулин, а
1-антитрипсин, а
2-ингибитор плазмина и кофактор II гепарина.
Фибринолитическая система. Обеспечивает лизис уже сформировавшихся тромбов. Основной представитель этой системы — плазмин. В крови он находится в неактивной форме, называемой плазминогеном, и для его активации необходимо наличие активированного фактора XII свертывающей системы или активаторов плазминогена (плазменного и тканевого).
Причины и механизмы тромбообразованияРудольф Вирхов первый выделил триаду причин тромбообразования, которая признается патологами всего мира, и в настоящее время эта триада представлена нарушением целости сосудистой стенки (эндотелия), изменениями тока крови и повышением коагуляционных свойств крови. Первые две причины могут быть отнесены к местным причинам тромбоза, последняя — к общим.
Нарушение целости эндотелия и сосудистой стенки как основной фактор в генезе тромбоза имеет особое значение при артериальных и сердечных тромбозах. Может встречаться в области атеросклеротических бляшек при атеросклерозе, гипертонической болезни и сахарном диабете; в случае воспаления сосудистой стенки при тромбоваскулитах различной природы (системных, инфекционных); на створках и заслонках клапанов при эндокардитах. Повреждения эндотелия могут вызываться самыми разными воздействиями — радиацией, токсичными продуктами экзогенного (компоненты табачного дыма) и эндогенного (холестерин, иммунные комплексы, токсины микроорганизмов) происхождения.
Нарушения тока крови в виде турбулентных потоков, завихрений имеют значение в развитии артериальных (в области атеросклеротических бляшек, аневризм сосудов) и сердечных (припороках сердца, фибрилляции предсердий, постинфарктной аневризмы) тромбов. При формировании турбулентных потоков может происходить повреждение эндотелия. Перемешивание слоев кровяного потока приводит тромбоциты, находящиеся в норме в его центре, в контакт с поврежденной сосудистой стенкой, а также способствует концентрации тромбогенных факторов и нарушению их выведения печенью. Венозные тромбы чаще развиваются на фоне стаза и замедления кровотока, что также может быть вызвано вторичными повреждениями эндотелия. Тромбоз на почве стазов развивается у больных с повышенной вязкостью крови при полицитемии, криоглобулинемии, макроглобулинемии, миеломной болезни, серповидно-клеточной анемии. Стаз венозной крови в гигантских кавернозных гемангиомах также может приводить к развитию тромбоза (синдром Казабаха — Меррита).
Гиперкоагуляция как общий фактор, способствующий тромбозу, наблюдается при многих заболеваниях — генетическом дефиците антитромбина III и протеина С, нефротическом синдроме (приобретенный дефицит антитромбина III и повышение концентрации коагулянтов), при тяжелых травмах, ожогах, онкологических заболеваниях (гиперкоагуляции, гиперфибриногенемия), в поздних стадиях беременности и послеродовом периоде. Во всех перечисленных ситуациях причины гиперкоагуляции различны. В целом они затрагивают активацию прокоагулянтов (фибриногена, протромбина, факторов VIIa, VIIIa и Ха или увеличение количества тромбоцитов), или уменьшением активности противосвертывающей и фибринолитических систем.
Морфогенез тромба. Складывается из четырех стадий:
▲ агглютинация тромбоцитов (эта стадия включает адгезию, секрецию и агглютинацию тромбоцитов вплоть до формирования первичной гемостатической бляшки);
▲ коагуляция фибриногена и образование фибрина (образование вторичной гемостатической бляшки, завершение каскадных реакций свертывающей системы);
▲ агглютинация форменных элементов крови;
▲ преципитация белков.
Исходы тромбоза. Могут быть благоприятными и неблагоприятными. Благоприятные исходы тромбоза связаны с полным лизисом мелких тромботических масс под действием ферментов лейкоцитов, входящих в состав тромба, или ферментативных лекарственных препаратов (стрептокиназа и др.). Крупные же тромбы обычно замещаются соединительной тканью (организация), прорастают эндотелиальными трубками (канализация), а затем по этим трубкам восстанавливается кровоток (васкуляризация). Возможно также обызвествление тромбов и формирование на их основе камней (флеболитов).
Наибольшее значение имеют неблагоприятные исходы тромбоза — гнойное расплавление тромба и тромбоэмболия.
ТРОМБОЭМБОЛИЯ•
Тромбоэмболия — второй компонент тромбоэмболического синдрома.
Эмболия (от греч. em-ballein — бросать) — циркуляция в крови или в лимфе не встречающихся в нормальных условиях частиц и закупорка ими просветов сосудов. 99
% эмболии являются тромбоэмболиями. Гораздо реже встречаются жировая, тканевая, газовая, воздушная эмболии. Распространение эмболов может быть по току крови (ортоградные), против тока крови (ретроградные) и могут быть парадоксальными (см. лекцию 9).
Тромбоэмболию подразделяют на венозную и артериальную.
Венозная эмболия — это тромбоэмболия в венозной части большого круга кровообращения. Источником венозной эмболии являются венозные тромбы в бедренных венах, венах голеней, малого таза, геморроидальных венах. Тромбы указанных локализаций сопровождаются развитием тромбоэмболии в 25—30 % случаев, 5—10 % которых заканчивается смертью. При венозной эмболии тромбоэмбол попадает в легочную артерию, в результате чего развивается тромбоэмболия легочной артерии. В зависимости от его размеров эмбол может остановиться в стволе или бифуркации ствола легочной артерии, вызвать острую обструкцию сосудов малого круга кровообращения с острой правожелудочковой недостаточностью и развитие пульмоно-коронарного рефлекса со спазмом веточек легочной артерии, венечных (коронарных) артерий сердца и артерий бронхов. Все это может привести к внезапной смерти. Не исключается также возможность развития пульмоно-коронарного рефлекса при ударе тромбоэмбола небольших размеров о рефлексогенную зону в области ствола легочной артерии. Тромбоэмболия мелкими тромбоэмболами сопровождается обтурацией средних и мелких ветвей легочной артерии, что при наличии венозного застоя в легких может привести к возникновению геморрагических инфарктов легкого.
Артериальная тромбоэмболия встречается несколько реже венозной и развивается при тромбоэмболическом синдроме, который будет разобран далее, в соответствующем разделе лекции.
* * *Третий компонент тромбоэмболического синдрома — инфаркт — подробно рассмотрен в лекции 8 "Некроз".
ТРОМБОЭМБОЛИЧЕСКИЙСИНДРОМ• Тромбоэмболический синдром, или
системный тромбоз,развивается при формировании тромбов в артериальной части большого круга кровообращения с последующим развитием артериальной тромбоэмболии.
Тромбоэмболический синдром встречается при различных заболеваниях, сопровождающихся развитием пристеночных тромбов в полостях левого желудочка и левого предсердия, на створках левого предсердно-желудочкового (митрального) и аортального клапанов, а также в аорте и ее крупных ветвях, сочетающихся с тромбоэмболией. В клинической практике наиболее часто приходится сталкиваться с тромбоэмболическим синдромом у больных с сердечно-сосудистыми, онкологическими и инфекционными (сепсис) заболеваниями, а также в послеоперационном периоде. В 30 % случаев тромбоэмболия у данных больных носит рецидивирующий характер.
Наиболее частым источником артериальных тромбоэмболии в большом круге кровообращения являются внутрисердечные тромбы (80—85 % случаев). В подавляющем числе случаев внутрисердечные тромбы формируются вторично при инфаркте миокарда (60—65 %), изредка при ревмокардите (5—10 %) и кардиомиопатиях (5 %), аритмиях (фибрилляции левого предсердия), септическом эндокардите, клапанных протезах, а также при парадоксальных тромбоэмболиях в случае незаращения овального отверстия или межжелудочковой перегородки. У 10—15 % больных источник тромбоэмболии остается не выясненным.
Тромбы на створках митрального или заслонках аортального клапанов могут образовываться при септическом или ревматическом эндокардите; межтрабекулярные тромбы левого желудочка или ушка левого предсердия — при ишемической болезни сердца, пороках сердца, фибрилляции предсердий, пристеночном ревматическом эндокардите; пристеночные тромбы, расположенные в полости острой или хронической аневризмы сердца, — при ишемической болезни сердца; пристеночные тромбы в аорте и крупных артериальных стволах, отходящих от аорты, — при атеросклерозе.
По данным анализа 13 000 патологоанатомических вскрытий, проведенных на кафедре патологической анатомии ММА им. И.М.Сеченова [Серов В.В. и др., 1980], тромбоз и его осложнения были обнаружены в 8157 наблюдениях, из которых 45,8 % составил артериальный тромбоз. Наибольшее число артериальных тромбов встречается у больных старше 70 лет (38,8 %), чаще у женщин, чем у мужчин. При ревматизме артериальные тромбы обнаруживались преимущественно в полостях сердца в 40,7 % случаев, при опухолях — в 4,7 %.
В отличие от венозной тромбоэмболии в большом круге кровообращения, тромбоэмболии в артериальной его части ведут к развитию инфарктов почек, селезенки, головного мозга, сердца, гангрене кишечника и конечностей. Частота поражения разных органов различна. Так, наиболее часто развивается гангрена нижних конечностей (70—75
% случаев), инфаркты головного мозга (10 %), инфаркты других внутренних органов (10 %), гангрена нижних конечностей (7—8 %).
Тромбоэмболия инфицированными тромбоэмболами, как это бывает при бактериальном эндокардите при септикопиемии и инфекционном эндокардите, приводит к развитию септических инфарктов с последующим формированием абсцессов.
Последствия тромбоэмболического синдрома для организма зависят не столько от величины тромбоэмбола и зоны некроза, им вызванного, сколько от их локализации. Так, обтурация крупным тромбоэмболом бедренной артерии, приводящая к развитию гангрены нижней конечности, необязательно заканчивается смертью больного. Тромбоэмболия селезеночной или веточки почечной артерии также не представляет опасности для жизни пациента. Напротив, мельчайший тромбоэмбол в среднемозговой артерии, как правило, заканчивается развитием летального инфаркта головного мозга, хотя имеются исключения и в данной ситуации, поскольку при сохранности сосудов артериального круга большого мозга (виллизиев круг) возможна компенсация за счет коллатерального кровообращения.
ТРОМБОБАКТЕРИАЛЬНАЯЭМБОЛИЯ• Тромбобактериальная эмболия — эмболия инфицированными тромбами. Источником тромбобактериальной эмболии могут быть тромбы, содержащие колонии микроорганизмов при гнойном тромбофлебите, тромботические наложения на клапанах сердца при бактериальном полипозно-язвенном и остром язвенном эндокардите у больных, страдающих сепсисом. Тромбобактериальная эмболия в венах закономерно развивается при формировании в организме септического очага и приводит к возникновению сепсиса. При тромбобактериальной эмболии в артериальные сосуды в органах развиваются инфицированные инфаркты, в которых некротическая ткань быстро подвергается гнойному расплавлению с последующим формированием абсцессов.