Аналитическая химия. Практикум : учеб. пособие / Харитонов Ю.Я., Григорьева В.Ю. - 2009. - 296 с.
|
|
|
|
Тема II АНАЛИЗ КАТИОНОВ ЧЕТВЕРТОЙ, ПЯТОЙ И ШЕСТОЙ АНАЛИТИЧЕСКИХ ГРУПП ПО КИСЛОТНО-ОСНОВНОЙ КЛАССИФИКАЦИИ
На изучение темы отводятся четыре или пять занятий, включающих краткое рассмотрение основных теоретических положений, предусмотренных текущим рабочим планом, решение задач по теме и экспериментальную часть.
Цель изучения темы
На основе знаний химико-аналитических свойств катионов четвертой, пятой и шестой аналитических групп по кислотно-основной классификации, теории растворов электролитов, протолитической теории кислот и оснований проводить характерные аналитические реакции катионов этих групп, определять их подлинность, анализировать их смеси.
Целевые задачи
1. Научиться проводить аналитические реакции катионов четвертой, пятой, шестой групп.
2. Научиться проводить анализ смеси катионов четвертой, пятой, шестой групп.
3. Научиться проводить расчеты рН растворов кислот, оснований, солей, буферных смесей.
Занятие 4. Аналитические реакции и анализ смеси катионов четвертой аналитической группы по кислотно-основной классификации
Цель занятия:
- научиться проводить аналитические реакции катионов четвертой аналитической группы;
- научится проводить анализ смеси катионов четвертой аналитической группы в растворе.
Задание для самоподготовки
К занятию надо знать
1. Общую химико-аналитическую характеристику катионов четвертой аналитической группы по кислотно-основной классификации (состав группы, групповой реагент).
2. Основные химические свойства катионов четвертой аналитической группы и их важнейших соединений (амфотерность, гидролитические и окислительно-восстановительные свойства, способность к комплексообразованию).
3. Аналитические реакции катионов четвертой аналитической группы.
4. Правила техники безопасности и работы в химико-аналитической лаборатории.
Уметь
1. Составлять уравнения окислительно-восстановительных реакций.
2. Составлять уравнения реакций гидролиза солей, растворения ам-фотерных гидроксидов катионов четвертой группы в щелочах с образованием гидроксокомплексов и других реакций комплексообразова-ния этих катионов.
Литература
Харитонов ^.^.Аналитическая химия (аналитика). 1, гл. 13, с. 328-
333; гл. 15, с. 372 - 383.
Лурье Ю.Ю. Справочник по аналитической химии. - М.: Химия,
1989.
Вопросы для самопроверки
1. Назовите групповой реагент и перечислите катионы, входящие в четвертую группу.
2. Укажите цвет гидроксидов катионов четвертой группы.
3. В чем растворяются гидроксиды катионов четвертой группы, и какие соединения образуются при этом? Напишите соответствующие уравнения реакций.
4. Какой катион четвертой группы образует с аммиаком комплексный ион? Напишите его формулу.
5. Напишите формулы комплексных анионов, которые образуют Sn(II), Sn(IV), As(III), As(V) в растворе концентрированной хлороводородной кислоты.
6. Перечислите катионы четвертой группы, проявляющие окислительно-восстановительные свойства. Как действует групповой реагент на эти ионы?
7. Напишите в ионном виде уравнение реакции окисления Cr3+ пе-роксидом водорода в щелочной среде.
8. Напишите в ионном виде уравнение реакции, подтверждающее восстановительные свойства арсенит-иона.
9. Какой из катионов четвертой группы окрашен?
10. Какую специфическую реакцию используют для обнаружения катионов хрома(Ш)?
11. Каков цвет хромат- и дихромат-ионов? Напишите уравнение реакции их взаимного перехода.
12. Для обнаружения какого катиона четвертой группы используют органический реагент ализарин?
13. Для обнаружения какого катиона четвертой группы используют органический реагент дитизон?
Лабораторная работа
Реактивы
1. Растворы солей:
- нитратов алюминия, хрома(Ш), цинка, висмута(Ш); хлорида олова(П), хромата и дихромата калия, иодида калия, арсенита и арсе-ната натрия, нитрата кобальта, сульфида аммония, молибдата аммония, гидрокарбоната натрия, гексацианоферрата(П) калия;
- раствор иода в иодиде калия;
- магнезиальная смесь (смесь растворов хлоридов магния и аммония и аммиака);
- 6 % раствор пероксида водорода;
- 0,2 % раствор крахмала.
2. Органические реагенты и растворители:
- насыщенный раствор ализарина в 50 % этиловом спирте, 0,1 % раствор дитизона в четыреххлористом углероде или хлороформе;
- амиловый спирт, диэтиловый эфир или их смесь.
3. Кристаллический гидрокарбонат натрия.
4. Металлическое железо (стружка или скрепки). Учебные таблицы
1. Частные реакции катионов четвертой аналитической группы.
2. Классификация катионов по кислотно-основному методу.
3. Реакции катионов цинка, алюминия с органическими реагентами.
1. Аналитические реакции катионовчетвертой аналитической группы по кислотно-основной классификации: Zn2+,Al3+,Sn2+,Sn4+,As3+,As5+,Cr3+
При действии группового реагента (водного раствора гидроксида натрия NaOH или калия KOH в присутствии пероксида водорода H2O2) катионы четвертой аналитической группы осаждаются из водного раствора в виде амфотерных гидроксидов, растворимых в избытке щелочи с образованием гидроксокомплексов, например:
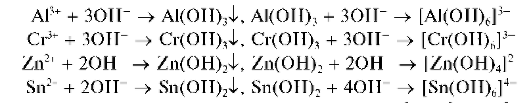
В присутствии пероксида водорода катионы Cr3+,As3+ иSn2+ окисляются соответственно до хромат-ионов CrO2.2, арсенат-ионов AsO4~ и гексагидроксостаннат(IV)-ионов [Sn(OH)6]2-.
Осадки гидроксидов катионов четвертой аналитической группы не растворяются в водном аммиаке, за исключением гидроксида цинка Zn(OH)2, который растворяется в водном растворе аммиака с образованием аммиачного комплекса [Zn(NH3)4]2+.
При рассмотрении катионов четвертой аналитической группы мы-шьяк(Ш) и мышьяк(V) считают катионами As3+ иAs5+ условно, так как в водных средах соответствующие соединения присутствуют обычно не в форме указанных катионов, а в форме анионов - арсенит-ионов AsO32 или AsO2 - анионов ортомышьяковистой H3AsO3 или метамы-шьяковистой HAsO2 кислот и арсенат-ионов AsO42 - анионов мышьяковой кислоты H3AsO4 В концентрированных растворах хлороводородной кислоты существуют комплексные анионы [AsCl4]^[AsCl6]-.
Даже если исходное вещество и содержало формально мышьяк в виде катионов, например, AsCl3,As2O3,As2O5 и т.д., то в водной среде оно гидролизуется с дальнейшим образованием анионной формы мы-шьяка(Ш) или мышьяка(V):
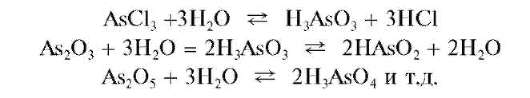
В соответствии с изложенным при проведении анализа по кислотно-основному методу обычно используют аналитические реакции на арсенитили арсенат-анионы, а не на катионы мышьяка(Ш) или мы-шьяка(V).
Действие группового реагента
При действии группового реагента (избыток 2 моль/л раствора гид-роксида натрия NaOH в присутствии пероксида водорода H2O2)нарас-твор, содержащий смесь катионов четвертой группы, наряду с образованием гидроксокомплексов происходит одновременное окисление пероксидом водорода хрома(Ш), мышьяка(Ш), олова(11) до высших степеней окисления с образованием соответственно анионов CrO4-, AsO4 - ,[Sn(OH)6]2-:
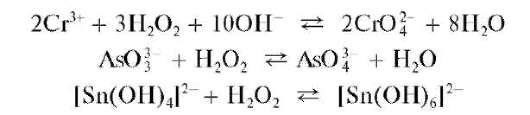
Методика. В четыре пробирки помещают по нескольку капель растворов солей алюминия(Ш), хрома(Ш), цинка, олова(11). В каждую пробирку осторожно, по каплям добавляют раствор гидроксида натрия, наблюдая за образованием аморфных осадков Al(OH)3,Zn(OH)2, Sn(OH)2 белого цвета, Cr(OH)3 - серо-зеленого или сине-фиолетового цвета. При последующем добавлении избытка гидроксида натрия осадки растворяются, давая при растворении гидроксидов алюминия, цинка, олова(11) бесцветные растворы, а при растворении гидр-оксида хрома(Ш) - зеленый раствор (цвет гидроксокомплексов хро-ма(Ш)).
При добавлении к зеленому раствору соли хрома нескольких капель раствора пероксида водорода и нагревании на водяной бане в течение 5-7 минут окраска переходит в желтую (цвет хромат-иона). Аналогичный эффект получают и при добавлении избытка гидроксида натрия к раствору соли хрома(Ш), в который заранее был добавлен пероксид водорода.
Изучают также действие раствора аммиака на соли алюминия, цинка, хрома(Ш) и олова(11) при недостатке и избытке реагента.
Аналитические реакции катиона цинка Zn2+
Реакция с щелочами. Катионы Zn2+ образуют с гидроксидами щелочных металлов белый осадок гидроксида цинка Zn(OH)2, растворяющийся в избытке щелочи с образованием бесцветного гидроксокомп-лекса [Zn(OH)4]2-: 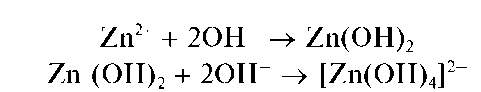
Методика. В пробирку вносят 5-6 капель раствора хлорида цинка ZnCl2, прибавляют 1-2 капли раствора NaOH. Выпадает белый осадок гидроксида цинка. Продолжают прибавлять по каплям раствор NaOH при перемешивании содержимого пробирки. Осадок растворяется.
Реакция с раствором аммиака. Как и щелочи, аммиак вначале образует с катионами Zn2+ белый осадок гидроксида цинка, который при дальнейшем прибавлении раствора аммиака растворяется с образованием бесцветного аммиачного комплекса цинка [Zn(NH3)4]2+:
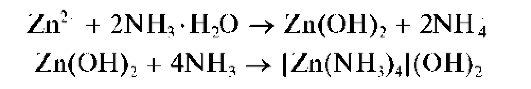
Методика аналогична предыдущей.
Реакция с сульфид-ионами (фармакопейная). Катионы Zn2+ образуют с сульфид-ионами S2-в нейтральной, слабокислой или слабощелочной среде (2 < рН < 9) белый осадок сульфида цинка ZnS:
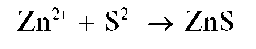
Осадок не растворяется в уксусной кислоте, но растворяется в растворах HO и других минеральных кислот. Реакцию часто проводят в уксуснокислой среде, так как в этих условиях открытию Zn2+ не мешают остальные катионы четвертой аналитической группы, за исключением олова(11).
Методика. К 2-3 каплям раствора ZnCl2 прибавляют 1-2 капли свежеприготовленного раствора сульфида аммония (NH4)2S. Выпадает белый осадок сульфида цинка.
Реакция с гексацианоферратом(П) калия (фармакопейная). Катионы Zn2+ образуют (быстрее - при нагревании) с K4[Fe(CN)6] в нейтральной или слабокислой среде белый осадок смешанного гексацианофер-рата(11) калия и цинка K2Zn3[Fe(CN)6]2:
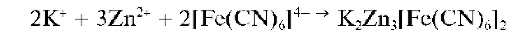
Осадок нерастворим в разбавленной HO; растворяется в щелочах, поэтому реакцию нельзя проводить в щелочной среде. Мешают все катионы, образующие малорастворимые ферроцианиды. Катионы Al3+ и Cr3+ не мешают.
Предельная концентрация при обнаружении катионов цинка составляет ~1 мкг/мл = 10-6 г/мл.
Методика. В пробирке к 5-10 каплям раствора ZnCl2 прибавляют 5-6 капель раствора K4[Fe(CN)6]. Смесь нагревают до кипения. Выпадает белый осадок гексацианоферрата(П) калия и цинка.
Реакция с дитизоном (дифенилтиокарбазоном). При смешивании хлороформного раствора дитизона (экстракционный реагент) с водным щелочным раствором, содержащим катионы Zn2+, образуется дитизонатный комплекс цинка красного цвета, экстрагирующийся из водной фазы в органическую. Хлороформный слой принимает более интенсивную красную окраску, чем водный.
Протекание реакции предположительно можно описать следующей схемой. В растворах дитизона устанавливается таутомерное равновесие между тионной и тиольной формами:
Тиольная форма представляет собой слабую двухосновную кислоту, способную отщеплять ионы водорода, в первую очередь - от группы SH, и образовывать комплексы с ионами металлов-комплексообразо-вателей. Если отщепляется только один протон, то в результате реакции с катионами цинка возникает внутрикомплексное соединение, содержащее два дитизонатных аниона:
Наличие щелочи способствует смещению равновесия вправо вследствие связывания выделяющихся ионов водорода в молекулы воды.
Реакция высокочувствительна: предел обнаружения - 0,025 мкг. Позволяет открывать катионы цинка при очень низких концентрациях. Мешают катионы, также образующие дитизонатные комплексы (Cd2+,Pb2+, Sn(II) и др.).
Методика. В пробирку вносят 5-10 капель раствора ZnCl2,прибав-ляют постепенно несколько капель раствора NaOH до растворения выпавшего белого осадка гидроксида цинка и ~5 капель хлороформного раствора дитизона. Пробирку встряхивают несколько раз. После расслоения смеси хлороформный слой окрашивается в красный цвет.
Реакция образования «зелени Ринмана». При нагревании смеси нитрата цинка Zn(NO3)2 и нитрата кобальта Co(NO3)2 протекает реакция образования смешанного оксида кобальта и цинка CoZnO2 зеленого цвета - так называемой «зелени Ринмана»:
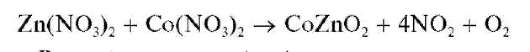
Методика. В пробирке или в фарфоровом тигле смешивают ~5 капель раствора Zn(NO3)2 и ~5 капель раствора Co(NO3)2 Смесь нагревают до кипения и кипятят около минуты. Горячим раствором смачивают полоску фильтровальной бумаги, высушивают ее и озоляют в фарфоровом тигле на газовой горелке. Образуется зола зеленого цвета.
Другие реакции катионов цинка. Катионы Zn2+ при реакциях в растворах образуют осадки разного состава: с тетрароданомеркуратом(П) аммония (NH4)2[Hg(SCN)4] - белый тетрароданомеркурат(П) цинка Zn[Hg(SCN)4]; с хлоридом кобальта CoCl2 и (NH4)2[Hg(SCN)4]-голу-бой ZnCofHg^CN^^Na^PO.j - белый Zn3(PO4)2 (растворяется в кислотах и в аммиаке), а в присутствии аммиака - менее растворимый белый NH4ZnPO4 (растворяется в кислотах, щелочах, аммиаке); c карбонатом натрия или калия - белый осадок основной соли переменного состава; с K2CrO4 - желтый ZnCrO4 (растворяется в кислотах и щелочах). Катионы цинка образуют также осадки комплексных соединений с различными органическими реагентами.
Аналитические реакции катиона алюминия Al3+
Реакция с щелочами. Катионы Al3+ при реакциях с щелочами в растворах дают белый осадок гидроксида алюминия Al(OH)3, который растворяется в избытке щелочи с образованием гидроксокомплекса [Al(OH)6]3- (иногда гидроксокомплексам алюминия в растворе приписывают состав [Al(OH)4]-):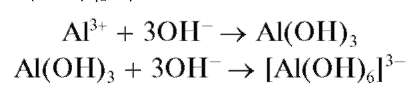
Наиболее полное осаждение гидроксида алюминия происходит при pH « 5-6. Осадок Al(OH)3 растворяется в кислотах, но не растворяется в аммиаке.
При добавлении солей аммония к щелочному раствору (особенно при нагревании), полученному после растворения гидроксида алюминия, гидроксокомплексы алюминия разрушаются и снова выпадает осадок гидроксида алюминия: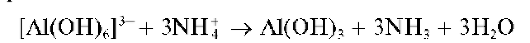
Методика. В пробирку вносят 3-5 капель раствора хлорида алюминия AlCl3 и прибавляют по каплям раствор NaOH. Выпадает белый осадок гидроксида алюминия. Продолжают прибавление по каплям раствора NaOH. Осадок растворяется.
К раствору прибавляют несколько кристаллов хлорида аммония и нагревают смесь. Снова выпадает осадок гидроксида алюминия.
Реакция с аммиаком. Катионы Al3+ образуют с аммиаком, как и с щелочами, белый аморфный осадок гидроксида алюминия:
В избытке раствора аммиака осадок не растворяется, в отличие от действия щелочей. Методика - аналогична предыдущей.
Реакция с нитратом кобальта - образование «тенаровой сини» (фармакопейная). При прокаливании соли алюминия, смоченной разбавленным раствором нитрата кобальта Co(NO3)2, образуется смешанный оксид алюминия и кобальта (алюминат кобальта) Co(AlO2)2 синего цвета - так называемая «тенаровая синь»:
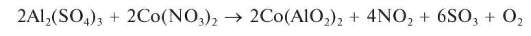
Методика. Полоску фильтровальной бумаги смачивают вначале 1-2 каплями раствора сульфата алюминия Al2(SO4)3, а затем 1-2 каплями разбавленного раствора нитрата кобальта. Бумагу высушивают, помещают в фарфоровый тигель и озоляют на газовой горелке. Получают золу синего цвета - «тенаровую синь».
Реакция с ализарином. Ализарин - 1,2-диоксиантрахинон, а также некоторые его производные при реакциях с катионами Al3+ в аммиачной среде образуют малорастворимые комплексные соединения ярко-красного цвета, называемые «алюминиевыми лаками». С ализарином реакция протекает по схеме:
Комплекс устойчив в уксуснокислой среде. Реакция высокочувствительна: предел обнаружения - 0,5 мкг. Мешают катионы, также образующие комплексы с ализарином (Zn2+,Sn(II),Cr3+,Mn2+,Fe3+ идр.).
Реакцию можно выполнять капельным методом на фильтровальной бумаге.
Методика. На лист фильтровальной бумаги наносят 1-2 капли раствора соли алюминия. Бумагу держат 1-2 мин в парах аммиака над склянкой с концентрированным раствором аммиака. Пары аммиака, соприкасаясь с влажным пятном, образуют на бумаге гидроксид алюминия.
На пятно наносят каплю раствора ализарина и снова держат бумагу в парах аммиака. Пятно вначале окрашивается в фиолетовый цвет (цвет фона ализарина). Бумагу подсушивают, наносят на нее 1-2 капли раствора уксусной кислоты и снова высушивают. Пятно становится розово-красным.
Если в растворе одновременно с катионами алюминия присутствуют другие катионы, также дающие с ализарином комплексы, то капельную реакцию с ализарином проводят на фильтровальной бумаге, пропитанной раствором ферроцианида калия K4[Fe(CN)6]. При нанесении капли раствора на такую бумагу образуются малорастворимые ферроцианиды мешающих катионов, дающие темное пятно, а катионы Al3+, не дающие осадка ферроцианида, при прибавлении капли воды переносятся растворителем на периферию пятна, где после обработки парами аммиака и раствором ализарина образуют ализариновый комплекс алюминия. При высушивании бумаги фиолетовый фон ализарина исчезает, а красная окраска алюминиевого лака - остается.
Реакция с алюминоном. Катион Al3+ при взаимодействии с алюминоном - аммонийной солью ауринтрикарбоновой ислоты (обозначим ее для краткости NH4L) образует в уксуснокислой или аммиачной среде комплекс красного цвета (по-видимому, состава Al(OH)2L). Точно строение комплекса в растворе неизвестно.
Реакция высокочувствительна. Мешают катионы Ca2+,Cr3+,Fe3+, также образующие окрашенные комплексы с алюминоном.
Методика. В пробирку вносят 3-4 капли раствора соли алюминия, 2-3 капли раствора уксусной кислоты и 3-5 капель 0,01 % раствора алюминона. Смесь нагревают на водяной бане, прибавляют несколько капель раствора аммиака до щелочной реакции (по лакмусовой бумаге) и 2-3 капли раствора карбоната аммония. Выпадает красный хлопьевидный осадок.
Другие реакции катиона алюминия. Катионы Al3+ образуют также осадки при реакциях в растворах: с Na2HPO4 - белый AlPO.j^ CH3COONa - белый CH3COOAl(OH)2, с оксихинолином (краткое условное обозначение HОx) - желто-зеленый [Al(Ox)3]исдругими неорганическими и органическими реагентами.
Аналитические реакции катиона олова(П)
Реакция с щелочами. Соединения олова(11) при взаимодействии с щелочами выделяют из растворов белый осадок гидроксида олова(11) Sn(OH)2, растворимый в избытке реагента с образованием гидроксо-комплекса [Sn(OH)4]2-:
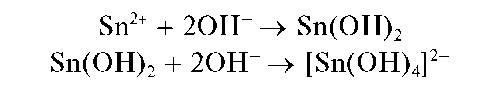
Осадок Sn(OH)2 растворяется в кислотах.
Методика. В пробирку вносят несколько капель раствора соли оло-ва(11) (обычно - солянокислого) и прибавляют по каплям раствор NaOH: вначале до выпадения белого осадка Sn(OH)2, а затем - до его растворения.
Реакция с аммиаком. При прибавлении раствора аммиака к раствору, содержащему олово(11), выделяется белый осадок гидроксида олова Sn(OH)2, который не растворяется в избытке аммиака:
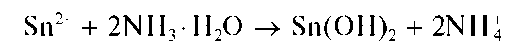
Методика проведения реакции аналогична предыдущей.
Реакция с сульфид-ионами. При взаимодействии олова(11) с сульфид-ионами S2- из раствора выпадает темно-коричневый осадок сульфида олова(11) SnS: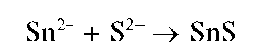
Осадок не растворяется в щелочах, в избытке раствора сульфида натрия.
Методика. К нескольким каплям раствора соли олова(11) прибавляют несколько капель раствора сульфида натрия Na2S (или же сульфида аммония (NH4)2S либо сероводородной воды). Выпадает бурый осадок сульфида олова(11) SnS.
Реакция с солями висмута(Ш). Олово(11) является хорошим восстановителем. Так, при взаимодействии с висмутом(Ш) в щелочной среде оно восстанавливает висмут(Ш) до металлического висмута, само окисляется до олова(ГУ): 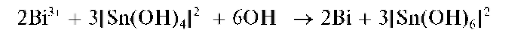
Металлический висмут, выделяясь в тонкодисперсном состоянии, образует осадок черного цвета.
Методика. В пробирку вносят 3- 5 капель раствора соли олова(II) и прибавляют по каплям раствор NaOH. Вначале выпадает белый осадок Sn(OH)2, который при дальнейшем прибавлении NaOH растворяется. К полученному щелочному раствору прибавляют 1-2 капли раствора нитрата висмута(Ш). При перемешивании смеси выпадает черный осадок металлического висмута.
Реакция с хлоридом ртути(П). Олово(II) восстанавливает соединения ртути(II) до металлической ртути, выделяющейся, как и металлический висмут, в виде черного осадка. Реакция протекает в две стадии. Вначале ртуть(II) восстанавливается до ртути(II), а затем - до металлической ртути: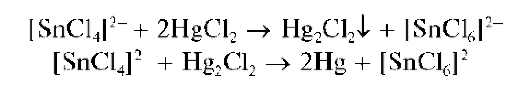
Методика. В пробирку вносят 3-5 капель солянокислого раствора хлоридаолова(П) иприбавляют2-3 каплирастворахлорида рту-ти(II) - сулемы HgCl2 Выпадает белый осадок каломели Hg2Cl2,кото-рый постепенно чернеет за счет выделяющейся металлической ртути.
Другие реакции олова(П). Соединения олова(II) при взаимодействии с молибдатом аммония образуют так называемую «молибденовую синь» (раствор окрашивается в синий цвет); с Na2HPO4 дают белый осадок Sn3(PO4)2 (растворяется в кислотах и щелочах); при реакции с FeCl3 восстанавливают железо(Ш) до железа(II), причем в присутствии гексацианоферрата(Ш) калия K3[Fe(CN)6] раствор сразу же окрашивается в синий цвет вследствие образования турнбулевой сини. Известны и другие реакции олова(II) с неорганическими и органическими реагентами.
Аналитические реакции олова(IV)
Олово(IV) обычно открывают, предварительно восстановив его металлическим железом, магнием, алюминием и т.д. до олова(II). Затем проводят реакции, характерные для олова(II), как описано в предыдущем разделе.
Реакция олова(IV) с щелочами. При медленном (по каплям) прибавлении раствора щелочи к раствору, содержащему олово(IV), вначале выпадает белый осадок Sn(OH)4, который называют а-оловянной кислотой - состав осадка можно также представить формулой H2SnO3 H2O. Свежеосажденный осадок растворяется в избытке раство-
ра щелочи с образованием гидроксокомплексов олова(IV) состава [Sn(OH)6]2- . Реакцию можно описать условной схемой:
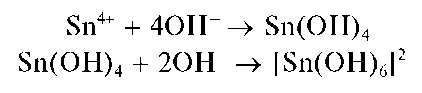
Иногда (особенно - в «старых» руководствах) последнюю реакцию представляют также в виде
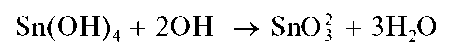
с образованием станнат-ионов SnO22-. Обе схемы эквивалентны, поскольку гидроксокомплексу соответствует также формула SnO2- 3H2O.
При стоянии раствора с осадком а-оловянной кислоты последняя постепенно «стареет» и превращается в р-оловянную кислоту H2SnO3, трудно растворимую в щелочах и в хлороводородной кислоте.
Методика. В пробирку вносят 3- 4 капли раствора соли олова(IV) и по каплям прибавляют раствор NaOH. Вначале выпадает белый осадок, который растворяется при добавлении избытка раствора щелочи.
Реакция с сульфид-ионами. Пропускание сероводорода H2S через кислые растворы, содержащие олово(IV), или прибавление к ним сероводородной воды приводят к выпадению желтого осадка сульфида олова(IV) SnS2:
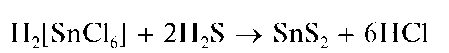
Осадок сульфида олова(IV), в отличие от сульфида олова(ГГ),рас-творяется в избытке сульфида аммония (NH4)2S или сульфида натрия Na2S с образованием тиосолей:
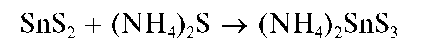
Поэтому при прибавлении растворов сульфидов аммония или натрия к кислым растворам солей олова(IV) осадок сульфида олова(IV) не выпадает.
Методика. В пробирку вносят 3-4 капли солянокислого раствора соли олова(IV) и прибавляют по каплям сероводородную воду. Выпадает желтый осадок сульфида олова(IV).
При добавлении к смеси раствора сульфида натрия или аммония осадок растворяется.
Реакция восстановления олова(IV) до олова(II). Для восстановления олова(IV) до олова(II) можно применять различные восстановители.
При восстановлении олова(IV) металлическим железом в солянокислой среде реакция протекает по схеме:
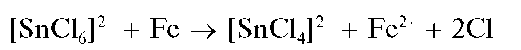
Олово(П), полученное после восстановления олова(IV), открывают реакциями с солями висмута(ГГГ), c хлоридом ртути(ГГ) и др.
Методика. В пробирку вносят 8-10 капель раствора соли олова(IV), 2-3 капли концентрированной HCl, прибавляют немного железных опилок или железных стружек и нагревают смесь до кипения. Через 3-5 мин отфильтровывают оставшееся металлическое железо и в фильтрате открывают олово(ГГ), как описано выше в предыдущем разделе.
Другие реакции олова(IV). C рядом органических реагентов оло-во(IV) образует окрашенные или малорастворимые комплексы. Так, с купфероном C6H5N(NO)ONH4 в кислой среде олово(IV) дает малорастворимый осадок купфероната олова(IV), состав которого, по-видимому, отвечает формуле [Sn(C6H5N(NO)O)4].
С хлоридами рубидия и цезия олово(IV) образует малорастворимые комплексные соли состава Rb2[SnCl6^Cs2[SnCl6]. Реакцию проводят как микрокристаллоскопическую.
Аналитические реакции мышьяка(Ш) и мышьяка(V)
Мышьяк(Ш) и мышьяк(V) обычно открывают в виде арсенит-ионов AsO32 (AsO-) и арсенат-ионов AsO32 соответственно, т.е. в форме анионов, а не в форме катионов. Поэтому реакции этих анионов описаны далее в разделе, посвященном рассмотрению аналитических реакций анионов.
Аналитические реакции катиона хрома(Ш) Cr3+
Реакции с щелочами и с аммиаком. Катионы Cr3+ с растворами щелочей или аммиака образуют осадок гидроксида хрома(Ш) Cr(OH)3 серо-зеленого или сине-фиолетового цвета:
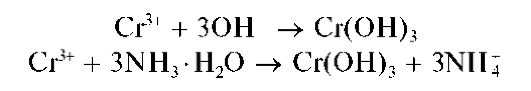
Осадок Cr(OH)3, обладающий амфотерными свойствами, растворяется как в щелочах, так и в кислотах: 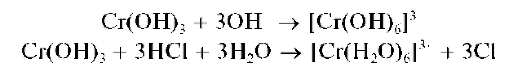
В растворе аммиака гидроксид хрома(III) растворяется лишь частично с образованием фиолетового комплекса [Cr(NH3)6]3+:
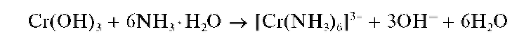
Методика. В две пробирки вносят по нескольку капель соли хро-ма(ГГГ). В пробирки прибавляют по каплям: в первую - раствор NaOH, во вторую - раствор аммиака до выпадения серо-зеленого (или сине-фиолетового) осадка. При прибавлении в первую пробирку (по каплям) раствора NaOH и перемешивании осадок растворяется с образованием раствора зеленого цвета. Добавление (по каплям) во вторую пробирку раствора аммиака приводит лишь к частичному растворению осадка. Раствор над осадком становится фиолетовым.
Реакции окисления катионов хрома(III) до хромат-ионов и дихромат-ионов. Катионы Cr3+ при взаимодействии с окислителями (перок-сидом водорода, перманганатом калия и др.) окисляются до хромат-анионов CrO2.- или до дихромат-анионов Cr2O7-, окрашивающих раствор в желтый (окраска хромат-ионов) или желто-оранжевый (окраска дихромат-ионов) цвет.
а) Окисление пероксидом водорода. Окисление пероксидом водорода H2O2 проводят обычно в щелочной среде при нагревании:
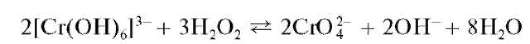
Методика. В пробирку вносят 2-3 капли раствора соли хрома(III), прибавляют 4-5 капель 2 моль/л раствора NaOH, 2-3 капли 3 % раствора H2O2 и нагревают до изменения зеленой окраски раствора (цвет аквокомплексов [Cr(H2O)6]3+) на желтую (цвет хромат-ионов CrO2-). Раствор сохраняют для проведения реакции получения надхромовой кислоты (см. ниже).
б) Окисление персульфатом аммония. Катион Cr3+ вкислойсреде окисляется персульфат-ионом S2O2_ до дихромат-иона Cr2O2_ ,окра-шивающего раствор в желто-оранжевый цвет:
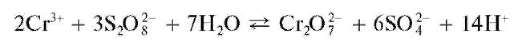
Реакция ускоряется в присутствии следов солей серебра(Г), действующих как катализатор.
Методика. В пробирку вносят последовательно 5-6 капель раствора персульфата аммония (NH4)2S2O8,1каплю1 моль/л раствора серной кислоты H2SO4, каплю раствора азотнокислого серебра AgNO3 и2-3 капли раствора сульфата или нитрата хрома(III) (но не хлорида, так
как хлорид-ионы также окисляются!). Раствор принимает желто-оранжевую окраску (цвет дихромат-ионов Cr2O7-).
в) Окисление перманганатом калия. Перманганат калия KMnO4 в сернокислой среде при нагревании окисляет катион Cr3+ до дихромат-иона, что можно описать схемой:
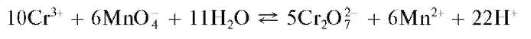
Раствор окрашивается в желто-оранжевый цвет. При прибавлении избытка раствора перманганата калия окисляется катион марганца(П) Mn2+ и выделяется бурый осадок MnO(OH)2:
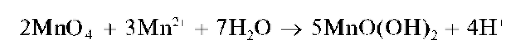
Увеличение кислотности среды препятствует образованию осадка
MnO(OH)2.
Методика. В пробирку вносят 3-4 капли раствора сульфата или нитрата (но не хлорида!) хрома(III), 3-4 капли раствора серной кислоты, смесь нагревают и прибавляют к ней по каплям раствор KMnO4 до приобретения раствором желто-оранжевой окраски. При дальнейшем прибавлении раствора KMnO4 выпадает бурый осадок MnO(OH)2.
Реакция образования надхромовой кислоты. Окисление катионов Cr3+ до хроматили дихромат-ионов подтверждают, помимо идентификации окраски раствора, реакцией образования надхромовой кислоты
H2CrO6.
При действии пероксида водорода H2O2 на раствор, содержащий хромат-ион (образовавшийся, например, при окислении катионов Cr3+ пероксидом водорода, как описано выше), в сернокислой среде образуется надхромовая кислота H2CrO6 синего цвета:
i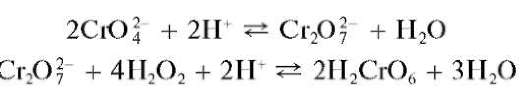
В водных растворах надхромовая кислота неустойчива и разлагается до соединений хрома(III), окрашивающих раствор в зеленый цвет. Однако в растворах органических растворителей она сравнительно устойчива. Поэтому ее обычно экстрагируют из водного раствора органическим экстрагентом (диэтиловым эфиром, изоамиловым спиртом и др.), который окрашивается в интенсивно синий цвет.
Реакция специфична для соединений хрома и высокочувствительна: предел обнаружения - 2,5 мкг.
Методика. Желтый раствор, полученный при окислении хрома(Ш) пероксидом водорода (см. выше), нагревают до кипения, охлаждают под струей холодной воды, прибавляют 5 капель пероксида водорода, ~0,5 мл смеси амилового спирта и диэтилового эфира, тщательно перемешивают и прибавляют по каплям раствор H2SO4 (1 моль/л). Верхний органический слой окрашивается в интенсивно синий цвет.
Другие реакции катионов хрома(Ш). Катион Cr3+ с гидрофосфатом натрия Na2HPO4 образует осадок фосфата хрома CrPO4 зеленого цвета, растворимый в кислотах и щелочах; c арсенитами и арсенатами дает малорастворимые осадки арсенита CrAsO3 и арсената CrAsO4 соответственно.
В табл. 5 охарактеризованы продукты некоторых аналитических реакций катионов четвертой аналитической группы.
2. Анализ смеси катионовчетвертой аналитической группы: Zn2+,Al3+,Sn2+,Sn4+,As3+,As5+,Cr3+
При наличии осадка его растворяют добавлением несколько капель 2 моль/л раствора хлороводородной кислоты HCl.
Анализ раствора, содержащего смесь всех катионов четвертой аналитической группы, ведут по следующей схеме.
Вначале проводят предварительные испытания: в отдельных небольших пробах (несколько капель) анализируемого раствора дробным методом открывают катионы, присутствующие в растворе, учитывая мешающее действие отдельных катионов друг на друга. Далее проводят систематический анализ, как описано ниже.
Предварительные испытания.
Открытие катионов алюминия Al3+. Катионы алюминия открывают капельным методом реакцией с ализарином. Открытию катионов алюминия с помощью этой реакции мешают катионы хрома, цинка, олова. Поэтому капельную реакцию с ализарином проводят на фильтровальной бумаге, пропитанной раствором гексацианоферрата(П) калия К4^е(С^6]. Мешающие катионы связываются в соответствующие малорастворимые гексацианоферраты(П) и образуют на бумаге темное пятно, а катионы алюминия перемещаются с водным раствором к периферии пятна, где при последующей реакции с ализарином в парах аммиака образуют комплекс с ализарином розового цвета - бумага окрашивается в розово-красный цвет.
Для проведения реакции 2-3 капли анализируемого раствора наносят в центр листа фильтровальной бумаги, пропитанной раствором гек-сацианоферрата(П) калия. Лист выдерживают в парах аммиака. Мешающие катионы дают темное пятно смеси гексацианоферратов(П), а катионы алюминия образуют гидроксид алюминия Al(ОН)3. На влажное пятно наносят 1-2 капли раствора ализарина и снова выдерживают бумагу над парами аммиака. Образуется розовый комплекс алюминия с ализарином. Пятно смачивают несколькими каплями уксусной кислоты (2 моль/л) и дают возможность растворителю самопроизвольно (за счет действия капиллярных сил) переместиться от центра пятна к периферии. Вместе с растворителем перемещаются катионы алюминия, образующие комплекс алюминия с ализарином, окрашивающий периферийный участок бумаги в розово-красный цвет на слабо-фиолетовом фоне (цвет ализарина). При высушивании бумаги фиолетовый фон свободного ализарина исчезает, а розово-красная окраска комплекса остается, поскольку комплекс устойчив в уксуснокислой среде.
Открытие катионов хрома(Ш) Cr3+. Катионы Сг3+ предварительно открывают, окисляя их пероксидом водорода до хромат-ионов CrO44 в присутствии щелочи. Если при прибавлении к пробе анализируемого раствора нескольких капель пероксида водорода и щелочи раствор окрашивается в желтый цвет, то это указывает на присутствие катионов Сг3+, которые окислились до хромат-ионов, придающих раствору желтую окраску.
Для дальнейшего подтверждения наличия катионов Сг3+ проводят реакцию образования надхромовой кислоты H^K^ Для этого к отдельной порции раствора (5-6 капель) прибавляют по 3-4 капли 3 % раствора пероксида водорода и 2 моль/л раствора гидроксида натрия. Смесь нагревают несколько минут на водяной бане, охлаждают до комнатной температуры, прибавляют еще ~5 капель раствора перокси-да водорода той же концентрации, ~0,5 мл смеси амилового спирта и эфира (экстрагент). Тщательно перемешивают полученную смесь двух жидких фаз (верхняя органическая и нижняя водная) и медленно прибавляют к ней ~5 капель серной кислоты (1 моль/л). Если органический слой окрашивается в интенсивный синий цвет, то это указывает на присутствие надхромовой кислоты H2CrО6 в органической фазе.
Открытие олова(11). Присутствие олова(11) доказывают реакциями с солью висмута(Ш) в щелочной среде и с солью ртути(11).
При реакции олова(11) с солью висмута(Ш) последний восстанавливается до металлического висмута, выпадающего в виде черного осадка. При реакции олова(11) с солью ртути(11) происходит восста-
новление ртути(11) вначале до ртути(1), а затем - до металлической ртути. При этом олово(11) окисляется до олова(ГУ).
Для проведения первой реакции к 3-5 каплям анализируемого раствора медленно прибавляют раствор 2 моль/л гидроксида натрия до сильно щелочной реакции и затем 1-2 капли раствора нитрата висму-та(Ш) Вi(NО3)3. В присутствии олова(11) появляется черный осадок металлического висмута.
Для проведения второй реакции к нескольким каплям анализируемого раствора прибавляют 2-3 капли раствора хлорида ртути(11) HgCl2 В присутствии олова(11) вначале происходит восстановление ртути(11) до ртути(1) и выделяется белый осадок каломели Hg2Cl2,m> степенно чернеющий вследствие образования тонкодисперсной металлической ртути при дальнейшем восстановлении ртути(1) оло-вом(11) до металлической ртути.
Открытие катионов цинка Zn2+. Катионы цинка открывают реакцией с сульфидом аммония (NH4)2S по выпадению белого осадка сульфида цинка ZnS. Открытию катионов цинка этой реакцией мешает олово(11), образующее черный осадок сульфида олова(11) SnS. Поэтому если олово(11) присутствует в растворе, то его предварительно окисляют пероксидом водорода до олова(ГУ) в щелочной среде, после чего открывают катионы цинка.
Для проведения реакции к ~0,5 мл анализируемого раствора прибавляют ~10 капель раствора пероксида водорода и ~10 капель концентрированного раствора гидроксида натрия. Полученный раствор кипятят 1-2 мин, охлаждают до комнатной температуры и прибавляют к нему 2-3 капли раствора сульфида аммония. В присутствии катионов цинка образуется белый осадок сульфида цинка ZnS.
Если олово(11) отсутствует в анализируемом растворе, то реакцию проводят в уксуснокислой среде, поскольку в данной среде остальные катионы четвертой группы не мешают открытию катионов цинка. В этом случае к ~0,5 мл анализируемого раствора прибавляют по каплям 2 моль/л раствор гидроксида натрия до сильнощелочной реакции. К образовавшемуся раствору прибавляют 2 моль/л раствор уксусной кислоты до кислой реакции (по лакмусу), после чего - несколько капель раствора сульфида аммония. В присутствии катионов цинка выпадает белый осадок сульфида цинка.
Рекомендуется открывать катионы цинка также реакцией с дитизо-ном - образуется дитизонатный комплекс цинка красного цвета. Однако целый ряд катионов также образует дитизонатные комплексы, что необходимо учитывать при проведении реакции.
Открытие мышьяка. Мышьяк открывают реакциями с сероводородной водой (или сульфидом аммония), с нитратом серебра и с мо-либдатом аммония.
Действие сероводородной воды или раствора сульфида аммония на кислые растворы, содержащие мышьяк(Ш) или мышьяк(У), приводит к образованию сульфидов As2S3 иAs2S5 желтого цвета. Сульфиды остальных катионов четвертой группы растворимы в растворах минеральных кислот.
К нескольким каплям анализируемого раствора, подкисленного раствором хлороводородной кислоты, прибавляют 2- 3 капли сероводородной воды или раствора сульфида аммония. В присутствии мышь-яка(Ш) или мышьяка(У) выделяется желтый осадок.
С нитратом серебра AgNО3 арсенит-ионы AsO3" образуют желтый аморфный осадок Ag3AsО3, а арсенат-ионы AsO3" -аморфныйосадок Ag3AsО4 шоколадного цвета. Оба осадка растворимы в азотной кислоте и в концентрированном растворе аммиака.
Для проведения реакции к 3-5 каплям анализируемого раствора прибавляют по каплям раствор нитрата серебра до выделения осадка.
С молибдатом аммония ^Н4)2МоО4 в азотнокислой среде арсе-нат-ионы образуют желтый осадок аммонийной соли мышьяковомо-либденовой гетерополикислоты ^Н4)3^О4(МоО3)12].
Для проведения реакции несколько капель анализируемого раствора выпаривают досуха в микротигле. К остатку прибавляют ~3 капли концентрированной азотной кислоты и упаривают смесь до влажного состояния остатка. К последнему прибавляют ~5 капель раствора мо-либдата аммония, перемешивают смесь и центрифугируют. В присутствии мышьяка(У) образуется желтый кристаллический осадок.
Систематический ход анализа. Систематический анализ смеси катионов четвертой аналитической группы - их разделение и последующее открытие - проводят следующим образом.
Вначале анализируемый раствор обрабатывают избытком группового реагента - раствором щелочи NaOH в присутствии пероксида водорода H2O2 при нагревании. Хром(Ш) переходит в хром(У1), оло-во(11) - в олово(ГУ), мышьяк(Ш) - в мышьяк(У). Выпавшие осадки гидроксидов растворяются в избытке группового реагента. Избыток пероксида водорода удаляют кипячением. Получают щелочной раствор, содержащий [Zn(OH)4]2-,[Al(ОН)6]3-,[Sn(ОН)6]2-,AsO3-иCrO4-.
Затем катионы алюминия и олово(ГУ) отделяют в виде осадка гидроксидов Al(ОН)3 иSn(OH)4 действием кристаллического хлорида
аммония N^Cl при частичном упаривании раствора. Осадок отделяют. В растворе остаются ^п(ОН)4]2- ,AsO4~ иCrO4~.
Осадок гидроксидов алюминия и олова(ГУ) растворяют в хлороводородной кислоте и в растворе открывают катионы алюминия - реакцией с ализарином и олово(ГУ) - реакциями с солями висмута(Ш) и ртути(11) после восстановления металлическим железом олова(ГУ) до олова(ГГ).
В растворе, полученном после отделения осадка гидроксидов алюминия и олова(ГУ), открывают катионы цинка, мышьяк(У) и хром (УГ) дробным методом, используя реакции, описанные выше (см. «Предварительные испытания»). Для контроля мышьяк(У) иногда открывают также реакцией с магнезиальной смесью - по образованию белого кристаллического осадка NН4MgAsО4.
При другом варианте окончания анализа из раствора (после отделения осадка гидроксидов алюминия и олова(ГУ)) действием концентрированного раствора соды ?2СО3 отделяют катионы цинка в виде белого осадка оксикарбоната цинка ^пОН)2СО3, который затем растворяют в хлороводородной кислоте и открывают в растворе катионы Zn2+. Хромат-ионы CrO2.- и арсенат-ионы AsO3" открывают(послеот-деления осадка (ZnОН)2CО3) дробным методом реакциями, описанными выше (см. «Предварительные испытания»).
Методика анализа. К 10-15 каплям анализируемого раствора, содержащего смесь катионов четвертой аналитической группы, в фарфоровой чашке прибавляют 3-5 капель 3 % раствора пероксида водорода и 20 % раствор гидроксида натрия при нагревании до полного растворения выпавшего осадка гидроксидов. Раствор кипятят непродолжительное время для полного удаления избытка пероксида водорода. При наличии в исходном растворе катионов хрома(Ш) Cr3+ получают раствор, окрашенный в желтый цвет за счет образования хромат-ионов CrO 4~.
К образовавшемуся раствору прибавляют малыми порциями кристаллы хлорида аммония и упаривают раствор до небольшого объема. Выпадает белый осадок гидроксидов алюминия и олова(ГУ), который отделяют центрифугированием от желтого раствора. Этот осадок промывают 2-3 раза холодной водой, отделяют от промывных вод центрифугированием и растворяют в небольшом объеме горячего раствора (2 моль/л) хлороводородной кислоты. В отдельных пробах полученного солянокислого раствора открывают катионы алюминия реакцией с ализарином (см. выше «Предварительные испытания») и олово.
При открытии олова вначале олово(ГУ) переводят в олово(ГГ) восстановлением металлическим железом. Для этого к нескольким кап-
лям солянокислого раствора прибавляют кусочек железной стружки или немного железных опилок. Через 2-3 мин удаляют остатки металлического железа и к раствору прибавляют несколько капель раствора хлорида ртути(ГГ) HgC12. В присутствии олова(ГГ) образуется вначале белый осадок каломели Hg2C12, который затем темнеет за счет выделения металлической ртути в тонкодисперсном состоянии.
Для контроля олово(ГГ) открывают также реакцией с нитратом вис-мута(ГГГ) (см. выше «Предварительные испытания»).
Желтый раствор, полученный после отделения катионов алюминия и олова(ГУ), анализируют по одному из двух вариантов.
При первом варианте в отдельных пробах этого раствора (несколько капель) открывают катионы цинка, хром и мышьяк дробным методом, как было описано выше (см. «Предварительные испытания»).
Мышьяк(У) - арсенат-ионы AsO4~ - открывают также реакцией с магнезиальной смесью. Для этого в пробирку вносят 3-5 капель раствора и столько же раствора магнезиальной смеси (раствор сульфата магния MgSО4, аммиака и хлорида аммония). Пробирку встряхивают. Для ускорения образования осадка потирают стенки пробирки стеклянной палочкой. Образуется белый кристаллический осадок магний-аммонийарсената NН4MgAsО4.
При втором варианте к желтому раствору, образовавшемуся после отделения гидроксидов алюминия и олова(ГУ), прибавляют концентрированный раствор соды ?2СО3 и нагревают смесь до полного удаления аммиака. Выпавший белый осадок оксикарбоната цинка ^пОН)2СО3 отделяют центрифугированием и растворяют в небольшом количестве 2 моль/л раствора хлороводородной кислоты. В полученном солянокислом растворе открывают катионы цинка реакцией с сульфидом аммония (см. выше «Предварительные испытания») и - для контроля - с дитизоном.
В последнем случае к 5-10 каплям раствора в пробирке прибавляют ~5 капель раствора дитизона в хлороформе и встряхивают пробирку. Органический слой окрашивается в красный цвет вследствие образования дитизонатного комплекса цинка, экстрагирующегося из водной фазы в органическую.
В отдельной пробе раствора, оставшегося после отделения катионов цинка, открывают арсенат-ионы реакцией с магнезиальной смесью (см. выше) или другими реакциями (см. «Предварительные испытания»), а также хромат-ионы, как было описано ранее (см. «Предварительные испытания»). Если раствор окрашен в желтый цвет, то это само по себе указывает на присутствие хромат-ионов.
Контрольные вопросы
1. Почему образование надхромовой кислоты для обнаружения хро-ма(Ш) проводят в присутствии амилового спирта?
2. Какие фармакопейные реакции используют для обнаружения ионов AsO3- иAsO3-?
3. Какую реакцию используют для дробного обнаружения мышьяка в смеси катионов четвертой группы? Напишите ее уравнение в ионном виде.
4. Как открывают катион алюминия дробным методом реакцией с ализарином в смеси катионов четвертой группы?
5. Почему при окислении иона AsO3- иодом необходимо добавлять гидрокарбонат натрия?
6. Какую специфическую реакцию используют для обнаружения катиона цинка дробным методом в смеси катионов четвертой группы?
7. Почему Sn(H) мешает обнаружению цинка в виде сульфида цинка?
8. Какие аналитические реакции можно использовать для обнаружения иона олова(ГГ) в смеси катионов четвертой группы? Напишите соответствующие уравнения реакций.
9. Какие реакции протекают в щелочном растворе, содержащем катионы четвертой группы при нагревании после добавления пероксида водорода? Изменяется ли при этом внешний вид раствора?
10. К солянокислому раствору, содержащему олово(ГГ), прибавили раствор сулемы. Какие изменения наблюдаются в растворе? Объясните происходящее и напишите соответствующие уравнения реакций.
Занятие 5. Аналитические реакции катионов пятой и шестой аналитических групп по кислотно-основной классификации
Допускается проведение практических работ в течение двух занятий.
Цель занятия:
- научиться рассчитывать значения рН растворов кислот, оснований;
- научиться проводить аналитические реакции катионов пятой и шестой аналитических групп.
Задание для самоподготовки
К занятию надо знать
1. Общую химико-аналитическую характеристику катионов пятой и шестой аналитических групп по кислотно-основной классификации (состав группы, групповой реагент).
2. Основные химические свойства катионов пятой, шестой аналитических групп и их важнейших соединений.
3. Aналитические реакции катионов пятой и шестой аналитических групп.
4. Основные положения протолитической теории кислот и оснований.
5. Основные представления о реакциях комплексообразования в растворах.
6. Правила техники безопасности и работы в химико-аналитической лаборатории.
Уметь
1. Составлять уравнения характерных аналитических реакций катионов пятой, шестой аналитических групп.
2. Рассчитывать рН растворов кислот, оснований.
Литература
Харитонов Ю.Jf7.Aналитическая химия (аналитика). 1, гл. 12,
с. 353-336; гл. 15, с. 384-417.
Лурье Ю.Ю. Справочник по аналитической химии. - М.: Химия,
1989.
Вопросы для самопроверки
1. Назовите групповые реагенты на катионы пятой и шестой аналитических групп.
2. Перечислите катионы, входящие в состав этих групп.
3. Какие элементы, катионы которых входят в состав пятой группы, проявляют переменную степень окисления?
4. Какие элементы, катионы которых входят в состав шестой группы, проявляют переменную степень окисления?
5. Напишите в ионном виде уравнения реакций взаимодействия:
а) соли железа(ГГ) с гексацианоферратом(ГГГ) калия;
б) соли железа(ГГГ) с гексацианоферратом(ГГ) калия. В какой среде протекают эти реакции?
6. Напишите в ионном виде уравнение реакции окисления марган-ца(ГГ) висмутатом натрия.
7. Какие катионы пятой и шестой групп подвергаются гидролизу?
8. Напишите в ионном виде уравнение реакции взаимодействия нитрата висмута(ГГГ) с хлоридом олова(ГГ). В какой среде протекает эта реакция?
9. Напишите реакцию окисления гидроксида марганца(ГГ) кислородом воздуха. Что наблюдается при этом?
10. Перечислите аналитические реакции катиона магния. Какие из них наиболее характерны?
11. Какой катион пятой группы обладает выраженными амфотер-ными свойствами?
12. Какие реакции используют для обнаружения катиона желе-за(ГГГ)? Напишите их уравнения в ионном виде.
13. Напишите общую формулу комплексных соединений катионов шестой группы с аммиаком. Дайте названия этих соединений.
14. Перечислите органические реагенты, применяемые для обнаружения катионов шестой группы.
15. Как действуют растворы щелочей и аммиака на катионы пятой и шестой аналитических групп? Напишите соответствующие уравнения реакций.
Лабораторная работа
Реактивы Растворы солей:
- железа(ГГ), железа(ГГГ), магния, марганца, висмута, сурьмы(ГГГ), сурьмы(У), никеля, кобальта(ГГ), меди, кадмия, ртути(ГГ);
- ацетата натрия, хлорида аммония, тиоцианата калия или аммония, иодида калия, сульфида натрия или аммония; с « 1 моль/л;
- свежеприготовленный раствор хлорида олова(П); с « 1 моль/л;
- насыщенные растворы тиосульфата натрия, хлорида натрия;
- раствор гидрофосфата натрия, гексацианоферрата(ГГ) и гексаци-аноферрата(Ш) калия; с « 1 моль/л;
- 30 % раствор тартрата калия и натрия (сегнетовой соли). Растворы кислот и оснований:
- серная кислота 1:3, соляная кислота 1:1, уксусная кислота 1:1;
- свежеприготовленная сероводородная вода. Органические реагенты и растворители:
- 1 % раствор 1-нитрозо-2-нафтола в уксусной кислоте 1:1;
- 5 % раствор купрона в этиловом спирте;
- насыщенный раствор тиоцианата калия или аммония в ацетоне;
- изоамиловый или амиловый спирт;
- 0,025 % щелочной раствор магнезона;
- 10 % раствор сульфосалициловой кислоты;
- 1 % раствор диметилглиоксима в этиловом спирте. Кристаллические: тиомочевина, висмутат натрия, соли аммония
(хлорид или нитрат).
Полоски фильтровальной бумаги 5 х 5 см, пропитанные раствором гексацианоферрата(II) калия.
Учебные таблицы
1. Частные реакции катионов пятой и шестой аналитических групп.
2. Классификация катионов по кислотно-основному методу.
3. Периодическая система элементов Д.И. Менделеева.
1. Аналитические реакции катионовпятой аналитической группы по кислотно-основной классификации: Mg2+,Sb3+,Sb5+,Bi3+,Mn2+,Fe2+,Fe3+
При действии группового реагента (водного раствора щелочи или аммиака) катионы пятой аналитической группы осаждаются из водного раствора в виде гидроксидов Mg(OH)2,Mn(OH)2,Fe(OH)2,Fe(OH)3, Sb(OH)3,SbO(OH)3,Bi(OH)3 Гидроксиды катионов пятой аналитической группы не растворяются в избытке группового реагента, в отличие от катионов четвертой аналитической группы.
На воздухе гидроксиды марганца(II) и железа(II) постепенно окисляются кислородом:
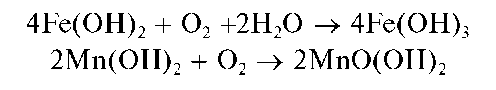
При действии группового реагента в присутствии пероксида водорода происходит окисление железа(II) до железа(III), марганца(II) - до марганца(IV), сурьмы(Ш) - до сурьмы(V):
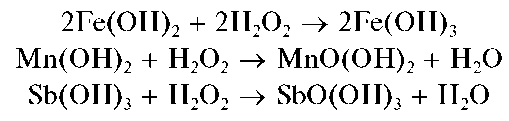
Методика.
а) В 6 пробирок помещают по нескольку капель растворов солей магния, марганца(II), железа(II), железа(III), сурьмы(III) и висму-та(III), добавляют по 3-4 капли воды и по каплям раствор натрия гидроксида до выделения осадка. Обращают внимание на цвет осад-
ков. Осадки отделяют от раствора центрифугированием и проверяют растворимость в азотной кислоте и в концентрированном растворе аммиака.
Осадки магния и марганца(ГГ) гидроксидов дополнительно проверяют на растворимость в насыщенном растворе аммония хлорида.
б) К осадкам железа(ГГ) и марганца(ГГ) гидроксидов добавляют по 2-3 капли разбавленного раствора натрия гидроксида и водорода пе-роксида. Наблюдают за изменением цвета осадков. Проверяют растворимость полученного черно-бурого осадка MnO(OH)2 в насыщенном растворе хлорида аммония и разбавленной азотной кислоте.
Аналитические реакции катиона магния Mg2+
Реакции с щелочами и аммиаком. Катионы Mg2+ придействиищело-чей и аммиака образуют белый аморфный осадок гидроксида магния
Mg(OH)2: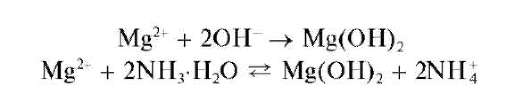
При реакции с аммиаком достигается неполное осаждение катионов Mg2+ ввидеMg(OH)2, так как гидроксид магния частично растворяется в растворах солей аммония (особенно в концентрированных) вследствие смещения последнего равновесия влево при увеличении концентрации катионов аммония.
Осадок Mg(OH)2 не растворяется в щелочах, но растворяется в кислотах:
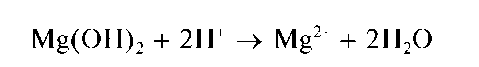
Методика. В две пробирки вносят по 5-6 капель раствора соли магния и прибавляют по каплям: в одну - раствор NaOH, в другую - раствор аммиака до выпадения белого аморфного осадка.
Реакция с гидрофосфатом натрия (фармакопейная). Катионы Mg2+ образуют с гидрофосфатом натрия в присутствии катионов аммония и аммиака (аммиачный буфер) белый мелкокристаллический осадок магнийаммонийфосфата NH4MgPO4:

При проведении реакции катионов Mg2+ с гидрофосфатом натрия в отсутствии катионов аммония и аммиака выпадает белый аморфный осадок гидрофосфата магния MgHPO4.
Осадок магнийаммонийфосфата растворяется в минеральных кислотах и в уксусной кислоте:
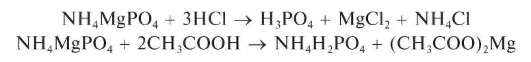
Реакция образования NH4MgPO4 достаточно чувствительна: предел обнаружения ~0,010 мкг (подругимданным - около10 мкг), предельное разбавление - 8,3 104 мл/г. Мешают катионы Li+,Ca2+,Sr2+,Ba2+ и другие, дающие малорастворимые фосфаты.
Реакцию можно проводить как микрокристаллоскопическую.
Методика.
Первый вариант. В пробирку вносят 2-3 капли раствора соли магния, прибавляют по 1-2 капли растворов NH4Cl, аммиака и Na2HPO4. Раствор мутнеет и образуется белый осадок NH4MgPO4.
Второй вариант. В пробирку вносят по одной капле растворов соли магния, NH4Cl и концентрированного аммиака. Каплю смеси наносят на предметное стекло и рядом помещают каплю раствора Na2HPO4 Приводят капли в соприкосновение и через 1-3 мин наблюдают под микроскопом образование прозрачных бесцветных кристаллов магнийаммонийфосфата.
Реакция с магнезоном 1 - п-нитробензолазорезорцином.Вщелочной среде магнезон 1, имеющий красную окраску, образует с катионами Mg2+ комплекс синего цвета, сорбирующийся на осадке гидроксида магния. Предположительно реакцию можно описать схемой:
В этой схеме показано строение фрагмента образующегося комплекса. С атомом магния(11) связаны, по-видимому, и другие лиганды (например, молекулы воды), поскольку координационное число 3 для магния(11) нехарактерно.
Реакция высокочувствительна: предел обнаружения - 0,5 мкг.Ме-шают многие катионы (Cd2+,Sn2+,Cr3+,Fe2+,Co2+,Ni2+ и др.), также образующие окрашенные комплексы с магнезоном.
Методика. На предметное стекло наносят каплю раствора соли магния и прибавляют каплю щелочного раствора магнезона. Образует-
ся синий осадок. При малых концентрациях катиона магния осадок не выделяется, а раствор окрашивается в синий цвет.
Реакция с 8-оксихинолином. Катионы Mg2+ образуют с 8-оксихино-лином в аммиачной среде при рН « 8-13 (лучше - при нагревании) желто-зеленый кристаллический осадок внутрикомплексного соединения - оксихинолината магния:
Осадок оксихинолината магния растворим в минеральных кислотах и в уксусной кислоте.
Реакция высокочувствительна: предел обнаружения - 0,25 мкг. Мешают катионы, также образующие комплексы с 8-оксихинолином (Cu2+,Zn2+,Cd2+,Fe3+ идр.).
Методика. В пробирку вносят 2- 3 капли раствора хлорида магния, 2 капли раствора аммиака и прибавляют по каплям раствор хлорида аммония до растворения первоначально выпавшего белого осадка гид-роксида магния Mg(OH)2. К раствору прибавляют по каплям раствор 8-оксихинолина до выпадения желто-зеленого осадка оксихинолината магния.
Реакция с хинализарином. Катион Mg2+ при взаимодействии с хина-лизарином в щелочной среде дает синий осадок комплексного соединения - хинализарината магния состава MgL(OH), где HL - условное обозначение молекулы хинализарина:
Строение комплекса точно неизвестно. Раствор самого хинализа-рина в щелочной среде имеет фиолетовую окраску.
При небольшом содержании катионов магния в растворе осадок не выпадает, а раствор окрашивается в васильково-синий цвет.
Реакция высокочувствительна: предел обнаружения - 0,25 мкг. Мешают катионы алюминия.
Методика. В пробирку вносят 3- 4 капли раствора MgCl2,2-3 капли спиртового раствора хинализарина и 2- 3 капли раствора NaOH. Выпадает синий осадок хинализарината магния, а раствор окрашивается в васильково-синий цвет.
Другие реакции катионов магния. Катионы Mg2+ образуют с оксала-том аммония (NH4)2C2O4 белый осадок оксалата магния MgC2O4,^^ фенилкарбазидом (C6H5NHNH)2CO - комплекс красно-фиолетового цвета. Свежевыпавший осадок Mg(OH)2 при взаимодействии с гипой-одитом калия KiO (или гипойодидом натрия NaiO) окрашивается в красно-бурый цвет вследствие сорбции йода на поверхности гидро-ксида магния. Катионы магния взаимодействуют также с другими реагентами с образованием продуктов различного состава.
Аналитические реакции сурьмы(Ш) и сурьмы(V)
Соли сурьмы(Ш) и сурьмы(V) гидролизуются в водных растворах с образованием осадков малорастворимых основных солей сурьмы. Поэтому обычно используют кислые растворы сурьмы(Ш) и сурьмы(V), в которых их гидролиз подавляется и образуются соответствующие аци-докомплексы. Так, в концентрированных растворах HO присутствуют ацидокомплексы [SbCl4]- или [SbCl6]- .
Соединения сурьмы окрашивают пламя газовой горелки в голубой цвет.
Аналитические реакции сурьмы(Ш)
Реакции с щелочами и раствором аммиака. При прибавлении раствора щелочи или аммиака к раствору, содержащему сурьму(ГГГ), выпадает белый осадок гидроксида сурьмы(ГГГ) Sb(OH)3 (который можно также представить как сурьмяную кислоту H3SbO3 или HSbO2H2O):
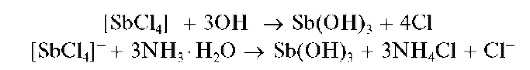
Свежевыпавший осадок Sb(OH)3 растворяется в избытке щелочи с образованием гидроксокомплексов [Sb(OH)4]-: 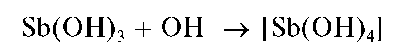
Осадок Sb(OH)3 растворяется также и в кислотах с образованием ацидокомплексов:
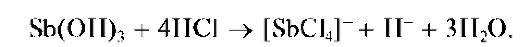
Придействиищелочивприсутствиипероксида водорода H2O2 су-рьма(Ш) окисляется до сурьмы(У), давая белый осадок SbO(OH)3:
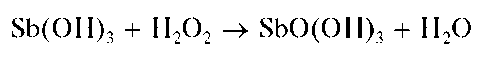
Методика. В пробирку вносят 3-4 капли солянокислого раствора сурьмы(ГГГ), прибавляют 3- 4 капли дистиллированной воды и затем по каплям - раствор NaOH до выпадения белого осадка Sb(OH)3. Продолжают прибавление по каплям раствора NaOH при перемешивании содержимого пробирки до растворения выпавшего осадка.
Реакция гидролиза. Разбавление водой растворов, содержащих сурь-му(ГГГ), приводит к ее гидролизу. Так, при добавлении воды к солянокислому раствору сурьмы(Ш) гидролиз идет (при рН « 3-4) с выделением белого осадка малорастворимого оксохлорида сурьмы(ГГГ) состава SbOCl:
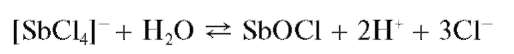
Свежевыпавший осадок оксохлорида сурьмы растворяется (лучше - при нагревании) в растворах HO, винной кислоты H2C4H4O6 иее солей:
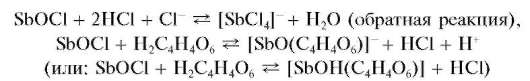
Методика. В пробирку вносят 2- 3 капли солянокислого раствора хлорида сурьмы(ГГГ) и прибавляют по каплям воду до образования белого хлопьевидного осадка SbOCl.
Реакция с сульфид-ионами. Сульфид-ионы S2- вкислойсреде осаждают из растворов сурьмы(ГГГ) оранжевый осадок сульфида сурь-мы(ГГГ) Sb2S3:
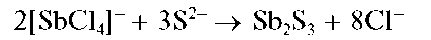
При избытке сульфид-ионов осадок растворяется с образованием тиосоли, содержащей анион SbS3-:
Осадок сульфида сурьмы(ГГГ) растворяется также в концентрированной HO при нагревании, в растворах щелочей:
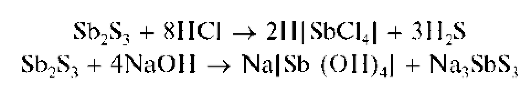
Методика. В пробирку вносят 3 капли солянокислого раствора хлорида сурьмы(Ш), 2 капли концентрированной HO и прибавляют по каплям раствор сульфида аммония (NH4)2S (или сульфида натрия Na2S) или сероводородную воду. Выпадает оранжевый осадок сульфида сурьмы(ГГГ).
Реакция с тиосульфатом натрия. Прибавление раствора тиосульфата натрия Na2S2O3 к кислому раствору сурьмы(ГГГ) приводит к образованию красного осадка «сурьмяной киновари» состава Sb2OS2:
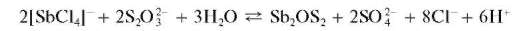
Ранее полагали, что этот осадок представляет собой смесь Sb2S3 и Sb2O3 Мешает висмут(Ш), образующий черный осадок.
Методика. В пробирку вносят 3-4 капли солянокислого раствора хлорида сурьмы(ГГГ) и прибавляют 2-3 капли раствора тиосульфата натрия. Выпадает красный осадок.
Реакции восстановления сурьмы(Ш) до сурьмы(0). Сурьма(Ш) восстанавливается до металлической сурьмы в кислой среде металлическими магнием, алюминием, цинком, оловом, железом, например:
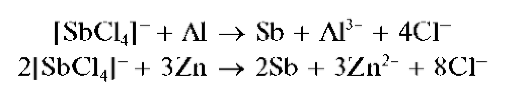
Металлическая сурьма выделяется в виде черного осадка на поверхности металла.
Методика. В пробирку вносят несколько капель солянокислого раствора хлорида сурьмы(ГГГ) и кусочек металлического алюминия или цинка, либо железа. Поверхность металла чернеет вследствие выделения хлопьевидного осадка свободной сурьмы.
Другие реакции сурьмы(Ш). При взаимодействии сурьмы(Ш) с фос-форномолибденовой гетерополикислотой образуется продукт реакции синего цвета - «молибденовая синь», экстрагируемый амиловым спиртом.
С метилфлуороном C13H4O2(OH)3CH3 сурьма(ГГГ) в присутствии H2O2 и HO дает продукт красного цвета (капельная реакция на фильтровальной бумаге); реакция специфична для сурьмы(ГГГ).
Такие окислители, как KMnO4,K2Cr2O7,KBrO3 идругие, окисляют в растворах сурьму(Ш) до сурьмы(У).
Известен и ряд других реакций сурьмы(ГГГ).
Аналитические реакции сурьмы(У)
Реакция с щелочами и аммиаком. Сурьма(У) образует с гидроксида-ми щелочных металлов и аммиаком белый осадок состава SbO(OH)3:
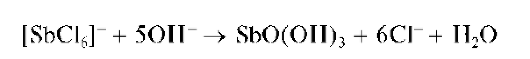
Свежевыпавший осадок SbO(OH)3 растворяется в избытке щелочи и в сильных кислотах:
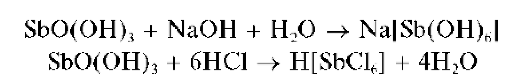
Методика. В пробирку вносят несколько капель солянокислого раствора сурьмы(У) и прибавляют по каплям раствор NaOH до выпадения белого осадка SbO(OH)3 При дальнейшем прибавлении раствора щелочи осадок растворяется.
Реакция гидролиза. При разбавлении водой растворов сурьмы(У) последняя гидролизуется с образованием основных солей. Так, при прибавлении воды к солянокислому раствору сурьмы(У) гидролиз идет до образования белого осадка оксохлорида сурьмы(У) состава SbO2Cl:
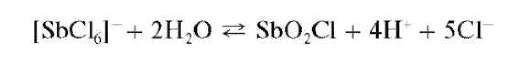
Осадок SbO2Cl растворяется в избытке HO (обратная реакция) и в растворах винной кислоты и ее солей.
Методика. В пробирку вносят 2-3 капли солянокислого раствора сурьмы(У) и по каплям прибавляют дистиллированную воду до выпадения белого осадка SbO2Cl.
Реакция с сульфид-ионами. При реакции с сульфид-ионами в кислой среде сурьма(У) образует оранжевый осадок сульфида сурьмы(У) Sb2S5:
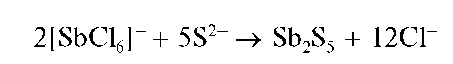
При избытке сульфид-ионов осадок растворяется с образованием тиосолей:
Осадок Sb2S5 растворяется в щелочах:
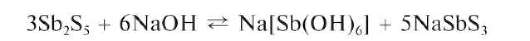
В концентрированной HQ при нагревании сульфид сурьмы(У) растворяется с выделением свободной серы и восстановлением сурьмы(У) до сурьмы(Ш):

Методика. В пробирку вносят ~3 капли солянокислого раствора су-рьмы(У), 2 капли концентрированной HQ и прибавляют по каплям раствор сульфида аммония (NH4)2S (или сульфида натрия Na2S) либо сероводородную воду. Выпадает оранжевый осадок Sb2S5. Прибавление избытка реагента приводит к растворению осадка.
Реакции восстановления сурьмы(У) до сурьмы(0). Сурьма(У), как и сурьма(Ш), восстанавливается в кислой среде металлическим магнием, цинком, алюминием, оловом, железом до свободной сурьмы(0). Условия проведения реакций восстановления сурьмы(У) аналогичны условиям проведения реакций восстановления сурьмы(Ш) (см. выше).
Реакция с родамином Б. Сурьма(У) в солянокислых растворах реагирует с органическим реагентом - родамином Б (условно обозначим его как L+Cl-):
с образованием фиолетового или сине-фиолетового соединения (ионного ассоциата) состава L+[SbCl6]- : 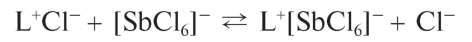
Образовавшийся ионный ассоциат экстрагируется из водной фазы бензолом или изопропанолом; при этом органический слой окрашивается в фиолетово-синий цвет.
Если в растворе присутствует не сурьма(У), а сурьма(Ш), то предварительно сурьму(Ш) окисляют нитритом натрия NaNO2 до сурьмы(У), после чего сурьму(У) открывают реакцией с родамином Б.
Методика. В пробирку вносят 3-4 капли солянокислого раствора сурьмы(У), прибавляют 2-3 капли концентрированной HC1, ~1 мл дистиллированной воды, 3-4 капли раствора родамина Б (обычно 0,06 %) и 5-6 капель бензола. Встряхивают смесь. Органический (бензольный) слой окрашивается в фиолетово-синий цвет.
В случае присутствия в растворе сурьмы(Ш) реакцию проводят аналогично, за исключением того, что после прибавления концентрированной HC1 в пробирку добавляют дополнительно 2-3 капли раствора нитрита натрия.
Другие реакции сурьмы(У). Сурьма(У) в солянокислых растворах (в форме [SbC16]-) реагирует с органическим реагентом метилфиолето-вым, с йодидами и некоторыми другими соединениями. С метилфио-летовым образуется тонкая суспензия малорастворимого соединения синего цвета. Йодидами сурьма(У) восстанавливается до сурьмы(Ш). При этом реакционная смесь принимает бурую окраску за счет выделения йода I2.
Аналитические реакции висмута(Ш)
Соли висмута(Ш) гидролизуются в водных растворах с образованием осадков малорастворимых оксосоединений - солей висмути-ла, формально содержащих катион висмутила BiO+ (например, BiOC1, BiONO3 и др.). Если соль висмута(Ш) растворить в воде, то получают мутный раствор вследствие образования частиц продуктов гидролиза. Для подавления гидролиза и получения прозрачных растворов соль висмута(Ш) растворяют не в чистой воде, а в растворах кислот, чаще всего - в растворе HC1, в котором висмут(Ш) присутствует в форме хлоридных комплексов [BiC16]3- . На практике обычно используют солянокислые растворы хлорида висмута(Ш).
Реакции с щелочами и аммиаком. При прибавлении растворов щелочей или аммиака к раствору соли висмута(Ш) выпадает белый осадок гидроксида Bi(OH)3:
Осадок растворяется в минеральных кислотах. При нагревании белый осадок Bi(OH)3 желтеет вследствие образования оксогидроксида висмута(Ш) BiO(OH) (гидроксида висмутила):
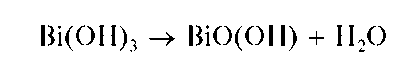
Методика. В пробирку вносят несколько капель солянокислого раствора хлорида висмута(Ш) и прибавляют по каплям раствор NaOH до выпадения белого осадка Bi(OH)3.
Реакция гидролиза. Разбавление водой растворов солей висмута(Ш) приводит к их гидролизу с выделением белого осадка оксохлорида висмута BiOCl (хлорида висмутила):
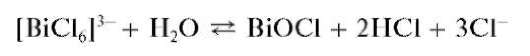
При прибавлении раствора HO и нагревании осадок растворяется (обратная реакция). В отличие от оксохлоридов сурьмы, осадок оксох-лорида висмута(Ш) не растворяется в растворах винной кислоты и ее солей.
Методика. К 2-3 каплям солянокислого раствора хлорида висму-та(Ш) в пробирке прибавляют по каплям воду до выпадения белого осадка BiOCl.
Реакция с сульфид-ионами (фармакопейная). Висмут(Ш) при реакции с сульфид-ионами в кислой среде образует черно-коричневый осадок сульфида висмута(Ш) Bi2S3:
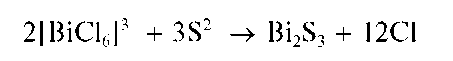
Осадок не растворяется в разбавленных минеральных кислотах, за исключением разбавленной HNO3, в которой он растворяется с выделением свободной серы:
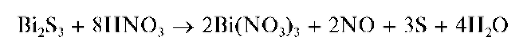
Осадок сульфида висмута растворяется в присутствии хлорида же-леза(Ш) FeCl3 - также с выделением свободной серы:
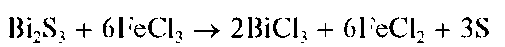
Методика. В пробирку вносят 3- 4 капли солянокислого раствора хлорида висмута(Ш) и прибавляют по каплям раствор (NH4)2S, или Na2S, или сероводородной воды. Выпадает черно-коричневый осадок сульфида висмута Bi2S3.
Реакция с иодидами (фармакопейная). При прибавлении растворов иодидов к кислым растворам висмута(Ш) выпадает черный осадок
иодида висмута(Ш) BiI3, растворимый в избытке реагента с образованием желто-оранжевого раствора, содержащего тетраиодовисму-тат(Ш)-ионы [BiI4] -:
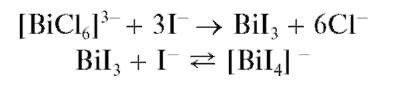
Разбавление полученного раствора водой приводит к выпадению осадка BiI3 с последующим его гидролизом и образованием желто-оранжевого оксоиодида висмута BiOI (иодида висмутила). Суммарно реакцию гидролиза можно описать схемой:
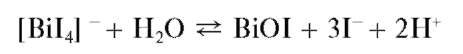
Методика. В пробирку вносят около 5 капель солянокислого раствора хлорида висмута(Ш) и прибавляют по каплям раствор KI до выпадения черного осадка йодида висмута(Ш). Дальнейшее прибавление избытка раствора KI приводит к растворению осадка и образованию оранжевого раствора. При прибавлении воды к этому раствору и его нагревании образуется оранжевый осадок йодида висмутила BiOI.
Реакция восстановления висмута(Ш) до висмута(О) соединениями олова(11). Вщелочнойсреде (рН « 10) олово(11) восстанавливает вис-мут(Ш) до металлического висмута(О), выделяющегося в виде черного осадка. Олово(11) при этом окисляется до олова(ГУ):
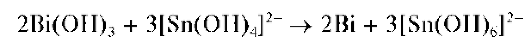
При большом избытке щелочи и нагревании выпадает также черный осадок металлического олова вследствие протекания реакции диспропорционирования:
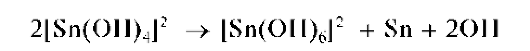
При недостатке щелочи может выпасть черный осадок оксида оло-ва(11) SnO:
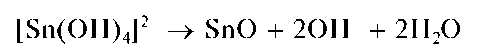
Методика. В пробирку вносят 2 капли солянокислого раствора хлорида олова(11), 8-10 капель 2 моль/л раствора NaOH до растворения первоначально выпавшего осадка Sn(OH)2 и добавляют 1-2 капли раствора соли висмута(Ш). Выпадает осадок черного цвета - металлический висмут.
Реакция с тиокарбамидом (тиомочевиной). Висмут(Ш) при взаимодействии с тиокарбамидом SC(NH2)2 в кислой среде образует раство-
римый комплекс желтого цвета состава [BiL3]3+, где L - условное обозначение молекулы тиокарбамида:
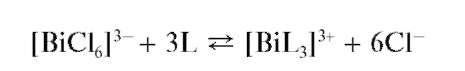
Мешают катионы Hg22+,Fe3+.
Методика. На предметное стекло наносят каплю солянокислого раствора хлорида висмута(Ш) и добавляют кристаллик тиокарбамида. Капля окрашивается в оранжевый цвет.
Другие реакции висмута(Ш). Известно большое число (несколько десятков) реакций висмута(Ш), которые могут иметь аналитическое значение. Так, с тиосульфатом натрия при нагревании выделяется осадок сульфида висмута Bi2S3; с гидрофосфатом натрия Na2HPO4 - белый осадок фосфата висмута BiPO4; c дихроматами - желтый осадок дихромата висмутила (BiO)2Cr2O7; с 8-оксихинолином и KI - оранжево-красный осадок комплексного соединения - и т.д.
Аналитические реакции катиона марганца(П) Mn2+
Аквокомплексы [Mn(H2O)6]2+ марганца(П) окрашены в бледно-розовый цвет, поэтому водные растворы солей марганца(П) при достаточно больших концентрациях имеют бледно-розовую окраску. Сильно разбавленные водные растворы солей марганца(П) практически бесцветны.
Реакции с щелочами и аммиаком. При прибавлении растворов щелочей или аммиака к растворам, содержащим катионы Mn2+, выпадает белый осадок гидроксида марганца(П) состава Mn(OH)2:
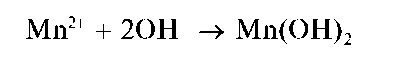
При стоянии осадок буреет за счет окисления кислородом воздуха до черно-коричневого оксогидроксида марганца(ГУ) состава
MnO(OH)2 (H2MnO3):
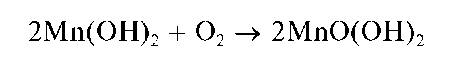
При действии щелочей на растворы солей марганца(П) в присутствии пероксида водорода образующийся вначале гидроксид марган-ца(11) Mn(OH)2 окисляется пероксидом водорода до черно-коричневого MnO(OH)2: 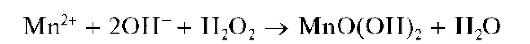
Осадок Mn(OH)2 растворяется в разбавленных растворах сильных кислот и в насыщенном растворе хлорида аммония:
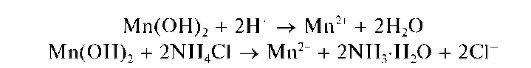
Осадок MnO(OH)2 не растворяется при действии этих реагентов. Методика.
а) В пробирку вносят 3-4 капли раствора соли марганца(П) и прибавляют по каплям раствор NaOH до прекращения выпадения белого осадка Mn(OH)2 При стоянии осадок темнеет вследствие образования
MnO(OH)2
б) К свежевыпавшему осадку Mn(OH)2, полученному, как описано выше, прибавляют по 3-4 капли растворов NaOH и H2O2 Белый осадок Mn(OH)2 переходит в черно-коричневый MnO(OH)2.
Реакции окисления катионов Mn2+ до перманганат-ионов. Катионы Mn2+ под действием различных окислителей окисляются до перманга-нат-ионов MnO4, окрашивающих раствор в малиново-фиолетовый цвет. В качестве окислителей применяют висмутат натрия NaBiO3, персульфат аммония (NH4)2S2O8, диоксид свинца PbO2 идр. Чаще всего используют висмутат натрия. Реакцию окисления катионов Mn2+ до MnO4 используют для открытия этих катионов в растворе.
Реакции окисления проводят в отсутствие хлорид-ионов Cl- , так как они восстанавливаются перманганат-ионами до хлора Cl2:
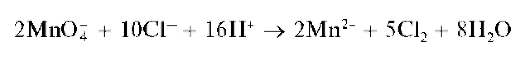
а) Окисление висмутатом натрия в кислой среде протекает по схеме:
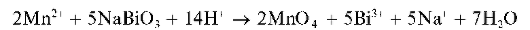
Избыток висмутата натрия может маскировать окраску раствора.
Методика. В пробирку вносят ~5 капель концентрированной HNO3, несколько крупинок висмутата натрия. Смесь перемешивают и прибавляют к ней 1-2 капли раствора сульфата MnSO4 или нитрата Mn(NO3)2 марганца(П) (но не хлорида MnCl2!). Раствор окрашивается в малиново-фиолетовый цвет.
б) Окисление персульфатом аммония. Реакцию проводят в кислой среде в присутствии катализатора - солей серебра (AgNO3)при нагревании: 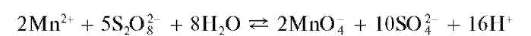
В качестве катализатора применяют также соли кобальта и меди.
В горячем растворе возможно разложение перманганат-ионов, которое замедляется в присутствии фосфорной кислоты H3PO4.
Методика. В пробирку вносят несколько кристалликов (NH4)2S2O8 (или ~0,5 мл насыщенного раствора (NH4)2S2O8), прибавляют ~2 мл раствора HNO3 (или H2SO4), 2- 3 капли раствора AgNO3 и1-2капли концентрированного раствора H3PO^ Нагревают смесь до кипения и прибавляют каплю раствора соли марганца(П). Раствор окрашивается в малиновый цвет.
в) Окисление диоксидом свинца в кислой среде при нагревании:
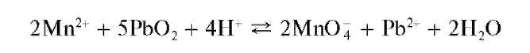
При избытке соли марганца(П) образуется MnO(OH)2, а не перман-ганат-ион.
Методика. В пробирку вносят небольшое количество PbO2 ипри-бавляют ~1 мл раствора HNO3. Смесь нагревают до кипения, прибавляют каплю раствора сульфата или нитрата марганца(П) и опять нагревают до кипения. Раствор окрашивается в малиновый цвет.
Реакция с сульфид-ионами. Катионы Mn2+ ссульфид-ионамиS2- образуют осадок сульфида марганца(П) MnS розовато-телесного цвета: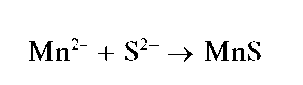
Осадок растворяется в разбавленных кислотах.
Методика. В пробирку вносят 3-4 капли раствора соли марган-ца(11) и прибавляют 1-2 капли раствора сульфида аммония (NH4)2S (или сульфида натрия Na2S) или сероводородной воды. Выпадает осадок сульфида марганца(П) телесно-розового цвета.
Другие реакции марганца(П). Катионы Mn2+ образуют с аммиакатом серебра [Ag(NH3)2]+ смесь MnO(OH)2 и металлического серебра буро-черного цвета:
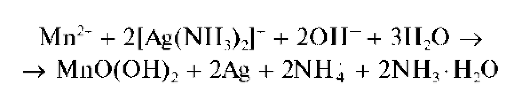
Реакцию можно проводить капельным методом на фильтровальной бумаге (наблюдается образование черно-бурого пятна).
Катионы Mn2+ дают ряд других реакций, представляющих меньший аналитический интерес.
Аналитические реакции катиона железа(П) Fe2+
Акво-ионы железа(11) [Fe(H2O)6]2+ практически бесцветны, поэтому растворы солей железа(11) обычно не окрашены.
Реакции с щелочами и аммиаком. Катионы Fe2+ образуют с щелочами и аммиаком белый осадок гидроксида железа(11) Fe(OH)2:
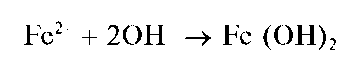
Гидроксид Fe(OH)2 растворяется в кислотах, но не растворяется в щелочах. При стоянии на воздухе гидроксид железа(11) Fe(OH)2 постепенно темнеет вследствие окисления железа(11) до железа(Ш) кислородом воздуха и образования красно-бурого гидроксида железа(Ш)
Fe(OH)3:
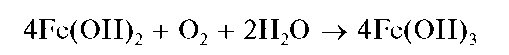
При действии щелочей на растворы солей железа(11) в присутствии пероксида водорода сразу образуется красно-бурый осадок Fe(OH)3 гидроксида железа(Ш):
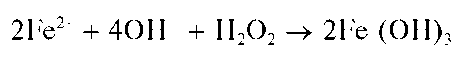
Методика
а) В пробирку вносят 5-6 капель раствора соли железа(11) и по каплям прибавляют раствор NaOH до прекращения выпадения белого осадка Fe(OH)2 На воздухе осадок постепенно темнеет.
б) К свежеприготовленному, как описано выше, белому осадку Fe(OH)2 прибавляют по 2-3 капли растворов NaOH и H2O2 Окраска осадка изменяется до красно-бурой.
Реакция с гексацианоферратом(Ш) калия - феррицианидом калия (фармакопейная). Катионы Fe2+ реагируют с феррицианидом калия K3[Fe(CN)6] в кислой среде с образованием темно-синего осадка турн-булевой сини. Ранее полагали, что состав этого осадка соответствует формуле Fe3[Fe(CN)6]xH2O с переменным количеством молекул воды, причем, в зависимости от условий осаждения, состав осадка изменяется и может соответствовать, напрмер, формуле KFeII[FeIII(CN)6]xH2O при избытке катионов калия в растворе. Однако позднее было показано, что уже при образовании этого осадка осуществляется окислительно-восстановительный процесс с переносом электрона от «внешне-сферного» железа(ГГ) к внутрисферному железу(Ш): 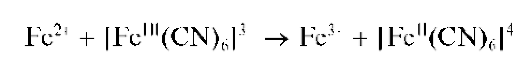
Образующиеся катионы Fe3+ и анионы [Feir(CN)6]4-дают темно-синий осадок конечного продукта состава Fe4III[FeII(CN)6]3xH2O, названный «турнбулевой синью»:
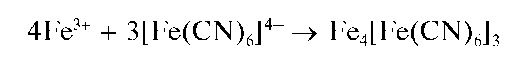
Суммарное уравнение реакции:
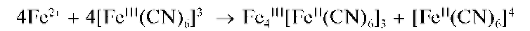
По составу, структуре и свойствам осадок турнбулевой сини идентичен осадку берлинской лазури, получаемому при прибавлении раствора ферроцианида калия K4[Fe(CN)6] к растворам солей железа(Ш) (см. далее «Аналитические реакции катионов железа(Ш) Fe3+»).
Реакция очень чувствительна: предел обнаружения - 0,05 мкг.Оса-док турнбулевой сини не растворяется в кислотах, но разлагается в щелочной среде.
Методика. В пробирку вносят 2-3 капли раствора соли железа(11), прибавляют 1-2 капли раствора HO и 2-3 капли раствора феррициа-нида калия K3[Fe(CN)6]. Раствор окрашивается в синий цвет и выделяется синий осадок турнбулевой сини.
Реакция с сульфид-ионами (фармакопейная). Катионы Fe2+ образуют с сульфид-ионами в нейтральной или аммиачной среде черный осадок сульфида железа(11) FeS:
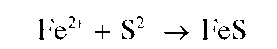
Осадок растворяется в разбавленных минеральных кислотах и в уксусной кислоте.
Методика. В пробирку вносят 3-4 капли раствора соли железа(11) и прибавляют 2-3 капли раствора сульфида аммония ^^^(илисуль-фида натрия). Выпадает черный осадок сульфида железа(11).
Другие реакции катионов железа(11). Катионы Fe2+ вступают в реакции со многими реагентами. Некоторые из этих реакций представляют аналитический интерес.
С диметилглиоксимом ^H3CNOH)2 катионы Fe2+ образуют розово-красный диметилглиоксиматный комплекс железа(11) состава FeL2, где HL - условное обозначение молекулы диметилглиоксима. Реакция высокочувствительна (предел обнаружения ~0,4 мкг), однако мешают другие катионы (особенно Ni2+), также образующие диметил-глиоксиматные комплексы.
Катионы Fe2+ образуют в кислой среде комплексные соединения розово-красного цвета с 2,2-дипиридилом, о-фенантролином.
Описан ряд других реакций катионов Fe3+, представляющих определенный аналитический интерес.
Аналитические реакции катионов железа(Ш) Fe3+
Акво-ионы железа(Ш) [Fe(H2O)6]3+ в водных растворах окрашены в желтый цвет и частично гидролизованы до растворимых гидроксоак-вокомплексов [Fe(OH)n(H2O)6- n]3-n, также окрашенных в желто-бурый цвет. Поэтому водные растворы солей железа(Ш) имеют желтую или красновато-бурую окраску.
Реакция с щелочами и аммиаком. Катионы Fe3+ при взаимодействии с щелочами и аммиаком в водных растворах образуют красно-бурый осадок гидроксида железа(Ш):
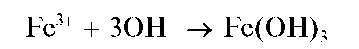
Осадок растворим в разбавленных кислотах; не растворяется в насыщенном растворе хлорида аммония (в отличие от белого осадка гид-роксида железа(11) Fe(OH)2) а также в растворах щелочей.
Методика. В пробирку вносят 3-4 капли раствора соли железа(Ш) и прибавляют 3-4 капли раствора NaOH. Выпадает красно-бурый осадок гидроксида железа(Ш) Fe(OH)3.
Реакция с гексацианоферратом(11) калия - с ферроцианидом калия (фармакопейная). Катионы Fe3+ вкислойсреде (рН « 2-3) реагируют с ферроцианидом калия с образованием темно-синего осадка берлинской лазури. Состав осадка чистой берлинской лазури описывают формулой Fe4[Fe(CN)6]3xH2O с переменным количеством молекул воды. Показано, однако, что, в зависимости от условий осаждения, осадок берлинской лазури, как и осадок турнбулевой сини (см. выше), увлекает из раствора другие катионы, так что его состав несколько изменяется и может соответствовать, например, формуле KFeIII[FeII(CN)6]. Поэтому все соединения данного типа называют «берлинскими лазу-рями».
Осадок берлинской лазури неустойчив в щелочной среде, но стабилен в кислом растворе, поэтому реакцию проводят в кислой среде при рН * 2-3.
Реакция образования чистой берлинской лазури протекает по схеме:
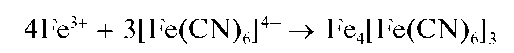
Реакция высокочувствительна: открываемый минимум ~0,05 мкг, предельное разбавление ~106 мл/г. Мешают, как и при получении осадка турнбулевой сини, окислители и восстановители. Окислители
окисляют ферроцианид до феррицианида, а восстановители восстанавливают железо(Ш) до железа(11).
Как и в случае турнбулевой сини, осадок берлинской лазури не растворяется в кислотах, разлагается при прибавлении раствора щелочи:
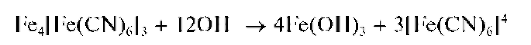
Методика. В пробирку вносят 2-3 капли раствора соли железа(Ш), прибавляют 1-2 капли раствора HO и 2 капли раствора K4[Fe(CN)6]. Раствор окрашивается в синий цвет и выпадает темно-синий осадок берлинской лазури.
Реакция с тиоцианат-ионами (фармакопейная). Катионы Fe3+ реагируют с тиоцианат-ионами NCS- (лучше - в кислой среде при рН « 3) с образованием тиоцианатных комплексов железа(Ш) красного цвета. В зависимости от соотношения концентраций реагентов могут доминировать комплексы различного состава [Fe(NCS)n (H2O)6- n]3- n,где n=1, 2, 3, 6. Все они имеют красную окраску и находятся в равновесии. Для подавления образования гидроксокомплексов, содержащих гид-роксильные группы OH-, реакцию проводят в кислой среде при рН « 3.
Реакция протекает по схеме:
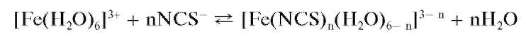
Реакция высокочувствительна: предел обнаружения катионов же-леза(Ш) составляет 0,25 мкг. Мешают многие вещества: окислители, восстановители, ртуть(11), фториды, йодиды, фосфаты, цитраты, тарт-раты и др. соединения. Катионы железа(11) Fe2+ не мешают.
Методика. В пробирку вносят 3-4 капли раствора соли железа(Ш) и прибавляют 2-3 капли раствора тиоцианата аммония NH4NCS или калия KNCS. Раствор окрашивается в красный цвет.
Реакция с сульфосалициловой кислотой (фармакопейная). Катион Fe3+ реагирует в водных растворах с сульфосалициловой кислотой с образованием окрашенных комплексов. В зависимости от рН среды и соотношения реагирующих компонентов состав и окраска образующихся комплексов могут быть различными. Так, при рН « 2-2,5 доминируют комплексы красного цвета, при рН « 4-8 - бурого и при рН « 9-11,5 - желтого. Наиболее устойчив комплекс желтого цвета, содержащий железо(Ш) и анионы сульфосалициловой кислоты в мольном отношении железо(Ш) : сульфосалицилат-анион, равном 1:3, т.е. на один атом железа приходятся три сульфосалицилатных лиганда. Этот комплекс доминирует в аммиачном растворе. Точное строение комплексов в растворе неизвестно.
Предполагается, что при рН * 9-11,5 реакция протекает с образованием трисульфосалицилатоферрат(Ш)-ионов [FeL3]3- по схеме:
где H2L - условное обозначение молекулы сульфосалициловой кислоты, а L2- - обозначение сульфосалицилат-аниона, образовавшегося из сульфосалициловой кислоты при отщеплении двух протонов предположительно от группCOOH иSO3H:
По-видимому, при рН = 2-2,5 образующийся красный комплекс содержит железо(Ш) и сульфосалицилатный лиганд в мольном отношении 1:1, при рН = 4-8 бурый комплекс - в мольном отношении 1:2.
При обнаружении катионов Fe3+ реакцией с сульфосалициловой кислотой предельная концентрация железа(Ш) составляет 0,05 мкг/мл, т.е. реакция - высокочувствительная.
Сходные реакции катионы Fe3+ дают и с салициловой кислотой - орто-оксибензойной кислотой HOC6H4COOH.
Методика. В пробирку вносят ~5 капель раствора соли железа(Ш), прибавляют ~10 капель раствора сульфосалициловой кислоты и ~0,5 мл концентрированного раствора аммиака. Раствор принимает желтую окраску.
Если вместо раствора аммиака прибавить ~1 мл раствора HCl (1:1), то получают не желтый, а красный раствор.
Реакция с сульфид-ионами (фармакопейная). Катионы Fe3+ при взаимодействии с сульфид-ионами S2- в нейтральных или слабоаммиачных растворах образуют черный осадок сульфида железа(Ш) Fe2S3:
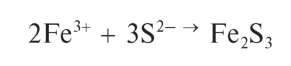
Осадок растворяется в минеральных кислотах.
Методика. В пробирку вносят 3-4 капли раствора соли железа(Ш) и прибавляют 2-3 капли раствора сульфида аммония (NH4)2S(mm Na2S) либо сероводородной воды. Выделяется черный осадок сульфида железа(Ш).
Другие реакции катионов Fe3+. Для катионов железа(Ш) описан ряд реакций, представляющих аналитический интерес, особенно - с органическими реагентами. Так, катионы Fe3+ приреакциисферро-ном (7-йод-8-оксихинолин-5-сульфоновой кислотой) в кислой среде (рН * 2,6) образуют комплексы зеленого цвета (реакция высокочувствительная: предел обнаружения - 0,5 мкг); при реакции с тайроном (1,2-диокси-3,5-дисульфобензолом) - комплексы синего цвета, изменяющие окраску на красную в щелочной среде (предел обнаружения - около ~0,05 мкг); при реакции с купфероном - красный осадок купфероната железа(Ш); при реакции с салициловой кислотой - са-лицилатные комплексы фиолетового или красно-фиолетового цвета - ит.д.
В табл. 6 охарактеризованы продукты некоторых аналитических реакций катионов пятой аналитической группы.
2. Аналитические реакции катионовшестой аналитической группы по кислотно-основной классификации: Cu2+,Cd2+,Hg2+,Co2+,Ni2+
При действии группового реагента (25 % водный раствор аммиака) на водные растворы, содержащие катионы шестой аналитической группы, вначале выделяются осадки различного состава, которые затем растворяются в избытке группового реагента (осадки соединений кобальта и ртути растворяются в избытке водного аммиака только в присутствии катионов аммония ).
Осадки, выпавшие из растворов солей кобальта(П) и ртути(11) при действии группового реагента, растворяются в избытке аммиака в присутствии солей аммония с образованием аммиачных комплексов:
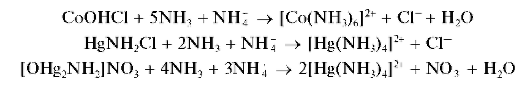
Аммиачный комплекс кобальта(П) грязно-желтого цвета окисляется на воздухе до аммиачного комплекса кобальта(Ш) вишнево-красного цвета.
Аналитические реакции катиона меди(П) Cu2+
Акво-ионы меди(11) [Cu(H2O)n]2+ окрашены в голубой цвет, поэтому растворы солей меди(11) имеют голубую окраску с разными оттенками (от голубой до сине-зеленой). В водных растворах акво-ионы меди(11) частично гидролизуются с образованием растворимых гидро-ксоаквокомплексов состава [Cu (H2O)n-m(OH)m]2-m по схеме:
Реакция с щелочами. При прибавлении раствора щелочи к раствору соли меди(11) выпадает осадок гидроксида меди(11) Cu(OH)2,имею-щий окраску от сине-зеленой до голубой:
При кипячении смеси раствора с осадком гидроксид меди(11) разлагается, теряя воду, до черного оксида меди(11) CuO:
Осадок Cu(OH)2 растворяется в кислотах, в растворах аммиака (с образованием комплекса [Cu(NH3)4]2+ синего цвета), комплексообра-зующих органических кислот (лимонная, винная), частично растворим в концентрированных щелочах с образованием гидроксокомплек-сов меди(11).
Методика. В пробирку вносят 3-4 капли раствора соли меди(11) и прибавляют 1-2 капли раствора NaOH. Образуется осадок гидроксида меди(11) голубого или сине-зеленого цвета.
Смесь осторожно нагревают до кипения и кипятят до потемнения осадка вследствие образования черного оксида меди(11).
Реакция с аммиаком (фармакопейная). При прибавлении раствора аммиака к раствору, содержащему соль меди(11), вначале выпадает
осадок основной соли меди (сине-зеленого цвета), который растворяется в избытке аммиака с образованием комплексного катиона [Cu(NH3)4]2+ ярко-синего цвета. Так, из раствора хлорида меди(11) ^Cl2 аммиак осаждает голубой оксихлорид меди(11) Cu(OH)Cl:
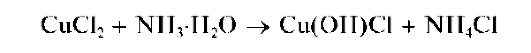
В избытке аммиака осадок растворяется:
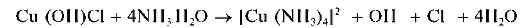
Раствор окрашивается в ярко-синий цвет.
В кислой среде комплексный тетрамминмедь(11)-катион разрушается:
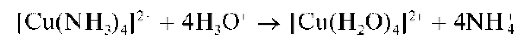
и окраска раствора из ярко-синей становится голубой (цвет аквокомп-лекса меди(11)).
Мешают катионы Co2+,Ni2+, олово(11).
Методика. В пробирку вносят 3-5 капель раствора соли меди(11) и прибавляют по каплям разбавленный раствор аммиака при перемешивании смеси. Выпадающий вначале голубой (или голубовато-зеленоватый) осадок основной соли меди(11) затем растворяется с образованием ярко-синего раствора.
Прибавляют по каплям разбавленный раствор одной из кислот - HCl, HNO3 или H2SO^ Окраска раствора из ярко-синей переходит в голубую.
Реакция с гексацианоферратом(11) калия. Катионы d2+ образуют с ферроцианидом калия K4[Fe(CN)6] в слабокислой среде красно-коричневый осадок гексацианоферрата(П) меди Cu2[Fe(CN)6]:
Осадок не растворяется в разбавленных кислотах, но растворяется в 25 % водном аммиаке:
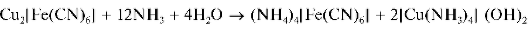
Мешают катионы, также образующие окрашенные осадки ферро-цианидов (Fe3+,Co2+,Ni2+).
Реакцию катионов меди(11) с ферроцианидом калия можно проводить капельным методом на фильтровальной бумаге.
Методика.
а) В пробирку вносят 3-4 капли раствора соли меди(11) и прибавляют 2-3 капли раствора K4[Fe(CN)6]. Выпадает красно-коричневый осадок ферроцианида меди(11).
б) На лист фильтровальной бумаги, пропитанный раствором фер-роцианида калия, наносят каплю раствора соли меди(11). На бумаге образуется красно-коричневое пятно.
Реакция с тиосульфатом натрия. При кипячении смеси подкисленного раствора соли меди(11) с избытком тиосульфата натрия Na2S2O3 происходит восстановление меди(11) до меди(1) с образованием сульфида меди(1) Ou2S. В результате выпадает темно-бурый осадок, представляющий собой смесь сульфида меди(1) Cu2S и свободной серы. Реакция, по-видимому, протекает по схеме:
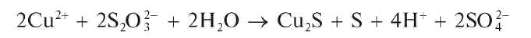
В литературе встречаются и другие схемы, описывающие эту реакцию.
Методика. В пробирку вносят 3-4 капли раствора соли меди(11), 2-3 капли разбавленного раствора H2SO4 и несколько кристалликов тиосульфата натрия. Пробирку осторожно нагревают до кипения. Выпадает темный осадок, содержащий смесь Cu2SиS.
Реакция с купроном (1-бензоиноксимом). Катионы Cu2+ при взаимодействии с органическим реагентом - купроном (обычно в аммиачной среде) образуют хлопьевидный зеленый осадок внутрикомплекс-ного соединения состава CuL2H2O, где H2L - условное обозначение купрона - 1-бензоиноксима:
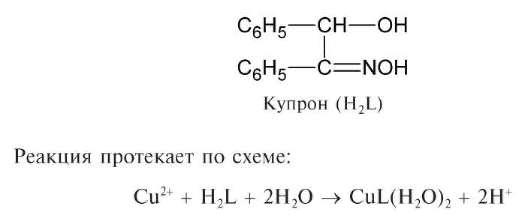
Протоны, очевидно, отщепляются от обеих гидроксильных групп молекулы купрона.
Осадок не растворяется в избытке аммиака.
Реакцию можно проводить капельным методом на фильтровальной бумаге. Предел обнаружения ~0,1 мкг.
Методика.
а) В пробирку вносят 2-3 капли кислого раствора соли меди(11), прибавляют 1-2 капли спиртового раствора купрона и 2-3 капли раствора аммиака. Образуется зеленый осадок комплекса меди(11) с куп-роном.
б) На лист фильтровальной бумаги наносят каплю подкисленного раствора соли меди(11), каплю спиртового раствора купрона и каплю раствора аммиака. На бумаге возникает зеленое пятно.
Реакция восстановления меди(11) металлами до металлической меди (фармакопейная). Металлы, расположенные в ряду напряжений металлов левее меди, восстанавливают катионы меди(11) Cu2+ до металлической меди. Чаще всего для этого применяют металлические алюминий, цинк, железо. При внесении этих металлов в растворы солей меди(11) поверхность металлов покрывается тонким слоем выделяющейся металлической меди красноватого цвета:
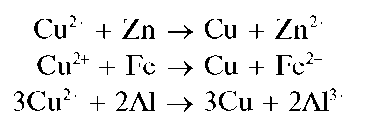
Методика. В пробирку с подкисленным раствором соли меди(11) погружают кусочек металлического алюминия или цинка, либо железа. Постепенно поверхность металла покрывается красным слоем металлической меди.
Окрашивание пламени газовой горелки. Соли меди окрашивают пламя газовой горелки в изумрудно-зеленый цвет.
Методика. Платиновую или нихромовую проволоку погружают в концентрированную хлороводородную кислоту, затем в сухую соль меди и вносят в пламя газовой горелки, которое окрашивается в зеленый цвет.
Другие реакции катионов меди(11). Катионы Cu2+ дают целый ряд реакций, имеющих аналитическое значение. Так, с тиоцианатами образуется черный осадок Cu(SCN)2, постепенно переходящий в белый CuSCN; с сульфид-ионами - черный осадок сульфида меди CuS; с фосфатами - голубой Qi3(PO4)2 и т.д. Известны реакции комплексо-образования меди(11) с различными органическими реагентами - куп-роином, купфероном, дитиооксамидом и др.
Используют также довольно чувствительную (предельное разбавление ~104 г/мл) микрокристаллоскопическую реакцию образования желто-зеленых кристаллов Cu[Hg(SCN)4].
Аналитические реакции катиона кадмия Cd2+
Акво-ионы кадмия [Cd(H2O)n]2+ в водных растворах бесцветны.
Реакция с щелочами и аммиаком. При прибавлении раствора щелочи или аммиака к раствору соли кадмия выпадает белый осадок гидро-ксида кадмия:
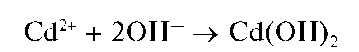
Осадок нерастворим в избытке щелочи, но растворяется в избытке аммиака с образованием бесцветного аммиачного комплекса [Cd(NH3)4]2+:
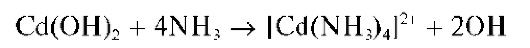
Осадок гидроксида кадмия растворяется в кислотах:
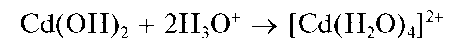
Методика. В две пробирки вносят по 3-4 капли раствора соли кадмия. В одну пробирку прибавляют 1-2 капли раствора NaOH или КОН. Выпадает белый осадок гидроксида кадмия Cd(OH)2.
В другую пробирку прибавляют по каплям раствор аммиака. Образующийся вначале белый осадок гидроксида кадмия растворяется в избытке аммиака.
Реакция с сульфид-ионами. Катионы Cd2+ образуют с сульфид-ионами S2- в слабокислых или щелочных растворах желтый осадок сульфида кадмия CdS:
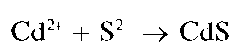
Осадок нерастворим в щелочах и в растворе сульфида натрия, частично растворяется в насыщенном растворе хлорида натрия с образованием хлоридного комплекса кадмия [CdCl4]2- :
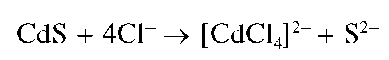
Сульфид кадмия нерастворим в кислотах, за исключением HO, в которой он растворяется с образованием хлоридного комплекса кадмия:
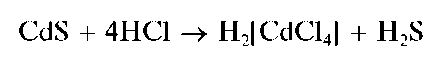
Методика. В пробирку вносят 2-3 капли раствора нитрата кадмия, прибавляют две капли раствора сульфида натрия Na2S. Выпадает желто-коричневый осадок сульфида кадмия CdS.
К выпавшему осадку прибавляют по каплям насыщенный раствор хлорида натрия NaCl при перемешивании смеси до растворения осадка.
Реакцию на катионы кадмия можно проводить также с сероводородной водой при рН « 0,5.
Реакция с тетрароданомеркуратом(11) аммония. Катионы кадмия при взаимодействии с тетрароданомеркуратом(П) аммония (NH4)2[Hg(SCN)4] образуют белый кристаллический осадок тетрарода-номеркурата(П) кадмия Cd[Hg(SCN)4]:
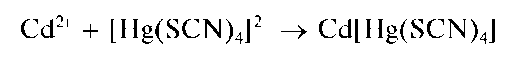
Реакция высокочувствительна: предел обнаружения составляет около 1 мкг, предельное разбавление равно ~103 мл/г.
Методика. В пробирку вносят 2-3 капли раствора соли кадмия и прибавляют примерно столько же капель раствора (NH4)2[Hg(SCN)4]. Выпадают бесцветные (или белые - в зависимости от размера частиц осадка) кристаллы тетрароданомеркурата(П) кадмия Cd[Hg(SCN)4].
Реакцию можно проводить как микрокристаллоскопическую. Для этого на предметное стекло наносят каплю раствора соли кадмия и каплю раствора тетрароданомеркурата(П) аммония. При рассмотрении под микроскопом можно видеть образовавшиеся бесцветные продолговатые кристаллы тетрароданомеркурата кадмия Cd[Hg(SCN)4].
Реакция с тетрайодовисмутатом(Ш) калия. Катионы кадмия дают с тетрайодовисмутатом(Ш) калия K[BiI4] черный осадок йодида вис-мута(Ш) BiI3:
Осадок йодида висмута(Ш) растворяется при прибавлении избытка растворов йодида калия KI или тиосульфата натрия Na2S2O3.
Методика. На лист фильтровальной бумаги наносят каплю раствора тетрайодовисмутата(Ш) калия K[BiI4] и каплю раствора соли кадмия. На бумаге появляется черное пятно. При добавлении по каплям раствора йодида калия или тиосульфата натрия черное пятно исчезает.
Другие реакции катионов кадмия. Известен целый ряд аналитических реакций на катионы кадмия, особенно - с комплексообразую-щими органическими реагентами: дитизоном, кадионом, меркапто-бензтиазолом, меркаптобензимидазолом, р-нафтохинолином, хиналь-диновой кислотой, со смесью йодида калия с трис-а-дипиридилжеле-зом(П) и т.д.
ВНИМАНИЕ! Все соединения ртути(П) сильно ядовиты, поэтому при работе с ними следует принимать меры предосторожности!
Акво-ионы ртути(П) [Hg(H2O)n]2+ в водных растворах бесцветны.
Реакции с щелочами и аммиаком. При добавлении водного раствора щелочи к водному раствору, содержащему катион Hg2+, выпадает желтый осадок оксида ртути(П) HgO:
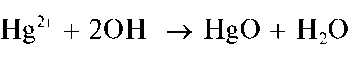
Реакция - фармакопейная.
Осадок HgO растворяется в азотной кислоте, в растворах хлоридов и йодидов щелочных металлов с образованием соответственно Hg(NO3)2, HgCl2 и комплекса [HgI4]2- :
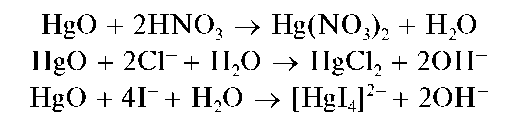
Методика. В пробирку вносят 3-4 капли водного раствора соли ртути(П) и прибавляют по каплям водный раствор NaOH или KOH. Выпадает желтый осадок оксида ртути(П) состава HgO.
При реакции с водным раствором аммиака катионы Hg2+ образуют белые осадки. Из водных растворов хлорида ртути(П) HgCl2 выпадает белый осадок состава HgNH2Cl, из водных растворов нитрата ртути(П) Hg(NO3)2 - белый осадок состава [OHg2NH2]NO3:
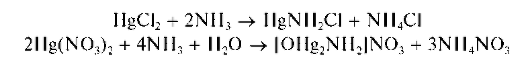
Осадки растворяются (лучше - при нагревании) в избытке аммиака, но только в присутствии солей аммония, с образованием бесцветного комплексного катиона тетрамминртути(П) [Hg(NH3)4]2+:
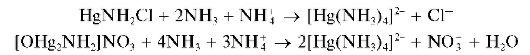
Методика. В одну пробирку вносят 3-4 капли водного раствора хлорида ртути(П) HgCl2, а в другую - столько же водного раствора нитрата ртути(П) Hg(NO3)2 В каждую пробирку прибавляют по каплям водный раствор аммиака до выпадения белых осадков. Затем в про-
бирки добавляют по 3- 4 капли водного раствора соли аммония (NH4Cl или NH4NO3) и по каплям - водный раствор аммиака при перемешивании до полного растворения осадков.
Реакция с йодидом калия (фармакопейная). Катионы Hg2+ дают с йодид-ионами I- в водном растворе красный осадок йодида ртути(П) HgI2, который при избытке йодид-ионов растворяется с образованием бесцветного тетрайодомеркурат(П)-иона [HgI4]2- :
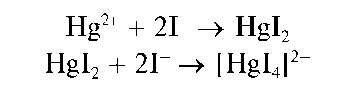
Мешают катионы Pb2+,Cu2+,Ag+, висмут(Ш) и некоторые другие, а также окислители.
Методика. В пробирку вносят 2-3 капли раствора соли ртути(П) и прибавляют каплю разбавленного (5 %) раствора йодида калия. Выпадает красный осадок йодида ртути(П) HgI2.
При дальнейшем прибавлении по каплям (при встряхивании) раствора йодида калия осадок растворяется с образованием бесцветного раствора.
Реакцию можно также проводить капельным методом на фильтровальной бумаге - наблюдается появление красно-оранжевого пятна, исчезающего при добавлении избытка раствора йодида калия.
Методика. На лист фильтровальной бумаги наносят каплю разбавленного водного раствора йодида калия, затем - каплю раствора соли ртути(П). Возникает красно-оранжевое пятно. При дальнейшем добавлении по каплям раствора йодида калия пятно обесцвечивается.
Эта методика рекомендуется для открытия катионов Hg2+ даже в присутствии мешающих катионов.
Реакция с сульфид-ионами (фармакопейная). Катионы Hg2+ осаждаются из водных растворов сульфид-ионами S2- в виде черно-коричневого осадка сульфида ртути(П) HgS. Реакция протекает в несколько стадий. Вначале образуется белый осадок, постепенно изменяющий окраску через желто-красную и бурую на коричнево-черную при избытке сульфид-ионов.
Так, при действии сероводорода H2S на водный раствор хлорида ртути(П) HgCl2 сначала выпадает белый осадок состава 2HgSHgCl2:
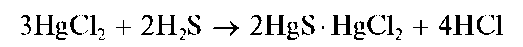
При избытке H2S белый осадок превращается в коричнево-черный
HgS: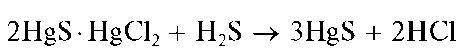
Аналогично протекает реакция HgCl2 с сульфидом натрия Na2S. Сульфид ртути(П) HgS не растворяется в разбавленной азотной кислоте, но растворим в царской водке (смесь HCl + HNO3):
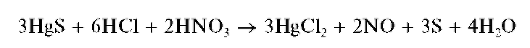
Методика. В пробирку вносят 2-3 капли раствора хлорида ртути(П) HgCl2 и прибавляют по каплям раствор сульфида натрия Na2S сероводородной воды. Выпадает белый осадок, чернеющий при дальнейшем прибавлении раствора Na2S или сероводородной воды.
Реакция с хлоридом олова(II). Катионы Hg2+ восстанавливаются оло-вом(П) вначале до катионов Hg22+, а затем - до металлической ртути Hg. Так, при взаимодействии хлорида ртути(П) HgCl2 с хлоридом оло-ва(П) образуется белый осадок каломели Hg2Cl2, который темнеет за счет выделения мелкодисперсной металлической ртути:
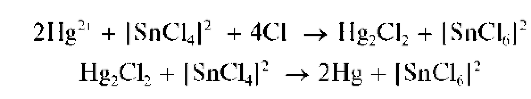
Мешают катионы Ag+, Hg2+, Sb(III), Bi(III).
Методика. В пробирку вносят 2- 3 капли раствора хлорида рту-ти(II) HgCl2 и прибавляют по каплям солянокислый раствор хлорида олова(II). Выпадает белый осадок Hg2Cl2, который постепенно темнеет.
Реакцию можно проводить капельным методом на фильтровальной бумаге: при нанесении на бумагу капли раствора хлорида олова(II) и капли раствора хлорида ртути(II) появляется темное пятно.
Аналогично протекают реакции солей ртути(II) c некоторыми другими восстановителями, например, с металлической медью. Для проведения этой реакции на медную поверхность наносят каплю раствора соли ртути(II). На поверхности возникает темное (черно-серое) пятно, которое при протирании фильтровальной бумагой становится серебристо-блестящим.
Другие реакции катионов ртути(II). Известны качественные реакции на ртуть(II) c рядом других неорганических и органических реагентов - с хромат-ионами (образуется желтый HgCrO4), с ортофос-фат-ионами (белый Hg3(PO4)2), с дифенилкарбазидом и с дифенилкар-базоном (комплексы сине-фиолетового цвета), с дитизоном (желто-оранжевый или красный комплексы, в зависимости от условий проведения реакции) и т.д.
Аналитические реакции катиона кобальта(П) Co2+
Акво-ионы кобальта(П) октаэдрической конфигурации [Co(H2O)6]2+ окрашены в розовый цвет, поэтому разбавленные водные растворы солей кобальта(П) также имеют розовую окраску. Однако при упаривании водных растворов солей кобальта(П) их фиолетовая окраска меняется на синюю, характерную для комплексов кобальта(П) тетраэдри-ческой структуры.
Соединения кобальта(П) сравнительно легко окисляются до соединений кобальта(Ш), причем в ряде случаев - уже кислородом воздуха (растворенным в воде), что необходимо учитывать при проведении качественных реакций на кобальт(П). В водных растворах кобальт(П) и кобальт(Ш) присутствуют исключительно в форме комплексных соединений. Комплексы кобальта(Ш) устойчивее комплексов кобаль-та(П), хотя известны и стабильные комплексы кобальта(П).
Реакция с щелочами. Катионы Со2+ приреакциисщелочами вначале образуют синий осадок гидроксосоли кобальта(П) (например, ^OHCl), которая затем переходит в розовый осадок гидроксида ко-бальта(П) Co(OH)2 Так, при взаимодействии хлорида кобальта(П) со щелочью реакция протекает по схеме:
Розовый гидроксид кобальта(П) Co(OH)2 медленно буреет вследствие окисления кислородом воздуха до черно-бурого гидроксида коба-льта(Ш) состава Co(OH)3:
Если к розовому осадку Co(OH)2 прибавить пероксид водорода H2O2, то реакция окисления Co(OH)2 вчерно-бурый Co(OH)3 протекает практически мгновенно:
Действие смеси H2O2 со щелочью на раствор соли кобальта(П) сразу приводит к образованию черно-бурого осадка Co(OH)3: 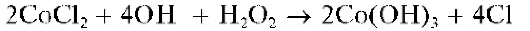
Методика. В пробирку вносят 3 капли раствора соли кобальта(П), например, Q)Cl2, и медленно, по каплям, при непрерывном перемешивании смеси прибавляют водный раствор NaOH или КОН. Образуется синий осадок CoOHCl, переходящий при дальнейшем прибавлении щелочи в розовый осадок Co(OH)2, который через некоторое время постепенно темнеет за счет окисления до Co(OH)3.
Реакция с аммиаком. При реакции катионов Co2+ с аммиаком также вначале образуется синий осадок основной соли. Дальнейшее прибавление раствора аммиака приводит к растворению осадка с образованием гексамминкобальт(П)-катионов [Co(NH3)6]2+ грязно-желтого цвета (раствор - желтого цвета):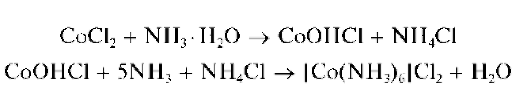
На воздухе раствор постепенно принимает вишнево-красный цвет вследствие окисления кобальта(П) до кобальта(Ш) с образованием хлоропентамминкобальт(Ш)-анионов [Co(NH3)5Cl]2- вишнево-красного цвета:
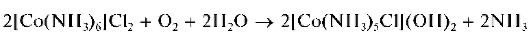
В присутствии пероксида водорода и солей аммония реакция окисления [Co(NH3)6]2+ до [Co(NH3)5Cl]2+ протекает практически мгновенно:
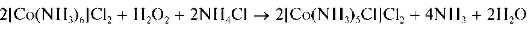
Методика. В пробирку вносят 3 капли раствора хлорида кобаль-та(П) и медленно, по каплям прибавляют раствор аммиака до выпадения синего осадка CoOHCl. Добавляют несколько кристалликов хлорида аммония и продолжают прибавление раствора аммиака при перемешивании смеси до полного растворения осадка и образования желтого раствора. При стоянии на воздухе раствор постепенно меняет окраску на вишнево-красную.
В другую пробирку вносят 3 капли раствора хлорида кобальта(П), прибавляют 2 капли раствора пероксида водорода и затем по каплям - раствор аммиака до выпадения черно-бурого осадка гидроксида ко-бальта(Ш). Добавляют по каплям концентрированный раствор аммиака до растворения осадка и образования вишнево-красного раствора, содержащего комплексы [Co(NH3)5Cl]2+.
Реакция с тиоцианат-ионами. Катионы Co2+ в слабокислой среде реагируют с тиоцианат-ионами NCS- c образованием синего комплекса - тетратиоцианатокобальтат(П)-иона [Co(NCS)4]2-:
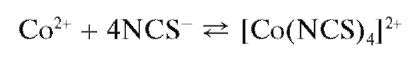
Комплекс в водных растворах неустойчив, и равновесие комплек-сообразования смещено влево в сторону образования розового акво-комплекса кобальта(П). Поэтому реакцию проводят при избытке тио-цианат-ионов, чтобы сместить равновесие вправо.
Равновесие смещается вправо также в водно-ацетоновых растворах, в силу чего реакцию иногда проводят в водно-ацетоновой среде (ацетон хорошо смешивается с водой).
В растворах органических растворителей (изоамиловый спирт, эфир) устойчивость комплекса повышается. Поэтому при проведении данной реакции водный раствор, содержащий катионы ^^смешива-ют с небольшим количеством органического растворителя (обычно - смесь изоамилового спирта и диэтилового эфира). При этом тетратио-цианатный комплекс кобальта(П) переходит в органическую фазу и окрашивает ее в синий цвет.
Предел обнаружения ионов кобальта(П) этой реакцией - 0,5 мкг.
Проведению реакции мешают катионы железа(Ш) Fe3+, меди(П) Cu2+, также образующие окрашенные соединения с тиоцианат-ионами - желто-бурый комплекс меди(П) и красные комплексы желе-за(Ш). Мешающее действие этих катионов можно устранить, восстановив их хлоридом олова(П) до железа(П) и меди(1).
Мешающее действие катионов Fe3+ устраняют также, связывая их в устойчивые бесцветные комплексы такими маскирующими агентами, как фторид- и тартрат-анионы, прибавляя фторид натрия NaF или тартрат натрия-калия NaKC4H4O6 соответственно. В качестве маскирующих агентов используют также оксалат-ионы C2O4~ и ортофосфат-ионы PO4~.
Методика. В пробирку вносят 2-3 капли раствора соли кобаль-та(11), прибавляют 8-10 капель насыщенного раствора тиоцианата калия KNCS или аммония NH4NCS (или несколько кристалликов этих солей), 5-6 капель органического растворителя (изоамиловый спирт или смесь изоамилового спирта с диэтиловым эфиром) и встряхивают смесь. Верхний слой органической фазы окрашивается в синий цвет.
В другую пробирку вносят 2-3 капли раствора соли кобальта(П), 2-3 капли раствора соли железа(Ш) и прибавляют 5-6 капель насыщенного раствора тиоцианата калия или аммония. Раствор принимает
красную окраску - цвет тиоцианатных комплексов железа(Ш), на фоне которого нельзя увидеть синюю окраску тиоцианатных комплексов кобальта(П). К смеси прибавляют порошкообразные NaF или NaKC4H4O6 до исчезновения красной окраски. Затем добавляют 5-6 капель органического растворителя и встряхивают пробирку. Наблюдается синее окрашивание верхней жидкой органической фазы.
Реакцию можно также проводить капельным методом на фильтровальной бумаге. Для этого на лист фильтровальной бумаги наносят каплю концентрированного раствора тиоцианата калия или аммония, каплю раствора соли кобальта(П) и высушивают бумагу на воздухе. Наблюдают образование синего пятна.
Реакция с тетратиоцианатомеркуратом(И) аммония (с тетрарода-номеркуратом(И) аммония). Катионы Co2+ при реакции с тетратиоциа-натомеркуратом(П) аммония (NH4)2[Hg(SCN)4] образуют комплекс Co[Hg(SCN)4], выпадающий из раствора в виде темно-синих кристаллов: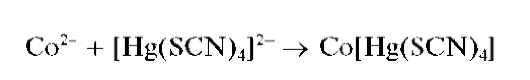
Из разбавленных растворов кристаллы выделяются медленно. Если же в растворе присутствуют катионы цинка Zn2+, то при проведении реакции сразу же выпадает голубой осадок смешанного тиоцианатного комплекса цинка и кобальта(П) состава ZnxCoy[Hg(SCN)4]x+y:
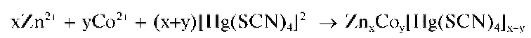
Прибавление даже небольших количеств соли цинка приводит к почти полному осаждению кобальта(П).
Проведению реакции мешают катионы Cd2+,Cu2+,Fe3+,Ni2+.
Методика. В пробирку вносят 4-5 капель раствора соли кобаль-та(П), прибавляют каплю раствора соли цинка (например, ZnSO4^ 3-4 капли раствора (NH4)2[Hg(SCN)4]. Выпадает голубой осадок смешанного тиоцианатного комплекса цинка и кобальта(П).
Реакция с сульфид-ионами. Катионы Co2+ приреакцииссульфид-ионами образуют черный осадок сульфида кобальта(П) CoS:
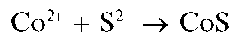
Свежевыпавший осадок CoS растворяется в минеральных кислотах, однако при стоянии он превращается в форму, трудно растворимую в разбавленной HO, но растворимую в кислотах в присутствии окислителей.
Методика. В пробирку вносят 2-3 капли раствора соли кобальта(П) и прибавляют 2-3 капли раствора сульфида аммония (NH4)2S. Выпадает черный осадок сульфида кобальта CoS.
Реакция с солями цинка - образование «зелени Ринмана». Если на листок фильтровальной бумаги нанести несколько капель раствора нитрата цинка Zn(NO3)2 и несколько капель раствора нитрата кобальта Co(NO3)2, после чего листок подсушить и озолить (например, поместить его в фарфоровый тигель и внести в пламя газовой горелки), то образуется зола зеленого цвета - «зелень Ринмана» состава CoZnO2:
Zn(NO3)2 + Co(NO3)2 - CoZnO2 + 4NO2 + O2
(см. также выше раздел «Аналитические реакции катионов цинка Zn2+»).
Реакция с 1-нитрозо-2-нафтолом - реактивом Ильинского. Ко-бальт(П) в этой реакции вначале окисляется до кобальта(Ш), который с 1-нитрозо-2-нафтолом образует внутрикомплексное соединение, выделяющееся в виде пурпурно-красного осадка. Если 1-нитрозо-2-наф-тол, который в растворе может существовать, как полагают, в двух тау-томерных формах, условно обозначить через HL
то реакцию можно описать схемой (после окисления кобальта(П) до кобальта(Ш)):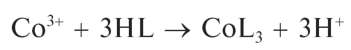
Реакцию проводят в нейтральной или слабокислой среде. Мешают катионы меди(11) Cu2+.
Методика.В пробирку вносят 2-3 капли раствора соли кобаль-та(11), 1-2 капли уксусной кислоты, 2-3 капли 1 % раствора 1-нитро-зо-2-нафтола. При осторожном нагревании наблюдают выделение пурпурно-красного осадка внутрикомплексного соединения.
Реакцию можно проводить также капельным методом на фильтровальной бумаге. Для этого на листок фильтровальной бумаги наносят каплю раствора соли кобальта(П) и каплю 1 % раствора 1-нитро-зо-2-нафтола в уксусной кислоте. На бумаге возникает красно-коричневое пятно.
Реакция с нитрозо-И-солью (фармакопейная). Нитрозо-Я-соль, которую, как и реактив Ильинского, можно представить в двух таутомер-ных формах
при взаимодействии с кобальтом(Ш), возникающем в кислой среде вследствие окисления кобальта(П) до кобальта(Ш), образует внутри-комплексное соединение состава CoL'3 (HI/ - условное обозначение молекулы нитрозо-Я-соли, как указано в вышеприведенной схеме) красного цвета: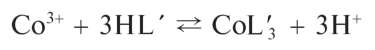
Реакцию проводят в кислой среде при нагревании. Раствор окрашивается в красный цвет. При достаточно больших концентрациях из раствора выпадает красный осадок внутрикомплексного соединения.
Реакция довольно чувствительна: предел обнаружения равен 0,05 мкг.
Методика. В пробирку вносят 3-4 капли раствора соли кобаль-та(11), 3-4 капли разбавленного раствора HCl. Раствор в пробирке нагревают до кипения, прибавляют 3-4 капли свежеприготовленного раствора нитрозо-Я-соли в 50 % уксусной кислоте и нагревают до кипения. Раствор окрашивается в красный цвет и из него выпадает красный осадок.
Другие реакции катионов кобальта(П). Катионы кобальта(П) c нитритом калия KNO2 в уксуснокислой среде образуют (после окисления до кобальта(Ш)) желтый кристаллический осадок гексанитрокобаль-тата(Ш) калия K3[Co(NO2)6]; по этой реакции катионы кобальта можно открыть в присутствии катионов никеля.
Соединения кобальта с бурой Na2B4O710H2O образуют перлы синего цвета, с рубеановодородной кислотой NH2CSCSNH2 (формулу которой можно также представить в виде HN=C(SH)-C(SH)=NH) - желто-бурый осадок комплексного соединения.
Известны и некоторые другие реакции на катионы кобальта.
Аналитические реакции катионов никеля(II) Ni2+
Аквокомплексы никеля(II) [Ni(H2O)6]2+ окрашены в зеленый цвет, поэтому водные растворы солей никеля(II) имеют зеленую окраску. В растворах никель(II) присутствует только в форме комплексных соединений.
Реакция с щелочами. Катионы никеля(II) Ni2+ осаждаются щелочами из водных растворов в виде малорастворимого гидроксида никеля(II) Ni(OH)2 зеленого цвета:
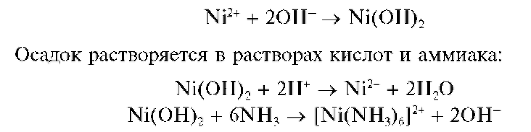
Методика. В пробирку вносят 2-3 капли раствора соли никеля(II) и прибавляют по каплям при перемешивании раствор щелочи. Выпадает светло-зеленый осадок.
Реакция с аммиаком. Аммиак осаждает из растворов солей нике-ля(II) светло-зеленые осадки оксисолей никеля(II), например:
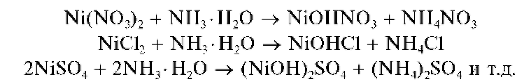
В избытке аммиака осадки оксисолей никеля(II) растворяются с образованием комплексных гексамминникель(II)-катионов синего цвета, например:
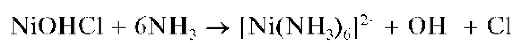
Гексамминникель(II)хлорид [Ni(NH3)6]Cl2, гексамминникель(П)-нитрат [Ni(NH3)6] (NO3)2, гексамминникель(II)сульфат [Ni(NH3)6]SO4 хорошо растворяются в воде. Некоторые другие гексааммиа-каты никеля(II), такие, как фиолетовый гексамминникель(II)бро-мид [Ni(NH3)6]Br2, голубой гексамминникель(II)перхлорат [Ni(NH3)6](ClO4)2, в воде малорастворимы.
Методика. В пробирку вносят 2-3 капли раствора хлорида нике-ля(11) NiCl2 (или нитрата Ni(NO3)2, или сульфата NiSO4) и прибавляют по каплям при перемешивании разбавленный раствор аммиака до выпадения зеленого осадка NiOHCl. Добавляют по каплям при перемешивании концентрированный (25 %) раствор аммиака до полного растворения осадка и образования раствора синего цвета.
Осторожно нагревают смесь и прибавляют к ней по каплям концентрированный раствор бромида калия KBr до выпадения фиолетового осадка [Ni(NH3)6]Br2.
Реакция с диметилглиоксимом (реактивом Чугаева). Катионы Ni2+ при реакции с диметилглиоксимом (реактивом Чугаева) при рН « 6-9 образуют малорастворимое в воде внутрикомплексное соединение розово-красного цвета - бис-диметилглиоксиматоникель(П) (старое название - «никельдиметилглиоксим»):
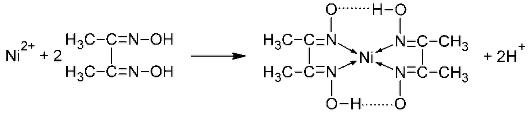
(здесь точками обозначены водородные связи OH). Обычно реакцию проводят в среде аммиака.
Осадок растворяется в сильных кислотах и щелочах, нерастворим в растворах аммиака.
Катионы кобальта(П) в малых концентрациях не мешают определению никеля. Мешают катионы Cu2+,Pb2+,Fe2+,Fe3+. Разработаны методики для устранения их мешающего действия.
Эта реакция, впервые предложенная Л.А.Чугаевым, является наиболее характерной для катионов никеля(II) и высокочувствительной: предел обнаружения равен 0,16 мкг, предельное разбавление - 3 105 мл/г. Чувствительность реакции повышается в присутствии небольших количеств окислителей (бром, йод и др.), переводящих ни-кель(II) в никель(Ш), комплекс которого с диметилглиоксимом имеет еще более интенсивную окраску.
Методика. В пробирку вносят 3-4 капли раствора соли никеля(II), прибавляют 3-4 капли концентрированного раствора аммиака и каплю спиртового раствора диметилглиоксима. Выпадает розово-красный осадок комплекса.
Реакцию можно проводить капельным методом на фильтровальной бумаге. Для этого на листок фильтровальной бумаги наносят каплю раствора соли никеля(II), затем - каплю спиртового раствора диме-тилглиоксима. Бумагу держат над склянкой с концентрированным раствором аммиака (в парах аммиака) до появления розово-красного пятна.
Другие реакции катионов никеля(П). Катионы Ni2+ ссульфид-иона-ми S2- в нейтральной среде образуют черный осадок сульфида нике-ля(II) NiS; со смесью щелочи и хлорной воды - черно-бурый осадок гидроксида никеля(Ш) Ni(OH)3; c тиоцианатом калия KNCS и пиридином (Py) - голубой осадок комплекса состава [NiPy4](NCS)2;cрубе-ановодородной кислотой - сине-фиолетовый осадок рубеаната никеля, малорастворимый в кислотах и аммиаке.
Описаны и другие реакции катионов Ni2+.
В табл. 7 охарактеризованы продукты некоторых аналитических реакций катионов шестой аналитической группы.
Контрольные вопросы
1. Какую окраску имеют гидроксиды катионов пятой группы?
2. Реакцию гидролиза каких ионов пятой группы используют для их обнаружения? Напишите уравнения соответствующих реакций.
3. Как отличить осадки SbOCl и BiOCl друг от друга?
4. Объясните с позиции протолитической теории растворение осадка гидроксида магния в насыщенном растворе хлорида аммония.
5. Какую роль играет хлорид аммония и аммиак при осаждении иона магния гидрофосфатом натрия? Составьте соответствующие уравнения реакций.
6. Как действует пероксид водорода в щелочной среде на железо(II) и марганец(П)? Напишите уравнения соответствующих реакций и укажите цвет продуктов реакции.
7. Как действует пероксид водорода в щелочной среде на кобальт(11)II? Напишите соответствующее уравнение реакции и укажите цвет продукта реакции.
8. Какую окраску имеют продукты осаждения катионов четвертой группы раствором аммиака или щелочей?
9. Какую окраску имеют аммиачные комплексы катионов шестой группы? Напишите их формулы.
10. Какую окраску имеют сульфиды кадмия, сурьмы(Ш) и сурьмы(V)? Из каких растворов они выделяются?
11. Летучие соли каких ионов пятой и шестой групп окрашивают пламя газовой горелки? Укажите цвет пламени.
12. Для чего при растворении основной соли кобальта(П) CoOHCl и HgNH2Cl в избытке концентрированного раствора аммиака добавляют сухую соль аммония? Дайте обоснование, используя уравнения реакций растворения этих солей.
13. Какую реакцию можно использовать для дробного обнаружения ртути(II) в смеси катионов пятой и шестой групп? Напишите ее уравнение в ионном виде.
14. Почему реакцию образования диметилглиоксимата никеля проводят в аммиачной среде? Поясните, написав соответствующее уравнение реакции.
15. Напишите формулы комплексных соединений:
а) Cu2+ скупроном,
б) Co2+ с 1-нитрозо-2-нафтолом.
16. При выполнении какой аналитической реакции катиона кобаль-та(П) применяют экстракцию? Объясните необходимость ее применения.
Занятие 6. Анализ смеси катионов четвертой, пятой и шестой аналитических групп по кислотно-основной классификации
Цель занятия:
- научиться проводить качественный анализ смеси катионов чет-вертой,пятойишестойаналитических группврастворе;
- научиться рассчитывать величину рН растворов гидролизующих-ся солей, буферных смесей.
Задание для самоподготовки
К занятию нужно знать
1. Как проводить дробный и систематический анализ растворов, содержащих смесь катионов четвертой, пятой и шестой групп.
2. Как устранять мешающее действие катионов друг на друга при их совместном присутствии.
3. Уравнения для расчетов значений рН растворов гидролизующих-ся солей и буферных систем.
4. Правила техники безопасности и работы в химико-аналитической лаборатории.
Уметь
1. Составлять схему анализа смесей катионов четвертой, пятой и шестой групп.
2. Проводить расчеты значений рН растворов гидролизующихся солей, буферных смесей.
3. Рассчитывать буферную емкость растворов.
Литература
Харитонов Ю.Я. Аналитическая химия (аналитика). 1, гл. 5, с. 126-141, гл. 13, с. 328-336.
Лурье Ю.Ю. Справочник по аналитической химии. - М.: Химия, 1989.
Вопросы для самопроверки
1. Какие из катионов четвертой, пятой и шестой групп окрашены?
2. Назовите групповые реагенты катионов четвертой, пятой и шестой аналитических групп. Опишите их действие на катионы.
3. Какие из гидроксидов катионов четвертой, пятой и шестой групп окисляются пероксидом водорода в щелочной среде?
4. Напишите химические формулы соединений, образующихся при взаимодействии катионов четвертой, пятой и шестой групп с избытком аммиака. Укажите растворимость и цвет образующихся соединений.
5. Что произойдет, если солянокислые растворы солей сурьмы(Ш), висмута(Ш), олова(П) разбавить водой и нагреть?
6. Назовите органические реагенты, используемые для обнаружения катионов четвертой, пятой и шестой групп.
7. Какой из катионов четвертой группы образует гидроксид, растворимый в избытке аммиака?
8. Какие комплексные соединения катионов пятой группы используются в качественном анализе?
9. Логарифмы общих констант устойчивости комплексных ионов: гексамминкобальта(П), тетрамминкадмия(П) и тетрамминмеди(П) соответственно равны 4,39; 6,56; 12,03. Какой из перечисленных ионов наиболее устойчив?
10. Какие из катионов четвертой, пятой и шестой групп обладают окислительно-восстановительными свойствами?
11. Напишите формулу расчета окислительно-восстановительного потенциала для равновесной редокс-системы, если в равновесии принимают участие ионы водорода.
12. Как на практике оценить полноту осаждения катиона из раствора и полноту его извлечения из осадка в раствор?
Лабораторная работа
Реактивы (см. занятия 4, 5) Учебные таблицы
1. Схема анализа смеси катионов четвертой, пятой и шестой аналитических групп
2. Частные реакции катионов четвертой, пятой и шестой аналитических групп.
Контрольная задача
Анализ смеси катионов четвертой, пятой и шестой аналитических групп
Предварительные наблюдения
Анализируемый раствор может быть без осадка или содержать осадок, в состав которого могут входить продукты гидролиза олова(П) и олова(IV), сурьмы(Ш) и сурьмы(V), висмута(Ш), ртути(П) и других катионов четвертой, пятой и шестой аналитических групп.
Анализируемый раствор (осадок) может быть бесцветным или окрашенным. По окраске раствора (осадка) делают предположение о наличии или отсутствии в нем тех или иных катионов.
Определение рН раствора
Значение рН анализируемого раствора устанавливают по универсальной индикаторной бумаге.
Если рН раствора 2-4 и раствор не содержит осадка, то в растворе отсутствуют олово(II) и олово(IV), сурьма(Ш) и сурьма(V), вис-мут(III), ртуть(II) и железо(III), продукты гидролиза которых осаждаются в указанном диапазоне значений рН.
Если при этих значениях рН (2-4) в растворе имеется осадок, то последний может включать продукты гидролиза вышеперечисленных ионов. При рН > 4 кроме этих ионов осадок может содержать также другие катионы четвертой, пятой и шестой групп.
Анализ раствора без осадка
Полученный для анализа раствор делят на три части. Одну часть раствора используют для выполнения предварительных испытаний, другую - для систематического анализа, третью - для контроля.
1. Предварительные испытания
Прежде всего приступают к обнаружению в растворе катиона желе-за(ГГ), который легко окисляется кислородом воздуха с образованием железа(Ш). Далее проводят пробы на отдельные группы катионов действием групповыми реагентами, а также обнаружение отдельных катионов дробными реакциями в определенной последовательности.
1.1. Обнаружение Fe2+ иЕе3+
Железо(II) обнаруживают реакцией с калия гексацианоферра-том(Ш) при рН = 3. В присутствии железа(II) выпадает осадок синего цвета. Образование осадка другого цвета говорит об отсутствии желе-
за(II).
Железо(Ш) обнаруживают реакцией c калия гексацианоферра-том(II) при рН » 3. В присутствии железа(Ш) выпадает осадок темно-синего цвета. Образование раствора синего или голубого цвета свидетельствует о наличии следов катиона железа(III), который образуется в результате окисления катиона железа(II), присутствующего в исходном растворе.
1.2. Действие разбавленным раствором гидроксида натрия в присутствии пероксида водорода. Обнаружение Cr3+.
К 8-10 каплям исходного раствора прибавляют 4-5 капель 3 % раствора пероксида водорода. Полученную смесь нагревают на кипящей водяной бане и прибавляют по каплям при перемешивании 2 моль/л раствор натрия гидроксида.
Если при постепенном добавлении щелочи выпадает осадок, который в избытке реагента полностью растворяется, то делают вывод об отсутствии катионов пятой и шестой групп и присутствии катионов четвертой группы.
Если образующийся осадок в избытке щелочи заметно не растворяется или растворяется частично, то делают вывод о возможном присутствии катионов всех трех групп. Окончательный вывод о наличии или отсутствии катионов четвертой группы возможен только после проведения аналитических реакций на катионы этой группы.
Обращают внимание на цвет осадка и раствора, делая на основе этих наблюдений вывод о возможном их составе. Так, появление желтой окраски раствора при действии пероксида водорода и избытка щелочи указывает на присутствие в исходном растворе катиона хро-
ма(III).
Для подтверждения вывода о присутствии хрома(III) в отдельной порции раствора после отделения осадка гидроксидов проводят реакцию образования надхромовой кислоты.
1.3. Действие концентрированным раствором аммиака. Обнаружение
Cu2+.
К 8-10 каплям исходного раствора добавляют несколько кристаллов хлорида аммония или нитрата аммония. Смесь нагревают на водяной бане и прибавляют к ней по каплям при перемешивании 25 % раствор аммиака.
Если при действии аммиака первоначально выделившийся осадок полностью растворяется в избытке реагента, то предполагают наличие в исходном растворе катионов четвертой группы, а также катионов цинка и магния. Другие катионы четвертой и пятой групп отсутствуют.
Если при испытаниях, описанных в п. 1.2, был получен осадок, полностью растворяющийся в избытке реагента, то предполагают наличие в исходном растворе катионов четвертой группы, а также катионов цинка и магния. Другие катионы четвертой и пятой групп отсутствуют.
Если при испытаниях, описанных в п. 1.2, был получен осадок, полностью растворяющийся в избытке щелочи (катионы пятой и шестой групп отсутствуют), а при действии избытка аммиака образуется белый осадок, то делают вывод о возможном присутствии только алю-миния(Ш), олова(II) и олова(IV). Если образуется осадок серо-зеленого цвета, то, кроме указанных катионов, предполагают наличие также катиона хрома(III).
Действие концентрированного раствора аммиака можно использо-ватъ для обнаружения меди(II), а также для предположений о наличии других катионов четвертой группы в исходном растворе. С этой целью обращают внимание на окраску раствора при действии на него избытка аммиака. Появление интенсивной синей окраски говорит о присутствии меди(II), синей окраски - о возможном присутствии нике-ля(II), грязно-желтой, переходящей в вишнево-красную, - кобаль-
та(II).
Для надежного обнаружения меди(II), если окраска раствора получается недостаточно характерной, поступают следующим образом. К 3-4 каплям исходного раствора прибавляют 2 капли 2 моль/л раствора гидроксида натрия. Образовавшийся при этом осадок нагревают на водяной бане в течение 5 мин; в присутствии меди(II) осадок приобретает черный цвет вследствие образования меди оксида. Затем добавляют 6 капель 2 моль/л раствора хлорида аммония, смесь перемешивают стеклянной палочкой и центрифугируют. Осадок обрабатывают 3-4 каплями 2 моль/л раствора азотной кислоты. К полученному раствору приливают 8-10 капель 25 % раствора аммиака. В присутствии меди(II) раствор окрашивается в интенсивный синий цвет.
1.4. Обнаружение мышьяка
Обнаружение мышьяка проводят реакцией с аммония молибдатом вазотнокислойсреде.
1.5. Обнаружение сурьмы
Обнаружение сурьмы проводят только в том случае, если исходный раствор имеет рН < 1.
К 2-3 каплям исходного раствора добавляют 2-3 капли 2 моль/л раствора азотной кислоты, 2-3 капли 3 % раствора пероксида водоро-
да, смесь нагревают на кипящей водяной бане в течение 2-3 мин. В присутствии сурьмы выпадает белый хлопьевидный осадок сурьмяной кислоты.
Для подтверждения вывода о наличии сурьмы в осадке смесь охлаждают, отделяют осадок от раствора центрифугированием, осадок растворяют в концентрированном растворе соляной кислоты. Раствор разбавляют в 2 раза дистиллированной водой и обнаруживают сурьму реакцией с сероводородной водой или с металлическим железом, цинком или алюминием.
Для обнаружения сурьмы в исходном растворе можно применить реакцию образования ионного ассоциата [SbCl6]- с метиловым фиоле-товымилиродамином6Ж.
1.6. Обнаружение Mn2+
Марганец(II) обнаруживают реакцией окисления до перманга-нат-иона, например, действием висмутата натрия в азотнокислой среде.
1.7. Обнаружение Co2+
В присутствии железа(III) и меди(II) кобальт(II) определяют реакцией с 1-нитрозо-2-нафтолом.
В отсутствии железа(III) и меди(II) кобальт(II) легко обнаруживают реакцией с тиоцианатом аммония или тиоцианатом калия.
1.8. Обнаружение Ni2+
В отсутствии катионов железа никель(II) обнаруживают реакцией с диметилглиоксимом в слабощелочной среде.
1.9. Обнаружение Hg2+
Ртуть(II) определяют реакцией с хлоридом олова(II).
1.10. Обнаружение Bi3+
В отсутствие сурьмы и ртути(II) висмут(III) легко обнаруживают реакцией восстановления висмута(III) до элементного состояния действием олова(II) хлорида в щелочной среде.
2. Систематический анализ
2.1. Отделение сурьмы
Эту операцию проводят только в том случае, если предварительные испытания показали присутствие сурьмы в исходном растворе. Для отделения сурьмы к порции раяствора (1-2 мл), оставленной для выполнения систематического анализа, добавляют 9-10 капель 2 моль/л раствора азотной кислоты и несколько капель 3 % раствора водорода пероксида. Смесь нагревают на кипящей водяной бане в течение 2-3 мин. Образовавшийся белый хлопьевидный осадок сурьмы(V) отделяют центрифугированием и отбрасывают.
2.2. Отделение катионов четвертой группы от катионов пятой и шестой групп
К центрифугату, оставшемуся после отделения сурьмы, прибавляют по каплям при перемешивании 2 моль/л раствор гидроксида натрия до нейтральной реакции среды, затем еще полуторный объем этого раствора и 5-8 капель 3 % раствора пероксида водорода. Смесь перемешивают и нагревают на кипящей водяной 6ане. При этом в осадок переходят катионы пятой и шестой групп в виде гидроксидов (оксидов, основных солей), а катионы четвертой группы остаются в растворе. Если в исследуемом растворе присутствует хром(III), то смесь продолжают нагревать до полного перехода цвета раствора из зеленого в желтый. После удаления избытка водорода пероксида нагреванием смесь центрифугируют, отделяют осадок от раствора и немедленно приступают к анализу осадка. Центрифугат сохраняют для последующего анализа.
2.3. Разделение гидроксидов катионов пятой и шестой групп Свежеосажденный осадок гидроксидов (оксидов, основных солей)
катионов пятой и шестой групп обрабатывают избытком 25 % раствора аммиака при нагревании на водяной бане и перемешивании стеклянной палочкой в течение 2-3 мин. При этом катионы шестой группы переходят в раствор в виде комплексных соединений, а в осадке остаются гидроксиды катионов пятой группы. Смесь центрифугируют. Обращают внимание на цвет осадка и раствора, делая на основе этих наблюдений вывод о возможном их составе.
Приступают к анализу осадка. Центрифугат сохраняют.
2.4. Анализ осадка гидроксидов катионов пятой группы (без сурьмы)
2.4.1. Отделение и обнаружение Mg2+
Осадок гидроксидов катионов пятой группы обрабатывают при перемешивании и нагревании на водяной бане насыщенным раствором хлорида аммония. Смесь центрифугируют. В центрифугате определяют катион магния(II) реакций с гидрофосфатом натрия.
2.4.2. Отделение и обнаружение марганца Mn2+
Осадок гидроксидов катионов пятой группы, оставшийся после отделения магния(II), обрабатывают 2 молъ/л раствором азотной кислоты при нагревании на водяной бане и перемешивании. Железо(III) и висмут(III) переходят в раствор, в осадке остается марганцоватистая кислота бурого цвета. Осадок отделяют от раствора центрифугированием. Центрифугат сохраняют для дальнейшего анализа, а в осадке определяют марганец реакцией с висмутатом натрия.
2.4.3. Обнаружение Fe3+ и Вi3+
Азотнокислый центрифугат, оставшийся после отделения осадка мар-ганцоватистой кислоты, делят на две части. В одной - определяют желе-зо(III) реакцией с тиоцианат-ионами, в другой - висмут(III) реакцией с иодидом калия или реакцией с гексагидроксостаннат(II)-ионами.
2.5. Анализ аммиачного раствора катионов шестой группы
2.5.1. Отделение меди(П) и ртути(П) от других катионов шестой группы
Аммиачный центрифугат, оставшийся после отделения осадка гид-роксидов катионов пятой группы (см. п. 2.3), подкисляют 3 моль/л раствором серной кислоты и делят на 2 части. В одной части проводят отделение меди(II) и ртути(II) от других катионов шестой группы, а вторую часть оставляют для обнаружения кобальта(II), никеля(II) и кадмия(II) на тот случай, если окажется, что медь(II) и ртуть(II) отсутствуют в растворе.
Для отделения меди(II) и ртути(II) к сернокислому раствору прибавляют при перемешивании стеклянной палочкой кристаллический тиосульфат натрия. Смесь нагревают на водяной бане в течение 2-3 мин. Обращают внимание на цвет образующегося осадка.
Если образуется осадок чисто желтого цвета (элементная сера), то делают вывод об отсутствии в исходном растворе катионов меди(II) и ртути(II).
Если при действии кристаллического натрия тиосульфата образуется осадок черного или темно-серого цвета, то предполагают наличие в нем меди(Г), ртути(II) сульфидов и элементной серы. Осадок отделяют от раствора центрифугированием. В осадке определяют медь и ртуть(II), а в центрифугате - кобальт(II), никель(II) и кадмий(II).
2.5.2. Отделение и обнаружение Си2+
Выделившийся черный или темно-серый осадок переносят в фарфоровый микротигель, обрабатывают 3 моль/л раствором азотной кислоты и нагревают на асбестовой сетке в течение 2-3 мин. Смесь охлаждают, переносят в пробирку и центрифугируют. В центрифугате определяют медь(II) действием избытка аммиака. В осадке определяют ртуть(II).
2.5.3. Обнаружение Hg2+
Если после обработки раствором азотной кислоты осадок стал желтым (элементная сера), его отбрасывают и делают вывод об отсутствии ртути(II) в исходном растворе. Если осадок черного или темно-серого цвета, то его переносят в фарфоровый микротигель и обрабатывают при нагревании на асбестовой сетке царской водкой (смесь концент-
рированных растворов азотной и соляной кислот в соотношении 1:3) или смесью Комаровского (смесь 6 моль/л раствора соляной кислоты и 6 % раствора пероксида водорода в соотношении 1:1). Полученный раствор упаривают до небольшого обьема, охлаждают, разбавляют водой и прибавляют к нему 2 моль/л раствор хлорида олова(II). В присутствии ртути(II) образуется белый, постепенно темнеющий осадок. 2.5.4. Обнаружение Со2+,?2+,С<12+
Часть сернокислого раствора, предназначенного для обнаружения кобальта(II), никеля(II) и кадмия(II) в случае отсутствия меди(II) и ртути(II) (см. п. 2.5.1), или сернокислый центрифугат, оставшийся после отделения меди(II) и ртути(II) действием тиосульфата натрия, делят на три части. В одной из них определяют кобальт(II) реакцией с 1-нитрозо-2-нафтолом или реакцией с избытком тиоцианат-ионов. В другой части определяют никель(II) реакцией с диметилглиоксимом. В третьей части определяют кадмий(II) реакцией с сероводородной водой при pH » 0,5.
2.6. Анализ щелочного центрифугата катионов четвертой группы Катионы четвертой группы открывают дробным методом из отдельных порций щелочного центрифугата (см. п. 2.2).
2.6.1. Обнаружение Cr3+
Хром определяют в щелочном центрифугате так, как указано в предварительных испытаниях (см. п. 1.2).
2.6.2. Обнаружение олова
8-10 капель щелочного центрифугата подкисляют 5-6 каплями концентрированного раствора соляной кислоты и погружают в этот раствор кусочек железной стружки для восстановления олова(IV) до тетрахлоростаннат(II)-иона. Через 2-3 мин стружку вынимают, к раствору добавляют 2-3 капли раствора ртути(II) хлорида. В присутствии олова(II) образуется белый, постепенно чернеющий осадок.
2.6.3. Обнаружение Zn2+
К 8-10 каплям щелочного центрифугата прибавляют 2-3 капли раствора сульфида аммония. В присутствии цинка(II) образуется белый осадок.
2.6.4. Обнаружение A13+
Алюминий(Ш) в щелочном центрифугате определяют реакцией с ализарином. Для этого 2-3 капли щелочного центрифугата подкисляют 2 моль/л раствором уксусной кислоты. На полоску фильтровальной бумаги, пропитанной раствором калия гексацианоферрата(II), наносят 2 капли уксуснокислого раствора, после чего открывают катионы алюминия реакцией с ализарином.
2.6.5. Обнаружение мышьяка
Мышьяк в щелочном центрифугате определяют реакцией с молиб-датом аммония.
Анализ раствора с осадком
При наличии осадка к анализируемой смеси прибавляют несколько капель 2 моль/л раствора азотной кислоты, после чего смесь нагревают на кипящей водяной бане в течение 4-5 мин при перемешивании. Если при этом осадок полностью растворяется, делают вывод об отсутствии сурьмы в исходной смеси и анализируют полученный азотнокислый раствор, как указано в разделе «Анализ раствора без осадка» (кромеп.1.5 ип.2.1).
Если осадок при действии азотной кислоты не растворяется, то его отделяют центрифугированием. Центрифугат сохраняют, а осадок анализируют на содержание в нем сурьмы следующим образом.
Осадок промывают 2 моль/л раствором азотной кислоты, переносят в фарфоровый микротигель и обрабатывают при нагревании концентрированным раствором соляной кислоты. Полученный раствор разбавляют водой в 2-3 раза и обнаруживают сурьму реакцией с сероводородной водой или другой реакцией.
Центрифугат, полученный после обработки исходного раствора с осадком азотной кислотой, анализируют, как указано в разделе «Анализ раствора без осадка» (кроме п. 1.5 и п. 2.1)
Контрольные вопросы
1. Какой вывод можно сделать о составе смеси катионов четвертой, пятой и шестой аналитических групп по внешнему виду анализируемого раствора?
2. Укажите возможный состав осадка при анализе смеси катионов четвертой, пятой и шестой групп, если рН раствора, содержащего осадок, меньше 4.
3.Укажите возможный состав раствора, не содержащего осадок, при анализе смеси катионов четвертой, пятой и шестой групп, если рН раствора равен 2-4.
4. Какие катионы четвертой, пятой и шестой групп можно обнаружить в их смеси дробным методом?
5. Перечислите основные этапы систематического анализа смеси катионов четвертой, пятой и шестой групп.
6. Как отделяют сурьму от других катионов по ходу анализа смеси катионов четвертой, пятой и шестой групп?
7. Каким образом можно отделить катионы четвертой группы от катионов пятой и шестой групп?
8. Для чего при отделении катионов четвертой группы от катионов пятой и шестой групп их смесь обрабатывают раствором гидроксида натрия с добавлением пероксида водорода? Напишите химические формулы соединений, образующихся в растворе и в твердой фазе.
9. Что можно сказать о составе осадка гидроксидов катионов пятой группы, если он:
а) белого цвета,
б) бурого цвета?
10. Как можно разделить магний(II) и марганец(II) в их смеси?
11. Какие катионы четвертой, пятой и шестой групп могут восстанавливаться в солянокислом растворе при погружении в него металлического железа, цинка или алюминия?
12. При обнаружении каких катионов четвертой, пятой и шестой групп используется экстракция образующихся соединений?
13. На какой реакции основано отделение меди(II) и ртути(II) от других катионов шестой группы?
14. Укажите возможный состав осадка, образующегося при действии тиосульфата натрия на сернокислый раствор, содержащий катионы четвертой группы, если он:
а) черного цвета,
б) желтого цвета.
15. Напишите уравнения растворения сульфида меди(I) в растворе азотной кислоты, а сульфида ртути(II) - в царской водке и в смеси Комаровского.
Занятие 7. Экстракция в качественном анализе катионов
Цель занятия:
- на основе знания теории и техники экстракционных процессов и химико-аналитических свойств ионов уметь обнаруживать ионы в растворе, используя экстракционные реакции, и выполнять анализ смеси катионов экстракционным методом.
Целевые задачи:
1. Выполнение экстракционных реакций ионов.
2. Анализ смеси катионов шестой аналитической группы экстракционным методом.
Введение
Экстракция - совокупность методов, основанных на использовании различий в растворимости извлекаемого компонента в двух контактирующих несмешивающихся фазах (двух жидких или жидкой и твердой).
В аналитической химии под экстракцией понимают процесс распределения вещества между двумя несмешивающимися жидкими фазами (экстракционное равновесие), а также метод выделения и разделения веществ, основанный на таком распределении.
В большинстве случаев используют комбинацию двух контактирующих несмешивающихся жидких фаз - органический растворитель (экстрагент) и водный раствор разделяемых (извлекаемых) веществ. В таком случае говорят о жидкостной экстракции.
В лабораторных условиях экстракцию проводят с помощью делительной воронки. В эту воронку помещают водный раствор, содержащий растворенное вещество, подлежащее экстрагированию, и не смешивающийся с водой органический растворитель, которым извлекается экстрагируемое вещество из водного раствора. Воронка энергично встряхивается (обычно 2-5 минут). При этом обе жидкие фазы диспергируются друг в друге, образуя капли различного размера. Экстрагируемое вещество через границу раздела водной и органической фаз переходит из водной фазы в органическую до тех пор, пока в системе не наступит межфазное равновесие, при котором достигаются равновесные концентрации экстрагируемого вещества в водной и в органической фазах. При достижении межфазного равновесия скорость перехода растворенного вещества из водной фазы в органическую становится равной скорости перехода того же вещества из органической фазы в водную, то есть осуществляется состояние динамического равновесия. После прекращения встряхивания обе жидкие фазы расслаиваются, причем тем быстрее, чем больше различие в плотности воды (водного раствора) и применяемого органического растворителя, плотность которого может быть как выше, так и ниже плотности воды.
Используемые органические растворители должны обладать способностью эффективно и избирательно извлекать экстрагируемое вещество из водного раствора, мало растворяться в воде и мало растворять воду, не гидролизоваться, иметь малое давление насыщенного пара при обычных температурах - быть нелетучими и достаточно вы-сококипящими (температура кипения при атмосферном давлении должна быть выше 50 °С). Их плотность по возможности должна максимально отличаться от плотности воды.
Распространенными растворителями являются хлороформ CHC13 (плотность 1,4890 г/см3 при 20 °С), четыреххлористый углерод СС14 (плотность 1,5940 г/см3 при 20 °С). Ароматические органические растворители менее удобны, так как обладают заметной токсичностью.
Органические растворители, используемые в качестве экстраген-тов, должны быть неогнеопасными, нетоксичными и доступными (дешевыми). Растворители, которые обладали бы всеми этими свойствами в полной мере, встречаются редко.
На практике в экстракции используют такие различные органические растворители, как алифатические и ароматические углеводороды (гексан, октан, декан, пентен, гексен, циклогексан, бензол, толуол и др.), соединения, содержащие одну функциональную группу (спирты - амиловый, октиловый; простые и сложные эфиры - диэтиловый эфир, диизопропиловый эфир, этилацетат; кетоны, нитросоединения; галогенпроизводные - хлороформ, четыреххлористый углерод, 1,2-дихлорэтан, хлорбензол; серосодержащие соединения - сероуглерод, тиофен), соединения, имеющие более одной функциональной группы, например, 2-хлоранилин, и др.
Экстракция широко применяется в качественном и количественном анализе.
Задание для самоподготовки
К занятию надо знать
1. Теоретические основы экстракции. Законы, лежащие в основе экстракции: закон распределения, закон действующих масс в применении к гетерогенным системам. Типы экстракционных систем. Закономерности экстракции хелатных комплексов и ионных ассоциатов. Экстракция как эффективный метод разделения.
2. Основные понятия: экстрагент, экстракционный реагент, экстракт, реэкстракция, реэкстракт, реэкстрагент, разбавитель, промывка, промывной раствор, периодическая экстракция, непрерывная экстракция, противоточная экстракция, экстрактор. Количественные ха-
рактеристики экстракции: константа распределения, коэффициент распределения, фактор извлечения, фактор разделения. Связь между количественными характеристиками.
3. Органические реагенты, применяемые в качественном анализе катионов четвертой, пятой, шестой групп.
Уметь
1. Составлять уравнения реакций образования хелатных комплексов катионов четвертой, пятой, шестой аналитических групп с органическими реагентами.
2. Выполнять аналитические реакции ионов с применением экстракции.
Литература
Харитонов Ю.Я.Аналитическая химия (аналитика). Кн. 1, гл. 9,
с. 240-263.
Лурье Ю.Ю. Справочник по аналитической химии. - М.: Химия,
1989.
Вопросы для самопроверки
1. Что такое экстракция? Какие преимущества имеет экстракция по сравнению с другими методами разделения?
2. Сформулируйте законы, лежащие в основе экстракционных методов.
3. Что такое экстрагент? Назовите экстрагенты, используемые в реакциях образования дитизоната цинка, надхромовой кислоты.
4. Какие требования предьявляются к органическим растворителям, применяемым для экстракции?
5. Перечислите органические растворители, наиболее часто используемые в экстракционном анализе.
6. Какие экстракционные реагенты вы знаете? Являются ли эти реагенты специфическими?
7. Что такое реэкстракция? Как ее выполняют?
8. Назовите основные типы экстракционных систем, имеющих наибольшее значение в анализе.
9. Каковы закономерности экстракции хелатных комплексов?
10. Что такое константа распределения и коэффициент распределения? В каких случаях эти характеристики совпадают?
11. Напишите формулу, связывающую фактор извлечения и коэффициент распределения.
12. Как повысить специфичность (избирательность) экстракционных реакций?
13. Что такое маскировка? Приведите примеры использования этого приема в экстракции.
14. Почему при проведении экстракции необходимо энергично перемешивать раствор и экстрагент?
15. Перечислите правила работы с огнеопасными и летучими жидкостями.
Лабораторная работа
Посуда
Воронки делительные вместимостью 50 мл, закрепленные в штативе.
Реактивы Амиловый спирт. Диэтиловый эфир. Бензол.
1 % раствор 8-оксихинолина в хлороформе. 20 % раствор ацетилацетона в хлороформе. 0,02 % раствор дитизона в четыреххлористом углероде. 0,002 % раствор дитизона в четыреххлористом углероде. Дитизон должен быть предварительно очищен по следующей методике.
1 г дитизона растворяют в 100 мл хлороформа и фильтруют. Хлороформный раствор обрабатывают несколькими порциями по 20 мл 0,2 моль/л водного раствора аммиака. Дитизон переходит в водную фазу, окрашивая ее в оранжевый цвет. Аммиачные фракции объединяют и подкисляют 2 моль/л раствором HC1. Дитизон, выпавший в осадок, извлекают несколькими порциями хлороформа объемом 10 мл. Хлороформные экстракты объединяют, промывают несколько раз водой и удаляют хлороформ, упаривая раствор в фарфоровой чашке на водяной бане при медленном нагревании. Реагент хранят в темной плотно закрытой склянке.
1%растворЭДТА.
10 % раствор солянокислого гидроксиламина.
0,2 % раствор метилового фиолетового.
5 % раствор фторида калия.
20 % раствор тартрата калия или натрия.
1 % раствор диметилглиоксима в этаноле.
Насыщенный раствор диметилглиоксима в хлороформе.
Насыщенный раствор калия перманганата.
30 % раствор гидроксида натрия.
Ацетат натрия кристаллический.
Тиоцианат калия или аммония кристаллический.
Нитрит калия кристаллический.
Тиосульфат натрия кристаллический.
1. Обнаружение катионов с помощью экстракционных реакций
1.1. Обнаружение Cr3+
Кислота надхромовая H2Cr2O6 образуется, как известно, при действии водорода пероксида на кислый раствор, содержащий диxpoмат-ионы. Окисление хрома(Ш) до дихромат-иона в кислой среде можно провести перманганатом калия:
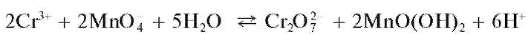
В присутствии органических растворителей - амилового спирта или диэтилового эфира - кислота надхромовая переходит в органический слой, окрашивая его в сине-фиолетовый цвет. Реакцию используют для дробного обнаружения хрома в присутствии всех других катионов.
Методика. В центрифужную пробирку помещают 2-3 капли исследуемого раствора, подкисляют 2 моль/л раствором HNO3, прибавляют избыток раствора KMnO4 и нагревают несколько минут на водяной бане. Окраска раствора должна быть ярко-малиновой. Если такой окраски нет, добавляют еще KMnO4 и нагревают. Центрифугируют, осадок отбрасывают, центрифугат хорошо охлаждают, прибавляют 8-10 капель диэтилового эфира, несколько капель раствора H2O2 и энергично встряхивают содержимое пробирки. Экстракт окрашивается в синий цвет.
1.2. Обнаружение Q)2+
Тиоцианат-ион образует с комплексный ион состава
[Co(NCS)4]2-. Комплекс в водном растворе неустойчив (р =1103). Прочность его повышается в менее полярных, чем вода, растворителях, например, в амиловом спирте. Реакции мешает ион Fe3+,образую-щий с тиоцианат-ионом окрашенный в кроваво-красный цвет комплекс. Мешающее действие Fe3+ устраняется за счет связывания его в прочный бесцветный комплекс [FeF6]3- .
Можно также использовать раствор хлорида олова(11). В этом случае устраняется мешающее действие не только Fe3+,ноиCu2+, которые восстанавливаются до Fe2+ иОд+. Реакция может быть использована для дробного открытия Fe3+,Cu2+ и^2+.
Методика. В пробирку помещают 1 мл дистиллированной воды и по 1 капле растворов солей кобальта, меди и железа(Ш), добавляют NH4NCS в виде сухой соли. Раствор окрашивается в кроваво-красный цвет, что свидетельствует о присутствии железа(Ш). Добавляют раствор KF до исчезновения кроваво-красной окраски и наблюдают коричневато-желтую окраску раствора, свидетельствующую о наличии меди(II). Прибавляют несколько капель раствора хлорида олова(II), 6-8 капель амилового спирта, встряхивают содержимое пробирки. Экстракт окрашивается в синий цвет.
1.3. Обнаружение Al3+
Al3+ образует с 8-оксихинолином в уксуснокислой среде окрашенное в желтый цвет внутрикомплексное соединение, плохо растворимое в воде и хорошо растворимое в ряде органических растворителей.
Методика. В пробирку помещают 2-3 капли раствора соли алюминия, добавляют кристаллический aцeтaт натрия до рН 5, равный объем 10 % раствора 8-оксихинолина в хлороформе и экстрагируют в течение 1-2 мин. Органический слой окрашивается в желтый цвет.
1.4. Обнаружение сурьмы(У)
Сурьма(У) в среде соляной кислоты образует комплексный анион [SbCl6]-, способный экстрагироваться неполярными растворителями в виде ионных ассоциатов с катионами некоторых органических красителей по схеме: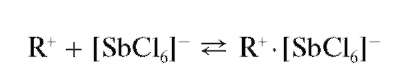
где R+ - катион метилового фиолетового или родамина 6Ж.
Методика. В пробирку помещают 1 каплю раствора сурьмы(Ш), 6 капель концентрированного раствора НС1, несколько кристаллов NaNO2 или KNO2, перемешивают и выдерживают 1 мин. Добавляют около 0,5 г (1 лопаточку) кристаллической мочевины для разрушения избытка нитрит-иона, 10 капель дистиллированной воды, 3 капли 0,2 % раствора метилового фиолетового и 6 капель бензола. Энергично встряхивают. Слой органического растворителя окрашивается в фиолетовый цвет.
Вместо метилового фиолетового можно применять родамин 6Ж. Экстракт в этом случае имеет розовую окраску.
1.5. Обнаружение Cu2+
Cu2+ с ацетилацетоном в азотнокислой среде образует внутрикомп-лексное соединение сине-зеленого цвета. Этот хелатный комплекс экстрагируется хлороформом, окрашивая его в сине-зеленый цвет. Реакция чувствительна, но недостаточно специфична.
1.6. Реакции с дитизоном
Внутрикомплексные соединения с дитизоном образуют многие катионы тяжелых металлов. Состав комплексов зависит от природы катиона, рН среды и концентрации реагента.
Экстракция в виде дитизонатов характерна для катионов, обладающих сродством к сере, т.е. образующих малорастворимые сульфиды. Катионы, дающие экстрагируемые дитизонаты, можно разделить на три группы:
1) Cu2+,Hg2+,Ag+;
2) Zn2+,Ni2+,Co2+;
3) Pb2+,Cd2+.
Извлечение дитизонатов ионов этих групп проводят, соответственно, из солянокислых (0,5-1 молъ/л HC1), уксуснокислых и щелочных растворов. Селективность разделения может быть повышена с помощью маскирования мешающих ионов.
1.6.1. Обнаружение Hg2+
К 2-3 каплям раствора HgC12 прибавляют 2 моль/л раствор азотной кислоты до рН = 1 по универсальному индикатору и 4-5 капель раствора дитизона в CC14, встряхивают. Органический слой окрашивается в оранжевый цвет.
1.6.2. Обнаружение Zn2+
К нескольким каплям раствора соли цинка, имеющего рН « 5, добавляют равный объем раствора дитизона в CC14,встряхивают.Экст-ракт окрашивается в красный цвет. Обрабатывают экстракт 10 каплями 30 % раствора NaOH.
Водная фаза окрашивается в красный цвет (отличие дитизоната цинка от дитизонатов других металлов).
1.6.3. Обнаружение Cd2+
К 2-3 каплям раствора соли кадмия(11) прибавляют несколько капель 20 % раствора тартрата натрия, 2-3 капли 30 % раствора NaOH и экстрагируют разбавленным раствором дитизона в СС14.В присутствии кадмия(11) органический слой окрашивается в красный цвет. При добавлении к экстракту 20-25 капель 1 % раствора ЭДТА и встряхивании органическая фаза становится оранжево-коричневой.
2. Применение экстракции для разделения катионов 2.1. Анализ смеси катионов цинка, кадмия и ртути(11) Для разделения катионов цинка, кадмия и ртути(11) можно использовать и один экстракционный реагент - раствор дитизона в CC14.
Методика. В делительную воронку помещают 4-5 мл дистиллированной воды и по одной капле растворов солей цинка, кадмия и рту-ти(11). Добавляют 2 моль/л раствор HNO3 до рН - 1-2 по универсальному индикатору и 1 мл раствора дитизона в CC14. Встряхивают 3 мин, органическую фазу сливают, а водную оставляют в той же воронке. Оранжевый цвет экстракта свидетельствует о наличии ртути(11).
К водной фазе, оставшейся в делительной воронке, добавляют сухой ацетат натрия до рН = 4-5, несколько кристаллов тиосульфата натрия и 1 мл раствора дитизона в CC14 Экстрагируют 3 мин. Дитизонат цинка окрашивает органический слой в красный цвет.
Разделяют фазы, сливая органический слой в пробирку. Для проверки наличия цинка в органической фазе экстракт обрабатывают 10 каплями 30 % раствора NaOH. В присутствии катионов цинка вод-
2.2.1. Предварительное обнаружение Ni2+ и^2+
К 1-2 каплям испытуемого раствора добавляют 2-3 капли раствора соли олова(11) в НС1 и сухую соль NН4NCS. Экстрагируют изоамило-вым спиртом. В присутствии кобальта(11) экстракт окрашивается в синий цвет.
К капле испытуемого раствора добавляют 2 капли 20 % раствора тартрата натрия-калия, 2 капли 10 % раствора NH2OHHCl и раствор аммиака до рН « 9. Экстрагируют насыщенным раствором диметил-глиоксима в хлороформе. В присутствии катионов никеля экстракт имеет желтую окраску (при высоких концентрациях Ni2+ экстракт окрашен в розовый цвет).
2.2.2. Обнаружение и отделение меди(П)
В делительную воронку помещают 4-5 мл исследуемого раствора и экстрагируют медь(II) 20 % раствором ацетилацетона в хлороформе, встряхивая воронку не менее 1 мин. После разделения фаз органический слой отделяют и помещают в пробирку. В присутствии меди экстракт имеет сине-зеленую окраску. В этом случае к водной фазе в делительной воронке добавляют еще 1 мл раствора ацетилацетона в хлороформе и снова встряхивают 1 мин. Экстракты, содержащие ацетила-цетонат меди, объединяют (органическая фаза 1). В водной фазе, оставшейся в делительной воронке, находятся катионы Cd2+,Hg2+, Ni2+,Co2+ (водная фаза 1).
Для доказательства присутствия меди в экстракте (органическая фаза 1) в пробирку добавляют 20-30 капель 6 моль/л раствора HC1 и встряхивают. Отбирают часть реэкстракта с помощью глазной пипетки. Доказывают в нем наличие катиона меди реакцией с K4[Fe(CN)6] (капельный вариант).
2.2.3. Обнаружение и отделение ртути(П)
К водной фазе в делительной воронке (водная фаза 1) добавляют 2 моль/л раствор НNО3 до рН « 1 по универсальной индикаторной бумаге, 1 мл 0,02 % раствора дитизона в CC14 и встряхивают 3 мин. Органическую фазу сливают в пробирку (органическая фаза 2), а водную оставляют в делительной воронке (водная фаза 2). Оранжевый цвет экстракта свидетельствует о наличии ртути(II). Для подтверждения содержания ртути(II) органическую фазу 2 переносят в другую делительную воронку, промывают водой, реэкстрагируют ртуть 2 мл 1 моль/л раствора KI с добавлением 4 капель раствора 1 моль/л H2SО4 при энергичном встряхивании. Разделяют фазы и к реэкстракту добавляют 2 моль/л раствор аммиака до рН « 8, после чего экстрагируют раствором дитизона. Оранжевая окраска экстракта свидетельствует о наличии дитизоната ртути(II).
2.2.4. Обнаружение катионов кадмия
К водной фазе 2 в делительной воронке, содержащей катионы кадмия, кобальта и никеля, добавляют 4-5 капель 20 % раствора тартрата натрия, 2 капли раствора диметилглиоксима в этаноле и 2-5 капель 30 % раствора ?OH до pH « 8-10. Экстрагируют 0,002 %-ным раствором дитизона в CC14 В присутствии катионов кадмия органический слой окрашивается в красный цвет. При добавлении к экстракту в отдельной пробирке 20-25 капель 1 % раствора ЭДТА и встряхивании органическая фаза приобретает темно-зеленую окраску.
Контрольные вопросы
1. Можно ли применять для экстракции в качестве органического растворителя такие вещества, как хлороформ, этиловый спирт, амиловый спирт, ацетон?
2. Как можно обнаружить Co2+ в присутствии Fe3+ иОд2+ реакцией с тиоцианатом калия?
3. Напишите реакцию образования дитизоната ртути. В какой цвет окрашен этот хелатный комплекс?
4. В каких условиях образуется дитизонат кадмия? Напишите уравнение соответствующей реакции и укажите ее аналитический эффект.
5. Назовите хелатные комплексы меди, имеющие аналитическое значение. В какой цвет окрашены эти соединения?
6. Почему при обнаружении Cr3+ по реакции образования надхромо-вой кислоты образующуюся кислоту необходимо экстрагировать органическим растворителем?
7. Как отличить дитизонат цинка от дитизонатов других металлов?
8. Предложите экстракционный вариант разделения катионов меди и кадмия; меди и ртути; ртути и цинка; ртути и кадмия.
9. Какие органические красители могут быть использованы в качестве реагентов для открытия сурьмы?
10. Что такое реэкстракция? Покажите на примере анализа катионов шестой группы.
11. Какие вещества и в каких реакциях используются как маскирующие реагенты?
12. Хелатное соединение одинаково хорошо извлекается растворителем А, имеющим плотность 1,04 г/см3, и растворителем В с плотностью 1,32 г/см3.Какой из растворителей следует использовать?
Примеры тестовых пунктов текущего контроля по теме II
I. Задания на установление соответствия
Инструкция. Установите соответствие. Каждый ответ может быть использован один раз, несколько раз или не использован совсем.
II. Задания с выбором одного или нескольких правильных ответов Инструкция. Для каждого незаконченного утверждения один или несколько ответов являются правильными. Выберите номера правильных ответов.
16. При обработке осадка гидроксидов катионов пятой и шестой групп концентрированным раствором аммиака при нагревании гидро-ксиды следующих металлов перейдут в раствор:
1. Cd(OH)2
2. Cu(OH)2
3. Co(OH)2
4. Fe(OH)3
Напишите уравнение реакции растворения одного из гидроксидов. Ответ:1,2,3
Cd(OH)2 + 4NH3 - [Cd(NH3)4]2+ + 2OH-
17. Катионы четвертой группы, окисляющиеся пероксидом водорода в щелочной среде:
1. Fe3+
2. Mn2+
3. Mg2+
4. Fe2+
Ответ:2,4
III. Тестовые пункты на определение причинно-следственных взаимосвязей
Инструкция. Вопрос состоит из двух утверждений, соединенных союзом «потому что». Проверьте, верно или неверно каждое утверждение в отдельности, а затем связь между ними. Для выбора ответов используйте приведенную ниже схему.
Ответ Утверждение I Утверждение II Связь
А верно верно верно
В верно верно неверно
С верно неверно неверно
D неверно верно неверно
Е неверно неверно неверно
18. Реакцию обнаружения Fe3+ в виде тиоцианатного комплекса же-леза(Ш) необходимо проводить в кислой среде, потому что катион Fe3+ не гидролизуется в кислой среде.
Ответ:А
Содержание письменной контрольной работы по теме II
1. Теоретические основы качественного анализа.
1.1. Применение закона действующих масс к кислотно-основным равновесиям в аналитической химии.
Протолитические равновесия в растворах слабых кислот и оснований. Основные понятия протолитической теории: кислота, основание, сопряженная кислотно-основная пара. Степень и константа ионизации, связь между ними. Константы кислотности и основности. рК кислот и оснований.
Автопротолиз воды. Ионное произведение воды. Водородный показатель. Расчет рН растворов слабых кислот и оснований.
Амфолиты. Использование их свойств в качественном химическом анализе катионов четвертой, пятой и шестой аналитических групп.
Гидролиз солей как протолитическая реакция. Гидролиз по катиону и аниону. Константа и степень гидролиза, связь между ними. Расчет рН растворов солей. Подавление и усиление гидролиза. Использование гидролиза в качественном химическом анализе на примере катионов пятой аналитической группы.
Буферные растворы. Протолитическое равновесие в буферных растворах. Расчет рН буферных растворов. Понятие о буферной емкости. Применение буферных растворов в качественном химическом анализе.
2. Кислотно-основной метод анализа.
Групповые реагенты. Состав четвертой, пятой и шестой аналитических групп катионов, их общая химико-аналитическая характеристика.
Частные реакции катионов четвертой, пятой, шестой групп. Дробный анализ смеси катионов четвертой группы. Систематический ход анализа катионов пятой и шестой групп. Систематический ход анализа смеси катионов четвертой, пятой и шестой групп.
3. Вычислительные задачи
3.1. Расчет рН растворов сильных кислот и оснований.
3.2. Расчет концентрации сильных кислот и оснований по величине
рН.
3.3. Расчет рН растворов слабых кислот и оснований.
3.4. Расчет степени ионизации слабых электролитов.
3.5. Расчет константы и степени гидролиза солей.
3.6. Расчет рН растворов солей.
3.7. Расчет рН буферных растворов.
3.8. Расчет состава буферных растворов по величине рН.
Пример билета письменной контрольной работы ? 2 (дневное отделение)
1. Автопротолиз воды. Ионное произведение воды. Водородный показатель. Влияние кислотности среды на проведение аналитических реакций (на примере катионов четвертой аналитической группы).
2. Анализ смеси катионов: Cr3+,Cu2+,Cd2+.
3. Рассчитайте константу и степень гидролиза аммония нитрата в растворе с молярной концентрацией 0,2 моль/л. Влиянием ионной силы раствора пренебречь.
4. Вычислите рН водного раствора аммиака с молярной концентрацией 0,05 моль/л.
Пример билета письменной контрольной работы ? 2 (вечернее отделение)
1. Буферные растворы, образованные слабой кислотой и ее солью.
2. Анализ смеси ионов: AsO44,Cu2+,Hg2+.
3. Рассчитайте рН и рОН раствора бария гидроксида с молярной концентрацией эквивалента 110-4 моль/л.