Клиническая фармакология. Общие вопросы клинической фармакологии. Практикум: учебное пособие. Сычев Д.А., Долженкова Л.С., Прозорова В.К. и др. / Под ред. В.Г. Кукеса. 2013. - 224 с.: ил.
|
|
|
|
МОДУЛЬ 6 КЛИНИЧЕСКАЯ ФАРМАКОГЕНЕТИКА
После освоения темы студент должен знать
1. Понятие о фармакогенетике и фармакогеномике.
2. Генетические факторы (или особенности) пациента, влияющие на эффективность и безопасность ЛС.
3. Принципы проведения фармакогенетического тестирования.
4. Понятие о персонализированной медицине.
5. Требования, предъявляемые к фармакогенетическим тестам для их использования в клинической практике.
6. Показания к проведению фармакогенетического тестирования.
7. Принципы интерпретации результатов фармакогенетического тестирования.
8. Принципы выбора ЛС и режимы их дозирования с учетом результатов фармакогенетического тестирования.
После освоения темы студент должен уметь
1. Определять показания и отбирать пациентов для проведения фармакогенетического тестирования.
2. Выбирать ЛС и режимы их дозирования на основе результатов фармакогенетического тестирования.
Литература, необходимая для освоения темы
Основная
Кукес В.Г. Клиническая фармакология. - М.: ГЭОТАР-Медиа,
2008. - С. 214-237.
Дополнительная
Клиническая фармакогенетика / под общ. ред. В.Г. Кукеса,
Н.П. Бочкова. - М.: ГЭОТАР-Медиа, 2007. - 248 с.
Середенин С.Б. Лекции по фармакогенетике. - М.: МИА, 2004. -
303 с.
Лекция, которую необходимо прослушать для освоения темы
Сычев Д.А. Клиническая фармакогенетика. http://lech.mma.ru/clinpharm/ucheb/pharm/lekt/1
Что такое фармакогенетика и фармакогеномика
Фармакогенетика - наука, изучающая роль генетических факторов в виде изменений в отдельных генах в формировании фармакологического ответа организма человека на ЛС. Иными словами, фармакогенетика изучает, как изменения в отдельных генах у пациента влияют на эффективность и безопасность ЛС. Фармакогеномика же изучает влияние всей совокупности генов человека, т.е. генома, на фармакологический ответ.
Выполните тестовые задания для самоконтроля
Выберите один или несколько правильных ответов.
1. Фармакогеномика отличается от фармакогенетики тем, что:
A. Изучает влияние носительства отдельных аллелей на фармакологический ответ у больного.
Б. Изучает влияние всего генома больного на фармакологический ответ.
B. Для внедрения в практику требует применения ДНК-чипов. Г. Не требует изучения генотипа больного.
2. В основе генетических особенностей пациентов, влияющих на фармакологический ответ, чаще всего лежат:
A. Однонуклеотидные полиморфизмы генов, кодирующих ферменты биотрансформации и транспортеры.
Б. Однонуклеотидные полиморфизмы генов, кодирующих молекулы-мишени лекарственных средств.
B. Хромосомные аберрации.
Г. Хромосомные транслокации.
3. Изменять фармакокинетику ЛС у больного могут полиморфизмы генов:
А. Кодирующих рецепторы.
Б. Кодирующих компоненты ренин-ангиотензин-альдостероновой системы.
В. Кодирующих ферменты I фазы биотрансформации ЛС. Г. Транспортеры ЛС.
4. Изоферменты цитохрома Р-450:
A. Имеют низкую субстратную специфичность по отношению к
ЛС.
Б. Метаболизируют определенные ЛС.
B. Генетически полиморфны.
Г. Участвуют в метаболизме эндогенных соединений.
5. Клиническое значение для индивидуализации фармакотерапии имеют исследования генетического полиморфизма:
A. CYP2D6. Б. CYP3A4.
B. CYP2C9. Г. CYP2C19.
6. При выявлении у больного с постоянной формой фибрилляции предсердий гетерозиготного носительства медленного аллельного варианта гена CYP2C9 необходимо:
A. Воздержаться от применения непрямых антикоагулянтов.
Б. Воздержаться от применения варфарина, назначить аценокумарол.
B. Воздержаться от назначения аценокумарола, назначить варфарин.
Г. Назначить варфарин или аценокумарол в минимальной начальной дозе.
7. У больного с болевым синдромом, у которого выявляется дубликация гена CYP2D6, обезболивающий эффект при применении трамадола будет:
A. Слабым.
Б. Выраженным.
B. Средним.
8. Фармакогенетический тест может быть использован в клинической практике, если:
A. Доказано, что при его использовании повышается эффективность и безопасность ЛС.
Б. Доказано, что при его использовании снижаются затраты на лечение.
B. Частота аллельного варианта, который определяет фармакогенетический тест в популяции, превышает 1%.
Г. Все перечисленное верно.
9. Полиморфизм генов системы биотрансформации и транспортеров у больного можно определить методом:
A. Иммуноферментного анализа.
Б. Иммунофлюоресцентного анализа.
B. Полимеразной цепной реакцией.
Г. Высокоэффективной жидкостной хроматографии.
10. Фармакогенетическое тестирование для индивидуализации фармакотерапии показано:
A. Больным с высоким риском развития нежелательных реакций.
Б. При назначении лекарственных средств с узким терапевтическим диапазоном.
B. При применении большого числа лекарственных средств у одного больного.
Г. Больным, работающим с ионизирующим излучением.
Что представляют собой генетические факторы, влияющие на фармакологический ответ
Эти генетические факторы (фактически генетические особенности пациента), как правило, представляют собой полиморфные участки генов белков, участвующих в фармакокинетике или фармакодинамике ЛС. Изменение этих участков может приводить к нарушениям работы гена: отсутствию синтеза белка, синтеза белка со сниженной или повышенной активностью, снижением или повышением синтеза неизмененного белка. Подобные изменения в полиморфных участках генов принято называть «полиморфизмами» или «аллельными вариантами». К изменению фармакологического ответа может приводить носительство полиморфизмов в генах, кодирующих белки, которые принимают участие в фармакокинетике и фармакодинамике ЛС. К первой группе относятся гены, кодирующие ферменты биотрансформации и гены транспортеров, участвующих во всасывании, распределении и выведении лекарственных средств из организма (так называемые фармакокинетические полиморфизмы). В настоящее время активно изучается роль генов, контролирующих синтез и работу ферментов биотрансформации лекарственных средств, в частности изоферментов цитохрома Р-450 (CYP2D6, CYP2C9, CYP2C19) и ферментов II фазы биотрансформации (N-ацетилтрансферазы). В последние годы начато изучение влияния на фармакокинетику ЛС полимор-
физма генов, так называемых транспортеров ЛС. Ко второй группе отнесены гены, кодирующие молекулы-мишени ЛС или белки функционально связанные с молекулами-мишенями (рецепторы, ферменты, ионные каналы), и гены, продукты которых вовлечены в патогенетические процессы (факторы свертывания крови, аполипопротеины и т.д.), так называемые фармакодинамические полиморфизмы (рис. 6.1).
Врач, ознакомившись с инструкцией по медицинскому применению ЛС или его ТКФС, самостоятельно может прогнозировать:
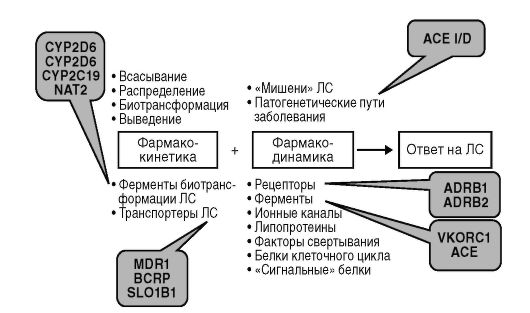 Рис. 6.1. Гены, полиморфизмы которых могут влиять на фармакологический ответ: CYP2D6 - ген, кодирующий изофермент цитохрома Р-450 2D6; CYP2C9 - ген, кодирующий изофермент цитохрома Р-450 2С9; CYP2C19 - ген, кодирующий изофермент цитохрома Р-450 2С19; MDR1 - ген, кодирующий транспортер ЛС гликопротеин-Р; BCRP - ген, кодирующий транспортер ЛС белок резистентности рака груди; SLO1B1 - ген, кодирующий транспортер органических анионов; ACE - ген, кодирующий ангиотензинпревращающий фермент; ADRB1 - ген, кодирующий β1-адренорецептор; ADRB2 - ген, кодирующий β2-адренорецептор; VKORC1 - ген, кодирующий витамин К эпоксидредуктазный комплекс, субъединицу 1 (молекуламишень оральных антикоагулянтов)
Рис. 6.1. Гены, полиморфизмы которых могут влиять на фармакологический ответ: CYP2D6 - ген, кодирующий изофермент цитохрома Р-450 2D6; CYP2C9 - ген, кодирующий изофермент цитохрома Р-450 2С9; CYP2C19 - ген, кодирующий изофермент цитохрома Р-450 2С19; MDR1 - ген, кодирующий транспортер ЛС гликопротеин-Р; BCRP - ген, кодирующий транспортер ЛС белок резистентности рака груди; SLO1B1 - ген, кодирующий транспортер органических анионов; ACE - ген, кодирующий ангиотензинпревращающий фермент; ADRB1 - ген, кодирующий β1-адренорецептор; ADRB2 - ген, кодирующий β2-адренорецептор; VKORC1 - ген, кодирующий витамин К эпоксидредуктазный комплекс, субъединицу 1 (молекуламишень оральных антикоагулянтов)
в каких генах полиморфизмы могут повлиять на фармакологический ответ, а следовательно, на эффективность и безопасность ЛС. Для этого врачу нужно обратить внимание:
• на указанные в разделе «Фармакокинетика» ферменты, участвующие в биотрансформации (особенно если известно, что они генетически полиморфные: CYP2C9, CYP2D6, CYP2C19, N-ацетилтрансфераза) или транспортеры, участвующие во всасывании, распределении и выведении ЛС (особенно если известно, что они генетические полиморфны: гликопротеин-Р (P-gp), который кодируется геном MDR1);
• на указанные в разделе «Фармакологическое действие» молекулы-мишени ЛС, которые тоже могут быть генетически полиморфными.
Например, сделаем предположение о генах, полиморфизмы которых могут влиять на эффективность и безопасность карведилола. Используя информацию из разделов «Фармакокинетика» и «Фармакологическое действие» ТКФС Государственного реестра ЛС, приложений 1 и 2 учебника В.Г. Кукеса «Клиническая фармакология», была составлена табл. 6.1, где представлены гены, полиморфизм которых может повлиять на эффективность и безопасность карведилола.
Таблица 6.1. Гены, полиморфизм которых может повлиять на эффективность
и безопасность карведилола
Лекарственное средство | Гены, полиморфизм которых влияет на фармакокинетику (фармакокинетические полиморфизмы) | Гены, полиморфизм которых влияет на фармакодинамику (фармакодинамические полиморфизмы) | |
Гены ферментов метаболизма (биотрансформации) | Гены транспортеров лекарственных средств | ||
Карведилол | CYP2D6, CYP2C9 | MDR1 (кодирует гликопротеин-Р) | Гены, кодирующие α1-адренорецептор (ADRA1), α2-адренорецептор (ADRA2), βj-адренорецептор (ADRB1) |
Выполните задание для самостоятельной работы
Задание 6.1. Предположите, полиморфизм каких генов будет влиять на эффективность и безопасность ЛС по вашей будущей специальности или предложенного преподавателем, для чего заполните таблицу по аналогии с табл. 6.1. Используйте информацию разделов «Фармакокинетика» и «Фармакологическое действие» ТКФС Государственного реестра лекарственных средств (www.regmed.ru).
Что такое фармакогенетический тест.
Каково его значение для выбора лекарственного
средства и режима дозирования?
Фармакогенетический тест - это процесс выявления конкретных полиморфизмов генов, влияющих на фармакологический ответ. Фармакогенетический тест проводится с помощью полимеразной цепной реакции, после предварительного выделения ДНК пациента. При этом в качестве источника ДНК (генетического материала) используется кровь больного или соскоб буккального эпителия. Сбор этого биологического материала у больного не требует предварительной подготовки. Результаты фармакогенетического теста представляют собой полученные генотипы больного по тому или иному полиморфизму гена. Как правило, врач - клинический фармаколог интерпретирует результаты фармакогенетического теста: формулирует рекомендации по выбору ЛС и его режима дозирования для конкретного пациента. Применение таких тестов позволяет заранее прогнозировать фармакологический ответ на ЛС, что позволяет индивидуально подойти к выбору ЛС и его режима дозирования, а в редких случаях и тактику ведения пациентов. В будущем, когда будут внедрены так называемые чип-технологии, появится возможность определять не отдельные полиморфизмы определенных генов, а сразу все (или почти все) изменения в геноме человека, которые могут влиять на фармакологический ответ, что и считается задачей фармакогеномики. При этом станет возможным составление так называемого генетического паспорта пациента. С этих позиций фармакогенетика, а в будущем и фармакогеномика в литературе рассматриваются как перспективные направления персонализированной медицины.
Какие фармакогенетические тесты могут использоваться в клинической практике
В настоящее время фармакогенетика считается активно развивающейся наукой: около 50% из всех применяемых в клинической практике ЛС уже имеют генетическую информацию: проведены исследования ассоциаций между полиморфизмами тех или иных генов и фармакологическим ответом на ЛС (развитие НПР, или неэффективность или, наоборот, высокая эффективность).
Полезная интернет-ссылка
Крупнейший ресурс по клинической фармакогенетике, на котором собраны результаты всех проведенных фармакогенетических исследований, при этом возможен их удобный поиск как по международному непатентованному названию ЛС, так и по названию гена: http://www.pharmgkb.org/
Тем не менее не каждая генетическая информация о ЛС может стать фармакогенетическим тестом, который может применяться в клинической практике. Для того чтобы это произошло, фармакогенетический тест должен отвечать следующим требованиям:
• наличие выраженной ассоциации между выявляемым полиморфизмом того или иного гена и фармакологическим ответом (развитие НПР, недостаточная эффективность или высокая эффективность);
• фармакогенетический тест должен с высокой чувствительностью и специфичностью прогнозировать фармакологический ответ (развитие НПР, недостаточная эффективность или высокая эффективность);
• должен быть хорошо разработан алгоритм применения ЛС в зависимости от результатов фармакогенетического теста: выбор ЛС, его режима дозирования;
• выявляемый полиморфизм должен встречаться в популяции с частотой не менее 1%;
• должны быть доказаны преимущества применения ЛС с использованием результатов фармакогенетического теста по сравнению с традиционным подходом: повышение эффективности, безопасности фармакотерапии и экономическая рентабельность подобного подхода;
• фармакогенетический тест должен быть доступен больным и врачам, т.е. фармакогенетический тест должен быть поставлен в лаборатории ЛПУ или коммерческих лабораториях.
В настоящее время этим требованиям удовлетворяет ограниченное количество фармакогенетических тестов, применение которых в клинической практике разрешено в большинстве стран мира и регламентировано в инструкциях и ТКФС (табл. 6.2). Однако некоторые коммерческие лаборатории предлагают и другие фармакогенетические тесты, но интерпретация их результатов пока носит спекулятивный характер.
Таблица 6.2. Фармакогенетические тесты, рекомендуемые для использования
в клинической практике
Рекомендуемые фармакогенетические тесты | Показания к исследованиям | Клиническое значение |
Определение полиморфизма генов CYP2C9 (аллельные варианты CYP2C9*2 и CYP2C9*3) и VKORC1 (полиморфный маркер G3673A) | Больные, которым показан прием оральных антикоагулянтов (варфарина, аценокумарола) | Результаты фармакогенетического тестирования позволяют осуществить персонализированный выбор начальной дозы варфарина или аценокумарола, что ускоряет подбор дозы для достижения целевых значений МНО, снижает риск кровотечений и чрезмерной гипокоагуляции |
Определение полиморфизмов гена CYP2D6 (аллельные варианты CYP2D6*4, CYP2D6*10, копии функциональных аллелей CYP2D6*1, CYP2D6*2) | Больные, которым показан длительный прием антидепрессантов или антипсихотических средств (нейролептиков) с высоким риском развития нежелательных реакций | Результаты фармакогенетического тестирования позволяют осуществить персонализированный выбор антидепрессантов и антипсихотических средств (нейролептиков) и их доз, что снижает риск развития нежелательных реакций |
Определение полиморфизмов гена CYP2D6 (аллельные варианты CYP2D6*4, CYP2D6*10). | Дети с синдромом дефицита концентрации внимания с гиперактивностью, которым планируется назначения атомоксетина | Результаты фармакогенетического тестирования позволяют прогнозировать развитие нежелательных реакций и более тщательно контролировать безопасность терапии атомоксетином |
Продолжение табл. 6.2
Рекомендуемые фармакогенетические тесты | Показания к исследованиям | Клиническое значение |
Определение полиморфизма гена CYP2C19 (аллель- ный вариант CYP2C19*2) | Больные с грибковыми заболеваниями, которым показано применение вориконазола | Результаты фармакогенетического тестирования позволяют прогнозировать развитие нежелательных реакций и более тщательно контролировать безопасность терапии вориконазолом |
Больные, которым планируется применение клопидогрела | Результаты фармакогенетического тестирования позволяют осуществить персонализированный выбор нагрузочной и поддерживающей дозы клопидогрела, что позволяет повысить эффективность лечения | |
Определение полиморфизмов гена NAT2 (медленные аллельные варианты NAT2) | Больные туберкулезом с высоким риском развития нежелательных реакций (гепатотоксичности, нейротоксичности) при применении противотуберкулезных средств (изониазид, пиразинамид, рифампицин) | Результаты фармакогенетического тестирования позволяют прогнозировать развитие нежелательных реакций и более тщательно контролировать безопасность терапии противотуберкулезными средствами (изониазид, пиразинамид, рифампицин) |
Определение полиморфного маркера HLA-B*1502 | Больные, принадлежащие к монголоидной расе, которым планируется применение карбамазепина | Результаты фармакогенетического тестирования позволяют выявить больных с очень высоким риском развития синдрома Стивенса- Джонсона при применении карбамазепина, что считается основанием для отказа от применения данного ЛС |
Продолжение табл. 6.2
Рекомендуемые фармакогенетические тесты | Показания к исследованиям | Клиническое значение |
Определение полиморфного маркера HLA-B*5701 | Больные с ВИЧинфекцией, которым планируется применение абакавира | Результаты фармакогенетического тестирования позволяют выявить больных с очень высоким риском развития гиперчувствительности замедленного типа при применении абакавира, что считается основанием для отказа от применения данного лекарственного средства |
Определение полиморфизма G1691A гена фактора свертывания V (так называемая «мутация Лейдена») | Женщины с отягощенным семейным анамнезом по тромботическим осложнениям, которым планируется применение гормональных контрацептивов | Результаты фармакогенетического тестирования позволяют выявить женщин с очень высоким риском развития тромботических осложнений при применении гормональных контрацептивов, что считается основанием для отказа от применения данной группы ЛС |
Определение полиморфизмов гена ТРМТ | Больные, которым планируется применение азатиоприна или меркаптопурина | Результаты фармакогенетического тестирования позволяют осуществить персонализированный выбор дозы азатиоприна или меркаптопурина, что снижает риск нежелательных реакций |
Определение полиморфизма гена UGT1A1 (аллельный вариант UGT1A*28) | Больные колоректальным раком, которым планируется применение иринотекана | Результаты фармакогенетического тестирования позволяют осуществить персонализированный выбор дозы иринотекана, что снижает риск нежелательных реакций |
Окончание табл. 6.2
Рекомендуемые фармакогенетические тесты | Показания к исследованиям | Клиническое значение |
Выявление в клетках опухоли экспрессии c-Kit* | Больные с неоперабельными и/или метастатическими злокачественными стромальными опухолями ЖКТ у взрослых, которым планируется применение иматиниба | Результаты фармакогенетического тестирования позволяют прогнозировать высокую эффективность иматиниба при наличии экспрессии c-Kit в клетках опухоли |
Выявление в к летках опухоли экспрессии EGFR* | Больные с местнораспространенным или метастатическим немелкоклеточным раком легкого, которым планируется применение эрлотиниба | Результаты фармакогенетического тестирования позволяют прогнозировать высокую эффективность эрлотиниба при наличии экспрессии EGFR в клетках опухоли |
Выявление в к летках опухоли экспрессии HER2* | Больные раком молочной железы, которым планируется применение трастузумаба | Результаты фармакогенетического тестирования позволяют прогнозировать высокую эффективность трастузумаба при наличии экспрессии HER2 в клетках опухоли |
* В качестве биологического материала для фармакогенетического тестирования используется опухолевая ткань.
В каких случаях показано фармакогенетическое тестирование?
Фармакогенетическое тестирование в клинической практике целесообразно проводить в следующих ситуациях:
• при длительном применении ЛС с большим спектром и выраженностью НПР (в том числе и ЛС с узким терапевтическим диапазоном), особенно у больных с высоким риском развития НПР;
• при наличии семейного анамнеза по развитию серьезных НПР;
• при применении ЛС, эффективных у ограниченного числа больных, особенно дорогостоящих ЛС.
Выполните задание для самостоятельной работы
Задание 6.2. Проанализируйте случай из клинической практики.
Больная П. с июня 2009 г. принимала линдинет 20* (монофазный гормональный контрацептив, содержащий этинилэстрадиол и гестоден) с целью контрацепции по рекомендации гинеколога. Заболела остро: появились боли в грудной клетке при дыхании, сухой кашель, а через 4 дня повысилась тела до 37,4 °С, отметила усиление болей при дыхании. Через неделю после начала заболевания появилась интенсивная одышка в покое, обратилась к терапевту по месту жительства, терапевтом диагностирован сухой плеврит слева, был назначен цефотаксим (по 1 г 2 раза в сутки, внутримышечно в течение 7 дней), на фоне чего боли, одышка исчезли, кашель уменьшился, однако сохранялась лихорадка (до 37,7 °С). Больная была направлена участковым терапевтом на компьютерную томографию легких, по результатам которой диагностирована двусторонняя полисегментарная пневмония (клиновидные субплевральные инфильтраты в S8, S9, S4, S5 левого легкого и S9 правого легкого) и утолщение листков плевры слева. В связи с чем больная направлена в стационар, госпитализирована для обследования и лечения в пульмонологическое отделение. В пульмонологическом отделении на основании рентгенологического исследования легких, данных перфузионно-вентиляционной сцинтиграфии легких и компьютерной томографии грудной клетки с контрастированием сосудов легких диагностирована тромбоэмболия мелких ветвей легочной артерии с формированием инфарктной пневмонии. При более детальном сборе семейного анамнеза стало известно, что у матери больной обнаружен тромбоз глубоких вен голеней. Врачи предположили, что тромбоэмболия мелких ветвей легочной артерии могла быть вызвана приемом гормонального контрацептива, поэтому при поступлении больной в стационар линдинет 20* был отменен, начаты антикоагулянтная терапия (гепарин натрия под контролем АЧТВ с последующим переходом на варфарин под контролем МНО), антибактериальная терапия. На фоне проведенного лечения состояние улучшилось, инфарктная пневмония разрешилась, больная выписалась в удовлетворительном состоянии.
1. Какие показания для проведения фармакогенетического тестирования были у пациентки?
2. Какой фармакогенетический тест мог прогнозировать высокий риск развития тромботических осложнений у пациентки (табл. 6.1) и какие рекомендации необходимо дать пациентке при выявлении носительства соответствующего полиморфизма?
Какие принципы интерпретации результатов фармакогенетического тестирования необходимо знать врачу?
Для каждого фармакогенетического теста, применяемого в клинической практике, разработаны свои алгоритмы выбора ЛС и их режимов дозирования (см. табл. 6.1). Существуют общие закономерности интерпретации результатов (выбор дозы ЛС) фармакогенетических тестов, в основе которых лежит определение полиморфизма генов, кодирующих ферменты биотрансформации. В большинстве случаев при применении изначально активного ЛС, метаболизирующегося определенным ферментом до неактивных метаболитов, выбор дозы в зависимости от результатов фармакогенетического тестирования осуществляется следующим образом:
• если носительство полиморфизма гена фермента биотрансформации не было обнаружено (такой генотип обозначается как ГЕН*1/*1 или «дикий» генотип, например CYP2D6*1/*1, а пациентов называют «распространенными метаболизаторами»), то необходимо выбрать среднюю терапевтическую дозу ЛС (по инструкции и ТКФС);
• если выявлено гетерозиготное носительство медленного полиморфизма (аллельного варианта) гена фермента биотрансформации (такой генотип обозначается ГЕН*1/*Х, например CYP2D6*1/*4, а пациентов называют «промежуточными метаболизаторами»), то необходимо выбрать минимальную терапевтическую дозу ЛС (по инструкции и ТКФС). Если таким пациентам применять ЛС в средней терапевтической дозе, то велика вероятность развития у них НПР;
• если выявлено гомозиготное носительство медленного полиморфизма (аллельного варианта) гена фермента биотрансформации (такой генотип обозначается ГЕН*Х/*Х, например CYP2D6*4/*4,
• а пациентов называют «медленными метаболизаторами»), то необходимо выбрать дозу ЛС вдвое меньше минимальной терапевтической. Кроме того, таким пациентам по возможности необходимо назначать «терапию прикрытия» (ЛС, снижающие риск развития НПР). Если таким пациентам применять ЛС в средней терапевтической дозе, то велика вероятность развития у них НПР, в том числе и серьезных; если выявлено носительство нескольких копий функциональных аллелей (более 2) гена фермента биотрансформации (такой генотип обозначается как ГЕН*1*2, например CYP2D6*1*2, а пациентов называют «быстрыми метаболизаторами»), то необходимо выбрать максимальную терапевтическую дозу ЛС (по инструкции и ТКФС). Если таким пациентам применять ЛС в средней терапевтической дозе, то будет отмечена низкая эффективность лечения.
Обратная ситуация с выбором дозы ЛС на основе результатов фармакогенетического тестирования в случае применения ЛС, являющегося пролекарством.
Выполните задание для самостоятельной работы
Задание 6.3. Разработайте принципы выбора дозы ЛС, являющегося пролекарством, в зависимости от результатов фармакогенетического тестирования, заполнив табл. 6.3.
Таблица 6.3. Принципы выбора дозы пролекарства в зависимости от резуль-
татов фармакогенетического тестирования
Генотип | Изменения в гене | Изменение фармакологического ответа при применении лекарственного средства в средней дозе | Оптимальная доза лекарственного средства |
Распространенный метаболизатор (EM) | ГЕН*1/*1 | ||
Пр омежуточный метаболизатор (UM) | ГЕН*1/*Х | ||
Медленный метаболизатор (EM) | ГЕН*Х/*Х | ||
Быстрый метаболизатор (UM) | ГЕН*1*2 |
Выполните задание для самостоятельной работы
Задание 6.4. Проанализируйте случай из клинической практики. При ответе на вопросы используйте ТКФС «Диклофенак» (разделы «Фармакокинетика», «Режим дозирования») Государственного реестра лекарственных средств (www.regmed.ru).
Больной С. 72 лет поступил в плановом порядке в терапевтическое отделение с диагнозом: ИБС. Стенокардия напряжения II ФК. Артериальная гипертензия 2-й степени, очень высокого риска. НК I (II ФК по NYHA). Остеохондроз грудного отдела позвоночника, вторичный корешковый синдром. Больной предъявлял жалобы на постоянные боли в левой половине грудной клетки, усиливающиеся при изменении положения тела и при глубоком дыхании. Аллергологический анамнез не отягощен. В анамнезе язвенная болезнь желудка, последнее обострение около 4 лет назад, желудочно-кишечных кровотечений не было. АД 160/80 мм рт.ст., ЧСС 78 в мин., тоны ритмичные. ЭКГ: ритм синусовый, признаки гипертрофии левого желудочка. В общем анализе мочи, клиническом и биохимическом анализе крови все показатели в пределах нормы. Коагулограмма: АЧТВ 23 мс, МНО 1,3. Больному назначен метопролол 12,5 мг 2 раза в сутки, периндоприл 4 мг 1 раз в сутки, гидрохлоротиазид 25 мг 1 раз в сутки. В качестве обезболивающего и противовоспалительного средства был назначен диклофенак 50 мг 3 раза в сутки внутрь. Через 3 дня боли значительно уменьшились. Через 8 дней больной отметил появление слабости, головокружение, тошноту. На 9-й день терапии диклофенаком отметил появление черного стула. Гемодинамика оставалось стабильной. В клиническом и биохимическом анализе крови все показатели в пределах нормы. Общий анализ мочи - показатели в пределах нормы. Коагулограмма: АЧТВ 30 мс, МНО 1,4. В связи с подозрением на желудочно-кишечное кровотечение больному проведена ЭГДС. Обнаружено кровотечение из язвы малой кривизны желудка (рис. 6.2, см. цв. вклейку). При фармакогенетическом исследовании выявлен генотип CYP2C9*3/*3.
1. Полиморфизмы в каких генах могут влиять на эффективность и безопасность лечения диклофенаком?
2. Какие показания для проведения фармакогенетического тестирования были у пациента?
3. Какая начальная доза диклофенака должна была быть для пациента с учетом результатов фармакогенетического тестирования?
4. Какие еще меры необходимо предпринять врачу для того, чтобы избежать данной НПР?
Для некоторых фармакогенетических тестов (в том числе и в которых определяются полиморфизмы генов ферментов биотрансформации) созданы более сложные и одновременно более точные (обладают большей предсказательной ценностью) алгоритмы выбора дозы ЛС. Как правило, эти алгоритмы учитывают не только генетические, но и негенетические факторы (пол, возраст, расовую принадлежность, отношение к курению, состояние функции почек и печени, совместно применяемые ЛС и т.д.). Например, такой алгоритм создан для выбора дозы орального антикоагулянта варфарина (так называемый алгоритм Gage). Этот алгоритм представляет собой сложную математическую формулу, в которую вводятся индивидуальные характеристики пациента, включая выявленные генотипы. При этом вычисляется индивидуальная начальная доза варфарина. В связи с тем, что вычисления по этой формуле сложны, авторы алгоритма разработали on-line калькулятор для вычисления начальной дозы варфарина.
Полезная интернет-ссылка
On-line калькулятор для вычисления начальной дозы варфарина на основе индивидуальных характеристик пациента, включая результаты фармакогенетического тестирования:
http://www.warfarindosing.org
Программа для вычисления начальной дозы варфарина на русском языке в составе комплексного программного продукта для клинических фармакологов (Г.Г. Кетова, В.М. Цветов):
http://pharmsuite.ru
Программа для вычиления начальной дозы варфарина на английском языке, разработанная Международным консорциумом по фармакогенетике варфарина (IWPC), в программе Excel:
http://content.nejm.Org/cgi/content/full/360/8/753/DC1
Выполните задание для самостоятельной работы
Задание 6.5. Проанализируйте случай из клинической практики. При ответе на вопросы используйте ТКФС «Варфарин» (разделы «Фармакокинетика», «Режим дозирования», «Побочное действие») Государственного реестра лекарственных средств (www. regmed.ru).
Пациентка 52 лет наблюдается в поликлинике по поводу хронической сердечной недостаточности III ФК класса (по NYHA), развившейся вследствие дилатационной кардиомиопатии. Больная не курит. На ЭКГ: постоянная форма фибрилляции предсердий, нормосистолическая форма. В анамнезе - тромбоэмболия левой лучевой артерии. По назначению кардиолога по месту жительства больная получает эналаприл 20 мг в сутки, фуросемид 40 мг в сутки, спиронолактон 25 мг в сутки. Для профилактики тромбоэмболических осложнений назначен варфарин в начальной дозе 5 мг в сутки (согласно инструкции и ТКФС) под контролем МНО (целевое значение МНО 2,5, т.е. между 2 и 3). МНО до начала лечения составило 1,2. На 5-й день лечения больная обратилась в поликлинику в связи с появлением на коже макулезной и петехиальной сыпи ярко-красного цвета, местами с синюшным оттенком, со склонностью к слиянию, которая была интерпретирована как геморрагический васкулит, индуцированный варфарином (рис. 6.3), в связи с чем больная была госпитализирована в стационар. В стационаре зарегистрировано МНО 9,1, варфарин был отменен, проводились переливания свежезамороженной плазмы, назначался викасол*. На фоне лечения явления геморрагического васкулита были купированы, МНО снизилось до 1,1, решается вопрос о повторном назначении варфарина. При обследовании обнаружено увеличение активности АСТ (78) и АЛТ (95), картина жирового гепатоза по данным УЗИ, вес больной составляет 67 кг, рост 172 см. При фармакогенетическом тестировании оказалось, что больная является носителем генотипа CYP2C9*1/*3, генотипа АА по полиморфному маркеру G3673A гена VKORC1, носительство других полиморфизмов не определялось.
1. Какие показания для проведения фармакогенетического тестирования были у больной?
2. Рассчитайте начальную дозу варфарина, которая должна быть назначена пациентке с учетом результатов фармакогенетического тестирования и других индивидуальных характеристик пациентки, используя on-line калькулятор (www.warfarindosing.org).
Подобный комплексный подход к выбору ЛС и их доз, основанный на учете генетических и негенетических особенностей пациентов, в настоящее время представляется наиболее перспективным.
Полезная интернет-ссылка
Некоторые коммерческие лаборатории и медицинские центры, предлагающие выполнение фармакогенетического тестирования: Ситилаб (Москва): http://citilab.ru/rus/ Примамедика (Москва): http://www.primamedica.ru/ Литех (Москва): http://www.lytech.ru/
Инвитро (Москва, сеть офисов по России): http://www.invitro.ru/ Хеликс (Санкт-Петербург): http://www.helix.ru/ Иммунобиосервис (Санкт-Петербург): http://www.immunobios.ru/ Новомедицина (Ростов-н/Д): http://www.novomedicina.ru/ Центр новых медицинских технологий (Новосибирск): http:// www.cnmt.ru/index.php