Аналитическая химия. Практикум : учеб. пособие / Харитонов Ю.Я., Григорьева В.Ю. - 2009. - 296 с.
|
|
|
|
Тема I АНАЛИЗ КАТИОНОВ ПЕРВОЙ, ВТОРОЙ И ТРЕТЬЕЙ АНАЛИТИЧЕСКИХ ГРУПП ПО КИСЛОТНО-ОСНОВНОЙ КЛАССИФИКАЦИИ
На изучение темы отводятся три занятия, включающие краткое рассмотрение основных теоретических положений, решение задач по теме и экспериментальную часть.
Цель изучения темы
На основе знаний основных понятий качественного химического анализа и химико-аналитических свойств катионов первой, второй и третьей аналитических групп по кислотно-основной классификации, положений теории растворов электролитов, закона действующих масс и химического равновесия научиться проводить характерные аналитические реакции катионов указанных трех групп, определять их подлинность (т.е. экспериментально доказывать их присутствие в анализируемом объекте), анализировать их смеси.
Целевые задачи
1. Освоение правил работы в химико-аналитической лаборатории и техники выполнения аналитических реакций преимущественно полумикрометодом.
2. Проведение аналитических реакций катионов первой, второй и третьей аналитических групп по кислотно-основной классификации.
3. Проведение расчетов характеристик чувствительности аналитических реакций, ионной силы раствора, активности ионов, произведения растворимости, растворимости малорастворимых электролитов в присутствии одноименных ионов и посторонних сильных электролитов.
4. Оформление протокола проведения лабораторной работы.
Введение
В состав многих лекарственных препаратов входят различные металлы, которые могут присутствовать в виде солей, оксидов, гидроксидов, комплексных, металлоорганических и других соединений. При контроле качества лекарственных препаратов требуется определение подлинности содержащихся в них компонентов, в том числе и катионов металлов, т.е. их идентификация. Для этого чаще всего анализируемую пробу переводят тем или иным способом в раствор и открывают катионы в этом растворе. Обычно лекарственный препарат содержит ограниченное число катионов металлов, причем заранее известно, какие катионы могут присутствовать в нем. Поэтому нет необходимости проводить систематический анализ катионов. Для их открытия используют аналитические реакции на эти катионы. Если соответствующие аналитические реакции включены в качестве обязательных или рекомендуемых в Фармакопеи или в отдельные фармакопейные статьи, то такие реакции называют фармакопейными.
Почти для каждого катиона известно значительное число разнообразных аналитических реакций, однако обычно лишь немногие из них используют при анализе лекарственных средств. В аналитической химии сформировались различные аналитические классификации катионов по группам (различные химические методы качественного анализа катионов): сероводородная (сульфидная), аммиачно-фосфатная, кислотно-основная, карбонатная, бифталатная, сульфидно-основная, тиоацетамидная. К наиболее распространенным относятся три следующие классификации катионов по группам: сероводородная (сульфидная), аммиачно-фосфатная (или фосфатно-аммиачная) и кислотно-основная.
Не существует такой аналитической классификации катионов, которая охватила бы все известные катионы или, по крайней мере, катионы всех металлов.
В данном руководстве применяется кислотно-основная аналитическая классификация катионов по группам.
Кислотно-основная классификация катионов по группам
Данная аналитическая классификация катионов по группам основана на использовании в качестве групповых реагентов водных растворов кислот и оснований - хлороводородной кислоты HCl, серной кислоты H2SO4, гидроксидов натрия NaOH или калия KOH (в присутствии пероксида водорода H2O2) и аммиака NH3.
Катионы, открываемые в рамках кислотно-основной классификации, подразделяют на шесть аналитических групп.
К первой аналитической группе относят катионы лития Li+, натрия ?+,калия K+, аммония NH+. Иногда катион лития не включают в эту группу. Групповой реагент отсутствует.
Ко второй аналитической группе относят катионы серебра Л§+,рту-ти(1) Hg2+ и свинца Pb2+. Групповым реагентом на катионы второй аналитической группы является водный раствор хлороводородной кислоты (обычно с концентрацией ~2 моль/л); реже - растворы растворимых в воде хлоридов.
К третьей аналитической группе относят катионы кальция Ca2+, стронция Sr2+ ибария Ba2+. Иногда к этой группе относят и катионы свинца Pb2+. Групповым реагентом на катионы третьей аналитической группы является водный раствор серной кислоты (обычно с концентрацией ~1 моль/л H2SO4); реже - растворы водорастворимых сульфатов.
Четвертая аналитическая группа включает катионы алюминия Al3+, хрома Cr3+, цинка Zn2+, мышьяка As(III) и As(V), олова Sn2+ иSn4+. Иногда сюда же относят и катионы сурьмы(Ш) Sb3+. Групповым реагентом является водный раствор гидроксида натрия NaOH (или калия KOH) в присутствии пероксида водорода H2O2 (обычно - избыток ~2 моль/л раствора NaOH в присутствии H2O2); иногда - без перокси-да водорода.
К пятой аналитической группе относятся катионы магния Mg2+, марганца Mn2+, железа Fe2+ иРе3+,сурьмь^Ь3+ иSb5+, висмута(Ш) Bi3+. Групповым реагентом является водный раствор щелочи (обычно ~2 моль/л раствор NaOH) или 25 % водный раствор аммиака.
К шестой аналитической группе относятся катионы меди(11) Cu2+, кадмия Cd2+, ртути(11) Hg2+, кобальта(П) Co2+, никеля(11) Ni2+. Групповым реагентом является 25 % водный раствор аммиака.
Занятие 1. Аналитические реакции и анализ смеси катионов первой аналитической группы по кислотно-основной классификации
Цель занятия:
- научиться проводить полумикрометодом аналитические реакции катионов первой аналитической группы;
- научится проводить анализ смеси катионов первой аналитической группы в растворе.
Задание для самоподготовки
К занятию надо знать
1. Основные понятия качественного химического анализа.
2. Классификацию катионов по кислотно-основному методу анализа.
3. Общую характеристику катионов первой аналитической группы (состав, общие свойства катионов и их соединений).
4. Отношение солей аммония к нагреванию.
5. Основные правила работы, техники безопасности и оказания первой помощи при работе в химической лаборатории.
6. Оборудование химической лаборатории для работы полумикро-методом.
Уметь
1. Составлять уравнения реакций диссоциации двойных и комплексных солей в водных растворах.
2. Называть комплексные соли по номенклатуре, рекомендованной ИЮПАК.
3. Составлять уравнения реакций в ионной форме.
4. Составлять уравнения реакций термического разложения солей аммония.
5. Обращаться с газовой горелкой и другими нагревательными приборами.
6. Пользоваться микроскопом.
Литература
Харитонов Ю.Я. Аналитическая химия (аналитика). Кн. 1, гл. 13,
с. 320-326; гл. 14, с. 344-353.
Лурье Ю.Ю. Справочник по аналитической химии. - М.: Химия,
1989.
Вопросы для самопроверки
1. Дайте определение понятиям: аналитическая реакция, дробный, систематический анализ, макро-, полумикроанализ.
2. Сформулируйте принцип аналитической классификации ионов.
3. Назовите групповые реагенты, применяемые в кислотно-основном методе качественного анализа. Какие катионы входят в состав первой аналитической группы?
4. Какие реагенты и реакции называются специфическими, селективными, групповыми?
5. Чем характеризуется чувствительность аналитической реакции? Что такое предел обнаружения, предельное разбавление, предельная концентрация?
6. Напишите уравнение реакции диссоциации: Zn(UO2)3(CH3COO)8,K[Sb(OH)6], K2[HgI4]иNa3[Co(NO2)6]вводном растворе.
7. Дайте названия следующим комплексным солям: K[Sb(OH)6],
Hg
/\
Na2Pb[Cu(NO2)6], K2[HgI4], [O NH2]+I и определите степень
Hg
окисления атома металла-комплексообразователя в них.
8. Напишите уравнение реакции между хлоридом аммония и гидро-ксидом натрия в ионной форме.
9. Напишите уравнение термического разложения сухих солей: нитрата аммония и хлорида аммония.
10. Какие соли катионов I аналитической группы применяются в качестве лекарственных веществ?
11. Какую посуду используют при работе полумикрометодом?
Лабораторная работа
Реактивы
1. Растворы солей: лития, аммония, натрия, калия нитратов или хлоридов, гидрофосфата аммония, карбоната натрия.
2. Специальные реактивы:
- насыщенный раствор гексагидроксостибата калия в насыщенном растворе хлорида калия;
- свежеприготовленный раствор гексанитрокобальтата(Ш) натрия;
- раствор гексанитрокупрата(П) натрия и свинца;
- реактив Несслера: K2[HgI4]+KOH. 3.Этанол.
4. Формалин - 40 % раствор формальдегида в воде.
5. 0,1 % спиртовой раствор фенолфталеина.
6. Сухие соли лития, аммония, натрия, калия.
7. Индикаторная бумага - красная лакмусовая.
Учебные таблицы
1. Классификация катионов по кислотно-основному методу.
2. Частные реакции катионов первой аналитической группы.
3. Периодическая система элементов Д.И. Менделеева.
1. Аналитические реакции катионовпервой аналитической группы по кислотно-основной классификации: Li+,Na+,K+, NH 4
Групповой реагент отсутствует.
При проведении реакций обращают внимание:
1) на наблюдаемый эффект: выпадение осадка, его цвет, характер, выделение газа, окрашивание раствора;
2) на условия проведения реакции: кислотность среды, нагревание, добавление органического реагента и т.д.;
3) на свойства выделяющихся осадков: растворимость их в растворах кислот, щелочей и т.д.;
4) на мешающие катионы в условиях обнаружения;
5) на чувствительность реакций.
Аналитические реакции катиона лития Li+
Реакция с двузамещенным гидрофосфатом натрия Na2HPO4 Гидрофосфат натрия Na2HPO4 в нейтральной или слабощелочной среде образует с катионами лития белый осадок фосфата (ортофосфата) лития
Li3PO4:
3Li+ + HPO2- <=* Li3PO4 + H+
Для увеличения полноты осаждения при проведении реакции добавляют этанол, поскольку в водно-этанольной среде растворимость фосфата лития уменьшается. Фосфат лития растворим в растворах кислот и солей аммония. Реакцию проводят обычно в аммиачной среде для связывания выделяющихся ионов водорода. Предел обнаружения катионов лития данной реакцией составляет 5 мкг. Мешают все катионы, образующие нерастворимые (малорастворимые) в воде фосфаты.
Методика. В пробирку вносят ~10 капель раствора соли лития, прибавляют столько же капель концентрированного раствора аммиака, несколько капель этанола и ~15 капель раствора гидрофосфата натрия. Через ~5 минут выпадает белый мелкокристаллический осадок, растворимый в уксусной кислоте. Большое количество этанола не следует прибавлять во избежание выделения осадка Na2HPO4.
Реакция с растворимыми карбонатами. Карбонат-ионы CO2,- осаждают из водных нейтральных, щелочных (но не кислых!) растворов солей лития белый осадок карбоната лития Li2CO3:
2Li+ + CO2" *± Li2CO3
Карбонат лития заметно растворим в воде, вследствие чего катионы лития осаждаются из раствора неполностью. Поэтому для проведения реакции используют концентрированные растворы солей лития и растворимых карбонатов. Реакцию предпочтительно проводить при нагревании, так как растворимость карбоната лития в воде уменьшается с ростом температуры. Карбонат лития растворяется в кислотах. Предел обнаружения ~500 мкг. Мешают все катионы, образующие малорастворимые в воде карбонаты.
Методика. В пробирку вносят несколько капель концентрированного раствора соли лития, прибавляют примерно столько же концентрированного раствора соды Na2CO3 (или поташа K2CO3) и нагревают смесь. Выпадает белый мелкокристаллический осадок карбоната лития Li2CO3.
Реакция с растворимыми фторидами. Фторид-ионы досаждают из водных растворов солей лития белый осадок малорастворимого в воде фторида лития LiF:
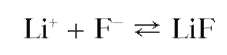
Растворимость фторида лития в воде уменьшается в присутствии аммиака. Предел обнаружения - 50 мкг. Мешают катионы Mg2+,Ca2+, Sr2+,Ba2+,Cu2+,Pb2+, также дающие осадки фторидов.
Методика. В пробирку вносят 3-4 капли раствора соли лития, 1- 2 капли концентрированного аммиака и 4-5 капель раствора фторида аммония NH4F. Смесь нагревают. Медленно выпадает аморфный осадок фторида лития. Осадок растворяется в уксусной кислоте.
Окрашивание пламени газовой горелки. Соли лития окрашивают пламя газовой горелки в карминово-красный цвет.
Методика. На платиновой или нихромовой проволочке (или на кончике графитового стержня) вносят в пламя газовой горелки несколько кристалликов хлорида лития LiCl. Пламя окрашивается в карми-ново-красный цвет. Если пламя окрашивается в желтый цвет из-за присутствия следов катионов натрия, то его рассматривают через синее стекло или индиговую призму - склянку специальной призматической формы, заполненную раствором красителя - индиго (синее стекло и раствор индиго поглощают желтые лучи).
Некоторые другие реакции катионов лития. Катионы лития образуют со стеаратом аммония CH3(CH2)16COONH4 малорастворимый осадок стеарата лития CH3(CH2)16COOLi, c цинкуранилацета-том Zn(UO2)3(CH3COO)8 - желто-зеленый осадок LiZn(UO2)3 (CH3COO)99H2O, с гексагидроксостибатом калия K[Sb(OH)6] -
белый осадок Li[Sb(OH)6], с гексанитрокобальтатом(Ш) натрия Na3[Co(NO2)6] - желтый осадок Li3[Co(NO2)6].
Аналитические реакции катиона натрия Na+
Известно ограниченное число аналитических реакций катиона натрия.
Микрокристаллоскопическая реакция с цинкуранилацетатом (фармакопейная). Катионы натрия дают с цинкуранилацетатом Zn(UO2)3 (CH3COO)8 в уксуснокислом растворе желтый кристаллический осадок натрийцинкуранилацетата NaZn(UO2)3(CH3COO)99H2O, нерастворимый в уксусной кислоте:
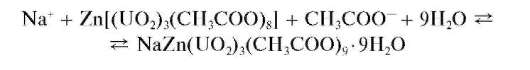
Натрийцинкуранилацетат образует кристаллы октаэдрической и тетраэдрической формы, хорошо различимые при рассмотрении под микроскопом в капле раствора. Предел обнаружения - около 0,8 мкг; реакция высокочувствительна. Мешают катионы Li+,K+, NHJ ,Mg2+, Ca2+,Sr2+,Ba2+,Cu2+,Zn2+,Cd2+,Hg2+,Al3+,Mn2+,Co2+,Ni2+ при их содержании более 5 мг в1 мл раствора.
Методика. На предметное стекло наносят каплю раствора NaCl, слегка упаривают до начала образования белой каемки по краям капли и прибавляют каплю раствора цинкуранилацетата. Через 2-3 мин наблюдают под микроскопом образование желтых октаэдрических и тет-раэдрических кристаллов.
Микрокристаллоскопическая реакция с гексагидроксостибатом(У) калия. Катионы натрия образуют с гексагидроксостибатом(У) калия K[Sb(OH)6] в нейтральном (рН « 7) растворе белый мелкокристаллический осадок гексагидроксостибата(У) натрия Na[Sb(OH)6]:
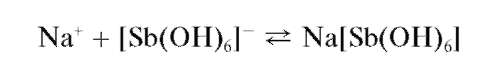
Из разбавленных растворов осадок выпадает медленно или вообще не выпадает. В сильно щелочной среде осадок не образуется, а из сильно кислых растворов выделяется белый аморфный осадок метасурьмя-ной кислоты HSbO3, который можно ошибочно принять за осадок гек-сагидроксостибата натрия. Поэтому образование белого осадка само по себе еще недостаточно для вывода о присутствии катионов натрия; необходимо при рассмотрении под микроскопом убедиться в том, что этот осадок - кристаллический. Реакцию проводят на холоду.
В присутствии нитрат-ионов выделение осадка замедляется.
Реакция малочувствительна и удается лишь при больших концентрациях катионов натрия. Мешают катионы лития, аммония, магния.
Методика. На предметное стекло наносят каплю концентрированного раствора NaCl и одну каплю раствора гексагидроксостибата(У) калия. Через 3-5 минут наблюдают под микроскопом образование кристаллов.
Окрашивание пламени газовой горелки соединениями натрия (фармакопейный тест). Соли и другие соединения натрия окрашивают пламя газовой горелки в желтый цвет. Реакция высокочувствительна. Открываемый минимум составляет 110-4 мкг.
Методика. На кончике графитового стержня (или на нихромовой либо платиновой проволочке) вносят в пламя газовой горелки несколько кристалликов соли натрия (например, NaCl). Пламя окрашивается в ярко-желтый цвет. Окраска не исчезает в течение нескольких секунд.
Аналитические реакции катиона калия K+
Наиболее часто катионы калия открывают реакциями с гексанитро-кобальтатом(Ш) натрия Na3[Co(NO2)6], с гексанитрокупратом(П) натрия и свинца Na2Pb[Cu(NO2)6], с гидротартратом натрия NaHC4H4O6 и по фиолетовому окрашиванию пламени газовой горелки.
Катионы аммония NH4, как правило, мешают открытию катионов калия, поэтому перед открытием катионов калия их необходимо предварительно удалить, если они присутствуют в анализируемом растворе.
Реакция с гексанитрокобальтатом(Ш) натрия (фармакопейная). Катионы калия в достаточно концентрированных растворах в уксуснокислой (рН «3) или нейтральной среде образуют с растворимым в воде Na3[Co(NO2)6] желтый кристаллический осадок гексанитрокобаль-тата(Ш) натрия и калия NaK2[Co(NO2)6]:
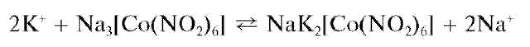
Из разбавленных растворов осадок выпадает медленно, при стоянии раствора. В сильно кислой среде образуется нестойкая, быстро разлагающаяся кислота H3[Co(NO2)6]. В щелочной среде выпадает бурый осадок гидроксида кобальта(Ш) Co(OH)3.
Для проведения реакции используют свежеприготовленный водный раствор Na3[Co(NO2)6], так как со временем этот реагент разлагается. Потирание стеклянной палочкой стенок пробирки ускоряет формирование осадка (NaK2[Co(NO2)6] склонен к образованию пересыщенных
растворов). В присутствии катионов серебра Ag+ выпадает еще менее растворимый осадок состава K2Ag[Co(NO2)6], поэтому наличие катионов серебра в растворе повышает чувствительность реакции.
Предел обнаружения - 4 мкг; предельное разбавление - 13-103 мл/г. Мешают катионы Li+, NH4, также образующие желтые осадки.
Методика. В пробирку вносят 2 капли концентрированного раствора соли калия и 2 капли свежеприготовленного концентрированного раствора Na3[Co(NO2)6]. Выпадает желтый осадок NaK2[Co(NO2)6]. Если осадок не образуется, то потирают стенки пробирки стеклянной палочкой.
Микрокристаллоскопическая реакция с гексанитрокупратом(П) натрия и свинца. Катионы калия в нейтральной среде образуют с гекса-нитрокупратом(П) натрия и свинца Na2Pb[Cu(NO2)6] черные кристаллы гексанитрокупрата(П) калия и свинца K2Pb[Cu(NO2)6]кубической формы, хорошо видимые под микроскопом:
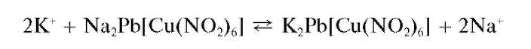
Реакция высокочувствительна: открываемый минимум - 0,15 мкг, предельное разбавление - 6,6-103 мл/г. Мешают катионы NHJ ,Rb+, Cs+, также дающие черный осадок с реактивом.
Методика. На предметное стекло наносят каплю раствора соли калия, осторожно упаривают над пламенем газовой горелки до образования белой каемки по краям капли, охлаждают до комнатной температуры и прибавляют каплю раствора Na2Pb[Cu(NO2)6]. Через 1-2 мин наблюдают под микроскопом образование в жидкости черных кубических кристаллов.
Реакция с гидротартратом натрия (фармакопейная). Катионы калия при реакции с гидротартратом натрия NaHC4H4O6 (или с винной кислотой H2C4H4O6 в присутствии ацетата натрия CH3COONa) в нейтральной среде образуют малорастворимый в воде гидротартрат калия KHC4H4O6, выпадающий в виде белого кристаллического осадка:
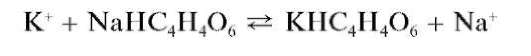
Образование осадка ускоряется при потирании стенок пробирки стеклянной палочкой.
Осадок растворяется в кислотах с образованием винной кислоты и в щелочах - с образованием средних тартратов, например, среднего тартрата калия K2C4H4O6.
Предел обнаружения - около 50 мкг, предельное разбавление ~103 мл/г. Мешают катионы NH44, образующие осадок состава NH4HC4H4O6, а также катионы Rb,Cs+.
Реакцию можно проводить микрокристаллоскопически. Методика. В пробирку вносят 2-3 капли раствора соли калия, 2 капли раствора гидротартрата натрия и потирают стенки пробирки стеклянной палочкой. Через некоторое время образуется белый кристаллический осадок.
Окрашивание пламени газовой горелки (фармакопейный тест). Соли и другие соединения калия при внесении их в пламя газовой горелки окрашивают его в фиолетовый цвет.
Методика. На кончике графитового стержня (или нихромовой либо платиновой проволочки) вносят в пламя газовой горелки кристаллики хлорида калия (или другой соли калия). Наблюдается окрашивание пламени в фиолетовый цвет.
Другие аналитические реакции катионов калия. С гексахлороплатинатом(IV) натрия Na2[PtCl6] и соответствующей кислотой H2[PtCl6] катионы калия образуют желтый кристаллический осадок гексахлороплатината(IV) калия K2[PtCl6]:
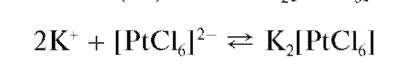
Предел обнаружения - около 25 мкг. Мешают катионы NH44, также дающие желтый осадок гексахлороплатината аммония (NH4)2[PtCl6].
С хлорной кислотой HClO4 катионы K+ выделяют белый кристаллический осадок перхлората калия KClO4:
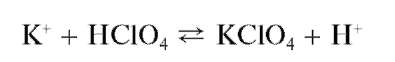
С кремнефтороводородной кислотой H2SiF6 в нейтральной среде катионы K+ образуют студенистый осадок гексафторосиликата калия
K2SiF6:
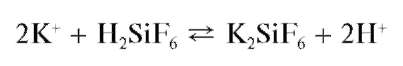
Катионы аммония не мешают этой реакции. Аналитические реакции катиона аммония NII4
Реакция разложения солей аммония щелочами (фармакопейная) .Соли аммония в растворах щелочей разлагаются с выделением газообразного аммиака: 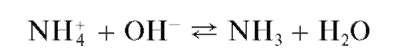
Выделяющийся газообразный аммиак обнаруживают с помощью влажной красной лакмусовой бумаги (синеет в парах аммиака), влажной фенолфталеиновой бумаги (в парах аммиака окрашивается в малиновый цвет) или стеклянной палочки, кончик которой смочен концентрированной хлороводородной кислотой - в парах аммиака наблюдается образование белого дыма хлорида аммония:
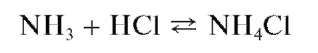
Реакция специфична и высокочувствительна: предел обнаружения равен 0,01 мкг, предельная концентрация - ~2-10 7 г/мл,предельное разбавление - ~5-106 мл/г.
Методика. В пробирку вносят 8-10 капель раствора соли аммония, прибавляют такой же объем раствора NaOH и осторожно нагревают раствор, не допуская его кипения и разбрызгивания. Над раствором помещают влажную красную лакмусовую бумагу, не касаясь ею стенок пробирки во избежание попадания на бумагу капелек щелочного раствора. Выделяющиеся пары аммиака окрашивают красную лакмусовую бумагу в синий цвет.
Реакция с реактивом Несслера - смесью раствора тетрайодомерку-рата(П) калия K2[HgI4] c KOH (фармакопейная). Катионы аммония образуют с реактивом Несслера аморфный красно-бурый осадок. Чаще всего состав этого осадка описывают формулами
Реакция высокочувствительна: предел обнаружения - 0,05-0,25 мкг, предельный объем ~0,05 мл. Позволяет открывать следы катионов аммония - наблюдается окрашивание раствора в желтый или бурый цвет. Мешают все катионы, дающие со щелочами окрашенные осадки (Cr3+,Fe3+,Co2+,Ni2+ и др.) или разлагающие реактив Несслера (Hg2+,
Sn2+,Sb3+).
Методика. К 1-2 каплям раствора соли аммония прибавляют ~2 капли реактива Несслера. Выпадает аморфный красно-бурый осадок.
Другие аналитические реакции катионов аммония. Катионы аммония в растворе образуют с Na3[Co(NO2)6^H2[PtCl6] желтые осадки соответственно (NH4)2Na[Co(NO2)6] и (NH4)2[PtCl6]; с гидротартратом натрия NaHC4H4O6 - белый осадок гидротартрата аммония NH4HC4H4O6;cNa2Pb[Cu(NO2)6] - черный осадок, что может помешать открытию катионов калия. Катионы аммония мешают также открытию катионов натрия.
Перед открытием катионов натрия и калия удаляют катионы аммония, если они присутствуют в анализируемом растворе.
В табл. 1 охарактеризованы продукты некоторых аналитических реакций катионов первой группы.
2. Контрольная задача. Анализ смеси катионов первой аналитической группы
Контрольную задачу получают в пробирке. Содержимое тщательно перемешивают и делят на две равные части. С одной частью проводят анализ. Другую часть оставляют для контроля.
Пусть для анализа взят раствор, содержащий смесь растворимых солей катионов первой аналитической группы. Требуется разделить катионы и открыть их.
Анализ в отсутствие катионов лития Li+. Если катионы лития отсутствуют в анализируемом растворе, то анализ проводят следующим образом.
Анализ смеси катионов первой аналитической группы: Na+,K+, NH+ Пусть имеется подлежащий анализу водный раствор, в котором возможно присутствие всех катионов первой аналитической группы, кроме катионов лития. Требуется открыть каждый из катионов.
Открытию катионов натрия и калия мешают катионы аммония, поэтому вначале открывают катионы аммония, а затем, после их удаления, открывают катионы натрия и калия.
Открытие и удаление катионов аммония NH+. Отбирают в две пробирки примерно по 5 капель анализируемого раствора. В одну из них (проба 1) прибавляют ~5 капель водного 1 моль/л раствора гидроксида натрия NaOH (или 1 моль/л раствора соды Na2CO3), в другую (проба 2) - ~5 капель водного 1 моль/л раствора гидроксида калия KOH (или 1 моль/л раствора поташа K2CO3). Нагревают обе пробирки на водяной бане. При наличии в растворе ионов аммония выделяется газообразный аммиак, который обнаруживают с помощью влажной лакмусовой бумаги: в парах аммиака розовая бумага синеет.
Присутствие катионов аммония подтверждают также в отдельной пробе (~1-2 капли) исходного анализируемого раствора с помощью реактива Несслера - образуется красно-бурый осадок состава [Hg2N]IH20.
В случае присутствия ионов аммония их удаляют для того, чтобы они не мешали последующему открытию катионов натрия и калия. Для этого обе пробирки с пробами 1 и 2 нагревают до полного удаления аммиака (до тех пор, пока при внесении в пары влажной розовой лакмусовой бумаги она не перестает синеть). Затем в пробе 1 открывают катионы калия, а в пробе 2 - катионы натрия.
Открытие катионов натрия Na+. После удаления ионов аммония из пробы 2 к ней прибавляют несколько капель разбавленной уксусной кислоты до нейтрализации раствора. Каплю полученного раствора помещают на предметное стекло, слегка упаривают и рядом с нею наносят каплю раствора цинкуранилацетата. Через 1-2 мин после соприкосновения обеих капель наблюдают под микроскопом образование характерных желтых октаэдрических и тетраэдрических кристаллов натрийцинкуранилацетата состава NаZn(U02)3(СНЗС00)9•9Н2O.
Для контроля катионы натрия открывают также микрокристалло-скопической реакцией с гексагидроксостибатом калия К^Ц0Н)6] - образуется белый микрокристаллический осадок гексагидроксости-бата натрия ?^(0Н)6]. 0ткрытию катионов натрия этой реакцией мешают даже следовые количества ионов аммония, в присутствии которых образуется белый аморфный осадок метасурьмяной кислоты ЖЬ03 Выпадение белого аморфного, а не кристаллического осадка (что определяется при рассмотрении под микроскопом) еще не свидетельствует о присутствии катионов натрия в исследуемом растворе.
Открытие катионов калия K+. После удаления ионов аммония в пробе 1 к ней прибавляют 3-4 капли 2 моль/л раствора уксусной кислоты и 2 капли раствора гексанитрокобальтата(Ш) натрия
?3[Со^02)6] - образуется желтый осадок гексанитрокобальтата(Ш) натрия и калия Na^Co^O^].
Удаление катионов аммония прокаливанием сухого остатка. Катионы аммония можно удалить из исходного анализируемого раствора также путем упаривания этого раствора с последующим прокаливанием сухого остатка. При прокаливании соли аммония разлагаются. Для этого в небольшой фарфоровый тигель помещают ~10 капель анализируемого раствора и выпаривают досуха. 0бразовавшийся сухой остаток осторожно прокаливают до полного удаления катионов аммония (до прекращения выделения белого дыма). К полученной массе прибавляют по нескольку капель дистиллированной воды и разбавленной уксусной кислоты. Если при этом образовался мутный раствор, то его центрифугируют и в центрифугате открывают ионы натрия и калия, как описано выше.
Анализ смеси катионов первой аналитической группы: Li+,Na+,K+, NH+
Анализ в присутствии катионов лития Li+. Катионы лития мешают открытию катионов натрия и калия, поэтому в их присутствии вначале в отдельных пробах анализируемого раствора открывают катионы лития и аммония, после чего эти катионы удаляют, а в остатке открывают катионы натрия и калия.
Катионы лития открывают реакцией с раствором двузамещенного ортофосфата натрия Na2НP04 в нейтральной или слабощелочной среде - образуется белый осадок ортофосфата лития Li3P04.
Катионы аммония открывают по выделению аммиака после прибавления к раствору щелочи и нагревания этого раствора - пары аммиака, выделяющегося при разложении катионов аммония в щелочной среде, окрашивают красную влажную лакмусовую бумагу в синий цвет.
Для контроля катионы аммония открывают отдельно в нескольких каплях исходного раствора также реактивом Несслера (смесь K2[HgI4] и К0Н), дающим с катионами аммония красно-бурый осадок.
0ткрытие катионов аммония реактивом Несслера можно провести и с внешним индикатором - влажной фильтровальной бумагой, пропитанной этим реактивом. При внесении листа такой бумаги в пары аммиака, выделяющиеся при нагревании щелочного раствора, она окрашивается в красно-бурый цвет.
Удаление катионов лития и аммония. Если катионы лития и аммония открыты в анализируемом растворе, то их удаляют.
Отделение катионов лития. Отбирают небольшую порцию анализируемого раствора (8-10 капель), прибавляют к ней 1-2 капли раствора аммиака (2 моль/л), 2-3 капли этанола, 4-5 капель раствора (NH4)2HPO4 (~1 моль/л). Полученную смесь нагревают до кипения, отделяют центрифугированием образовавшийся осадок ортофосфата лития LiзРО4 и проверяют полноту отделения катионов лития прибавлением в центрифугат раствора (NH4)2HPO4 (при полном удалении катионов лития не должен появляться осадок - раствор остается прозрачным).
Удаление катионов аммония. Катионы аммония можно удалить из раствора, полученного после отделения катионов лития, различными способами: термическим разложением, кипячением раствора с щелочами, связыванием в растворе в гексаметилентетрамин (уротропин) при реакции с формальдегидом.
Удаление катионов аммония термическим разложением. Центрифу-гат после удаления катионов лития выпаривают досуха в фарфоровой чашке, к сухому остатку прибавляют 1-2 капли концентрированной азотной кислоты HN03 и прокаливают полученную массу. При этой операции разрушаются и удаляются ионы аммония. Полноту их удаления проверяют реактивом Несслера на предметном стекле: при прибавлении крупинки прокаленного остатка к капле реактива Несслера не должно наблюдаться образование красно-бурого осадка.
Прокаленный остаток растворяют в нескольких каплях дистиллированной воды, выдерживают около 15 мин, при необходимости - центрифугируют и в центрифугате открывают катионы натрия и калия.
Удаление катионов аммония кипячением щелочных растворов. Этот прием описан выше в предыдущем разделе.
Удаление катионов аммония реакцией с формальдегидом. Сущность метода состоит в том, что катионы аммония в щелочной среде реагируют с формальдегидом НСНО с образованием гексаметилентетрами-на (уротропина) (CH2)6N4, который не мешает открытию катионов натрия и калия. Реакция протекает по схеме:
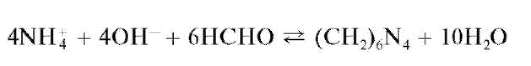
Для проведения реакции к 3-4 каплям центрифугата, полученного после удаления катионов лития, приливают столько же 40 % раствора формальдегида и 1 каплю фенолфталеина (индикатор). Смесь обрабатывают раствором соды ?2С0З до появления красной окраски раство-
ра (рН > 9), нагревают 1-2 мин, охлаждают, подкисляют уксусной кислотой до исчезновения красной окраски. В полученном растворе открывают катионы калия.
Если вместо соды ?2С03 прибавлять раствор поташа К2С03,тов полученном растворе открывают катионы натрия.
Открытие катионов натрия и калия. В отдельной части (1-2 капли) центрифугата, полученного после удаления катионов аммония (термическим разложением), открывают катионы натрия микрокристалло-скопической реакцией с цинкуранилацетатом в уксуснокислой среде (выделяется желтый осадок состава NaZn(U02)3(СН3С00)9•9Н20, образующий кристаллы правильной тетраэдрической и октаэдрической формы, хорошо видимые под микроскопом уже при восьмикратном увеличении) и реакцией (также микрокристаллоскопической) с гекса-гидроксостибатом(У) калия K[Sb(OH)6] - выделяется белый осадок гексагидроксостибата(У) натрия ?^Ь(0Н)6], который образует кристаллы характерной формы, отчетливо видимые под микроскопом.
В оставшейся части центрифугата открывают катионы калия реакциями с гексанитрокобальтатом(Ш) натрия ?3[Со^02)6] (в нейтральной или уксуснокислой среде образуется желтый осадок комплексной соли состава Na^Co^O^]), а также с гексанитрокупратом(П) натрия и свинца Na2Pb[Cu(NO2)6] - в нейтральной или уксуснокислой среде выделяются коричневые или черные кубические кристаллы комплексной соли состава K2Pb[Cu(NO2)6], хорошо видимые под микроскопом.
Контрольные вопросы
1. Дайте общую характеристику первой аналитической группы катионов.
2. Напишите формулы и назовите реагенты, используемые для обнаружения ионов:
а) натрия,
б) калия,
в) лития.
3. Напишите уравнения реакций обнаружения иона натрия с цинкура-нилацетатом и иона калия с гексанитрокобальтатом(Ш) натрия. 0бъясните, почему эти реакции нельзя проводить в сильнокислой и сильнощелочной среде.
4. Можно ли проводить реакцию обнаружения иона натрия с помощью K[Sb(OH)6] в сильнокислой среде? 0твет подтвердите написанием соответствующих уравнений реакций.
5. Перечислите микрокристаллоскопические реакции обнаружения катионов первой аналитической группы.
6. Укажите химический состав реактива Несслера.
7. 0ткрытию каких катионов мешает ион аммония? 0бъясните, почему?
8. Какую реакцию следует использовать для обнаружения иона аммония в присутствии солей тяжелых металлов? Напишите ее уравнение.
9. Какие катионы первой группы окрашивают пламя газовой горелки? Укажите окраску пламени.
10. Какие вы знаете методы связывания и удаления аммиака? Напишите уравнения протекающих при этом реакций.
11. Что собой представляет «контрольный опыт»? Как его проводят?
12. Как по ходу анализа смеси катионов первой аналитической группы отделить ионы лития?
Занятие 2. Аналитические реакции катионов второй и третьей аналитических групп по кислотно-основной классификации
Цель занятия:
- научиться проводить аналитические реакции катионов второй и третьей аналитических групп;
- научиться решать типовые расчетные задачи по теме I;
- научится рассчитывать характеристики чувствительности аналитических реакций, ионную силу раствора и активность ионов в растворе; выполнять расчеты, необходимые для приготовления растворов заданной концентрации.
Задание для самоподготовки
К занятию нужно знать
1. 0бщую характеристику катионов второй и третьей аналитических групп (групповые реагенты, их действие, состав группы, свойства катионов и их соединений - гидроксидов, оксидов, солей).
2. Способы выражения концентрации растворов: массовая доля, молярная концентрация, молярная концентрация эквивалента. Связь между ними.
3. 0сновные понятия теории сильных электролитов: активность, коэффициент активности, ионная сила раствора, рН растворов.
4. Правила техники безопасности и работы в химико-аналитической лаборатории. Уметь
1. Выполнять аналитические реакции катионов полумикромето-дом.
2. Выполнять реакции окрашивания пламени газовой горелки летучими солями; микрокристаллоскопические реакции.
Литература
Харитонов Ю.Я. Аналитическая химия (аналитика). Кн. 1, гл. 13, с. 320-324, 326-328; гл. 14, с. 353-371.
Лурье Ю.Ю. Справочник по аналитической химии. - М.: Химия,
1989.
Вопросы для самопроверки
1. Назовите групповые реагенты на катионы второй и третьей аналитических групп. Какие вещества образуются при их действии на катионы этих групп?
2. Перечислите катионы, входящие в состав второй и третьей аналитических групп. К каким группам периодической системы они относятся?
3. Дайте общую характеристику катионов и соединений второй и третьей аналитических групп.
4. Дайте определение понятиям «ионная сила раствора», «активность», «коэффициент активности иона».
5. Какие факторы влияют на ионную силу раствора?
6. Напишите формулу, по которой рассчитывают ионную силу раствора.
7. Как зависит коэффициент активности иона от ионной силы раствора? Напишите формулу Дебая-Хюккеля, определяющую эту зависимость.
8. Какие ионы находятся в равновесии в водном растворе дихромата калия? Напишите уравнение электролитической диссоциации дихромата калия.
9. Назовите наиболее широко применяемые в медицине и фармации лекарственные вещества, содержащие катионы второй и третьей аналитических групп.
10. 0бъясните, почему при кислотно-основной классификации катионов катион свинца одновременно попадает во вторую и третью аналитические группы?
Лабораторная работа
Реактивы
1. Растворы солей:
- ртутив); 0,05 моль/л серебра, свинца, бария, стронция, кальция нитратов;
- аммония оксалата, калия дихромата, хромата, гексацианоферра-та(П), олова(П) хлорида - свежеприготовленный; натрия или калия хлорида, бромида, иодида;
- 30 % раствор натрия или аммония ацетата; насыщенный раствор аммония хлорида;
- «гипсовая вода» (насыщенный раствор кальция сульфата);
- этанол;
- медные пластинки или монеты.
2. Сухие соли: бария, стронция, кальция хлориды.
Учебные таблицы
1. Классификация катионов по кислотно-основному методу.
2. Частные реакции катионов второй аналитической группы.
3. Частные реакции катионов третьей аналитической группы.
4. Периодическая система элементов Д.И. Менделеева.
1. Аналитические реакции катионоввторой аналитической группы по кислотно-основной классификации: Ag+, Hg2+ ,Pb2+
Групповой реагент (водный раствор хлороводородной кислоты) осаждает из водных растворов катионы второй аналитической группы в виде осадков малорастворимых в воде хлоридов серебра AgCl, ртути^) Hg2Cl2 и свинца PbCl2 Произведения растворимости этих трех хлоридов при комнатной температуре равны соответственно 1,78 10-10, 1,3 10-18, 1,6 10-5. Хлорид свинца заметно растворим в воде, особенно - при нагревании. Растворимость хлорида свинца в воде составляет (г/100 г воды): 0,99 при 25 °C и 2,62 при 80 °C. При действии группового реагента катионы свинца осаждаются из водного раствора неполностью - частично они остаются в растворе.
Аналитические реакции катионов серебра Ag+
ВНИМАНИЕ! Соли серебра ядовиты! Работать осторожно!
Катионы серебра образуют осадки со многими реагентами. Для открытия катионов Ag+ чаще всего используют осадительные реакции с анионами Cl- ,Br- ,I- ,CrO2_, а также окислительно-восстановительную реакцию, например, с формальдегидом HCHO (реакция «серебряного зеркала»).
Реакция с растворимыми хлоридами (фармакопейная), бромидами и йодидами. Катионы Ag+ при взаимодействии с растворимыми хлоридами, бромидами и йодидами образуют соответственно осадки: белый - хлорида серебра AgCl, желтоватый - бромида серебра AgBr и желтый - йодида серебра AgI:
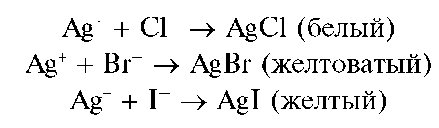
Осадок хлорида серебра растворяется в концентрированном аммиаке с образованием комплекса [Ag(NH3)2]Cl:
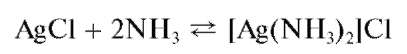
При подкислении раствора этого комплекса снова выпадает осадок
AgCl: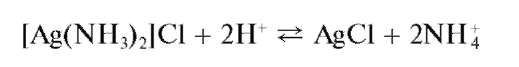
При прибавлении к раствору комплекса раствора йодида калия KI образуется осадок йодида серебра AgI:
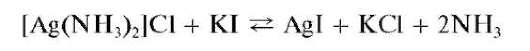
Осадок AgCl растворяется также в концентрированных растворах HO и хлоридов, в присутствии цианида калия KCN, тиосульфата натрия Na2S2O3 с образованием растворимых комплексов:
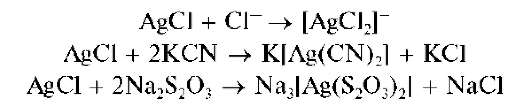
Осадок AgBr малорастворим, а AgI - нерастворим в концентрированном аммиаке.
Открытию катионов Ag+ реакцией с хлорид-ионами мешают катионы Cu+,Au+,Tl+,Pb2+, Hg2+, также образующие малорастворимые осадки хлоридов.
Методика. В одну пробирку вносят 2-3 капли раствора NaCl, в другую - столько же капель раствора NaBr, в третью - столько же раствора KI. В каждую пробирку добавляют по 3-5 капель раствора нитрата серебра AgNO3 Наблюдается помутнение растворов и выпадение осадков AgCl, AgBr и AgI.
Испытывают растворимость осадков, прибавляя в каждую пробирку по 5-10 капель концентрированного аммиака. При этом осадок AgCl растворяется полностью, осадок AgBr - частично, осадок AgI - не растворяется.
Раствор [Ag(NH3)2]Cl из первой пробирки делят на две примерно равные части. В одну из них прибавляют несколько капель раствора HNO3, в другую - несколько капель раствора KI. Наблюдается выпадение осадков AgCl и AgI соответственно.
Реакция с хромат-ионами CrO2.-. При взаимодействии катионов Ag+ c хромат-ионами в нейтральной среде (рН « 6,5-7,5) выделяется осадок хромата серебра Ag2CrO4 кирпично-красного цвета:
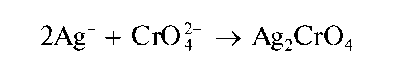
Осадок растворим в растворах кислот. В концентрированном аммиаке растворяется с образованием аммиачного комплекса серебра:
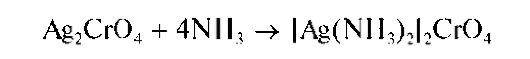
Если реакцию между Ag+ иCrO4- проводить в щелочной среде, то вместо хромата серебра выпадает осадок оксида серебра Ag2O. В уксуснокислой среде образуется дихромат серебра Ag2Cr2O7 красно-бурого цвета.
Мешают все катионы, образующие малорастворимые хроматы (Sr2+, Ba2+, Hg2+ ,Hg2+,Pb2+,Bi3+ идр.).
Методика. В пробирку вносят 2-3 капли раствора нитрата серебра AgNO3, прибавляют 1-2 капли раствора хромата калия K2CrO4 Выпадает кирпично-красный осадок.
Реакция с формальдегидом HCHO - реакция «серебряного зеркала» (фармакопейная). В присутствии в растворах восстановителей катионы Ag+ восстанавливаются до металлического серебра, которое, осаждаясь на стенках чистой пробирки, образует тонкую блестящую пленку - «серебряное зеркало». В качестве восстановителя часто применяют разбавленный раствор формальдегида в аммиачной среде при слабом нагревании (при сильном нагревании металлическое серебро выделяется в виде черно-бурого осадка). Вначале при реакции катионов Ag+ с
аммиаком образуется гидроксид серебра AgOH, переходящий в черно-бурый оксид серебра Ag2O, который растворяется в избытке аммиака с образованием аммиачного комплекса [Ag(NH3)2]+. Этот комплекс при взаимодействии с формальдегидом дает металлическое серебро. Реакцию можно описать схемой:
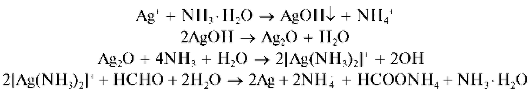
Мешают катионы ртути Hg 2+ ,Hg2+.
Методика. Вчистую, тщательно промытую (раствором хромовой смеси, а затем дистиллированной водой) пробирку вносят 3-4 капли раствора AgNO3, прибавляют несколько капель раствора аммиака до растворения выпавшего осадка оксида серебра Ag2O, несколько капель разбавленного раствора формальдегида и слегка нагревают пробирку (избегать сильного нагревания!). Стенки пробирки покрываются тонкой блестящей зеркальной пленкой металлического серебра.
Другие реакции катионов серебра. При взаимодействии катионов Ag+ с сероводородом H2S или растворимыми сульфидами образуется черно-коричневый осадок сульфида серебра Ag2S; с щелочами - черный осадок оксида серебра Ag2O; с тиоцианатом калия KSCN и с другими растворимыми тиоцианатами - белый осадок тиоцианата серебра AgSCN, растворимый в избытке реагента; с тиосульфатом натрия Na2S2O3 - белый осадок тиосульфата серебра Ag2S2O3, растворимый в избытке реактива; с гидрофосфатом натрия Na2HPO4 - желтый осадок фосфата (ортофосфата) серебра Ag3PO4; с ферроцианидом K4[Fe(CN)6] и феррицианидом K3[Fe(CN)6] калия - белый осадок Ag4[Fe(CN)6^ кирпично-красный осадок Ag3 [Fe(CN)6] соответственно. С дитизоном катионы Ag+ образуют окрашенные комплексы. Известны и другие реакции катионов серебра.
Аналитические реакции катиона ртути(1) Hg 2+ ВНИМАНИЕ! Соединения ртути очень токсичны! Работать осторожно!
Реакция с хлорид-ионами. Катионы Hg224 при взаимодействии с хлорид-ионами Cl- в растворах образуют белый осадок каломели Hg2Cl2: 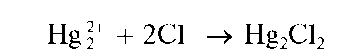
На свету осадок постепенно чернеет с выделением тонкодисперсной металлической ртути: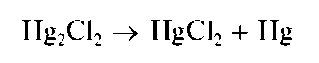
Осадок не растворяется в разбавленной, но растворяется в концентрированной азотной кислоте:
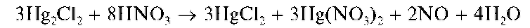
При прибавлении к осадку каломели раствора аммиака он темнеет вследствие выделения тонкодисперсной металлической ртути:
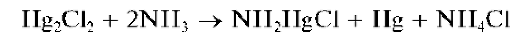
Реакции образования каломели и ее взаимодействие с аммиаком используются при дробном открытии ртути(I).
Методика. В пробирку вносят ~5 капель раствора нитрата ртути(I) Hg2(NO3)2 и прибавляют такое же количество раствора хлорида натрия. Выпадает белый осадок каломели. Осадок разделяют на две части. К одной части прибавляют концентрированную азотную кислоту - осадок растворяется. К другой части прибавляют несколько капель раствора аммиака - осадок чернеет.
Восстановление Hg2+ до металлической ртути хлоридом олова(П). Катионы ртути(I) при реакциях с восстановителями дают металлическую ртуть.
Так, при реакции Hg2+ с хлоридом олова(II) выделяющийся вначале белый осадок каломели Hg2Cl2 постепенно чернеет вследствие образования тонкодисперсной металлической ртути при восстановлении Hg2+ оловом(II):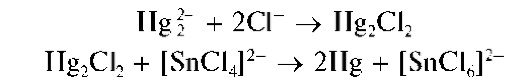
Мешают катионы ртути(II) Hg2+, также восстанавливающиеся до металлической ртути.
Методика. В пробирку вносят ~2 капли раствора нитрата ртути(I) Hg2(NO3)^ прибавляют ~2 капли раствора хлорида олова(II). Выпадает белый осадок каломели, постепенно чернеющий за счет выделения металлической ртути.
Восстановление Hg2+ металлической медью. Катионы Hg2+ восстанавливаются металлической медью до металлической ртути, образующей с медью амальгаму меди:
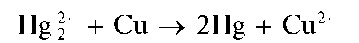
Мешают катионы ртути(II) Hg2+, дающие такой же эффект.
При нагревании ртуть улетучивается (отличие от аналогичной реакции с солями серебра).
Методика. На свежеочищенную (промытую раствором аммиака и затем дистиллированной водой или протертую наждаком) медную поверхность (например, на медную монету) наносят каплю раствора Hg2(NO3)2 Через некоторое время на поверхности образуется серое пятно амальгамы меди, которое после протирания поверхности мягкой тканью или сухой фильтровальной бумагой становится блестящим.
Если медную монету полностью погрузить в раствор Hg2(NO3)2^ затем, после извлечения из раствора, через некоторое время протереть мягкой тканью или сухой фильтровальной бумагой, то вся монета становится блестящей.
Реакция с водным раствором аммиака. Катионы Hg 224 реагируют с аммиаком в водном растворе с образованием черного осадка, представляющего собой смесь тонкодисперсной металлической ртути и соли, содержащей катион [OHg2NH2]NO3 Если в качестве соединения ртути(1) использовать нитрат Hg2(NO3)2, то реакцию можно описать схемой:
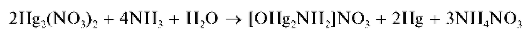
Методика. В пробирку вносят 2-3 капли раствора нитрата ртути(1) Hg2(NO3)2 и прибавляют ~5 капель раствора аммиака. Выпадает черный осадок.
Реакция с йодидами. Катионы Hg2+ образуют при взаимодействии с йодид-ионами 1-зеленый осадок йодида ртути(1) Hg2I2, растворимый в избытке реактива с образованием бесцветного комплексного тетрайо-домеркурат(П)-иона [HgI4]2^ черного осадка тонкодисперсной металлической ртути:
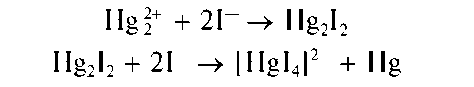
Методика. В пробирку вносят 3-4 капли раствора Hg2(NO3)2 ипри-бавляют одну каплю раствора йодида калия KI. Выпадает осадок Hg2I2. Добавляют избыток (~5-10 капель) раствора KI. На дне пробирки под бесцветным раствором остается черный осадок металлической ртути.
Реакция с хромат-ионами. Катионы Hg2+ образуют с хромат-ионами CrO2.- кирпично-красный осадок хромата ртути(!) Hg2CrO4: 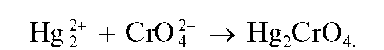
Мешают все катионы, образующие малорастворимые хроматы (Sr2+, Ba2+,Pb2+ идр.).
Методика. В пробирку вносят 3-4 капли раствора Hg2(NO3)2,при-бавляют 1-2 капли раствора хромата калия K2CrO4 Выпадает красный осадок хромата ртутив).
Реакция с щелочами. Щелочи (NaOH, KOH) выделяют из растворов, содержащих катионы Hg2+, черный осадок оксида ртутив) Hg2O:
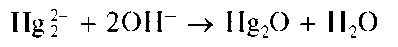
Осадок растворяется в азотной и концентрированной уксусной кислотах.
Методика. В пробирку вносят 3-4 капли раствора Hg2(NO3)2 ипри-бавляют 2-3 капли раствора NaOH или KOH. Выделяется черный осадок оксида ртути^).
Другие реакции катионов ртути(^. Катионы Hg2+ образуют осадки при реакциях: с сульфид-ионами S2-- черный HgS + Hg; с иодат-ионами IO- - желтый Hg2(IO3)2; с оксалат-ионами QO2.- - белый Hg2C2O4; с фосфат-ионами - белый (Hg2)3(PO4)2; с карбонат-ионами - желтый Hg2CO3 (быстро темнеющий вследствие разложения по схеме: Hg2CO3 -> HgO + Hg + CO2); с K4[Fe(CN)6]иK3[Fe(CN)6] - соответственно бледно-желтый и желто-зеленый ферро- и феррициани-ды ртути.
С дифенилкарбазидом катионы Hg224 образуют комплексы синего цвета.
Аналитические реакции катиона свинца Pb2+
ВНИМАНИЕ! Соединения свинца токсичны! Работать осторожно!
Известно значительное число реакций катионов свинца с различными соединениями, при которых образуются осадки или окрашенные продукты взаимодействия.
Реакция с хлорид-ионами. Катионы свинца образуют с хлорид-ионами (при рН<7) белый осадок хлорида свинца PbCl2:
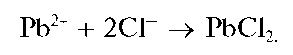
Хлорид свинца заметно растворим в воде, особенно при нагревании, поэтому катионы Pb2+ осаждаются из растворов хлорид-ионами неполностью.
Осадок хлорида свинца растворяется в горячей воде; при охлаждении раствора из него снова выпадает хлорид свинца, но уже в форме игл.
Из разбавленных щелочных растворов выпадает осадок гидроксида свинца; из концентрированных щелочных растворов осадок хлорида свинца не выпадает.
Методика. В пробирку вносят 3-4 капли раствора нитрата свинца Pb(NO3)2, прибавляют 3-4 капли раствора хлорида натрия. Выпадает белый осадок хлорида свинца.
К полученной смеси приливают ~1,5 мл дистиллированной воды и нагревают до растворения осадка. При охлаждении раствора из него снова выпадает осадок хлорида свинца в виде игл.
Реакция с йодид-ионами (фармакопейная). Катионы свинца при взаимодействии в растворах с йодид-ионами I- образуют желтый осадок йодида свинца, растворимый в избытке реактива с образованием тетрайодоплюмбат(П)-ионов [PbI4]2-:
Pb2+ + 2I- -> PbI2 PbI2 + 2I- -> [PbI4]2-
Осадок йодида свинца растворяется при нагревании в воде, в растворе уксусной кислоты. При охлаждении раствора из него снова выпадают красивые золотисто-желтые кристаллы йодида свинца (реакция «золотого дождя»). Мешают катионы Cu2+,Ag+, Hg2+ ,Hg2,Bi3+,
Fe3+.
Методика. В пробирку вносят 3-5 капель раствора нитрата свинца Pb(NO3)2, прибавляют 3 капли раствора йодида калия KI. Выпадает желтый осадок йодида свинца.
К смеси прибавляют несколько капель воды, подкисленной уксусной кислотой, и нагревают до полного растворения осадка. При медленном охлаждении пробирки (ее погружают в холодную воду или оставляют остывать на воздухе) выпадают красивые блестящие золотисто-желтые чешуйчатые кристаллы йодида свинца.
Реакция с хромат-ионами и дихромат-ионами. Катионы свинца образуют с хромат-ионами CrO4- и дихромат-ионами Cr2O27 вуксусно-кислой среде желтый кристаллический осадок хромата свинца PbCrO4:
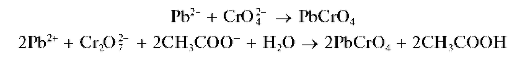
Осадок хромата свинца не растворяется в уксусной и разбавленной азотной кислотах, в водном аммиаке, но растворяется в щелочах с образованием комплексов [Pb(OH)4]2-: 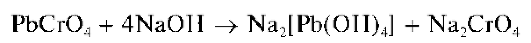
Мешают катионы, образующие нерастворимые хроматы (Ba2+,Hg2+, Bi3+ идр.).
Методика. В пробирку вносят 2-3 капли раствора Pb(NO3)2,2-3 капли раствора ацетата натрия и ~3 капли раствора хромата K2CrO4 или дихромата K2Cr2O7 калия. Выпадает желтый кристаллический осадок хромата свинца.
Реакция с сульфат-ионами. Катионы Pb2+ при взаимодействии в растворе с сульфат-ионами SO2" образуют белый осадок сульфата свинца PbSO4: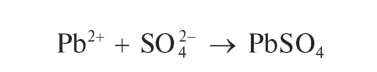
Осадок растворяется при нагревании в щелочах (в отличие от осадков сульфатов кальция, стронция и бария):
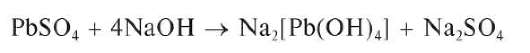
Растворяется также в концентрированной серной кислоте:
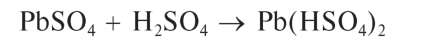
Растворяется в 30 % растворе ацетата аммония:
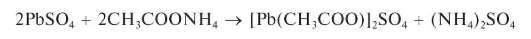
Открытию катионов свинца в виде сульфата свинца мешают катионы, образующие малорастворимые сульфаты (Ca2+,Sr2+,Ba2+, Hg2+ идр.).
Методика. В пробирку вносят 5 капель раствора Pb(NO3)2,прибав-ляют столько же капель раствора сульфата натрия или калия. Выпадает белый осадок сульфата свинца. Осадок делят на две части, помещая их в две разные пробирки. К одной части прибавляют раствор щелочи, к другой - 30 % раствор ацетата аммония. Осадок растворяется в обоих случаях.
Реакция сродизонатом натрия Na2C6O6. Катионы свинца образуют с органическим реагентом - родизонатом натрия
окрашенный комплекс синего цвета (по-видимому, состава Pb3(C6O6)2(OH)2), который в слабокислой среде (рН = 2,8; тартратный буферный раствор) изменяет окраску на красную.
Реакция высокочувствительна: определяемый минимум равен 0,1 мкг, предельная концентрация - 2 10-6 г/мл, предельное разбавление - 5 105 мл/г. Позволяет открывать катионы свинца даже при очень низких концентрациях.
Реакцию обычно проводят капельным методом на фильтровальной бумаге. Мешают катионы Ag+,Cd2+,Sr2+,Ba2+,Tl+, Sn(II).
Методика. На лист фильтровальной бумаги наносят каплю раствора Pb(NO3)2 и каплю свежеприготовленного 0,2 % раствора родизоната натрия. Образуется синее пятно или кольцо. На пятно наносят каплю тартратного буферного раствора. Цвет пятна изменяется на красный.
Тартратный буферный раствор при рН = 2,8 готовят из расчета того, чтобы 1 мл раствора содержал 0,019 г гидротартрата натрия и 0,015 г винной кислоты.
Реакция с сульфид-ионами (фармакопейная). Катионы свинца при реакции с сульфид-ионами S2-образуют черный осадок сульфида свинца PbS: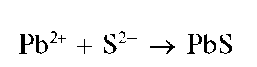
Осадок растворяется в азотной кислоте.
Методика. В пробирку вносят 2-3 капли раствора соли свинца(П) и прибавляют 2-3 капли раствора сульфида натрия Na2Smm сероводородной воды. Выпадает черный осадок сульфида свинца PbS.
Другие реакции катионов свинца. Катионы свинца образуют осадки при реакциях: с водным аммиаком - основные соли белого цвета (например, PbOHCl); с молибдатом аммония (NH4)2MoO4 - белый PbMoO4;сK4[Fe(CN)6] - белый ферроцианид свинца Pb2[Fe(CN)6]; cNa2HPO4 - белый Pb3(PO4)2 и с рядом других соединений.
Очень чувствительна реакция катионов свинца с органическим реагентом - дитизоном. При смешивании хлороформного раствора дити-зона с водным раствором соли свинца образуется красный дитизонат-ный комплекс свинца, экстрагирующийся из водной фазы в органическую и окрашивающий слой хлороформа в красный цвет. Предел обнаружения составляет 0,04 мкг.
Мешают катионы Cu2+,Ag+,Zn2+ и некоторые другие.
Катионы свинца образуют комплексы и с другими органическими реагентами.
В табл. 2 охарактеризованы продукты некоторых аналитических реакций катионов второй аналитической группы.
2. Аналитические реакции катионовтретьей аналитической группы по кислотно-основной классификации: Ca2+,Sr2+,Ba2+
При действии группового реагента (водного раствора серной кислоты ^SO.j) катионы третьей аналитической группы осаждаются в виде малорастворимых в воде сульфатов кальция CaSO4,стронцияSrSO4 и бария BaSO4 (свинец осаждается в виде сульфата PbSO4). Числовые значения произведений растворимости этих сульфатов при комнатной температуре равны: Ks°(CaSO4) = 2,5 10-5,Ks° (SrSO4) = 3,2 10-7, Ks°(BaSO4) = 1,110-10,Ks°(PbSO4) = 1,6 10-8. При действии группового реагента катионы кальция неполностью осаждаются из водного рас-творавформеосадкасульфата кальция - частьионов Ca2+ остается в растворе. Для более полного осаждения катионов кальция в форме сульфата кальция при действии группового реагента к анализируемому раствору прибавляют этанол, в присутствии которого растворимость сульфата кальция уменьшается.
Сульфаты кальция, стронция и бария практически нерастворимы в разбавленных кислотах, щелочах. Сульфат бария заметно растворяется в концентрированной серной кислоте с образованием кислой соли Ba(HSO4)2 Сульфат кальция растворим в водном растворе сульфата аммония (NH4)2SO4 с образованием комплекса (NH4)2[Ca(SO4)2]; сульфаты стронция и бария - не растворяются.
Аналитические реакции катиона кальция Ca2+
Реакция с сульфат-ионами. Катионы кальция образуют с сульфат-ионами SO2" белый осадок малорастворимого в воде сульфата кальция, который при медленной кристаллизации выделяется в форме игольчатых кристаллов гипса - дигидрата сульфата кальция-CaSO42H2O: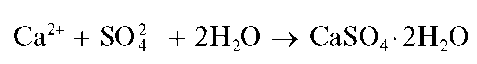
Для увеличения полноты осаждения к раствору прибавляют равный объем этанола - в водно-этанольной среде растворимость сульфата кальция уменьшается по сравнению с растворимостью в чистой воде.
Осадок сульфата кальция нерастворим в кислотах и щелочах, но растворяется в насыщенном водном растворе сульфата аммония с образованием комплекса (NH4)2[Ca(SO4)2]:
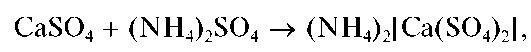
что позволяет отделить катионы Ca2+ от катионов Sr2+ иBa2+.
При нагревании с растворимыми карбонатами, например, с раствором соды Na2CO3, белый осадок сульфата кальция переходит в белый же осадок карбоната кальция:
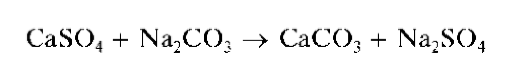
Карбонат кальция растворим в кислотах, поэтому нагревание CaSO4 с раствором соды с последующим растворением образующегося CaCO3 используют для отделения катионов кальция (вместе с катионами стронция и бария) от других катионов и перевода их в раствор.
Реакцию катионов кальция с сульфат-ионами обычно проводят как микрокристаллоскопическую. Предельное разбавление равно 2,5-104 мл/г.
Методика. Каплю раствора хлорида кальция CaCl2 наносят на предметное стекло, прибавляют каплю раствора серной кислоты и слегка упаривают смесь. Под микроскопом наблюдают образовавшиеся игольчатые кристаллы гипса CaSO4 •2H2Oв виде красивых сросшихся пучков или звездочек.
Реакция с оксалатом аммония (фармакопейная). Катионы Ca2+ образуют с оксалатом аммония (NH4)2C2O4 белый кристаллический осадок оксалата кальция CaC2O4:
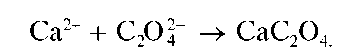
Реакцию проводят в слабокислой среде (рН « 6-6,5) в присутствии уксусной кислоты, в которой оксалат кальция не растворяется. В конце проведения реакции можно добавить аммиак.
Осадок CaC2O4 нерастворим в растворе аммиака, но растворяется в разбавленных минеральных кислотах с образованием щавелевой кислоты H2C2O4, например:
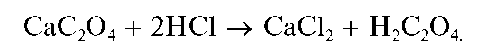
Открываемый минимум - около 100 мкг, предельное разбавление - 6 104 мл/г (подругимданным~3 • 105 мл/г).
Мешают катионы Sr2+,Ba2+,Mg2+, дающие аналогичные осадки.
Методика. В пробирку вносят 3 капли раствора CaCl2, прибавляют каплю раствора уксусной кислоты и 3 капли раствора оксалата аммония. Выпадает белый кристаллический осадок оксалата кальция.
Реакция с гексацианоферратом(П) калия. Катионы Ca2+ образуют с гексацианоферратом(П) калия K4[Fe(CN)6] при нагревании раствора до кипения в присутствии катионов аммония белый кристалличе-
ский осадок смешанного гексацианоферрата(П) аммония и кальция 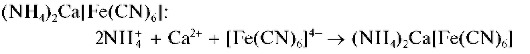 Осадок нерастворим в уксусной кислоте.
Осадок нерастворим в уксусной кислоте.
Открываемый минимум равен 25 мкг, предельное разбавление - 2-103 мл/г.
Мешают катионы Ba2+ и другие катионы, образующие осадки фер-роцианидов.
Методика. В пробирку вносят 3-4 капли насыщенного водного раствора CaCl2, 2-3 капли раствора аммиака. Нагревают раствор до кипения и прибавляют 5-6 капель свежеприготовленного насыщенного раствора K4[Fe(CN)6]. Выпадает белый кристаллический осадок.
Реакция сродизонатом натрия. Катионы Ca2+ образуют со свежеприготовленным раствором родизоната натрия Na2C6O6 вщелочнойсреде осадок фиолетового комплекса, состав которого, по-видимому, можно описать формулой Ca2C6O6(OH)2:
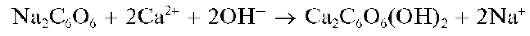
Реакция довольно чувствительна: предел обнаружения - 1 мкг, предельное разбавление - 5-104 мл/г. Катионы Sr2+ иBa2+ не мешают, так как в щелочной среде не образуют осадки с родизонатом натрия.
Реакцию можно проводить капельным методом на фильтровальной бумаге.
Методика. В пробирку вносят 3-4 капли раствора CaCl2,3-4 капли раствора NaOH и ~2 капли свежеприготовленного 0,2 % раствора ро-дизоната натрия. Выпадает фиолетовый осадок.
При проведении реакции на фильтровальной бумаге поступают следующим образом. На лист фильтровальной бумаги наносят каплю щелочного раствора CaCl2 и каплю свежеприготовленного 0,2 % раствора Na2C6O6 Образуется пятно (или осадок) фиолетового цвета.
Окрашивание пламени газовой горелки (фармакопейный тест). Соли (или другие соединения) кальция окрашивают пламя газовой горелки в кирпично-красный цвет.
Методика. На кончике платиновой или нихромовой проволоки, смоченной раствором HCl, вносят в пламя газовой горелки несколько кристалликов соли кальция или каплю раствора CaCl2 Пламя окрашивается в кирпично-красный цвет.
Другие реакции катионов кальция. Катионы Ca2+ образуют также осадки при реакциях в растворах: с растворимыми карбонатами - белый осадок CaCO3 (растворяется в кислотах), с гидрофосфатом натрия
Na2HPO4 - белый CaHPO4 (растворяется в кислотах), с хроматами - желтый CaCrO4, с фторидами - белый студенистый CaF2 (малорастворимый в кислотах и разлагающийся при нагревании с концентрированной серной кислотой).
Аналитические реакции катиона стронция Sr2+
Реакция с сульфат-ионами. Катионы Sr2+ образуют с сульфат-ионами белый осадок сульфата стронция SrSO4:
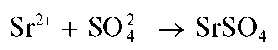
Осадок нерастворим в щелочах, в растворе сульфата аммония (NH4)2SO4 (в отличие от сульфата кальция, который растворяется в этом реагенте).
Осадок сульфата стронция образуется и при прибавлении «гипсовой воды» (насыщенный водный раствор сульфата кальция) к растворам, содержащим соли стронция, поскольку растворимость в воде сульфата стронция ниже растворимости сульфата кальция. Добавление «гипсовой воды» приводит к образованию осадка SrSO4 лишь при нагревании; без нагревания осадок SrSO4 выделяется только при длительном стоянии. Мешают катионы Ba2+.
При нагревании осадка SrSO4 с раствором соды он, как и сульфат кальция, переходит в карбонат стронция SrCO3, также нерастворимый в кислотах.
Методика.
а) Реакция с «гипсовой водой». В пробирку вносят 4 капли раствора хлорида стронция SrCl2, прибавляют 5-6 капель «гипсовой воды», нагревают на водяной бане и оставляют на ~10-15 минут. Постепенно выделяется белый осадок сульфата стронция.
б) Реакция с серной кислотой. В пробирку вносят 1-2 капли раствора SrCl2, прибавляют 2-3 капли раствора серной кислоты. Выпадает белый кристаллический осадок сульфата стронция.
Реакция с карбонат-ионами. Катионы Sr2+ образуют при нагревании с карбонат-ионами CO32-белый кристаллический осадок карбоната стронция: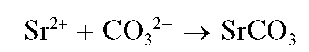
Осадок растворяется в кислотах.
Методика. В пробирку вносят 3-5 капель раствора SrCl2,прибавля-ют столько же капель раствора карбоната аммония (NH4)2CO3 иосто-рожно нагревают пробирку с раствором. Выпадает белый осадок карбоната стронция.
Реакция с родизонатом натрия. Катионы Sr2+ образуют с родизона-том натрия Na2C6O6 в нейтральной среде бурый осадок родизоната стронция, по-видимому, состава SrC6O6:
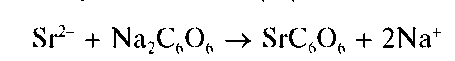
Реакцию проводят капельным методом на фильтровальной бумаге. Предел обнаружения - 7 мкг.
Катионы бария также образуют бурый осадок с родизонатом натрия. Однако родизонат стронция, в отличие от родизоната бария, растворим в хлороводородной кислоте, тогда как родизонат бария при взаимодействии с HO превращается в ярко-красный гидрородизонат бария.
Методика. На лист фильтровальной бумаги наносят каплю раствора SrCl2 и каплю свежеприготовленного 0,2 % раствора родизоната натрия. Наблюдается образование красно-бурого пятна.
На пятно наносят каплю раствора HO. Окраска пятна исчезает (в присутствии катионов бария окраска не исчезает, а переходит из бурой в ярко-красную).
Окрашивание пламени газовой горелки. Соли (и другие соединения) стронция при внесении в бесцветное пламя газовой горелки окрашивают пламя в карминово-красный цвет. Методика аналогична описанной выше для теста на другие катионы.
Другие реакции катионов стронция. Катионы Sr2+ образуют также осадки при реакциях в растворах: c оксалатом аммония (NH4)2C2O4 - белый SrC2O4 (частично растворяется в уксусной кислоте), с гидрофосфатом натрия Na2HPO4 - белый SrHPO4 (растворяется в кислотах), с хроматом калия K2CrO4 - желтый SrCrO4 (растворяется в уксусной кислоте; реакция высокочувствительна: предел обнаружения - 0,8 мкг).
Применяют также довольно чувствительную (предельное разбавление - 104 мл/г) микрокристаллоскопическую реакцию образования сине-зеленых кубических кристаллов K2Sr[Cu(NO2)6].
Аналитические реакции катионов бария Ba2+
ВНИМАНИЕ! Соединения бария токсичны!
Катионы бария Ba2+ образуют с сульфат-ионами белый кристаллический осадок сульфата бария BaSO4: 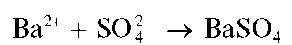
Осадок нерастворим в щелочах и кислотах, за исключением концентрированной серной кислоты, в которой он заметно растворяется с образованием гидросульфата бария Ba(HSO4)2:
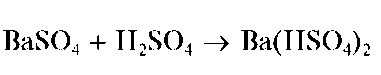
При нагревании с растворами карбонатов (например, соды Na2CO3) сульфат бария превращается в малорастворимый в воде карбонат бария BaCO3, который растворяется в кислотах.
Предел обнаружения каионов бария данной реакцией составляет 10 мкг. Мешают катионы Ca2+,Sr2+,Pb2+.
Методика. В пробирку вносят 2-3 капли раствора BaCl2,прибавля-ют по каплям раствор H2SO4 Выпадает белый мелкокристаллический осадок сульфата бария.
Реакция с дихромат-ионами. Катионы Ba2+ образуют с дихромат-ионами Cr2O27" в присутствии ацетат-ионов желтый осадок хромата бария BaCrO4:
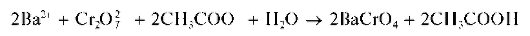
Образование хромата бария BaCrO4, а не дихромата BaCr2O7,вэтой реакции объясняется тем, что хромат бария менее растворим в воде, чем дихромат бария.
В водных растворах дихроматов устанавливается равновесие
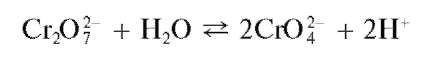
В присутствии катионов Ba2+ образуется и выпадает в осадок малорастворимый хромат BaCrO4,тогда какдихроматBa2Cr2O7 восадокне выпадает вследствие его более высокой растворимости. В результате равновесие смещается вправо, и в растворе накапливаются ионы водорода, что, однако, препятствует более глубокому смещению равновесия. Поэтому для нейтрализации ионов водорода в раствор вводят ацетат натрия CH3COONa. Ацетат-ионы CH3COO-, образующиеся при электролитической диссоциации ацетата натрия, связывают ионы водорода в малодиссоциированную слабую уксусную кислоту CH3COOH, вследствие чего равновесие образования хромат-ионов из дихромат-ионов смещается вправо. При этом возрастает полнота осаждения хромата бария.
Осадок хромата бария растворяется в сильных кислотах, но не растворяется в уксусной кислоте.
Мешают Ag+,Pb2+,Cd2+,Co2+,Ni2+ и другие катионы, дающие осадки хроматов. Катионы Ca2+,Sr2+ не мешают открытию катионов бария.
Методика. В пробирку вносят 5 капель раствора BaCl2, прибавляют 5 капель раствора дихромата калия K2Cr2O7 и 4-5 капель раствора ацетата натрия CH3COONa. Выпадает желтый кристаллический осадок хромата бария.
Хромат бария образуется также при реакции катионов Ba2+ схро-мат-ионами: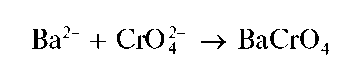
Однако при реакции с дихромат-ионами в присутствии ацетат-ионов катионы бария осаждаются практически количественно.
Реакция с родизонатом натрия. Катионы Ba2+ реагируют с родизона-том натрия Na2C6O6 в нейтральной среде с образованием красно-бурого осадка родизоната бария:
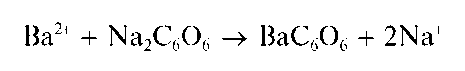
При прибавлении раствора хлороводородной кислоты красно-бурый осадок родизоната бария превращается в ярко-красный гидроро-дизонат бария Ba (HC6O6)2.
Предел обнаружения - 0,25 мкг. Мешают катионы Pb2+.
Реакцию проводят капельным методом на фильтровальной бумаге. Методика аналогична описанной для реакции катионов стронция с родизонатом натрия.
Окрашивание пламени газовой горелки. Соли и другие соединения бария окрашивают пламя газовой горелки в желто-зеленый цвет. Методика - такая же, как и в других вышеописанных случаях.
Другие реакции катионов бария. Катионы Ba2+ образуют также осадки при реакциях: с растворимыми оксалатами - белый BaC2O4 (растворяется в HCl, HNO3, при нагревании - также и в CH3COOH); с гидрофосфатом натрия Na2HPO4 - белый BaHPO4 (растворяется в кислотах); с растворимыми карбонатами - белый BaCO3 (растворяется в кислотах); с сульфитами - белый BaSO3 (растворяется в кислотах).
Катионы Ba2+ образуют окрашенные комплексы с некоторыми органическими реагентами, например, с 8-оксихинолином (желто-зеленый), с сульфоназо III (сине-зеленый) и др.
В табл. 3 охарактеризованы продукты некоторых аналитических реакций катионов третьей аналитической группы по кислотно-основной классификации.
В табл. 4 суммированы ориентировочные сведения по растворимости в воде солей катионов первой, второй и третьей аналитических групп, наиболее часто встречающихся в аналитической практике.
Контрольные вопросы
1. Перечислите аналитические реакции катиона свинца и напишите их уравнения. Какая реакция называется реакцией «золотого дождя»?
2. Хлорид какого катиона хорошо растворяется в горячей воде?
3. Какие катионы второй группы образуют комплексные соединения? Напишите их формулы.
4. Напишите уравнение реакции растворения хлорида серебра в водном аммиаке.
5. Напишите уравнение реакции взаимодействия ртутив) хлорида с водным аммиаком.
6. Напишите уравнения реакций обнаружения катионов бария и свинца в виде хроматов. Почему при выполнении реакции в раствор добавляют ацетат натрия?
7. Напишите уравнения реакций растворения:
а) хромата свинца в гидроксиде натрия;
б) сульфата кальция в сульфате аммония;
в) сульфата свинца в гидроксиде натрия и ацетате натрия.
8. Назовите реакции обнаружения ионов кальция и напишите их уравнения. Укажите свойства образующихся осадков.
9. В какой цвет окрашивают пламя летучие соли катионов третьей аналитической группы?
10. Какие катионы второй и третьей групп неполностью осаждаются групповыми реагентами и частично остаются в растворе?
11. Какая из солей растворится при обработке концентрированным раствором аммиака осадка, состоящего из хлорида, бромида, иоди-да серебра? Напишите уравнение протекающей при этом реакции.
12. Какие лекарственные вещества содержат катионы второй и третьей аналитических групп?
Занятие 3. Анализ смеси катионов первой, второй и третьей аналитических групп
Цель занятия:
- научиться проводить систематический анализ смеси катионов первой, второй и третьей аналитических групп;
- научиться рассчитывать растворимость малорастворимых солей в присутствии одноименного иона и постороннего электролита (солевой эффект);
- научиться составлять уравнения реакций катионов первой, второй и третьей аналитических групп.
Задание для самоподготовки
К занятию нужно знать
1. Закон действующих масс применительно к гомогенному и гетерогенному (осадок - раствор) равновесию. Концентрационную и термодинамическую константы химического равновесия, произведение растворимости и произведение активностей ионов. Растворимость малорастворимых электролитов. Дробное осаждение. Влияние различных факторов на растворимость осадка (одноименных ионов, посторонних электролитов и др.) Солевой эффект. Образование и растворение осадков.
2. Использование произведения растворимости для перевода одних малорастворимых электролитов в другие.
3. Основные этапы анализа смеси катионов. Групповые реагенты, реакции обнаружения катионов первой, второй и третьей аналитических групп.
4. Правила техники безопасности и работы в химико-аналитической лаборатории.
Уметь
1. Выполнять аналитические реакции катионов первой, второй и третьей аналитических групп.
2. По величине произведения растворимости сравнивать растворимость электролитов.
3. Рассчитывать растворимость малорастворимых солей в моль/л и г/л по величине произведения растворимости и наоборот.
Литература
Харитонов ^.^.Аналитическая химия (аналитика). Кн. 1, гл. 4, с. 84-109, гл. 13, с. 320-328.
Лурье Ю.Ю. Справочник по аналитической химии. - М.: Химия,
1989.
Вопросы для самопроверки
1. Сформулируйте понятие произведения растворимости. Какая существует связь между произведением растворимости и произведением активности ионов?
2. Сформулируйте условия выделения осадка сильного малорастворимого электролита.
3. Перечислите способы выражения растворимости малорастворимых электролитов.
4. Как влияет введение одноименного иона на растворимость сильного малорастворимого электролита?
5. Как влияет присутствие постороннего электролита на растворимость сильного малорастворимого электролита?
6. Сущность и механизм «солевого эффекта». Разберите на конкретном примере.
7. Какая существует связь между растворимостью и произведением растворимости сильного малорастворимого электролита? Покажите на примере: а) AgCl, б) Ag2CrO4,в)Ag3PO4.
8. Пользуясь табличными значениями произведения растворимости Ag2S, Ag2CrO4, AgI, решите вопрос о том, какое из этих веществ имеет наименьшую растворимость в г/л.
9. Напишите формулу, связывающую растворимость в г/л с растворимостью в моль/л.
10. Что такое дробное осаждение? Приведите пример.
11. Назовите специфические реакции обнаружения катионов первой, второй и третьей аналитических групп и напишите их уравнения.
12. Какие микрокристаллоскопические реакции катионов первой, второй и третьей аналитических групп используются для их открытия? Напишите уравнения реакций.
13. Перечислите основные этапы хода анализа смеси катионов первой, второй и третьей аналитических групп.
14. Полоскикраснойисинейлакмусовойбумагипогрузиливрас-твор:
а) разбавленной хлороводородной кислоты;
б) разбавленной щелочи. Как изменился их цвет?
15. Напишите уравнения реакции растворения карбоната кальция в уксусной и хлороводородной кислотах.
16. Какой из сульфатов третьей аналитической группы катионов труднее всего переводится в карбонаты? Для ответа используйте табличные значения произведения растворимости сульфатов и карбонатов.
Лабораторная работа
Реактивы (См. занятия 1, 2) Учебные таблицы
1. Систематический ход анализа смеси катионов первой, второй и третьей групп.
2. Частные реакции катионов первой, второй и третьей групп.
Контрольная задача
Анализ смеси катионов первой, второй и третьей аналитических групп
Контрольную задачу получают в пробирке, перемешивают и делят на 2 части. Для анализа используют только одну часть раствора. В соответствии с предлагаемым ходом анализа оформляют протокол, фиксируя все свои действия, наблюдения, выводы из них, записывая соответствующие уравнения реакций обнаружения катионов в ионном виде.
Предварительные наблюдения
Исследуемый раствор, содержащий смесь катионов трех групп, может быть с осадком или без осадка. Осадок может содержать либо хлориды серебра, свинца, ртути^), либо сульфаты бария, стронция, свинца, кальция, в концентрированном растворе - также сульфаты серебра, ртути^), либо все вместе взятые. Если осадок темнеет при стоянии, можно предположить, что присутствуют катионы серебра или ртути^), хлориды которых разлагаются на свету.
Предварительные испытания
В случае раствора без осадка действуют на отдельные порции раствора (0,3-0,5 мл).
а) Раствором гидроксида натрия или калия с целью обнаружения ионов аммония.
б) Групповыми реагентами на катионы второй и третьей аналитических групп с целью их обнаружения.
В случае образования белых осадков при добавлении одного из реагентов делают вывод о присутствии катионов либо только второй, либо только третьей аналитических групп. В том случае, когда осадок образуется при добавлении как HCl, так и H2SO4, можно предположить, что в растворе присутствуют:
- либо катионы второй и третьей групп одновременно,
- либо только катионы свинца.
в) При отрицательной реакции на катионы третьей группы проводят обнаружение катиона кальция, добавляя к сернокислому раствору этанол. В присутствии кальция происходит помутнение раствора.
В случае раствора с осадком предварительные испытания ограничивают только действием на отдельную порцию раствора гидроксида натрия с целью обнаружения иона аммония.
В зависимости от внешнего вида контрольной задачи (с осадком или без осадка) выбирают систематический ход анализа катионов.
1. Систематический анализ раствора без осадка
1.1. Отделение и анализ катионов второй аналитической группы
1.1.1. Выделение катионов второй аналитической группы
К части исследуемого раствора (2-3 мл) прибавляют по каплям раствор хлороводородной кислоты до полного выделения осадка. Полноту осаждения катионов проверяют следующим образом: раствор с осадком сначала центрифугируют, а затем к прозрачному раствору над осадком (центрифугату) добавляют каплю раствора хлороводородной кислоты. Отсутствие мути доказывает полноту осаждения. В противном случае повторяют операцию до отрицательного эффекта. Осадок, состоящий из хлоридов серебра, ртутиЦ), свинца, отделяют от раствора центрифугированием и промывают раствором HCl 1 моль/л. Для этого к осадку добавляют 0,5-1,0 мл кислоты, перемешивают содержимое пробирки энергичным встряхиванием или стеклянной палочкой, после чего отделяют осадок от раствора центрифугированием. Осадок и раствор (центрифугат 1), в котором остаются катионы первой и третьей групп и частично катионы свинца, сохраняют для дальнейшего анализа.
1.1.2. Анализ осадка хлоридов катионов второй группы
Отделение и открытие катионов свинца РЪ2+. К осадку хлоридов серебра, ртути и свинца прибавляют небольшой объем горячей дистиллированной воды и смесь нагревают до кипения. Растворимость хлорида свинца в воде увеличивается с повышением температуры, поэтому при нагревании хлорид свинца переходит в раствор, а в осадке остаются хлориды серебра и ртути. Эту операцию при необходимости повторяют.
Горячую смесь центрифугируют, горячий раствор, содержащий хлорид свинца, отделяют от осадка и в отдельных пробах этого раствора открывают катионы свинца реакциями с дихроматом калия К2&2О7 в присутствии ацетата натрия СН3СОО? (выпадает желтый кристаллический осадок хромата свинца РЪ&О^ растворимый в щелочах и нерастворимый в уксусной кислоте) и с иодидом калия KI (выпадает желтый кристаллический осадок иодида свинца РЫ2, растворимый в избытке иодида калия).
Отделение и открытие катионов серебра Ag+. Повторяют обработку осадка хлоридов серебра и ртути дистиллированной водой при нагревании для полного удаления следов оставшегося хлорида свинца, в чем убеждаются реакцией с дихроматом калия (в пробе раствора не должен образовываться хромат свинца).
Затем отделяют и открывают катионы серебра. К осадку (AgCl + Hg2Cl2) прибавляют небольшой объем раствора концентрированного аммиака, смесь перемешивают, слегка нагревают на водяной бане и центрифугируют. При обработке осадка аммиаком хлорид серебра растворяется с образованием бесцветного аммиачного комплекса серебра [Ag(NH3)2]+. В осадке остается хлорид ртути(1).
Смесь центрифугируют. Катионы серебра открывают в отдельных порциях центрифугата реакциями с концентрированной HNО3 (выпадает белый осадок хлорида серебра AgCl - раствор мутнеет) и с раствором иодида калия (выпадает желтый осадок иодида серебра AgI - раствор также мутнеет).
Открытие катионов ртутив) Hg2+. Осадок хлорида ртути(1) Щ202, оставшийся после обработки аммиаком смеси хлоридов серебра и ртути, должен почернеть, так как при реакции хлорида ртути(1) с аммиаком выделяется металлическая ртуть в тонкодисперсном состоянии, придавая осадку черный цвет:
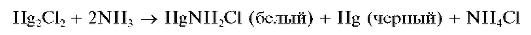
Почернение осадка свидетельствует о присутствии катионов ртути(1).
Для контроля осадок растворяют в царской водке, раствор упаривают до полного удаления избытка азотной кислоты. В оставшемся растворе присутствуют ионы ртути(11), которые открывают реакцией с хлоридом олова(11) - первоначально образующийся белый осадок Hg2Cl2 чернеет вследствие образования тонкодисперсной ртути при восстановлении ртути(1) до металлического состояния.
1.2. Выделение и анализ катионов третьей аналитической группы
1.2.1. Выделение катионов третьей аналитической группы
К центрифугату, оставшемуся после выделения хлоридов второй аналитической группы, добавляют по каплям раствор серной кислоты до полного выделения осадка сульфатов катионов третьей группы (проба с 1 моль/л серной кислотой). Осадок, состоящий из сульфатов бария, стронция, кальция и свинца, отделяют от раствора центрифугированием и подвергают анализу. Центрифугат отбрасывают.
1.2.2. Анализ осадка сульфатов катионов третьей группы
Отделение сульфата свинца. Осадок сульфатов обрабатывают 2-3 раза 5 каплями 30 % раствора ацетата аммония или натрия при нагревании на водяной бане до полного удаления сульфата свинца (про-
ба с дихроматом калия). После центрифугирования раствор ацетата натрия, содержащий ионы свинца, отбрасывают.
Переведение сульфатов катионов третьей группы в карбонаты. Поскольку сульфаты катионов третьей группы практически нерастворимы ни в кислотах, ни в щелочах, их переводят в карбонаты - соли, растворимые в кислотах. Для этого к оставшемуся после отделения свинца осадку сульфатов прибавляют 10-15 капель насыщенного раствора карбоната натрия, перемешивают стеклянной палочкой или встряхиванием пробирки и нагревают на водяной бане в течение 5-7 минут. Осадок отделяют центрифугированием, центрифугат отбрасывают. Операцию обработки осадка раствором карбоната натрия и отделения осадка центрифугированием повторяют еще 2 раза, после чего промывают осадок дистиллированной водой до отрицательной реакции на сульфат-ион с хлоридом бария. После этого осадок растворяют в 10-12 каплях 2 моль/л раствора уксусной кислоты при нагревании и подвергают анализу. Если после растворения остается небольшой осадок, то его отбрасывают. При значительном количестве осадка операцию переведения сульфатов в карбонаты повторяют.
Открытие и отделение катионов бария Ва2+. Для открытия катионов бария используют реакцию с дихроматом калия. Реакцию проводят с отдельной порцией (5-7 капель) уксуснокислого раствора. В случае положительного эффекта к раствору прибавляют дихромат калия до полного осаждения бария. Осадок отделяют центрифугированием и отбрасывают. В центрифугате остаются катионы кальция и стронция. Раствор подвергают дальнейшему анализу.
Отделение катионов кальция и стронция от дихромат-ионов. Центри-фугат окрашен в желто-оранжевый цвет вследствие присутствия дихромат-ионов. Ионы стронция и кальция отделяют от дихромат-ионов, действуя на центрифугат раствором карбоната натрия до перехода окраски из желто-оранжевой в желтую. Выделившийся осадок карбонатов стронция и кальция отделяют от раствора центрифугированием. Цен-трифугат отбрасывают, осадок промывают дистиллированной водой и растворяют в растворе 2 моль/л уксусной кислоты. В отдельных порциях полученного раствора открывают ионы стронция и кальция.
Открытие катионов стронция Sr2+ реакцией с «гипсовой водой».
Открытие катионов кальция Ca2+. В отсутствие катионов стронция катионы кальция открывают как реакцией с оксалатом аммония, так и реакцией с гексацианоферратом(П) калия в присутствии солей аммония. В присутствии же ионов стронция кальций открывают только реакцией с гексацианоферратом(П) калия.
1.3. Обнаружение катионов первой группы
1.3.1. Обнаружение катионов аммония NH+
Катионы аммония открывают в предварительных испытаниях.
1.3.2. Обнаружение катионов калия К+ инатрия
Катионы калия и натрия открывают в отдельных пробах первоначального раствора после отделения в виде карбонатов катионов второй и третьей групп.
При открытии катионов калия к исследуемому раствору прибавляют раствор карбоната натрия и отделяют выделившийся осадок центрифугированием. Осадок отбрасывают, в центрифугате после подкис-ления уксусной кислотой открывают ион калия, принимая во внимание присутствие или отсутствие ионов аммония.
При открытии катионов натрия к первоначальному раствору прибавляют карбонат калия и отделяют выделившийся осадок центрифугированием. Осадок отбрасывают, в центрифугате после подкисления уксусной кислотой открывают катионы натрия реакцией с цинкурани-лацетатом или с гексагидроксостибатом калия.
2. Систематический анализ раствора с осадком
2.1. Полное выделение осадка
Для проведения анализа раствор с осадком перемешивают, отбирают 2-3 мл исследуемой смеси и, последовательно приливая по каплям хлороводородную и серную кислоты, добиваются полного осаждения хлоридов и сульфатов катионов второй и третьей аналитических групп. Взвесь центрифугируют и отделяют раствор от осадка. В растворе остаются катионы первой группы и часть ионов кальция, в осадке - хлориды катионов второй группы, сульфаты катионов третьей группы и сульфат свинца. Отдельно проводят анализ раствора и осадка.
2.2. Анализ осадка
2.2.1. Отделение и обнаружение катионов свинца РЪ2+ См. выше систематический анализ раствора без осадка.
2.2.2. Отделение и обнаружение катионов серебра Ag+ См. п. 1.1.2.
2.2.3. Обнаружение и отделение катионов ртути(I) Hg2+ См. п. 1.1.2.
Для отделения ртути осадок неоднократно обрабатывают концентрированной азотной кислотой при нагревании. Обработку азотной кислотой лучше проводить в микротигле. Черный цвет осадка должен
при этом исчезнуть. Оставшийся белый осадок сульфатов катионов третьей группы отделяют от азотнокислого раствора центрифугированием, промывают водой и подвергают дальнейшему анализу. Центри-фугат отбрасывают.
2.2.4. Анализ осадка сульфатов катионов третьей группы
См. выше. При выполнении анализа учитывают, что свинец в осадке отсутствует.
2.3. Обнаружение катионов первой группы
Анализ проводят из первоначального раствора. См. выше систематический анализ раствора без осадка.
Контрольные вопросы
1. Все ли аналитические реакции используют для обнаружения данного иона? Дайте обоснованный ответ.
2. Исследуемый раствор, содержащий смесь катионов трех аналитических групп, имеет белый осадок. Сделайте предположение о возможном составе осадка.
3. Как проверяют полноту выделения осадка?
4. Как проводят промывание осадка? Для чего это делают?
5.Как проводят обнаружение катиона кальция в предварительных испытаниях?
6. Как удаляют катионы свинца:
а) из осадка хлоридов катионов второй аналитической группы,
б) из осадка сульфатов катионов третьей аналитической группы?
7. Каким приемом при этом достигают полноту отделения?
8. Какая соль свинца выделяется в осадок при добавлении к раствору, содержащему катионы свинца, смеси разбавленных хлороводородной и серной кислот? Для ответа используйте значения произведений растворимости хлорида свинца и сульфата свинца.
9. Почему в ходе систематического анализа смеси катионов первой, второй и третьей аналитических групп проводят перевод осадка сульфатов катионов третьей аналитической группы в карбонаты?
10. Можно ли по систематическому ходу анализа смеси катионов первой, второй и третьей групп для растворения карбонатов третьей группы вместо уксусной кислоты использовать хлороводородную или азотную?
11. Почему анализ смеси катионов первой, второй и третьей аналитических групп начинают с обнаружения и отделения катионов бария?
12. Почему необходимо удалить катионы свинца, приступая к анализу осадка хлоридов катионов второй группы и сульфатов катионов третьей группы?
13. Как открывают катионы кальция и стронция при их совместном присутствии?
14. Почему катионы натрия и калия при анализе смеси катионов первой, второй и третьей групп катионов лучше открывать из первоначального раствора после отделения катионов второй и третьей групп в виде карбонатов?
15. Перечислите основные этапы систематического анализа смеси катионов первой, второй и третьей аналитических групп для:
а) раствора без осадка,
б) раствора с осадком.
Примеры тестовых пунктов текущего контроля по теме I
I. Тестовые пункты с одним правильным ответом
Инструкция. Из следующих за утверждением ответов выберите один правильный.
1. Произведение растворимости - это:
A. произведение активностей ионов малорастворимого сильного электролита в его растворе
B. произведение молярных концентраций ионов малорастворимого сильного электролита при 298 К
C. произведение молярных концентраций ионов малорастворимого сильного электролита в растворе при определенной температуре
D. произведение активностей ионов малорастворимого сильного электролита в степенях их стехиометрических коэффициентов в насыщенном растворе
E. произведение активностей ионов малорастворимого сильного электролита в насыщенном растворе
Ответ'^
2. Наиболее характерна для катиона ртути(1) реакция:
A. образования хромата
B. образования сульфата
C. восстановления хлоридом олова(11)
D. образования хлорида
E. образования сульфида
Напишите уравнение соответствующей реакции.
Ответ:С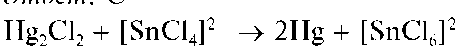
II. Задания на установление соответствия
Инструкция. Установите соответствие. Каждый ответ может быть использован один раз, несколько раз или не использован совсем.
III. Задания с выбором одного или нескольких правильных ответов
Инструкция. Для каждого незаконченного утверждения один или несколько ответов являются правильными. Выберите номера правильных ответов.
16. Условия обнаружения иона К+ микрокристаллоскопической реакцией с Na2Pb[Cu(NO2)6]:
1. уксуснокислая среда
2. нагревание
3. комнатная температура
4. добавление хлорида аммония
Напишите в ионном виде соответствующие уравнения реакции. Ответ:1,3
2K+ + Pb2+ + [Cu(NO2)6]4- = K2Pb[Cu(NO2)6]
17. Хлорид и сульфат свинца из осадков хлоридов второй и сульфатов третьей групп по систематическому ходу анализа смеси катионов отделяют действием реагентов:
1. концентрированный раствор щелочи
2. 30 % раствор аммония ацетата
3. концентрированный раствор серной кислоты
4. горячая дистиллированная вода Ответ:2,4
IV. Тестовые пункты на определение причинно-следственных взаимосвязей
Инструкция. Вопрос состоит из двух утверждений, соединенных союзом «потому что». Проверьте, верно или неверно каждое утверждение в отдельности, а затем связь между ними. Для выбора ответов используйте приведенную ниже схему.
18. Катионы аммония в смеси катионов первой, второй и третьей аналитических групп открывают дробной реакцией с реактивом Несслера в газовой камере, потому что реакция иона аммония со щелочью является специфической.
Ответ:В
19. Отделение катионов бария от других катионов третьей аналитической группы при систематическом ходе анализа катионов третьей группы проводят дихроматом калия в уксуснокислой среде, потому что хромат бария растворим в разбавленной уксусной кислоте.
Ответ:С
Содержание письменной контрольной работы по теме I
1. Теоретические основы качественного химического анализа
1.1. Основные понятия
Аналитическая реакция. Пробирочные, капельные, микрокристал-лоскопические реакции, реакции окрашивания пламени. Специфические, селективные, групповые реакции и реагенты. Макро-, полумик-ро-, микроанализ.
Чувствительность аналитических реакций, способы ее выражения. Предел обнаружения, предельная концентрация, предельное разбавление, минимальный объем.
Дробный и систематический анализ. Принципы аналитической классификации катионов. Понятие о сероводородном и аммиач-но-фосфатном методах анализа. Оборудование и техника работы в химической лаборатории.
1.2. Основные положения теории растворов сильных электролитов Способы выражения концентрации растворов: массовая доля, молярная концентрация, молярная концентрация эквивалента. Связь между ними.
Активность, коэффициент активности, ионная сила раствора, связь между ними. Формула Дебая-Хюккеля. Влияние различных факторов на ионную силу раствора.
1.3. Применение закона действующих масс к гомогенному равновесию Растворы слабых электролитов. Степень ионизации, константа равновесия, связь между ними. Термодинамическая и концентрационная константы равновесия.
1.4. Применение закона действующих масс к гетерогенному равновесию
Равновесие между осадком малорастворимого сильного электролита и его насыщенным раствором. Произведение растворимости и произведение активности ионов.
Смещение равновесия между осадком и насыщенным раствором электролита. Условия образования и растворения осадков. Перевод одних малорастворимых соединений в другие. Дробное осаждение.
Растворимость осадка (моль/л и г/л). Влияние одноименных ионов на растворимость осадка. Солевой эффект, его обоснование.
2. Кислотно-основная классификация катионов.
Кислотно-основная классификация катионов; аналитические группы катионов: состав, групповые реагенты, общая химико-аналитическая характеристика. Аналитические реакции катионов первой, второй и третьей аналитических групп. Систематический ход анализа катионов первой, второй и третьей аналитических групп.
3. Типовые расчетные задачи.
3.1. Расчеты по приготовлению растворов.
3.2. Расчет ионной силы и активности ионов.
3.3. Расчет произведения растворимости по растворимости малорастворимых электролитов.
3.4. Расчет растворимости малорастворимых электролитов: а) в воде, б) в присутствии одноименного иона, в) в присутствии постороннего электролита.
Пример билета письменной контрольной работы (дневное отделение)
1. Концентрационная и термодинамическая константы равновесия, связь между ними и зависимость от различных факторов.
2. Характерные реакции и ход анализа смеси катионов ^Pb^Sr2".
3. Вычислите предел обнаружения и предельное разбавление для катиона стронция в виде стронция оксалата, если реакция получается с 0,1 мл 0,001 моль/л раствора стронция нитрата.
4. Вычислите активности ионов SO2,- иFe3+ в 0,0001 моль/л растворе сульфата железа(Ш).
5. Во сколько раз изменится растворимость сульфата кальция в 0,01 моль/л растворе нитрата магния по сравнению с его растворимостью в чистой воде?
Пример билета письменной контрольной работы (вечернее отделение)
1. Чувствительность аналитической реакции, способы ее выражения (предел обнаружения, предельная концентрация, предельное разбавление, минимальный объем). Примеры.
2. Аналитические реакции, анализ смеси катионов: Ag+, Hg 2+ ,Ba2+.
3. Вычислите растворимость сульфата бария в г/мл в 0,1 моль/л растворе нитрата натрия.