Руководство к практическим занятиям по гинекологии: Учебное пособие / Под ред. В.Е. Радзинского. - 2007. - 600 с. : ил.
|
|
|
|
ГЛАВА 4 НЕЙРОЭНДОКРИННЫЕ СИНДРОМЫ
Что понимают под термином «нейроэндокринные синдромы»?
Нейроэндокринными синдромами (НЭС) называют клинические симптомокомплексы, обусловленные первичным нарушением секреции гормонов аденогипофиза и гипоталамических рилизинг-гормонов.
Синонимом НЭС является термин «нейроэндокринно-обменные синдромы», поскольку эти состояния в ряде случаев сопровождаются выраженными обменными нарушениями - ожирением, истощением, нарушением углеводного обмена.
Какие заболевания относят
к нейроэндокринным синдромам?
К НЭС традиционно относят:
- пангипопитуитаризм, связанный с некрозом гипофиза или его ножки, в том числе в результате нарушений гемоциркуляции в послеродовом периоде (синдром Шихена);
- психогенную, «голодную» аменорею;
- аменорею после приема некоторых лекарств (в том числе «синдром гиперторможения»);
- первичный гипоталамический гипогонадизм (в том числе синдром Каллмана);
- предменструальный синдром;
- поликистозные яичники (ПКЯ);
- гиперпролактинемию;
- посткастрационный синдром;
- патологию перименопаузы.
Каков патогенез нейроэндокринных синдромов?
Патогенез НЭС определяется первичным нарушением (повышением или снижением) секреции гормонов аденогипофиза и прежде всего гонадотропных гормонов (ЛГ и ФСГ), а также пролактина или гипоталамических рилизинг-гормонов с нарушением секреции гормонов гипофиза.
Обменные нарушения, сопровождающие НЭС, чаще всего являются следствием сопутствующих нарушений секреции ТТГ, АКТГ, первичного истощения (психогенная анорексия, голод) и в ряде случаев - глубокого угнетения функции половых желез.
Каковы основные проявления нейроэндокринного синдрома?
Характерными симптомами НЭС являются ановуляция, нарушение менструального цикла по типу олигоменореи, прогрессирующее увеличение массы тела и гипертрихоз. Бесплодие может быть первичным, особенно в тех случаях, когда нейроэндокринные нарушения возникают в пубертатном периоде или с началом половой жизни. Интенсивность указанных клинических проявлений обусловлена степенью вовлечения гипоталамических структур и длительностью заболевания. Для НЭС характерны диэнцефальные нарушения: полиурия, полидипсия, нарушения сна, гипертермия.
Какие исследования имеют наибольшее значение в диагностике нейроэндокринного синдрома?
В диагностике данной патологии важное значение имеют гормональные исследования.
Как называется заболевание, связанное с гипопитуитаризмом?
Это заболевание называется синдромом Шихена или послеродовым гипопитуитаризмом. Оно известно с конца XIX в., но только в
Каков патогенез синдрома Шижена?
Синдром Шихена развивается вследствие некротических изменений в гипофизе, возникающих на фоне спазма или внутрисосудистого свертывания крови в сосудах передней доли гипофиза после кровотечений, бактериального шока при родах или аборте.
Гестоз является предрасполагающим фактором. Кроме того, у беременных с тяжелой формой гестоза имеется склонность к внутри- сосудистому свертыванию крови. После родов имеет место физиологическое снижение выделения АКТГ, что также способствует ишемии гипофиза.
Какова клиническая картина синдрома Шижена?
Клиническая картина характеризуется различной степенью гипофункции эндокринных желез, прежде всего щитовидной, надпо- чечников и половых. Z. Morandi (1957) выделяет следующие формы синдрома Шихена в зависимости от недостаточности тропных гормонов гипофиза:
- глобальная форма - с клиническими проявлениями недостаточности ТТГ, гонадолиберинов, АКТГ. Заболевание может протекать в легкой или тяжелой форме;
- частичная форма - с недостаточностью гонадотропной, тиреотропной, адренокортикотропной функций;
- комбинированная недостаточность гонадотропной и тиреотропной функций; тиреотропной и адренокортикотропной.
Каковы клинические формы синдрома Шихена?
Выделяют 3 клинические формы синдрома: легкую, средней тяжести и тяжелую. Легкая форма характеризуется головной болью, быстрой утомляемостью, зябкостью, тенденцией к гипотензии. У больных сни- жается функция щитовидной железы и глюкокортикоидная функция коры надпочечников. Форма средней тяжести отличается снижением гормональной функции яичников (олигоменорея, ановуляторное бесплодие) и щитовидной железы (пастозность, склонность к отечности, ломкость ногтей, утомляемость, гипотензия с наклонностью к обморокам, причем эти симптомы могут встречаться в различных сочетаниях). При тяжелой форме выявляется симптоматика тотальной гипофункции гипофиза с выраженной недостаточностью гонадотропинов (стойкая аменорея, гипотрофия половых органов и молочных желез), тиреотропного гормона (микседема, облысение, сонливость, снижение памяти), АКТГ (гипотензия, адинамия, слабость, усиленная пигментация кожи). При тяжелой форме значительно падает масса тела, а при легких формах чаще наблюдается ее увеличение в связи с
пастозностью и склонностью к отечности вследствие гипофункции щитовидной железы. Для синдрома Шихена характерна также анемия, плохо поддающаяся обычной терапии.
Каковы методы диагностики синдрома Шихена?
Самыми важными опорными пунктами в диагностике заболевания являются характерный анамнез и связь начала заболевания с кровотечением или септическим шоком при родах или аборте. Характерными признакоми синдрома Шихена считаются отсутствие нагрубания молочных желез после родов и агалактию. При гормональных исследованиях выделяют разные степени снижения в крови гонадотропинов, АКТГ, ТТГ, а также Е2, кортизола, Т3 и Т4. При введении тропных гормонов соответственно повышается уровень периферических гормонов в крови. Отмечаются также гипогликемия и гипогликемический тип сахарной кривой при нагрузке глюкозой. В моче снижено содержание 17-КС.
С какими заболеваниями следует дифференцировать синдром Шихена?
Дифференциальный диагноз проводят с нервной анорексией, опухолью гипофиза, болезнью Аддисона-Бирмера, микседемой. Большую помощь при этом оказывает характерный анамнез больных - кровотечение или септический шок при родах или аборте.
Каковы принципы лечения синдрома Шихена?
При клинических проявлениях гипофункции соответствующих желез проводят заместительную терапию глюкокортикоидами и тиреотропными препаратами. Преднизолон назначают по 5 мг 2 раза в день в течение 2-3 нед курсом один раз в 2-3 мес. При аменорее или олигоменорее женщинам до 40 лет рекомендуется циклическая гормонотерапия. После 40 лет используют андрогены, учитывая их анаболический эффект: метилтестостерон по 5 мг в день в течение 2-3 мес.; удовлетворительный эффект оказывают андрогены при выпадении волос. Успешно применяют анаболические препараты: ретаболил, метиландростендиол и др. Питание должно быть полноценным, следует избегать дефицита белка в пище. С учетом анемии больным показаны препараты железа под контролем анализа крови.
Больных с тяжелой формой синдрома Шихена лечат только в условиях эндокринологического стационара.
В чем заключается профилактика развития синдрома Шихена?
Профилактикой заболевания являются: рациональная тактика ведения беременных с гестозами, своевременная терапия; бережное родоразрешение с профилактикой кровотечения и адекватные реанимационные мероприятия при кровотечениях во время родов, абортов и при септическом шоке.
4.1. ПРЕДМЕНСТРУАЛЬНЫЙ СИНДРОМ
Что такое предменструальный синдром?
Предменструальный синдром (ПМС) - сложный патологический симптомокомплекс, возникающий в предменструальные дни и про- являющийся нейропсихическими, вегетососудистыми и эндокринно-обменными нарушениями. Обычно симптомы ПМС возникают за 2-10 дней до менструации и исчезают сразу после начала менструации или в первые ее дни.
Каков патогенез ПМС?
Патогенез ПМС сложен и недостаточно изучен, о чем свидетельствует существование множества теорий, объясняющих его.
Основоположник гормональной терапии A. Frank предположил, что ПМС обусловлен избыточным уровнем эстрогенных гормонов, повышением эстрадиола и снижением прогестерона в лютеиновую фазу менструального цикла.
Другая теория - теория «водной интоксикации». Задержку жидкости у больных ПМС объясняют нейроэндокринными нарушениями, в частности изменениями в системе ренин-ангиотензин-альдостерон. Считается, что повышение секреции АКТГ гипофизом под влиянием стресса и высоких уровней серотонина и ангиотензина II способствуют увеличению продукции альдостерона. Предшественник ангиотензина II - ангиотензиноген - секретируется печенью под влиянием эстрогенов. Ренин является ферментом, который превращает ангиотензиноген в ангиотензин.
Какова роль эстрогенов в развитии отеков?
Эстрогены обладают способностью вызывать задержку натрия, что приводит к задержке жидкости в межклеточном пространстве и развитию отеков. При недостаточности прогестерона возникает задержка
жидкости в организме. К сожалению, механизм ее задержки в организме при ПМС точно не известен. Следовательно, теорией «водной интоксикации» нельзя объяснить все симптомы заболевания. Возможно, эстрогены могут вызывать задержку натрия и жидкости путем увеличения продукции альдостерона, однако только этим фактом нельзя объяснить возникновение отеков.
Какие существуют теории возникновения ПМС?
Наибольшее число сторонников имеет теория психосоматических нарушений, приводящих к развитию ПМС. При этом считают, что соматические факторы играют первостепенную роль, а психические следуют за биохимическими изменениями, возникающими в результате нарушений гормонального статуса.
Существует также аллергическая теория, согласно которой ПМС является результатом гиперчувствительности к эндогенному прогестерону.
В последние годы большая роль в патогенезе ПМС отводится пролактину. Полагают, что пролактин, являясь модулятором действия многих гормонов, способствует натрийзадерживающему эффекту альдостерона и антидиуретическому влиянию вазопрессина.
Теория о роли простагландинов в возникновении ПМС предполагает, что нарушение их синтеза в мозге, молочных железах, желудочно-кишечном тракте, почках и в репродуктивной системе может способствовать появлению ряда симптомов ПМС: депрессии, раздражительности, нервозности, масталгии, боли внизу живота, метеоризма, повышения температуры тела. Дефицит простагландина Е1 может привести к аффективным расстройствам.
Недостаточность ненасыщенных жирных кислот в продуктах питания, а также магния, витамина В6, аскорбиновой кислоты и цинка играет большую роль в генезе ПМС, так как дефицит этих факторов питания способствует нарушению синтеза простагландина Е1.
Таким образом, ПМС является следствием дисфункции различных отделов ЦНС и возникает в результате воздействия неблагоприятных факторов у женщин с врожденной либо приобретенной неполноцен- ностью гипоталамо-гипофизарной системы. Возникновение различных форм ПМС, по-видимому, объясняется вовлечением в патологический процесс различных структур гипоталамуса и лимбико-ретикулярного комплекса, а также различным характером нарушений биохимических процессов в этих областях.
Каковы клинические проявления ПМС?
Клинические проявления ПМС характеризуются большим разнообразием. В зависимости от преобладания в клинической картине тех или иных симптомов выделены 4 основные формы ПМС: нервно-психическая, отечная, цефалгическая, кризовая.
Какие выделяют стадии ПМС?
Выделяют 3 стадии ПМС: компенсированную, субкомпенсированную и декомпенсированную. При компенсированной стадии симптомы болезни с годами не прогрессируют, появляются во второй фазе менструального цикла и с наступлением менструации прекращаются. При субкомпенсированной стадии тяжесть заболевания с годами усугубляется, симптомы ПМС исчезают только с прекращением менструации. При декомпенсированной стадии симптомы ПМС продолжаются в течение нескольких дней после прекращения менструации, причем «светлые» промежутки между прекращением и появлением симптомов постепенно сокращаются.
Чем характеризуется клиника нервно-психической формы ПМС?
Клиническая картина нервно-психической формы ПМС характеризуется преобладанием таких симптомов, как раздражительность, депрессия, слабость, плаксивость, агрессивность. Среди частых, не менее выраженных жалоб следует отметить повышенную чувствительность к звукам и запахам, онемение рук, метеоризм, нагрубание молочных желез. Если у молодых женщин при ПМС преобладает депрессия, то в переходном возрасте отмечается агрессивность.
Какова клиническая картина отечной формы ПМС?
В клинической картине больных с отечной формой ПМС преобладают резко выраженное нагрубание и болезненность молочных желез, отечность лица, голеней, пальцев рук, вздутие живота, слабость, зуд кожи, повышенная чувствительность к запахам, потливость. У подавляющего числа больных с ПМС во вторую фазу менструального цикла отмечается задержка жидкости до 500-700 мл. У 20% женщин, несмотря на отечность лица и вздутие живота, водный баланс остается положительным. Среди симптомов, наименее выраженных при отечной форме ПМС, отмечаются раздражительность, слабость, потливость.
Какова клиническая картина цефалгической формы ПМС?
В клинической картине больных с цефалгической формой ПМС преобладают: головная боль, раздражительность, тошнота, рвота, повышенная чувствительность к звукам и запахам, головокружение. Более чем у трети пациенток отмечаются депрессия, боль в области сердца, потливость, онемение рук, нагрубание молочных желез, отеки при положительном диурезе.
Головная боль при цефалгической форме ПМС характеризуется пульсирующей, дергающей болью, которая начинается в височной области и иррадирует в глазное яблоко. У женщин в это время появляются чувство «выпирания глазного яблока», отечность глаз. Головная боль сопровождается тошнотой и рвотой, при этом уровень артериального давления не изменяется.
У больных с цефалгической формой ПМС довольно часто возникают мигрень, заболевания желудочно-кишечного тракта и травмы черепа.
Чем характеризуется клиническая картина кризовой формы ПМС?
При кризовой форме ПМС в клинической картине преобладают симпатико-адреналовые кризы. Они начинаются с повышения АД, чувства сдавления за грудиной, появления страха смерти, сопровождаются похолоданием и онемением конечностей, сердцебиением при неизмененной ЭКГ. Довольно часто кризы заканчиваются обильным мочеотделением. Следует отметить, что у некоторых женщин даже незначительные подъемы систолического давления (на 10-20 мм рт. ст. от исходных цифр) провоцируют криз. Обычно кризы возникают вечером или ночью.
Кризы могут быть спровоцированы инфекционным заболеванием, усталостью, стрессами. В межкризовый период нередко беспокоят головные боли, раздражительность, подъем артериального давления. Как правило, кризы наблюдаются у женщин с нелеченными нервно-психической, отечной или цефалгической формами ПМС.
Какова частота и тяжесть клинических форм ПМС в различные возрастные периоды?
Наибольшая частота и тяжесть кризовой и цефалгической форм ПМС наблюдаются в переходном периоде жизни женщины; в возрасте 16-19 лет и 25-34 года отмечена наибольшая частота нервно-психической формы ПМС, в 20-24 года - отечной.
Какие гормональные изменения наблюдаются при различных формах ПМС?
При отечной форме ПМС снижен уровень прогестерона и повышено содержание серотонина в крови; при нервно-психической форме повышен уровень пролактина и гистамина; при цефалгической форме повышено содержание серотонина и гистамина у молодых женщин; при кризовой форме повышен уровень пролактина и серотонина во вторую фазу менструального цикла, а также отмечена гиперфункция коры надпочечников у женщин переходного возраста. Общим симптомом для всех клинических групп больных является относительная или абсолютная гиперэстрогения.
На чем основана диагностика ПМС?
Основа диагностики - циклический характер появления патологических симптомов.
Установлению диагноза помогает ведение в течение одного менструального цикла дневника-вопросника, в котором ежедневно отмечают все патологические симптомы.
Какие дополнительные методы исследования применяют при нервно-психической, отечной, цефалгической и кризовой формах ПМС?
При всех клинических формах ПМС необходимо обследование по тестам функциональной диагностики, а также определение пролактина, Е2, прогестерона в крови в обе фазы цикла.
При нервно-психической форме ПМС требуется консультация невропатолога и психиатра. Из дополнительных методов обследования назначают краниографию и ЭЭГ.
При отечной форме ПМС следует измерять диурез и количество выпитой жидкости в течение 3-4 дней в обе фазы цикла. Надо помнить, что в норме выделяется на 300-400 мл жидкости больше, чем выпива- ется. При болях и нагрубании молочных желез показано проведение маммографии в первую фазу менструального цикла. Исследуют также выделительную функцию почек, определяют показатели остаточного азота, креатинина и др.
При цефалгической форме ПМС выполняют ЭЭГ, РЭГ сосудов мозга, изучают состояние глазного дна и периферических полей зрения; производят рентгенографию черепа, турецкого седла и шейного отдела
позвоночника. Рекомендуется консультация невропатолога, окулиста, аллерголога.
При кризовой форме ПМС показано измерение диуреза и количества выпитой жидкости, АД. В целях дифференциальной диагностики с феохромоцитомой необходимо определить содержание катехоламинов в крови или моче и выполнить УЗИ надпочечников. Проводят также ЭЭГ, РЭГ, исследование полей зрения, глазного дна, размеров турецкого седла на краниограмме черепа. Эти больные нуждаются в обследовании у терапевтов и невропатологов.
Какое лечение проводят больным с ПМС?
Лечение больных с ПМС начинают с психотерапии, включающей доверительную беседу с пациенткой и объяснение сущности заболевания, аутогенной тренировки. Необходим совет, касающийся режима труда и отдыха, соблюдения диеты, особенно во вторую фазу менструального цикла, с ограничением кофе, чая, поваренной соли, жидкости, животных жиров, молока. Рекомендуют общий массаж или массаж воротниковой зоны, бальнеотерапию.
В связи с относительной или абсолютной гиперэстрогенией показана терапия гестагенами: дюфастон по 10 мг 2 раза в день с 16-го дня цикла в течение 10 дней, прогестерон с 18-го дня цикла 8-10 дней или по 200-300 мг в день с 17-го дня цикла. Молодым женщинам показано применение комбинированных эстроген-гестагенных препаратов (двухфазные или трехфазные контрацептивы - марвелонрегулон (этинилэстра-диол 30 мкг и дезогестрел 0,15 мг в 1 таблетке), трирегол (этинилэстрадиол и левоноргестрел по 30 мкг и 0,05 мг, 40 мкг и 0,075 мг, 30 мг и 125 мг соответственно в 1 таблетке).
В российских и зарубежных исследованиях было показано, что при использовании марвелона снижается частота развития большинства симптомов ПМС уже на третьем месяце применения препарата, а эффективность лечения ПМС составила от 33,3% до 90% в зависимости от выраженности симптомов (Межевитинова Е.А. 2003). В сравнительном исследовании Марвелона с моно- и трехфазными ОК, содержащими левоноргестрел (Bakstrom 1992), Марвелон в большей степени способствовал улучшению настроения женщин, чем ЛНГ-содержащие препараты.
При повышенном уровне серотонина и гистамина у больных с ПМС, в том числе при указании на аллергические реакции, назначают
антигистаминные препараты (тавегил, диазолин или терален) на ночь ежедневно за 2 дня до ухудшения состояния, включая первый день менструации.
Терален, являясь препаратом фенотиазинового ряда, обладает выраженным антигистаминным и антисеротониновым действием с седативной активностью подобно аминазину. Оказывает блокирующее влияние на дофаминергические рецепторы.
В целях улучшения
кровоснабжения и энергетических процессов головного мозга и снижения
секреции пролактина показано применение ноотропила по 1 капсуле (400
мг) 3-4 раза в день, аминалона по
В качестве диуретических средств показан антагонист альдостерона - верошпирон, диуретический эффект которого выражен умеренно и проявляется обычно на 2-5-й день от начала лечения. Верошпирон назначают за 4 дня до появления симптомов ПМС по 25 мг 2 раза в день до начала менструации.
С учетом гипотезы о роли простагландинов в патогенезе ПМС целесообразно применение препаратов, обладающих свойством подавлять синтез эндогенных простагландинов, например напросина по 250 мг 2 раза в день за 2-3 дня до начала менструации.
При эмоциональной лабильности с 10-го дня менструального цикла назначают психотропные средства: нейролептики (сонапакс) и транквилизаторы (седуксен, рудотель), дисменорм.
Лечение больных с ПМС проводят циклами - в течение 3 менструальных циклов с перерывом 2-3 цикла. В случае рецидива заболевания лечение возобновляют.
При достижении положительного эффекта рекомендуют профилактическое поддерживающее лечение, включающее витамины, транквилизаторы (особенно при длительном стрессе, тяжелых экстрагенитальных заболеваниях, перемене климата, инфекционных заболеваниях).
Какое лечение проводится при повышении уровня пролактина?
Препаратом выбора является парлодел (бромокриптин), назначаемый по 1,25 мг (1/2 таблетки) в день во вторую фазу цикла за 2 дня до ухудшения состояния в течение 8-10 дней.
4.2. ГИПЕРПРОЛАКТИНЕМИЯ
Где синтезируется ПЛ и как регулируется его секреция?
ПЛ синтезируется в специфических гипофизарных клетках - пролактофорах (пролактотропоцитах). Факторами, регулирующими синтез Прл на уровне пролактофоров, являются ионы кальция и цАМФ.
Синтез и секреция ПЛ происходят не только в тканях гипофиза, но и в клетках эндометрия и плаценты, эпителиальных клетках тонкой кишки и раковых клетках легких и почек.
Уровень ПЛ регулируется постоянным тоническим поступлением тиролиберина (ТЛ) и пролактинингибирующего фактора (ПИФ) из гипоталамуса.
Секреция Прл в отличие от других гипофизарных гормонов находится под преимущественным ингибирующим контролем гипота- ламуса. Наиболее важным из эндогенных пролактинингибирующих субстанций является дофамин (ДА), который самостоятельно тормозит секрецию ПЛ. Уменьшение содержания ДА в гипоталамусе приводит к снижению уровня ПИФ и увеличению количества ПЛ, циркулирующего в организме.
Морфин и эндогенные опиаты - эндорфины (ЭНД) и метэнкефалин - активируют секрецию ПЛ.
Эстрогены способны усиливать секрецию ПЛ, не только стимулируя пролактофоры в гипофизе, но и блокируя секрецию ДА и его антагонистов.
В каком ритме секретируется пролактин?
Секреция ПЛ имеет циркадный характер. Наиболее высокий уровень регистрируется через 2-3 ч после засыпания, наиболее низкий - от 10 до 14 ч дня. Содержание этого гормона имеет тенденцию к повышению в лютеиновую фазу менструального цикла с 14 до 24 ч, и максимум его обнаруживается за день или в день овуляторного пика ЛГ. У женщин в постменопаузальном периоде уровень ПЛ снижается в ответ на гипофункцию яичников, связанную с возрастом.
Какова функция пролактина в организме женщины?
Важными функциями ПЛ являются регуляция процессов лактогенеза и участие в эндокринной функции репродуктивной системы.
Какова частота гиперпролактинемии?
Гиперпролактинемия наблюдается у 15-30% женщин, обращающихся по поводу вторичной аменореи, и почти у 70% - по поводу бесплодия.
Какие причины приводят к развитию патологической гиперпролактинемии?
Патологическая гиперпролактинемия развивается в результате анатомических или функциональных нарушений в системе гипоталамус- гипофиз. Различают первичную и вторичную гиперпролактинемию. Кроме того, существует так называемая бессимптомная гиперпро0 лактинемия, при которой повышен уровень биологически активного Прл, - транзиторная, или скрытая (только ночная).
Каковы причины первичной гиперпролактинемии?
Таким причинам относятся:
- первичное поражение гипоталамо-гипофизарной системы;
- дисфункция гипоталамо-гипофизарной системы и нарушение синтеза пролактинингибирующего фактора;
- воспалительные процессы в области гипоталамуса, гипофиза - лимфоидный гипофизит;
- поражения ножки гипофиза (травмы, воспаления);
- «пустое» турецкое седло;
- пролактинсекретирующие опухоли гипофиза;
- гормонально-неактивные опухоли гипофиза (интра- и супраселлярные) - краниофарингиомы, менингиомы, эктопические пинеаломы;
- пролактиномы (микро- и макроаденомы);
- акромегалия, болезнь Иценко-Кушинга.
Каковы причины вторичной гиперпролактинемии?
Эндокринные, неэндокринные и ятрогенные факторы:
- гипотиреоз;
- некоторые формы климактерического, предменструального синдромов и синдром ПКЯ;
- гиперандрогения - транзиторная гиперпролактинемия;
- хронический психогенный стресс;
- почечная недостаточность;
- саркоидоз, гистиоцитоз Х;
- рак бронхов;
- операции, герпес и травмы в области грудной клетки;
- раздражение сосков молочных желез (транзиторная гиперпролактинемия);
- частое выскабливание стенок тела матки;
- лекарственные препараты (фенотиазины, транквилизаторы, резерпин, эстрогены, стероидные контрацептивы, простаглан- дины, ципротеронацетат и др.).
Каков патогенез гиперпролактинемии?
В основе патогенеза первичной гипоталамо-гипофизарной гиперпролактинемии лежит нарушение тонического дофаминергического ингибирующего контроля секреции ПЛ, вызванного дисфункцией гипоталамуса. Непрерывная стимуляция секреции ПЛ приводит сначала к гиперплазии пролактофоров, а затем и к формированию микро- и макроаденом (пролактином) гипофиза.
Гиперпролактинемия и нарушение менструальной функции могут возникать при частых выскабливаниях слизистой тела матки или после ручного обследования стенок послеродовой матки. В этих случаях повышенное выделение ПЛ является следствием повреждения внутриматочных рецепторов.
Опухоли, воспалительные процессы, артериовенозные аномалии в области гипоталамуса могут нарушать синтез и/или выделение дофамина из тубероинфундибулярных нейронов. Повреждение ножки гипофиза опухолью, при травмах, воспалительных процессах нарушает транспорт дофамина в гипофиз.
Каким образом гиперпролактинемия нарушает функцию репродуктивной системы?
Повышенная секреция ПЛ, помимо поддержания патологической лактации, нарушает репродуктивную функцию у женщин следующим образом:
- путем непосредственного влияния на яичники: высокая концентрация ПЛ вызывает недостаточность желтого тела, что сопровождается снижением секреции прогестерона. В то же
время ПЛ, конкурентно связываясь с рецепторами гонадотропинов на уровне яичников, тормозит влияние гонадотропинов на стероидогенез и снижает чувствительность яичников к экзо- генным и эндогенным гонадотропинам;
- гиперпролактинемия тормозит гонадотропинсекретирующую функцию гипофиза, блокируя спонтанный пик секреции ЛГ;
- снижая чувствительность гипоталамуса к эстрогенам, гиперпролактинемия ингибирует выделение рилизинг-гормон люте- инизирующего гормона (РГ ЛГ).
Какие клинические симптомы характерны для гиперпролактинемии?
Одним из основных симптомов является галакторея - от единичных капель молозива до струйного отделения молока.
Гиперпролактинемия почти всегда сопровождается изменением функции яичников, которое может проявляться в виде ановуляции, недостаточности лютеиновой фазы, нерегулярных менструаций или аменореи.
Наряду с патологической лактацией и нарушением менструального цикла отмечают также бесплодие, снижение libido, нередко - ожирение.
Какие формы гиперпролактинемии выделяют в зависимости от клинических проявлений?
В зависимости от клинических проявлений выделяют следующие формы синдрома гиперпролактинемии, галактореи и нарушения менструальной функции:
- галакторея, олиго-или аменорея в сочетаниис опухолью гипофиза;
- галакторея, олигоили аменорея без аденомы гипофиза, так называемая функциональная форма;
- послеродовая галакторея-аменорея, или синдром Киари-Фром- меля;
- галакторея, олигоменорея и признаки первичного гипотиреоза.
Какие клинические симптомы отмечаются при галакторее-гипотиреозе?
При галакторее-гипотиреозе отмечаются слабость, утомляемость, замедление психической реакции, зябкость, запор, сонливость, сухость кожи, ломкость ногтей.
Иногда первым признаком скрытого гипотиреоза может быть спонтанная галакторея. Сочетание аденомы гипофиза с первичным гипотиреозом и галактореей, а также нарушениями менструальной функции встречается редко.
Каковы методы диагностики синдрома гиперпролактинемии?
Прежде всего используют определение исходного уровня ПЛ. Установлено, что у 95% больных с неопухолевым генезом гиперпро- лактинемии уровень ПЛ не превышает 2000 мМЕ/л. При опухолевом генезе заболевания уровень ПЛ выше 2000 мМЕ/л. Уровень ПЛ при микроаденоме ниже, чем при макроаденоме. Уровень ЛГ и ФСГ, как правило, снижен.
Каковы дополнительные методы диагностики опухоли гипофиза?
С целью диагностики опухоли гипофиза необходим рентгеновский снимок турецкого седла.
Ранними рентгенологическими симптомами развития опухоли гипофиза являются локальный или тотальный ОП стенок турецкого седла, неровность участка внутреннего контура его костной стенки при неизмененной структуре костей свода черепа.
Существенную помощь в диагностике микроаденом оказывает компьютерная томография, особенно с применением методики усиления с введением контрастного вещества. При помощи этой методики удается диагностировать так называемое «пустое» турецкое седло, которое нередко обнаруживают у больных с галактореей и различными нарушениями менструального цикла. В норме цереброспинальная жидкость не попадает в область турецкого седла благодаря диафрагме, закрывающей вход в седло. Первичное «пустое» турецкое седло формируется при недостаточности диафрагмы седла или повышении давления цереброспинальной жидкости. Вторичное «пустое» турецкое седло возникает при арахноидальных кистах, инфарктах, неврозах, гуммах и гранулемах гипофиза, а также после хирургического или лучевого лечения опухолей гипофиза.
Методами диагностики «пустого» турецкого седла являются также пневмоэнцефалография и контрастная энцефалография, при которых полость седла в той или иной степени заполняется газом или контрас- тным веществом.
Какие диагностические тесты применяют
для дифференциальной диагностики физиологической
и патологической гиперпролактинемии?
Существуют диагностические тесты (с агонистами и антагонистами дофамина), которые позволяют отличить физиологическую гиперпролактинемию от патологической.
Проба с тиролиберином. Препарат вводят внутривенно в дозе от 200 до 500 мкг. У здоровых женщин нормальной реакцией считается удвоение уровня Прл по сравнению с исходным через 15 мин. после введения тиролиберина. При гиперпролактинемии неопухолевого генеза отмечается небольшое повышение содержания Прл, а при опухоли гипофиза уровень Прл не меняется. Многими специалистами признано, что диагностическая ценность данного метода невелика.
Проба с метоклопрамидом (церукалом). Метоклопрамид - антагонист дофамина. С этим препаратом связывают надежду на разработку критериев дифференциации гипепролактинемии опухолевого и гипо- таламического генеза. При внутривенном введении 10 мг препарата у здоровых женщин через 1-2 ч уровень Прл в крови повышается в 7-10 раз. При пролактиноме гипофиза уровень Прл практически не меняется, а при функциональной гиперпролактинемии реакция ослаблена.
Проба с парлоделом. Парлодел - агонист дофамина, тормозит секрецию Прл, действуя преимущественно на уровне гипофизарных пролактофоров. Препарат принимают утром натощак однократно в дозе 2,5 или 5 мг, после чего исследуют уровень Прл в течение первых 2-4 ч. У здоровых лиц в норме уровень Прл резко снижается, при опухоли реакция отсутствует, при функциональной гиперпролактинемии реакция ослаблена.
Диагностика синдрома галактореи-аменореи-гипотиреоза основывается на клинической картине гипотиреоза, а также снижении уровня трийодтиронина и общего тироксина, а также повышении ТТГ.
Какие применяются методы лечения гиперпролактинемии?
Лечение больных с гиперпролактинемией и различными нарушениями менструальной функции может быть хирургическим и консервативным (медикаментозным) и зависит от причины заболевания. При макроаденоме гипофиза и гиперпролактинемии лечение в основном направлено на разрушение или подавление активности аденомы гипофиза (хирургические или лучевые методы воздействия).
Как охарактеризовать понятие «хирургическое выздоровление»?
Понятие хирургического выздоровления означает нормализацию уровня Прл в течение 2 ч после операции и появление овуляции в последующие 40 дней. Частота наступления беременности после хирургического лечения составляет 40%. Быстрая нормализация уровня Прл сопровождается нормализацией регуляции его секреции. Это проявляется повышением уровня Прл под влиянием введения тиролиберина и появлением пика секреции Прл во время ночного сна. Отмечено, однако, что в некоторых случаях секреция Прл реагирует на введение тиролиберина и метоклопрамида только спустя 6-12 мес после операции.
Какие консервативные (медикаментозные)
методы лечения применяют при гиперпролактинемии?
В настоящее время для лечения больных гиперпролактинемией используют ряд блокаторов и стимуляторов биогенных аминов, участвующих в регуляции секреции ПЛ. Одним из наиболее эффективных препаратов, способствующих подавлению повышенной продукции ПЛ, является парлодел (бромкриптин, СВ-154) - полусинтетический алкалоид спорыньи. Механизм действия препарата заключается в стимуляции рецепторов дофамина. Парлодел также восстанавливает циклическую секрецию гонадотропинов, нормализует их гипофизарный резерв, реакцию на РГ ЛГ и способствует нормализации эндогенной секреции гонадотропин-рилизинг-гормона.
Какой метод лечения применяют
при пролактинсекретирующих аденомах гипофиза?
Препаратом выбора при этом является парлодел благодаря его выраженному антипролиферативному влиянию. Обычно препарат парлодел назначают по следующей схеме: 0,8 мг (1/3 таблетки) - 3 дня; 1,25 мг (1/2 таблетки - 3 дня; 2,5 мг (1 таблетка) - 3 нед, через 1 мес. определяют уровень пролактина. При его повышении принимают дополнительно по 1 таблетке в течение 4 нед. Иногда для восстановления овуляторного менструального цикла требуется увеличение суточной дозы до 7,5 мг. Прием препарата контролируется определением уровня Прл в сыворотке крови и базальной температуры. Лечение продолжается до нормализации уровня ПЛ.
Какое лечение проводят
при синдроме галактореи-аменореи
неопухолевого генеза?
Для лечения синдрома галактореи-аменореи неопухолевого генеза используют парлодел. При этих формах синдрома суточные дозы препарата составляют 5,0-7,5 мг. Лечение приводит к быстрому восста- новлению менструального цикла и овуляции. Через 3-4 нед от начала лечения, как правило, лактация прекращается и восстанавливается менструальный цикл. Беременность наступает через 1-3 мес от начала лечения у 70,6-80,0 % больных.
В тех случаях, когда препарат
недостаточно эффективен для восстановления овуляторных менструальных
циклов (НЛФ, ановуляция), наряду с его использованием назначают
кломифен по 50-100 мг с 5-го по 9-й день менструального цикла. При
отсутствии эффекта применяют парлодел в сочетании с кломифеном и ХГЧ.
ХГЧ вводят по 1500-3000 ЕД на 2-6-й день повышения базальной
температуры или 6000-10 000 ЕД при достижении фолликулом диаметра около
Какое лечение проводят больным с синдромом галактореи, нарушениями менструального цикла и явлениями первичного гипотиреоза?
Лечение проводят препаратами тиреоидных гормонов: тиреоидином (
Каков прогноз при функциональной гиперпролактинемии?
Прогноз при функциональной гиперпролактинемии, как правило, благоприятный.
4.3. ПОЛИКИСТОЗНЫЕ ЯИЧНИКИ
Что понимают под термином «поликистозные яичники»?
В настоящее время общепринят термин «поликистозные яичники». Под этим термином понимают патологию структуры и функции яичников на фоне нейрообменных нарушений. В яичниках повышается образование андрогенов, нарушается процесс фолликулогенеза. Из нейрообменных эндокринных нарушений наиболее постоянны ановуляция, гипертрихоз, ожирение.
Какие виды поликистозных яичников различают?
Различают первичные ПКЯ (истинные), или болезнь ПКЯ (БПКЯ), или синдром Штейна-Левенталя, и вторичные ПКЯ, или синдром ПКЯ (СПКЯ).
4.4. БОЛЕЗНЬ ПОЛИКИСТОЗНЫХ ЯИЧНИКОВ
Каков патогенез БПКЯ?
БПКЯ - мультифакторная патология, в патогенез которой включаются регулирующие механизмы (секреция РГ ЛГ и выделение тропных гормонов гипофиза) и местные факторы, участвующие в процессе синтеза стероидов яичников. Результатом являются структурные изменения яичников, гиперандрогения и относительная гиперэстрогения, определяющие клиническую симптоматику. Давно известно сочетание БПКЯ и ожирения, однако примерно у половины женщин при этой патологии превышения массы тела не отмечают. В этой связи предложены два патогенетических варианта БПКЯ у женщин с ожирением и нормальной массой тела.
Чем характеризуется патогенетический вариант БПКЯ с ожирением?
При ожирении имеется резистентность к инсулину, результатом которой является гиперинсулинемия. Тека-клетки яичников имеют рецепторы к инсулину, кроме того, инсулин повышает образование инсулиноподобного фактора роста-1 (ИПФР-1), усиливающего синтез андрогенов в клетках тека и интерстициальной ткани яичников. Инсулин, помимо этого, снижает уровень стероидсвязывающего гло-
булина и, следовательно, повышает уровень свободного, биологически активного тестостерона. Роль жировой ткани в метаболизме половых гормонов известна давно. Стромальные клетки жировой ткани обладают ароматазной активностью (содержат энзимы) и способствуют превращению андрогенов в эстрогены (андростендиона в эстрон). Действие этих ферментов усиливается под влиянием инсулина и ИПФР-1.
Каковы особенности патогенеза БПКЯ при нормальной массе тела?
При данном патологическом варианте происходит нарушение цирхорального ритма выделения РГ ЛГ в ядрах клеток медиобазального гипоталамуса. В связи с этим возрастает уровень ЛГ в крови с соответствующим увеличением соотношения ЛГ/ФСГ до 2,5 (в норме не более 1,5). Кроме того, отмечается повышение уровня гормона роста (ГР) в плазме крови, что усиливает образование ИПФР-1 в клетках гранулезы. ИПФР-1 также увеличивает связывание ЛГ тека-клетками ткани яичников. Оба процесса стимулируют синтез андрогенов яич- никами.
Чем характеризуется конечный этап двух патогенетических вариантов БПКЯ?
В двух патогенетических вариантах БПКЯ конечным этапом является усиление синтеза андрогенов в тека-клетках и интерстициальной ткани яичников. В первом - процесс инициирует инсулин, во втором - ГР ЛГ. Андрогены способствуют процессу атрезии фолликулов, характерному для БПКЯ. В процессе атрезии участвуют и другие факторы роста (эпидермальный фактор роста, интерлейкин-1). В обоих случаях создается метаболический порочный круг, приводящий к ановуляции, бесплодию, нарушению цикла, гипертрихозу, а также структурным изменениям яичников.
Чем характеризуется клиническая картина БПКЯ?
Основными клиническими симптомами БПКЯ (первичных ПКЯ) при своевременном менархе (в 12-13 лет) являются:
- нарушение менструальной функции по типу олигоаменореи с менархе;
- увеличение размеров яичников;
- первичное бесплодие;
- повышение массы тела у 50% женщин;
- гипертрихоз с менархе.
Каковы особенности морфотипа и ожирения?
Морфотип всегда женский. Распределение жировой ткани равномерное, имеет универсальный характер. Молочные железы развиты правильно, без признаков гипоплазии.
Каков характер нарушений менструального цикла при первичных ПКЯ?
Нарушение менструальной функции начинается с менархе, возраст наступления менархе, как и в популяции, приходится на 12- 13 лет. После менархе регулярный цикл не устанавливается, развивается олигоменорея. У 10-17% девушек и молодых женщин отмечаются ациклические маточные кровотечения, причиной которых является длительное монотонное влияние эстрогенов на эндометрий на фоне снижения секреции прогестерона и отсутствия секреторной трансформации. Гиперплазия эндометрия наблюдается также при отсутствии маточных кровотечений на фоне олиго- и аменореи.
Каков характер бесплодия при первичных ПКЯ?
Бесплодие всегда имеет первичный характер, поскольку нарушение функции начинается с момента пубертатной активации функции яичников. Первичное бесплодие - основной признак БПКЯ.
Каковы особенности гипертрихоза при БПКЯ?
Гипертрихоз обычно нерезко выражен. Стержневые волосы расположены на голени, задней поверхности бедер, промежности, реже на белой линии живота. Оволосение лица обычно ограничивается «усиками» над верхней губой.
Каковы особенности яичников при БПКЯ?
Основным макроскопическим признаком БПКЯ является двустороннее увеличение яичников, в 2-6 раз превышающее их нормаль- ные размеры, с наличием множественных кистозно-атрезирующихся фолликулов. Поверхность яичников сглажена, следов овуляции нет,
капсула плотная, белесоватая, с перламутровым оттенком, при осмотре невооруженным глазом представляется утолщенной. Капсула настолько утолщена, что фолликулярные кисточки иногда не просвечивают через нее, что является важным диагностическим признаком первичных ПКЯ при лапароскопии. На капсуле расположены мелкие древовидно ветвящиеся сосуды. На разрезе определяется резко утолщенная капсула - плотная сероватая строма, в которой ближе к периферии расположены мелкие фолликулярные кисточки.
Каковы методы диагностики БПКЯ?
К методам диагностики БПКЯ относятся:
- клинические данные;
- УЗИ;
- гормональные исследования;
- лапароскопия;
- морфологическое исследование.
На каких основных клинических симптомах основывается диагностика БПКЯ?
Диагностика БПКЯ основывается на следующих данных:
- нарушенияменструальногоцикла(чащеолигоменорея)сменархе;
- гипертрихоз с менархе;
- телосложение женского типа;
- первичное бесплодие;
- часто универсальное ожирение.
Каковы особенности эхографии при БПКЯ?
Эхографическими критериями БПКЯ являются:
- увеличение размеров яичников в объеме более 9 см3 (табл. 4.1);
- наличие 8-10 фолликулярных кист диаметром 3-8 мм;
- увеличение стромальной плотности.
Таблица 4.1. Эхографические размеры поликистозных яичников (см)
Изучаемые параметры | ПКЯ | Нормальные яичники |
Длина | 3,9?0,5 | 3,2?0,4 |
Толщина | 2,6?0,6 | 1,8?0,3 |
Ширина | 3,6?0,4 | 2,9?0,5 |
Какие гормональные изменения характерны для БПКЯ?
Для БПКЯ патогномонично увеличение отношения ЛГ к ФСГ до 3:1. Однократное определение гормонов и их метаболитов в крови и моче малоинформативно, поскольку не указывает на источник андрогенов, поэтому гормональное исследование необходимо проводить на фоне гормональных проб с дексаметазоном. Для БПКЯ характерно умеренное повышение уровня тестостерона в крови при содержании 17-ОНП и ДЭА в пределах нормы. 17-КС в моче умеренно повышены. После пробы с дексаметазоном содержание тестостерона незначительно снижается (не более чем на 20-25%), уровни 17-ОНП и ДЭА остаются без изменений. Незначительно уменьшается также и содержание 17-КС в суточной моче.
Каковы особенности первичных ПКЯ при лапароскопическом исследовании?
Типичная
картина первичных ПКЯ: сглаженная белесоватая капсула, на поверхности
которой видны древовидно-ветвящиеся мелкие сосуды, увеличение размеров
яичников до 5-6 см в длину и
Что характерно для гистологической картины БПКЯ?
Для гистологической картины БПКЯ характерны:
- склероз белочной оболочки (капсулы) яичников с ее утолщением до 600 мкм;
- гиперплазия стромы яичников;
- кистозная атрезия фолликулов;
- гиперплазия (иногда с лютеинизацией) клеток внутренней оболочки (тека-клеток) кистозно-атрезирующихся фолликулов;
- отсутствие желтых тел.
С какими заболеваниями проводят дифференциальную диагностику первичных ПКЯ?
Дифференциальную диагностику первичных ПКЯ проводят с постпубертатной формой АГС, нейрообменно-эндокринным синдромом.
Какова цель лечения первичных ПКЯ и какие методы лечения применяются?
Лечение первичных ПКЯ направлено на восстановление фертильности и профилактику гиперпластических процессов эндометрия, в том числе и аденокарциномы. В современной клинике используют консервативные и оперативные методы лечения.
Какое лечение проводят с целью восстановления фертильности?
С этой целью применяют препараты, индуцирующие овуляцию. Для индукции овуляции назначают кломифен, относящийся к антиэстрогенам. Механизм его действия заключается в блокаде эстрадиоловых рецепторов на уровне гипоталамуса, благодаря чему прерываются сигналы отрицательной обратной связи между яичником и передней долей гипофиза, поэтому после отмены кломифена происходит выброс ЛГ и ФСГ. Увеличение уровня ФСГ стимулирует созревание фолликулов, а увеличение синтеза эстрадиола в его гранулезных клетках является сигналом положительной обратной связи для овуляторного выброса ЛГ. Таким образом, в реализации лечебного эффекта кломифена играют роль механизмы положительной и отрицательной обратной связи. Кломифен назначают в дозе 50-150 мг/сут с 5-го по 9-й день менструального цикла.
Контролем действия кломифена является также определение Е2 на 10-11-й и прогестерона на 22-24-й день цикла; с помощью эхо- графии яичников проводят динамическое наблюдение за появлением и увеличением размеров доминантного фолликула. Наиболее простой метод контроля - измерение базальной температуры, характер которой позволяет оценить функцию яичников и регулировать дозу кломифена.
Эффективность лечения кломифеном оценивают по наступлению овуляции, которая отмечается примерно в 75-80% случаев; беремен- ность регистрируется значительно реже - у 45-50% пациенток; частота многоплодной беременности составляет 1,25-8%.
При проявлениях антиэстрогенного действия кломифена (приливы, уменьшение количества цервикальной слизи) рекомендуется с 9-го по 15-й день условного менструального цикла принимать эстрогенсодержащие препараты, например этинилэстрадиол, по 0,025 мг в день.
Какие еще препараты применяют для стимуляции овуляции?
С целью стимуляции овуляции применяют гонадотропный гормон ФСГ - метродин (пурегон), так как при БПКЯ снижен уровень ФСГ. Препарат рекомендуется вводить с 3-го или 5-го дня менструальных выделений по 75 ЕД (1 ампула) в день в течение 5-7 дней под контролем эхографии, определяя размеры доминантного фолликула. При достижении им размеров 18-20 мм вводят препарат хорионического гонадотропина (профази или прегнил) в дозе 10 000 ЕД. Если указанная доза метродина не вызывает развития доминантного фолликула, ее увеличивают до 150-225 ЕД в день.
Применяют РГ ЛГ в пульсирующем цирхоральном режиме - 1 раз в час. Частота овуляции и наступление беременности колеблются от
80 до 95%.
Какие препараты применяют с целью профилактики гиперпластических процессов эндометрия?
С этой целью применяют комбинированные эстроген-гестагенные препараты (оральные контрацептивы) для подавления повышенного уровня гонадотропинов и торможения пролиферации эндометрия. Применение комбинированных гормональных контрацептивов по стандартной схеме в течение 6-8 мес в циклическом режиме не только подавляет пролиферацию эндометрия, но и уменьшает гипертрихоз. Этот эффект достигается торможением синтеза андрогенов в яичниках.
Предпочтение стоит отдавать препаратам 3-го поколения, содержащим прогестагены с выраженным антигонадотропным действием (дезогестрел). Например, при использовании марвелона эффективно подавляется синтез ЛГ гипофизом и андрогенов в яичниках, и, как следствие, уменьшаются морфологические и клинические симптомы
СПКЯ.
В последние годы представлены исследования о целесообразности пролонгированного режима приема КОК, поскольку при циклическом режиме в период отмены КОК восстанавливается гонадотропная функция, а, следовательно, рост фолликулов и синтез половых стероидов. При использовании КОК в непрерывном режиме имеет место более стойкое торможение секреции гонадотропных и яичниковых гормонов. В исследовании Ruchhoft с соавторами (1996) было показано, что при
использовании марвелона в пролонгированном режиме (63 активные таблетки с последующим 7-дневным перерывом) наблюдается более выраженное снижение ФСГ, стойкое подавление ЛГ и тестостерона, сходное с применением аГнРГ.
Кроме того, для трансформации эндометрия из фазы пролиферации в фазу секреции принимают гестагены с 16-го дня менструального цикла в течение 10 дней.
Как проводят лечение ожирения?
Поскольку жировая ткань играет особую роль в патогенезе БПКЯ, обязательным этапом терапии является лечение ожирения. Снижение массы тела на фоне диеты (общая калорийность пищи до 2000 ккал в день) приводит к нормализации углеводного и жирового обмена. В случае отсутствия эффекта применяют препарат из класса бигуанидов - метформин, повышающий чувствительность периферических тканей к инсулину. Метформин снижает периферическую инсулинорезистентность, улучшая утилизацию глюкозы в печени, мышцах и жировой ткани; нормализует липидный профиль крови, снижая уровень триглицеридов и ЛПНП. Препарат назначают по 1000-1500 мг в сут в течение 3-6 мес под контролем глюкозотолерантного теста. После нормализации массы тела проводят стимуляцию овуляции при исключении трубного и мужского фактора бесплодия.
Какие существуют показания к оперативному лечению БПКЯ?
Показаниями к оперативному лечению являются:
- бесплодие, отсутствие эффекта от консервативного лечения;
- гиперпластический процесс эндометрия (редуцирующая железисто-кистозная, атипическая гиперплазия эндометрия).
Какие методы оперативного лечения применяют при БПКЯ?
Применяют следующие методы оперативного лечения:
- клиновидную резекцию яичников (удаляют до 1/2 ткани яичника с частичной демедуляцией, т.е. удаление в доступных пределах и мозгового слоя яичника);
- электрокаутеризация и термокаутеризация яичников (на каждый яичник наносят 6-8 пунктур).
Каким методом производят операции?
Эти операции выполняют эндоскопическим методом. Его преимуществом являются укорочение времени операции, сокращение пребывания в стационаре до 2-3 дней, а также отсутствие спаек в малом тазу, которые могут быть причиной перитонеального бесплодия.
В чем заключается лечебный эффект этих операций?
Лечебный эффект обусловлен снятием угнетения гипоталамических центров андрогенами вследствие удаления ткани яичников, являю- щихся источником избыточной продукции андрогенов.
Что свидетельствует об эффективности оперативного лечения при БПКЯ?
Косвенным свидетельством эффективности операции служит появление менструальноподобных выделений через 2-3 дня после вмешательства; о произошедшей овуляции свидетельствует подъем базальной температуры через 14-16 дней после операции.
Какова эффективность оперативного лечения при БПКЯ?
У 80% оперированных восстанавливается регулярный менструальный цикл, у 60% - наступает беременность в первые 6 мес после операции.
Какова длительность эффективности хирургического лечения?
Фертильность снижается уже в конце первого года после операции, и через 3-5 лет восстанавливается стойкая ановуляция, поэтому оперированные женщины нуждаются в диспансерном наблюдении. Стимуляция овуляции кломифеном и другими препаратами, о которых сказано выше, рекомендуется в первые месяцы после оперативного вмешательства, если после него сохраняется ановуляция или недостаточность второй фазы менструального цикла.
4.5. СИНДРОМ ПОЛИКИСТОЗНЫХ ЯИЧНИКОВ (ВТОРИЧНЫЕ ПОЛИКИСТОЗНЫЕ ЯИЧНИКИ)
Что означают вторичные ПКЯ?
Вторичные ПКЯ - результат хронической ановуляции. В гинекологической практике вторичные ПКЯ встречаются у женщин с надпочечниковой гиперандрогенией, гиперпролактинемией, нейрообменно-эндокринным синдромом, связанным и не связанным с беременностью.
4.6. ПОЛИКИСТОЗНЫЕ ЯИЧНИКИ НА ФОНЕ НАДПОЧЕЧНИКОВОЙ ГИПЕРАНДРОГЕНИИ
Чем характеризуются ПКЯ при врожденном адреногенитальном синдроме?
При врожденном АГС, сопровождающемся высоким содержанием андрогенов в крови и грубой вирилизацией (гетеросексуальное пре- ждевременное половое развитие, увеличение клитора, персистенция урогенитального синуса, вирильный гипертрихоз), яичники уменьшены в размерах и содержат множество примордиальных, преантральных и антральных фолликулов, которые не достигают величины овуляторного. Эти изменения являются следствием торможения нормального развития яичников в препубертатном возрасте под влиянием высокого уровня андрогенов надпочечников.
Каков патогенез ПКЯ у женщин с постпубертатным АГС?
Увеличение синтеза андрогенов в надпочечниках нарушает процесс фолликулогенеза и синтез эстрогенов в яичниках, развитие антральных и преовуляторных фолликулов затруднено, синтез андрогенов в яичниках возрастает, развивается процесс кистозной атрезии фолликулов. Снижение синтеза эстрогенов и увеличение синтеза ингибина вызывают уменьшение выделения ФСГ и увеличение выделения ЛГ аденогипофизом. Эти изменения, в свою очередь, приводят к развитию ПКЯ, однако нарушение выбросов ФСГ и ЛГ не столь выражено, как при первичных ПКЯ, и периодически возможны созревание фолликула и даже овуляция. Кроме того, экстрагонадный синтез эстрогенов,
характерный для первичных ПКЯ, не повышается, поскольку у женщин с АГС масса тела не повышена.
Чем характеризуется клиника синдрома ПКЯ на фоне постпубертатной формы АГС?
Основными клиническими симптомами синдрома ПКЯ на фоне надпочечниковой гиперандрогении (постпубертатная форма АГС) являются:
- развитие гипертрихоза до менархе;
- позднее менархе (после 14-15 лет);
- нарушение менструальной функции по типу олигоменореи;
- телосложение приближается к мужскому;
- вторичное бесплодие.
Каков характер оволосения при синдроме ПКЯ?
Оволосение носит избыточный характер, нередко выражено более интенсивно, чем у женщин с БПКЯ, гипертрихоз распространяется на внутреннюю поверхность бедер, промежность, низ живота; на лице появляются стержневые волосы не только над верхней губой, но и на щеках («бакенбарды») и на подбородке.
Каковы особенности телосложения при ПКЯ?
Фенотип женщин характеризуется нерезко выраженными чертами вирилизации: незначительное сужение размеров таза - в основном межвертельного и увеличение ширины плеч за счет величины межа- кромиального размера. Такое телосложение можно охарактеризовать термином «спортивный тип». Превышения массы тела не наблюдается, особенно у молодых женщин. Молочные железы слегка гипопластичны.
Как изменяются размеры яичников при синдроме ПКЯ на фоне надпочечниковой гиперандрогении?
Размеры яичников, как правило, не достигают такой величины, как при первичных ПКЯ, увеличение их часто бывает асимметричным. При макроскопическом исследовании капсула яичников не столь резко утолщена, как при первичных ПКЯ, о чем свидетельствует просвечивание множественных фолликулярных кист.
Каковы основные отличия синдрома ПКЯ на фоне надпочечниковой гиперандрогении от первичных ПКЯ?
При синдроме ПКЯ возможны овуляция и наступление беременности; чрезвычайно редко возникают гиперпластические процессы эндометрия.
Какие существуют методы диагностики синдрома ПКЯ на фоне надпочечниковой гиперандрогении?
К методам диагностики синдрома ПКЯ относятся:
- клинические данные;
- эхография;
- гормональные исследования;
- морфологическое исследование.
Каковы особенности эхографии при синдроме ПКЯ?
При эхографии малого таза у женщин с надпочечниковой формой ПКЯ определяется незначительное асимметричное увеличение яичников в сочетании с умеренной гипоплазией матки.
Какие гормональные изменения возникают при синдроме ПКЯ на фоне надпочечниковой гиперандрогении?
Отмечается увеличение содержания 17-ОНП, ДЭА в крови и 17-КС в моче.
Какова морфологическая картина при синдроме ПКЯ?
При микроскопическом исследовании характерны неравномерное утолщение капсулы, нерезко выраженная гиперплазия стромы, атре- зирующиеся фолликулы, белые и изредка желтые тела.
С какими заболеваниями проводят дифференциальную диагностику синдрома ПКЯ?
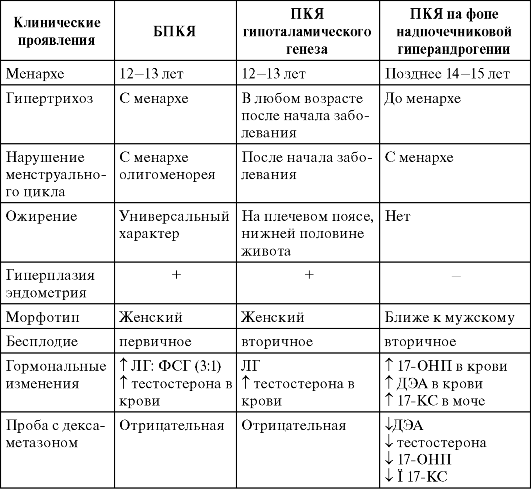
Дифференциальную диагностику синдрома ПКЯ на фоне надпочечниковой гиперандрогении проводят с БПКЯ (табл. 4.2).
Таблица 4.2. Дифференциальная диагностика различных форм ПКЯ
Какое лечение рекомендуется при синдроме ПКЯ на фоне надпочечниковой гиперандрогении?
Для коррекции нарушений гормональной функции коры надпочечников используют глюкокортикоидные препараты.
Принцип лечения АГС - подавление выделения АКТГ передней долей гипофиза препаратами глюкокортикоидного ряда. Чаще всего применяют дексаметазон. Дозу препарата определяют под контролем содержания 17-КС в моче, тестостерона, ДЭА и 17-ОНП в крови, уровень которых на фоне приема дексаметазона не должен превышать верхней границы нормы. Укорочение интервалов между менструациями, появление двухфазной температуры служат достоверными признаками эффективности лечения.
Какое лечение проводят при отсутствии овуляции или при недостаточности желтого тела?
При отсутствии полноценной второй фазы менструального цикла, кроме глюкокортикоидных препаратов, назначают кломифен по общепринятой схеме по 50-150 мг в день с 5-го по 9-й день цикла. На фоне такого сочетанного лечения у женщин часто наступает беременность. После наступления беременности терапию глюкокортикоидными препаратами прерывать не следует во избежание самопроизвольного выкидыша или прекращения развития оплодотворенной яйцеклетки.
Клиновидная резекция, как правило, неэффективна, поскольку нарушение функции надпочечников не устраняется.
Какие препараты применяют для лечения гипертрихоза?
Для лечения гипертрихоза успешно применяют ципротерона ацетат (андрокур) независимо от источника образования андрогенов. Препарат тормозит образование дигидротестостерона из тестостерона в волосяных фолликулах, блокируя цитозол-рецепторы тестостерона. Препарат назначают в дозе 50-150 мг в сут в течение длительного времени - с 5-го по 25-й день цикла (4-6 мес). Еще более эффективны в лечении гипертрихоза комбинированные препараты, содержащие ципротерона ацетат, дроспиренон и диеногест, входящие в состав КОК: «Диане-35» (этинилэстрадиол 35 мг и ципротерон 2 мг в 1 драже), «Жанин» (этинилэстрадиол 30 мг и диеногест 2 мг в 1 драже), «Ярина» (этинилэстрадиол 35 мг и дроспиренон 3 мг в 1 драже). Благодаря содержанию этинилэстрадиола препарат регулирует менструальный цикл. Препараты назначают с 5-го по 25-й день цикла. В течение 4- 6 мес подавляется рост волос на лице и туловище, ликвидируются такие проявления гиперандрогении, как жирная себорея и угревая сыпь.
Антиандрогенными свойствами обладает верошпирон (спиролактон). Механизм его действия также заключается в подавлении образования дигидротестостерона из тестостерона в коже, волосяных фолликулах и сальных железах. Лечение верошпироном проводят в течение 4-6 мес по 25 мг 2 раза в день.
Вторичные поликистозные яичники у женщин с нейрообменно-эндокринным синдромом.
В отечественной литературе эта форма описана как ПКЯ «центрального генеза».
Каков патогенез развития ПКЯ
при гипоталамических нарушениях?
Патогенез можно представить следующим образом: нарушение образования и выделения нейротрансмиттеров (дофамина - ДА и ЭНД) в надгипоталамической области передних и/или медиобазальных структурах гипоталамуса вследствие инфекции, интоксикации, эмоционального, психического стресса, беременности изменяет ритм выделения РГ ЛГ и выброса ЛГ из клеток передней доли гипофиза. Следствием этого является ановуляторная дисфункция яичников с нарушением процесса фолликулогенеза. Далее включаются патогенетические механизмы, сходные с таковыми при первичных ПКЯ: увеличение синтеза андрогенов в клетках оболочки фолликула и стромы яичников, вторичный дефицит ароматазной активности. В результате закрепляется нарушение выбросов ЛГ и ФСГ, развиваются гиперплазия стромы и кистозная атрезия фолликулов, яичников, которые макроскопически приобретают черты, весьма сходные с таковыми при БПКЯ.
Что может послужить причиной развития ПКЯ «центрального генеза»?
Для анамнеза женщин с ПКЯ на фоне нейроэндокринного синдрома характерна четкая граница начала заболевания:
- ангины, аденовирусные инфекции (чаще всего в пубертатном возрасте);
- эмоционально-психические травмы;
- роды, аборты (искусственные или самопроизвольные);
- начало половой жизни.
Какова клиническая характеристика ПКЯ «центрального генеза»?
Для данной патологии характерны следующие проявления диэнцефальных (гипоталамических) нарушений:
- вегетососудистая дистония обычно по гипертоническому типу;
- повышение аппетита;
- жажда;
- нарушение сна и бодрствования;
- эмоциональные нарушения (раздражительность, плаксивость);
- ожирение III-IV степени;
- нарушение менструальной функции;
- вторичное бесплодие;
- гипертрихоз;
- гиперпластические процессы эндометрия.
Каков характер ожирения при ПКЯ
на фоне нейрообменно-эндокринного синдрома?
Ожирение имеет специфический характер: жировая ткань локализуется на плечевом поясе и нижней половине живота. Молочные железы даже у молодых нерожавших женщин отвислые за счет большого содержания жировой ткани.
Какие нарушения менструальной функции возникают при ПКЯ на фоне нейрообменно-эндокринного синдрома?
Менархе у этих пациенток обычно наступает в те же сроки, что и в популяции (12-13 лет). В пубертатном периоде менструальный цикл имеет нередко так называемый неустойчивый характер, интервалы между менструациями составляют 21-36 дней; летом часто отмечаются более длительные интервалы - до 1,5-2,0 мес. Нарушения менструального цикла чаще по типу олигоменореи развиваются позже, как правило, после перечисленных причин. Обычно отмечается вторичное бесплодие (ановуляторное), ановуляция формируется через стадию недостаточности желтого тела.
Когда возникает гипертрихоз при ПКЯ на фоне нейроэндокринного синдрома?
Гипертрихоз при этом заболевании развивается на фоне олигоменореи и выраженном ожирении.
Как часто возникает гиперпластический процесс в эндометрии?
Частота гиперпластических процессов и предрака эндометрия не отличается от таковых у женщин с первичными ПКЯ.
На чем основывается диагностика синдрома ПКЯ гипоталамического генеза?
Диагностика синдрома ПКЯ гипоталамического генеза основывается на следующих признаках:
- заболевание развивается после нейроинфекции, интоксикации, осложненной беременности или родов;
- множественные вегетососудистые, обменно-эндо-кринные нарушения;
- нарушения менструального цикла от аменореи до ациклических кровотечений;
- вторичное бесплодие;
- специфическое ожирение с преимущественным отложением жира на плечевом поясе и нижней половине живота часто в сочетании с полосами растяжения.
С какими заболеваниями проводят дифференциальный диагноз?
Дифференциальный диагноз проводят с БПКЯ (первичные ПКЯ) и ПКЯ на фоне надпочечниковой гиперандрогении (см. табл. 4.2).
Каковы принципы лечения
при ПКЯ гипоталамического генеза?
Лечение следует начинать с коррекции метаболических нарушений, снижения массы тела на 12-15%.
После снижения массы тела на 12-15% у женщин восстанавливается регулярный менструальный цикл, причем у 2/3 из них - овуляторный;
Клиновидная резекция яичников у больных с гипоталамической формой ПКЯ показана при рецидивирующих гиперпластических процессах эндометрия.
Для лечения гипертрихоза применяют «Диане-35», «Жанин», «Ярина», верошпирон (антиандрогенное действие).
4.7. ПАТОЛОГИЯ ПЕРИМЕНОПАУЗАЛЬНОГО ПЕРИОДА
Что представляет собой климактерический период?
Климактерический (переходный) период (КП) в жизни женщины наступает после репродуктивного периода. Климактерий (от греч. climax - лестница, переход, что-то неустойчивое, преходящее; отсюда и слово «климакс») - период, отражающий неизбежные процессы старения организма. Знание физиологических и патологических процессов, возникающих в переходном, климактерическом периоде жизни жен-
щины, крайне важно, так как оно позволяет обоснованно проводить профилактику и лечение некоторых заболеваний, характерных именно для этого периода жизни.
Какие термины используют
при описании климактерического периода?
При описании климактерического периода применяют следующие термины:
- пременопаузальный период - от 45 лет до наступления менопаузы;
- менопауза - последняя менструация в жизни женщины, которая наступает в среднем возрасте 50,8 года;
- постменопаузальный период (постменопауза) начинается после менопаузы и длится до смерти женщины;
- перименопаузальный период (перименопауза) - это пременопаузальный период и 2 года после менопаузы.
В каком возрасте наступает менопауза и от чего это зависит?
Средний возраст менопаузы (50,8 года) зависит от популяционных и индивидуальных особенностей. В настоящее время средняя продолжительность жизни женщин в развитых странах составляет 68-77 лет. Таким образом, 1/3 своей жизни женщина проводит в постме- нопаузальном периоде. Следует отметить, что у части женщин менопауза наступает существенно раньше среднепопуляционных показателей. При этом говорят о раннем (40-44 года) или преждевременном (38-40 лет) климаксе. Его причиной чаще всего является истощение овариальных резервов (так называемый синдром истощенных яичников).
Какова частота проявлений климактерических расстройств в зависимости от возраста и тяжести течения заболевания?
Различные по степени тяжести проявления КП встречаются у 40-60% женщин старше 40 лет. Первые его признаки возникают чаще в 45-50 лет - на рубеже пре- и постменопаузы. Кривая появления приливов жара носит волнообразный характер соответственно сезонным изменениям функционального состояния гипоталамических структур.
Первые симптомы заболевания появляются чаще в весеннее (фев- раль-март) или осеннее (сентябрь-октябрь) время года.
Почти у половины женщин с КП отмечается тяжелое течение заболевания (51%), у каждой третьей (33%) его проявления носят умеренный характер и только у 16% женщин КП сопровождается легкими прояв- лениями [В.П. Сметник, Л.Г. Тумилович, 1995]. Более легкое и менее продолжительное течение КС встречается, как правило, у практически здоровых женщин, тогда как у больных с хроническими психосоматическими заболеваниями КС протекает атипично и имеет наклонность к продолжительному течению.
Какие изменения происходят в репродуктивной системе?
В климактерии на фоне возрастных изменений всего организма инволюционные процессы преобладают именно в репродуктивной системе. Они характеризуются сначала прекращением детородной функции, а затем и менструации. Большинство симптомов климактерических расстройств являются следствием прогрессирующего дефицита половых гормонов. Известно, что половые гормоны оказывают влияние на различные органы и ткани, связываясь со специфическими рецепторами. Эти рецепторы, кроме матки и молочных желез, локализуются также в клетках мочеполового тракта, костной ткани, мозга, сердца и артерий, кожи, слизистых оболочках рта, гортани, конъюнктивы и пр.
С чем связаны изменения в репродуктивной системе?
Причиной снижения эстрогенной насыщенности в переходном периоде является постепенное истощение фолликулярных резервов яичников и, следовательно, снижение синтеза половых стероидов (эстрогенов, анд- рогенов, гестагенов), но более всего эстрадиола - наиболее активного эстрогена. Основным источником синтеза эстрогенов в постменопаузе становится внегонадный путь - в периферической жировой клетчатке за счет ароматизации надпочечниковых и отчасти яичниковых андрогенов (андростендиона) в эстрон.
Как меняется уровень гипофизарных гормонов в ответ на снижение уровня эстрогенов?
Снижение уровня секреции эстрогенов в ткани яичников сопровождается повышением (по принципу обратной связи) секреции
ФСГ. В течение первого года после менопаузы уровень содержания ФСГ в плазме периферической крови возрастает в 13 раз, ЛГ - приблизительно в 3 раза.
Какова классификация симптомов климактерических расстройств по времени их появления?
В связи с тем, что возрастное снижение синтеза половых стероидов начинается с 35-41 года, некоторые симптомы переходного периода могут появиться за 5-7 лет до наступления менопаузы (в среднем 49-51 год). Другие симптомы характерны для постменопаузального периода.
В целом все симптомы климактерических расстройств по времени их появления можно подразделить на ранние (вазомоторные, психоэмоциональные), средневременные (урогенитальные, атрофические изменения кожи, ногтей, волос и слизистых оболочек) и поздние (сердечно-сосудистые заболевания, ОП).
Что относится к ранним симптомам переходного периода?
Сочетание вазомоторных и психоэмоциональных симптомов формирует понятие «климактерический синдром» (КС). Это - ранние симптомы переходного периода, характеризующиеся разнообразными нарушениями, которые могут быть условно разделены на нейровегетативные, психоэмоциональные и урогенитальные.
К нейровегетативным проявлениям относятся приливы жара, ночная потливость, сердцебиение, головокружение, приступы головной боли, неустойчивый стул или запоры, миалгии и артралгии, сухость и атрофия кожи.
Психоэмоциональные расстройства проявляются бессонницей, слабостью, раздражительностью, тревожностью, подавленным настро- ением, утомляемостью, эмоциональной лабильностью, слезливостью, неуверенностью в себе, снижением памяти и концентрации внимания, парестезиями.
Что лежит в основе патогенеза ранних преклимактерических расстройств?
В патогенезе климактерического синдрома существенную роль играют изменения функционального состояния гипоталамических структур и вегетативного равновесия вследствие изменений в выработке нейро- трансмиттеров (норадреналина и допамина), участвующих в процессе
терморегуляции. Повышение тонуса норадренергических и допаминергических структур центральной нервной системы обусловливает пароксизмальное расширение кожных сосудов и появление феномена прилива жара.
Прилив жара сопровождается повышением уровня ЛГ и ТТГ при отсутствии изменений в уровне содержания ФСГ, пролактина и тире- оидных гормонов в плазме периферической крови. У больных с КС сохранены суточные ритмы секреции ТТГ со значительным повышением его уровня в ночное время, что способствует учащению приливов жара в это время суток. Поддержание постоянно высокого уровня активных фракций тиреоидных гормонов способствует повышению чувствительности периферических тканей к катехоламинам, что и вызывает характерные вазомоторные реакции.
Ощущение жара возникает вследствие центральной гипертермии и появляется спустя 30-60 с после обнаружения спастического состояния в артериальных коленах капилляров кожи при капилляроскопическом исследовании.
На чем основана классификация тяжести климактерического синдрома?
Наиболее удачной для клиницистов считается классификация Е.М. Вихляевой (1970), основанная на определении тяжести КС по количеству «приливов». К легкой форме КС следует относить заболевание с числом «приливов» до 10 в сут при ненарушенном общем состоянии и работоспособности. КС средней тяжести характеризуется наличием 10-20 «приливов» в сут при ненарушенном общем состоянии и работоспособности. КС средней тяжести сопровождается головной болью, головокружением, болью в области сердца, ухудшением общего состояния, снижением работоспособности. Тяжелая форма характеризуется резко выраженными проявлениями КС, очень частыми «приливами» (более 20 в сут) и другими симптомами, приводящими к значительной или почти полной потере трудоспособности.
Какие существуют методы диагностики ранних климактерических расстройств?
Диагностика ранних проявлений климактерического синдрома (вазомоторных, психоэмоциональных расстройств) не представляет особых сложностей и строится в основном на данных жалоб и анамнеза больной.
Что относится к средневременным симптомам?
Постменопаузальный период характеризуется прогрессированием урогенитальных нарушений, атрофии кожи, ногтей, волос, конъюнктивы глаз, познавательной деятельности и памяти, увеличением частоты сердечно-сосудистых заболеваний, развитием остеопении и ОП.
Что относится к органам и тканям-мишеням при урогенитальных расстройствах КС?
Нижний урогенитальный тракт имеет общее эмбриональное происхождение и является крайне чувствительным к гипоэстрогении. Об этом свидетельствуют довольно частые (52-80%) урогенитальные нарушения в климаксе.
Урогенитальные расстройства включают комплекс осложнений, обусловленных развитием атрофических процессов в эстро-гензависимых тканях нижних отделов мочеполовой системы - нижней трети мочевого тракта, мышечном слое и слизистой влагалища, а также в связочном аппарате органов малого таза и мышцах тазового дна.
Рецепторы к эстрогенам обнаружены:
- в слизистой оболочке и мышечных слоях стенки влагалища;
- в эпителиальной, мышечной, соединительнотканной и сосудистой структурах уретры;
- в слизистой и мышцах-детрузорах мочевого пузыря; мышцах тазового дна; круглой маточной связке; соединительнотканных структурах малого таза.
Что лежит в основе патогенеза средневременных климактерических расстройств?
Эстрогены оказывают влияние на эпителий, соединительную ткань и мышцы стенок влагалища. Число эстрогенных рецепторов в стенках уретры, соединительной ткани и в окружающих их мышцах почти такое же, как и во влагалище, отсюда снижение эластичности.
На фоне возрастного дефицита эстрогенов возникают атрофические изменения во влагалище: преобладают базальные и парабазальные клетки, снижаются кровоток и кровоснабжение, происходят фрагмен- тация эластичных и гиалиноз коллагеновых волокон. Уменьшается содержание гликогена в клетках эпителия, снижается колонизация лактобацилл, рН повышается до 5,5-6,8. Нередко присоединяется
инфекция, особенно активизируется рост кишечных бактерий, стрепто- и стафилококков.
Дефицит эстрогенов вызывает подобные изменения в эпителии уретры и васкуляризации подслизистого слоя. Это предрасполагает к частым рецидивам восходящей бактериальной инфекции, что может вести к фиброзу и развитию «уретрального синдрома», характеризующегося частым, болезненным и непроизвольным мочеиспусканием.
Атрофические изменения нижнего отдела урогенитальной системы часто сочетаются дистрофическими изменениями кожи, ее сухостью, истончением и ранимостью, появлением и прогрессированием морщин, что объясняется дистрофическими изменениями основного вещества соединительной ткани при снижении уровня эстрогенов. Усиливаются ломкость ногтей, сухость и выпадение волос. Атрофические процессы наблюдаются в слизистой оболочке ЖКТ, конъюнктиве и т.д.
Каковы клинические проявления урогенитальных расстройств?
Атрофические урогенитальные изменения могут возникать как в пери-, так и в постменопаузе и называются иногда «местными климактерическими расстройствами». Они могут проявляться в виде так называемой «молчаливой» атрофии, когда женщина еще не предъявляет жалоб, но при осмотре в зеркалах уже имеют место петехиальные кровоизлияния, истончение, ранимость слизистой. Эти атрофические изменения проявляются в виде:
- сухости и зуда во влагалище;
- диспареунии (болезненные половые сношения);
- патологических выделений из половых путей (бели);
- рецидивирующих инфекций мочевыводящих и половых путей;
- дизурических явлений и недержания мочи.
Все это приводит к потере интереса к половой жизни, снижению либидо, аноргазмии, что усугубляет психоэмоциональные нарушения и нередко может сопровождаться депрессивными расстройствами.
Какие существуют методы диагностики средневременных признаков климактерических расстройств?
Диагностика урогенитальных расстройств может иметь определенные сложности. Часто таким больным ставят диагноз цистита, и они подвергаются длительной местной и системной антибактериальной
терапии с быстрым нарастанием симптомов, пока им не будут назначены препараты эстрогенов. Аналогичная ситуация наблюдается с кольпитами в переходном возрасте.
Что относится к поздним симптомам климактерических расстройств?
Поздние симптомы (остеопороз (ОП), атеросклероз венечных, мозговых, почечных артерий) долгие годы протекают латентно и проявляются в возрасте 60-70 лет, зачастую нося фатальный характер (перелом позвоночника, шейки бедра, инсульт, инфаркт миокарда) и приводя женщину к инвалидизации или смерти.
Что такое остеопороз?
Остеопороз - системное заболевание скелета, характеризующееся снижением костной массы и микроструктурными повреждениями костной ткани, приводящими к повышению ломкости костей и предрасположенности к переломам. ОП называют «безмолвной эпидемией», так как потеря массы кости происходит исподволь и часто диагностируется уже после переломов. С увеличением продолжительности жизни женщин риск развития ОП и переломов возрастает.
Первичный, или инволюционный, ОП представляет собой системное поражение скелета у лиц пожилого возраста (50 лет и более). Вторичный ОП - следствие эндокринных заболеваний.
Различают два типа первичного ОП: постменопаузальный и старческий, или сенильный.
Какие существуют факторы риска развития первичного постменопаузального ОП?
Факторы риска первичного ОП нередко наследственно обусловлены, а также связаны с особенностями семейного или личного анамнеза:
- пожилой возраст;
- изящные, небольшого роста женщины, с хрупким телосложением и светлой кожей, особенно из числа жительниц стран Северной Европы и Азии;
- указания на переломы в семейном анамнезе;
- позднее менархе (после 15 лет);
- ранняя менопауза (до 50 лет);
- олигоили аменорея в репродуктивном возрасте;
- ановуляция и бесплодие;
- более 3 беременностей и родов в репродуктивном возрасте;
- длительная лактация (более 6 мес)
Какие существуют факторы риска вторичного ОП?
Вторичный ОП - мультифакторное заболевание, в возникновении которого лежат следующие факторы:
- эндокринные (гипертиреоз, гипопаратиреоз, гиперкортицизм, диабет, гипогонадизм);
- недостаточность питания и дефицит кальция в пище;
- избыточный прием алкоголя, никотина, кофе (более 5 чашек в день);
- длительный прием (свыше 4 нед) кортикостероидов, гепарина;
- генетические факторы: неполный остеогенез, низкая пиковая масса кости;
- другие факторы: хроническая почечная недостаточность, снижение абсорбции кальция в кишечнике, длительная иммобилизация, гиподинамия.
Какова частота первичного ОП?
С наступлением менопаузы и закономерно выраженным дефицитом половых гормонов процесс потери костной массы значительно ускоряется. При ОП, обусловленном гипоэстрогенией, поражаются губчатые кости (тела позвонков, дистальные отделы костей предплечья и пр.). Сенильный ОП развивается ближе к 70 годам и характеризуется преимущественным поражением трубчатых костей с учащением переломов шейки бедра. Частота возрастного (первичного) ОП в развитых странах составляет 25-40% с преобладанием этого заболевания среди женщин белой расы. К 70-летнему возрасту 40% белых женщин имеют в анамнезе не менее одного перелома, обусловленного ОП.
Что лежит в основе патогенеза ОП?
Прямое влияние половых гормонов (эстрадиола, прогестерона и тестостерона) на кости осуществляется посредством связывания их со специфическими рецепторами на остеобластах и остеокластах, поэтому в настоящее время принято называть губчатое вещество костей «третьим органом-мишенью» для половых гормонов.
Для патогенеза ОП при эстрогендефицитных состояниях характерно:
- повышение чувствительности к паратгормону вследствие увеличения содержания в костной ткани рецепторов к паратгормону и усиление резорбции;
- снижение уровня кальцитонина и соответственно снижение всасывания ионов кальция;
- повышение экскреции ионов кальция с мочой;
- снижение всасывания ионов кальция в кишечнике;
- снижение гидроксилирования витамина D в почках;
- недостаточное поступление ионов кальция в костную ткань.
ОП развивается постепенно и долгое время может быть незамеченным. Проявление характерных его симптомов достигает максимума приблизительно через 10-15 лет.
Каковы клинические симптомы ОП?
Основными клиническими симптомами являются боли в костях поясничного или грудного отдела позвоночника, продолжающиеся в течение нескольких месяцев, которые могут трансформироваться в картину радикулита. Отмечается медленное уменьшение роста с соответствующими изменениями осанки, прогрессирующее ограничение двигательной активности позвоночника, потеря массы тела. Больные нередко в течение длительного времени лечатся без достаточного эффекта по поводу «радикулита», ошибочно диагностированной миеломной болезни, метастазов злокачественной опухоли, множественных травм позвоночника.
Переломы - поздние и наиболее яркие проявления ОП. Нередко переломы возникают в домашних условиях при падении с высоты роста. Наиболее часто отмечаются переломы лучевой кости, позвонков. Компрессионные переломы позвоночника в типичных случаях наблюдаются в позвонках Th8-L3, происходят приблизительно у 25% женщин старше 60 лет. Особенно трагичны переломы шейки бедра, смертность при которых от пневмонии или тромбоэмболии легочной артерии составляет 20-25% в течение первых 6 мес, а тяжелая инвалидизация наступает в 40-45% случаев.
Появление болей в мышцах, суставах и костях также характерно для этого периода и носит название скелетно-мышечных климакте- рических нарушений.
На чем основана диагностика ОП?
Основанием для диагностика ОП являются:
- жалобы больной (боли в поясничном или грудном отделе позвоночника);
- данные анамнеза (переломы лучевой кости, позвонков, возникающих при минимальной травме, иногда при падении с высоты собственного роста);
- данные объективного обследования: уменьшение роста, изменение осанки, ограничение двигательной активности позвоночника.
Инструментальная диагностика ОП:
- одно- и двухфотонная денситометрия (абсорбциометрия);
- одно- и двухэнергетическая рентгеновская абсорбциометрия (денситометрия);
- количественная компьютерная томография;
- УЗИ пяточной кости;
- рентгенография.
Одноэнергетические рентгеновские и ультразвуковые приборы используют для скрининговых исследований или для постановки предварительного диагноза.
В настоящее время золотым стандартом для измерения минеральной плотности костей осевого скелета (поясничные позвонки, проксимальный отдел бедренной кости) и периферических участков является двухэнергетическая рентгеновская абсорбциометрия (ДЭРА).
У женщин в возрасте старше 50 лет минеральная плотность костной ткани (МПКТ) поясничного отдела позвоночника снижается на 1% в год, у мужчин - на 0,5% в год.
Каковы основные методы обследования женщин в перименопаузальном периоде жизни?
- гинекологический осмотр и консультация акушера-гинеколога;
- лабораторные методы обследования: мазок на флору и степень чистоты влагалища, онкоцитологическое исследование, обследование гормонального статуса: ФСГ, ЛГ;
- общеклинические исследования: общий анализ мочи, клинический анализ крови, биохимический анализ крови (сахар, атерогенные факторы - холестерин и его фракции , триглицериды, фракции липопротеидов; печеночные пробы - билирубин, аланин- и аспатртатаминотрансфераза (АлАТ, АсАТ), щелочная фосфатаза (ЩФ); содержание кальция и других электролитов крови по необходимости - онкомаркеры);
- УЗИ матки и придатков с использованием вагинального датчика;
- УЗИ щитовидной железы;
- УЗИ молочных желез;
- кольпоскопическое исследование: бесконтактный и безболезненный метод аппаратного обследования - осмотр шейки матки под многократным увеличением. Этот метод позволяет увидеть изменения в эпителии шейки матки, еще не видимые при обычном осмотре невооруженным глазом. Особенно это важно для ранней диагностики атипических, предраковых и раковых изменений в эпителии шейки матки;
- ЭКГ;
- консультация кардиолога;
- при урогенитальных расстройствах - консультация врачауролога;
- консультация невролога.
Какое печение климактерических нарушений является патогенетически обоснованным?
С учетом того, что в основе большинства нарушений лежит дефицит половых гормонов, в первую очередь эстрогенов вследствие возрастного истощения функции яичников, назначение препаратов с эстрогенной активностью является основой патогенетического лечения. Остальные мероприятия - антигипертензивная терапия, транквилизаторы, антидепрессанты, витамины, бифосфоны и препараты кальция, препараты кальцитонина, физиотерапевтические воздействия - могут рассматриваться как дополнительное лечение отдельных клинических форм патологии переходного периода.
Какие существуют виды гормонального лечения?
С внедрением ГЗТ как основного вида патогенетического лечения появился новый подход к классификации симптомов климактерических расстройств. С точки зрения показаний к различным методам ГЗТ все симптомы подразделяют на системные и урогенитальные. Системные симптомы требуют системного применения лекарственных средств (перорального, инъекционного, трансдермального, введения имплантов), в то время как урогенитальные расстройства могут быть
купированы местным назначением эстрогенов с избирательной урокольпотропной активностью (эстриол).
Какова основная цель назначения ГЗТ?
Цель назначения ГЗТ:
- снижение частоты и выраженности вазомоторных симптомов (прежде всего приливов жара, чрезмерного ночного потоотделения), если они заставляют пациентку обратиться за медицинской помощью;
- снижение выраженности урогенитальных расстройств (в том числе рецидивирующих, кольпитов); профилактика ОП (для первичной профилактики);
- снижение риска ишемической болезни сердца (только для первичной профилактики).
Каковы принципы и продолжительность ГЗТ?
Для ГЗТ используют только натуральные эстрогены, преимущество которых заключается в том, что они в отличие от синтетических метаболизируются в организме подобно эндогенным эстрогенам и не оказывают отрицательного влияния на обмен веществ.
Для ГЗТ применяют дозы эстрогенов, соответствующие уровню эндогенного эстрадиола в ранней фолликулярной фазе менструального цикла. Стандартные суточные дозы пероральных эстрогенов составляют: для 17b-эстрадиола и эстрадиола валерата - 2 мг, для конъюгированных эстрогенов - 0,625 мг, для трансдермальной формы 17 -эстрадиола - 0,05 мг. После 60-летнего возраста доза эстрогенов должна быть снижена.
У женщин с интактной маткой с целью профилактики гиперпластических процессов эндометрия эстрогены обязательно должны дополняться гестагенами в циклическом или непрерывном режиме.
Гормонотерапия климактерического синдрома продолжается от нескольких месяцев до 1,5-2,0 лет. Гормонопрофилактика ОП, остеоартроза, ССЗ, болезни Альцгеймера должна проводиться длительное время (около 3 лет) препаратами эстрадиола или конъюгированными эстрогенами. Терапия урогенитальных расстройств препаратами эстриола может быть более длительной.
Обязательным условием прекращения ГЗТ является постепенное снижение дозы эстрогена.
Чем обоснован выбор режима ГЗТ?
ГЗТ проводят в виде монотерапевтического (только эстрогенами) или комбинированного (эстроген и прогестаген) режима. Комбинированный режим может быть циклическим (прогестаген добавляют на 10-14 дней в конце каждого цикла) или непрерывным (прогестаген добавляютя ежедневно). При выборе режима необходимо учитывать, находится ли пациентка в периили постменопаузе, была ли произведена гистерэктомия и каков результат гистологического исследования.
У женщин без матки используют монотерапевтический режим эстрогенами. При эндометриозе в анамнезе даже у женщин, перенесших гистерэктомию, применяют комбинированный режим ГЗТ. При наличии нарушений в мочеполовом тракте препаратом выбора является эстриол. Монотерапию эстриолом можно проводить без дополнения прогестагеном, так как эстриол обладает короткой продолжительностью действия и при назначении однократно в сут не вызывает пролиферации эндометрия. Эстриол не обладает системным влиянием и избирательно восполняет дефицит эстрогенов в урогенитальной зоне, поэтому его используют только для лечения урогенитальных расстройств, а также применяют до и после пластических операций по поводу пролапса гениталий.
В перименопаузе у женщин с интактной маткой используют циклический режим (двухили трехфазные препараты), в постменопау- зе (не ранее, чем через 2 года после менопаузы) - непрерывный режим ГЗТ.
В России зарегистрированы следующие препараты для циклической ГЗТ: двухфазные: климонорм, цикло-прогинова (21 драже: эстрадиол валерат 2 мг -11, эстрадиол валерат 2 мг и норгестрел 0,5 мг - 10), дивина, климен, фемостон и трехфазные - трисеквенс (23 таблетки: 17- -эстрадиол 2 мг - 12, 17- -эстрадиол 2 мг и норэтистерон ацетат 1 мг - 10, 17- -эстрадиол 1 мг -6 с календарной шкалой) - при применении которых возникает менструальноподобная реакция (МПР). В препарате климен в качестве прогестагенного компонента используют ципротерон-ацетат, который обладает антиандрогенным эффектом, поэтому рекомендуется женщинам с симптомами гиперандрогении (гирсутизм, гипертрихоз, акне, жирная себорея).
В постменопаузе, как правило, МПР воспринимается женщинами негативно, поэтому необходимо свести к минимуму кровянистые
выделения из матки. С этой целью допустимо использовать пролонгированный циклический режим, когда прогестагенный компонент добавляют в каждом 3-м цикле приема эстрогенов, например, дивитрен (91 таблетка: эстрадиол валерат 2 мг - 70 таблеток, эстрадиол валерат 2 мг и медроксипрогестерона ацетат 20 мг - 14, плацебо - 7 таблеток), или непрерывный режим комбинированной терапии - клиогест (17- -эстрадиол 2 мг и норэтистерон ацетат 1 мг). Практически не вызывает МПР препарат ливиал, каждая таблетка которого содержит 2,5 мг синтетического стероида тиболона, который обладает эстрогенными, гестагенными и слабыми андрогенными свойствами. Кроме того, любую форму эстрадиола или конъюгированные эстрогены можно комбинировать с прогестагеном как в циклическом, так и в непрерывном режиме.
Для ГЗТ можно использовать и комбинацию эстрогена с андрогеном, представленную пролонгированным инъекционным препара- том - гинодиан-депо (эстрадиол валерат 4 мг и прогестерон ацетат 200 мг в 1 мл). Препарат вводят внутримышечно один раз в 4-6 нед, показан пациенткам после тотальной овариэктомии с выраженной астенизацией, гипотонией и снижением либидо.
Каков объем обследования и периодичность наблюдения при назначении ГЗТ?
Перед назначением ГЗТ необходимо изучить соматический и генекологический анамнез с учетом противопоказаний к ГЗТ и провести гинекологическое, маммографическое и биохимическое обследование.
Гинекологическое обследование проводят с цитологическим, кольпоскопическим контролем и УЗИ органов малого таза на 5-7-й день менструального цикла.
При толщине эндометрия до
Маммографию проводят в возрасте от 40 до 50 лет 1 раз в 2 года, после 50 лет - ежегодно.
Исследование биохимических показателей (глюкоза, холестерин, липопротеиды, триглицериды, фибриноген, протромбиновый индекс, печеночные пробы, а также измерение артериального давления, под-
счет индекса массы тела, индекса талия/бедра) необходимо проводить с учетом того, что у данной категории женщин могут быть выявлены соматические заболевания, требующие наблюдения у терапевта, кар- диолога или эндокринолога.
Женщины, принимающие препараты половых гормонов, должны находиться под диспансерным наблюдением. Первое контрольное обследование рекомендуется через 3 мес, последующие - каждые 6 мес. Ежегодно повторяют УЗИ органов малого таза и маммографию.
Каковы абсолютные противопоказания для назначения ГЗТ?
К абсолютным противопоказаниям относятся:
- маточное кровотечение неустановленной этиологии;
- рак молочной железы (после радикального удаления опухоли возможны исключения);
- рак эндометрия (после радикального удаления опухоли возможны исключения);
- острый тромбоз глубоких вен;
- острая тромбоэмболия;
- заболевания печени в активной стадии и/или сопровождающиеся нарушением функциональных показателей печени;
- врожденные нарушения метаболизма липидов (возможны исключения).
Каковы относительные противопоказания для назначения ГЗТ?
Относительными противопоказаниями являются:
- хронические заболевания печени в стадии ремиссии;
- эндометриоз (по отношению к эстрогенам без гестагенов);
- гормониндуцированная тромбоэмболия в анамнезе;
- эмболия легких нетравматической этиологии в анамнезе.
Каковы основные направления лечебного воздействия при назначении ГЗТ?
Перед проведением лечения менопаузальных расстройств следует иметь ясную цель лечебных мероприятий и предусматривать возможные
варианты дальнейшей стратегии. Могут быть выделены три направления (стратегии) лечебного воздействия:
1) коррекция вазомоторных нарушений - так называемая краткосрочная стратегия;
2) коррекция урогенитальных нарушений;
3) профилактика ОП - так называемая долгосрочная стратегия.
Какие гормоны применяются
для лечения климактерических расстройств?
В отличие от синтетических эстрогенов, входящих в состав оральных контрацептивов, для лечения климактерических расстройств применяют натуральные эстрогены, обладающие меньшей способностью вызывать пролиферацию эндометрия. Существует два основных пути введения натуральных эстрогенов для системной терапии - оральный и парентеральный. При первом пути с учетом частичной дезактивации в желудочно-кишечном тракте и печени необходимы более высокие дозы, при втором (импланты, наклейки, трансдермальные гели) - дозы могут быть уменьшены. В случае изолированных урогенитальных расстройств применяются эстрогены местного действия с интраваги- нальным путем введения (эстриол).
Какова роль гестагенов, входящих в состав препаратов для ГЗТ, при лечении КС?
Для профилактики развития гиперпластических процессов в эндометрии на фоне приема эстрогенов в течение 12-14 дней в большинстве современных препаратов для ГЗТ используют прогестагены, которые вызывают ежемесячное отторжение эндометрия в конце каждого цикла приема препарата. С этой целью чаще используют прогестагены, производные прогестерона (дидрогестерон, МПА), не имеющие андрогенного эффекта или обладающие антиандрогенным эффектом (ципротерон ацетат) либо прогестагены, производные 19-норстероидов (левоноргестрел).
Какие еще гормоны используют для коррекции климактерических нарушений?
Наряду с эстрогенами применяют андрогены, тиреоидные и анаболические гормоны. Андрогены назначают для коррекции отдельных про-
явлений менопаузальных нарушений, не поддающихся в полной мере эффективному лечению эстрогенами (при снижении либидо, потере мышечной ткани, ОП, тяжелых депрессиях, висцеральном ожирении и посткастрационном синдроме). В тяжелых случаях остеопороза и/или истощения назначают анаболические гормоны. Тиреоидные гормоны применяют при сопутствующем гипотиреозе. Следует отметить синергичное действие тиреоидных гормонов и эстрогенов на сердечнососудистую систему, ЦНС и метаболизм липидов.
Что такое посткастрационный синдром?
Особой формой клинических расстройств, напоминающих по спектру симптомов патологию переходного периода, является постовариэктомический (посткастрационный) синдром. Его отличительная особен- ность - быстрое прогрессирование всех климактерических расстройств.
Каковы основные принципы ГЗТ и его особенности при посткастрационном синдроме?
ГЗТ при постовариэктомическом синдроме в целом соответствует основным принципам, представленным выше. Особенностью его лечения при гистерэктомии (отсутствии матки как органа-мишени) является назначение чистых эстрогенов (табл. 4.3) и отсутствие необходимости в применении гестагенов.
Таблица 4.3. Монофазные препараты чистых эстрогенов для заместительной гормональной терапии
Препарат | Упаковка и состав |
Премарин | Таблетки по 0,3; 0.625; 0,9; 1,25 и 2,5 мг конъюгированных эстрогенов |
Прогинова | 21 драже по 2 мг эстрадиола валерата с календарной шкалой |
Эстрофем | 23 таблетки по 2 мг 17-в-эстрадиола |
Какова краткосрочная стратегия применения ГЗТ?
Лечение вазомоторных расстройств (приливы жара, ночныех поты) обычно проводят в течение непродолжительного промежутка времени - в пременопаузу и первые 1-3 года постменопаузы. Лекарствами выбора являются средства с эстрогенной активностью и влиянием на ЦНС и сердечно-сосудистую систему. Выбор препарата для ГЗТ должен проводиться с учетом желания женщины иметь регуляр-
ные менструальноподобные кровотечения. При наличии матки для профилактики развития рака эндометрия дополнительно назначают прогестагены.
Какие существуют различия в выборе времени, начала приема препаратов в пре- и постменопаузе?
Пациенткам, у которых менструации не прекратились, ГЗТ рекомендуется начинать в первый день после начала менструации. Женщинам с нерегулярными менструациями перед назначением ГЗТ целесообразно индуцировать менструальноподобное кровотечение прогестагеном, назначив его в течение (10-14 дней. Для этого могут быть использованы норколут - 1 таблетка (5 мг/сут), оргаметрил - 1 таблетка (5 мг/сут), дюфастон - 1 таблетка (10 мг 2 раза в сут). В постменопаузе лечение можно начинать в любое время.
Какие препараты для ГЗТ и в каком режиме назначаются пациенткам в пременопаузальном периоде?
В пременопаузальном периоде, у женщин с сохраненной маткой предпочтение следует отдавать двухфазным препаратам с гес-тагенным компонентом - производным 19-норэтистерона (фемостон, климонорм, циклопрогинова), а также дивина, климен,. Циклическая двух- и трехфазная (трисеквенс) ГЗТ в перименопаузе способствует регуляции менструального цикла, а также профилактике гиперпластических процессов в эндометрии благодаря циклическому добавлению прогестеронов (табл. 4.4).
Таблица 4.4. Двух- и трехфазные препараты для ГЗТ
Препарат Состав упаковки
Фемостон | 28 таблеток (14 - по 2 мг 17-β-эстрадиола; 14 -по 2 мг 17-в-эстрадиола + 10 мг дидрогестерона) с календарной шкалой |
Дивина | 21 таблетка (11 - по 2 мг эстрадиола валерата и 10 - по 2 мг эстрадиола валерата + 10 мг МПА) с календарной шкалой |
Дивитрен | 91 таблетка (70 - по 2 мг эстрадиола валерата; 14 - по 2 мг эстрадиола валерата + 20 мг МПА; 7 - плацебо) |
Окончание таблицы 4.4
Препарат Состав упаковки
Климен | 21 драже (П - по 2 мг эстрадиола валерата и 10 - по 2 мг эстрадиола валерата + 1,0 мг ципротерона ацетата) с календарной шкалой |
Климонорм | 21 драже (9 - по 2 мг эстрадиола валерата и 12 - по 2 мг эстрадиола валерата + 0,15 мг левоноргес- трела) с календарной шкалой |
Трисеквенс | 23 таблетки (12 - по 2 мг 17-β-эстрадиола; 10 - по 2 мг 17-β-эстрадиола + 1 мг норэтистерона ацетата и 6 - по 1 мг 17-Я-эстрадиола) с календарной шкалой |
Гинодиан-Депо | Раствор для инъекций масляный по 1 мл в шприц-ампуле - 4 мг эстрадиола валерата + 200 мг прогестерона ацетата |
Циклопрогинова | 21 драже (11 - по 2 мг эстрадиола валерата и 10 - по 2 мг эстрадиола валерата + 0,5 мг норгестрела) с календарной шкалой |
Какие препараты для ГЗТ и в каком режиме назначают в постменопаузальном периоде?
В постменопаузальном периоде у женщин с сохраненной маткой предпочтение отдают постоянному режиму ГЗТ (эстрогены+гестагены). Цель постоянного назначения гестагенов - достижение атрофии эндометрия.
Для лечения вазомоторных и урогенитальных расстройств в постменопаузе могут быть использованы сочетания препаратов эстрогена (эстрадиола/эстрона) и гестагена или комбинированные препараты, содержащие сбалансированное количество обоих половых гормонов (табл. 4.5).
Таблица 4.5. Монофазные препараты для ГЗТ
Препарат | Упаковка и состав |
Клиогест | 28 таблеток (каждая содержит 2 мг 17-β-эстрадиола + 1 мг норэтистерона ацетата) с календарной шкалой |
Ливиал | 28 таблеток (каждая содержит 2,5 мг тиболона) с календарной шкалой |
Окончание таблицы 4.5
Анжелик | 28 таблеток (каждая содержит 1 мг эстрадиола и 2 мг дроспиренона) |
Климоден | 28 таблеток (каждая содержит 2 мг эстрадиола и 2 мг диеногита) |
Какие препараты для ГЗТ используют при отсутствии матки и почему?
При отсутствии матки для лечения климактерического синдрома целесообразно применение чистых эстрогенов, так как в данной ситуации не требуется защитный эффект гестагенов по отношению к эндометрию. В этой связи при удаленной матке для лечения климактерического синдрома рекомендуется назначение чистых эстрогенов без гестагенов (пероральные таблетки, подкожные импланты, накожные пластыри и гели, вагинальный крем и суппозитории) или тиболона. Некоторые препараты натуральных эстрогенов представлены в табл. 4.6.
Таблица 4.6. Препараты натуральных эстрогенов без гестагена
Препарат Состав упаковки | |
Для внутреннего применения | |
Премарин | 28 таблеток (по 0,625 конъюгированных эстрогенов) |
Прогинова | 21 драже (по 2 мг эстрадиола валерата) |
Эстрофем | 28 таблеток (по 2 мг 17-β-эстрадиола) с календарной шкалой |
Для наружного применения | |
Гели | |
Дивигель | 28 пакетиков с гелем для наружного применения 1%. Каждый пакетик содержит эстрадиола гемигидрат по 0,5 или 1мг |
Эстрожель | для наружного применения или в комплекте со шпателем-дозатором. 1 доза ( содержит 1,5 мг 17-β-эстрадиола |
Трансдермальные терапевтические системы (ТТС) - пластыри | |
Климара | 4 шт. В каждом - 3,9 мг 17-β-эстрадиола; обеспечивает поступление в организм эстрадиола в количестве 0,05 мг/сут в течение 7 дней |
Положительный эффект от назначения препаратов с эстрогенной активностью при приливах жара и чрезмерном ночном потоотделении достигается в течение первых недель лечения. В тяжелых случаях иногда требуется дополнительное назначение андрогенных препаратов. В целом же первые 2 мес лечения эстрогенсодержащими препаратами одновременно следует рассматривать и как своеобразный диагностический тест, который может показать, являются ли имеющиеся симптомы следствием дефицита эстрогенов. Если в течение этого промежутка времени наблюдается улучшение клинической картины без последующего ухудшения на фоне лечения, то можно предполагать наличие перименопаузальных расстройств и продолжить дальнейшее лечение. При отсутствии положительной динамики или только временном улучшении на фоне лечения необходимо провести дифференциальную диагностику с другими заболеваниями, прежде всего психосоматическими, а также эндокринными расстройствами.
Какие еще существуют формы ГЗТ, кроме таблетированных?
Трансдермальное (гели и накожные пластыри) введение половых гормонов особенно важно у женщин с такими заболеваниями, как гипертриглицеридемия, артериальная гипертония, мигрень, при инсулинне- зависимом сахарном диабете, риске тромбоэмболических осложнений, при плохой кишечной абсорбции лекарств или существенной прибавке массы тела на фоне приема пероральных препаратов для ГЗТ.
В чем преимущество трансдермального введения эстрогенов?
Трансдермальное введение эстрогенов имеет рад преимуществ перед пероральными препаратами. Известно, что при приеме внутрь часть эстрадиола, прежде чем попасть в системный кровоток, метаболизируется в эстрон в кишечнике и печени, что приводит к повышению концентрации эстрона в плазме крови, а при длительном лечении - к кумуляции эстрона и сульфата эстрона. Это сопровождается усилением синтеза печенью ангиотензиногена. Последнее обстоятельство может влиять на сосудистый тонус и водно-солевой обмен. При трансдермальном приеме эстрадиол поступает в неизмененном виде непосредственно в кровоток с поддержанием уровня, соответствующего ранней фолликулиновой фазе. При этом соотношение концентраций эстрадиола и
эстрона в плазме крови изменяется от 0,2-0,5 до 0,9-1,35, т.е. до значений, соответствующих уровню у женщин с нормальной функцией яичников в позднем репродуктивном возрасте.
Эстрадиол в виде пластыря (так называемая трансдермальная терапевтическая система - ТТС) прикрепляется к интактному участку кожи и обеспечивает постепенное и непрерывное высвобождение эстрадиола из резервуара с активным веществом на кожу. Активное вещество проникает через кожу непосредственно в кровоток.
Как используется эстрадиоп в виде пластыря?
Накожные пластыри с эстрадиолом применяют 1-2 раза в нед, т.е. их следует менять каждый 3-4-й или 7-й день. Лечение начинают с применения пластыря, высвобождающего 25-50 мкг эстрадиола в сут. В дальнейшем дозировку подбирают индивидуально, причем появление чувства напряжения в молочной железе или ациклические кровотечения являются признаком повышенной дозировки, которую необходимо снизить. Если через 2-3 нед признаки и симптомы дефицита эстрогенов посредством подобранной дозы не уменьшаются, ее необходимо увеличить. Для поддерживающей терапии следует всегда подбирать самую низкую эффективную дозу. Обычно накожные пластыри с эстрадиолом применяют циклами: после 3 недели лечения (6 аппликаций) делают перерыв на 7 дней. Во время перерыва могут появиться кровянистые выделения. У женщин с интактной маткой ТТС проводят в комбинации с гестагенами по следующим схемам:
- при циклическом применении трансдермального пластыря рекомендуется в последние 10-12 дней лечения эстрадиолом принимать гестаген так, чтобы 4-я неделя каждого цикла оставалась свободной от терапии любым гормоном;
- при непрерывном применении трансдермального пластыря: в первые 10-12 дней каждого месяца дополнительно назначают гестаген (например, дюфастон - 20 мг/сут). В обоих случаях после окончания 10-12-дневной терапии гестагеном обычно наступает кровотечение;
- непрерывный режим использования трансдермальных препаратов эстрадиола также выбирают для женщин после гистерэктомии или в случаях, когда симптомы дефицита эстрогенов возоб- новляются во время 7-дневного перерыва.
Какими препаратами проводят фармакологическую коррекцию изолированных проявлений менопаузальных расстройств?
Лечение и предупреждение урогенитальных нарушений, обусловленных дефицитом эстрогенов, проводят с помощью лекарственных средств, обладающих эстрогенным действием на ткани влагалища, мочевого пузыря и уретры. Необходимо отметить, что не все проявления дефицита эстрогенов одинаково эффективно поддаются лечению препаратами эстрогенов. Некоторые из них, например императивное неудержание мочи или стрессовое недержание мочи, могут потребовать дополнительного лечения другими лекарственными средствами (табл. 4.7).
Таблица 4.7. Фармакологическая коррекция отдельных проявлений мено- паузальных расстройств
Менопаузальные расстройства | Лекарственные средства | |
Стандартное лечение | Дополнительные препараты | |
Приливы жара и ночные поты | Эстрогены: табл. (1-2 мг эстрадиола или 0,625 мг конъюгированных эстрогенов в сут), гели для накожного применения, трансдермальные пластыри, подкожные импланты) Тиболон (ливиал - таблетки 2,5 мг в сут) | Клонидин (возможно, другие агонисты центральных α2-адренорецепторов) |
Рецидивирующие кольпиты | Эстрогены, предпочтительнее местные формы (вагинальные суппозитории или крем) эстриола (овестин, до 0,5 мг в сут) | Нет |
Недержание мочи при напряжении | Эстрогены, предпочтительнее местные формы: - α-адреномиметики - мидодрин (гутрон) Ингибиторы холинэстеразы | Нет |
Окончание таблицы 4.7
Менопаузальные расстройства | Лекарственные средства | |
Стандартное лечение | Дополнительные препараты | |
Цисталгия, дизурия | Местные формы эстрогенов (см. выше) | Возможно, селективные α21-адреноблокаторы (теразозин 1-2 мг на ночь и др.) |
Императивное неудержание мочи | Ингибиторы холинэстеразы | Возможно, селективные α1-адреноблокаторы (см. выше) |
Остеопении (лечение) и ОП (профилактика) | Эстрогены или тиболон (ливиал) (см. выше), ралоксифен (эвиста) в сочетании с препаратами кальция (1-1,5 г в сут) и витамином D (кальций-D3 - 2 таблетки в сут) | Бифосфонаты, кальцитонин, анаболические стероиды |
ОП (лечение) | Бифосфонаты - фосамакс (алендронат натрия) по 1 таблетки в сут 28 дней | Кальцитонин, анаболические стероиды с препаратами кальция (1 г/сут) и витамином D (кальций-D3 - 2 таблетки в сут) Фториды |
Ишемическая болезнь сердца | Статины | Возможно, эстрогены, неалкилированные андрогены или их сочетание |
Показаниями к назначению препаратов эстрогенов являются атрофические изменения нижнего отдела мочеполового тракта, проявляющиеся болезненностью при половых сношениях, сухостью во вла- галище, зудом. Эстрогены применяют для профилактики рецидивов инфекций влагалища, уретры и мочевого пузыря, при частом и/или болезненном мочеиспускании, недержании мочи при напряжении легкой степени (см. табл. 4.7). Их назначают для профилактики пред- и послеоперационных осложнений у женщин в постменопаузе, которым предстоит или проведена операция влагалищным доступом, а также при сомнительных результатах цитологического исследования шейки матки (подозрение на опухолевый процесс) на фоне атрофических изменений.
Каков механизм действия эстрогенов при урогенитальных нарушениях?
Механизм лечебного и профилактического действия эстрогенов при рецидивирующих атрофических кольпитах связан с тем, что эти препараты вызывают пролиферацию, утолщение и «созревание» эпителия влагалища, сопровождающееся интенсивным синтезом гликогена, необходимого для жизнедеятельности нормальной микрофлоры, синтезирующей из него молочную кислоту. Следовательно, применение эстрогенов способствует восстановлению нормальной микрофлоры и физиологического показателя рН среды влагалища, а также повышению устойчивости эпителия влагалища к инфекции и воспалению.
Какие препараты используют
для лечения урогенитальных нарушений?
Для лечения урогенитальных расстройств могут быть использованы как препараты с системным действием (таблетированные и транс- дермальные формы), так и местные (вагинальные) формы эстрогенов. Первым отдают предпочтение при сочетании урогенитальных нарушений с вазомоторными проявлениями климактерического синдрома («приливы», ночные поты), а также при проведении долгосрочной профилактики ОП и сердечнососудистых осложнений. Местные формы эстрогенов используютя при так называемых изолированных формах урогенитальных нарушений или превалировании симптомов урогенитальных расстройств над остальными проявлениями дефицита эстрогенов.
Местные формы эстрогенов (вагинальный крем или суппозитории) различаются по активному веществу в своем составе. Это могут быть препараты конъюгированных эстрогенов, эстрадиола или эстриола. На сегодняшний день единственной местной формой эстрогенов, зарегистрированной в России, является Овестин, который содержит эстриол. Все они обладают хорошим терапевтическим эффектом при атрофических изменениях влагалища, уретры и нижней трети мочевого пузыря, рецидивирующих инфекциях нижнего отдела мочеполового тракта. При этом у препаратов эстриола в меньшей степени выражено пролиферативное влияние на эндометрий.
В отличие от других эстрогенов эстриол взаимодействует с ядрами клеток эндометрия в течение небольшого промежутка времени
(для сравнения: 20-24 ч - у эстрадиола и до 6 ч - у эстриола), поэтому при приеме рекомендованной суточной дозы последнего (один раз в день на ночь) пролиферации эндометрия не происходит.
Какой режим дозирования
вагинальных форм эстриола (Овестина)?
Режим дозирования вагинальных форм эстриола (Овестина) представлен в табл. 4.8.
Таблица 4.8. Режимы дозирования вагинальных форм эстриола (овестина)

Примечание: * - вагинальные формы эстрогенов лучше вводить на ночь.
Лечение местными формами эстриола снижает частоту рецидивов воспалительного процесса влагалища в 3-6 раз, а потребление антибактериальных препаратов - в 5-7 раз. Положительный эффект наступает в первые 3-4 нед лечения эстрогенами. Затем пациент переводится на поддерживающую терапию эстриолом. В дальнейшем вопрос о продолжении применении эстриола и его дозах должен решаться индивидуально.
Наличие местных форм эстрогенов, особенно эстриола, позволяет с высокой степенью безопасности проводить лечение и вторичную профилактику урогенитальных расстройств на протяжении длительного времени.
Какова тактика лечения при недержании мочи?
Недержание мочи при напряжении в меньшей степени поддается лечению эстрогенами, хотя при их применении часто наблюдается клиническое улучшение. Это связано с тем, что в патогенезе недержания мочи наибольшую роль играют анатомические дефекты соединительной ткани и мышц тазового дна, приобретенные, как правило, еще в репродуктивном возрасте во время родов, оперативных вмешательств, травм, а также при опущении внутренних половых органов; врожденная несостоятельность мышц и соединительной ткани. Атрофия урогенитального тракта вследствие дефицита эстрогенов в данном случае играет дополнительную, иногда разрешающую роль в комплексе неблагоприятных факторов, приводящих к недержанию мочи при напряжении.
Наиболее резистентным из урогенитальных расстройств к лечению эстрогенами является императивное недержание мочи. Это связано с тем, что этиологические и патогенетические факторы такого рас- стройства в большинстве своем не известны. Прежде всего это касается моторного компонента недержания мочи - нестабильности детрузора. Большое значение также имеют психологические факторы. В то же время связанные с дефицитом эстрогенов атрофия слизистой нижней трети мочевого пузыря и уретры, а также сопутствующие воспалительные заболевания составляют сенсорный компонент императивного недержания мочи. В этой связи, хотя эстрогены и не являются основным средством лечения данного заболевания, их применение в постменопаузе является патогенетически обоснованным.
Какова цель профилактики и лечения ОП?
1. Увеличение или прекращение потери минеральной плотности кости.
2. Нормализация или улучшение профиля маркеров костного метаболизма.
3. Улучшение качества кости.
4. Улучшение качества жизни больных.
В чем заключается немедикаментозная профилактика и лечение ОП?
Обязательная составная часть комплексной профилактики ОП включает:
- активный, здоровый образ жизни с умеренными физическими нагрузками;
- питание должно содержать достаточное количество кальция (молочные продукты, рыба, морепродукты, бобовые);
- отказ от вредных привычек (курение, злоупотребление алкоголем, кофе).
Какие лекарственные средства применяются для профилактики ОП?
Для профилактики ОП назначают длгосрочную (не менее 3-5 лет) программу ГЗТ. Начинать профилактику наиболее целесообразно в пременопаузе или в первые годы постменопаузы.
В каких случаях назначают монотерапию эстрогенами?
Монотерапия эстрогенами (эстрофем, премарин, прогинова) назначается пациенткам с удаленной маткой.
Какие препараты ГЗТ назначают пациенткам с интактной маткой?
Больным с интактной маткой назначают комбинированные препараты ГЗТ, содержащие эстрогены с прогестагенами в пременопаузе в циклическом режиме (фелюстон, дивина, климен и др.); в постменопаузе в непрерывном монофазном режиме (клиогест, ливиал, анжелик и др.).
Какие еще лекарственные препараты используются для профилактики и лекчения ОП?
С целью профилактики ОП применяются препараты витамина D и кальция.
Какие препараты кальция используются?
Кальций D3 никомед содержит активные компоненты: кальция карбоната 1250 мг, что соответствует 500 мг кальция и витамин
D3 - 450 МЕ.
Каким действием обладают витамин D и кальций?
Витамин D влияет на процессы как резорбции, так и костеобразования посредством:
- стимуляции всасывания кальция и фосфора в кишечнике;
- увеличения кальция и фосфора в костном матриксе;
- ингибиции повышенного уровня паратгормона;
- усиления нервно-мышечной проводимости.
Возможно ли одновременно использовать препараты кальция и ГЗТ?
Совместное использование комбинированных препаратов кальция и витамина D с ГЗТ при первичной профилактике остеопороза увеличивает эффективность терапии.
В чем заключается патогенетическая терапия ОП?
Патогенетическая терапия ОП должна обладать следующими свойствами:
- замедлять костную резорбцию (бифосфонаты, например, фосамакс; селективные модулятры эстрогеновых рецепторов, такие, как тамоксифен; эстрогены);
- усиливать костеобразование (паратгормон, фториды, анаболические стероиды, андрогены, соматоторопный гормон);
- оказывать многоплановое действие на костную ткань.
Какие препараты замедляют костную резорбцию?
К ингибиторам костной резорбции относятся бифосфонаты - препараты первой линии для лечения ОП:
- алендронат натрия (фосамакс): прием по 1 капсуле 1 раз в нед (после 70 лет) или по 10 мг ежедневно длительно (до 5 лет);
- кальцитонин (миакальцик) по своему дейстивию является антагонистом паратгормона, подавляет образование и актив- ность остеокластов, обладает анальгетическим эффектом при болях костного происхолждения; связан с прямым влиянием на рецепторы центральной нервной системы, повышением уровня β-эндорфинов в плазме; применяют в виде спрея интраназально, суточная доза - 200 МЕ в день в течение 2-3 мес.;
- ралоксифен - повышает минеральную плотность костной ткани, суточная доза составляет 60 мг внутрь в непрерывном режиме;
- стронция ранелат (бивалос) - ингибирует резорбцию костной ткани, принимают по
Какие лекарственные средства усиливают костеобразование?
К лекарственным препаратам, усиливающим костеобразование, относятся паратиреоидный гормон, фториды, анаболические стероиды, андрогены, соматотртопный гормон.
Фториды обладают выраженным стимулирующим влиянием на активность остеобластов и существено усиливают костеобразование.
Анаболические стероиды, например, нандролона деканоат (ДекаДураболин), по химической структуре относятся к мужским половым гормонам, но обладают более высокой анаболической и менее выраженной андрогенной активностью, способствуют фиксации кальция в костях, увеличению костной массы при ОП. Назначают в дозе 50 мг внутримвышечно 1 раз в нед.
Как оценивается эффективность препарата при лечении остеопороза?
Основной критерий эффективности препарата, используемого для терапии остеопороза - это снижение частоты переломов при длительном (3-5 лет) применении.
Каковы правила наблюдения и ведения больных с ОП?
Терапия постменопаузального ОП должна быть длительной.
Мониторинг терапии осуществляется ежегодно.
Оценка эффективности лечения проводится при помощи двухэнергетической рентгеновской абсорбциометрии (ДРА) - золотого стандарта среди методов костной денситометрии. Оценивается состояние МПКТ центрального скелета (позвоночника и проксимальных отделов бедренных костей).
Как оценивается прогноз течения заболевания?
Характер течения заболевания определяется при оценке динамики МПКТ за 1 год.
Положительная динамика устанавливается при повышении МПКТ более, чем на 2-3 % за год, при отсутствии новых переломов.
Стабилитзация - когда нет новых переломов, но не выявляется повышение МПКТ или ее снижение.
Прогрессирование ОП (отрицательная динамика) определяется при возникновении новых переломов за период лечения или при снижении МПКТ более, чем на 3 % за 1 год.
В чем заключается онкологическая настороженность при назначении ГЗТ?
При проведении ГЗТ также необходима разумная онкологическая настороженность. Ее элементами являются ежегодные (каждые 3 мес) медицинские осмотры с контролем артериального давления, онкоцитологическим исследованием, ультразвуковым контролем гениталий и маммографии (один раз в год), устное или письменное предупреждение женщины о необходимости самоконтроля и своевременного обращения к врачу при появлении «подозрительных» симптомов. В случае возникновения маточного кровотечения следует провести УЗИ (желательно трансвагинальное) и диагностическое выскабливание.
Каковы современные принципы назначения ГЗТ?
На основании документа «Консенсус о ГЗТ в РФ», принятого на форуме «Мать и дитя» (Москва, 2004), в основе ГЗТ должны лежать следующие положения.
Показания к ГЗТ:
- наличие симптомов климактерического синдрома;
- урогенитальные нарушения;
- преждевременная и ранняя менопауза;
- профилактика ОП;
- улучшение качества жизни. При назначении ГЗТ необходимо:
- информирование пациентки и индивидуальная оценка преимуществ и риска ГЗТ;
- осознанный выбор, осуществляемый пациенткой;
- определение типа, дозы и путей введения ГЗТ с учетом индивидуальных показаний в данный период времени;
- после гистерэктомии - назначение монотерапии эстрогенами (исключение - эндометриоз);
- после 60 лет - подбор минимально оптимальной дозы;
- при заболеваниях печени, поджелудочной железы, риске тромбоза - применение парентеральных форм эстрогенов(гель/плас- тырь) с добавлением натуральных прогестагенов (прогестерон, дидрогестерон-дюфастон);
- при изолированных урогенитальных расстройствах - применение местной терапии эстриолом (Овестин);
- ежегодная оценка эффективности терапии, коррекция типа и дозы препаратов с учетом клинической реакции.
Средняя продолжительность ГЗТ - 3-5 лет.