Военная токсикология, радиобиология и медицинская защита - Учебник Под редакцией профессора С.А. Куценко
|
|
|
|
Глава 4. Токсикокинетика
Токсикокинетика - раздел токсикологии, в рамках которого изучаются закономерности резорбции, распределения, биотрансформации ксенобиотиков в организме и их элиминации (рис. 4).
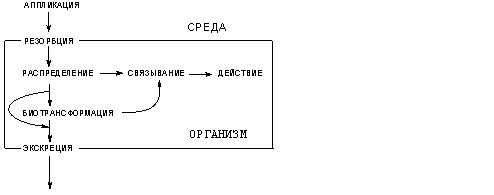
Рисунок 4. Этапы взаимодействия организма с ксенобиотиком
Возможности современной науки по изучению токсикокинетики различных веществ возрастают по мере расширения знаний об организме и совершенствования методов химико-аналитического определения ксенобиотиков в биосредах. Токсикокинетические характеристики каждого вещества изучаются экспериментально на лабораторных животных и уточняются в условиях клиники.
4.1. Общие понятия токсикокинетики
С позиций токсикокинетики организм представляет собой сложную систему, состоящую из большого числа компартментов (отделов: кровь, ткани, внеклеточная жидкость, внутриклеточное содержимое и т.д.) с различными свойствами, отделенных друг от друга биологическими барьерами (рис. 5).
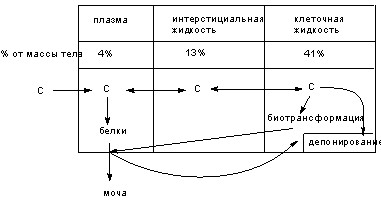
Рисунок 5. Схема движения веществ (С) по основным компартментам организма
В ходе поступления, распределения, выведения вещества осуществляются процессы его растворения, диффузии, конвекции в жидких средах, осмоса, фильтрации через биологические барьеры.
Растворение - накопление вещества в жидкой фазе (растворителе) в молекулярной или ионизированной форме. Проникнуть во внутренние среды организма могут лишь растворившиеся (в поте, жировой смазке кожи, желудочном или кишечном соке и т.д.) вещества.
Конвекция - механическое “перемешивание” среды, приводящее к уравниванию концентрации ксенобиотика, растворенного в ней. Вещества, проникшие в кровоток, распределяются в организме, прежде всего, путем конвекции. Так как скорость кровотока в капиллярах существенно ниже, чем в крупных сосудах (в капиллярах - 0,03 - 0,05 см/сек; в аорте - 20 см/сек), перемешивание токсиканта в крови, в основном осуществляется в сердце, аорте и крупных сосудах.
Диффузия - перемещение массы вещества в среде в соответствии с градиентом концентрации, осуществляемое вследствие хаотического движения молекул. Физиологически значимые диффузионные процессы осуществляются на небольшие расстояния - от нескольких микрон до миллиметра. Дело в том, что время диффузии возрастает пропорционально квадрату пути, проходимому молекулой (для диффузии на расстояние 1 мкм потребуется время 10-2 с, для 1 мм - 100 с, для 10 мм - 10000 с, т.е. три часа). Поэтому за счет диффузии в организме осуществляется, главным образом, преодоление веществами различного рода барьеров и их распределение внутри клеток.
Фильтрация - движение растворенного вещества вместе с растворителем через пористые мембраны под действием гидростатического давления.
Осмос - процесс перемещения растворителя через мембрану, не проницаемую для растворенного вещества, в сторону более высокой концентрации последнего, под влиянием силы осмотического давления. Осмотическое давление раствора пропорционально количеству частиц растворенного вещества.
Токсикокинетические характеристики вещества обусловлены как его свойствами, так и особенностями структурно-функциональной организации клеток, органов, тканей и организма в целом.
К числу важнейших свойств вещества, определяющих его токсикокинетику, относятся:
- агрегатное состояние. Как известно вещество может находиться в твердом, жидком и газообразном состоянии. Биодоступность ксенобиотика, т.е. его способность поступать во внутренние среды организма, а также пути проникновения во многом определяются агрегатным состоянием. Так, пары синильной кислоты поступают в организм через легкие, жидкая синильная кислота может попасть в организм через кожу (в очень ограниченном количестве) и через желудочно-кишечный тракт, через желудочно-кишечный тракт поступают также соли синильной кислоты и их растворы;
- коэффициент распределения в системе “масло/вода”. Определяется отношением растворимости вещества в неполярных растворителях (в том числе липидах) к растворимости в воде. Этот показатель влияет на способность соединений преимущественно накапливаться в соответствующей среде (жирорастворимые накапливаются в липидах; водорастворимые - в водной фазе плазмы крови, межклеточной и внутриклеточной жидкости), а также преодолевать биологические барьеры;
- размер молекулы. Чем больше молекула, тем меньше скорость ее диффузии, тем в большей степени затруднены процессы фильтрации и т.д. Поэтому размеры, прежде всего, влияют на проницаемость ксенобиотиков через биологические барьеры. Так, молекула СО (оксид углерода, угарный газ) практически мгновенно проникает в организм через легкие и быстро распределяется в крови и тканях, а молекуле ботулотоксина (МВ более 150000) для этого требуются часы;
- наличие заряда в молекуле. Влияет на прохождение веществ через барьеры и их растворимость в различных биосредах. Заряженные молекулы (ионы) плохо проникают через ионные каналы, не проникают через липидные мембраны, не растворяются в липидной фазе клеток и тканей. Даже ионы одного и того же элемента, имеющие различный заряд, по-разному преодолевают биологические барьеры: ионы Fe+2 - всасываются в желудочно-кишечном тракте, а Fe+3 - нет;
- величина константы диссоциации солей, слабых кислот и оснований. Определяет относительную часть молекул токсиканта, диссоциировавших на ионы в условиях внутренней среды;
- химические свойства. Влияют на сродство токсикантов к структурным элементам клеток различных тканей и органов.
Важнейшими характеристиками организма, влияющими на токсикокинетику ксенобиотиков, являются свойства его компартментов и разделяющих их биологических барьеров.
Основными свойствами компартментов являются:
- соотношение воды и жира. Биологические структуры, ткани, органы могут содержать большое количество липидов (биологические мембраны, жировая ткань, мозг) либо преимущественно состоять из воды (мышечная ткань, соединительная ткань и т.д.). Чем больше жира в структуре, тем в большем количестве в ней накапливается жирорастворимые вещества. Так, жирорастворимый хлорорганический пестицид дихлордифенилтрихлорметилметан (ДДТ) будет накапливаться в жировой клетчатке и сальнике. Хорошо растворимые в липидах молекулы фосфорорганических соединений легко проникают в мозг.
- наличие молекул, активно связывающих токсикант. Например, клетки тканей, с высоким содержанием цистеина (кожа и ее придатки) активно накапливают вещества, образующие прочные связи с сульфгидрильными группами (мышьяк, таллий и т.д.). Белки костной ткани активно связывают двухвалентные металлы (стронций, свинец).
К числу биологических барьеров (с позиций токсикокинетики) относятся структуры самого разного строения. Это клеточные и внутриклеточные мембраны, гистогематические барьеры (например: гематоэнцефалический, плацентарный и т.д.) покровные ткани (кожа, слизистые оболочки). Все барьеры - гидрофобные образования, богатые липидами, поэтому их легко преодолевают вещества с высоким значением коэффициента распределения в системе “масло/воды” (хорошо растворимые в липидах). Многие барьеры содержат “поры” - заполненный водой “каналы” в биологическом барьере (структура и размеры пор в различный барьерах совершенно различны).
Основные свойства барьеров:
- толщина и суммарная площадь. Чем тоньше барьер и чем больше площадь его поверхности, тем большее количество вещества может через него пройти в единицу времени. Как видно из данных приведенных в таблице 3, среди барьеров, образованных покровными тканями, наибольшую поверхность имеет альвеолярно-капиллярный барьер легких и слизистая тонкого кишечника.
Таблица 3.
Площадь “всасывающих” поверхностей тела человека, м2
Орган |
Площадь |
Кожа Полость рта Желудок Тонкий кишечник Толстый кишечник Прямая кишка Полость носа Легкие |
1,2 - 2 0,02 0,1 - 0,2 100 0,5 - 1,0 0,04 - 0,07 0,01 70 |
Однако наибольшую суммарную площадь поверхности, во много раз превосходящую площадь покровных тканей и гистогематических барьеров, имеет гипотетический интегральный барьер, образуемый мембранами всех клеток организма, отделяющий их от внеклеточной жидкости. Поэтому все, что всасывается в организм через покровные ткани, быстро попадает в клетки тех или иных органов;
- наличие и размеры пор. Через поры диффундируют и фильтруются водорастворимые соединения. Диаметр пор и их суммарная площадь в различных биологических барьерах не одинакова (табл. 4).
Таблица 4.
Характеристики различных биологических барьеров
Тип барьера |
Проницаемость для веществ |
Примеры |
Липидная мембрана (поры отсутствуют) |
Хорошо растворимые в жирах, неионизированные молекулы |
Слизистые полости рта, эпителий почечных канальцев, эпителий кожи, гематоэнцефалический барьер |
Липидная мембрана с порами малого диаметра (0,3 - 0,8 нм) |
Хорошо растворимые в жирах и низкомолекулярные водорастворимые молекулы (до 200 Д) |
Эпителий тонкой и толстой кишки |
Липидная мембрана с порами средних размеров (0,8 - 4 нм) |
Липофильные и в меньшей степени гидрофильные молекулы |
Слизистые оболочки глаз, носоглотки, мочевого пузыря |
Липидная мембрана с порами большого диаметра (более 4 нм) |
Липофильные и гидрофильные молекулы с молекулярной массой до 4000 Д |
Печеночные капилляры, желчные капилляры, альвеолярно-капиллярный барьер, капилляры кожи, мышц |
Пористая мембрана |
Гидрофильные молекулы с молекулярной массой до 50000 Д |
Гломерулярный аппарат почек |
- наличие механизмов активного или облегченного транспорта химических веществ. Не растворимые в липидах соединения диффундируют и фильтруются через биопоры, либо преодолевают барьер благодаря механизму активного транспорта. Активный транспорт веществ через биологические мембраны проходит с большей скоростью, чем диффузия. Он осуществляется специальными транспортными белками и следует закономерностям ферментативных реакций. Активный транспорт обеспечивает ток малых молекул и ионов против градиента их концентраций. Для обеспечения процессов нужна энергия, запасенная в форме макроэргических соединений (например, АТФ) (табл. 5).
Таблица 5.
Признаки специфического транспорта
1. Связывание ксенобиотика с наружной поверхностью мембраны и молекулой-носителем |
2. Транслокация связавшегося вещества через мембрану специальным носителем |
3. Высвобождение вещества из связи с носителем внутри клетки |
4. Субстратная специфичность взаимодействия вещества с носителем |
5. Кинетика процесса, описываемая гиперболой (наличие максимальной скорости процесса - Vmax, и константы процесса - Km) |
6. Наличие веществ, избирательно блокирующих процесс |
7. Более высокая скорость процесса в сравнении с процессом диффузии |
Транспорт через биологические мембраны токсикантов, имеющих очень большую массу (белковых токсинов), может осуществляться с помощью цитозов (пиноцитоза, рецептор-связанного эндоцитоза и т.д.). Цитозы - процессы, неразрывно связанные с клеточным метаболизмом (табл. 6).
Таблица 6.
Транспорт веществ путем цитозов
1. Эндоцитозы: захват вещества клеткой 1.1. Фагоцитоз: захват корпускулярных частиц 1.2. Пиноцитоз: захват капель жидкости и растворенных в ней молекул 1.3. Рецептор-обусловленный эндоцитоз: связывание макромолекул на специфических рецепторах клеточной мембраны с последующим образованием шероховатых везикул |
2. Экзоцитзы: выделение веществ из клетки 2.1. Гранулокринная секреция: выделение везикул, содержащих клеточное вещество 2.2. Отпочковывание: выделение части цитоплазмы содержащихся в ней веществ путем краевого отделения части клетки |
3. Трансцитоз (цитопемзис): транспорт веществ через объем клетки |
4. Синцитозы 4.1. Слияние клеток 4.2. Слияние клеток липидными везикулами, содержащими вещества |
5. Интрацитоз: образование везикул и их слияние внутри клетки |
4.2. Резорбция
Резорбция - это процесс проникновения вещества из внешней среды в кровяное или лимфатическое русло организма.
Основными структурами, участвующими в резорбции токсикантов, являются легкие (ингаляционное воздействие), кожа (трансдермальное воздействие), желудочно-кишечный тракт (энтеральное воздействие, пероральная интоксикация).
Ингаляционное поступление
Легкие являются основным путем поступления в организм газов (паров) и аэрозолей.
Благодаря большой площади поверхности и тесному контакту воздуха с капиллярным руслом, процесс резорбции здесь проходит с высокой эффективностью.
Скорость перехода газа (пара) из вдыхаемого воздуха в кровь тем выше, чем больше градиент концентрации в системе воздух-кровь. Содержание газа в оттекающей от легких крови пропорционально его парциальному давлению во вдыхаемом воздухе. Усиление легочной вентиляции увеличивает диффузию газа (пара) в направлении концентрационного градиента или градиента парциального давления (из организма - в организм, в зависимости от указанных выше условий). Скорость резорбции газообразного (парообразного) токсиканта увеличивается с увеличением скорости кровотока в легочной ткани.
Захват газов кровью зависит от их растворимости в крови. При прочих равных условиях, состояние равновесия в системе альвеолярный воздух - кровь, устанавливается тем быстрее, чем менее растворим токсикант в крови.
Легочная резорбция аэрозолей. Аэрозоли представляют собой фазовые смеси, состоящие из воздух и мелких частиц жидкости (туман) или твердого вещества (дымы). Закономерности резорбции аэрозолей в дыхательных путях отличаются от закономерностей резорбции газов (паров).
Резорбция в дыхательной системе аэрозоля является функцией количества вещества, адсорбировавшегося на поверхности легких и дыхательных путей и зависит от концентрации аэрозоля, размера его частиц, частоты и глубины дыхания.
Адсорбция крупных частиц (около 5 мкм) происходит преимущественно в верхних дыхательных путях, мелких частиц (около 1 мкм) - в глубоких отделах дыхательных путей и альвеолах.
В силу тесного контакта между альвеолярным воздухом и капиллярным руслом, порозности альвеолярно-капиллярного барьера в дыхательных путях могут всасываться даже макромолекулы (ботулотоксин и др.). Частицы аэрозоля, адсорбировавшиеся на поверхности дыхательных путей, могут захватываться макрофагами и с ними поступать в кровоток.
Некоторые вещества, действуя в форме газов и аэрозолей, обладая высокой реакционной способностью, взаимодействуют непосредственно с легочной тканью, вызывая местное действие (хлор, фосген и т.д.). Такие вещества резорбции практически не подвергаются; закономерности, характеризующие процесс, на них не распространяются.
Поступление через кожу
Морфология, биохимия кожи препятствуют резорбции большинства токсикантов. Для водорастворимых веществ кожа представляет непреодолимый барьер. Некоторой проницаемостью кожные покровы обладают для веществ, хорошо растворимых в липидах (например, для зомана, фосфорилтиохолинов, иприта, люизита, тетраэтилсвинца и т.д.). Возможны два способа прохождения токсиканта через кожу: трансэпидермальный (через клетки эпидермиса) и трансфолликулярный (через волосяные фолликулы).
Помимо способности растворяться в липидах, на скорость резорбции веществ через кожу влияет: агрегатное состояние, дисперсность (размер частиц аэрозолей), площадь и область кожных покровов, на которую нанесен токсикант, интенсивность кровотока в кожных покровах.
Механические повреждения, мацерация кожи, раздражение, сопровождающиеся усилением кровотока, усиливают процесс резорбции токсикантов. Некоторые органические растворители, разрушающие липидный слой кожи, могут усиливать кожную резорбцию.
Поступление через желудочно-кишечный тракт
Энтеральная резорбция предполагает хотя бы минимальную растворимость токсиканта в содержимом ЖКТ. Слизистая желудочно-кишечного тракта в силу особенностей строения приспособлена для быстрой резорбции веществ. Поскольку сосудистая сеть желудочно-кишечного тракта развита хорошо, резорбция здесь не лимитирована фактором кровоснабжения. Закономерности резорбции аналогичны во всех отделах желудочно-кишечного тракта.
Имеющиеся особенности всасывания в различных отделах ЖКТ определяются:
- различиями рН содержимого отделов. Содержимое желудка имеет кислую реакцию. Слабые кислоты (например, производные барбитуровой кислоты и др.), в основном, здесь находятся в недиссоциированном состоянии, и потому относительно легко всасываются. Слабые основания (алкалоиды), напротив, в желудочном соке находятся в форме ионов, и потому - не всасываются. В кишечнике рН - щелочная и поэтому здесь преобладает ионизированная форма кислот и неионизированная форма слабых оснований.
- неодинаковой площадью всасывающей поверхности (см. табл. 1).
Количество и качество пищи, принятой вместе (до, после) с токсикантом могут существенно повлиять на скорость его резорбции.
4.3. Распределение
Транспорт веществ кровью
Всосавшееся вещество попадает в кровь и с током крови разносится по организму. Кровь может осуществлять транспорт веществ в свободной и связанной форме.
Способностью связывать ксенобиотики обладают альбумины, гликопротеиды и липопротеиды плазмы крови. В основе связывания ксенобиотиков белками лежит образование между ними слабых гидрофобных, водородных и ионных связей. Связанные соединения приобретают характеристики распределения, свойственные белкам. Сильные связи белок-ксенобиотик затрудняют отток вещества в ткани.
Положительно заряженные ксенобиотики могут адсорбироваться на отрицательно заряженной мембране эритроцитов. Липофильные вещества проникают через эритроцитарную мембрану и взаимодействуют с гемоглобином. Связавшаяся с гемоглобином фракция ксенобиотика порой не в состоянии диффундировать из клетки и длительно циркулирует в таком состоянии в крови.
Поступление в ткани
Характер распределения токсикантов в организме определяется общими закономерностями (см. выше). Дополнительными факторами, влияющими на процесс, являются интенсивность кровоснабжения органов (рис. 6) а также суммарная площадь их капиллярного русла (табл. 7).

Рисунок 6. Особенности кровоснабжения различных органов и тканей
Таблица 7.
Площадь капиллярного русла различных органов собаки, см2/г ткани
Мозг |
Почки |
Печень |
Легкие |
Мышцы |
240 |
350 |
250 |
250 |
70 |
Так, например, захвату ксенобиотиков печенью способствуют хорошее кровоснабжение органа, высокая степень порозности эндотелия капиллярного русла. Клеточные мембраны гепатоцитов также содержат большое количество пор, что облегчает поступление веществ в клетки. Помимо указанного, накоплению ксенобиотиков в органе способствуют механизмы их активного захвата из плазмы крови (активный транспорт кислот, щелочей, пиноцитоз макромолекул).
Напротив, проникновение из крови в ЦНС многих (прежде всего водорастворимых) ксенобиотиков существенно затруднено наличием так называемого гематоэнцефалического барьера.
Гематоэнцефалический барьер формируется при участии ряда анатомических структур головного мозга.
Во-первых, эндотелий капиллярного русла головного мозга отличается от эндотелия других органов чрезвычайно тесным контактом клеток друг с другом. Эффективный радиус пор капилляров мозга значительно меньше, чем в других тканях и составляет, например, у кролика 0,7 - 0,9 нм. Крупные молекулы не в состоянии проникать через эндотелиальный барьер. Водорастворимые и заряженные молекулы могут проходить непосредственно через биомембраны и цитоплазму эндотелиальных клеток только в том случае, если имеют малые размеры (CN-). В норме эндотелиальные клетки мозга лишены способности к пиноцитозу. Лишь при некоторых патологических состояниях (гипоксия мозга) в эндотелии сосудов образуются пиноцитарные вакуоли, при этом возрастает проницаемость гематоэнцефалического барьера, увеличивается уязвимость мозга для действия токсикантов.
Во-вторых, капилляры мозга плотно окутаны отростками астроцитарной глии. Астроцитарная оболочка препятствует проникновению гидрофильных ксенобиотиков из крови в ткань мозга и их взаимодействию с другими клеточными элементами. В некоторых областях мозга, таких как срединное возвышение гипоталямуса, медиальная преоптичесая область, область четвертого желудочка мозга, астроцитарная оболочка капилляров развита сравнительно слабо. В этих регионах возможно проникновение водорастворимых и даже заряженных молекул токсикантов в ЦНС, но также в ограниченном количестве.
Наконец последней структурой, вносящей вклад в формирование ГЭБ, является базальная мембрана, залегающая между эндотелиальными клетками капилляров и отростками астроцитов. Эта мембрана имеет упорядоченную фибриллярную макропротеидную структуру, обеспечивающую избирательное проникновение в мозг ряда важных для обеспечения его жизнедеятельности молекул (кислород, глюкоза и др.).
Аналогичный ГЭБ барьер окружает периферический отдел нервной системы (гематоневральный барьер). Однако также как и в ЦНС здесь имеются анатомические образования с повышенной проницаемостью для токсикантов. К числу таких относятся спинальные корешки дорзальных (чувствительных) ганглиев и вегетативные (автономные) ганглии.
Плацентарный барьер проницаем для многих веществ, в том числе высокомолекулярных соединений. Это обстоятельство может иметь неблагоприятные последствия для плода особенно при попадании токсикантов в организм матери в первые 12 недель беременности (период органогенеза).
Важным элементом распределения некоторых ксенобиотиков в организме является их депонирование. Депонирование - это накопление и длительное сохранение химического вещества в относительно высокой концентрации в одном или нескольких органах (или тканях). Порой депонирование не сопровождается повреждением биологически значимых молекул-мишеней (токсический процесс не формируется).
В основе депонирования лежат два явления:
- высокое физико-химическое сродство ксенобиотика к неким компонентам биосистемы (химическое взаимодействие с элементами биосистемы или избирательное накопление липофильных веществ в жировой ткани);
- кумуляция благодаря избирательному, активному захвату токсиканта клетками органа (ткани).
Ряд токсикантов депонируется в тканях настолько прочно, что выведение их из организма практически невозможно. Например, период полуэлиминации кадмия из организма человека составляет более 20 лет.
Явление депонирование веществ связано с явлением кумуляция, но не тождественно ему. Под материальной кумуляцией понимают процесс постепенного накопления токсиканта при длительном поступлении в организм преимущественно в области функционально-значимых структур-мишеней, действие на которые приводит к развитию токсического процесса. Явление кумуляции лежит в основе хронических интоксикаций. (В ряде случаев выявляется так называемая функциональная кумуляция - накопление неблагоприятных эффектов токсиканта при его продолжительном введении).
4.4. Элиминация
Элиминацией называется вся совокупность процессов, приводящих к снижению содержания токсиканта в организме. Она включает процессы экскреции (выведения) ксенобиотика из организма и его биотрансформацию.
4.4.1. Экскреция
Основными органами экскреции являются легкие (для летучих соединений), почки, печень, в меньшей степени слизистая желудочно-кишечного тракта, кожа и ее придатки.
Легочная экскреция
Газы и пары летучих веществ выделяются через легкие в соответствии с градиентом их парциального давления между кровью и альвеолярным воздухом. Закономерности экскреции газообразных (парообразных) веществ полностью идентичны закономерностям их поступления через легкие (см. выше).
Почечная экскреция
Почки - важнейший орган выделения. Через почки выводятся продукты обмена веществ, многие ксенобиотики и продукты их метаболизма. Масса почек чуть менее 0,3% массы тела, однако, через орган протекает около 30% минутного объема крови. Благодаря хорошему кровоснабжению, находящиеся в крови вещества, подлежащие выведению, быстро переходят в орган, а затем и выделяются с мочой. В основе процесса лежат три механизма (рис. 7):
- фильтрация через гломерулярно-капиллярный барьер;
- секреция эпителием почечных канальцев;
- реабсорбция клетками эпителия.
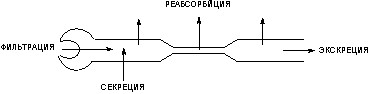
Рисунок 7. Механизмы, регулирующие процесс экскреции ксенобиотиков через почки
Фильтрация:
- все низкомолекулярные вещества, находящиеся в растворенном состоянии в плазме крови.
Секреция:
- органические кислоты, мочевая кислота и т.д.;
- сильные органические основания, тетраэтиламмоний, метилникотинамид и т.д.;
Реабсорбция:
- пассивная обратная диффузия всех жирорастворимых веществ;
- неионизированные молекулы органических кислот;
- активная реабсорбция глюкозы, лактата, аминокислот, мочевой кислоты, электролитов, воды.
Через почки протекает около 700 мл плазмы крови в минуту, из которых 20% (125 - 130 мл/мин) отфильтровывается через гломерулярно-капиллярный барьер. Собирающаяся в почечных клубочках первичная моча, по сути, представляет собой сыворотку крови. Более 99% отфильтрованной жидкости реабсорбируется в почечных канальцах. При этом концентрация растворенных в моче веществ возрастает в 100 раз. Хорошо растворимые в липидах соединения, по этой причине, практически полностью диффундируют из первичной мочи, через эпителий почечных канальцев, обратно в кровь (реабсорбция). Выведение таких веществ из организма практически не происходит.
Способность к выведению через почки у слабых кислот и оснований во многом определяется рН первичной мочи: выведение слабых оснований усиливается при подкислении мочи (преобладает ионизированная форма оснований - затруднена реабсорбция их в канальцах); выделение слабых кислот усиливается при подщелачивании мочи (преобладает ионизированная форма кислот).
Многие токсиканты выводятся через почки с помощью механизма активной секреции. Функции секретирующей структуры выполняет эпителий почечных канальцев. Существуют независимые механизмы активного транспорта для веществ со щелочными и кислотными свойствами.
Печеночная экскреция
Печеночная экскреция - отчасти следствие простой диффузии веществ в желчь, отчасти - активного транспорта ксенобиотиков, осуществляемого гепатоцитами. Благодаря активному транспорту отношение концентраций веществ в желчи и плазме крови значительно выше 1. Высокая концентрация химических веществ в желчи обеспечивает осмос воды из сосудистого русла в желчные ходы. Наиболее активно печенью выводятся вещества с молекулярной массой более 600 дальтон, имеющие в структуре полярную анионную или катионную группу.
Ряд ксенобиотиков, выделяющихся с желчью (липофильные вещества, либо гидрофильные соединения, превращающиеся в липофильные под влиянием кишечной флоры), способны к обратному всасыванию слизистой кишечника и по системе портальной вены повторно накапливаются в печени. Это явление называется гепато-энтеральной циркуляцией.
4.4.2. Метаболизм ксенобиотиков (биотрансформация)
Многие ксенобиотики в организме подвергаются метаболическим превращениям (биотрансформации).
Основной биологический смысл биотрансформации - превращение исходного токсиканта в форму, удобную для скорейшей экскреции. Биотрансформация - ферментативный процесс.
Выделяют 2 фазы метаболических превращений чужеродных соединений (рис. 8):
- I фаза, окислительной, восстановительной либо гидролитической трансформации молекулы;
- II фаза - синтетических превращений.
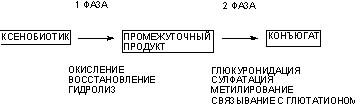
Рисунок 8. Фазы метаболизма чужеродных соединений
В первой фазе происходят следующие реакции биотрансформации:
- окисление - гидроксилирование, декарбоксилирование, образование оксидов, десульфурирование, дегалогенизирование молекул, окисление спиртов и альдегидов;
- восстановление - восстановление альдегидов, азовосстановление, нитровосстановление;
- гидролиз - расщепление эфиров, амидных связей.
Основные энзимы, активирующие процессы биотрансформации первой фазы: цитохром Р-450 зависимые оксидазы смешанной функции (Р-450), флавинсодержащие монооксигеназы смешанной функции (ФМО), гидропероксидазы, алкоголь и альдегиддегидрогеназы, флавопротеинредуктазы, эпоксидгидраза.
Нередко в результате метаболизма вещества на первом этапе образуются промежуточные продукты, обладающие высокой биологической активностью (табл. 8).
Таблица 8.
Примеры биотрансформации ксенобиотиков с образованием активных промежуточных продуктов в ходе l фазы метаболизма
Исходное вещество |
Продукт реакции |
Класс соединения |
Энзимы |
хлороформ |
фосген |
ацилгалоген |
Р-450 |
аллиловый спирт |
акролеин |
ненасыщенный альдегид |
алкоголь дегидрогеназа |
дихлорэтан |
хлорацетальдегид |
альдегид |
Р-450 |
диметил нитрозамин |
ион метилдиазониума |
алкил диазониум |
Р-450 |
гексан |
гександион |
дикетон |
Р-450 алкоголь дегидрогеназа |
винилхлорид |
хлорэтиленэпоксид |
эпоксид |
Р-450 |
бенз(а)пирен |
бензпирендиолэпоксид |
диол эпоксид |
Р-450 эпоксидгидролаза пероксидаза |
бензол |
бензохинол |
хинол |
Р-450 пероксидаза |
тетрахлор метан |
тетрахлорметил-радикал |
алкильный радикал |
Р-450 |
р-аминофенол |
р-бензохинонимин |
хинонимин |
пероксидаза |
Большинство энзимов первой фазы локализованы в гладком эндоплазматическом ретикулуме клетки (микросомальные энзимы); часть - в растворимой фазе цитозоля (алкоголь-, альдегиддегидрогеназа, эстеразы). Некоторые гидролазы содержатся в плазме крови (карбоксилэстераза, арилэстераза).
Во второй фазе происходят следующие реакции биотрансформации:
- конъюгация промежуточных продуктов с глюкуроновой кислотой,
- конъюгация с серной кислотой,
- конъюгация с глутатионом,
- метилирование,
- ацилирование,
- образование меркаптосоединений.
Основные энзимы, активирующие процесс биотрансформации второй фазы: УДФ-глюкуронозилтрансфераза, сульфотрансфераза, ацетил-КоА-амин-N-ацетилтрансфераза, глутатион-S-трансфераза, цистеинконъюгирующие лиазы.
Общая характеристика реакций конъюгации ксенобиотиков представлена на таблице 9.
Таблица 9.
Характеристика основных реакций конъюгации ксенобиотиков
Реакция |
Присоединяемый агент |
Функциональная группа ксенобиотика |
А. Реакции, протекающие при участии активированных форм присоединяемых агентов |
||
Конъюгация с глюкуроновой кислотой |
УДФ-глюкуроновая кислота |
-ОН; -СООН; NH2; -NR2; -SH; -CH |
Конъюгация с глюкозой |
УДФ-глюкоза |
-ОН; -SH; COOH; =NH |
Сулфатация |
ФАФС |
-ОН; -NH2; -SH |
Метилирование |
S-аденозилметионин |
-ОН; -NH2 |
Ацетилирование |
Ацетил КоА |
-ОН; -NH2 |
Детоксикация цианида |
Сульфон-сульфид |
-CN- |
Б. Реакции, протекающие при участии активированных форм ксенобиотиков |
||
Конъюгация с глутатионом |
Глутатион |
Ареноксиды; эпоксиды; галогенированные алкильные и арильные углеводороды |
Конъюгация с аминокислотами |
Глицин; глутамин; орнитин; таурин; цистеин |
-СООН |
Большинство энзимов второй фазы локализованы в растворимой фазе цитозоля.
Основным органом, метаболизирующим ксенобиотики, является печень. В меньшей степени активно идут превращения ксенобиотиков в легких, почках, кишечнике, коже, селезенке и других тканях. Некоторые вещества метаболизируют в крови. Как правило, в метаболических превращениях ксенобиотика принимают участие несколько органов (рис. 9).
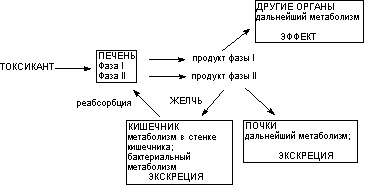
Рисунок 9. Локализация этапов метаболических превращений ксенобиотиков в организме
На интенсивность биотрансформации ксенобиотиков могут влиять различные факторы.
Естественные факторы:
- вид организма, пол, возраст, состояние питания.
Экзогенные факторы:
- повреждение структур, метаболизирующих ксенобиотики. На метаболизме ксенобиотиков сказываются: гепатоэктомия, адреналэктомия, кастрация.
- химические вещества, способные вызывать индукцию (усиление) метаболизма, конкурентное и неконкурентное ингибирование метаболизма.
К числу индукторов биотрансформации чужеродных веществ относятся: барбитураты, полициклические углеводороды, андрогенные стероиды, анаболические стероиды, глюкокортикоиды, спиронолактон и др.
К числу ингибиторов биотрансформации относятся: метирапон, пиперонилбутаксид, 7,8-бензофлавон, SKF-525, Lilly 18947 и др.
Биологическими последствиями биотрансформации ксенобиотиков могут стать:
- ослабление или полная потеря биологической активности токсикантов (ФОВ, синильная кислота);
- изменение биологической активности: исходное вещество и продукты его метаболизма в достатчной степени токсичны, но действуют на различные биомишени (метанол, дихлоэтан и т.д.);
- усиление токсичности или появление новых свойств (иприт, фторэтанол, бенз(а)пирен и др.).
Процесс увеличения активности токсиканта в ходе его метаболизма называется биоактивацией.
Биоактивация, как правило, осуществляется в ходе первой фазы метаболизма (образование промежуточных продуктов метаболизма, часто обладающих высокой реакционной способностью).
В ходе второй фазы метаболизма биологическая активность продукта превращения обычно существенно снижается.
Неопределенные последствия метаболизма многих ксенобиотиков заставляют с большой осторожностью относиться к модификации процесса с помощью доступных в настоящее время средств и методов.
4.5. Количественные характеристики токсикокинетики
Количественная токсикокинетика - раздел токсикологии, разрабатывающий математические модели, описывающие поступление, распределение, элиминацию ксенобиотиков.
Основой создания токсико-кинетических моделей является получаемые экспериментально графики зависимости концентрации веществ в крови и тканях от времени после различных способов введения токсиканта (рис. 10).
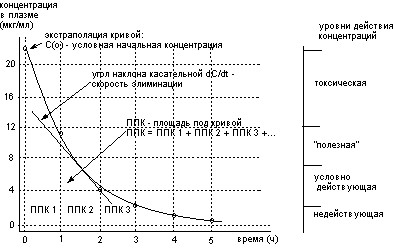
Рисунок 10. Зависимость концентрации вещества в плазме крови от времени после внутривенного введения
Исходными данными для анализа являются:
- введенное количество вещества (D - мг);
- концентрация в крови (C - мг/мл), определенная в различное время после введения D;
- время от начала введения (t - мин).
На основании полученных данных рассчитывается площадь под кривой (ППК - мг мин/мл), ограниченная осями координат и кривой зависимости “концентрация в крови - время”.
Изучение зависимости концентрации вещества в плазме крови от времени позволяет установить наиболее часто используемые характеристики токсикокинетики:
- квота резорбции, QR
- объем распределения, VD
- период полуэлиминации, t1/2
- общий клиренс, Cl
Квота резорбции (биодоступность). Количественной характеристикой способности вещества проникать в организм различными путями может служить величина “квоты резорбции вещества (КРВ)”. КРВ представляет собой отношение всосавшегося вещества к общему количеству апплицированного тем или иным способом. КРВ может быть рассчитана путем построения диаграмм в координатах: “время-концентрация токсиканта в крови”. Площадь под кривой такой диаграммы (ППК) определяется, среди прочего, количеством всосавшегося токсиканта. Если соотнести величину ППК токсиканта для внутривенного введения (ППКiv) с величиной ППКd при ином (любом) способе аппликации, то значение коэффициента QR = ППКd/ППКiv и определит величину квоты резорбции для исследуемого способа введения токсиканта. Чем ближе значение QR к 1, тем лучше всасывается вещество исследуемым способом.
При анализе данных необходимо учитывать, что в таком прочтении величина биодоступности не в полной мере отражает последствия действия токсиканта на организм. Дело в том, что ППК при разных способах воздействия может быть одинаковой, но различная скорость поступления и одновременно протекающая элиминация соединения могут привести к совершенно разным эффектам одного и того же вещества. Пример такой ситуации приведен на рисунке 11.
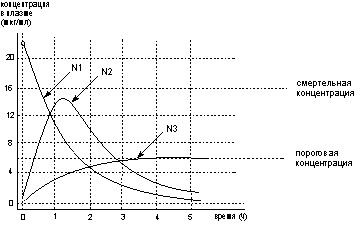
Рисунок 11. Кривые динамики концентрации вещества А в плазме крови экспериментального животного
Вещество введено в дозе D различными способами:
N1 - внутривенное введение
N2 - введение через желудочно-кишечный тракт
N3 - введение через желудочно-кишечный тракт в форме, адсорбированной на ионно-обменной смоле
Как видно из данных приведенных на рисунке, не смотря на прекрасную всасываемость вещества в ЖКТ, смертельный эффект может развиться лишь при его внутривенном введении в дозе D.
Объем распределения. Абсолютным объемом распределения вещества (VD) называется сумма мнимых объемов внутренней среды организма, в которых вещество распределилось таким образом, что его концентрация в них равна концентрации в плазме крови (С).
VD рассчитывается как отношение введенного количества токсиканта (D) к величине его концентрации в плазме крови:
VD = D/С
Относительный объем распределения (VR) целесообразно рассчитывать с учетом массы организма (М):
VR = VD /М - выражается в процентах от массы тела.
Для веществ, распределяющихся только в плазме крови, VR равен объему плазмы крови, распределяющихся во внеклеточной жидкости - суммарному объему плазмы крови и внеклеточной жидкости и т.д. Для веществ, активно связывающихся тканями организма, относительный объем распределения может быть более 100%.
Периодом полуэлиминации называется время, в течение которого элиминирует половина введенного количества токсиканта. Период полуэлиминации зависит от строения вещества и функционального состояния органов, метаболизирующих и экскретирующих ксенобиотики. В подавляющем большинстве случаев элиминации осуществляется в соответствии с кинетическим уравнением 1-го порядка, т.е. зависимость “концентрация-время” носит экспоненциальный характер (рис. 10). Представление зависимости в координатах “ln концентрации - время”, позволяет преобразовать ее в прямую (рис. 12).
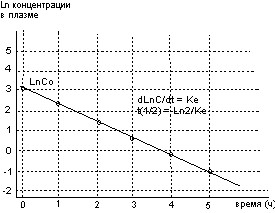
Рисунок 12. Зависимость концентрации вещества в плазме крови от времени после внутривенного введения в системе полулогарифмических координат
Величина угла наклона кривой (lnC/t) называется константой скорости элиминации (Ке), зная которую, легко рассчитать период полуэлиминации (t1/2). Зная период полуэлиминации, просто оценить время пребывания вещества в организме: при в/в введении вещества - это время приблизительно составляет 5t1/2. Через этот промежуток времени в организме остается не более 3% от введенного количества токсиканта.
Клиаренс (Cl - мл/мин) - часть абсолютного объема распределения (условно: плазмы крови), полностью освобождающегося от ксенобиотика в единицу времени. Величина клиаренса может быть рассчитана по формуле:
Cl = D/ППК, где
D - доза введенного вещества (мг)
ППК - площадь под кривой (мг мин/мл).