|
|
|
|
ГЛАВА 28. ПСИХОТРОПНЫЕ ЛЕКАРСТВЕННЫЕ СРЕДСТВА
ОСОБЕННОСТИ КЛИНИЧЕСКОЙ ФАРМАКОЛОГИИ ПСИХОТРОПНЫХ СРЕДСТВ
Лекарственные средства, избирательно влияющие на эмоции, познавательную (когнитивную) функцию и поведение человека, называют психотропными или психоактивными. По данным ВОЗ, приблизительно одна треть взрослого населения развитых стран принимает психотропные препараты, и на них в мире выписывают около 20% всех рецептов. В последнее время в связи с появлением нового поколения препаратов, обладающих качественно более высокой переносимостью, психотропные средства уверенно перешагнули порог психиатрических клиник и амбулаторий, их стали активно применять врачи общемедицинской практики, прежде всего в первичной медицинской сети. Поэтому любой врач, назначающий психотропные препараты, должен быть в курсе новейших научно-исследовательских данных в этой области. Основные направления здесь - разработка новых препаратов и показаний к применению уже существующих, анализ фармакокинетики и фармакодинамики психофармакологических средств, а также диагностика и лечение нежелательных эффектов, связанных с их применением.
Механизм действия психотропных средств
Многое из того, что мы знаем о биохимии психических нарушений, - это результат исследований, которые были начаты ещё в 50-х годах ХХ в. В 1957 г. было показано, что резерпин вызывает истощение моноаминов в нервной системе, нарушая хранение этих нейропередатчиков в нервных клетках. Примерно в это же время было обнаружено, что препараты, подобные изониазиду ( применяемые для лечения туберкулёза), ингибируют действие моноаминоксидазы - фермента, разрушающего моноаминовые нейропередатчики в нервных синапсах. При исследовании трициклических агентов (препаратов, содержащих три углеродных кольца в своей структуре) было выявлено, что они дают антидепрессивный эффект и ингибируют обратный захват моноаминов
(норадреналина и серотонина) нервными клетками. Таким образом, в середине 60-х годов исследователи предположили, что психические нарушения связаны с дефицитом моноаминов в головном мозге, а эффект действия моноаминов, возможно, зависит от степени их связывания с постсинаптическими рецепторами.
На рис. 28-1 показано, что передача нервного импульса осуществляется при помощи нейропередатчиков-моноаминов, которые выходят в синаптическую щель из везикул пресинаптического нервного окончания. Одна часть нейротрансмиттеров связывается с опре- делёнными рецепторами постсинаптической мембраны, другая часть разрушается моноаминокидазой (МАО), а оставшиеся в синаптической щели моноамины подвергаются обратному захвату через ферментативный насос пресинаптической мембраны, и передача нервного импульса прекращается. Затем всё повторяется сначала. При психических нарушениях количество моноаминов в синаптической щели недостаточно для передачи нормального нервного импульса. Кроме того, поскольку каждый из моноаминов отвечает за определённые психические функции, то дефицит нейромедиаторов способствует развитию определённых клинических проявлений различной психической патологии (табл. 28-1).
Появление моноаминовой теории привело к разработке многих новых психотропных средств, поэтому условно все группы психотропных средств можно разделить по доминирующему в патогенезе психического расстройства нейромедиатору (табл. 28-2).
Таблица 28-1. Роль основных нейромедиаторов
 Таблица 28-2. Деление групп психотропных средств по доминирующему нейромедиатору в патогенезе психических расстройств
Таблица 28-2. Деление групп психотропных средств по доминирующему нейромедиатору в патогенезе психических расстройств
 Механизмы
действия психотропных средств, как и патогенез заболеваний, для лечения
которых их применяют, до сих пор не изучены полностью. У большинства
исследователей не вызывает сомнений роль моноаминов в процессах
синаптической передачи нервного возбуждения. Однако унитарная
моноаминовая концепция психических расстройств на примере депрессии не
способна в полной мере объяснить действие, например, антидепрессантов.
Наиболее важная из этих причин состоит в отсутствии убедительных
доказательств того, что депрессию характеризует состояние
недостаточности норадренергических и серотонинергических
нейромедиаторов. Напротив, у многих депрессивных больных повышен
метаболизм норадреналина. Более того, блокада обратного захвата
нейромедиаторов и подавление МАО под действием антидепрессантов
развиваются быстро (в течение нескольких часов) после приёма препаратов,
но антидепрессивный эффект проявляется значительно позже, очень редко
раньше 3 нед. В настоящее время ведут исследования, изучающие
«медленные» изменения в нейронах в процессе развития эффекта препаратов.
Традиционные гипотезы сменяют современные интегративные концепции
депрессии, постулирующие многомерное (нейромедиаторная,
гипоталамо-гипофизарно-адреналовая, тиреоидная,
геномрегуляторная-внутриклеточ- ная «оси») воздействие антидепрессантов.
R.S. Duman (2004) кратко, но ёмко определяет современное состояние
проблемы крылатым выражением: «от моноаминов к нейропластичности».
Механизмы
действия психотропных средств, как и патогенез заболеваний, для лечения
которых их применяют, до сих пор не изучены полностью. У большинства
исследователей не вызывает сомнений роль моноаминов в процессах
синаптической передачи нервного возбуждения. Однако унитарная
моноаминовая концепция психических расстройств на примере депрессии не
способна в полной мере объяснить действие, например, антидепрессантов.
Наиболее важная из этих причин состоит в отсутствии убедительных
доказательств того, что депрессию характеризует состояние
недостаточности норадренергических и серотонинергических
нейромедиаторов. Напротив, у многих депрессивных больных повышен
метаболизм норадреналина. Более того, блокада обратного захвата
нейромедиаторов и подавление МАО под действием антидепрессантов
развиваются быстро (в течение нескольких часов) после приёма препаратов,
но антидепрессивный эффект проявляется значительно позже, очень редко
раньше 3 нед. В настоящее время ведут исследования, изучающие
«медленные» изменения в нейронах в процессе развития эффекта препаратов.
Традиционные гипотезы сменяют современные интегративные концепции
депрессии, постулирующие многомерное (нейромедиаторная,
гипоталамо-гипофизарно-адреналовая, тиреоидная,
геномрегуляторная-внутриклеточ- ная «оси») воздействие антидепрессантов.
R.S. Duman (2004) кратко, но ёмко определяет современное состояние
проблемы крылатым выражением: «от моноаминов к нейропластичности».
Предполагают, что в основе снижения регуляции лежит клеточный механизм, определяющий поддержание гомеостаза моноаминовых функций рецептора (межклеточные мостики регулируют значительную часть клеточных белков генов-мишеней, а эта система, в свою очередь, может служить «мишенью» воздействия антидепрессантов). В течение всего периода лечения моноаминовые рецепторы со сниженной регуляцией поддерживаются в активном состоянии. Согласно гипотезе нейропластичности, депрессия может быть результатом изменений нейрональной адаптации различных областей мозга, контро-
лирующих настроение. Эта гипотеза, получившая экспериментальное подтверждение при изучении эмоций у животных, экстраполирована на механизмы развития депрессии у человека. При изучении методами прижизненной визуализации мозга у взрослых депрессивных пациентов были выявлены структурные изменения (снижение нейрогенеза в гиппокампе, атрофия пирамидальных нейронов гиппокампа, редукция плотности глии и размеров нейронов в префронтальной коре), а также изменения синаптической трансмиссии. Представление о том, что антидепрессанты способны предотвращать атрофию нейронов гиппокампа и их гибель при депрессии, опирается на данные о воздействии тианептина на нервные клетки этой области головного мозга. Таким образом, концепция нейрональной адаптации (пластичности) подчеркивает потенциал головного мозга, реализуемый в экстремальных условиях.
В анатомическом плане все психотропные ЛС оказывают влияние на кору головного мозга и подкорковые структуры, прежде всего лимбическую область, базальные ганглии, гипоталамус.
Цель лекарственной терапии психических расстройств - смягчение или устранение патологических моделей поведения, мышления или настроения с помощью химических или других биологических средств.
Особенности действия психотропных средств
У лекарственных средств, применяемых для лечения психических расстройств, есть так называемое собственное психотропное действие, заключённое в характерном для каждого препарата (группы препаратов) влиянии на аффективное состояние человека. Оно выражается в первую очередь в затормаживающем (психолептическом) или активирующем (стимулирующем, психоаналептическом) влиянии на психическую активность.
Спектр психотропной активности, относительно индивидуальный у каждого препарата (у группы препаратов), отражает его тропизм к психопатологическим проявлениям (синдромам);
Избирательная антипсихотическая активность, выражающаяся как в общем (глобальное влияние на разные проявления психоза), так и в избирательном (элективном, «прицельном») воздействии на симп- том-мишень, главным образом на психопатологические расстройства - психотического и невротического уровней.
Классификация препаратов
Психофармакологические средства по основному, собственно психотропному действию, традиционно разделяют на психолептические и
психоаналептические (табл. 28-3). Психолептические средства оказывают успокаивающее, затормаживающее и депримирующее действие на ЦНС. Напротив, психоаналептические средства обладают возбуждающим, стимулирующим, активирующим и психоэнергизирующим действием. Следует иметь в виду, что некоторые авторы к психоаналептическим средствам относят и нейрометаболические стимуляторы (ноотропные средства, церебропротекторы, адаптогены).
Таблица 28-3. Классификация психотропных средств
 Вместе
с тем необходимо заметить, что приведённая классификация носит
достаточно условный характер, так как между отдельными классами
психотропных средств существуют многочисленные переходные препараты,
которые одновременно обладают свойствами обеих групп. Примером подобных
переходных препаратов могут служить тимонейролептики (сульпириди
тимотранквилизаторы (алпразолам) , а также транквилоноотропы
(мексидол*). Кроме того, клиническая практика показывает, что один
препарат может быть эффективным при разнообразных состояниях (например,
карбамазепин эффективен не только как противоэпилептическое средство, но
и при маниях, депрессиях, агрессивном поведении, болевых синдромах и
др.), а представители одного класса психотропных средств могут с успехом
применять при различных психопатологических феноменах (например,
антидепрессанты эффективны и при депрессиях, и при тревожных, и
обсессивно-компульсивных расстройствах, и др.), что может объясняться
либо широтой диапазона психофармакологического действия препарата, либо
известной общностью патогенеза некоторых психопатологических состояний.
Вместе
с тем необходимо заметить, что приведённая классификация носит
достаточно условный характер, так как между отдельными классами
психотропных средств существуют многочисленные переходные препараты,
которые одновременно обладают свойствами обеих групп. Примером подобных
переходных препаратов могут служить тимонейролептики (сульпириди
тимотранквилизаторы (алпразолам) , а также транквилоноотропы
(мексидол*). Кроме того, клиническая практика показывает, что один
препарат может быть эффективным при разнообразных состояниях (например,
карбамазепин эффективен не только как противоэпилептическое средство, но
и при маниях, депрессиях, агрессивном поведении, болевых синдромах и
др.), а представители одного класса психотропных средств могут с успехом
применять при различных психопатологических феноменах (например,
антидепрессанты эффективны и при депрессиях, и при тревожных, и
обсессивно-компульсивных расстройствах, и др.), что может объясняться
либо широтой диапазона психофармакологического действия препарата, либо
известной общностью патогенеза некоторых психопатологических состояний.
Для клинической практики также характерно применение более высоких доз препаратов, чем дозы, утверждённые соответствующими органами контроля доз препаратов. Для упрощения лекарственного режима применяют некоторые комбинированные препараты, хотя при этом возникают сложности в связи с тем, что ограничиваются воз-
можности врача в выборе дозы каждого компонента и минимизации нежелательных эффектов. Использование комбинированных препаратов может также быть причиной назначения двух медикаментов, когда недостаточно эффективности одного.
Особенности фармакокинетики
При острых психотических состояниях кратчайший путь к достижению терапевтических концентраций лекарственных средств в крови - их внутривенное введение, которое, однако, чревато высоким риском внезапных угрожающих жизни последствий. При хронических состояниях используют депонированные формы некоторых антипсихотических препаратов, что делает возможным их назначение 1 раз в 1-4 нед.
Все основные виды метаболических превращений психофармакологических средств осуществляет группа ферментов цитохромов Р-450 (CYP), особенно CYP2D6 и CYP3A3/4, преимущественно локализующихся в печени, мозге и кишечнике. В случаях, когда болезненный процесс или одновременно применяемый второй препарат воздействуют на клиренс психотропного вещества, концентрация последнего в крови может достигать токсического уровня.
Особенности фармакодинамики
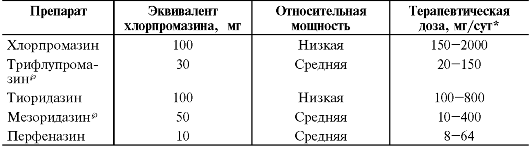
Под мощностью психотропного препарата понимают соответствующую дозу, требуемую для достижения видимого эффекта. Например, галоперидол более эффективен, чем хлорпромазин, потому что всего 5 мг галоперидола требуется для достижения терапевтического эффекта, аналогичного воздействию 100 мг хлорпромазина. Поэтому для определения мощности, например, антипсихотических препаратов используют понятие «хлорпромазиновый или аминазиновый эквивалент» (табл. 28-4). В то же время галоперидол и хлорпромазин равны по своей максимальной эффективности, т.е. наибольшему клиническому результату, достигаемому при назначении этих лекарств.
Таблица 28-4. Определение мощности антипсихотических препаратов по аминазиновому эквиваленту
 Окончание табл. 28-4
Окончание табл. 28-4
 * Максимальная доза.
* Максимальная доза.
Сопутствующие фармакологические эффекты большинства препаратов часто являются прямым следствием их первичных фармакодинамических свойств и лучше определяются таким понятием, как нежелательные эффекты. Терапевтический индекс определяет токсичность или безопасность препарата. При снижении чувствительности человека к действию препарата, назначаемого длительное время, говорят о толерантности. Последняя связана с появлением физической зависимости, определяемой как необходимость продолжения приёма лекарства во избежание развития симптомов отмены.
Дозировка
Двумя наиболее распространёнными причинами неудач лечения психотропными препаратами считают низкие дозы и неадекватную методику применения. Хорошо известно, что антидепрессанты более эффективны в дозах, превышающих эквивалент 225 мг имипрамина в день. Развитие нежелательных эффектов при высоких дозах приводит к отказу пациентов от лечения, поэтому часто врачи неохотно идут на увеличение доз больным, жалующимся на побочные эффекты. При проведении лекарственной терапии необходимо ограничиваться терапевтическими дозами препарата.
Продолжительность лечения
Для большинства психотропных препаратов 3 нед - минимальный срок лечения, необходимый для определения их эффективности. В идеальном варианте, если позволяют клинические условия, продолжительность терапевтического воздействия должна составлять 4-6 нед. Важно иметь в виду, что эффект психотропных средств в основном проявляется лишь при длительном применении. Быстрота
наступления эффекта препаратов может отличаться у разных больных, одни реагируют на терапию быстрее, чем другие.
Оценка эффективности и безопасности психотропных средств
Субъективные ощущения - хорошая переносимость психотропных препаратов в течение столь длительного срока терапии способствует хорошей комплаентности (согласию больного на лечение и соблюдению им рекомендаций врача), что, в свою очередь, является залогом уменьшения прогредиентности заболевания, более быстрого наступления ремиссии, снижения количества рецидивов, улучшения качества жизни и лучшей социальной адаптации пациента.
Объективные данные - терапевтический эффект от психотропного препарата определяется положительной динамикой в клинической картине заболевания (например, редукцией психотической симптоматики), а в процессе подбора оптимальной дозы психотропного препарата для достижения терапевтического эффекта определяющую роль играют нежелательные эффекты (активирующее или затормаживающее действие, депрессогенное действие и др.).
Функциональное состояние органов-мишеней зависит от мощности, от эффективно подобранной дозы психотропных препаратов, а также от вида и выраженности нежелательных эффектов, например, неврологического действия.
Лабораторные показатели также зависят от вида и выраженности нежелательных эффектов, например, соматотропного действия психотропных препаратов (показатели крови, изменения на ЭКГ, изменения функций печени и почек и др.).
28.2. ПСИХОЛЕПТИЧЕСКИЕ СРЕДСТВА
Психолептические средства оказывают успокаивающее, угнетающее действие на психику человека и включают:
антипсихотики (нейролептики) - редуцирующие психотическую симптоматику и психомоторное возбуждение; анксиолитики (транквилизаторы) - оказывающие успокаивающее, противотревожное и антифобическое действия как при невротических состояниях, так и у здоровых людей; гипнотики - вызывающие сон или облегчающие его наступление; нормотимики (тимоизолептики) - способные сглаживать циркулярные расстройства аффективной сферы (колебания настроения), а при профилактическом применении предотвращать развитие депрессивной и маниакальной симптоматики.
28.2.1. Антипсихотические препараты (нейролептики, большие транквилизаторы)
Общая информация
Антипсихотические препараты - это основное терапевтическое средство для лечения наиболее тяжёлых психически больных. Термин «нейролептик» подразумевает воздействие этих препаратов лишь на двигательную активность, но не на их клиническую эффективность, а «большой транквилизатор» вводит в заблуждение, предполагая сходство с бензодиазепинами и другими анксиолитиками (малыми транквилизаторами).
К нейролептикам относят ЛС, способные редуцировать психотическую симптоматику и психомоторное возбуждение. Под общим антипсихотическим действием понимают глобальное, недифференцированное, инцизивное «режущее», «проникающее», общее редуцирующее влияние на психоз, сравнимое с терапевтическим действием шоковых методов. Это действие ответственно за замедление темпа прогредиентности (прогрессирования) психоза, а в благоприятных случаях за переход к стационарному или регредиентному течению. Избирательное антипсихотическое действие характеризует способность препарата элективно воздействовать на определённые психопатологические проявления и установить свои симптомы-мишени. В соответствии с концепцией Г.Я. Авруцкого, индивидуальный спектр психотропной активности препарата формируется в результате соотношения следующих элементов: собственного психотропного действия, общего антипсихотического эффекта, избирательного антипсихотического воздействия, специфического влияния на разные уровни психопатологических расстройств, соотношения сомато- и нейротропных эффектов.
Желательные эффекты данных препаратов включают редукцию продуктивной (позитивной) симптоматики (т.е. чрезмерного усиления нормальных мозговых функций), например галлюцинаций (в основном слуховых), негативизма, бреда, дезорганизации речи, психомоторной активности (возбуждение или заторможенность), способности воспринимать информацию (формальное мышление) и неестественное/като- тоническое поведение. Продуктивная симптоматика при шизофрении в большей степени уменьшается в процессе антипсихотической терапии. Однако негативные или дефицитарные симптомы (т.е. потеря нормальных мозговых функций), такие, как уплощение аффекта, апатия, ангедония (потеря чувства удовольствия), обрыв мыслей, бед-
ность речи и социальное отчуждение, менее подвержены воздействию данных препаратов.
Основной механизм действия нейролептиков заключается в блокаде постсинаптических дофаминовых рецепторов и в компенсаторном усилении синтеза и метаболизма дофамина. Это подтверждает повышенное содержание в биологических жидкостях его основного метаболита - гомованилиновой кислоты.
Фармакодинамические свойства нейролептиков определяет их химическая структура, имеющая общий фрагмент, ответственный за развитие специфических эффектов. В зависимости от особенностей строения молекулы и боковой цепи выделяют различные подгруппы нейролептиков: фенотиазины, тиоксантены, бутирофеноны, дифенилбутилпиперидины, бензамиды, а также производные индола*, пиримидина и резерпина. Вместе с тем для связывания с теми или иными нейрорецепторами имеет значение не столько сама химическая структура, сколько пространственная конфигурация молекулы. Согласно гипотезе Т. Savini (1974), нейролептики по пространственной структуре могут быть разделены на шесть больших групп:
фенотиазины и другие трициклические производные;
бутирофеноны и дифенилбутилпиперидиновые или пиперазино-
вые производные;
бензамиды;
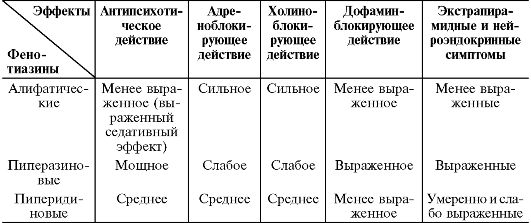
производные пиримидина и имидазолидинона; производные индола; производные раувольфии. Фенотиазины в свою очередь, подразделяются на алифатические, пиперазиновые и пиперидиновые производные (табл. 28-5).
Таблица 28-5. Сравнительная характеристика эффектов группы фенотиазина
 Механизм действия
Механизм действия
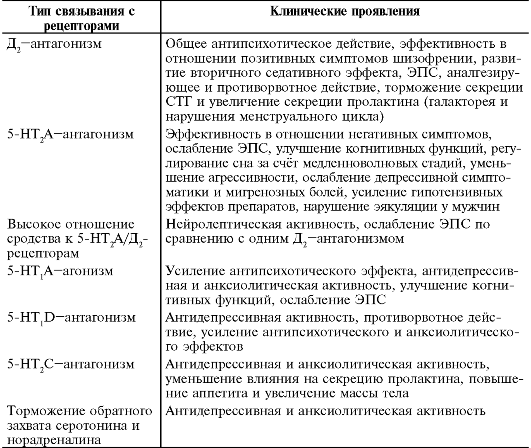
В развитии и проявлении шизофрении и других психозов играет роль дисбаланс различных нейромедиаторных систем. Нарушения дофаминергической системы включают повышение активности дофамина в мезолимбических («эмоциональных») дофаминергических цепях и снижение активности дофамина в мезокортикальных («мыслительных») дофаминергических цепях. При шизофрении также могут наблюдать нарушения систем серотонина, глутамата, норадреналина, ацетилхолина, γ-аминомасляной кислоты и других медиаторов. Поскольку конечный медиатор, запускающий симптомы шизофрении, - дофамин, то идеальным решением проблемы шизофрении было бы стабильное усиление или ослабление секреции дофамина путём применения нейролептиков, т.е. основной общей мишенью для всех нейролептиков является дофамин. Но широта спектра психотропной активности антипсихотиков зависит от того, на какие рецепторы они действуют (табл. 28-6).
Таблица 28-6. Возможные клинические проявления связывания нейролептиков с разными типами рецепторов
 Окончание табл. 28-6
Окончание табл. 28-6
 Из табл. 28-6 видно, что нейролептики блокируют дофаминовые, серотониновые рецепторы, α1-адренорецепторы, м1-холинорецепторы, н1-рецепторы,
причём доказана прямая зависимость выраженности антипсихотического
действия препаратов от степени его блокирующего воздействия на различные
типы дофаминовых рецепторов. На сегодняшний день известны 5 типов
дофаминовых рецепторов, которые локализуются в различных областях мозга
(табл. 28-7).
Из табл. 28-6 видно, что нейролептики блокируют дофаминовые, серотониновые рецепторы, α1-адренорецепторы, м1-холинорецепторы, н1-рецепторы,
причём доказана прямая зависимость выраженности антипсихотического
действия препаратов от степени его блокирующего воздействия на различные
типы дофаминовых рецепторов. На сегодняшний день известны 5 типов
дофаминовых рецепторов, которые локализуются в различных областях мозга
(табл. 28-7).
В табл. 28-8 систематизированы эффекты блокады дофаминовых рецепторов в зависимости от их локализации в мозге.
Таблица 28-7. Типы и локализация дофаминовых рецепторов
 Таблица 28-8. Эффекты блокады дофаминовых рецепторов
Таблица 28-8. Эффекты блокады дофаминовых рецепторов
 Окончание табл. 28-8
Окончание табл. 28-8
 Выраженность
паркинсоноподобной симптоматики при применении нейролептиков зависит от
их способности блокировать м-холинорецепторы. Холинергическая и
дофаминергическая системы оказывают противоположное влияние на функции
ядер экстрапирамидной системы. Возбуждение Д2-рецепторов в нигростриатной области уменьшает высвобождение ацетилхолина. При блокаде более 75% Д2-рецепторов
в нигростриатной области преобладает холинергическое влияние, что
обосновывает применение холиноблокирующих препаратов для коррекции
экстрапирамидных нарушений, вызванных нейролептиками. Тиоридазин,
хлорпротиксен, клозапин и оланзапин оказывают выраженное центральное
м-холиноблокирующее действие и практически не вызывают экстрапирамидных
побочных эффектов. Галоперидол и пиперазиновые производные фенотиазина
выраженно блокируют дофаминовые рецепторы, но очень слабо влияют на
холинорецепторы. Этим обусловлена их способность вызывать выраженные
экстрапирамидные нежелательные явления, которые могут уменьшаться при
применении очень высоких доз препаратов, когда их холиноблокирующее
влияние становится ощутимым.
Выраженность
паркинсоноподобной симптоматики при применении нейролептиков зависит от
их способности блокировать м-холинорецепторы. Холинергическая и
дофаминергическая системы оказывают противоположное влияние на функции
ядер экстрапирамидной системы. Возбуждение Д2-рецепторов в нигростриатной области уменьшает высвобождение ацетилхолина. При блокаде более 75% Д2-рецепторов
в нигростриатной области преобладает холинергическое влияние, что
обосновывает применение холиноблокирующих препаратов для коррекции
экстрапирамидных нарушений, вызванных нейролептиками. Тиоридазин,
хлорпротиксен, клозапин и оланзапин оказывают выраженное центральное
м-холиноблокирующее действие и практически не вызывают экстрапирамидных
побочных эффектов. Галоперидол и пиперазиновые производные фенотиазина
выраженно блокируют дофаминовые рецепторы, но очень слабо влияют на
холинорецепторы. Этим обусловлена их способность вызывать выраженные
экстрапирамидные нежелательные явления, которые могут уменьшаться при
применении очень высоких доз препаратов, когда их холиноблокирующее
влияние становится ощутимым.
Классификация препаратов
Нейролептики, используемые для лечения шизофрении, делят на 2 большие группы: старые, типичные нейролептики, например, хлорпромазин и галоперидол, и новые, атипичные нейролептики, включающие клозапин, амисульпирид*, рисперидон , оланзапин, кветиапин, зипразидон* и арипипразол.
Типичные нейролептики, или нейролептики первого поколения, действуют путём изолированной блокады Д2-рецептров, со всеми вытекающими отсюда последствиями (см. табл. 28-6, 28-8). Хлорпромазин, флуфеназин, галоперидол, тиоксантен*, трифторперазин, перфеназин, тиоридазин и другие нейролептики эффективно ослабляют позитивные симптомы шизофрении, но практически не действуют на негативные симптомы. К нежелательным эффектам этих препаратов, кроме ЭПС и нейроэндокринных, относят также возможность развития вторичных негативных симптомов.
Атипичные нейролептики, или нейролептики второго поколения, - Д2/5-НТ2А-антагонисты, действуют как на дофаминергическую, так и на серотонинергическую систему. Эти препараты ослабляют позитивные симптомы и, возможно, также некоторые негативные симптомы за счёт блокады 5-НТ2А-рецепторов. Благодаря блокаде 5-НТ2А-рецепторов стриатума они редко вызывают экстрапирамидные симптомы.
На рис. 28-4 показана степень связывания с различными типами рецепторов, на которые действуют атипичные нейролептики (клозапин, рисперидон, зипразидон*, арипипразол, оланзапин и кветиапин) в сравнении с галоперидолом - представителем типичных нейролептиков. Видно, что все атипичные нейролептики, за исключением арипипразола, в значительно меньшей степени связываются с Д2-рецепторами, но в большей степени, чем галоперидол, имеют связь с 5-НТ-рецепторами. Это доказывает, что у данной группы препаратов менее выражены дофаминблокирующие свойства и, соответственно, меньше выражены ЭПС, но при этом они могут оказывать значительное влияние на негативные симптомы и когнитивные нарушения. По связи с другими рецепторами (М1, Н1, α1) атипичные нейролептики значительно отличаются друг от друга.
Группа атипичных нейролептиков довольно разнородна и в отношении сродства к разным типам рецепторов (табл. 28-9).
Таблица 28-9. Сродство атипичных нейролептиков к рецепторам (Ki, нM)
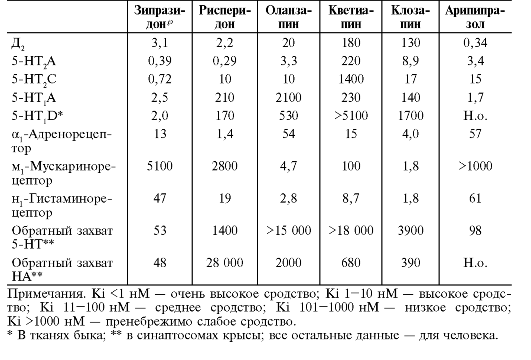 Из табл. 28-9 видно, что самым высоким сродством к Д2-рецепторам
из атипичных нейролептиков обладает арипипразол, в меньшей степени, но
высоким сродством - рисперидон и зипразидон*, средним - оланзапин,
низким - клозапин и кветиапин. По серотониновым рецепторам наибольшее
сродство наблюдают у зипразидона*, арипипразола и рисперидона, меньшее -
у клозапина и оланзапина, самое низкое - у кветиапина. Таким образом,
из всех атипичных нейролептиков арипипразол выгодно отличается, сочетая в
себе выраженную антипсихотическую активность, влияние на позитивные и
негативные симптомы шизофрении, улучшение когнитивных функций, с очень
слабой или дозозависимой экстрапирамидной симптоматикой и минимальными
нежелательными эффектами.
Из табл. 28-9 видно, что самым высоким сродством к Д2-рецепторам
из атипичных нейролептиков обладает арипипразол, в меньшей степени, но
высоким сродством - рисперидон и зипразидон*, средним - оланзапин,
низким - клозапин и кветиапин. По серотониновым рецепторам наибольшее
сродство наблюдают у зипразидона*, арипипразола и рисперидона, меньшее -
у клозапина и оланзапина, самое низкое - у кветиапина. Таким образом,
из всех атипичных нейролептиков арипипразол выгодно отличается, сочетая в
себе выраженную антипсихотическую активность, влияние на позитивные и
негативные симптомы шизофрении, улучшение когнитивных функций, с очень
слабой или дозозависимой экстрапирамидной симптоматикой и минимальными
нежелательными эффектами.
Поскольку нейрохимические нарушения при шизофрении затрагивают множество нейромедиаторных систем, все атипичные нейролептики (за исключением клозапина и кветиапина) эффективно ослабляют позитивные симптомы. Различия между препаратами зависят и от их сродства, и от степени связывания с рецепторами, и это может объяснять различие влияния на негативные симптомы и на нарушение когнитивных функций, а также различие их нежелательных эффектов. Таким образом, внедрение в клиническую практику атипичных нейролептиков позволяет более успешно достигать терапевтического эффекта благодаря высокой эффективности, безопасности и переносимости лечения.
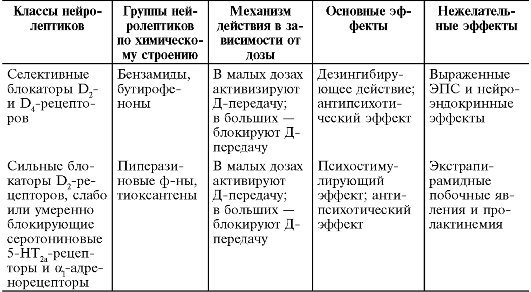
По способности связываться с рецепторами все типичные и атипичные нейролептики можно разделить на пять групп (табл. 28-10).
Таблица 28-10. Классификация нейролептиков по связи с рецепторами
 Окончание табл. 28-10
Окончание табл. 28-10
 P.
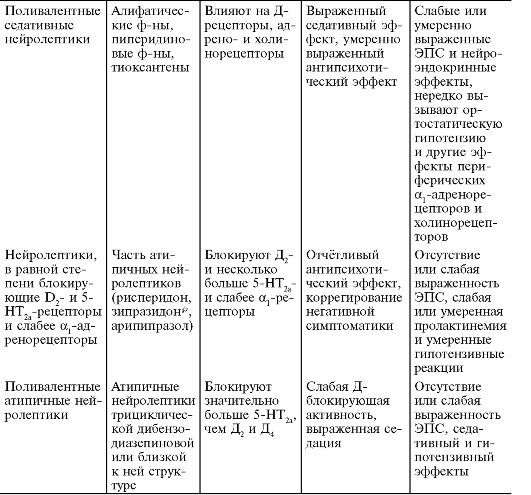
Deniker и D. Ginestet (1975) выделили четыре основные группы
нейролептиков, противопоставив их седативный и растормаживающий эффекты.
Эта классификация получила наибольшее распространение в Европе. В
несколько модифицированном нами виде она представлена в табл. 28-11. К
седативным нейролептикам относят препараты с умеренно выраженным
антипсихотическим действием, но с ярко выраженным седативным эффектом и
нежелательными нейроэндокринными проявлениями. К средним (малым)
нейролептикам относят препараты с умеренными антипсихотическими и
седативными свойствами, не вызывающие выраженных нежелательных эффектов.
Поливалентные нейролептики сочетают в себе мощное антипсихотическое
действие с седативным или дезингибирующим. Группа растормажива-
P.
Deniker и D. Ginestet (1975) выделили четыре основные группы
нейролептиков, противопоставив их седативный и растормаживающий эффекты.
Эта классификация получила наибольшее распространение в Европе. В
несколько модифицированном нами виде она представлена в табл. 28-11. К
седативным нейролептикам относят препараты с умеренно выраженным
антипсихотическим действием, но с ярко выраженным седативным эффектом и
нежелательными нейроэндокринными проявлениями. К средним (малым)
нейролептикам относят препараты с умеренными антипсихотическими и
седативными свойствами, не вызывающие выраженных нежелательных эффектов.
Поливалентные нейролептики сочетают в себе мощное антипсихотическое
действие с седативным или дезингибирующим. Группа растормажива-
ющих нейролептиков оказывает активирующее действие преимущественно при их назначении в небольших дозах.
В связи с тем, что фармацевтический рынок России молод и быстро развивается, считают целесообразным приведение данных о соответствии международных (генерических) наименований и торговых марок нейролептиков, зарегистрированных в нашей стране, что позволит лучше ориентироваться в большом многообразии антипсихотических ЛС (табл. 28-12).
Таблица 28-11. Клиническая классификация нейролептиков
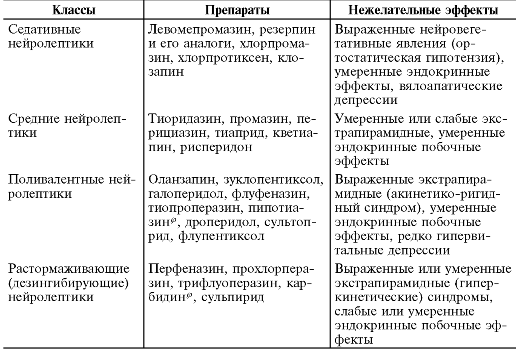 Таблица 28-12. Перечень нейролептиков, разрешённых к применению в РФ
Таблица 28-12. Перечень нейролептиков, разрешённых к применению в РФ
 Продолжение табл. 28-12
Продолжение табл. 28-12
 Окончание табл. 28-12
Окончание табл. 28-12
 Фармакокинетика
Фармакокинетика
Нейролептики хорошо всасываются при приёме внутрь и быстро распределяются в тканях организма, легко проникают через гематоэнцефалический барьер; их высокие концентрации создаются в лёгких, печени и надпочечниках.
Биодоступность нейролептиков варьирует от 60 до 80%.
Cmax в крови производных фенотиазина и бутирофенона при пероральном приёме отмечают через 2-6 ч, а T1/2 составляет 10-35 ч, у бензамидов - 0,5-3 ч и 3-10 ч соответственно. Эти показатели у представителей нового поколения атипичных нейролептиков составляют соответственно у клозапина - 1,5-2,5 и 12 ч, у рисперидона - 2 и 32 ч, у оланзапина - 5-8 ч и 21-54 ч, у кветиапина - 1,2-1,8 ч и 6 ч. Css препаратов в крови достигается в среднем через неделю после начала лечения.
Нейролептики связываются с белками плазмы на 85-99%. Большинство препаратов легко проникает через плаценту (за исключением тиоксантенов) и в небольших количествах в грудное молоко.
Хотя концентрация нейролептиков в плазме крови не коррелирует напрямую с эффективностью терапии, для большинства нейролептиков существует определённый нижний порог концентраций, после достижения которого чаще всего развивается клинический эффект.
Нейролептики метаболизируются в печени путём гидроксилирования, окисления или деметилирования и последующего конъюгирования с глюкуроновой кислотой. Многие нейролептики, особенно фенотиазиновые производные, образуют активные метаболиты. Большинство нейролептиков метаболизируется системой цитохромов Р-450 (в частности, галоперидол, перфеназин, флуфеназин, тиоридазин, зуклопентиксол, флупентиксол и рисперидон изоферментом CYP2D6, а клозапин и левомепромазин - CYP1A2), что нужно учитывать при сочетанном применении нейролептиков с другими ЛС, имеющими с ними общие пути метаболизма.
Большинство нейролептиков выводится преимущественно в виде неактивных метаболитов почками, некоторые препараты (например, пипотиазин* , хлорпротиксен, дроперидол, тиоридазин) экскретируются преимущественно с жёлчью.
Показания
• Острые и хронические психозы различной этиологии (например, шизоаффективный психоз и шизофрения, органические и интоксикационные психозы, включая делириозные состояния, детские и старческие психозы).
• Синдромы психомоторного возбуждения (например, психотического, маниакального, тревожного, психопатического).
• При шизофрении для купирования и профилактики обострений, коррекции негативных (дефицитарных) расстройств, сдерживания темпа прогредиентности.
• Некоторые обсессивно-компульсивные расстройства.
• Синдром Жиля де ла Туретта (для которого характерны множественные двигательные и вокальные тики, возникающие в возрасте до 21 года) и другие гиперкинетические двигательные расстройства (например, хорея Гентингтона, гемибаллизм).
• Нарушения поведения и сферы влечений при психопатиях и психопатоподобных синдромах, в том числе у детей.
• Некоторые психосоматические и соматоформные расстройства (например, болевые синдромы, сенесто-ипохондрическая симптоматика).
• Выраженная бессонница.
• Неукротимая рвота.
• Премедикация перед наркозом, нейролептаналгезия (дроперидол).
Несмотря на перечисленные разнообразные показания к применению нейролептиков, в 80-90% случаев их применяют в психиатрической практике при шизофрении или для купирования маниакального возбуждения.
Противопоказания
• Индивидуальная непереносимость.
• Токсический агранулоцитоз в анамнезе.
• Закрытоугольная глаукома и аденома предстательной железы (для препаратов с холиноблокирующими свойствами).
• Порфирия, паркинсонизм, феохромоцитома (для бензамидов).
• Аллергические реакции в анамнезе на нейролептики этой же химической группы.
• Тяжёлые нарушения функций почек и печени.
• Заболевания сердечно-сосудистой системы в стадии декомпенсации.
• Острые лихорадочные состояния.
• Интоксикация веществами, оказывающими депримирующее действие на ЦНС, коматозное состояние.
• Беременность и лактация (особенно производные фенотиазина).
Выбор нейролептика
Выбор нейролептиков базируют на спектре их психотропной активности, определяемой следующими клиническими проявлениями.
Общее антипсихотическое (инцизивное) действие - способность препарата недифференцированно и равномерно редуцировать различные проявления психоза и препятствовать прогредиентности заболевания, что феноменологически напоминает действие шоковых методов терапии. Этот эффект, по-видимому, связан с первичным эмоциотропным действием нейролептиков и купированием наиболее напряжённых аффектов: страха, тревоги, растерянности, мании, депрессии и др. По мере развития антипсихотического эффекта нередко обнаруживают типичные паркинсонические побочные эффекты, акинетико-ригидный симптомокомплекс и вторичную седацию, которые могут предшествовать появлению нейролептической депрессии. С общим антипсихотическим действием нейролептиков связывают их способность замедлять темп прогредиентности течения шизофрении.
Первичное седативное (затормаживающее) действие, необходимое для быстрого купирования галлюцинаторно-бредового или маниакального возбуждения, при правильном подборе дозы наблюдают уже в первые часы терапии. В некоторых случаях нейролептики могут первично вызывать обратную реакцию, связанную с острыми явлениями экстрапирамидного дистонического криза и сопровождающуюся резким психомоторным возбуждением. Эта реакция обычно исчезает при увеличении дозы препарата или введении холиноблокаторов.
Избирательное (селективное) антипсихотическое действие связано с преимущественным воздействием на отдельные симптомы-мишени, например бред, галлюцинации, расторможённость влечений, мыслительные расстройства или нарушение поведения. Поэтому для проявления избирательного антипсихотического действия необходим длительный и систематический приём нейролептиков.
Активирующее (растормаживающее, дезингибирующее и антиаутистическое) действие связано с редукцией кататонических проявлений и компенсацией аутистических нарушений с нормализацией интерперсональных связей. Психоактивирующее действие проявляется прежде всего в сглаживании апато-абулических нарушений у больных шизофренией с дефицитарной (негативной) симптоматикой. Активирующий эффект отмечают уже на начальных этапах терапии, он свойствен малым дозам большинства нейролептиков с сильным общим антипсихотическим действием. Этот эффект часто сопровождается явлениями акатизии и тахикинезии. В последние годы появилась группа препаратов (например, сульпирид) , у которых дезингибирующее действие основное в спектре их психотропной активности.
Когнитотропное действие проявляется у атипичных нейролептиков в способности улучшать высшие корковые функции (память, внимание, исполнительскую деятельность, коммуникативные и другие познавательные процессы).
Депрессогенное действие- способность нейролептиков при длительном применении вызывать специфические нейролептические (с психомоторной заторможённостью) депрессии. При применении седативных нейролептиков развиваются вяло-апатические формы депрессии, а инцизивных нейролептиков - чаще гипервитальные.
Неврологическое (экстрапирамидное) действие - экстрапирамидные нарушения проявляются на разных этапах терапии разнообразным спектром неврологических расстройств: от острых (пароксизмальных) до хронических (практически необратимых). Этот эффект минимален у новой группы атипичных нейролептиков (клозапин, рисперидон, оланзапин и др.).
Соматотропное действие связано, в основном, с выраженностью адренолитических и антихолинергических свойств препарата. Проявляется в виде нейровегетативных и эндокринных нежелательных эффектов, в том числе гипотензивных реакций и гиперпролактинемии.
Наиболее важное значение при клиническом выборе нейролептика имеет соотношение первых двух параметров, т.е. глобального антипсихотического и первичного седативного эффектов, на основании которого выделяют:
• группу седативных антипсихотиков (левомепромазин, хлорпромазин, промазин, хлорпротиксен, алимемазин* , перициазин и др.), которые независимо от дозы сразу вызывают определённый затормаживающий эффект;
• препараты с мощным глобальным антипсихотическим действием, или инцизивные антипсихотики (галоперидол, зуклопентиксол, пипотиазин* , тиопроперазин, трифлуоперазин, флуфеназин и др.), которым при применении в малых дозах свойственны активирующие эффекты, а с увеличением дозы нарастают и их купирующие психотическую (галлюцинаторно-бредовую) и маниакальную симптоматику свойства;
• дезингибирующие антипсихотики (сульпирид, карбидин* и др.), преимущественно (т.е. в большом диапазоне доз) обладающие растормаживающим, активирующим действием;
• в силу особого механизма действия и спектра психотропной активности отдельную группу составляют атипичные антипсихотики (клозапин, оланзапин, рисперидон, кветиапин, амисульпирид* , зипразидон* и др.), которые, обладая отчётливым антипсихотическим эффектом, не вызывают или вызывают дозозависимые экстрапирамидные расстройства и способны корригировать негативные и когнитивные нарушения у больных шизофренией.
При шизофрении антипсихотики могут применяться как курсом для купирования острого психоза, так и длительно в целях непрерывного подавления продуктивной симптоматики при хроническом течении психоза или для профилактики обострений заболевания и сдерживания темпа его прогредиентности, а также для коррекции негативных (дефицитарных) расстройств.
Такие препараты, как левомепромазин, хлорпромазин, промазин, клозапин, перициазин, обладают выраженными затормаживающими и сомнолентными свойствами и способны резко снижать вигилитет (уровень бодрствования) больных, что приводит к развитию психической индифферентности, пассивности и депрессии. Нейролептикам с сильным общим антипсихотическим действием (например, галоперидол, пипотиазин* , тиопроперазин, сультоприд) при применении в малых дозах свойственны растормаживающие или активирующие эффекты. С нарастанием дозы увеличиваются их купирующие (инцизивные) и антиманиакальные свойства, т.е. способность «обрывать» психотическую (галлюцинаторно-бредовую) и маниакальную симптоматику. В силу двойственности клинических эффектов в зависимости от применяемых доз такие нейролептики иногда называют биполярными, или двухфазными, в отличие от монополярных (седативных), независимо от дозы обладающих затормаживающими свойствами.
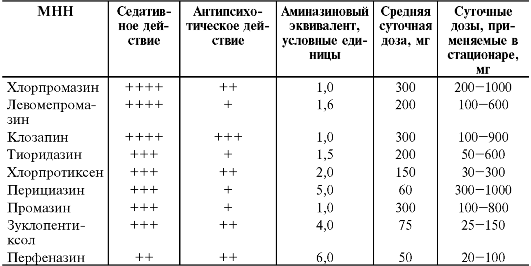
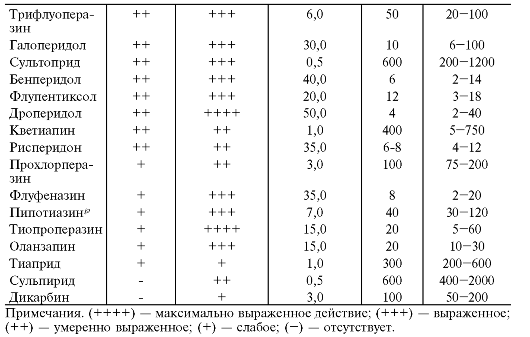
В табл. 28-13 представлены основные нейролептики, их суточная доза, выраженность антипсихотического и седативного действий.
Приведённые дозы и аминазиновые эквиваленты используют при пероральном приёме препаратов, а в случае парентерального введения дозу следует уменьшить в среднем в 2 раза.
Таблица 28-13. Седативное и антипсихотическое действия нейролептиков, дозы и аминазиновые эквиваленты
 Окончание табл. 28-13
Окончание табл. 28-13
 Существенно
облегчает проведение длительной амбулаторной терапии применение
пролонгированных форм антипсихотиков (галоперидол деканоат,
зуклопентиксола деканоат* , флуфеназина деканоат* , флупентиксола деканоат*
, рисперидон-микросферы). Пролонгированные формы нейролептиков
позволяют обеспечить максимальную непрерывность терапевтического
воздейстия, надёжный контроль за их приёмом в случае несоблюдения
больным режима терапии, а также более низкую суммарную дозу препарата и
стоимость лечения.
Существенно
облегчает проведение длительной амбулаторной терапии применение
пролонгированных форм антипсихотиков (галоперидол деканоат,
зуклопентиксола деканоат* , флуфеназина деканоат* , флупентиксола деканоат*
, рисперидон-микросферы). Пролонгированные формы нейролептиков
позволяют обеспечить максимальную непрерывность терапевтического
воздейстия, надёжный контроль за их приёмом в случае несоблюдения
больным режима терапии, а также более низкую суммарную дозу препарата и
стоимость лечения.
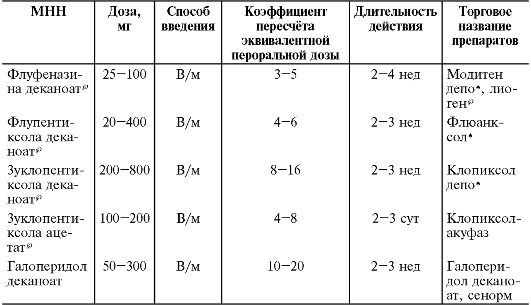
Назначение комбинации антипсихотических препаратов (особенно вместе с атипичными антипсихотиками) не рекомендуется из-за возрастания риска развития нежелательных явлений. Замедленный, или ретардированный, эффект этих соединений связан с различными механизмами. При соединении активной молекулы с карбоновыми кислотами образуются эфиры, вследствие замедленного гидролиза постепенно высвобождающие действующее вещество из депо. Длительность действия препарата определяется типом карбоновой кислоты. Так, при соединении с энантановой кислотой полное высвобождение нейролептика происходит в течение 10-14 дней, с ундициленовой - в течение 15-21 дня, с декановой - за 16-25 дней, а с пальмитиновой - за 25-28 дней (табл. 28-14). Более редкое введение такого нейролептика приводит к обострению продуктивной симптоматики, а при более частом введении возможна кумуляция.
Таблица 28-14. Нейролептики пролонгированного действия
 Пролонгированные
(депонированные) формы инъекционных антипсихотических препаратов
эффективны при профилактике рецидивов и повторных госпитализаций у
больных шизофренией. Лучше всего назначать депонированные формы больным,
которые принимают лекарства нерегулярно или не принимают лекарств
вообще. Отсутствие согласия лечиться - наиболее распространённая
проблема применения антипсихотических препаратов внутрь больным
шизофренией: 40-50% амбулаторных больных и 40% пациентов дневного
стационара не в состоянии принимать препараты в соответствии с
рекомендациями. Обычная доза наиболее широко применяемого
пролонгированного антипсихотического препарата флуфеназина деканоата*
составляет 12,5-50,0 мг каждые 2 нед. Использование меньших доз -
1,25-5,0 мг в 2 нед приводит к увеличению числа рецидивов. Количество
нежелательных эффектов у больных, получающих инъекции флуфеназина
деканоата*, не превышает таковое у принимающих антипсихотические
средства внутрь. Пролонгированные препараты нейролептиков имеют ряд
неоспоримых преимуществ перед обычными. Они позволяют обеспечить
максимальную непрерывность терапевтического воздействия, надёжный
контроль за приёмом нейролептика в случае отсутствия у больного должного
понимания необходимости проведения длительной терапии; более стабильную
и низкую концентрацию нейролептика в крови, с чем, вероятно, связана
меньшая выраженность нежелательных явлений; более низкую суммарную дозу,
что также снижает риск возникновения поздних нежелательных эффектов.
Пролонгированные
(депонированные) формы инъекционных антипсихотических препаратов
эффективны при профилактике рецидивов и повторных госпитализаций у
больных шизофренией. Лучше всего назначать депонированные формы больным,
которые принимают лекарства нерегулярно или не принимают лекарств
вообще. Отсутствие согласия лечиться - наиболее распространённая
проблема применения антипсихотических препаратов внутрь больным
шизофренией: 40-50% амбулаторных больных и 40% пациентов дневного
стационара не в состоянии принимать препараты в соответствии с
рекомендациями. Обычная доза наиболее широко применяемого
пролонгированного антипсихотического препарата флуфеназина деканоата*
составляет 12,5-50,0 мг каждые 2 нед. Использование меньших доз -
1,25-5,0 мг в 2 нед приводит к увеличению числа рецидивов. Количество
нежелательных эффектов у больных, получающих инъекции флуфеназина
деканоата*, не превышает таковое у принимающих антипсихотические
средства внутрь. Пролонгированные препараты нейролептиков имеют ряд
неоспоримых преимуществ перед обычными. Они позволяют обеспечить
максимальную непрерывность терапевтического воздействия, надёжный
контроль за приёмом нейролептика в случае отсутствия у больного должного
понимания необходимости проведения длительной терапии; более стабильную
и низкую концентрацию нейролептика в крови, с чем, вероятно, связана
меньшая выраженность нежелательных явлений; более низкую суммарную дозу,
что также снижает риск возникновения поздних нежелательных эффектов.
При проведении терапии нейролептиками важно знать, что резкая отмена препарата увеличивает риск развития симптомов отмены, включающих потливость, тошноту, диарею, тремор, возбудимость и инсомнию. Для дифференциации синдрома отмены от рецидива психотических симптомов следует помнить, что симптомы отмены появляются в течение нескольких дней после последнего приёма препарата и уменьшаются на 2-й нед, в то время как рецидив начинается спустя несколько недель и тяжесть его прогрессирует.
Таким образом, несмотря на структурное разнообразие нейролептиков, ни один из них существенно не превосходит другой. Все антипсихотические соединения одинаково эффективны, если используются в оптимальных дозах. Различаются они по мощности и нежелательным эффектам. Тем не менее у некоторых больных эффективность достигается одним препаратом лучше, чем другим. При этом не существует способа предсказания этого ответа.
Нежелательные эффекты
У 50-75% пациентов, принимающих традиционные нейролептики, наблюдают развитие неврологических экстрапирамидных нежелательных эффектов, для их коррекции применяют центральные холиноблокаторы.
Острые дискинезии и дистонии развиваются в первые дни терапии традиционными нейролептиками у 40-50% больных без применения холиноблокаторов и у 10-13% при сочетании с ними. В последующем у 30-40% больных могут появиться паркинсоноподобная (акинето-ригидная) симптоматика, у 50% больных - акатизия (беспокойство в ногах, неусидчивость; субъективно наиболее неприятный феномен, нередко провоцирующий тревогу и суицидальные тенденции). У 1-3% пациентов развиваются тяжёлые осложнения нейролептической терапии: злокачественный нейролептический синдром, в 15-30% случаев заканчивающийся смертельным исходом, и судорожные припадки (при применении клозапина возникает в 5% случаев). При применении классических нейролептиков на отдалённых этапах терапии у 10-20% больных могут возникнуть так называемые поздние дискинезии (включая мелкий тремор нижней губы - синдром «кролика»), носящие практически необратимый характер. Риск развития поздних дискинезий пропорционален длительности терапии и каждый год повышается в среднем на 3%. Поздние дискинезии чаще возникают у пожилых больных с патологией сосудов головного мозга, а также при длительном использовании холиноблокаторов.
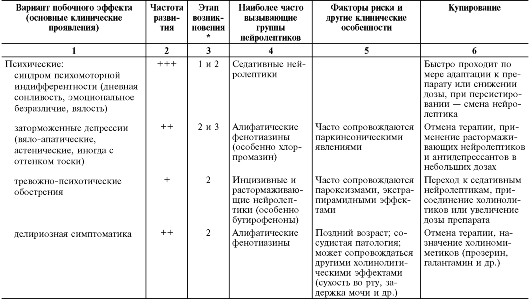
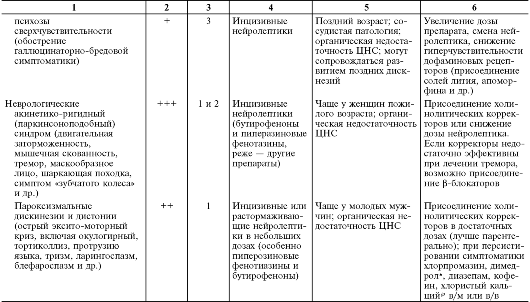
В табл. 28-15 перечислены побочные эффекты и осложнения нейролептической терапии, включая их основные клинические проявления, частоту развития в зависимости от применяемой группы нейролептиков, этапы возникновения, факторы риска и другие клинические особенности, а также тактика их лечения.
Таблица 28-15. Нежелательные эффекты нейролептиков
 Продолжение табл. 28-15
Продолжение табл. 28-15
 Продолжение табл. 28-15
Продолжение табл. 28-15
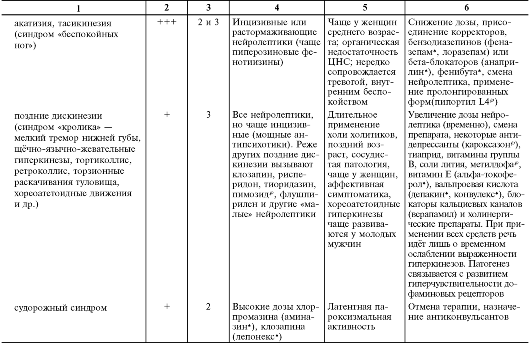 Продолжение табл. 28-15
Продолжение табл. 28-15
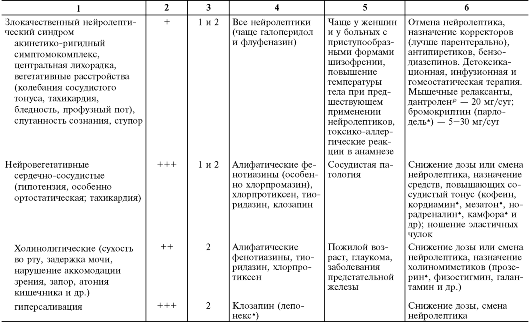 Продолжение табл. 28-15
Продолжение табл. 28-15
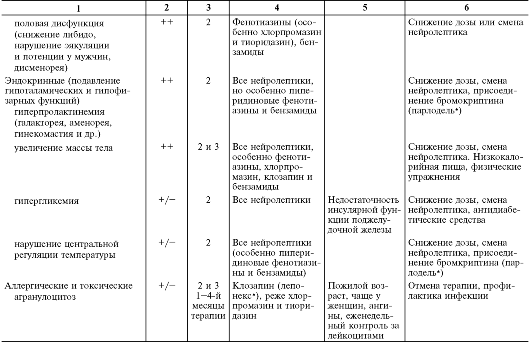 Окончание табл. 28-15
Окончание табл. 28-15
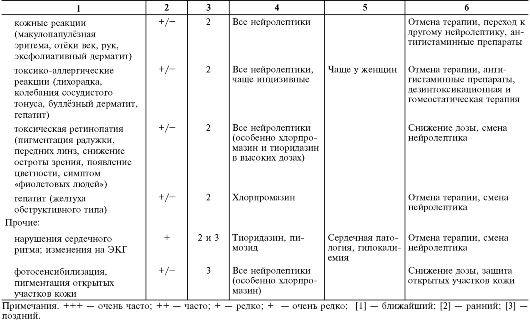 Экстрапирамидные
нежелательные эффекты достаточно быстро купируют с помощью различных
антипаркинсонических или холиноблокирующих средств, называемых
корректорами нейролептической терапии. Холиноблокаторы более эффективны
при острых дистониях и акинето-ригидном симптомокомплексе, менее - при
дискинезиях, акатизии и треморе. Эти препараты обладают выраженными
атропиноподобными побочными эффектами и противопоказаны при
закрытоугольной глаукоме и аденоме предстательной железы. Выделяют
холиноблокаторы со стимулирующими свойствами (тригексифенидил,
бипериден) и препараты с седативными свойствами (бенактизин,
дифенилтропин). Первые чаще используют при лечении дефицитарной
(негативной) симптоматики с целью усиления дезингибирующих эффектов
нейролептиков, вторые - при ажитированных психозах. Обычно корректоры
назначают для купирования уже развившихся экстрапирамидных расстройств и
редко - с профилактической целью, так как они могут снизить
эффективность нейролептической терапии и привести к развитию
нежелательных эффектов.
Экстрапирамидные
нежелательные эффекты достаточно быстро купируют с помощью различных
антипаркинсонических или холиноблокирующих средств, называемых
корректорами нейролептической терапии. Холиноблокаторы более эффективны
при острых дистониях и акинето-ригидном симптомокомплексе, менее - при
дискинезиях, акатизии и треморе. Эти препараты обладают выраженными
атропиноподобными побочными эффектами и противопоказаны при
закрытоугольной глаукоме и аденоме предстательной железы. Выделяют
холиноблокаторы со стимулирующими свойствами (тригексифенидил,
бипериден) и препараты с седативными свойствами (бенактизин,
дифенилтропин). Первые чаще используют при лечении дефицитарной
(негативной) симптоматики с целью усиления дезингибирующих эффектов
нейролептиков, вторые - при ажитированных психозах. Обычно корректоры
назначают для купирования уже развившихся экстрапирамидных расстройств и
редко - с профилактической целью, так как они могут снизить
эффективность нейролептической терапии и привести к развитию
нежелательных эффектов.
Помимо холиноблокаторов, для коррекции акатизии и тремора часто используют β-адреноблокаторы (пропранолол) и антигистаминные препараты (дифенгидрамин), реже - амантадин ; для коррекции острых дистонических реакций и акатизии - производные бензодиазепина (диазепам , феназепам*, лоразепам ) ; для коррекции поздних дискинезий и эндокринных нарушений - дофаминостимуляторы (амантадин, бромокриптин) и ГАМК-ергические препараты (фени- бут*); для коррекции акинетико-ригидной симптоматики - амантадин и толперизон.
Лекарственные взаимодействия
Нейролептики можно с низкой степенью риска сочетать с большинством ЛС, но следует иметь в виду, что они потенцируют действие всех веществ, угнетающих ЦНС (например, алкоголя, барбитуратов, бензодиазепинов), гипотензивных средств (например, метилдопы, резерпина, фентоламина), антигистаминных и холиноблокирующих препаратов (возможно развитие делирия) по причине конкурентного влияния на ГАМК-, α-адрено-, н1- и м1-рецепторы. Сочетание с бензодиазепинами и барбитуратами может способствовать угнетению дыхательного центра из-за многократного усиления тормозного влияния и снижения чувствительности дыхательного центра к содержанию углекислого газа в крови. Амфетамины и дофаминостимулирующие средства ослабляют антипсихотический эффект нейролептиков (антагонистическое влияние на дофамин), а совместное применение с флуоксетином может приводить к усилению экстрапирамидных не-
желательных реакций (по причине усиления дофаминблокирующего действия). Дроперидол усиливает действие миорелаксантов, так как, обладая наиболее мощным нейролептическим действием (используются для нейролептаналгезии в анестезиологии), при совместном применении суммирует миорелаксирующий эффект на скелетную мускулатуру. При гипотензивной реакции, вызванной нейролептиками, следует избегать применения эпинефрина, так как вследствие блокады α-адренорецепторов возможно развитие парадоксальной реакции - ещё большего снижения АД. С другой стороны, барбитураты усиливают метаболизм нейролептиков и могут снизить их клиническую эффективность. Нейролептики фенотиазинового ряда угнетают метаболизм фенитоина, при этом возрастает риск развития интоксикации этим препаратом. Фенитоин может снижать содержание галоперидола и клозапина в плазме крови. Алпразолам и буспирон увеличивают содержание в крови галоперидола и флуфеназина. Нейролептики могут ослабить гипогликемические эффекты инсулина и других препаратов. Антигипертензивный эффект гуанетидина и клонидина нейролептики способны нивелировать.
Биотрансформация некоторых нейролептиков происходит с участием цитохромов СYР, что нужно учитывать при их сочетании с ЛС, имеющими с этими нейролептиками общие пути метаболизма. Так, совместное применение нейролептиков (прежде всего фенотиазинов и галоперидола) с трициклическими антидепрессантами может увеличивать риск развития аритмий, ортостатической гипотензии, судорожного синдрома, холиноблокирующего действия вследствие повышения содержания этих антидепрессантов в плазме крови.
Большинство нейролептиков препятствует также развитию психостимулирующего действия других препаратов. При сочетании нейролептиков с ингибиторами МАО и солями лития нужно избегать применения высоких доз последних из-за возможности развития артериальной гипертензии и нейротоксических реакций (например, при сочетании галоперидола с солями лития) по причине блокады моноаминоксидазы, способствующей увеличению концентрации нейромедиаторов в синаптической щели. Карбамазепин может ускорять метаболизм галоперидола и некоторых других, сходных с ним по химической структуре нейролептиков. Вальпроевая кислота, напротив, угнетает метаболизм хлорпромазина, но не галоперидола. Некоторые антикоагулянты способны снижать эффективность нейролептиков и наоборот. Антацидные препараты и циметидин уменьшают всасывание нейролептиков в желудке. Циметидин замедляет метаболизм клозапина и может способствовать развитию токсических реакций. Нейролептики с сильным холиноблокирующим действием могут замедлять абсорбцию парацета-
мола, леводопы, дигоксина и солей лития. В приложении представлены эффекты лекарственных взаимодействий различных групп препаратов с нейролептиками.
Таким образом, благодаря успехам психофармакотерапии в лечении психических заболеваний, включая тяжёлые и хронические формы, происходит перенос центра тяжести терапевтического процесса в амбулаторную практику, что позволяет более успешно сочетать фармакотерапию с социореабилитационными и психотерапевтическими методами воздействия, не нарушая привычных для больного межперсональных связей.
28.2.2. Анксиолитики (малые транквилизаторы)
Общая информация
Анксиолитики, или противотревожные препараты (от латинского anxius - «тревожный» и греческого lysis - «растворение»), представляют собой одну из самых часто назначаемых врачами групп психотропных средств. Раньше чаще использовался термин «малые транквилизаторы» (от латинского tranquillium - «спокойствие»), который несколько устарел в связи с расширением спектра действия этой группы препаратов. Но существуют и другие, менее распространённые названия - атарактики (от греческого ataraxia - «невозмутимость»), психоседативные, антиневротические средства.
В общей классификации психотропных средств анксиолитики вместе с антипсихотиками относятся к классу психолептических средств, оказывающих депримирующее, подавляющее, угнетающее действие на ЦНС. В целом, к анксиолитикам или транквилизаторам относятся лекарственные средства, способные уменьшать выраженность тревоги, страха и эмоциональной напряжённости, причём анксиолитики способны снимать состояние психического напряжения и/или страха как у здоровых людей, так и у больных при широком круге невротических и неврозоподобных расстройств. В отличие от нейролептиков они не обладают антипсихотическим действием и не вызывают экстрапирамидных эффектов, поэтому широко применяются в терапии неглубокой степени выраженности психических расстройств, т.е. непсихотического уровня. Помимо основного анксиолитического (противотревожного) действия у большинства препаратов отмечают наличие седативного, гипнотического, миорелаксирующего, противосудорожного, вегето- и соматостабилизирующего эффектов, соотношение и выраженность которых значительно варьирует, что позволяет говорить о различиях спектра психотропной активности анксиолитиков.
Разработка первых транквилизаторов относится к 50-м годам XX в. (мепробамат, хлордиазепоксид). На сегодняшний день группа анксиолитиков насчитывает более 100 препаратов, причём производных 1,4- бензодиазепина - наиболее популярной подгруппы - более 40. Производители фармацевтических препаратов продолжают активный поиск новых и совершенствование уже известных противотревожных средств.
Механизм действия
По спектру психотропной активности принято выделять 6 основных эффектов анксиолитиков, в той или иной степени свойственных большинству препаратов:
• анксиолитический (успокаивающий, снимающий тревогу, страх, эмоциональную напряжённость);
• седативный (вызывающий психомоторную заторможенность, дневную сонливость, снижение концентрации внимания, уменьшение быстроты реакции, потенцирование действия алкоголя и других депримирующих ЦНС средств);
• миорелаксирующий (в клинических условиях часто проявляется в виде ощущений слабости, вялости, усталости);
• противосудорожный (подавляющий пароксизмальные, эпилептические проявления);
• снотворный или гипнотический (вызывающий сон, в зависимости от применяемой дозы свойственен всем бензодиазепинам, но особенно препаратам с коротким периодом полувыведения);
• вегето- и соматостабилизирующий (регулирующий деятельность вегетативной нервной системы и связанных с ней соматических проявлений, обнаруживается при купировании нейровегетативных проявлений тревоги и диэнцефальных кризов).
Помимо этого, у ряда анксиолитиков выделяются дополнительные эффекты:
• психостимулирующий (медазепам, оксазепам, тофизопам и другие так называемые дневные анксиолитики);
• тимоаналептический (алпразолам);
• антифобический (алпразолам, клоназепам и др.), позволяющий положительно влиять на панические расстройства, фобии и состояния навязчивости.
По выраженности седативного действия все транквилизаторы делят на препараты с выраженным седативным эффектом (применяются в том числе и как снотворные средства) и дневные, не вызывающие значительной сонливости и миорелаксации.
По механизму действия анксиолитиков выделяют 7 основных групп:
• прямые агонисты ГАМК-А-бензодиазепинового комплекса (большинство бензодиазепинов);
• частичные агонисты бензодиазепинового рецептора (БДР), вещества с различной тропностью к субъединицам БДР и ГАМКА-рецептора (имидазопиридины, имидазобензодиазепины);
• эндогенные регуляторы (модуляторы) ГАМК-А-бензодиазепинового рецепторного комплекса (фрагменты эндодиазепинов - ингибитора связывания диазепама , производные β-карболина, никотинамид и его аналоги);
• агонисты ГАМК-В-рецепторного комплекса (фенибут*, ГАМК);
• мембранные модуляторы ГАМК-А-бензодиазепинового рецепторного комплекса (афобазол*, тофизопам);
• глутаматергические анксиолитики (кетамин, ифенпродил*, лиганды глицинового участка);
• агонисты и частичные агонисты серотониновых 5НТ-1А-рецеп- торов (буспирон), антагонисты 5HT-1C-, 5НТ-1D-рецепторов, 5НТ-2А-, 5HT-2B-, 5НТ-2С-рецепторов (ритансерин*, алтансе- рин*), 5НТ-3А-рецепторов (закоприд* ондансетрон).
Среди бензодиазепинов как прямых агонистов ГАМК-А-бензодиазепинового комплекса выделяют препараты с преобладанием собственно анксиолитического действия (хлордиазепоксид, диазепам, оксазепам, лоразепам); с преобладанием снотворного действия (нитразепам, флунитразепам) и с преобладанием противосудорожного действия (клоназепам). Бензодиазепины действуют на специфические бензодиазепиновые рецепторы, которые связаны с ГАМК-А-рецепторами. Они связываются с различными участками этого рецептора и усиливают тормозное влияние γ-аминомасляной кислоты. Бензодиазепины действуют посредством аллостерической регуляции, изменяя конфигурацию рецептора так, что его сродство к ГАМК увеличивается. Бензодиазепины обладают ГАМК-егрическим действием, усиливают эффективность эндогенной ГАМК, что облегчает передачу импульсов, как на пре-, так и на постсинаптическом уровнях. Одновременно увеличивается проницаемость каналов для хлора, что в конечном итоге снижает уровень возбудимости ЦНС. Бензодиазепины воздействуют прежде всего на ретикулярную формацию, усиливая ее тормозное влияние на другие отделы ЦНС. Большое количество бензодиазепиновых рецепторов находится в спинном мозге, с чем связывают миорелаксирующее действие, в стволе и коре головного мозга (противосудорожное действие), мозжечке (атаксические нарушения) и лимбической системе (анксиолитический эффект).
Механизм действия небензодиазепинового транквилизатора буспирона, по-видимому, связан с блокадой пресинаптических 5-ТН1а- серотонинергических рецепторов, поэтому он не обладает миорелаксирующими или седативными свойствами и редко вызывает лекарс-
твенную зависимость, что даёт ряд неоспоримых преимуществ перед бензодиазепиновыми производными. Однако в отличие от бензодиазепинов эффект буспирона развивается постепенно, как правило, через 2 нед лечения и более, поэтому он больше показан при хронических тревожно-фобических расстройствах. Кроме того, оказалось, что препарат совершенно не влияет на коморбидную генерализованному тревожному расстройству (ГТР) симптоматику, что ограничивает его применение у более чем 50% больных, у которых течение болезни сопровождается сопутствующей фобической или аффективной симптоматикой. Наконец, судя по публикациям последних лет, буспирон недостаточно эффективен даже в отношении собственно генерализованной тревоги.
Результаты исследований, проведённые под руководством С.Б. Серединина, о диссоциации анксиолитического и седативного эффекта транквилизаторов позволили установить рецепторные механизмы, определяющие фенотипические различия эмоционально-стрессовых реакций (пассивный и активный). В ГУ НИИ фармакологии им. В.В. Закусова РАМН РФ на основе оригинальной фармакогенетической концепции анксиолитического эффекта и сформулированных представлений о новой нейрохимической мишени фармакологической коррекции эмоционально-стрессовых реакций, ориентированной на регуляцию нарушенного мембранно-рецепторного взаимодействия, был разработан новый селективный анксиолитик афобазол*. Механизм его действия состоит в том, что препарат препятствует развитию мембранозависимых изменений в ГАМК-бензодиазепиновом рецепторном комплексе, наблюдаемых при формировании эмоциональнострессовых реакций и приводящих к снижению доступности бензодиазепинового рецепторного участка к соответствующему лиганду. Таким образом, афобазол* является мембранным модулятором ГАМК-А-бензодиазепинового рецепторного комплекса.
С первых дней лечения в дозе 30 мг афобазол, не являясь агонистом бензодиазепиновых рецепторов, проявляет селективное анксиолитическое действие с активирующим компонентом и не вызывает в отличие от бензодиазепинов седативного эффекта. По данным клинических испытаний, проведенных в ГУ НИИ фармакологии им. В.В. Закусова РАМН РФ, эффективность афобазола не отличается от эффективности диазепама по выраженности анксиолитического действия. Кроме того, препарат не обладает миорелаксантными свойствами и негативным влиянием на показатели памяти и внимания. Особенностью фармакодинамики афобазола* является то, что седативное действие выявляется в дозах, в 40-50 раз превышающих ED50 для анксиолитического действия. Афобазол* нетоксичен (LD50 у крыс со-
ставляет 1,1 г при ED50 0,0001 г), не обладает эмбриотоксическим, тератогенным действием, мутагенным, аллергезирующими и иммунотоксическими свойствами, не оказывает отрицательного действия на постнатальное развитие потомства и генеративную функцию. Следует особо отметить, что при применении афобазола* не формируется лекарственная зависимость. В отличие от буспирона афобазол* является эффективным в лечении больных с ГТР и с расстройствами адаптации. Он хорошо переносится больными, нежелательных лекарственных явлений практически нет и отсутствует синдром отмены.
Классификация анксиолитиков
По химическому строению анксиолитики разделяют на:
• производные бензодиазепина - адиназолам*, алпразолам , бро- мазепамгидазепам*, диазепам, клобазам*, клоназепам , клоразепат* , клотиазепин* , лоразепам, лоразепат* , медазепам, нитразепам, оксазепам, темазепам* , тофизопам, триазолам* , феназепам*, флунитразепам, эстазолам* , хлордиазепоксид и многие другие;
• производные эфиров замещённого пропандиола - мепробамат;
• производные триметоксибензойной кислоты - триоксазин* ;
• производные азаспиродекандиона - буспирон;
• производные 2-меркаптобензимидазола - афобазол*;
• производные дифенилметана - бенактизин (амизил*);
• производные различной химической структуры - альпидем* , гидроксизин, глютетимид* , мебикар*, мексидол*, метилпентинол* , оксилидин* и другие.
В клинической практике традиционно выделяют группу «дневных транквилизаторов», у которых наименьшим образом выявляются сопутствующие анксиолитическому эффекты, такие, как седативный, снотворный, миорелаксантный. К этой группе относятся следующие препараты: мезапам, триоксазин* , тофизопам (грандаксин*), гидазепам*. Все дневные транквилизаторы, в том числе и новый анксиолитик афобазол*, можно назначать амбулаторно и в дневное время.
Фармакокинетика
Бензодиазепины при пероральном приёме хорошо всасываются и быстро проникают в кровь. Максимальная концентрация в плазме крови для большинства препаратов достигается через 1-2 ч после введения. Вместе с тем оказалось, что диазепам и хлордиазепоксид значительно лучше всасываются и проникают в ЦНС при приёме внутрь, чем при внутримышечном введении, что важно для быстрого контроля острой тревоги. Внутривенное введение диазепама является одним из наиболее эффективных методов купирования судорожного синдрома,
среди бензодиазепинов быстрее всасывается клоразепат* , а наиболее медленно - празепам* и оксазепам. При в/м введении наиболее быстрое и пропорциональное всасывание имеет лоразепам. Пик концентрации в крови при пероральном приёме варьирует у отдельных препаратов и достигается в среднем за 1-4 ч (см. табл. 28-16), что также имеет важное клиническое значение. Например, для быстрого достижения анксиолитического эффекта лучше применять диазепам или клоразепат* , а не хлордиазепоксид или оксазепам.
Бензодиазепины связываются с альбуминами крови, уровень связывания у отдельных препаратов колеблется от 80 до 95% (например, у диазепама он составляет 95%, у оксазепама - 90%, у алпразолама - около 85%). Ещё большее клиническое значение имеет период полувыведения препарата (см. табл. 28-16), в соответствии с которым все бензодиазепиновые производные можно разбить на 3 категории:
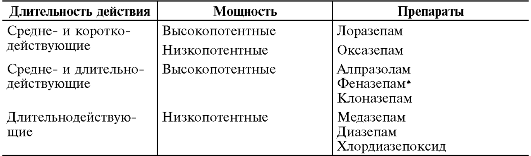
• длительного действия (период полувыведения вместе с метаболитом составляет более 25 ч) - хлордиазепоксид, диазепам, клоназепам, нитразепам, флунитразепам и медазепам;
• средней длительности действия (период полувыведения от 10 до 25 ч) - лоразепам, бромазепам, оксазепам, и др.
• короткого действия (период полувыведения около 10 ч) - триазолам* , мидазолам.
Увеличение длительности элиминации у многих препаратов связано с периодом полувыведения их активных метаболитов (см. табл. 28- 16), что может вызвать явления кумуляции. К ним, например, относятся диазепам, клоразепат* , празепам* , галазепам* , деметилированный метаболит (дезметилдиазепам) которых выводится за 50-100 ч. Следует отметить, что такие анксиолитики, как алпразолам, диазепам, золпидем, клоназепам, мидазолам, и триазолам* , метаболизируются через систему цитохромов CYP3A3/4, а диазепам дополнительно и CYP2C19, что следует учитывать при их назначении с другими ЛС, чтобы избежать нежелательного лекарственного взаимодействия. Некоторые бензодиазепины (оксазепам, лоразепам, бромазепам) не образуют активных метаболитов, они сразу связываются с системой ферментов глюкуронилтранфераз (UGT2В7), ацетилируются или сульфатируются и быстрее выводятся из организма. Метаболический путь этих препаратов значительно короче и они не оказывают чрезмерной нагрузки на печень и, как следствие, значительно легче переносятся больными, даже в случае снижения функциональной активности печени (например, при алкоголизме или у лиц пожилого возраста) или при конкурентном взаимодействии с другими ЛС. Выводятся бензодиазепины, в основном, с мочой или с калом (10%) в виде конъюгатов и около 0,5-2% - в неизмённом виде.
Скорость элиминации бензодиазепинов зависит также от их липофильности. Более липофильные препараты, прежде всего диазепам, интенсивнее проникают через гемато-энцефалический барьер и, следовательно, их непосредственное психотропное действие наступает через меньший промежуток времени после введения. Оно, однако, быстрее и истощается, так как происходит перераспределение препарата в периферические жировые ткани. Препараты с низкой липофильностью, такие, как лоразепам и оксазепам, действуют медленнее, но более длительно, так как концентрация в мозге поддерживается дольше. С возрастом, а также при заболеваниях печени период полувыведения бензодиазепинов может возрастать в 2 и более раз, что приводит к развитию кумуляции. В этих случаях более предпочтительным является применение оксазепама и лоразепама, не подвергающихся деметилированию или гидроксилированию в печени.
Таблица 28-16. Фармакокинетические параметры анксиолитиков и их активных метаболитов
 Все
бензодиазепины обладают сходным по выраженности анксиолитическим
эффектом и спектром нежелательных лекарственных реакций. Основные
различия между препаратами, определяющие их клинический выбор,
заключаются в фармакокинетических свойствах (коротко-, средне- и
длительнодействующие препараты) и мощности
Все
бензодиазепины обладают сходным по выраженности анксиолитическим
эффектом и спектром нежелательных лекарственных реакций. Основные
различия между препаратами, определяющие их клинический выбор,
заключаются в фармакокинетических свойствах (коротко-, средне- и
длительнодействующие препараты) и мощности
действия, которое коррелирует с силой связывания с ГАМК-А-рецепторами и уровнем эффективной дозы (табл. 28-17).
Таблица 28-17. Основные фармакокинетические различия, обусловливающие клинический выбор анксиолитика
 Особенности
фармакокинетики афобазола*: это «коротко живущее» средство с периодом
полувыведения при приёме внутрь - 0,82+0,54 ч, поэтому кратность
применения разовой дозы - 3 раза в сутки. Средняя величина максимальной
концентрации (Сmах) - 0,130+0,073 мкг/мл; среднее время
удержания препарата в организме (МRТ) - 1,60+0,86 ч. Для афобазола*
характерен высокий клиренс, обеспечивающий быстрое перераспределение из
плазмы крови в ткани и органы, поэтому с первых дней (5-7 день) терапии в
суточной дозе 30 мг начинает проявляться анксиолитическое и
активизирующее действие препарата, достигая максимального
терапевтического эффекта к 4 нед. При длительном применении афобазола* не выявлено ослабления его анксиолитическоно эффекта и признаков синдрома отмены.
Особенности
фармакокинетики афобазола*: это «коротко живущее» средство с периодом
полувыведения при приёме внутрь - 0,82+0,54 ч, поэтому кратность
применения разовой дозы - 3 раза в сутки. Средняя величина максимальной
концентрации (Сmах) - 0,130+0,073 мкг/мл; среднее время
удержания препарата в организме (МRТ) - 1,60+0,86 ч. Для афобазола*
характерен высокий клиренс, обеспечивающий быстрое перераспределение из
плазмы крови в ткани и органы, поэтому с первых дней (5-7 день) терапии в
суточной дозе 30 мг начинает проявляться анксиолитическое и
активизирующее действие препарата, достигая максимального
терапевтического эффекта к 4 нед. При длительном применении афобазола* не выявлено ослабления его анксиолитическоно эффекта и признаков синдрома отмены.
Показания. Различные тревожные синдромы непсихотического уровня как острые, так и хронические, развивающиеся в рамках различых пограничных состояний.
Особо отметим перспективы, которые открывает перед врачом использование в лечебной практике нового транквилизатора афобазола*:
• ГТР;
• тревожные расстройства при заболеваниях соматической сферы: сердечно-сосудистой системы, органов дыхания, органов пищеварения;
• неврастения;
• расстройства адаптации.
Кроме того, применение афобазола* особо показано людям с преимущественно астеническими личностными чертами в виде тревожной мнительности, неуверенности, повышенной ранимости и эмоциональной лабильности, склонных к «пассивному» фенотипу эмоциональнострессовой реакции.
Противопоказания - индивидуальная непереносимость, миастения, порфирия, декомпенсированная лёгочная недостаточность, повышенная чувствительность к бензодиазепинам, злоупотребление алкоголем или лекарственными препаратами, тяжёлые нарушения функций печени и почек, I триместр беременности.
Режим дозирования
При подборе адекватной дозы анксиолитика необходимо руководствоваться правилом «минимальной достаточности», т.е. подобрать такую дозу, чтобы обеспечить нормальный режим функционирования больного (контроль тревоги при минимуме побочных эффектов). Помимо профиля психотропной активности, при выборе ЛС необходимо руководствоваться приведёнными выше его индивидуальными фармакокинетическими параметрами и прежде всего скоростью всасывания и периодом полувыведения (см. табл. 28-16).
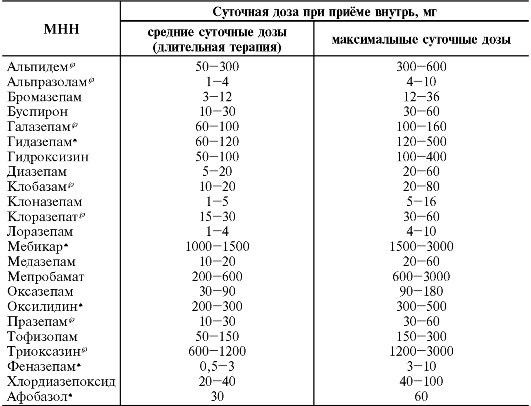
Средние дозы основных анксиолитиков, применяемых для купирования состояний острой тревоги и при проведении длительной терапии, приведены в табл. 28-19.
Таблица 28-19. Уровень доз основных анксиолитиков при лечении состояний тревоги
 Прекращение
применения, особенно коротко действующих анксиолитиков, следует
проводить постепенно с целью предотвращения развития синдрома отмены.
Прекращение
применения, особенно коротко действующих анксиолитиков, следует
проводить постепенно с целью предотвращения развития синдрома отмены.
В последние годы значительные успехи в лечении панического расстройства были достигнуты с помощью применения новых анксиолитиков: альпразолама* , адиназолама* и клоназепама (ривотрил*). При этом рекомендуемые дозы обычно выше, чем при лечении других тревожных состояний.
Имеются данные о том, что некоторые анксиолитики (диазепам , лоразепам, феназепам*, клоназепам) способны купировать психотическую тревогу. Нередко в сочетании с нейролептиками и солями лития их используют при купировании тяжёлого психомоторного возбуждения у маниакальных и психотических больных. Особое значение применение анксиолитиков приобретает при явлениях нейролептической интолерантности, которая достаточно часто встречается у больных шизофренией с признаками органической недостаточности ЦНС.
Помимо тревожных состояний, другим, наиболее частым показанием к применению анксиолитиков бензодиазепинового ряда являются нарушения сна. В этих случаях выбирают быстродействующие и коротко живущие препараты, с тем, чтобы предотвратить дневную сонливость (триазолам* , флунитразепам, темазепам* и др.). При сочетании бессонницы с тревогой желательно разовое (перед сном) применение более длительно действующих препаратов (диазепам, клоразепат* ). Более детально вопросы применения анксиолитиков для лечения расстройств сна освещены в разделе о снотворных средствах.
Анксиолитики с успехом применяются также для купирования явлений абстиненции и делириозных нарушений при хроническом алкоголизме и наркомании. В этих целях обычно применяют хлордиазепоксид, феназепам* или диазепам. Дозы и способ введения зависят от тяжести состояния. Другие фармакологические свойства бензодиазепинов используются при лечении больных эпилепсией (клоназепам, диазепам) и столбняка (диазепам в/в из расчёта 3-10 мг/кг в сутки), в анестезиологической практике - в качестве премедикации при проведении эндоскопических исследований или оперативных вмешательств; в акушерской практике - с целью премедикации и для ускорения раскрытия шейки матки во время родов; при некоторых неврологических расстройствах, протекающих с повышением мышечного тонуса (миорелаксирующее действие), включая резистентную к корректорам экстрапирамидную неврологическую симптоматику (акатизия, дистония, мышечная ригидность). Нередко эти препараты применяют также в качестве вегетостабилизаторов при вегетососудистых дистониях
и диэнцефально-кризовой симптоматике (диазепам, тофизопам), а в сочетании с другими средствами - для облегчения кардиалгий и нарушений ритма.
Нежелательные лекарственные реакции
В отличие от нейролептиков и антидепрессантов анксиолитики не вызывают выраженных нежелательных лекарственных реакций и хорошо переносятся больными. Более того, у многих соматически ослабленных больных вегетостабилизирующий эффект бензодиазепинов оказывает дополнительное благоприятное влияние.
Тем не менее длительно действующие бензодиазепины могут вызывать дневную сонливость, слабость и другие явления гиперседации. Длительный период полувыведения метаболитов у ряда препаратов (см. табл. 28-16) способствует развитию явлений кумуляции, которая может выражаться в ослаблении концентрации внимания, трудностях при запоминании новой информации, забывчивости, пониженном уровне бодрствования и даже спутанности сознания. Объективные нейропсихологические тесты у здоровых добровольцев показывают, что даже в небольших дозах бензодиазепины вызывают лёгкие нарушения некоторых интеллектуальных функций и психомоторных навыков - так называемый феномен поведенческой токсичности. Выраженность этих явлений уменьшается по мере адаптации к препарату. Поэтому при приёме анксиолитиков не рекомендуется водить машину и работать с другими сложными механизмами, требующими предельного сосредоточения внимания. Особенно часто эти явления наблюдаются при употреблении во время лечения этанола даже в небольших дозах.
У некоторых больных применение анксиолитиков может вызвать так называемые парадоксальные реакции - усиление ажитации и агрессивных тенденций, нарушения сна. Как правило, они возникают в первую неделю лечения у больных, злоупотребляющих алкоголем и ранее склонных к потере контроля над собой. Эта симптоматика обычно проходит спонтанно или при снижении дозы препарата.
Внутривенное введение диазепама больным с хроническим бронхитом или эмфиземой лёгких снижает чувствительность дыхательного центра к содержанию углекислого газа в крови, что может существенно осложнить ситуацию. В этих случаях лучше использовать парентеральное применение лоразепама. При использовании короткодействующих бензодиазепинов-гипнотиков на пике концентрации в крови могут наблюдаться кратковременные периоды антероградной амнезии.
Более редко встречаются другие побочные эффекты: мышечная гипотония, физическая слабость, атаксия, головокружение, головные
боли, тошнота, боли в животе, запоры, дизартрия, повышение массы тела, кожные высыпания, недержание мочи и кала, нарушение половой функции, включая дисменорею, и в единичных случаях агранулоцитоз. При применении диазепама может развиваться обострение глаукомы.
Спектр нежелательных явлений других анксиолитиков может несколько отличаться от бензодиазепиновых производных, хотя большинство из них, особенно в начале применения, дают излишнюю седацию и вызывают явления «поведенческой токсичности». Практически не обладает этими свойствами препарат буспирон. Однако при его применении относительно часто наблюдаются головная боль, головокружение и тошнота. Особенно выгодно по спектру нежелательных лекарственных реакций отличается отечественный анксиолитик афобазол*, у которого, по данным клинических исследований, НЛР практически отсутствовали: доля таких НЛР, как кратковременная тошнота и головная боль, составила 0,1 и трактовались они авторами как мавловероятно связанные с применением данного препарата.
Наиболее отрицательной стороной длительного применения анксиолитиков является развитие психической и физической зависимости. По сравнению с барбитуратами и этанолом у анксиолитиков эта способность выражена значительно меньше. Чаще других препаратов лекарственную зависимость вызывают мепробамат, хлордиазепоксид, клоразепат* , диазепам, а также короткодействующие бензодиазепины. Риск появления зависимости возрастает у лиц, склонных к злоупотреблению алкоголем, при самопроизвольном повышении дозировок и особенно при непрерывном применении препаратов более двух месяцев. Резкая отмена терапии ведет к развитию абстинентной симптоматики (тревога, тремор, бессонница, возбуждение, головная боль, потеря аппетита, тошнота, гипергидроз, кошмарные сновидения, колебания сосудистого тонуса, сердцебиение, мышечные подергивания, делириозная симптоматика, судорожный синдром и др.). Эти явления следует дифференцировать с рецидивом невротической тревоги. Необходимо особо отметить, что новый оригинальный анксиолитик афобазол* не вызывает ни психической, ни физической зависимости, а также синдрома отмены и практически не имеет нежелательных явлений, поэтому он может более широко использоваться не только психиатрами и неврологами, но и врачами общей практики, учитывая и тот факт, что афобазол* официально разрёшен к безрецептурному отпуску.
А при применении длительно действующих бензодиазепинов синдром отмены может появиться через 7-10 дней после прекращения терапии. Чтобы избежать этих явлений, отмену терапии, особенно при
уже сформированной зависимости, нужно проводить крайне постепенно (в течение 2-6 нед) и быстрее подключать психотерапевтические и социальные меры коррекции. Вегетативную симптоматику абстинентного синдрома можно значительно облегчить присоединением β-адреноблокаторов или карбамазепина (финлепсин*, тегретол*).
В связи с массовым распространением анксиолитиков актуальна проблема передозировки. Обычно у больных, не страдающих тяжё- лыми соматическими расстройствами, появляется резкая заторможенность, вплоть до ступора, и они засыпают глубоким сном, который может продолжаться до двух суток. В отдельных случаях наблюдаются дизартрия, ригидность или клонические подергивания мышц конечностей. Поэтому в сравнении с другими психотропными средствами передозировка бензодиазепинов (например, с суицидальной целью) значительно менее опасна для жизни.
Лекарственное взаимодействие
Анксиолитики можно сочетать с другими психотропными средствами. Они потенцируют седативное и анксиолитическое действие нейролептиков, что позволяет снизить их дозу. Ингибиторы МАО, кофеин, стрихнин и коразол снижают терапевтическую эффективность бензодиазепиновых производных. По сравнению с барбитуратами, бензодиазепиновые препараты мало влияют на индукцию печёночных ферментов. Они могут понижать содержание барбитуратов в крови. В отличие от них уровень фенитоина в плазме крови может повышаться. Циметидин и омепразол вследствие конкурентной блокады ферментов печени могут на 50% повышать содержание в плазме крови диазепама и хлордиазепоксида и усиливать седативные эффекты, а также нарушают метаболизм нитразепама, альпразолама* и триазолама* , но не вмешиваются в метаболизм оксазепама, лоразепама и темазепама* . Анксиолитики заметно снижают толерантность организма к алкоголю, что может привести к интоксикации при употреблении умеренной дозы алкоголя. При сочетании бензодиазепинов с алкоголем и другими веществами, угнетающими ЦНС (нейролептики, наркотические анальгетики, барбитураты, антигистаминные препараты и др.), седативные эффекты могут резко усиливаться вплоть до угнетения дыхания. Эуфиллин*, теофиллин и кофеин уменьшают эффективность диазепама, лоразепама и других бензодиазепиновых производных. Соли вальпроевой кислоты примерно в два раза увеличивают содержание свободной фракции диазепама в крови, усиливая его клинические эффекты. Рифампицин увеличивает, а изониазид снижает клиренс диазепама и других бензодиазепинов. Дисульфирам (тетурам*) нарушает метаболизм диазепама, хлордиазепоксида и других бензодиазепинов,
разрушающихся путем деметилирования и гидроксилирования, но не меняет метаболизм лоразепама и оксазепама. Гепарин натрия может увеличивать свободную фракцию в крови диазепама, хлордиазепоксида и оксазепама. Применение пероральных контрацептивов обычно снижает клиренс диазепама, хлордиазепоксида и алпразолама. Последний может также увеличивать содержание в плазме крови имипрамина. β-Адреноблокаторы способны понижать клиренс диазепама. Глюкагон и другие гипергликемические средства снижают содержание в плазме крови всех бензодиазепинов, за исключением хлордиазепоксида.
Афобазол* не оказывает влияния на наркотический эффект этанола и гипнотическое действие тиопентала натрия. Потенцирует противосудорожный эффект карбамазепина. Вызывает усиление анксиолитического действия диазепама.
28.2.3. Снотворные средства (гипнотические средства)
Общая информация
Снотворные ЛС вызывают сон или облегчают его наступление. Выделение снотворных препаратов в отдельную группу носит условный характер, поскольку гипнотический эффект имеется у различных классов психотропных ЛС.
Механизм действия
Все снотворные средства укорачивают время засыпания (латентный период сна) и удлиняют продолжительность сна, но по-разному влияют на соотношение парадоксального и медленноволнового сна. Препараты, оказывающие минимальное воздействие на основные фазы сна, наиболее предпочтительны при лечении бессонницы.
Барбитураты оказывают быстрый снотворный эффект даже в тяжё- лых случаях бессонницы, но существенно нарушают физиологическую структуру сна, подавляя парадоксальную фазу. Барбитураты, взаимодействуя с аллостерическим участком ГАМК-рецепторного комплекса, повышают рецепторную чувствительность к ГАМК. Считают, что снотворный, противосудорожный и транквилизирующий эффекты барбитуратов обусловлены ГАМК-ергическим действием. Наряду с раскрытием ионных каналов для ионов хлора, они угнетают адренергические структуры мозга, нарушая проницаемость мембран для ионов натрия, и подавляют дыхание митохондрий нервной ткани. Замедляя восстановление синаптической передачи, барбитураты угнетают стимулирующие механизмы ретикулярной формации стволовой части мозга.
Наиболее широко в качестве снотворных препаратов в настоящее время применяют производные бензодиазепинового ряда, которые также усиливают тормозное влияние ГАМК в ЦНС за счёт повышения рецепторной чувствительности (механизм действия, см. главу 2). В отличие от барбитуратов они в меньшей степени изменяют нормальную структуру сна (несколько редуцируют представленность как парадоксальной фазы, так и медленноволнового сна и увеличивают число «сонных веретен»), значительно менее опасны в отношении формирования лекарственной зависимости и не вызывают выраженных побочных эффектов.
Зопиклон (имован*) и золпидем (ивадал*) являются представителями совершенно новых классов химических соединений. Механизм действия этих ЛС отличается от бензодиазелинов. Золпидем избирательно действует на W1 бензодиазепиновые рецепторы, представляющие собой супрамолекулярный комплекс ГАМК-А рецепторов. Следствием этого является облегчение ГАМК-ергической нейропередачи. Зопиклон непосредственно связывается с макромолекулярным хлорионным комплексом, регулируемым ГАМК. Увеличение потока поступающих ионов Cl- вызывает гиперполяризацию мембран и тем самым сильное торможение ассоциированного нейрона. В отличие от бензодиазепинов новые препараты связываются только с центральными рецепторами и не обладают сродством к периферическим бензодиазепиновым рецепторам.
Классификация
Таблица 28-19. Классификация снотворных средств с учетом длительности их действия
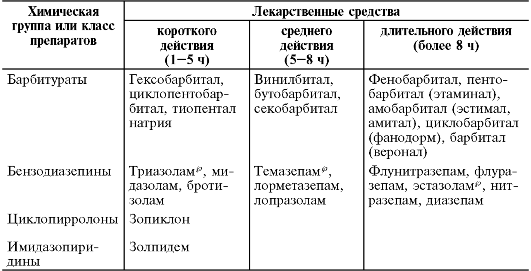 Окончание табл. 28-19
Окончание табл. 28-19
 В
отличие от бензодиазепинов зопиклон не влияет на продолжительность
парадоксальной фазы сна, необходимой для восстановления психических
функций, памяти, способности к обучению, и несколько удлиняет
медленноволновую фазу сна, важную для физического восстановления (см.
табл. 28-20). Золпидем менее последовательно удлиняет медленоволновый
сон, но более часто, особенно при длительном применении, увеличивает
парадоксальную фазу сна.
В
отличие от бензодиазепинов зопиклон не влияет на продолжительность
парадоксальной фазы сна, необходимой для восстановления психических
функций, памяти, способности к обучению, и несколько удлиняет
медленноволновую фазу сна, важную для физического восстановления (см.
табл. 28-20). Золпидем менее последовательно удлиняет медленоволновый
сон, но более часто, особенно при длительном применении, увеличивает
парадоксальную фазу сна.
Подобно барбитуратам мепробамат и глютетимид* также угнетают парадоксальную фазу сна и формируют лекарственную зависимость. Киназолон (метаквалон), хлорметиазол (геминеврин) и хлоралгидрат обладают очень быстрым гипнотическим эффектом и практически не нарушают полиграфическую структуру сна, однако, метаквалон и хлорметиазол относятся к активным токсикоманическим препаратам.
Бромиды и бромуреиды в последние годы редко используются в медицинской практике. Они быстро всасываются, но обладают край-
не медленным метаболизмом, что часто является причиной развития явлений кумуляции и «бромизма» (кожные воспалительные заболевания, конъюнктивит, атаксия, пурпура, агранулоцитоз, тромбоцитопения, депрессивная или делириозная симптоматика).
В качестве снотворных до сих пор нередко используют некоторые антигистаминные средства: дифенилгидрамин (димедрол*), гидроксизин (атаракс), доксиламин (донормил), прометазин (пипольфен). Они вызывают угнетение парадоксальной фазы сна, обладают значительным «последействием» (головные боли, сонливость по утрам) и обладают холиноблокирующими свойствами. Наиболее важным преимуществом антигистаминных препаратов является отсутствие формирования зависимости даже при длительном применении. В «большой» прихиатрии, при психотических состояниях, для коррекции нарушений сна в завимости от ведущего синдрома применяют седативные нейролептики или седативные антидепрессанты.
В последние годы в литературе обсуждается вопрос о целесообразности использования мелатонина для лечения инсомнии. Мелатонин - нейрогормон, вырабатываемый эпифизом, сетчаткой и кишечником. Биологические эффекты мелатонина многообразны: снотворный, гипотермический, антиоксидантный, противораковый, адаптогенный, синхронизационный. Мелатонин часто используют и как снотворное средство, поскольку это вещество максимально синтезируется в темноте - его содержание в плазме крови человека ночью в 2-4 раза выше, чем днём. Мелатонин оказывает слабое действие на структуру сна, тем не менее он способен ускорять засыпание и нормализовывать структуру цикла «сон-бодрствование», в связи с чем может использоваться при биоритмологических сдвигах (сменной работе, перелётах через часовые пояса, инверсии цикла «сон- бодрствование»).
Таблица 28-20. Сравнительное влияние снотворных лекарственных средств на стадии сна
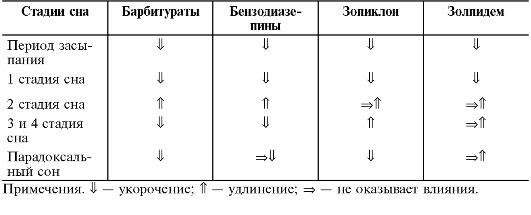 Фармакокинетика
Фармакокинетика
Барбитураты быстро всасываются, хорошо растворяются в жирах и частично связываются с альбуминами плазмы, легко проникают через тканевые барьеры, в том числе и плацентарный, в небольшом количестве секретируются с грудным молоком. Барбитураты короткого действия высокорастворимы в жирах, потому быстро метаболизируются, хорошо реабсорбируются почечными канальцами. Поскольку метаболизм барбитуратов среднего и короткого действия в печени является основным путем их элиминации, при поражении почек безопаснее использовать пентобарбитал, чем фенобарбитал. До 80% этаминаланатрия метаболизируется в печени. Барбитураты являются активными индукторами цитохрома CYP, стимулируют микросомальное окисление, повышают активность таких ферментов, как синтетаза дельтааминолевулиновой кислоты, печёночная глюкуронилтрансфераза и связывающего билирубин Y-протеина. Индукция микросомальных ферментов после введения барбитуратов отмечается через 10 ч, и скорость ферментативных реакций возрастает в несколько раз. Поэтому барбитураты могут снижать эффективность непрямых антикоагулянтов, хинидина, хлорпромазина, фенилбутазона, стероидных гормонов, трициклических антидепрессантов, пероральных контрацептивов, а также некоторых антибиотиков и сульфаниламидов. При регулярном введении кумуляция барбитуратов отмечается на 4-5-й день лечения, что требует перерыва в их назначении на 1-2 дня. У ряда больных отмечается толерантность, связанная с повышением устойчивости клеток мозга. При нарушении функций почек и печени кумулятивные свойства усиливаются.
Из короткодействующих производных бензодиазепина триазолам* вызывает наибольшее количество побочных явлений (усиление тревоги, агрессивности, психотической симптоматики, антероградную амнезию, нарушения памяти, рецидив бессонницы после отмены препарата), а темазепам* достаточно медленно всасывается, что затрудняет его использование при нарушении засыпания.
Зопиклон и золпидем быстро всасываются из желудочно-кишечного тракта. Их пиковые концентрации в плазме крови достигаются через 1,5-2 ч, а пороги снотворного действия - в пределах 30 мин после приёма. Препараты не имеют активных метаболитов. Период полувыведения из организма для зопиклона составляет 3,5-6 ч, а для золпидема - 1,5-4 ч, что характризует их как снотворные быстрого и короткого действия. Биодоступность зопиклона составляет около 80%. Высокие цифры позволяют сделать предположение об отсутствии у него «эффекта прохождения через печень». Биодоступность золпидема - около 66%. Распределение препаратов по органам и тканям
происходит довольно быстро. Время Т1/2 у зопиклона колеблется в пределах 2 ч. При тяжёлой почечной недостаточности период полувыведения препарата увеличивается и составляет у больных с циррозом печени в среднем 11 ч.
Показания. Затрудненное засыпание, раннее или ночное пробуждение, вторичные нарушения сна при психических расстройствах.
Противопоказания. Возраст до 15 лет, беременность, период лактации, выраженная дыхательная недостаточность, повышенная чувствительность к снотворным ЛС.
Режим дозирования и применение. Выбор снотворного ЛС следует делать с учетом причин и характера нарушений сна, а также фармакокинетических свойств самого препарата.
Короткодействующий препарат почти не вызывает кумуляции, но сон может быть пролонгирован недостаточно. И, наоборот, препараты со средним и длительным периодом полужизни дают хороший восьмичасовой сон, но вызывают утреннюю сонливость. Кроме того, в отличие от долгодействующих препаратов гипнотики с короткой и средней длительностью действия вызывают более резкие явления синдрома отмены с рецидивом нарушений сна (так называемая бессонница отнятия) и обострением дневной тревоги (тревога отнятия).
Барбитураты в терапевтических дозах не оказывают влияния на экскрецию мочи, однако при в/в введении отмечается уменьшение количества мочи из-за снижения скорости клубочковой фильтрации вследствие как непосредственного их действия на почечные канальцы, так и стимуляции антидиуретического гормона. Наблюдаемая олигурия при остром отравлении барбитуратами связана главным образом с тяжёлой гипотензией.
В последние годы барбитураты все реже применяются в качестве снотворных средств. Это обусловлено несколькими причинами: они часто и быстро формируют лекарственную зависимость; жизненно опасны при передозировке; противопоказаны при алкоголизме, почечной, печёночной или дыхательной недостаточности, порфирии и некоторых других заболеваниях; вызывают многочисленные побочные эффекты (дневную сонливость, заторможенность, чувство отупления в голове, ослабление концентрации внимания, атаксию, парадоксальные реакции возбуждения и др.); стимулируют метаболическую активность печени, снижая эффективность многих ЛС (например, непрямых антикоагулянтов, ГКС, пероральных антидиабетических и эстрогеннопрогестероновых препаратов) и влияют на другие фармакокинетические параметры многих лекарствнных средств.
При лечении длительной невротической бессонницы, в которой ведущую роль играют тревожные переживания, хороший результат
даёт однократное (на ночь) применение бензодиазепинов с длительным периодом полувыведения (диазепам, феназепам*, флунитразепам, флуразепам, нитразепам, клоразепам и др.). При транзиторных или временных нарушениях сна, связанных, например, с эмоционально-стрессовыми переживаниями, смещением циркадианных ритмов, в ночь перед хирургическими вмешательствами желательно применение гипнотиков с коротким (мидазолам, триазолам*, зопиклон, золпидем, бротизолам) или средним (темазепам*) периодом полувыведения. Длительного применения гипнотиков следует избегать в связи с возможностью быстрого развития явлений привыкания к ним.
Побочные эффекты обнаруживается, в основном, при длительном применении снотворных средств. Ниболее часто наблюдаются остаточные явления или симптомы подействия, характеризующиеся повышенной сонливостью в течение дня, снижением работоспособности, концентрации внимания, ухудшением настроения. Некоторые исследователи эти явления называют «поведенческой токсичностью» препарата, которая затрудняет выполнение обычной активности и работы (например, вождение автомобиля) и влияет на безопасность пациента. Поведенческая токсичность более выражена у склонных к кумулятивному эффекту снотворных с длительным периодом элиминации. Хлоралгидрат и паральдегид вызывают серьёзные желудочно-кишечные нарушения, имеют очень узкое «окно» между терапевтическими и токсическими дозами, а также нередко вызывают кожные аллергические реакции.
Нередко при приёме препаратов, преимущественно бензодиазепиновых производных, отмечаются нарушения памяти в виде антероградной амнезии. При этом поведение больных не меняется. Амнестические расстройства особенно неприятны у больных старшего возраста, которые вынуждены несколько раз в течение ночи вставать с постели. Кроме того, при лечении пожилых людей необходимо учитывать, что фармакокинетика и фармакодинамика большинства снотворных препаратов с возрастом меняется. Поэтому терапию следует начинать с небольших доз (примерно на 50% меньше обычных), повышение доз нужно проводить более постепенно и тщательно следить за состоянием больных.
Особого внимания при применении снотворных средств также требуют больные с нарушением дыхательной функции, особенно при хронических респираторных заболеваниях и синдроме апноэ. Считается, что большинство снотворных препаратов угнетает дыхательный центр. Меньшим влиянием в этом отношении обладает зопиклон.
Длительное назначение снотворных может приводить к развитию толерантности и формированию лекарственной зависимости. В отли-
чие от типичного синдрома зависимости, характеризующегося, прежде всего, появлением тягостных сомато-вегетативных симптомов при отмене препарата, в случае применения снотворных начальные признаки зависимости проявляются в виде невозможности отменить препарат вследствие быстрого рецидива бессонницы. У некоторых больных симптомы привыкания появляются уже через 2-3 нед терапии. Риск развития лекарственной зависимости можно уменьшить применением прерывистых курсов со сменой препаратов, а также тщательным наблюдением за больным и постоянным контролем принимаемой дозы.
В сравнении с наиболее распространёнными снотворными препаратами (нитразепам , триазолам*) зопиклон (имован*) и золпидем (ивадал*) оказывают более физиологическое действие. Они не обладают миорелаксирующим, противосудорожным и остаточным сомнолентным или седативным действием, не меняют уровень дневного функционирования больного и, по-видимому, имеют более низкую вероятность формирования лекарственной зависимости и развития толерантности. Препараты хорошо переносятся. У отдельных больных зопиклон может вызывать ощущение горечи или сухости во рту, а золпидем - лёгкие нарушения памяти и психомоторной координации.
Взаимодействие современных снотворных препаратов должно учитываться врачом при проведении сочетанной фармакотерапии как в плане ее эффективности, так и в отношении побочных эффектов. В повседневной жизни наиболее часто приходится встречаться с взаимодействием снотворных препаратов и алкоголя, которое может привести к значительному угнетению ЦНС и серьёзным последствиям.
28.2.4. НОРМОТИМИКИ (ТИМОИЗОЛЕПТИКИ)
ЛС, способные нивелировать циркулярные расстройства аффективной сферы (колебания настроения) и при профилактическом применении предотвращать развитие депрессивной и маниакальной симптоматики.
К препаратам нормотимического действия относятся:
• соли лития (карбонат, глюконат, сульфат, хлорид, цитрат, оксибутират, пролонгированные препараты лития);
• производные карбазепина:
- карбамазепин (финлепсин*, тегретол*);
- окскарбазепин (трилептал*);
• производные вальпроевой кислоты (все указанные ниже соединения имеют общий механизм действия, обусловленный уровнем вальпроата в плазме крови):
- соли вальпроевой кислоты:
■ натриевая (депакин*, конвулекс*, вальпарин*, ацедипрол*, эвериден*, энкорат*, апилепсин*);
■ кальциевая (конвульсофин*);
■ магниевая (дипромал*);
- дипропилацетамид* (депамид*);
- дивальпроекс натрия* (депакот*);
• блокаторы кальциевых каналов: верапамил (финоптин*, изоптин*), нифедипин (адалат*, коринфар*), дилтиазем (кардил*).
Фармакодинамика
Нормотимический эффект связывают с воздействием на ГАМК-ергическую систему. Известно, что периферические ГАМК-ергические рецепторы принимают участие в регуляции активности кальциевых каналов и функциональной стабилизации клеточных мембран. Оказалось, что карбамазепин в высоких дозах и соли вальпроевой кислоты, подобно солям лития, снижают метаболизм ГАМК путём ингибирования её трансаминазы в гиппокампе, базальных ганглиях и коре головного мозга. ГАМК же, в свою очередь, является пресинаптическим модулятором дофаминергических нейронов, чем, соответственно, и тормозит гипотетический пусковой механизм циркулярных фаз.
Кроме дофаминергического эффекта, определённым сходством нормотимики обладают во влиянии на холинергическую систему. Было высказано предположение, что эти препараты прерывают нейрональную передачу за счёт подавления проводимости для Na+ на уровне клеточной мембраны и регулирования переноса через нее моновалентных катионов.
Центральное действие препаратов связано с влиянием на бензодиазепиновые и опиатные рецепторы, с подавлением активации аденилатциклазы циклического цАМФ, цГМФ и целым рядом других механизмов. Этим, наверное, можно объяснить широкий спектр показаний к применению солей лития и противосудорожных ЛС с нормотимической активностью.
Нормотимические препараты обладают отчётливым антиманиакальным эффектом, антидеперссивное их действие при лечебном и, в меньшей степени, при профилактическом применении выражено значительно слабее. Имеются также данные, что все они оказывают минимальное регулирующее или замедляющее влияние на биологические ритмы в целом, в том числе на циркадианный. Это, в частности, обнаруживается в нормализации ритма «сон-бодрствование», нарушенного у больных с фазовыми проявлениями.
Фармакокинетика
Независимо от путей введения, соли лития быстро диссоцируют и циркулируют в виде ионов. Ионы лития легко всасываются из желудочно-кишечного тракта, максимальная концентрация в крови при пероральном приёме карбоната лития создается уже через 1-3 ч. Ионы лития не связываются с белковыми фракциями крови и поэтому быстро распределяются по всем тканям организма. Быстрее всего литий проникает в почки, наиболее медленно - в мозг. В спинномозговой жидкости содержится в среднем в два раза меньше лития, чем в плазме крови. 95% введённого лития выводится почками. Хотя для полного выведения из организма требуется 10-14 дней, половина введённой дозы элиминируется уже через сутки. Выведение лития происходит пропорционально его концентрации в плазме крови, при этом 4/5 части фильтруемого через клубочки лития реабсорбируется вместе с натрием и водой в проксимальных канальцах. В дистальных канальцах литий практически не подвергается обратному захвату. Поэтому почечный клиренс лития весьма постоянен и составляет около 1/5 части уровня клубочковой фильтрации. При отрицательном балансе натрия и воды увеличивается и реабсорбция лития. Кроме того, литий обладает собственным салуретическим и диуретическим действием.
Карбамазепин медленно всасывается из желудочно-кишечного тракта и пик его концентрации в крови достигается только через 4- 10 ч после приёма. Период полувыведения карбамазепина колеблется от 36 до 15 ч и зависит от длительности применения. Концентрация карбамазепина в грудном молоке составляет около 25-60% концентрации препарата в плазме.
Таблица 28-21. Некоторые фармакокинетические параметры карбоната лития, карбамазепина и вальпроата натрия
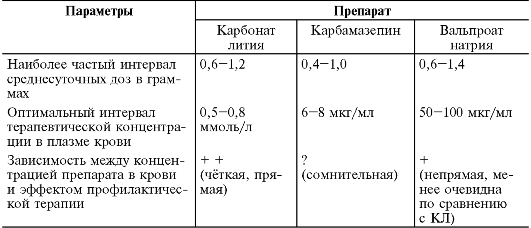 Окончание табл. 28-21
Окончание табл. 28-21
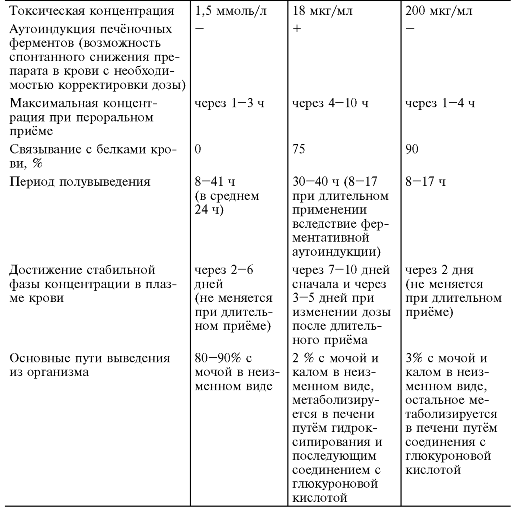 Показания
Показания
С профилактической целью применяются при фазнопротекающих аффективных нарушениях (психотических расстройствах настроения).
Противопоказания применения карбоната лития, карбамазепина и вальпроевой кислоты представлены в табл. 28-22.
Режим дозирования и особенности применения. Действие солей лития обусловлено постоянным присутствием определённого количества лития в организме. Однократный приём терапевтического эффекта не даёт, поэтому в крови должна поддерживаться необходимая концентрация лития.
Таблица 28-22. Противопоказания к назначению карбоната лития, карбамазепина и вальпроата натрия
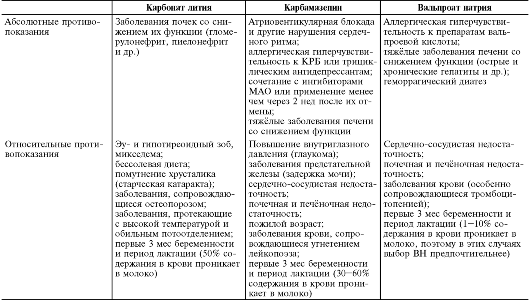 Окончание табл. 28-22
Окончание табл. 28-22
 Для
эффективной терапии солями лития чрезвычайно большое значение имеет
правильно подобранная доза, которая рассчитывается так, чтобы
концентрация лития в плазме крови была не ниже 0,5 и не выше 1,2
ммоль/л. При более низких концентрациях как лечебное, так и
профилактическое действие лития, как правило, не проявляется, при более
высоких - могут появляться начальные симптомы интоксикации.
Для
эффективной терапии солями лития чрезвычайно большое значение имеет
правильно подобранная доза, которая рассчитывается так, чтобы
концентрация лития в плазме крови была не ниже 0,5 и не выше 1,2
ммоль/л. При более низких концентрациях как лечебное, так и
профилактическое действие лития, как правило, не проявляется, при более
высоких - могут появляться начальные симптомы интоксикации.
Оптимальный интервал для достижения антиманиакального терапевтического эффекта составляет 0,8-1,2 ммоль/л, профилактического - 0,4-0,8 ммоль/л. Концентрация лития определяется через 8-12 ч после приёма последней дозы лития, чаще утром, натощак.
Так, пожилым больным в связи с общим снижением уровня клубочковой фильтрации для поддержания адекватной концентрации лития требуются дозы значительно меньшие, чем молодым больным. Например, больному в возрасте 65 лет необходимо назначить дозу в среднем на 34% меньшую, чем больному в возрасте 25 лет.
В настоящее время наиболее распространено применение углекислой соли лития - карбоната лития. Лечение маниакальных состояний рекомендуется начинать с 900 мг/сут (по одной таблетке 3 раза), постепенно повышая дозу за 4-5 дней до 1500-2100 мг. В первую неделю особенно уровень лития желательно определять дважды. При отсутствии побочных явлений и если концентрация лития в плазме не превышает 1,2 ммоль/л, дозу препарата под контролем концентрации в крови продолжают повышать до достижения отчётливого терапевтического эффекта. После купирования основных проявлений маниакального состояния, как правило, ко 2-3-й неделе, дозу лития постепенно снижают и поддерживают его концентрацию в крови на уровне 0,5-0,8 ммоль/л. При установлении равновесия между приёмом и выделением лития, которое характеризуется подобранной устойчивой дозой и концентрацией его в крови, определение лития в крови может проводится один раз в месяц.
Профилактическую терапию карбонатом лития начинают с минимальных суточных доз (300-600 мг). Через неделю определяют концентрацию лития в плазме крови. Если она не достигает необходимого уровня (0,6 ммоль/л), дозу повышают на 300 мг и через неделю вновь проверяют концентрацию. Постепенно повышая таким образом дозу, подбирают количество препарата, обеспечивающее концентрацию 0,4-0,6 ммоль/л. Обычно профилатические дозы составляют 900-1200 мг карбоната лития в день, их равномерно распределяют на трёхразовый приём. Для подбора адекватной профилактической дозы необходимо определить концентрацию лития в крови вначале не реже одного раза в два месяца, в последующем - один раз в 4-6 мес. При
изменении дозы лития концентрацию вновь необходимо проверить через неделю.
Несколько облегчает проведение профилактической терапии применение пролонгированных (ретардированных) форм препаратов лития (микалит* и др.), которые можно применять 1 раз в сутки.
Карбамазепин (финлепсин*, тегретол* и др.) назначается по 200 мг после еды. Существуют ретардированные формы карбамазепина (тегретол СР*, финлепсин-ретард*) по 200 и 400 мг в таблетках, которые всасываются постепенно в течение 24 ч и обеспечивают более равномерную концентрацию в плазме в течение суток.
Увеличение дозы карбамазепина осуществляют постепенно, по мере адаптации к нему от 1-2 таблеток в первую неделю с последующим увеличением на 1 таблетку в неделю. Замедленный темп увеличения дозы карбамазепина связан с возникновением в первые дни лечения или при резком повышении дозы побочных явлений в виде тошноты, сонливости, вялости, мышечной слабости, диплопии, дизартрии, головокружений, атаксических нарушений походки и координации движений. При медленном темпе повышения дозировок подобных явлений, как правило, не наблюдается. В случае их возникновения необходимо уменьшить дозу на 1-2 таблетки. Через 2-3 нед лечения при отсутствии побочных явлений дозу корректируют в сторону увеличения, что связано с явлениями аутоиндукции биотрансформации печёночными ферментами. По этой причине содержание препарата в крови может снижаться на 20-30%, что требует повышения дозы. Однако нет прямой связи между содержанием карбамазепина в крови и его эффективностью в плазме крови. Большую прогностическую ценность имеет определение концентрации в крови метаболитов карбамазепина, в частности 10, 11-карбамазепин-эпоксида.
Вальпроат натрия* обладает раздражающим действием на слизистую оболочку желудка, поэтому его назначают после еды в минимальных дозах (150-300 мг) с последующим постепенным увеличением дозы один раз в 2-3 дня. Медленный темп повышения дозировок необходим для предотвращения развития диспептических расстройств и тремора. Эффективная профилактическая доза обычно варьирует в пределах 600-1400 мг/сут, реже необходимо применение более высоких доз - до 1800 мг/сут. Терапевтическая концентрация вальпроата натрия в плазме крови составляет 50-100 мкг/мл. У вальпроата натрия отмечается определённая связь между эффектом и содержанием препарата в плазме крови. Поэтому для более эффективного применения необходимо проведение фармакокинетического мониторинга.
Блокаторы кальциевых каналов, как и другие нормотимики, обладают отчётливыми антиманиакальными свойствами, которые в несколько
большей степени выражены у нифедипина. В профилактических целях блокаторы кальциевых каналов применяются, в основном, при неэффективности или непереносимости других нормотимических препаратов. При длительном применении желательно контролировать содержание кальция в плазме крови. Верапамил обладает слабой антипароксизмальной активностью и у некоторых больных может приводить к усилению выраженности тревоги и депрессивной симптоматики (см. главу 9).
Классической моделью клинического применения нормотимиков является маниакально-депрессивный психоз (МДП), при котором достигаются наиболее выраженные результаты (70-90% случаев успешной профилактики). При этом происходит предотвращение развития как маниакальных, так и депрессивных фаз.
ЛС этой группы обладают отчётливым антиманиакальным эффектом, позволяющим применять их уже в маниакальной фазе, чаще в сочетании с нейролептиками. Наиболее быстрым антиманиакальным эффектом обладает вальпроевая кислота (эффект развивается через 5- 7 дней от начала лечения), затем карбамазепин (7-14 дней) и карбонат лития (10-14 дней). При лечении мании используемые дозы должны быть в 1,5-2 раза выше средних профилактических. Карбамазепин обладает также определённым антидепрессивным действием, что позволяет применять его при развитии депрессии. В этом отношении препарат, однако, существенно уступает трициклическим антидепрессантам. Поэтому при развитии тяжёлых депрессивных состояний необходимо проведение комбинированной терапии. Прямое влияние на депрессивные фазы карбоната лития и вальпроевой кислоты сомнительно.
Побочные эффекты
Принято выделять побочные эффекты, возникающие в период адаптации к препарату и развивающиеся, как правило, в течение первого месяца лечения, и побочные явления, возникающие на поздних этапах терапии, т.е. при длительном профилактическом приёме. Ранние побочные явления обычно исчезают в процессе лечения и не требуют отмены терапии. При необходимости их коррекции достаточно разделить суточную дозу на более удобный приём, перейти на ретардированные лекарственные формы или временно снизить дозу.
Наиболее типичные ранние (адаптационные) и поздние (отдалён- ные) побочные явления нормотимической терапии в сравнительном аспекте представлены в табл. 28-23.
Некоторые из указанных в таблицах ранних побочных явлений могут принимать затяжной характер. Отравление литием обычно наступает при концентрации лития в плазме крови выше 2,0 ммоль/л, хотя у некоторых больных симптомы интоксикации могут появиться и при более низких уровнях концентрации лития в плазме.
Таблица 28-23. Побочные эффекты нормотимических лекарственных средств
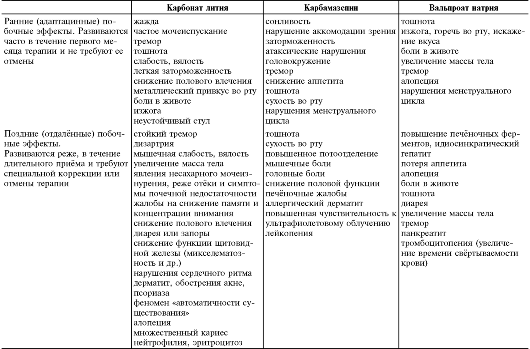 В
процессе профилатической терапии лития карбонатом существенно чаще, по
сравнению с антиконвульсантами, встречаются слабость, вялость, быстрая
утомляемость, тремор, симптомы несахарного мочеизнурения, повышение
аппетита и увеличение массы тела, а также снижение полового влечения,
жалобы на ухудшение памяти, интеллектуальных возможностей, способности к
концентрации внимания и другие расстройства.
В
процессе профилатической терапии лития карбонатом существенно чаще, по
сравнению с антиконвульсантами, встречаются слабость, вялость, быстрая
утомляемость, тремор, симптомы несахарного мочеизнурения, повышение
аппетита и увеличение массы тела, а также снижение полового влечения,
жалобы на ухудшение памяти, интеллектуальных возможностей, способности к
концентрации внимания и другие расстройства.
Почти у половины больных наблюдается характерный тремор. Появляется неритмичное, медленное, крупноразмашистое дрожание пальцев рук, языка, век, а также нарушение почерка, не носящее характера микрографии. Антипаркинсонические средства в этих случаях неэффективны. Необходимо либо снижение дозы лития, либо применение бета-адреноблокаторов, которые в дозе 40-120 мг/сут почти в половине случаев снимают тремор или уменьшают его выраженность.
Часто наблюдаются функциональные почечные расстройства, увеличивается диурез, появляются симптомы несахарного диабета, жажда, полиурия (в отдельных случаях больные выпивают от 5 до 10 л жидкости в день), никтурия, иногда недержание мочи (энурез). Некоторые больные жалуются на отёки голени и стоп, реже лица; в большинстве случаев это носит временный характер. Непосредственной причиной развития несахарного диабета является прямое воздействие ионов лития на клетки дистальных канальцев почек, которые становятся нечувствительными к действию антидиуретического гормона, а также прямое угнетение литием синтеза последнего.
При длительном применении лития иногда возникает так называемый интерстициальный нефрит, который выражается фиброзом и первичным воспламенением интерстициальной ткани.
Довольно часто отмечается увеличение массы тела. В ряде случаев может развиться стойкая диарея. Реже больные жалуются на кожные проявления, аллергические дерматиты, экземы, потерю либидо, импотенцию, ухудшение памяти, потерю вкуса к пище, облысение, а также развитие множественного кариеса вследствие разрушения зубной эмали. Иногда возможно развитие своеобразного гипотиреогидного зоба (увеличение щитовидной железы, понижение ее функции, микседематозность и другие явления гипотиреоидизма). Могут наблюдаться расстройства сердечного ритма (экстрасистолии, частичные блокады), депрессия и инверсия зубца Т на ЭКГ.
При применении карбамазепина развиваются нарушения аккомодации зрения (диплопия), атаксия, головные боли, а при применении вальпроевой кислоты наблюдаются диспепсические жалобы, потеря аппетита, тошнота, искажение вкуса, горечь во рту. Эти явления воз-
никают обычно на ранних этапах терапии и исчезают после снижения дозы или замедления темпов ее наращивания. Иногда при длительном приёме солей вальпроевой кислоты развиваются алопеция и увеличение массы тела.
Из более редких эффектов карбамазепина следует отметить возможность развития лейкопении и аллергических кожных реакций, сопровождающихся мучительным зудом, а также тромбоцитопении, тремора и атаксии при применении вальпроевой кислоты. В литературе имеются указания на возможность возникновения при приёме антиконвульсантов агранулоцитоза, гепатита и нарушений сердечного ритма. В этих случаях терапию рекомендуется немедленно прекратить.
Взаимодействие
При необходимости все нормотимические препараты могут сочетаться с другими психотропными средствами - нейролептиками, антидепрессантами или анксиолитиками. При этом в редких случаях могут возникать нежелательные лекарственные взаимодействия, которых можно избежать применением нормотимиков в более низких дозах. В частности, соли лития могут усиливать серотонинергическое действие антидепрессантов (особенно селективных) и вызывать характерные желудочно-кишечные и неврологические побочные явления. Карбамазепин и соли вальпроевой кислоты являются индукторами ферментов печени и могут менять метаболизм многих ЛС, снижая их эффективность или повышая риск развития токсических явлений.
Исключается совместное применение ингибиторов МАО с карбамазепином или солей лития с диуретиками (кроме осмотических и ингибиторов карбоангидразы). БМКК (дилтиазем, верапамил) на 30-50% могут увеличивать содержание карбамазепина в плазме крови. Почти такой же эффект оказывают антибиотики-макролиды (эритромицин), изониазид. Карбамазепин усиливает метаболизм ГКС и поэтому может давать ложноположительную реакцию на дексаметазоновый тест.
В других случаях происходит усиление или ослабление основного действия препаратов. Так, карбамазепин понижает эффективность пероральных контрацептивов, снижает концентрацию в крови теофиллина, непрямых антикоагулянтов, других противосудорожных ЛС (включая вальпроаты и фенитоин) . Препарат усиливает метаболизм имипрамина. И, наконец, могут увеличиваться риск развития токсических проявлений или возникать непредвиденные парадоксальные реакции (например, при сочетании карбамазепина с флуоксетином или средствами общего наркоза). Следует избегать сочетанного применения блокаторов кальциевых каналов с солями лития вследствие опасного усиления побочных эффектов (тошнота, атаксия, мышечные
подергивания и другие токсические явления). Кроме того, при совместном применении с карбамазепином содержание последнего в плазме крови увеличивается, что может приводить к развитию токсических реакций.
Вальпроевая кислота приблизительно в 2 раза увеличивает свободную фракцию диазепама и некоторых других бензодиазепинов в крови, но не меняет метаболизм клоназепама. Флуоксетин, хлорпромазин (аминазин*) и особенно ацетилсалициловая кислота замедляют метаболизм вальпроата и увеличивают его свободную фракцию в крови. Вальпроевая кислота может снижать метаболизм и других антиконвульсантов (этосуксимид, фенитоин), но удлиняет период полувыведения фенобарбитала. Последний, однако, способен уменьшать концентрацию препарата в крови.
28.3. ПСИХОАНАЛЕПТИКИ
28.3.1. Антидепрессанты
Лекарственные средства психоаналептического действия с преимущественным влиянием на патологически сниженное настроение или депрессивный аффект. Эйфоризирующим эффектом они не обладают, так как у здоровых лиц повышения настроения не вызывают.
Фармакодинамика и механизм действия
Большинство фармакологических эффектов антидепрессантов обусловлено их влиянием на уровень межнейронной передачи импульсов.
Ингибиторы МАО блокируют метаболические пути разрушения нейромедиаторов (норадреналина, серотонина, дофамина), а трициклические антидепрессанты - их обратный захват пресинаптической мембраной, что приводит к повышению содержания свободных нейромедиаторов в синаптической щели. Это обуславливает повышение продолжительности и интенсивности их воздействия на постсинаптическую мембрану. Механизм обратного захвата в норме предотвращает гиперстимуляцию рецепторов постсинаптической мембраны.
Установлено, что вторичные амины преимущественно блокируют обратный захват норадреналина, а третичные амины - как норадреналина, так и серотонина (кломипрамин даже в большей степени блокирует обратный захват серотонина).
Потенцирование серотонинергических структур мозга связывается с основным тимоаналептическим действием антидепрессантов, а норадренергических - с общим активирующим, в том числе психо-
моторную сферу, действием. Установлено, что норадреналин является нейромедиатором, поддерживающим уровень бодрствования и принимающим участие в формировании когнитивных адаптационных реакций, а серотонин осуществляет контроль за импульсивными влечениями, половым поведением, снижением агрессивности, аппетита, облегчением засыпания, регуляцией циклов сна, уменьшением чувствительности к боли, поэтому его называют нейромедиатором «хорошего самочувствия».
Экспериментальным путём была определена активность блокады обратного захвата норадренална и серотонина. Установлены большие различия в проявлении этого эффекта: так, мапротилин в 470 раз активнее блокирует обратный захват норадреналина, чем серотонина; дезипрамин - в 380 раз, доксепин - в 15 раз, а классические трициклические антидепрессанты - имипрамин и амитриптилин - соответственно только в 3,2 и в 2,8 раза. Тразодон, напротив, в 26 раз, а кломипрамин в 5 раз сильнее блокируют обратный захват серотонина, чем норадреналина (см. табл. 28-9).
В настоящее время выделяется особая группа антидепрессантов, так называемая группа ингибиторов обратного захвата серотонина, с еще большей избирательностью блокирующего действия на обратный захват серотонина. К ним относятся флувоксамин, флуоксетин, циталорам, сертралин и пароксетин.
Таблица 28-24. Сравнительная активность некоторых антидепрессантов по способности блокировать обратный захват норадреналина по отношению к серотонину
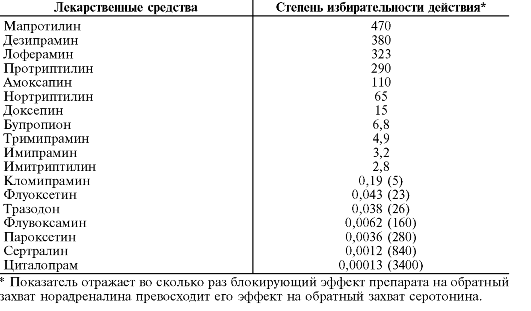 При
оценке спектра фармакологической активности антидепрессанта нужно иметь
в виду, что избирательность действия не равнозначна силе блокирующего
влияния на обратный захват нейромедиатора. Так, по этому показателю
наиболее активным воздействием на обратный захват норадреналина в
экспериментальных условиях обладает дезипрамин (см. табл. 28-10),
который почти в 4 раза превосходит идущие вслед за ним нортриптилин,
амоксапин и мапротилин. Существенную активность в этом отношении имеют
также имипрамин, доксепин, амитриптилин, кломипрамин. Остальные
препараты достаточно слабо блокируют обратный захват норадреналина.
При
оценке спектра фармакологической активности антидепрессанта нужно иметь
в виду, что избирательность действия не равнозначна силе блокирующего
влияния на обратный захват нейромедиатора. Так, по этому показателю
наиболее активным воздействием на обратный захват норадреналина в
экспериментальных условиях обладает дезипрамин (см. табл. 28-10),
который почти в 4 раза превосходит идущие вслед за ним нортриптилин,
амоксапин и мапротилин. Существенную активность в этом отношении имеют
также имипрамин, доксепин, амитриптилин, кломипрамин. Остальные
препараты достаточно слабо блокируют обратный захват норадреналина.
Таблица 28-25. Сравнительная фармакологическая активность антидепрессантов
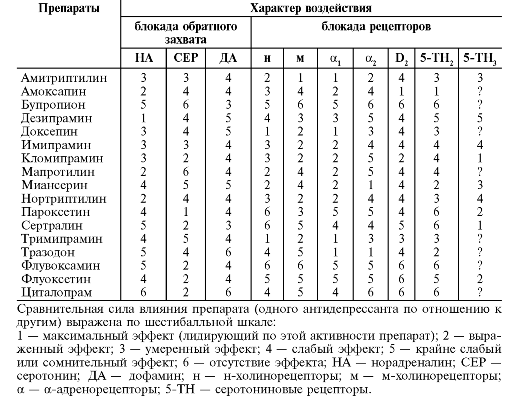 По
выраженности блокирующего влияния на обратный захват серотонина
выделяются пароксетин, сертралин и кломипрамин, причём последний в 2
раза превосходит известный серотонинергический антидепрессант
флувоксамин и в 4 раза - флуоксетин, за которым следуют амитриптилин и
имипрамин. При этом амитриптилин действует в 3 раза активнее тразодона,
который является высоко избирательным,
По
выраженности блокирующего влияния на обратный захват серотонина
выделяются пароксетин, сертралин и кломипрамин, причём последний в 2
раза превосходит известный серотонинергический антидепрессант
флувоксамин и в 4 раза - флуоксетин, за которым следуют амитриптилин и
имипрамин. При этом амитриптилин действует в 3 раза активнее тразодона,
который является высоко избирательным,
но слабым блокатором обратного захвата серотонина. За ним идёт основная группа антидепрессантов.
Из таблиц также следует, что наиболее активными антидепрессантами, неизбирательно блокирующими как обратный захват серотонина, так и норадреналина, является классическая триада трициклических антидепрессантов (имипрамин, амитриптилин и кломипрамин), эффективность которых при депрессиях проверена многолетним опытом их практического применения. Среди них следует выделить кломипрамин, который, наряду с равным по активности двум другим препаратам норадренергическим действием, в 5 раз сильнее блокирует пресинаптический захват серотонина и является одним из самых активных тимоаналептических средств.
Выяснилось также, что молекулы антидепрессантов, в частности нефазодона, способны непосредственно блокировать рецепторы постсинаптической мембраны, препятствуя действию нейромедиаторов. Прямое воздействие препаратов на постсинаптическую мембрану в настоящее время признается важной составной частью их антидепрессивного эффекта.
Кроме того, синтезированы и введены в практику препараты «двойного» действия, ингибирующие обратный захват как серотонина, так и норадреналина - милнаципран, миртазапин и др. Миртазапин по механизму обратной связи блокирует α2-рецепторы или ауторецепторы и, таким образом, способствует выбросу серотонина и норадреналина в синаптическую щель, с одной стороны. С другой стороны, он блокирует 5НТ2- и 5НТ3-рецепторы и серотонину приходится связываться с 5НТ1-рецепторами, с которыми и связано развитие собственно тимоаналептического эффекта.
Существуют также препараты, обнаруживающие отчётливые тимоаналептические свойства, механизм действия которых остаётся до конца не понятным. К этим препаратам относятся тианептин (коаксил), S-аденозинметионин (гептрал), некоторые бензодиазепиновые производные, например, алпразолам и нейропептиды. В частности, тианептин усиливает обратный захват серотонина пресинаптической мембраны, т.е. фактически оказывает действие, противоположное эффектам основных антидепрессантов, и способствует усилению сберегающего естественного механизма этого нейромедиатора в пресинаптическом окончании. Кроме того, препарат путём геномрегуляторных механизмов способствует уменьшению количества или плотности серотониновых рецепторов на постсинаптической мембране, что ведёт к снижению чувствительности постсинаптической мембраны к серотонину и тем самым обеспечивает тианептину более высокую переносимость. Было показано, что тианептин способен коррегировать стрессовый
выброс адреналина через гипоталамо-гипофизарно-надпочечниковую систему, а также тианептин имеет нейропротективные свойства, так как способен увеличивать длину и число апикальных дендритов пирамидальных клеток гиппокампа. Еще одним достоинством тианептина является его способность увеличивать содержание внеклеточного дофамина во фронтальной коре, а этот механизм, свойственный атипичным нейролептикам, принято связывать с редуцирующим воздействием на дефицитарную симптоматику шизофрении, в частности на когнитивные дисфункции.
Антидепрессанты связываются с различными рецепторами как в центральной, так и в периферической нервной системе. Однако их воздействие по сравнению с более специфическими средствами, используемыми в соматической медицине, относительно невелико.
Многие препараты клинически значимо блокируют м-холинорецепторы и Н1-гистаминовые рецепторы. В последние годы получены данные, что некоторые трициклические антидепрессанты (амитриптилин, имипрамин, кломипрамин, дезипрамин) могут связываться также с опиатными рецепторами, чем, вероятно, объясняются их антиноцептивные (аналгезирующие) свойства.
Важная роль в механизмах развития эффекта антидепрессанта принадлежит изменению в процессе терапии рецепторной чувствительности. Этим, в частности, объясняется отставленность на 2- 3 нед их клинического эффекта. Практически все антидепрессанты в эксперименте после трёхнедельного введения вызывают уменьшение числа постсинаптических β-адренорецепторов, снижают выработку циклического цАМФ. Трициклические антидепрессанты вызывают гиперчувствительность α1-адренорецепторов (увеличение плотности) и снижают чувствительность (уменьшение плотности и функциональной активности) β-адрено-, ГАМК- (типа Б), α2-адрено- и серотониновых рецепторов (типа 5ТН2) на постсинаптической мембране в кортикальных структурах мозга, а также снижают функциональную активность дофаминовых ауторецепторов, увеличивают плотность, но снижают активность лимбических серотониновых (типа 5ТН1а) рецепторов. Таким образом, можно отметить, что тимоаналептический эффект любого антидепрессанта, особенно при длительном применении, реализуется посредством комплексного воздействия на большинство нейромедиаторных и рецепторных систем мозга. Эти эффекты могут быть объяснены в свете взаимодействия между различными моноаминергическими системами мозга. Стимуляция одной системы приводит к быстрым или отставленным по времени изменениям в другой системе моноаминов. Поэтому индивидуальный спектр эффектов антидепрессанта зависит от соотношения первичности и выраженности
этих воздействий. Взаимосвязь фармакологических эффектов антидепрессантов с их клиническими проявлениями представлена в табл.
28-26.
Таблица 26. Фармакологические свойства антидепрессантов и их клинические проявления
 Продолжение табл. 28-26
Продолжение табл. 28-26
 Окончание табл. 28-26
Окончание табл. 28-26
 Фармакокинетика
Фармакокинетика
При пероральном приёме трициклические антидепрессанты быстро всасываются и распределяются по всему организму. Около 50% введённой дозы элиминируется в среднем за двое суток, преимущественно с мочой, остальная часть связывается с белками крови и полностью утилизируется лишь через 2 нед.
Большинство как трициклических, так и серотонинергических антидепрессантов метаболизируется путём гидроксилирования ферментами печени, изоферментом цитохрома CYP2D6, активность которого может индивидуально варьировать вследствие генетического полиморфизма, чем отчасти определяется и эффективность терапии (см. главу 7 «Клиническая фармакогенетика»).
Многие метаболиты активны и играют роль большую, чем основной препарат в формировании терапевтического эффекта.
Норфлуоксетин по сравнению с флуоксетином имеет существенно больший период полувыведения, что во многом определяет характер побочных реакций последнего.
N-дезметилциталопрам значительно активнее действует, по сравнению с норфлуоксетином в отношении блокады обратного захвата норадреналина.
Для некоторых трициклических антидепрессантов (нортриптилин и бупропион) имеется «терапевтическое окно» концентрации, при которых развивается клинический эффект. Многие трициклические
антидепрессанты имеют линейную зависимость между их содержанием в плазме крови и клинической эффективностью. Так, например, при концентрации имипрамина в плазме крови меньше 150 нг/мл клинический эффект отмечался только у 29% больных, а при концентрации больше 250 нг/мл - у 93% больных. Следовательно, у таких препаратов дозу можно повышать до уровня переносимой или до наступления эффекта. Однако для большинства антидепрессантов, в том числе последнего поколения, чёткой связи между эффектом и концентрацией в крови не найдено. Более того, оказалось, что серотонинергические антидепрессанты, независимо от концентрации в крови, часто оказываются более эффективными при применении в низких дозах.
Период полувыведения широко варьирует у отдельных антидепрессантов и составляет, например, для имипрамина и флувоксамина - 15 ч, для амитритилина - 16 ч, для пароксетина - 20 ч, для нортриптилина - 24 ч, для сертралина - 25 ч, а для протриптилина - 126 ч, флуоксетина - около 60 ч, а его метаболита (норфлуоксетина) около 300 ч (7-15 дней!) (табл. 28-12). У препаратов с длительным периодом полувыведения равновесная концентрация достигается значительно позднее (у флуоксетина, например, через 1-4 мес после начала лечения), но реже возникает синдром отмены при резком прекращении приёма препарата.
Скорость выведения из организма является важной характеристикой антидепрессантов, по крайней мере, исходя из двух соображений: во-первых, - частоты назначения препарата и, во-вторых, - риска развития тяжёлой интоксикации при передозировке препаратов с длительным периодом полувыведения. Депрессивные больные, как известно, достаточно часто используют «подручные» ЛС в суицидальных целях.
Содержание антидепрессанта в плазме крови у отдельных больных может различаться в 5-10 раз. Такой разброс связан, главным образом, с индивидуальными различиями процессов метаболизма в печени. Их скорость зависит от многих причин: генетически детерминированной активности цитохромов CYP, функционального состояния печени и организма в целом, явлений лекарственной аутоиндукции или аутоингибирования ферментов (например, повышенные дозы флуоксетина и пароксетина угнетают метаболическую активность изофермента цитохрома CYP2D6, что может приводить к существенному увеличению их содержания в крови и удлинению периода полувыведения), от применяемого препарата (например, превращение имипрамина в дезипрамин происходит значительно быстрее, чем амитриптилина в
нортриптилин) и во многом также от возраста больного. Пожилые вследствие замедленного метаболизма склонны к быстрому развитию тяжёлых побочных эффектов, особенно при применении третичных аминов, которые уменьшают и без того сниженную окислительную активность ферментов печени. У детей метаболизм, наоборот, ускорен и в пересчёте на единицу массы тела иногда требуется применение более высоких доз препарата, хотя именно в этом возрасте передозировка антидепрессантов особенно опасна. Кроме того, уровень антидепрессанта в плазме крови может существенно изменяться вследствие различных лекарственных взаимодействий.
Показания
Депрессии различного генеза, в том числе депрессивные состояния циклотимического уровня, дистимии, меланхолический синдром, атипичные депрессии, астенические и адинамические расстройства, депрессии с идеаторной и двигательной заторможенностью, деперссивные нарушения с ипохондрической симптоматикой и др. Паническое расстройство, обсессивно-компульсивное расстройство, социальная фобия, нервная анорексия и булимия, нарколепсия, соматоформные расстройства. В клинике алкоголизма их применяют вне периода абстиненции, при повышенной утомляемости, при отсутствии выраженной тревоги, бессоннице, дисфорических нарушениях.
Противопоказания
Состояние возбуждения, судорожные припадки, острые случаи спутанности сознания, поражения печени и почек в стадии декомпенсации, стойкая гипотензия, нарушение кровообращения. Беременность. Индивидуальная непереносимость.
Дозы и принципы выбора антидепрессантов
Интервалы средних суточных доз при пероральном и парентеральном введении основных антидепрессантов приведены в табл. 28-27, для лечения тяжёлых эндогенных депрессий в условиях стационара. В амбулаторной и общей терапевтической практике часто оказывается достаточным применение ЛС в более низких дозах.
Обычно клинический эффект антидепрессантов развивается через 2-3 нед их применения в адекватных дозах. Большинство из них могут назначаться 1-2 раза в день (в зависимости от периода их полувыведения из организма). При этом препараты с седативным действием применяются преимущественно на ночь, а со стимулирующими свойствами - утром и днём.
Таблица 28-27. Интервал суточных доз антидепрессантов и периоды их полувыведения
 Продолжение табл. 28-27
Продолжение табл. 28-27
 Окончание табл. 28-27
Окончание табл. 28-27
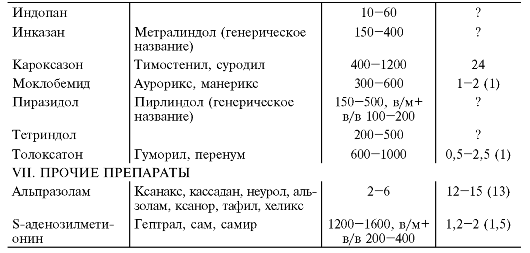 Сравнительное
изучение спектров психотропной активности антидепрессантов показывает,
что они различаются, прежде всего, по способности воздействовать на
большую или меньшую глубину витально изменённого аффекта, т.е. на
депрессии «психотического» или «невротического» уровня. Такие
классические антидепрессанты, как кломипрамин, имипрамин , амитриптилин
чаще применяют при эндогенной депрессии и поэтому иногда называются
«большими» антидепрессанатами. Препараты типа азафена, дезипрамина,
трансамина, миансерина, тразодона, цефедрина, вилоксазина более
эффективны при депрессиях с менее глубоким аффектом (невротические,
реактивные, соматогенные, на почве сосудистых поражений головного мозга и
др.) и условно могут быть отнесены к «малым» антидепрессантам. В
зависимости от глубины и нозологической принадлежности депрессии часто
меняется уровень эффективных дозировок и продолжительность терапии. При
тяжёлых стационарных депрессиях следует прибегать прежде всего к
«большим» антидепрессантам, обладающим выраженным собственно
тимоаналептическим действием и пригодным и для парентерального введения
(кломипрамин, амитриптилин, имипрамин, мапротилин).
Сравнительное
изучение спектров психотропной активности антидепрессантов показывает,
что они различаются, прежде всего, по способности воздействовать на
большую или меньшую глубину витально изменённого аффекта, т.е. на
депрессии «психотического» или «невротического» уровня. Такие
классические антидепрессанты, как кломипрамин, имипрамин , амитриптилин
чаще применяют при эндогенной депрессии и поэтому иногда называются
«большими» антидепрессанатами. Препараты типа азафена, дезипрамина,
трансамина, миансерина, тразодона, цефедрина, вилоксазина более
эффективны при депрессиях с менее глубоким аффектом (невротические,
реактивные, соматогенные, на почве сосудистых поражений головного мозга и
др.) и условно могут быть отнесены к «малым» антидепрессантам. В
зависимости от глубины и нозологической принадлежности депрессии часто
меняется уровень эффективных дозировок и продолжительность терапии. При
тяжёлых стационарных депрессиях следует прибегать прежде всего к
«большим» антидепрессантам, обладающим выраженным собственно
тимоаналептическим действием и пригодным и для парентерального введения
(кломипрамин, амитриптилин, имипрамин, мапротилин).
Профиль психотропной активности различных антидепрессантов колеблется в значительных пределах: от тимоэретиков (ингибиторы МАО), в действии которых может настолько доминировать стимулирующий компонент, что некоторые из них нередко рассматриваются в классе психостимуляторов (сиднофен, индопан) до седативных тимолептиков, тормозное действие которых сравнимо с нейролептическим.
К группе антидепрессантов с седативной активностью относятся амитриптилин, доксепин (синэкван), миансерин (леривон), трими-
прамин (герфонал, сюрмонтил), азафен, амоксапин, опипрамол (инсидон), тразодон (триттико) и др., к группе антидепрессантов-стимуляторов - ингибиторы МАО, включая моклобемид (аурорикс), дезипрамин (пертофран, петилил), нортриптилин (авентил), цефедрин, имипрамин (имизин, мелипрамин), инказан, бупропион, аминептин (сюрвектор), флуоксетин (прозак) и др. Выделяют и промежуточную группу препаратов с более широким, поливалентным или сбалансированным спектром действия, которые характеризуются тропизмом как к тревожным, так и к заторможенным формам депрессий. К ним относятся мапротилин (лудиомил), пиразидол, дибензепин (новерил), кломипрамин (анафранил), тианептин (коаксил), досулепин (протиаден). Эти антидепрессанты наиболее эффективны при «размытых», недостаточно чётко оформленных или полиморфных депрессивных синдромах, а также при неустойчивых состояниях с колебаниями глубины и структурных особенностей аффекта (табл. 28-28).
Указанная классификация не учитывает, однако, тимоаналептическую активность препаратов и не разделяет седативный и анксиолитический эффекты. Вместе с тем многие современные антидепрессанты (например, селективные ингибиторы обратного захвата серотонина) практически лишены собственно седативных свойств (включая сомнолентный эффект), но обладают значительным анксиолитическим действием. В последние годы у ряда препаратов со стимулирующим действием (ингибиторы МАО, кломипрамин) была выявлена способность редуцировать фобические расстройства; у еще более узкой подгруппы препаратов (кломипрамин, серотонинергические антидепрессанты) обнаружен отчётливый антиобсессивный эффект. Причём эти свойства не связаны прямо с основным тимоаналептическим эффектом. В действии антидепрессантов на соматическую сферу принято выделять вегетостабилизирующее, холиноблокирующее и гипотензивное действие, которое также имеет важное значение при выборе того или иного препарата для конкретного больного. Поэтому полностью особенности клинической эффективности того или иного препарата могут быть учтены только в индивидуальных спектрах психотропного действия.
Таблица 28-28. Клиническая классификация антидепрессантов
 Окончание табл. 28-28
Окончание табл. 28-28
 Одним
из наиболее надёжных указаний на благоприятный исход лечения может
служить ранняя положительная реакция на применение антидепрессанта или
его эффективность в предшествующих обострениях. Несмотря на широко
распространённое мнение, что действие антидепрессантов развивается
только к концу 2-3-й недели лечения, в некоторых случаях заметное
клиническое улучшение наступает уже в первую неделю терапии.
Одним
из наиболее надёжных указаний на благоприятный исход лечения может
служить ранняя положительная реакция на применение антидепрессанта или
его эффективность в предшествующих обострениях. Несмотря на широко
распространённое мнение, что действие антидепрессантов развивается
только к концу 2-3-й недели лечения, в некоторых случаях заметное
клиническое улучшение наступает уже в первую неделю терапии.
Подбор эффективной дозы препарата зависит не только от тяжести состояния, но и от индивидуальных особенностей организма, а также от стадии развития депрессивной фазы.
Общее правило для большинства трициклических антидепрессантов заключается в том, что терапию начинают с 25-50 мг/сут и в течение 3-4 дней доводят дозы до 100 мг/сут, при хорошей переносимости и отсутствии эффекта в течение 10 дней при применении половины максимальной дозы (для трициклических антидепрессантов она составляет около 150 мг/сут) дозы быстро увеличивают до максимальных.
Эти положения не действуют при подборе дозы серотонинергических антидепрессантов, которые сразу назначаются в стандартной, фиксированной на весь срок терапии дозе (она не меняется даже при проведении последующей длительной профилактической терапии). Более того, у многих больных более эффективным оказывается применение препаратов именно в низких дозах.
При отсутствии какого бы то ни было эффекта в течение 3-4 нед необходимо переходить к другому антидепрессанту, лучше другой химической структуры и другого механизма действия. В случае некоторого облегчения состояния больного, особенно при применении серотонинергических антидепрессантов, по-видимому, более целесообразно подождать до 6-8 нед терапии, так как эффект у многих больных развивается более постепенно.
Кроме того, следует помнить, что постоянным риском при медикаментозном лечении депрессий является возможность употребления больным больших доз антидепрессантов с суицидальной целью. Многие из антидепрессантов, особенно трициклические и гетероциклические соединения, при передозировке, в основном из-за кардиотоксичности приводят к летальному исходу. К относительно безопасным препаратам следует отнести селективный стимулятор обратного захвата серотонина тианептин, группу селективных ингибиторов обратного захвата серотонина (флуоксетин, флувоксамин, сертралин, пароксетин) и селективный ингибитор обратного захвата норадреналина миансерин. Все остальные группы антидепрессантов являются потенциально опасными при передозировке, среди которых самыми опасными следует считать амитриптилин и транилципрамин (табл. 28-29).
Таблица 28-29. Безопасность антидепрессантов при передозировке
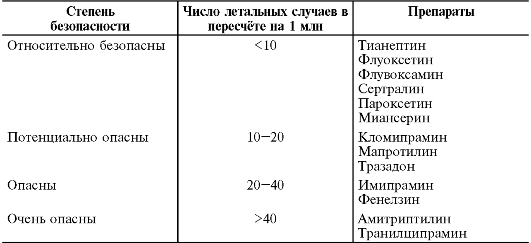 Также нельзя забывать и о возможных последствиях, возникающих при резком прекращении лечения антидепрессантами и выражающихся:
Также нельзя забывать и о возможных последствиях, возникающих при резком прекращении лечения антидепрессантами и выражающихся:
• продолжительной эутимией (состоянием благодушия);
• рецидивом депрессии;
• синдромом отмены;
• переходом депрессии в эутимию;
• переходом в гипоманию;
• утратой положительной реакции на отмену антидепрессанта при последующем его применении.
Так, например, при резком обрыве терапии риск развития рецидива возрастает на 20-50%. Поэтому атидепрессанты нужно отменять постепенно, плавно снижая дозу и иногда оставляя приём 2-3 раза в неделю.
Что касается продолжительности терапии антидепрессантами, то большинство клиницистов признают правомочность схемы лечения депрессии, предложенной Kupfer в 1991 г. В этой схеме условно выделено три фазы терапии депрессии: купирующая, поддерживающая и профилактическая. Купирующая фаза редуцирует симптомы депрессии и продолжается до наступления ремиссии (обычно 6-12 нед). Поддерживающая фаза снижает риск рецидивов и продолжается 4-9 мес после наступления ремиссии. А профилактическая фаза редуцирует риск развития повторных эпизодов депрессии и продолжается неограниченно долго (1 год и более). Столь длительное применение антидепрессантов объясняется длительностью нейрохимической перестройки и данными клинической практики, которая показывает, что рецидивирование или обострение депрессивной симптоматики после успешной терапии острого депрессивного эпизода наблюдается в первый год у 30% пациентов, на второй - у 50%, на третий - у 70%.
Побочные эффекты
Возникновение побочных явлений обусловлено в основном блокирующим влиянием на рецепторы периферической нервной системы и для каждого конкретного препарата во многом определяется индивидуальными особенностями профиля его фармакологической активности.
Большинство побочных эффектов трициклических антидепрессантов связано с их влиянием на вегетативную нервную систему. К ним относится, например, ортостатическая гипотензия, возникающая чаще у пожилых людей и больных гипертонической болезнью при нарушении функции левого желудочка и особенно при сочетанном применении с диуретиками и сосудорасширяющими средствами. При терапии трициклическими антидепрессантами эти явления встречаются в начале терапии, а при использовании ингибиторов МАО - на второй неделе лечения.
Холиноблокирующее побочное действие чаще наблюдается при применении трициклических антидепрессантов в достаточно высоких дозах (200-300 мг/сут) в виде сухости слизистых оболочек полости рта, уменьшения потоотделения, тахикардии, затруднён- ного мочеиспускания (атония мочевого пузыря), нечёткости зрения (нарушение аккомодации), ахалазии пищевода, запора вследствие атонии кишечника и угнетения перистальтики вплоть до паралитического илеуса. Во всех случаях они обратимы и быстро исчезают при снижении дозы или временной отмене препарата. Стойкая задержка мочи у предрасположенных больных купируется подкожным введением 0,25-1,0 мл 1% раствора галантамина или 1 мл 0,05% раствора прозерина.
У пожилых лиц уже при применении антидепрессантов в небольших дозах, особенно в вечерние часы, может появляться мерцающая делириозная симптоматика (спутанность, неполная ориентированность в месте, времени и собственной личности, усиление тревоги, ажитации, элементы галлюцинаторного или иллюзорно-бредового восприятия). Реже, как правило, при передозировке развивается картина типичного атропиноподобного делирия с устрашающими зрительными галлюцинациями. Лечение заключается в отмене антидепрессанта, назначении детоксикационной терапии и холиномиметических средств (внутривенное введение физостигмина). Последний, однако, часто вызывает тошноту, рвоту, диарею, брадикардию, может обострить астму или спровоцировать судорожный синдром.
Около 10% больных, принимающих трициклические антидепрессанты, страдают мелкоразмашистым быстрым тремором, который уменьшается при присоединении небольших доз фенобарбитала или
пропранолола. При передозировке тремор может приобретать генерализованный характер, появляются дизартрия, миоклонические подергивания и другие неврологические симптомы.
К довольно серьёзным побочным эффектам следует отнести нарушение сердечной проводимости. Трициклические антидепрессанты имеют свойство накапливаться в миокарде, при этом их концентрация там более чем в 100 раз превышает содержание в плазме крови. Резкое угнетение активности парасимпатической нервной системы приводит к развитию тахикардии и появлению эктопических импульсов. Кроме того, в больших дозах трициклические антидепрессанты обладают собственным хинидиноподобным действием, с которым связывают замедление желудочковой проводимости (вплоть до блокады) и отрицательный инотропный эффект. Известно, что все антиаритмические средства I класса (хинидин, прокаинамид, дизопирамид), свойства которых разделяют трициклические антидепрессанты, в 10% случаях дают проаритмические эффекты, особенно после инфаркта миакарда, что может привести к летальному исходу. На ЭКГ отмечаются удлинение сегмента QRS и интервала P-Q, расширение зубца Т, экстрасистолы и другие формы аритмии, признаки нарушений атриовентрикулярной проводимости. Все эти явления обычно развиваются в первый месяц лечения при применении в высоких дозах и исчезают в течение нескольких недель после отмены препарата. Тем не менее именно с нарушением сердечной проводимости связываются отдельные случаи внезапной смерти при применении трициклических антидепрессантов. При более длительной терапии антидепрессантами описано развитие кардиомиопатии с атрофией левого желудочка, ишемических нарушений и даже инфаркта миокарда.
Изменения крови в виде анемии, лейкопении и эозинофилии отмечаются весьма редко и быстро исчезают при отмене препарата. Лекарственный агранулоцитоз описан в единичных наблюдениях при применении имипрамина, а тромбоцитопения - при терапии доксепином. При применении имипрамина наблюдались случаи венозного тромбоза и тромбоэмболии.
Изредка возникают кожные аллергические реакции по типу маку- лопапулёзной сыпи с отёком, дерматоваскулита или в виде повышенной чувствительности к солнечному облучению.
У некоторых больных трициклические антидепрессанты могут снижать порог судорожной активности и вызывать пароксизмальные явления (особенно у предрасположенных больных).
Среди более редких побочных эффектов нужно отметить множественный кариес зубов, развивающийся вследствие длительной ксеростомии (сухость во рту).
Таблица 28-30. Характеристика побочных эффектов антидепрессантов
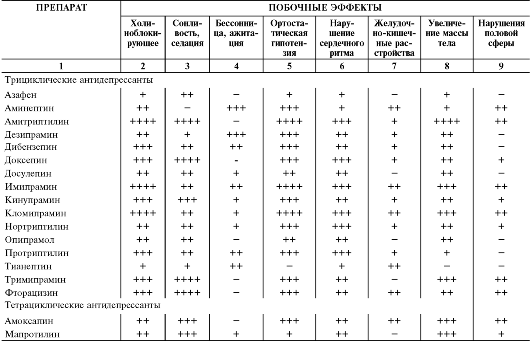 Окончание табл. 28-30
Окончание табл. 28-30
 У
некоторых больных наблюдаются обменно-эндокринные нарушения в виде
задержки жидкости с небольшой отёчностью тканей, увеличение массы тела в
связи с повышением аппетита, дисменорея, а также дисфункция половой
сферы, включая снижение либидо, нарушение эрекции, задержку эякуляции,
аноргазмию. Эти расстройства преходящие и обычно устраняются витаминами
группы В, присоединением мочегонных средств в небольших дозах или
дигидроэрготамина (10-20 капель 3 раза в день).
У
некоторых больных наблюдаются обменно-эндокринные нарушения в виде
задержки жидкости с небольшой отёчностью тканей, увеличение массы тела в
связи с повышением аппетита, дисменорея, а также дисфункция половой
сферы, включая снижение либидо, нарушение эрекции, задержку эякуляции,
аноргазмию. Эти расстройства преходящие и обычно устраняются витаминами
группы В, присоединением мочегонных средств в небольших дозах или
дигидроэрготамина (10-20 капель 3 раза в день).
Более редки идиосинкратические гепатиты вследствие аллергического холангита, которые сопровождаются повышением печёночных функциональных проб, гепатоцеллюлярные нарушения более свойственны гидразиновым ингибиторам МАО.
Поскольку трициклические антидепрессанты проникают через плаценту и в грудное молоко (ребёнок получает примерно 1% дозы матери), при беременности и лактации их применение требует особой осторожности. Хотя тератогенных эффектов зарегистрировано не было, по-видимому, следует избегать назначения антидепрессантов в первый триместр беременности.
При применении необратимых ингибиторов МАО, помимо холиноблокирующих побочных эффектов, могут развиваться так называемые тираминовые или «сырные» реакции, связанные с несовместимостью с некоторыми пищевыми продуктами, содержащими тирамин (копчёности, сыр, кофе, шоколад, дрожжи, бобовые, красное вино, пиво и т.д.), а также препаратами с адрено- и симпатомиметическими свойствами (адреналин, мезатон, фентоламин, эфедрин, фенамин, изадрин, резерпин, нафтизин, лобелин, цититон, бемегрид и др.). При совместном назначении этих веществ с ингибиторами МАО возможны развитие гипертонического криза, острое повышение внутриглазного давления, сердечная аритмия, стенокардия, церебральнососудистые нарушения (см. главу 5 «Взаимодействие лекарственных средств»).
Лёгкие «сырные» реакции быстро купируются назначением БМКК нифедипина. В более тяжёлых случаях необходимо применение фентоламина (5 мг в/м или в/в) и других α-адреноблокаторов (тропафен) или ганглиоблокирующих средств (пентамин).
Кроме «сырных» реакций, ингибиторы МАО могут вызывать ортостатическую гипотензию, повышение массы тела, бессонницу, нарушение половой сферы, сухость во рту, запор, задержку мочеиспускания, тошноту, нарушения двигательной координации, отёки; реже - миоклонические подёргивания, потливость, ощущение жара или холода, акатизию, нейропатию, связанную с дефицитом витамина В6.
В отличие от трициклических антидепрессантов, которые достаточно часто (особенно при пероральном введении) вызывают некоторую заторможенность, сонливость, слабость, вялость, чувство усталости, разбитости в течение дня, применение ингибиторов МАО, напротив, обычно сопровождается психомоторным возбуждением, раздражительностью, неуступчивостью, усилением бессонницы и тревоги. При биполярном течении аффективного психоза ингибиторы МАО нередко приводят к развитию инверсии фазы.
Многие из атипичных антидепрессантов и особенно селективные ингибиторы обратного захвата серотонина не имеют перечисленных в таблице церебральных, сердечно-сосудистых или висцеро-вегетативных токсических реакций и лишены холиноблокирующих побочных явлений, которые зависят от воздействия на м-холинорецепторы. Поэтому, в целом, их переносимость значительно выше, с чем связано их более широкое распространение в амбулаторной, гериатрической и соматической практике, а также при проведении длительной профилактической терапии.
Вместе с тем введение в широкую практику целого ряда антидепрессантов, селективно блокирующих обратный захват серотонина (флуоксетин, флувоксамин, циталопрам, сертралин, пароксетин), вызвало появление нового круга побочных явлений, связанных с гиперстимуляцией центральной и периферической серотонинергических систем.
К ним относятся прежде всего желудочно-кишечные расстройства (тошнота, жидкий стул), связанные с усилением выброса серотонина в кишечной стенке. Реже встречаются снижение аппетита (анорексия), нарушения половой сферы (в основном, задержка эякуляции у мужчин и аноргазмия у женщин), тремор и повышенное потоотделение. Сухость во рту и запоры чаще наблюдаются при применении пароксетина, диспептические расстройства (тошнота) - при приёме флувоксамина, а психомоторная активация - при применении флуоксетина. Все серотонинергические препараты способны вызывать лёгкую экстрапирамидную симптоматику (тремор), которая меньше выражена у сертралина в связи с его некоторой дофаминстимулирующей активностью.
Наиболее серьёзным осложнением терапии серотонинергическими антидепрессантами является так называемый серотониновый синдром, который в редких случаях может принимать злокачественное течение и приводить к смертельному исходу.
Начальные проявления синдрома затрагивают, главным образом, органы ЖКТ и ЦНС. Первично появляются бурление, колики в жи-
воте, метеоризм, жидкий стул, тошнота, реже рвота и другие диспептические жалобы. При сочетанном применении с нейролептиками эти признаки могут маскироваться противорвотной активностью последних, неврологические симптомы включают тремор, дизартрию, неусидчивость, гиперрефлексию, мышечный гипертонус и миоклонические подергивания, которые обычно начинаются в ступнях и распространяются по всему телу. Наличие миоклонуса позволяет проводить раннюю дифференциальную диагностику со злокачественным нейролептическим синдромом в случаях проведения комбинированной терапии. Могут наблюдаться атаксические расстройства, нарушения координирующих проб. Хотя серотонинергические антидепрессанты практически не оказывают влияния на сердечно-сосудистую систему и даже способны замедлять сердечный ритм, при развитии серотонинового синдрома часто наблюдаются тахикардия и повышение АД. При утяжелении состояния у многих больных развивается маниакальноподобное состояние (не путать с возможной инверсией фазы) со скачкой идей, ускоренной смазанной речью, нарушением сна, гиперактивностью, а иногда - спутанностью и симптомами дезориентировки. Финальная стадия состояния очень похожа на картину злокачественного нейролептического синдрома: резко повышается температура тела, появляются профузный пот, маскообразность, сальность лица. Смерть наступает от острых сердечно-сосудистых нарушений.
Такое злокачественное течение наблюдается крайне редко, однако характерные гастроэнтерологические и неврологические расстройства достаточно часто встречаются при сочетании серотонинергических антидепрессантов и даже кломипрамина с ингибиторами МАО (по некоторым данным, почти у половины больных), а также с L-триптофа- ном, мексамином и фенфлурамином, т.е. средствами потенцирующими серотонинергические процессы. Соли лития также могут усиливать серотонинергические эффекты антидепрессантов.
Основная симптоматика «серотонинового» синдрома обратима и быстро исчезает после снижения дозы или отмены антидепрессантов. В случае применения флуоксетина возможно более затяжное (несколько дней) течение, так как препарат и его активный метаболит крайне медленно выводятся из организма. В более тяжёлых случаях помогает назначение антисеротонинового препарата ципрогептадина (перитол) в дозе 16-32 мг/сут, β-адреноблокатора пропранолола , обладающего свойствами антагониста 5-ТН1-серотониновых рецепторов, а также дезинтоксикационная терапия и другие мероприятия, направленные на поддержание гомеостаза и проводимые при купировании злокачественного нейролептического синдрома.
При выборе антидепрессанта с учетом сомато-неврологического состояния больного необходимо правильно оценивать сравнительный риск возникновения наиболее встречающихся побочных явлений.
Холиноблокирующие побочные эффекты чаще всего наблюдаются при применении классических трициклических антидепрессантов (амитриптилина, нортриптилина), реже их вызывают дезипрамин, ещё реже - пароксетин, мапротилин, миансерин, тразодон и практически не вызывают бупропион, сертралин, флуоксетин, флувоксамин и циталопрам.
Среди сердечно-сосудистых побочных эффектов антидепрессантов особое внимание следует уделить нарушению сердечной проводимости (аритмия, депрессия зубца Т и т.д.). Риск их развития убывает в следующем ряду препаратов: амитриптилин, кломипрамин, доксепин, тразодон, мапротилин, серотонинергические (флуоксетин, циталопрам, флувоксамин и т.д.) и другие атипичные антидепрессанты (миансерин, бупропион, моклобемид и т.д.).
У пожилых больных в целях профилактики травматических последствий ортостатической гипотензии необходимо обращать внимание на выбор антидепрессантов с минимальными гипотензивными свойствами, таких, как нортриптилин, доксепин, вилоксазин, миансерин, пиразидол, дезипрамин, бупропион, флуоксетин, сертралин, пароксетин и других селективных ингибиторов обратного нейронального захвата серотонина.
Другой заботой врача является способность некоторых антидепрессантов понижать порог судорожной активности. Риск развития пароксизмальных явлений убывает в следующем ряду препаратов: мапротилин, бупропион, тримипрамин, имипрамин, кломипрамин, флувоксамин, миансерин, дезипрамин, ингибиторы МАО, серотонинергические антидепрессанты и другие препараты нового поколения. Амитриптилин, вилоксазин и доксепин, по некоторым данным, обладают собственным противосудорожным эффектом, хотя в экспериментальных условиях также снижают порог судорожной активности.
Основными противопоказаниями к применению антидепрессантов являются сердечная, почечная и печёночная недостаточность, а также повышенная чувствительность к препаратам сходной химической структуры. Препараты трициклической структуры и ингибиторы МАО, вследствие выраженных холиноблокирующих свойств, противопоказаны при закрытоугольной глаукоме и гипертрофии предстательной железы. Общие противопоказания также - острые заболевания печени, почек, кроветворных органов, нарушения мозгового кровообращения, декомпенсированные пороки сердца, сахарный диабет, тиреотокси-
коз, судорожные припадки и некоторые другие тяжёлые соматические заболевания, а также I триместр беременности и период лактации. Частные противопоказания для отдельных групп антидепрессантов детально изложены выше.
Взаимодействие
Фармакодинамическое взаимодействие связано в основном с действием на различные виды центральных и периферических рецепторов. Повышенную осторожность нужно соблюдать при сочетании трициклических антидепрессантов с другими лекарственными средствами. Многие препараты способны менять фармакокинетику антидепрессантов, увеличивая или уменьшая содержание их свободной фракции в плазме крови.
Трициклические антидепрессанты могут усиливать действие опиатных анальгетиков, антиаритмических средств и непрямых антикоагулянтов. Совместное применение их с антигистаминными и антипаркинсоническими препаратами может вызвать значительный седативный эффект и усилить холиноблокирующие побочные эффекты (задержка мочи, спутанность и т.д.).
Гипотензивный эффект препаратов гуанетидинового ряда (октадин, изобарин) снижается при применении норадренергических антидепрессантов. Тримипрамин, доксепин, дезипрамин, имипрамин, амитриптилин и миансерин снижают гипотензивное действие клонидина (клофелин), метилдофа (допегит), гуанобенза (витензин) и гуанфацина (тенекс). Амитриптилин, доксепин, тримипрамин, тразодон могут значительно потенцировать антигипертензивное действие α-1-адреноблокаторов (празозина и теразозина) и вызвать резкое снижение АД.
Прессорные эффекты адреномиметиков усиливаются антидепрессантами, поэтому следует избегать их совместного внутривенного применения. Прессорные эффекты симпатомиметиков (эфедрин, тирамин и др.), напротив, блокируются антидепрессантами трициклического и тетрациклического строения. При сочетании доксепина, нортриптилина и других антидепрессантов с препаратами сульфонилмочевины (бутамид, букарбан) возможно усиление их гипогликемических эффектов. Антидепрессанты, обладающие значительным холиноблокирующим действием, препятствуют всасыванию леводопа и фенилбутазона.
Одновременное применение ингибиторов МАО с нейролептиками может привести к усилению экстрапирамидных расстройств, развитию судорожного синдрома и делирия. Сочетание с дофаминостимулято-
рами (например, леводопа) может вызвать развитие психотической (галлюцинаторно-бредовой) симптоматики. Ингибиторы МАО усиливают гипотензивное действие клонидина (клофелин), октадина и метилдофа. Кроме того, ингибиторы МАО несовместимы со средствами для ингаляционного наркоза (например, фторотаном), барбитуратами, наркотическими анальгетиками, алкоголем, так как усиливается их токсическое действие. Ингибиторы МАО потенцируют гипогликемические эффекты инсулина и сульфаниламидных препаратов. Выраженная гипертермия с летальным исходом может развиться при сочетании ингибиторов МАО с меперидином и декстрометорфаном. При сочетании с буспироном были замечены случаи повышения артериального давления. Следует избегать совместного применения ингибиторов МАО с препаратами женьшеня из-за развития явлений гиперстимуляции нервной системы.
При сочетании ингибиторов МАО с трициклическими антидепрессантами могут возникать тяжёлые вегетативные расстройства, резкая гипертензия, судороги, гиперпирексия, нейротоксические реакции, описаны случаи летального исхода, поэтому их нужно назначать не ранее, чем через две недели после отмены ингибиторов МАО, когда восстанавливается активность фермента. При лечении гипертонических кризов, вызванных подобной лекарственной или пищевой (тираминовой) несовместимостью, используют α-адреноблокаторы (1 мл 0,5% раствора фентоламина внутримышечно или внутривенно; 2-3 мл 1% раствора пирроксана внутримышечно; 1-2% раствора тропафена подкожно или внутримышечно) или ганглиоблокирующие средства (0,5-1 мл 1% раствора димеколина внутримышечно; 0,5-1 мл 5% раствора пентамина внутримышечно).
Следует отметить, что при лечении ниаламидом, в сравнении с другими препаратами, реакции несовместимости наблюдаются более редко. При применении современных обратимых ингибиторов МАО (моклобемид, пиразидол, брофаромин, толоксатон) эти побочные эффекты практически не встречаются. Циметидин (тагамет) способен увеличивать период полувыведения моклобемида и других обратимых ингибиторов МАО. При применении эфедрина в высоких дозах моклобемид может усиливать его прессорные эффекты.
Как трициклические, так и серотонинергические антидепрессанты, а также некоторые другие препараты метаболизируются системой цитохрома CYP. Поэтому их совместное применение может привести к развитию серьезных нейротоксических явлений. Наиболее часто они наблюдались при сочетании флуоксетина и пароксетина с нортриптилином, имипрамином и особенно дезипрамином, в меньшей степени - с тразодоном и бупропионом. Существенно меньшей активнос-
тью в этом отношении обладает циталопрам, что, главным образом, связано с его деметилированным метаболитом. Флуоксетин может повышать содержание в плазме крови нейролептиков, барбитуратов и триазолобензодиазепинов (алпразолам), усиливая тем самым их седативные и побочные эффекты. В то же время препарат уменьшает анксиолитическое действие буспирона. Флуоксетин увеличивает уровень в крови карбамазепина и вальпроата, что может вызвать токсические реакции. Отдельные взаимодействия (головные боли, отёки, реакции) отмечены при применении флуоксетина с блокаторами кальциевых каналов (верапамил, нифедипин). Важно учитывать, что угнетающая активность антидепрессантов на цитохром CYP резко возрастает при увеличении дозы препаратов.
28.3.2. Психостимуляторы (психотоники)
Психостимуляторы - средства психоаналептического действия, вызывающие психомоторную активацию как больных, так и здоровых лиц, оказывая преимущественное влияние на кору головного мозга.
К психостимуляторам относят амфетамины (фенамин), метилфен идат,синднонимины (сиднокарб, сиднофен), кофеин, пемолин, меридил (центедрин), пипрадол и некоторые другие препараты.
Фармакодинамика и механизм действия
Психостимуляторы временно повышают работоспособность, концентрацию внимания и поддерживают состояние бодрствования, снижают аппетит и массу тела. Некоторые из них могут оказывать эйфоризирующий эффект и приводить к развитию лекарственной зависимости. В медицинской практике используются как право-, так и левовращающие изомеры амфетамина. Декстроамфетамин и метамфетамин являются в 3-4 раза более сильными психостимуляторами, чем их левовращающий изомер, иногда их используют для стимуляции сердечно-сосудистой системы.
Психостимуляторы усиливают выброс всех моноаминовых нейромедиаторов (преимущественно норадреналина и дофамина) в синаптическую щель (в том числе за счёт ингибирования активности МАО) и блокируют их обратный захват. Действие препаратов обнаруживается как на центральном, так и на периферическом уровнях. В ЦНС амфетамины стимулируют корковые и стволовые структуры, а также таламус и ядра среднего мозга. Стимуляция ретикулярной формации в этих областях ответственна за поддержание состояния бодрствования, стимуляция подкорковых структур вызывает улучшение на-
строения (чувство удовольствия) и снижение аппетита, а активация корковых нейронов приводит к повышению психомоторных реакций и улучшению деятельности когнитивной сферы. Амфетамины оказывают истощающий эффект на ЦНС и вслед за стимулирующим эффектом без увеличения дозы по механизму ауторегуляции (активация пресинаптических дофаминовых рецепторов) наступает торможение и развитие депрессии и усталости, с чем связывают быстрое формирование зависимости. Амфетамин в малых дозах может изначально оказывать парадоксально затормаживающее действие. Именно этот эффект используется для коррекции гиперкинетических расстройств у детей и подростков. Малые дозы препарата, по-видимому, стимулируют незрелые структуры ретикулярной формации, что позволяет уменьшить психомоторную активность и улучшить концентрацию внимания.
Клинические эффекты стимуляции периферической нервной системы (α- и β-адренорецепторов) проявляются в виде тахикардии, тахиаритмии и гипертензии. У некоторых больных амфетамин может парадоксально вызывать брадикардию вследствие активации барорецепторов при повышении артериального давления.
Амфетамин вызывает расширение зрачков и уменьшает кровенаполнение (отёк) слизистых оболочек, т.е. оказывают эффекты симпатомиметиков (например, эфедрина). Метилфенидат (риталин) близок по химической структуре и механизму действия к амфетамину, однако он слабее стимулирует корковую активность и психомоторную сферу и меньше вызывает привыкание. Психостимулятор пемолин, применяемый в основном для лечения гиперактивности детей, в отличие от амфетамина обладает незначительной симпатомиметической активностью. Пемолин увеличивает синтез и накопление дофамина в ЦНС. Его эффект развивается постепенно, через 3-4 нед лечения. Центральный стимулирующий эффект препарата слабее, чем у амфетамина и метилфенидата и он реже вызывает привыкание и периферические побочные эффекты.
Фармакологический эффект оригинальных отечественных психостимуляторов из группы сиднониминов (сиднокарб и сиднофен) связан с активацией преимущественно адренорецепторов, а также кратковременным ингибированием МАО. Препараты практически не вызывают характерных для амфетамина периферических эффектов. У сиднофена выявляется отчётливый тимоаналептический компонент, по-видимому, связанный с более значительной блокадой МАО. Поэтому препарат применяется также для лечения астено-депрессивных и депрессивно-ипохондрических состояний. Однако к нему применины все
противопоказания и лекарственные взаимодействия, характерные для ингибиторов МАО.
Психостимулирующими свойствами обладают многие другие лекарственные средства и вещества, рекламируемые как анорексигенные средства и применяемые для снижения массы тела (фентермин, фенметразин, диэтилпропион, мазиндол, фенфлурамин и др.) или являющиеся составной частью пищевых продуктов или многокомпонентных таблеток от головной боли и простуды, находящихся в безрецептурном отпуске. К таким средствам относятся, например, фенилпропаноламин и кофеин.
Фенилпропаноламин по химическому строению близок к амфетамину, но является симпатомиметиком центрального и периферического действия. Препарат вызывает артериальную гипертензию, нередко сопровождающуюся рефлекторной брадикардией.
Кофеин - самый распространённый психостимулятор в мире, ежедневно потребляемый большинством населения в виде кофе, чая или безалкогольных напитков типа «Кола». Кофеин усиливает и регулирует процессы возбуждения в коре головного мозга, в результате чего повышается умственная работоспособность, облегчается восприятие, ускоряются двигательные реакции, увеличивается двигательная активность, уменьшается утомление и сонливость. Он также возбуждает дыхательный и сосудодвигательный центры, повышает возбудимость спинного мозга за счёт чего увеличивается и работоспособность скелетных мышц. При этом увеличивается сила сокращений и уменьшается мышечная усталость. На фоне понижения функций центров продолговатого мозга при коллаптоидных и шоковых состояниях, отравлении веществами, угнетающими ЦНС, кофеин в терапевтических дозах, как правило, вызывают повышение артериального давления, углубление и учащение дыхания. Многие эффекты кофеина обусловлены подавлением активности фосфодиэстеразы и замедлением разрушения цАМФ. Кроме того, препарат является антагонистом аденозиновых рецепторов. Кофеин оказывает бронхорасширяющее, положительное ино-, хроно-, дромо- и батмотропное, а также сосудосуживающее действие. Кофеин также вызывает увеличение системного сосудистого сопротивления, что ведет к повышению артериального давления. Эти эффекты связывают с блокадой вазодилатации, вызываемой аденозином, и с активацией симпатической нервной системы. У здоровых лиц под влиянием кофеина в малых дозах замедляется частота сокращений сердца вследствие возбуждения центра блуждающего нерва, в больших дозах возникает тахикардия в результате преобладания периферического действия. Под влиянием кофеина несколько возрастает диурез за счёт уменьшения канальцевой реабсорбции натрия и расширения
приводящих артериол. Кофеин стимулирует секрецию желудочного сока (выработку пепсина и соляной кислоты париетальными клетками) и увеличивает плазменный уровень жирных кислот в плазме. Кофеин также угнетает сократимость матки, увеличивает концентрацию катехоламинов в плазме крови и головном мозге, вызывает кратковременное увеличение уровня глюкозы в плазме за счёт стимулирования гликогенолиза и липолиза.
Фармакокинетика
Амфетамин быстро всасываются в желудочно-кишечном тракте и равномерно распределяется в различных тканях организма, легко проникая через гематоэнцефалический барьер вследствие высокой липофильности. Пик концентрации в крови и основные клинические эффекты наступают через 30-60 мин после приёма препарата. Амфетамин не метаболизируются в печени и выводится с мочой в неизменном виде. Период полувыведения зависит от рН мочи: при рН менее 5,6 он составляет около 7 ч, а при увеличении щелочности (более 7,1-8,0) он может увеличиваться до 30 ч. Повышение рН на 1,0 увеличивает период полувыведения приблизительно на 7 ч, что связано с повышенным обратным всасыванием препарата в кровь. Поэтому употребление пищевых продуктов и лекарственных средств, приводящих к ощелачиванию мочи, в период приёма препарата следует избегать. В среднем период полувыведения амфетамина составляет около 12 ч.
Метилфенидат хорошо всасывается в желудочно-кишечном тракте. Пик его концентраци в крови достигается через 1-3 ч после приёма препарата. Период полувыведения составляет около 1-3 ч, однако клинические эффекты могут наблюдаться на протяжении 6 ч. Метилфенидат активно метаболируется в печени и метаболиты выводятся с мочой.
Пемолин хорошо всасывается в желудочно-кишечном тракге, пик концентрации в крови достигается через 2-4 ч после приёма. Период полувыведения препарата составляет 12 ч. Приблизительно половина дозы выводится с мочой в неизменном виде, остальная часть подвергается метаболизму в печени.
Кофеин быстро всасывается из желудочно-кишечного тракта, при повышении рН абсорбция препарата в желудке возрастает. Пик концентрации в крови наступает примерно через 1 ч после приёма. Учитывая высокую липофильность, кофеин легко проникает через гематоэнцефалический барьер и равномерно распределяется в тканях организма. Только 15-30% препарата связывается с белками крови. Большая часть кофеина метаболизируется в печени путём окисления и деметилирования и выводится с мочой (около 1% - в неизменном виде). Период полувыведения индивидуально широко варьирует и со-
ставляет от 2,5 до 12 ч (в среднем 3-7 ч). У новорождённых период полувыведения составляет 65-130 ч. Кофеин легко проникает через плаценту и достигает в крови и тканях плода концентраций, близких к таковым в организме матери. Приём большого количества продуктов, содержащих кофеин, может увеличивать риск возникновения спонтанных абортов и задержки внутриутробного развития плода, а также приводить к появлению аритмии у плода. Поэтому беременным не рекомендуется принимать более 300 мг кофеина (3 чашки кофе) в сутки. В грудное молоко кофеин проникает в очень малых количествах. Хотя концентрация кофеина в грудном молоке составляет лишь 1% его концентрации в плазме крови матери, у ребёнка кофеин может накапливаться.
Показания
У здоровых лиц психостимуляторы применяются для преодоления усталости, сонливости и для временного повышения физической и умственной работоспособности. При этом психостимуляторы лишь мобилизуют резервы организма и не устраняют потребности в нормальном отдыхе и восстановлении сил.
Сиднонимины показаны при всех вариантах астенических состояний, протекающих с заторможенностью, сонливостью, вялостью, апатией, снижением работоспособности и при нарколепсии.
Противопоказания:
• состояние ажитации (психомоторного возбуждения), тревога и тревожные расстройства;
• выраженный атеросклероз и сердечно-сосудистые заболевания;
• злоупотребление лекарствами и лекарственная зависимость в анамнезе, алкоголизм;
• глаукома;
• артериальная гипертензия;
• гипертиреоз;
• психозы;
• эпилепсия и другие судорожные расстройства;
• нарушение функций печени и почек;
• синдром Жилль де ла Туретта и другие гиперкинетические расстройства, в том числе тики;
• перекрёстная повышенная чувствительность к амфетамину и другим адрено- и симпатомиметикам (например, эфедрину, адреналину, изадрину, мезатону, псевдоэфедрину и др.), для кофеина - повышенная чувствительность к другим ксантинам (эуфиллин*, теофиллин и др.).
Режим дозирования и применение
Сиднокарб применяют преимущественно при астенических состояниях различного генеза в дозе 5-60 мг/сут, реже при операторской (ночной) работе для поддержания состояния бодрствования.
При правильном подборе дозы (от 5-10 мг до 60 мг/сут) сиднокарб и сиднофен уменьшают ощущение утомления, вызывают чувство бодрости, прилива сил, энергии, повышают работоспособность, снижают потребность во сне. При приёме сиднокарба эффект развивается в течение нескольких часов и по сравнению с амфетамином отличается большей длительностью.
При лечении нарколепсии у взрослых суточная доза может достигать 60 мг/сут. Метилфенидат назначают по тем же правилам в дозе 5-60 мг/сут, распределённой на 2-3 приёма за 30-45 мин до еды. Пемолин (цилерт) применяют в дозах от 37,5 до 112,5 мг/сут. Эффект психостимуляторов при синдроме детской гиперактивности развивается постепенно, обычно через 3-4 нед терапии.
Кофеин обычно используют как стимулятор ЦНС с целью поддержания умственной работоспособности и состояния бодрствования при усталости и сонливости. В качестве вспомогательного средства кофеин применяют при апноэ у новорождённых, для усиления эффекта электросудорожной терапии, для лечения головных болей сосудистого характера (в сочетании с эрготамином), при аналгезирующей терапии в сочетании с ацетоминофеном (парацетамолом) или ацетилсалициловой кислотой. У взрослых и подростков средняя разовая доза кофеина составляет 100-250 мг, при необходимости ее можно повторять через 3-4 ч до 1 г/сут. Детям до 12 лет кофеин применять не рекомендуют.
При лечении психостимуляторами врач должен периодически оценивать толерантность к препарату и другие признаки, указывающие на развитие лекарственной зависимости, а также измерять артериальное давление и следить за сердечным ритмом. Резкое прекращение приёма пихостимуляторов может привести к развитию синдрома отмены.
Побочные эффекты
При длительном применении психостимуляторы могут приводить к развитию лекарственной зависимости. К соматическим побочным реакциям относится развитие аритмии, раздражительности, ажитации, бессонницы, нарушения аккомодации зрения, запоры, потеря аппетита, тошнота, спазмы и боль в желудке, рвота, сухость или неприятный привкус во рту, повышенное потоотделение, аллергичес-
кие реакции (кожная сыпь или крапивница), боль в грудной клетке, тики, синдром Жилль де ла Туретта (двигательные гиперкинезы), гипертермия.
При длительном применении или использовании в высоких дозах могут развиваться миокардиопатия, повышение артериального давления, психотические реакции или токсичские психозы, снижение полового влечения и потенции, снижение массы тела, спутанность сознания или делирий, повышенная тактильная или болевая чувствительность, тремор, мышечные подёргивания, звон в ушах, мерцание света перед глазами, судорожный синдром.
Взаимодействие
При совместном применении с трициклическими антидепрессантами возможно усиление симпатомиметических эффектов вследствие усиления высвобождения норадреналина, что может приводить к развитию аритмий, тахикардии, выраженной гипертензии и гипертермии. Ингибиторы МАО, включая фуразолидон, прокарбазин и селегилин, могут пролонгировать и усиливать стимуляцию сердечной деятельности и прессорные эффекты амфетамина (аритмия, головная боль, рвота, гипертонические и гиперпирексические кризы) вследствие выброса катехоламинов, накопившихся в нейрональных депо. Поэтому амфетамин не следует назначать раньше, чем через 14 дней после отмены ингибиторов МАО.
Применение симпатомиметиков и леводопы в сочетании с амфетамином может привести к перевозбуждению ЦНС с развитием выраженного психомоторного возбуждения, бессонницы, а в некоторых случаях и судорожного синдрома. Прессорные и другие сердечно-сосудистые эффекты симпатомиметиков также усиливаются. Психостимуляторы ослабляют антипсихотическую активность нейролептиков. С другой стороны, нейролептики, особенно препараты с выраженными адреноблокирующими свойствами, препятствуют действию психостимуляторов.
При одновременном применении амфетамина с β-адреноблокаторами (кроме лабеталола) возможно усиление риска развития гипертензии и чрезмерной брадикардии вплоть до блокады проводимости. Гликозиды наперстянки также могут увеличивать риск развития сердечных аритмий. Анальгезирующие эффекты меперидина могут усиливаться амфетамином, однако их совместное применение не рекомендуют, так как это может приводить к гипотензии, выраженному угнетению дыхания, судорогам и гипертермии.
Эффекты гормонов щитовидной железы и амфетамина могут усиливаться, в частности, увеличивается риск развития коронарной не-
достаточности. Передозировка пропоксифена может усиливать центральное стимулирующее действие амфетамина, возможно развитие судорожного синдрома со смертельным исходом. Амфетамин может снижать гипотензивный эффект некоторых гипотензивных ЛС, в том числе диуретиков. Средства для ингаляционного наркоза (фторотан и, в меньшей степени, энфлюран и др.) могут повышать чувствительность миокарда к действию симпатомиметических средств, в том числе амфетамина, увеличивая тем самым риск развития тяжёлых желудочковых аритмий. При одновременном применении с амфетамином возможно замедление всасывания в кишечнике некоторых противосудорожных ЛС (этосукцимида, фенобарбитала и фенитоина) . Средства, повышающие кислотность желудочного сока (аскорбиновая кислота, фруктовые соки, глютаминовая кислота и др.), а также средства, повышающие кислотность мочи (хлорид аммония, фосфокислый натрий и др.), могут снижать эффект амфетамина вследствие снижения их всасывания и ускорения выделения. Средства, подщелачивающие мочу (антацидные препараты, содержащие кальций и магний, ингибиторы карбонангидразы, цитраты, углекислый натрий и др.), усиливают действие амфетамина вследствие замедления его выведения из организма.
Благодаря вторичным антихолинергическим эффектам амфетамина и метилфенидата действие холиноблокирующих средств может усиливаться. Метилфенидат повышает концентрацию в плазме крови фенитоина, фенобарбитала и примидона, непрямых антикоагулянтов (производных кумарина и индандиона) и фенилбутадона - ослабляться. Совместное применение кофеина с другими ксантинами (эуфил- лин*, теофиллин и др.), а также адренергическими бронхорасширяющими средствами может увеличивать риск развития аддитивных фармакодинамических и токсических эффектов. Циметидин, макролиды (эритромицин), ципрофлоксацин, эноксацин и пероральные контрацептивы, а также дисульфирам (тетурам) снижают метаболизм кофеина и увеличивают его концентрацию в крови. Фенитоин, примидон и барбитураты увеличивают клиренс кофеина. Совместное назначение кофеина с β-адреноблокаторами может приводить к взаимному подавлению терапевтических эффектов. Кофеин усиливает выведение лития из организма и может снижать его концентрацию в плазме крови, а также препятствует всасыванию кальция в желудочно-кишечном тракте. Мексилетин, напротив, может снижать выведение кофеина на 50% и усиливать его стимулирующие эффекты.
28.3.3. Нейрометаболические стимуляторы (ноотропы, церебропротекторы)
Это средства психоаналептического действия, способные активизировать нейрометаболические процессы в головном мозге и оказывать антигипоксический эффект.
В психиатрической практике к церебропротекторам или ноотропам относят пирацетам, аминалон, пиритинол, пантогам, пикамилон, фе- нибут*, ацефен, бемитил и церебролизин.
Ноотропные средства усиливают энергетические процессы в тканях головного мозга. Циклическое производное ГАМК - пирацетам относят к нейрометаболическим стимуляторам коркового действия, активирующим окислительно-восстановительные процессы и облегчающим синаптическую проводимость в корковых структурах головного мозга и межполушарную нейропередачу. Препарат восстанавливает и стабилизирует церебральные функции, а также ослабляет вестибулярные расстройства.
Фармакокинетика
Пирацетам быстро всасывается после приёма внутрь, пик концентрации его в плазме крови достигает через 40 мин. Биодоступность составляет 100%. Длительность приёма на постоянство абсорбции не влияет. Препарат распределяется гомогенно в печени, почках, селезён- ке, лёгких и мозговой ткани, легко проникая через гематоэнцефалический барьер. Пирацетам не связывается с белками плазмы, не метаболизируется, в основном, выводится почками в неизменённом виде и только 1-2% с жёлчью. Период полувыведения составляет около 4 ч и не зависит от дозы или длительности его применения. Пирацетам быстро проникает через плацентарный барьер и в молоко матери.
Оксибутират натрия, легко проникая в ЦНС, оказывает не только седативное, но и центральное миорелаксирующее и противошоковое действие, а в больших дозах вызывает сон и наркоз, хотя аналгезирующий эффект у самого препарата выражен мало. Он также оказывает антигипоксическое действие и повышает устойчивость организма, в том числе тканей мозга, сердца, а также сетчатки глаза к кислородной недостаточности.
Показания
Острая или резидуальная церебрально-органическая недостаточность, когнитивные расстройства ЦНС, астенические состояния различного происхождения, снижение общей активности, аспонтанность, интеллектуально-мнестические нарушения при сосудистых, травмати-
ческих, инфекционных, токсических, дегенеративных и других поражениях головного мозга.
Препараты с отчётливыми стимулирующими свойствами (ацефен, пиридитол, бемитил, пирацетам) нашли применение при астенодепрессивных и астеноапатических состояниях и даже при некоторых депрессиях органического происхождения. Сбалансированный спектр действия пантогама обуславливает и более широкие показания к его применению, включая неврозоподобные и диссомнические расстройства. В неврологической практике показана эффективность ноотропов при мигренях, невралгиях и других болевых синдромах, в офтальмологии - у больных с первичной открытоугольной глаукомой (оксибутират натрия).
Противопоказания. Индивидуальная непереносимость
Режим дозирования и применение. В психиатрической практике церебропротекторы обычно назначаются в виде курса лечения (1-3 мес) в следующих дозах (г/сут): аминалон - 1,5-3,0; ацефен - 0,3- 1,0; пикамилон - 0,1-0,2; пиридитол - 0,3-0,5; бемитил -0,5-1,5; пантогам - 1,5-3,0; фенибут* - 0,5-1,5; пирацетам - 2,4-8,0.
При острых органических психозах и коматозных состояниях до 20-30 г/сут, включая парентеральное и особенно внутривенное капельное введение.
При острой патологии (инсульты, коматозные состояния) фармакологический эффект пирацетама проявляется прежде всего в пробуждающем воздействии. На некоторое время может восстанавливаться люцидность сознания, исчезает неврологическая симптоматика. К сожалению, в большинстве случаев эффект носит транзиторный и истощающий характер. При хронической патологии (резидуальная органическая недостаточность ЦНС, психоорганический синдром) появляются различные другие церебропротекторные свойства - редуцируются астенические, эпилептиформные расстройства, уменьшаются нарушения памяти и др. Ноотропное действие препаратов обнаруживается и у здоровых лиц, прежде всего речь идет об усилении активности и повышении эффективности высших интегративных (корковых) функций мозга (увеличение умственной работоспособности).
Необходимо учитывать, что ноотропное действие не органичивается только повышением интеллектуально-мнестических возможностей, оно также связано с психостимулирующим и антиастеническим действиями. Адаптогенный эффект частично реализуется посредством вегето-стабилизирующего, антипаркинсонического и транквилизирующего действия. Многие из перечисленных эффектов присущи другим классам психотропных средств и соответствуют самостоятельным
терапевтическим мишеням, но лишь их совокупность создает те особые свойства, которые позволяют выделить нейрометаболические стимуляторы в отдельную группу.
Большинство препаратов в той или иной степени обладают психостимулирующими свойствами. В наибольшей мере они выражены у ацефена, пиридитола и бемитила. Лишь фенибут*, пикамилон, пантогам и мексидол* имеют отчётливое седативное действие, что позволяет их назначать в вечернее время при органических нарушениях с гиперстеническими чертами, а также у возбудимых олигофренов. Пантогам и пикамилон обладают противосудорожной активностью и применяются у больных эпилепсией. Кроме того, эти препараты и фенибут* оказывают антипаркинсоническое и антидискинетическое действие, что особенно важно при лечении интолерантных к нейролептикам больных.
В последнее время ноотропные свойства были обнаружены у анксиолитика мебикара* и новых отечественных препаратов - димефосфана, мексидола*, семакса, фентропила, нооглютила и дипептидов пирролидинкарбоновых кислот.
Побочное действие
Нейрометаболические стимуляторы, как правило, хорошо переносятся и не имеют противопоказаний. В некоторых случаях (у пожилых лиц) при применении средств с психостимулирующей активностью (ацефен, пиридитол, бемитил, пирацетам) могут развиваться транзиторные явления гиперстимуляции в виде тревожности, раздражительности и нарушений сна. При быстром в/в введении оксибутирата натрия возможно развитие двигательного возбуждения, судорожного синдрома.