Клиническая фармакология: учебник / Н.В. Кузнецова. - 2-е изд., перераб. и доп. - 2013. - 272 с.
|
|
|
|
РАЗДЕЛ 1 ОБЩИЕ ВОПРОСЫ КЛИНИЧЕСКОЙ ФАРМАКОЛОГИИ
1.1. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ КАК НАУКА, ЕЁ ЗАДАЧИ И ОСНОВНЫЕ ПОЛОЖЕНИЯ
Цель
После изучения темы студент должен иметь представление об основных этапах развития клинической фармакологии (КФ) и знать:
• понятие «клиническая фармакология»;
• её предмет и задачи;
• значение КФ для практической деятельности медицинской сестры;
• понятия «лекарственное средство» и «лекарственная форма».
Основные этапы развития клинической фармакологии
В качестве самостоятельной науки КФ сфор- мировалась во второй половине XX в.
С 30-х годов прошлого столетия начинается развитие научных основ КФ. Это совпадает с фундаментальными открытиями и началом применения сульфаниламидов, блокаторов Н1-рецепторов, фосфорорганических соединений, гипотензивных средств (раувольфинp), фенитоина и других препаратов.
В развитие представлений об индивидуальной фармакотерапии (ФТ) внесли опре- делённый вклад многие выдающиеся оте- чественные и зарубежные учёные. Развитию лекарственной токсикологии как науки о фар-
макокинетике (ФК) и фармакодинамике (ФД) лекарственных средств (ЛС) и ядов способствовал А.П. Нелюбин (1785-1858).
В трудах Н.П. Кравкова (1865-1924) были заложены основы изучения действия новых лекарственных препаратов на моделях изолированных органов. Исследованию закономерностей влияния ЛС на живой организм в условиях искусственно вызванных патологических состояний была посвящена научная деятельность М.П. Николаева (1893-1949). Кроме того, он был организатором лекционного курса по КФ, который в 30-х годах ХХ в. был введён в программу обучения в медицинских вузах (рис. 1). Создателем фармакопрофилактического направления стал Н.В. Лазарев (1895-1974), посвятивший свои работы изучению адаптогенов - средств, повышающих работоспособность и выносливость организма.
В 40-х годах были открыты и созданы пенициллины, тетрациклины, стрептомицин, аминосалициловая кислота, ан- тибластомные средства, ганглиоблокаторы, миорелаксанты и глюкокортикоиды. В 50-х годах в клиническую практику ввели психотропные препараты (хлорпромазин, галоперидол, резерпин, имипрамин, диазепам), в буквальном смысле развязавшие руки психически больным пациентам. В эти годы были созданы новые методы и средства лечения сахарного диабета (СД), гипертонической, опухолевой и ряда ин- фекционных болезней, гормональных нарушений, бронхиальной астмы (БА), пре- параты для комбинированного обезболивания и наркоза.
Выделению КФ - науки о поведении ЛС в организме больного и здорового человека - в отдельную дисциплину пред-

Рис. 1.
шествовало накопление большого багажа знаний. Сначала это были сведения о разнообразных эффектах отдельных ЛС у больных с разным течением того или иного заболевания (ФД препаратов), полученные посредством детального клинического, клинико-функционального и лабораторного обследования больных до и в процессе лекарственной терапии. В период зарождения КФ знаниями о ФД препаратов владели врачи - специалисты разного профиля, но в основном - терапевты и педиатры. Одним из них был академик АМН СССР Б.Е. Вотчал. Существенный толчок к переоценке взглядов на роль ЛС в повседневной клинической практике, системе «врач-ди- агноз-лекарство-больной» дали «Очерки клинической фармакологии» Б.Е. Вотчала (1965). Эта уникальная книга, которую автор скромно оценил как «итоги многолетних клинических наблюдений за действием лекарств», предопределила необходимость формирования «фармакологического мышления у постели больного».
Большую известность приобрела научная школа фармакологов и фармакотерапевтов, созданная в России М.Д. Машковским, и справочник «Лекарственные средства», который к настоящему времени претерпел уже 14 изданий и пользуется заслуженным вниманием практических врачей уже более сорока лет. Многие полезные разработки в области фармакологии сделаны научны- ми школами, возглавляемыми В.В. Закусовым, П.В. Сергеевым, Д.А. Харкевичем, В.Г. Кукесом, Ю.Б. Белоусовым, В.А. Гуселем, Г. В. Ковалевым, В.К. Лепахиным и др.
В 60-70-е годы стали доступными полусинтетические пенициллины, цефалоспорины, рифампицин, новые наркотические и ненаркотические анальгетики (фентанил, опиоидные пептиды, диклофенак и др.), простагландины и ингибиторы их синтеза, иммунокорректоры и противовирусные средства.
В 70-е годы во всём мире были созданы кафедры, отделения и институты КФ, в том числе при Медицинском институте им. И.М. Сеченова - кафедра КФ (заведующий - профессор В.Г. Кукес).
В последние десятилетия прошлого столетия, ознаменовавшиеся прогрессом медицинской техники, внедрением в практику врача тонких биохимических, цитологических, микробиологических, электрофизиологических, иммунологических и других методов, произошло накопление громадного арсенала информации о поведении ЛС в организме больных, их ФК, взаимодействии, способах введения препаратов в организм больного, контроле эффективности и безопасности лекарственных препаратов и др.
Возникла необходимость в специалистах, аккумулирующих эту информацию, и произошло окончательное формирование новой дисциплины - КФ. Во всех передовых странах мира были организованы лаборатории и кафедры КФ; специалисты этого профиля вошли в штаты больниц.
В
В
В
В начале ХХI в. КФ стала важной основой рационального применения ЛС, а фармакокинетические исследования - важнейшим компонентом изучения лекарственных препаратов. Количественная оценка абсорбции, распределения, метаболизма и элиминации ЛС помогла разработать рекомендации по рациональным режимам дозирования и наилучшему использованию арсенала препаратов, имеющихся в распоряжении врача.
Следует учитывать, что для рациональной ФТ необходимо совмещать всевозможные сведения о собственно ЛС со знаниями индивидуальных особенностей больного и его реакций (положительных и отрицательных) на применяемый препарат.
Предмет и задачи клинической фармакологии
КФ - наука, занимающаяся изучением ЛС в применении к человеку (определение ВОЗ). Её цель - оптимизация лекарственной терапии, т.е. достижение максимальной эффективности и безопасности.
КФ состоит из двух основных частей: фармакологии и терапевтической оценки (определение клинической ценности ЛС и способа его оптимального применения).
• Фармакология:
- ФД - исследование изолированного и сочетанного (с другими препаратами) действия ЛС на организм молодого, пожилого, здорового и больного человека;
- ФК - исследование всасывания, распределения, метаболизма и экскреции ЛС (т.е. влияние здорового или больного организма на ЛС).
• Терапевтическая оценка ЛС:
- официальные (формальные) контролируемые терапевтические исследования;
- наблюдения за эффективностью и нежелательными эффектами ЛС.
Задачи КФ
• Организация и проведение клинических испытаний новых и старых ЛС.
• Разработка методов эффективной и безопасной ФТ.
• Организация информационно-консультативной работы в лечебно-профилактических учреждениях, аптеках и среди населения; обучение студентов, врачей и провизоров.
Актуальность изучения клинической фармакологии для практической деятельности медицинской сестры
Необходимость знания основ КФ медицинским персоналом обусловлена неуклонным увеличением количества новых ЛС, выпускаемых мировой фармацевтической промышленностью. Известно, что в настоящее время общее число препаратов в разных странах мира превышает более 20 тыс. наименований. Важно признание того, что выбор ЛС и его безопасное и эффективное применение зависит от информации, которую можно получить только при систематическом изучении препарата в клинических условиях. К сожалению, в настоящее время зачастую необоснованно и бесконтрольно назначают ЛС, что приводит к развитию нежелательных побочных эффектов и осложнений, снижающих эффективность лечения. Именно поэтому каждый медицинский работник должен владеть достаточными знаниями КФ.
Название лекарственного средства и лекарственная форма
ЛС - любое вещество, которое после введения в живой организм изменяет его функционирование (ВОЗ, 1969). Индивидуальное химическое вещество (активный ингредиент препарата) может содержать множество других субстанций, которые обеспечивают стабильность лекарственной формы (ЛФ), назначаемой больному. В нашей стране ЛС - препараты, разрешённые установленным порядком для применения (Фармакологическим и Фармакопейными комитетами). Термины «лекарственное средство» и «лекарство» обычно используют как синонимы.
Классификация и название лекарственных средств
Классификация ЛС основана на следующих принципах.
• Лечебное применение: антигипертензивные, антиангинальные, антиаритмические и др.
• Механизм или место действия:
- молекулярный - блокаторы рецепторов (α- и β-адреноблокаторы и др.), ингибиторы ферментов (например, фермента, конвертирующего ангиотензин) и др.;
- внутриорганный - петлевые диуретики (действуют в почке на уровне петли Генле) и др.;
- физиологическая система - вазодилататоры, гиполипидемические, антикоагулянты и др.
• Молекулярная структура: барбитураты, гликозиды и др.
Названия (номенклатура) ЛС могут быть трёх видов.
• Полное химическое название: обычно не употребляют во врачебной практике и используют в специальных справочных изданиях, аннотациях к препаратам.
• Непатентованное (международное) название: единое, официально принятое в фармакопеях разных стран (например, пропранолол, верапамил, изосорбида динитрат и др).
• Патентованное (коммерческое) название: присваивают фармацевтические фирмы; служит их коммерческой собственностью, торговой маркой (для верапамила - финоптин♠, изоптин♠ и др.; для изосорбида динитрата - изокет♠ и др).
Непатентованные наименования ЛС должны отвечать трём главным требованиям: иметь чёткое звучание и написание, выраженное отличие от других, уже существующих нефирменных или фирменных названий, и быть близкими к наименованиям препаратов, сходных по строению или механизму действия, т.е. принадлежащих к той же группе. Например, часто используют общую конечную часть названия: «олол» - для β-адреноблокаторов (пропранолол, ацебутолол, надолол и др.); «статин» - для одной из групп гипо- липидемических средств (ловастатин, правастатин, симвастатин; в последнее время эту группу препаратов стали упрощённо называть «статинами», что принято даже в научной клинико-фармакологической литературе). Создание патентованных названий преследует другую цель: максимально выделить (отделить) препарат от подобных непатентованных средств, выпускаемых другими фирмами. Нередко в такое название вводят определённую часть, указывающую на принадлежность препарата к конкретной фирме (напри-
мер, в конце названия - «кет», «мак» и др.). В последнее время в название часто вводят слова, цифры или окончания, указывающие на особенности ЛФ:
• «спрей» - ингаляционная форма;
• «лонг» или «SR» - для препаратов пролонгированного действия и др.;
• цифры, указывающие на дозу (в миллиграммах), - изоптин* 80, изоптин* 240 или изокет* 20, изокет* 60, изокет* 120;
• для выделения дозы одного и того же ЛС в таблетках или драже (большая доза - «форте», малая доза - «мите»).
Лекарственные формы
ЛФ - состояние, придаваемое лекарственному веществу и делающее его удобным для практического применения, при котором достигается необходимый лечебный или профилактический эффект. Другими словами, ЛФ - способ выпуска ЛС.
В зависимости от способа введения ЛФ делят на:
• сублингвальные - гранулы, таблетки и близкие к ним;
• аэрозоли (спреи) - ЛФ для введения в полость рта (например, нитроглицерин);
• буккальные - пластинки и таблетки с адгезивными свойствами для помещения на слизистую оболочку полости рта (например, пластины тринитролонга♠, динитросорбилонга♠; таблетки сусадринаp и др.);
• оральные (пероральные) - для приёма внутрь в виде таблеток, драже, капсул, редко - облаток и растворов;
• парентеральные - для внутривенного, внутримышечного или подкожного введения (растворы в ампулах, флаконах);
• трансдермальные (накожные) - мази, пластыри или диски (например, с нитроглицерином).
Принципиально важно различать ЛФ:
• обычной продолжительности действия (свойственна для конкретного химического соединения);
• пролонгированного действия, полученные с помощью применения различных систем контролируемого длительного высвобождения (методом микрокапсулирования, присоединения к полимерам), сложных систем для очень большой пролонгации эффекта (пластыри или диски, депо-формы), благодаря растворению лекарственного вещества в масле, желатине, синтетической среде.
Понятие фармакотерапии и фармакопрофилактики
ФТ - учение о лечении болезней с помощью ЛС. Фармакопрофилактика - учение о предупреждении болезней с помощью ЛС.
В связи с практической необходимостью в настоящее время формируется новое направление - фармаковалеология (валеология - наука о здоровье), призванная укреплять здоровье людей с помощью ЛС адаптогенного и антиоксидантного действия.
Научно обоснованное применение ЛС для лечения и предупреждения болезней основано на знаниях механизмов развития болезней, защитных и компенсаторных резервов организма. Успех ФТ зависит от знаний ФД, ФК и метаболизма ЛС.
Различают следующие основные виды лекарственного лечения.
Этиотропная терапия (от греч. aetia - причина, tropo - направляю) направлена на устранение или ослабление действия причинного фактора болезни (например, при инфекционных болезнях и отравлениях).
К ЛС этиотропного действия относят антимикробные препараты (дезинфицирующие, антисептические, химиотерапевти- ческие), лечебные сыворотки, содержащие антитела к антигенам бактерий определённого вида, а также различные антидоты, вступающие в прочную связь с токсическими веществами. Этот вид лечения наиболее эффективен.
Патогенетическая терапия (от греч. pathos - болезнь, genesis - происхождение) направлена на устранение или ослабление молекулярных и других механизмов развития болезни. С её помощью осуществляют лечение большинства немикробных заболеваний. К ЛС патогенетического действия относят большинство фармакотерапев- тических средств. Например, сердечные гликозиды могут устранить слабость сердечной мышцы, но они не способны ликвидировать пороки клапанного аппарата сердца, которые служат причиной развития сердечной недостаточности (СН). Противовоспалительное действие ацетилсалициловой кислоты обусловлено уменьшени- ем синтеза простагландинов, которые вызывают развитие отёка и покраснения тканей, а также чувство боли при воспалении.
К средствам патогенетической терапии относят довольно большую группу лекарственных препаратов заместительного действия (ферментные препараты, соляная кислота, гормональные и витаминные средства, различные препараты минерального происхождения), восполняющих недостаток эндогенных веществ.
Средства заместительной терапии, не влияя на причины болезни, могут обеспечить нормальное существование организма. Например, препараты инсулина при СД не устраняют причину из- менений (отсутствие или недостаточное образование инсулина), но при условии постоянного введения в организм в течение всей жизни обеспечивают нормальный обмен углеводов.
Симптоматическая терапия направлена на устранение или ослабление отдельных симптомов заболевания (например, применение обезболивающих средств при головной боли, употребление слабительных при запорах или вяжущих средств при диарее).
Лекарственные препараты, устраняющие отдельные признаки болезни, называют симптоматическими средствами. Их лечебное действие основано лишь на ослаблении какого-либо симптома болезни, при этом основной механизм её развития сохраняется. Именно поэтому лечебная ценность симптоматических лекарственных препаратов хотя и несомненна, но не столь существенна.
Профилактическую терапию проводят для предупреждения заболевания (вакцины, сыворотки, противовирусные средства, антисептики, дезинфицирующие препараты).
Стратегия ФТ состоит в устранении или ослаблении действия причин и механизмов развития болезни, а также стимуляции естественных защитных механизмов компенсации и выздоровления. Наиболее быстрое и полное выздоровление достигают при одновременном применении лекарственных препаратов, устраняющих причину болезни и подавляющих механизмы её развития (патогенез), и средств, стимулирующих защитные механизмы организма, поэтому врач иногда вполне оправданно стремится к одновременному назначению нескольких ЛС.
Эффективность ФТ повышается при её назначении в комплексе с определённым режимом отдыха или активности, соответствующей диетой, подходящими физиотерапевтическими процедурами. Кроме того, она может дополнять хирургические методы лечения.
Терминология
Абсорбция - процесс всасывания ЛС при его внесосудистом введении (чаще всего - в ЖКТ).
Аллергия лекарственная - повышенная чувствительность к некоторым фармакологическим или ЛС, обычно возникающая при их повторном применении и основанная на иммунном механизме.
Биотрансформация - совокупность химических изменений ЛС в организме.
Биодоступностъ - показатель, определяющий, какое количество ЛС попало в систему кровообращения. Предполагают, что при внутривенном введении в кровоток проникает 100% препарата.
Взаимодействие - процесс взаимодействия двух или трёх ЛС на этапе абсорбции, транспорта, метаболизма или элиминации из организма.
Высшая разовая доза - максимальная доза ЛС, однократное назначение которой не причиняет вред здоровью пациента.
Высшая суточная доза - максимальная доза ЛС, назначение которой в течение суток не причиняет вред здоровью пациента.
Доза - количество ЛС, выраженное в весовых, объёмных или условных биологических или радиоактивных единицах.
Доза максимально переносимая - наибольшая доза ЛС, назначение которой сопровождается симптомами отравления, но не приводит к гибели пациента.
Доза летальная - доза ЛС, назначение которой приводит к смертельному исходу.
Канцерогенностъ - способность веществ вызывать развитие злокачественной опухоли.
Ксенобиотик - чужеродное для организма химическое вещество.
Клиренс - величина, характеризующая скорость выведения ЛС из организма человека. При его уменьшении концентрация препарата в крови и тканях постепенно увеличивается, что в большинстве случаев приводит к возникновению нежелательных побочных эффектов.
Кумуляция - накопление вещества в организме.
Курсовая доза - среднее суммарное количество ЛС, необходимое для лечения какого-либо патологического состояния.
Лекарственная непереносимость - индивидуальная сверхчувствительность, выражающаяся в развитии токсических эффектов при применении препарата в терапевтической дозе.
Лекарственное вещество - индивидуальное химическое соединение или биологическое вещество.
Лекарственное взаимодействие - изменение действия ЛС под влиянием другого препарата, применяемого одновременно, до или после введения первого.
ЛС - фармакологическое средство, разрешённое для применения в установленном порядке уполномоченным государственным
органом с целью лечения, предупреждения или диагностики заболевания у человека или животного.
Лекарственный препарат - ЛС, представленное в определён- ной ЛФ.
Максимальная терапевтическая доза - максимальная доза ЛС, назначение которой не причиняет вреда здоровью пациента.
Минимальная (пороговая) терапевтическая доза - минимальная доза ЛС, оказывающая терапевтическое действие.
Мутагенность - способность вещества вызывать изменения ге- нетического аппарата и передачу изменённых свойств по наследству.
Объём распределения - величина, определяющая степень проникновения препарата в органы и ткани. Жирорастворимые препараты имеют большой объём распределения, водорастворимые - малый.
Побочное действие - способность вещества одновременно с основным терапевтическим эффектом оказывать нежелательное или вредное влияние.
Привыкание - пониженная реакция организма на повторное применение вещества.
Пристрастие - непреодолимое стремление к приёму фармако- логического или ЛС.
Распределение - процесс проникновения препарата из кровотока в ткани (описывают специальными математическими моделями).
Связь с белками плазмы крови - связь между фармакологическим веществом и белками плазмы крови, обеспечивающая равновесие между свободной и связанной фракцией ЛС.
Скорость всасывания - постоянная величина, показывающая, какая часть действующего вещества попадает в кровь за опре- делённый период времени.
Смах и Тмах - максимальная концентрация и время её достижения после применения препарата.
Средняя терапевтическая доза - доза ЛС, оказывающая терапевтическое действие у большинства пациентов. Как правило, средняя терапевтическая доза составляет 1/3-1/2 максимальной терапевтической дозы.
Тахифилаксия - снижение фармакологического эффекта при повторном применении препарата в течение короткого времени.
Тератогенность - способность вещества нарушать развитие тканей и органов плода и приводить к возникновению врождён- ных уродств при использовании в период беременности.
Токсичность - свойство ЛС вызывать нежелательные биологические эффекты при назначении в дозах, превышающих лечебные.
Т1/2 (период полувыведения) - время, в течение которое концентрация ЛС в крови снижается на 50%. Знание этой величины позволяет определить интервал между приёмами препарата. Например, Т1/2 пропранолола - 2-3 ч, следовательно, препарат необходимо принимать каждые 4-6 ч. При ХПН у пожилых, стариков и новорождённых, а также при некоторых патологических состояниях Т1/2 многих ЛС увеличивается.
Токсическая доза - доза ЛС, при назначении которой она оказывает повреждающее действие на организм больного.
Ударная (болюсная) доза - высшая разовая доза, назначаемая больному для создания максимальной концентрации ЛС в плазме крови или органе-мишени.
Фармакодинамика - наука, изучающая особенности действия ЛС на организм.
Фармакокинетика - наука, изучающая поведение ЛС в организме человека: процессы абсорбции, распределения, метаболические превращения в печени и других органах и тканях, а также элиминацию из организма.
Элиминация - процесс выведения ЛС из организма. Знание путей элиминации, в основном почечного и печёночного (с жёлчью, кишечным содержимым), имеет важное практическое значение. При малейшем нарушении деятельности почек дозу ЛС, выведение которого целиком зависит от их функций, необходимо строго корректировать, увеличивая интервалы между приёмами.
Формулярная система
В условиях ограниченного финансирования здравоохранения рациональное использование ЛС - задача государственной важ- ности. Для её решения Минздравсоцразвития РФ и Российская академия медицинских наук разрабатывают и внедряют федеральную систему рационального использования ЛС. С
разработаны рекомендации по лечению ряда синдромов и заболеваний, в том числе АГ, БА, СН и др.
Согласно определению ВОЗ, функционирование системы рационального обеспечения ЛС определяют следующие показатели:
• законы в области рационального обеспечения ЛС;
• перечень жизненно необходимых и важнейших ЛС (ЖНВЛС);
• всеобщая доступность ЖНВЛС;
• механизмы покрытия расходов на ЖНВЛС;
• система закупок ЖНВЛС;
• стандарты применения ЛС;
• система обеспечения качества ЛС;
• информационные системы учёта расходования ЛС;
• система учёта побочных действий ЛС;
• рациональное назначение ЛС и их использование потребителями.
Принципы построения формулярной системы
Формулярная система предполагает разработку ограничительных списков ЛС, издание формулярных справочников, внедрение стандартов лечения и программ оценки использования лекарственных препаратов. Национальная формулярная система включает множество уровней (государство регион, область медицинское учреждение) и работает по принципу обратной связи. Её внедрение направлено на решение следующих основных задач.
• Отбор экспертами Формулярного комитета наиболее эффективных и безопасных ЛС, применение которых экономически обоснованно, из всех имеющихся на фармацевтическом рынке страны.
• Разработка и распространение объективной информации о ЛС.
• Внедрение для медицинского и фармацевтического персонала обучающих программ в области рационального использования ЛС.
• Мониторинг правильности использования ЛС.
• Принятие мер по предотвращению и исправлению ошибок ФТ. Внедрение формулярной системы направлено на решение задач
социального, клинического и экономического характера. Введение ограничительных формулярных списков ЛС обычно распространяется на государственный сектор здравоохранения, где они могут помочь в осуществлении принципа социальной справедливости, используемого при оказании медицинской (в том числе лекарственной) помощи всему населению.
Система рационального использования лекарственных средств в России
Формулярный комитет Министерства здравоохранения РФ был создан в августе
В его обязанности входит разработка Перечня ЖНВЛС, в который включают препараты, используемые:
• при угрожающих жизни заболеваниях или синдромах (если без применения ЛС продолжится прогрессирование процесса, возникнут осложнения или наступит смерть пациента);
• для специфического лечения социально значимых заболеваний (группы ЛС, входящих в Перечень ЖНВЛС, должны охватывать все виды медицинской помощи, предоставляемой гражданам РФ бесплатно, включая бесплатное и льготное лекарственное обеспечение за счёт бюджетов всех уровней и средств обязательного медицинского страхования);
• во время оказания скорой медицинской помощи при состояниях, угрожающих жизни и здоровью гражданина или окружающих его лиц и вызванных внезапным заболеванием, обострением хронических заболеваний, несчастными случаями, травмами и отравлениями, осложнениями беременности и родов (стационарная помощь при острых заболеваниях, обострениях хронических болезней, отравлениях и травмах, требующих интенсивной терапии, круглосуточного наблюдения и изоляции по эпидемиологическим показаниям; при патологии беременности, родах и абортах; при плановой госпитализации с целью проведения лечения и реабилитации в стационарных условиях);
• для оказания амбулаторной и стационарной специализированной помощи при венерических заболеваниях, туберкулёзе и СПИДе;
• для оказания медицинской помощи в рамках базовой программы ОМС.
Контрольные вопросы
• Как называется наука, занимающаяся изучением ЛС?
• В каком году КФ признали в качестве самостоятельной медицинской науки?
• В каком году была утверждена специальность «Клиническая фармакология»?
• Какие основные задачи ставит практическая медицина перед КФ?
• Что такое ЛС и лекарственное вещество?
• Принципы классификации ЛС.
• Основные виды лекарственного лечения.
• Что такое формулярная система и на чём она основана?
1.2. ФАРМАКОКИНЕТИКА
Цель
После изучения темы студент должен уметь оценивать действие лекарственных препаратов на пациента и знать:
• особенности введения ЛС;
• виды абсорбции и биотрансформации;
• пути экскреции.
ФК изучает особенности поступления препарата в организм в зависимости от пути введения, всасывание и биологическую усво- яемость, связь с белками плазмы крови, а также распределение и элиминацию ЛС и их метаболитов из организма. Другими словами, ФК позволяет оценить динамику пребывания ЛС и его метаболитов в организме (рис. 2) и отвечает на вопрос: «Что организм делает с лекарством?» Для КФ важны исследования фармакологи- ческих процессов у здоровых и больных пациентов.
Знание ФК ЛС предоставляет возможность осуществлять индивидуальный подбор лекарственной терапии конкретному боль- ному, исходя из состояния поражённых патологическим процессом и интактных органов и систем.
Данные ФК позволяют определить дозу, оптимальный путь введения, режим применения препарата и длительность лечения.
Регулярный контроль содержания препаратов в биологических средах (лекарственный мониторинг) позволяет своевременно вно- сить необходимые коррективы в схему лечения.
Изучение ФК имеет особое значение в случаях неэффективного лечения или плохой переносимости ЛС.
Фармакокинетические исследования необходимы при проведении ФТ у пациентов с заболеваниями печени и почек, а также при назначении комбинированного лекарственного лечения.
Без фармакокинетических исследований нельзя обойтись при разработке новых ЛС и их ЛФ, а также при экспериментальных и клинических испытаниях новых лекарственных препаратов.
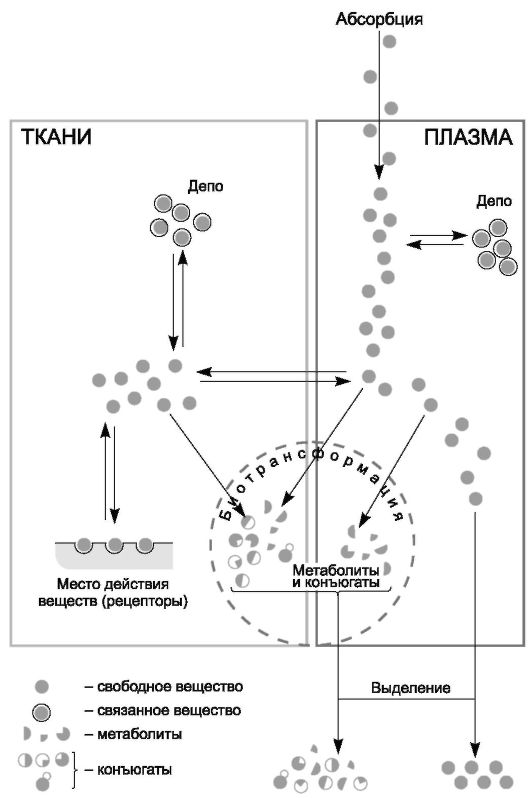
Рис. 2. Фармакокинетика лекарственных средств (схема)
Особенности введения лекарственных средств в организм
В организм ЛС можно ввести различными путями: через ЖКТ (через рот, в прямую кишку), кожу, инъекционно (в мышцу, вену и др.), ингаляторно и др. Путь введения во многом определяет возможность достижения ЛС места действия; от него зависит эффективность и безопасность препарата.
Традиционно выделяют энтеральный и парентеральный пути введения ЛС в организм.
Энтеральный путь введения
В этом случае ЛС вводят через ЖКТ (табл. 1). Этот путь очень удобен, так как пациент может осуществлять введение самосто- ятельно, без помощи медицинского персонала. Он сравнительно безопасен (отсутствует риск инфицирования и развития местных осложнений, например, образование инфильтратов, возникновение боли). При энтеральном способе введения ЛС могут оказывать не только резорбтивное, но и местное действие (на- пример, в кишечнике). Последнее характерно для некоторых сульфаниламидов и противоглистных средств (пиперазина адипат, пирантел).
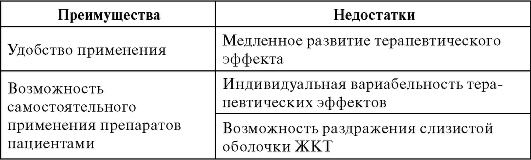
Таблица 1. Преимущества и недостатки энтерального (приём внутрь) пути введения лекарственных средств

Энтеральное введение можно осуществлять разными способами.
Приём внутрь (через рот - per os). С помощью этого способа введения назначают лекарственные препараты для оказания резорбтивного воздействия или создания в ЖКТ высоких концентраций фармакологически активных компонентов, входящих в их состав. В первом случае ЛС должно хорошо всасываться в желудке или кишечнике, а во втором - наоборот, плохо.
Среди недостатков приёма внутрь следует выделить относительно медленное развитие терапевтического эффекта, достаточ- но большое различие в скорости и полноте всасывания, невозможность применения при рвоте и бессознательном состоянии пациента препаратов, оказывающих раздражающее действие на
ЖКТ (табл. 2).
Таблица 2. Преимущества и недостатки приёма внутрь лекарственных средств
Приём внутрь используют для введения различных ЛФ: растворов, гелей, суспензий, порошков, таблеток, капсул, драже и пилюль. Раздражающее действие некоторых ЛС устраняют с помощью покрытия таблеток плёнками, обеспечивающими всасывание препарата в опре- делённой среде. Для пролонгирования эффекта применяют таблетки с многослойными оболочками. Следует помнить, что некоторые капсулы и таблетки при приёме в положении лёжа могут задерживаться в пищеводе и вызывать язвенное поражение его стенок. Особенно это касается пожилых людей, у которых перистальтика ЖКТ нарушена. В таком случае рекомендуют запивать ЛС большим количеством воды.
Для приёма внутрь существуют специальные ЛФ, обеспечивающие постепенное замедленное высвобождение действующего вещества с постоянной скоростью в течение длительного времени и пролонгированный терапевтический эффект. Ретардные ЛФ при отсутствии разделительной полоски не подлежат дроблению, так как при этом утрачиваются свойства ЛС. С помощью различных технологий ретардирования созданы четыре ЛФ пролонгированного действия.
• Таблетки ретард с послойным распределением вещества и биополимера 12- и 24-часового действия разработаны для:
- антагонистов кальция (нифедипин SRp, фелодипин ERp);
- теофиллина, индапамида, НПВС (диклофенак), нитратов (изосорбида динитрат, изосорбида мононитрат), прокаи- намида;
- β-адреноблокаторов (метопролол, окспренолол).
• Капсулы ретард (растворимые капсулы 12- и 24-часового действия с микрогранулами вещества, покрытые биополимерной оболочкой):
- антагонисты кальция (верапамил SRp);
- НПВС (диклофенак), β-адреноблокаторы (пропранолол).
• Таблетки ретард с двуфазным высвобождением 12-часового действия содержат быстрорастворимую и медленнорастворимую фракции вещества:
- нифедипин SI/.
• Желудочно-кишечные терапевтические системы (таблетки и капсулы 24-часового действия с контролируемой скоростью высвобождения вещества, покрытые нерастворимой полупроницаемой оболочкой):
- нифедипин-GITS^, верапамил-SODAS^. Сублингвальный способ (приём под язык). Обильное кровоснабжение слизистой оболочки ротовой полости создаёт условия для быстрого проникновения всасывающихся через неё лекарственных веществ в системный кровоток. Лечебный эффект наступает быстро, так как ЛС не подвергаются действию желудочного сока и попадают в системный кровоток по венам пищевода (минуя печень), что позволяет избежать их биотрансформации.
Сублингвально назначают, например, нитроглицерин (для купирования приступов стенокардии), нифедипин (при гипертоническом кризе) или бупренорфин (обезболивающее средство). Препараты обычно держат под языком до полного рассасывания. При частом использовании этого метода может возникнуть раздражение слизистой оболочки ротовой полости.
Разновидностью приёма ЛС через рот считают буккальный спо - соб. Так употребляют ЛС, выпускаемые в виде полимерных плёнок (нитроглицерин или тринитролонг♠). Последние «приклеивают» к десне или щеке. Их расплавление под действием слюны создаёт условия для постепенного высвобождения фармакологически активного вещества (например, нитроглицерина в тринитролонге*), его всасывания и создания в системном кровотоке терапевтических концентраций в течение определённого времени.
Ректальный способ (введение в прямую кишку). Многие ЛС хорошо всасываются с поверхности слизистой оболочки прямой кишки, имеющей густую сеть кровеносных и лимфатических сосудов. Минуя печень, через геморроидальные вены в нижнем отделе прямой кишки они попадают в системный кровоток.
Ректальный способ введения позволяет избегать раздражающего действия лекарств на желудок и тонкую кишку. Он также приемлем и при невозможности приёма препарата внутрь. ЛС назначают ректально в форме свечей или в виде жидкостей с помощью клизм. При этом они оказывают как местный, так и резорбтивный эффект.
Парентеральный путь введения
Парентеральный путь - введение ЛС в организм, минуя ЖКТ (рис. 3).
Различают следующие виды парентерального введения ЛС (рис. 4).
Внутривенное введение обеспечивает быстрое возникновение лечебного эффекта, позволяет сразу остановиться при развитии
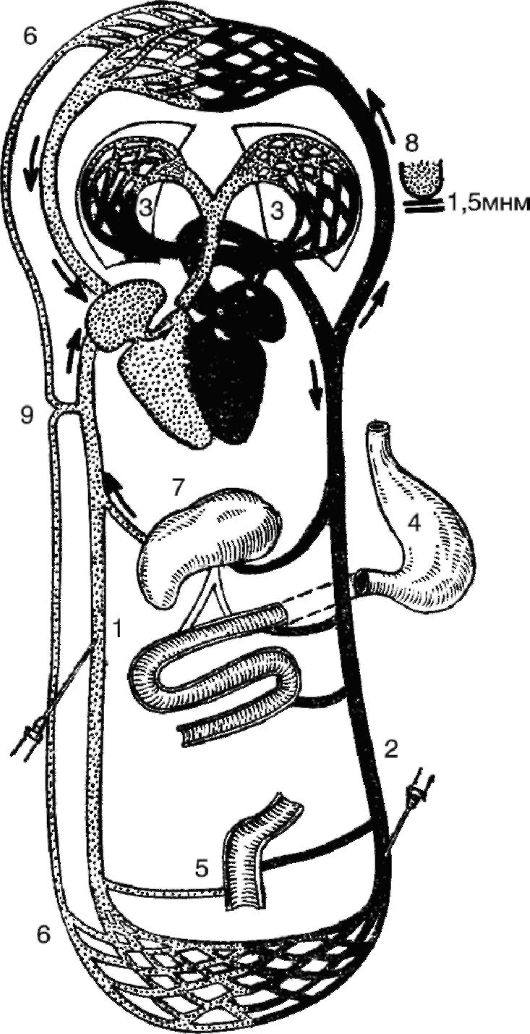
Рис. 3. Пути поступления лекарственных веществ в кровь. 1 - вены; 2 - артерии; 3 - легкие; 4 - желудок; 5 - прямая кишка, 6 - лимфатическая система; 7 - печень; 8 - альвеола; 9 - общий
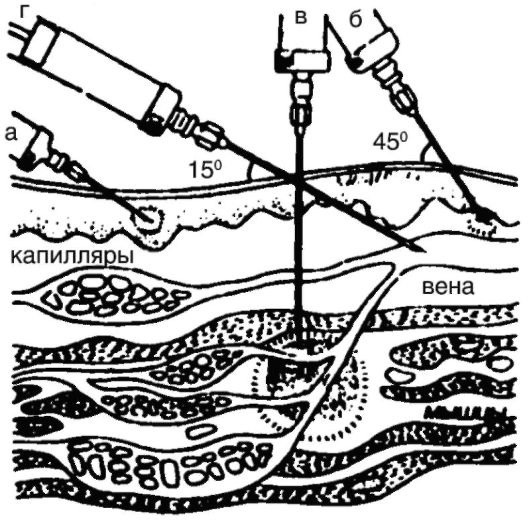
Рис. 4. Виды парентерального введения лекарственных средств:
а - внутрикожная инъекция; б - подкожная инъекция; в - внутримышечная
инъекция; г - внутривенная инъекция
нежелательных реакций и осуществить точное дозирование ЛС. Внутривенно вводят препараты, которые плохо всасываются из ЖКТ или оказывают на него раздражающее действие.
Способы внутривенного введения инъекционных растворов
Болюсное введение (от греч. bolos - комок) - быстрое внутри- венное введение препарата в течение 3-6 мин. Дозу введённого ЛС обозначают в миллиграммах препарата либо в миллилитрах раствора определённой концентрации.
Инфузионное введение (обычно внутривенное, но иногда - внутриартериальное или внутрикоронарное) проводят с опре- делённой скоростью, причём дозу рассчитывают количественно (например, мл/мин, мкг/мин, мкг/[кг×мин]) либо менее точно (в виде количества капель раствора, вводимых в 1 мин). Для более точной продолжительной инфузии предпочтительно, а в ряде случаев, - строго обязательно (например, внутривенное введение нитропруссида натрия) использовать специальные шприцы-дозаторы, системы для инфузии микроколичеств препарата, специальные соединительные трубки для предупреждения потери ЛС в системе вследствие его адсорбции на стенках трубок (например, при введении нитроглицерина).
Комбинированное внутривенное введение позволяет быстро достичь постоянной терапевтической концентрации препарата в крови. Например, внутривенно вводят болюс и сразу же начинают поддерживающую внутривенную инфузию или регулярное внутримышечное введение того же ЛС (например, лидокаина) через определённые интервалы времени.
При осуществлении внутривенного введения следует убедиться в том, что игла находится в вене: проникновение ЛС в околовенозное пространство может привести к раздражению или некрозу тканей. Некоторые ЛС, особенно при длительном применении, оказывают раздражающее действие на стенки вен, что может сопровождаться развитием тромбофлебита и венозного тромбоза. При внутривенном введении существует опасность инфицирования вирусами гепатита В, С и ВИЧ.
Лекарственные вещества в зависимости от клинической ситуации и особенностей ФК препарата вводят в вену с разной скоростью. Например, если нужно быстро создать в крови терапевтическую концентрацию ЛС, подверженного интенсивному метаболизму или связыванию с белками, используют быстрое (болюсное) введение (верапамил, лидокаин и др.). Если существует опасность передозировки при быстром введении и высок риск раз- вития нежелательных и токсических эффектов (сердечные гликозиды, прокаинамид), препарат вводят медленно и в разведении (с изотоническими растворами декстрозы или натрия хлорида). Для создания и поддержания терапевтических концентраций в крови на протяжении определённого времени (несколько часов) применяют капельное введение ЛС с помощью систем для переливания крови (аминофиллин, глюкокортикоиды и др.).
Внутриартериальное введение применяют для создания высоких концентраций препаратов в соответствующем органе (например, в печени или конечности). Чаще всего это касается препаратов, быстро метаболизирующихся или связывающихся тканями. Системное действие ЛС при таком способе введения практически отсутствует. Наиболее серьёзным осложнением внутриартериального введения препаратов считают тромбоз артерии.
Внутримышечное введение - один из самых частых способов парентерального введения ЛС, обеспечивающий быстрое наступление эффекта (в течение 10-30 мин). Внутримышечно вводят депо-препараты, масляные растворы и некоторые ЛС, обладающие умеренным местным и раздражающим действием. Нецелесо-
образно вводить однократно более 10 мл препарата и выполнять инъекции вблизи нервных волокон. Внутримышечное введение сопровождается местной болезненностью; нередко в месте введения развиваются абсцессы. Опасно проникновение иглы в кровеносный сосуд.
Подкожное введение. По сравнению с внутримышечной инъекцией, при этом способе лечебный эффект развивается медленнее, но сохраняется более длительно. Его нецелесообразно применять при шоковом состоянии, когда вследствие недостаточности периферического кровообращения всасывание ЛС минимально.
В последнее время весьма распространён метод подкожной имплантации некоторых ЛС, обеспечивающий длительное лечебное воздействие (дисульфирам - для лечения алкоголизма, налтрексон - для лечения наркоманий, некоторые другие препараты).
Ингаляционное введение - способ применения ЛС, выпускаемых в виде аэрозолей (сальбутамол и другие β2-адреномиметики) и порошков (кромоглициевая кислота). Кроме того, ингаляционно применяют летучие (эфир для наркоза, хлороформ) или газообразные (циклопропан) анестетики. Этот способ введения обеспечивает как местное β2-адреномиметики), так и системное (средства для наркоза) действие. Ингаляционно не вводят ЛС, обладающие раздражающими свойствами. Необходимо помнить, что в результате ингаляции препарат сразу поступает через лёгочные вены в левые отделы сердца, что создаёт условия для развития кардиотоксического эффекта.
Ингаляционное введение ЛС позволяет ускорить всасывание и обеспечить избирательность действия на дыхательную систему.
Достижение того или иного результата зависит от степени проникновения ЛС в бронхиальное дерево (бронхи, бронхиолы, аль- веолы). При ингаляционном введении всасывание усилится, если частицы препарата будут проникать в его самые дистальные отделы, т.е. в альвеолы, где абсорбция происходит через тонкие стенки и на большей площади. Например, нитроглицерин при ингаляционном введении поступает непосредственно в системный кровоток (в отличие от энтерального способа введения).
Для достижения избирательного действия ЛС на дыхательную систему, например при лечении БА, необходимо распределение основной массы препарата в бронхах среднего и мелкого калибра. Вероятность возникновения системных эффектов зависит от количества вещества, попавшего в общий кровоток.
Для ингаляционного введения используют специальные системы доставки:
• дозируемый аэрозольный ингалятор, содержащий газ-пропеллент;
• ингалятор для введения сухого порошкообразного вещества, активируемый дыханием (турбухалер);
• небулайзер.
Проникновение ЛС в организм зависит от размера частиц препарата, техники ингаляции и объёмной скорости вдоха. При применении большинства аэрозольных ингаляторов в дыхательную систему попадает не более 20-30% общей дозы лекарственного вещества (респирабельная фракция). Остальная часть препарата задерживается в полости рта и глотке, а затем проглатывается больным, вызывая развитие системных эффектов (чаще - неже- лательных).
Создание ингаляционных форм доставки - порошковых ингаляторов - позволяет увеличить респирабельную фракцию пре- парата до 30-50%. Такие ингаляторы основаны на образовании турбулентных потоков воздуха, которые размельчают крупные частицы сухого лекарственного вещества, в результате чего ЛС лучше достигают дистальных отделов дыхательных путей. Пре- имущество порошковых ингаляторов - отсутствие газа-пропеллента, оказывающего негативное влияние на окружающую среду. Ингаляторы для введения сухого порошкообразного вещества разделяют по способам использования препарата: он либо встроен в ингалятор, либо прилагается к нему в виде специальной ЛФ.
Ингаляторы, активируемые дыханием (турбухалеры), облегчают поступление ЛС в дыхательные пути, так как не требуют координирования вдоха и нажатия на баллончик ингалятора. Препарат поступает в дыхательные пути при вдохе меньшего усилия, что увеличивает эффект от лечения.
Другой путь увеличения респирабельной фракции при использовании ингаляторов состоит в применении вспомогательных ус- тройств типа спейсеров и небулайзеров.
Спейсеры применяют вместе с дозируемыми аэрозольными ингаляторами. Они способствуют увеличению расстояния между последним и полостью рта больного. В результате возрастает временной интервал между выбросом ЛС из баллончика и его попаданием в полость рта. Благодаря этому частицы успевают потерять излишнюю скорость, а газ-пропеллент испаряется, оставляя
больше частиц ЛС нужного размера суспензированными в спейсере. Поскольку скорость струи аэрозоля уменьшается, снижается и воздействие на заднюю стенку глотки. Больные в меньшей степени ощущают холодовый эффект фреона, и у них реже возникает рефлекторный кашель. Основные характеристики спейсера - объём и наличие клапанов. Наибольшего эффекта достигают при использовании спейсеров большего объёма; клапаны предупреждают потерю аэрозоля.
Небулайзеры - устройства, которые функционируют посредством пропускания мощной струи воздуха или кислорода под давлением через раствор препарата, либо за счёт ультразвуковой вибрации последнего. В обоих случаях образуется мелкая аэрозольная взвесь частиц ЛС, и больной вдыхает её через мундштук или лицевую маску. Доза препарата доставляется в течение 10- 15 мин, пока пациент нормально дышит. Небулайзеры оказывают максимальный терапевтический эффект при наилучшем соотношении местного и системного воздействия. Препарат максимально поступает в дыхательные пути, не требуется дополнительного усилия для вдоха. Возможно введение ЛС детям с первых дней жизни и пациентам с различной степенью тяжести заболевания. Кроме того, небулайзеры можно применять как в стационарах, так и на дому.
Ингаляционным путём нельзя вводить раздражающие ЛС. При использовании газообразных веществ прекращение ингаляции приводит к быстрому прекращению их действия.
Местное применение - нанесение ЛС на поверхность кожи или слизистых оболочек для получения эффектов в месте аппликации. При нанесении на слизистые оболочки носа, глаз и кожу (например, пластыри, содержащие нитроглицерин) активные компоненты многих препаратов подвергаются всасыванию и оказывают системное действие. При этом эффекты могут быть желательными (профилактика приступов стенокардии с помощью нитроглицериновых пластырей) и нежелательными (побочные эффекты глюкокортикоидов, вводимых ингаляционно).
Другие способы введения. Иногда для непосредственного действия на ЦНС ЛС вводят в субарахноидальное пространство. Так осуществляют спинномозговую анестезию, вводят антибактериальные препараты при менингите. Для переноса ЛС с поверхности кожи в ткани, расположенные глубоко, используют метод электро- или фонофореза.
Информация для медицинского работника.
• При любом способе введения ЛС сестринский персонал обязан информировать пациента о:
- названии и назначении ЛС;
- возможных побочных действиях;
- сроках и признаках наступления эффекта применяемого ЛС;
- способе применения ЛС.
• Прежде чем дать пациенту ЛС:
- внимательно прочитайте лист назначения;
- убедитесь в том, что перед вами тот пациент, фамилия которого указана в листе назначения;
- проверьте название ЛС, его дозу, способ применения, соответствие этикетки на упаковке назначению врача.
• Будьте особенно внимательны при выполнении назначений пациентам с одинаковыми фамилиями и (или) получающим одинаковые ЛС.
• Никогда не давайте пациенту ЛС при отсутствии упаковки.
• Пациент имеет право знать название, назначение и дозу ЛС.
• Ему нужно сообщить, чем запивать ЛС.
• Пациент должен быть проинформирован об особенностях взаимодействия принимаемого ЛС с пищей. Разжёвывание таблеток и других твёрдых ЛВ изменяет действие препарата.
Любое ЛС, покупаемое в аптеке, сопровождает специальная инструкция по применению. Между тем соблюдение (несоблюдение) правил приёма может оказывать большое, а иногда и решающее влияние на действие препарата. Например, при приёме внутрь пища, желудочный сок, пищеварительные ферменты и жёлчь, которые выделяются в процессе переваривания, могут взаимодействовать с ЛС и изменить его свойства. Именно поэтому имеет значение связь приёма лекарства с приёмом пищи: натощак, во время или после еды.
Через 4 ч после или за 30 мин до следующего приёма пищи (натощак) желудок пуст, количество пищеварительного сока в нём минимально (несколько столовых ложек). Желудочный сок (продукт, выделяемый железами желудка в процессе пищеварения) в это время содержит мало соляной кислоты. С приближением завтрака, обеда или ужина количество желудочного сока и соляной кислоты в нём возрастает, а с первыми порциями пищи их выделение становится особенно обильным. По мере поступления пищи
в желудок кислотность желудочного сока снижается в результате нейтрализации пищей (особенно при употреблении яиц или молока). В течение 1-2 ч после еды она снова возрастает, поскольку желудок к этому времени освобождается от пищи, а выделение сока ещё продолжается. Особенно выраженную вторичную кислотность обнаруживают после употребления жирного жареного мяса или чёрного хлеба. Кроме того, при приёме жирной пищи её выход из желудка задерживается и иногда происходит заброс панкреатического сока, вырабатываемого поджелудочной железой, из кишечника в желудок (рефлюкс).
Пища, перемешанная с желудочным соком, переходит в начальный отдел тонкой кишки - двенадцатиперстную кишку. Туда же начинает поступать жёлчь, вырабатываемая печенью, и панкреатический сок, выделяемый поджелудочной железой. Благодаря содержанию большого количества пищеварительных ферментов в панкреатическом соке и биологически активных веществ в жёлчи начинается активный процесс переваривания пищи. В отличие от панкреатического сока жёлчь выделяется постоянно (в том числе между приёмами пищи). Её избыточное количество поступает в жёлчный пузырь, где создаётся резерв для нужд организма.
Если в инструкции или назначениях врача отсутствуют указания, ЛС лучше принимать натощак (за 30 мин до приёма пищи), так как взаимодействие с пищей и пищеварительными соками может нарушить механизм всасывания или привести к изменению свойств препарата.
Натощак принимают:
• все настойки, настои, отвары и им подобные препараты, изготовленные из растительного сырья, так как они содержат действующие вещества, некоторые из которых под действием соляной кислоты желудка могут перевариваться и переходить в неактивные формы; кроме того, в присутствии пищи может нарушаться всасывание отдельных компонентов таких препаратов и, как следствие, возникать недостаточный или ис- кажённый эффект;
• все препараты кальция (например, кальция хлорид), оказывающие выраженное раздражающее действие; кальций, связываясь с жирными и другими кислотами, образует нерастворимые соединения; во избежание раздражающего действия лучше запивать такие ЛС молоком, киселём или рисовым отваром;
• ЛС, всасывающиеся с пищей, но по каким-то причинам оказывающие неблагоприятное воздействие на пищеварение или расслабляющие гладкую мускулатуру (например, дротаверин - средство, устраняющее или ослабляющее спазмы гладкой мускулатуры);
• тетрациклин (нельзя запивать его и другие тетрациклиновые антибиотики молоком, так как препараты связываются с кальцием).
Во время приёма пищи или сразу после него принимают все поливитаминные препараты. После еды лучше принимать препараты, раздражающие слизистую оболочку желудка (индометацин, ацетилсалициловая кислота, гормональные средства, метронидазол, резерпин и др.).
Особую группу составляют ЛС, которые должны действовать непосредственно на желудок или процесс пищеварения. Так, пре- параты, снижающие кислотность желудочного сока (антациды), а также средства, ослабляющие раздражающее воздействие пищи на больной желудок и предупреждающие обильное выделение желудочного сока, принимают обычно за 30 мин до приёма пищи. За 10-15 мин до еды рекомендовано принимать средства, стимулирующие секрецию пищеварительных желёз (горечи), и жёлчегонные препараты.
Заменители желудочного сока принимают вместе с пищей, а заменители жёлчи (например, аллохол♠) - в конце или сразу после еды. Препараты, содержащие пищеварительные ферменты и спо- собствующие перевариванию пищи (например, панкреатин), принимают обычно до, во время или сразу после еды. Средства, подавляющие выделение соляной кислоты (например, циметидин) следует принимать сразу или вскоре после приёма пищи, иначе они блокируют пищеварение на самой ранней стадии.
Не только присутствие пищевых масс в желудке и кишечнике влияет на всасывание ЛС. Состав пищи тоже может изменять этот процесс. Например, при употреблении пищи, богатой жирами, увеличивается концентрация витамина А в крови (возрастает скорость и полнота его всасывания в кишечнике). Молоко способствует усилению всасывания витамина D, избыток которого опасен, в первую очередь, для ЦНС. При преимущественно белковом питании или употреблении маринованных, кислых и солёных продуктов ухудшается всасывание противотуберкулёзного средства изониазида, а при безбелковом, наоборот, - улучшается.
Информация для пациента
Кроме техники приёма (введения), необходимо уточнить, знает ли пациент:
• цель приёма назначенного ЛС;
• ожидаемый эффект и возможные побочные действия;
• как поступить при возникновении побочных явлений;
• способ и время приёма;
• чем запивать ЛС;
• о необходимости исключения из рациона каких-либо продуктов во время лечения;
• о необходимости исключения алкоголя;
• предполагаемую продолжительность лечения;
• последствия несоблюдения схемы лечения;
• о влиянии применения других ЛС в дополнение к существующей схеме (особенно важно - при самостоятельном приёме пациентом препаратов, которые ему не были назначены).
Если пациент не имеет всей необходимой информации, это может привести к несоблюдению режима приёма (введения) ЛС. Больные, страдающие хроническими заболеваниями, часто забывают о необходимости постоянного применения одного или нескольких ЛС. Необходим контроль эффективности лекарственной терапии со стороны медицинской сестры.
Абсорбция
Абсорбция или всасывание ЛС - процесс поступления вещества из места введения в системный кровоток. Препарат должен пройти через несколько мембран, прежде чем достигнет специфического рецептора. Через клеточные мембраны, содержащие липопротеиды, ЛС проникает посредством диффузии, фильтрации или активного транспорта (рис. 5).
Диффузия - пассивное прохождение ЛС через водяные канальцы в мембране либо посредством растворения в ней. Такой механизм присущ неионизированным неполярным, растворяющимся в липидах и полярным (т.е. представленным электрическим диполем) химическим соединениям. Большинство ЛС - слабые органические кислоты и основания, поэтому их ионизация в водных растворах зависит от рН среды. В желудке рН составляет около 1,0, в верхнем отделе кишечника - около 6,8, в нижнем отделе тонкой кишки - около 7,6, в слизистой оболочке полости рта - 6,2-7,2,
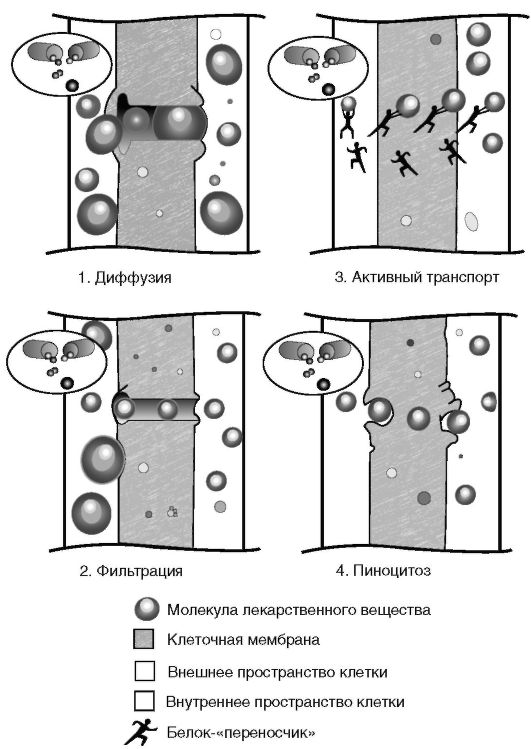
Рис. 5. Основные механизмы всасывания лекарственных средств
в крови - 7,4 ? 0,04, в моче - 4,6-8,2. Именно поэтому механизм диффузии наиболее важен для абсорбции ЛС.
Фильтрация - проникновение ЛС через поры в клеточной мембране в результате разности гидростатического или осмотического давления по обе её стороны. Такой механизм абсорбции свойственен многим растворимым в воде полярным и неполярным химическим соединениям. Вместе с тем из-за небольшого диаметра пор в клеточных мембранах (от 0,4 нм в мембранах эрит-
роцитов и эпителии кишечника до 4 нм в эндотелии капилляров) такой механизм абсорбции ЛС имеет небольшое значение (важен только для прохождения препаратов через почечные клубочки).
Активный транспорт. В отличие от диффузии такой механизм абсорбции ЛС требует активного потребления энергии, так как препарат должен преодолеть химический или электрохимический градиент с помощью переносчика (компонента мембраны), образующего с ними специфический комплекс. Переносчик обеспе- чивает селективный транспорт и насыщение клетки ЛС даже при невысокой концентрации последнего вне клетки.
Пиноцитоз - поглощение мембранами внеклеточного материала с образованием везикул. Этот процесс особенно характерен для ЛС полипептидной структуры с молекулярной массой более 1000 килодальтон.
Абсорбция ЛС в основном происходит в тонкой кишке, что связано с большой площадью её слизистой оболочки (около
Факторы, влияющие на абсорбцию
• Характер кинетики препарата. При кинетике первого порядка скорость пассивной диффузии пропорциональна количеству остающегося в ЖКТ ЛС (характерно для препаратов, вводимых внутримышечно, подкожно и ректально). При этом период полувыведения (время, в течение которого концентрация вещества уменьшается наполовину) не зависит от концентрации препарата в крови. При кинетике нулевого порядка скорость прохождения ЛС не зависит от концентрации лекарства в ЖКТ.
• Особенности ЛФ для приёма внутрь: быстрорастворимые ЛС (например, водные растворы) абсорбируются быстрее, а растворимые (масляные растворы или твёрдые ЛФ) - медленнее.
• Поверхность абсорбции и способ введения.
• Присутствие в ЖКТ ряда других препаратов или пищевых продуктов, влияющих на абсорбцию ЛС.
• Моторика различных отделов ЖКТ, объём и состав пищи, количество принимаемой жидкости, интервал времени между приёмом пищи и препаратов.
Распределение лекарственных средств
После абсорбции или парентерального введения происходит распределение ЛС в интерстициальной, клеточной и межклеточной жидкости. Скорость, величина и характер начального распределения зависят от физико-химических свойств препарата, функционального состояния сердца и регионарного кровотока. На распределение веществ существенно влияют биологические барьеры:
• стенка капилляра;
• клеточные мембраны;
• гематоэнцефалический барьер;
• плацентарный барьер.
Через гематоэнцефалический барьер плохо проходят полярные соединения, липофильные - хорошо. Через плацентарный барьер хорошо проходят липофильные соединения, полярные - плохо.
Первый барьер для ЛС - стенка капилляра, представляющая собой липидную мембрану. Растворимые в липидах препараты проникают через неё посредством диффузии, а нерастворимые - путём фильтрации через поры мембраны. ЛС очень быстро проникают в сердце, мозг, печень, почки и другие хорошо перфузируемые ткани, медленнее - в мышцы, и очень медленно - в жировую ткань (рис. 6).
ЛС могут накапливаться в тканях в более высоких концентрациях, чем в плазме, благодаря градиенту рН, связыванию, ак- тивному транспорту и высокой растворимости в жирах. Такие ткани служат резервуаром для препарата, обеспечивая его более продолжительное действие. Большая часть ЛС в первые минуты после всасывания попадает в органы и ткани с самым богатым кровоснабжением (скорость перфузии в почках, лёгких, мозге, надпочечниках, щитовидной железе - более 1 мл/мин; печени, сердце, селезёнке - 0,1-1 мл/мин), а затем - в менее интенсивно кровоснабжаемые органы (скорость перфузии в мышцах, слизистых оболочках, коже и жировой ткани, костях - менее 0,1 мл/мин).
Для достижения терапевтических концентраций ЛС в тканях с низкой (менее 0,1 мл/мин) скоростью перфузии требуется от не- скольких минут до нескольких часов.
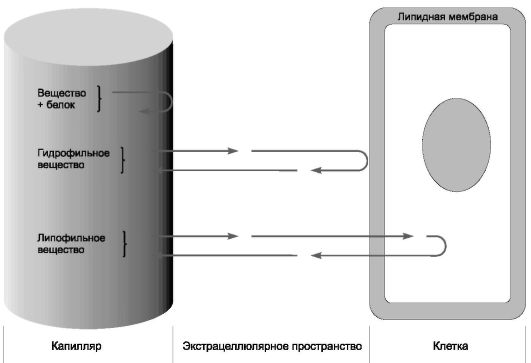
Рис. 6. Факторы, влияющие на распределение вещества
Важным фактором, определяющим распределение ЛС, служит скорость его диффузии в различных тканях. Легче и быстрее она протекает в интерстициальной ткани. Капилляры хорошо проницаемы и для гидрофильных, и для липофильных веществ, поэтому водорастворимые препараты (например, стрептомицин), которые плохо всасываются из кишечника, вводят парентерально.
Гидрофильные ЛС имеют малый объём распределения (менее 0,2 л/кг), липофильные - большой (более 0,2 л/кг).
Организм можно условно рассматривать как группу компартментов (камер, отделений), различных по доступности для ЛС: плазма - центральный компартмент, различные ткани - периферические.
Основные факторы, определяющие неравномерное распределение препарата в организме: связывание с белками плазмы, различными компонентами тканей, жировой тканью, а также проникновение через гематоэнцефалический барьер (ГЭБ).
Связывание ЛС с белками плазмы, во-первых, способствует созданию более высокой концентрации лекарственного препарата в крови по сравнению с таковой во внеклеточной жидкости. Во-вторых, образуется депо ЛС, так как его часть, связанная с
белком, находится в динамическом равновесии со свободной фракцией: вследствие метаболизма и экскреции не связанного с белком препарата, из связанной фракции освобождается его дополнительное количество, так как связь с белком слабая. В-третьих, увеличивается период полувыведения ЛС, так как препарат, связанный с белком, не может фильтроваться через почечные клубочки и не подвергается биологической трансформации (метабо- лизму). Связанное с белком ЛС неактивно до тех пор, пока оно не перейдёт в свободную фракцию. Препараты связываются главным образом с альбуминами, хотя некоторые гормональные и другие средства могут соединяться с одной из фракций глобулинов.
Способность белков к связыванию с ЛС может быть ограничена, и при насыщении связей или гипопротеинемии дальнейшее поступление препарата может привести к интоксикации, вызванной увеличением фракции лекарственного вещества, не связанной с белком (т.е. фармакологически активной). Выраженное уменьшение способности белков плазмы к связыванию ЛС может наступить при уремии, гипоальбуминемии (менее 30 г/л), гипербилирубинемии и печё- ночной недостаточности. Связывание препаратов с белками может усиливаться (например, для β-адреноблокаторов пропранолола и окспренолола) при остром воспалении, в начальной стадии инфекционного заболевания, а также при увеличении СОЭ (более 20 мм/ч).
Связывание ЛС с белком могут угнетать свободные жирные кислоты, например пальмитиновая кислота - в большей степени, чем олеиновая (две основные свободные жирные кислоты в плазме). Некоторые препараты при совместном применении способны влиять на связывание с белками.
Доказано, что концентрация ЛС в слюне приближается к содержанию в крови его фракции, не связанной с белком. При точном определении концентрации ЛС в плазме и слюне можно установить, что содержание препарата, связанного с белком, равно разности его концентраций в плазме и слюне. Чаще всего определение содержания препарата в слюне неточно, так как эта биологическая жидкость представляет сложную и непостоянную смесь секретов различных желёз ротовой полости, обладающих неодинаковой способностью к выделению ЛС.
Связывание ЛС с тканями. Препарат может связываться с белками тканей, кислыми мукополисахаридами и нуклеиновыми кислотами. Отдельные лекарственные вещества могут селективно соединяться с некоторыми тканями (например, дигоксин и диги-
токсин - с тканями сердца, печени и почек), что приводит к увеличению их концентрации в органах.
При приёме липофильных препаратов отмечают их накопление в жировой ткани, но она относительно плохо снабжается кровью, и ЛС перераспределяются в мышечную ткань.
ГЭБ даже при внутривенном введении большинства ЛС препятствует их проникновению в ЦНС вместе со спинномозговой жидкостью.
Из других факторов, влияющих на распределение ЛС, следует отметить форменные элементы крови, в частности эритроциты. С увеличением концентрации в крови некоторых препаратов может усиливаться их сродство к эритроцитам. По-видимому, на этот процесс также влияет возраст больного. ЛС либо связывается с мембраной эритроцита, либо проникает внутрь него. Это необходимо учитывать, так как лишь свободная часть препарата, нахо- дящаяся в плазме, фармакологически активна.
Биотрансформация (метаболизм) лекарственных средств
Биотрансформация - комплекс физико-химических и биохимических превращений ЛС, в процессе которых образуются полярные водорастворимые вещества (метаболиты), способные элиминироваться из организма (рис. 7).
Выделяют два основных вида превращения ЛС:
• метаболическую трансформацию;
• коньюгацию.
Метаболическая трансформация - это превращение веществ в результате окисления, восстановления, гидролиза.
Коньюгация - это бисинтетический процесс, сопровождающий присоединением к ЛВ, или его метоболитам ряда химических групп или молекул эндогенных соединений.
Метаболизм ЛС включает комплекс химических превращений в организме, подготавливающих выведение препарата и осущест- вляемый в двух направлениях:
• уменьшение растворимости ЛС в липидах;
• уменьшение биологической активности лекарственного препарата.
Метаболизм ЛС может происходить во всех тканях и жидких средах организма. Наиболее выраженные процессы разрушения веществ происходят в полостях и слизистых оболочках желудка и кишечника.
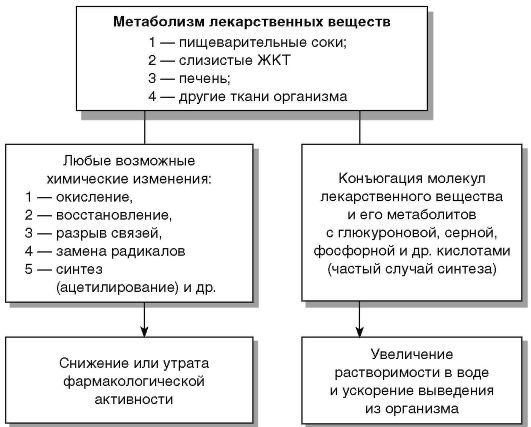
Рис. 7. Основные места и способы метаболизма лекарственных и токсических веществ в организме (схема)
Печень - основной орган, в котором происходит метаболизм ЛС. Кроме того, отдельные вещества могут подвергаться биотран- сформации в почках (например, имипенем), плазме крови и других тканях (например, в стенке кишечника).
Большинство ЛС в неизменном виде растворимы в липидах и, будучи слабыми органическими кислотами либо основаниями, не способны элиминироваться из организма. Например, при прохождении через почки (после фильтрации в почечных клубочках) они снова реабсорбируются клетками почечных канальцев. Метаболиты препаратов хуже растворимы в липидах, более растворимы в воде и менее ионизированы при физиологических значениях рН. Они в меньшей степени способны к связыванию с белками и фильтрации через клеточные мембраны, в меньшем количестве накапливаются в жировой ткани. Следовательно, метаболические превращения ЛС в большинстве случаев абсолютно необходимы. Их основная часть происходит в печени, где
препарат превращается в фармакологически неактивные или активные метаболиты.
Химические изменения ЛС могут быть несинтетическими и синтетическими. При несинтетических превращениях молекулы препарата изменяются посредством окисления преимущественно в микросомах печени, а также путём восстановления и гидролиза. В результате исходная фармакологическая активность ЛС может изменяться в сторону уменьшения, увеличения или полной утраты. При синтетических химических изменениях молекулы препаратов соединяются с другими веществами, в частности, с глюкуроновой (образование глюкуронидов), уксусной (ацетилирование), серной (с образованием эфиров) кислотами, глицином, аденозилметионином, глутатионом и др.
Микросомальные ферменты, участвующие в метаболизме ЛС, представлены оксидазами и монооксидазами со смешанными функциями, т.е. они могут принимать участие в различных реакциях. Индукцию ферментов, метаболизирующих препараты, может вызывать приём жирной пищи, кофе, чая (некоторые сосудорасширяющие средства), некоторых других препаратов, принимаемых одновременно (фенобарбитал, резерпин и др.), алкоголь и курение (теофиллин и др.). Низкобелковая пища, напротив, задерживает метаболизм ряда ЛС. Длительный приём одного и того же препарата иногда приводит к индукции ферментов, влияющих на него, при этом метаболизм ЛС может усилиться в 2-4 раза.
Ингибирование ферментов приводит к ещё более серьёзным последствиям, чем их индукция. Это избирательный процесс, происходящий при взаимодействии препаратов: ингибирование циметидином метаболизма пропранолола приводит к большей выраженности брадикардии при приёме последнего.
Экскреция лекарственных средств
Экскреция - выведение ЛС из организма.
ЛС экскретируются из организма после частичного или полного превращения в водорастворимые метаболиты; некоторые препараты выводятся в неизменном виде. Наиболее частый путь экскреции препаратов - с мочой (рис. 8). Другие пути элиминации лекарств - с жёлчью, выдыхаемым воздухом, слюной, потом, молоком, слезой и фекалиями.
Выведение веществ в значительной степени зависит от процесса их реабсорбции (обратное всасывание) в почечных канальцах.
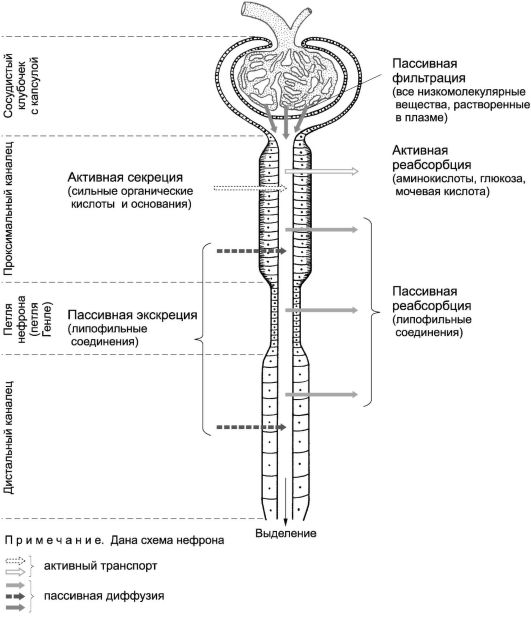
Рис. 8. Основные процессы, влияющие на выведение почками фармакологических веществ
Лекарственные средства реабсорбируются главным образом путем простой диффузии.
Почечная экскреция зависит от величины почечного клиренса, концентрации препарата в крови, а также от степени его связывания с белком.
Почечный клиренс ЛС - объём плазмы, который полностью очищается почками от препарата за единицу времени. Клиренс не
может превышать величину скорости клубочковой фильтрации (у взрослых мужчин - около 127 мл/мин). Если клиренс превышает её, то это означает, что часть ЛС дополнительно секретируется почечными канальцами (например, для бензилпенициллина почечный клиренс составляет 480 мл/мин). Если почечный клиренс постоянен, то скорость элиминации препарата прямо пропорциональна его концентрации в плазме крови.
Зависимость почечного клиренса от рН мочи подчиняется следующему правилу: у ЛС со свойствами оснований он тем выше, чем более кислая моча; у препаратов со свойствами кислот связь обратная. При заболеваниях почек, сопровождающихся нарушением их функций, некоторые ЛС и их метаболиты накапливаются (кумулируются) в крови, вызывая токсические симптомы.
Экскреция ЛС через кишечник. Через кишечник экскретируются два вида ЛС.
• Нерастворимые в липидах или ионизированные при рН кишечника молекулы, которые не абсорбируются через его слизистую оболочку и выделяются в неизменном виде либо перед выделением образуют комплексы с жёлчью, присутствующей в просвете кишечника (например, анионобменные смолы колестерамин, колестипол).
• Неионизированные молекулы (например, дигоксин), полярные вещества с молекулярной массой более 300 (например, гормоны, антидепрессанты, эритромицин), растворимые в воде. Многие ЛС и их метаболиты, попадая с жёлчью в ЖКТ, затем реабсорбируются и позже выделяются с мочой, что приводит к более длительному поддержанию их концентрации в крови. Препарат может попасть с жёлчью в жёлчный пузырь и задержаться в нём.
Экскреция со слюной. ЛС, экскретируемые со слюной, попадают в ротовую полость и обычно проглатываются, как и препараты, принятые внутрь. Слюна представляет смесь секретов околоушных, подчелюстных, подъязычных и других желёз, несколько различающихся по составу белков.
В отдельных случаях существует корреляция между концентрациями препарата, не связанного с белком, в крови и слюне. При быстром внутривенном введении прокаинамида его содержание в слюне сначала выше, чем в плазме, а затем постепенно изменяется. Концентрация препарата в слюне обычно не отражает таковую в плазме крови.
Экскреция через лёгкие касается не только летучих анестетиков, но в других случаях (например, в отношении сердечно-сосудистых препаратов) её значение невелико.
Экскреция с грудным молоком. Лекарственные вещества, содержащиеся в плазме крови кормящей матери, могут в небольших количествах экскретироваться с молоком и оказывать нежелательное влияние на грудного ребёнка. Грудное молоко отличается большей кислотностью, чем плазма крови. ЛС со свойствами оснований в большей степени ионизируются и накапливаются в нём, так же как и препараты с хорошей растворимостью в липидах. Количество средства, связанного с белками грудного молока, обычно в два раза меньше такового, связанного с белками плазмы. Необходимо учитывать, что новорождённого иногда докармливают коровьим моло- ком, в котором могут присутствовать антибиотики (бензилпенициллин и др.), способные вызвать аллергические реакции у ребёнка.
Кормящей матери противопоказан приём следующих сердечно-сосудистых препаратов: антикоагулянта непрямого действия фениндиона, антиаритмического средства амиодарона, ацетилсалициловой кислоты (при длительном приёме), β-адреноблокатора соталола (большинство других β-адреноблокаторов безопасны), мочегонных средств (некоторые подавляют лактацию) и глюкокортикоидов (например, при приёме преднизолона в дозе 10 мг/сут и более возможно развитие надпочечниковой недостаточности, но заместительная терапия безопасна).
Основные фармакокинетические параметры
• Константа выведения или элиминации (Kel) - служит для количественной оценки скорости выведения препарата из организма; измеряют в ч-1, мин-1.
• Период полувыведения (Т1/2) - показатель, характеризующий время, в течение которого в результате метаболизма и экскреции из плазмы крови исчезает половина введённого ЛС. Выражают обычно в часах, хотя для некоторых препаратов этот показатель составляет минуты или даже сутки. Период полувыведения имеет значение для построения схемы и режима дозирования ЛС и значительно варьирует в зависимости от пола, возраста, времени года, патологического состояния и прочих факторов.
• Объём распределения (Vd) - условная величина, характеризующая степень захвата препарата тканями из плазмы крови. Выражают в литрах и рассчитывают по специальным формулам.
В клинических условиях позволяет определить способность лекарств к депонированию (кумуляции) в организме, лежащему в основе передозировки и развития токсических эффектов. Служит для расчёта нагрузочной дозы препарата, требуемой для достижения необходимой концентрации ЛС в крови.
• Биодоступность - показатель, характеризующий степень всасывания ЛС из места введения в системный кровоток и накопления в нём в терапевтически значимой концентрации, а также скорость, с которой этот процесс происходит (выражают в процентах). Если ЛС в виде раствора ввести внутривенно, это обеспечит абсолютную биодоступность (100%). Изменение ЛФ, технологии производства, дозы или пути введения может оказать значительное влияние на биодоступность препарата. В этом случае говорят об относительной биодоступности, которую определяют для разных серий ЛС, при изменении технологии их производства или ЛФ, а также для препаратов, выпущенных различными производителями. Показатель относительной биодоступности имеет большое практическое значение. С ним связано весьма важное понятие клинической ФК - биоэквивалентность.
• Биоэквивалентность приобрела важное клиническое, фармацевтическое и экономическое значение с тех пор, когда в клинической практике стали отмечать существенные различия в терапевтической эффективности и безопасности препаратов-генериков, выпускаемых различными производителями, т.е. после регистрации случаев терапевтической неэквивалентности, обусловленной различной биодоступностью ЛС. Указанное обстоятельство заставило тщательно изучать эту проблему (особенно на стадии регистрации препаратов) с помощью исследований биоэквивалентности, проводимых на здоровых добровольцах. Лекарственные препараты называют биоэквивалентными, если они в сравниваемые интервалы времени обеспечивают одинаковую концентрацию действующего вещества в крови и тканях организма.
• Терапевтический мониторинг ЛС - совокупность лабораторных мероприятий, с помощью которых определяют концентрацию ЛС в крови и оптимизируют схемы их индивидуального дозирования в клинических условиях.
На концентрацию ЛС в крови влияют многие факторы. Их особенно трудно определить в клинических условиях при наличии
сопутствующих заболеваний, патологии печени и почек, нарушении всасывания препаратов, их низкой биодоступности, проведе- нии комбинированной ФТ и др.
Чаще всего терапевтический мониторинг проводят для ЛС с узким диапазоном терапевтических концентраций, способных вызывать опасные побочные эффекты (в результате передозировки) и назначаемых длительно. К ним относят препараты дигиталиса, противоаритмические и противосудорожные средства, антибиотики и др.
Использование фармакокинетических параметров лекарственного средства для поддержания постоянного фармакодинамического эффекта
Внутривенное введение. Время, необходимое для достижения плато концентрации, т.е. стационарного состояния, определяют константой скорости элиминации. Оно не зависит от скорости инфузии препарата. Если период полувыведения ЛС выражают в минутах, то при определённой скорости инфузии плато концентрации будет достигнуто через время, измеряемое в минутах, а если его выражают в часах, то и плато наступит через несколько часов.
Длительный приём внутрь. Среднюю величину стационарной концентрации ЛС определяют величинами общего клиренса и фактора доступности. Чем выше клиренс и чем ниже биодоступность, тем меньше будет средняя концентрация препарата в крови при назначенной схеме приёма внутрь.
Частота приёма препарата в пределах суточной дозы для поддержания его стационарной концентрации зависит от величины пе- риода полувыведения: если он короче 4 ч, ЛС следует принимать не менее четырёх раз в сутки, если 4-8 ч - три раза в день, если более 8 ч - два раза в день. Это правило неприменимо для специальных ЛФ пролонгированного действия (например, для нитратов), так как длительность поддержания концентрации препаратов в крови в этих случаях определяется не периодом полувыведения, а продолжительностью их замедленного высвобождения из ЛФ и последующего поступления в кровь.
Концентрация лекарственного вещества в крови и фармакологический эффект. Возможна различная связь этих параметров.
• Корреляция: по динамике эффекта (антигипертензивного, диуретического, антикоагулянтного, гипогликемического) применения препарата, определяемой количественно, можно судить об изменении его концентрации и принимать меры по
оптимизации лечения больного. В других случаях, наоборот, прибегают к мониторированию (слежению) концентрации препарата в плазме крови, чтобы сделать лечение более эффективным и безопасным:
- для предупреждения редких эпизодов обострения заболеваний (пароксизмы наджелудочковой или желудочковой аритмии);
- в случае невозможности быстро и достоверно количественно определить эффект при подборе оптимальной дозы препарата;
- если трудно различить границу между терапевтическим и токсическим эффектами, например по регистрации наджелудочковых аритмий во время приёма дигоксина и антиаритмических средств, способных также оказывать нежелательный проаритмический эффект (усиление, а не подавление аритмий);
- для контроля над соблюдением больным предписанного режима приёма препарата (приверженности больного назначенному лечению) и решения вопроса об эффективности назначенной дозы препарата;
- для уменьшения риска возникновения побочных эффектов при лечении препаратами с малым терапевтическим индексом;
- для лечения передозировки ЛС.
• Отсутствие корреляции: возможно в случаях, когда ЛС необратимо действует на ферменты и рецепторы, а восстановление их активности занимает несколько дней или недель, как, например, при приёме ингибиторов моноаминоксидазы, ацетилсалициловой кислоты (антитромбоцитарный эффект), некоторых антихолинэстераз или противоопухолевых препаратов.
• Слабая корреляция:
- значительная часть ЛС находится в связанном (фармакологически неактивном) состоянии (например, связь с белками плазмы), при этом общая концентрация препарата (неактивной связанной и активной свободной фракции) не коррелирует с его эффектом (необходимо раздельно определять указанные фракции препарата в плазме крови);
- препараты (например, лидокаин или дизопирамид) назначают больным в острой стадии воспалительного процесса,
при этом они связываются с α1-кислым гликопротеином, содержание которого в крови резко повышено;
- эффект препарата в значительной степени зависит от концентрации его активных метаболитов, содержание которых необходимо измерять раздельно (не всегда возможно при использовании радиоиммунологических методов, необходимо применять специальные методы раздельного химического анализа).
Факторы, количественно и качественно изменяющие эффект лекарственных средств
• Физиологические факторы:
- возраст - дети часто более чувствительны к изменениям водного, электролитного обмена и кислотно-щелочного баланса, вызываемым ЛС; пожилые больные могут необычно реагировать из-за нарушений распределения, инактивации и выведения препарата вследствие возрастных анатомических и физиологических изменений в организме, а также из-за сопутствующих заболеваний;
- пол - женщины (особенно во время беременности) могут быть более чувствительны к ЛС;
- хронестезия - циклические изменения чувствительности биологических систем организма к ЛС (циркадианные изменения - в течение суток; циркатригентантные - в течение месяца; цирканнуальные - в течение года);
- хронергия - изменения биологических системных эффектов (например, эффективности препаратов), подчиняющиеся определённому ритму; учёт хронергии позволяет определить время достижения оптимального эффекта (например, гормональных препаратов) при минимальном риске возникновения побочных явлений.
• Особенности индивидуальной ФК ЛС.
• Время введения ЛС в зависимости от приёма и характера пищи, влияния факторов внешней среды.
• Генетические факторы, влияющие на биологическую усвояемость и эффективность ЛС.
• Лекарственное взаимодействие при приёме нескольких препаратов.
• Сопутствующие патологические изменения в органах (печень, почки, ЖКТ).
• Чувствительность больного к ЛС.
• Приверженность больного лечению.
Контрольные вопросы
• Что такое ФК?
• Какое значение имеет ФК в лечении заболеваний внутренних органов?
• От чего зависит путь введения ЛС?
• Что такое абсорбция? Виды абсорбции.
• Перечислите факторы, влияющие на абсорбцию ЛС.
• Пути распределения ЛС в организме.
• С какими основными компонентами происходит связывание ЛС в организме?
• Что такое биотрансформация ЛС?
• Что такое экскреция ЛС?
• Перечислите основные пути экскреции, приведите примеры.
• Перечислите основные фармакокинетические параметры.
• От каких параметров зависит постоянный фармакологический эффект?
• Перечислите основные факторы, от которых зависит эффект ЛС?
1.3. ФАРМАКОДИНАМИКА
Цель
После изучения темы студент должен уметь оценивать действие лекарственных препаратов на пациента и знать:
• механизм действия ЛС;
• избирательность действия ЛС;
• дозирование ЛС;
• виды действия ЛС;
• взаимодействие ЛС;
• нежелательные эффекты ЛС;
• побочные действия ЛС;
• особенности применения ЛС.
ФД - раздел клинической фармакологии, изучающий механизмы действия ЛС (сущность процессов взаимодействия с ткане- выми, клеточными или субклеточными специфическими и неспецифическими рецепторами) и фармакологические эффекты (их содержание и изменения в зависимости от возраста, пола больного, характера и течения заболевания, сопутствующей патологии).
Выбор лекарственного препарата для лечения конкретного заболевания или синдрома основан не только на понимании его ме- ханизма действия, но и на знании особенностей фармакологических эффектов ЛС при патологических состояниях, свойственных разным возрастным группам больных.
Механизм действия лекарственных средств
Подавляющее большинство ЛС оказывает лечебное действие посредством изменения деятельности физиологических систем организма. Под влиянием лекарственных веществ в организме, как правило, изменяется скорость течения различных естественных процессов. Торможение или возбуждение приводит соответственно к угнетению или усилению соответствующих функций органов и тканей. В результате изменяется течение патологических процессов, послуживших причиной развития заболевания, нормализуются нарушенные функции, происходит регресс симптомов.
Выделяют следующие механизмы действия ЛС:
• действие на специфические рецепторы;
• влияние на активность ферментов;
• физико-химическое действие на мембраны клеток;
• прямое химическое (цитотоксическое) воздействие.
Действие лекарственных средств на специфические рецепторы
Рецепторы клеток - макромолекулярные структуры, обладающие избирательной чувствительностью к определённым химичес- ким соединениям. Взаимодействие ЛС с рецепторами вызывает биохимические и физиологические изменения в клетках и организме в целом, что приводит к развитию того или иного фармакологического эффекта.
В зависимости от действия на рецепторы вещества разделяют на:
• агонисты - вещества, прямо возбуждающие или повышающие функциональную активность рецепторов;
• антагонисты - вещества, препятствующие действию специфических агонистов или блокирующие рецепторы;
• вещества, обладающие одновременно свойствами агониста и антагониста (результирующий эффект зависит от исходной функциональной активности рецепторов).
Антагонизм к рецепторам может быть:
• конкурентным, если ЛС конкурирует с агонистами за одни и те же специфические рецепторы, при этом блокаду рецеп-
• тора, вызванную конкурентным антагонистом, можно устранить назначением больших доз агониста (препарата или естественного медиатора); неконкурентным, когда ЛС занимает другие участки макромолекулы, не относящиеся к специфическому рецептору. Следует учитывать, что количество рецепторов на поверхности клеток и их чувствительность непостоянны, неодинаковы и зависят от многих факторов (возраст, патологический процесс, повреждение тканей и др.), а также от влияния самих ЛС. Так, количество и (или) функциональная активность рецепторов могут уменьшаться при длительном использовании препаратов-агонистов, что сопровождается постепенным ослаблением фармакологического эффекта (толерантностью). Возможно увеличение количества и (или) усиление функциональной активности рецепторов под воздействием препарата-антагониста. Клинически это может манифестировать развитием синдрома отмены после резкого прекращения введения препарата.
Влияние лекарственных средств на активность ферментов
Некоторые ЛС усиливают или угнетают активность специфических ферментов (внутриклеточных или внеклеточных). Веду- щую роль в обеспечении функций клеток играет универсальная аденилатциклазная система клеток, и действие многих ЛС связано с активностью ферментов аденилатциклазы или фосфодиэстеразы, регулирующих концентрацию внутриклеточного циклического аденозинмонофосфата (цАМФ).
ЛС могут стимулировать или ингибировать ферменты, взаимодействовать с ними в разной степени, обратимо или необратимо, что влияет на выраженность и продолжительность фармакологического эффекта.
Физико-химическое действие лекарственных средств на мембраны клеток
Физико-химическое действие на мембраны клеток состоит в изменении трансмембранного электрического потенциала в результате влияния на транспорт ионов через мембрану клеток. Это имеет значение для деятельности клеток нервной и мышечной систем: нарушается проведение нервных импульсов через синапсы, подавляется электрическая активность клеток.
Таким образом действуют антиаритмические, противосудорожные препараты, средства для общего наркоза и местные анестетики.
Прямое химическое (цитотоксическое) воздействие лекарственных средств
ЛС могут непосредственно взаимодействовать с небольшими внутриклеточными молекулами или структурами, приводя к нарушению жизнедеятельности клеток.
Подобное действие оказывают антибактериальные препараты, противовирусные и цитостатические средства.
Действие ЛС может быть не связано с изменением функций клеток (например, нейтрализация соляной кислоты антацидны- ми средствами или действие масляных слабительных).
Избирательность действия лекарственных средств
Избирательность действия ЛС достигается посредством различного распределения и накопления препаратов в органах, тка- нях, клетках и селективности их механизма действия.
Селективность - способность оказывать определённый желаемый эффект и не вызывать другие нежелательные влияния благодаря действию на отдельные типы или подтипы рецепторов. Например, β-адреноблокаторы (метопролол, атенолол), антагонисты серотониновых рецепторов (кетансерин) действуют на определён- ный подтип соответствующих рецепторов, но селективность таких препаратов чаще всего относительна и при увеличении дозы тех же β-адреноблокаторов может отчасти утрачиваться. Другой подход к обеспечению относительной селективности действия препарата - избирательное введение соответствующей ЛФ в место желаемого действия (например, внутрикоронарное введение нитроглицерина больным с ИБС).
Нет ЛС, абсолютно избирательно действующих на тот или иной рецептор, орган или патологический процесс. Чем выше избира- тельность действия ЛС, тем оно эффективнее.
ЛС с низкой избирательностью действия влияют на многие ткани, органы и системы, вызывая множество побочных реакций. Каждый препарат имеет более или менее широкий спектр действия и может вызывать ряд желательных либо нежелательных реакций.
Например, морфин, обладающий выраженной анальгетической активностью, относят к группе наркотических анальгетиков. Вместе с тем он угнетает дыхание, подавляет кашлевой рефлекс, оказывает седативное действие, вызывает рвоту, запор, бронхоспазм, высвобождение гистамина, оказывает антидиуретическое действие и др.
Противоопухолевые средства, воздействуя на быстро делящиеся клетки, повреждают не только ткань опухоли, но и костный мозг, эпителий кишечника, провоцируя тяжёлые нежелательные реакции.
Чем выше избирательность действия ЛС, тем его лучше переносят больные и тем меньшее число нежелательных реакций оно вызывает.
Примером могут служить блокаторы Н2-рецепторов третьего поколения, блокаторы М1-холинорецепторов, ингибиторы Н+, K+-
АТФазы.
Избирательность действия ЛС зависит от его дозы. Чем она выше, тем менее избирателен препарат.
Так, селективные β1-адреноблокаторы преимущественно влияют на миокард, но при увеличении дозы они оказывают действие и на β2-адренорецепторы, расположенные в бронхах, сосудах, поджелудочной железе и других органах, приводя к развитию нежела- тельных реакций (бронхоспазма, вазоконстрикции).
Селективность действия противовирусных препаратов, например ацикловира, также зависит от дозы: подавление вирусной ДНК-полимеразы происходит при концентрациях препарата в 3000 раз меньших, чем те, которые влияют на ДНК-полимеразу клеток человеческого организма, поэтому ацикловир в терапевтических дозах нетоксичен.
Доза и дозовый режим
Действие ЛС в большой степени определяется его дозой. В зависимости от неё (концентрации) изменяется скорость развития эффекта, его выраженность, продолжительность и характер (рис. 9).
Виды доз лекарственных веществ
Известно, что действие лекарственного препарата на организм зависит от его химической структуры, физико-химических свойств и дозы. Последние по своим характеристикам, назначению и эффекту могут различаться.
Наименьшую дозу ЛС, после приёма которой возникает минимальный терапевтический эффект, называют пороговой или ми- нимальной терапевтической дозой. В медицинской практике для лечения больных используют так называемую среднюю терапевтическую (лечебную) дозу, после приёма которой у большинства больных наблюдают устойчивый терапевтический эффект.
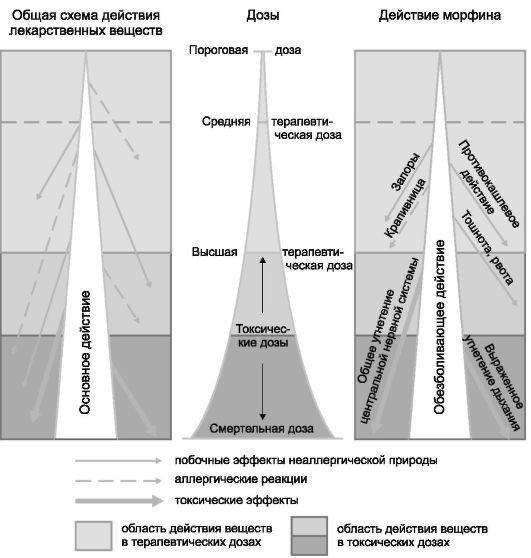
Рис. 9. Дозы, фармакотерапевтические и неблагоприятные эффекты лекарственных средств (в качестве примера приведены основные, побочные и токсические эффекты)
В ряде случаев эта доза оказывает недостаточный лечебный эффект и приходится прибегать к более высоким дозам, что небезопасно для организма. Именно поэтому для большинства ЛС установлены предельно допустимые дозы на один приём и приём в течение суток - высшая разовая доза (ВРД) и высшая суточная доза (ВСД).
ВРД лекарственного вещества - предельно допустимая доза, разрешённая для одного приёма. После её применения наблюдают наибольший лечебный эффект.
ВСД - предельно допустимая доза лекарственного вещества, разрешённая для приёма в течение суток.
Обычно ВРД и ВСД устанавливают для препаратов списка «А» (ядовитые и наркотические вещества) и «Б» (сильнодействующие вещества).
Диапазон доз ЛС от минимальной терапевтической до высшей разовой называют широтой терапевтического действия вещества. Чем она больше, тем менее токсичен препарат, и наоборот.
Кроме вышеперечисленных, известны другие дозы ЛС.
Токсическая доза - доза лекарственного вещества, вызывающая отравление без смертельного исхода.
Смертельная (летальная) доза - доза лекарственного вещества, приём которой приводит к смерти.
Курсовая доза - доза лекарственного вещества, предназначенная для проведения курса лечения.
В клинической практике чаще всего применяют следующие виды доз:
• однократная (разовая) доза - количество лекарственного вещества на один приём;
• суточная доза - доза, с помощью которой удаётся поддерживать терапевтическую концентрацию ЛС в плазме крови в течение суток;
• пробная доза - доза ЛС, с которой начинают лечение, учитывая, что в ряде случаев на приём некоторых препаратов развиваются непредвиденные реакции фармакодинамического (например, эффект первой дозы при применении празозина - резкое снижение артериального давления в положении стоя) или аллергического типов;
• насыщающая доза - доза, с помощью которой удаётся создать в тканях необходимую концентрацию ЛС (например, при лечении амиодароном, сердечными гликозидами);
• ударная доза - доза, позволяющая создать оптимальную тканевую (плазменную) концентрацию препарата, необходимую для его конкуренции с определённым эндогенным субстратом (например, ударная доза сульфаниламидов, необходимая для конкуренции с парааминобензойной кислотой за место в структуре молекулы фолиевой кислоты на этапе синтеза последней).
Дозовый режим - величина дозы (однократной или суточной) и частота введения ЛС в течение суток. Дозовый режим зависит от многих факторов, но наиболее важным из них считают период
полувыведения. Рациональный план ФТ предусматривает введение начальной терапевтической дозы с последующим приме- нением такой же дозы в интервалы, соответствующие периоду полувыведения ЛС. Для препаратов с очень коротким (бензилпенициллин - 30 мин) или длинным (дигитоксин - 9 дней) периодом полувыведения эти режимы не подходят, так как слишком частые введения обременительны, а редкие - вызывают значительные колебания плазменной концентрации препарата. Это снижает фармакологический эффект и повышает токсичность ЛС. В таких случаях прибегают к другим дозовым режимам. Если период полувыведения короткий, начальную дозу увеличивают так, чтобы она оставалась эффективной до окончания дозового интервала. Такой режим наиболее рационален при применении бензилпенициллина, так как его высокие начальные концентрации малотоксичны и только 0,3% дозы препарата остаётся в организме к концу обычного 4-часового дозового интервала. Препараты с низким терапевтическим индексом (отношение терапевтической дозы к токсической) и коротким периодом полувыведения (например, норэпинефрин) обычно назначают внутривенно капельно.
На дозовый режим заметно влияет функциональное состояние органов элиминации (печень, почки) и кровообращения. Изучение ФК антибиотиков у больных с почечной недостаточностью показало, что элиминация хлорамфеникола и эритромицина почти не изменяется, а гентамицин и стрептомицин выводятся значительно медленнее, поэтому частоту их введения необходимо снижать. При заболеваниях печени метаболизм ЛС замедляется, и препараты вводят реже.
Принципы дозирования лекарственных веществ в зависимости от возраста и массы тела
Действие лекарственных веществ на организм зависит от возраста. Известно, что дети и лица старше 60 лет более чувствительны к действию ЛС. Именно поэтому при определении доз ЛС обя- зательно принимают во внимание возраст больных. ВРД и ВСД ядовитых и сильнодействующих веществ для пациентов разных возрастных групп приведены в соответствующих таблицах Государственной фармакопеи. Для остальных ЛС дозы (в зависимости от возраста) рассчитывают исходя из дозы для взрослого (старше 25 лет), которую принимают за единицу (табл. 3).
Таблица 3. Расчет дозы лекарственного средства в зависимости от возраста
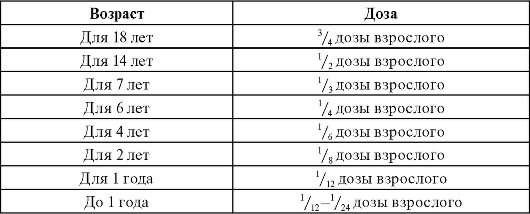
Для лиц старше 60 лет дозу лекарственного вещества (кроме антибиотиков, витаминов и сульфаниламидов) уменьшают до 2/3 или 1/2 дозы взрослого.
Особенности дозирования лекарственных средств у новорождённых
Несовершенство рецепторного аппарата новорождённых, выражающееся в его различной функциональной активности, приводит к большим индивидуальным колебаниям ответной реакции организма ребёнка на введение стандартных доз ЛС. Так, например, непрогнозируемые реакции на лекарственные препараты у новорождённых регистрируют в 3-5 раз чаще, чем у взрослых.
Таким образом, незавершённость развития организма ново- рождённых приводит к тому, что риск возникновения у них побоч- ных эффектов на приём ЛС существенно выше, чем у взрослых.
В настоящее время выделяют следующие механизмы, ответственные за формирование побочных эффектов ФТ у новорождённых.
• Токсические эффекты ЛС, обусловленные незрелостью ферментных систем, которые обеспечивают детоксикацию организма (например, токсический эффект витамина К, связанный с низкой активностью глюкозо-6-фосфатдегидрогеназы в эритроцитах).
• Токсические эффекты, связанные с особенностями взаимодействия ЛС с белками плазмы крови новорождённых (например, производные нитрофурана вытесняют билирубин из связи с белками, что приводит к повышению концентрации последнего в плазме крови и развитию желтухи).
• Токсические эффекты ЛС, обусловленные несовершенством выделительной функции почек у новорождённых.
• Токсические эффекты ЛС, вызванные генетически обусловленными дефектами ферментных систем у новорождённых.
• Токсические эффекты ЛС, вызванные извращённой реакцией организма новорождённого на препарат. Частота их возникновения у пациентов этой возрастной группы достигает 24,5%, у взрослых колеблется в пределах 6-17%.
Ввиду существенных различий в ФД ЛС у детей (особенно первого года жизни) и взрослых, простое пропорциональное возрасту уменьшение дозы при расчёте безопасной и эффективной дозы ЛС для ребёнка недопустимо, так как может привести к непредсказуемым последствиям (табл. 4).
Таблица 4. Зависимость дозы лекарственного средства от площади тела ребёнка
Ряд зарубежных авторов предлагают расчёт дозы ЛС на килограмм массы тела ребёнка. Например, правило Кларка:
доза для ребёнка = взрослая доза × масса ребёнка [кг] ÷ 70.
Этот метод вызывает определённые возражения, так как у многих детей (особенно младшей возрастной группы) объём жидкости в организме нестабилен и может способствовать уменьшению или увеличению массы тела. Именно поэтому доза ЛС, рассчитанная только на основании массы тела ребёнка, может оказаться как неэффективной, так и токсической.
Отечественными учёными разработано несколько схем расчёта доз ЛС для ребёнка с учётом массы его тела, возраста, функцио- нального состояния и др.
Для детей с нормальной массой тела дозу ЛС можно рассчитать по формуле

Если по этой формуле, например, рассчитать дозу наркотических анальгетиков для ребёнка первого года жизни, получится отрицательная величина, т.е. наркотические анальгетики детям этого возраста не назначают (соответствует действующим нормам).
Детям с избыточной массой тела или недостаточным питанием дозу ЛС целесообразно рассчитывать индивидуально, пользуясь для расчёта так называемым дозис-фактором. Для того чтобы рас- считать дозу ЛС с учётом дозис-фактора, необходимо дозу ЛС для взрослых пересчитать на
Таблица 5. Величина дозис-фактора в зависимости от возраста ребёнка
Например, необходимо рассчитать разовую дозу ацетилсалициловой кислоты для ребёнка в возрасте 8 лет с массой тела
При назначении детям различного возраста сильнодействующих и ядовитых ЛС, относящихся к списку «А» и «Б», медицин- ский работник обязан руководствоваться таблицей дозирования ЛС, опубликованной в Х Государственной фармакопее СССР. Дозу других ЛС, не относящихся к списку «А» и «Б», для детей рассчитывают следующим образом: ребёнку первого года жизни назначают 1/24-1/12 дозы взрослых, в возрасте одного года - 1/12 дозы взрослых, 2-3 лет - 1/8, 4-6 лет - 1/6 дозы, 6 лет - 1/4 дозы, 7 лет - 1/3 дозы, 8-14 лет 1/2 дозы, 15-16 лет - 3/4 дозы взрослых.
Следует понимать, что подбор дозы ЛС следует осуществлять строго индивидуально для каждого ребёнка. При этом необходимо учитывать как особенности его функционального развития и степень тяжести патологического процесса, так и особенности ФД и ФК конкретных ЛС. Также следует помнить, что доза ЛС для ребёнка, рассчитанная любым методом, не должна превышать таковую для взрослых.
Влияние индивидуальных особенностей организма на действие лекарственных средств
В эксперименте на животных было показано, что к ряду веществ (никотин, стрихнин) мужские особи менее чувствительны, чем женские. Кроме того, были отмечены различия в метаболизме ряда веществ, но клинически проблема зависимости действия ЛС от пола пациента исследована недостаточно.
Женщины, особенно во время беременности, могут быть более чувствительны к лекарственным препаратам.
Возраст
Чувствительность к ЛС меняется в зависимости от возраста. В связи с этим выделяют так называемую перинатальную фармако- логию, исследующую особенности влияния ЛС на плод на сроках
гестации от 24 нед до родов, и на новорождённого (до 4-й нед жизни). По чувствительности к ЛС плод в последние 3 мес гестации и новорождённые в первый месяц жизни существенно отличаются от взрослых. Это связано с недостаточной активностью многих ферментов, сниженной функцией почек, повышенной проницаемостью ГЭБ и недоразвитием ЦНС. Рецепторы в этот период жизни также обладают иной чувствительностью к ЛС. Например, ново- рождённые более чувствительны к некоторым веществам, влияющим на ЦНС (в частности, к морфину). Для них очень токсичен хлорамфеникол, применение которого может привести к смертельному исходу. Это объясняется тем, что печень новорождённых не синтезирует ферменты, необходимые для детоксикации препарата. Детям младшего возраста не следует назначать лекарственные вещества, усиливающие секрецию желёз (бронхиальных, слизистой оболочки носа и др.), так как они могут вызвать нарушения дыхания и послужить причиной развития патологии дыхательной системы.
В пожилом и старческом возрасте замедлено всасывание ЛС, менее эффективно протекает их метаболизм, снижена скорость экскреции препаратов почками. В целом чувствительность к большинству лекарственных препаратов в пожилом и старческом возрасте повышена, в связи с чем дозу необходимо снизить. При этом ассортимент лекарственных веществ следует ограничивать минимально токсичными средствами.
Изучение особенностей действия и применения ЛС у лиц пожилого и старческого возраста (гериатрическая фармакология) приобретает всё большее значение, так как доля пациентов этих возрастных групп среди населения значительно возросла.
Генетические факторы
Чувствительность к ЛС может быть обусловлена генетически. Это выражается как количественно, так и качественно. Например, при генетической недостаточности холинэстеразы плазмы крови длительность действия миорелаксанта суксаметония йодида резко возрастает и может достигать 6-8 ч и более (в обычных условиях препарат действует в течение 5-7 мин).
Известно, что скорость ацетилирования противотуберкулёз- ного средства изониазида варьирует довольно широко. Выделяют лиц с быстрой и медленной метаболизирующей активностью. Считают, что при отсутствии у пациентов генов, которые регулируют синтез фермента, обеспечивающего ацетилирование, происходит медленная инактивация препарата.
Известны примеры развития атипичных реакций на введение различных веществ (идиосинкразия). Например, противомалярийные препараты из группы 8-аминохинолина (примахин и др.) у лиц с генетической энзимопатией могут вызвать гемолиз (дефицит глюкозо-6-фосфатдегидрогеназы приводит к образованию хинона, который и обладает гемолитическим действием). Известны и другие вещества с потенциальным гемолитическим действием. К ним относят аминохинолины (примахин, хлорохин), сульфоны (дапсон), сульфаниламиды (сульфаниламид, сульфацетамид, сульфаметоксипиридазин), нитрофураны (фуразолидон, нитрофурантоин), ненаркотические анальгетики (ацетилсалициловая кислота) и другие вещества (налидиксовая кислота, хинин, хинидин, хлорамфеникол).
Исследование влияния генетических факторов на чувствительность организма к лекарственным веществам - основная задача специальной области фармакологии - фармакогенетики.
Функциональное состояние организма
Действие препаратов может зависеть от состояния организма, в частности - от сопутствующей патологии, на фоне которой их назначают. Так, жаропонижающие средства снижают температуру тела только при лихорадке (при нормотермии они не действуют). Действие сердечных гликозидов на кровообращение осуществляется только на фоне СН. Гипотензивный эффект ганглиоблокаторов тем более выражен, чем выше тонус симпатической нервной системы. При гиперфункции щитовидной железы повышается чувствительность миокарда к эпинефрину.
Значение суточных ритмов
Суточные ритмы имеют большое значение для функционирования организма. Общеизвестно, что чередование фаз бодрствования и сна существенно сказывается на активности нервной системы и эндокринных желёз и, соответственно, на состоянии других органов и систем. В свою очередь это отражается на чувствительности организма к различным веществам. Исследование зависимости фармакологического эффекта от суточного периодизма - одна из основных задач нового направления, названного хронофармакологией. Последняя включает хронофармакодинамику и хронофармакокинетику.
В зависимости от времени суток действие веществ может изменяться не только количественно, но и качественно. В большинстве
случаев наиболее выраженный эффект ЛС отмечают в период максимальной активности (у людей - в дневное время, у ночных животных - в тёмное время суток). Так, у человека болеутоляющее средство морфин более активно в начале второй половины дня, чем ранним утром или ночью. Обнаружены суточные колебания продукции эндогенных пептидов с анальгетической активностью (энкефалинов и эндорфинов). При стенокардии нитроглицерин более эффективен утром, чем во второй половине дня.
Токсичность веществ также в большой степени зависит от суточного периодизма. Так, при введении фенобарбитала в токси- ческой дозе животным в разное время суток летальность колеблется от 0 до 100%. Фармакологические параметры также зависят от суточных ритмов. В частности, наибольшее всасывание противогрибкового препарата гризеофульвина у человека регистрируют примерно в 12 ч дня. В течение суток изменяется метаболизм веществ (например, фенобарбитала). В зависимости от времени су- ток существенно трансформируются функция почек и их способность элиминировать фармакологические средства. Доказано, что у человека особенно большое количество амфетамина выделяется почками ранним утром, что, по-видимому, связанно с колебаниями рН мочи. Препараты лития при введении внутрь в меньшем количестве выделяются ночью, чем в дневное время.
Таким образом, ФД и ФК веществ зависят от суточного периодизма. К этому следует добавить, что сами ЛС могут влиять на фазы и амплитуду суточного ритма. Необходимо учитывать, что результат их взаимодействия с организмом в разное время суток может изменяться при различных патологических состояниях и заболеваниях.
Хотя объём сведений в области хронофармакологии весьма ограничен, значимость этих данных для рационального дозирования препаратов в зависимости от времени приёма не вызывает сомнений. Известно, что для физиологических функций опре- делённое значение имеют также сезонные ритмы, что, очевидно, сказывается на эффектах ЛС.
Алкоголь и табакокурение
Этиловый спирт способен оказывать выраженное действие на процессы метаболизма ряда ЛС, отличающееся при однократном и длительном применении. В первом случае он угнетает активность печёночных ферментов и замедляет биотрансформацию таких средств, как барбитураты, бензодиазепины, фенотиазиды, амитриптилин, сахароснижающие средства для приёма внутрь и
непрямые антикоагулянты. На этом фоне выраженность их эффекта возрастает. Кроме того, указанные препараты сами способны усиливать действие этилового спирта на организм.
Длительное применение этилового спирта (хронический алкоголизм), наоборот, сопровождается увеличением активности ферментов, участвующих в лекарственном метаболизме. Эффективность ФТ многими ЛС (барбитураты, бензодиазепины, парацетамол) при этом снижается.
При совместном применении ЛС (метронидазол, фуразолидон, хлорамфеникол и др.) с этанолом в результате угнетения биотран- сформации последнего может наблюдаться антабусный эффект. При этом в организме в избытке накапливается ацетальдегид (один из продуктов окисления этанола) и возникает интоксикация. Следует также иметь в виду, что при алкогольных поражениях печени метаболизм многих ЛС может нарушаться. При этом увеличивает- ся период полувыведения препаратов, что может приводить к их материальной кумуляции и передозировке.
Табакокурение (курение высушенных листьев табака) также влияет на ФТ. Компоненты табачного дыма (никотин, 3,4-бензи- перен и их производные) способны в значительной степени изменять биотрансформацию некоторых ЛС. Например, известно, что курение повышает скорость метаболизма пропранолола, теофиллина, хлорпромазина и диазепама.
Виды действия лекарственных средств
Характер действия лекарственных веществ на организм различен и зависит от многих факторов, в том числе и от свойств самого препарата.
Виды действия лекарственных веществ на организм и их краткие характеристики представлены в табл. 6.
Важнейшими характеристиками ЛС считают время действия препарата, быстроту наступления эффекта, его силу и продолжи- тельность. Во времени действия препарата выделяют:
• латентный период;
• период максимального действия;
• время удержания эффекта;
• время последействия.
Латентный период действия ЛС - время с момента приёма препарата до начала его терапевтического действия. Чем короче латентный период, тем быстрее препарат начинает действовать.
Таблица 6. Действие лекарственных веществ на организм
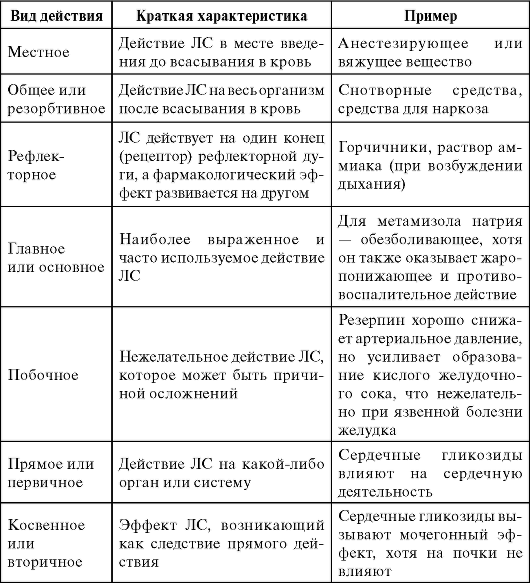
Период максимального действия ЛС - время, в течение которого в максимальной мере проявляется терапевтический эффект препарата.
Время удержания эффекта - показатель, определяющий частоту и длительность приёма препарата и связанный с особенностями его ФК.
Время последействия ЛС - время после прекращения приёма препарата, в течение которого в организме сохраняются функциональные изменения, вызванные его действием.
Быстрота, сила и продолжительность действия ЛС зависят от многих факторов, среди которых можно выделить основные:
• скорость введения и количество ЛС;
• функциональное состояние всего организма или органовмишеней.
Если функциональное состояние сохранено, при правильном подборе доз ЛС, как правило, достигают нужного терапевтического эффекта. В тех случаях, когда функциональное состояние организма или органов-мишеней в результате патологического процесса резко нарушено, реакция на ЛС может уменьшиться, отсутствовать или быть извращенной.
Взаимодействие лекарственных средств
Если одновременно используют два и более лекарственных веществ, принято считать, что они оказывают комбинированное действие, которое может протекать по типу синергизма или антагонизма (рис. 10).
Синергизм - взаимное усиление действия при одновременном применении ЛС. Он может быть суммарным (простое сложение эффектов) и потенциальным, когда совместный эффект лекарственных веществ усиливается в несколько раз. Примером синергизма служит совместное применение метамизола натрия и кофеина при головной боли.
Выделяют четыре вида синергизма ЛС:
• сенситизация или сенситизирующее действие ЛС;
• аддитивное действие ЛС;
• суммация эффекта;
• потенцирование эффекта.
Антагонизм - взаимное ослабление действия при одновременном применении ЛС. Например, антагонистами считают вяжущие и слабительные вещества, средства, снижающие артериальное давление (АД) и повышающие его.
Сенситизация - применение нескольких ЛС, обладающих различными, зачастую неоднотипными механизмами действия, усиливается фармакологическое действие лишь одного из препаратов, входящих в комбинацию.
Другим примером сенситизирующего действия ЛС может быть увеличение концентрации ионов железа в плазме крови при совместном назначении аскорбиновой кислоты и препаратов,
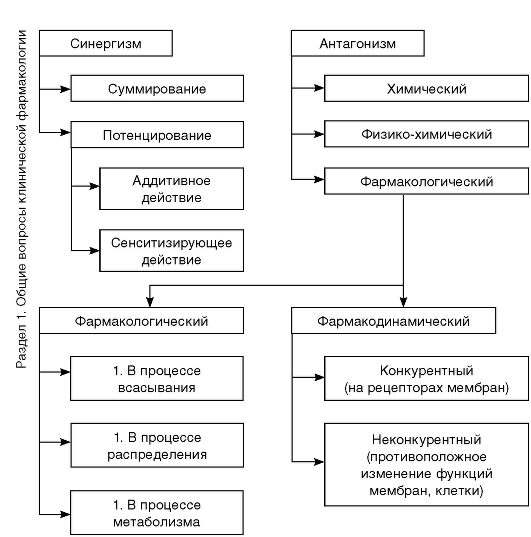
Рис. 10. Взаимодействие лекарственных средств (схема)
содержащих железо. Такой вид взаимодействия ЛС выражают формулой 0 + 1 = 1,5.
Аддитивное действие ЛС - вид взаимодействия, при котором фармакологический эффект комбинации ЛС больше, чем эффект каждого отдельного препарата, входящего в комбинацию, но меньше математической суммы их эффектов. Пример - терапевтический эффект от совместного назначения β2-адреномиметика сальбутамола и ингибитора фосфодиэстеразы теофиллина пациентам, страдающим бронхиальной астмой. Сальбутамол и теофиллин обладают бронхолитическим (бронхорасширяющим) действием. Такой вид взаимодействия ЛС выражают формулой 1 + 1 = 1,75.
Суммация эффектов ЛС - вид взаимодействия, при котором фармакологический эффект их комбинации равен математической сумме фармакологических эффектов каждого из совместно назначенных препаратов. Например, совместное назначение пациентам с СН двух мочегонных средств - этакриновой кислоты и фуросемида (относят к группе петлевых диуретиков, т.е. обладают близким механизмом действия) - приводит к суммации их мочегонного действия. Такой вид взаимодействия выражают формулой 1 + 1 = 2.
Потенцирование эффекта ЛС - вид взаимодействия, при котором фармакологический эффект комбинации ЛС больше математической суммы фармакологических эффектов каждого отдельного из одновременно назначенных препаратов (например, гипертензивный эффект комбинации глюкокортикоида преднизолона и α-адреномиметика норэпинефрина при шоке; бронхолитический эффект преднизолона и ингибитора фосфодиэстеразы аминофиллина при астматическом статусе). Такой вид взаимодействия ЛС выражают формулой 1 + 1 = 3.
При антагонизме ЛС в результате совместного применения нескольких препаратов ослабляется или блокируется фармако- логическое действие одного или нескольких средств, входящих в комбинацию. Например, при совместном назначении органических нитратов и β1-адреноблокаторов для лечения ИБС последние, блокируя β1-рецепторы сердца, препятствуют развитию рефлекторной тахикардии, вызываемой препаратами нитроглицерина. Такой вид взаимодействия выражается формулой 1 + 1 = 0,5.
В основе взаимодействия ЛС лежат четыре основных механизма, обусловливающих его основные типы:
• фармацевтическое (физико-химическое) взаимодействие;
• фармакодинамическое взаимодействие;
• физиологическое взаимодействие;
• фармакокинетическое взаимодействие.
Фармацевтическое (физико-химическое) взаимодействие лекарственных средств
Фармацевтическое (физико-химическое) взаимодействие ЛС - физико-химические процессы, происходящие при совместном применении препаратов до введения их в организм больного (в шприце, капельнице и др.), в месте инъекции и просвете ЖКТ. Например, при совместном применении раствора ингибитора
фосфодиэстеразы аминофиллина, антигистаминного препарата дифенгидрамина или аминофиллина и сердечного гликозида строфантина-К происходит образование белой взвеси.
Вследствие простого химического взаимодействия препаратов происходит реакция нейтрализации, в результате которой смешиваемые ЛС теряют свою фармакологическую активность.
Правильный подбор ЛС для совместного применения подразумевает тщательный учёт их совместимости. В табл. 7 приведены примеры несовместимых ЛС.
Таблица 7. Несовместимость лекарственных средств, применяемых для инъекций и инфузий (вливаний)
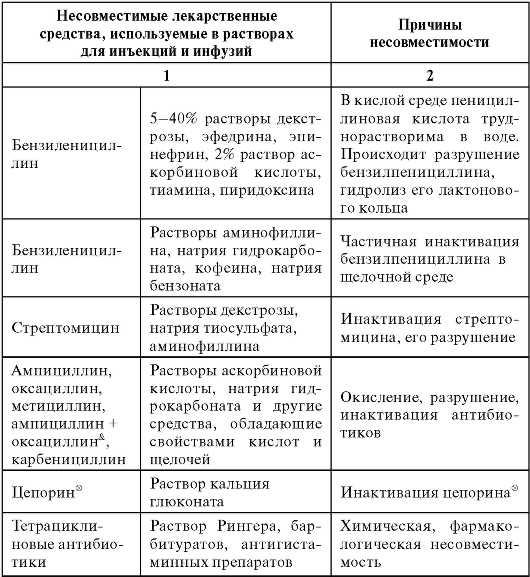
Продолжение табл. 7
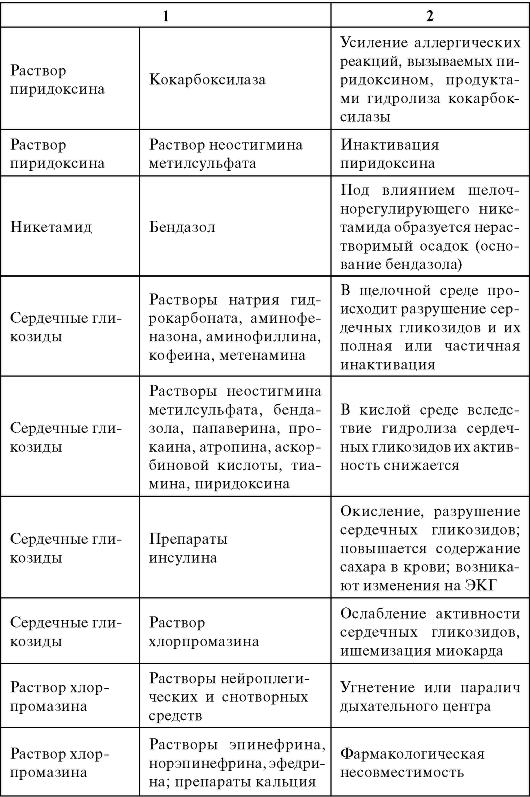
Окончание табл. 7
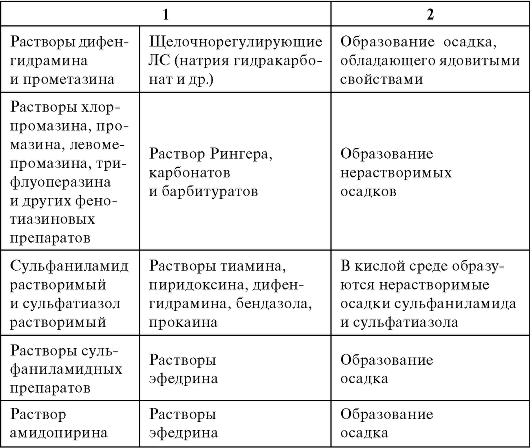
Физико-химическое взаимодействие может протекать без внешних признаков, но возможно образование осадка в растворах, изменение их цвета, выделение газа. Если смешивание веществ в одном шприце или капельнице сопровождается такими явлениями, следует отказаться от применения препарата или прекратить введение, если оно уже начато. К аминокислотам и жировым эмульсиям нельзя добавлять растворы натрия гидрокарбоната и маннитола.
Всасывание тетрациклинов, дигоксина и хлорпромазина нарушают антацидные средства, тетрациклинов - препараты, со- держащие соли висмута, железа. Препараты кальция образуют с тетрациклинами невсасывающиеся хелаты.
В настоящее время весьма распространено применение разнообразных энтеросорбентов, но следует помнить, что они адсор- бируют другие ЛС, в результате чего терапевтическая активность последних может снижаться.
Вероятность физико-химического взаимодействия можно существенно уменьшить, если тщательно планировать и соблюдать способ, время, последовательность и порядок введения препаратов.
Фармакодинамическое взаимодействие лекарственных средств
В результате фармакодинамического взаимодействия ЛС возможно развитие следующих процессов.
• Соревнование за рецепторы: возникает, если оба препарата действуют через одни и те же рецепторы.
• Влияние на субстанцию, выступающую в роли медиатора действия препарата. Например, гуанетидин истощает запасы норадреналина в симпатических нервах, поэтому снижается эффект симпатомиметических аминов, которые действуют на высвобождение эндогенного норадреналина при совместном применении с гуанетидином.
• Изменение чувствительности ткани к ЛС. Например, при назначении диуретиков, обладающих калийуретическим действием, увеличивается чувствительность миокарда к дигиталису и повышается его токсичность (вследствие потери миокардом калия).
• Усиление или снижение активности ЛС, т.е. аддитивного (потенцирующего) положительного или антагонистического эффекта при применении некоторых комбинаций препаратов. Например, при приёме комбинации из различных групп антиангинальных средств отмечают:
- положительный аддитивный антиангинальный эффект при сочетании пропранолола (β-адреноблокатор) с изосорбида динитратом или нифедипином (антагонист кальция);
- антагонистический эффект комбинации нифедипина с изосорбида динитратом.
Потенцирование эффекта от применения комбинации некоторых препаратов в одних случаях может оказать благоприятное действие, а в других - вызвать нежелательный эффект, связанный с возможностью развития побочных явлений.
Благоприятное взаимодействие ЛС отмечают, например, при комбинированном применении ряда гипотензивных средств с ди- уретиками, β-адреноблокаторов с периферическими вазодилататорами, салуретиков с калийсберегающими препаратами.
Неблагоприятное взаимодействие ЛС (6-10% случаев) манифестирует, например, повышением токсичности сердечных гли- козидов при их комбинированном применении с салуретиками.
Фармакодинамическое взаимодействие препаратов широко используют с целью получения оптимального терапевтического эффекта. Способность антигипертензивных средств усиливать действие друг друга - необходимое условие рационального лечения артериальной гипертензии (АГ). Комбинация ингибиторов АПФ с тиазидными диуретиками не только обеспечивает более мощное гипотензивное действие, но и предупреждает развитие гипокалиемии. В анестезиологии широко применяют комплекты лекарственных препаратов для потенцирования действия средств для наркоза и устранения их побочных эффектов.
В стационаре больной нередко получает до 4-10 препаратов и более одновременно, а в амбулаторных условиях - три ЛС и более. Количество назначаемых препаратов обычно зависит от тяжести состояния, характера основной патологии и наличия нескольких сопутствующих заболеваний, а также от продолжительности пребывания больного в лечебном учреждении. Нередко пациенты (иногда - не без участия врача) злоупотребляют приёмом снотворных, седативных, психотропных средств и антибиотиков.
Взаимодействие ЛС может начаться ещё на стадии, предшествующей проникновению в организм (фармацевтическое взаимо- действие), например, при их смешивании в растворах для внутривенного введения. Позднее они могут взаимодействовать на этапе от поступления в организм до всасывания из ЖКТ (во время него); после поступления в систему кровообращения и органы, где ЛС подвергаются метаболизму; в органах и тканях, где осуществляется их фармакологический эффект; во время элиминации.
В настоящее время ни у кого не вызывает сомнений, что эффективное лечение многих заболеваний (например, гипертонической болезни [ГБ], БА, язвенной болезни желудка, ревматоидного артрита и др.) возможно только при комбинированном применении ЛС.
Ввиду увеличения продолжительности жизни населения постоянно увеличивается число пациентов, страдающих сочетанной патологией, включающей два, три заболевания и более, что, соответственно, требует одновременного и (или) последовательного назначения нескольких ЛС.
Одновременное использование нескольких препаратов у одного пациента называют полипрагмазией. Она может быть ра- циональной, т.е. полезной для больного, и, наоборот, приносить ему вред.
Как правило, в практических условиях одновременное назначение нескольких ЛС для лечения одного заболевания преследует три основные цели:
• повышение эффективности лечения;
• снижение токсичности ЛС посредством уменьшения доз комбинируемых препаратов;
• предупреждение и коррекцию побочных эффектов ЛС.
При этом комбинируемые ЛС могут действовать на одни и те же звенья патогенеза или разные составляющие патологического процесса. Например, при лечении ГБ возможно применение комбинации блокаторов медленных кальциевых каналов (БМКК) и мочегонных средств. Первые обладают мощными вазодилатирующими (сосудорасширяющими) свойствами, в основном в отно- шении периферических артериол, снижают их тонус и тем самым способствуют снижению АД. Большинство мочегонных средств уменьшают АД путём усиления экскреции (выведения) ионов Na+ с мочой, снижения объёма циркулирующей крови (ОЦК) и внеклеточной жидкости и уменьшения сердечного выброса, т.е. две разные группы ЛС, воздействуя на различные звенья патогенеза ГБ, усиливают эффективность антигипертензивной терапии.
Примером комбинирования ЛС для предупреждения побочных эффектов может служить назначение нистатина для предупреждения развития кандидоза (грибковое поражение слизистых оболочек) при длительном лечении антибиотиками из группы пенициллина, тетрациклина, неомицина или применение препаратов, содержащих ионы К+, для предупреждения развития гипокалиемии на фоне лечения сердечными гликозидами пациентов с СН.
Фармакокинетическое взаимодействие лекарственных средств
После всасывания препараты могут взаимодействовать:
• во время распределения в депо, т.е. до связывания со специфическими рецепторами;
• при связывании с белками плазмы крови (образование неактивных комплексов);
• со специфическими рецепторами, ферментами, бактериями, вирусами и др.;
• во время биотрансформации в организме (метаболизм);
• во время элиминации (экскреции).
Фармакокинетическое взаимодействие чаще бывает неожиданным в отличие от фармакодинамического взаимодействия,
особенно в случаях, когда ФК препаратов недостаточно изучена. При фармакокинетическом взаимодействии один препарат трансформирует активность другого, изменяя его абсорбцию, распределение, связывание с белками плазмы крови, метаболизм или экскрецию.
Возможно влияние ЛС на моторику ЖКТ, кислотность желудочного содержимого, состояние кровообращения в органах пищеварения. От этого зависит всасывание других препаратов через ЖКТ. Так, повышение значений рН желудочного содержимого (снижение кислотности) на фоне приёма натрия гидрокарбоната, блокаторов Н2-рецепторов (ранитидин, фамотидин) или ингибиторов Н+, К+-АТФазы (омепразол) способствует существенному ослаблению всасывания антибиотиков тетрациклинового ряда. Метоклопрамид может снижать усвоение дигоксина, поскольку ускоряет его эвакуацию из зоны всасывания. Хорошо известно, что полнокровие слизистой оболочки ЖКТ, вызываемое этанолом, ускоряет всасывание аминофиллина.
ЛС могут вступать во взаимодействие при транспорте кровью и распределении в органах и тканях. Так, взаимодействуя с белками плазмы крови, некоторые НПВС вытесняют сульфаниламиды из связи с альбуминами и способствуют увеличению их свободной фракции. Дигоксин аналогичным образом может повышать кардиотоксичность хинидина.
Взаимодействие лекарственных средств и процессы биотрансформации
Какое бы благо ни приносил лекарственный препарат, организм от него всегда защищается как от чужеродного соединения - ксенобиотика. Важнейший механизм такой защиты - метаболизм ЛС. Один из ведущих органов, обеспечивающих биотрансформацию лекарственных препаратов, - печень. Различные ферменты печени метаболизируют ЛС, в результате чего вещества утрачивают активность (в конечном счете, всегда происходит инактивация, хотя на некоторых этапах могут образовываться активные метаболиты) и приобретают структуру, позволяющую организму активно выводить их.
Принципиально важно, что активность ферментов, метаболизирующих ЛС, может изменяться под влиянием ксенобиотиков. Возможно её повышение (индукция) и снижение (ингибирование). Лекарственные препараты, стимулирующие активность ферментов, называют индукторами микросомальных ферментов
печени, а снижающие - ингибиторами. При этом ЛС изменяют как собственный метаболизм, так и биотрансформацию ряда других препаратов.
Индукция ферментов метаболизма происходит постепенно, в течение 2-4 сут. При отмене применения индуктора ферментативная активность приблизительно в такие же сроки возвращается к исходной. Именно поэтому следует иметь в виду, что присоединение индуктора к другому ЛС приведёт к ускорению метаболизма и снижению фармакологического эффекта последнего. Если эффективную дозу препарата подбирали на фоне параллельного приёма средства-индуктора, его отмена повлечёт за собой избыточное действие первого препарата. Так, присоединение фенобарбитала к варфарину приведет к ослаблению антикоагулянтного эффекта последнего. С другой стороны, если дозу варфарина подбирали на фоне одновременного приёма барбитурата, отмена применения фенобарбитала будет способствовать возникновению признаков передозировки антикоагулянта. Не следует забывать, что некоторые препараты безрецептурного отпуска, а следовательно, часто применяемые больными с целью самолечения, могут содержать барбитураты (корвалол♠ и др.).
Выраженной способностью к индукции микросомальных ферментов печени обладает рифампицин, в связи с чем он ослабляет эффективность гормональных контрацептивов, противоэпилептических средств и варфарина.
Ингибиторы ферментов печени, напротив, снижают метаболизм других ЛС, поэтому последние накапливаются и могут ока- зывать токсическое действие. Например, эритромицин или ципрофлоксацин способствуют кумуляции теофиллина, особенно при использовании его ЛФ длительного действия. В итоге через 5-7 дней совместного применения противомикробных средств и теофиллина возникают признаки передозировки последнего.
Хорошо известно, что взаимодействие азатиоприна или меркаптопурина с аллопуринолом может оказаться фатальным для больного. Дело в том, что аллопуринол ингибирует ксантиноксидазу, которая метаболизирует и азатиоприн, и меркаптопурин, в результате чего оба средства накапливаются в организме и вызывают тяжелейшую интоксикацию.
Следует иметь в виду, что индукторы микросомальных ферментов печени могут повышать гепатотоксичность некоторых других ЛС. Так, фенобарбитал повышает вероятность токсическо-
го действия тетрациклинов на печень. Это объясняется тем, что в результате индукции ферментов могут накапливаться некоторые токсичные метаболиты, которые и оказывают повреждающее действие на гепатоциты.
Возможно взаимодействие ЛС на этапе выведения из организма. Экскреция почками многих лекарственных препаратов со свойствами кислот или оснований зависит от рН мочи. Если моча обладает кислой реакцией, из организма быстрее выводятся препараты со свойствами оснований (кодеин, морфин, хинидин). При ощелачивании мочи активнее выводятся препараты со свойствами кислот (барбитураты, салицилаты, сульфаниламиды, фенилбутазон и некоторые другие НПВС).
Некоторые ЛС элиминируются из организма посредством канальцевой секреции. Конкурируя за механизмы активного пере- носа, ЛС могут замедлять выведение друг друга. Так, канальцевую секрецию дигоксина нарушают такие средства, как спиронолактон, хинидин, амиодарон, верапамил, нифедипин, что может привести к развитию признаков гликозидной интоксикации.
Фармакокинетическое взаимодействие ЛС целесообразно контролировать с помощью лекарственного мониторинга. К со- жалению, в России лекарственный мониторинг с определением концентрации лекарственных препаратов в крови в клинической практике практически не используют, хотя в ряде стран это исследование относят к категории рутинных.
Нежелательные эффекты лекарственных средств
При проведении ФТ, к сожалению, нередко возникают нежелательные эффекты ЛС, но часть из них можно предупредить с по- мощью профилактики и коррекции.
Нежелательные эффекты - любые реакции на ЛС, возникающие при использовании препаратов для лечения, диагностики или профилактики заболеваний и причиняющие вред организму.
• Практически любое ЛС может вызвать нежелательные эффекты.
• Нежелательные реакции могут быть специфическими или повторять клинические симптомы заболевания.
• В 100% случаев пациенты должны быть осведомлены о возможных нежелательных реакциях на ЛС (особенно при длительной ФТ). В применении у детей о них должны знать родители.
• Все побочные реакции на ЛС должны быть зарегистрированы медицинским персоналом и подвергнуты тщательному анализу.
• Вероятность возникновения нежелательных эффектов особенно велика в группах риска: у детей раннего возраста и пожилых пациентов, больных с патологией органов биотрансформации, экскреции (печень, почки) и отягощённым анамнезом.
• На вероятность возникновения нежелательных эффектов ЛС могут оказать влияние такие факторы, как физико-химическое состояние ЛС (липофильность), полипрагмазия, путь введения лекарственного препарата, профессия пациента (фармацевты, медицинские сёстры) и особенности организма (индивидуальная чувствительность, генетическая детерминированность, возраст, пол, наличие вредных привычек, фоновых заболеваний).
По тяжести клинического течения нежелательные реакции можно разделить на:
• фатальные, т.е. способные привести к смертельному исходу (например, анафилактический шок);
• тяжёлые, требующие немедленной отмены ЛС и проведения коррекционных мероприятий;
• средней тяжести, не требующие коррекционных мероприятий (необходима лишь отмена ЛС, например, при крапивнице);
• лёгкие, не требующие отмены препарата (например, седативный эффект клонидина).
В большинстве случаев нежелательные эффекты зависят от концентрации ЛС в крови. При этом их содержание может соответс- твовать терапевтическому или токсическому уровню. Некоторым нежелательным эффектам не свойственна такая зависимость.
Задача медицинского персонала - предупредить возможность возникновения нежелательных эффектов:
• своевременно распознать (важно отличать их от симптомов заболевания);
• не допустить развития тяжёлых реакций и возникновения нового ятрогенного заболевания;
• исключить одновременное назначение токсических веществ подобного действия;
• при необходимости - отказаться от применения конкретного препарата.
Классификация нежелательных эффектов ЛС
• Нежелательные эффекты, возникающие при терапевтической концентрации препарата в плазме крови.
• Нежелательные эффекты, возникающие при токсической концентрации препарата в плазме крови.
• Нежелательные эффекты, возникновение которых не связано с концентрацией препарата в плазме крови.
Нежелательные эффекты, возникающие
при терапевтической концентрации препарата в плазме крови
Такие эффекты можно разделить на несколько групп: побочные эффекты, аллергические и псевдоаллергические реакции, ге- нетически детерминированные реакции, наркомании и синдром обкрадывания.
Побочные эффекты. Различают фармакодинамические и фармакокинетические побочные эффекты.
Фармакодинамические эффекты заложены в механизм действия ЛС; они первичны и служат признаком низкой избирательности действия препаратов (например, изопреналин возбуждает не только β2-, но и β1-адренорецепторы, что сопровождается тахикардией или аритмией).
Фармакокинетические эффекты вторичны и связаны со способностью ЛС оказывать определённое влияние на процессы био- трансформации экзогенных и эндогенных веществ. Так, индукторы микросомальных ферментов (барбитураты, рифампицин и др.) могут ускорять метаболизм гормонов, витаминов и приводить к гиповитаминозам. При длительном применении некоторых лекарственных веществ, например пропранолола, могут накапливаться фармакологически активные метаболиты, что создаёт условия для усиления ФД (брадикардия) средства.
Аллергические реакции. Некоторые ЛС могут взаимодействовать с белком, образуя комплексы, и этим придают ему антигенные свойства. Но чаще препараты, выступая в роли гаптенов, ковалентно связываются с белками и становятся истинными антигенами. Для возникновения аллергической реакции нужен период сенсибилизации, составляющий в среднем 10-14 дней. В ряде случаев период сенсибилизации протекает в скрытой форме (например, раньше больной получал бензилпенициллин вместе с консервированными продуктами) или имеет перекрёстный характер (например, ранее больному вводили цефалоспорины -
β-лактамные антибиотики из той же группы, что и пенициллины). В этих случаях аллергическая реакция может развиваться быстрее - через 3-5 дней или даже мгновенно. Особенно велика опасность возникновения аллергических реакций у людей с наследственной склонностью к ним.
Псевдоаллергические реакции характеризуются прямым влиянием ЛС на тучную клетку без синтеза антител. В отличие от аллергических реакций они дозозависимы; у больных, как правило, нет отягощённого аллергического анамнеза; кожные пробы и пробы in vitro отрицательны. Псевдоаллергические реакции могут быть вызваны ампициллином (особенно у детей с инфекционным мононуклеозом и цитомегалией), йодсодержащими рентгеноконтрастными веществами, местными анестетиками, миорелаксантами, ацетилсалициловой кислотой и другими лекарственными препаратами.
Генетически детерминированные реакции относят к истинной идиосинкразии (гиперчувствительность или непереносимость). Как и два предыдущих вида побочных эффектов, генетические реакции предугадать невозможно. Они связаны либо с наследственным дефектом ферментных систем, либо с наследственными болезнями обмена веществ.
Развитие психической и физической зависимости (наркомании) вызывают такие препараты, как опий и его алкалоиды (мор- фин, кодеин), тримеперидин и другие синтетические наркотические анальгетики, кокаин, амфетамин, этанол, некоторые барбитураты и др.
Синдром обкрадывания возникает при использовании сильных вазодилататоров (нитратов, БМКК и др.). При этом улучшается кровоток в неишемизированных участках и, наоборот, происходит отток крови от участка органа, где сосуды склерозированы. В результате могут возникать нарушения мозгового или коронарно- го кровообращения.
Нежелательные эффекты, возникающие
при токсической концентрации препарата в плазме крови
Токсические эффекты могут развиваться даже при незначительном увеличении концентрации препарата в плазме крови, возникшем в результате его кумуляции. Это особенно важно для препаратов с малой широтой терапевтического действия. При этом возникает опасность прямого токсического действия ЛС на
соответствующий орган-мишень. Например, аминогликозидные антибиотики вызывают нефро- и отоксичность, хлорамфеникол - гематотоксичность и др. Основные причины увеличения концентрации препаратов в крови - нарушение режима дозирования и незнание их ФК.
Существенная передозировка лекарственного препарата (отравление) - проблема особой области медицины - токсикологии. При токсическом воздействии могут возникать необратимые морфологические изменения в тканях и органах.
ЛС в терапевтических и токсических концентрациях способны вызвать эмбриотоксическое, тератогенное и фетотоксическое действие. Эти варианты нежелательного влияния могут быть следствием прямого токсического воздействия на плод, а также результатом нарушений гемодинамики в фетоплацентарной системе, гормонального, витаминного, углеводного, минерального балансов в организме беременной и плода.
Эмбриотоксический эффект возникает в первые 3 нед после оплодотворения, при этом неимплантированная бластоциста, как правило, погибает. Его могут вызвать гормоны (эстрогены, прогестагены, соматропин, дезоксикортон), антиметаболиты (меркаптопурин и др.), барбитураты, сульфаниламиды, антимитотические средства (колхицин и др.), фторсодержащие вещества, никотин и др.
Тератогенный эффект возникает в период с начала 4-й до конца 10-й недели беременности. Он заключается в нарушении дифференцировки тканей плода и возникновении аномалий внутренних органов и систем.
По степени опасности для человеческого плода различают три группы ЛС.
Первая группа - очень опасные для плода и поэтому абсолютно противопоказанные беременным препараты: талидомидp, андрогены, метотрексат и другие антифолиевые препараты, диэтилстилбэстрол и оральные гормональные противозачаточные средства.
Вторая группа - менее опасные препараты: противоэпилептические средства (фенитоин, фенобарбитал и др.), сахароснижа- ющие средства для приёма внутрь (толбутамид, глибенкламид и др.), цитостатики (хлорэтиламиноурацил, хлорамбуцил и др.).
Третья группа - препараты, вызывающие пороки развития в предрасполагающих к этому условиях (I триместр беременности,
возраст беременной, патология органов элиминации, дозы препарата и др.). Следует отметить, что ЛС этой группы широко применяют в клинической практике. К ним относят: антибиотики (хлорамфеникол, тетрациклины и др.), салицилаты, изониазид, имипрамин, галотан, антагонисты витамина К (этил бискумацетат, варфарин и др.), нейролептики и транквилизаторы, мочегонные средства, пропранолол и др.
Различные вещества чаще вызывают качественно похожие пороки развития. Всё зависит от того, в какие сроки беременности лекарственный препарат поступил в организм женщины.
Фетотоксический эффект - результат реакции созревающего или уже зрелого плода на ЛС. При этом реакция плода практически не отличается от таковой взрослого человека и может быть причиной развития тяжёлой патологии или даже гибели.
Следует отметить, что лекарства могут оказать влияние на плод ещё на стадии прогенеза, губительно воздействуя на размножение, трофику и функцию мужских и женских половых клеток, вызывая хромосомные аберрации или мутации генов. Именно поэтому при планировании беременности необходимо не менее чем за полгода исключить приём всех ЛС.
Нежелательные эффекты, возникновение которых не связано с концентрацией препарата в плазме крови
Нежелательные эффекты, возникновение которых не связано с концентрацией препарата в плазме крови, относят к биологическим вторичным нежелательным эффектам:
• дисбактериоз - качественное и количественное изменение состава естественной микрофлоры кишечника (его крайнее выражение - суперинфекция);
• гиповитаминоз;
• угнетение иммунитета и снижение реактивности макроорганизма.
Особое место среди нежелательных эффектов ЛС занимают синдром отмены, синдром рикошета и лекарственная зависимость.
Синдром отмены - развитие отрицательного фармакодинамического действия при резкой отмене ЛС после курсового лечения в течение нескольких месяцев или недель.
Синдром рикошета - возвращение выраженных симптомов заболевания, по поводу которого препарат был назначен, после резкого прекращения его приёма.
Лекарственная зависимость - патологическая потребность в приёме ЛС (как правило - психотропных), направленная на предупреждение развития синдрома абстиненции или нарушений психики при резком прекращении применения препарата. Выделяют психическую и физическую лекарственную зависимость. Психическая зависимость - состояние пациента, характеризующееся немотивированной потребностью в приёме какого-либо ЛС (чаще - психотропного) с целью предотвращения психического дискомфорта вследствие прекращения применения препарата, не сопровождающегося развитием абстиненции. Физическая зависимость - состояние пациента, характеризующееся развитием синдрома абстиненции вследствие прекращения приёма ЛС или в результате введения его антагониста. Абстиненция (абстинентный синдром) - состояние пациента, возникающее после прекращения приёма какого-либо психотропного ЛС и характеризующееся беспокойством, депрессией, потерей аппетита, спастическими болями в животе, головной болью, дрожанием, потливостью, слёзотечением, чиханием, «гусиной» кожей, повышением температуры тела и др.
Лекарственная устойчивость - отсутствие эффекта от приёма ЛС, не преодолеваемое увеличением дозы и сохраняющееся даже при назначении такой дозы препарата, которая всегда вызывает побочное действие. Механизм развития этого феномена не всегда ясен. Не исключено, что в его основе лежит не устойчивость организма пациента к какому-либо ЛС, а снижение индивидуальной чувствительности к препарату, обусловленное генетическими или функциональными особенностями конкретного больного.
Парамедикаментозное действие ЛС обусловлено не их фармакологическими свойствами, а эмоциональной (психогенной) реакцией пациента на тот или иной препарат. Например, больной длительно принимал антагонист ионов кальция нифедипин, выпускаемый фирмой AWD (Германия) под названием «коринфар♠». В аптеке, где он обычно покупал этот препарат, средства, выпускаемого фирмой AWD, не оказалось, и пациенту предложили нифедипин под названием «адалат♠», выпускаемый фирмой Bayer (Германия). Его приём вызывал у пациента сильное головокружение, слабость и другие симптомы недомогания. В этом случае можно говорить не о собственно побочном действии нифедипина, а о парамедикаментозной, психогенной реакции, которая возникла у пациента подсознательно в связи с нежеланием поменять коринфар♠на аналогичный препарат.
Эффекты лекарственных средств при повторном применении
При повторном применении действие ЛС может усиливаться или уменьшаться. Усиление эффекта препарата, как правило, связано с его кумуляцией (накоплением).
Кумуляция характерна для длительно действующих препаратов, медленно элиминирующихся из организма, например для сердечных гликозидов.
Накопление ЛС при длительном применении может привести к возникновению токсических эффектов. Для их предотвращения необходимо постепенно уменьшать дозу, увеличивать интервалы между приёмами ЛС или делать перерывы в лечении.
Толерантность
Эффективность некоторых ЛС (гипотензивных, анальгетиков, слабительных и др.) со временем снижается и развивается толе- рантность (привыкание). Толерантность к лекарственным препаратам бывает:
• относительной (развивается при изменении ФК ЛС, т.е. в результате уменьшения всасывания, увеличения скорости биотрансформации и выведения, вследствие чего снижается концентрация препарата в плазме крови);
• абсолютной (не связана с уменьшением концентрации ЛС в плазме крови, а возникает в результате изменения его действия на уровне клетки, например, в связи со снижением чувствительности рецепторов).
Так, длительное назначение β2-адреномиметиков больным с БА может сопровождаться ослаблением их бронходилатирующего действия, вызванным уменьшением количества и снижением чувствительности β2-адренорецепторов в бронхах.
Длительное применение нитратов в высоких дозах также приводит к ослаблению их антиангинального действия.
Уменьшение эффективности противомикробных средств связано с развитием устойчивости микроорганизмов.
При относительной толерантности дозу препарата необходимо увеличить. При абсолютной толерантности повышение дозы не приводит к усилению эффекта, поэтому требуется замена одного препарата другим с иным механизмом действия. Быстрая толерантность (тахифилаксия) может развиться уже ко второму введению препарата (например, при применении эфедрина).
Для предупреждения нежелательного действия ЛС необходимо учитывать особенности организма больного, по возможности назначать препарат в низких, но достаточных для получения терапевтического эффекта дозах, внимательно наблюдать за его действием и переносимостью.
Эффективность и переносимость ЛС, их дозирование и продолжительность применения зависят от особенностей патологического процесса и его динамики, которые оценивают при помощи объективных критериев. Внедрение новых инструментальных, лабораторных и морфологических методов, а также использование вычислительной техники значительно расширило возможности количественной оценки действия лекарственных препаратов медицинским работником.
Назначая ЛС, следует хорошо представлять, какое действие он оказывает при конкретном заболевании (этиотропное, патогене- тическое, симптоматическое), изменения каких субъективных и объективных симптомов, лабораторных показателей, функциональных параметров и в какие сроки следует ожидать, когда и какие дополнительные исследования необходимо проводить.
Побочные действия препаратов можно разделить на две основные группы побочных реакций:
• реакции типа А наблюдают у всех больных при увеличении дозы препарата. Они обусловлены избыточностью обычного, т.е. известного фармакологического действия ЛС. Частоту возникновения и тяжесть таких реакций можно уменьшить правильным использованием ЛС: тщательным отбором больных и исключением тех, у кого высок риск развития побочного действия; назначением в начале лечения малых доз; постепенным увеличением разовой и суточной дозы, а для ряда препаратов - их постепенной отменой; использованием комбинаций с другими препаратами, нейтрализующими побочные реакции избранного ЛС;
• реакции типа Б регистрируют у небольшого числа больных. Их относят к проявлениям обычных фармакологических свойств препарата, вызванным необычными (часто очень опасными) реакциями на ЛС организма отдельных больных. Последние можно предсказать только с помощью дорогостоящих и потому практически недоступных для многих больных специальных тестов (методов). К этому типу относят побочные действия на препарат, обусловленные генетическими
особенностями больного и его иммунологических реакций на конкретный препарат или родственные ему вещества. Чувствительность отдельных групп больных к препаратам различна. Среди них выделяют лиц с непереносимостью ЛС (например, с идиосинкразией, т.е. качественно необычной реакцией на лекарственный препарат, обусловленной генетическими аномалиями), пациентов с обычной реакцией и лиц с повышенной устойчивостью к нежелательным реакциям.
В этой связи при условии знания показаний и противопоказаний, побочных действий препарата, точного диагноза основного и сопутствующих заболеваний можно предупредить возникновение побочных действий типа А и, особенно, типа Б, и выделить группы больных с высоким риском их развития:
• дети раннего возраста (особенно недоношенные и новорож- дённые), пожилые пациенты (следует учитывать, что паспортный возраст может не соответствовать биологическому) и беременные;
• больные с поражением органов, осуществляющих биотрансформацию и экскрецию ЛС;
• больные с отягощённым анамнезом;
• больные, длительно получающие ЛС;
• больные, получающие одновременно более четырёх препаратов.
У этих категорий больных ФД и ФК ЛС непредсказуема. При диагностике побочные действия делят на три категории: определённые, возможные и сомнительные.
• Определённые:
- развиваются на фоне приёма препарата, по времени возникновения совпадают с развитием его действия и по характеру соответствуют представлениям о побочном действии ЛС;
- исчезают после отмены препарата;
- вновь возникают при его повторном назначении.
• Возможные:
- развиваются на фоне приёма препарата, по времени возникновения соответствуют развитию его действия, а по характе- ру соответствуют представлениям о побочном действии ЛС;
- исчезают после отмены препарата.
• Сомнительные:
- возникают во время приёма препарата и исчезают, несмотря на продолжение лечения им;
- возникают на фоне приёма препарата и исчезают после его отмены, но причинная связь нежелательного эффекта с приёмом препарата сомнительна. Синдром отрицательного последействия - развитие отрицательной фазы фармакодинамического эффекта после первоначального положительного действия одной дозы препарата. Он развивается, например, после приёма внутрь эффективной дозы нитроглицерина пролонгированного действия в таблетках, спустя 4 ч после фазы положительного действия. При этом во время последующих повторных физических нагрузок, когда в крови уже нет терапевтической концентрации препарата, в течение опре- делённого времени возникают более выраженные эпизоды ишемии, чем предшествующие приёму препарата. Развитие этого синдрома возможно при нерегулярном приёме препаратов в течение суток.
Парадоксальный эффект - обострение тех симптомов заболевания, для устранения которых назначено ЛС. Например, у опре- делённой части больных антиаритмические средства могут вызвать увеличение частоты возникновения нарушений ритма; некоторые антигипертензивные средства могут вызвать гипертензивную реакцию; антиангинальные средства иногда способны увеличить частоту или выраженность эпизодов ишемии миокарда.
Другие необычные реакции больного на лекарственные средства
Гиперреактивность - обычная реакция больного на применение необычно низкой дозы ЛС.
Гиперчувствительность - повышенная реакция больного на применение обычной дозы препарата.
Гипореактивность - обычный эффект препарата при приёме очень больших доз.
Иммунность - толерантность к препарату, возникающая в ре- зультате образования антител к нему.
Методы оценки эффективности и безопасности применения лекарственных препаратов
Достаточно информативные критерии эффективности и безопасности использования препаратов с указанием их временных и качественных характеристик - одна из важных задач КФ. К со- жалению, далеко не для всех ЛС такие критерии разработаны, что связано с целым рядом объективных причин.
Можно выделить несколько групп критериев, используемых в настоящее время на практике.
• Лабораторные: определение концентрации препарата в крови; клиническое исследование крови, мочи и др.; копрограмма; определение биохимических, бактериологических и иммунологических показателей и т.д.
• Параклинические (инструментальные): ЭКГ, ЭхоКГ, ЭЭГ, рентгенография, фиброгастроскопия, спирометрия и др.
• Клинические: учёт динамики состояния больного и нежелательных реакций на препарат.
Оценку вышеназванных критериев при длительном применении препаратов следует осуществлять до, в начале и во время лечения. При изменении режима дозирования и использовании препаратов с малой широтой терапевтического действия проведение такого контроля крайне необходимо.
Выбор препарата для проведения рациональной ФТ должен быть основан только на знании клинико-фармакологической характе- ристики (ФД, ФК, взаимодействия и нежелательных эффектов) ЛС.
Качество жизни как критерий действия лекарственных средств
Качество жизни - совокупность параметров, отражающих изменения течения жизни и включающих физическое состояние, психологическое, социальное и духовное благополучие, социальные отношения и функциональные способности.
Один из аспектов клинической оценки действия ЛС - определение их влияния на качество жизни больных. В большинстве случаев эти изменения не столь значительны, но и они могут повлиять на результаты лечения.
Определение качества жизни особенно важно при хронических заболеваниях (АГ, ревматоидный артрит, СД, ИБС, БА), требующих постоянного лечения на протяжении длительного времени.
Эксперты ВОЗ предложили следующее определение: «Здоровье - состояние полного физического, умственного и социального благополучия, а не только отсутствие болезни». Оно послужило основой для формирования современных представлений о качестве жизни. Большинство исследователей считают качество жизни интегральным показателем, включающим несколько компонентов:
• функциональное состояние (работоспособность, толерантность к физической нагрузке, выполнение домашней работы);
• симптомы, связанные с заболеванием и (или) его лечением (боль, одышка, побочные эффекты ЛС - тошнота, сухость во рту, отёки, выпадение волос);
• психическое состояние (депрессия или возбуждение, которые могут быть следствием собственно заболевания или результатом применения ЛС);
• социальная активность, половая функция, удовлетворение медицинской помощью и др.
Существуют различные методы оценки качества жизни. Одни из них применимы к больным с любыми заболеваниями, другие - только к пациентам с определённой патологией.
Оценка динамики качества жизни больными носит субъективный характер и зависит от многих факторов. Среди них можно назвать особенности характера (в том числе - тип высшей нервной деятельности), медицинскую информированность (знание разнообразной патологии), социальные обстоятельства, воспитание и др.
С понятием качества жизни неразрывно связано ещё одно понятие - приверженность к лечению (compliance). Если больному предписан сложный режим приёма препарата (неудобные часы и путь введения, зависимость от приёма пищи), он может не выполнять его, что ухудшит результаты лечения. Напротив, полностью соблюдая предписанную схему приёма, пациент значительно улучшит качество своей жизни.
Самая частая причина нарушения приверженности к лечению - большая кратность приёма ЛС в течение суток, поэтому её уменьшение до 1-2 раз позволяет не только обеспечить выполнение врачебных рекомендаций, но и улучшить качество жизни.
Особенности применения лекарственных средств
Применение лекарственных средств у лиц пожилого и старческого возраста
Рациональная ФТ лиц пожилого и старческого возраста, несомненно, позволяет не только существенно продлить их жизнь, но и улучшить её качество. Вместе с тем именно у пожилых людей частота осложнений, возникающих после проведения лекарственной терапии, по сравнению с пациентами в возрасте 30-50 лет, увеличивается в 1,5-2 раза. Более того, максимальное число летальных (смертельных) исходов, обусловленных нерациональным назначе- нием ЛС, приходится на пациентов в возрасте 80-90 лет.
С чем же связано увеличение частоты развития побочных эффектов, вызванных приёмом ЛС, у лиц пожилого возраста? Таких факторов много, но основными из них считают следующие:
• изменение функционального состояния основных органов и систем;
• изменение метаболизма (обмена веществ);
• стойкое повышение чувствительности к ЛС, во многом обусловленное их длительным приёмом;
• увеличение числа сочетанных заболеваний, требующее одновременного назначения большого количества ЛС;
• трудности в соблюдении режима приёма ЛС пожилыми людьми.
Большинство ЛС люди пожилого возраста, впрочем, как и пациенты других возрастных групп, принимают внутрь, но при назначении им препаратов следует учитывать, что у пожилых больных, даже не страдающих заболеваниями ЖКТ, присутствует прогрессирующая с возрастом гипокинезия различных отделов желудка и кишечника. Желудок у них в большинстве случаев удлиняется и приобретает так называемую форму крючка, причём его нижний полюс опускается ниже верхнего уровня костей таза. Такое расположение органа приводит к снижению его эвакуаторной функции и, как следствие, - к замедлению перемещения ЛС в тонкую кишку. Торможение эвакуации лекарственного препарата из желудка в тонкую кишку (место максимальной абсорбции большинства ЛС) приводит к более медленному нарастанию его концентрации в плазме крови и снижению терапевтического эффекта.
О феномене задержки эвакуации из желудка у пожилых людей следует помнить при назначении ЛС с коротким периодом полу- выведения, кислотонеустойчивых препаратов (например, антибиотиков из группы пенициллинов), а также препаратов, которые в значительной степени метаболизируются в тонкой кишке (например, противопаркинсонических препаратов из группы леводопы).
В том случае, когда пожилой пациент с замедленной эвакуаторной функцией желудка получает ЛС с коротким периодом полувыведения, его концентрация в крови может не достигать терапевтической ввиду медленного нарастания содержания препарата в плазме крови и быстрой элиминации. Назначение пожилым пациентам с задержкой опорожнения желудка кислотонеустойчивых ЛС может быть неэффективным ввиду инактивации (разрушения) последних соляной кислотой. Приём пациентом с замедленной
эвакуаторной способностью желудка ЛС, в значительной степени метаболизирующегося в стенке тонкой кишки, может быть неэффективным в связи с тем, что препарат практически полностью инактивируется в её стенке и, следовательно, попадает в кровь в очень низкой концентрации.
Всасывание ЛС у пожилых пациентов (особенно в возрасте старше 80 лет) замедляется при подкожном и внутримышечном введе- нии. В этом случае замедление абсорбции препаратов связано как с замедлением скорости кровотока, так и с уменьшением проницаемости стенок капилляров. Именно поэтому при этих способах введения следует учитывать, что эффект ЛС может манифестировать несколько позже и менее интенсивно, чем у молодых пациентов.
Применение лекарственных средств в период беременности
Лечение беременных - наиболее сложная проблема КФ, с которой приходится сталкиваться медицинским работникам вне зависимости от профиля их деятельности. При этом основной и наиболее сложный вопрос - соотношение пользы и риска при назначении того или иного ЛС. Это во многом обусловлено тем, что организм беременной функционирует как единая система мать- плацента-плод.
Медицинские работники, безусловно, обязаны знать этот раздел КФ, так как, согласно некоторым статистическим данным, новорождённый уже имеет контакт в среднем с восемнадцатью лекарственными препаратами, а у одной трети из них обнаруживают побочные реакции на ЛС, которые во время беременности принимали их матери. Более того, у 3-5% новорождённых обнаруживают пороки развития, обусловленные повреждающим дей- ствием лекарственных препаратов на плод.
Сложность этой проблемы усугубляется тем, что женщина могла принимать ЛС ещё до того, как узнала о беременности, т.е. в первые 2-3 нед с момента зачатия, а некоторые препараты влияют на процессы формирования и функционирования половых клеток отца и матери ещё до наступления беременности.
В связи с вышеизложенным медицинский работник должен рассматривать каждую пациентку детородного возраста как потенциальную беременную. Только в этом случае риск токсического воздействия ЛС на организм матери и плода можно свести к минимуму, а женщина может получить своевременную рекомендацию о необходимости применения противозачаточных средств
при прохождении курса лечения препаратами, обладающими потенциально возможным повреждающим действием на плод. В тех случаях, когда женщина уже беременна, медицинский работник обязан объяснить ей возможный риск и пользу применения ЛС и только после этого, с её согласия, назначить тот или иной препарат. Это необходимо не для снятия ответственности за возможные неблагоприятные последствия лечения с медицинского работника, а для того, чтобы беременная максимально внимательно выполняла рекомендации и в случае возникновения каких-либо отклонений от нормы (например, уменьшение или усиление двигательной активности плода или появление выделений из влагалища) сразу обратилась в специализированное медицинское учреждение.
Группа А - ЛС, которые большое количество беременных и женщин детородного возраста принимали без каких-либо доказа- тельств их влияния на частоту возникновения врождённых аномалий или повреждающего действия на плод.
Группа В - ЛС, которые ограниченное количество беременных и женщин детородного возраста принимали без каких-либо доказательств их влияния на частоту возникновения врождён- ных аномалий или повреждающего действия на плод. При этом в исследованиях на животных не установлено увеличение частоты повреждений плода или такие результаты получены, но не доказана их связь с приёмом препарата.
Группа С - ЛС, которые в исследованиях на животных продемонстрировали тератогенное или эмбриотоксическое действие. Существует предположение, что они могут оказать обратимое повреждающее воздействие на плод или новорождённых (обусловленное фармакологическими свойствами), но не вызывают возникновения врождённых аномалий. Контролируемые исследования на людях не проводились.
Группа D - ЛС, вызывающие или подозреваемые в том, что они могут вызвать врождённые аномалии или необратимые повреждения плода. Следует соотносить риск для плода с потенциальной пользой от применения лекарственного препарата.
Группа X - ЛС, применение которых сопровождается высоким риском возникновения врождённых аномалий или стойких повреждений плода, поскольку существуют доказательства их тератогенного или эмбриотоксического действия на животных и человека. Эту группу лекарственных препаратов не следует применять во время беременности.
Повышение чувствительности или уязвимости тканей плода к токсическому действию ЛС обусловлено тем, что в его быстро рас- тущих органах происходит множественное деление клеток. В этот период токсическое действие ЛС на организм плода может реализоваться в разрушении межклеточных сочленений, деформации клеток и даже в прекращении их роста. После рождения ребёнка это может выразиться дефектами развития конкретных органов и тканей организма и (или) задержкой общего и психического развития. Доказано, что чем меньше срок беременности, т.е. чем менее развит эмбрион, тем большее повреждающее действие на него оказывают ЛС. Исходя из этого выделяют критические периоды жизни плода, в которые он наиболее чувствителен к повреждающему действию ЛС.
• С момента зачатия по 10-й день (токсическое действие ЛС в этом периоде, как правило, приводит к гибели плода).
• С 11-го по 28-й день (период органогенеза). В этот период регистрируют собственно тератогенное (способное вызвать нарушения внутриутробного развития плода, приводящие к аномалиям развития) действие ЛС. Конкретный вид порока развития обусловлен сроком беременности (гестации), т.е. органом или функциональной системой, формирующейся в период токсического воздействия ЛС. В подавляющем большинстве случаев после окончания формирования органа или функциональной системы лекарственный препарат уже не оказывает на них собственно тератогенного действия.
• С начала 4-й до начала 9-й нед. Как правило, ЛС уже не оказывают собственно тератогенного действия, но высок риск задержки развития (роста) плода.
• С 9-й нед до окончания беременности (плодный период). В это время ЛС обычно не вызывают задержки развития органов и тканей плода, но в результате их токсического действия возможны нарушение функций органов и систем ребёнка в постнатальном периоде и реализация различных поведенческих аномалий.
• Период, непосредственно предшествующий родам, или собственно роды. Неоправданное применение ЛС в это время может ухудшить течение неонатального периода (от момента рождения до 28-го дня жизни ребёнка). Например, назначение резерпина непосредственно перед родами может привести к обструкции дыхательных путей, анорексии и смерти но- ворождённых.
Применение лекарственных средств у кормящих матерей
Секрецию молока в физиологических условиях контролирует гормон передней доли гипофиза - пролактин. Скорость его вы- работки регулируют нейросекреторные структуры гипоталамуса, которые синтезируют специальные вещества, стимулирующие (пролактолиберин) или тормозящие (пролактостатин) высвобождение пролактина.
На молокообразование существенное влияние оказывает кровоснабжение молочных желёз, которое в определённой мере регу- лируют такие гормоны, как соматотропин, адренокортикотропин, инсулин и др. Объёмный кровоток в молочной железе в 400-500 раз превышает объём продуцируемого ею молока и очень чувствителен к концентрации катехоламинов (адреналин, норадреналин) в плазме крови. Увеличение их содержания приводит к снижению объёмной скорости кровотока в молочной железе и, следовательно, к угнетению секреции молока. Отделение последнего происходит при помощи расположенных вдоль молочных ходов миоэпителиальных клеток, активность которых регулирует гормон задней доли гипофиза окситоцин.
Естественно, что ЛС, влияющие на функцию желёз внутренней секреции, трофику и кровоснабжение молочной железы, могут стимулировать или угнетать её молокообразующую функцию.
Гиполактия (пониженное молокообразование) может быть первичной (вызвана недостаточной выработкой гормонов, регулирующих секреторную функцию молочных желёз) и вторичной (развивается на фоне какого-либо заболевания).
Для лечения первичной гиполактии обычно применяют синтетические гормоны, стимулирующие секреторную функцию молочной железы (лактин♠, демокситоцин и др.), или ЛС, стимулирующие секрецию пролактина (метоклопрамид, амисульприд и др.).
Лечение вторичной гиполактии, как правило, комплексное и направлено на основное заболевание и восстановление лактации.
Необходимо отметить, что, помимо приёма ЛС, при лечении гиполактии кормящая мать обязательно должна соблюдать режим сна и отдыха, рационально и полноценно питаться, обязательно ежедневно употреблять не менее
В тех случаях, когда необходимо подавление лактации, применяют такие ЛС, как бромокриптин, лизуридp, оральные гормональные контрацептивы и др.
Не менее важной медицинской проблемой считают вопрос о применении кормящими матерями ЛС для лечения соматических или психических заболеваний. В настоящее время постоянно растёт количество женщин, страдающих хроническими заболеваниями и нуждающихся в постоянном приёме одного или нескольких препаратов во время беременности и всего периода кор- мления ребёнка грудью. Сложность этой проблемы обусловлена тем, что большинство ЛС, применяемых кормящими матерями, выделяются с молоком и могут оказать повреждающее действие на организм ребёнка (в том числе существенно повлиять на его психический статус).
Кроме того, некоторые лекарственные препараты могут влиять на кровоснабжение молочных желёз, секрецию пролактина, окси- тоцина и других гормонов, что может уменьшить или полностью подавить лактацию. К таким препаратам относят средства, содержащие эстрогены и прогестерон, эпинефрин и норэпинефрин, симпатомиметик эфедрин, петлевой диуретик фуросемид, препарат для лечения паркинсонизма леводопу и др.
Лекарственные препараты проникают в молоко только в тех случаях, когда они не связаны с белками плазмы крови, т.е. при- сутствуют в ней в свободном активном состоянии. Как правило, их относительная молекулярная масса не превышает 200. В большинстве случаев экскреция ЛС в молоко осуществляется посредством пассивной диффузии. Способностью к ней обладают лишь неионизированные малополярные липофильные молекулы ЛС. Вследствие того, что рН молока (6,8) меньше, чем рН плазмы крови (7,4), препараты, молекулы которых являются слабыми основаниями, в большей степени способны накапливаться в молоке, чем ЛС, молекулы которых являются слабыми кислотами. Незначительное количество препаратов может экскретироваться в молоко посредством активного транспорта и пиноцитоза. Вследствие того, что молоко - жировая эмульсия, некоторые ЛС могут накапливаться в его липидной фракции в более высокой концентрации, чем в плазме крови.
Как правило, ребёнку с молоком поступает 1-2% дозы лекарственного препарата, принятого матерью, но этого количества ЛС достаточно, чтобы оказать повреждающее действие на его орга-
низм. Помимо концентрации препарата в молоке матери, существенное значение имеет функциональное состояние ЖКТ ребёнка. ЛС, присутствующие в грудном молоке в высоких концентрациях (например, аминогликозиды), при нормальном состоянии слизистой оболочки кишечника ребёнка практически не всасываются. При её воспалительных изменениях такие препараты активно абсорбируются в кишечнике и оказывают на организм ребёнка повреждающее действие.
Необходимо чётко понимать, что существует множество индивидуальных особенностей функционирования организма матери и ребёнка и слишком большое количество неизвестных или непредсказуемых факторов, способных влиять на экскрецию ЛС в молоко и их абсорбцию ЖКТ ребёнка. Именно поэтому, назначая лекарственные препараты кормящим матерям, медицинский работник должен придерживаться следующего правила: по возможности попытаться заменить ЛС, хорошо проникающее в молоко, на препарат аналогичного действия, плохо или вообще не проникающий в него и не оказывающий повреждающего влияния на организм ребёнка. Если такого препарата не существует, проводить ФТ следует только в тех ситуациях, когда ухудшение состояния здоровья матери может нанести больший вред ребёнку, чем назначенное ей ЛС.
В тех случаях, когда назначение ЛС необходимо, для максимального уменьшения повреждающего действия на ребёнка при- ём следует производить во время кормления или сразу же после него, так как при этом максимально снижается концентрация ЛС в молоке матери. В случае приёма один раз в сутки препарат рационально принимать вечером, а ночное кормление грудью заменить молоком, сцеженным перед приёмом ЛС.
Необходимо объяснить матери, что без консультации с медицинским работником ЛС принимать не следует. Кроме того, её нужно проинформировать о том, что при возникновении первых, даже незначительных, изменений состояния ребёнка, при- ём назначенного препарата и кормление грудью следует временно прекратить во избежание накопления ЛС и развития тяжёлых осложнений. Кормление грудью и приём лекарственных препара- тов можно возобновить лишь после консультации со специалистом и получения однозначного ответа на вопрос о том, что более вредно для здоровья ребёнка: ухудшение состояния матери или приём ею ЛС.
В тех случаях, когда лечение необходимо, а лекарственный препарат, выделяясь с молоком, может оказать вредное влияние на организм ребёнка, необходимо перейти на искусственное вскармливание.
Лекарственные средства, противопоказанные к применению у кормящих матерей
Кормящим матерям противопоказаны некоторые ЛС. В случае необходимости их применения грудное вскармливание на период лечения следует прекратить.
• ЛС, действующие на ЦНС:
- снотворные препараты из группы барбитуратов (барбитал, пентобарбитал и др.);
- муколитические препараты (ацетилцистеин, карбоцистеин).
• Гормональные ЛС:
- глюкокортикоиды (бетаметазон, гидрокортизон);
- препараты инсулина.
• Противомикробные ЛС:
- антибиотики из группы пенициллина (ампициллин, бакампициллин, бензилпенициллин, карбенициллин, клоксациллин, оксациллин, пиперациллин);
- антибиотики-карбапемены (имипенем + циластатин);
- аминогликозиды (амикацин, неомицин);
- антибиотики-макролиды (цинка ацетат + эритромицин);
- синтетические противомикробные препараты (пипемидовая кислота);
- нитрофураны (нитрофурал, нитрофурантоин, фуразидин, фуразолидон);
- противотуберкулёзные препараты (изониазид, метазид, пиразинамид, опиниазид, фтивазид, этионамид);
- противопротозойные препараты (тинидазол, хлорохин);
- противогрибковые препараты (амфотерицин В, клотримазол, натамицин, нистатин);
- противовирусные препараты (ремантадин).
• Витамины (за исключением жирорастворимых витаминов А и D) в высоких дозах.
Применение лекарственных средств у новорождённых
ФД и ФК ЛС в организме новорождённого (особенно недоношенного) в значительной мере отличаются от таковых не только у взрослых, но даже у грудных детей, вышедших из неонатального
периода. На протяжении последнего ФД и ФК ЛС могут меняться ежедневно и к его концу или приближаются к показателям, харак- терным для взрослого человека, или значительно от них отличаются.
Особенности введения лекарственных средств
Особенности внутривенного введения ЛС в первые часы жизни ребёнка. ЛС новорождённому чаще вводят внутривенно, относительно реже - внутримышечно и подкожно, но, исходя из особенностей его состояния, препараты можно вводить внутрь, ингаляционно или ректально.
При проведении реанимационных мероприятий только что родившемуся ребёнку рационально использовать для внутривенного введения ЛС пупочную вену. При этом до 50% препаратов через венозный проток попадают в системный кровоток, минуя печень, а 50% - в систему воротной вены и далее - в печень, т.е. подвергаются пресистемной элиминации. Следует помнить, что венозный проток функционирует недолго и уже через 10-15 мин после рождения ребёнка возникает его спазм, а кровоток через него резко уменьшается. При необходимости длительной инфузии желательно ввести полихлорвиниловый катетер ниже пупочного кольца на глубину 5-6 см в пупочную вену. Таким образом, его дистальный конец проходит через венозный проток и проникает в нижнюю полую вену. Катетер перед введением заполняют 0,9% раствором хлорида натрия, а место его введения и прилегающую кожу обрабатывают раствором антибактериального препарата (лучше - мазью). Длительность инфузии ЛС через пупочный катетер - не более нескольких часов с момента рождения, после чего для введения препаратов используют другие вены.
Особенности внутривенного введения ЛС. Выбирая вену для инфузии, следует учитывать, что препараты, введённые через вены кожи головы, очень быстро попадают в сосуды малого круга кровообращения, особенно в тех случаях, когда открыты артериаль- ный проток и овальное отверстие. Необходимо подчеркнуть, что инфузия ЛС в вены кожи головы ребёнка, особенно недоношенного, сопровождается изменением реоэнцефалограммы, что косвенно свидетельствует о возможном нарушении мозгового кровотока. Именно поэтому для этих целей желательно использовать вены, расположенные в складках кожи у локтя и предплечья, реже - сосуды подмышечной области.
Внутривенное введение ЛС (даже болюсное) следует проводить медленно, со скоростью не более 1-2 мл/мин, чтобы не вызвать
гиперволемию и не создать очень высокие концентрации препаратов в плазме. Последние могут оказать токсическое влияние на печень и сердце, дестабилизировать систему свёртывания крови и др. Новорождённым не следует вводить внутривенно гипертонические растворы, так как они могут повредить эндотелий сосудов, нарушить функции ГЭБ и вызвать развитие внутримозговых геморрагий.
Особенности внутримышечного и подкожного введения ЛС.
Внутримышечное введение новорождённым назначают редко, обычно в тех случаях, когда внутривенное введение препаратов по каким-либо причинам невозможно. При его проведении следует учитывать тот факт, что ввиду нестабильности гемодинамики у новорождённых (особенно при патологии сердечно-сосудистой системы, нарушении дыхания, гиповолемии, токсикозе) ЛС могут накапливаться в месте инъекции, создавая в мышце депо препарата. При восстановлении кровотока ЛС начинает быстро высвобождаться из депо, в результате чего его концентрация в плазме крови резко возрастает и может достичь токсических величин.
Подкожное введение ЛС новорождённым используют ещё реже, так как вероятность создания лекарственных депо в этом случае значительно выше. Кроме того, подкожные инъекции могут вызвать у ребёнка сильную боль, что, естественно, отрицательно скажется на его состоянии.
Особенности ингаляционного введения ЛС. Ингаляционный способ введения ЛС новорождённым чаще всего применяют для лечения заболеваний лёгких (например, для профилактики и лечения респираторного дистресс-синдрома недоношенных детей). В этом случае обычно используют колфосцерила пальмитат - препарат, снижающий тенденцию альвеол к коллапсу (спадению). Препарат действует местно, т.е. на лёгочную ткань, но ингаляционный способ введения можно использовать для получения резорбтивного (системного) эффекта (например, при ингаляции кислорода или проведении ингаляционного наркоза).
При ингаляционном введении ЛС следует учитывать, что слизистая оболочка дыхательных путей новорождённых легкорани- ма, и распылённые во вдыхаемом воздухе препараты могут вызвать её раздражение, гиперемию, повреждение и др. Например, ингаляция новорождённым кислорода в высокой концентрации вызывает повреждение альвеол.
Особенности интраназального введения ЛС. Есть сообщения о высокой эффективности интраназального введения липофильных ЛС детям. Например, для премедикации перед наркозом эффективно интраназальное введение снотворного ЛС мидозолама. В этом случае требуется меньшая доза препарата, а эффект развивается быстрее, чем при внутримышечном или ректальном способе введения.
Особенности трансдермального введения ЛС. В отличие от взрослых у детей (особенно новорождённых) ЛС достаточно легко всасываются через кожу, т.е. при трансдермальном способе введения. Это связано с тем, что кожа новорождённых обладает тонким роговым слоем и очень хорошо кровоснабжается. При этом подкожная жировая клетчатка у этой категории больных практически отсутствует. Всё это приводит к тому, что ЛС, нанесённые на кожу новорождённого, легко и быстро всасываются в кровь и могут достичь концентрации, опасной для жизни ребёнка. Так, например, применение спиртовой настойки йода для обработки кожи ново- рождённых (особенно недоношенных) может сопровождаться её быстрой абсорбцией и резким повышением концентрации йодидов в плазме крови, что, в свою очередь, может повлечь за собой угнетение секреторной функции щитовидной железы. Не менее опасно применение у новорождённых присыпок, содержащих борную кислоту. Их применение в неонатальном периоде сопровождается быстрым всасыванием борной кислоты и резким увеличением её концентрации в тканях и органах (особенно в почках).
Интоксикация борной кислотой манифестирует рвотой, тошнотой, падением АД, судорогами, возникновением скарлатино- подобной сыпи. В литературе описано более сотни летальных исходов, вызванных применением присыпок, содержащих борную кислоту.
Особенности приёма ЛС внутрь. Новорождённым ЛС обычно вводят внутрь в виде водных растворов и суспензий. Используя этот способ применения препаратов, необходимо учитывать особенности их всасывания в ЖКТ. У новорождённых (особенно не- доношенных) существенно снижена секреция соляной кислоты, замедлена эвакуаторная способность желудка. Длительное пребывание ЛС в нём может способствовать более полному всасыванию и, следовательно, повышению концентрации препаратов в плазме крови. Время пребывания ЛС в кишечнике новорождённых трудно предсказать, так как перистальтика у них нестабильна и далеко не всегда связана с приёмом пищи. Необходимо отметить, что у
новорождённых в период до и после кормления скорость всасывания лекарственных препаратов замедляется.
В настоящее время доказано, что на поверхности слизистой оболочки ЖКТ имеется слой связанной воды, который в опре- делённой мере регулирует скорость всасывания, и чем он толще, тем хуже протекает процесс активного и пассивного всасывания веществ. Считают, что у новорождённых в связи с высоким содержанием воды в организме толщина слоя связанной воды на поверхности слизистой оболочки кишечника больше, что замедляет процесс всасывания ЛС.
При лечении новорождённых следует учитывать, что гиперосмолярные растворы многих ЛС (даже сахарозы♠) могут вызвать у них развитие некротического энтероколита.
На скорость всасывания препаратов влияют патологические процессы в ЖКТ. Так, например, при стеаторее существенно за- медляется скорость всасывания жирорастворимых витаминов А и D, а при кишечном инфантилизме (дистрофическом заболевании тонкой кишки, сопровождающемся остеопорозом и склонностью к перелому трубчатых костей и рёбер) - антибиотика цефалоспоринового ряда цефалексина и др.
Особенности ректального введения ЛС. Ректальный способ введения препаратов достаточно прост и удобен, но у новорождённых ЛС, введённое ректально, может удерживаться в просвете кишки в течение разного времени, что, естественно, сказывается на объёме его всасывания и концентрации препарата в плазме крови. Необходимо отметить, что слизистая оболочка прямой кишки ново- рождённых очень нежная, и препараты могут вызвать её раздражение и воспаление.
Гидрофильные препараты, обладающие низкой связью с белками, легко распределяются во внеклеточной жидкости и также быстро из неё выводятся, при этом их концентрация в плазме крови незначительна. При дегидратации, когда объём внеклеточной жидкости резко снижается, концентрация водорастворимых ЛС в плазме может резко возрастать, вследствие чего возможно развитие побочных эффектов.
У новорождённых проницаемость ГЭБ для липофильных ЛС существенно повышена. Это приводит к тому, что такие сильно- действующие препараты, как, например, наркотические анальгетики, накапливаются в тканях головного мозга в более высоких концентрациях, чем у детей старшего возраста, и, следовательно,
увеличивается риск манифестации их токсических эффектов. Именно поэтому для лечения новорождённых наркотические анальгетики практически не применяют.
Контрольные вопросы
• Что такое ФД?
• Перечислите механизмы действия ЛС.
• Что подразумевают под термином «фармакологический эффект»
ЛС?
• Перечислите факторы, определяющие фармакологический эффект.
• Какими путями достигают избирательности действия ЛС?
• Виды действия ЛС на организм и его системы.
• Основные характеристики действия ЛС.
• Что означает термин «прямое действие» ЛС?
• Понятие дозы и дозового режима.
• Какие дозы ЛС чаще всего применяют для лечения больных?
• Что положено в основу расчёта доз ЛС?
• Понятие «терапевтическая широта».
• Какие лечебные дозы различают по величине?
• Что такое разовая, суточная, курсовая дозы?
• Дозирование ЛС в зависимости от возраста.
• Виды взаимодействия ЛС.
• Что такое синергизм и антагонизм?
• Что такое полипрагмазия?
• Что такое нежелательные эффекты ЛС и от чего они зависят?
• Какие нежелательные реакции чаще всего возникают у пациента?
• Какие бывают побочные действия ЛС?
• Что такое толерантность и передозировка, от чего они зависят?
• Что такое синдром рикошета и синдром обкрадывания?
• Что такое кумуляция и чем она опасна?
• Что такое идиосинкразия?
• Почему во время беременности применять ЛС следует с большой осторожностью?
• Укажите основные особенности организма, от которых зависит действие ЛС.