Общая неврология А.С. Никифоров, Е.И. Гусев - 2007г. - 720 с
|
|
|
|
ГЛАВА 16 СПЕЦИАЛЬНЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ В НЕВРОЛОГИИ
16.1. ОБЩИЕ ПОЛОЖЕНИЯ
Для уточнения топического и нозологического неврологического диагноза, помимо лабораторных исследований, дающих главным образом информацию о составе жидких сред (кровь, моча, цереброспинальная жидкость), иммунологических и биологических исследований, применяются электрофизиологические, рентгенологические, ультразвуковые методы, а в последние десятилетия и неинвазивные методы визуализации головного и спинного мозга: компьютерная томография (КТ), магнитно-резонансная томография (МРТ), позит- ронно-эмиссионная томография (ПЭГ). Данные, полученные с помощью этих методов, в процессе диагностики поражений и заболеваний нервной системы нередко имеют очень важное, а иногда и решающее значение.
Дополнительными специальными методами исследования надо пользоваться в случаях действительной целесообразности их применения. За исключением экстремальных ситуаций к ним надо прибегать, если создавшееся после клинического обследования больного мнение о диагнозе нуждается в уточнении. Исключением из этого правила являются острые заболевания и поражения мозга, прежде всего инсульты и случаи черепно-мозговой травмы, при которых точный диагноз необходим незамедлительно, к тому же методы визуализации патологического процесса нередко имеют решающее значение для определения тактики лечения больного.
В процессе составления плана проведения физиологических, рентгенологи- ческих и других специальных исследований надо учитывать их информативность и возможность возникновения побочных явлений и осложнений. Необоснованных исследований следует избегать, так как они ведут к дополнительной затрате времени и излишним материальным расходам, а некоторые из методов, особенно инвазивные, могут оказаться небезразличны для состояния пациента.
16.2. ЭЛЕКТРОФИЗИОЛОГИЧЕСКИЕ МЕТОДЫ
16.2.1. Диагностика электровозбудимости нервно-мышечного аппарата
К электродиагностике прибегают при решении вопросов о характере и степени поражения периферических двигательных нейронов и иннервируемых
ими мышечных волокон. В ряде случаев при анализе результатов исследования возникают и некоторые дополнительные возможности уточнения диагноза.
Для исследования электровозбудимости можно пользоваться различными приборами, в частности отечественным аппаратом КЭД (классическая электродиагностика), пантостатом и др. Эти приборы получают ток от собственной электробатареи или от электросети. Из электродов один индифферентный площадью 50-100 см2, другой - активный, в форме шарика или пуговки площадью 3-5 см2. Активный электрод соединен с рукояткой, снабженной прерывателем тока. Прибор имеет трансформаторную систему и амперметр для определения силы тока, а также приспособление, позволяющее делать активным то катод, то анод.
Раздражение нерва и мышцы постоянным (гальваническим) током и импульсным (переменным, фарадическим) с частотой 40-50 Гц, длительностью импульса 1 мс позволяет судить о количественном и качественном изменении их возбудимости. При раздражении мышцы (прямое раздражение) или нерва (непрямое раздражение), обеспечивающего двигательную иннервацию этой мышцы, в норме возникает мышечное сокращение. Раздражение осуществляется с определенных участков кожи, именуемых двигательными (моторными) точками, которые располагаются в местах расположения нерва близко к поверхности тела; поиску этих точек помогают созданные на основании анато- мических представлений и эмпирических данных схематические рисунки.
Исследование электровозбудимости мышц и нерва переменным током позволяет определить только количественное изменение порога их возбудимости. При силе переменного тока выше пороговой в течение всего периода прямого или непрямого раздражения мышцы возникают ее тетанические сокращения.
Исследование электровозбудимости мышцы и нерва постоянным током дает более полное представление о состоянии нервно-мышечного аппарата. Постоянный ток в норме вызывает молниеносное сокращение мышцы лишь в момент замыкания и размыкания электрической цепи (закон полярного раздражения Дюбуа-Реймона), при этом порог возбудимости нервов варьирует в пределах от 0,5 до 3,0 мА.
В норме катод (отрицательный полюс) сильнее раздражает мышцу (вызывает ее сокращение при меньшей силе тока), чем анод (положительный полюс), т.е. катодзамыкательное сокращение (КЗС) больше анодзамыкательного (АЗС). Кроме того, анодзамыкательное сокращение больше анодразмыкательного (АРС), а последнее - катодразмыкательного (КРС). В итоге полная формула нормальной электрической реакции (полярная формула) выглядит так: КЗС>АЗС>АРС>КРС.
При периферическом параличе мышцы (ее денервации) исследование электровозбудимости, реакция ее на раздражение электрическим током изменяется качественно, при этом обнаруживается реакция перерождения (РП), reactio degenerationis (RD).
Признаки реакции перерождения: 1) на раздражение нерва как переменным, так и постоянным током мышечных сокращений нет; 2) раздражение мышцы переменным током также не вызывает ее реакции, прямое же раздражение мышцы постоянным током сопровождается ее сокращением, но при этом АЗС>КЗС, а само сокращение мышцы не быстрое, как в норме, а вялое, червеобразное. Такое состояние электровозбудимости наступает приблизительно через 2 нед после перерыва нерва или после гибели тел соответствующих периферических мотонейронов и называется полной реакцией перерождения (ПРП).
При длительной (более года) полной реакции перерождения мышцы может вообще исчезнуть ее способность реагировать как на импульсный, так и на постоянный ток. Такая полная утрата электровозбудимости мышцы указывает на развитие в ней необратимых дегенеративных процессов.
При периферическом парезе мышцы вследствие неполного нарушения функции иннервирующего ее двигательного нерва может наблюдаться неполная (частичная) реакция перерождения; в таких случаях при непрямом раздражении переменным и постоянным электрическим током, а также при прямом раздражении переменным электрическим током возбудимость мышцы сохраняется, но она резко снижена, и при этом раздражении постоянным током катодзамыкательное сокращение оказывается приблизительно таким же, как и анодзамыкательное, т.е. КЗС = АЗС, а темп сократительной реакции мышцы замедленный.
При центральном парезе или параличе наблюдается снижение порога электровозбудимости, при миопатии он повышается. При миотонии возникает так называемая миотоническая реакция: раздражение мышцы сопровождается длительным ее сокращением и медленным расслаблением. При миастении может быть выявлена патологическая утомляемость мышцы, при этом каждое последующее мышечное сокращение сопровождается повышением порога возбудимости; в таких случаях для получения эффекта требуется постепенное увеличение силы тока.
Таким образом, исследование электровозбудимости нервно-мышечного аппарата способствует дифференциации первичного и вторичного поражения мышцы и распознаванию характера паралича или пареза, а также нозологической диагностике некоторых нервно-мышечных заболеваний. Наличие полной или неполной (частичной) реакции перерождения указывает на степень поражения структур периферической нервной системы или мышцы. Кроме того, состояние элект- ровозбудимости помогает составить представление о более вероятном прогнозе. Повреждение периферического нерва, протекающее без реакции перерождения или с частичной реакцией перерождения, позволяет надеяться на сравнительно быстрое (через 4-6 нед) восстановление функции иннервируемых этим нервом мышц. Выявление полной реакции перерождения указывает на тяжелое поражение нервно-мышечного аппарата и делает шансы на восстановление нарушенных функций сомнительными. Полная утрата электровозбудимости мышцы указывает на практически абсолютную невозможность восстановления ее функции.
16.2.2. Электромиография
Электромиография (ЭМГ, классическая ЭМГ) - более современный и информативный метод диагностики нервно-мышечных заболеваний, основанный на регистрации спонтанных колебаний электрических потенциалов мышечных и нервных волокон. Впервые запись ЭМГ осуществил в 1907 г. H. Piper. Однако распространение на практике метод получил в 30-е годы. В 1948 г. R. Hodes предложил методику определения скорости распространения возбуждения (СРВ) по двигательным волокнам периферических нервов в клинических условиях. В том же году M. Dawson и G. Scott разработали методику определения СРВ по афферентным волокнам периферических нервов, что и положило начало электронейрографии.
При суммарной ЭМГ анализируются биопотенциалы множества двигательных единиц, образующих интерференционную, или суммарную, кривую. По одной из классификаций суммарной ЭМГ выделяется 4 типа.
1-й тип - ЭМГ с быстрыми, частыми, изменчивыми по амплитуде колебаниями потенциала (частота колебаний 50-100 Гц). ЭМГ этого типа регист- рируется в норме, а в случаях снижения амплитуды колебаний потенциала ре- гистрируется у больных с различными формами миопатии, радикулоневрита, центральными парезами мышц.
2-й тип - уменьшенная частота колебаний на ЭМГ (менее 50 Гц), когда визуально хорошо прослеживаются отдельные колебания потенциалов, частота которых может быть менее 10 Гц (тип IIА, тип «частокола») или более высокой - до 35 Гц (тип IIБ); проявляется в случаях невритических и нейрональных поражений.
3-й тип - залпы частых осцилляций длительностью 80-100 мс (частота колебаний 4-10 Гц), характерен для всех заболеваний, при которых имеют место повышение мышечного тонуса по экстрапирамидному типу и насильственные движения - гиперкинезы.
4-й тип - «биоэлектрическое молчание» - отсутствие биоэлектрической активности мышцы, несмотря на попытку вызывать произвольное или тоническое напряжение мышц. Наблюдается при вялых параличах в случае поражения всех или большей части иннервирующих их периферических мотонейронов.
При проведении ЭМГ исследуется потенциал в мышце, возникающий при ее прямой, непрямой или рефлекторной стимуляции, при этом чаще проверяется реакция мышцы в ответ на стимуляцию иннервирующего ее нерва. Среди вызванных электрических ответов выделяются М-ответ - потенциал, возникающий при электрическом раздражении двигательных волокон нерва, Н-ответ - рефлекторный, возникающий в мышце при раздражении низкопороговых чувствительных волокон нерва, и F-ответ - проявляющийся в мышце при электрической стимуляции двигательных аксонов нерва, обусловленный антидромным проведением волны возбуждения от места стимуляции к телу мотонейрона, возбуждения его и обратного проведения волны возбуждения до иннервируемых этим мотонейроном мышечных волокон.
Развитие метода и совершенствование диагностической аппаратуры способствовали формированию его направлений: 1) собственно электромиографические исследования, т.е. регистрация спонтанной мышечной активности в покое и при различных формах двигательной активности (глобальная ЭМГ); 2) стимуляционная электромиография и электронейрография. Сочетание этих двух направлений нередко обозначается термином электронейромиография.
Наиболее информативной оказалась классическая ЭМГ с игольчатыми электродами.
В настоящее время ЭМГ является основным методом в диагностике болезней периферических мотонейронов, нервов, мышц, нервно-мышечной передачи.
Возможности метода. ЭМГ позволяет получить объективные сведения, спо- собствующие решению следующих вопросов.
1) Имеется ли повреждение чувствительных волокон нерва?
2) Снижение мышечной силы у больного нейрогенной природы или речь идет о первичной миопатии?
3) Нарушена ли нейромышечная передача?
4) Имеется ли валлеровское перерождение нервных волокон и продолжается ли процесс денервации?
5) Если нерв поврежден, то преимущественно страдают осевые цилиндры нервных волокон или их миелиновая оболочка?
6) В случае невропатии: связана ли хроническая частичная денервация мышц с повреждением нервных корешков, ствола нерва или объясняется полиневропатическим процессом?
Таким образом, применение ЭМГ-исследования дает возможность выявить поражения нейромоторного аппарата: первично-мышечного, неврального, переднерогового, при этом возникает возможность дифференцировать единичные или множественные невропатии (моно- и полиневропатии), аксональные и демиелинизирующие невропатии; провести топическую диагностику поражения спинномозговых корешков, нервного сплетения или периферического нерва; определить уровень компрессии нерва при туннельных синдромах, а также состояние нервно-мышечной передачи.
Использование метода игольчатой миографии дает возможность определить некоторые особенности денервационно-реиннервационного процесса, что важно для оценки тяжести поражения периферических нервов, прогноза и, соответственно, планирования лечебной тактики.
Диагностика должна проводиться с учетом клинической картины заболевания, поскольку изменения электрической активности мышц связаны с определенными симптомами, а не с нозологическими формами.
Методика. Для проведения ЭМГ используют специальный аппарат - электромиограф, состоящий из электронного усилителя и регистрирующей систе- мы (осциллографа). Он обеспечивает возможность усиления биотоков мышцы в 1 млн раз и более и регистрирует их в виде графической записи. Отведение мышечных биопотенциалов осуществляется с помощью поверхностных или игольчатых электродов. Поверхностные электроды позволяют регистрировать суммарную электрическую активность многих мышечных волокон. Игольчатые электроды, погружаемые в мышцу, могут регистрировать биоэлектрические потенциалы отдельных двигательных единиц (ДЕ) - понятие, введенное Ч. Шеррингтоном для обозначения комплекса, состоящего из периферического мотонейрона, его аксона, ветвлений этого аксона и совокупности иннервируемых мотонейроном мышечных волокон.
При анализе ЭМГ учитывается частота биопотенциалов, величина их амплитуды (вольтаж), а также общая структура осциллограмм (монотонность осцилляций или их расчлененность на залпы, частота и длительность этих залпов и пр.).
ЭМГ проводится при различном состоянии исследуемых мышц: их расслаблении и произвольном сокращении, рефлекторных изменениях их тонуса, возникающих во время сокращения других мышц, во время вдоха, а также при эмоциональном возбуждении и пр.
У здорового человека в покое (при произвольном расслаблении мышц) на ЭМГ наблюдаются слабые, низкоамплитудные (до 10-15 мкВ), высокочастотные колебания. Рефлекторное повышение тонуса сопровождается небольшим усилением амплитуды биопотенциалов мышцы (до 50-100 мкВ). При произвольном мышечном сокращении возникают частые высокоамплитудные колебания (до 1000-3000 мкВ).
При заболеваниях, сопровождающихся денервацией мышцы, вовлечение в патологический процесс чувствительных волокон нерва позволяет дифференцировать невропатию от поражения клеток передних рогов спинного мозга. При ЭМГ возможно объективное раннее (иногда в доклинической стадии)
выявление нарушений функции нервно-мышечного аппарата, определение уровня его поражения (центральный, сегментарный, невропатический, нервно-мышечных синапсов, миопатический), а также характера (аксонопатия, миелинопатия), степени и стадии поражения периферических нервов. Установление характера невропатического процесса имеет важное значение, так как способствует диагностике основного заболевания и разработке наиболее рациональной программы лечения.
Если электродиагностические данные указывают на аксонопатию, особенно в случае прогрессирующей полиневропатии с подострым или хроническим течением, есть основание считать вероятным наличие метаболических нарушений или экзогенной интоксикации. Если же в процессе электродиагностики выявляется первичная демиелинизация нерва, среди возможных причин заболевания следует рассмотреть приобретенную демиелинизирующую невро- патию, обусловленную нарушением иммунитета, или наследственные невропатии, отдельные формы которых сопровождаются равномерным и резко выраженным снижением скорости проведения возбуждения по нервам.
ЭМГ позволяет также судить о состоянии нервно-мышечной передачи, способствует выявлению ее нарушения; кроме того, дает возможность контролировать регенеративный процесс после травматического поражения нерва, помогая таким образом решать вопрос о целесообразности в этих случаях нейрохирургического вмешательства.
При первичной мышечной патологии характерно снижение амплитуды биопотенциалов, укорочение длительности одиночного потенциала и увеличение процента полифазных потенциалов (в норме до 15-20%). При поражении периферических нервов возникает снижение амплитуды осцилляций, возможно появление неритмичных потенциалов фибрилляции с амплитудой до 200 мкВ. Если развивается периферический паралич с дегенерацией нервных и мышечных волокон, биопотенциалы исчезают (наступает биоэлектрическое «молчание»).
Поражение структур передних рогов спинного мозга сопровождается уменьшением частоты осцилляций; фасцикуляции в таких случаях отражаются на графике ритмичными потенциалами с амплитудой до 300 мкВ и частотой 5- 35 Гц - «ритм частокола». При центральных парезах во время произвольных движений снижается амплитуда колебаний, в то же время при рефлекторных повышениях мышечного тонуса амплитуда биопотенциалов резко увеличивается и появляются частые несинхронные колебания.
При исследовании функции периферического нерва важную информацию можно получить при определении скорости проведения импульсов и параметров вызванных потенциалов действия. С этой целью проводится электронейромиография - метод, при котором классическая ЭМГ сопровождается электрической стимуляцией периферического нерва с последующим анализом параметров вызванных потенциалов, регистрируемых с мышцы (стимуляци- онная электромиография) или с иннервирующего ее нерва (стимуляционная электронейрография). Возможны регистрация и анализ параметров вызванных потенциалов (ВП) мышцы и нерва (латентный период, форма, амплитуда и длительность ВП), определение скорости проведения импульсов по двигательным и чувствительным волокнам периферических нервов, подсчет моторносенсорного и краниокаудального коэффициентов асимметрии и выявление отклонения их от нормы, определение числа функционирующих двигательных единиц (ДЕ).
Метод определения скорости проведения импульсов применим для исследования любого доступного периферического нерва. Обычно он определяется у срединного, локтевого, большеберцового и малоберцового нервов, реже - у локтевого и седалищного нервов. Электронейромиографию следует проводить при исследовании функционального состояния как двигательных, так и чувствительных волокон. Для определения скорости проведения импульсов (СПИ) сначала измеряется время наступления потенциала действия мышцы (в мил- лисекундах) при стимуляции двигательного нерва возле самой мышцы (латентное время - Т2 - ответа в дистальной точке) и в точке, расположенной проксимальнее по ходу нерва на некотором расстоянии (латентное время - Т1 - в проксимальной точке). Зная расстояние между двумя точками стимуляции (S) и разность латентных периодов (Т1 - Т2), можно вычислить скорость проведения нервного импульса (скорость распространения возбуждения - СРВ) по формуле:
СПИ, или СРВ = S/(T1 - Т2) мм/мс
Для большинства нервов в норме СПИ, или СРВ, составляет 45-60 мм/мс или м/с.
При аксонной дегенерации, например при алкогольной или диабетической невропатии, на фоне выраженных денервационных изменений скорость проведения возбуждения снижается незначительно, при этом амплитуда потенциалов действия нервов и мышц прогрессивно уменьшается по мере того, как поражение распространяется по составляющим нерв волокнам. При аксонной полиневропатии можно установить ее субклиническое течение, активность и степень реиннервации.
При сегментарной демиелинизации, например при синдроме Гийена-Бар- ре, скорость проведения возбуждения снижается гораздо больше - до 60% от нормы. С электрофизиологической точки зрения демиелинизация характеризуется другими особенностями. Они включают десинхронизацию (дисперсию) вызванных потенциалов действия мышцы, непропорциональное увеличение латентного времени ответа в дистальной точке, замедление F-ответов (потен- циалов действия, направляющихся к спинному мозгу и возвращающихся назад к мышце) и блокаду проводимости. Блокада проводимости определяется по внезапному резкому падению амплитуды вызванного потенциала действия мышцы при стимуляции нерва в точках на все большем отдалении (в проксимальном направлении) от регистрирующего электрода.
Проверяя скорость проведения импульса по нерву, можно оценить выраженность вторичного валлеровского перерождения, диагностировать и отдифференцировать миотонию от продолжительной мышечной активности невропатической природы; проанализировать и четко отличить мышечный спазм от физиологической контрактуры, для которой характерно электрическое «молчание».
Снижение скорости проведения возбуждения по отдельным нервам - признак мононевропатии - может быть, например, проявлением туннельного синдрома, тогда как снижение скорости проведения по симметричным нервам на всех или, как это бывает чаще, на нижних конечностях указывает на наличие полиневропатии.
Экстрапирамидные гиперкинезы на ЭМГ характеризуются залпами частых высокоамплитудных колебаний, возникающих на фоне низкоамплитудной
кривой. При миотонии на ЭМГ при движении выявляется характерное нарас- тающее снижение амплитуды биопотенциалов - «миотоническая задержка».
Возможна и компьютерная обработка частотного спектра ЭМГ по методу Фурье, позволяющая определить суммарную мощность спектра, распределение и мощность отдельных частотных диапазонов.
16.2.3. Вызванные потенциалы
Метод вызванных потенциалов (ВП) осуществляется путем регистрации биоэлектрических ответов головного мозга на определенные экзогенные или эндогенные раздражители. Установленные биоэлектрические потенциалы мозга, полученные в результате неинвазивной стимуляции специфических афферентных путей, позволяют с помощью компьютерной обработки полученной информации судить о функциональном состоянии этих путей. Коротковолно- вые вызванные потенциалы (ВП) представляют собой ответную реакцию мозговых структур на дозированный раздражитель различной модальности (свет, звук, соматосенсорные раздражения). ВП возникают вследствие трансформации энергии раздражителя в поток нервных импульсов, который подвергается сложной обработке на пути следования к коре больших полушарий. ВП позволяют выявить субклиническое поражение сенсорных путей, объективизировать его наличие, а иногда и уровень поражения исследуемых афферентных структур. Вместе с тем этот метод не способствует определению причины нарушения их функций.
Зрительные вызванные потенциалы (ЗВП) регистрируются в срединно-затылочной области при поочередной стимуляции каждого глаза. Исследование результатов ЗВП позволяет установить наличие поражения зрительного анализатора, что имеет важное значение, например при диагностике рассеянного склероза. У большинства больных, перенесших ретробульбарный неврит, определяются изменения ЗВП.
Слуховые ВП ствола (СВПС) возникают при направлении в ухо звуковых стимулов (серии щелчков) с помощью наушников. СВПС позволяют определить локализацию выявить наличие поражения слуховых путей при регистрации биоэлектрических сигналов, регистрируемых в теменной области, в зоне макушки (вертекса - от лат. vertex вершина, верхушечная точка). Потенциалы регистрируются в течение 10 с после слуховой стимуляции и отражают последовательную активность различных уровней слухового анализатора. При клинической интерпретации основное внимание уделяется первым пяти пикам, длительности их латентного периода и величине межпиковых интервалов. Это позволяет судить об уровне поражения слухового анализатора (на уровне VIII черепного нерва, его ядер, верхней оливы, боковой петли, нижнего бугра четверохолмия). СПВС могут способствовать ранней диагностике патологи- ческих процессов (например, очагов демиелинизации, роста глиальных опухолей, инфарктных очагов и пр.), возникших на уровне периферического отдела слухового анализатора или поражающих ствол мозга.
Исследование звуковых и зрительных вызванных потенциалов позволяет объективизировать наличие у пациентов нарушений соответственно слуха или зрения, что может быть использовано с экспертной целью, а также для оценки состояния слуха и зрения у людей, контакт с которыми ограничен из-за наличия у них интеллектуально-мнестических расстройств.
Соматосенсорные ВП (ССВП) исследуют, стимулируя электротоком опреде- ленные периферические нервы, при этом биоэлектрическую активность регист- рируют как на поверхности головы, так и на различных уровнях позвоночника. ССВП, полученные при стимуляции, например большеберцового и малоберцового нервов, позволяют определить локализацию поражения на уровне этих нервов, пояснично-крестцового сплетения, спинного мозга, ствола головного мозга и таламусов. Практически любое заболевание, поражающее соматосенсорные пути, например рассеянный склероз, опухоли спинного мозга, спондилогенная шейная миелопатия и др., сопровождается изменениями ССВП.
Дифференцируются ранние и поздние компоненты ВП. Ранние компонен- ты связаны с быстропроводящими (миелиновыми) проекционными нервными волокнами и характеризуются короткими латентными периодами; тогда как поздние компоненты ВП отражают проведение импульсов по неспецифическим структурам, в частности по РФ ствола, и по структурам вегетативной нервной системы, для них характерны более длительные латентные периоды.
Вызванные потенциалы позволяют определять наличие и степень повреждения различных отделов нервной системы, в частности стволовых и подкорковых структур мозга. В клинической практике чаще применяют акустические стволовые вызванные потенциалы (АСВП) и коротколатентные соматосенсорные вызванные потенциалы (ССВП).
Исследование вызванных потенциалов может проводиться для контроля функциональной целостности структур центральной нервной системы во время оперативного вмешательства с тем, чтобы по возможности раньше распознать их дисфункцию и избежать их необратимых повреждений.
16.2.4. Электроэнцефалография
Электроэнцефалография (ЭЭГ) - метод исследования функционального состояния головного мозга, основанный на регистрации его биоэлектрической активности через неповрежденные покровные ткани головы. На ЭЭГ регистрируется электрическая активность мозга, генерирующаяся в коре, синхронизирующаяся и модулирующаяся таламусом и ретикулярными активирующими структурами. Первая запись биотоков головного мозга была произведена в 1928 г. Гансом Бергером (H. Berger).
Регистрация биоэлектрических потенциалов головного мозга и графическое их изображение фотографическим методом или путем чернильной записи производится специальным прибором - электроэнцефалографом. Его основным узлом являются высокочувствительные электронные усилители, позволяющие на бумажной ленте в реальном времени получать картину изменения колебаний биопотенциалов в разных областях коры больших полушарий, и осцилло- графические системы регистрации. Современные электроэнцефалографы - это многоканальные приборы (чаще 16, иногда 20 и более усилительно-регистрирующих блоков - каналов), позволяющие одновременно регистрировать биотоки, отводимые от нескольких симметричных отделов головы. Исследование должно проводиться в свето- и звукоизолированном помещении. В процессе регистрации биотоков мозга пациент находится в кресле в удобном положении (полулежа), при этом ему не следует: а) находиться под воздействием седативных средств; б) быть голодным (в состоянии гипогликемии); в) быть в состоянии психоэмоционального возбуждения.
Электроды для ЭЭГ могут быть пластинчатые, чашечные, игольчатые. Они крепятся на голове пациента с помощью резиновых жгутов, липкой ленты или специальной шапочки симметрично относительно сагиттальной линии головы по общепринятой международной схеме. Стандартные зоны отведения (и соответствующие им электроды) следующие: затылочные (occipitalis, О1 и О2), теменные (parietalis, Р3 и Р4), центральные (centralis, C3 и C4), лобные (frontalis, F3 и F4), лобные полюсные (polus, Fp1 и Fp2), нижнелобные (F7, F8), височные (temporalis, T3, T4), задневисочные (T5, T6). Кроме того, по сагиттальной линии головы располагаются сагиттальные электроды: теменной сагиттальный (PZ), центральный сагиттальный (CZ) и лобный сагиттальный (FZ). В качестве референтных электродов используются электроды, которые закрепляются на мочках ушей зажимами. По международной системе они обозначаются как электроды А1 и А2 (от лат. auriculus - ушной).
Отведения ЭЭГ бывают монополярные или биполярные. При монополярном отведении измеряются потенциалы между активной точкой на голове и относительно неактивной зоной, не дающей собственных ритмических колебаний (референтным электродом, чаще - ушным или наложенным на область сосцевидного отростка). При биполярном отведении измеряют разность по- тенциалов между двумя активными зонами мозга, например затылочным и теменным отведением (О-Р). Для диагностических целей целесообразно использовать комбинацию моно- и биполярных отведений.
Записанная кривая, отражающая характер биотоков мозга, называется электроэнцефалограммой (ЭЭГ).
Электроэнцефалограмма отражает суммарную активность большого количества клеток мозга и состоит из многих компонентов. Анализ электроэнцефалограммы позволяет выявить на ней волны, различные по форме, постоянству, периодам колебаний и амплитуде (вольтажу). У здорового взрослого человека, находящегося в состоянии покоя, на ЭЭГ обычно выявляются: а) альфа-волны, которые характеризуются частотой 8-13 Гц и амплитудой 30-100 мкВ, они симметричные, синусообразной формы, лучше выражены при закрытых глазах пациента, преимущественно определяются в затылочно-теменной области; эти волны нарастают и убывают спонтанно и обычно быстро исчезают, когда пациент сосредоточивает внимание или открывает глаза; б) бета-волны с частотой колебаний больше 13 Гц (чаще 16-30) и амплитудой до 15 мкВ, на «нормальных» электроэнцефалограммах они симметричны и особенно характерны для лобной области; в) дельта-волны, имеющие частоту 0,5-3 Гц и амплитуду до 20-40 мкВ; г) тета-волны с частотой 4-7 Гц и с амплитудой в тех же пределах (рис. 16.1).
При выраженной альфа-активности дельта- и тета-ритмы у здорового взрослого человека практически не заметны, так как они перекрываются имеющим более выраженную амплитуду альфа-ритмом. Однако при угнетении альфаритма, обычно возникающем при возбуждении пациента, а также в дремотном состоянии и при неглубоком сне (первая и вторая стадии), дельта- и тета-ритм на ЭЭГ проявляются, и амплитуда их может нарастать соответственно до 150 и 300 мкВ. При глубоком сне (третья стадия) на ЭЭГ максимально регистриру- ется медленная активность. Медленные волны чаще проявляются в виде диффузных, реже локальных (в зоне патологического очага в мозге), ритмических колебаний, формирующихся во «вспышки».
Уровень бодрствования влияет на характер ЭЭГ. В норме у спящего взрослого человека ритм биоэлектрической активности симметричен, при этом по-
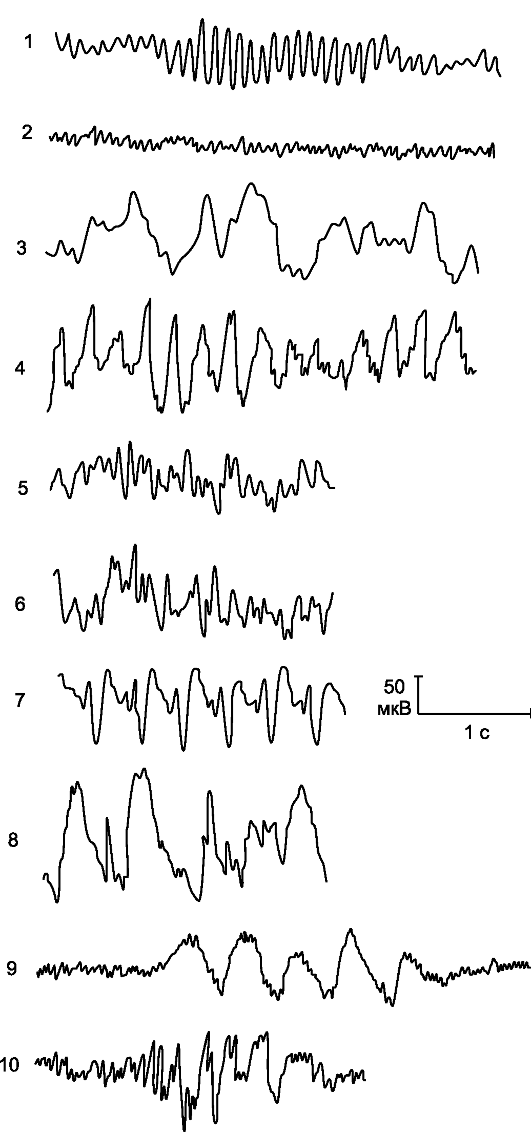
Рис. 16.1. Проявления биоэлектрической активности головного мозга на электроэнцефалограмме. 1 - альфа-ритм; 2 - бетаритм; 3 - дельта-ритм; 4 - тета-ритм; 5 - пики; 6 - острые волны; 7 - пик-волна; 8 - острая волна; 9 - пароксизм дельтаволн; 10 - пароксизм острых волн.
являются нарастающие по амплитуде медленные волны и сонные веретена в теменных зонах. Любая ориентировочная реакция на внешние воздействия находит отражение на ЭЭГ здорового человека в виде временного уплощения кривой. Эмоционально-психическое возбуждение обычно сопровождается появлением быстрых ритмов.
В процессе перехода от младенческого состояния к взрослому характер нормальной ЭЭГ постепенно меняется. В раннем детском возрасте на ней отражены главным образом медленные колебания, которые постепенно сменяются более частыми, и к 7 годам формируется альфа-ритм. Полностью процесс эволюции ЭЭГ завершается к 15-17 годам, приобретая к этому возрасту черты ЭЭГ взрослого человека (рис. 16.2).
В возрасте старше 50-60 лет нормальная ЭЭГ отличается от таковой у лиц молодого возраста уменьшением частоты дельта-ритма, нарушением его регуляции и увеличением числа тета-волн.
Признаком патологической активности на ЭЭГ взрослого бодрствующего человека являются тета- и дельта-активность, а также эпилептическая активность.
Особенно значимым ЭЭГ-обследование оказывается при выявлении эпилептической активности, указывающей на предрасположенность к судорожным состояниям и проявляющейся следующими признаками: 1) острые волны (пики) - колебание потенциала, имеющего крутое нарастание и крутой спад, при этом острота волны обычно превышает амплитуду фоновых колебаний, с которыми они сочетаются; острые волны могут быть единичными или групповыми, выявляются в одном или многих отведениях; 2) комплексы пик-волна, представляющие собой колебания потенциала, состоящие из острой волны (пика) и сопутствующей ей медленной волны; при эпилепсии эти комплексы могут быть единичными или следуют друг за другом в виде серий; 3) пароксизмальные ритмы - ритмы колебаний в форме вспышек высокой амплитуды разной частоты, обычны пароксизмальные ритмы тета- и дельта-колебаний или медленных волн 0,5-1,0 Гц.
По данным ЭЭГ возможно отличить диффузное поражение мозга от локального патологического процесса, установить сторону и в определенной степени локализацию патологического очага, отдифференцировать поверхностно расположенный патологический очаг от глубинного, распознать коматозное состояние и степень его выраженности, выявить фокальную и генерализованную эпилептическую активность.
Расширению возможностей ЭЭГ в определении функционального состояния мозга и некоторых его патологических состояний, прежде всего эпилептической активности, способствуют специальные провокационные пробы: проба с гипервентиляцией - глубокие дыхательные движения с частотой 20 в мин, ведущие к алкалозу и сужению сосудов мозга; проба со световым раздражителем - фотостимуляцией с помощью мощного источника света (стробоскопа); проба со звуковым раздражителем. Так, реакции больного на фотостимуляцию говорят о том, что обследуемый по крайней мере воспринимает свет. Если реакция на фотостимуляцию отсутствует в одном полушарии, то можно судить о том, что на его стороне имеет место нарушение проводимости зрительных импульсов от подкорковых центров до коркового отдела зрительного анализатора. Если фотостимуляция провоцирует появление на ЭЭГ патологических волн, стоит думать о наличии повышенной возбудимости корковых структур. Более продолжительная фотостимуляция может спровоцировать появление на
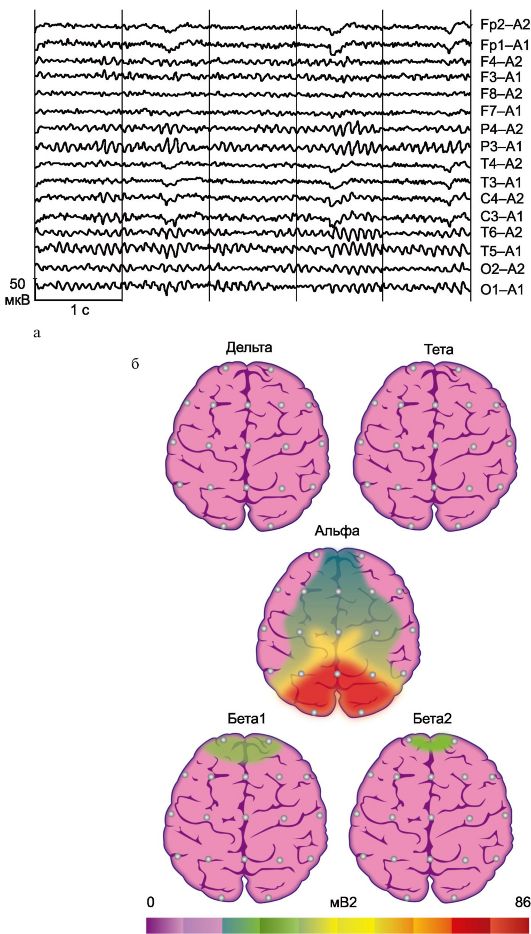
Рис. 16.2. Электроэнцефалограмма и ее топоселективная картограмма в норме. а - монополярные ЭЭГ-отведения (по международной системе «10-20»): О - окципитальные; Р - париетальные; С - центральные; Т - темпоральные; F - фронтальные; Fp - нижние лобные; нечетные цифровые индексы соответствуют электродам над левым полушарием мозга, четные - над правым; б - распространение активности 10 Гц на картограмме.
ЭЭГ истинных судорожных разрядов, а при особенно высокой готовности к судорожным состояниям иногда развиваются отчетливые миоклонические подергивания мышц лица, шеи, плечевого пояса, рук, которые могут переходить в генерализованные истинные мышечные судороги (фотопароксизмальная реакция).
Информативность электроэнцефалограммы повышается, если запись ее производится у пациента, находящегося в состоянии сна.
С помощью ЭЭГ получают информацию о функциональном состоянии мозга при разных уровнях сознания пациента. Достоинством этого метода являются его безвредность, безболезненность, неинвазивность.
Электроэнцефалография нашла широкое применение в неврологической клинике. Особенно значимы данные ЭЭГ в диагностике эпилепсии, возможна их определенная роль в распознавании опухолей внутричерепной локализации, сосудистых, воспалительных, дегенеративных заболеваний головного мозга, коматозных состояний. ЭЭГ с применением фотостимуляции или стимуляции звуком может помочь отдифференцировать истинные и истерические расстройства зрения и слуха либо симуляцию таких расстройств. ЭЭГ может быть использована при мониторном наблюдении за больным. Отсутствие на ЭЭГ признаков биоэлектрической активности головного мозга является одним из важнейших критериев его смерти.
В нейрохирургических учреждениях во время операции при наличии показаний может производиться запись биотоков с обнаженного мозга - электрокортикография. Иногда в условиях нейрохирургической операционной запись электроэнцефалограммы ведется с помощью электродов, погруженных в мозг.
Использование современной компьютерной техники или специализированных спектроанализаторов позволяет производить автоматическую обработку ЭЭГ, что дает возможность выявить количественные характеристики ее частотного состава. Возможность компрессированного спектрального анализа ЭЭГ, основанного на компьютеризированной трансформации первичной ЭЭГ в спектр мощности по быстрому преобразователю Фурье, дает возможность оценивать ЭЭГ количественно, представить ее в более наглядной форме, так как на спектрограммах находит отражение мощность или амплитуда частотных составляющих ЭЭГ за данный исследуемый отрезок времени (эпоху), что позволяет определить соотношение мощности разных ритмов ЭЭГ и выявить те частоты, которые не выявляются при простом рассмотрении кривой ЭЭГ, и таким образом повысить информативность результатов обследования.
Топоселективное картирование электрической активности мозга. В процессе анализа многоканальной ЭЭГ имеется возможность трансформировать результаты обследования в числовую форму в виде спектра мощности электрогенеза коры полушарий большого мозга. Затем полученные данные представляются в виде карты распределения мощности различных видов электрической активности мозга. На карте особенности электрической активности в различных участках коры мозга воспроизводятся в условном цвете, а при черно-белом изображении - в виде штриховки; при этом каждой величине мощности (когерентности) соответствует свой цвет или плотность штриховки (см. рис. 16.2б).
Метод позволяет объективно оценить выраженность асимметрии ЭЭГ, наличие и генерализованных, и очаговых изменений электрической активности мозга, проявляющихся непосредственно во время ЭЭГ-исследования.
16.2.5. Реоэнцефалография
Реоэнцефалография (от греч. reos - поток, encephalon - мозг, grapho - писать) - метод изучения мозгового кровотока путем выявления изменений электрического сопротивления содержимого черепа, обусловленного в основном объемными колебаниями кровенаполнения и отчасти состоянием ско- рости кровотока в мозговых и экстракраниальных сосудах при прохождении через него переменного тока высокой частоты.
Первые сообщения о возможности применения реографии для оценки состояния мозгового кровообращения принадлежат K. Polzer, F. Schuhfried (1950) и F. Jenkner (1959).
Реоэнцефалография (РЭГ) дает косвенную информацию о показателях интенсивности кровенаполнения сосудов головного мозга, состоянии тонуса и эластичности мозговых сосудов и венозного оттока из полости черепа. Метод основан на графической регистрации изменений величины переменного электрического сопротивления (импеданса) тканей головы, обусловленных пульсовыми колебаниями их кровенаполнения.
Запись РЭГ производится специальным прибором реоэнцефалографом или электроэнцефалографом с реографической приставкой, представляющей собой генератор высокочастотного тока (120 кГц). Метод позволяет исследовать гемодинамику в сосудах как каротидного, так и вертебрально-базилярного бассейна. В первом случае электроды накладывают на область сосцевидного отростка височной кости и верхний край надбровной дуги (фронтомастоидальное отведение, FM), во втором - на затылок и сосцевидный отросток (окци- питально-мастоидальное отведение, OM).
Реоэнцефалограмма представляет собой кривую, синхронную с пульсом. При анализе РЭГ обращают внимание на величину амплитуды и форму реографических волн (анакрот), которые определяются степенью кровенаполнения в исследуемом участке сосудистого русла, на время развития восходящей и нисходящей частей волны, дополнительной волны, их выраженность и расположение на нисходящей части основной волны. Изучение этих параметров дает определенные сведения об имеющейся у больного сосудистой патологии. Так, при церебральном атеросклерозе (без признаков острого нарушения мозгового кровообращения) выявляется уплощение вершины основной реографической волны, иногда приобретающей вид плато. При тяжелых формах атеросклероза реографическая волна приобретает аркообразный или куполообразный вид.
Диагностические возможности метода могут быть расширены при применении функциональных проб, позволяющих отличить функциональные изменения от органических, уточнить локализацию поражения сосудистой системы. Применяется, в частности, проба с нитроглицерином, гипервентиляция в течение 3 мин, при исследовании вертебрально-базилярного сосудистого бассейна - повороты и запрокидывания головы. При функциональных изменениях тонуса сосудов прием нитроглицерина нормализует показатели РЭГ, в случаях органической сосудистой патологии нитроглицерин незначительно влияет на характер РЭГ.
Некоторые признаки, учитывающиеся при качественном анализе РЭГ: 1) при снижении тонуса артериальных сосудов отмечаются увеличение амплитуды РЭГ-волны, нарастание крутизны подъема анакроты, укорочение анакроты, заострение вершины, увеличение и смещение дикротического зубца к
основанию; 2) при повышении тонуса артериальных сосудов наблюдаются снижение амплитуды РЭГ-волны, уменьшение крутизны подъема анакроты, удлинение анакроты, смещение дикротического зубца к вершине, уменьшение выраженности дикротического зубца, закругление и уплощение вершины РЭГ-волны, дополнительные волны на анакроте; 3) при сосудистой дистонии отмечаются изменчивость дикротического зубца («плавающий зубец»), появление дополнительных волн на катакроте, эпизодические венозные волны; 4) при затруднении венозного оттока выявляются удлинение катакроты, вы- пуклость катакроты.
В процессе количественного анализа РЭГ учитывается ряд параметров: 1) длительность анакроты - время (в секундах) от начала волны до ее вершины - отражает период полного раскрытия сосуда и зависит от возраста: чем эластичнее стенка сосуда, тем меньше время восходящей части реографической волны (у здоровых молодых людей 0,1<$E?>0,01 с); 2) реографический индекс (РИ) - отношение амплитуды РЭГ-волны к амплитуде калиб- ровочного сигнала - отражает величину систолического притока (в норме 0,15<$E?>0,01 Ом); 3) дикротический индекс (ДКИ) - отношение амплитуды РЭГ-волны к амплитуде калибровочного сигнала - характеризует преимущественно тонус артериол и зависит от состояния периферического сопротивления (в норме 40-70%); 4) диастолический индекс (ДИ) - отношение амплитуды на уровне дикротического зубца к максимальной амплитуде РЭГволны - отражает преимущественно состояние оттока крови и тонус вен (в норме равен 75%).
РЭГ-исследование целесообразно применять при диагностике сосудисто-мозговой патологии функционального характера (вегетативно-сосудистая дистония, мигрень), при атеросклерозе, острых и хронических расстройствах мозгового кровообращения, а также при оценке эффективности некоторых лекарственных препаратов и немедикаментозных методов лечения. Высока эффективность РЭГ-исследований при выявлении вертеброгенного влияния на позвоночные артерии со стороны патологически измененного шейного отдела позвоночника (остеохондроз, спондилит, последствия травмы и пр.). При наличии компримирующего воздействия на позвоночные артерии со стороны шейных позвонков, а также в случае вазоспастических реакций за счет раздражения пе- риартериальных сплетений этих артерий возникает значительная (более 30%) асимметрия амплитуды сигналов в сочетании с признаками повышения сосудистого тонуса.
В силу динамичности и недостаточной специфичности результатов данные реоэнцефалографии следует рассматривать как вспомогательные.
16.3. УЛЬТРАЗВУКОВЫЕ МЕТОДЫ
Ультразвук представляет собой механически распространяющиеся колебания среды с частотой выше, чем у слышимого звука (больше 18 кГц). Он обладает способностью проникать в ткани и в зависимости от их особенностей в той или иной степени ими поглощается или отражается. На величину отраженного сигнала, помимо коэффициента отражения, существенное влияние оказывает форма отражающей поверхности. С помощью методов ультразвукового исследования обычно выявляют взаимоотношения различных тканей, в частности
тканей черепа и его содержимого, с разным акустическим сопротивлением на основе эхолокации. Под акустическим сопротивлением среды подразумевается ее способность проводить ультразвуковую энергию.
Безопасной для пациента признается интенсивность ультразвука, представляющая собой количество энергии, проходящей за 1 с через 1 см2 площади, не превышающей 0,05 Вт/см2.
16.3.1. Эхоэнцефалография
Эхоэнцефалография (ЭхоЭГ) - метод, основанный на регистрации ультразвука, отраженного от границ внутричерепных образований и сред с различным акустическим сопротивлением (кости черепа, мозговое вещество, кровь, ЦСЖ). В неврологическую практику его ввел шведский врач Л. Лекселл (Leksell L., 1956). Предназначенный для этого аппарат эхоэнцефалограф создает возбуждающий генераторный импульс и обеспечивает возможность регистрации отраженного эхосигнала на экране осциллографа (эхоэнцефалоскопия), которая может быть зафиксирована и в записи (собственно эхоэнцефалография).
В процессе эхоэнцефалографии может быть использован режим эхолокации (эмиссионный метод), при этом применяется один и тот же пьезодатчик для излучения и приема отраженного от мозговых структур ультразвука, а при трансмиссионном режиме локализации сигнал, излучаемый из одного пьезодатчика, принимается другим пьезоэлементом.
Полученную эхоэнцефалограмму составляют начальный комплекс - эхосигнал от мягких тканей головы и черепной кости, находящихся непосредственно под ультразвуковым зондом; эхосигналы от различных внутримозговых структур и конечный комплекс - эхосигналы от внутренней поверхности костей черепа и мягких тканей противоположной стороны (рис. 16.3). Из эхосигналов от внутримозговых структур важнейшим является сигнал с наибольшей амплитудой - М-эхо (первый диагностический критерий Лекселла), отраженный от срединных структур головного мозга, расположенных в сагиттальной плоскос- ти (III желудочек и его стенки, прозрачная перегородка, большой серповидный отросток, межполушарная щель, эпифиз); расположенные по сторонам от М-эха дополнительные сигналы значительно меньшей амплитуды (второй диагностический критерий Лекселла) в норме обычно являются отражением от стенок боковых желудочков.
В норме структуры, образующие М-эхо, расположены строго в сагиттальной плоскости и находятся на одинаковом расстоянии от симметричных точек правой и левой сторон головы, поэтому на эхоэнцефалограмме при отсутствии патологии сигнал М-эхо в равной степени отстоит от начального и конечного комплексов.
Отклонение срединного М-эха более чем на 2 мм в одну из сторон должно рассматриваться как проявление патологии. Наиболее информативным показателем наличия в супратенториальном пространстве объемного патологического очага (опухоль, абсцесс, локальный отек мозга, внутричерепная гематома) следует считать смещение срединного М-эха в сторону, противоположную расположению этого очага. Появление на ЭхоЭГ большого количества отраженных сигналов между начальным комплексом и сигналом М-эха указывает на вероятное наличие отека головного мозга. Если сигнал срединного М-эха
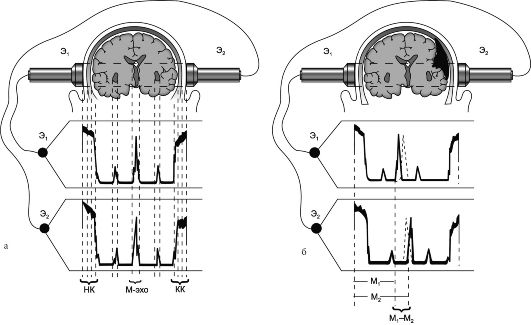
Рис. 16.3. Эхоэнцефалограммы.
а - эхоэнцефалограмма в норме: смещение срединных структур головного мозга отсутствует; НК - начальный комплекс; М-эхо - срединный комплекс; КК - конечный комплекс; б - эхоэнцефалограмма при смещении срединных структур головного мозга; Ml и М2 - расстояние до срединных структур головного мозга слева и справа; Э - электроды.
состоит из двух импульсов или имеет зазубренные вершины и широкое основание, это свидетельствует о расширении III желудочка мозга. Различное число эхосигналов левого и правого полушарий мозга рассматривается как ультразвуковая межполушарная асимметрия, причиной которой может быть патологический очаг различного происхождения в одном или в обоих полушариях мозга. Дополнительные сигналы от патологических структур, находящихся в полости черепа (третий диагностический критерий Лекселла), указывают на наличие в полости черепа тканей с разной плотностью. Они могут быть различного происхождения, поэтому их не следует переоценивать при опреде- лении сущности обусловливающих их причин.
В последние годы разработаны методы многоосевой ЭхоЭГ и эхопульсография, позволяющая оценивать форму и амплитуду пульсирующих эхосигналов от сосудов и стенок желудочковой системы, определять степень дислокации сосудов и судить о выраженности внутричерепной гипертензии.
16.3.2. Ультразвуковая допплерография
Метод ультразвуковой допплерографии (УЗДГ) основан на эффекте Допплера. Иоганн Кристиан Допплер (Doppler I.K.) - австрийский математик и физик, в 1842 г. сформулировал принцип, который позволяет оценить направление и скорость движения любого объекта по изменениям отраженного от него эхосигнала. Основанное на этом принципе неинвазивное ультразвуковое исследование внечерепных сосудов получило широкое распространение в клинической практике во второй половине ХХ в., когда S. Satomura (1959), D. Franclin и соавт. (1966) показали возможность измерения скорости кровотока в сосудах при использовании эффекта Допплера. В настоящее время УЗДГ может рассматриваться как метод графической регистрации линейной скорости кровотока и его направления в магистральных артериях головы.
В процессе исследования производится локация в определенных проекциях магистральных сосудов (экстракраниальная допплерография) посредством ультразвуковых датчиков с различной частотой излучения (2, 4, 8 МГц). Сдвиг частоты (разность между частотой излучения и частотой отраженных ультразвуковых волн - допплеровская частота) пропорционален скорости движения крови, в частности эритроцитов, в сосудах и косинусу угла между осью сосуда и датчика. При пересечении потоком эритроцитов ультразвукового луча возникает отраженный сигнал, содержащий набор частот (допплеровский спектр). Набор частот в спектре меняется в течение сердечного цикла. Во время систолы профиль скорости кровотока уплощается и максимум частотного спектра смещается в сторону высоких частот, а ширина спектра уменьшается. Этим обусловлено формирование спектрального «окна». В период диастолы распределение частот более равномерное.
Допплерограмма за сердечный цикл имеет форму пульсограммы. Режимы излучения ультразвукового сигнала непрерывный и импульсный. Непрерывный сигнал позволяет измерять линейную скорость кровотока на относительно больших глубинах, импульсный режим дает возможность определить глубину залегания сосуда и объемную скорость кровотока. В результате в процессе УЗДГ удается получить информацию о состоянии и функции экстракраниальных отделов сонных и позвоночных артерий (экстракраниальная допплерография).
При исследовании сонных артерий определенное значение имеет измерение скорости и направления кровотока в конечной ветви глазничной артерии - надблоковой артерии (ветвь внутренней сонной артерии), анастомозирующей с угловой артерией, и тыльной артерией носа (ветви наружной сонной артерии) в медиальном углу глазницы - допплеровский офтальмический анастомоз (рис. 16.4). При УЗДГ могут быть получены сведения о функционировании этого анастомоза и направленности по нему кровотока, что позволяет судить о возможном стенозе (или окклюзии) в системе внутренней сонной артерии.
Для определения путей коллатерального кровообращения применяются тесты компрессии в доступных для этого местах общей сонной и ветвей наружной сонной артерии.
Таким образом, метод УЗДГ позволяет чрескожно производить измерение линейной скорости кровотока и его направление в неглубоко расположенных сосудах, в том числе в экстракраниальных отделах сонных и позвоночных артерий.
По характеру кровотока в сосуде (ламинарный, турбулентный) можно определить наличие стеноза артерии и его степень.
Кровоток в исследуемых артериях можно оценить по качественным (аудиовизуальным) и количественным характеристикам. Среди качественных показателей учитываются форма допплерограммы, распределение частот в спектре, направленность кровотока, звуковые характеристики допплеровского сигнала. С помощью количественных характеристик можно определить ряд параметров допплерограммы и вычислить индексы по специально разработанным формулам.
В 70-х годах XX в. созданы методики, позволившие получать изображение артерий, что привело к разработке методов ультразвуковой ангиографии, которая, однако, дает возможность судить лишь о состоянии просвета сосуда, не
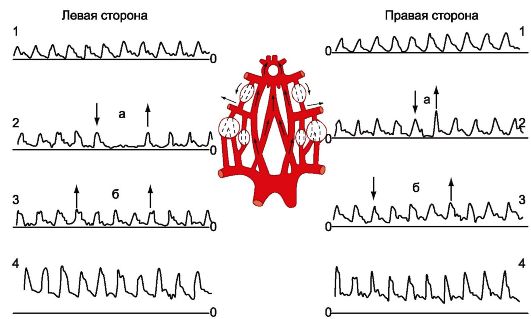
Рис. 16.4. Ультразвуковая допплерограмма (УЗДГ) сонных артерий в норме. 1-3 - надблоковая артерия; 4 - общая сонная артерия; а - компрессия общей сонной артерии; б - компрессия ветвей наружной сонной артерии.
давая при этом информации о его стенке. К тому же в результате УЗДГ, оценивая функциональное состояние сосуда (объемную скорость кровотока и пр.), нельзя определить состояние самого сосуда и выявить сужение его просвета, не превышающее 60%.
Ультразвуковая эхотомография (УЗЭТ), или ультразвуковая ангиография, разработанная в 70-х годах XX в., позволяет визуализировать исследуемые крупные артериальные сосуды, оценивая при этом ширину их просвета и пульсацию. Кроме изучения анатомических особенностей сосудов, оценивают их функциональное состояние с учетом показателей объемной скорости кровотока, характера, локализации и распространенности патологического процесса, но и этот метод не дает возможности выявить начальные изменения в магистральных артериях и достоверно различать интактную артерию и артерию со стенозом менее 60%.
Дуплексное сканирование (ДС) - метод ультразвукового исследования, сочетающий в себе возможности УЗДГ и УЗЭТ, что позволяет одновременно оценивать состояние сосудов и их просвета, а также особенности кровотока в этих сосудах. Диагностические возможности ДС увеличиваются в связи с визуализацией его результатов, при этом удается получить ультразвуковое изображение стенки и просвета сосудов в черно-белом изображении или в режиме цветного допплеровского картирования.
Одним из достоинств дуплексного сканирования является его способность выявлять небольшие атеросклеротические изменения в магистральных артериях, определять морфологию бляшки, диагностировать наличие, уточнять локализацию, степень и протяженность множественных поражений артерий (рис. 16.5).
Показаниями к проведению дуплексного сканирования магистральных артерий головы являются:
1) факторы риска развития атеросклероза этих сосудов, в частности проявления недостаточности мозгового кровообращения;
2) шум, выявляемый при аускультации магистральных сосудов головы;
3) асимметрия или отсутствие пульса и артериального давления на руках;
4) наличие в анамнезе острых нарушений мозгового кровообращения и признаков дисциркуляторной энцефалопатии;
5) наличие объемных патологических процессов на шее;
6) скаленус-синдром.
Несомненна диагностическая ценность метода для выявления сужения просвета экстракраниальных сосудов (от небольших изменений до окклюзии), изучения морфологических особенностей атеросклеротической бляшки, оценки способности магистральных артерий головы участвовать в кровоснабжении мозга.
Дуплексное сканирование информативно при диагностике атеросклероза, неспецифического аортоартериита, деформаций и аневризм экстракраниальных сосудов, ангиодисплазии, а также экстравазальной компрессии артерий, имеющей различное происхождение.
В 1982 г. R. Aaslid и соавт. предложили метод транскраниальной ультразвуковой допплерографии (ТКУЗДГ), позволяющий оценить состояние кровотока в крупных внутричерепных сосудах. С тех пор началось внедрение ультразвуковых устройств, работающих в режиме пульсирующих колебаний и генерирующих ультразвуковые волны высокой частоты (1-2 МГц), способные проникать через кости черепа. Воспринимаемые при проведении ТКУЗДГ сиг-
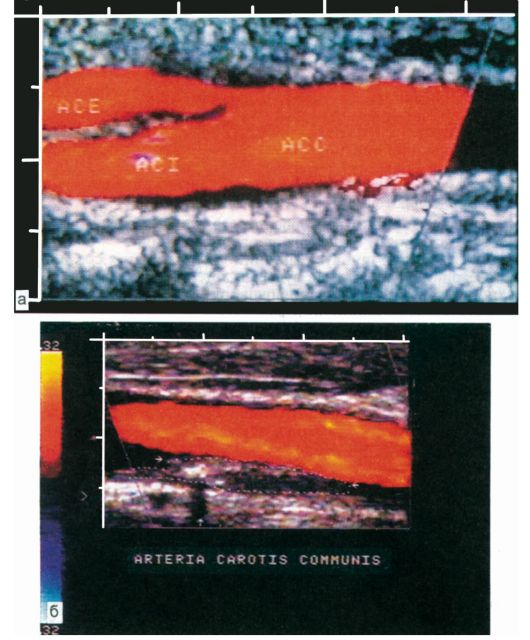
Рис. 16.5 Ультразвуковое изображение в режиме цветового допплеровского картирования бифуркации общей сонной артерии в норме (а) и при наличии атеросклеротической бляшки в общей сонной артерии (б).
налы анализируются с помощью быстрого преобразователя Фурье, создающего возможность получить качественные и количественные данные о состоянии кровотока в исследуемых сосудах. Метод позволяет одномоментно измерять максимальную линейную скорость (систолическую), минимальную линейную скорость (диастолическую), среднюю скорость кровотока и индекс пульсации, отношение разности величин систолической и диастолической линейной скорости кровотока к средней его скорости.
Исследование проводится через основные черепные «окна»: трансорбитальное, транстемпоральное («окно» через чешую височной кости) и трансокципитальное («окно» большого затылочного отверстия). Так, исследование средней мозговой артерии проводится через височное «окно», а для исследования кровотока и транскраниальное дуплексное сканирование в общей и во внутренней сонных артериях используется субмандибулярный доступ; основной артерии - через большое затылочное отверстие.
Транскраниальная допплерография может быть применена для регистрации кровотока не только во внутричерепных артериях, но и в венозной системе головного мозга и способствовать получению информации о состо- янии венозного оттока из полости черепа. Поскольку венозный застой ведет к внутричерепной гипертензии, он может провоцировать псевдотуморозный синдром.
В настоящее время транскраниальная допплерография позволяет выявлять источник и пути коллатерального кровообращения при окклюзирующих поражениях магистральных артерий шеи, определять резервные возможности сосудистой системы мозга, диагностировать окклюзирующие поражения и спазм сосудов артериального круга большого мозга (артериальный круг большого мозга), проводить мониторинг во время нейрохирургических вмешательств, операций на сердце и магистральных сосудах, в некоторых случаях выявлять аневризмы, уточнять эхоструктуру опухолей головного мозга, оценивать эффективность лечения сосудисто-мозговой патологии.
Транскраниальное дуплексное сканирование артерий способствует выявлению стеноза артерий виллизиева круга, спазм мозговых артерий, особенности кол- латерального кровообращения при окклюзирующих поражениях магистральных сосудов головы.
16.4. РЕНТГЕНОЛОГИЧЕСКИЕ МЕТОДЫ
Среди рентгенологических методов исследования наиболее простым и доступным является рентгенография. При обследовании неврологических больных особенно часто применяется рентгенография черепа (краниография) и позвоночника (спондилография).
16.4.1. Краниография
Рентгенографию черепа (краниографию) проводят прежде всего в двух проекциях: боковой и прямой (фронтальной).
Обзорный снимок черепа в боковой проекции дает представление о состоянии черепа в целом: свода и основания черепа, турецкого седла, черепных швов, лицевого скелета. Для его получения больного укладывают на стол таким об- разом, чтобы сагиттальная плоскость черепа была параллельна плоскости стола. Центральный рентгеновский луч направляется на 2 см выше линии, соединяющей верхненаружный край глазницы с наружным слуховым проходом. При правильной укладке на краниограмме должны наслаиваться друг на друга наружные слуховые проходы, верхние стенки глазниц и клиновидные отростки; обращается внимание на четкость контуров турецкого седла.
Для получения краниограммы в прямой (фронтальной) проекции больного укладывают вниз лицом, при этом он только лбом прикасается к кассете. Пра- вильность укладки проверяется по симметричности сосцевидных отростков. На снимке обычно хорошо видны чешуя лобной кости, передние отделы теменных костей, венечный шов. Стоит иметь в виду, что к 35 годам окостенение (синостоз) этого шва заканчивается и он становится неразличимым. На жестких снимках у пациентов в возрасте до 25-30 лет можно видеть ламбдовидный и сагиттальный (стреловидный) швы, а в 1-2% случаев и так называемый ме-
топический шов, расположенный на лобной кости в сагиттальной плоскости и таким образом оказывающийся как бы продолжением сагиттального.
В процессе изучения краниограмм обращается внимание на размеры и форму черепа, линии основания черепа, выраженность дуг его свода, толщину костей и ее идентичность в симметричных костных структурах, состояние черепных швов, у детей раннего возраста - на размеры родничков. Особое внимание уделяется форме и размерам турецкого седла.
По показаниям, возникающим обычно при черепно-мозговой травме или при подозрении на наличие объемных внутричерепных новообразований, проводится краниография при специальных укладках больного.
Для визуализации основания черепа, состояния его отверстий (рваного, овального, остистого), турецкого седла, вершин пирамид височных костей проводят аксиальную краниографию. При подозрении на поражение задней черепной ямки иногда целесообразно получить заднюю полуаксиальную рентгенограмму, на которой можно видеть большое затылочное отверстие и внутренние слуховые проходы.
Если есть основания думать о возможности невриномы VIII нерва, может быть произведена рентгенография пирамид височных костей по Стейнверсу (на снимке при этом выявляются внутренние слуховые проходы, вершины и верхние грани пирамид височных костей), а также снимки височных костей: косой, по Шюллеру, и аксиальный, по Майеру, позволяющие определить состояние внутреннего слухового прохода, ячеек сосцевидного отростка и среднего уха.
Для определения изменений в стенках глазниц проводится передняя полуаксиальная рентгенограмма, по которой можно судить о состоянии глазниц, малых и больших крыльев клиновидной кости и верхних глазных щелей, а также решетчатой кости, лобной и верхнечелюстной (гайморовой) пазухи. При подозрении на опухоль зрительного нерва для выявления их каналов проводятся косые рентгенограммы глазниц по Розе.
В детской нейрохирургической практике для выявления участков истончения и выбухания костей свода черепа целесообразно получить тангенциальные рентгенограммы, выполненные при такой позиции головы больного, при которой исследуемый участок кости занимает краеобразующее положение.
Краниография может выполняться на фоне введенных в ликворные вместилища контрастных веществ. Если в качестве контраста используется воздух, то такой метод называется пневмоэнцефалографией или пневмовентрикулографией. Они отличаются друг от друга прежде всего тем, что в первом случае воздух вво- дится в конечную или в большую цистерну, во втором - в задний или передний рог одного из боковых желудочков (чаще правого желудочка) мозга. Эти методы позволяют уточнить проходимость, объем и форму ликворных пространств, при гидроцефалии дают возможность визуализировать объем и возможную деформацию желудочков мозга. При подозрении на объемный процесс в хиазмально-селлярной области (арахноидальная киста, краниофарингиома, аденома гипофиза) может быть информативной пневмоцистернография, при которой воздух вводится в небольшом количестве через поясничный прокол, при этом его перемещение в субарахноидальном пространстве обеспечивается изменением в определенной последовательности положения головы больного.
Введение воздуха в ликворные пространства ввиду раздражения им стенок желудочковой системы сопровождается резкой распирающей головной болью, иногда рвотой, выраженной общей вегетативной реакцией и подчас весьма тяжело переносится пациентом.
Следует отметить, что краниография после предварительного введения в ликворные пространства воздуха в настоящее время, если имеется такая возможность, успешно заменяется визуализирующими мозг неинвазивными методами: КТили МРТ-исследованиями, позволяющими получить в большинстве случаев достаточно достоверную информацию о состоянии ликворных путей.
16.4.2. Ангиография головного мозга
Ангиография головного мозга (АГ) - это инвазивный метод, представляющий собой серийную краниографию, производимую в процессе внутриартериального введения рентгенконтрастного вещества. Делается серия ангиограмм, отражающих состояние артериального, капиллярного и венозного отделов сосудистой системы мозга или бассейнов определенных мозговых сосудов. Этот метод был предложен в 1927 г. португальским неврологом Е. Моницем (Moniz E.), впервые его применил в клинике в 1936 г. с целью выявления внутричерепной гематомы W. Lohr. Распространение АГ сосудов мозга получила лишь с 50-х годов прошлого века, когда появились подходящие контрастные препараты. В нашей стране метод был внедрен в 1954-1957 гг. ростовскими нейрохирургами В.А. Никольским и Э.С. Темировым.
В настоящее время ангиографические исследования выполняются на рентгеновских аппаратах - сериографах. В качестве рентгеноконтрастного вещества применяются урографин, уротраст, верографин, трийодтраст и другие трийодистые препараты, а также современные рентгеноконтрастные вещества: омнипак, ультравист и др.
Варианты ангиографии сосудов мозга: каротидная, вертебральная и селективная, при которых удается получить ангиограмму бассейна отдельных артерий головного мозга. При каротидной и вертебральной ангиографии проводится прямая чрескожная пункция соответствующего магистрального сосуда головы и через пункционную иглу вводится контрастный препарат. При селективной ангиографии контрастное вещество вводится через катетер, обычно погруженный в бедренную артерию (по Сельдингеру), и далее ретроградно относительно тока крови введенное в соответствующий артериальный мозговой сосуд.
При анализе характера полученных ангиограмм учитывается линейная скорость мозгового кровотока. В норме она составляет 5-8 с, при внутричерепной гипертензии - до 10-15 с. Обычно для заполнения бассейна сонной артерии вводят 8-10 мл контрастного вещества за 1-2 с. В период прохождения контраста через сосудистую систему (артерии, капиллярную сеть и вены) мозга производится серия снимков черепа в прямой и боковой проекциях.
Ангиография нередко позволяет визуализировать сосуды внутричерепной опухоли и, следовательно, способствует ее выявлению. Бедные сосудами опухоли и другие объемные очаги на ангиограммах можно распознать по косвенным признакам, в частности по смещению и деформации расположенных вблизи сосудов мозга. Ангиография особенно информативна при выявлении врожденных аномалий сосудов, участвующих в кровоснабжении мозга, артериальных аневризм и артериовенозных соустий, стеноза или окклюзии от- дельных сосудов; в таких случаях ангиография может обеспечивать информацию, превышающую по значимости более популярные в настоящее время такие неинвазивные методы обследования, как КТ и МРТ. Кроме того, АГ
способствует получению важной информации при диагностике таких объемных патологических очагов, как внутричерепные опухоли и гематомы, абсцессы, паразитарные кисты.
Принимая во внимание высокую степень информативности ангиографии, нельзя не учитывать и возможных осложнений применения этого инвазивного метода рентгеновского исследования. При введении контрастного вещества в сосудистое русло возможны рефлекторные расстройства дыхания, рвота, сердечно-сосудистые реакции (изменения АД, брадиаритмия, пароксизмальная тахикардия, экстрасистолия), иногда с клинической картиной коллапса. Из неврологических расстройств возможны судорожные припадки, преходящие нарушения мозгового кровообращения, очень редко - инсульты. Сосудистомозговые расстройства в таких случаях обычно объясняются спазмом мозговых сосудов. Возникающий при ангиографии отек и иногда сопутствующая дислокация мозга, вероятно, являются следствием реакции на йодсодержащее контрастное вещество в связи с проникновением йода через гематоэнцефалический барьер, что особенно вероятно при его повреждении (черепно-мозговая травма, внутричерепная опухоль и пр.). Осложнения встречаются в 0,4-1,9% случаев; их возникновение зависит от многих причин, в частности от общего состояния больного, его иммунной системы, характера основной церебральной патологии и техники проведения ангиографии.
Дигитальная (цифровая) субтракционная ангиография, при которой контраст вводится внутривенно в меньшем количестве, основана на вычитании бескон- трастного рентгенологического изображения из контрастного, что позволяет элиминировать сигналы от костей и улучшает четкость изображения сосудов. Метод обладает меньшей, чем обычная КТ, разрешающей способностью, но может помочь диагностике, например, таких форм сосудистой патологии, как стеноз сонной артерии или тромбоз сагиттального синуса.
16.4.3. Спондилография
Рентгенография позвоночника, или спондилография, проводится для уточнения характера поражения позвоночного столба, а также сопряженных с вертебральной патологией заболеваний спинного мозга и периферической нервной системы.
Обычно делаются рентгеновские снимки фрагмента позвоночника, охватывающего в среднем 4-6 позвонков, во взаимно перпендикулярных проекциях (задней и боковой). Изучаются стенки и просвет позвоночного канала и межпозвонковых отверстий, форма, структура и контуры тел позвонков, их дуг, суставных, остистых и поперечных отростков, а также состояние межпозвонковых дисков и суставов; особое значение придается дорсальной поверхности тел позвонков, патологическим обызвествлениям в позвоночном канале и в паравертебральных тканях. Могут быть выявлены остеофиты, расщепление дужек позвонков, сакрализация V поясничного или люмбализация I крестцового позвонков, катушечная форма тел позвонков, их разрежение (трабекулярность), характерное для гормональной спондилопатии, гемангиомы тел позвонков, компрессионный перелом тела позвонка, клин Урбана (вклинение фрагмента тела разрушенного позвонка в позвоночный канал), обычно неравномерное истончение корней дужек позвонка и расширение позвоночного канала (симптом Элсберга-Дайка), характерные для экстрамедуллярной внутрипозвоночной опухоли, и др.
Анализ спондилограмм и раннее выявление признаков развивающейся патологии подчас затруднительны ввиду сложности анатомического строения объекта обследования и наслоения на него изображений других органов и тканей.
Дополнительная информация может быть получена на так называемых функциональных спондилограммах, выполненных при обычном положении позвоночника и при максимальном его сгибании, разгибании и наклонах в стороны. Это помогает определению биомеханических возможностей позвоночника и состояния отдельных его сегментов. Информативность функциональных спондилограмм особенно значительна при дегенеративных изменениях в позвоночнике, при последствиях травматического его поражения (но не в острой фазе!). Возможно выявление нестабильности позвоночника, спондилолистеза и других проявлений остеохондроза, а также кальцинации связочного аппарата позвоночного столба, особенно значительной при анкилозирующем спондилоартрите (болезни Бехтерева).
16.4.4. Миелография
С целью расширения возможностей спондилографии в распознавании прежде всего внутрипозвоночных новообразований американский нейрохирург W.E. Dandy (1886-1946) в 1919 г. предложил метод пневмомиелографии - спондилографии в процессе введения при поясничном проколе в конечную (терминальную) ликворную цистерну воздуха. Воздушный пузырь, создаваемый в субарахноидальном пространстве, распространяется вверх и в случае сужения и тем более перекрытия патологическим очагом этого пространства на спинальном уровне (чаще при экстрамедуллярной опухоли или кистозном арахноидите) задерживается под его нижним полюсом.
Метод совершенствовался и получил значительное распространение, но контрастность воздуха зачатую оказывается недостаточной; вместо него стали вводить йодсодержащие растворы, нерастворимые в цереброспинальной жидкости (раствор йода в маковом масле - липоидол, или йодлипол), которые обычно вводили через цистернальный прокол (прокол большой, или прокол мозжечково-мозговой цистерны). Тяжелое контрастное вещество, спускаясь по субарахноидальным спинальным пространствам, задерживалось над верхним полюсом, перекрывающего спинальные ликворные пути патологического очага. Не удаленный во время операции липоидол оставался в подоболочечном пространстве в течение многих лет, иногда обусловливая клинические проявления асептического арахноидита.
Ввиду возможных осложнений после введения липоидола несколько позже были предложены водорастворимые органические соединения йода. Наибольшее признание получили йодфенилундецилаты (пантопак, майодил и др.). Эти препараты могут вводиться через поясничный прокол (восходящая миелография). Имея меньшую вязкость по сравнению с липоидолом, они заполняют очень узкие, щелевидные пространства, корешковые «карманы», со временем всасываются и выделяются из организма.
С внедрением в практику КТ и особенно МРТ значимость миелографии уменьшилась и стала реже производиться. Однако для повышения эффективности обследования больного КТ иногда комбинируется с миелографией.
16.5. МЕТОДЫ ВИЗУАЛИЗАЦИИ МОЗГА
Для визуализации мозга применяют группу современных неинвазивных методов исследования: компьютерную, магнитно-резонансную, позитронноэлектронную томографию. Эти методы основаны на различных технических принципах, позволяющих видеть на дисплее, а затем и на рентгеновской пленке точные изображения срезов головы, в частности головного мозга. Возникает возможность судить о состоянии ткани мозга на любой глубине, о его ликворных путях, а также о хрящевых структурах, в том числе межпозвонковых дисках. Возможно выявление очагов деструкции в ткани мозга, участков демиелинизации, гидроцефалии, деформации желудочков мозга и подоболочечных пространств и, наконец, объемных патологических очагов: гематом, опухолей, абсцессов, мозговых кист, инфекционных гранул, а при проведении позит- ронно-электронной томографии удается наблюдать за состоянием некоторых метаболических процессов.
16.5.1. Компьютерная томография
Компьютерная аксиальная томография (КТ) головного мозга была введена в клиническую практику в 70-х годах XX в. и до настоящего времени является наиболее распространенным неинвазивным методом визуализации живых тканей и, в частности, ткани мозга (рис. 16.6).
Метод компьютерной томографии теоретически разработал в 1962-1963 гг. американский ученый А. McCormack. Практическую реализацию идеи - создание аппарата для исследования головы и первый опыт сканирования мозга осуществил в 1971-1972 гг. C. Hounsfield - инженер английской фирмы элек- тромузыкальных инструментов EMI. В 1979 г. А. McCormack и C. Hounsfield
была присуждена Нобелевская премия по медицине и биологии. К этому времени уже было создано 26 моделей компьютерного томографа.
Компьютерная томография - неинвазивный метод исследования анатомических структур, основанных на компьютерной обработке рентгенологических изображений. Внедрение в практику компьютерного томографа ознаменовало новый этап развития медицинской техники и значительно расширило возможности диагностики многих неврологических заболеваний.
При проведении компьютерной томографии осуществляется круговое просвечивание объекта рентгеновскими лучами и последующее построение с помощью компьютера его послойного изображения.
Рис. 16.6. МРТ головного мозга пациента 65 лет, возрастная норма.
Компьютерный томограф состоит из сканирующего устройства, стола для пациента, консоли и специализированной компьютерной техники. Сканирующее устройство представляет собой круговую раму с вращающейся рентгеновской трубкой и блоком детекторов, число которых в современных аппаратах достигает 3-5 тыс., что позволяет значительно ускорить время сканирования каждого среза - до 2-5 с. Консоль в сочетании с компьютерной техникой осуществляет управление сканированием и обработку данных, реконструкцию изображения, архивирование томограмм.
Компьютер выполняет математическую реконструкцию вычисленных коэффициентов абсорбции (КА) рентгеновских лучей и их пространственное распространение на многоклеточной матрице с последующей трансформацией в виде черно-белого или цветного изображения на экране дисплея. Изображение среза при этом имеет большое количество полутонов, зависящих от КА.
КА обозначается в относительных единицах (Н) по шкале (единицы Хаунсфилда). Шкала составлена в соответствии с физическими замерами КА, при этом КА различных тканей сравнивается с поглощающей способностью воды. Диапазон шкалы плотностей в настоящее время определяется в пределах от - 1000 ед. Н до +1000 ед. Н, при этом за 0 принимается КА воды. Плотность кости равна +500 ед. Н, плотность воздуха -500 ед. Н.
КТ обеспечивает денситометрию - определение плотности тканей и сред организма. Гиперденсивными (более плотными, чем обычная мозговая ткань, и дающими яркий сигнал) являются гематомы, менингиомы, цистицерки, очаги кальцификации; гиподенсивными (низкая плотность с темным сигналом) оказываются зоны ишемического инфаркта, энцефалитических очагов, некоторые глиальные и метастатические опухоли, кисты, редко выявляемые на КТ очаги демиелинизации.
При КТ единственным фактором, определяющим контрастность изображения тканей, является их электронная плотность. Существует линейная зависимость между степенью поглощения рентгеновских лучей и гематокритом, концентрацией белков и гемоглобина, что определяет высокую плотность острых гематом. Вклад кальция крови в рентгеновскую плотность гематом незначителен. Атом железа, входящий в состав гемоглобина, также не играет существенной роли, так как составляет всего 0,5% от массы молекулы. Таким образом, характер изображения внутричерепной гематомы на КТ определяется ее плотностью, объемом, локализацией и такими параметрами, как толщина среза, уровень и ширина окна (заданная оператором часть из полного диапазона шкалы коэффициентов поглощения, которой соответствует перепад величины яркости от белого до черного), угол сканирования. Участки пониженной плотности в острых гематомах могут быть обусловлены наличием жидкой несвернувшейся крови, что возможно при очень быстром кровоизлиянии. Атипично низкую плотность на КТ могут иметь острые гематомы у больных с выраженной анемией из-за низкой концентрации гемоглобина и у больных с коагулопатиями, при которых происходит неполноценное формирование кровяного сгустка. Со временем плотность гематомы обычно уменьшается приблизительно на 1,5 ед. Н в сут. Между 1 и 6 нед (чаще через 2-4 нед) после инсульта внутричерепные гематомы проходят стадию изоденсивности (идентичная электронная плотность), а затем и гиподенсивности по отношению к мозговой ткани. Появление участка повышенной плотности в хронической гематоме чаще обусловлено повторным кровотечением, при этом на дисплее возникает изображение, напоминающее кровоизлияние в опухоль.
В процессе КТ-исследования может быть произведено контрастное усиление изображения сосудов путем введения в кровяное русло, обычно в вену, контрастных веществ (гипак, урографин и др.), что помогает в некоторых случаях выявить патологический очаг, определить его границы и степень васкуляризации. Иногда контрастное вещество вводится в ликворные пути, что помогает уточнить состояние у больного ликворных путей, в частности ликворных цистерн, и судить таким образом о ликвородинамике.
С внедрением в клиническую практику КТ на получаемых изображениях срезов головы впервые удалось видеть ткань мозга, изучать его строение на уровне различных срезов, установить наличие деформации мозговых желудочков, дислокации и атрофии мозговой ткани, в частности атрофические процессы в мозге при дисциркуляторной энцефалопатии. Высокая разрешающая способность КТ позволяет видеть на экране дисплея и фотопленке не только желудочковую систему, субарахноидальные пространства и их деформации, но и дифференцировать белое и серое вещество мозга, кровоизлияния в полости черепа, мозговые кисты, внутричерепные новообразования.
К сожалению, ишемические очаги диагносцируются на КТ обычно лишь на вторые сутки, редко удается обнаружить очаги демиелинизации при рассеянном склерозе. Значение метода в диагностике поражений мозга уменьшается и в связи с тем, что изображения срезов головы и позвоночника можно получить только в одном, поперечном к оси тела (аксиальном) направлении. Эти ограничения возможностей КТ могут быть преодолены путем применения МРТ.
Вместе с тем КТ имеет и некоторые преимущества в сравнении с МРТ: на КТ раньше выявляется кровоизлияние, четче, чем на КТ, определяются признаки костной патологии.
По показаниям, в частности для диагностики внутричерепных новообразований, при КТ применяется контрастирование, которое, однако, ограничивается возможностью изменения функции почек и аллергическими реакциями.
Сочетание КТ и цистернографии после ведения через поясничный прокол в субарахноидальное пространство рентгенопозитивного контрастного вещества известно как компьютерно-томографическая цистернография (КТЦГ).
Внедрению КТЦГ в клиническую практику способствовала разработка неионных рентгеноконтрастных веществ, таких как омнипак, ультравист. Метод эффективен для уточнения диагноза при гидроцефалии, порэнцефалии, кистах различной локализации и ликворных фистул (ликвореи). КТЦГ удачно соединяет возможности визуализации мозговых и костных структур и движения контрастного вещества, отражающего некоторые особенности состояния ликвородинамики.
Противопоказанием к КТЦГ является аллергическая реакция на контрастное вещество и блокада субарахноидальных путей выше места поясничного прокола, посредством которого контраст после премедикации (церукал, антигистаминные препараты, транквилизаторы) медленно (1-2 мл/с) вводится в подоболочечные пространства. При введении контраста возможно возникновение умеренных корешковых болей, тошнота. Если исследование проводится больному натощак, рвота у него обычно не возникает. Возможны преходящие проявления менингизма. После исследования больному рекомендуется постельный режим и употребление повышенного количества жидкости в течение суток.
Проявлением расширения возможностей метода КТ головы является трехмерная компьютерно-томографическая реконструкция (ТКТР) - одно из пос-
ледних достижений рентгеновской КТ, позволяющее получать объемные изображения костей, мягких тканей и сосудов в различных плоскостях и под различными углами. Этот метод стал применяться после внедрения в практику компьютеров нового поколения - спиральных рентгеновских томографов, которые позволяют получить реконструированные изображения, что особенно важно для изучения особенностей черепно-мозговой травмы, сопровождающейся переломом и выраженной деформацией костей черепа. Для получения ТКТР под разными углами строятся проекции срезов черепа (от 3 до 6), что обеспечивает формирование стереоскопического изображения заданной зоны черепа и мозга, при этом возникает возможность выявления деталей повреждений черепа сложной конфигурации и изучения их как с внешней стороны, так и с внутренней стороны костей черепа.
16.5.2. Магнитно-резонансная томография
Магнитно-резонансная томография (МРТ) - современный неинвазивный диагностический метод, обеспечивающий визуализацию глубоко расположенных биологических тканей, нашедший широкое применение в медицинской практике, в частности в неврологии и нейрохирургии.
МРТ, как следует из названия, основан на явлении ядерного магнитного резонанса (ЯМР), открытого в 1946 г. F. Bloch. Суть ЯМР сводится к следующему. Ядра химических элементов в твердом, жидком или газообразном веществе можно представить как быстро вращающиеся вокруг своей оси магниты. Если эти ядра-магниты поместить во внешнее магнитное поле, то оси вращения начнут прецессировать (т.е. вращаться вокруг направления силовой линии внешнего магнитного поля), причем скорость прецессии зависит от величины напряженности магнитного поля. Если теперь исследуемый образец облучить радиоволной, то при равенстве частоты радиоволны и частоты прецессии наступит резонансное поглощение энергии радиоволны «замагниченными» ядрами. После прекращения облучения ядра атомов будут переходить в первоначальное состояние (релаксировать), при этом энергия, накопленная при облучении, будет высвобождаться в виде электромагнитных колебаний, которые можно зарегистрировать с помощью специальной аппаратуры.
В медицинских томографах по ряду причин используется регистрация ЯМР на протонах - ядрах атомов водорода, входящих в состав молекулы воды. В силу того, что используемый в МРТ метод чрезвычайно чувствителен даже к незначительным изменениям концентрации водорода, с его помощью удается не только надежно идентифицировать различные ткани, но и отличать нормальные ткани от опухолевых (Damadian R., 1971).
Современные томографы позволяют путем сканирования получить томограммы в произвольно ориентированной плоскости без изменения положения пациента. В МРТ-исследовании используются аналогичные КТ, принципы пространственного кодирования информации и обработки данных. За одно сканирование сбор данных обычно производится приблизительно с 20 уровней черепа и мозга с толщиной среза в 4-5 мм. Время сканирования зависит от поставленных задач и параметров магнитно-резонансного томографа и составляет в среднем 2-7 мин. В конечном итоге на экране дисплея появляются изображения срезов исследуемой ткани, в частности ткани мозга. При стан-
дартном сканировании в процессе МР-томографии используются программы, позволяющие получить изображения, контрастность которых определяется в основном Т1- и Т2-релаксационным временем. T1 - это величина, характеризующая среднее время пребывания протонов на верхнем энергетическом уровне (T1 - время продольной релаксации); Т2 - константа, отражающая скорость распада синхронной прецессии протонов (Т2 - время поперечной релаксации).
На МРТ, выполненных в режиме T1, мозговое вещество выглядит более светлым, чем на томограммах в режиме Т2. ЦСЖ на томограммах T1, представляется более темной, чем на томограммах Т2. Интенсивность сигналов от патологически измененных тканей зависит от релаксационного времени (Т1 и Т2).
МРТ-исследование позволяет дифференцировать некоторые особенности состава исследуемых тканей и происходящих в них метаболических изменениях, в частности изменение гидрофильности ткани по результатам изучения интенсивности сигналов атомов водорода, натрия, калия, фосфора, кальция и других элементов в нормальной и патологически измененной ткани мозга.
Метод МРТ создает возможность визуализировать на экране дисплея, а затем и на пленке срезы черепа и головного мозга, позвоночного столба и спинного мозга. Информация, полученная в режимах Т1 и Т2, позволяет дифференцировать серое и белое вещество мозга, судить о состоянии его желудочковой системы, субарахноидального пространства, выявлять многие формы патологии, в частности объемные процессы в мозге, зоны демиелинизации, очаги воспаления и отека, гидроцефалию, травматические повреждения, гематомы, абсцессы, кисты, очаги проявления нарушений мозгового кровообращения по ишемическому и геморрагическому типу (кстати, ишемические очаги в мозге могут быть выявлены в гиподенсивной форме уже через 2-4 ч после инсульта).
Немаловажным преимуществом МРТ перед КТ является возможность получения изображения в любой проекции: аксиальной, фронтальной, сагиттальной. Это позволяет визуализировать субтенториальное пространство, позвоночный канал, выявить невриному слухового нерва в полости внутреннего слухового прохода, опухоль гипофиза, субдуральную гематому в подостром периоде, даже в тех случаях, когда на КТ она не визуализируется. МРТ стала основным методом выявления некоторых форм аномалий: аномалии мозолистого тела, аномалии Арнольда-Киари, очаги демиелинизации в паравентрикулярном и других отделах белого вещества мозга при рассеянном склерозе. На МРТ раньше, чем на КТ, выявляются очаги ишемии мозга; их можно выявить в стволе мозга, в мозжечке, в височной доле. На МРТ хорошо видны контузионные очаги, абсцессы мозга и зоны отека мозговой ткани. Важная роль отводится МРТ при выяснении причин деменции. В то же время изменения мозговой ткани зачастую неспецифичны и подчас сложно дифференцировать, например, очаги ишемии и демиелинизации.
Ценная информация выявляется на МР-томограммах позвоночника, особенно на сагиттальных срезах, при этом визуализируются структурные проявления остеохондроза, в частности состояние позвонков и связочного аппарата, межпозвонковых дисков, их пролабирование и воздействие на твердую мозговую оболочку, спинной мозг, конский хвост; визуализируются также внутрипозвоночные новообразования, проявления гидромиелии, гематомиелии и многие другие патологические процессы.
Диагностический потенциал МРТ можно повысить предварительным введением некоторых контрастных веществ. В качестве вводимого в кровяное
русло контрастного вещества обычно применяется элемент из группы редкоземельных металлов - гадолиний, обладающий свойствами парамагнетика. Стандартная доза препарата (0,1 ммоль/кг) вводится внутривенно. Оптимальное контрастирование отмечается на Т1-взвешенных снимках; значительно слабее контрастное усиление на Т2-взвешенных снимках. При сохранности гематоэнцефалического барьера (ГЭБ) контрастное вещество в головной мозг не проникает. В местах нарушенной целостности ГЭБ введенный внутривенно гадолиний проникает в вещество мозга, вызывая усиление МР-сигнала. В таких случаях накопление контрастного вещества в менингиомах, метастатических опухолях, аденомах гипофиза проявляется практически сразу после введения, а, например, при некоторых демиелинизирующих заболеваниях мозга контрастное вещество накапливается медленно и в связи с этим МРТ следует проводить не сразу после введения контраста, а через 30-40 мин.
Преимущество МРТ перед КТ наиболее очевидно при исследовании тех отделов нервной системы, изображение которых нельзя получить с помощью КТ из-за перекрытия исследуемой мозговой ткани прилежащими костными структурами. Кроме того, при МРТ можно различать недоступные КТ изме- нения плотности ткани мозга, белое и серое вещество, выявлять поражение ткани мозга (очаги демиелинизации) при рассеянном склерозе и пр.
При МРТ больной не подвергается ионизирующему облучению. Вместе с тем для применения МРТ есть некоторые ограничения. Так, МРТ противопоказана при наличии в полости черепа металлических инородных тел, так как существует опасность их смещения под действием магнитного поля и, сле- довательно, дополнительного повреждения близлежащих структур головного мозга. Противопоказана МРТ при наличии у больных наружного водителя ритма, беременности, выраженной клаустрофобии (боязни пребывания в небольшом помещении). Осложняет применение МРТ-обследования его длительность (30-60 мин), в течение которого пациент должен находиться в неподвижном состоянии.

16.5.3. Позитронная эмиссионная томография
Позитронная эмиссионная томография (ПЭТ) - метод, который, помимо визуализации мозга, позволяет получить информацию о характере происходящих в нем метаболических процессов в норме и при патологии. В настоящее
время этот метод получил распространение только в высокоразвитых странах ввиду его высокой стоимости.
Суть метода ПЭТ заключается в высокоэффективном способе слежения за чрезвычайно малыми концентрациями ультракороткоживущих радионуклидов (УКЖР), которыми помечены изучаемые в организме ткани, что позволяет исследовать происходящие в них метаболические процессы. Используется свойство неустойчивости ядер УКЖР, в которых количество протонов превышает количество нейтронов. При переходе ядра в устойчивое состояние оно излучает позитрон, свободный пробег которого (около 1 мм) заканчивается столкновением с электроном и их аннигиляцией. Аннигиляция сопровождается появлением фотонов с энергией 511 кэВ, летящих в строго противоположных направлениях. Эти фотоны можно зарегистрировать с помощью системы детекторов. Если детекторы расположить в виде кольца вокруг исследуемого объекта, то можно зарегистрировать все акты аннигиляции в этой плоскости, а при присоединении к системе электронно-вычислительного комплекса, используя специальные программы реконструкции, - получить изображение распределения концентрации УКЖР.
Для уменьшения радиационной нагрузки на пациента при ПЭТ-обследовании применяют короткоживущие изотопы с периодами полураспада от 2 до 110 мин. Это практически исключает возможность транспортировки ПЭТ-изотопов на значительные расстояния. Такова основная причина того, что на территории лечебного учреждения, как правило, размещается весь комплекс оборудования, необходимый для проведения ПЭТ-исследования, включающий циклотрон: ускоритель, на котором производятся УКЖР, радиохимическую лабораторию по производству РФП, линию транспортировки РФП и ПЭТ-камеру.
В процессе исследования больных ПЭТ позволяет изучать состояние мозгового кровотока, уровень потребления мозговой тканью кислорода, глюкозы, синтез белков, выявлять маркеры опухолей и контролировать некоторые другие параметры, определяющие характер различных метаболических процессов. Выявляя с помощью меченых УКЖР нарушения мозгового кровотока и особенности происходящих в мозговой ткани обменных процессов, можно расширить диапазон возможностей диагностики определенных заболеваний, в частности болезней неврологического профиля.
При поражении мозга ПЭТ-исследование может визуализировать изменения в мозговой ткани, которые нельзя выявить другими методами. Так, при инсульте в острой стадии ПЭТ позволяет рано выявить нежизнеспособные участки мозговой ткани, оценить их объем и локализацию. При эпилепсии ПЭТ с 18- ФДГ1 дает возможность в межприступном периоде обнаружить участок мозга, в котором имеется снижение метаболизма глюкозы, характерное для эпилептогенного фокуса и его перифокальной зоны.
При хорее Гентингтона, когда на КТ и МРТ не удается обнаружить патологических изменений, при ПЭТ может быть выявлено понижение метаболизма глюкозы в полосатом теле.
Таким образом, ПЭТ может во многом содействовать уточнению патогенеза некоторых заболеваний нервной системы и во многих клинических случаях способствовать уточнению клинического диагноза. Этот метод практически не имеет противопоказаний для применения и со временем, надо надеяться, станет более доступным для невропатологов и нейрохирургов.
118-ФДГ - Ф-дезоксиглюкоза.