Аналитическая химия. Практикум : учеб. пособие / Харитонов Ю.Я., Григорьева В.Ю. - 2009. - 296 с.
|
|
|
|
Тема V АНАЛИЗ СМЕСЕЙ КАТИОНОВ И АНИОНОВ (КАЧЕСТВЕННЫЙ ХИМИЧЕСКИЙ АНАЛИЗ ВЕЩЕСТВА)
На изучение темы отводится одно занятие.
Занятие 12. Качественный химический анализ твердофазного вещества
Цель занятия:
научиться проводить качественный анализ твердофазного вещества на примере анализа соли или смеси солей. Задание для самоподготовки
Для выполнения лабораторной работы надо знать
1. Как проводить подготовку к качественному химическому анализу вещества.
2. Как выбрать схему качественного анализа вещества.
3. Как проводить предварительные наблюдения и испытания.
4. Как переводить анализируемый твердофазный образец в раствор.
5. Как проводить открытие катионов.
6. Как проводить открытие анионов.
7. Правила техники безопасности и работы в химико-аналитической лаборатории.
Уметь
1. Проводить аналитические реакции катионов и анионов полу-микрометодом.
2. Выполнять микрокристаллоскопические реакции.
3. Открывать в ходе предварительных испытаний ряд катионов и анионов.
4. Проводить визуальные наблюдения и делать правильные выводы из них.
5. Вести протокол анализа.
6. Оказывать первую помощь при несчастном случае в химической лаборатории.
Литература
Харитонов Ю.Я. Аналитическая химия (аналитика). Кн. 1, гл. 19,
с. 501-514.
Лурье Ю.Ю. Cправочник по аналитической химии. - М.: Химия,
1989.
Вопросы для самопроверки
1. Объясните на конкретном примере, в чем состоит сущность дробного анализа катионов и анионов.
2. Объясните, в чем состоит сущность систематического анализа катионов.
3. Перечислите катионы, летучие соли которых окрашивают пламя горелки.
4. Приведите микрокристаллоскопические реакции, применяемые в ходе анализа катионов.
5. Назовите катионы, дающие окрашенные аквокомплексы.
6. Каким образом можно перевести в раствор следующие соединения:
а) хлорид свинца, сульфат свинца;
б) сульфаты кальция, стронция, бария;
в) соли висмута(Ш);
д) гидроксиды цинка, меди, кобальта, никеля, кадмия.
7. Как отделить катионы первой аналитической группы от катионов второй - шестой аналитических групп?
8. Перечислите основные этапы хода анализа анионов.
9. Что такое «содовая вытяжка»?
10. Чем отличается ход анализа смеси анионов в присутствии катионов тяжелых металлов от хода анализа анионов в их отсутствие?
11. Какова роль групповых реакций в анализе катионов и анионов? Перечислите основные этапы анализа «сухой» соли. C какой целью проводят предварительные испытания и наблюдения при анализе неизвестного образца?
Материальное обеспечение
Посуда, реактивы, приборы, справочная литература - указаны при описании предыдущих работ по качественному анализу катионов и анионов.
Учебные таблицы
1. Cхема анализа катионов всех аналитических групп.
2. Ход анализа шести аналитических групп катионов по кислотно-основному методу.
3. Cхема анализа анионов.
Лабораторная работа
Качественный химический анализ вещества (соли или смеси солей)
В общем случае анализируемый твердофазный объект может содержать любой из катионов всех шести аналитических групп и анионов по классификации, основанной на образовании малорастворимых солей.
Проведение анализа такого объекта - длительная и трудоемкая процедура, которая может быть осуществлена в течение нескольких занятий. В учебных целях эту процедуру целесообразно упростить, взяв для анализа соль или смесь солей, содержащих лишь ограниченное число катионов и анионов. В связи с этим далее охарактеризованы два варианта лабораторной работы:
1) упрощенный вариант анализа, рассчитанный на одно занятие;
2) общий вариант полного анализа.
1. Упрощенный вариант анализа (анализ «сухой» соли)
Контрольную задачу получают в виде измельченной сухой соли или смеси солей.
: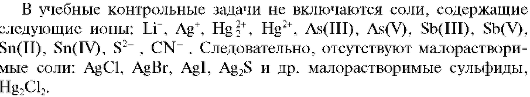
Необходимо учитывать, что при смешении возможны химические реакции между компонентами смеси, приводящие к образованию новых (в том числе окрашенных) соединений.
Полученное для анализа вещество делят на три части: одну часть используют для обнаружения катионов, вторую - для обнаружения анионов, а третью - для проведения предварительных испытаний и проверки результатов анализа.
Методика выполнения работы
1. Предварительные наблюдения и испытания
Имеют целью на основании визуальных наблюдений и выполнения некоторых дробных реакций обнаружения катионов и анионов сделать предварительные выводы о качественном составе анализируемого образца.
1.1. Органолептический анализ
Определяют цвет, запах анализируемого вещества, его однородность при рассматривании под лупой или под микроскопом и делают соответствующие выводы.
Так, характерная окраска исследуемого образца может быть обусловлена как наличием окрашенных солей катионов хрома, железа, кобальта, никеля, меди, так и продуктов их взаимодействия (например, роданида железа). Белая же окраска образца свидетельствует об отсутствии этих катионов. Обводненность смеси может быть следствием ее гигроскопичности или растворения одной соли в кристаллизационной воде другой соли.
ВНИМАНИЕ! Запрещается пробовать анализируемые вещества на вкус!
1.2. Окрашивание пламени газовой горелки позволяет обнаружить некоторые катионы.
Несколько крупинок анализируемого вещества, смоченного каплей концентрированной HCl, вносят при помощи нихромовой проволоки (или прокаленного графитового стержня) в бесцветное пламя газовой горелки и наблюдают окрашивание пламени. При наличии летучих солей натрия, калия, кальция, стронция, бария, висмута, свинца, мышьяка, сурьмы пламя горелки окрашивается в характерные цвета.
1.3. Действие разбавленной серной кислоты
К небольшому (~0,01 г) количеству исследуемого вещества прибавляют несколько капель разбавленной серной кислоты. При наличии карбонат-иона происходит энергичное вспенивание за счет выделения CO2, сопровождающееся шипением. При наличии хлорид-, сульфит-, тиосульфатили ацетат-ионов выделяются бесцветные газы, имеющие характерный запах. При наличии нитрат-иона выделяется красно-бурый газ с резким запахом.
1.4. Действие концентрированной серной кислоты
ВНИМАНИЕ! Работать с серной кислотой _с большой осторожностью!_
К ~0,01 г вещества добавляют несколько капель кислоты. При этом разрушаются не только перечисленные выше анионы, но также нитрат-, хлорид-, бромид-, иодид-анионы, о выделении которых можно судить по характерному цвету и запаху.
На основании предварительных испытаний делают предположения о составе анализируемой смеси, которые дополняют и уточняют в ходе последующего анализа.
2. Перевод вещества в растворенное состояние
Для подбора растворителя берут ~0,01 г вещества и 0,5-1,0 мл растворителя. Подбор растворителя начинают с проверки растворимости исследуемого вещества в дистиллированной воде. Если исследуемое вещество не растворимо в воде, пробуют растворимость его в разбавленных, а затем в концентрированных кислотах - уксусной, азотной, хлороводородной. Далее проверяют растворимость вещества в растворах едких щелочей, карбонатов и аммиака.
К следующему растворителю переходят, если вещество не растворяется в предыдущем. Вначале пробуют растворить исследуемое вещество при комнатной температуре, затем при нагревании.
По ходу подбора растворителя делают соответствующие выводы о возможном составе образца. Так, полная растворимость в воде свидетельствует об отсутствии карбонатов, сульфатов, фосфатов катионов второй - шестой аналитических групп. Растворимость в едких щелочах свидетельствует о наличии катиона четвертой группы либо свинца; растворимость в растворе аммиака - катиона шестой группы либо цинка.
2.1. Растворение в воде
Анализируемое вещество может растворяться в воде полностью или частично. При полной растворимости можно воздержаться от испытаний другими растворителями. Пробу на частичную растворимость проводят следующим образом. Небольшое количество (2-3 мг)веще-ства встряхивают в пробирке с 1-2 мл воды и центрифугируют. Две-три капли центрифугата выпаривают досуха на предметном стекле. Наличие налета на стекле указывает на частичную растворимость вещества в воде. При частичной растворимости вещества в воде водный раствор необходимо отделить от осадка, а для осадка подобрать подходящий растворитель.
2.2. Растворение в разбавленных кислотах (уксусной, азотной, хлороводородной)
Испытание на растворимость в кислотах проводят, если соль полностью не растворяется в воде. Для этого используют 2-3 мг сухой соли. Cледует учитывать, что сульфаты катионов третьей группы и свинца не растворяются в указанных выше кислотах. Для их перевода в раствор прибегают к обработке насыщенным раствором карбоната натрия или калия.
2.3. Обработка насыщенным раствором карбоната натрия (соды) или карбоната калия (поташа)
Cульфаты катионов третьей аналитической группы и свинца переводят в раствор путем многократной обработки насыщенным раствором карбоната натрия при нагревании и последующем растворении осадка в 2 моль/л уксусной кислоте. Вместо соды в этом процессе можно применить карбонат калия (поташ).
После перевода образца в раствор приступают к обнаружению катиона (если анализируемая соль двойная - присутствуют два катиона).
3. Обнаружение катиона
Растворяют 0,2- 0,3 г вещества в 10 мл подобранного растворителя. Если вещество растворено в дистиллированной воде, проверяют рН раствора, обращают внимание на окраску раствора и делают соответствующие выводы о природе соли.
3.1. Предварительные испытания Определяют:
- дробным методом - присутствие отдельных катионов , Fe2+,Fe3+,Cr3+,Mn2+,Ni2+,Cu2+), используя специфические и характерные реакции;
- присутствие отдельных групп катионов, действуя групповыми реагентами по ходу анализа.
3.2. Обнаружение катиона по систематическому ходу анализа
По систематическому ходу анализа определяют катионы, учитывая обнаруженные в предварительных испытаниях группы катионов, и дробным методом (см. выше) те катионы, присутствие которых доказано действием групповых реагентов. К ним также относятся катионы первой аналитической группы К+ и?+. Во избежание ошибок в ходе анализа необходимо добиваться полного разделения групп и отделения отдельных катионов.
Все операции по анализу «сухой» соли и вывод о присутствии в ее составе катионов должны быть зафиксированы в лабораторном журнале в форме протокола.
4. Обнаружение аниона
В зависимости от присутствующего катиона выбирают соответствующую схему анализа.
4.1. Присутствует только катион первой группы
В этом случае 0,2-0,3 г анализируемой смеси растворяют в 10 мл дистиллированной воды. В полученном растворе определяют анион, используя ранее изученную схему анализа смеси анионов.
4.2. Присутствует катион второй - шестой групп
В этом случае катион отделяют от аниона способом «содовой вытяжки» или методом ионообменной хроматографии. Предварительно испытывают анализируемую соль на содержание карбонат-иона.
Отделение катиона способом «содовой вытяжки» проводят следующим образом.
К 0,2-0,3 г сухойсоливтиглеприбавляют~1 г карбоната натрия, приливают 5 мл дистиллированной воды, перемешивают стеклянной палочкой, нагревают до кипения и кипятят в течение 5 мин, прибавляя воду по мере ее испарения. После этого содержимое тигля переносят в центрифужную пробирку и отделяют раствор («содовую вытяжку») от осадка. В осадке остаются катионы «тяжелых» металлов, а в раствор переходят анионы.
Большую часть «содовой вытяжки» нейтрализуют 2 моль/л уксусной кислотой для удаления избытка карбоната натрия. Нейтрализацию раствора проводят осторожно, хорошо перемешивая жидкость после прибавления каждой капли кислоты, тщательно избегая избытка ее, так как некоторые анионы (например, нитрит-ионы) могут быть потеряны.
Нейтрализованную уксусной кислотой «содовую вытяжку» используют для обнаружения анионов.
Оставшуюся часть «содовой вытяжки» осторожно нейтрализуют.
Отделение катионов методом ионообменной хроматографии
В анализируемом растворе устанавливают рН « 1,5-2 при помощи 2 моль/л HCl или 2 моль/л ?ОН (по универсальному бумажному индикатору). Далее слабокислый раствор пропускают через колонку, заполненную катионитом КУ-2 или ОДВ-З в Н+-форме, со скоростью 1-2 капли в секунду (подготовка катионита и хроматографической колонки выполняется заранее).
При пропускании исследуемого раствора на ионообменнике удерживаются катионы металлов, тогда как анионы проходят в элюат в виде кислот.
В процессе работы необходимо следить за тем, чтобы над зернами катионита постоянно находилась жидкость слоем не менее 2 см.
Колонку промывают дистиллированной водой до полного вымывания продуктов обмена (кислот). Промывание заканчивают, когда про-
ба на индикатор метиловый оранжевый покажет желтую окраску. Элюат и промывные воды собирают в стакан, упаривают и открывают анионы известными способами. В лабораторном журнале делают вывод об обнаруженных анионах.
Катионит регенерируют, пропуская вначале через колонку 15-20 мл 6 моль/л раствора HCl со скоростью 1-2 капли в секунду, а затем дистиллированную воду до появления желтой окраски элюата с индикатором метиловым оранжевым.
Оформление протокола завершают общим выводом об обнаруженных в составе анализируемого образца катионах и анионах. В заключительной части протокола следует привести список используемой литературы.
Контрольные вопросы
1. Как проводят подбор растворителя для образца контрольной задачи «Анализ сухой соли»?
2. Какой предположительный вывод о составе образца сухой соли можно сделать, если он бесцветен?
3. Какой реактив можно использовать для осаждения всех катионов тяжелых металлов?
4. Какое значение в ходе систематического анализа катионов имеет проверка полноты осаждения или удаления из осадка отдельных катионов или групп катионов?
5. Какое заключение о составе сухой соли можно сделать, если образец полностью растворяется в воде?
6. Каков возможный состав образца сухой соли, если он не растворяется в концентрированных кислотах?
7. Какие катионы могут входить в состав анализируемого образца, если при разбавлении и последующем нагревании его солянокислого раствора выделяется белый хлопьевидный осадок?
8. Почему при анализе неизвестного вещества обнаружение катионов проводят перед обнаружением анионов?
9. Что можно сказать о составе осадка, если часть его растворяется в горячей воде, а другая - в насыщенном растворе ацетата натрия?
10. Что можно сказать о составе осадка, содержащем катионы четвертой - шестой аналитических групп, если он не растворяется при кипячении в 6 моль/л HNO3, но растворяется в 6 моль/л HCl?
11. Какие анионы входят в состав анализируемой смеси солей, если при обработке сухого образца 2 моль/л серной кислотой бурно выделяется бесцветный газ, не имеющий запаха?
2. Общий вариант полного анализа
Проводится при углубленном изучении темы.
Предварительные наблюдения и испытания
Окрашивание пламени газовой горелки
Платиновую или нихромовую проволоку с петлей (или с крючком) на конце предварительно очищают, погружая ее в разбавленную HCl, затем прокаливая в пламени газовой горелки и охлаждая до комнатной температуры. На кончик подготовленной таким путем платиновой или нихромовой проволоки, смоченной разбавленной HCl (иногда для тех же целей используют графитовый стержень), помещают несколько крупинок анализируемого вещества и вносят в пламя газовой горелки. Cмачивание проволоки хлороводородной кислотой проводят для того, чтобы получить в пламени летучие хлориды катионов, присутствующих в пробе (если она содержит нелетучий или труднолетучий компонент).
По окрашиванию пламени судят о присутствии того или иного катиона в анализируемом образце. Желтое окрашивание пламени указывает на присутствие катионов натрия, фиолетовое - калия, кирпично-красное - кальция, карминово-красное - лития, стронция, зелено-желтое - бария, зеленое - бора, меди или висмута, бледно-синее - свинца, олова, мышьяка, сурьмы.
Если испытуемый образец содержит достаточно большое количество натрия, то интенсивная желтая окраска, которую дает в пламени натрий, может маскировать менее интенсивную окраску пламени другими катионами. В этом случае рекомендуется рассматривать пламя через синее стекло или синюю индиговую призму, не пропускающие желтые лучи.
Испытание на продукты термического разложения
По характеру продуктов термолиза (прокаливания) пробы твердого анализируемого вещества иногда можно судить о наличии в анализируемом веществе некоторых катионов и анионов.
Для проведения этого теста небольшую порцию анализируемого вещества помещают на дно тугоплавкой пробирки (длиной ~7 см)или запаянной с одного конца трубки из тугоплавкого стекла (калильной трубки) и нагревают пробу, закрепив пробирку в горизонтальном положении, в пламени газовой горелки (под тягой!). При термическом разложении пробы выделяются газообразные продукты термолиза, часть которых конденсируется на холодном конце пробирки (трубки).
Выделение фиолетовых паров йода и их конденсация в виде темных кристалликов указывает на возможность присутствия йодид-ионов или других йод-содержащих анионов.
Кроме фиолетовых паров йода могут выделяться бурые пары брома (возможно присутствие бромид-ионов и других бром-содержащих анионов), желто-бурые пары оксидов азота (возможно присутствие нитратов и нитритов), а также газообразные CO (возможно присутствие оксалатов), CO2 (возможно присутствие карбонатов, оксалатов), Cl2 (возможно присутствие хлорид-ионов и других хлор-содержащих анионов), SO2 (возможно присутствие сульфитов, тиосульфатов), SO3 (возможно присутствие сульфатов), NH3 (возможно присутствие солей аммония), O2 (возможно присутствие пероксидов, нитратов, хроматов, дихроматов и т.п.).
Появление капелек воды на стенках холодной части пробирки (трубки) свидетельствует о том, что либо анализируемый образец содержит кристаллизационную воду, либо вода образуется в процессе термолиза пробы (с выделением воды разлагаются гидроксиды, кислые и основные соли, органические соединения).
По цвету возгона на стенках холодной части пробирки (трубки) можно высказать некоторые предположения о природе продуктов термолиза:

Испытание на окрашивание фосфатных и боратных перлов Предварительную информацию о возможном присутствии некоторых катионов в анализируемом образце можно получить, сравнивая окраску фосфатных или боратных перлов (стеклышек), образующихся при взаимодействии в пламени газовой горелки плава (продукта плавления) гидрофосфата натрия и аммония NaNH4HPO4 или буры Na2B4O710H2O с анализируемым веществом.
Для проведения этого теста небольшое количество NaNH4HPO4 или буры вносят на кончике (в петле или в ушке) платиновой проволоки в пламя газовой горелки и прокаливают его до прекращения вспучивания массы и образования прозрачного стеклообразного плава - перла. Этим еще горячим перлом захватывают небольшое количество твердого анализируемого вещества, снова вносят в пламя горелки и
прокаливают пробу. В результате получают прозрачный или окрашенный стеклообразный перл, цвет которого зависит от того, какие катионы присутствуют в анализируемом образце.
При нагревании гидрофосфата натрия и аммония NaNH4HPO4 в пламени газовой горелки он термически разлагается с образованием плава метафосфата натрия состава NaPO3:
NaNH4HPO4 -- NaPO3 + NH3 + H2O
Плав метафосфата натрия, взаимодействуя при высокой температуре с соединениями металлов, содержащимися в анализируемом образце, дает бесцветные или окрашенные стеклообразные фосфатные перлы.
При нагревании буры Na2B4O710H2O в пламени газовой горелки она теряет воду и превращается в боратный плав. Этот плав, взаимодействуя при высокой температуре с соединениями металлов, содержащимися в анализируемом образце, дает бесцветные или окрашенные стеклообразные метаборатные перлы, включающие, например, Cu(BO2)2,Cr(BO2)3,Ni(BO2)2 и т.д. Уединения металлов могут образовывать также растворы в стеклообразной боратной массе.
Цвет образующихся фосфатных или боратных перлов не зависит от природы исходного плава-основы (фосфат или бура); он определяется природой катиона, температурой и тем, в какой части пламени газовой горелки получен перл - в окислительной (верхняя часть пламени) или в восстановительной (средняя внутренняя часть пламени). В горячем состоянии перл может иметь одну окраску, а при охлаждении - другую.
В табл. 10 в качестве примера охарактеризована окраска фосфатных и боратных перлов ряда элементов как в окислительном, так и в восстановительном пламени газовой горелки.
Если перл, полученный как в окислительном, так и в восстановительном пламени газовой горелки, прозрачен и бесцветен в нагретом и охлажденном состоянии, то это указывает на отсутствие в исходном анализируемом образце катионов меди, серебра, сурьмы, висмута, титана, ванадия, хрома, молибдена, вольфрама, урана, марганца, железа, кобальта, никеля. Возможно, однако, присутствие катионов щелочных металлов, кальция, магния, цинка, кадмия, алюминия, свинца, олова. Если охлажденные перлы - белые (имеют вид белой эмали), то возможно присутствие в исходном анализируемом образце небольших количеств стронция или бария.
При одновременном присутствии в анализируемом образце нескольких катионов, окрашивающих перлы, результирующий цвет перла получается смешанным, промежуточным между цветами перлов отдельных катионов, что мешает их однозначному открытию. Действие разбавленной и концентрированной серной кислоты Действие разбавленной (~1 моль/л) серной кислоты. Разбавленная серная кислота вытесняет слабые кислоты из их солей - карбонатов, сульфитов, тиосульфатов, сульфидов, цианидов, нитритов, ацетатов. Выделяющиеся слабые кислоты, неустойчивые в кислой среде, либо улетучиваются, либо разлагаются с образованием газообразных продуктов. Некоторые из этих продуктов обладают характерным цветом или запахом.
При наличии в анализируемом образце карбонатов выделяется газообразный диоксид углерода CO2 (бесцветный и без запаха). При наличии сульфитов и тиосульфатов выделяется диоксид серы SO2 с запахом горящей серы; при наличии сульфидов - сероводород H2S c запахом тухлых яиц; при наличии цианидов - пары синильной кислоты HCN с запахом горького миндаля; при наличии нитритов - бу-
рые пары диоксида азота NO2 (находящиеся в равновесии с N2O4: 2NO2 N2O4); при наличии ацетатов - пары уксусной кислоты CH3COOH с запахом уксуса.
Для проведения теста (операции проводят только под тягой!)отбира-ют анализируемую пробу массой ~0,010 г в пробирку и по каплям прибавляют к ней разбавленную серную кислоту. Выделение газов указывает на присутствие в анализируемой пробе вышеуказанных анионов слабых, неустойчивых в кислой среде кислот.
Действие концентрированной серной кислоты. Концентрированная серная кислота при взаимодействии с анализируемым веществом может выделять газообразные продукты реакций также из фторидов, хлоридов, бромидов, йодидов, тиоцианатов, оксалатов, нитратов.
При наличии в анализируемом веществе фторидов выделяются пары фтороводорода HF; при наличии хлоридов - пары HCl и газообразный хлор Cl2; при наличии бромидов - пары HBr и желтый газообразный бром Br2; при наличии йодидов - фиолетовые пары йода I2; при наличии тиоцианатов - газообразный диоксид серы SO2;при наличии оксалатов - бесцветные газообразные оксид CO и диоксид CO2 углерода.
Соответствующий тест необходимо проводить только под тягой, с большой осторожностью, так как возможно разбрызгивание мелких капель концентрированной серной кислоты!
К небольшому количеству твердого анализируемого вещества (~0,010 г) в пробирке медленно, осторожно, по каплям прибавляют концентрированную серную кислоту. Если наблюдается газовыделение, то это свидетельствует о присутствии в анализируемом образце вышеуказанных анионов.
Во избежание возможного разбрызгивания серной кислоты тест можно проводить по-другому. В пробирку, в которой проводилось испытание с разбавленной серной кислотой, после окончания газовыделения осторожно прибавляют по каплям уже концентрированную серную кислоту. Если после прибавления нескольких капель данного реагента снова наблюдается выделение газов и паров, то это указывает на возможное присутствие в исходной пробе фторидов, хлоридов, бромидов, йодидов, тиоцианатов, оксалатов, нитратов.
Перевод анализируемого образца в раствор (растворение)
Предварительные наблюдения и испытания позволяют сделать более или менее аргументированные предположения и выводы о наличии тех или иных катионов и анионов в анализируемом образце. Даль-
нейшее подтверждение этих предположений и выводов, а также прямые доказательства присутствия катионов и анионов получают при проведении дробного или систематического анализа. Для этого анализируемый твердый образец вначале переводят в раствор, подбирая подходящий растворитель.
Растворимость анализируемого вещества в различных растворителях исследуют, отбирая небольшие порции его (2-5 мг).
Растворение в воде. Вначале проверяют растворимость в воде при комнатной температуре и (в случае необходимости) при нагревании. Для этого 2-3 мг анализируемого вещества вносят в пробирку, прибавляют ~1,5 мл дистиллированной воды и перемешивают смесь некоторое время. Если вещество при этом полностью растворилось в воде, то большую часть вещества, отобранную для анализа, растворяют в возможно минимальном количестве дистиллированной воды и полученный раствор анализируют далее. Небольшую часть исходной твердой анализируемой пробы оставляют для проведения повторных или проверочных тестов, если это окажется необходимым.
Анализируемое вещество может растворяться в воде неполностью. Для выяснения того, произошло ли частичное растворение пробы в воде, смесь анализируемого вещества (2-3 мг) с водой в пробирке тщательно перемешивают, центрифугируют, отбирают 2-3 капли центри-фугата, наносят на часовое или предметное стекло и выпаривают досуха. Если после выпаривания на стекле образовался налет твердого вещества, то это означает, что часть твердой пробы растворилась в воде. В таком случае к большей части исходной пробы прибавляют дистиллированную воду, смесь тщательно перемешивают, центрифугируют и отделяют центрифугат от осадка. Последний промывают 3-4 раза небольшим количеством дистиллированной воды, присоединяя промывные воды к центрифугату. Промывные воды и центрифугат, представляющие собой водную вытяжку растворившейся части пробы, подвергают дальнейшему анализу отдельно от осадка, который далее испытывают на растворимость в кислотах.
Растворимость в кислотах. Растворимость в растворах кислот испытывают в том случае, когда анализируемое вещество нерастворимо или частично растворимо в воде. В первом случае проверяют растворимость в кислотах проб (2-3 мг) исходного твердого анализируемого вещества, во втором - проб (2-3 мг) осадка, оставшегося после отделения водной вытяжки.
Отдельно в разных пробирках испытывают растворимость проб в разбавленной уксусной кислоте, разбавленных и концентрированных
HCl и HNO3, при необходимости - также в царской водке (при комнатной температуре или при нагревании).
Для проведения теста (только под тягой!) в пробирки вносят по 2-3 мг анализируемой твердой фазы и прибавляют несколько капель соответствующей кислоты - разбавленной или концентрированной, наблюдая за тем, выделяются или не выделяются газообразные продукты реакций (CO2,SO2,H2S, NO2). Если вещество не растворяется в кислоте при комнатной температуре, то испытывают его растворимость при нагревании.
При полном растворении пробы в той или иной кислоте для дальнейшего анализа используют полученный раствор.
В случае растворения пробы как в растворе HCl, так и в растворе HNO3, для последующего анализа отбирают полученный азотнокислый раствор, так как нитраты менее летучи, чем хлориды, которые частично могут быть потеряны на дальнейших стадиях анализа.
Если проба частично растворяется в уксусной кислоте, то анализируемый образец обрабатывают уксусной кислотой, отделяют центрифугированием нерастворившийся остаток от раствора и уксуснокислый центрифугат подвергают дальнейшему анализу отдельно от осадка. Осадок же испытывают на растворимость в HCl, HNO3 , в царской водке, каждый раз отбирая для дальнейшего анализа соответствующий раствор в случае частичного растворения пробы в той или иной кислоте.
Таким образом могут быть получены несколько растворов (водная вытяжка, растворы в разных кислотах), в которых предстоит открыть катионы и анионы. Это в целом облегчает ход анализа, так как уже на этапе растворения происходит частичное разделение некоторых катионов и анионов, которые могут мешать открытию друг друга, если они одновременно присутствуют в одном и том же растворе.
Когда анализируемый образец содержит сульфаты свинца и катионов третьей аналитической группы, нерастворимые в кислотах, их можно перевести в растворимые в кислотах карбонаты кипячением с насыщенным водным раствором соды Na2CO3 и поташа K2CO3 или же сплавлением со смесью Na2CO3 иK2CO3.
Правда, сульфат свинца частично растворяется в концентрированной серной кислоте с образованием бисульфата свинца Pb(HSO4)2. Также и сульфат кальция частично растворим в концентрированной серной кислоте. Поэтому при обработке исходного твердого анализируемого образца концентрированной серной кислотой (см. выше) некоторое количество катионов свинца и кальция переходит в сернокислый раствор.
Перевод сульфатов свинца, кальция, стронция, бария в карбонаты
а) Кипячение с содой и поташом. К смеси сульфатов PbSO4,CaSO4, SrSO4,BaSO4 (возможно присутствие в осадке не всех четырех сульфатов, а только некоторых из них), нерастворимой в кислотах, прибавляют избыток насыщенного раствора Na2CO3 или K2CO3 (или же обеих солей), смесь нагревают на водяной бане ~5-10 минут. Cульфаты превращаются в карбонаты:
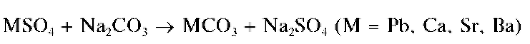
Cульфат натрия переходит в раствор, а карбонаты свинца, кальция, стронция и бария остаются в осадке. Cмесь центрифугируют, центри-фугат сливают с осадка. Обычно однократное нагревание осадка сульфатов с насыщенным карбонатным раствором бывает недостаточным для полного превращения сульфатов в карбонаты. Поэтому операцию повторяют 2-3 раза. Каждый раз отделяют раствор от осадка, который тщательно промывают дистиллированной водой и проверяют наличие сульфат-иона в промывных водах реакцией с хлоридом бария BaCl2 При отсутствии сульфат-иона не наблюдается помутнение раствора (образование осадка BaSO4) после прибавления раствора BaCl2 к отделенной от основного осадка промывной жидкости.
Полученную таким путем смесь карбонатов растворяют в разбавленной (2 моль/л) уксусной кислоте. Образовавшийся уксуснокислый раствор анализируют в дальнейшем на присутствие в нем катионов Pb2+,Ca2+,Sr2+,Ba2+.
б) Сплавление со смесью соды и поташа. К осадку сульфатов, помещенному в фарфоровую чашку или фарфоровый тигель (лучше - в платиновый тигель), прибавляют примерно десятикратный избыток (по массе) смеси твердых соды и поташа. Cплавляют всю массу. При сплавлении сульфаты превращаются в карбонаты, как и при кипячении (см. выше). Полученный плав несколько раз повторно кипятят с дистиллированной водой, выщелачивая из плава растворимые в воде соли - сульфаты и карбонаты натрия и калия. После каждого кипячения раствор отделяют от осадка.
Выщелачивание кипячением с дистиллированной водой повторяют до тех пор, пока в жидкости, отделенной от остатка плава, не будет наблюдаться образование белой мути BaSO4 после прибавления к ней раствора хлорида бария (отрицательная реакция на сульфат-ионы).
Полученный промытый водой остаток плава, состоящий уже из карбонатов свинца, кальция, стронция, бария, растворяют в разбав-
ленной уксусной кислоте и анализируют уксуснокислый раствор на присутствие катионов Pb2+,Ca2+,Sr2+,Ba2+.
Сплавление твердого вещества с реагентами. Для перевода твердого анализируемого образца, нерастворимого в воде и в кислотах, в продукты реакции, растворяющиеся в воде или в кислотах, его сплавляют как с карбонатами натрия NaHCO3,Na2CO3 или калия K2CO3, так и - при необходимости - с другими реагентами: щелочами, бисульфатом калия KHSO4, пиросульфатом калия K2S2O7, а также со смесями соды с окислителями (KClO3,KNO3,NaBiO3,Na2O2) и с некоторыми другими реагентами (сера, цианид калия KCN и т.д.). При таком сплавлении компоненты твердого анализируемого образца, нерастворимые в воде и в кислотах, превращаются в продукты реакций, растворяющиеся в кислотах.
Так, например, диоксид кремния и нерастворимые силикаты при сплавлении (лучше - в платиновом тигле) со смесью соды и поташа превращаются в растворимые силикаты натрия или калия и соответствующие карбонаты:
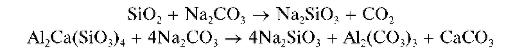
После охлаждения плав обрабатывают водой. Силикат натрия переходит в раствор, а нерастворимые в воде карбонаты сохраняются в остатке. Последний обрабатывают раствором HCl. Карбонаты металлов растворяются. В остатке присутствует небольшое количество примесной кремниевой кислоты (в виде студенистой массы), которую можно удалить нагреванием с концентрированной HCl (повторным выпариванием). Кремниевая кислота при этом обезвоживается и переходит в нерастворимый остаток, который отделяют от раствора. Раствор подвергают анализу на присутствие катионов.
Малорастворимые оксиды алюминия Al2O3, железа(Ш) Бе^^тита-на(IV) TiO2, циркония(IV) ZrO2, хрома(Ш) Cr2O3 и т.д. можно превратить в растворимые продукты реакции сплавлением с KHSO4 или K2S2O7 (в кварцевых тиглях с крышками), например:
Образовавшийся пиросульфат калия подвергается термолизу:
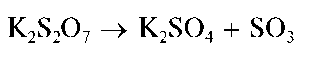
Выделяющийся SO3 реагирует с оксидами металлов и переводит их в растворимые сульфаты, например:
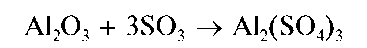
Некоторые оксиды металлов превращаются в растворимые соли также при сплавлении с содой, например:

Диоксид олова сплавляют со смесью соды с серой:
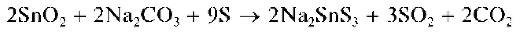
При этом образуется растворимая тиосоль Na2SnS3.
Во многих других случаях описаны способы и методики перевода нерастворимых образцов в растворимые продукты реакций сплавлением твердых фаз с различными реагентами.
Открытие катионов
После растворения исходного анализируемого образца получают один или несколько растворов, в которых открывают катионы, проводя дробный или систематический анализ катионов методами, описанными выше. При этом учитывают данные предварительных наблюдений и испытаний.
Открытие анионов
Анионы открывают в растворах, полученных при растворении исходного анализируемого объекта, методами, охарактеризованными ранее. Обычно систематический анализ анионов не проводят, а используют дробный метод их обнаружения с учетом сведений предварительных наблюдений и испытаний, а также данных, полученных при открытии катионов.
Если растворы содержат, наряду с ионами водорода H3O+,только катионы натрия и калия (остальные катионы отсутствуют), то их непосредственно анализируют на присутствие анионов. Если же в растворах присутствуют катионы II-VI аналитических групп, то их обычно предварительно отделяют, так как они могут помешать открытию не-
которых анионов. Удаление катионов II-VI аналитических групп можно осуществить либо обработкой раствором соды или поташа, переводя эти катионы (а также катион лития Li+) в малорастворимые карбонаты, либо методом ионообменной хроматографии.
Перевод катионов II-VI аналитических групп в малорастворимые карбонаты
Предварительно в отдельных порциях анализируемого раствора открывают карбонат-ион и ацетат-ион, как описано ранее.
Затем к пробе анализируемого раствора (~30 капель) осторожно, по каплям прибавляют разбавленный раствор соды для нейтрализации раствора до слабощелочной реакции, после чего добавляют еще ~30 капель раствора соды. Cмесь нагревают до кипения и кипятят около 5 минут, периодически добавляя по каплям дистиллированную воду по мере упаривания раствора, поддерживая объем жидкой фазы приблизительно постоянным. Полученную смесь центрифугируют, цент-рифугат отделяют от осадка (который сохраняют для дальнейшего анализа - в случае необходимости). К большей части центрифугата осторожно, при перемешивании, по каплям прибавляют разбавленную уксусную кислоту до рН « 7 для удаления избытка карбонат-ионов:
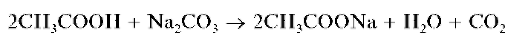
Полученный раствор анализируют далее на присутствие анионов.
Меньшую часть центрифугата также осторожно нейтрализуют разбавленной HNO3 или H2SO4 и дополнительно анализируют полученный раствор на присутствие ацетат-ионов, как было описано ранее (если эти анионы не были открыты ранее).
Перевод в карбонаты катионов II-VI аналитических групп и лития можно осуществить, обрабатывая содой не только раствор, но и исходный твердый анализируемый образец. Для этого отбирают ~0,2-0,3 г твердого образца, помещают в тигель или стакан из тугоплавкого стекла, прибавляют к нему ~1 г соды Na2CO3 и~5 мл дистиллированной воды. Cмесь нагревают при перемешивании (стеклянной палочкой) до кипения и кипятят около 5 минут, добавляя по каплям дистиллированную воду по мере упаривания жидкой фазы (поддерживая объем ее приблизительно постоянным). Затем раствор отделяют от осадка центрифугированием и обрабатывают уксусной кислотой, как описано выше.
Отделение катионов методом ионообменной хроматографии Cущность метода заключается в следующем.
Анализируемый раствор доводят до рН « 1,5-2, прибавляя, в зависимости от его кислотности, либо разбавленную HCl, либо разбавленный раствор NaOH. Затем этот раствор пропускают через хроматогра-фическую колонку (стеклянную трубку с носиком и затвором в нижней части), заполненную катионообменником - катионитом в кислой форме (Н+-форме). При прохождении раствора через хроматографиче-скую колонку с катионитом катионы, содержавшиеся в растворе, обмениваются с Н+-ионами и остаются (удерживаются) в фазе катиони-та, тогда как Н+-ионы переходят в раствор - элюат - и уносятся вместе с ним. По выходе из хроматографической колонки элюат, таким образом, уже не содержит никаких катионов, кроме катионов водорода, т.е. представляет собой раствор смеси кислот анионов, присутствовавших в первоначальном растворе. Другими словами, происходит полное отделение всех катионов, оставшихся в фазе катионита.
Колонку промывают дистиллированной водой для полного вымывания оставшихся кислот, чтобы не потерять часть анионов, имевшихся в исходном растворе. Промывание проводят до тех пор, пока отобранные порции водного элюата, выходящего из колонки, не будут принимать устойчивую желтую окраску при прибавлении к ним двух-трех капель индикатора - метилового оранжевого.
Элюат и промывные воды объединяют, осторожно упаривают до требуемого объема (поскольку при хроматографировании произошло разбавление раствора), и анализируют полученный кислый раствор на присутствие анионов.
При описанном способе из раствора могут быть удалены все катионы, кроме ионов водорода. Раствор получается кислым. Следовательно, он уже не может содержать анионы кислот, неустойчивых в кислой среде и разрушающихся при подкислении исходного раствора. Эти анионы должны быть открыты в отдельных пробах исходного анализируемого раствора, как было описано ранее.
После проведения хроматографирования катионит регенерируют, переводя его снова в кислую форму. Для этого через колонку пропускают (со скоростью выхода элюата примерно 1-2 капли в минуту) около 20 мл раствора 6 моль/л HCl, а затем промывают колонку дистиллированной водой до устойчивой желтой окраски отбираемой водной порции при прибавлении к ней 1-2 капель индикатора метилового оранжевого.
Элюат и промывные воды, полученные после регенерации катио-нита, объединяют и при необходимости дополнительно анализируют на содержание катионов.