Военная токсикология, радиобиология и медицинская защита - Учебник Под редакцией профессора С.А. Куценко
|
|
|
|
Глава 12. Отравляющие и высокотоксичные вещества нейротоксического действия
Нейротоксичность - это способность химических веществ, действуя на организм, вызывать нарушение структуры и/или функций нервной системы. Нейротоксичность присуща большинству известных веществ. Она может быть следствием прямого, или опосредованного повреждением других органов, действия токсикантов на нервную систему. Поэтому практически любая острая интоксикация в той или иной степени сопровождается нарушениями функций нервной системы. Тем не менее выделяют группу веществ, условно обозначаемых как нейротоксиканты.
К числу нейротоксикантов относят вещества, для которых порог чувствительности нервной системы (отдельных её гистологических и анатомических образований) существенно ниже, чем других органов и систем, и в основе интоксикации которыми лежит поражение именно нервной системы. Токсический процесс, развивающийся в результате действия нейротоксикантов, проявляется нарушением механизмов нервной регуляции жизненно важных органов и систем, а также памяти, мышления, эмоций, поведения и т.д.
В основе токсического действия нейротоксикантов может лежать повреждение любого структурного элемента нервной системы путем модификации пластического и энергетического обмена, нарушения генерации, проведения нервного импульса по возбудимым мембранам, передачи сигнала в синапсах.
Также условно нейротоксиканты можно разделить на две группы:
1. Вызывающие преимущественно функциональные нарушающие со стороны центрального и периферического отделов нервной системы.
2. Вызывающие органические повреждения нервной системы.
Вещества первой группы даже при острых смертельных отравлениях, не вызывают видимой альтерации нервной ткани. Для веществ второй группы, напротив, характерно токсическое действие, сопровождающееся, прежде всего деструктивными изменениями в отделах ЦНС и ПНС.
Часть нейротоксикантов вызывают при остром воздействии тяжелые нарушения нервной регуляции функций жизненно важных органов и систем. Для них характерно близкое значение доз, провоцирующих утрату боеспособности (непереносимые дозы) и оказывающих смертельное поражение (смертельные дозы). Поражения этими токсикантами характеризуются большим числом смертельных исходов, а в структуре санитарных потерь преобладают тяжело пораженные, требующие оказания помощи по жизненным показаниям (табл. 38). ОВТВ, обладающие такими свойствами, по большей части относятся к веществам смертельного действия.
Таблица 38.
Предполагаемые потери живой силы в районе применения отравляющего вещества VX из выливных авиационных приборов, %
(по В.В. Мясникову, 1989)
Степень защищенности живой силы |
Смертельные и тяжелые поражения |
Легкие поражения |
Высокая Средняя Слабая |
10 10 - 20 50 – 90 |
30 30 - 50 10 - 50 |
В основе клиники поражения другими нейротоксикантами лежит преимущественно нарушение функций высшей нервной деятельности. Для основных представителей этой подгруппы характерно более чем тысячекратное различие доз, вызывающих нарушение боеспособности и смерть. Поэтому, как правило, в очагах поражения формируются преимущественно транзиторные токсические реакции и легкие формы отравления, не совместимые с выполнением боевой задачи. Случаи смертельного поражения встречаются редко. Такие вещества относятся к временно выводящим из строя ОВТВ.
Из числа представленных в таблице 39 веществ VX, зоман, зарин относятся к первой подгруппе, BZ - ко второй.
Таблица 39.
Токсичность некоторых отравляющих веществ (по В.В. Мясникову, 1989)
Наименование |
Поражение через органы дыхания |
|
LCt50 г мин/м3 |
ICt50 г мин/м3 |
|
VX Зоман Зарин BZ |
0,035 0,05 0,1 110,0 |
0,005 0,025 0,055 0,11 |
Большинство промышленных токсикантов, пестицидов, лекарственных средств (применение которых возможно в качестве диверсионных агентов), занимают промежуточное положение между смертельно действующими отравляющими веществами и временно выводящими из строя. Различие значений их смертельных и выводящих из строя доз больше, чем у представителей первой подгруппы, и меньше, чем у представителей второй.
12.1. Вещества, вызывающие преимущественно
функциональные нарушения со стороны нервной системы
Наиболее токсичные представители рассматриваемой группы первично повреждают механизмы проведения и передачи сигнала в нервной ткани, т.е. относятся к веществам, вызывающим преимущественно функциональные нарушающие со стороны центрального и периферического отдела нервной системы.
Как хорошо известно, распространение сигнала по нервному волокну имеет электрическую природу. Достигнув нервного окончания (пресинаптические структуры), электрический сигнал вызывает высвобождение химического вещества (нейромедиатора), которое, диффундируя через пространство, отделяющее нервное окончание от поверхности иннервируемой клетки (синаптическая щель), действует на селективные рецепторы (постсинаптические) и вызывает их возбуждение. Возбуждение рецептора приводит к изменению потенциала постсинаптической мембраны. Таким образом, инициируется ответная реакция клетки, находящейся под контролем нейрона. Нейромедиатор, выделившийся в синаптическую щель, не только взаимодействует с постсинаптическими рецепторами, но и подвергается либо энзиматическому расщеплению, либо обратному захвату пресинаптическими структурами. Находящийся в синаптической щели нейромедиатор также взаимодействует с пресинаптическими рецепторами, возбуждая их, и по механизму обратной связи прерывает дальнейший выброс и активирует обратный захват.
Для передачи нервного импульса в синапсах в качестве медиаторов нейроны используют различные химические вещества. Нейромедиаторы синтезируются в пресинаптических структурах и находятся здесь в связанной форме, главным образом в специальных клеточных органеллах, так называемых синаптических везикулах.
В настоящее время в ЦНС и на периферии идентифицировано более 17 типов регуляторных систем (классифицируемых по строению нейромедиатора), на которые воздействуют, в том числе, и токсиканты. Среди них: холинэргическая (мускариночувствительная - 4 подтипа, никотиночувствительная - 2 подтипа), ГАМК-эргическая (2 подтипа), глутаматэргическая (4 подтипа), глицинэргическая (1 подтип), адренэргическая (9 подтипов), дофаминэргическая (5 подтипов), серотонинэргическая (5 подтипов), опиоидная (4 подтипа), пептидэргическая (более 5 подтипов), гистаминэргическая (3 подтипа), пуринэргическая (6 подтипов) и т.д.
Помимо “классических” медиаторов нервного импульса в нервной ткани определяются и другие вещества, как правило, пептидной природы, модулирующие эффекты нейромедиаторов на синаптические рецепторы. В настоящее время таких нейромодуляторов в ЦНС млекопитающих идентифицировано более 60.
В основе действие токсикантов на передачу нервного импульса лежат следующие механизмы (рис. 42):
- влияние на синтез, хранение, высвобождение и обратный захват нейромедиатора;
- непосредственное действие на селективные рецепторы;
- изменение сродства рецепторных структур к нейромедиаторам;
- изменение скорости синтеза, разрушения и распределения рецепторов в тканях;
- модификация состояния механизмов сопряжения между рецептором и эффекторной системой клеток.
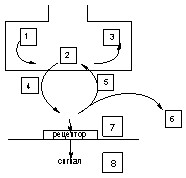
Рисунок 42. Места действия токсикантов на синапс
Схема этапов оборота нейромедиатора, воздействуя на которые токсикант может инициировать токсический процесс: 1 - синтез; 2 - хранение; 3 - метаболизм; 4 - выделение; 5 - обратный захват; 6 - разрушение; 7 - рецептор; 8 - механизм проведения сигнала.
Среди отравляющих и высоко токсичных веществ, относящихся к числу нейротоксикантов, вызывающих преимущественно функциональные нарушения, можно выделить две основные подгруппы:
1. Нервно-паралитического действия;
2. Писходислептического действия.
12.1.1. Отравляющие и высокотоксичные вещества
нервно-паралитического действия
До недавнего времени к числу веществ нервно-паралитического действия относили исключительно боевые отравляющие вещества из класса фосфорорганических соединений (ФОС) - фосфорорганические отравляющие вещества (ФОВ). В настоящее время запасы ФОВ, хранящиеся в арсеналах, подлежат уничтожению, в связи с чем снижается вероятность их применения при ведении военных действий. Однако появились новые токсиканты, поражение которыми не исключено в ходе военных конфликтов, при аварийных ситуаций на объектах синтеза, хранения высокотоксичных веществ и средствах их транспортировки, при совершении террористических актов.
К числу ОВТВ нервно-паралитического действия можно отнести:
1. Фосфорорганические соединения (зарин, зоман, VX, фосфакол, армин, карбафос, дихлофос и др.);
2. Производные карбаминовой кислоты (пропуксор, альдикарб, диоксакарб и др.);
3. Бициклофосфаты (бутилбициклофосфат, изопропилбициклофосфат и др.);
4. Производные гидразина (гидразин, диметилгидразин и т.д.)
5. Сложные гетероциклические соединения (тетродотоксин, сакситоксин, норборнан и др.);
6. Белковые токсины (ботулотоксин, тетанотоксин).
Структурные формулы отдельных представителей групп даны на рисунке 43.
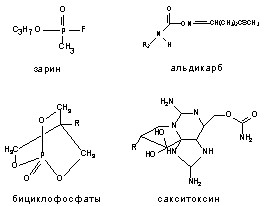
Рисунок 43. Строение некоторых представителей ОВТВ нервно-паралитического действия
Современные нервно-паралитические ОВТВ различаются не только строением, но и особенностями токсического действия (таблицы 3). Вещества одной группы при тяжелых интоксикациях вызывают развитие судорожного синдрома, комы и гибели пострадавшего, как правило, от остановки дыхания и сердечной деятельности на фоне истощения энергетических ресурсов организма. Другие – первично вызывают паралич произвольной мускулатуры, в том числе и дыхательной, и гибели от асфиксии.
Интоксикация некоторыми веществами развивается достаточно быстро, и у медицинской службы практически нет резерва времени для спасения жизни пострадавших. В этих случаях с целью медицинской защиты личного состава должны использоваться антидоты само- и взаимопомощи. Интоксикация другими представителями группы развивается медленно. Основной задачей врача в этом случае является своевременное выявление пораженных и скорейшая эвакуация на этапы оказания квалифицированной помощи. В связи с этим нервно-паралитические ОВТВ можно классифицировать следующим образом (табл. 40):
Таблица 40.
Классификация нервно-паралитических ОВТВ в соответствии
с особенностями их токсического действия на организм
По основному проявлению тяжелой интоксикации |
По скорости формирования токсического процесса |
1. Судорожного действия: ФОС, карбаматы, бициклофосфаты, норборнан, тетанотоксин, гидразиноиды |
1. Быстрого действия (скрытый период - минуты): ФОС, карбаматы, бициклофосфаты, ноборнан, сакситоксин, тетродотоксин, гидразиноиды |
2. Паралитического действия: сакситоксин, тетродотоксин, ботулотоксин. |
2. Замедленного действия (скрытый период - часы-сутки): ботулотоксин, тетанотоксин |
Судорожный синдром является следствием действия веществ на центральную нервную систему. Механизмы, посредством которых токсиканты вызывают судороги, могут быть классифицированы исходя из представлений, согласно которым нормальное функциональное состояние ЦНС определяется балансом между процессами возбуждения и торможения нейрональных систем. Судороги возникают либо в результате гиперактивации процессов возбуждения, либо угнетения процессов торможения (табл. 41).
Таблица 41.
Возможные общие механизмы генерации судорожного синдрома
Активация процессов возбуждения |
Угнетение процессов торможения |
- прямая активация возбудимых мембран нервных клеток; - активация постсинаптических рецепторов возбуждающих нейромедиаторов; - увеличение количества возбуждающего нейромедиатора, высвобождающегося в синаптическую щель при прохождении нервного импульса; - пролонгация действия возбуждающего нейромедиатора вследствие угнетения механизмов его разрушения или обратного захвата; - повышение чувствительности постсинаптических рецепторов к возбуждающему нейромедиатору; - снижение потенциала покоя постсинаптических мембран клеток |
- блокада постсинаптических рецепторов тормозных нейромедиаторов; - уменьшение количества тормозного нейромедиатора, высвобождающегося в синаптическую щель при прохождении нервного импульса; - блок высвобождения тормозного нейромедиатора; - понижение чувствительности постсинаптических рецепторов к тормозному нейромедиатору; - сокращение продолжительности действия тормозного нейромедиатора в результате активации механизмов разрушения и реаптейка |
Основными возбуждающими нейромедиаторами мозга являются ацетилхолин и возбуждающие аминокислоты (глутамат, аспартат).
Тормозные процессы осуществляются с помощью пресинаптических и постсинаптических механизмов. В различных отделах ЦНС механизмы пре- и постсинаптического торможения опосредованы высвобождением в синаптическую щель γ-аминомасляной кислоты (ГАМК). В спинном и продолговатом мозге постсинаптическое торможение осуществляется при участии глицина.
Паралич произвольной мускулатуры и как следствие - смерть от нарушения дыхания, является результатом нарушения либо проведения нервного импульса в нервно-мышечных синапсах, в которых нейромедиатором является ацетилхолин, либо способности возбудимых мембран нервных и мышечных клеток воспринимать нервный импульс.
Классификация ОВТВ нервно-паралитического действия в соответствие с механизмами, посредством которых они инициируют токсический процесс, представлена в таблице 42.
Таблица 42.
Классификация нервно-паралитических ОВТВ в соответствии
с механизмами токсического действия на организм
1. Действующие на холинореактивные синапсы |
1.1. Ингибиторы холинэстеразы: ФОС, карбаматы |
1.2. Пресинаптические блокаторы высвобождения ацетилхолина: ботулотоксин |
|
2. Действующие на ГАМК-реактивные синапсы |
2.1. Ингибиторы синтеза ГАМК: производные гидразина |
2.2. Антагонисты ГАМК (ГАМК-литики): бициклофосфаты, норборнан |
|
2.3. Пресинаптические блокаторы высвобождения ГАМК: тетанотоксин |
|
3. Блокаторы Na+-ионных каналов возбудимых мембран |
тетродотоксин, сакситоксин |
Ингибиторы холинэстеразы (непрямые холиномиметики), ГАМК-литики и вещества, блокирующие синтез ГАМК и ее высвобождение в синаптическую щель инициируют при тяжелых интоксикациях судорожный синдром. Вещества, угнетающие высвобождение ацетилхолина и блокирующие Na+-ионные каналы возбудимых мембран вызывают паралич произвольной мускулатуры.
12.1.1.1. Отравляющие и высокотоксичные вещества
судорожного действия
12.1.1.1.1. Конвульсанты, действующие на холинореактивные синапсы
Синаптические структуры, в которых медиаторную функцию выполняет ацетилхолин, обнаружены как в центральной нервной системе, так и на периферии.
Процесс передачи сигнала в холинэргических синапсах может быть представлен несколькими этапами:
- синтез медиатора из холина и ацетата при участии энзима холин-ацетил трансферазы (ХАТ) и его депонирование в пресинаптических везикулах;
- выделение ацетилхолина в синаптическую щель (спонтанно и при поступлении в нервное окончание возбуждающего сигнала);
- взаимодействие ацетилхолина с холинорецепторами постсинаптической (по некоторым данным, и пресинаптической) мембраны и инициация стимула в иннервируемой клетке;
- разрушение выделившегося в синаптическую щель нейромедиатора энзимом ацетилхолинэстеразой (АХЭ) и прекращение процесса передачи сигнала;
- захват пресинаптическими структурами высвободившегося холина.
Наиболее уязвимыми для действия высокотоксичных веществ являются этапы выделения ацетилхолина в синаптическую щель, взаимодействия медиатора с холинорецепторами и разрушения его энзимом АХЭ (рисунок 44).
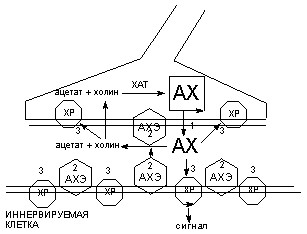
Рисунок 44. Схема функционирования холинэргического синапса
ХР - холинорецептор; АХЭ – ацетилхолинэстераза;
1 - 3 - способы воздействия токсикантов на синапс: 1 - ботулотоксин; 2 - ингибиторы АХЭ; 3 - холинэргические и антихолинэргические средства
Установлено, что нейромедитор и в ЦНС и в ПНС взаимодействует с двумя видами рецепторов: мускариновыми и никотиновыми, отличающимися между собой способностью отвечать на воздействие ряда агонистов (М-холинорецепторы избирательно возбуждаются мускарином; Н-холинорецепторы - никотином), механизмом рецепции сигнала и его передачи на эффекторную клетку (нейрон, миоцит, железистую клетку). Н-холинорецепторы непосредственно связаны с ионными каналами постсинаптической мембраны для Na+, K+, Ca2+. М-холинорецепторы представляют собой структуры, которые также влияют на проницаемость ионных каналов для Na+ и K+. Однако это влияние опосредовано изменением активности сопряженных с рецептором ферментов, регулирующих содержание в иннервируемой клетке вторичных мессенджеров восприятия сигнала (цАМФ, цГМФ, фосфоинозитола и т.д.). И в том и в другом случае действие ацетилхолина на рецепторы приводит к усилению проницаемости постсинаптических мембран для ионов натрия, что сопровождается деполяризацией мембраны и ее возбуждением. Различается скорость генерации постсинаптического сигнала: в Н-холинэргических синапсах изменение конформации ионных каналов развивается практически мгновенно, а в М-холинэргических - постепенно.
Установлено, что в синапсах на пресинаптической мембране локализуются холинорецепторы, выполняющие функцию регуляторов проведения импульса.
Прерывание нервного импульса осуществляется путем гидролиза ацетилхолина ферментом ацетилхолинэстеразой. Механизм взаимодействия ацетилхолина с холинэстеразой изучен достаточно подробно. Известно, что в состав молекулы ацетилхолина входят реакционноспособные атомы, которые образуют две группы: катионную (четвертичный атом азота с тремя метильными радикалами) и сложноэфирную (эфирный кислород и карбонильные углерод и кислород) (рис. 45).
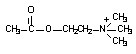
Рисунок 45. Структура ацетилхолина
Соответственно реакционным группам ацетилхолина, в активных центрах холинэстеразы также выделяются два участка: анионный и эстеразный. Предполагается, что анионный участок образован карбоксил-анионом двухосновной аминокислоты. На расстоянии 0,4-0,5 нм от анионного центра расположен эстеразный участок, в котором функциональную роль играет гидроксильная группа аминокислоты серина.
Взаимодействие ацетилхолина с холинэстеразой начинается с ориентации катионной “головки” ацетилхолина на анионном участке фермента. Это приводит к фиксации молекулы ацетилхолина на определенном расстоянии от эстеразного участка, на котором и проходит ферментативный гидролиз медиатора (разрушение эфирной связи между холином и ацетатом).
Для его осуществления гидроксильная группа серина проводит нуклеофильную атаку на соответствующий электрофильный атом субстрата. В результате реакции образуются ацетилированный по серину фермент и холин, сорбированный на анионном участке. В последующем холин отщепляется от анионного участка фермента, а затем происходит и деацетилирование холинэстеразы - восстанавливается ее первоначальная структура.
В ЦНС плотность М-холинэргических синапсов между нейронами существенно выше, чем Н-холинэргических. Наивысшая - в хвостатом, прилежащем, чичевичном ядрах, гиппокампе, гипоталамусе, коре головного мозга, мозжечке млекопитающих и человека.
На периферии М-холинэргические синапсы связывают окончания постганглионарных нервных волокон парасимпатической системы с иннервируемыми ими гладкомышечными волокнами (кишечник, бронхи, миокард) и клетками экзокринных желез (слюнных, желудочно-кишечного тракта, бронхиальных, потовых).
Периферические Н-холинэргические синапсы выявляются главным образом в области окончаний нервных волокон мотонейронов, иннервирующих поперечно-полосатую мускулатуру, волокон, иннервирующих ганглионарные нейроны парасимпатического и симпатического отделов вегетативной нервной системы, а также в каротидном клубочке, хромаффонинных клетках мозгового вещества надпочечников.
Как указывалось ранее, перевозбуждение центральных холинэргических механизмов может приводить к развитию судорожного синдрома. Наибольшей активностью в этом плане обладают ингибиторы АХЭ, способные проникать через гематоэнцефалический барьер (ФОС, карбаматы). Перевозбуждение периферических холинореактивных структур этими токсикантами сопровождается существенным, порой не совместимым с жизнью, нарушением функций органов и систем.
12.1.1.1.1.1. Ингибиторы холинэстеразы
Фосфорорганические соединения
Фосфорорганические соединения нашли применение как инсектициды (хлорофос, карбофос, фосдрин, лептофос и др.), лекарственные препараты (фосфакол, армин и т.д.), наиболее токсичные представители группы приняты на вооружение армий целого ряда стран в качестве боевых отравляющих веществ (зарин, зоман, табун, Vx). Поражение ФОС людей возможно при авариях на объектах по их производству, при применении в качестве ОВ или диверсионных агентов.
Впервые ФОС были синтезированы Тенаром в 1846 г. В нашей стране основоположником химии ФОС был А.Е. Арбузов, предложивший в 1905 г. новый метод их синтеза. На токсические свойства этих соединений внимание было обращено только в 1932 г., когда Ланге и Крюгер впервые описали симптомы отравления диметил- и диэтилфторфосфатом, синтезированных в процессе поиска новых инсектицидов. Бесспорная практическая значимость таких средств явилась причиной масштабных исследований, направленных на всестороннее изучение нового класса биологически активных веществ. Так, за короткий промежуток времени только в Германии, в лаборатории Шрадера, с целью изыскания все новых средств борьбы с вредными насекомыми было синтезировано и изучено более 2000 ФОС, среди которых многие обладали высокой токсичностью и для млекопитающих. Это послужило поводом для создания на их основе новых образцов химического оружия. К началу второй мировой войны химиками Германии были синтезированы такие высокотоксичные отравляющие вещества, как табун, зарин, несколько позже – зоман. Одновременно были определены перспективы изыскания еще более токсичных для человека соединений, что на практике было реализовано Таммелином (1955), синтезировавшим метилфторфосфорилхолин, явившийся прообразом новой группы ФОВ, обозначаемых как V-газы (Vх). В 70 - 80х годах 20 столетия была разработана технология применение ФОВ в так называемых бинарных боеприпасах. При этом два относительно мало ядовитые химические соединения хранятся, транспортируются и размещаются в боеприпасах раздельно. Компоненты смешиваются лишь после выстрела и образуют на пути к цели, в ходе химической реакции, высокоядовитое ОВ. Чрезвычайно высокая токсичность и особенности физико-химических свойств, позволяющие быстро создавать обширные очаги химического заражения, до недавнего времени делали ФОВ (зарин, зоман, V-газы) наиболее опасными из всех известных ОВ. В соответствии с международными договоренностями, запасы ФОВ в большинстве стран мира подлежат уничтожению.
В настоящее время исследования в области создания все новых биологически активных веществ на основе ФОС продолжаются. Сейчас это, как и в начале 30х годов 20 века, в основном, поиск инсектицидов, которых на сегодняшний день известны сотни наименований.
Физико-химические свойства. Токсичность
ФОС – производные кислот пятивалентного фосфора. Все токсичные соединения фосфорной (1), алкилфосфоновой (2) и диалкилфосфиновой (3) кислот имеют структуру:
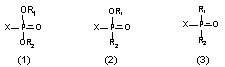
Фосфор с помощью двойной связи соединен с атомом кислорода или серы; двумя связями - с алкил-, алкокси- арил-, моно- или диалкиламиногруппами и т.д. (R1, R2); пятая (Х) - насыщена группой, относительно легко отщепляющейся от атома фосфора (F-, CN-, -ОR, -SR и т.д.). За счет высвобождающейся при этом валентности, ФОС и взаимодействует с активными центрами ряда энзимов.
Структурные формулы некоторых ФОС представлены на рисунке 46.
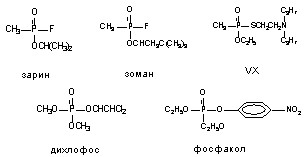
Рисунок 46. Структура некоторых фосфорорганических соединений
Биологическая активность ФОС, в том числе и токсичность, зависит от их строения (табл. 43).
Таблица 43.
Токсичность (ЛД50) некоторых ФОС для белых мышей
Название вещества |
Способ введения |
Токсичность, мг/кг |
О,О-Диметил-S-(1,2-дикарбоэтоксиэтил)дитиофосфат (карбафос, малатион) |
через рот |
400 - 930 |
О,О-Диметил-О-(2,2-дихлорвинил)фосфат (ДДВФ, дихлорофос) |
через рот |
75 - 175 |
Диэтил-(4-нитрофенил)-тиофосфат (паратион) |
через рот внутрибрюшинно |
25,0 5,5 |
Диэтил-(4-нитрофенил)-фосфат (фосфакол, параоксон) |
подкожно |
0,8 |
Диизопропилфторфосфат (ДФФ) |
через рот подкожно внутривенно |
36,8 5 0,4 |
N,N-диметиламидо-О-этилцианфосфат (табун) |
подкожно внутрибрюшинно внутривенно |
0,6 0,6 0,15 |
О-изопропилметилфторфосфонат (зарин) |
подкожно внутрибрюшинно |
0,2 0,2 |
О-диметилизобутилметилфторфосфонат (зоман) |
подкожно |
0,06 |
О,О-диэтоксифосфорилтиохолин |
подкожно внутрибрюшинно |
0,26 0,14 |
Метилфторфосфорилгомохолин |
внутрибрюшинно внутривенно |
0,05 0,006 |
Все ФОС обладают высокой реакционной способностью. Особое значение придают реакциям фосфорилирования, гидролиза и окисления, поскольку именно эти реакции определяют стойкость токсикантов в окружающей среде, имеют отношение к метаболизму и механизму токсического действия ядов в организме, на них основаны некоторые принципы дегазации, обнаружения, антидотной профилактики и терапии интоксикаций.
ФОС легко отдают электроны, активно вступают в реакции с электрофильными группами других соединений и за счет этого фосфорилируют многие вещества (аминокислоты, полифенолы, гидроксиламин, гидроксамовые кислоты и др.).
В качестве примера приводим реакцию фосфорилирования зарином гидроксиламина:
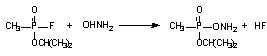
Все ФОС при взаимодействии с водой подвергаются гидролизу с образованием нетоксичных продуктов. Скорость гидролиза ФОС, растворенных в воде, различна (например, зарин гидролизуется быстрее, чем зоман, а зоман – быстрее, чем V-газы).
В общей форме реакция гидролиза может быть представлена следующим образом:
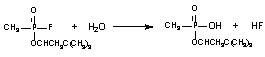
Реакция гидролиза ФОС с разрывом ангидридной связи происходит и в организме, как спонтанно, так и при участии энзимов.
В результате реакции окисления, ФОС также разрушаются, однако в ряде случаев (при окислении фосфотионатов до фосфатов) некоторые вещества даже повышают свою активность. Это иллюстрируется примером
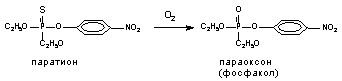
Токсичность параоксона для млекопитающих и человека выше, чем паратиона.
Важнейшие свойства фосфорорганических отравляющих веществ представлены в таблицах 44-46.
Таблица 44.
Основные свойства зарина
Зарин |
GВ |
Химическое название |
изопропил метилфосфонофторид |
Агрегатное состояние |
бесцветная жидкость, пары бесцветны |
Молекулярный вес |
140,10 |
Плотность пара (по воздуху) |
4,86 |
Плотность жидкости |
1,089 |
Точка кипения |
1580С |
Концентрация пара в воздухе (мг/м3) |
11300 (при 200С) |
Температура разрушения |
полное разрушение в течение 2,5 часов при 1500 |
Растворимость в воде (%) |
100 |
Скорость гидролиза |
зависит от рН. Период полураспада при рН 1,8: 7,5 часов; в незабуференной среде - 30 часов; быстрый гидролиз в щелочной среде. |
Продукт гидролиза |
в кислой среде НF; в щелочной среде изопропиловый спирт и полимеры |
Растворимость в липидах |
хорошая |
Стабильность при хранении |
стабилен в стальных контейнерах при 650. Чем чище вещество, тем стабильнее |
Действие на металлы |
легкое коррозийное |
Запах |
Отсутствует |
Среднесмертельная токсодоза (ингаляционно) |
100 мг.мин/м3- в состоянии покоя; 35 мг.мин/м3 - при физической нагрузке |
Средненепереносимая токсодоза (ингаляционно) |
75 мг.мин/м3 - в покое; 35 мг.мин/м3 - при физической нагрузке |
Скорость детоксикации |
быстро детоксицируется; |
Кожные эффекты (жидкость) среднесмертельная доза |
1,7 г/человека. Жидкость не повреждающая кожу, но легко пенетрирующая во внутренние среды. Необходима немедленная деконтаминация кожных покровов. Пары также проникают через неповрежденную кожу. |
Среднесмертельная токсодоза (пара через кожу, при защищенных органах дыхания) |
12000 мг.мин/м3 для обнаженного человека, 15000 мг.мин/м3, для человека, находящегося в обычном обмундировании |
Средненепереносимая токсодоза (пара через кожу) |
8000 мг.мин/м3 для человека в обычном обмундировании |
Стойкость |
Зависит от средств доставки и погодных условий (в среднем - до 5 суток) |
Таблица 45.
Основные свойства зомана
Зоман |
GD |
Химическое название |
пинаколиловый эфир метилфторфосфоновой кислоты |
Агрегатное состояние |
бесцветная жидкость; бесцветный пар |
Молекулярный вес |
182,2 |
Плотность пара (по воздуху) |
6,33 |
Концентрация пара в воздухе (мг/м3) |
3000 (при 200С) |
Плотность жидкости |
1,02 |
Температура кипения |
1980 |
Температура разрушения |
нестабилизированное вещество разрушается при 1300 в течение 4 часов, стабилизированное - 200 часов |
Растворимость в воде (%) |
1,5 |
Скорость гидролиза |
зависит от рН; в присутствии NaOH(5%) полное разрушение в течение 5 минут; период полуразрушения при рН 6,65 и 250 - 45 часов |
Продукт гидролиза |
НF |
Растворимость в липидах |
Высокая |
Стабильность при хранении |
менее стабилен, чем GB |
Запах |
фруктовый; при наличии примеси - камфорный |
Среднесмертельная токсодоза (ингаляционно) |
70-100 мг.мин/м3 |
Кожные эффекты |
чрезвычайно токсичен при действии через кожу. Кожу не повреждает, но быстро абсорбируется. |
Средненепереносимая доза через кожу (жидкая форма) |
0,35 г/человека |
Необходимость защиты |
противогаз, защита кожных покровов. Обычное обмундирование задерживает пары в течение 30 минут после контакта. Перед снятием противогаза необходимо удалять обмундирование, зараженное капельно-жидким ОВ |
Стойкость |
зависит от способа применения и погодных условий. Крупные проливы персистируют на местности в течение 1-2 недель при обычной погоде |
Таблица 46.
Основные свойства фосфорилтиохолина (Vx)
V-газы |
Vх |
Агрегатное состояние |
янтарного цвета жидкость, напоминающая машинное масло |
Молекулярный вес |
267,4 |
Плотность пара (по воздуху) |
9,2 |
Плотность жидкости |
1,008 (при 250) |
Температура замерзания |
ниже -510 |
Температура кипения |
3000 |
Концентрация пара (мг/м3) |
5 (при 200С) |
Скорость и температура разрушения |
период полураспада - 36 часов при 1500; 1,6 часов при 2000; 36 сек при 2950 |
Скорость гидролиза |
период полураспада при 250, рН 2-3:100 дней; рН 13 - 16 минут, рН 14 - 1,3 минут |
Продукты гидролиза |
диэтилметилфосфонат; 2-диизопропил-аминоэтилмеркаптан; при рН 7-10 продукты гидролиза токсичны |
Растворимость в липидах |
очень высокая |
Стабильность при хранении |
относительно стабильно при комнатной температуре |
Действие на металлы |
практически отсутствует |
Среднесмертельная токсодоза (ингаляционно)) |
30 мг.мин/м3 |
Средненепереносимая токсодоза (ингаляционно) |
50 мг.мин/м3 |
Кожная токсичность |
чрезвычайно токсичен при попадании на кожу и слизистые глаз. Кожу не повреждает, абсорбция быстрая. Необходима немедленная деконтаминация кожи. |
Средненепереносимая доза (через кожу) |
0,006 г/человека |
Защиты |
противогаз, защитная одежда |
Стойкость |
зависит от способа применения и погодных условий. Обширные проливы жидкого ОВ персистируют на местности при обычных погодных условиях |
Как видно из представленных данных ФОВ образуют зоны стойкого химическиого заражения. Прибывающие из зоны заражения пораженные ФОВ представляют реальную опасность для окружающих.
Токсикокинетика
Отравление происходит при вдыхании паров и аэрозолей, всасывании ядов в жидком и аэрозольном состоянии через кожу, слизистую глаз, с зараженной водой или пищей – через слизистую желудочно-кишечного тракта. Высокотоксичные ФОС не обладают раздражающим действием на месте аппликации (слизистые оболочки верхних дыхательных путей и желудочно-кишечного тракта, конъюнктива глаз, кожа) и проникают в организм практически незаметно. Наивысшая скорость проникновения ядов в организм при их ингаляции, наименьшая - при действии через кожу. Но и при нанесении на кожу действующей дозы ФОС, резорбция осуществляется в течение нескольких минут (скорость зависит от строения токсиканта).
Попав в кровь, ФОС неспецифически связываются с мембранами клеток эндотелия сосудов, эритроцитов крови, белками плазмы крови. За счет этого некоторая часть токсикантов выключается из токсикодинамического процесса. Специфично взаимодействуют вещества с активным центром карбоксилэстеразы - гидролазы, присутствующей в плазме крови человека. Это взаимодействие играет существенную роль в элиминации ФОС. Предварительное угнетение активности карбоксилэстеразы три-о-крезилфосфатом (ТОКФ) существенно повышает токсичность зарина и зомана.
Распределение веществ в организме и скорость элиминации определяются наличием или отсутствием в молекуле ФОС заряженных группировок, способностью связываться со структурными элементами крови и тканей, интенсивностью метаболических превращений. Незаряженные молекулы, к числу которых относятся практически все высокотоксичные ФОС, в том числе все ОВ, легко проникают через гематоэнцефалический барьер и оказывают токсическое действие, как в центральной нервной системе, так и на периферии. Заряженные соединения, содержащие, например, аммониевые, сульфониевые группировки, обладают практически только периферическим действием.
Важными механизмами элиминации фосфорорганических соединений из организма являются реакции их метаболизма. При этом некоторые, по большей части, мало токсичные вещества способны к относительно продолжительному персистированию (карбофос - сутки и более). Наиболее токсичные представители, как правило, быстро гидролизуются, окисляются (см. выше) при участии гидролаз (фосфорилфосфатаз, флюорогидролаз, карбоксилэстераз, арилэстераз и т.д.) крови и тканей, микросомальных цитохром-Р450 зависимых оксидаз смешанной функции, а затем связываются энзимом глутатион-S-трансферазой с глутатионом. Уже спустя час после внутрибрюшинного введения экспериментальным животным в крови ФОВ определяются в следовых количествах либо не определяются вовсе. Период полуэлиминации зарина и зомана составляют около 5 минут, Vх несколько больше. Осуществлять метаболизм ФОС способны практически все органы и ткани в соответствие с содержанием и активностью в них энзимов, принимающих участие в превращениях ксенобиотиков.
Из организма выделяются только нетоксичные метаболиты веществ и потому выдыхаемый воздух, моча, кал не опасны для окружающих.
Основные проявления интоксикации
Симптомы интоксикации ФОС при ингаляционном поражении развиваются значительно быстрее, чем при поступлении через рот или кожу.
При ингаляции ФОВ смерть может наступить в течение 1-10 минут после воздействия. В случае поступления ОВТВ с зараженной пищей, симптомы интоксикации развиваются в течение 0,5 часа. Резорбция с поверхности кожи действующей дозы высоко токсичных веществ происходит в течение 1 - 10 минут, однако скрытый период может продолжаться в течение 0,5 - 2 часов.
ФОС оказывают местное и резорбтивное действие. Подавляющее большинство развивающихся эффектов является следствием перевозбуждения мускарин- и никотинчувствительных холинэргических синапсов центральной нервной системы и периферии.
Местное действие проявляется функциональными изменениями органов на месте аппликации: возникновением миоза и гиперемии конъюнктивы при контакте яда со слизистой глаза; гиперемией слизистой оболочки носа и ринорреей – при проникновении ФОС ингаляционным путем; тошнотой, рвотой, спастическими болями в области живота – при попадании ядов внутрь; фибрилляцией подлежащих мышечных групп, пилоэрекцией и выделением капелек пота на зараженном участке кожи. Однако все явления непродолжительны и в конечном итоге не определяют тяжести интоксикации.
Резорбтивное действие ФОС всегда сопровождается нарушениями со стороны ЦНС, жизненно важных органов и систем: дыхательной, сердечно-сосудистой, а также желудочно-кишечного тракта и др. Продолжительность этих нарушений и степень их выраженности зависят от количества яда, попавшего в организм, и в известной степени, – от путей проникновения. Интоксикации могут быть легкими, средней степени тяжести и тяжелыми.
При отравлении легкой степени обычно наблюдается возбуждение, бессонница, головные боли, галлюцинации, чувство страха, апатия, депрессия, легкий тремор. Зрачки сужены (при поражении незащищенного человека ФОС в парообразной или аэрозольной форме). При этом нарушается зрение, особенно в темноте. Появляется головная боль, затруднение при дыхании, тошнота и другие диспептические явления. Военно-профессиональная работоспособность отравленного временно утрачивается. Пострадавший нуждается в оказании медицинской помощи. Сроки врачебного наблюдения за пораженным – от нескольких часов до 5-7 суток.
При отравлении средней степени тяжести возникают приступы удушья, напоминающие тяжелые приступы бронхиальной астмы. Поэтому такие формы отравления определяются как бронхоспастические. Приступы, как правило, возобновляются через каждые 10-15 мин, но и в промежутках между ними дыхание остается затрудненным. Отмечается усиленная секреция бронхиальных, слюнных и потовых желез. Отчетливо выражено повышение артериального давления. Отравление нередко сопровождается рвотой, поносом и схваткообразными болями в области живота. Наблюдаются фибриллярные подергивания мышц, в особенности жевательных. Чаще сознание сохранено, но чувство страха, возбуждение, эмоциональная лабильность - нарушают критическое восприятие окружающей обстановки. Зрачки резко сужены. Симптомы интоксикации отмечаются в течение 2-3 суток и более. К последствиям отравления средней степени тяжести можно отнести сохраняющуюся в течение 2-3 недель эмоциональную неустойчивость, вегетативную лабильность, мышечную слабость, нарушения функций желудочно-кишечного тракта и другие признаки астеновегетативного синдрома.
При тяжелых поражениях развивается судорожный синдром, который протекает на фоне полной утраты сознания. Если отравление не заканчивается летальным исходом от остановки дыхания в первые 10-30 минут, развивается кома. Кожа бледная, влажная, с резко выраженным акроцианозом. Наблюдается непрекращающаяся фибрилляция всех групп мышц, тремор. Дыхание дезорганизовано из-за периодически возникающих приступов удушья. Также отмечаются гипотензия и брадикардия. Зрачки сужены (однако миоз может сменяться мидриазом), реакция зрачков на свет отсутствует. Периодически возникают повторные приступы клонико-тонических судорог. Изо рта и носа выделяется пенистая жидкость. Наблюдается непроизвольное мочеиспускание и дефекация, а в особо тяжелых случаях – развивается полная арефлексия. Смерть может наступить в течение ближайших часов или первых суток после начала отравления, от остановки дыхания, реже - сердечной деятельности. При благоприятном исходе на протяжении длительного времени (1,5-2 месяца и более) у таких пораженных сохраняется общая слабость, астенизация, повышенная раздражительность, нарушение сна, устрашающие сновидения, головокружение, головная боль и другие невротические расстройства, составляющие астенический симптомокомплекс. Нередко, особенно при поражении зоманом или длительно персистирующими в организме отравленного ФОС, в периоде выздоровления у пострадавших развиваются признаки нейропатий (нарушения кожной чувствительности, мышечная слабость, как правило, дистальных групп мышц). Кроме того, могут возникать пневмония, острая сердечно-сосудистая недостаточность (причина поздней гибели), нарушение функции желудочно-кишечного тракта (тошнота, расстройство стула, боли в эпигастральной области), печени и почек.
Патогенез интоксикации
Пусковым механизмом практически всех симптомов, развивающихся при интоксикации ФОС, является перевозбуждение никотиновых и мускариновых холинергических синапсов, локализованных в центральной нервной системе и на периферии (табл. 47). При тяжелых поражениях в патологический процесс, по мере развития интоксикации, вовлекаются и нехолинэргические механизмы. К числу таковых относятся: нарушение функционального состояния глутаматэргической, катехоламинэргических, ГАМК-эргической нейромедиаторных систем мозга, увеличение содержания в крови биологически активных веществ (гормонов, продуктов перекисного окисления липидов, лейкотриенов, простогландинов, фактора агрегации тромбоциотв и т.д.), прогрессирующая гипоксия, изменение кислотно-основного состояния и электролитного баланса и т.д.
Таблица 47.
Признаки острого поражения ФОС и механизмы их развития
Анатомическое образование |
Развивающиеся эффекты |
МЕСТНОЕ ДЕЙСТВИЕ |
|
1. Воздействие на мускаринчувствительные синапсы |
|
Зрачок |
Миоз, иногда максимальный (размер с “булавочную головку”), анизокория |
Цилиарное тело |
Боль в области глаз, нарушение дальнего зрения (спазм аккомодации) |
Слизистая носа |
Гиперемия, риноррея |
Дыхательные пути (слизистая, гладкомышечные волокна) |
Затруднение дыхания, кашель, бронхоспазм, усиление секреции бронхиальных желез, |
Кожа |
Локальное усиление потоотделения, пилоэрекция |
Желудочно-кишечный тракт (слизистая, гладкомышечные волокна) |
Тошнота, рвота |
РЕЗОРБТИВНОЕ ДЕЙСТВИЕ |
|
1. Воздействие на периферические мускаринчувствительные синапсы |
|
Дыхательные пути |
Нарушение дыхания с затрудненным выдохом (как следствие бронхоспазма и повышенной секреции бронхиальных желез), диспное, боли в груди, кашель, отек легких |
Желудочно-кишечный тракт |
Анорексия, тошнота, рвота, схваткообразные боли в животе, боли в эпигастрии, понос, тенезмы, непроизвольная дефекация. |
Потовые железы |
Усиленное потоотделение |
Слюнные железы |
Слюнотечение |
Сердце |
Брадикардия |
Зрачок |
Миоз, анизокория |
Цилиарное тело |
Нарушение зрения, боли в области глаз |
Мочевой пузырь |
Непроизвольное мочеиспускание |
2. Воздействие на периферические никотинчувствительные синапсы |
|
Произвольная мускулатура |
Слабость, фасцикулляции, непроизвольные сокращения отдельных групп мышц, паралич мускулатуры (включая дыхательную) |
Симпатические ганглии |
Бледность кожных покровов, транзиторный подъем артериального давления, сменяющийся гипотензией |
3. Воздействие на центральные холинэргические синапсы |
|
Остро развивающиеся эффекты |
Общая слабость, гипотермия, потеря сознания, судороги, кома, угнетение дыхательного и сосудодвигательного центров (диспное, цианоз, гипотензия, остановка дыхания), |
Отсроченные эффекты |
Головокружение, напряженность, беспокойство, возбуждение, эмоциональная лабильность, бессонница, кошмарные сновидения, головная боль, тремор, депрессия, заторможенность, затруднение конценторации внимания, спутанность сознания, нарушение речи, атаксия. |
4. Нехолинэргические механизмы |
|
Остро развивающиеся эффекты |
Прогрессирующая кома, тканевая гипоксия, ацидоз, отек мозга |
Отсроченные эффекты |
Нарушение функций печени и почек, пневмония, невропатии, энцефалопатия |
Особое значение в патогенезе интоксикации придают гипоксии, носящей смешанный характер. В результате бронхоспазма, бронхорреи, угнетения дыхательного центра и слабости дыхательной мускулатуры развивается расстройство легочной вентиляции, что приводит к недостаточному насыщению артериальной крови кислородом и формированию гипоксической гипоксии. Если бронхоспазм появляется рано (в результате местного действия ФОС), то уже через несколько минут после начала отравления происходит снижение степени насыщения артериальной крови кислородом. При возникновении судорог снижение прогрессирует. Вследствие гипотонии и брадикардии, замедления скорости кровотока и ухудшения микроциркуляции, появляются застойные явления, и также нарушается снабжение тканей кислородом - возникает и циркуляторная гипоксия. Наконец, по мере углубления нарушений биоэнергетических процессов, накопления в тканях недоокисленных продуктов, развития ацидоза, ткани утрачивают способность утилизировать кислород, доставляемый кровью - развивается тканевая гипоксия. Кислородная недостаточность занимает важное место в патогенезе отравления ФОС, во многом определяя и степень тяжести, и исход интоксикации.
В основе отдаленных последствий острых отравлений может лежать иммунотоксическое действие ФОС. Так, иммуносупрессия может стать причиной развивающихся пневмоний, а инициация аутоиммунного процесса и угнетение активности нейрэстеразы (фермента, необходимого для обеспечения обменных процессов в нервных волокнах) - нейро- и энцефалопатий.
Механизм токсического действия
Как указывалось, практически все эффекты, выявляемые на начальных этапах развития интоксикации ФОС, могут быть объяснены явлением гиперактивации холинэргических механизмов передачи нервного импульса в ЦНС и на периферии. В основе феномена, как установлено, лежит способность токсикантов угнетать активность ацетилхолинэстеразы, а также некоторые другие механизмы действия на холинэргические структуры, в частности, непосредственное взаимодействие с холинорецепторами, сопровождающееся прямым холиномиметическим эффектом, и повышением чувствительности холинорецепторов к ацетилхолину и негидролизуемым холиномиметикам (холиносенсибилизирующее действие).
Антихолинэстеразное действие. ФОС являются ингибиторами АХЭ, практически необратимо взаимодействующими с ее активным центром. В результате их действия угнетается процесс разрушения АХ в синапсах. Так, при отравлении ФОС существенно возрастает содержание ацетилхолина в мозге (более чем в три раза; нормальное содержание - 2,4 мкг/г ткани). Медиатор накапливается в синаптической щели и вызывает стойкое перевозбуждение постсинаптических холинэргических рецепторов (непрямое холиномиметическое действие ФОС). Перевозбуждение холинорецепторов избытком ацетилхолина приводит к стойкой деполяризации постсинаптических мембран, иннервируемых клеток. Это, в свою очередь, первоначально сопровождается гиперактивацией центральных и периферических М- и Н-холинореактивных механизмов передачи нервных импульсов, а затем, в случае крайне тяжелого отравления, - блоком проведения нервного импульса, преимущественно в Н-холинэргических синапсах. Таким образом, отравление ФОС, по сути, - отравление эндогенным ацетилхолином, накапливающимся в крови и тканях, вследствие прекращения его разрушения ферментом ацетилхолинэстеразой.
С антихолинэстеразной теорией согласуются факты, свидетельствующие о существовании параллелизма между токсичностью ФОС и их способностью угнетать активность фермента in vitro, степенью угнетения холинэстеразы различных органов и выраженностью развивающихся эффектов. Легкое поражение ФОС, как правило, развивается при угнетении АХЭ более чем на 40%, средней степени тяжести - более 70%, тяжелой - около 90%.
Способность ФОС взаимодействовать с активным центром энзима объясняют структурным сходством молекул ядов с молекулой ацетилхолина. Некоторые ФОС (зарин, диизопропилфторфосфат и др.) имитируют сложноэфирную часть молекулы медиатора, поскольку группировка (Р=О) поляризована так же, как и карбонильная (С=О) группа ацетилхолина. Другие ФОС (например, фосфорилхолины) могут имитировать как эфирную, так и катионную часть ацетилхолина. При этом катионная головка, взаимодействуя с анионным участком активного центра фермента, обеспечивает ориентацию на нем токсиканта, а фосфорсодержащая часть молекулы яда взаимодействует с эстеразным центром. И в первом и во втором случае взаимодействие ФОС с активным центром ацетилхолинэстеразы приводит к образованию прочной ковалентной связи атома фосфора с гидроксильным радикалом серина, входящего в структуру эстеразного участка активного центра холинэстеразы, вызывая его фосфорилирование.
Таким образом, можно представить, что взаимодействие фермента с ФОС проходит по тому же механизму, что и с ацетилхолином. Взаимодействие ацетилхолина, зарина и VX с активным центром холинэстеразы показано на рис. 47.
Рисунок 47. Схема взаимодействия ацетилхолина, зарина и фосфорилтиохолина с активным центром ацетилхолинэстеразы
Чем выше структурное сходство ФОС с ацетилхолином, тем, как правило, выше его антихолинэстеразная активность и токсичность.
Принципиальное различие во взаимодействии ацетилхолина и ФОС с АХЭ состоит в том, что реакция декарбоксилирования активного центра после гидролиза АХ проходит практически мгновенно и энзим снова восстанавливает способность взаимодействовать с субстратом, а дефосфорилирование – протекает медленно. Причем с течением времени изначально обратимая связь ФОС-АХЭ, которая может разрушаться спонтанно (“спонтанная реактивация”) или с помощью некоторых веществ, вводимых отравленному (реактиваторы АХЭ), становится необратимой, неспособной к разрушению. Таким образом, взаимодействие ФОС и АХЭ проходит в две фазы и может быть представлено следующим образом:
![]()
Процесс превращения образовавшейся в первой фазе обратимо фосфорилированной холинэстеразы в необратимо связанную форму называется “старение” фосфорилхолинэстеразы. Как скорость “спонтанной реактивации” АХЭ (и самопроизволное восстановление ее активности), так и “старения”, зависит от структуры ФОС, а именно от строения алкильных радикалов при атоме фосфора. Чем “тяжелее” радикалы, тем ниже скорость “спонтанной реактивации” и выше скорость “старения”. Поэтому АХЭ, ингибированная VX (R -OC2H5), стареет чрезвычайно медленно, зарином (R -OCН(СH3)2) - в течение нескольких часов, зоманом (R -OCНСН3С(СH3)3) - в считанные минуты. В основе “старения” лежит процесс отщепления от атома фосфора, связанного с активным центром энзима, алкильных радикалов. При этом одновременно изменяется конформация белковой части энзима (с этим, вероятно, связано то обстоятельство, что фосфорилированные одним и тем же веществом холинэстеразы, выделенные из тканей разных млекопитающих, “стареют” с разной скоростью).
В настоящее время обнаружены соединения (гидроксиламин, гидроксамовые кислоты, оксимы), способные, взаимодействуя с остатком ФОС, связанного с АХЭ, отрывать его от молекулы энзима (если не произошло его “старение”) и, тем самым, восстанавливать ферментативную активность. Такие вещества, получившие название реактиваторов холинэстеразы, при своевременном введении отравленному существенно ослабляют выраженность токсического процесса, что подтверждает справедливость антихолинэстеразной теории действия ФОС.
Даже ингибированная Vх ацетилхолинэстераза, “стареющая” с минимальной скоростью, а “спонтанно реактивирующаяся” относительно быстро, дефосфорилируется в течение нескольких суток. Вот почему ФОС называют необратимыми ингибиторами холинэстеразы. In vitro способность ФОС угнетать АХЭ уменьшается при увеличении концентрации в инкубационной среде естественного субстрата энзима - ацетилхолина. По этой причине ФОС называют также конкурентными ингибиторами АХЭ. За активный центр энзима ФОС конкурируют не только с ацетилхолином, но и с ингибиторами энзима из других классов соединений, в частности с карбаматами. Последние вызывают обратимое карбамилирование активного центра АХЭ и потому называются обратимыми ингибиторами АХЭ. Установленная в опытах in vitro и in vivo способность обратимых ингибиторов холинэстеразы (прозерина, галантамина и т.д.) защищать холинэстеразу от угнетения ФОС, предупреждать действие этих ядов на органы и системы и, тем самым, препятствовать развитию интоксикации используется на практике при разработке профилактических антидотов ФОС (см. ниже).
Холинэстеразная активность выявляется не только в синаптических структурах, но и в крови млекопитающих и человека. Причем в мембране эритроцитов содержится ацетилхолинэстераза, по сути, идентичная энзиму нервной ткани, а в плазме крови - бутирилхолинэстераза, отличающаяся от АХЭ более высоким сродством к эфирам холина и жирных кислот с большей молекулярной массой, чем ацетат (например, бутирилхолину - эфиру холина и масляной кислоты). ФОС, при поступлении в организм, угнетают оба типа холинэстераз крови. Степень инактивации энзимов пропорциональна степени угнетения активности синаптической ацетиохолинэстеразы. Это явление используется для диагностики интоксикации ФОС, а также для верификации степени тяжести поражения. При отсутствии иных причин, снижение активности холинэстеразы крови более чем на 50% свидетельствует об интоксикации антихолинэстеразными ядами. При необходимости контролировать состояние синаптического энзима, для исследования можно изучать активность АХЭ в эритроцитах, выделенных методом центрифугирования.
Способность ФОС угнетать холинэстеразу используют также для индикации ФОС в воде, продовольствии и т.д. (биохимический метод индикации).
Действие на холинорецепторы. Из возможных неантихолинэстеразных механизмов наиболее важным является действие ФОС на холинорецепторы. Поскольку и холинорецепторы, и холинэстераза адаптированы к одному и тому же нейромедиатору, ингибиторы холинэстеразы могут проявить активность и по отношению к холинорецепторам.
По-видимому, блокада проведения нервно-мышечного сигнала, развивающаяся при смертельной интоксикации ФОС, связана не только со стойким деполяризующим действием избыточного количества ацетилхолина, но и с прямым действием ФОС на нервно-мышечные синапсы (по типу действия деполяризующих миорелаксантов). Так, в эксперименте на изолированном нервно-мышечном препарате млекопитающего, при внесении в инкубационную среду достаточной дозы ФОС, наблюдается полное прекращение передачи нервного импульса с нервного волокна на мышцу. Однако через некоторое время на фоне практически “тотального” угнетения активности холинэстеразы отмечается восстановление нервно-мышечной проводимости в синапсах. Повторно блок можно вызвать, вновь добавив ФОС в инкубационную среду.
Сенсибилизирующее действие на холинорецептор зарина, ДФФ и других ФОС, проявляется, в частности, существенным повышении чувствительности отравленных экспериментальных животных к холиномиметикам, негидролизуемым ацетилхолинэстеразой (никотину, ареколину и т.д.). Установлено, что сенсибилизация к М-холиномиметикам (ареколину) сохраняется значительно дольше, чем к Н-холиномиметикам (никотину). Причины различия, вероятно, обусловлены особенностями проведения нервных импульсов в М- и Н-холинэргических синапсах (см. выше).
Восстановление нормального проведения нервного импульса у лиц, перенесших интоксикацию ФОС, осуществляется за счет медленно протекающих процессов дэфосфорилирования АХЭ (“спонтанная реактивация”), синтеза АХЭ в перикарионе нервных клеток de novo и транспорта ее в нервные окончания, снижения содержания ацетилхолина в синаптической щели, десенситизации холинорецепторов (понижение чувствительности к ацетилхолину).
Нехолинэргические механизмы токсического действия. Помимо действия на холинореактивные структуры, ФОС, в высоких дозах, обладают прямым повреждающим действием на клетки различных органов и тканей (нервной системы, печени, почек, системы крови и т.д.), в основе которого лежат общие механизмы цитотоксичности: нарушение энергетического обмена клетки; нарушение гомеостаза внутриклеточного кальция; активация свободнорадикальных процессов в клетке; повреждение клеточных мембран. Чем менее токсично ФОС, тем значимее роль указанных механизмов в развитии проявлений тяжелого поражения данным токсикантом. Существуют ФОС полностью лишенные антихолинэстеразной активности, токсичность которых обусловлена исключительно их цитотоксическим действием (три-о-крезилфосфат). Клиника отравления такими веществами полностью отличается от описанной выше.
Мероприятия медицинской защиты
Специальные санитарно-гигиенические мероприятия:
- использование индивидуальных технических средств защиты (средства защиты кожи; средства защиты органов дыхания) в зоне химического заражения;
- участие медицинской службы в проведении химической разведки в районе расположения войск; проведение экспертизы воды и продовольствия на зараженность ОВТВ;
- запрет на использование воды и продовольствия из непроверенных источников;
- обучение личного состава правилам поведения на зараженной местности.
Специальные профилактические медицинские мероприятия:
- проведение частичной санитарной обработки (использование ИПП) в зоне химического заражения;
- проведение санитарной обработки пораженных на передовых этапах медицинской эвакуации.
- применение профилактических антидотов перед входом в зону химического заражения и контактом с пораженными, поступающими из очага;
Специальные лечебные мероприятия:
- применение антидотов и средств патогенетической и симптоматической терапии состояний, угрожающих жизни, здоровью, дееспособности, в ходе оказания первой (само-взаимопомощь), доврачебной и первой врачебной (элементы) помощи пострадавшим.
- подготовка и проведение эвакуации
Медицинские средства защиты
К числу средств медицинской защиты относятся:
1. Средства предотвращающие поступления веществ в организм через кожу - индивидуальные противохимические пакеты (ИПП - см. раздел “Специальная обработка”);
2. Медикаментозные средства медицинской защиты.
Медикаментозные средства представлены препаратами, назначаемыми с целью профилактики поражения, само- и взаимопомощи, раннего (догоспитального) лечения. Сюда относятся этиотропные, патогенетические и симптоматические средства.
Этиотропные средства защиты (антидоты).
Разработка этиотропных средств защиты - специфических противоядий (антидотов) ФОВ, долго считавшихся основным видом химического оружия, началась сразу после второй мировой войны и продолжается до настоящего времени. Основные направления исследований в области разработки медицинских средств защиты представлены в таблице 48.
Таблица 48.
Основные направления разработки средств медицинской защиты от фосфорорганических отравляющих веществ (по С.Н. Голикову и соавт., 1972)
Направление |
Препараты |
Защита холинорецепторов |
Холинолитические (антихолинэргические) средства |
Реактивация холинэстеразы |
Оксимы |
Защита холинэстеразы от необратимого угнетения ФОС |
Обратимые ингибиторы холинэстеразы |
Нейтрализация ФОС |
Оксимы; специфические антитела |
Ускорение метаболизма ФОС |
Индукторы микросомальных ферментов |
Возмещение холинэстеразы |
Препараты очищенной холинэстеразы |
Подавление синтеза и высвобождения ацетилхолина |
Производные дифенилгликолятов, гемихолиний |
Холинолитики как антидоты ФОС. Как известно, вещества различного строения имеют неодинаковую способность проникать через гематоэнцефалический барьер. Поэтому все холинолитики подразделяются на центральные (проникающие через ГЭБ: амизил, тропацин и др.) и периферические (непроникающие через ГЭБ). Неодинаково и сродство веществ с различным строением к рецепторам разных типов. По этому показателю антихолинэргические препараты разделяют на М-холинолитики (атропин, скополамин, метацин и др.) и Н-холинолитики (пентамин, бензогексоний, мекамиламин и др.).
Холинолитики (антихолинэргические средства) являются физиологическими антагонистами ФОС в действии на холинэргические синапсы. Они связываются с постсинаптическими рецепторами, защищая их от гиперактивации ацетилхолином, накапливающимся в избытке в синаптической щели.
Как указывалось ранее, ингибирование ацетилхолинэстеразы, развивающееся при отравлении ФОС, приводит к накоплению нейромедиатора в холинэргических синапсах всех типов: центральных и периферических, мускарин- и никотинчувствительных. Поэтому при интоксикации ФОС с целью защиты изучалась антидотная активность холинолитиков разных типов (С.В. Аничков, С.Н. Голиков, М.Я. Михельсон, Н.В. Саватеев и др.). В результате многолетних исследований удалось установить ряд закономерностей:
1. Ни один из представителей различных групп холинолитиков не является полным антагонистом ФОС, так как, блокируя лишь определенный тип рецепторов, устраняет эффекты, инициируемые возбуждением только рецепторов этого типа.
2. Чувствительность отравленных к холинолитикам резко снижается и для получения антидотного эффекта препараты следует вводить в дозах, во много раз превосходящих фармакопейные.
3. Продолжительность действия холинолитиков в организме (блокада М-, и Н-холинорецепторов) не велика, а на фоне тяжелой интоксикации ФОС еще более сокращается и, как правило, в среднем составляет не более 1-3 часов. Это указывает на необходимость повторного назначения холинолитиков при отравлениях.
4. Наибольший защитный эффект удается получить при раннем использовании комплекса холинолитиков, связывающихся как с центральными, так и периферическими, М- и Н-холинорецепторами. Однако, в то время как симптоматика, обусловленная возбуждением М-холинорецепторов, сохраняется длительное время (дни), нарушения, связанные с активацией Н-холинорецепторов отмечаются сравнительно непродолжительное время (часы). Поэтому по мере развития токсического процесса эффективность Н-холинолитиков быстро снижаться, а потребность в их назначении исчезает.
5. При раннем назначении отравленным препаратов отдельных групп наибольшая антидотная активность выявляется у центральных холинолитиков (амизил, скополамин, циклодол и т.д.). Однако активность этих средств на периферии выражена менее отчетливо. Поскольку всегда существует необходимость повторного введения препаратов, для устранения, в том числе и периферических эффектов, возникает опасность их побочного действия на центральную нервную систему. Поэтому при создании профилактических противоядий предпочтение отдают центральным холинолитикам, а лечебных - препаратам периферического действия.
Выявленные закономерности позволили разработать тактику использования холинолитиков при поражениях ФОС. В состав профилактических средств и средств само- и взаимопомощи, назначаемых при появлении первых признаках интоксикации, они входят в качестве важнейших компонентов соответствующих рецептур (см. ниже), а для целей лечения пораженных используются в виде самостоятельных препаратов.
В течение длительного времени препаратом выбора для лечения отравленных ФОС является атропин. Этот препарат был предложен уже через несколько недель после окончания 2-й Мировой Войны и захвата арсеналов химического оружия немецкой армии. Будучи М-холинолитиком преимущественно периферического действия, атропин устраняет такие проявления интоксикации как бронхоспазм, бронхорея, брадикардия, тошнота, рвота, боли в животе, понос, гиперсаливация и т.д. Однако атропин не защищает никотиновые рецепторы от токсического действия ФОС, и, следовательно, не устраняет явления, связанные с перевозбуждением нейронов симпатических ганглиев (нарушения гемодинамики и т.д.), нервно-мышечных синапсов (фасцикулляции, паралич мускулатуры). Атропин обладает слабой противосудорожной активностью.
Доза и схема назначения атропина отравленным определяется по клиническим показаниям.
Для устранения проявлений местного действия ФОС на орган зрения (спазм аккомодации) несколько капель 0,1% раствора препарата вносят в конъюнктивальный мешок.
При легкой интоксикации вещество вводят внутримышечно в дозе 2 мг. При необходимости (сохранение или рецидив симптоматики) инъекции повторяют каждые 30 минут до появления признаков легкой переатропинизации (сухость и покраснение кожных покровов, прекращение саливации, расширение зрачка, учащение пульса).
При отравлении средней степени тяжести внутримышечно вводят 4 мг атропина, а затем каждые 10 минут по 2 мг вещества до полного прекращения симптоматики и появления признаков легкой атропинизации (см. выше). Иногда пострадавшие нуждаются в ведении вещества в течение 2 суток.
Тяжело пораженному ФОС желательно внутривенно (или внутримышечно) ввести 4 - 6 мг атропина, а затем через каждые 5 - 10 минут повторять инъекцию в дозе 2 мг. По существующим данным в течение первых суток может потребоваться до 100 мг и более атропина.
Необходимость введения атропина в больших дозах делает чрезвычайно опасным случайное (ошибочное) его назначение не отравленным людям (неправильный диагноз, паника и т.д.). В таких случаях развиваются признаки отравления антидотом: покраснение кожных покровов, сухость во рту, жажда, мидриаз, ухудшение зрения вблизи (паралич аккомодации), тахикардия, головокружение, нарушение ориентации, галлюцинации. Плохая переносимость препарата здоровым человеком делает невозможным его использование как средства индивидуальной защиты, выдаваемого бойцу на руки.
Еще одна опасность связана с введением атропина тяжело пораженным в поздние сроки на фоне выраженной гипоксии. В этом случае возрастающая чувствительность миокарда к симпатомиметическим влияниям может стать причиной смертельной фибрилляции желудочков сердца при блокаде атропином окончаний блуждающего нерва. Для предупреждения этого осложнения введению препарата должны предшествовать мероприятия по устранению гипоксии.
Антидотными свойствами помимо атропина обладают и многие другие холинолитики, особенно, как указывалось, с выраженным действием на центральную нервную систему. Перечень холинолитических средств, рекомендуемых для лечения отравлений ФОС, представлен в таблице 49.
Таблица 49.
Холинолитические средства, рекомендуемы для оказания неотложной медицинской помощи пораженным ФОС (по С.И. Локтионову, 1970)
Название препарата (форма выпуска) |
Действие |
Начальная доза |
Атропин (ампулы) |
М-холинолитическое |
2,0 мл 0,1% раствора внутримышечно (внутривенно) |
Амизил (порошок, таблетки) |
М-холинолитическое |
1 - 2 мг внутрь |
Метацин (таблетки, ампулы) |
М-холинолитическое |
2 - 5 мг внутрь 0,5 - 1,0 мл 0,1% раствора под кожу (внутривенно) |
Скополамин (раствор) |
М-холинолитическое |
1,0 мл 0,05% раствора под кожу |
Апрофен (таблетки, ампулы) |
М,Н-холинолитическое |
0,25 мг внутрь 0,5 - 1,0 мл 1% раствора под кожу (внутримышечно) |
Арпенал (таблетки, ампулы) |
ганглиоблокирующее, М-холинолитическое |
50 мг внутрь 1,0 - 2,0 мл 2% раствора под кожу (внутримышечно) |
Тропацин (таблетки) |
ганглиоблокирующее, М-холинолитическое |
10 - 12,5 мг внутрь |
Бензогексоний (таблетки, ампулы) |
ганглиоблокирующее |
100 - 250 мг внутрь 1,0 мл 2,5% раствора под кожу (внутримышечно) |
Пентамин (ампулы) |
ганглиоблокирующее |
1,0 мл 5% раствора внутримышечно |
Помимо классических холинолитиков, выраженным центральным и периферическим антихолинэргическим действием обладают препараты и других фармакологических групп: некоторые нейролептики, антидепрессанты, главным образом, производные тиоксантена (хлорпротиксен и др.) и фенотиазина (аминазин, фторацизин и др.). Фторацизин является компонентом профилактических антидотов ФОВ (П-6, П-10М).
Некоторые миорелаксанты (Н-холинолитики), например мекамиламин, потенцируют профилактическую эффективность рецептур, включающих М-холинолитики и обратимые ингибиторы холинэстеразы.
Реактиваторы холинэстеразы. Восстановление каталитической активности холинэстеразы, угнетенной ФОС, определяется как процесс реактивации. Фармакологические препараты, способные ускорять этот процесс, называются реактиваторами холинэстеразы и являются биохимическими антогонистами ФОС. Первым веществом, для которого была показана реактивирующая способность, был гидроксиламин (Виллсон, 1951), затем последовали производные гидроксамовой кислоты и, наконец, в качестве средств оказания помощи пораженным, были предложены оксимы, менее токсичные и более активные вещества, содержащие в молекуле оксимную группировку (-НС=N-OH). К числу наиболее известных реактиваторов холинэстеразы относятся пралидоксим (2-ПАМ), дипирокисм (ТМБ-4), токсогонин (LuH-6) (рис. 48).
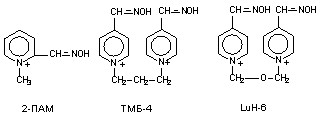
Рисунок 48. Структура некоторых реактиваторов холинэстеразы
Биохимический механизм процесса реактивации холинэстеразы (Е) схематично представлен на рисунке 49.
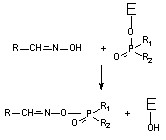
Рисунок 49. Дефосфорилирование хлинэстеразы с помощью оксима
В результате нуклеофильной атаки оксимной группы на фосфорилированный энзим разрывается ковалентная связь между атомом фосфора ФОС с кислородом серина активного центра холинэстеразы и образуется новое соединение – фосфорилированный оксим и свободный энзим.
Реактивация ингибированных холинэстераз как in vitro, так и in vivo характеризуется двумя показателями: скоростью, то есть количеством восстановленного энзима в единицу времени, и уровнем реактивации – максимальным количеством дефосфорилированного фермента, которое можно получить, обрабатывая фосфорилированную холинэстеразу реактиватором. Эти характеристики зависят от структуры ФОС, строения реактиватора и времени, прошедшего с момента взаимодействия ФОС с активным центром холинэстеразы. Например, скорость реактивации холинэстеразы эритроцитов человека, ингибированной зарином, под влиянием 2 ПАМ в 10 раз выше, чем холинэстеразы, угнетенной ДФФ. Феномен может быть следствием влияния стерических (пространственно-структурных) факторов. Так, при реактивации холинэстеразы, ингибированной веществами с сильно разветвленными алкильными радикалами (ДФФ), затрудняется образование связи между атомом фосфора и кислородом оксимной группы, без чего невозможна реактивация.
Из известных реактиваторов наивысшей активностью обладают биспиридиниевые соединения (содержат два пиридиновых кольца в молекуле): ТМБ-4, токсогонин и др. Слабой реактивирующей и антидотной активностью, не смотря на способность проникать через ГЭБ, обладают реактиваторы, не содержащие в молекуле пиридиновых радикалов с четвертичным азотом: диацетиламиноксим (ДАМ-оксим), изонитрозин и др.
Как указывалось ранее, холинэстеразы, ингибированные ФОС, с течением времени приобретают устойчивость к воздействию реактиваторов. Это явление получило название “старения” фосфорилхолинэстераз. Поэтому на реактивационный эффект при действии оксимов можно рассчитывать только при условии их применения в первую (обратимую) фазу торможения, продолжительность которой, в зависимости от строения действующих ФОС, будет значительно различаться (минуты – часы). Наиболее устойчивой к реактиваторам является быстро “стареющая” холинэстераза, ингибиорованная зоманом.
Помимо свойства дефосфорилировать холинэстеразу и восстанавливать ее активность, реактиваторы способны деблокировать (десенсибилизировать) холинорецепторы и восстанавливать их функцию, разрушать ФОС при непосредственном взаимодействии с ядами.
Деблокирующее действие реактиваторов достаточно подробно изучено на мионевральных синапсах. Так, показано, что с помощью 2-ПАМ, ТМБ-4 удается устранять блок проведения на нервно-мышечном препарате диафрагмы крысы, вызванный зоманом или метилфторфосфорилхолином. Этот факт нельзя объяснить реактивацией холиэстеразы, так как яды образуют с ферментом практически нереактивируемый комплекс.
Десенсибилизирующее действие оксимов, проявляется способностью снижать возникающую при действии ФОС повышенную чувствительность Н-холинорецепторов (центральной нервной системы, вегетативных ганглиев) к холиномиметикам, не гидролизуемым холинэстеразой. Полагают, что и деблокирующее и десенсибилизирующее действие оксимов на Н-холинорецепторы осуществляется за счет расщепления комплекса ФОС – холинорецептор.
Некоторые оксимы (2-ПАМ, ТМБ-4) обладают Н-холинолитической активностью (курареподобным действием), что также играет роль в их способности устранять нервно-мышечный блок.
Один из механизмов защитного действия реактиваторов связан с прямой нейтрализацией (разрушением) яда, циркулирующего в крови. Суть явления состоит в том, что оксимы образуют связь с атомом фосфора ингибитора, замещая при этом подвижную группу в молекуле ФОС. При этом образуется комплекс яда с оксимом, который, распадаясь, дает уже неактивное соединение. Однако в некоторых случаях скорость распада продукта взаимодействия ФОС–оксим мала. При этом в организме накапливается вещество, обладающее, порой, мощными ингибиторными свойствами. Поэтому в практике оказания помощи отравленным следует избегать введения неоправданно большого количества оксимов.
В последнее время появились сообщения о способности реактиваторов холинэстеразы восстанавливать активность карбоксилэстеразы крови и тканей, что важно, поскольку при отравлении ФОС этот фермент играют существенную роль в детоксикации ядов.
Под влиянием реактиваторов холинэстеразы ускоряется восстановление сознания у пораженных, ослабляется выраженность бронхоспазма, спазма кишечника, ослабляются или прекращаются фибриллярные мышечные подергивания, предупреждается развитие мышечной слабости, нормализуется функция нервно-мышечных синапсов и восстанавливается деятельность дыхательной мускулатуры, что в свою очередь приводит к ослаблению гипоксии.
Изложенные представления о механизмах антидотного действия оксимов определяют тактику их применения.
Необходимостью раннего введения обусловлено включение реактиватора холинэстеразы в состав антидота само- и взаимопомощи АЛ-85 (см. ниже). В качестве лечебных антидотов реактиваторы применяют при отравлениях средней степени тяжести и тяжелых поражениях ФОС.
В опытах на животных показано, что минимальной действующей концентрацией пралидоксима (2-ПАМ) в крови является 4 мг/мл. Внутривенное введение препарата со скоростью 500 мг/час обеспечивает поддержание концентрации в плазме крови 15 мг/мл. Для достижения действующей концентрации препаратов в крови и тканях человека и поддержания ее на этом уровне в течение необходимого времени (около 1,5 часов) рекомендуют повторно, с интервалом 20 минут вводить внутривенно (или внутримышечно) 500 - 2000 мг пралидоксима (2-ПАМ) или 150 - 250 мг дипироксима (ТМБ-4). При необходимости инъекции можно повторить спустя 4 - 6 часов после первого введения. Возможно внутривенное капельное введение препаратов в указанных дозах со скоростью: 2-ПАМ - 100 мг/мин, ТМБ-4 - 25 мг/мин. Более высокие дозы оксимов или более частое и длительное их применение не только не оправдано, но может привести к осложнениям, обусловленным способностью образовывать с ФОС стойкие токсичные комплексы, миорелаксирующим действием оксимов.
При лечении острых отравлений ФОС реактиваторы холинэстеразы применяются в сочетании с холинолитическими веществами. В эксперименте установлено, что при применении атропина или других холинолитиков (например амизила, пентафена) вместе с оксимами наблюдался эффект потенцирования. Это выражалось в увеличении антидотной мощности противоядий и в ускорении восстановления нарушенных функций.
На снабжении армии США принят реактиватор холинэстеразы пралидоксим (2-ПАМ). При чрезвычайных ситуациях на руки бойцу выдают 3 автоинъектора с пралидоксимом, каждый содержит 600 мг оксима. Препараты рекомендуют вводить при появления первых признаков поражения. Отечественной наукой разработан эффективный, отличающийся высокой реактивационной способностью биспиридиноксим - карбоксим.
Обратимые ингибиторы холинэстеразы. В 1946 году Костер показал, что предварительное введение физостигмина (алкалоид растительного происхождения), существенно повышает резистентность экспериментальных животных к ДФФ, а Келле в том же году связал этот эффект со способностью алкалоида, защищать активный центр АХЭ от действия яда. Этим было положено начало изучения еще одной группы биохимических антагонистов ФОС - обратимых ингибиторов холинэстеразы. Эти вещества, как правило, являются производными карбаминовой кислоты (NH2COOH) и потому нередко называются карбаматами (рис. 50).
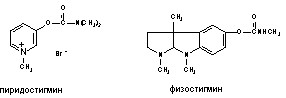
Рисунок 50. Структура некоторых обратимых ингибиторов холинэстеразы
В настоящее время установлено, что профилактическое введение обратимых ингибиторов, как проникающих (физостигмин, галантамин, аминостигмин), так и непроникающих (пиридостигмин) через ГЭБ, обеспечивает защиту экспериментальных животных от высокотоксичных ФОС. Наибольшей активностью обладают проникающие через ГЭБ третичные карбаматы (физостигмин, галантамин, аминостигмин и др.).
Структурно эти вещества напоминают естественный субстрат энзима - ацетилхолин, однако как катионная, так и кислотная часть молекулы ингибитора имеют большую массу, чем соответствующие фрагменты молекулы субстрата. За счет этого осуществляется относительно прочная фиксация веществ на активном центре фермента (карбамилирование активного центра), что и лежит в основе его ингибирования. Поскольку комплекс фермент-ингибитор достаточно быстро спонтанно разрушается (как правило, в течение 6 часов) карбаматы называются конкурентными, обратимыми ингибиторами холинэстеразы. Обратимость в действии карбаматов на фермент отличает их от ФОС.
Профилактический эффект при воздействии ФОВ наблюдается при введении обратимых ингибиторов в дозах, вызывающих угнетении ХЭ на 40% и более. В этих условиях ФОС, попавшее в организм, в значительно меньшей степени угнетает активность холинэстеразы, поскольку активные центры энзима в момент воздействия яда защищены карбаматом и накапливающимся в синаптической щели ацетилхолином. В дальнейшем ФОС быстро разрушается в организме, а карбамат покидает активный центр холинэстеразы, активность которой восстанавливается. При этом подъем уровня ацетилхолина в тканях защищенного не столь выражен и значительно менее продолжителен. Так, на фоне тяжелой интоксикации зоманом повышенное содержание ацетилхолина в мозге крыс отмечается в течение 5 - 6 часов. При профилактическом введении физостигмина нормализация уровня ацетилхолина происходит в течение 30 минут.
Человек безсимптомно переносит карбамилирование 20-30% ацетилхолинэстеразы. Поэтому для предотвращения развития неблагоприятных эффектов, связанных с угнетение холинэстеразы обратимым ингибитором, и защиты холинорецепторов в состав профилактических антидотов дополнительно вводят холинолитики.
В США препаратом выбора является четвертичный карбамат, не проникающий через ГЭБ - пиридостигмин. Препарат выпускается в таблетках по 30 мг вещества в каждой. Продолжительность защитного действия - 6-8 часов.
В состав отечественных профилактических антидотов входит аминостигмин, вещество проникающее через ГЭБ, и, следовательно, защищающее не только периферические, но и центральные холинэргические синапсы.
Индукторы микросомальных ферментов. Поскольку ФОВ метаболизируют в организме при участии микросомальных ферментов с образованием нетоксичных продуктов, в 60-е годы прошлого века была высказана идея о возможности использовать для целей профилактики вещества, активирующие эту группу энзимов - индукторы микросомальных ферментов (Рыболовлев Р.С., Линючев М.Н. и др.). Препаратом выбора долгое время считался бензонал (производное барбитуровой кислоты), не обладающий снотворным действием и потому не снижающий военно-профессиональную работоспособность. Вещество рекомендовали к приему в течение 3-х суток, после чего примерно на неделю резистентность организма к действию ФОВ (по данным на экспериментальных животных) возрастала в 1,5 и более раз. В настоящее время к этой группе средств профилактики отношение достаточно настороженное, поскольку при чрезвычайных ситуациях причиной поражения человека могут стать не только ФОС, но чаще другие вещества, некоторые из которых усиливают свою токсичность в организме в процессе метаболизма.
Другие этиотропные средства. Препараты с иными механизмами антагонизма с ФОС (см. табл. 48) при их изучении показали слабую эффективность или плохую переносимость и потому не нашли применения в военно-медицинской практике. Наиболее продуктивно изучалась возможность создания средств иммунной профилактики поражения ФОВ, на основе получения антител к ним. Теоретически такой подход может быть использован применительно к любому токсиканту, на основе которого может быть синтезирован комплексный антиген (токсикант или его фрагмент, связанный с высокомолекулярной иммуногенной группой). В настоящее время в эксперименте показана возможность создания антидотов на рассматриваемом принципе в отношении некоторых фосфорорганических соединений (зоман, малатион, фосфакол и др.). Однако на практике существуют значительные ограничения возможности использования антител (в том числе моноклональных) в целях лечения и профилактики интоксикаций (см. раздел “Антидоты”).
Симптоматические и патогенетические средства, применяемые с целью медицинской защиты при поражении ФОС. Необходимость применения средств симптоматической и патогенетической терапии для целей медицинской защиты от ФОС определяется, прежде всего, тем обстоятельством, что среди противоядий не существует “абсолютного” антагониста этих ядов в действии на биологические системы. Кроме того средства медицинской защиты и лечебные антидоты оказываются эффективными лишь при своевременном (раннем) введении. Появление симптоматики свидетельствует о развитии патологического процесса, и в этих условиях устранение пускового звена (нормализация состояния холинореактивных структур), совсем не означает устранение проявлений, которые могут быть следствием вторичных патохимических и патофизиологических процессов. Наиболее ранимой в этом плане является функция ЦНС. Спасти жизнь пострадавшему оказывается проще, чем сохранить его профессиональную работоспособность, так как перевозбуждение холинэргических механизмов быстро перерастает в полимедиаторную патологию за счет тесного структурно-функционального взаимодействия различных нейромедиаторных систем мозга. Поэтому при поражении ФОС в высоких дозах клиника интоксикации может развиться, не смотря на своевременное применение этиотропных средств защиты. Во всех этих случаях необходимо использовать значительно больший арсенал средств и методов терапии, с помощью которых только и удается оказать помощь пострадавшему: спасти жизнь, сохранить здоровье. Группы препаратов, используемые для указанных целей, представлены в таблице 50.
Таблица 50.
Основные направления патогенетической и симптоматической терапии отравлений ФОС
Основные направления |
Группы препаратов |
Нормализация гомеостаза внутриклеточного кальция |
Блокаторы кальциевых каналов (верапамил, нифедипин и др.) |
Нормализация электролитного обмена |
Электролиты (препараты калия) |
Устранение гипоксии |
Кислородотерапия Антигипоксанты (олифен, цитохром “С”) Препараты янтарной кислоты |
Угнетение перекисного окисления липидов |
Антиоксиданты (токоферол, аскорбат) |
Защита клеток мозга от повреждения возбуждающими аминокислотами |
Антагонисты глутаматных рецепторов (кеталар и др.) |
Устранение психических нарушений |
Нейролептики Антидепрессанты Психостимуляторы |
Устранение судорожного синдрома |
Противосудорожные (производные бензодиазепина; производные барбитуровой кислоты; антагонисты ВАК и т.д.) |
Стимуляция дыхания |
Этимизол |
Поддержание сердечно-сосудистой деятельности |
Сердечные гликозиды Вазотоники |
Из препаратов, представленных в таблице 50, в качестве средств медицинской защиты могут быть рекомендованы противосудорожные средства из группы производных бензодиазепина, в частности диазепам (10 мг препарата, желательно ввести внутривенно). Как указывалось ранее, при отравлении ФОС возбуждение холинергических структур в центральной нервной системе является лишь пусковым моментом в механизме развития судорог. В последующем этот процесс в значительной степени теряет свою специфичность. Поэтому при продолжающихся судорогах, которые не удалось купировать введением холинолитиков, следует использовать фармакологические средства, повышающие тонус тормозных нейромедиаторных систем мозга, в частности ГМАК-эргической. Бензодиазепинам, как средствам медицинской защиты, предпочтение отдают в силу их высокой противосудорожной активности, большой терапевтической широты, удобства применения при массовом потоке пораженных (препараты могут быть изготовлены в форме шприцов-тюбиков). Необходимо иметь в виду, что устранение судорожного синдрома не защищает жизнь пострадавшего. В эксперименте показано, что на фоне диазепама, ФОС в смертельной дозе вызывает гибель животных при полном отсутствии судорог.
Профилактические антидоты. Представляют собой таблетированные средства, которые военнослужащие принимают по указанию командира (начальника) до возможного контакта с токсикантом (перед входом в зону, зараженную ФОС, при необходимости контакта с военнослужащими, выходящим из зоны химического заражения и т.д.). Профилактические антидоты представляют собой сбалансированный комплекс обратимых ингибиторов холинэстеразы и холинолитиков. Иногда в состав антидота включают реактиватор холинэстеразы или противосудорожное средство. В качестве средств профилактики в разные годы на снабжение армии принимали препараты: П-3 (галантамин, атропин и другие холинолитики, изонитрозин), П-6 (аминостигмин, фторацизин, феназепам), П-10М. Препараты отличаются антидотной мощностью, продолжительностью защитного действия, способностью потенцировать действие антидотов само-взаимопомощи.
Антидоты само-взаимопомощи. Представляют собой средства, изготовленные в форме шприца-тюбика, объемом 1,0 мл, которые военнослужащие вводят себе самостоятельно при появлении первых признаков отравления ФОС. Это рецептуры, состоящие из холинолитиков с различным сродством к М- и Н-холинорецепторам центральной нервной системы и периферии и, в некоторых случаях, реактиваторов ХЭ. В различное время на снабжение армии принимались такие средства как афин, сафолен, будакисм, АЛ-85 (пеликсим) и др. Препараты различаются по антидотной мощности и переносимости военнослужащими.
Карбаматы
Производные карбаминовой кислоты - карбаматы (рис. 51, 52) давно известны человечеству. Первый представитель этого класса химических соединений, физостигмин (эзерин, калабарин), был выделен в 1864 году Джобстом и Хессом из растения, произрастающего на западе Африки, Physostigma venenosum (калабарские бобы) и идентифицирован, как алкалоид - производное карбаминовой кислоты, в 1926 году Стедманом и Баргером. В настоящее время известны сотни химических веществ этого класса, как растительного, так и, главным образом, синтетического происхождения.
Рисунок 51. Структурная формула карбаматов
Аварии при производстве карбаматов, их хранении и транспортировке опасны в плане формирования очагов поражения людей. Не исключено использование средств для совершения террористических актов.
Токсичность. Физико-химические свойства
Токсичность соединений определяется строением радикала (R1) при кислородном атоме карбамильной группы кислоты (рис. 52). Большинство высокотоксичных карбаматов содержат в молекуле заряженный атом азота. R2 - у современных синтетических карбаматов представлен метильной группой.
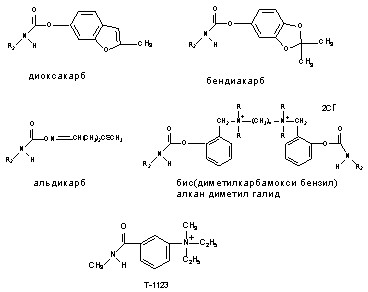
Рисунок 52. Структура некоторых производных карбаминовой кислоты (карбаматов)
Некоторые представители группы обладают достаточно высокой токсичностью (ЛД50 физостигмина для мышей при подкожном введении - 0,75 мг/кг; альдикарба - 1 мг/кг), но в силу избирательности действия они широко используются в качестве лекарственных препаратов (физостигмин, галантамин, пиридостигмин, неостигмин и т.д.), а также средств борьбы с грызунами (альдикарб). Многие синтетические аналоги, обладающие меньшей токсичностью для млекопитающих, но высокотоксичные для насекомых, применяются как инсектициды (ЛД50 для мышей: изопрокарб - 400 - 485 мг/кг; пропоксур - 90 - 124 мг/кг; диоксакарб - 60 - 80 мг/кг; бендиакарб - 60 мг/кг). В настоящее время известны и чрезвычайно токсичные для млекопитающих синтетические производные карбаминовой кислоты (Т-1123; бис-(диметилкарбамоксибензил)-алкан диметил галид: ЛД50 - 0,005 мг/кг), которые рассматривались как возможные образцы химического оружия (Бадави, Хассан, 1995; Байгар, 1998).
Производные карбаминовой кислоты - твердые кристаллические соединения, способные образовывать в воздухе мелкодисперсную пыль. Они хорошо растворяются в воде, хуже в липидах. В химическом отношении инертны. Не летучи. Устойчивы к гидролизу. Образуют зоны стойкого химического заражения. Прибывающие из зоны заражения пораженные могут представлять опасность для окружающих.
Токсикокинетика
Вещества способны проникать в организм через желудочно-кишечный тракт с зараженной водой и пищей. Высокотоксичные соединения могу вызывать интоксикацию, действуя в форме аэрозоля через слизистую глаз и органы дыхания. При ингаляционном поступлении токсичность веществ в 10 - 50 раз выше, чем при приеме через рот. Через неповрежденную кожу карбаматы в организм проникают плохо.
Незаряженные молекулы легко проникают через гематоэнцефалический барьер и оказывают непосредственное действие на холинэргические синапсы мозга. Соединения, содержащие в молекуле четвертичный атом азота (заряженные), действуют в основном на ПНС (вегетативный и двигательный отделы). Элиминация токсикантов в основном осуществляется путем энзиматического гидролиза эфирной связи, а также выведения через почки неизмененной молекулы вещества. Действующие концентрации карбаматов в крови могут быть определены, как правило, в течение не более 3 - 5 часов.
Основные проявления интоксикации
Проявления токсического процесса при остром отравлении карбаматами, закономерности и механизмы его развития, чрезвычайно напоминает поражение ФОС. Основная особенность действия токсикантов (в сравнении с ФОС) - меньшая продолжительность развивающихся нарушений. Так, при внесении физостигмина в конъюнктивальный мешок глаза, спазм аккомодации регистрируется в течение не более 2 часов.
При приеме веществ через рот наблюдается усиление перистальтики кишечника, схваткообразные боли в области живота, тошнота, рвота, понос. При ингаляционном поражении первые симптомы - чувство стеснения в груди, затруднение дыхания, обусловленное бронхоспазмом и гиперсекрецией бронхиальных желез. При резорбции высоких доз токсикантов симптоматика усиливается. Проникающие через ГЭБ вещества, вызывают психоэмоциональные нарушения, сначала возбуждают, а затем угнетают дыхательный и сосудодвигательный центры: подъем артериального давления, сменяется его падением, возможна остановка дыхания. Эффекты обусловлены не только способностью веществ активировать холинэргические механизмы мозга, но и действовать на рефлексогенную зону синокаротидного клубочка. Как и при отравлении ФОС наблюдаются фасцикулляции мышечных групп. Проявлением тяжелого поражения карбаматами является судорожный синдром. Если в течение нескольких часов не развивается летальный исход, состояние пострадавшего относительно быстро улучшается.
Механизм токсического действия
Карбаматы являются конкурентными, обратимыми ингибиторами холинэстеразы (см. раздел “Фосфорорганические соединения”). Отравление ими приводит к накоплению в холинэргических синапсах ацетилхолина, который и вызывает перевозбуждение М- и Н-холинореактивных структур в ЦНС и на периферии. Помимо антихолинэстеразного, эти вещества обладают прямым холиномиметическим действием на холинорецеторы синапсов. Так, внутриартериальное введение физостигмина экспериментальному животному, вызывает сокращение денервированных (путем перерезки нервных стволов) мышечных групп, т.е. возбуждает Н-холинорецепторы поперечно-полосатой мускулатуры в условиях отсутствия выброса АХ из пресинаптических нервных окончаний.
Процесс восстановления нормального проведения нервного импульса в холинергических синапсах осуществляется, в основном, за счет быстрого, в течение нескольких часов, декарбамилирования АХЭ (спонтанной реактивации) и удаления вещества из синапсов.
Мероприятия медицинской защиты
Специальные санитарно-гигиенические мероприятия:
- использование индивидуальных технических средств защиты (средства защиты органов дыхания) в зоне химического заражения;
- участие медицинской службы в проведении химической разведки в районе расположения войск; проведение экспертизы воды и продовольствия на зараженность ОВТВ;
- запрет на использование воды и продовольствия из непроверенных источников;
- обучение личного состава правилам поведения на зараженной местности.
Специальные профилактические медицинские мероприятия:
- проведение частичной санитарной обработки (использование ИПП) в зоне химического заражения;
- проведение санитарной обработки пораженных на передовых этапах медицинской эвакуации.
Специальные лечебные мероприятия:
- применение антидотов и средств патогенетической и симптоматической терапии состояний, угрожающих жизни, здоровью, дееспособности, в ходе оказания первой (само-взаимопомощь), доврачебной и первой врачебной (элементы) помощи пострадавшим.
- подготовка и проведение эвакуации
Средства медицинской защиты
В качестве медицинских средств защиты при поражении карбаматами могут быть использованы средства защиты от ФОВ (см. выше). При этом необходимо учитывать, что холинолитики и рецептуры на их основе оказываются более эффективными при отравлении карбаматами (оказывают положительный эффект в меньших дозах, чем это требуется для оказания помощи пораженным ФОС); реактиваторы ХЭ - менее эффективными (увеличение доз вводимых препаратов с целью повышения эффективности ни при каких условиях не допустимо). Противопоказано для целей профилактики применять препараты П-6, П-10М, содержащие в рецептуре высоко активные обратимые ингибиторы ХЭ.
12.1.1.1.2. Конвульсанты, действующие на ГАМК-реактивные синапсы
ГАМК - нейромедиатор в тормозных межнейрональных синапсах ЦНС животных и человека (рис. 53).
Рисунок 53. Структура γ-аминомасляной кислоты (ГАМК)
Действуя на соответствующие рецепторы, ГАМК формирует ингибиторный постсинаптический потенциал (ИПСП). Установлено, что в основе эффекта лежит усиление нейромедиатором проницаемости возбудимых мембран для ионов хлора, которые под влиянием концентрационного градиента устремляются из внеклеточной среды в клетку и вызывают тем самым гиперполяризацию мембраны.
ГАМК обнаружена во всех структурах ЦНС. Концентрация аминокислоты в разных областях мозга колеблется в пределах от 2 до 10 мкМ/г ткани. Наивысшее её содержание - в чёрной субстанции. Высокая плотность ГАМК-эргических синапсов, выявлена в коре головного мозга, клиновидном ядре, ядре Дейтерса, ядрах передних рогов спинного мозга, в обонятельных бугорках, коре мозжечка, гиппокампе, продолговатом мозге (нейронах ретикулярной формации), латеральных коленчатых телах, гипоталамусе. Нейроны этих образований высоко чувствительны к ГАМК.
В нервных окончаниях ГАМК обнаруживается главным образом в цитоплазме в несвязанной форме (60 - 80%); относительно небольшое количество вещества заключено в пресинаптических везикулах.
В нервной ткани ГАМК образуется путем декарбоксилирования глютамата под влиянием энзима глютаматдекарбоксилазы (ДГК) (рис. 54). Источником веществ-предшественников глютамата является цикл Кребса. ДГК - цитоплазматический энзим, широко представленный в структурах мозга, содержащих ГАМК в высокой концентрации. Катаболизм нейромедиатора осуществляется митохондриальным энзимом ГАМК-трансаминазой (ГМАК-Т), превращающей вещество в сукцинатсемиальдегид (ССАД). Этот метаболит, в свою очередь, окисляется другим митохондриальным энзимом, дегидрогеназой сукцинатсемиальдегида, до янтарной кислоты; последняя утилизируется циклом Кребса. Поскольку и ДГК и ГАМК-Т являются пиридоксальфосфат-зависимыми энзимами, вещества, нарушающие обмен этого кофактора вызывают при интоксикациях тяжелые нарушения функций ЦНС, вплоть до развития судорожного синдрома.
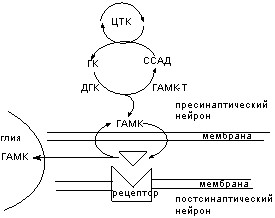
Рисунок 54. Схема обмена ГАМК в ЦНС
ЦТК - цикл трикарбоновых кислот; ГК - глутаминовая кислота; ДГК - декарбоксилаза глутаминовой кислоты; ГМАК-Т - ГАМК-трансаминаза; ССАД - сукцинатсемиальдегид
Большая часть выделившейся в синаптическую щель ГАМК удаляется путем высокоафинного, Na+-зависимого активного захвата, как нервными окончаниями, так и клетками глии. До 50% ГАМК мозга определяется в глиальных элементах. Пул ГАМК, содержащейся в глиальных клетках, также имеет функциональное значение: выход нейромедиатора из глии в межклеточное пространство инициируется повышением в межнейрональной жидкости ионов калия (что наблюдается при гиперактивации нейронов).
Конвульсанты, действующие на ГАМК-эргический синапс, либо блокируют синтез ГАМК (производные гидразина и др.) и ее высвобождение (тетанотоксин) в синаптическую щель, либо являются физиологическими антагонистами нейромедиатора, взаимодействующими с ГАМК-рецепторами (ГАМК-литики).
Структура и физиология ГАМК-рецепторов окончательно не изучены. Не существует и их единой классификации. Наиболее распространено разделение рецепторов на ГАМКА и ГАМКБ типы. Рецепторы первого типа чувствительны к ГАМК-литику бикукуллину, второго типа - не чувствительны к этому веществу, но избирательно возбуждаются баклофеном. ГАМКА-рецепторы непосредственно сопряжены с хлор-ионными каналами возбудимых мембран. ГАМКБ-рецепторы сопряжены с калиевыми и кальциевыми каналами мембран через систему G-протеинов. Наиболее изучены ГАМКА рецепторы, действию на которые и приписывают основные тормозные эффекты нейромедиатора. С ГАМКА-рецепторами способно взаимодействовать большое количество химических веществ, как облегчающих, так и блокирующих поступление ионов хлора через возбудимую мембрану (рис. 55). Эти вещества являются соответственно агонистами (мусцимол, диазепам, гексобарбитал и т.д.) или антагонистами ГАМК (бикукуллин, флюмазенил, пикротоксин и т.д.).
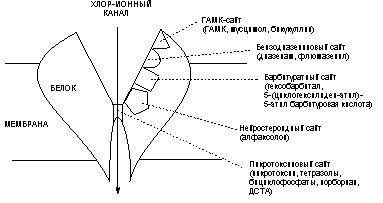
Рисунок 55. Схема строения ГАМК-рецептора, с указанием сайтов связывания ГАМК-ергических биологически активных веществ
12.1.1.1.2.1. Ингибиторы синтеза ГАМК
К числу веществ, угнетающих синтез ГАМК, принадлежат, прежде всего, ингибиторы декарбоксилазы глутаминовой кислоты (ДГК), в частности, антагонисты пиридоксальфосфата (коэнзим ДГК). По большей части это производные гидразина. Структура некоторых из них представлена на рисунке 56.
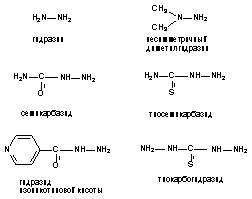
Рисунок 56. Структура некоторых веществ - антагонистов пиридоксальфосфата
Наиболее токсичным веществом, из представленных на рисунке, является тиокарбогидразид, наименее токсичным - гидразид изоникотиновой кислоты (изониазид).
Для военной токсикологии особый интерес представляют гидразин и его алкильные производные (диметилгидразин), являющиеся компонентами ракетных топлив. Вещества могут вызывать формирование зон стойкого химического заражения и очаги химического поражения людей при аварийных ситуациях на объектах по производству и хранению токсикантов, при их транспортировке.
Гидразин
Гидразин применяется в производстве лекарств, пластмасс, резин, инсектицидов, взрывчатых веществ, в качестве консерванта и как компонент ракетного топлива.
Физико-химические свойства. Токсичность
Гидразин – бесцветная маслянистая жидкость с запахом аммиака. Летуч. Плотность пара в 1,1 раза выше плотности воздуха. Вещество хорошо растворяется в воде. Водные растворы обладают свойствами оснований. Разлагается при нагревании. Гидразин и его производные (монометилгидразин и диметилгидразин) – легковоспламеняющиеся вещества; горят с образованием высокотоксичных летучих нитросоединений.
Летальная доза гидразина для грызунов при введении в желудок составляет около 60 мг/кг, диметилгидразина - 33 мг/кг. При ингаляции паров в течение 4 часов, смертельной является концентрация гидразина 0,32 г/м3, диметилгидразина - 0,11 г/м3 (в 200 - 500 раз менее токсичны, чем зарин).
Токсикокинетика
В организм гидразин и его алкильные производные в виде пара и аэрозоля проникает ингаляционно и через кожу, в виде жидкости – через кожные покровы и при приеме внутрь. Проникновению веществ через кожу способствует повреждающее действие токсикантов на покровные ткани. С кровью распределяются в органах и тканях, легко проникают через ГЭБ. Элиминация гидразина из организма частично осуществляется за счет выделения с мочой в неизмененном виде, частично за счет метаболизма. Основной путь метаболических превращений – конъюгация с эндогенным уридином, фосфатом, ацетатом при участии соответствующих трансфераз (реакции конъюгации) и биологическое окисление, активируемое микросомальными цитохром-Р450-зависимыми оксидазами смешанной функции, до азота, диимида и диазена. Пораженные, подвергшиеся санитарной обработке, не представляют опасности для окружающих.
Основные проявления интоксикации
Пары гидразина вызывают сильное раздражение слизистых оболочек глаз, дыхательных путей. При тяжелых поражения возможно развитие токсического отека легких, токсической пневмонии. Жидкий гидразин (в эпицентре аварии) при попадании на кожу или глаза вызывает химический ожог ткани и сопутствующие этому общие реакции организма. Местное действие на покровные ткани диметилгидразина выражено значительно слабее.
При резорбции гидразина к проявлениям местного действия токсикантов присоединяются признаки поражения ЦНС, крови, печени и почек. Симптоматика отравления развивается спустя 30-90 мин от начала воздействия.
При легкой интоксикации (наиболее вероятная форма поражения в зоне химического заражения) появляются беспокойство, возбуждение, чувство страха, бессонница. Нарушение работоспособности в течение суток и более.
При поступлении в организм в дозах, близких к смертельным, вещества вызывают тошноту, рвоту, нарушение сознания, клонико-тонические судороги, приступы которых чередуются с периодами ремиссии. У пострадавших развивается коматозное состояние на фоне нарушений функций сердечно-сосудистой системы (брадикардия, коллапс). По выходе из комы наблюдается психоз с бредом, слуховыми и зрительными галлюцинациями. Состояние психоза может продолжаться в течение нескольких дней.
Характерным проявлением интоксикации являются метгемоглобинемия, гемолиз (метгемоглобинообразование более характерно для арильных производных гидразина, например фенилгидразина). Максимум снижения содержания эритроцитов в крови отмечается к 10-м суткам.
Достаточно часто встречающимся проявлением острой интоксикации гидразином является отсроченное во времени поражение печени и почек в форме острого токсического гепатита и токсической нефропатии. В эксперименте у животных, отравленных гидразином в высоких дозах, отмечаются жировое перерождение печени, некроз эпителия проксимального отдела извитых канальцев почек. Изменения со стороны внутренних органов развиваются через 48 и более часов после поступления яда в организм.
Механизм токсического действия
Основными механизмами, лежащими в основе токсического действия гидразина и его производных на ЦНС, являются:
1) снижение содержания пиридоксальфосфата в тканях мозга;
2) инактивация ферментов, кофактором которых является пиридоксальфосфат и, в частности, энзимов, участвующих в метаболизме ГАМК;
3) снижение содержания ГАМК и, как следствие этого, подавление тормозных процессов в ЦНС;
4) снижение активности моноаминоксидазы (МАО) и повышение содержания биогенных аминов (норадреналин, дофамина, серотонина) в ЦНС.
При отравлении гидразином и его производными запасы пиридоксальфосфата в тканях резко снижаются. В основе эффекта лежит способность токсиканта вступать в химическую связь с альдегидными группами пиридоксаля:
В результате этой реакции, во-первых, снижается содержание пиридоксаля, во-вторых, образуется пиридоксальгидразон – вещество, являющееся конкурентным обратимым ингибитором фермента пиридоксалькиназы (как in vitro, так и in vivo). Функция пиридоксалькиназы - активация реакции фосфорилирования пиридоксаля, в ходе которой образуется пиридоксальфосфат - кофактор многих энзимов, участвующих в метаболизме веществ. Угнетение приридоксалькиназы пиридоксальгидразоном быстро приводит к истощению запасов приридоксальфосфата и, следовательно, к снижению активности ферментов, кофактором которых он является.
При отравлении гидразинами из строя выходит около 20 энзимов, среди них трансаминазы, декарбоксилазы аминокислот, аминоксидазы и др. Особенно сильно снижается активность декарбоксилазы глутаминовой кислоты (ДГК) - основного энзима синтеза ГАМК в мозге. Как указывалось ранее ДГК – пиридоксальфосфат-зависимый энзим. Судорожный синдром при введении гидразина развивается на фоне снижения активности энзима до уровня 40% от нормы. В результате нарушается синтез ГАМК. Гамма-аминомасляная кислота не проникает через гемато-энцефалический барьер. Ее синтез осуществляется непосредственно в ГАМК-ергических нейронах. Глиальные элементы также не синтезируют нейромедиатор.
Одновременно подавляется активность и ГАМК-Т (также пиридоксальфосфоат-зависимый энзим) и, следовательно, блокируются не только процессы синтеза, но и распада ГАМК. Блок синтеза нейромедиатора в нейронах с одновременным замедлением его распада приводит к перераспределению ГАМК: в нервных клетках (где осуществляется синтез нейромедиатора) содержание вещества снижается, в глиальных – несколько возрастает. По этой причине не всегда удается проследить четкую корреляцию между тяжестью интоксикации и степенью снижения ГАМК в ткани мозга. Тем не менее при тяжелых отравлениях экспериментальных животных, сопровождающихся развитием судорог, уровень ГАМК составляет 50 - 70% от нормы.
Таким образом, от момента начала действия гидразина до развития эффектов, являющихся непосредственной причиной судорожного синдрома, разыгрывается целая цепь патохимических процессов. С этим связано наличие скрытого периода, наблюдающегося даже при крайне тяжелых формах отравления гидразином.
Гидразин и его производные являются необратимыми ингибиторами моноаминоксидазы (МАО) – фермента, участвующего в разрушении нейромедиаторных веществ мозга: дофамина, норадреналина, серотонина. На основе гидразина созданы лекарственные препараты - ингибиторы МАО (фенелзин и др.). При отравлении веществом через 5-6 ч после начала интоксикации количество катехол- и индоламинов в ЦНС существенно увеличивается, что может явиться дополнительной причиной явлений, наблюдающихся как при легких интоксикациях (состояние возбуждения, бессонница), так и по выходе пострадавшего из коматозного состояния (зрительные, слуховые галлюцинации, бред и т.д.).
Гемолитическое действие гидразина и его производных, по-видимому, связано с их метгемоглобинообразующей активностью. Образование метгемоглобона приводит к снижению содержания в эритроцитах глутатиона, необходимого для стабилизации биологических мембран. Поэтому эритроциты, содержащие метгемоглобин, менее устойчивы и легко разрушаются в селезенке.
Механизмы поражения печени и почек окончательно не установлены. Возможно, в основе цитотоксического действия гидразина и его производных лежит все то же нарушение активности пиридоксальзависимых ферментов. Кроме того, в эксперименте установлено снижение митохондриальной активности в тканях печени и почек, активация свободнорадикальных процессов и перекисного окисления липидов, повреждение системы антирадикальной защиты, и в частности, глутатиона.
Мероприятия медицинской защиты
Специальные санитарно-гигиенические мероприятия:
- использование индивидуальных технических средств защиты (средства защиты кожи и органов дыхания) в зоне химического заражения;
- участие медицинской службы в проведении химической разведки в районе расположения войск; проведение экспертизы воды и продовольствия на зараженность ОВТВ;
- запрет на использование воды и продовольствия из непроверенных источников;
- обучение личного состава правилам поведения на зараженной местности.
Специальные профилактические медицинские мероприятия:
- проведение санитарной обработки пораженных на передовых этапах медицинской эвакуации.
Специальные лечебные мероприятия:
- применение антидотов и средств патогенетической и симптоматической терапии состояний, угрожающих жизни, здоровью, дееспособности, в ходе оказания первой (само-взаимопомощь), доврачебной и первой врачебной (элементы) помощи пострадавшим.
- подготовка и проведение эвакуации
Средства медицинской защиты
При попадании гидразина на поверхность кожи, в глаза первая помощь оказывается в соответствии с общими принципами оказания помощи отравленным. В отношении легко отравленных осуществляются мероприятия, проводимые при оказании помощи пораженным и другими веществами раздражающего действия (см. раздел “ОВТВ раздражающего действия”). При тяжелых поражениях кожи и глаз мероприятия аналогичны, проводимым при отравлении ипритом (см. раздел “ОВТВ цитотоксического действия”). При ингаляционном поражении мероприятия должны быть направлены на профилактику, а в случае необходимости – на раннее лечение токсического отека легких (см. раздел “ОВТВ удушающего действия”).
В процессе целенаправленного поиска антидотов резорбтивного действия гидразина испытаны вещества, обладающие химическим, биохимическим и физиологическим антагонизмом к токсиканту.
В качестве химических антагонистов изучены вещества, содержащие в молекуле альдегидную группу. Как указывалось, гидразин, взаимодействуя с альдегидами, образует гидразоны. По большей части это вещества менее токсичные, чем исходный яд. В частности показано, что in vitro токсикант активно связывается α-кетоглутаровой кислотой. Это же вещество в эксперименте оказывает положительное действие при профилактическом введении лабораторным животным. Применение α-кетоглутаровой кислоты с лечебной целью не дает желательного результата, так как вещество не способно вытеснять гидразин из связи с пиридоксалем. Препарат не используется в практике медицинской защиты, так как не отвечает требованиям, предъявляемым к профилактическим антидотам.
Биохимическим антагонистом гидразина является пиридоксин. Введение вещества отравленным сопровождается увеличением его содержания в тканях, вытеснением пиридоксальгидразонов из связи с активным центром пиридоксалькиназы и восстановлением ее активности. В итоге происходит нормализация процесса синтеза пиридоксальфосфата. За счет этого восстанавливается активность пиридоксальфосфатзависимых энзимов. Людям, отравленным гидразинами, пиридоксин (витамин В6) с лечебной целью вводят в форме 5% раствора в дозе 25 мг/кг (1/4 дозы в/в, 3/4 - в/м); при необходимости инъекцию повторяют через каждые 2 ч.
Поиск антидотов, обладающих физиологическим антагонизмом по отношению к гидразину, проводили среди веществ, повышающих тонус ГАМК-эргической медиаторной системы мозга и нейролептиков (блокируют α-адренорецепторы, дофаминэргические и серотонинэргические рецепторы мозга).
Эффективными оказались препараты из группы производных бензодиазепина. Эти вещества потенцируют действия ГАМК в ГАМК-эргических синапсах центральной нервной системы. Диазепам (седуксен) в дозе 5-10 мг/кг в 100% случаев предотвращает острую гибель экспериментальных животных, отравленных гидразином в смертельной дозе.
Производные барбитуровой кислоты (фенобарбитал) и оксазолидиндионы (триметадион) также подавляют судороги, вызываемые производными гидразина, как у человека, так и у лабораторных животных.
Дибензодиазепины (клозапин) снижают выраженность психотических реакций, развивающихся при легкой и средней степени тяжести отравления гидразином. Вещества малотоксичны, обладают слабым седативным и гипотензивным действием. Клозапин назначают в дозе 25 - 100 мг (таблетки).
Из указанных препаратов достаточной эффективностью, переносимостью и удобством применения в полевых условиях отличаются диазепам и клозапин, которые и могут быть рекомендованы как средства медицинской защиты: клозапин - при возбуждении, чувстве страха; диазепам - при появлении судорог.
12.1.1.1.2.2. Пресинаптические блокаторы высвобождения ГАМК
Тетанотоксин
Тетанотоксин - физиологически активное вещество (ФАВ), исследовавшееся за рубежом в военных целях (З. Франке, 1973, В.К. Курочкин и соавт., 1994). Является экзотоксином микроорганизма, вызывающего инфекционное заболевание “столбняк”.
Боевое применение тетанотоксина маловероятно. Это вещество может рассматриваться лишь в качестве возможного диверсионного агента.
Физико-химические свойства. Токсичность
Тетанотоксин продуцируется анаэробными спорообразующими бактериями Clostridium tetani. Это белок, состоящий из двух субъединиц с молекулярной массой 100000 и 50000 дальтон. Растворим в воде. Неустойчив при нагревании. Летальная доза для грызунов при подкожном введении - около 2⋅10-6 мг/кг массы животного. Для людей смертельная одноразовая доза токсина составляет менее 0,2 - 0,3 мг.
Пораженные не представляют опасности для окружающих.
Токсикокинетика
В желудочно-кишечном тракте быстро разрушается, и потому при поступлении per os не действует. Через неповрежденную кожу в организм не проникает. При внутримышечном введении лабораторным животным быстро попадает в кровь, где также достаточно быстро разрушается при участии протеаз до неактивных пептидов, а затем и аминокислот. Время нахождения в крови токсина не установлено. Будучи белком, вещество не проникает через ГЭБ. Полагают, что в двигательные ядра ЦНС поступает с помощью механизма ретроградного аксонального тока по волокнам нервных стволов, с окончаниями которых специфично связывается. Имеются доказательства способности токсина к транссинаптической миграции, т.е. переходу от одного нейрона к другому, диффундируя через синаптическую щель.
Основные проявления интоксикации
После воздействия скрытый период может продолжаться от нескольких часов до 3 и более суток. Вслед за общими проявлениями недомогания (головная и мышечная боль, лихорадка, повышение потливости, слабость, сонливость), развивается возбуждение, чувство страха, тризм жевательной мускулатуры, а затем приступы клонико-тонических судорог. Захватываются мышцы спины, конечностей, возникает опистотонус. Приступы судорог провоцируются внешним звуковым и тактильным раздражением. Выраженность судорожных приступов столь велика, что порой приводит к разрывам мышц, компрессионному перелому позвоночника. Сознание, как правило, сохранено. Поэтому субъективно интоксикации переносится крайне тяжело. Стойкое сокращение дыхательных мышц, диафрагмы и мышц гортани может привести пострадавшего к смерти от асфиксии.
Механизм токсического действия
Механизм действия вещества изучен недостаточно. Установлено, что тетанотоксин блокирует выброс тормозных нейромедиаторов ГАМК и глицина нервными окончаниями соответствующих нейронов ЦНС. В ряде исследований показано наличие в окончаниях волокон нервных клеток специфических сайтов связывания токсина. Эти структуры представляют собой ганглиозиды или углеводные комплексы, близкие по строению ганглиозидам. Сиаловая кислота, как полагают, - важнейший компонент этих сайтов. Тетанотксин не связывается с ненейрональными клеточными мембранами и в этом одна из причин его высокой токсичности. Как установлено, структурно рецептор тетанотоксина напоминает рецептор белкового гормона тириотропина. In vitro токсин способен связываться с препаратом мембран, приготовленных из ткани щитовидной железы, при этом тиреотропин блокирует это связывание. Вместе с тем in vivo гормон потенцирует связывание токсина мембранами нервных клеток, усиливая его токсичность. Связавшийся с пресинаптическими структурами токсин проникает внутрь нервного окончания путем пиноцитоза и, разрушаясь здесь, выделяет полипептид, угнетающий механизм спонтанного и вызываемого нервными импульсами экзоцитоза нейромедиаторов (ГАМК, глицина). Поскольку последние не оказывают тормозного воздействия на нейроны мозга, развивается возбуждение ЦНС и судорожный приступ.
Мероприятия медицинской защиты
Специальные профилактические медицинские мероприятия:
- организация профилактических прививок.
Специальные лечебные мероприятия:
- своевременное выявление пораженных;
- применение средств патогенетической и симптоматической терапии состояний, угрожающих жизни, здоровью, дееспособности, в ходе оказания первой (само-взаимопомощь), доврачебной и первой врачебной (элементы) помощи пострадавшим;
- подготовка и проведение эвакуации.
Средства медицинской защиты
С целью профилактики поражения тетанотоксином возможна плановая иммунизация военнослужащих столбнячным анатоксином.
Поскольку интоксикация развивается постепенно, в случае возникновения поражения важнейшая задача медицинской службы состоит в скорейшем выявлении пострадавших.
На догоспитальном этапе при выявлении пораженных перед их эвакуацией, с целью профилактики судорожного синдрома, необходимо ввести нейроплегическую смесь: 2,5% раствор аминазина - 2,0; 2% раствор пантопона - 1,0; 2% раствора димедрола - 2,0; 0,05% раствора скополамина - 0,5. Через 30 минут внутримышечно - 5-10 мл 10% раствора гексенала. Бензодиазепины - малоэффективны при поражении тетанотоксином.
Специфическим противоядием токсина является противостолбнячная сыворотка, содержащая антитела к веществу, а также противостолбнячный гамма-глобулин. Так как введение этих препаратов на догоспитальном этапе не возможно, они не используются в качестве средств медицинской защиты.
В специализированных центрах пострадавших переводят на искусственную вентиляцию легких после предварительной тотальной миорелаксации, и внутримышечно вводят сыворотку по 100000 - 150000 МЕ.
12.1.1.1.2.3. Антагонисты ГАМК
Антагонисты γ-аминомасляной кислоты (ГАМК-литики), взаимодействуя с различными сайтами связывания на ГАМКА-рецепторах, либо экранируют их, либо изменяют чувствительность к нейромедиатору. Это приводит к деполяризации возбудимых мембран и повышению чувствительности многочисленных популяций нервных клеток к возбуждающим воздействиям. Развивается активация, а затем и гиперактивация структур мозга, сопровождающаяся глубоким нарушением функций ЦНС, а в случаях тяжелого поражения судорогами и смертью.
К числу ГАМК-литиков относятся вещества самого разного строения. Здесь и алкалоиды растительного происхождения (бикукуллин) и безазотистые растительные вещества (пикротоксин), а также многочисленные синтетические соединения: дисульфотетразоадамантан (ДСТА), норборнан, силатраны, бициклофосфаты и т.д. (рис. 57)
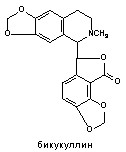
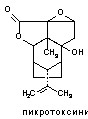
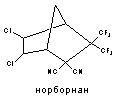
Рисунок 57. Структура некоторых высокотоксичных ГАМК-литиков
В практике здравоохранения и хозяйственной деятельности эти вещества не используются. В силу высокой токсичности и избирательности действия их применяют в лабораторных исследованиях при изучении физиологии и биохимии ЦНС. С военными целями изучались бициклические фосфорорганические соединения и их аналоги (В.К. Курочкин и соавт., 1994; Байгар, 1998).
Бициклические фосфорорганические соединения (БЦФ) и их аналоги
В 1973 году Bellet и Casida описали группу бициклических фосфорорганических соединений, не обладающих антихолинэстеразной активностью, но вызывающих приступ судорог и гибель экспериментальных животных при введении в малых дозах. Структура БЦФ представлена на рисунке 58. Биологически активные вещества такого строения относятся к бициклофосфатам, бициклофосфоротионатам и бициклофосфитам.
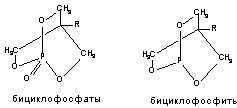
Рисунок 58. Структура молекул бициклических фосфорорганических соединений
Токсичность БЦФ существенно зависит от строения радикала R и может быть очень высокой для отдельных соединений. Так, ЛД50 третбутилбициклофосфата для грызунов составляет около 0,05 мг/кг массы (близка токсичности зарина).
Близкие по структуре соединения бициклоортокарбоксилаты (БЦК) (рис. 59) также способны инициировать токсический процесс.
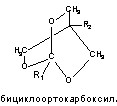
Рисунок 59. Структура молекул триоксибициклокарбоксилатов
Токсичность БЦК зависит от строения радикалов R1 и R2 и для некоторых представителей, при внутрибрюшинном способе введения, ЛД50 составляет около 1 мг/кг массы экспериментального животного (4-третбутил-1(3,4-дихлофенил)-бициклоортобензоат).
Все БЦФ и БЦК твердые вещества, плохо растворимые в воде. Не проникают в организм через неповрежденную кожу. Могут оказывать токсическое действие при подкожном, внутримышечном, внутривенном, а некоторые представители, и при ингаляционном способе введения (в форме аэрозоля). Хорошо всасываются в желудочно-кишечном тракте.
Основные проявления интоксикации
Признаки отравления БЦФ и БЦК изучались на лабораторных животных. Поскольку проявления интоксикации различными ГАМК-литиками достаточно близки, для характеристики поражения можно использовать также результаты немногочисленных клинических наблюдений людей, отравленных аналогами рассматриваемых веществ, в частности пикротоксином и др.
БЦФ не обладают выраженным местным действием. Эффекты развиваются после резорбции веществ в кровь и поступлении их в ЦНС. Скрытый период редко превышает 30 минут. На центральную нервную систему ГАМК-литики действуют возбуждающим образом. Первыми признаками отравления является повышение рефлекторной деятельности. Усиливается дыхание, возникает тошнота, возможна рвота. Появляется беспокойство, чувство страха, возбуждение иногда с галлюцинациями. Отмечается напряженность различных групп мышц, дрожание конечностей. Температура тела повышается. Такое состояние может продолжаться в течение нескольких часов и более, и сопряжено с полной утратой дееспособности.
Если доза вещества близка смертельной, спустя несколько минут от начала интоксикации формируется состояние повышенной судорожной готовности - внешние раздражители (прикосновение, звук и т.д.) провоцируют ризус. Пострадавший падает на бок. Развиваются тонические судороги, опистотонус. На фоне судорог дыхание останавливается. Лицо становится цианотичным. Зрачки расширены (реже сужены). Возможно непроизвольное мочеиспускание и дефекация. В таком положении пострадавший находится 1 - 2 минуты, затем приступ прекращается, мускулатура расслабляется. Восстанавливается дыхание. В межсудорожном периоде выявляется некоторый подъем артериального давления, брадикардия. Через непродолжительное время приступ повторяется. При первых судорожных припадках сознание сохранено, затем, после нескольких судорожных приступов, наблюдается переход в ступорозное состояние и потеря сознания. Через 5 - 10 припадков наступает смерть от асфиксии, нарушения сердечной деятельности, резкого падения артериального давления.
Среди ГАМК-литиков особенностью токсического действия обладает 2,2-ди(трифторметил)-3,3-дициано-5,6-дихлорнорборнан (норборнан) - один из самых токсичных синтетических конвульсантов.
Норборнан - кристаллическое вещество, практически нерастворимое в воде, оказывает эффект при всех способах введения. Видовая чувствительность к нему выражена слабо. Среднелетальная доза - 0,07 - 0,2 мг/кг. Вещество синтезировано в начале 80-х годов Мидлтоном (США).
Интоксикация веществом характеризуется растянутой во времени клиникой. Так, при подкожном введении экспериментальным животным смертельной дозы норборнана, скрытый период составляет около 1,5 часов, судорожный - до 4 часов, продолжительность жизни отравленных смертельными дозами животных - более 6 часов (для сравнения, аналогичные токсикодинамические характеристики пикротоксина составляют, соответственно: 0,5 часа; 0,5 часа и 1 час). При несмертельных интоксикациях повышенная судорожная готовность у экспериментальных животных сохраняется несколько суток.
Механизм токсического действия
Поскольку ГАМК-реактивные структуры выявлены только в ЦНС, все эффекты, наблюдаемые при отравлении ГАМК-литиками, имеют центральное происхождение. Считается, что БЦФ и БЦК - неконкурентные антагонисты ГАМК. Они не взаимодействуют с сайтом связывания ГАМК на ГАМКА-рецепторе, а непосредственно действуют на хлорионофорный канал (на эту же структуру действуют некоторые другие ГАМК-литики: пикротоксин, ДСТА, норборнан). В результате такого действия конформация ионофорного протеина изменяется - стабилизируется его “запертое” состояние. В итоге активация ГАМК-рецептора гамма-аминомасляной кислотой в физиологических концентрациях оказывается недостаточной для “открытия” канала и усиления трансмембранного тока ионов хлора. Неспособность ионов хлора проникать через возбудимые мембраны нейронов ЦНС приводит к снижению их потенциала покоя (деполяризации) и, следовательно, существенному понижению порога чувствительность к возбуждающим воздействиям. Существуют два методических приема, позволяющих количественно оценить способность различных ГМАК-литиков действовать на хлорионофорные каналы. Первый - основан на способности исследуемого вещества связываться с хлорионофорным протеином (изучается методами радиолигандных исследований). Второй метод предполагает определение in vitro способности вещества угнетать захват радиоактивного хлора суспензией, приготовленной из нейрональных мембран, выделенных методом ультрацентрифугирования. В многочисленных опытах показано, что токсичность БЦФ и БЦК для экспериментальных животных прямо пропорциональна их активности, по обоим показателям.
Установлено (Головко А.И. и соавт., 1996), что различия в продолжительности судорожного периода в клинике отравления ГАМК-литиками также могут быть объяснены особенностями их взаимодействия с хлорионофорным белком. Так, в отличие от БЦФ и БЦК, образующих с протеином хотя и прочную, но обратимую связь, норборнан практически необратимо связывается ионофором.
Полагают, что способность ГАМК-литиков изменять конформацию хлорионофорного канала зависит от степени активации других сайтов связывания на ГАМК рецепторе. Так in vitro при добавлении в инкубационную среду гамма-аминомасляной кислоты (активация ГАМК-сайта) переход рецептора в неактивное состояние под влиянием ГАМК-литиков ускоряется, а при добавлении бензодиазепинов (активация бензодиазепинового сайта) - замедляется. Это открывает возможность создания медицинских средств защиты от токсикантов.
Мероприятия медицинской защиты
Специальные санитарно-гигиенические мероприятия:
- использование индивидуальных технических средств защиты (средства защиты органов дыхания) в зоне химического заражения;
- участие медицинской службы в проведении химической разведки в районе расположения войск, экспертиза воды и продовольствия на зараженность ОВТВ;
- запрет на использование воды и продовольствия из непроверенных источников;
- обучение личного состава правилам поведения на зараженной местности.
Специальные профилактические медицинские мероприятия:
- проведение санитарной обработки пораженных на передовых этапах медицинской эвакуации.
Специальные лечебные мероприятия:
- применение антидотов и средств патогенетической и симптоматической терапии состояний, угрожающих жизни, здоровью, дееспособности, в ходе оказания первой (само-взаимопомощь), доврачебной и первой врачебной (элементы) помощи пострадавшим.
- подготовка и проведение эвакуации
Медицинские средства защиты
Поскольку ГАМК-литики не являлись и не являются табельными ОВ современных армий, а масштабы их использования в хозяйственной деятельности крайне ограничены, разработка средств медицинской защиты от высокотоксичных веществ данной группы систематически не проводилась. Имеются отдельные сообщения о возможности разработки таких средств и целесообразности их использования в случае необходимости.
Основу медицинской защиты могут составить медикаментозные средства. Основные направления исследований в этой области представлены в таблице 51.
Таблица 51.
Основные направления разработки средств медицинской защиты
от поражающего действия ГАМК-литиков (А.И. Головко и соавт., 1996)
Направление |
Препараты |
Активация ГАМКА-рецепторов |
Барбитураты Бензодиазепины и др. |
Противосудорожные средства, действующие на иные нейромедиаторные системы |
Антагонисты возбуждающих аминокислот (МК-801, кетамин и др.) |
Подавление разрушения и обратного захвата ГАМК |
Ингибиторы ГАМК-трансаминазы (аминоксиуксусная кислота, вигабатрин и др.) |
Ускорение метаболизма токсикантов |
Индукторы микросомальных ферментов |
Ускорение метаболизма. Установлено, что профилактическое назначение индукторов микросомальных энзимов экспериментальным животным (бензонал, фенобарбитал - 1 раз в сутки, трехкратно в дозе 40 мг/кг, внутрибрюшинно; перфтордекалин - 2 г/кг) в 1,5 - 1,8 раз снижает чувствительность к БЦФ на трое и более суток. Практическому использованию данного направления защиты препятствует существующая у индкуторов, наряду со способностью понижать токсичность БЦФ, способность одновременно, на относительно длительный срок, повышать чувствительность организма к веществам, активируемым в процессе метаболизма. Поражение такими веществами не исключается в современных военных конфликтах.
Подавление разрушения ГАМК. Аминооксиуксусная кислота (АОУК), вигабатрин, γ-винил-ГАМК и другие ингибиторы ГАМК-трансаминазы, повышают уровень ГАМК в тканях головного мозга, за счет угнетения процесса ее разрушения. При этом, возможно, блокируется также процесс обратного захвата ГАМК нервными окончаниями ГАМК-эргических нейронов и осуществляется накопление нейромедиатора в клетках глии. Повышение уровня ГАМК в ткани мозга приводит к усилению тормозных процессов в ЦНС и, тем самым, к снижению токсичности ГАМК-литиков. Так, при профилактическом введении, АОУК (50 мг/кг внутрибрюшинно за 2 часа до введения токсиканта) в 1,2 - 1,5 раз понижает чувствительность экспериментальных животных к смертельным дозам пикротоксина. Этот факт указывает на теоретическую возможность разработки профилактических антидотов на основе ингибиторов ГАМК-Т. Средства, допущенные к клиническому применению, среди ингибиторов ГАМК-Т в настоящее время отсутствуют.
Бензодиазепины. В качестве специфических противоядий ГАМК-литиков, обладающих физиологическим антагонизмом, возможно использование бензодиазепинов. Вещества этой группы, в зависимости от вводимой дозы, обладают седативным, противосудорожным и центральным миорелаксирующим действием и потому широко используются в медицинской практике. В настоящее время синтезированы и испытаны тысячи соединений. К клиническому использованию допущено несколько десятков веществ. В качестве противосудорожных средств предпочтение отдают клоназепаму, нитразепаму, лоразепаму, диазепаму. Бензодиазепины хорошо всасываются в желудочно-кишечном тракте, некоторые обладают удовлетворительной биодоступностью при внутримышечном введении (диазепам, феназепам и т.д.). Диазепам (рис. 60), лоразепам выпускают в форме таблеток и раствора для инъекций (5 мг/мл и 2,4 мг/мл соответственно).
Рисунок 60. Диазепам
Вещества легко проникают через ГЭБ. Взаимодействуя с ГАМКА-рецепторами, они усиливают эффекты ГАМК в ЦНС (включая спинной мозг, гиппокамп, черную субстанцию, кору мозга и мозжечка), повышая эффективность ГАМК-эргического синаптического торможения. Бензодиазепины взаимодействуют с собственным сайтом ГАМК-рецептора и не действуют на сайт связывания ГАМК и хлорионофорный протеин. Их фармакологический эффект обусловлен повышением частоты открытий хлор-ионного канала возбудимых мембран нейронов, а также увеличением сродства (афинности) ГАМК-рецептора к ГАМК.
Как следует из приведенного ранее материала, основными механизмами антидотного действия бензодиазепинов при отравлении ГАМК-литиками являются: повышение эффективности обусловленного ГАМК торможения нейронов ЦНС, за счет модификации функционального состояния ГАМК-рецепторов, не связанных с ГАМК-литиками; уменьшение сродства ГАМК-рецепторов к ГАМК-литикам; понижение активности ГАМК-литиков в отношении рецепторов, защищенных бензодиазепином. При интоксикации ГАМК-литиками бензодиазепины оказываются эффективными при лечебном, но особенно при профилактическом способе применения. Так, в эксперименте, при введении за 30 минут до ДСТА, феназепам (2 мг/кг) защищал от 2 и более среднесмертельных доз токсиканта. Показана их антидотная активность при отравлениях лабораторных животных бикукуллином, пикротоксином, БЦФ.
К числу недостатков бензодиазепинов, как антидотов, относится их слабая эффективность при отравлениях ГАМК-литиком длительного действия норборнаном, а также выраженное и продолжительное седативное, а в действующих дозах и снотворное действие. Время действия бензодиазепинов зависит от скорости их метаболизма микросомальными энзимами печени и последующей конъюгации метаболитов, и составляет после однократного введения от 10 до 100 и более часов.
Барбитураты. Барбитураты - физиологические антагонисты ГАМК-литиков. Они обладают антидотными свойствами при отравлениях бикукуллином, пикротоксином, БЦФ. Мединал, барбамил и фенобарибитал проявляли антидотную активность при профилактическом (за 15 минут) и лечебном (при появлении первых признаков интоксикации) применении в условиях пероральной интоксикации лабораторных животных (крыс, кошек) БЦФ (третбутилбициклофосфатом) (С.И. Локтионов и соавт.). Антидотная активность различных барбитуратов не в полной мере коррелирует с выраженностью их седативного и снотворного действия. Наибольшей активностью отличается фенобарбитал.
Механизм антидотного действия объясняют: потенцированием действия ГАМК на ГАМК-эргические рецепторы различных отделов ЦНС, обусловленного способностью барбитуратов увеличивать продолжительность периода открытия хлорионных каналов; способностью непосредственно активировать хлорионные каналы, взаимодействуя, в относительно высоких дозах, с хлорионофорным протеином; препятствовать действию на возбудимые мембраны возбуждающих аминокислот (глутамата и др.); блокировать Ca2+-ионные каналы, препятствуя тем самым проникновению кальция из межклеточной среды внутрь нейрона, что необходимо для развития процесса возбуждения (Mg2+-подобное действие) и т.д.
К числу недостатков барбитуратов, препятствующих их использованию в качестве средств медицинской защиты, можно отнести: недостаточную терапевтическую широту (противосудорожное действие отчетливо проявляется при введении веществ в дозах, вызывающих сон, угнетение дыхательного центра); необходимость введения веществ в относительно больших объемах (5 и более мл.).
Другие противосудорожные средства. Препараты других фармакологических групп оказались недостаточно эффективными при отравлении ГАМК-литиками. Способностью потенцировать антидотное действие бензодиазепинов и барбитуратов обладают антагонисты возбуждающих аминокислот (кетамин), некоторые блокаторы кальциевых каналов (нифедипин и др.).
12.1.1.2. Отравляющие и высокотоксичные вещества
паралитического действия
12.1.1.2.1. Пресинаптические блокаторы высвобождения ацетилхолина
Ботулотоксин
Ботулотоксин - белок, продуцируемый микроорганизмами Clostridium botulinum. Эти бактерии способны размножаться в белковой среде в анаэробных условиях и продуцируемый ими экзотоксин порой является причиной массовых отравлений, при использовании в пищу испорченных консервов, копченостей, грибов и т.д. (ботулизм). Впервые случай ботулизма был зарегистрирован в 1735 г. Первое описание вспышки массового отравления, обусловленного потреблением контаминированной кровяной колбасы, было сделано в Германии в 1793 г. Название - ботулизм, происходит от латинского слова botulus - колбаса (термин впервые использован для обозначения заболевания в 19 веке). В конце 19 века Ван Эрменген связал развитие ботулизма с действием водорастворимого токсина, вырабатываемого анаэробной бактерией, названной тогда Bacillus botulinus.
Очищеный препарат экзотоксина Clostridium botulinum - ботулотоксин - изучался военными специалистами США в качестве возможного отравляющего вещества (шифр - XR).
Физико-химические свойства. Токсичность
В настоящее время известны более 7 серологических типов токсина: A, B, C, D, E, F и т.д., близких по структуре и токсической активности. Ботулотоксин представляет собой протеины с молекулярной массой 150000 дальтон, состоящие из двух субъединиц (МВ 100000 и 50000), соединенных дисульфидными связями. Токсин выделен в кристаллической форме. В водных растворах частично гидролизуется; устойчив к кипячению в течение часа.
Вещество проникает в организм через желудочно-кишечный тракт с зараженной водой и пищей, а при применении его в виде аэрозоля - через органы дыхания и раневые поверхности. Смертельная доза токсина для человека при алиментарном способе воздействия составляет около 50 нг/кг массы. При применении в форме аэрозоля среднесмертельная токсодоза (LCt50) - 2 10-5 - 5 10-5 г мин/м3. Наибольшей токсичностью ботулотоксин обладает при попадании в организм через раневые поверхности (ЛД50 менее 1 нг/кг).
Токсикокинетика
В пищеварительном тракте ботулотоксин не разрушается протеолитическими ферментами и всасывается через слизистые оболочки желудка и кишечника. При ингаляции аэрозоля вещество проникает в дыхательные пути и адсорбируется на поверхности слизистой бронхов, бронхиол и альвеолоцитов, где также происходит его всасывание. Часть адсорбированного токсина мерцательным эпителием дыхательный путей выносится в ротовую полость, откуда он поступает в желудочно-кишечный тракт. Поскольку молекулярная масса токсина велика, скорость резорбция мала. Механизмы проникновения этого белкового токсина через неповрежденные слизистые оболочки не выяснены.
Циркулирующий в крови токсин постепенно разрушается протеазами плазмы. Точное время нахождения молекулы токсина в крови не известно.
При исследовании радиоизотопным методом распределения токсиканта в организме установлено, что он избирательно захватывается нервными терминалиями холинэргических волокон; часть введенного токсина путем ретроградного аксонального тока транспортируется в тела нервных клеток. Об этом свидетельствует, в частности, высокое содержание J125 в телах мотонейронов спинного мозга экспериментальных животных после введения им яда, меченного этим изотопом.
Проявления интоксикации
Скрытый период интоксикации составляет от нескольких часов до суток и более (чаще до 36 часов). Продолжительность периода зависит от пути поступления токсина в организм и подействовавшей дозы. Наименее продолжителен скрытый период при попадании вещества на раневые поверхности. В клинике поражения выделяют общетоксический, гастроинтестинальный и паралитический синдромы. Первые симптомы - это вегетативные реакции (тошнота, рвота, слюнотечение) и признаки общего недомогания (головная боль, головокружение). Через 1 - 2 суток постепенно развивается неврологическая симптоматика. Усиливается слабость, появляется сухость во рту и сухость кожных покровов. Нарушается зрение (затруднена аккомодация, расширяются зрачки, выявляется их слабая реакция на свет). Основным проявлением интоксикации является постепенно развивающийся паралич поперечно-полосатой мускулатуры. Процесс начинается с глазодвигательной группы мышц (диплопия, нистагм). Ранним признаком отравления является птоз век. Позже присоединяется паралич мышц глотки, пищевода (нарушение глотания), гортани (осиплость голоса, афония), мягкого неба (речь с носовым оттенком, при попытке глотания жидкость выливается через нос). Затем присоединяется парез (а позже и паралич) мимической мускулатуры, жевательных мышц, мышц шей, верхних конечностей и т.д. Мышечная слабость нарастает в нисходящем направлении и порой первоначально более выражена в проксимальных мышечных группах конечностей (важный диагностический признак). Токсический процесс постепенно нарастает. Иногда лишь на 10 сутки и в более поздние сроки может наступить смерть от паралича дыхательной мускулатуры и асфиксии (при тяжелых поражениях на 3 - 5 день заболевания). Расстройств чувствительность при поражении ботулотоксином не бывает. Сознание у пострадавшего полностью сохранено весь период интоксикации. Не редко присоединяются острые пневмонии, токсический миокардит, сепсис (при раневом процессе). Летальность при отравлении ботулотоксином составляет от 15 до 30%, а при несвоевременном оказании помощи может достигать 90%. По данным литературы (И.В. Маркова и соавт., 1999) кардинальными признаками бтоулизма являются:
- отсутствие лихорадки;
- полностью сохраненное сознание;
- нормальная или замедленная частота пульса;
- отсутствие нарушений чувствительности;
- симметричность неврологических нарушений.
Механизм токсического действия
Ботулотоксин оказывает повреждающее действие на различные структурно-анатомические образования периферической нервной системы: нервно-мышечный синапс, нервные окончания преганглионарных нейронов и парасимпатических постганглионарных нейронов. Токсины избирательно блокируют высвобождение ацетилхолина в этих структурах. Наиболее уязвимыми являются нервно-мышечные синапсы.
В опытах in vitro и in vivo, выполненных за рубежом (Пирс и соавт., 1997), установлено, что действие ботулотоксина приводит к угнетению как спонтанного, так и вызванного возбуждением нервного волокна выброса нейромедиатора в нервных окончаниях. Чувствительность постсинаптических рецепторов к ацетилхолину не изменяется. Блокада передачи сигнала не сопровождается изменением характеристик процессов синтеза и хранения ацетилхолина. При исследованиях in vitro установлено, что после добавления в инкубационную среду токсина в концентрации 10-8 М спонтанная и вызванная активность концевой пластинки мотонейрона снижается на 90% в течение 60 - 90 минут. По расчетам, для блокады одного синапса достаточно 10 молекул яда. В экспериментах установлено также, что чем выше нервная активность, тем быстрее развивается блок проведения импульса в синапсах.
Полагают, что в основе эффекта лежит нарушение токсином механизма взаимодействия синаптических везикул, в которых депонирован ацетилхолин, с аксолемой, - необходимый этап процесса Ca2+-зависимого экзоцитоза медиатора в синаптическую щель. Электрофизиологические исследования показывают, что в отличие от нормальной реакции нервно-мышечного синапса на повышение содержания кальция в инкубационной среде (дозо-зависимый выброс нейромедиатора), увеличение концентрации экстрацеллюлярного кальция с 2 до 16 мМ не приводит к усилению выброса ацетилхолина нервным окончанием, обработанным ботулотоксином. Только совместное введение в инкубат Ca2+ (4 мМ и выше) и некоторых ионофоров (4-аминопиридин, гуанидин и др.) временно усиливает выброс ацетилхолина из нервных окончаний.
Действие вещества продолжительно, до нескольких недель, и потому характер взаимодействия токсина с пресинаптическими структурами-мишенями можно рассматривать как необратимое. Полагают, что восстановление нормальной иннервации мышц происходит в результате формирования новых синаптических контактов.
Морфологические изменения в пораженных синапсах не выявляются методами световой и электронной микроскопии.
Молекулярный механизм действия токсина окончательно не выяснен. Доказанными являются следующие представления.
Как указывалось ранее, периоду клинических проявлений предшествует скрытый период, во время которого происходит взаимодействие токсиканта с нервными окончаниями. Выделяют четыре периода действия токсина на синапс:
- связывание его с плазматической мембраной холинэргических нервных окончаний;
- интернализация токсина путем эндоцитоза внутрь нервного окончания;
- высвобождение действующей части белковой молекулы токсина и проникновение ее в цитозоль пресинаптического окончания при участии pH-зависимой транслоказы;
- проявление действующей частью токсина свойств метал-зависимых эндопротеаз и разрушение специфических белков, участвующих в процессе выделения ацетилхолина из нервного окончания.
За процесс связывания с рецептором (акцептором) нервного окончания ответственна, прежде всего, тяжелая субъединица сложной молекулы токсина. Афинность окончаний различных холинэргических нейронов к молекулам ботулотоксина неодинакова. Наивысшим сродством обладают окончания мотонейронов, иннервирующих произвольную мускулатуру. У различных серологических типов ботулотоксина, сродство к акцепторам неодинаково.
Интернализация связавшегося с рецепторами токсина осуществляется путем эндоцитоза. В результате токсин оказывается внутри нервного окончания, заключнным в мембранные везикулы, называемые эндосомами.
После проникновения внутрь нервного волокна высокомолекулярная субъединица токсина образует пору в мембране эндосомы, которая действует как канал, через который легкая цепь проникает в цитозоль пресинаптического окончания.
Теперь свободно передвигаясь в нервном окончании, легкая цепь токсина оказывает воздействие на субстратные белки.
Биохимические исследования показали, что нейротоксины обладает цинк-зависимой эндопептидаэной активностью и энзиматически расщепляют ряд белков нервных окончаний, важных для нормального высвобождения нейротрансмиттеров. Ботулотоксины А и Е расщепляют белок SNAP-25, ботулотоксин С - НРС-1 (синтаксин), токсины D и F расщепляют изоформу VAMP-1 (синаптобревин-1), токсин В - VAMP-2 (синаптобревин-2) и т.д. Протеолитическое расщепление этих специфических белков в нервных окончания приводит к угнетению нормального высвобождения ацетилхолтина и, в конечном счете, к появлению основных признаков ботулизма.
Мероприятия медицинской защиты
Специальные санитарно-гигиенические мероприятия:
- использование индивидуальных технических средств защиты (средства защиты органов дыхания) в зоне химического заражения;
- участие медицинской службы в проведении химической разведки в районе расположения войск; проведение экспертизы воды и продовольствия на зараженность ОВТВ;
- запрет на использование воды и продовольствия из непроверенных источников;
- обучение личного состава правилам поведения на зараженной местности.
Специальные профилактические медицинские мероприятия:
- проведение санитарной обработки пораженных на передовых этапах медицинской эвакуации.
Специальные лечебные мероприятия:
- своевременное выявление пораженных;
- применение средств патогенетической и симптоматической терапии состояний, угрожающих жизни, здоровью, дееспособности, в ходе оказания первой (само-взаимопомощь), доврачебной и первой врачебной (элементы) помощи пострадавшим;
- подготовка и проведение эвакуации.
Медицинские средства защиты
Специфическими противоядиями ботулотоксина являются противоботулинические сыворотки (А, В, Е). При подозрении на поражение токсином возможно профилактическое внутримышечное введение сывороток по 1000 - 2000 МЕ каждого типа с последующим наблюдением за пострадавшим в течение 10 - 12 дней. Решение о назначении сывороток достаточно сложно и требует участия квалифицированного специалиста, поскольку с одной стороны эти лекарственные средства не всегда оказываются эффективными (иные серологические типы токсина, быстрое необратимое взаимодействие яда с нервными окончаниями), а с другой достаточно высока вероятность осложнений, связанных с их применением (анафилаксия, сывороточная болезнь).
В эксперименте in vitro нервную передачу в синапсах, нарушенную ботулотоксином, временно нормализует 4-аминопиридин. Полагают, что действие вещества обусловлено его способностью облегчать транспорт ионов кальция через мембрану нервных окончаний и преодолевать тем самым блок Ca2+-зависимого экзоцитоза ацетилхолина. При введении летальной дозы токсина экспериментальному животному, последующее назначение 4-аминопиридина отчасти восстанавливает двигательную активность животного на 1 - 2 часа. К сожалению, из-за высокой токсичности и кратковременности эффекта, 4-аминопиридин не может рассматриваться как эффективное противоядие. Табельные средства медицинской защиты отсутствуют.
При появлении признаков угнетения дыхания необходимо предусмотреть возможность перевода пострадавшего на искусственную вентиляцию легких.
12.1.1.2.2. Блокаторы Na+-ионных каналов возбудимых мембран
Сакситоксин. Тетродотоксин
В строгом смысле слова вещества этой группы не относятся к “чистым” нейротоксикантам, поскольку, блокируя ионные каналы, действуют на возбудимые мембраны всех типов клеток организма: нервных, мышечных, железистых. Порой не возможно решить, поражение какой из структур является ведущим в патогенезе острой интоксикации. Тем не менее, внешние признаки тяжелого поражения очень напоминают действие миорелаксантов, традиционно относимых к группе нейротоксикантов. И поэтому, хотя механизм действия веществ иной, представляется целесообразным рассмотреть их свойства в данном разделе. Достаточно хорошо изученными представителями группы являются сакситоксин и тетродотоксин, признаки поражения которыми, по сути, одинаковы. Боевое применение токсинов маловероятно, однако эти вещества рассматривались в качестве возможных диверсионных средств (В.В. Мясников, 1989; Франке, 1973). В 60х - 70х годах свойства токсинов активно изучались военным ведомством США.
Физико-химические свойства. Токсичность
Сакситоксин. В 1957 году Шантцем и соавт. были изучены свойства так называемого “паралитического яда моллюсков” - одного из наиболее токсичных веществ небелковой природы. По названию морского моллюска, из ткани которого токсикант выделили (Saxidomus), вещество получило название сакситоксин. Позже было установлено, что в организме животных сакситоксин не синтезируется, а поступает туда с одноклеточными (жгутиковые) вида Gonyaulax catenella, которыми молюски питаются. Количество вырабатываемого простейшими вещества колеблется в очень широких пределах и зависит от географического региона, времени года и других условий.
Целый ряд моллюсков, в случае массового размножения Gonyaulax, поглощают их в большом количестве и концентрируют в своих тканях токсин, который для них практически безвреден. Становясь при этом ядовитыми, моллюски, съедобные для человека в обычных условиях, при использовании в пищу, вызывают случаи массового отравления людей.
Сине-зелёные водоросли пресноводных водоемов также синтезируют сакситоксин. Имели место случаи отравления скота водой, зараженной этими водорослями.
Сакситоксин (МВ - 372) - аморфный, хорошо растворимый в воде, спирте, метаноле, ацетоне порошок. Вещество устойчиво в водных растворах. Химическое строение представлено на рисунке 61. Молекулы сакситоксина, выделенные из разных источников, не полностью идентичны.
Рисунок 61. Структура молекулы сакситоксина
Расчетная смертельная доза сакситоксина для человека составляет по разным данным 0,004 - 0,01 мг/кг. Токсичность для мышей при внутрибрюшинном способе введения - около 0,009 мг/кг (с регистрацией гибели в течение 30 минут). При назначении вещества через рот смертельная доза - 0,25 мг/кг.
Тетродотоксин обнаружен в тканях целого ряда живых существ, среди которых рыбы (более 70 видов, в том числе семейства Tetrodontidae - четырехзубообразные), лягушки (3 вида), моллюски (1 вид). В Японии, где представитель четырехзубообразных, рыба Фугу, является деликатесом, десятки людей ежегодно отравляются в результате неумелого приготовления блюда.
Вещество выделено в чистом виде, структура его изучена (рис. 62). Это бесцветный порошок хорошо растворимый в воде. Раствор стабилен при комнатной температуре. Молекулярная масса - 319,3.
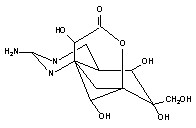
Рисунок 62. Структура молекулы тетродотоксина
Токсичность вещества для белых мышей при внутрибрюшинном способе введения около 0,01 мг/кг массы. Доза в 0,005 мг/кг (подкожно) вызывает у собак рвоту и нарушение дыхания, а дозы более 0,006 мг/кг в течение час приводят к гибели в результате прекращения дыхания и асфиксии.
Токсикокинетика
Через неповрежденную кожу вещества не проникают. Опасность представляет попадание токсинов на раневые поверхности, а также (прежде всего) потребление воды и пищи, зараженной ядами. Вещества быстро абсорбируется в кишечнике и столь же быстро выводится из организма с мочой. Детально токсикокинетика токсинов не изучена. Дискуссионным остается вопрос о способности вещества проникать через гематоэнцефалический барьер.
Основные проявления интоксикации
Независимо от способа поступления в организм симптомы отравления практически одинаковы.
Спустя 10 - 45 минут появляется тошнота, рвота, боли в животе, понос. Ранними признаками поражения являются парестезии в области рта, губ, языка, десен, распространяющиеся на область шеи, покалывание, ощущение жжения кожи конечностей. Позже развивается бледность кожных покровов, беспокойство, общая слабость, онемение конечностей, возникает ощущение невесомости тела. Зрачок сначала сужен, затем расширяется. В тяжелых случаях взгляд фиксирован, зрачковый и корнеальный рефлексы отсутствуют, появляются признаки бульбарных нарушений: затруднение глотания, речи (иногда - афония), нарастают брадикардия и гипотензия, отмечаются гиперсаливация, профузная потливость, понижение температуры тела. Дыхание учащается, становится поверхностным, развивается цианоз губ и конечностей.
Двигательные расстройства проявляются все отчетливее: появляются подергивания отдельных групп мышц, тремор, координация движений нарушается. Постепенно развивающийся паралич охватывает все большие группы мышц, начавшись в области конечностей, он распространяется на другие мышечные группы. Сознание, как правило, сохраняется весь период интоксикации. Смерть наступает от паралича дыхательной мускулатуры и асфиксии в течение 6 - 24 часов от начала интоксикации. Если больной выживает, в течение последующих суток наступает практически полная нормализация состояния, в большинстве случаев, без отдаленных последствий.
Помимо типичной паралитической формы выделяют также гастро-интестинальный и аллергический варианты течения отравления. Первый вариант проявляется признаками общего недомогания, чувством жажды, саливацией, болями в животе, тошнотой, рвотой, поносом.
Аллергическая форма отравления развивается у отдельных лиц с повышенной чувствительностью к токсинам. Характерно появление экзантем (эритематозная форма). Иногда на коже и слизистых образуются пузыри.
Механизм токсического действия
Тетродотоксин, как и сакситоксин, оказывают избирательное действие на возбудимые мембраны нервов и мышц. Как известно градиент концентрации ионов между внутренней и внешней средой клетки формирует потенциал покоя возбудимой мембраны, равный примерно 90 мВ (табл. 52).
Таблица 52.
Распределение ионов внутри и вне возбудимых клеток, мМ/л
(по Katz, 1971)
ионы |
мышечная клетка |
нервная клетка |
||
снаружи |
внутри |
снаружи |
внутри |
|
Na+ K+ Cl- |
120 2,5 120 |
9,2 140 3 - 4 |
460 10 540 |
50 400 40 - 100 |
Градиенты концентраций калия и хлора примерно уравновешивают друг друга. Поэтому проницаемость мембраны для этих ионов хотя и ограничена, но относительно высока. Проницаемость натриевых каналов в покое ничтожно мала. Более того, Na+ постоянно “выкачивается” за пределы нейрона с помощью энергозависимых механизмов против высокого электрохимического градиента. Таким образом, потенциал покоя представляет собой ни что иное, как готовый к использованию источник накопленной энергии, необходимой для генерации сигнала (потенциала действия). Если возбудимая мембрана деполяризуется примерно на 15 мВ, электровозбудимые натриевые каналы открываются, проницаемость их для ионов резко возрастает, Na+ устремляется в клетку, разница потенциалов по обе стороны мембраны падает, деполяризация мембраны еще более усиливается, формируется потенциал действия и явление возбуждения передается по нервному (или мышечному) волокну. Затем в течение около 0,8 мсек потенциал на мембране возвращается примерно к исходному уровню, главным образом за счет выхода ионов калия из клетки. Усиление проницаемости для К+ необходимо для полной реполяризации мембраны и восстановления исходного потенциала покоя. При этом восстанавливается и исходная проницаемость мембраны для натрия.
Тетродотоксин и сакситоксин полностью блокируя проникновение ионов Na+ по ионным каналам возбудимых мембран внутрь клеток. При этом становится невозможным формирования потенциала действия возбудимых мембран - нарушается проведение нервных импульсов по нейронам, сокращение миоцитов. В эксперименте показано, что вещества действует только при экстрацеллюлярной аппликации. В соответствии с расчетами одна молекула токсинов полностью блокирует один ионный канал. Полагают, что взаимодействие токсикантов с белковыми молекулами, формирующими ионный канал, осуществляется за счет группы гуанидина, содержащейся в структуре как сакси-, так и тетродотоксина. Взаимодействие токсинов с белками ионных каналов обратимо. In vitro яды могут быть удалены с поверхности возбудимой мембраны простым отмыванием биопрепарата.
Исчерпывающих данных о причинах развивающихся эффектов нет. Так, до конца не определено, возбудимые мембраны каких структур, нервных клеток (ЦНС, периферии) или миоцитов, являются более чувствительными к действию токсинов. Так, по мнению одних исследователей остановка дыхания является следствием действия токсинов на нейроны дыхательного центра, другие полагают, что основным является нарушение проведения нервного импульса по дыхательным нервам или возбудимости дыхательных мышц. Вероятно, более справедливо последнее предположение, поскольку электровозбудимость диафрагмы блокируется меньшими дозами токсикантов, чем проведение нервного импульса по диафрагмальному нерву. Кроме того, в опытах на анестезированных кошках показано, что при введении вещества в смертельной дозе, проведение нервных импульсов по диафрагмальному нерву не прекращается, даже тогда, когда электромиограмма диафрагмальной мышцы уже безмолвствует.
Развивающееся снижение артериального давления также связывают как с блокадой проведения нервных импульсов по симпатическим нервным волокнам, так и с параличом гладкомышечных клеток сосудистой стенки. Сердечная мышца вовлекается в процесс при введении токсиканта лабораторным животным в дозе 0,007 мг/кг.
Нарушение чувствительности (парестезии с последующим онемением) - следствие поражения возбудимых мембран чувствительных нейронов.
Многие центральные эффекты, такие как атаксия, головокружение, нарушение речи и т.д., могут быть связаны с действием вещества непосредственно на нейроны ЦНС.
Мероприятия медицинской защиты
Специальные санитарно-гигиенические мероприятия:
- участие медицинской службы в проведении химической разведки в районе расположения войск; проведение экспертизы воды и продовольствия на зараженность ОВТВ
- запрет на использование воды и продовольствия из непроверенных источников.
Специальные лечебные мероприятия:
- своевременное выявление пораженных;
- применение средств патогенетической и симптоматической терапии состояний, угрожающих жизни, здоровью, дееспособности, в ходе оказания первой (само-взаимопомощь), доврачебной и первой врачебной (элементы) помощи пострадавшим;
- подготовка и проведение эвакуации.
Медицинские средства защиты
В порядке оказания доврачебной и первой врачебной помощи у пострадавшего необходимо вызвать рвоту, провести зондовое промывание желудка. Специфических средств профилактики и терапии интоксикации нет. Поскольку при тяжелых формах поражения единственным надежным способом сохранения жизни является перевод пострадавшего на искусственную вентиляцию легких необходимо принять меры к скорейшей эвакуации пострадавших в лечебные учреждения. В случае сохранения жизни прогноз благоприятный: выздоровление бывает быстрым и полным.
12.1.2. Отравляющие и высокотоксичные вещества
психодислептического действия
ДУРМАН
Дурману девочка наелась,
Тошнит, головка разболелась,
Пылают щечки, клонит в сон,
Но сердцу сладко, сладко, сладко:
Все непонятно, все загадка,
Какой-то звон со всех сторон:
Не видя, видит взор иное,
Чудесное и не земное,
Не слыша, ясно ловит слух
Восторг гармонии небесной -
И невесомой, бестелесной
её довел домой пастух.
Наутро гробик сколотили.
Над ним попели, покадили,
Мать порыдала... И отец
Прикрыл его тесовой крышкой
и на погост отнес под мышкой...
Ужели сказочке конец?
И. Бунин, 1916 г.
Психодислептическим можно назвать токсическое действие химических веществ, сопровождающееся нарушением процессов восприятия, эмоций, памяти, обучения, мышления и формированием состояния, характеризующегося неадекватными поведенческими реакциями личности на внешние раздражители.
Научное изучение психоактивных веществ (влияющих на психические процессы), началось лишь во второй половине ХХ века, хотя действие некоторых из них знакомо человечеству уже тысячелетия. В настоящее время известны сотни соединений с подобными свойствами, причем многие - широко используются в клинической практике, а некоторые - испытывались на предмет применения с военными целями, как боевые отравляющие вещества.
Способность вызывать психодислептический эффект у разных психоактивных веществ выражена неодинаково. Так, в рекомендованных врачом дозах, большинство психотропных лекарственных препаратов (нейролептики, антидепрессанты, психостимуляторы, наркотические аналгетики и т.д.) угнетают или активируют (в зависимости от свойств) процессы, лежащие в основе высшей нервной деятельности, сохраняя в целом адекватное отношение личности к окружающей действительности. Только в относительно больших дозах, они в той или иной степени могут извращать процессы восприятия, эмоций, памяти и т.д.
Однако известны вещества, для которых психодислептический эффект является основным в профиле их биологической активности. Количество такого вещества, делающего человека полностью недееспособным, в сотни - тысячи раз меньше того, в котором это же вещество угнетает сознание или вызывает соматические расстройства. Такие вещества иногда называют психодислептиками, психотомиметиками, психогениками, психоделиками, подчеркивая их особую способность извращать функции высшей нервной деятельности.
В таблице 53 представлена классификация наиболее изученных соединений.
Таблица 53.
Химическая классификация психодислептиков
Группа соединений |
Представители |
Производные триптамина |
диметилтриптамин буфотенин псилоцин псилоцибин диэтиламид лизергиновой кислоты (ДЛК) гармин |
Производные фенилалкиламинов |
мескалин 2,5-диметокси-4метиламфетамин 2,5-диметокси-4этиламфетамин триметоксифенизопропиламин |
Пиперидилгликоляты |
атропин скополамин хинуклединилбензилаты |
Производные фенилпиперидина и бензимидазола |
фентанил суфентанил этонитазен |
Разные |
фенциклидин (сернил) Δ-тетрагидроканнабинол |
Строение некоторых веществ, относящихся к этой группе, представлено на рисунке 63.
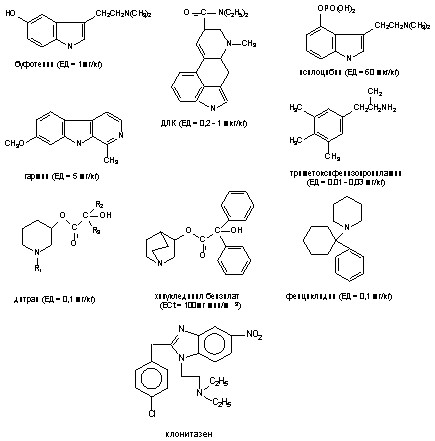
Рисунок 63. Структура некоторых химических веществ, обладающих психодислептической активностью
Признаки тяжелого поражения психодислептиками достаточно однотипны. Напротив, картина легкого и средней степени тяжести отравления характеризуется значительной полиморфностью и даже при воздействии одного и того же соединения, развивающиеся эффекты существенно зависят от индивидуальных личностных особенностей человека и ситуации, на фоне которой произошло поражение. Тем не менее психотоксический профиль психодислептиков неодинаков. Наблюдения показывают, что можно выделить несколько типичных вариантов течения интоксикации. Так, при отравлениях некоторыми веществами доминирует изменение эмоционального статуса (эйфория и т.д.); другие вещества – преимущественно вызывают нарушения процессов восприятия (иллюзии, галлюцинации и т.д.) с умеренным извращением ассоциативных процессов; третьи - формируют глубокое извращение психической активности, затрагивающее все её стороны (делирий). Эти особенности обусловлены, прежде всего, различными механизмами действия веществ на центральную нервную систему. В этой связи есть основания выделить группы токсикантов в соответствии с особенностями формируемых ими токсических процессов:
1. Эйфориогены: Δ-тетрагидроканнабинол, суфентанил, клонитазен и др.
2. Галлюциногены (иллюзиогены): ДЛК, псилоцин, псилоцибин, буфотенин, мескалин и др.
3. Делириогены: BZ, скополамин, дитран, фенциклидин, и др.
Поскольку препараты первой группы вызывают отчетливое психодислептическое действие лишь в дозах, близких к тем, в которых отмечается угнетение сознание, нарушение двигательной активности, а иногда и угнетение дыхательного и сосудодвигательного центров, для военной медицины интерес представляют психодислептики только второй и третьей групп. Некоторые из них ранее предполагали использовать на поле боя в качестве отравляющих веществ, временно выводящих из строя личный состав противника (психотомиметические ОВ). С этой целью в различное время изучали такие вещества как N,N-диметилтриптамин, буфотенин, мескалин, диэтиламид лизергиновой кислоты (ДЛК), фенил-циклогексил-пиперидин (фенциклидин), 3-хинуклидинил-бензилат (BZ) и т.д. Эти вещества также можно рассматривать как потенциальные диверсионные яды для заражения воды и продовольствия.
12.1.2.1. Галлюциногены
Галлюциногенами называют вещества, в клинике отравления которыми преобладают нарушения восприятия в форме иллюзий и галлюцинаций, при этом пострадавшие, как правило, не утрачивают контакт с окружающими. К числу галлюциногенов относятся некоторые производные триптамина и фенилэтиламина (см. выше), нарушающие проведение нервного импульса преимущественно в серотонинэргических и катехоламинэргических синапсах мозга. Характерной особенностью интоксикации галлюциногенами является отсутствие амнезии на пережитые события.
Большинство галлюциногенов - вещества животного и растительного происхождения, используемые человеком с древних времён для самоотравления с ритуальными целями. Некоторые токсиканты и сегодня используются наркоманами. 3 - 4 ежедневных приема веществ приводит к развитию толерантности, которая, однако, быстро проходит. Перекрестная толерантность отмечается между мескалином, псилоцибином, ДЛК, некоторыми другими психодислептиками. Наиболее опасным из галлюциногенов считается синтетическое вещество - метилен диоксиамфетамин (МДА). Острые отравления МДА иногда заканчиваются смертью.
Представителем группы, долгое время исследовавшимся военными ведомствами, является диэтиламид лизергиновой кислоты.
12.1.2.1.1. Диэтиламид лизергиновой кислоты (ДЛК)
Психодислептические свойства ДЛК стали известны человечеству 16 апреля 1943 года. Именно в этот день Гофман, работавший в лаборатории Штоля в Базеле, случайно принял ничтожное количество вещества внутрь. В результате развилась интоксикация, сопровождавшаяся нарушением психики. С этого момента началось экспериментальное изучение галлюциногенов. Долгое время ДЛК рассматривали, как потенциальное ОВ и потому свойства его подверглись глубокому исследованию. В настоящее время целесообразность применения вещества на поле боя отрицается, но не исключено использование его в качестве диверсионного агента.
Физико-химические свойства. Токсичность
ДЛК – белый кристаллический порошок без запаха. Плавится при температуре 830С с разложением. Не летуч. Плохо растворим в воде, растворяется в органических растворителях. Некоторые соли ДЛК (тартарат) хорошо растворимы в воде.
Летальная доза для мышей - 50 мг/кг, для крыс - 15 мг/кг. При приеме вещества внутрь человеком в дозе 0,005 мг/кг развиваются выраженные психозы. В качестве пороговой дозы называют 0,0002-0,0003 мг/кг. Выводящая из строя токсодоза при ингаляционном воздействии аэрозоля составляет 0,01 - 0,1 г мин/м3.
Токсикокинетика
Вещество способно быстро проникать в организм через желудочно-кишечный тракт, а также через слизистые дыхательных путей при ингаляции в форме аэрозоля. Максимальная концентрация в крови и тканях отмечается через 10 - 20 минут после приема. В ткани мозга в этот момент содержится менее 1% от введенного количества. Через 3 часа 80% вещества определяется в стенках и содержимом кишечника, 3% - в печени. С мочой в неизмененном виде выделяется около 1% от введенного количества вещества. Метаболизм ДЛК включает реакции окисления молекулы (6-гидроксилирование) и ее конъюгации с метильным радикалом (N-метилирование).
Основные проявления интоксикации
В экспериментальных исследованиях, выполненных на животных различных видов (мыши, крысы, кролики, собаки, обезьяны) установлено, что ДЛК вызывает изменения спонтанного поведения и нарушения условнорефлекторной деятельности.
Характер действия ДЛК на поведение иллюстрируется протоколом опыта на павиане гамадриле, у которого был выработан прочный двигательный пищевой рефлекс, на два типа звонков (сильный и слабый), двигательный оборонительный рефлекс на метроном и ориентировочная реакция на комплексный раздражитель (тон+свет).
11 ч 00 мин. Обезьяна подвижна. При включении положительных сигналов быстро подходит к стержню, сильно толкает его и бежит к кормушке. Получает пищевое подкрепление. Дифференцировка полная. При включении метронома подбегает к рычагу и нажимает на него, тем самым, выключая ток, поданный на решетку, расположенную на полу камеры. При включении первого компонента ориентировочного сигнала (тон) бежит к окну, где включается свет, и рассматривает выставленные там предметы.
11 ч 25 мин. Внутримышечно введен ДЛК в дозе 0,04 мг/кг.
11 ч 35 мин. Включен слабый звонок. Реакции нет, облизывается. При движении качается. На звуковой сигнал (звонок) не реагирует. Включен ориентировочный сигнал. Оглянулась и пошла не к ориентировочному окну, а к противоположной стенке.
11 ч 40 мин. Включен метроном. Реакции нет. Сделала неудачную попытку побежать. Сидит в необычной позе.
11 ч 50 мин. При включении сигнала испуганно убегает. Резкая настороженность.
12 ч 00 мин. Подошла к рычагу. Взяла его двумя лапами, но не нажала, чтобы выключить ток. Включены последовательно сильный и слабый звонок. Реакции нет. Движения стали более координированными. При включении ориентировочного сигнала вздрогнула. Движения резкие.
14 ч 30 мин. Состояние близко к исходному. Несколько угнетена. Большую часть времени сидит на одном месте. Восстановилась условная реакция на сильный и слабый звонки. Дифференцировка полная. Реагирует правильно на ориентировочный сигнал.
Клиника отравления ДЛК у человека складывается из нарушений восприятия, психики, соматических и вегетативных нарушений.
Нарушение восприятия проявляются искажением формы и цвета наблюдаемых объектов, затруднением фокусирования зрения на объекте, обострением слухового восприятия и, реже, парестезиями и синестезиями, зрительными, тактильными, вкусовыми галлюцинациями, расстройством ощущения “схемы тела”.
Психические нарушения – это изменение настроения (эйфория, сменяющаяся депрессией, беспокойство), напряжение, сонливость, нарушение чувства времени (“время остановилось”), затрудненность в выражении мыслей, деперсонализация (утрата представлений о собственном “Я”), возникновение ощущений, похожих на сновидения, спутанность сознания.
Соматические нарушения сопровождаются головокружением, слабостью, тремором рук, атаксией, дизартрией, спастическими состояниями, угнетением дыхания и т.д.
Вегетативные расстройства - тошнота, мидриаз, тахикардия, сменяющаяся брадикардией, гипергликемия, пиломоторные реакции, гипотония.
Первые признаки отравления появляются через 40 - 60 мин после приема токсиканта (при внутривенном введении вещества - через 5 - 10 минут). Симптомы достигают максимума через 1,5 - 3 часа.
Отравление, как правило, развивается в определенной последовательности: вначале появляются соматические и вегетативные симптомы, затем нарушается перцепция, изменяется настроение, нарушается психика.
Перед началом психоза отравленный чувствует легкую тошноту, зрачки расширяются. Появляется беспокойство, расстройство зрения, ослабление внимания, беспричинный смех, затруднения речи. Зрительные восприятия искажаются – предметы и вещи деформируются, увеличиваются или уменьшаются в размерах и принимают неестественную окраску (иллюзии). Отравленный теряет ощущение времени. Реакции значительно замедляются.
Зрительные галлюцинации проявляются в виде фантастических ярко окрашенных и пестрых образов, калейдоскопически сменяющих друг друга. Галлюцинации более выражены при закрытых глазах. Настроение при этом у испытуемых, по их словам “необыкновенно хорошее”. Однако иногда (как правило, у людей не знавших о назначении им галлюциногена) появляется чувство страха, враждебное и недоверчивое отношение к окружающим. Пораженные повышенно чувствительны к прикосновению и иногда реагируют на него импульсивно и злобно. На протяжении всего периода легкой интоксикации сохраняется способность к правильным суждениям и умозаключениям. Контакт с пораженным затруднен, но возможен. Тяжелые интоксикации сопровождаются нарушениями мышления вплоть до помрачения сознания.
Общая продолжительность интоксикации составляет 6 - 12, реже до 24 часов. По выходе из состояния пострадавший помнит пережитое. Возможны спонтанные рецидивы, а также затяжные психозы в результате воздействия галлюциногена в обычной дозе (как правило, у лиц со скрытой формой психических заболеваний).
Механизм токсического действия
ДЛК действует на центральный и периферический отделы нервной системы. К числу центральных эффектов ДЛК относится все сенсорные и психические нарушения, часть соматических и вегетативных реакций, таких как гипертермия, гипергликемия, тахикардия и т.д. Периферическое действие ДЛК проявляется тремором, мидриазом, сокращением мускулатуры матки, гипотонией, пилоэрекцией, брадикардией и т.д.
В основе токсических эффектов, развивающихся при действии ДЛК на нервную систему, лежит способность вмешиваться в проведение нервных импульсов в серотонинэргических и катехоламинэргических синапсах.
Серотонинэргическая медиаторная система мозга представлена 10 - 20 тысячами клеток (менее 0,1% нейронов), тела которых компактно залегают в ядрах шва - образованиях вентральной покрышки среднего мозга, расположенных, в основном, под сильвиевым водопроводом. Эти нейроны иннервируют все отделы ЦНС, особенно плотно, образования зрительного анализатора, лимбической системы, гипоталамуса (в норме содержание серотонина в различных структурах мозга составляет 5 - 30 нг/мг белка).
Первоначально полагали, что основным видом действия токсиканта является ее способность блокировать постсинаптические рецепторы в синапсах, образуемых окончаниями аксонов серотонинэргических нейронов в иннервируемых ими отделах мозга. Было показано, что особенно выражено антисеротонинэргическое действие на 5-НТ2-подтип рецепторов (преимущественная локализация - кора головного мозга). Однако только этим объяснить развивающийся эффект не удается, поскольку в настоящее время существует большое количество центральных серотонинолитиков, обладающих преимущественно антагонистическим действием в отношении 5-НТ2-подтип рецепторов серотонина, лишенных психодислептической активности. В какой-то мере снимают противоречие данные, полученные в эксперименте. Так установлено, что ДЛК не только выступает в качестве антагониста серотонина, но и способна угнетать спонтанную активность самих серотонинэргических нейронов. Более того, установлено, что при определенных концентрациях в тканях мозга ДЛК может выступать и как агонист серотонина, особенно в отношении 5-НТ1А (преимущественная локализация - ядра шва) и 5-НТ1С-рецепторов. Высказано предположение, что вещество прежде всего возбуждает ауторецепторы, образуемые окончаниями нейронов, на своих собственных телах. Функция такой иннервации - подавлять активность нервных клеток по механизму отрицательной обратной связи. За счет этого, в отличие от эффектов классических серотонинолитиков, при отравлении ДЛК уровень нейромедиатора в ЦНС не только не понижается, но напротив существенно возрастает (в основном связанной формы). Установлено, что ДЛК в эффективных дозах не действует на ферменты, обеспечивающие синтез (5-гидрокситриптофандекарбоксилаза) и разрушение (моноаминоксидаза) серотонина, а также на систему его транспорта в мозге. Предполагается, что повышение содержания серотонина в мозге является следствием замедления скорости его “оборота”, которое наступает при подавлении активности нервных клеток. В пользу такого предположения свидетельствуют и данные, указывающие на снижение секреции с мочой 5-гидроксиндолилуксусной кислоты, которая рассматривается как основной метаболит серотонина. Выявлено совпадение во времени указанных биохимических изменений с развитием нарушений поведения.
Так или иначе, происходит смещение баланса процессов торможения и возбуждения, как внутри самой серотонинэргической системы, так и в других, тесно взаимодействующих с ней, нейромедиаторных системах мозга (катехоламинэргической, холинэргической, ГАМК-эргической), что в определенной степени коррелирует с симптомами интоксикации.
Нейрофармакологические, биохимические и электрофизиологические исследования показывают, что ДЛК избирательно воздействует на нейрональные катехоламинэргические системы ретикулярной формации и других образований мозга. Отдельные симптомы отравления, такие, как моторная гиперактивность, тахикардия, гипертензия, мидриаз, гипертермия и другие, указывают на преобладание у отравленных симпатотонии.
Дофаминэргическая медиаторная система мозга представлена четырьмя основными отделами: стрионигральным, мезолимбическим, фронтальным, тубероинфундибулярным. Тела нейронов этих отделов залегают в области черной субстанции и межножкового ядра среднего мозга, и иннервируют соответственно: стриатум, мезолимбические структуры, фронтальные отделы коры мозга и некоторые ядра гипоталамуса.
ДЛК активирует ДА-эргические нейроны всех отделов системы (дофаминомиметическое действие). При этом активируется процесс синтеза нейромедиатора, ускоряется его оборот в стриатуме, гипоталамусе, лимбических ядрах. Ускорение оборота приводит к снижению уровня дофамина в соответствующих структурах мозга. Активируются и другие катехоламинэргические системы. В последнее время получены убедительные данные, свидетельствующие о снижении у животных под влиянием ДЛК уровня норадреналина, главным образом, в среднем мозге и гипоталамусе. По-видимому, ДЛК повышает активность и норадренэргических структур мозга (как показано, возбуждая α-адренорецепторы) вследствие чего увеличивается высвобождение норадреналина и развивается дефицит его функциональных запасов. О значении нарушений со стороны катехоламинэргических образований в патогенезе интоксикации ДЛК, говорит и то, что назначение отравленным животным аминазина (дофамин- и адренолитика) облегчает течение интоксикации, резерпин (истощает запасы катехоламинов в ЦНС), напротив, усиливает действие ДЛК.
Мероприятия медицинской защиты
Специальные санитарно-гигиенические мероприятия:
- проведение экспертизы воды и продовольствия на зараженность ОВТВ;
- запрет на использование воды и продовольствия из непроверенных источников.
Специальные лечебные мероприятия:
- своевременное выявление пораженных;
- применение средств патогенетической и симптоматической терапии состояний, угрожающих здоровью и дееспособности, в ходе оказания первой (само-взаимопомощь), доврачебной и первой врачебной (элементы) помощи пострадавшим;
- подготовка и проведение эвакуации.
Медицинские средства защиты
Табельные средства защиты отсутствуют. Частичными специфическими антагонистами ДЛК (физиологические антагонисты) являются нейролептики. Как известно в основе антипсихотического действия препаратов этой группы, лежит способность блокировать рецепторы дофамина (преимущественно D2- и D4-рецепторы, в меньшей степени D1-рецепторы), а также α1-рецепторы норадреналина и 5-НТ2-рецепторы. К числу нейролептиков относятся производные фенотиазина (аминазин, тиоридазин, трифлюоперазин и т.д.), тиоксантена (тиотикрен), бутирофенона (галоперидол), бензамида (метоклопрамид, диметпрамид) и т.д. Эти средства могут быть использованы для оказания помощи пострадавшим с целью ликвидации приступа паники, нормализации психического статуса, восстановления психической работоспособности. Наиболее эффективны: аминазин (50 - 75 мг внутримышечно), трифлюоперазин (2 - 6 мг внутримышечно), галоперидол (5 - 15 мг внутримышечно). Поскольку нейролептики блокируют не только DA- и α1-рецепторы, возбуждаемые ДЛК, но и НТ2-рецепторы, которые также блокируются токсикантом, антагонизм между лечебными средствами и ядом не полный. Отсюда ограничения эффективности препаратов. Попытка усилить антидотный эффект путем значительного увеличения дозы вводимых нейролептиков недопустима, т.к. при этом проявляется их центральное холинолитическое действие и психоз может усилиться (см. ниже).
При развитии психомоторного возбуждения, реакции беспокойства, страха возможно назначение симптоматических средств, в частности, бензодиазепинов (диазепам 2 - 10 мг через рот или внутримышечно).
Поскольку вещество отчасти в неизмененном состоянии выводится в просвет кишечника, откуда затем может повторно всасываться (энтеральная циркуляция), целесообразно назначить пострадавшим активированный уголь, солевое слабительное.
Эвакуация необходима лишь при развитии затяжных психозов.
12.1.2.2. Делириогены
Делирий способны вызывать все вещества, обладающие центральной холинолитической активностью. Издавна известны случаи отравлений беленой, дурманом, красавкой - растениями, содержащими алкалоиды атропин и скополамин. Дозы соответствующих лекарственных препаратов, вызывающих психодислептический эффект указаны в таблице 54.
Таблица 54.
“Психотомиметические” дозы некоторых холинолитиков, мг/кг
Вещество |
Доза |
Атропин Скополамин Пентафен Амизил Дитран |
0,08 – 0,12 0,04 – 0,06 3,0 – 4,0 0,1 – 1,0 0,04 – 0,12 |
Наряду с “классическими” холинолитиками, сходную клинику поражения могут вызывать лекарственные препараты из группы нейролептиков (производные фенотиазина) и некоторые трициклические антидепрессанты (фторацизин и др.), которые в высоких дозах также блокируют центральные М-холинорецепторы, т.е. проявляют свойства холинолитиков.
Основными проявлениями делирия являются:
- беспокойство;
- нарушение оценки своего состояния;
- спутанность сознания;
- галлюцинации;
- бред;
- нарушение контакта с окружающими;
- нарушение координации движений;
- гиперрефлексия;
- гипертермия;
- психомоторное возбуждение;
- амнезия.
В зависимости от действующей дозы токсикантов можно выделить несколько степеней тяжести острого отравления (табл. 55).
Таблица 55.
Степени тяжести и стадии течения интоксикаций атропиноподобными препаратами (по Крылову С.С. и соавт., 1999)
Степени тяжести |
Основные проявления |
Фазы течения |
Субпсихотическая |
Снижение работоспособности, ухудшение самочувствия |
Не прослеживаются |
Легкая |
Оглушенность, маниакально- и галлюцинозоподобные комплексы |
Астения с резидуальными состояниями |
Средняя |
“Субделирий” |
- Оглушенность - “Субделирий” - Критический сон - Астения |
Тяжелая |
Делирий, делириозноаментивные состояния |
- Оглушенность - Делирий - Критический сон - Астения (возможна энцефалопатия) |
Сверхтяжелая |
Делирий, сопор, кома, |
- Оглушенность - Делирий - Кома (при недостаточности лечения) - Астения (возможна энцефалопатия) |
Наиболее токсичным представителем группы является вещество BZ - производное хинуклединилбензилата, находящееся на снабжении армий некоторых государств в качестве ОВ несмертельного действия.
12.1.2.2.1. Вещество BZ
Физико-химические свойства. Токсичность
Это твердое кристаллическое, термостабильное вещество без цвета и запаха, устойчивое в водном растворе. Планируемый способ применения - аэрозоль (дым). Среднеэффективная токсодоза (ЕСt50) для человека составляет около 0,1 г мин/м3; среднесмертельная токсодоза - 110 г мин/м3. Возможно использование с диверсионными целями.
Токсикокинетика
В организм вещество проникает через легкие при ингаляции аэрозоля, либо через желудочно-кишечный тракт с зараженной водой и продовольствием. Через неповрежденную кожу в организм не проникает. При распределении в организме BZ легко преодолевает гематоэнцефалический барьер. Так, исследования, проведенные с использованием вещества, меченного радиоактивным изотопом, показали, что BZ быстро поступает в мозг и уже через 2,5 мин после внутривенного введения животным достигает максимальной концентрации в большинстве его структур. По уровню аккумуляции BZ структуры мозга располагаются в следующем порядке: полосатое тело > кора больших полушарий > гиппокамп > гипоталамус > мозжечок.
Проникший в мозг хинуклединилбензилат практически необратимо (по некоторым данным ковалентно) связывается с холинорецепторами, на много суток выводя их из строя. По-видимому, стабильность комплекса “вещество-рецептор” и определяет длительность психоза, развивающегося у пораженных.
Не связавшаяся часть токсиканта довольно быстро разрушается, в основном за счет гидролиза эфирной связи пиперидинового кольца с гликолиевой группой. В неизмененном виде с мочой выделяется менее 1% от введенного количества вещества.
Основные проявления интоксикации
В эксперименте на животных (крысы, собаки) при интоксикации BZ после непродолжительного латентного периода наблюдаются расстройства спонтанного поведения. Вначале извращаются движения животных (становятся замедленными, неуверенными). Затем нарастает оглушенность, снижаются или полностью исчезают реакции на внешние раздражители. На высоте интоксикации животные чаще лежат или бесцельно передвигаются по помещению, не способны преодолеть препятствия, встречающиеся на пути. Нарушения спонтанного поведения сохраняются на протяжении 6-8 ч. В последующем наблюдается слабость. Нарушение “выработанных” поведенческих навыков и срывы условно-рефлекторной деятельности также характерны для интоксикации. Одновременно регистрируются и вегетативные нарушения. Они проявляются тахикардией, сухостью слизистых носа, мидриазом. Электрофизиологическими методами определяется медленно-волновая, высокоамплитудная биоэлектрическая активность головного мозга.
Картина отравлений BZ у людей развивается через 15 - 20 минут (до нескольких часов) после воздействия. Она сходна с клиникой отравления другими холинолитиками. Симптоматика включает вегетативные, соматические и психические расстройства.
При действии BZ в малых дозах превалирует вегетативная симптоматика. Одновременно наблюдаются легкая заторможенность, безразличное отношение к окружающему, замедление мышления. Особенно чувствительными к действию психотомиметика являются такие функции мозга, как запоминание и активное внимание, нарушение которых приводит к полной утрате психической работоспособности. Критическое отношение к своему состоянию при этом не страдает.
Вдыхание аэрозоля BZ в достаточно высоких концентрациях приводит к развитию интоксикации, которая, по данным ВОЗ, характеризуется следующей динамикой (табл. 56).
Таблица 56.
Развитие интоксикации BZ средней степени тяжести
Время с начала интоксикации, ч |
Проявления |
1 - 4 |
головокружение, нарушение походки и речи, сухость во рту, мидриаз, парез аккомодации, тахикардия, рвота, гипертермия, спутанность сознания, оцепенение, переходящее в ступор. |
4 - 12 |
затруднение концентрации внимания, потеря логической связи мыслей, потеря связи с окружающей средой, зрительные, слуховые и осязательные галлюцинации, бред воздействия, агрессивное поведение, эмоциональная неустойчивость, нарушение координации движений, гиперемия кожи, выраженная тахикардия, задержка мочеиспускания. |
12 - 96 |
усиление симптоматики, психомоторное возбуждение, беспорядочное, непредсказуемое поведение; постепенное возвращение к нормальному состоянию в течение 2 - 4 дней; по выходе из состояния - полная амнезия |
Характерным проявлением тяжелой интоксикации является психомоторное возбуждение. При этом состоянии пораженные мечутся, не реагируют на препятствия, проявляют агрессивность и сопротивление при попытках ограничения их активности.
Приведенную динамику отравлений BZ следует рассматривать только как схему, поскольку характер симптоматики определяется совокупностью ряда факторов, включающих, помимо дозы ОВ, индивидуальные особенности пораженного.
Помимо центральных эффектов, при отравлении BZ, отмечаются периферические эффекты (соматические и вегетативные реакции). Важнейшими среди них являются нарушения сердечной деятельности (тихикардия) и гипертермия. В условиях повышенной температуры окружающего воздуха, при тяжелой интоксикации ВZ, возможен смертельный исход.
Механизм токсического действия
Основа механизма токсического действия BZ – блокада мускариночувствительных холинэргических структур в головном мозге и нарушение вследствие этого медиаторной функции ацетилхолина в синапсах ЦНС. ВZ - мощный центральный холинолитик, прочно связывающийся с М-холинорецепторами мозга (константа связывания с мембранами синаптосом, выделенных из ткани головного мозга крыс, кошек и обезьян имеет величину порядка 2.10-8 моль). Характер распределения BZ в ЦНС соответствует плотности М-холинорецепторов в структурах мозга: полосатое тело > кора больших полушарий > гиппокамп > гипоталамус > мозжечек. Известно, что ацетилхолину принадлежит важная роль в обеспечении равновесия процессов возбуждения и торможения в ЦНС, а холинергические механизмы лежат в основе многих форм поведения, включая обучение и память. В связи с этим понятно, что блокада холинорецепторов центральной нервной системы приводит к нарушению психической деятельности человека.
Влияние психотомиметика на холинэргическую передачу не ограничивается блокадой постсинаптических холинорецепторов. ВZ действует и на пресинаптические рецепторы, активность которых контролирует выброс ацетилхолина нервными окончаниями и интенсивность его оборота (по механизму обратной связи: возбуждение рецепторов ацетилхолином угнетает его выброс и снижает скорость оборота). Кроме того, токсикант вызывает усиленное высвобождение ацетилхолина в синаптическую щель и избыточное его разрушение ацетилхолинэстеразой, а также угнетает активность холинацетилазы, тормозя синтез ацетилхолина. В итоге запасы ацетилхолина в центральной нервной системе существенно истощаются (в норме содержание АХ в ткани мозга: 10 - 30 нМ/г ткани; скорость оборота: 2 - 20 нМ/г мин).
Снижение содержания ацетилхолина имеет функциональное значение. Об этом свидетельствует наличие корреляции между изменениями уровня ацетилхолина в мозге, ЭЭГ и поведением животных, возникающими под влиянием BZ. Существует предположение о прямой связи между степенью снижения содержания ацетилхолина в мозге с психотомиметическим действием холинолитических средств. Наряду с центральными, блокируются и периферические холинореактивные системы. Этим можно объяснить развитие вегетативных нарушений, наблюдаемых при отравлении BZ.
Поскольку в ЦНС существует тесное функционально-морфологическое взаимодействие нейронов, передающих нервный импульс с помощью различный нейромедиаторов, помимо нарушений холинэргических механизмов мозга при отравлении BZ, как и другими холинолитиками, отмечаются нарушения в системе норадренэргической, дофаминэргической, серотонинэргической медиации.
Многие симптомы, характерные для отравления BZ (например, периодические вспышки психомоторного возбуждения), могут быть объяснены гиперактивностью адренэргических медиаторных систем мозга. Нельзя исключить, что в больших дозах гликолаты могут тормозить синтез и обратный захват катехоламинов в синапсах мозга.
Мероприятия медицинской защиты
Специальные санитарно-гигиенические мероприятия:
- использование индивидуальных технических средств защиты (средства защиты органов дыхания) в зоне химического заражения;
- участие медицинской службы в проведении химической разведки в районе расположения войск; проведении экспертизы воды и продовольствия на зараженность ОВТВ;
- запрет на использование воды и продовольствия из непроверенных источников;
- обучение личного состава правилам поведения на зараженной местности.
Специальные профилактические медицинские мероприятия:
- проведение санитарной обработки пораженных на передовых этапах медицинской эвакуации.
Специальные лечебные мероприятия:
- своевременное выявление пораженных;
- применение антидотов и средств патогенетической и симптоматической терапии состояний, угрожающих жизни, здоровью, дееспособности, в ходе оказания первой (само-взаимопомощь), доврачебной и первой врачебной (элементы) помощи пострадавшим.
- подготовка и проведение эвакуации
Медицинские средства защиты
Специфическими противоядиями (функциональными антагонистами) при отравлении холинолитиками вообще и BZ в частности являются непрямые холиномиметики - обратимые ингибиторы холинэстеразы, способные проникать через гематоэнцефалический барьер, например галантамин, эзерин, аминостигмин и т.д. (Г.И. Мильштейн, Г.А. Софронов и др.). Механизмы антагонистических отношений между холинолитиками и ингибиторами холинэстеразы, рассмотрены выше (см. разделы “ФОС. Обратимые ингибиторы ХЭ”).
Недостатком обратимых ингибиторов, как антидотов BZ, является непродолжительность их действия. Вещества угнетают активность энзима всего на несколько часов, в то время как токсикант связывается с рецепторами синапсов очень прочно и на долго (до нескольких суток). В этой связи однократного введения антидотов бывает недостаточно - развиваются ремиссии интоксикации. Повторное введение обратимых ингибиторов с каждым разом становится все менее эффективным. Это дало повод рекомендовать для устранения психозов необратимые ингибиторы ХЭ (ДФФ, фосфорилтиохолины). Однако высокая токсичность и малая терапевтическая широта веществ, препятствует их применению в клинической практике.
Исходная доза и продолжительность введения обратимых ингибиторов ХЭ определяются степенью тяжести интоксикации. Препараты целесообразно назначать как можно раньше, желательно при появлении первых признаков интоксикации. Однако при этом важно установить, что нарушения психики обусловлены именно действием холинолитиков, а не психодислептиков с иным механизмом действия (например, ДЛК) или нейротоксикантов смертельного действия в малых дозах (ФОС, карбаматы, ГАМК-литики). Поскольку сделать это быстро практически невозможно, перед введением антидота, следует понаблюдать за пострадавшим и убедится, что в основе процесса лежит антихолинэргическое действие (ориентируясь в основном на характер вегетативных нарушений и особенности нарушения психики).
При легкой степени поражения BZ для восстановления нормальной психической деятельности препараты вводят внутримышечно: аминостигмин – 2 мл 0,1% раствора внутримышечно; галантамин - 2 мл 0,5% раствора; эзерин - 2 мл 0,05%. Если лечебный эффект недостаточно полный, препараты следует вводить повторно через 30-60 мин до исчезновения симптомов отравления.
При средних и тяжелых формах отравления показано раннее многократное введение обратимых ингибиторов холинэстеразы дробными дозами. Так, аминостигмин в первые-третьи сутки следует вводить 3 – 5 раз; галантамин вначале следует вводить внутримышечно или внутривенно в 1% растворе по 2-3 мл. В последующем через каждые 30-40 мин по 1-2 мл 0,5% раствора до получения позитивного эффекта.
Поскольку помимо холинэргических механизмов в действии BZ на мозг присутствует и другие механизмы (в частности активация катехоламинэргических механизмов) при тяжелых отравлениях устранить патологические эффекты с помощью только холиномиметиков не представляется возможным. Чрезвычайно сложным, но вместе с тем и ответственным мероприятием при интоксикации является борьба с психомоторным возбуждением. Из медикаментозных средств для этой цели, прежде всего, рекомендуют нейролептики, лишенные холинолитической активности, например трифтазин (0,2% - 1,0 мл).
Кроме нейролептиков для борьбы с психомоторным возбуждением могут быть использованы симптоматические средства: бензодиазепины (диазепам) и наркотические аналгетики (промедол: 2 мл 2% раствора внутримышечно).
Для устранения нарушений, обусловленных периферическим холинолитическим действием ОВ (тахикардия, сухость кожи, нарушение функции кишечника, задержка мочевыделения и др.) и усиления действия антидотов, показано применение ингибиторов ХЭ не проникающих через ГЭБ, например прозерина в виде 0,05% раствора по 3-5 мл внутримышечно.
При выраженной тахикардии (порой угрожающей жизни) показаны препараты с β-адреноблокирующим действием, например анаприлин (пропранолол), который следует вводить внутримышечно в дозе 2 мл 0,25% раствора. Блокируя β-рецепторы синусного узла и обладая мембраностабилизирующим действием, эти препараты устраняют активирующее влияние на сердце симпатической иннервации и адреналина и нормализуют сердечный ритм.
После купирования (по возможности) проявлений острого психоза, пораженные должны быть эвакуированы в специализированные медицинские учреждения, и оставаться под наблюдением психиатра не менее недели. Длительность наблюдения определяют индивидуально в зависимости от тяжести перенесенной интоксикации.
12.1.2.2.2. Фенциклидин (сернил)
Это вещество, впервые синтезировано в 50-е годы, как средство для наркоза (один из аналогов кетамина). В процессе испытаний была выявлена его высокая психодислептическая активность. В медицине в настоящее время не используется. В ветеринарии применяют как анестезирующее средство. Вещество изучалось военными ведомствами на предмет создания на его основе ОВ. Возможно использование в качестве диверсионного агента.
Физико-химические свойства. Токсичность
Бесцветное кристаллическое вещество, хорошо растворимое в воде. Эффективная доза - 0,02 - 1 мг/кг.
Токсикокинетика
Вещество всасывается в желудочно-кишечном тракте и быстро распределяется в органы, хорошо снабжаемые кровью. Обладая высокой липофильностью, легко проникает в мозг. Затем происходит перераспределение токсиканта и накопление его в тканях с низкой интенсивностью гемоперфузии. Вещество метаболизируется в печени. Конечным продуктом метаболизма является пиперидин (вещество с запахом рыбы), выделяющийся в том числе и через легкие. Период полуэлиминации составляет около 11 часов. Частично выводится в неизмененном виде (до 9%) печенью и почками.
Основные проявления интоксикации
При приеме вещества в количестве 5 мг развивается состояние, напоминающее опьянение, появляются галлюцинации, нарушается чувство времени. Проявления интоксикации фенциклидином, в зависимости от действующей дозы, представлены на таблице 57.
Таблица 57.
Проявления интоксикации фенциклидином в зависимости от дозы
Доза, мг |
Проявления интоксикации |
5 – 10 |
Атаксия, нистагм, деперсонализация, нарушение чувства времени, ухудшение настроения, галлюцинации, парестезии, тошнота, рвота. Начало: 1 - 2 часа; продолжительность: 4 - 8 часов |
10 – 20 |
Ступор, гиперрефлексия, гипертензия, стереотипии, нистагм, миоз. Начало: 0,5 - 1 час; продолжительность: 8 - 24 часа |
50 – 100 |
Нистагм, гипотензия, брадикардия, затруднение дыхания, судорожные приступы, кома. Продолжительность: до 4 суток, амнезия. |
более 100 |
Гипертермический криз, угнетение дыхания, смерть в течение 3 - 10 суток от остановки дыхания |
Характерными нарушениями, возникающими при легком отравлении сернилом, являются апатия, эмоциональное безразличие, утрата побуждения к действию, инициативы. Пораженный испытывает сонливость, указывают на чувство нереальности окружающего и ощущение глубокого изменения собственной личности.
При более высоких дозах появляются кататонические расстройства (восковая ригидность мышц), расстройства мышления (нелогичность суждений, конфабуляции)
Психозы, развивающиеся при отравлении сернилом, характеризуются грубым расстройством “схемы тела”, развитием делириозного состояния: зрительными и слуховыми галлюцинациями, бредом, агрессивным поведением, буйством.
Механизм токсического действия
В основе токсического действия фенциклидина лежит способность блокировать проведение нервных импульсов в глютаматэргических синапсах центральной нервной системы. Глютамат - возбуждающий медиатор ЦНС. Выявлено несколько подтипов рецепторов к этому нейротрансмиттеру. Основными являются: каинатный (избирательный агонист - каиновая кислота), АМПА-рецептор (агонист - α-амино-3-гидрокси-5-метил-4-изоксазол пропионовая кислота), НМДА-рецептор (агонист - N-метил-D-аспртат). Фенциклидин - блокатор НМДА-рецепторв глютатамата. Наибольшая плотность этих рецепторов в мозге выявляется в ядрах таламуса. Как известно таламус - “релейная” структура, в которую стекается вся сенсорная информация, получаемая мозгом. Здесь она обрабатывается и передается в кору головного мозга. Фенциклидин, нарушая передачу нервных импульсов в глютамтэргических синапсах таламуся, выступает в качестве разобщителя, между структурами, передающими в ЦНС информацию, поступающую от проприоцеторов и органов чувств, и воспринимающими ее (кора мозга). За счет этого реализуется не только аналгезирующее действие вещества (аналог кетамина), но одновременно и его психодислептическое действие.
При действии больших доз токсиканта отмечаются нарушения со стороны и других нейромедиаторных систем (холинэргической, дофаминэргической, адренэргической).
Мероприятия медицинской защиты
Специальные санитарно-гигиенические мероприятия:
- использование индивидуальных технических средств защиты (средства защиты органов дыхания) в зоне химического заражения;
- участие медицинской службы в проведении химической разведки в районе расположения войск; проведение экспертизы воды и продовольствия на зараженность ОВТВ;
- запрет на использование воды и продовольствия из непроверенных источников;
- обучение личного состава правилам поведения на зараженной местности.
Специальные профилактические медицинские мероприятия:
- проведение санитарной обработки пораженных на передовых этапах медицинской эвакуации.
Специальные лечебные мероприятия:
- своевременное выявление пораженных;
- применение средств патогенетической и симптоматической терапии состояний, угрожающих жизни, здоровью, дееспособности пораженного, в ходе оказания первой (само-взаимопомощь), доврачебной и первой врачебной (элементы) помощи пострадавшим.
- подготовка и проведение эвакуации
Медицинские средства защиты
В настоящее время медицина не располагает веществами, способными избирательно возбуждать НМДА-рецепторы и устранять эффекты токсиканта. С целью оказания неотложной помощи при интоксикациях, сопровождающихся психомоторным возбуждением, буйством, судорогами целесообразно назначение диазепама (5 - 10 мг, внутривенно или внутримышечно). В эксперименте введение диазепама в дозе 0,2 - 0,3 мг/кг внутривенно за 5 минут до фенциклидина существенно снижает риск развития психоза. Назначение нейролептиков при отравлении фенциклидином противопоказано. В эксперименте на лабораторных животных аминазин усиливает проявления интоксикации веществом. Необходима эвакуация пострадавшего в специализированное лечебное учреждение.
12.2. Вещества, вызывающие
органические повреждения нервной системы
В основе токсического действия веществ рассматриваемой группы, как правило, лежат нарушения пластического обмена в нервной системе, сопровождающиеся её структурно-морфологическими изменениями. Механизмы действия токсикантов, благодаря которым они вызывают нарушения, многообразны и малоизученны. Проявления токсического процесса часто зависят не столько от механизма действия веществ, сколько от анатомического образования, на которое они подействовали, т.е. особенностей их токсикокинетики. Характерной особенностью поражения является медленное, постепенное развитие, часто прогрессирующее и после прекращения действия токсиканта. Следствием острой интоксикации чаще является длительно текущий, хронический патологический процесс, инвалидизация пораженных, а не их гибель в острой фазе интоксикации. Перечисленные особенности сближают вещества рассматриваемой группы с ОВТВ цитотоксического действия. Их отличительная особенность – чрезвычайно высокое сродство к нервной системе.
К числу веществ, вызывающих органические повреждения структур центрального и периферического отделов нервной системы, имеющих военно-медицинское значение, относятся некоторые металлы и металлорганические соединения (таллий, тэтраэтилсвинец и др.).
12.2.1. Таллий
Физико-химические свойства. Токсичность
Таллий принадлежит к группе алюминия. Атомное число - 81, атомный вес – 204,4. Это кристаллический, бело-голубой металл. В своих соединениях встречается в одно- и трехвалентной форме. На воздухе окисляется, покрываясь пленкой коричневато-черного оксида. Таллий высокоактивный элемент, растворимый в кислотах. Известно, по крайней мере, 18 природных соединений таллия, среди которых оксид таллия (Tl2O3), ацетат таллия (CH3COOTl), карбонат таллия (Tl2CO3), хлорид таллия (TlCl), иодид таллия (TlJ), сульфат таллия (Тl2SO4). Растворенные в воде соли образуют безвкусные, бесцветные, лишенные запаха растворы. Наиболее распространенное соединение – сульфат таллия.
Таллий – сильный токсикант, поражающий центральную и периферическую нервную систему, желудочно-кишечный тракт, почки, кожу и ее придатки. Он опасен при остром, подостром и хроническом воздействии. Производные одновалентного талия более токсичны, чем трехвалентного. ЛД50 сульфата таллия для мышей составляет 35 мг/кг, хлорида таллия - 24 мг/кг. Не смертельные, но вызывающие тяжелые нарушения со стороны нервной системы, дозы в десятки раз меньше. Токсичность металла для человека значительно выше, чем для грызунов.
Источники. Производство. Использование
Металл был открыт в 1861 году Вильямом Крукесом. Его высокая токсичность была обнаружена уже в 1863 году.
Таллий добывают из металлсодержащих руд, а также в качестве побочного продукта при получении кадмия, свинца, цинка.
В развитых странах основные области потребления таллия - это производство электроники, фотоэлектрических элементов, ламп, сцинтилляционных счетчиков. Таллий также применяют для изготовления оптических линз, красителей, как катализатор в химическом синтезе, в производстве искусственных ювелирных изделий.
В 1920 г. в Германии соли таллия начали применять в качестве пестицидов (инсектицидов и средств для борьбы с грызунами). Действующий агент содержал 2% сульфата таллия. Стойкость вещества в окружающей среде и кумуляция в организме млекопитающих сделали его идеальным родентицидом. Именно в качестве пестицида таллий стал причиной отравлений человека. В 1965 году использование таллия в качестве пестицида в США было запрещено, однако в других странах мира он продолжает использоваться с этой целью.
В военной токсикологии таллий рассматривается как возможный диверсионный агент (З. Франке). Поражение наиболее вероятно при приеме воды и/или пищи, зараженной металлом.
Токсикокинетика
Острые отравления таллием, как правило, являются следствием случайного или преднамеренного приема больших доз солей металла per os. Возможны также ингаляционные поражения металлической пылью или парами металла, а также отравления при попадании его на кожу.
Всасывание вещества осуществляется всеми возможными путями: через кожу, слизистые желудочно-кишечного тракта и дыхательных путей, - быстро (в течение 1 часа) и практически полностью (в опытах на грызунах – до 100% нанесенного вещества). Соединения таллия в руках неопытного человека представляют большую опасность, как для него самого, так и для окружающих.
После проникновения в кровь элемент быстро распространяется в организме. Наибольшее количество концентрируется в почках. Высокое содержание определяется также в слюнных железах, сердечной мышце, печени. Концентрация в жировой ткани и мозге относительно невелика.
Основные пути выделения – через почки и желудочно-кишечный тракт. Слюнными железами таллия выделяется в 15 раз больше, чем почками. Однако выделившееся со слюной вещество опять поступает в кишечник, где вновь всасывается. Период полувыведения из организма человека - около 30 суток. Даже в тех случаях, когда в моче и фекалиях обнаруживаются достаточно высокие содержание металла, концентрация его в плазме крови относительно невысока.
Основные проявления интоксикации
Основные проявления интоксикации таллием представлены в таблице 58.
Таблица 58.
Основные проявления интоксикации таллием
Острое отравление |
тошнота, рвота, боли в животе, желудочно-кишечные кровотечения, тремор, атаксия, нейропатия черепномозговых нервов (птоз, офтальмоплегия, неврит лицевого нерва и др.), психоз, судороги, кома, параличи, мышечная атрофия |
Подострое отравление |
Утомляемость, эмоциональные нарушения, атаксия, дистальная парастезия, дистальная мышечная слабость, восходящая нейропатия, полиневрит, психозы, дерматит (эритема, изменение ногтей, шелушение кожи), запоры |
При однократном приеме даже высоких доз токсиканта клиника развивается после продолжительного скрытого периода (до 12 - 14 часов и более). При пероральной интоксикации первыми симптомами являются тошнота, рвота, общая слабость, бессонница, усиленное слюноотделение. Затем, в течение последующих 2 - 14 дней появляются боли в животе, запоры, ощущение тяжести в желудке. Другие клинические проявления интоксикации таллием развиваются также медленно в течение нескольких недель. Одним из ранних признаков отравления таллием является симптом Види: черное веретенообразное утолщение длиной 1 мм в прикорневой части растущего волоса. Поражения кожи проявляются эритемой, ангидрозом, симптомами себорреи, потерей волосяного покрова, шелушением кожных покровов, нарушением нормального рост ногтей.
Неврологические симптомы характеризуются невритами, преимущественно нижних конечностей. Появляются характерные сенсорные нарушения в виде парестезий, онемения конечностей, болезненности по ходу нервных стволов. Чем тяжелее интоксикация, тем быстрее формируются и в большей степени выражены проявления. Через 1-3 недели развивается атаксия, тремор конечностей, болезненность по ходу нервов усиливается. Мышечные рефлексы сохраняются обычно достаточно долго. В процесс вовлекаются краниальные нервы (нистагм, скатома, офтальмоплегия). Поражение блуждающего нерва сопровождается тахикардией, умеренной гипертензией, парезом кишечника. Психические расстройства проявляются депрессией и психозом. Выздоровление происходит медленно и растягивается на месяцы.
При тяжелых смертельных интоксикациях после скрытого периода появляются рвота, кровавый понос, беспокойство, чувство тревоги, делирий, галлюцинации, судороги, кома. Смерть развивается в течение нескольких суток в результате угнетения сердечной деятельности, шока, нарушения функций почек. При вскрытии обнаруживаются: воспаление слизистой кишечника, жировая дегенерация печени и почек, отек и кровоизлияния в миокарде и мозге.
Механизм токсического действия
В основе токсического действия таллия лежит его способность повреждать клеточные структуры, в которых он накапливается (цитотоксичность). Механизм повреждающего действия изучен недостаточно. Как и другие металлы, вещество может вступать во взаимодействие с многочисленными эндогенными лигандами, нарушая свойства биомолекул. Некоторое значение имеет образование химических связей с низкомолекулярными веществами, например цистеином. За счет этого взаимодействия талий накапливается в клетках кожи, ее придатках, и вызывает их поражение. Однако можно предположить, что основными молекулами-мишенями являются структурные белки, каталитические центры ферментов, транспортные системы биомембран.
Действие таллия на белки может приводить к перераспределению зарядов внутри макромолекул, и, в результате, изменению их третичной структуры и биологической активности. Таллий взаимодействует с митохондриями, эндоплазматическим ретикулумом, лизосомами, вызывая их повреждение. Внешняя поверхность клеточной мембраны первой взаимодействует с металлом, поэтому именно здесь, прежде всего, образуются прочные связи металла с лигандами. Нарушаются механизмы трансмембранного движения ионов и других биологически активных веществ.
Токсическое действие таллия на нервные клетки и миоциты, как полагают, во многом обусловлено его конкуренцией с ионом калия. Токсикант накапливается преимущественно внутриклеточно, замещает К+ в биосредах. Показано, что талий является конкурентом калия за трансмембранный перенос ионов (блокатор “Na-K-АТФ-азного насоса”). Как известно калий участвует в формировании потенциала покоя возбудимых мембран, и ответственен за восстановление потенциала биомембраны после ее деполяризации, лежащей в основе формирования потенциала действия (см. выше). Замещение калия таллием в возбудимых клетках приводит к тому, что процесс реполяризации клеточных мембран после формирования потенциала действия (и приведение системы в “исходное” состояние) замедляется. Клетки становятся более чувствительными к возбуждающему сигналу.
Мероприятия медицинской защиты
Специальные санитарно-гигиенические мероприятия:
- проведение экспертиза воды и продовольствия на зараженность ОВТВ;
- запрет на использование воды и продовольствия из непроверенных источников.
Специальные лечебные мероприятия:
- своевременное выявление пораженных;
- применение антидотов и средств патогенетической и симптоматической терапии состояний, угрожающих жизни, здоровью, дееспособности, в ходе оказания первой (само-взаимопомощь), доврачебной и первой врачебной (элементы) помощи пострадавшим.
Средства медицинской защиты
При пероральном отравлении рекомендуют промыть желудок 1% раствором иодистого натрия или 3% раствором тиосульфата натрия.
В настоящее время специальные средства медицинской защиты отсутствуют. Они могут быть разработаны на основе препаратов, ускоряющих выведение таллия из организма. В опытах на животных известной активностью обладали комплексообразователи диэтилдитиокарбамат (дитиокарб: 30 мг/кг в сутки, через рот) и дифенилтиокарбазон (дитизон: 20 мг/кг в сутки, через рот). Однако по данным некоторых авторов введение этих препаратов при тяжелой острой интоксикации приводит к перераспределению таллия в организме с усилением комы. По-видимому, дитиокарб образует с токсикантом липофильный комплекс, облегчающий поступление металла в ЦНС.
Хотя калий и таллий – конкуренты за механизм активного транспорта через клеточные мембраны, и калий в высоких дозах вытесняет таллий из связи с внутриклеточными рецепторами, назначение только препаратов калия в ряде случаев приводит к усилению симптомов интоксикации в результате нежелательного перераспределения металла внутри организма. Поэтому в некоторых исследованиях рекомендуют применение хлористого калия в сочетании с активированным углем. При использовании этого комплекса средств, схема оказания помощи следующая: КCl – 20 милиэквивалента 4 раза в сутки; активированный уголь – 20-30 грамм 4 раза в сутки. Оба препарата - per os (терапия продолжается в течение нескольких недель, а иногда и месяцев).
Имеются указания на эффективность использования при острой интоксикации таллием прусского голубого (ферроцианоферрат калия). Препарат назначают per os в дозе 250 мг/кг в сутки в 50 мл 15% маннитола в два приема (до 10 грамм два раза в день). Прусский голубой не всасывается в желудочно-кишечном тракте. Ион калия, образующийся при диссоциации вещества в кишечнике, всасывается во внутренние среды организма и вытесняет таллий, который, выделяясь в просвет кишечника, связывается с ионом ферроцианоферрата и выводится из организма.
Есть сообщения об эффективности бензодиазепинов при судорогах и возбуждении, вызванных таллием. Однако эти препараты, хотя и облегчают оказание помощи пораженным, не сказывается на общем течении токсического процесса.
12.2.2. Тетраэтилсвинец (ТЭС)
С 1923 года ТЭС применяют в качестве антидетонатора. В чистом виде вещество не используется, а идет на приготовление этиловой жидкости, которую добавляют к различным сортам бензина, с целью улучшения их эксплуатационных свойств. За последние десятилетия производство вещества непрерывно возрастает. Большая часть расходуемого во всем мире горючего этилировано тэтраэтилсвинцом.
ТЭС обладает высокой токсичностью, и поэтому до начала второй мировой войны рассматривался как возможное ОВ. По программе англо-американских военно-химических исследований токсикология свинецорганических соединений была изучена систематически. В настоящее время военное применение ТЭС отрицают. Однако вещество следует рассматривать как чрезвычайно опасный промышленный агент, могущий при авариях и катастрофах стать причиной формирования зон химического заражения и очагов поражения людей.
Физико-химические свойства. Токсичность
Тетраэтилсвинец (ТЭС) - Pb(C2H5)4 - металлорганическое соединение, в котором атом свинца ковалентно связан с четырьмя этильными радикалами. Это маслянистая жидкость, практически не растворимая в воде, но хорошо растворяющаяся в жирах и органических растворителях, легко проникает через одежду, обувь, сорбируется штукатуркой, бетоном, древесиной. Не замерзает при температурах до - 1300 С. ТЭС летуч, и при 200С насыщенный его парами воздух содержит свыше 5 г/м3 вещества. Пары - в 11,2 раз тяжелее воздуха. В малых концентрациях имеет ароматический, сладковатый запах; в высоких - резкий, неприятный. Образует зоны стойкого химического заражения. Дегазация ТЭС, в результате которой он превращается в неорганические соединения, возможна при обработка поверхностей растворами хлористого водорода в дихлорэтане. Лабораторную посуду рекомендуют дегазировать бромной водой или растворами хлорной извести. Среднесмертельная концентрация для крыс при внутрибрюшинном способе введения составляет около 10 мг/кг массы. Несмертельные поражения, сопровождающиеся тяжелыми и стойкими нарушениями функций нервной системы, развиваются при действии вещества в значительно меньших дозах. Люди более чувствительны к действию токсиканта, чем экспериментальные животные. Отравления людей наблюдались при ингаляции паров ТЭС в концентрации около 0,0015 г/м3.
Токсикокинетика
В виде пара вещество может проникать в организм ингаляционно и через неповрежденную кожу; в жидком виде - через кожу; через рот - с продовольствием, контаминированным токсикантом. В течение 3 - 4 суток ТЭС в неизмененном виде обнаруживается в крови и тканях. Легко проникает через гематоэнцефалический барьер в мозг. Постепенно в результате метаболизма в печени и других органах ТЭС превращается в триэтилсвинец, с образованием которого и связывают развитие патологии. Триэтилсвинец длительно (до 20 суток) определяется в крови, постепенно локализуясь в печени и ЦНС. Наибольшее количество вещества депонируется в таламусе, гипоталамусе, стриатуме, фронтальных отделах коры больших полушарий мозга - структурах, плотно иннервируемых дофаминэргическими нервными окончаниями. В дальнейшем вещество разрушается до неорганического свинца, который частично откладывается в тканях, а частично выводится с мочой и калом.
Основные проявления интоксикации
Вещество не оказывает местного действия ни на кожные покровы, ни на слизистые глаз, органов дыхания или желудочно-кишечного тракта. Симптомы резорбтивного действия вещества появляются после скрытого периода продолжающегося от 10 часов до 10 суток (чаще до 2 суток). В основе острого токсического процесса лежат нарушения функций ЦНС, главным проявлением которых является острый интоксикационный психоз.
Различают молниеносную (развивается при действии чрезвычайно высоких доз ТЭС) и затяжную формы острого отравления. Весь период развития тяжелой интоксикации разделяют на скрытый период, начальный период, период разгара заболевания, период выздоровления (Е.В. Ермаков, 1963).
В начальном периоде пострадавшие предъявляют жалобы на слабость, быструю утомляемость, головную боль, потерю аппетита, усиленное слюнотечение, расстройства сна (бессонница, кошмарные сноведения). Позже присоединяются артралгии, миалгии, боли в области груди и живота. Характерны вегетативные нарушения, такие как повышенная саливация, потливость и т.д. Ранними объективными признаками отравления являются гипотония (АД до 80/40 мм Hg), брадикардия (до 40 ударов в минуту) и гипотермия (до 350С). В ряде случаев эти нарушения могут длительно сохраняться (недели) и быть единственными признаками поражения. При более тяжелых вариантах течения, у отравленных обнаруживаются признаки органического поражения центральной нервной системы: атаксия, тремор, амимия, оглушенность или эйфория, нарушение памяти, тактильные иллюзии (ощущение инородного тела во рту). При легких отравлениях процесс более не прогрессирует, но период выздоровления продолжается 2 - 4 недели.
Период разгара характеризуется клиникой острых нервно-психических нарушений. Формируется делириозный симптомокомплекс: устрашающие зрительные (реже тактильные, обонятельные, слуховые) галлюцинации, бред преследования, физического воздействия, психомоторное возбуждение, нарушение ориентации в окружающей обстановке. Температура тела резко повышается (до 400). Усиливаются признаки органического поражения мозга: отмечается атаксия, дизартрия, нарушение координации движений, птоз, парез лицевого нерва, патологические рефлексы, появляются приступы беспорядочных сокращений различных групп мышц или мышц всего тела. При крайне тяжелых отравлениях ТЭС психомоторное возбуждение может смениться депрессией, адинамией, гипотонией (пульс становиться учащенным, нитевидным). Нарушается дыхание, развивается цианоз, иногда формируется отек легких (признак острой сердечной недостаточности). На этом фоне пострадавшие нередко погибают. Со стороны других внутренних органов особых изменений обычно не наблюдается (незначительное увеличение печени).
Если не наступил летальный исход болезнь переходит в период выздоровления, который продолжается в течение 2-х и более месяцев. У больных нарушена память, отмечаются утомляемость, вялость, заторможенность (признаки кататонии), кошмарные сновидения, галлюцинации. Хотя возможны и благоприятные исходы, часто случаи отравления заканчиваются стойкими нарушениями психики
Механизм токсического действия
ТЭС обладает прямым цитотоксическим действием на нервные клетки, вызывая их повреждение вплоть до некробиоза и некроза. В большей степени повреждаются структуры мозга, в которых вещество преимущественно накапливается (см. выше). Гибель нервных клеток лежит в основе органического синдрома поражения мозга. Механизм цитотоксичности ТЭС до конца не выяснен. Полагают, что в основе процесса лежит нарушение пластического обмена в клетках, обусловленное ковалентным связыванием свинца с биомолекулами, в состав которых входят амино-, карбокси-, имидазол-, фосфатные и SH-группы. Результатом такого взаимодействия является денатурация молекул, нарушение их свойств и функций. Свинец, высвободившийся в нервных клетках, в результате метаболических превращений, из связи с алкильными радикалами, конкурирует здесь с двухвалентными металлами, такими как Ca2+ и Zn2+. В итоге угнетается активность большого числа ион-зависимых энзимов (аденилатциклазы, Na-K-АТФазы и т.д.), нарушается синтез белка в клетках, повреждаются процессы, проходящие в митохондриях (угнетение окисления жирных кислот, декарбоксилирования пировиноградной кислоты, снижаются запасы макроэрогов) и т.д.
Существенно страдает обмен дофамина в ЦНС, свидетельством чего является увеличение потребления тирозина тканями мозга; усиливается выброс дофамина окончаниями дофаминэргических нейронов в стриатуме, гипоталямусе, лобных отделах коры мозга; нарушается обратный захват нейромедиатора соответствующими нейронами клеток. Одновременно повышается тонус холинэргических структур: уровень ацетилхолина в ткани мозга возрастает, активность холинэстеразы снижается. Повреждение дофаминэргических и холинэргических систем мозга обусловлено тесным структурно-функциональным взаимодействием этих двух нейромедиаторных систем ЦНС.
Мероприятия медицинской защиты
Специальные санитарно-гигиенические мероприятия:
- использование индивидуальных технических средств защиты (средства защиты кожи; средства защиты органов дыхания) в зоне химического заражения;
- участие медицинской службы в проведении химической разведки в районе расположения войск, экспертиза воды и продовольствия на зараженность ОВТВ;
- запрет на использование воды и продовольствия из непроверенных источников;
- обучение личного состава правилам поведения на зараженной местности.
Специальные профилактические медицинские мероприятия:
- проведение санитарной обработки пораженных на передовых этапах медицинской эвакуации.
Специальные лечебные мероприятия:
- своевременное выявление поражонных;
- применение средств патогенетической и симптоматической терапии состояний, угрожающих жизни, здоровью, дееспособности, в ходе оказания первой (само-взаимопомощь), доврачебной и первой врачебной (элементы) помощи пострадавшим;
- подготовка и проведение эвакуации.
Медицинские средства защиты
Для целей медицинской защиты необходимо использовать средства, препятствующие всасыванию вещества во внутренние среды организма и симптоматические средства, облегчающие течение токсического процесса. Специфические противоядия ТЭС не разработаны.
Для частичной санитарной обработки открытых участков кожи, зараженной ТЭС, в зависимости от условий можно использовать: ИПП, бензин и керосин с последующим обмыванием кожи теплой водой с мылом, 10 - 15% раствор дихлорамина или монохлорамина в 700 спирте. Для промывания глаз рекомендуют 0,25 - 0,5% водный раствор монохлорамина. С целью предотвращения всасывания яда из желудочно-кишечного тракта вызывают рвоту, назначают активированный уголь, проводят зондовое промывание желудка.
Медикаментозные средства. Хотя в моче отравленных в течение длительного времени в малых количествах определяется свинец назначение комплексообразователей (унитиол, пентацин и т.д.) неэффективно. Тем более неэффективно назначение этих средств на догоспитальном этапе, поскольку действующим фактором, инициирующим развитие токсического процесса, являются органические соединения свинца (тетраэтилсвинец, триэтилсвинец), не связывающиеся комплексонами.
При появлении признаков психомоторного возбуждения (на догоспитальном этапе) назначают седативные средства: барбитураты, бензодиазепины, нейролептики, 25% раствор сернокислой магнезии (по 3 - 5 мл внутривенно). Облегчая течение интоксикации, эти средства тем не менее не устраняют проявлений токсического процесса, обусловленные органическим повреждением нервной ткани. Применение наркотических аналгетиков противопоказано!