Аналитическая химия. Практикум : учеб. пособие / Харитонов Ю.Я., Григорьева В.Ю. - 2009. - 296 с.
|
|
|
|
Тема IV КАЧЕСТВЕННЫЙ АНАЛИЗ АНИОНОВ
На изучение темы отводятся три (или четыре) занятия, включающие краткое рассмотрение основных теоретических положений, решение задач по теме и экспериментальную часть - проведение аналитических реакций анионов (два или три занятия) и анализ их смеси (одно занятие).
Цель изучения темы
На основе знаний химико-аналитических свойств анионов - проводить характерные аналитические реакции анионов, определять их подлинность, анализировать их смеси.
Целевые задачи
1. Изучить различные классификации анионов по группам.
2. Научиться проводить аналитические реакции анионов по классификации, основанной на образовании анионами малорастворимых солей бария и серебра.
3. Научиться проводить аналитические реакции некоторых органических анионов.
4. Научиться проводить анализ смеси анионов.
5. Научиться решать задачи по применению закона действующих масс к окислительно-восстановительным равновесиям и равновесиям комплексообразования.
Введение
1. Аналитическая классификация анионов по группам
Как и катионы, многие анионы входят в состав лекарственных препаратов. При контроле качества лекарственных средств, технологических стадий их получения, лекарственного сырья и в ряде других случаев возникает необходимость проведения качественного и количественного анализа анионов. Идентификацию анионов чаще всего про-
водят с использованием различных аналитических реакций, позволяющих открывать эти анионы.
В Государственную Фармакопею включены общие реакции на подлинность для целого ряда анионов: на ацетат-ионы CH3COO-,бензо-ат-ионы C6H5COO-, бромид-ионы Br-, йодид-ионы I-, карбонат-ионы CO2" и гидрокарбонат-ионы HCO3, арсенит-ионы AsO3" и арсенат-ионы AsO3", нитрат-ионы NO3, салицилат-ионы HOC6H4COO-,суль-фат-ионы SO4" ,cульфит-ионыSO33, тартрат-ионы C4H4O2~, фосфат-ионы PO433, хлорид-ионы C1-, цитрат-ионы C6H5O373. Во временные фармакопейные статьи, в другую нормативную документацию на различные лекарственные средства введены качественные аналитические реакции и на другие анионы, не указанные в общих фармакопейных статьях.
При испытаниях лекарственных препаратов на чистоту и допустимые пределы примесей в них предусматривается проведение качественных реакций на хлориды и сульфаты.
0бычно открытие анионов в фармацевтическом анализе осуществляют с использованием различных качественных аналитических реакций в растворах на тот или иной анион.
Аналитическая классификация анионов по группам, в отличие от аналитической классификации катионов, разработана не столь подробно. Не существует общепризнанной и повсеместно принятой классификации анионов по аналитическим группам. 0писаны различные классификации анионов.
Чаще всего принимают во внимание растворимость солей бария и серебра тех или иных анионов и их окислительно-восстановительные свойства в водных растворах. В любом случае удается логически разделить на группы только часть известных анионов, так что всякая классификация анионов ограничена и не охватывает все анионы, представляющие аналитический интерес.
В табл. 8 и 9 приведены примеры классификации анионов по аналитическим группам.
При аналитической классификации анионов, основанной на образовании ими малорастворимых солей бария и серебра, анионы, охваченные этой классификацией, делят обычно на три группы (табл. 8).
К первой группе относят анионы, образующие малорастворимые в воде (в нейтральной или слабощелочной среде) соли с катионами бария Ba2+. Групповым реагентом является обычно водный раствор хлорида бария BaC12 В табл. 8 в эту первую группу включены 10 анионов: сульфат-анион SO2", сульфит-анион SO3", тиосульфат-анион S2O2~,
Примечания.
1Во вторую группу иногда включают также бензоат-анион C6H5COO-.
2 Бромат-ион иногда относят к III группе, так как бромат серебра AgBrO3 растворяется в разбавленной HNO3.
3 Сульфид серебра Ag2S растворяется при нагревании в растворе HNO3.
4 Иногда к III группе относят перхлорат-анион C1O", салицилат-анион HOC6H4COO- и некоторые другие анионы.
оксалат-анион C2O2", карбонат-анион CO3", тетраборат-анион B4O2" (сюда же относятся анионы и мета-борной кислоты BO"), фосфат-анион (ортофосфат-анион) PO3", арсенат-анион ASO3", арсенит-ани-он AsO3", фторид-анион F-. Иногда в эту группу включают хромат-анион CrO2", дихромат-анион Cr2O7", йодат-анион IO", перйодат-анион IO", тартрат-анион C4H4O6", цитрат-анион C6H5O7" .Предложено также включить в эту группу и некоторые другие анионы, не указанные в табл. 8, а именно: VO",SiO3",MoO4",WO4",GeO2",PO", P2O7" ,[SiF6]2-,SeO3" ,SeO2" ,TeO2" ,TeO4".
Вторая группа включает анионы, образующие с катионами серебра Ag+ в разбавленных водных растворах азотной кислоты HNO3 малорастворимые соли серебра. Групповым реагентом является водный азотнокислый раствор нитрата серебра AgNO3 В табл. 8 включены 7 таких анионов: хлорид-анион C1-, бромид-анион Br-, йодид-анион Е,бро-мат-анион BrO" (этот анион иногда исключают из второй группы, поскольку бромат серебра AgBrO3 растворяется в разбавленной азотной кислоте), цианид-анион CN-, тиоцианат-анион (роданид-анион) SCN-, сульфид-анион S2-. Порой к этой группе относят анион C6H5COO- бензойной кислоты и ряд других анионов: [Fe(CN)6]4-, [Fe(CN)6]3-,IO", ClO^^).
К третьей аналитической группе в рамках рассматриваемой классификации относят анионы, не образующие малорастворимых в воде со-
лей бария или серебра. В табл. 8 представлены только три таких аниона: нитрит-анион NO", нитрат-анион NO" и ацетат-анион CH3COO-, хотя число их гораздо больше. Например, в третью группу иногда включают салицилат-анион HOC6H4COO-, бромат-анион BrO" ,пер-хлорат-анион C1O". Групповой реагент на анионы третьей аналитической группы отсутствует.
При аналитической классификации анионов, основанной на их окислительно-восстановительных свойствах, анионы обычно делят на три группы (табл. 9): анионы-окислители, анионы-восстановители и индифферентные анионы, т.е. такие, которые не обладают выраженными окислительно-восстановительными свойствами в обычных условиях.
Примечания.
1 Нитрат-ион NO" в слабокислой среде практически не реагирует с йодидом калия KI.
2 Нитрит-ион NO2" относят к I или II группе.
3 Оксалат-ион C2O2" заметно обесцвечивает раствор перманганата калия только при нагревании.
4 Хлорид-ион C1- в обычных условиях медленно реагирует с раствором пер-манганата калия.
К первой группе в рамках этой классификации относят анионы-окислители, окисляющие йодид-ионы I- в сернокислой среде до молекулярного йода I2 В табл. 9 таких анионов - четыре: бромат-анион BrO", арсенат-анион AsO3", нитрат-анион NO" (хотя этот анион всла-
бокислой среде практически не реагирует с йодид-ионами) и нитрит-анион NO 2. Последний анион иногда относят ко второй группе анионов-восстановителей, поскольку, в зависимости от условий, нитрит-анион может реагировать и как окислитель, и как восстановитель. Групповым реагентом на анионы-окислители первой группы является водный раствор йодида калия KI в сернокислой среде.
Вторая группа включает анионы-восстановители, которые в водных растворах способны восстанавливать йод I2 до йодид-ионов I- или обесцвечивают водный сернокислый раствор перманганата калия KMnO4, восстанавливая марганец(VП) в перманганат-ионе MnO2 до марганца(П) - катионов Mn2+. В табл. 9 перечислены 11 таких анионов-восстановителей: сульфид-анион S2-, сульфит-анион SO2,2,тио-сульфат-анион S2O32, арсенит-анион AsO32, нитрит-анион NO2 (иногда он включается в первую группу; см. выше), оксалат-анион CO2,2, хлорид-анион Cl-, бромид-анион Br-, йодид-анион I-, цианид-анион CN-, тиоцианат-анион SCN-. Групповым реагентом на все анионы этой группы является водный сернокислый раствор перманганата калия KMnO4 В присутствии анионов-восстановителей розово-фиолетовая окраска раствора перманганата калия исчезает (раствор обесцвечивается), поскольку перманганат-ионы разрушаются. В качестве группового реагента на первые четыре аниона (сульфид-, сульфит-, тиосульфат- и арсенит-анионы) рекомендуют также использовать раствор йода в водном растворе йодида калия, который также обесцвечивается в присутствии указанных анионов-восстановителей (исчезает желтая окраска раствора йода) вследствие восстановления йода до йодид-ионов:
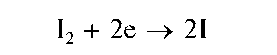
Йодид калия вводится в раствор йода для того, чтобы повысить растворимость йода: в присутствии йодид-ионов растворимость йода увеличивается по сравнению с его растворимостью в чистой воде вследствие образования хорошо растворимого трийодида калия KI3:
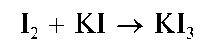
К третьей группе относят анионы, не являющиеся в обычных условиях ни окислителями, ни восстановителями. В табл. 9 указаны только пять таких анионов: сульфат-анион SO22, карбонат-анион CO32, ортофосфат-анион PO3,2, ацетат-анион CH3COO- и тетраборат-анион B4O22 (или BO32 ,BO2). Групповой реагент отсутствует.
2. Материальное обеспечение выполнения темы IV
Посуда (в расчете на 1 студента) Пробирки для полумикроанализа. Пробирки центрифужные. Пробирки для микроанализа. Стекло предметное (2x4 см). Стекло часовое. Палочки стеклянные. Пипетки глазные. Фарфоровые микротигли.
Реактивы (ч.д.а.)
1. Растворы хлорида натрия или калия, бромида калия, иодида калия, бромата калия, тиоцианата аммония или калия, сульфата натрия, сульфита натрия, тиосульфата натрия, оксалата аммония, гидрофосфата натрия, карбоната натрия, тетрабората натрия, нитрата натрия или калия, нитрита натрия или калия, ацетата натрия, молибдата аммония, хлорида или нитрата магния, хлорида или нитрата бария, нитрата серебра, хлорида аммония, ацетата свинца, нитрата свинца, хлорида железа(Ш), хлорида или нитрата кобальта, хлорида кадмия, пер-манганата калия, арсенита и арсената натрия с молярной концентрацией 0,5 моль/л, насыщенный раствор карбоната аммония.
2. Разбавленные растворы гидроксида натрия или калия, аммиака, серной, соляной, азотной и уксусной кислот с молярной концентрацией 2 моль/л.
В дальнейшем в тексте слово «разбавленные» опущено и под термином «раствор кислоты или основания» понимается разбавленный раствор.
3. Концентрированные растворы серной, соляной и азотной кислот, гидроксида натрия или калия, аммиака.
4. Раствор йода в иодиде калия, раствор дифениламина, 5 % раствор антипирина, 1 % раствор сульфаниловой кислоты и 0,3 % раствор 1-нафтиламина в 30 % уксусной кислоте, 10 % раствор нитропруссида натрия, красная и синяя лакмусовая бумага, универсальный индикатор.
5. Хлорная вода, сульфид натрия или аммония, известковая или баритовая вода, 0,5 % раствор крахмала.
6. Твердые соли: тиоцианат аммония или калия, хлорид или сульфат аммония, сульфат железа(П).
7. Растворители: хлороформ, амиловый спирт, этиловый спирт.
Приборы
1. Прибор для определения анионов CO3" ,SO2" ,C2O4".
2. Центрифуга.
3. Газовая горелка.
4. Водяная баня.
Прочие материалы и принадлежности
Спички, фильтровальная бумага, ерши для мытья посуды, штативы для пробирок, моющие растворы, мыло, полотенце, аптечка. Учебные таблицы
1. Классификация анионов, основанная на реакциях осаждения.
2. Классификация анионов, основанная на окислительно-восстановительных свойствах.
3. Реакция нитрит- и нитрат-ионов с антипирином.
Литература
Харитонов Ю.Я. Аналитическая химия (аналитика). Кн. 1, гл. 16, 17, 18, с. 418-500; гл. 6, 7, 8, с. 146-232.
Лурье Ю.Ю. Справочник по аналитической химии. - М.: Химия,
1989.
Занятие 9. Аналитические реакции анионов первой аналитической группы по классификации, основанной на образовании малорастворимых солей бария и серебра
Цель занятия:
научиться проводить аналитические реакции анионов первой аналитической группы.
Задание для самоподготовки К занятию надо знать
1. Принципы классификации анионов.
2. Общую химико-аналитическую характеристику анионов первой группы.
3. Состав группы, действие групповых реагентов.
4. Правила техники безопасности и работы в химико-аналитической лаборатории.
Уметь
1. Составлять уравнения реакций в молекулярной и ионной форме.
2. Составлять уравнения окислительно-восстановительных реакций.
3. Проводить аналитические реакции на анионы первой аналитической группы.
Литература
Харитонов Ю.Я. Аналитическая химия (аналитика). Кн. 1, гл. 16, с. 418-449.
Лурье Ю.Ю. Справочник по аналитической химии. - М.: Химия,
1989.
Вопросы для самопроверки
1. Сформулируйте принципы аналитической классификации анионов.
2. Назовите групповые реагенты в классификации анионов по способности образовывать малорастворимые соединения и по способности проявлять окислительно-восстановительные свойства.
3. Назовите анионы-окислители и восстановители, входящие в состав первой группы. Напишите их формулы.
4. Какие анионы-восстановители: а) обесцвечивают раствор йода, б) сернокислый раствор перманганата калия? Напишите их формулы.
5. Какойанионизпервойгруппы выделяет I2 из KI в кислой среде?
6. Какие анионы индифферентны по отношению к окислителям и восстановителям? Напишите их формулы.
7. Какие реакции применяются для обнаружения ионов SO4", AsO3"? Напишите их уравнения.
1. Какой реакцией можно обнаружить карбонат-ион?
2. Могут ли в растворе одновременно находиться следующие пары ионов: C2O2" иГО3,";AsO3" иMnO"?
3. Могут ли в растворе находиться одновременно следующие пары ионов: S2O3" иSO2" ;SO3" ига2" ;MnO" иГ ;AsO;j" иГ ?
4. Могут ли в растворе находиться одновременно следующие пары ионов: AsO4" иSO3" ;BO" иО2; ?
Лабораторная работа
Аналитические реакции анионов первой аналитической группы: SO2", SO3", S2O2",C2O4",CO3",B4O2" (BO"), PO4",AsO3",AsO3",F-
Групповым реагентом на анионы первой аналитической группы является водный раствор хлорида бария BaC12, с которым анионы данной группы образуют осадки соответствующих бариевых солей, малорастворимые в нейтральных или слабощелочных водных растворах.
Поэтому реакции с групповым реагентом и проводят в нейтральной или слабощелочной среде. Осадки бариевых солей рассматриваемых анионов растворяются в минеральных кислотах, за исключением сульфата бария BaSO4.
Карбонат BaCO3, тетраборат BaB4O7, ортофосфат Ba3(PO4)2 иарсе-нат Ba3(AsO4)2 растворимы и в уксусной кислоте.
Катионы серебра Ag+ также дают осадки солей серебра с анионами первой группы, за исключением фторид-аниона F-, поскольку фторид серебра AgF растворим в воде. Эти осадки растворяются в азотнокислом растворе, в отличие от солей серебра анионов второй аналитической группы. Соли свинца анионов первой группы также нерастворимы в воде, за исключением тетрабората и перйодата.
Анионы первой аналитической группы в водных растворах бесцветны. Первая группа включает как анионы-окислители (AsO4", иногда также CrO4" ,Cr2O2"), так и восстановители (AsO3" ,S2O2" ,SO3", C2O2"). Под действием минеральных кислот анионы «летучих» кислот (CO2" ,SO2" иS2O2") разрушаются с выделением газообразных CO2 или
SO2.
Аналитические реакции сульфат-иона SO4"
Сульфат-ион - анион сильной двухосновной серной кислоты H2SO4 (pK2 = 1,94). В водных растворах бесцветен, практически не гид-ролизуется, обладает окислительными свойствами, которые, однако, в разбавленных растворах обычно не реализуются. Сульфат-ион как ли-ганд образует сравнительно малостойкие сульфатные комплексы металлов.
Сульфаты аммония и многих металлов хорошо растворяются в воде. Сульфаты кальция, стронция, бария, свинца(П) малорастворимы в воде, что широко используется в химическом анализе.
Реакция с катионами бария (фармакопейная). Сульфат-ионы при взаимодействии с катионами бария Ba2+ образуют белый мелкокристаллический осадок сульфата бария BaSO4:
Ba2+ + SO2" - BaSO4
Осадок не растворяется в минеральных кислотах, за исключением концентрированной H2SO4, в которой он частично растворим с образованием Ba(HSO4)2:
BaSO4 + H2SO4 - Ba (HSO4)2
Если в растворе присутствует перманганат калия KMnO4,тоосадок сульфата бария окрашивается в фиолетово-красный цвет за счет адсорбции перманганат-ионов MnO" на осадке.
Методика. В пробирку вносят 3-4 капли раствора сульфата натрия Na2SO4 (или другого растворимого сульфата), прибавляют каплю разбавленного раствора HQ и 2-3 капли раствора BaC12 Выпадает белый осадок сульфата бария.
Реакция с катионами свинца. Сульфат-ион дает с катионами свинца Pb2+ белый кристаллический осадок сульфата свинца PbSO4:
Осадок частично растворяется в минеральных кислотах; растворяется в щелочах и в водных растворах ацетатов натрия CH3COONa или аммония CH3COONH4 с образованием комплексных соединений.
Растворение в щелочах:
Комплексам, образующимся при растворении сульфата свинца в растворах ацетатов натрия и аммония, различные исследователи приписывают неодинаковый состав.
Методика. В пробирку вносят 3-4 капли раствора сульфата натрия и прибавляют 2-3 капли раствора нитрата свинца Pb(NO3)2 Выпадает белый осадок сульфата свинца.
Реакция с родизонатом бария. Сульфат-ионы при взаимодействии с красным родизонатом бария разрушают его с образованием сульфата бария, вследствие чего красный родизонат бария обесцвечивается:
Реакция высокочувствительна: предел обнаружения - 5 мкг. Реакцию обычно проводят капельным методом на фильтровальной бумаге.
Методика. На листок фильтровальной бумаги наносят каплю раствора хлорида бария BaCl2 и каплю раствора родизоната натрия Na2C6O6 или родизоновой кислоты H2C6O6. На бумаге возникает красное пятно родизоната бария. На это пятно наносят 1- 2 капли раствора, содержащего сульфат-ионы (разбавленной серной кислоты или растворимых сульфатов). Пятно обесцвечивается.
Некоторые другие реакции сульфат-ионов. Сульфат-ион открывают также реакциями с некоторыми органическими реагентами - сульфа-нозо III и солями бария, с карбонатом бария и фенолфталеином в нейтральной среде и т.д.
Аналитические реакции сульфит-иона SOf2
Cульфит-ион SO32 и гидросульфит-ион HSO2 - анионы двухосновной нестабильной в водных растворах сернистой кислоты H2SO3, которая при ионизации по первой стадии является кислотой средней силы (pK1 = 1,85), а по второй - очень слабой (pK2 =7,20).Вводных растворах сульфит-ионы бесцветны, подвергаются гидролизу, являются сильными восстановителями (уже в водных растворах они медленно окисляются кислородом воздуха до сульфатов). Однако некоторые сильные восстановители, например, металлический цинк в кислой среде, могут восстанавливать сульфиты до сероводорода H2S. Сульфит-ион обладает довольно эффективными комплексообразующими свойствами как лиганд.
Средние сульфиты натрия и калия хорошо растворяются в воде, средние сульфиты других металлов, как правило, малорастворимы в воде.
При действии кислот на сульфиты они разлагаются.
Реакция с хлоридом бария (фармакопейная). Сульфит-ионы при взаимодействии с катионами бария образуют белый кристаллический осадок сульфита бария BaSO3 :
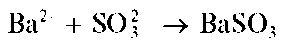
Осадок растворяется в разбавленных HCl и HNO3 с выделением газообразного диоксида серы SO2, например:
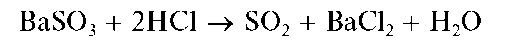
Аналогично протекает реакция сульфит-ионов и с хлоридом стронция SrCl2.
Методика. В пробирку вносят 2-3 капли раствора сульфита натрия Na2SO3 и прибавляют 2-3 капли раствора BaCl2 Выпадает белый осадок сульфита бария.
К полученной смеси прибавляют по каплям раствор HO. Осадок растворяется.
Реакция разложения сульфитов кислотами (фармакопейная). Все сульфиты разлагаются минеральными кислотами с выделением газообразного диоксида серы SO2:
Выделяющийся диоксид серы обнаруживают по характерному запаху, а также по обесцвечиванию водного раствора йода или пермангана-та калия:
Разложение сульфитов под действием кислот ускоряется при нагревании и при понижении рН среды.
Реакцию обычно проводят в приборе для обнаружения газов, состоящем из двух пробирок 1 и 2. Одна пробирка (1) снабжена пробкой с газоотводной изогнутой стеклянной трубкой, свободный конец которой погружают в раствор (для поглощения выделяющегося газа), которым заполняется другая пробирка-приемник 2.
Методиш.
Первый вариант. В пробирку 1 с пробкой вносят 6-8 капель раствора сульфита натрия, быстро прибавляют 6-8 капель разбавленной H2SO4, сразу же закрывают пробирку пробкой с газоотводной трубкой, свободный конец которой погружают в пробирку-приемник 2,запол-ненную сильно разбавленным (светло-розового цвета) раствором пер-манганата калия, подкисленным серной кислотой. Розовый раствор в пробирке-приемнике обесцвечивается.
Второй вариант. В пробирку вносят 5-6 капель раствора сульфита натрия, прибавляют столько же капель раствора HC1 или H2SO4 и встряхивают пробирку с раствором. Постепенно выделяется газообразный диоксид серы с характерным запахом.
Реакция с нитратом серебра. Сульфит-ионы дают с нитратом серебра AgNO3 белый осадок сульфита серебра Ag2SO3, растворимый при избытке сульфит-ионов с образованием растворимых комплексных дисульфитоаргентат(!)-ионов [Ag(S2O3)2]3-:
При кипячении смеси белый осадок сульфита серебра темнеет за счет выделения оксида серебра Ag2O:
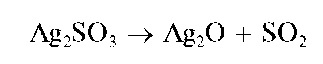
Методика. В пробирку вносят 2-3 капли раствора сульфита натрия и по каплям прибавляют раствор нитрата серебра до выпадения белого осадка сульфита серебра. К образовавшейся смеси по каплям при перемешивании прибавляют раствор сульфита натрия до растворения осадка.
В другой пробирке аналогично получают белый осадок сульфита серебра и кипятят смесь осадка с раствором. Осадок постепенно становится бурым.
Реакция с перманганатом калия. Сульфит-ион при реакции с пер-манганатом калия KMnO4 в кислой среде окисляется до сульфат-ионов:
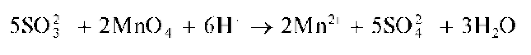
При этом розовый раствор перманганата калия обесцвечивается.
В нейтральной среде сульфит-ион при реакции с перманга-нат-ионом также окисляется до сульфат-иона. Одновременно образуется темный хлопьевидный осадок MnO(OH)2:
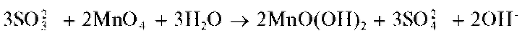
Методика. В каждую из двух пробирок вносят по 2-3 капли раствора сульфита натрия.
В одну пробирку прибавляют 2-3 капли раствора H2SO4 ипокап-лям - сильно разбавленный (до светло-розовой окраски) раствор пер-манганата калия. Раствор обесцвечивается.
В другую пробирку добавляют по каплям такой же раствор перман-ганата калия. Выпадает темный хлопьевидный осадок MnO(OH)2.
Реакция с раствором йода (фармакопейная). Сульфит-ионы в нейтральных или слабокислых растворах окисляются йодом до сульфат-ионов. При этом желтый раствор йода обесцвечивается вследствие восстановления йода до йодид-ионов:
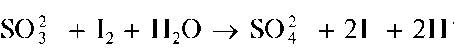
Аналогично протекает реакция сульфит-иона с бромной водой.
Методика.
а) В пробирку вносят 2-3 капли раствора сульфита натрия, прибавляют по каплям раствор уксусной кислоты до нейтральной реакции (по лакмусовой бумажке), затем также по каплям добавляют разбавленный раствор йода (бледно-желтого цвета), который обесцвечивается.
б) В пробирку вносят 2-3 капли раствора сульфита натрия и добавляют 2-3 капли раствора йода, который обесцвечивается.
Реакция восстановления сульфит-иона металлическим цинком в кислой среде. Сульфит-ион восстанавливается металлическим цинком в кислой среде до сероводорода H2S. Реакцию можно описать схемой:
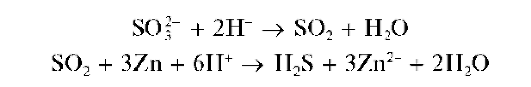
Выделяющийся газообразный сероводород можно обнаружить по почернению фильтровальной бумаги, смоченной раствором соли свинца(11), вследствие образования черного сульфида свинца PbS:
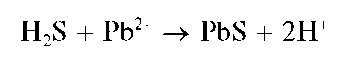
Методика. В пробирку вносят 3-4 капли раствора сульфита натрия, прибавляют 2 капли раствора HO и немного металлического цинка. В верхнюю часть пробирки помещают полоску фильтровальной бумаги, смоченной раствором соли свинца. Бумага чернеет.
Другие реакции сульфит-иона. Для открытия сульфит-иона в растворах используют также реакции с красителями - фуксином, малахитовым зеленым (обесцвечивание красителя), с дихроматом калия (раствор обесцвечивается), с нитропруссидом натрия Na2[Fe(CN)5NO] (образуются продукты реакции розово-красного цвета), с ацетатом ме-ди(11) и уксуснокислым раствором бензидина на фильтровальной бумаге (возникает темное пятно) и др.
Аналитические реакции тиосульфат-иона S2O232
Тиосульфат-ион S2O32 - анион неустойчивой двухосновной тио-серной кислоты H2S2O3 средней силы (pK1 =0,60,pK2 = 1,72), которая в водных растворах разлагается с выделением элементной серы:
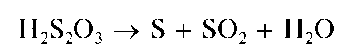
В водных растворах тиосульфат-ион бесцветен, практически не гидролизуется, является сильным восстановителем и достаточно эффективным лигандом-комплексообразователем.
Тиосульфаты щелочных металлов, стронция, цинка, кадмия, мар-ганца(II), железа(II), кобальта(П), никеля(II) растворимы в воде. Тио-сульфаты других металлов малорастворимы в воде.
Реакция с хлоридом бария. Тиосульфат-ион при взаимодействии с катионами бария образует белый мелкокристаллический осадок тиосульфата бария:
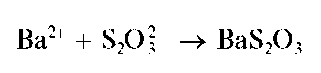
Осадок растворяется в кислотах с разложением:
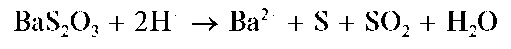
Методика. В пробирку вносят 2-3 капли раствора тиосульфата натрия Na2S2O3 и прибавляют 2-3 капли раствора хлорида бария. Выпадает белый осадок тиосульфата бария.
Осадок образуется медленно. Для ускорения выделения осадка можно потереть внутреннюю стенку пробирки стеклянной палочкой.
Реакция разложения тиосульфатов кислотами (фармакопейная). При действии минеральных кислот на тиосульфаты вначале образуется нестабильная тиосерная (серноватистая) кислота H2S2O3,быстро разлагающаяся с выделением газообразного диоксида серы SO2 иэле-ментной серы S, которая вызывает помутнение раствора:
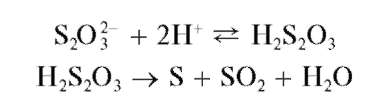
Выделяющийся газообразный диоксид серы обнаруживают либо по характерному запаху, либо по обесцвечиванию им растворов перман-ганата калия или йода.
Методика.
а) В пробирку вносят 3-4 капли раствора тиосульфата натрия и столько же капель разбавленного раствора хлороводородной кислоты HCl. Раствор мутнеет вследствие выделения элементной серы, и ощущается характерный запах диоксида серы.
б) Реакцию проводят с использованием прибора для обнаружения газов, описанного выше.
В пробирку 1 вносят 6-8 капель раствора тиосульфата натрия и 6-8 капель разбавленного раствора HCl. Пробирку сразу же закрывают пробкой с газоотводной трубкой, свободный конец которой погружают в сильно разбавленный раствор KMnO4 (бледно-розового цвета) или в сильно разбавленный раствор йода (бледно-желтого цвета), на-
ходящийся в пробирке-приемнике 2. Раствор в первой пробирке мутнеет вследствие выделения элементной серы. Раствор в пробирке-приемнике обесцвечивается.
Реакция с йодом. Тиосульфат-ион обесцвечивает нейтральные или слабощелочные растворы йода, восстанавливая йод до йодид-ионов I- с одновременным образованием тетратионат-иона S4Og2:
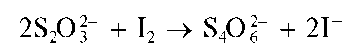
Эта реакция имеет большое значение в количественном титримет-рическом анализе.
Методика. В пробирку вносят 3-4 капли разбавленного раствора йода, имеющего желтую окраску, и прибавляют по каплям раствор тиосульфата натрия до обесцвечивания раствора йода.
Реакция с нитратом серебра (фармакопейная). Тиосульфат-ион с катионами серебра Ag+ образует белый осадок тиосульфата серебра
Ag2S2O3:
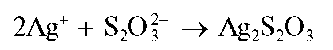
Осадок тиосульфата серебра быстро разлагается до черного сульфида серебра(1) Ag2S. Цвет осадка последовательно изменяется на желтый, бурый и под конец - на черный. Реакция протекает по схеме:
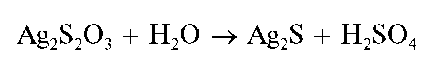
При избытке тиосульфат-ионов осадок тиосульфата серебра растворяется с образованием комплексных дитиосульфатоаргентат(1)-ионов IAg(S2O3)2]3- :
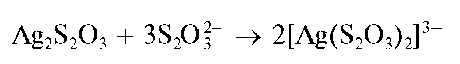
Методика. В пробирку вносят 2-3 капли раствора тиосульфата натрия и прибавляют 2-3 капли раствора нитрата серебра AgNO3 Выделяется белый осадок тиосульфата серебра, постепенно изменяющий окраску на буро-черную.
В другой пробирке аналогично получают белый осадок тиосульфата серебра и сразу же прибавляют к нему при перемешивании избыток раствора тиосульфата натрия до растворения осадка.
Реакция с сульфатом меди(П). Тиосульфат-ион при взаимодействии с катионами меди(11) Cu2+ образует черный осадок сульфида меди(1) Cu2S:
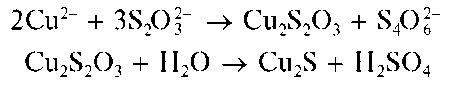
Методика. В пробирку вносят 2-3 капли раствора тиосульфата натрия, прибавляют 2-3 капли раствора сульфата меди(II) CuSO4 иосто-рожно нагревают пробирку. Выпадает черный осадок сульфата ме-ди(I).
Некоторые другие реакции тиосульфат-иона. Тиосульфат-ион легко окисляется различными окислителями (H2O2,KMnO4,K2Cr2O7 идр.); при реакциях с хлоридом железа(Ш) FeCl3 образует тиосульфатный комплекс [Fe(S2O3)2]- фиолетового цвета (постепенно разлагающийся в водном растворе), с солями ртути(II) - черный осадок сульфида рту-ти(II) HgS и т.д.
Аналитические реакции оксалат-иона C2O24
Оксалат-ион C2O42 - анион двухосновной щавелевой кислоты H2C2O4 средней силы (pK1 = 1,25; pK2 = 4,27), сравнительно хорошо растворимой в воде. Оксалат-ион в водных растворах бесцветен, частично гидролизуется, сильный восстановитель, эффективный ли-ганд - образует устойчивые оксалатные комплексы с катионами многих металлов.
Оксалаты щелочных металлов, магния и аммония растворяются в воде. Оксалаты других катионов, как правило, малорастворимы в воде.
Реакция с хлоридом бария. Соли бария осаждают из водных растворов оксалат-ион в виде белого осадка оксалата бария BaC2O4:
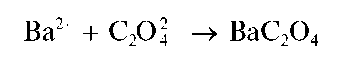
Осадок оксалата бария растворяется в минеральных кислотах, а при кипячении - и в уксусной кислоте.
Методика. В каждую из двух пробирок вносят по 2-3 капли раствора оксалата аммония (NH4)2C2O4 и прибавляют по 2-3 капли раствора бария хлорида. В обеих пробирках выпадает белый осадок оксалата бария.
В одну пробирку прибавляют по каплям при перемешивании раствор HO до полного растворения осадка.
В другую пробирку прибавляют 6-7 капель раствора уксусной кислоты и осторожно нагревают смесь до кипения. При кипячении смеси осадок постепенно растворяется.
Аналогично протекает реакция оксалат-ионов с катионами кальция (фармакопейная) с образованием белого осадка оксалата кальция CaC2O4, который растворяется в минеральных кислотах, но не растворяется в уксусной кислоте.
Реакция с нитратом серебра. Оксалат-ионы при взаимодействии с катионами серебра Ag+ образуют белый творожистый осадок оксалата серебра Ag2C2O4: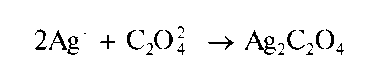
Осадок оксалата серебра растворяется в азотной кислоте, в концентрированном растворе аммиака. Действие раствора HO на оксалат серебра приводит к образованию хлорида серебра:
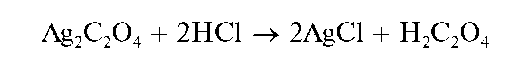
Методика. В каждую из трех пробирок вносят по 2-3 капли раствора оксалата аммония (NH4)2C2O4 и прибавляют по 2-3 капли раствора AgNO3 В каждой пробирке выпадает белый осадок оксалата серебра.
В одну пробирку прибавляют по каплям при перемешивании раствор HNO3 до растворения осадка.
В другую пробирку также по каплям при перемешивании добавляют концентрированный раствор аммиака до растворения осадка.
В третью пробирку прибавляют 4-5 капель раствора HO; в пробирке остается белый осадок хлорида серебра.
Реакция с перманганатом калия. Оксалат-ионы при взаимодействии с перманганатом калия KMnO4 в кислой среде при нагревании окисляются с выделением газообразного диоксида углерода CO2; раствор пер-манганата калия при этом обесцвечивается вследствие восстановления марганца(УП) до марганца(П):
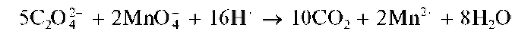
При проведении этой реакции можно использовать прибор для обнаружения газов, аналогичный тому, который применяется при изучении реакции разложения сульфитов кислотами.
Методика.
а) В пробирку вносят 2-3 капли раствора оксалата аммония, прибавляют 3-5 капель раствора серной кислоты, нагревают смесь до ~70-80 oC (не выше!) и медленно, по каплям прибавляют разбавленный раствор перманганата калия. Последний обесцвечивается; наблюдается выделение пузырьков газа - диоксида углерода.
б) В пробирку 1 вносят 6-8 капель раствора оксалата натрия Na2C2O4 (или другого растворимого оксалата), прибавляют столько же капель раствора H2SO4 и 5-6 капель разбавленного раствора KMnO4. Раствор в пробирке 1 окрашивается в бледно-розовый цвет перманга-нат-ионов.
Пробирку 1 закрывают пробкой с газоотводной трубкой, погружая ее свободный конец в раствор баритовой воды (насыщенный раствор гидроксида бария Ba(OH)2) или известковой воды (насыщенный раствор гидроксида кальция Ca(OH)2), находящийся в другой пробирке-приемнике 2.
Осторожно нагревают раствор в первой пробирке до ~70-80 oC. При нагревании раствор обесцвечивается и из него выделяются пузырьки газа (СО2), который через газоотводную трубку попадает в пробирку-приемник 2 и вызывает помутнение известковой воды вследствие образования малорастворимого карбоната кальция CaCO3:
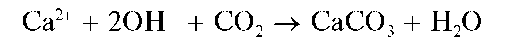
Некоторые другие реакции оксалат-ионов. Оксалат-ионы дают с а-нафтиламином и п-толуидином в присутствии ацетата меди(11) осадки комплексов соответственно желтого и зеленого цвета. При проведении капельной реакции на фильтровальной бумаге с уксуснокислым раствором бензидина и ацетатом меди оксалат-ионы образуют комплекс коричневого цвета (на фильтровальной бумаге наблюдается возникновение коричневого пятна).
Аналитические реакции карбонат-иона CO2-
Карбонаты - соли нестабильной очень слабой угольной кислоты H2CO3 (pK1 = 6,35, pK2 = 10,32), которая в свободном состоянии в водных растворах неустойчива и разлагается с выделением диоксида углерода СО2:
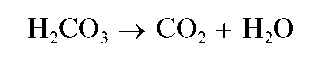
Угольная кислота образует два ряда солей: средние карбонаты (или просто карбонаты), содержащие анион CO3~, и гидрокарбонаты, содержащие анион HCO3. Карбонаты аммония, натрия, калия, рубидия, цезия растворимы в воде. Карбонат лития в воде малорастворим. Карбонаты других металлов, как правило, также малорастворимы в воде. Гидрокарбонаты растворяются в воде.
Карбонат-ионы в водных растворах бесцветны, не обладают ни окислительными, ни восстановительными свойствами, способны, как
лиганды к образованию различных по устойчивости карбонатных комплексов с катионами ряда металлов.
Карбонат-ионы в водных растворах подвергаются гидролизу. Водные растворы гидрокарбонатов щелочных металлов не окрашиваются при прибавлении к ним капли раствора фенолфталеина, что позволяет отличать растворы карбонатов от растворов гидрокарбонатов (фармакопейный тест).
Реакция с хлоридом бария. Карбонат-ион при взаимодействии с катионами бария образует белый мелкокристаллический осадок карбоната бария BaCO3:
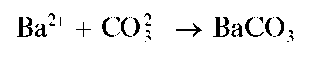
Осадок растворяется в минеральных кислотах (в растворе H2SO4 образуется белый осадок BaSO4) и в уксусной кислоте.
Аналогичные осадки карбонатов дают катионы кальция (CaCO3^ стронция (SrCO3).
Методика. В пробирку вносят 2-3 капли раствора карбоната натрия Na2CO3 и прибавляют 2-3 капли раствора хлорида бария. Выпадает белый осадок карбоната бария.
К осадку медленно, по каплям прибавляют раствор HCl до полного растворения осадка.
Реакция с сульфатом магния (фармакопейная). Карбонат-ион CO2,- с сульфатом магния образует белый осадок карбоната магния MgCO3:
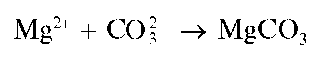
Осадок карбоната магния растворяется в кислотах. Гидрокарбонат-ион HCO- образует с сульфатом магния осадок MgCO3 только при кипячении:
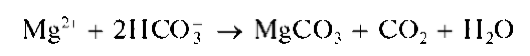
Методика. В пробирку вносят 3- 5 капель раствора карбоната натрия Na2CO3 и прибавляют столько же капель насыщенного раствора сульфата магния MgSO4 Выпадает белый осадок карбоната магния.
Реакция с минеральными кислотами (фармакопейная). Карбонат-ионы и гидрокарбонат-ионы при взаимодействии с кислотами образуют слабую нестабильную угольную кислоту, быстро разлагающуюся в кислой среде с выделением газообразного диоксида углерода CO2: 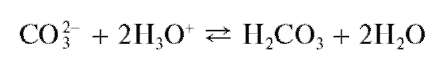
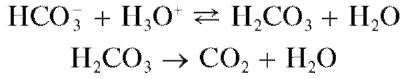
Выделяющийся газообразный диоксид углерода обнаруживают по помутнению баритовой или известковой воды в приборе для обнаружения газов.
Методика. В пробирку 1 вносят 8-10 капель раствора карбоната натрия Na2CO3 или гидрокарбоната натрия NaHCO3, прибавляют столько же капель раствора HCl или H2SO4 и сразу же закрывают пробирку 1 пробкой с газоотводной трубкой, свободный конец которой быстро погружают в баритовую или известковую воду, находящуюся в пробирке-приемнике 2. В первой пробирке наблюдается выделение пузырьков газа (СО2), в пробирке-приемнике - помутнение раствора.
Реакция с гексацианоферратом(П) уранила. Карбонат-ионы обесцвечивают коричневый раствор гексацианоферрата(П) уранила (UO2)2[Fe(CN)6], разлагая его на бесцветный карбонат уранила UO2CO3 (или на карбонатные комплексы уранила) и ферроцианид-ионы [Fe(CN)6]4- , которые в малых концентрациях не придают раствору интенсивной окраски. Реакция протекает по схеме:
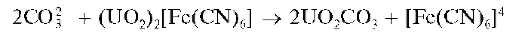
Коричневый раствор гексацианоферрата(П) уранила получают, смешивая раствор ацетата уранила (CH3COO)2UO2 с раствором гекса-цианоферрата(П) калия:
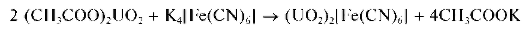
Реакция - высокочувствительная: предел обнаружения равен 0,4 мкг.
Методика. В пробирку вносят 3-4 капли раствора ацетата уранила и прибавляют 2-3 капли раствора гексацианоферрата(П) калия. Раствор окрашивается в коричневый цвет вследствие образования гекса-цианоферрата(П) уранила. К полученному раствору прибавляют по каплям раствор Na2CO3 или K2CO3 при перемешивании до исчезновения коричневой окраски.
Раздельное открытие карбонат-ионов и гидрокарбонат-ионов реакци-ямискатионамикальция исаммиаком. Если в растворе одновременно присутствуют карбонат-ионы CO3- и гидрокарбонат-ионы HCO- ,то каждый из этих анионов можно открыть раздельно. Для этого вначале к анализируемому раствору прибавляют избыток раствора хлорида
кальция. При этом карбонат-анионы CO2 осаждаются в виде карбоната кальция CaCO3:
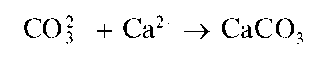
Гидрокарбонат-анионы HCO- остаются в растворе, так как Ca(HCO3)2 растворим в воде.
Осадок CaCO3 отделяют от раствора, и к последнему прибавляют раствор аммиака. Гидрокарбонат-анионы с аммиаком и катионами кальция дают снова осадок карбоната кальция:
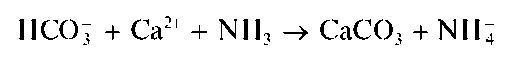
Методика. В пробирку вносят 6- 8 капель раствора гидрокарбоната натрия NaHCO3, одну каплю раствора карбоната натрия Na2CO3 и прибавляют 4-5 капель раствора CaCl2 Выпадает белый осадок карбоната кальция CaCO3, который отделяют от раствора центрифугированием.
К центрифугату добавляют по каплям раствор аммиака до прекращения выделения белого осадка карбоната кальция.
Другие реакции карбонат-иона. Карбонат-ион вступает во многие реакции, однако лишь некоторые из них имеют аналитическое значение.
Карбонат-ионы при реакции с хлоридом железа(Ш) FeCl3 образуют бурый осадок гидрокарбоната железа(Ш) Fe(OH)CO3, с нитратом серебра - белый осадок карбоната серебра Ag2CO3, растворимый в HNO3 и разлагающийся при кипячении в воде до темного осадка Ag2O иCO2: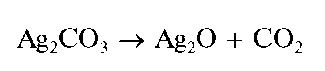
Аналитические реакции борат-ионов B4O7-и BO2
Тетраборат-ион B4O7- - анион слабой двухосновной тетраборной кислоты H2B4O7 (pK1 =3,74,pK2 = 7,70), которая в свободном (индивидуальном) состоянии неизвестна, но может существовать в растворах.
Тетраборат-ион в водных растворах бесцветен, подвергается глубокому гидролизу, не проявляет окислительно-восстановительных свойств, не обладает выраженной комплексообразующей способностью, как лиганд.
Метаборат-ион BO- (часто называемый просто «борат-ионом») - анион (по составу) не существующей в растворах метаборной кислоты HBO2 Однако в свободном индивидуальном состоянии метаборная кислота существует в виде трех кристаллических модификаций.
Как и тетраборат-ион, метаборат-ион в водных растворах бесцветен, подвергается гидролизу, индифферентен как окислитель и восстановитель; обладает умеренной комплексообразующей способностью, как лиганд. Истинное строение и состав метаборат-иона в растворе неизвестны.
Применяемая на практике борная кислота - это трехосновная орто-борная кислота H3BO3, которую можно также описать формулой B(OH)3 Борная кислота хорошо растворяется в воде и в водных растворах является очень слабой кислотой (pK1 = 9,15,pK2 = 12,74,pK3 = 13,80), поэтому в кислых средах она практически полностью присутствует в недиссоциированной форме H3BO3.
В водных растворах тетра-, орто- и метаборная кислоты находятся в равновесии
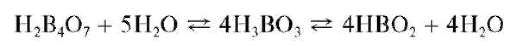
Ортоборная кислота не образует соли с катионами металлов, но дает со спиртами сложные эфиры, например (CH3O)3B, ^^^^и т.д. Мета- и тетраборная кислоты образуют соли - бораты, анионы которых содержат соответственно метаборат-анион BO- и тетрабо-рат-анион B4O 7-. Бораты аммония и щелочных металлов растворимы в воде. Бораты других металлов, как правило, малорастворимы в воде. Из боратов наибольшее практическое значение имеет декагидрат тет-рабората натрия Na2B4O710H2O - белое кристаллическое вещество, обычно называемое бурой. Бура применяется в качественном анализе для открытия металлов по образованию окрашенных плавов - «перлов» буры, а также в количественном титриметрическом анализе как первичный стандарт, по которому стандартизуют растворы кислот.
Метабораты всегда содержат кристаллизационную воду, поэтому иногда полагают, что они на самом деле являются кислыми солями ортоборной кислоты. Например, двухводному борату кальция Ca(BO2)22H2O приписывают формулу Ca(H2BO3)2.
Реакция с хлоридом бария. Борат-ионы при взаимодействии с хлоридом бария в водных растворах образуют белый кристаллический осадок метабората бария Ba(BO2)2
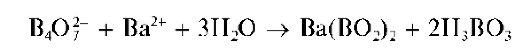
Осадок растворяется в азотной и уксусной кислотах.
Методика. В пробирку вносят 3-4 капли раствора буры и прибавляют по каплям раствор BaCl2 до прекращения образования белого осадка метабората бария.
Окрашивание пламени горелки сложными эфирами борной кислоты (фармакопейный тест). Борат-ионы или борная кислота образуют с этанолом C2H5OH в присутствии серной кислоты сложный этиловый эфир борной кислоты (C2H5O)3B, который окрашивает пламя в зеленый цвет. Реакцию образования сложных эфиров борной кислоты можно описать схемой
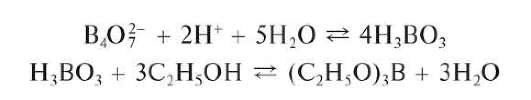
Аналогичные продукты реакции борная кислота и бораты дают с глицерином, метанолом и др. спиртами.
Методика. В фарфоровую чашку или в микротигель помещают 4- 6 капель раствора буры и выпаривают раствор досуха. К сухому остатку после его охлаждения до комнатной температуры прибавляют 2-3 капли концентрированной серной кислоты и 5-6 капель этанола. Смесь перемешивают и поджигают. Пламя окрашивается в зеленый цвет.
Реакция с куркумином (фармакопейная). Борная кислота и бораты при взаимодействии с красителем куркумином вкислойсредеобразуют куркуминовый комплекс розового или темно-красного цвета (в зави-симостиотконцентрацииборнойкислоты), которыйв щелочной или аммиачной среде изменяет окраску на зеленовато-черную или синевато-черную.
Реакцию образования куркуминового комплекса с борной кислотой можно предположительно описать следующим образом.
Краситель куркумин (желтого цвета) в растворах может существовать в двух таутомерных формах - кетонной и енольной, находящихся в равновесии
Щелочные растворы куркумина имеют красно-коричневый цвет, кислые - светло-желтый. При реакции куркумина с борной кислотой (в кислой среде бораты образуют борную кислоту) образуется куркуми-новый комплекс бора. Некоторые исследователи полагают, что в реакции комплексообразования участвует енольная форма куркумина и образуется куркуминовый комплекс бора - розоцианин красного цвета:
ОСН3
осн3
Куркуминовый комплекс бора - розоцианин (красный)
Другие исследователи считают, что в реакцию образования красного куркуминового комплекса вступает кетонная таутомерная форма куркумина (см. схему на стр 199).
Реакцию проводят обычно с помощью куркумовой бумаги. Ее готовят, пропитывая белую плотную фильтровальную бумагу спиртовым раствором куркумина (спиртовой настойкой куркумы) и затем высушивая ее в защищенном от света месте в атмосфере, не содержащей паров кислот и аммиака.
осн3
Куркуминовый комплекс бора
Методика. В пробирку вносят 4-6 капель раствора буры, 2-3 капли раствора HCl. В этот раствор погружают высушенную куркумовую бумагу, выдерживают около одной мин и высушивают. Желтая окраска куркумина изменяется на темно-красную или коричневую - цвет комплекса. Бумагу смачивают раствором аммиака; цвет бумаги изменяется на зеленовато-черный или синевато-черный.
Некоторые другие реакции борат-ионов. В качественном анализе используют реакцию получения перлов буры: при плавлении буры образуется прозрачная стекловидная масса - перлы буры. Если плавить смесь буры с солями металлов, то образуется окрашенные перлы, цвет которых зависит от природы катиона металла.
Борная кислота образует комплексные кислоты с глицерином и маннитом; с рядом других органических реагентов, содержащих гид-роксильные группы (ализарин, хинализарин, пурпурин, хромотроп 2В и др.), в кислой среде - окрашенные комплексы.
Аналитические реакции ортофосфат-ионов
Фосфат-ион PO4-, гидрофосфат-ион HPO4-, дигидрофосфат-ион H2PO- - анионы трехосновной ортофосфорной кислоты H^O^^ra-рая по первой стадии диссоциации является кислотой средней силы (pK1 = 2,15), а по второй и третьей - очень слабой кислотой (pK2 = 7,21, pK3 = 12,30). Известны многочисленные фосфаты - соли разных фосфорных кислот.
Обычно к фосфатам относят соли ортофосфорной кислоты H3PO4 (ортофосфаты), пирофосфорной кислоты H4P2O7 (пирофосфаты или дифосфаты) а также многочисленные конденсированные полифосфаты различного состава и строения (метафосфаты, например, метафос-фат калия состава KPO3, триполифосфаты, тетраполифосфаты и т.д.). В фармацевтическом анализе чаще других встречаются анионы орто-фосфорной кислоты - средний ортофосфат-ион PO4-, обычно называемый просто «фосфат-ион», гидрофосфат-ион HPO4- и дигидрофосфат-ион H2PO-. Другие фосфат-ионы играют меньшую роль в фармацевтическом анализе. Поэтому в дальнейшем рассматриваются только реакции среднего и кислых ортофосфат-ионов. Эти анионы в водных растворах бесцветны и подвергаются гидролизу, не проявляют окислительно-восстановительных свойств, образуют с катионами металлов многочисленные устойчивые фосфатные комплексы.
Ортофосфаты аммония и щелочных металлов, а также дигидрофос-фаты щелочноземельных металлов растворимы в воде. Ортофосфаты других металлов, как правило, малорастворимы в воде, но обычно растворяются в минеральных кислотах и в уксусной кислоте (кроме FePO4,AlPO4,CrPO4,Pb3(PO4)2, которые в уксусной кислоте не растворяются). Фосфат висмута(Ш) BiPO4 малорастворим в разбавленной азотной кислоте.
Реакция с хлоридом бария. Средний ортофосфат-ион PO4- с катионами бария образует белый осадок среднего ортофосфата бария Ba3(PO4)2
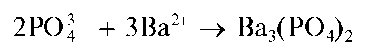
Гидрофосфат-анион HPO2" с катионами бария дает белый осадок гидрофосфата бария BaHPO4
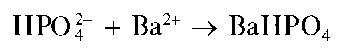
В аммиачной среде реакция гидрофосфат-ионов с катионами бария приводит к образованию осадка среднего ортофосфата бария
Ba3(PO4)2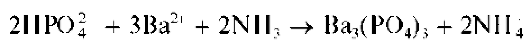
Свежеосажденный осадок среднего ортофосфата бария растворяется в HNO3, HCl, CH3COOH.
Методика. В пробирку вносят 4-6 капель раствора гидрофосфата натрия Na2HPO4, 2-3 капли раствора аммиака и прибавляют по каплям раствор хлорида бария до прекращения образования белого осадка среднего ортофосфата бария.
Реакция с нитратом серебра (фармакопейная). Средний ортофос-фат-ион PO432 или гидрофосфат-ион HPO422 образуют с катионами серебра в нейтральной среде желтый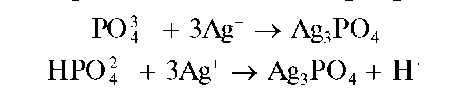 осадок фосфата серебра Ag3PO4:
осадок фосфата серебра Ag3PO4:
Осадок растворяется в азотной кислоте, в концентрированном аммиаке.
Методика. В пробирку вносят 4-5 капель раствора фосфата или гидрофосфата натрия и прибавляют по каплям раствор AgNO3 до прекращения выделения желтого осадка фосфата серебра.
Реакция с магнезиальной смесью (фармакопейная). Гидрофосфат-ион HPO2- при взаимодействии с магнезиальной смесью (MgCl2 + NH4Cl + + NH3), получаемой смешиванием водных растворов хлорида магния, хлорида аммония и аммиака, образует белый мелкокристаллический осадок магнийаммонийфосфата NH4MgPO4:

Осадок магнийаммонийфосфата растворяется в кислотах. Методика.
а) В пробирку вносят 3-4 капли раствора Na2HPO4, прибавляют столько же капель раствора магнезиальной смеси и перемешивают содержимое пробирки. Образуется белый кристаллический осадок маг-нийаммонийфосфата.
б) В пробирку вносят 2- 3 капли раствора Na2HPO4, прибавляют по 2 капли растворов NH4Cl и NH3, одну каплю раствора MgSO4 .Выпадает белый кристаллический осадок магнийаммонийфосфата.
Реакция с молибдатом аммония (фармакопейная). Ортофосфат-ионы при взаимодействии с молибдатом аммония (NH4)2MoO4 вазотнокис-лой среде при нагревании образуют желтый кристаллический осадок комплексной аммонийной соли фосфоромолибденовой гетеропо-ликислоты - фосфоромолибдат аммония (NH4)3[PO4(MoO3)12](mni (NH4)3[PMo12O40]):
PO42 + 3NHJ + 12MoO;i2 + 24H+ -- (NH4)3[PO4(MoO3)12] + 12H2O
Иногда эту реакцию описывают схемой:
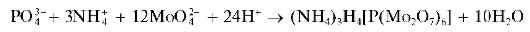
по которой осадку приписывают состав кислой аммонийной соли фос-форомолибденовой гетерополикислоты H7[P(Mo2O7)6].
Осадок фосфоромолибдата аммония растворяется в HNO3,врас-творах щелочей и аммиака. Он также растворим в присутствии большого количества фосфат-ионов с образованием желтого раствора, поэтому реакцию проводят при избытке молибдата аммония, чтобы перевести в комплексную соль все фосфат-ионы. При недостатке молиб-дата аммония осадок не выделяется, но раствор сохраняет желтый цвет.
Чувствительность реакции повышается при добавлении в раствор кристаллического нитрата аммония NH4NO3.
Считается, что рассматриваемая реакция является наилучшей для открытия фосфат-ионов при отсутствии арсенат-ионов, дающих аналогичный эффект.
Мешают также анионы-восстановители SO3-,S2O3-,S2- идр.,вос-станавливающие комплексный гетерополианион до молибденовой сини состава Mo2O5Mo2O36H2O.
Методика
а) В пробирку вносят 1-2 капли раствора гидрофосфата натрия Na2HPO4, прибавляют 6-7 капель концентрированной HNO3 и9-10 капель концентрированного раствора молибдата аммония. При нагревании раствора до ~40-50 °C он приобретает желтую окраску и из него выпадает желтый осадок фосфоромолибдата аммония.
б) В пробирку вносят 1-2 капли раствора гидрофосфата натрия, прибавляют 6-7 капель азотной кислоты, несколько кристалликов нитрата аммония NH4NO3, 6-7 капель раствора молибдата аммония и осторожно нагревают смесь до приобретения ею желтой окраски и выпадения желтого осадка фосфоромолибдата аммония.
Иногда реакцию с молибдатом аммония проводят в присутствии бензидина - появляется синее окрашивание. Присутствие бензидина повышает чувствительность реакции (предел обнаружения - 0,05 мкг, предельное разбавление равно 106 мл/г).
Другие реакции фосфат-ионов. Фосфат-ионы вступают в реакции с многочисленными реагентами, однако только немногие из этих реакций имеют аналитическое значение. В основном - это реакции, описанные выше.
Аналитические реакции арсенит-иона AsO3
Арсенит-ион AsO32 - анион слабой трехосновной ортомышьякови-стой (или просто мышьяковистой) кислоты H3AsO3 (pK1 = 9,23), которая в свободном (индивидуальном) состоянии неизвестна и может существовать только в растворах. В водных растворах, как полагают, устанавливается равновесие:
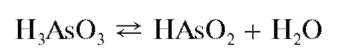
смещенное в обычных условиях вправо - в сторону образования слабой одноосновной метамышьяковистой кислоты HAsO2 Поэтому приведенное выше значение pK1 = 9,23 можно относить как к первой стадии диссоциации ортомышьяковистой кислоты, так и к диссоциации метамышьяковистой кислоты, а арсенит-ионом можно считать как анион AsO32 ,так ианионAsO2.
Большинство арсенитов - производные метамышьяковистой кислоты (содержат по составу анион AsO222).
Арсенит-ионы в водных растворах бесцветны, гидролизуются, обладают восстановительными свойствами. Комплексные соединения металлов, содержащие арсенит-ионы в качестве лигандов, малоизуче-ны.
Большинство арсенитов малорастворимы в воде. Арсениты аммония, щелочных металлов и магния - растворяются в воде.
ВНИМАНИЕ! Соединения мышьяка токсичны! При работе с ними необходимо проявлять особую осторожность!
Реакция с хлоридом бария. Арсенит-ионы в аммиачной среде при взаимодействии с катионами бария образуют белый осадок арсенита бария Ba3(AsO3)2:
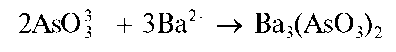
Методика. В пробирку вносят 2- 3 капли раствора арсенита натрия Na3AsO3, 2 капли раствора аммиака и добавляют по каплям раствор BaCl2 до прекращения образования белого осадка арсенита бария.
Реакция с сульфид-ионами в кислой среде (фармакопейная). Арсе-нит-ионы при реакциях с растворимыми сульфидами (натрия, аммония) образуют желтый осадок сульфида мышьяка(Ш) As2S3 только в сильнокислой среде: 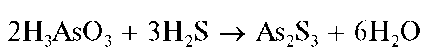
Из нейтральных или щелочных растворов осадок не выпадает.
Осадок As2S3 нерастворим в HCl, но растворяется в растворах щелочей, аммиака, карбоната аммония при избытке сульфидов аммония или натрия с образованием тиосолей, например:
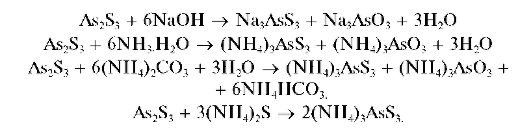
Методика. В пробирку вносят 3-4 капли раствора арсенита натрия Na3AsO3, 4-5 капель раствора HCl и по каплям добавляют раствор сульфида натрия Na2S или сероводородной воды. Выпадает желтый осадок сульфида мышьяка(Ш).
Реакция с нитратом серебра (фармакопейная). Арсениты образуют с нитратом серебра AgNO3 желтый аморфный осадок арсенита серебра Ag3AsO3:
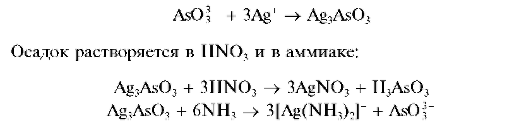
Методика. К 3-5 каплям раствора арсенита натрия Na3AsO3 прибавляют по каплям раствор AgNO3 Выпадает желтый осадок.
Реакция с йодом. Арсениты окисляются йодом I2 до арсенатов в нейтральной или слабощелочной среде (раствор йода обесцвечивается):
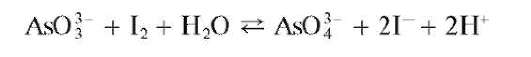
Реакция обратима. Для смещения равновесия вправо в раствор прибавляют твердый гидрокарбонат натрия NaHCO3, связывающий ионы водорода в слабую угольную кислоту.
Аналогично протекают реакции с хлорной и бромной водой, которые окисляют арсениты до арсенатов.
Методика. В пробирку вносят 3-5 капель раствора Na3AsO3, прибавляют небольшое количество твердого гидрокарбоната натрия NaHCO3 и добавляют по каплям раствор йода, который обесцвечивается.
Реакция с солями меди(П). Арсениты или мышьяковистая кислота при реакциях с солями меди(II) в слабощелочной среде образуют желто-зеленый осадок арсенита меди Cu3(AsO3)2:
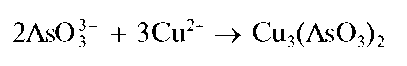
Осадок растворяется в избытке щелочи. При этом раствор окрашивается в синий цвет:
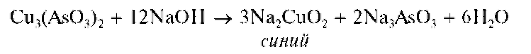
При кипячении этого синего щелочного раствора мышьяк(Ш) окисляется медью(II) до мышьяка(V), и из раствора выпадает красный осадок оксида меди(I) Cu2O:
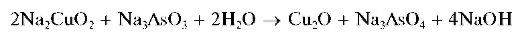
Реакцию используют для отличия соединений мышьяка(Ш) от соединений мышьяка(V).
Методика. В пробирку вносят 3-4 капли разбавленного раствора сульфата меди(II) CuSO4, прибавляют 1-2 капли 2 моль/л раствора NaOH и 2 капли раствора арсенита Na3AsO3 или гидроарсенита Na2HAsO3 натрия.
К смеси добавляют по каплям при перемешивании раствор NaOH до растворения осадка и образования синего раствора. Последний осторожно нагревают до кипения и кипятят до прекращения выпадения красного осадка оксида меди(I).
Реакция восстановления соединений мышьяка до арсина AsH3 (фармакопейная). Небольшие количества арсенитов, арсенатов или других соединений мышьяка (при содержании ~0,001-0,1 мг мышьяка) открывают очень чувствительной реакцией восстановления соединений мышьяка до газообразного арсина AsH3, который идентифицируют реакциями с азотнокислым серебром AgNO3 или хлоридом ртути(II) HgCl2 Реакцию получения AsH3 проводят в кислой среде (H2SO4 или HCl); восстановитель - часто металлический цинк (точнее - водород в момент выделения, образующийся при растворении металлического цинка в кислотах):
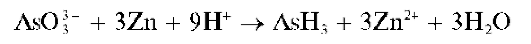
Вместо металлического цинка иногда используют металлический магний (а также алюминий - в щелочной среде).
Выделяющийся газообразный арсин AsH3 при взаимодействии с AgNO3 образует вначале соединение состава AsAg6(NO3)3 желтого цвета:
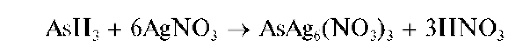
затем темнеющее вследствие разложения с выделением тонкодисперсного металлического серебра:
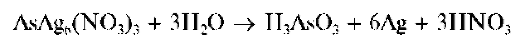
ПривзаимодействииAsH3 с хлоридом ртути(II) HgCl2 вначале образуется желто-оранжевый продукт реакции состава As(HgCl)3Hg2Cl2, который под воздействием влаги изменяет окраску на бурую из-за разложения с выделением свободного мышьяка As (и Hg2Cl2).
Мешают соединения сурьмы, фосфора, окислители.
Арсин очень ядовит! Реакции проводят только под тягой!
Методика. В чистую пробирку вносят ~1 мл раствора H2SO4 (или ~10 % раствора HCl), немного металлического цинка и прибавляют 3-4 капли разбавленного раствора Na3AsO3 (или Na2HAsO4).
Для поглощения возможных мешающих примесей сероводорода в верхнюю часть пробирки помещают вату, пропитанную раствором ацетата свинца (CH3COO)2Pb; при наличии сероводорода в парах вата чернеет за счет образования черного сульфида свинца.
Отверстие пробирки покрывают фильтровальной бумагой, смоченной раствором AgNO3 Через 3- 4 мин после начала реакции на бумаге возникает бурое или черное пятно.
Если вместо бумаги, пропитанной AgNO3, использовать фильтровальную бумагу, смоченную спиртовым раствором HgCl2 (фармакопейная реакция), то на бумаге появится желто-бурое пятно.
Другие реакции арсенит-иона. Арсениты при взаимодействии с хлоридом олова(11) в среде HCl восстанавливаются и образуют черно-коричневый осадок свободного мышьяка.
Аналитические реакции арсенат-иона AsO3,2
Арсенат-ион AsO42 - анион трехосновной мышьяковой кислоты H3AsO4, сравнимой по силе с ортофосфорной кислотой. Для мышьяковой кислоты pK1 = 2,25, pK2 = 6,77, pK3 = 11,53. Cредние и кислые соли этой кислоты называются арсенатами.
В водных растворах арсенат-ион бесцветен, гидролизуется, обладает умеренными окислительными свойствами в кислой среде, способен, как лиганд, к образованию координационных соединений металлов, однако арсенатные комплексы металлов малоизучены.
Арсенаты большинства катионов малорастворимы в воде. Арсенаты щелочных металлов и аммония растворяются в воде.
ВНИМАНИЕ! Все соединения мышьяка ядовиты!
Реакция с хлоридом бария. Арсенат-ион AsO 42 образует с катионами бария в аммиачной среде белый осадок арсената бария Ba3(AsO4)2:
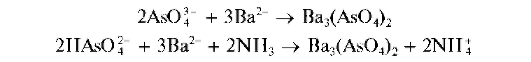
Осадок арсената бария растворяется в минеральных кислотах и в уксусной кислоте.
Методика. В пробирку вносят 3-5 капель раствора арсената натрия, 2 капли раствора аммиака и прибавляют по каплям раствор хлорида бария до прекращения выпадения белого осадка арсената бария.
Реакция с нитратом серебра (фармакопейная). Арсенаты образуют с нитратом серебра AgNO3 аморфный осадок арсената серебра Ag3AsO4 шоколадного цвета:
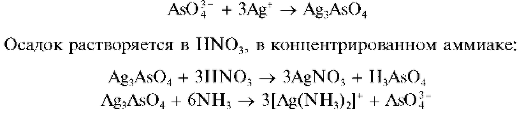
Методика. К 3- 5 каплям раствора арсената натрия в пробирке прибавляют по каплям раствор AgNO3 до выпадения осадка шоколадного цвета.
Реакция с магнезиальной смесью (фармакопейная). Арсенат-ион с магнезиальной смесью (аммиачный раствор MgSO4 иNH4Cl) медленно образует белый мелкокристаллический осадок магнийаммонийар-сената NH4MgAsO4: 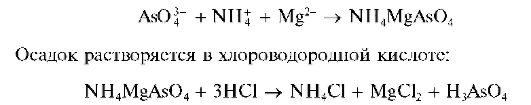
Мешают фосфат-ионы. C арсенит-ионами осадок не образуется.
Методика. В пробирку вносят 3-5 капель раствора арсената натрия Na2HAsO4 и такой же объем магнезиальной смеси (или же ~2-3 капли раствора MgSO4, ~1-2 капли раствора аммиака и 4-5 капель раствора NH4Cl). Пробирку встряхивают, стенки пробирки потирают стеклянной палочкой. Медленно образуется белый мелкокристаллический осадок.
Реакцию можно проводить и как микрокристаллоскопическую.
Реакция с сульфидами или сероводородной водой (фармакопейная). Ар-сенаты при взаимодействии с сульфид-ионами S2- в сильнокислой среде образуют желтый аморфный осадок сульфида мышьяка(У) As2S5:
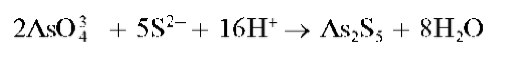
Для смещения равновесия вправо реакцию проводят при большом избытке ионов водорода (в среде концентрированной HCl).
Осадок растворяется в растворах (NH4)2S, аммиака, (NH4)2CO3,в щелочах, в концентрированной азотной кислоте, но не растворяется в хлороводородной кислоте.
Методика. В пробирку вносят 3-5 капель раствора арсената натрия, прибавляют 3-5 капель раствора концентрированной HCl и вводят по каплям раствор сульфида аммония или сероводородную воду до выпадения желтого осадка.
Реакция с молибдатом аммония. Арсенат-ионы образуют с молибда-том аммония (NH4)2MoO4 вазотнокислойсреде (рН < 1) при нагревании желтый кристаллический осадок аммонийной соли мышьяково-молибденовой кислоты состава (NH4)3[AsO4(MoO3)12]:
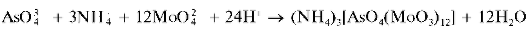
Осадок растворяется в щелочах, но не растворяется в HNO3. Мешают фосфат-ионы, дающие аналогичный осадок. Арсениты осадка не дают.
Чувствительность реакции возрастает в присутствии NH4NO3. Методика.
Первый вариант. В микротигель вносят 3 капли раствора арсената натрия, содержимое тигля выпаривают досуха. К остатку прибавляют 3 капли концентрированной HNO3 и упаривают смесь до получения влажного остатка. Прибавляют 5 капель раствора молибдата аммония, смесь перемешивают и переносят в центрифужную пробирку. После центрифугирования получают желтый кристаллический осадок.
Второй вариант. В пробирку вносят 2-3 капли раствора арсената натрия, прибавляют 10-15 капель раствора молибденового реагента (раствор (NH4)2MoO4 иNH4NO3 вHNO3) и нагревают смесь несколько минут на водяной бане до выпадения желтого кристаллического осадка.
Реакция с йодидами. Арсенат-ион при взаимодействии в кислой среде с йодид-ионами I- восстанавливается до арсенит-иона AsO32 свы-делением йода, окрашивающего раствор в желтый цвет:
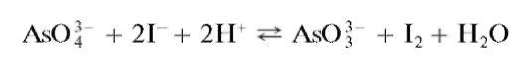
В присутствии крахмала раствор окрашивается в синий цвет. Поскольку реакция обратима, то для смещения равновесия вправо ее проводят при избытке ионов водорода - в среде концентрированной
HCl.
Мешают окислители (например, NO2 ,NO2 ,BrO2 идр.).
Методика. В пробирку вносят 3-5 капель раствора арсената натрия Na2HAsO4, прибавляют 1-2 капли концентрированной HCl, 3-4 капли раствора йодида калия KI и 2-3 капли раствора крахмала. Раствор окрашивается в синий цвет.
Другие реакции арсенат-ионов. Арсенаты восстанавливаются хлоридом олова(11) в растворе HCl до свободного мышьяка As, выпадающего в виде черного осадка.
При незначительном содержании арсенат-ионов в растворе их открывают, как и арсенит-ионы, реакцией восстановления до арсина AsH3 (см. выше «Реакция восстановления соединений мышьяка до арсина AsH3»).
При внесении соединений мышьяка(Ш) или мышьяка(У) в пламя газовой горелки оно окрашивается в голубой цвет.
Аналитические реакции фторид-иона F-
Фторид-ион F- - анион одноосновной фтороводородной (фтористоводородной) кислоты HF средней силы (pK = 3,21). Водные растворы HF называют плавиковой кислотой.
HF взаимодействует с обычным силикатным стеклом, образуя растворимые в воде продукты, поэтому растворы HF нельзя хранить в стеклянной посуде.
Фторид-ион в водных растворах бесцветен, гидролизуется, способен к образованию многочисленных устойчивых фторидных комплексов различных металлов, не окисляется в обычных условиях.
Большинство фторидов металлов растворяется в воде, включая фторид серебра AgF. Малорастворимы в воде фториды лития, щелочноземельных металлов, меди, цинка, алюминия, свинца.
Реакция с хлоридом бария. Фторид-ионы F- дают с хлоридом бария белый студенистый осадок фторида бария BaF2:
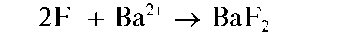
Осадок растворяется при нагревании в HCl и HNO3, а также в присутствии катионов аммония.
Методика. В пробирку вносят 3-4 капли раствора фторида натрия или калия и прибавляют по каплям раствор хлорида бария до образования белого объемистого осадка.
Реакция с тиоцианатными комплексами железа(Ш). Тиоцианатные комплексы железа(Ш) состава [Fe(NCS)n(H2O)6-n]3-n, гдеп= 1, 2,... , 6, имеющие в растворе красный цвет, в присутствии фторид-ионов разрушаются и переходят в более устойчивые бесцветные комплексные гексафтороферрат(Ш)-ионы [FeF6]3-:
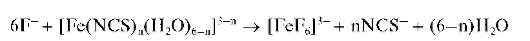
Красный раствор при этом обесцвечивается. Реакцию используют также для маскирования катионов железа(Ш) при открытии катионов кобальта(П) в виде тиоцианатных комплексов кобальта(Ш) синего цвета: в присутствии фторид-ионов железо(Ш) связывается в прочные бесцветные комплексы [FeF6]3-и не мешает открытию катионов коба-льта(11).
Если в растворе имеются катионы натрия, то может образоваться белый осадок малорастворимой комплексной соли Na3[FeF6].
Методика. В пробирку вносят 2-3 капли раствора соли желе-за(Ш), прибавляют одну каплю разбавленного раствора тиоцианата калия KNCS. Раствор окрашивается в красный цвет вследствие образования тиоцианатных комплексов железа. К полученному раствору прибавляют по каплям раствор фторида калия до обесцвечивания раствора.
Другие реакции фторид-ионов. Фториды лития, щелочноземельных металлов, свинца, алюминия малорастворимы в воде. Так, фторид-ионы при реакции с катионами кальция Ca2+ дают белый осадок фторида кальция CaF2, малорастворимый в кислотах; с хлоридом желе-за(Ш) FeCl3 в присутствии катионов натрия, как уже отмечено выше, образуют белый кристаллический осадок гексафтороферрата(Ш)
натрия Na3[FeF6]; при реакциях с солями циркония(ГУ) образуют белый осадок тетрафторида циркония ZrF4, растворимый в присутствии избытка фторид-ионов с образованием гексафтороцирконатЦУ)-ионов [ZrF6]2-.
В присутствии фторид-ионов в кислой среде красный раствор комплекса циркония(ГУ) с ализарином изменяет окраску на желтую (цвет свободного ализарина) вследствие того, что ализариновый комплекс циркония разрушается, переходя в более устойчивый бесцветный комплекс [ZrF6]2-, и выделяется свободный (не связанный в комплексе) ализарин, окрашивающий раствор в желтый цвет.
Эту реакцию можно проводить капельным методом на фильтровальной бумаге.
Контрольные вопросы
1. Какие анионы первой группы проявляют окислительно-восстановительные свойства? Напишите уравнения реакций.
2. Какие анионы первой группы не проявляют окислительно-восстановительных свойств?
3. Какие вы знаете анионы летучих кислот первой группы?
4. Какие групповые реагенты можно предложить для ионов S0 244, S024 ,As044, исходя из их окислительно-восстановительных свойств? Напишите уравнения реакций.
5. Какие осадки выделяются из растворов, содержащих ионы Р0344, As0434,As0334, при добавлении к ним хлорида бария в присутствии аммиака?
6. Какие бариевые соли анионов первой группы растворяются в уксусной кислоте?
7. Предложите реакции для обнаружения фосфат-иона.
8. Предложите реакцию для обнаружения тетраборат-иона. Напишите уравнение реакции.
9. Предложите специфическую реакцию для тиосульфат-иона. Напишите уравнение реакции.
10. Как открыть арсенат-ион в присутствии арсенит-иона?
11. Что наблюдается при пропускании через известковую воду избытка диоксида углерода?
Занятие 10. Аналитические реакции анионов
второй и третьей аналитических групп
по классификации, основанной на образовании
малорастворимых солей бария и серебра.
Аналитические реакции некоторых органических
анионов
Цель занятия:
научиться проводить аналитические реакции анионов второй и третьей аналитических групп по классификации, основанной на образовании малорастворимых солей бария, серебра, и аналитические реакции некоторых органических анионов.
Задание для самоподготовки
К занятию нужно знать
1. Общую химико-аналитическую характеристику анионов второй и третьей аналитических групп по классификации, основанной на образовании малорастворимых солей бария и серебра.
2. Общую химико-аналитическую характеристику органических анионов: тартрат-, цитрат-, бензоат- и салицилат-ионов.
3. Аналитические реакции анионов второй, третьей групп и некоторых органических анионов.
4. Правила работы с высокотоксичными веществами (синильной кислотой, цианистым калием, другими цианидами, сульфидами, сероводородом, нитритами).
Уметь
1. Составлять уравнения аналитических реакций изучаемых анионов.
2. Составлять уравнения реакций комплексообразования. Литература
Харитонов Ю.Я. Аналитическая химия (аналитика). Кн. 1, гл. 17, с. 450-478; гл. 18, с. 479-500.
Лурье Ю.Ю. Справочник по аналитической химии. - М.: Химия,
1989.
Вопросы для самопроверки
1. Назовите анионы, входящие во вторую группу, и групповой реагент.
2. Назовите анионы, входящие в третью группу.
3. Назовите анионы окислители и восстановители, входящие в состав второй и третьей аналитических групп.
4. Какой анион, входящий в третью группу, не проявляет окислительно-восстановительных свойств?
5. Назовите анионы летучих кислот, входящие во вторую и третью группы.
6. Могут ли в растворе одновременно находиться следующие пары ионов: I- иС1- ;I- иРг04 ?
7. Могут ли в растворе одновременно находиться следующие пары ионов: S2- иMn04 ;N04 иМЗ4, ?
8. Могут ли в растворе одновременно находиться пары ионов: Mn044 иС1-;Рг- иСН3С00- ?
Внимание! Перед началом лабораторной работы проводится беседа по технике безопасности при работе с высокотоксичными веществами: с синильной кислотой, цианистым калием и другими цианидами, с сероводородом и сульфидами, с хлором, бромом, нитритами.
Лабораторная работа
Допускается проведение данной лабораторной работы в течение не одного, а двух занятий.
1. Аналитические реакции анионоввторой аналитической группы: Cl-, Br- ,I- ,BrO3,CN- , SON- ,S2-
Групповым реагентом на анионы второй аналитической группы является водный раствор нитрата серебра AgN03 в разбавленной азотной кислоте (обычно - в 2 моль/л растворе HN03). В присутствии катионов серебра анионы этой группы образуют осадки солей серебра, практически нерастворимые в воде и в разбавленной азотной кислоте. Правда, сульфид серебра Ag2S растворяется в азотной кислоте при нагревании.
Все анионы второй аналитической группы в водных растворах бесцветны, их бариевые соли растворимы в воде.
Сульфид-ион S2- является сильным восстановителем (легко обесцвечивает раствор йода); хлорид-ион С1- ,бромид-ионРг- , йодид-ион I- , цианид-ион CN-, тиоцианат-ион (роданид-ион) SCN- (или NCS-) также обладают восстановительными свойствами, но менее выраженными, чем у сульфид-иона (например, они обесцвечивают раствор перманганата калия). Бромат-ион Рг04 в кислой среде является эффективным окислителем.
Аналитические реакции хлорид-иона СГ
Хлорид-ион Cl- - анион сильной одноосновной хлороводородной (хлористоводородной, соляной) кислоты HCl. В водных растворах хлорид-ион бесцветен, не гидролизуется, обладает восстановительными свойствами, эффективный лиганд, способный к образованию устойчивых хлоридных комплексов с катионами многих металлов. Хлориды аммония, щелочных, щелочноземельных и большинства других металлов хорошо растворяются в воде. Хлориды меди(1) CuCl, серебра(1) AgCl, ртути(1) Hg2Cl2, свинца(11) PbCl2 малорастворимы в воде.
Реакция с нитратом серебра (фармакопейная). Хлорид-ионы Cl- образуют с катионами серебра Ag+ белый творожистый осадок хлорида серебра AgCl:
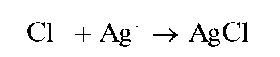
Осадок при стоянии на свету темнеет вследствие выделения тонкодисперсного металлического серебра за счет фотохимического разложения хлорида серебра. Он растворяется в растворах аммиака, карбоната аммония, тиосульфата натрия с образованием растворимых комплексов серебра(1).
Методика. В пробирку вносят 3-4 капли раствора HCl, NaCl или KCl и прибавляют по каплям раствор нитрата серебра до прекращения образования белого осадка хлорида серебра.
Реакция с сильными окислителями. Хлорид-ионы окисляются сильными окислителями (обычно - в кислой среде), например, перманга-натом калия KMnO4, диоксидом марганца MnO2, диоксидом свинца PbO2 и др., до молекулярного хлора Cl2:
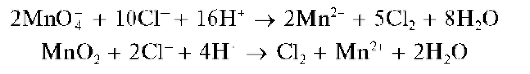
Выделяющийся газообразный хлор обнаруживают по посинению влажной йодид-крахмальной бумаги вследствие образования молекулярного йода: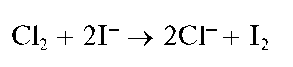
Молекулярный йод дает с крахмалом на йодид-крахмальной бумаге молекулярный комплекс синего цвета.
Мешают восстановители, в том числе Br- ,I-, также взаимодействующие с окислителями.
Методика. В пробирку вносят 5-6 капель раствора HCl, NaCl или KCl, прибавляют 5-6 капель концентрированного раствора KMnO4
(или несколько кристаллов KMnO4), 2-3 капли концентрированной серной кислоты и нагревают смесь (обязательно под тягой!). Образовавшийся вначале розово-фиолетовый раствор постепенно частично или полностью обесцвечивается. Каплю смеси наносят на йодид-крах-мальную бумагу. На бумаге возникает синее пятно.
Можно также, не нанося каплю смеси, поднести влажную йодид-крахмальную бумагу к отверстию пробирки; бумага постепенно синеет.
Некоторые другие реакции хлорид-иона. Хлорид-ионы образуют с дихроматом калия K2Cr2O7 в кислой среде летучий хлорид хромила CrO2Cl2 (бурые пары). Известны также и другие реакции хлорид-ионов, представляющие меньший аналитический интерес.
Аналитические реакции бромид-иона Br-
Бромид-ион Br- - анион сильной одноосновной бромоводородной (бромистоводородной) кислоты HBr. В водных растворах бромид-ион бесцветен, не гидролизуется, обладает восстановительными свойствами, образует устойчивые бромидные комплексы с катионами многих металлов.
Бромиды аммония и большинства металлов хорошо растворимы в воде. Малорастворимы в воде бромиды меди(!) CuBr, серебра(I) AgBr, золота(I) AuBr и золота(Ш) AuBr3, таллия(I) TlBr, ртути(I) Hg2Br2, свинца(П) PbBr2.
Реакция с нитратом серебра (фармакопейная). Бромид-ионы образуют с катионами серебра осадок бромида серебра AgBr желтоватого цвета:
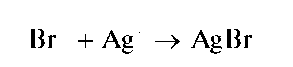
Осадок бромида серебра практически нерастворим в воде, в азотной кислоте, в растворе карбоната аммония. Частично растворяется в концентрированном растворе аммиака (но намного меньше, чем хлорид серебра). Растворяется в растворе тиосульфата натрия с образованием тиосульфатного комплекса серебра(I) [Ag(S2O3)2]3- :
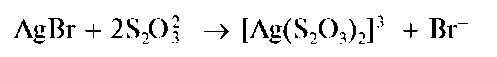
Методика. В пробирку вносят 3-4 капли раствора NaBr или KBr и прибавляют 4-5 капель раствора AgNO3 Выпадает светло-желтый осадок бромида серебра.
Реакция с сильными окислителями (фармакопейная). ильные окислители (KMnO4,MnO2,KBrO3, гипохлорит натрия NaClO, хлорная
вода, хлорамин и др.) в кислой среде окисляют бромид-ионы до брома, например:
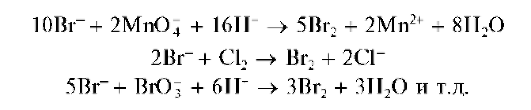
Образующийся молекулярный бром, придающий водному раствору желто-бурую окраску, можно экстрагировать из водной фазы органическими растворителями (хлороформ, четыреххлористый углерод, бензол и др.), в которых он растворяется больше, чем в воде. Органический слой окрашивается в желто-бурый или желто-оранжевый цвет.
Молекулярный бром можно также обнаружить реакцией с фуксин-сернистой кислотой на фильтровальной бумаге (бумага принимает сине-фиолетовую окраску) а также реакцией с флюоресцеином (красное окрашивание).
Проведению реакции мешают другие восстановители (сульфид-, сульфит-, тиосульфат-, арсенит-ионы и др.), также взаимодействующие с окислителями.
При окислении бромид-ионов большим избытком хлорной воды образуется желтый BrCl, и раствор окрашивается в желтый цвет:
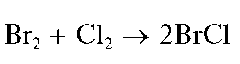
Методика. В пробирку вносят 3-4 капли раствора NaBr или KBr, прибавляют 2-3 капли раствора H2SO4 и 4-5 капель хлорной воды (или хлорамина). Встряхивают раствор, добавляют 4-5 капель хлороформа и снова встряхивают смесь. Нижний органический слой окрашивается в темно-желтый, оранжевый или светло-коричневый цвет. Окраска водной фазы становится бледно-желтой.
Известны и другие реакции бромид-ионов, имеющие, однако, меньшее значение для фармацевтического анализа.
Аналитические реакции йодид-иона Г
Йодид-ион I- - анион сильной одноосновной йодоводородной (йодистоводородной) кислоты HI. В водных растворах йодид-ион бесцветен, не гидролизуется, обладает выраженными восстановительными свойствами; как лиганд образует устойчивые йодидные комплексы с катионами многих металлов.
Йодиды аммония и большинства металлов хорошо растворяются в воде. Малорастворимы в воде йодид меди(!) CuI, серебра(!) AgI, золо-
та(Ц AuI и золота(Ш) AuI3, таллия(Ц TlI, свинца(Н) PbI2 (растворяется при нагревании), висмута(Ш) BiI3.
Реакция с нитратом серебра (фармакопейная). Йодид-ионы осаждаются катионами серебра из водных растворов в виде светло-желтого осадка йодида серебра AgI:
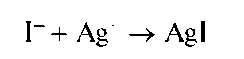
Осадок йодида серебра практически нерастворим в воде, в азотной кислоте и в аммиаке. Растворяется в растворах тиосульфата натрия и при большом избытке в растворе йодид-ионов.
Методика. В пробирку вносят 3-4 капли раствора KI, прибавляют 4-5 капель раствора AgNO3 Выпадает светло-желтый осадок йодида серебра.
Реакция с окислителями (фармакопейная - с NaNO2 иFeCl3 вкаче-стве окислителей). Окислители (хлорная или бромная вода, KMnO4, KBrO3,NaNO2,FeCl3,H2O2 и др.) в кислой среде окисляют йодид-ионы I- до йода I2, например:
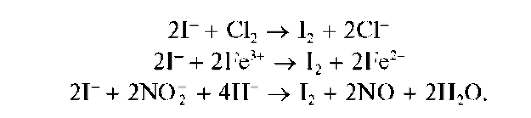
Чаще всего применяют хлорную воду.
Выделяющийся йод окрашивает раствор в желто-коричневый цвет. Молекулярный йод можно экстрагировать из водной фазы хлороформом, бензолом и другими органическими растворителями, не смешивающимися с водой, в которых молекулярный йод растворяется лучше, чем в воде. Органический слой окрашивается в фиолетовый цвет, а водный - в светло-коричневый.
При избытке хлорной воды образующийся йод окисляется далее до бесцветной йодноватой кислоты HIO3, и раствор обесцвечивается:
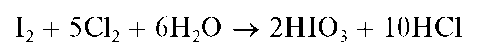
Проведению реакции мешают восстановители (S2- ,S2O32 ,SO32), также реагирующие с окислителями.
Методика (окисление йодид-ионов хлорной водой). В пробирку вносят 2-3 капли раствора KI и прибавляют по каплям хлорную воду до выделения свободного йода. Затем добавляют 3-5 капель хлороформа и встряхивают смесь. Органический слой окрашивается в фиолетовый цвет за счет йода, перешедшего в него из водной фазы. ^ова прибав-
ляют по каплям хлорную воду, встряхивая пробирку, до обесцвечивания раствора вследствие окисления йода до бесцветной йодноватой кислоты.
Реакции окисления бромид- и йодид-ионов используют для открытия Рг- иЕ при их совместном присутствии. Для этого к водному сернокислому раствору, содержащему анионы Рг- и!", прибавляют хлорную воду и органический растворитель, не смешивающийся с водой, способный экстрагировать бром и йод из водного раствора (например, хлороформ). При взаимодействии с хлорной водой первыми окисляются йодид-ионы I- до йода I2 Органический слой окрашивается в фиолетовый цвет - так открывают йодид-ионы.
Затем при прибавлении хлорной воды йод окисляется до HI03, и фиолетовая окраска органического слоя исчезает. Присутствующие в растворе бромид-ионы Рг- окисляются хлорной водой до молекулярного брома Рг2, который окрашивает органическую фазу уже в оранжевый цвет - так открывают бромид-ионы. Дальнейшее прибавление хлорной воды приводит к образованию желтого РгС1, и органический слой принимает желтую окраску.
Методика. В пробирку вносят 2 капли раствора ?Рг или KРr, 2 капли раствора KI, 5 капель хлороформа и медленно, по каплям, при встряхивании пробирки прибавляют хлорную воду. Вначале образуется йод, и органический слой окрашивается в фиолетовый цвет, что указывает на присутствие йодид-ионов в исходном водном растворе. При дальнейшем прибавлении хлорной воды фиолетовая окраска органической фазы исчезает (I2 окисляется до HI03), и она становится оранжево-желтой (или буровато-желтой) за счет растворившегося в ней молекулярного брома, что указывает на присутствие бромид-ионов в исходном водном растворе. Добавление избытка хлорной воды приводит к изменению окраски органической фазы на желтую вследствие образования РгС1.
Йодкрахмальная реакция. Молекулярный йод, возникающий при окислении йодид-ионов различными окислителями, часто открывают реакцией с крахмалом, который образует с йодом (точнее, с трийо-дид-ионами ) комплекс синего цвета. По появлению синей окраски судят о присутствии йода. Эта высокочувствительная реакция (предельная концентрация Cimm « 10-5 г/мл) издавна применяется для открытия йода.
Методика.
а) В пробирку вносят 3-4 капли раствора KI, каплю раствора НС1, 2-3 капли раствора окислителя - KN02 или NaN02 идобавляют кап-
лю свежеприготовленного водного раствора крахмала. Cмесь принимает синюю окраску.
б) На фильтровальную бумагу, пропитанную свежеприготовленным раствором крахмала, наносят каплю раствора окислителя - NaNO2 или KNO2 и каплю подкисленного раствора KI. Бумага окрашивается в синий цвет.
Реакция с солями свинца. Йодид-ионы образуют с катионами свин-ца(П) Pb2+ желтый осадок йодида свинца PbI2:
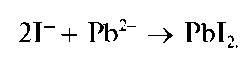
Осадок растворяется в воде при нагревании. При охлаждении раствора йодид свинца выделяется в виде красивых золотистых чешуйчатых кристаллов (реакция «золотого дождя»). Эта реакция была описана ранее при характеристике аналитических реакций катионов свин-ца(П).
Другие реакции йодид-ионов. Йодид-ионы вступают в многочисленные реакции с различными реагентами. Например, с солями меди(П) они образуют бурый осадок (смесь йодида меди(I) CuI и йода I2), с солями ртути(П) - осадок йодида ртути(П) HgI2 красного цвета, с солями ртути(I) - осадок йодида ртутив) Hg2I2 зеленого цвета, с солями висмута(Ш) - осадок йодида висмута(Ш) BiI3 черно-бурого цвета ит.д.
Аналитические реакции бромат-иона BrO32
Бромат-ион - анион одноосновной бромноватой кислоты HBrO3 средней силы (pK = 0,70), в водных растворах бесцветен, почти не подвержен гидролизу, обладает выраженными окислительными свойствами, не склонен как лиганд к образованию прочных комплексов с катионами металлов, эффективно бромирует (вместе с Br- )многиеоргани-ческие соединения.
Бромат натрия - хорошо, а бромат калия - умеренно растворимы в воде. Малорастворимы в воде броматы серебра(I) AgBrO3,бария
Ba(BrO3)2, свинца Pb(BrO3)2.
Реакция с нитратом серебра. Концентрированные растворы брома-тов с нитратом серебра AgNO3 дают осадок бромата серебра AgBrO3 бледно-желтого цвета:
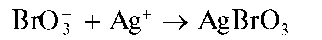
Осадок бромата серебра растворяется в разбавленных растворах HNO3,H2SO4, в растворах аммиака, тиосульфата натрия.
Методика. В пробирку вносят 3-4 капли раствора бромата калия KBrO3 и прибавляют 3-4 капли раствора AgNO3 Выпадает бледно-желтый осадок бромата серебра.
Реакция восстановления бромат-ионов бромид-ионами или йодид-ионами в кислой среде. Бромат-ионы восстанавливаются бромид-и йодид-ионами в кислой среде, окисляя их до свободных брома Br2 и йода I2 соответственно:
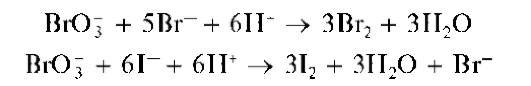
Выделяющиеся свободные бром Br2 ийод I2 обнаруживают, экстрагируя их из водной фазы в органическую.
Проведению реакции мешают восстановители (S2-,SO232,S2O232 и др.), также реагирующие с бромат-ионами (см. ниже).
Методика. В каждую из двух пробирок вносят по 2-3 капли раствора бромата калия KBrO3, по 2-3 капли раствора HCl или H2SO4 ипо 5-6 капель хлороформа. В первую пробирку прибавляют 4-5 капель раствора бромида калия KВr, во вторую - 4-5 капель раствора йодида калия KI и встряхивают обе пробирки. В первой пробирке органический слой окрашивается в оранжевый цвет (образовался бром Br2), во второй - в фиолетовый цвет (присутствует йод I2).
Некоторые другие реакции бромат-иона. Бромат-ион в кислой среде окисляет анионы-восстановители S^SO2,2 иS2O32 до сульфат-ионов SO22. Cам бромат-ион восстанавливается вначале до свободного брома Br2 (раствор желтеет), а при избытке указанных восстановителей - до бромид-иона Br- (раствор обесцвечивается). Реакции можно описать схемами:
Бромат-ионы (концентрированный раствор) с хлоридом бария образуют белый кристаллический осадок бромата бария BaBrO3, растворимый в HCl и HNO3.C органическими аминами бромат-ионы в кислой среде образуют окрашенные продукты, цвет которых зависит от природы органического реагента.
Аналитические реакции цианид-иона CN-
Цианиды - соли, содержащие цианид-анионы CN- слабой (pK = 9,30) цианистоводородной кислоты HCN (синильной кислоты).
^нильная кислота - летуча (имеет запах горького миндаля), очень ядовита и даже при незначительных дозах (меньше 0,05 г) приводит к смерти!
Цианид-ион в водных растворах бесцветен, сильно гидролизуется, обладает восстановительными свойствами, является очень эффективным лигандом и образует многочисленные весьма устойчивые цианид-ные комплексы с катионами многих металлов.
Цианиды щелочных и щелочноземельных металлов, а также цианид ртути(П) Hg(CN)2 растворяются в воде. Цианиды остальных металлов обычно в воде малорастворимы. При кипячении в водных растворах цианид-ион практически полностью гидролитически разлагается до аммиака и формиат-ионов:
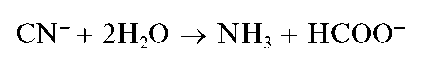
Под действием кислорода воздуха цианид-ионы окисляются до ци-анат-ионов NCO- :
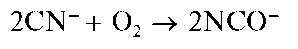
Все эти особенности реакционной способности цианид-ионов необходимо учитывать при их открытии в водных растворах.
Цианиды, особенно цианистый калий KCN, - сильно ядовитые вещества. Поэтому при работе с ними следует соблюдать повышенную осторожность!
Все операции проводятся только под тягой! Избегать разбрызгивания растворов!
Реакция с нитратом серебра. Цианид-ион при взаимодействии с катионами серебра, в зависимости от условий, образует либо белый осадок цианида серебра AgCN, либо белый осадок комплексной соли - дицианоаргентата^) серебра Ag[Ag(CN)2].
Если к раствору, содержащему цианид-ионы, постепенно прибавлять раствор нитрата серебра, то образующийся осадок цианида серебра AgCN сразу же растворяется в избытке цианид-ионов с образованием бесцветных дицианоаргентат(I)-ионов [Ag(CN)2] - :
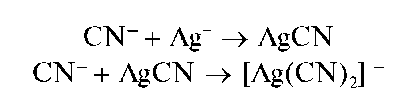
Этот процесс будет протекать до тех пор, пока все присутствующие в растворе ионы CN- не прореагируют с катионами серебра. По мере дальнейшего прибавления нитрата серебра из раствора осаждается белая малорастворимая комплексная соль Ag[Ag(CN)2]:
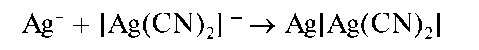
Осадок не растворяется в разбавленных кислотах, но растворим в растворах аммиака, карбоната аммония (NH4)2CO3, тиосульфата натрия Na2S2O3.
Если, наоборот, к раствору, содержащему катионы Ag+, постепенно прибавлять раствор, содержащий ионы CN- , то выпадает белый творожистый осадок цианида серебра AgCN - до тех пор, пока все катионы серебра не прореагируют с прибавляемыми цианид-ионами. При дальнейшем добавлении раствора цианида осадок цианида серебра растворяется - образуются комплексные анионы [Ag(CN)2]- .
Методика. Осторожно! Цианистый калий очень ядовит!
В пробирку вносят 3-4 капли раствора цианистого калия и прибавляют по каплям раствор AgNO3 Образующийся вначале белый осадок цианида серебра растворяется. Продолжают прибавлять по каплям раствор AgNO3 до прекращения выпадения белого осадка дицианоар-гентата(I) серебра Ag[Ag(CN)2].
Реакция с дисульфидом аммония и с хлоридом железа(Ш). Цианид-ион при реакции с дисульфид-ионом S222 переходит в тиоцианат-ион
NCS-:
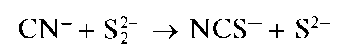
В присутствии железа(Ш) тиоцианат-ионы образуют красные тио-цианатные комплексы железа(Ш) общего состава: [Fe(NCS)n(H2O)6-n]3-n - раствор приобретает красную окраску.
Методика. Осторожно! Цианистый калий очень ядовит!
В микротигель вносят ~5 капель концентрированного раствора KCN, 5 капель свежеприготовленного раствора дисульфида аммония
(NH4)2S2 Осторожно (только под тягой!) выпаривают смесь досуха на водяной бане. К сухому остатку прибавляют 1-2 капли раствора HCl и 2капли раствора FeCl3 Cмесь окрашивается в красный цвет вследствие образования тиоцианатных комплексов железа(Ш).
Реакция образования берлинской лазури. Цианид-ионы с солями же-леза(П) в щелочной среде при нагревании образуют ферроцианид-ионы [Fe(CN)6]4- :
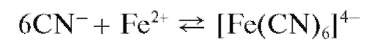
При добавлении в этот раствор (после его подкисления) раствора, содержащего железо(Ш), образуется синий осадок берлинской лазури:
Методика. Осторожно! Цианиды очень ядовиты!
В пробирку вносят 4-5 капель раствора цианистого калия, каплю раствора NaOH, каплю раствора соли железа(П) и осторожно нагревают раствор несколько минут на водяной бане. К полученному раствору прибавляют 1-2 капли хлороводородной кислоты HCl и каплю раствора соли железа(Ш). Выпадает синий осадок берлинской лазури, а раствор приобретает синюю окраску.
Некоторые другие реакции цианид-ионов. Цианид-ион образует многочисленные устойчивые комплексные соединения с солями различных металлов. Так, например, буро-черный сульфид меди(П) CuS растворяется в присутствии цианид-ионов с образованием бесцветных цианидных комплексов медиЦ) - тетрацианокупрат(I)-ионов [Cu(CN)4]3-. Указанную реакцию иногда используют для открытия цианид-ионов. Обычно ее проводят капельным методом на фильтровальной бумаге. Для этого фильтровальную бумагу смачивают аммиачным раствором сульфата меди(П), слегка высушивают и вносят в пары сероводорода (или опрыскивают сероводородной водой). Бумага темнеет вследствие образования сульфида меди(П) CuS. На бумагу наносят 1-2 каплю раствора, содержащего цианид-ионы. Бумага обесцвечивается. Эта реакция позволяет открывать цианид-ионы в присутствии ряда мешающих анионов (тиоцианаты, ферро- и феррицианиды и др.).
Цианид-ионы реагируют с пикриновой кислотой с образованием продуктов реакции красного цвета; с ацетатом меди(П) и бензидином дают продукты реакции синего цвета (реакцию используют для обнаружения следов синильной кислоты в воздухе), а также вступают в другие различные реакции.
Аналитические реакции тиоцианат-иона (роданид-иона) SCN-
Тиоцианат-ион (или роданид-ион), обозначаемый эквивалентными формулами SCN- или NCS- , - анион сильной роданистоводород-ной кислоты HSCN. Иногда (особенно - в старой литературе) его обозначают также формулами CNS- или SNC- ,что неточно, так как тиоцианат-ион имеет линейное строение (S-CWN)- .Связь сера-углерод S-C имеет порядок ~1,5 (она промежуточна между ординарной S-C (порядок связи равен единице) и двойной S=C (порядок связи равен двум) связями сера-углерод. Связь углерод-азот С-N имеет порядок, равный ~2,5 (она промежуточна между двойной C=N (порядок связи равен двум) и тройной (порядок связи равен трем) связями углерод-азот. Формулы SCN- иNCS- используются как эквивалентные, равно как и эквивалентные термины «тиоцианат-ион» и «роданид-ион».
В координационной химии этот ион, выступающий в роли лиганда, называют по-разному, в зависимости от того, через какой атом - серы или азота - он связан с атомом металла-комплексообразователя M во внутренней сфере комплекса. Если лиганд NCS- связан с атомом М через атом серы (M-SCN), то его называют «тиоцианатогруппа» или «роданогруппа». Если лиганд NCS- связан с атомом М через атом азота (M-NCS), то его называют «изотиоцианатогруппа» или «изородано-группа». Если же лиганд NCS- связан одновременно с двумя атомами металлов-комплексообразователей М и М', образуя мостиковую структуру M-NCS-M', то его называют «мостиковая тиоцианатогруп-па» или «мостиковая роданогруппа».
В аналитической химии эти особенности номенклатуры комплексных соединений часто не принимают во внимание, поскольку обычно речь идет не о строении соединения, а о его составе, и группу NCS- называют «тиоцианат-ион» или «роданид-ион», независимо от того, как эта группа связана во внутренней сфере комплекса или же она находится во внешней сфере в ионном состоянии.
Тиоцианат-ион в водных растворах бесцветен, не гидролизуется, обладает окислительно-восстановительными свойствами, с солями различных металлов образует устойчивые тиоцианатные комплексы, например, [Co(NCS)4]2- , [Fe(NCS)6]3- ит.д.
Тиоцианаты щелочных и большинства других металлов хорошо растворяются в воде, за исключением тиоцианатов меди(П) Cu(SCN)2, медиа) CuSCN, серебра(Ц AgSCN, ртути(П) Hg(SCN)2, свинца(П) Pb(SCN)2, таллия(I) T1SCN, которые малорастворимы в воде.
Реакция с нитратом серебра. Тиоцианат-ион при взаимодействии с катионами серебра образует белый творожистый осадок тиоцианата серебра AgSCN:
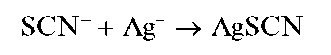
Осадок нерастворим в минеральных кислотах и в растворе карбоната аммония. Растворяется в водном аммиаке, в растворах тиосульфата натрия, цианида калия, при избытке тиоцианат-ионов с образованием соответствующих растворимых комплексов серебра:
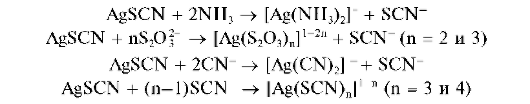
Методика. В пробирку вносят 2-3 капли раствора тиоцианата калия KSCN или тиоцианата аммония NH4SCN и прибавляют по каплям раствор AgNO3 до выпадения белого осадка тиоцианата серебра. Продолжают прибавлять по каплям раствор KSCN или NH4SCN, встряхивая пробирку, до растворения осадка тиоцианата серебра.
Реакция с солями кобальта(П). Тиоцианат-ионы в присутствии катионов кобальта(П) образуют синие тетратиоцианатокобальтат(П)-ионы [Co(NCS)4]2- , окрашивающие раствор в синий цвет:
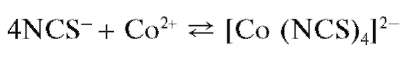
Однако эти комплексы недостаточно прочны, при не очень большом избытке ионов NCS- равновесие смещено влево, и раствор окрашивается не в синий, а в розовый цвет (окраска аквокомплексов ко-бальта(П)). Для смещения равновесия вправо реакцию проводят в водно-ацетоновой среде или же экстрагируют комплекс органическими растворителями, в которых он растворяется лучше, чем в воде (например, в смеси изоамилового спирта и диэтилового эфира).
Эта реакция была описана ранее при характеристике аналитических реакций катиона кобальта(П).
Реакция с солями железа(Ш). Тиоцианат-ионы образуют с катионами железа(Ш) в кислой (для подавления гидролиза железа(Ш)) среде тиоцианатные комплексы железа(Ш) красного цвета состава [Fe(NCS)n(H2O)6-n]3-n, где n = 1, 2, ... , 6. Все комплексы железа(Ш) с разным содержанием тиоцианатогрупп окрашены в красный цвет и в
растворе находятся в равновесии друг с другом. При повышенных концентрациях ионов NCS- в растворе доминируют комплексы с большим значением n, при пониженных - с меньшим значением n. Образующиеся комплексы можно экстрагировать органическими растворителями - диэтиловым эфиром, амиловым спиртом и др.
Эта высокочувствительная реакция была описана ранее при характеристике аналитических реакций катионов железа(Ш). Ее можно проводить капельным методом на фильтровальной бумаге.
Мешают различные анионы - S2-,SO22 ,S2O22 ,C2O22 ,I- ,NO2 идр.
Методика. На фильтровальную бумагу наносят каплю раствора KNCS или NH4NCS и каплю раствора соли железа(Ш). Бумага окрашивается в красный цвет.
Реакция с йодат-ионами. В кислой среде тиоцианат-ионы окисляются йодат-ионами с выделением свободного йода:
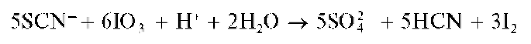
Однако проведению этой реакции мешают анионы-восстановители, также реагирующие с йодат-ионами.
Предел обнаружения тиоцианат-ионов этой реакцией составляет ~4 мкг. Поскольку при реакции образуется сильно ядовитая синильная кислота HCN, то ее следует проводить только под тягой!
Методика. Фильтровальную бумагу смачивают свежеприготовленным раствором крахмала и высушивают. Получают крахмальную бумагу. На нее наносят каплю разбавленного раствора HCl, каплю раствора KSCN и каплю раствора йодата калия KIO3 Бумага окрашивается в синий цвет вследствие образования синего молекулярного комплекса крахмала с йодом, выделяющимся в процессе реакции.
Некоторые другие реакции тиоцианат-ионов. Тиоцианат-ионы разлагаются растворами H2SO4,HNO3 и сильных окислителей, вступают в многочисленные реакции комплексообразования, осаждения, окислительно-восстановительные и др. реакции. Так, например, с нитратом ртути(П) Hg(NO3)2 они образуют белый осадок тиоцианата ртути(П) Hg(SCN)2, растворимый при избытке SCN--ионов; с катионами Cu2+ - растворимые комплексы изумрудно-зеленого цвета или (при избытке катионов Cu2+) черный осадок тиоцианата меди(П) Cu(SCN)2, который при нагревании превращается в белый тиоцианат медиЦ) CuSCN, и т.д.
Аналитические реакции сульфид-иона S2-
Cульфид-ион S2- - бесцветный анион очень слабой двухосновной сероводородной кислоты H2S(pK = 6,99,pK2 = 12,60). В водных растворах сульфид-ион подвергается глубокому гидролизу, не склонен к образованию комплексов металлов. Cредние сульфиды аммония, щелочных и щелочноземельных металлов хорошо растворяются в воде. Cредние сульфиды большинства других металлов, как правило, малорастворимы в воде. Кислые гидросульфиды, содержащие гидросульфид-анион HS- , хорошо растворяются в воде.
Cульфид-ион - очень эффективный восстановитель и окисляется большинством известных окислителей. Так, например, сероводородная кислота в водном растворе (раствор H2S в воде называют, как уже отмечалось ранее, «сероводородной водой») окисляется кислородом воздуха с выделением элементной серы:
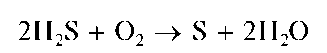
Поэтому при стоянии сероводородная вода мутнеет. Cероводород H2S - весьма ядовит. Работать с сероводородной водой необходимо только под тягой!
Реакция с нитратом серебра. Cульфид-ионы с катионами серебра дают черный осадок малорастворимого сульфида серебра Ag2S:
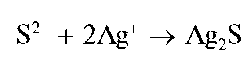
Осадок сульфида серебра не растворяется в водном аммиаке, растворим в разбавленной азотной кислоте при нагревании с выделением элементной серы:
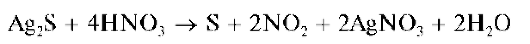
Методика. В пробирку вносят 2-3 капли раствора сульфида натрия Na2S или аммония (NH4)2S и прибавляют по каплям раствор AgNO3 до прекращения образования черного сульфида серебра.
Реакция с сильными кислотами. Cульфид-ион при действии сильных кислот переходит в сероводородную кислоту, которая выделяется из растворов в виде газообразного сероводорода H2S:
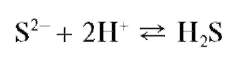
При избытке ионов водорода равновесие смещается вправо, и образующийся сероводород удаляется из сферы реакции.
Выделяющийся сероводород обнаруживают по характерному запаху, а также по почернению фильтровальной бумаги, пропитанной растворами ацетата свинца (CH3COO)2Pb или гидроксокомплекса свинца Na2[Pb(OH)4], так как при этом образуется черный сульфид свинца
PbS:
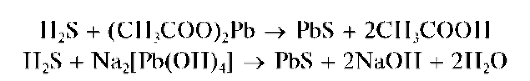
Методика. В пробирку вносят (под тягой!) 2-3 капли раствора сульфида натрия или аммония и прибавляют 3-4 капли разбавленного раствора HCl или H2SO4 Ощущается характерный запах сероводорода. К отверстию пробирки подносят фильтровальную бумагу, пропитанную раствором ацетата свинца. Бумага чернеет вследствие выделения черного сульфида свинца.
Реакция с катионами кадмия. Cульфид-ион образует с катионами кадмия в кислых и нейтральных растворах желтый осадок сульфида кадмия CdS:
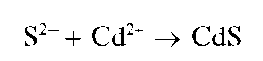
Эта реакция была описана ранее при характеристике аналитических реакций катионов кадмия.
Реакция с нитропруссидом натрия. Cульфид-ион при взаимодействии с нитропруссидом натрия Na2[Fe(CN)5NO] в щелочной или аммиачной среде образует комплексный анион фиолетового цвета состава [Fe(CN)5NOS]4- :
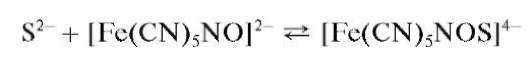
В кислой среде, содержащей гидросульфид-ион HS- (сероводородная вода, растворы гидросульфидов), указанный комплекс в заметных количествах не образуется (отличие S2- от HS-).
Методика. В пробирку вносят 2-3 капли свежеприготовленного раствора Na2S или (NH4)2S, прибавляют 3-4 капли раствора NaOH или аммиака и каплю раствора нитропруссида натрия. Раствор окрашивается в фиолетовый цвет.
Другие реакции сульфид-иона. Cульфид-ион вступает в многочисленные реакции с различными веществами. Так, он образует малорастворимые сульфиды с катионами ряда металлов (см. выше), обесцвечивает кислый раствор перманганата калия и раствор йода с выделением серы - и т.д.
2. Аналитические реакции анионовтретьей аналитической группы: NO3,NO2,CH3COO-
Как уже отмечалось выше, анионы третьей аналитической группы не имеют группового реагента. Чаще всего в эту группу включают три аниона (табл. 8) - нитрит-ион NO2, нитрат-ион NO2 и ацетат-ион CH3COO- , хотя иногда сюда же относят и некоторые другие анионы (хлорат-ион C1O2, перманганат-ион MnO2 и т.д.).
Далее рассмотрены аналитические реакции только трех вышеуказанных анионов - нитрит-, нитрат- и ацетат-ионов. Все они в водных растворах бесцветны.
Аналитические реакции нитрит-иона NO22
Нитрит-ион - анион довольно слабой одноосновной азотистой кислоты HNO2 (pK = 3,29), которая в водных растворах при обычных температурах неустойчива и легко разлагается по схеме:
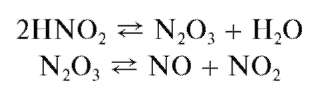
что следует принимать во внимание при анализе кислых растворов, содержащих нитриты.
Нитрит-ион как анион слабой кислоты в водных растворах гидро-лизуется; редокс-амфотерен: обладает как окислительными, так и восстановительными свойствами. Нитриты хорошо растворяются в воде (нитрит серебра AgNO2 - при нагревании). Нитрит-ион образует комплексы со многими металлами. Некоторые из этих координационных соединений, в отличие от «простых» нитритов, малорастворимы в воде, например, гексанитрокобальтаты(Ш) калия K3[Co(NO2)6]иам-мония (NH4)3[Co(NO2)6], что используют в качественном анализе.
Нитриты - токсичны!
Реакция с дифениламином (фармакопейная). Нитрит-ион при реакции с дифениламином NH(C6H5)2 всредеконцентрированной серной кислоты переводит (как и другие окислители) данный органический реагент в продукт его окисления - синий дифенилдифенохинондии-мин («дифенилбензидиновый фиолетовый» или «голохиноид»). Полагают, что превращения дифениламина в дифенилдифенохинондиимин под действием окислителей (в том числе и нитритов) в кислой среде осуществляются следующим образом. Вначале происходит необратимое окисление дифениламина в дифенилбензидин:
Две молекулы дифениламина отдают окислителю два электрона и теряют два иона водорода.
Затем происходит обратимое окисление молекулы бензидина присутствующим окислителем до окрашенного в синий цвет дифенилди-фенохинондиимина, при котором молекула дифенилбензидина также отдает окислителю два электрона и теряет два иона водорода:
В результате раствор окрашивается в синий цвет. Образовавшийся синий продукт окисления дифениламина далее необратимо разрушается вначале до продуктов реакции бурого, а затем - желтого цвета. Природа этих продуктов реакции пока точно не установлена.
В соответствии со сказанным при стоянии синей смеси ее окраска постепенно изменяется вначале на бурую, а затем - на желтую.
Мешают как анионы-окислители (ClO2,BrO2,Cr2O?r и др.), так и анионы-восстановители (S2-,SO32,S2O32,I- идр.).
Нитрат-ион NO2 дает аналогичную реакцию с дифениламином.
Методика. В фарфоровую чашку (фарфоровый микротигель) или на чистую сухую стеклянную (фарфоровую) пластинку наносят 3- 4 капли раствора дифениламина в концентрированной серной кислоте и каплю (или кристаллик) нитрита натрия NaNO2 Cмесь окрашивается в ярко-синий цвет, который через некоторое время изменяется в бурый и, наконец, в желтый.
Реакция с сильными кислотами (фармакопейная). Нитрит-ион под действием разбавленных сильных кислот (HCl, H2SO4) вначале переходит в неустойчивую азотистую кислоту HNO2, которая затем разлагается с выделением оксидов азота (газообразные продукты желто-бурого цвета):
Методика. В пробирку вносят 2-3 капли раствора нитрита натрия и прибавляют 2-3 капли разбавленной серной кислоты. Выделяются желто-бурые пары оксидов азота.
Реакция с йодидом калия (нитрит-ион - окислитель). Нитрит-ион в кислой среде (HCl, H2SO4,CH3COOH) окисляет йодид-ионы до свободного йода:
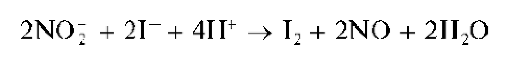
Образующийся йод обнаруживают реакцией с крахмалом (по посинению раствора) или экстрагируя его органическим растворителем - бензолом, хлороформом (органический слой окрашивается в фиолетовый цвет).
Нитрат-ион NO32 не мешает проведению реакции, поэтому ионы NO 22 можно открыть с помощью рассматриваемой реакции в присутствии нитрат-ионов.
Мешают окислители (MnO42,Cr2O722 и некоторые другие).
Методика.
а) В пробирку вносят 2-3 капли раствора йодида калия KI, прибавляют 3-4 капли разбавленной серной кислоты, каплю свежеприготовленного раствора крахмала и 2-3 капли раствора NaNO2 Cмесь окрашивается в синий цвет.
б) В пробирку вносят 2-3 капли раствора KI, прибавляют 3-4 капли раствора H2SO4, 3-4 капли органического экстрагента (бензол или хлороформ) и 2-3 капли раствора NaNO2 Встряхивают смесь. Органический слой окрашивается в фиолетовый цвет за счет образовавшегося йода.
Реакция с перманганатом калия (нитрит-ион - восстановитель). Нитрит-ион в сернокислой среде окисляется до нитрат-иона NO2 пер-манганат-ионами MnO2, обесцвечивая раствор перманганата калия:
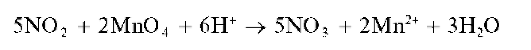
Мешают другие восстановители (S2-,SO32 ,S2O32 ,C2O22 ,SCN- , AsO32,I- ,Br- и др.), также реагирующие с перманганат-ионами.
Нитрат-ион NO2, не обесцвечивает раствор перманганата калия (отличие от нитрит-иона - фармакопейный тест).
Методика. В пробирку вносят 1-2 капли разбавленного раствора KMnO4, прибавляют 1-2 капли разбавленной H2SO4 и3-4 каплирас-твора NaNO2. Розовый раствор перманганата калия обесцвечивается.
Реакция с реактивом Грисса-Илошвая (смесью сульфаниловой кислоты HS03C6H4NH2 с 1-нафтиламином C10H7NH2). Нитрит-ион при реакции с реактивом Грисса-Илошвая (иногда называемым просто «реактивом Грисса») в нейтральных или уксуснокислых растворах дает ярко-красный продукт реакции (азокраситель). Эту реакцию называют также «реакция Грисса». Образующаяся в кислой среде в присутствии нитрит-иона азотистая кислота HN02 реагирует с сульфаниловой кислотой, давая соль диазония:
В результате раствор окрашивается в красный цвет. Данная реакция - одна из наиболее чувствительных на нитрит-ион: предел обнаружения равен ~0,01 мкг. Нитрат-ион N0- аналогичной реакции не дает.
Вместо сульфаниловой кислоты используют и некоторые другие ароматические амины, а вместо 1-нафтиламина - 1-амино-2-нафтол, 2-нафтол и т.д.
Методика. На стеклянную пластинку наносят 2 капли нейтрального или уксуснокислого раствора NaNO2, прибавляют каплю раствора сульфаниловой кислоты и каплю раствора 1-нафтиламина (или 1-ами-но-2-нафтола). Cмесь окрашивается в ярко-красный цвет вследствие образования соответствующего азокрасителя.
Реакция с солями аммония - реакция разложения (удаления) нитрит-ионов. Нитрит-ион NHJ окисляет катионы аммония при нагревании до свободного азота N2:
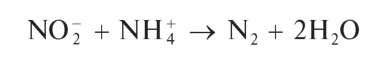
Аналогично до азота нитрит-ионы разрушаются и при реакции с карбамидом:
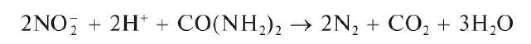
Эти реакции используют для удаления нитрит-ионов из раствора.
Методика. В пробирку вносят 5 капель раствора NaNO2,прибавля-ют кристаллы NH4Cl или (NH4)2SO4 до получения насыщенного раствора (часть кристаллов прибавленной соли аммония не должна раствориться) и осторожно нагревают смесь. Наблюдается выделение пузырьков газа - азота.
Для того чтобы убедиться в полноте протекания реакции, в пробирку прибавляют каплю раствора йодида калия KI и каплю крахмала. Если раствор не окрашивается в синий цвет, то это означает, что нитрит-ион в растворе отсутствует, т.е. содержавшийся в растворе нитрит прореагировал с катионами аммония полностью.
Реакция с антипирином (фармакопейная). Нитрит-ион при взаимодействии с органическим реагентом антипирином в слабокислой среде образует нитрозоантипирин, окрашивающий раствор в изумрудно-зеленый цвет:
Нитрат-ион NO32 с антипирином дает нитроантипирин ярко-красного цвета.
Методика. В пробирку вносят 4-5 капель раствора NaNO2,прибав-ляют 4-5 капель раствора антипирина и каплю раствора H2SO4 или HCl. Встряхивают пробирку. Раствор окрашивается в ярко-зеленый цвет.
Некоторые другие реакции нитрит-иона. Известен ряд других реакций нитрит-иона, представляющих аналитический интерес. Так, с органическим реагентом этакридином в кислой среде нитрит-ион образует окрашенный в красный цвет диазоэтакридин; с солями кобальта и KCl в уксуснокислой среде дает желтый кристаллический осадок гек-санитрокобальтата(Ш) калия K3[Co(NO2)6]; с FeSO4 всернокислой или уксуснокислой среде образует комплекс состава бу-
бу-
рого цвета - и т.д.
Аналитические реакции нитрат-иона NO2
Нитрат-ион NO2 - анион одноосновной сильной азотной кислоты HNO3 В водных растворах бесцветный нитрат-ион не гидролизуется, обладает окислительными свойствами. Как лиганд нитрат-ион малоэффективен и образует неустойчивые нитратокомплексы металлов, из которых координированные нитратогруппы легко вытесняются молекулами воды в водных растворах. Поэтому в аналитической химии нитраты щелочных металлов (например, KNO3) используются в качестве фона как индифферентные (т.е. не реагирующие с другими ионами в растворе) сильные электролиты для поддержания постоянной ионной силы раствора.
Нитраты металлов хорошо растворяются в воде.
Некоторые аналитические реакции являются общими как для нитрат-, так и для нитрит-ионов. В отличие от нитритов, нитраты не обесцвечивают подкисленные водные растворы перманганата калия (фармакопейный тест).
Реакция с дифениламином (фармакопейная). Эта реакция - общая для нитрат-иона NO2 и нитрит-иона NO2 и проводится точно так же, как и для нитрит-иона (см. выше); только вместо раствора нитрита натрия используют раствор нитрата натрия или калия. Поэтому данной реакцией нельзя открывать нитраты в присутствии нитритов.
Реакция довольно чувствительна: предел обнаружения нитрат-иона составляет около 0,5 мкг.
Реакция с металлической медью (фармакопейная). Нитрат-ион взаимодействует в среде концентрированной серной кислоты при нагрева-
нии с металлической медью с образованием буро-желтых паров оксидов азота:
Методика. В пробирку вносят 2- 3 капли концентрированной серной кислоты, кусочек металлической меди и осторожно нагревают пробирку (под тягой!). Выделяются буро-желтые пары диоксида азота.
Реакция с сульфатом железа(П) и концентрированной серной кислотой. Нитрат-ион при нагревании с FeSO4 в среде концентрированной H2SO4 образует соединение состава [FeNO]SO4, окрашенное в бурый цвет:
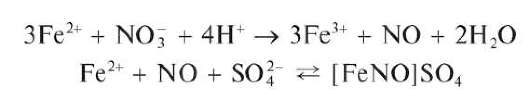
Реакцию с образованием того же соединения дает и нитрит-ион, поэтому нельзя открыть этой реакцией нитрат-ион в присутствии нитрит-иона.
Предел обнаружения нитрат-ионов - около 2,5 мкг. Мешают анионы Br- ,I- ,SO32,S2O32,CrO42,MnO2. Методика
а) В пробирку вносят 4-6 капель раствора NaNO3 или KNO3,6-8 капель насыщенного раствора FeSO4 и осторожно по стенке пробирки приливают по каплям концентрированную серную кислоту. При соприкосновении раствора H2SO4 с раствором в пробирке появляется бурое (или буро-коричневое) окрашивание жидкости.
б) На поверхность стеклянной пластинки наносят каплю раствора NaNO3 или KNO3, к которой прибавляют кристаллик сульфата железа и каплю концентрированной серной кислоты. Около кристалла образуется бурое (или буро-коричневое) пятно.
Реакция с антипирином. Нитрат-ион образует с антипирином в кислой среде нитроантипирин ярко-красного цвета:
Нитрит-ион в аналогичных условиях дает с антипирином нитрозо-антипирин зеленого цвета (см. выше).
Методика. В пробирку вносят 2-3 капли раствора NaNO3 или KNO3, 2-3 капли раствора антипирина и осторожно, по каплям прибавляют 12-15 капель концентрированной серной кислоты при встряхивании пробирки до появления ярко-красной окраски нитроантипирина.
Реакция с металлическим алюминием или цинком. Нитрат-ион при взаимодействии с металлическим алюминием или цинком в щелочной среде восстанавливается до аммиака:
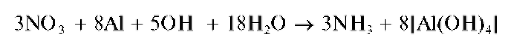
Выделяющийся аммиак ощущается по запаху и окрашивает влажную красную лакмусовую бумагу в синий цвет.
Мешают катионы аммония NH4, выделяющие аммиак в щелочной среде, а также другие анионы, способные восстанавливаться до аммиака (NO2,SCN- , ферро- и феррицианид-ионы).
Методика. В пробирку вносят 5-6 капель раствора NaNO3 или KNO3, 5-6 капель раствора NaOH и несколько кусочков металлического алюминия. Cмесь осторожно нагревают. Ощущается запах аммиака. Над пробиркой помещают увлажненную красную лакмусовую бумагу; бумага синеет.
Другие реакции нитрат-ионов. Известно сравнительно небольшое число аналитических реакций, позволяющих при определенных условиях открывать нитрат-ион в растворе. К ним можно отнести восстановление нитрат-иона до нитрит-иона металлическим цинком вуксус-нокислой среде, реакцию с органическим реагентом - нитроном C20H16N4 в уксуснокислой среде (образуются белые игольчатые кристаллы нитрата нитрона C20H16N4HNO3) и некоторые другие.
Аналитические реакции ацетат-иона CH3COO
Ацетат-ион CH3COO- -анионслабой(pK = 4,76) одноосновной уксусной кислоты CH3COOH; в водных растворах бесцветен, подвергается гидролизу, не обладает окислительно-восстановительными свойствами. При реакциях со спиртами в кислой среде дает сложные эфиры.
Ацетат-ион - довольно эффективный лиганд и образует устойчивые ацетатные комплексы с катионами многих металлов.
Ацетаты аммония, щелочных и большинства других металлов хорошо растворяются в воде. Ацетаты серебра CH3COOAg и ртутив) менее ацетатов других металлов растворимы в воде.
Реакция с хлоридом железа(Ш) (фармакопейная). Ацетат-ион с катионами железа(Ш) при рН = 5-8 дает растворимый темно-красный (цвета крепкого чая) ацетат или оксиацетат железа(Ш).
В водном растворе он частично гидролизуется; подкисление раствора минеральными кислотами подавляет гидролиз и приводит к исчезновению красной окраски раствора.
При кипячении первоначально полученного раствора из него выпадает хлопьевидный осадок основного ацетата железа(Ш) Fe(OH)2CH3COO, образующегося за счет глубокого протекания гидролиза:
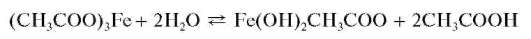
Осадок выделяется только при избытке ацетат-ионов в растворе.
В зависимости от соотношения концентраций железа(Ш) и ацетат-ионов состав осадка может изменяться и отвечать, например, формулам FeOH(CH3COO)2,Fe3(OH)2O3(CH3COO), Fe3O(OH)(CH3COO)6 или Fe3(OH)2(CH3COO)7.
Мешают анионы CO>2- ,SO2- ,PO32, [Fe(CN)6]4-,образующиеосад-ки с железом(Ш), а также анионы SCN- (дающие красные комплексы с катионами Fe3+), йодид-ион I- , окисляющийся до йода ^придаю-щего раствору желтую окраску.
Методика. В пробирку вносят 6-7 капель раствора ацетата натрия CH3COONa и прибавляют 2-3 капли раствора хлорида железа(Ш) FeCl3. Раствор окрашивается в красно-бурый цвет. Осторожно нагревают содержимое пробирки до кипения и кипятят раствор. При кипячении из раствора выпадает красно-бурый осадок основного ацетата же-леза(Ш).
Реакция образования уксусноэтилового эфира (фармакопейная). Ацетат-ион в сернокислой среде (концентрированная H2SO4) реагирует со спиртами с образованием сложных эфиров уксусной кислоты. Так, при взаимодействии с этанолом образуется уксусноэтиловый эфир (этилацетат) CH3COOC2H5:
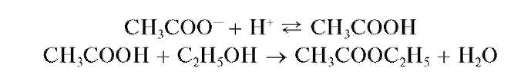
Выделяющийся этилацетат обнаруживают по характерному приятному запаху.
серебра катализируют эту реакцию, поэтому при ее проведении рекомендуется добавлять небольшое количество AgNO3.
Аналогично при реакции с амиловым спиртом C5H11OH образуется также обладающий приятным запахом амилацетат CH3COOC5H11 (так называемая «грушевая эссенция»).
Методика
а) В пробирку вносят небольшое количество сухого ацетата натрия CH3COONa, прибавляют 4-5 капель концентрированной H2SO4,4- 5 капель этилового спирта, 1-2 капли раствора AgNO3 (катализатор) и осторожно нагревают смесь. Ощущается характерный приятный запах уксусноэтилового эфира.
б) В пробирку вносят 4-5 капель концентрированного раствора ацетата натрия, столько же капель концентрированной H2SO4,1- 2 капли раствора AgNO3 (катализатор) и 4-5 капель этанола. Ощущается характерный запах этилацетата, усиливающийся при осторожном нагревании смеси.
Реакция с серной кислотой. Ацетат-ион в сильнокислой среде переходит в слабую уксусную кислоту, пары которой имеют характерный запах уксуса: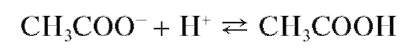
Мешают анионы NO2 ,S2- ,SO22 ,S2O32, также выделяющие в среде концентрированной серной кислоты газообразные продукты с характерным запахом.
Некоторые другие реакции ацетат-иона. Ацетат-ионы при реакции с нитратом лантана La(NO3)3 и раствором йода в аммиачной среде образуют продукты реакции синего или синевато-бурого цвета. Мешают SO22 ,PO3 2.
При растирании твердых проб, содержащих ацетаты, с твердыми NaHSO4 или KHSO4 выделяется уксусная кислота CH3COOH, обнаруживаемая по характерному запаху уксуса.
3. Аналитические реакции некоторых органических анионов: тартрат-, цитрат-, бензоат-и салицилат-ионов
Отечественная Государственная Фармакопея XI издания предусматривает общие реакции на подлинность некоторых органических анионов: тартрат-иона -00C-CH(0H)-CH(0H)-C00-, бензоат-иона
C6H5C00- , цитрат-иона -00CCH2-C(0H)(C00-)-CH2C00- исали-
цилат-иона орто-Н0-С6Н4-С00-. Аналитические реакции этих анионов кратко рассмотрены ниже.
Аналитические реакции тартрат-иона OOC-CH(OH)-CH(OH)-COO-
Тартрат-ион - анионслабойдвухосновной(/^ = 3,04, pK2 = 4,37) винной кислоты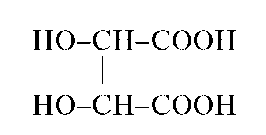
хорошо растворимой в воде. В водных растворах тартрат-ионы бесцветны, подвергаются гидролизу, склонны к комплексообразованию, давая устойчивые тартратные комплексы с катионами многих металлов. Винная кислота образует два ряда солей - средние тартраты, содержащие двухзарядный тартрат-ион - OOCCH(OH)CH(OH)COO- ,и кислые тартраты - гидротартраты, содержащие однозарядный гидро-тартрат-ион HOOCCH(OH)CH(OH)COO-. Гидротартрат калия («винный камень») HOOCCH(OH)CH(OH)COOK (или KHC4H4O6)практи-чески нерастворим в воде, что используют для открытия катионов калия. Cредняя кальциевая соль CaC4H4O6 также малорастворима в воде. Cредняя калиеваясольK2C4H4O6 хорошо растворяется в воде.
Реакция с хлоридом калия (фармакопейная). Из концентрированных растворов тартратов при добавлении к ним хлорида калия KCl выпадает белый кристаллический осадок гидротартрата калия KHC4H4O6:
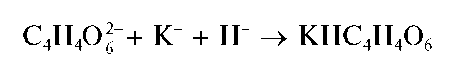
Иногда для уменьшения растворимости осадка в смесь добавляют этанол.
Осадок растворяется в растворах минеральных кислот и щелочей.
Реакция идет лучше в присутствии ацетат-ионов.
Методика. В пробирку вносят 4-5 капель концентрированного раствора тартрата, прибавляют кристаллик хлорида калия, 2-3 капли этанола и каплю раствора ацетата натрия. Образуется белый кристаллический осадок гидротартрата калия.
Для ускорения образования осадка стенки пробирки потирают стеклянной палочкой и охлаждают пробирку холодной водой.
Реакция с резорцином в кислой среде (фармакопейная). Тартраты при нагревании с резорцином меmа-C6H4(OH)2 в среде концентрированной серной кислоты образуют продукты реакции вишнево-красного цвета.
Аналогично реагируют тартраты с пирогалолом и с галловой кислотой.
Методика. В пробирку вносят 3-4 капли раствора тартрата, 3-4 капли концентрированной H2SO4, прибавляют несколько кристалликов резорцина и осторожно нагревают пробирку. Через ~30 секунд раствор окрашивается в вишнево-красный цвет.
Реакция с аммиачным комплексом серебра. При прибавлении к раствору тартрата растворов азотнокислого серебра AgNO3 и аммиака выделяется металлическое серебро. Вначале раствор приобретает бурую окраску; при кипячении из него выпадает черный осадок аморфного металлического серебра.
Методика. В пробирку вносят 3-4 капли раствора тартрата, прибавляют 5-6 капель раствора AgNO3 и столько же капель раствора аммиака. Раствор темнеет. Осторожно нагревают смесь до кипения и кипятят около мин. Выпадает черный осадок металлического серебра.
Реакция с сульфатом железа(И) и пероксидом водорода. Прибавление разбавленного водного раствора сульфата железа(П) и пероксида водорода H2O2 к раствору, содержащему тартраты, приводит к образованию неустойчивого комплекса железа желтого цвета. Последующая обработка раствором щелочи NaOH приводит к возникновению комплекса голубого цвета.
Методика. К5 мл водного раствора, содержащего около 15 мг растворенного тартрата, прибавляют 0,05 мл 1 % раствора FeSO4 и0,05 мл 10 % раствора H2O2 Раствор окрашивается в желтый цвет. Через некоторое время желтая окраска исчезает. После ее исчезновения к раствору прибавляют по каплям 2 моль/л раствор NaOH. Появляется интенсивная голубая окраска раствора.
Аналитические реакции цитрат-иона
Цитрат-ион -OOCCH22C(OH)(COO-)2CH2COO- - анион слабой (pK1 = 3,13, pK2 = 4,66, pK3 = 6,4) трехосновной лимонной кислоты
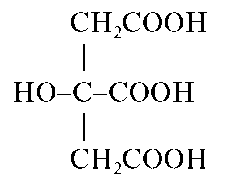
Протон от спиртовой группы в растворах в обычных условиях практически не отщепляется (pK4 = 16,0). Лимонная кислота хорошо растворима в воде. В водных растворах цитрат-ионы бесцветны, подвергаются гидролизу, способны образовывать устойчивые цитратные комплексы с катионами многих металлов.
Cредний цитрат натрия растворяется в воде.
Cредняя кальциевая соль лимонной кислоты малорастворима в горячей воде, но хорошо растворяется в холодной воде, что используется на практике.
Реакция с хлоридом кальция (фармакопейная). Цитрат-ионы при взаимодействии с катионами кальция (хлорид или гидроксид кальция) в нейтральной среде не образуют осадка - раствор остается прозрачным. При кипячении раствора из него выпадает белый осадок среднего цитрата кальция:
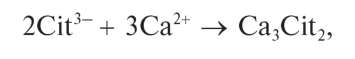
где Cit3- - условное сокращенное обозначение среднего цитрат-иона.
Осадок растворяется при охлаждении смеси, а также в разбавленной HCl.
Методика. В пробирку вносят 5-6 капель нейтрального раствора цитрата и прибавляют 5-6 капель раствора хлорида кальция CaCl2 Раствор остается прозрачным.
Осторожно нагревают смесь до кипения. Выделяется белый осадок. Охлаждают пробирку с холодной водой. Осадок растворяется.
Реакция с уксусным ангидридом (фармакопейная). Цитрат-ион при взаимодействии с уксусным ангидридом (CH3CO)2O образует продукт реакции красного цвета.
Методика. В пробирку вносят 3-4 капли раствора цитрата, прибавляют 3-4 капли уксусного ангидрида и осторожно нагревают смесь. Примерно через минуту раствор становится красного цвета.
Реакция образования пентабромацетона. Цитрат-ионы при взаимодействии с бромной водой в сернокислой среде образуют белый кристаллический осадок пентабромацетона CBr3COCHBr2.
Предполагается, что вначале в сернокислом растворе происходит окисление лимонной кислоты до ацетондикарбоновой кислоты O=C(CH2COOH)2:
Затем ацетондикарбоновая кислота бромируется и переходит в пен-табромацетон:
Мешают органические кислоты и фенолы, дающие осадки продуктов бромирования.
Методика. В пробирку вносят 3-5 капель раствора цитрата, прибавляют столько же капель разбавленной H2S04 и2-3 каплибромной воды. Через ~5 минут медленно образуется белый кристаллический осадок пентабромацетона. При стоянии смеси осадок постепенно растворяется.
Реакция с ртутью(11). Цитрат-ион (и сама лимонная кислота) при взаимодействии с катионами ртути(11) в сернокислой среде в присутствии перманганата калия образует белый осадок соли ртути(11) аце-тондикарбоновой кислоты:
Методика. В пробирку вносят 3-5 капель раствора цитрата, прибавляют столько же капель разбавленной H2SO4, 2-3 капли разбавленного раствора перманганата калия и 2-3 капли раствора соли ртути(П) (Hg(NO3)2). Раствор обесцвечивается и из него выпадает белый осадок соли ртути(П) ацетондикарбоновой кислоты.
Аналитические реакции бензоат-иона C6H5COO-
Бензоат-ион - анион слабой (pK = 4,20) одноосновной бензойной кислоты С6Н5С00Н, мало растворимой в воде (~0,3 % при 20 °С). Бензоат-ион в водных растворах бесцветен, подвергается гидролизу, способен к образованию бензоатных комплексов металлов.
Бензоат натрия, в отличие от бензойной кислоты, хорошо растворяется в воде.
Реакции с минеральными кислотами. При подкислении растворов, содержащих бензоаты, минеральными кислотами, например, раствором HCl, образуется белый осадок бензойной кислоты:
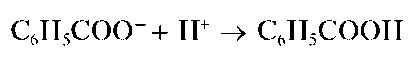
Выпавшую бензойную кислоту после ее отделения от маточника, перекристаллизации и высушивания в вакуум-эксикаторе при ~2 кПа можно идентифицировать либо по температуре плавления (120- 124 °C), либо по ИК спектру поглощения.
Реакция с хлоридом железа(Ш) (фармакопейная). Бензоат-ион с катионами железа(Ш) в нейтральной среде образует малорастворимый бензоатной комплекс, выпадающий из раствора в виде розово-желтого осадка. Разные исследователи приписывают осадку неодинаковый состав: бензоат (C6H5COO)3Fe или основной бензоат (C6H5COO)3FeFe(OH)3 7H2O железа(Ш).
Большинство авторов полагает, что состав осадка, выпадающего из нейтральных растворов, отвечает формуле основного бензоата железа, так что реакцию можно описать схемой:
Если реакцию проводить в кислой среде, то осадок не образуется, так как основная соль растворима в кислотах, а малорастворимая бензойная кислота может выпасть в осадок.
Если реакцию проводить в щелочной среде, то из раствора будет выпадать бурый осадок гидроксида железа(Ш).
Осадок растворяется в эфире.
При аналогичной реакции бензоат-ионов с сульфатом меди(П) выделяется осадок бирюзового цвета.
Реакции анионов различных карбоновых кислот с катионами ме-ди(П), железа(Ш), кобальта(П) и т.д. с образованием окрашенных осадков карбоксилатных комплексов различного состава являются общими групповыми реакциями на карбоксилатную группу и широко используются в фармацевтическом анализе. Проведению реакции мешают фенолы.
Методика. В пробирку вносят 5-6 капель нейтрального раствора, содержащего бензоат-ионы, и прибавляют медленно, по каплям раствор FeCl3 до образования розово-желтого осадка.
Аналитические реакции салицилат-иона орто-HO-C^ H4-COO-
Cалицилат-ион - анион слабой одноосновной салициловой (орто-оксибензойной) кислоты орто-HO-QH.j-COOH. Диссоциации по карбоксильной группе соответствует pK1 = 2,97, отщеплению протона по фенольной группе - pK2 = 13,59, т.е. в обычных условиях в растворе протон от фенольной группы практически не отщепляется (только - в сильнощелочных средах).
Cалициловая кислота очень плохо растворяется в воде (~0,22 % при 20 °C), поэтому при подкислении растворов ее солей (салицилатов) она выпадает из растворов в виде белого осадка. Cалицилат-ионы в водных растворах бесцветны, подвергаются гидролизу, способны к комплексо-образованию. Известны салицилатные комплексы целого ряда металлов.
Cалициловая кислота дает два ряда солей, содержащих либо однозарядные анионы HOC6H4COO- (сокращенно HSal-), либо двухзаряд-ные анионы - OC6H4COO- (Sal2- ). Кристаллические салицилаты ко-бальта(11) Co(HSal)24H2O, никеля(11) Ni(HSal)24H2O, марганца(П) Mn(HSal)24H2O, цинка Zn(HSal)22H2O, имеющие окраску соответствующего катиона и представляющие собой типичные комплексные соединения, растворяются в воде. Белый салицилат кадмия Cd(HSal)22H2O малорастворим в холодной воде.
Безводные салицилаты Co(HSal)2,Ni(HSal)2,Cd(HSal)2 - малорастворимы в холодной воде; безводный Zn(HSal)2 растворяется в воде.
Cалицилаты натрия NaHSal и калия KHSal растворяются в воде. Известные безводные салицилаты ZnSal, CdSal и MnSal малорастворимы в воде.
Реакция с хлоридом железа(Ш) (фармакопейная). Cалицилат-ион в нейтральных водных и спиртовых растворах реагирует с хлоридом желе-за(Ш) c образованием комплексного соединения сине-фиолетового или красно-фиолетового цвета. При добавлении небольшого количества разбавленного раствора уксусной кислоты окраска сохраняется, но при подкислении минеральными кислотами раствор обесцвечивается - комплекс разрушается с выделением белого кристаллического осадка свободной салициловой кислоты. Реакция, по-видимому, протекает по схеме:
Методика. В пробирку вносят 5-6 капель раствора, содержащего салицилат-ионы, и каплю раствора FeCl3 Раствор окрашивается в сине-фиолетовый (или красно-фиолетовый) цвет.
К раствору прибавляют по каплям хлороводородную кислоту до исчезновения окраски (раствор становится светло-желтым - цвет акво-комплексов железа(Ш)) и образования осадка салициловой кислоты.
Реакция с минеральными кислотами. Поскольку салициловая кислота малорастворима в воде, то при подкислении минеральными кислотами (например, раствором HCl) растворов, содержащих салицилаты, образуется салициловая кислота, которая выпадает в виде белого осадка:
После отделения осадка от раствора, перекристаллизации и высушивания в вакуум-эксикаторе при ~2 кПа образовавшуюся салициловую кислоту можно идентифицировать либо по температуре плавления (156-161 °C), либо по ИК спектру поглощения.
Контрольные вопросы
1. Какие анионы при действии минеральных кислот дают летучие соединения?
2. Какой цвет имеют осадки солей серебра, образованные анионами второй аналитической группы?
3. Какой общий реагент можно применить для обнаружения хлорид- и иодид-ионов?
4. Что произойдет, если к хлороформному экстракту йода добавить избыток хлорной воды? Напишите уравнение соответствующей реакции.
5. Напишите уравнение реакции обнаружения иона CH3COO-.
6. Напишите уравнение реакции обнаружения иона BrO2,.
7. Напишите уравнения реакций обнаружения ионов NO2, иМЗ2,.
8. При открытии каких анионов используют экстракцию?
9. Почему при протекании реакции окисления оксалат-ионов перман-ганатом калия в кислой среде раствор нельзя нагревать выше 70 °C?
10. Какие ионы и почему мешают обнаружению нитрит-ионов реакцией с йодид-ионами?
11. Какие ионы и почему мешают обнаружению нитрит- и нитрат-ионов реакцией с дифениламином?
12. Как обнаружить нитрат-ион в присутствии нитрит-иона и наоборот?
13. Какими реакциями открывают тартрат-ионы?
14. Какими реакциями открывают цитрат-ионы?
15. Какими реакциями открывают бензоат-ионы?
16. Какими реакциями открывают салицилат-ионы?
Занятие 11. Анализ смеси анионов
Цель занятия:
научиться проводить анализ смесей анионов. Задание для самоподготовки
К занятию нужно знать
1. Как проводить анализ смесей анионов дробным методом.
2. Как проводить систематический анализ смесей анионов.
3. Правила техники безопасности и работы в химико-аналитической лаборатории.
Уметь
1. Выбирать оптимальную схему анализа смесей анионов с учетом присутствия или отсутствия тех или иных анионов.
2. Составлять уравнения соответствующих аналитических реакций анионов.
3. Оформлять заключение по итогам проведенного анализа. Литература
Харитонов Ю.Я. Аналитическая химия (аналитика). Кн. 1, гл. 18,
с. 479-500.
Лурье Ю.Ю. Справочник по аналитической химии. - М.: Химия,
1989.
Вопросы для самопроверки
1. Какие анионы могут входить в состав анализируемых смесей?
2. Какие анионы не могут присутствовать совместно в анализируемом растворе?
3. Какие анионы чаще всего могут присутствовать в лекарственных препаратах?
4. В каких случаях предпочтительным является дробный анализ смесей анионов, а в каких - систематический?
5. Всегда ли используется одна и та же схема анализа смесей анионов или же в каждом конкретном случае намечается собственный ход анализа? Почему?
6. Что определяют в предварительных испытаниях?
7. Как влияет рН раствора на возможность присутствия или отсутствия в нем тех или иных анионов?
8. Какие меры предосторожности необходимо соблюдать при проведении анализа смесей анионов?
Лабораторная работа
Анализ смеси анионов
Для анализа предлагается раствор солей щелочных металлов, содержащий предпочтительно не более 5-6 анионов. Этот раствор может содержать некоторые из анионов всех трех аналитических групп, кроме арсенит-, арсенат-, цианид- и сульфид-ионов, которые не рекомендуется давать в учебных контрольных растворах (в контрольных задачах).
В контрольной задаче также исключается совместное присутствие анионов-окислителей, анионов-восстановителей и продуктов их взаимодействия.
Перечисленные анионы могут содержаться в контрольных задачах при углубленном изучении качественного анализа.
Контрольную задачу получают в виде раствора в пробирке и делят ее на две части. С одной частью проводят анализ. Другую часть оставляют для контроля.
В обычной учебной практике рекомендуется проводить обнаружение анионов дробным методом в отдельных порциях раствора.
Систематический анализ смесей анионов рекомендуется проводить при углубленном изучении качественного анализа, например, в курсовых или элективных работах.
1. Анализ анионов дробным методом
Ниже кратко охарактеризована схема качественного анализа смесей анионов различных групп в растворах (один из возможных вариантов), которые содержат в качестве катионов только катионы натрия и калия.
При работе по этой общей схеме следует принимать во внимание отсутствие в растворе анионов, перечисленных выше (арсенит-, арсе-нат-, цианид- и сульфид-ионов; совместно - окислителей и восстановителей).
Общая логическая схема анализа смеси анионов обычно состоит в следующем.
Вначале на первом этапе проводят предварительные испытания, в ходе которых определяют рН раствора, устанавливают с помощью групповых реагентов присутствие или отсутствие анионов первой и второй аналитических групп, выясняют наличие анионов-окислителей, анионов-восстановителей, проводят пробу на выделение газов.
Затем на втором этапе дробным методом открывают отдельные анионы в небольших пробах анализируемого раствора.
Предварительные испытания
Определение рН среды. Определяют значение рН анализируемого раствора обычно с помощью универсальной индикаторной бумаги.
Если рН < 2, то в анализируемом растворе отсутствуют анионы неустойчивых кислот, разлагающихся в кислой среде, т.е. SO32 ,S2O32, CO222 ,S2-,NO2. В кислой среде (рН < 5) также не могут сосуществовать
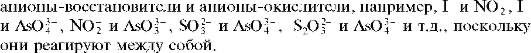
В щелочной среде могут присутствовать все рассматриваемые анионы.
Если рН > 2, то для определения наличия в анализируемом растворе неустойчивых (разлагающихся в кислой среде) кислот в пробирку отбирают 4-5 капель этого раствора, прибавляют 4-5 капель разбавленной серной кислоты и осторожно нагревают смесь, не доводя ее до кипения. Если наблюдается выделение пузырьков газа (SO2,CO2,H2S, NO2), то это означает, что в анализируемом растворе возможно присутствие анионов SO222 ,S2O22,CO22 ,S2-,NO2. Желто-бурый цвет газов окислов азота указывает на наличие нитрит-иона NO22 в растворе наряду с возможным присутствием и остальных анионов неустойчивых кислот.
Помутнение раствора при его подкислении свидетельствует о наличии в нем тиосульфат-иона S2O232, разлагающегося с выделением элементной серы.
Проба на присутствие анионов первой аналитической группы. Вотде-льной пробе анализируемого раствора (несколько капель) устанавливают присутствие или отсутствие анионов первой аналитической группы. Бариевые соли этих анионов малорастворимы в воде (при рН = 7- 9), поэтому при добавлении раствора хлорида бария BaCl2 кпробеана-лизируемого раствора выпадает белый осадок этих солей в нейтральной или слабощелочной среде, если какие-либо анионы первой аналитической группы имеются в растворе. Если осадок не выпадает, то указанные анионы отсутствуют в анализируемом растворе.
В случае выпадения солей бария полученную смесь раствора с осадком подкисляют разбавленной HCl. При этом все соли бария анионов первой аналитической группы растворяются в кислой среде, за исключением сульфата бария BaSO4, который остается в осадке. Если же осадок полностью растворился при прибавлении раствора HCl, то это означает, что среди анионов первой аналитической группы в анализируемом растворе отсутствует сульфат-ион SO42.
Методика. В пробирку вносят 4-5 капель анализируемого раствора, доводят (при необходимости) значение рН раствора до 7-9, добавляя по каплям раствор гидроксида бария Ba(0H)2, и прибавляют 4- 5 капель раствора BaCl2 Образование белого осадка указывает на присутствие в растворе анионов первой аналитической группы.
К смеси раствора с осадком прибавляют по каплям избыток разбавленной Hd при перемешивании. Если осадок растворился неполностью (остался твердый BaS04), то это означает, что в исходном анализируемом растворе присутствует сульфат-ион S04- .Полное растворение осадка указывает на отсутствие сульфат-ионов в растворе.
Проба на присутствие анионов второй аналитической группы. Вот-дельной пробе раствора (несколько капель) устанавливают наличие или отсутствие анионов второй аналитической группы. Если в анализируемом растворе присутствуют анионы этой группы, дающие малорастворимые в азотнокислой среде соли серебра (кроме бромата серебра AgBr03), то при прибавлении азотнокислого раствора AgN03 должен образоваться осадок солей серебра анионов второй аналитической группы. Если осадок не выпадает, то это означает, что анионы второй аналитической группы в анализируемом растворе отсутствуют (возможно, однако, присутствие бромат-иона Br03-).
Методика. В пробирку вносят 4-5 капель анализируемого раствора, прибавляют 1-2 капли разбавленной HN03 и 4-5 капель раствора AgN03 Выпадение осадка указывает на присутствие в растворе анионов второй аналитической группы. В противном случае можно сделать вывод об их отсутствии (за исключением возможного присутствия бромат-ионов Br0-) в растворе.
Проба на присутствие анионов-окислителей. Наличие в растворе анионов-окислителей (As04- ,Br0- ,N0- ,N0-) устанавливают в отдельной пробе реакцией с йодидом калия в сернокислой среде (рН « 1) в присутствии раствора крахмала (или органического экстрагента). Окислители переводят йодид-ионы I- вйод I2, при образовании которого крахмальный раствор окрашивается в синий цвет (или органический слой экстрагента принимает фиолетовую окраску).
Методика. К 5-6 каплям анализируемого растивора прибавляют 2 капли разбавленной H2S04, 1-2 капли свежеприготовленного раствора крахмала и 2-3 капли раствора KI. Если раствор окрасился в синий цвет, то это означает, что в нем содержатся ионы-окислители As03- ,Br0- ,N0- ,N0-. Если синяя окраска не появляется, то эти анионы в растворе отсутствуют.
Проба на присутствие анионов-восстановителей. Наличие в растворе анионов-восстановителей устанавливают в отдельной пробе реакциями с йодом (раствор йода обесцвечивается, поскольку йод в нейтральной или слабокислой среде окисляет анионы-восстановители S2-, S02,- ,S203- ,As03 -) и с раствором перманганата калия в сернокислой среде (раствор перманганата калия обесцвечивается вследствие восстановления анионами-восстановителями S2-,S02- ,S203- ,С202- ,As03-,
Cl- ,Br- ,I- ,CN- ,SCN- ,N02-).
Методика
а) К 5-6 каплям анализируемого раствора прибавляют 1-2 капли разбавленной серной кислоты, 2-3 капли разбавленного раствора пер-манганата калия и при необходимости (если раствор не обесцветился) осторожно нагревают смесь. Если раствор обесцвечивается, то в нем присутствуют анионы-восстановители, указанные выше.
б) К 3-4 каплям анализируемого раствора прибавляют каплю разбавленной серной кислоты и 2-3 капли раствора йода. Обесцвечивание раствора указывает на присутствие в нем анионов S2-,S03- ,S202- ,As03-.
Дробное обнаружение анионов
С учетом данных, полученных при предварительных испытаниях, делают заключение о возможном присутствии тех или иных анионов в анализируемом растворе, после чего открывают отдельные анионы дробным методом. При дробном обнаружении анионов некоторые из них мешают открытию друг друга. Поэтому мешающие анионы обычно удаляют тем или иным способом.
Все нижеследующие операции проводят с отдельными пробами (несколько капель) исходного анализируемого раствора.
Открытие сульфат-иона. Ион S02.- обнаруживают в предварительных испытаниях реакцией с хлоридом бария в кислой среде, как описано выше (см. «Проба на присутствие анионов первой аналитической группы»).
Открытие сульфид-иона. (В учебной контрольной задаче этот анион не дается). Ион S2- обнаруживают, подкисляя пробу анализируемого раствора разбавленной Hd. Если сульфид-ион присутствует в анализируемом растворе, то из него при подкислении выделяется газообразный сероводород H2S, образование которого устанавливают по почернению фильтровальной бумаги, смоченной раствором соли свинца(П) (обычно - раствором ацетата свинца (CH3C00)2Pb или гидроксоком-плекса Na2[Pb(0H)4]), при поднесении ее к отверстию пробирки (образуется черный сульфид свинца(П) PbS).
Открытие карбонат-иона
а) Если в анализируемом растворе отсутствуют сульфит-ион S0 3- и тиосульфат-ион S203-, то карбонат-ион открывают по выделению газообразного диоксида углерода C02, который вызывает помутнение баритовой или известковой воды (см. выше «Аналитические реакции карбонат-иона»).
б) Если в анализируемом растворе присутствуют анионы S0 23- и S202-, также разлагающиеся в кислой среде с выделением газообразного продукта - диоксида серы S02, вызывающего помутнение баритовой или известковой воды, то карбонат-ион открывают одним из двух следующих способов.
Первый способ. К пробе анализируемого раствора (5-8 капель) в пробирке прибавляют 5-6 капель разбавленного (3 %) раствора перок-сида водорода H202 и слегка нагревают пробирку на водяной бане. Сульфит-ион окисляется до сульфат-иона S04-, а тиосульфат-ион - до тетратионат-иона S406-, которые уже не мешают открытию карбонат-иона. (Можно также окислять сульфит- и тиосульфат-ионы растворами перманганата калия KMn04 или дихромата калия K2Cr207). В полученном растворе открывают карбонат-ион, как описано выше в пункте а).
Второй способ. Опыт проводят с помощью прибора, состоящего из трех пробирок 1, 2 и 3 с пробками, соединенных последовательно газоотводными трубками (см. Учебник, кн. 1, гл. 18, с. 484).
В пробирку 1 вносят 10-20 капель анализируемого раствора, в пробирку 2 - разбавленный сернокислый раствор перманганата калия (розового цвета), в пробирку 3 - свежеприготовленную баритовую или известковую воду. Собирают прибор. Затем в пробирку 1быстро прибавляют 10 капель разбавленного раствора H2S04 или Hd и сразу же закрывают ее пробкой с газоотводной трубкой. Если в анализируемом растворе (пробирка 1) присутствует карбонат-ион, то в кислой среде он разлагается с выделением диоксида углерода C02, который, проходя через пробирку 2, попадает в раствор, заполняющий пробирку 3, и вызывает помутнение баритовой или известковой воды вследствие образования малорастворимых карбонатов бария BaC03 иCaC03 соответственно.
Если раствор в пробирке 2 обесцвечивается вследствие восстановления перманганат-ионов диоксидом серы S02, то это означает, что в анализируемом растворе присутствуют ионы S02- или S203- (или оба вместе), из-за разложения которых в кислой среде и образовался газообразный диоксид серы.
Помутнение раствора в пробирке 1 (образование элементной серы) указывает на присутствие тиосульфат-иона S2O32 ванализируемом растворе.
Если же раствор в пробирке 1 не мутнеет, то тиосульфат-ион отсутствует в анализируемом растворе.
Таким способом, как видно из изложенного, можно открывать не только карбонат-ион, но и тиосульфат-ион (раствор в пробирке 1 мутнеет, а в пробирке 2 - обесцвечивается), а при отсутствии тиосульфат-иона в анализируемом растворе - сульфит-ион (раствор в пробирке 1 остается прозрачным, а в пробирке 2 - обесцвечивается).
Открытие сульфит-иона
а) Если в анализируемом растворе отсутствуют анионы S2- иS2O 32, то сульфит-ион открывают, подкисляя пробу анализируемого раствора и идентифицируя выделяющийся газообразный SO2 в приборе для обнаружения газов, как было описано ранее (см. «Аналитические реакции сульфит-иона»).
б) Если в анализируемом растворе присутствуют ионы S2- иS2O 32, то сульфит-ион вначале переводят в осадок в виде сульфита стронция SrSO3, прибавляя к анализируемой пробе раствор соли стронция (SrCl2 или Sr(NO3)2):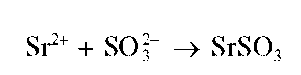
Осадок сульфита стронция затем отделяют, растворяют в кислоте, не допуская избытка кислоты (во избежание выделения газообразного SO2), и прибавляют желтый раствор йода I2 в KI. В присутствии сульфит-иона раствор йода обесцвечивается вследствие восстановления йода I2 сульфит-ионами до йодид-ионов I- .
Методика. В пробирку вносят ~10 капель анализируемого раствора и прибавляют раствор хлорида SrCl2 или нитрата Sr(NO3)2 стронция до полного осаждения сульфита стронция SrSO3 Cмесь центрифугируют, маточник отделяют от осадка, который промывают 4-5 каплями воды и удаляют промывную жидкость (во избежание попадания тиосульфат-ионов в осадок). К осадку прибавляют 2-3 капли разбавленной H2SO4 или HCl и затем по каплям - раствор йода в йодиде калия. Перемешивают смесь. Осадок сульфита стронция растворяется, а раствор йода обесцвечивается.
Открытие тиосульфат-иона
а) Ион S2O 32 можно открыть по помутнению пробы анализируемого раствора при подкислении ее серной или хлороводородной кислотой. В кислой среде тиосульфат-ион разлагается с выделением элемен-
тной серы - раствор мутнеет (см. выше «Предварительные испытания»).
б) Тиосульфат-ион можно открыть также, прибавляя к анализируемой пробе разбавленный раствор нитрата серебра - выпадает белый осадок тиосульфата серебра Ag2S203, постепенно чернеющий на воздухе вследствие образования черного сульфида серебра Ag2S.
Сульфид-ионы S2- мешают, поскольку также дают осадок Ag2S. Для удаления сульфид-ионов к раствору прибавляют небольшое количество свежеосажденного карбоната кадмия CdC03 и взбалтывают смесь. Образуется твердый CdS. Смесь CdC03 и CdS отфильтровывают и в фильтрате открывают тиосульфат-ион реакцией с нитратом серебра, как описано выше.
Открытие оксалат-иона
а) При отсутствии в исходном анализируемом растворе карбонат-ионов и анионов-восстановителей, мешающих обнаружению оксалат-ионов, последние открывают реакцией с перманганатом калия в сернокислой среде при нагревании раствора до ~60-70 °С в приборе для обнаружения газов (см. выше «Аналитические реакции оксалат-иона С202-») - раствор перманганата калия в пробирке 1 обесцвечивается вследствие восстановления перманганат-ионов оксалат-ионами, а баритовая или известковая вода в пробирке-приемнике 2 мутнеет за счет образования осадка карбоната бария BaC03 или карбоната кальция CaC03 при взаимодействии выделяющегося диоксида углерода с баритовой или известковой водой соответственно.
Методика. В пробирку 1 прибора для обнаружения газов вносят 1 мл анализируемого раствора, прибавляют 4-5 капель разбавленной серной кислоты и 5-6 капель разбавленного раствора перманганата калия до окрашивания раствора в пробирке 1 в бледно-розовый цвет. Быстро закрывают пробирку 1 пробкой с газоотводной трубкой, свободный конец которой погружен в баритовую или известковую воду, находящуюся в пробирке-приемнике 2. Пробирку 1 осторожно нагревают до ~60-70 °С. Если раствор в пробирке 1 обесцвечивается, а в пробирке 2 мутнеет, то это означает, что исходный анализируемый раствор содержит оксалат-ионы.
б) Если исходный анализируемый раствор содержит мешающие карбонат-ионы и анионы-восстановители, то оксалат-ион предварительно отделяют в виде оксалата кальция CaC204,действуянаанализи-руемый раствор избытком раствора хлорида кальция CaCl2 вуксусно-кислой среде (оксалат кальция нерастворим в уксусной кислоте) при нагревании. Полученный и тщательно промытый горячей водой (для
удаления возможных примесей мешающих анионов) осадок оксалата кальция обрабатывают раствором разбавленной серной кислоты при нагревании. При этом оксалат-ионы переходят в раствор, а в осадке остается сульфат кальция CаSO4:
К образовавшемуся раствору (который можно отделить от осадка сульфата кальция центрифугированием или фильтрованием) прибавляют разбавленный раствор перманганата калия. Если раствор пер-манганата калия обесцвечивается при нагревании, то это указывает на присутствие оксалат-ионов в исходной анализируемой пробе.
Методика. В пробирку вносят 10 капель анализируемого раствора, прибавляют по каплям разбавленную уксусную кислоту до рН « 4-5 (по универсальной индикаторной бумаге), ~10 капель раствора хлорида кальция (избыток) и нагревают пробирку на водяной бане. Выпадает белый осадок оксалата кальция, который отделяют центрифугированием, тщательно промывают 2-3 раза горячей дистиллированной водой, отделяют промывные воды, к осадку (в пробирке) прибавляют 8-10 капель разбавленной серной кислоты и несколько минут нагревают смесь на водяной бане. К горячему (~60-70 °C) раствору (предварительно его можно отделить от осадка сульфата кальция центрифугированием, хотя это и не обязательно) прибавляют по каплям и при встряхивании пробирки разбавленный раствор перманганата калия. Если прибавляемый раствор перманганата калия обесцвечивается, то это означает, что исходный анализируемый раствор содержит окса-лат-ионы.
Открытие тетраборат-иона. Тетраборат-ион обнаруживают в отдельной пробе анализируемого раствора (4-6 капель) по окрашиванию в зеленый цвет пламени горелки сложными эфирами борной кислоты (см. выше «Аналитические реакции борат-ионов B4O72 иBO2»).
Открытие ортофосфат-, арсенат- и арсенит-ионов (арсенат- и арсе-нит-ионы в обычной учебной контрольной задаче отсутствуют).
а) При отсутствии арсенат-ионов AsO42 и арсенит-ионов AsO32 в исходном анализируемом растворе ортофосфат-ионы открывают реакцией с молибдатом аммония (NH4)2MoO4 (см. выше «Аналитические реакции ортофосфат-ионов»), предварительно разрушив мешающие анионы-восстановители нагреванием с азотной кислотой.
Методика. В микротигель вносят 5-6 капель анализируемого раствора, прибавляют 5-6 капель концентрированной HNO3 и осторожно
выпаривают смесь досуха. При этом разрушаются мешающие анионы-восстановители. К полученному сухому остатку прибавляют 3 капли концентрированной HN03, кристаллик нитрата аммония NH4N03 (для повышения чувствительности реакции) и 9-10 капель раствора молибдата аммония. Если образуется желтый кристаллический осадок фосфоромолибдата аммония (NH4)3[P04(Mo03)12]mm же смесьокра-сится в желтый цвет, то это указывает на присутствие ортофос-фат-ионов в исходном анализируемом растворе.
б) В случае присутствия в анализируемом растворе арсенат-ионов и арсенит-ионов (при углубленном изучении качественного анализа)эти ионы мешают открытию ортофосфат-ионов реакцией с молибдатом аммония, так как арсенат-ион также образует желтый продукт реакции (арсенит-ионы окисляются до арсенат-ионов, которые реагируют с молибдатом аммония). В таком случае поступают следующим образом.
Вначале осаждают фосфат- и арсенат-ионы действием магнезиальной смеси (раствор MgCl2 иNH4C1 в водном аммиаке при рН « 9) в виде белого осадка, содержащего смесь магнийаммонийфосфата NH4MgP04 и магнийаммонийарсената NH4MgAs04 Этот осадок отделяют от раствора, в котором предполагается присутствие арсенит-иона, промывают дистиллированной водой и делят на две части, в одной из которых открывают фосфат-ион, а в другой - арсенат-ион.
Часть осадка растворяют в азотной кислоте и к полученному раствору прибавляют небольшое количество винной кислоты (в присутствии винной кислоты арсенат-ионы не образуют желтый продукт при реакции с молибдатом аммония) и избыток молибдата аммония. Если смесь окрасилась в желтый цвет фосфоромолибдата аммония, то это свидетельствует о присутствии ортофосфат-ионов в исходном анализируемом растворе.
Другую часть осадка растворяют в HCl, к полученному раствору прибавляют раствор йодида калия, небольшое количество органического экстрагента (бензол, хлороформ и др.) и перемешивают смесь. В присутствии арсенат-ионов последние окисляют йодид-ионы до свободного йода, который, переходя в органическую фазу, окрашивает ее в фиолетовый цвет.
Арсенит-ион As03- открывают в растворе, оставшемся после отделения осадка магнийаммонийфосфата и магнийаммонийарсената. Для этого используют разные реакции. Можно, подкислив этот раствор хлороводородной кислотой, осадить при нагревании желтый осадок сульфида мышьяка(Ш) As2S3 действием сероводорода или сероводо-
родной воды. Осадок растворяется в водном аммиаке, из которого он вновь осаждается при подкислении раствора.
Арсенит-ион открывают и реакцией с раствором AgN03 (выпадает желтый осадок арсенита серебра Ag3As03), а также окисляя арсе-нит-ионы до арсенат-ионов пероксидом водорода в присутствии магнезиальной смеси - образуется осадок NH4MgAs04.
Методика. В пробирку помещают 5-8 капель анализируемого раствора и прибавляют 6-8 капель магнезиальной смеси (или же ~3 капли разбавленного раствора NH4Cl в водном аммиаке при рН « 9(по универсальной индикаторной бумаге) и ~5 капель раствора MgCl2). Постепенно (в течение 10-15 минут) выпадает белый кристаллический осадок - смесь NH4MgP04 иNH4MgAs04.Для ускорения образования осадка стенки пробирки потирают стеклянной палочкой. Смесь центрифугируют, центрифугат сливают с осадка и сохраняют для дальнейшего обнаружения арсенит-ионов. Осадок промывают 2-3 раза небольшим количеством дистиллированной воды, в которую добавляют 2-3 капли раствора аммиака (для уменьшения растворения осадка), и делят на две примерно равные части, оставляя одну часть в пробирке для центрифугирования, а вторую часть переносят в другую пробирку. Одну часть осадка используют для открытия фосфат-ионов, другую - для открытия арсенат-ионов.
К одной части осадка прибавляют по каплям разбавленную HN03 до растворения осадка, 2-3 капли раствора винной кислоты и по каплям - раствор молибдата аммония (NH4)2Mo04. Если смесь окрасилась в желтый цвет (возможно образование желтого осадка), то это означает, что в исходном анализируемом растворе содержатся фосфат-ионы.
К другой части осадка (в другой пробирке) прибавляют по каплям разбавленную HCl до растворения осадка, 4-5 капель раствора йодида калия KI и 3-4 капли хлороформа или бензола. Смесь энергично встряхивают. Если органический слой окрасился в фиолетовый цвет вследствие образования свободного йода за счет окисления йодид-ионов арсенат-ионами, то это указывает на присутствие арсе-нат-ионов в исходном анализируемом растворе.
Для обнаружения арсенит-ионов As03- центрифугат, оставшийся после отделения осадков NH4MgP04 иNH4MgAs04,подкисляютпокап-лям разбавленной HCl до кислой реакции (по универсальной индикаторной бумаге) и добавляют по каплям сероводородную воду. Если ар-сенит-ион присутствует в растворе, то образуется желтый осадок сульфида мышьяка(Ш) As2S3 В этом случае смесь центрифугируют, центрифугат сливают с осадка, а к осадку прибавляют по каплям рас-
твор аммиака до растворения осадка сульфида мышьяка(Ш). К полученному раствору по каплям прибавляют разбавленную HCl. ^ова выпадает желтый осадок сульфида мышьяка(Ш).
При другом способе обнаружения арсенит-ионов к центрифугату после отделения осадков магнийаммонийфосфата и магнийаммонийар-сената добавляют по каплям раствор пероксида водорода H202 при перемешивании смеси. Выпадает белый осадок магнийаммонийарсената NH4MgAs04.
Открытие фторид-иона. Фторид-ион обнаруживают по обесцвечиванию красного раствора тиоцианатных комплексов железа(Ш), которые разрушаются в присутствии фторид-ионов с образованием устойчивого бесцветного фторидного комплекса железа(Ш) [FeF6]3- (см. выше «Аналитические реакции фторид-иона F- »).
Методика. Готовят красный раствор тиоцианатных комплексов же-леза(Ш), для чего к небольшому количеству раствора хлорида желе-за(Ш) FeCl3 прибавляют каплю разбавленного раствора тиоцианата калия KNCS и 2-3 капли разбавленной HCl.
В пробирку вносят 6-8 капель анализируемого раствора и по каплям при перемешивании прибавляют красный раствор тиоцианатных комплексов железа(Ш). Если первые прибавляемые капли красного раствора обесцвечиваются, то это указывает на присутствие фторид-иона в анализируемом растворе.
Открытие тиоцианат-ионов
а) Если в растворе отсутствуют йодид-ионы, то тиоцианат-ионы SCN-открывают реакцией с хлоридом железа(Ш) FeCl3 вкислойсреде (рН « 2-3). Образуются тиоцианатные комплексы железа(Ш) [Fe(NCS)n(H20)6- n]3- n, окрашивающие раствор в красный цвет. В кислой среде анионы кислот, разлагающихся в кислых растворах, не мешают проведению реакции, поскольку они не могут существовать в таких растворах. Для ускорения разложения этих анионов подкисленную (раствором HCl) пробу анализируемого раствора предварительно нагревают непродолжительное время, а затем уже открывают в ней тиоцианат-ионы.
Если из мешающих анионов кислот, разлагающихся в кислой среде, присутствуют только сульфид-ионы S2-, которые могут восстановить железо(Ш) до железа(11), не образующего красных тиоцианатных комплексов, то сульфид-ионы рекомендуется предварительно удалить в виде белого осадка сульфида цинка ZnS. Для этого к пробе анализируемого раствора при осторожном нагревании прибавляют по каплям раствор соли цинка (ZnS04 или (CH3C00)2Zn) до прекраще-
ния образования белого осадка сульфида цинка, который отделяют фильтрованием или центрифугированием, а уже в маточном растворе обнаруживают тиоцианат-ионы реакцией с раствором соли желе-за(Ш).
Реакцию можно проводить либо капельным методом на фильтровальной бумаге, как было описано выше (см. «Аналитические реакции тиоцианат-иона SCN- »), либо непосредственно в пробе анализируемого раствора по нижеследующей прописи.
Методика. В пробирку вносят 9-10 капель анализируемого раствора, 3-5 капель разбавленной HCl, осторожно нагревают (под тягой!) раствор почти до кипения (3-4 мин) и охлаждают до комнатной температуры. Прибавляют по каплям разбавленный раствор хлорида же-леза(Ш). Если в растворе присутствуют тиоцианат-ионы, то он окрашивается в красный цвет вследствие образования красных тиоцианат-ных комплексов железа(Ш).
б) Если в анализируемом растворе присутствуют йодид-ионы, то они мешают обнаружению тиоцианат-ионов реакцией с солями желе-за(Ш), так как железо(Ш) окисляет йодид-ионы до свободного йода:
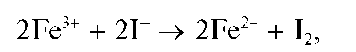
который окрашивает раствор в желто-коричневый цвет, скрадывающий красную окраску тиоцианатных комплексов железа(Ш).
Для устранения мешающего влияния йодид-ионов к пробе анализируемого раствора прибавляют несколько капель органического экст-рагента (например, хлороформа) и при добавлении раствора соли же-леза(Ш) энергично встряхивают смесь. Последняя расслаивается. Образовавшийся йод переходит в органическую фазу и окрашивает ее в малиново-фиолетовый цвет. Если в анализируемом растворе присутствуют тиоцианат-ионы, то водная фаза окрашивается в красный цвет тиоцианатных комплексов железа(Ш).
Таким способом одновременно открывают тиоцианат- и йодид-ионы.
Методика. В пробирку вносят 6-8 капель анализируемого раствора, 2-3 капли разбавленной HCl, 3-4 капли хлороформа, 6-8 капель раствора хлорида железа(Ш) и энергично встряхивают пробирку. Если в растворе одновременно присутствуют тиоцианат-ионы и йодид-ионы, то водный слой окрашивается в красный цвет, а органический - в малиново-фиолетовый. При отсутствии в растворе тиоциа-нат-ионов (но йодид-ионы присутствуют) водный слой приобретает бледно-желтую окраску (за счет небольшого количества остаточного
йода), а органический - малиново-фиолетовую. При отсутствии в растворе йодид-ионов (но тиоцианат-ионы присутствуют) водный слой окрашивается в красный цвет, а органический - остается бесцветным.
Открытие хлорид-иона
а) Если в растворе отсутствуют тиоцианат-ионы и цианид-ионы,то хлорид-ион открывают следующим образом. К азотнокислой пробе анализируемого раствора прибавляют раствор нитрата серебра AgNO3 до полного выпадения осадка солей серебра различных анионов, имевшихся в растворе, в том числе и осадка хлорида серебра AgCl. Осадок смеси солей отделяют и обрабатывают насыщенным водным раствором карбоната аммония (NH4)2CO3 Хлорид серебра растворяется:
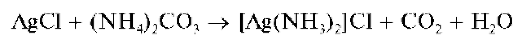
Cеребряные соли остальных анионов остаются в осадке. Бромид серебра AgBr, частично растворяющийся в водном аммиаке, в данном случае остается в осадке, так как он практически нерастворим в концентрированном растворе карбоната аммония.
Растворотделяютотосадкаидоказываютприсутствиевнемхло-рид-иона реакцией с HNO3 - выпадает белый осадок AgCl:
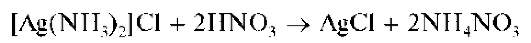
Проведению реакции мешают тиоцианат-ион и цианид-ион, так как выпадающие осадки AgSCN и AgCN также растворяются в растворе карбоната аммония с образованием комплексов [Ag(NH3)2]+.
Иногда осадок, полученный при осаждении солей серебра, рекомендуют обрабатывать не насыщенным водным раствором (NH4)2CO3, а реактивом Фаургольта - буферным раствором, содержащим аммиак, нитрат серебра и нитрат калия, в котором, как и в насыщенном растворе карбоната аммония, растворяется AgCl, но не растворяется AgBr.
Для приготовления реактива Фаургольта берут 1,7 г AgNO3,25 г KNO3, растворяют в небольшом количестве дистиллированной воды, прибавляют 17 мл 25 % раствора аммиака и доводят дистиллированной водой объем раствора до одного литра.
Методика. В пробирку вносят 5-10 капель анализируемого раствора, прибавляют ~0,5 мл разбавленной азотной кислоты и медленно, по каплям добавляют раствор AgNO3 до прекращения образования осадка солей серебра. Cмесь центрифугируют, центрифугат отделяют от осадка и к осадку прибавляют 10-12 капель насыщенного раствора карбоната аммония (NH4)2CO3 Cмесь тщательно перемешивают, центрифу-
гируют, отделяют центрифугат и прибавляют к нему по каплям концентрированную HNO3 Если наблюдается образование белого осадка AgCl, то это свидетельствует о присутствии хлорид-ионов в исходном анализируемом растворе.
б) Если в исходном анализируемом растворе имеются тиоцианат- и цианид-ионы (цианид-ионы в обычной учебной контрольной задаче должны отсутствовать), то они, как уже указывалось, мешают обнаружению хлорид-ионов вышеописанным способом, поскольку при взаимодействии с катионами серебра(1) они, как и хлорид-ион, образуют белые осадки малорастворимых солей серебра:
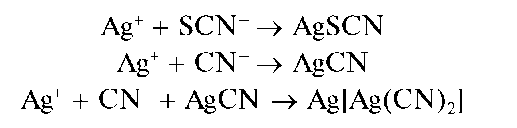
Эти осадки, так же, как и хлорид серебра, растворяются в растворе карбоната аммония с образованием тех же аммиачных комплексов серебра [Ag(NH3)2]+:
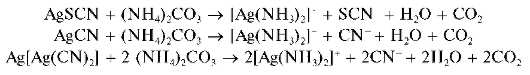
При подкислении такого раствора (действием HNO3) в осадок выпадают вместе с хлоридом серебра AgCl тиоцианат и цианид серебра, поскольку они также не растворяются в кислотах:
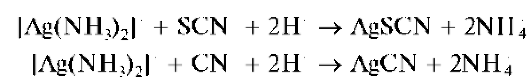
Поэтому при обнаружении хлорид-ионов в присутствии тиоцианат-и цианид-ионов анионы SCN- необходимо удалить, после чего
уже можно открывать хлорид-ионы, как указано выше (см. пункт а)).
Для этого пробу исходного анализируемого раствора вначале обрабатывают раствором AgNO3 вазотнокислойсредеиполучаютосадок, состоящий из смеси солей серебра различных анионов второй аналитической группы. Осадок отделяют, промывают водой и обрабатывают концентрированным раствором аммиака. Хлорид, тиоцианат, цианид и - частично - бромид серебра растворяются с образованием аммиачных комплексов серебра [Ag(NH3)2]+. Полученный раствор отделяют от оставшегося осадка и подкисляют концентрированной HNO3. В азотнокислой среде аммиачные комплексы серебра разрушаются, и
в осадок выпадает смесь хлорида, бромида, тиоцианата и цианида серебра. Осадок отделяют от раствора, переносят в фарфоровую чашку, прибавляют концентрированную HNO3 и нагревают смесь на водяной бане около часа (под тягой!). При длительном нагревании тиоцианат серебра разрушается:
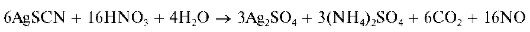
Цианид серебра при продолжительном нагревании с концентрированной азотной кислотой разлагается с образованием синильной кислоты HCN:
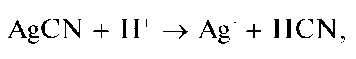
которая частично улетучивается, а частично разрушается. В осадке остаются хлорид AgCl и бромид AgBr серебра. Этот осадок отделяют, промывают водой и обрабатывают насыщенным раствором карбоната аммония или реактивом Фаургольта. Бромид серебра остается в осадке, а хлорид серебра переходит в раствор в виде аммиачного комплекса [Ag(NH3)2]Cl. Раствор отделяют от осадка бромида серебра и подкисляют концентрированной HNO3 Если при этом образуется белый осадок хлорида серебра, то это означает, что исходный анализируемый раствор содержит хлорид-ионы.
В осадке бромида серебра открывают бромид-ионы. Для этого осадок бромида серебра промывают водой и прибавляют к нему свежеприготовленную хлорную воду, разбавленную серную кислоту и хлороформ (экстрагент для брома). Бромид-ионы окисляются хлорной водой до свободного брома Br2:
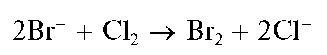
Выделившийся бром переходит в органическую фазу и окрашивает ее в желто-бурый цвет. При избытке хлорной воды бром реагирует с хлором с образованием желтого BrCl:
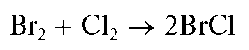
Желто-бурая окраска органической фазы при этом изменяется на светло-желтую.
Таким способом одновременно с хлорид-ионами открывают и бромид-ионы.
Методика. В пробирку вносят 10 капель анализируемого раствора, прибавляют 5 капель разбавленной HNO3 и 10-15 капель раствора AgNO3 Выпадает белый осадок смеси солей серебра. Cмесь центрифу-
гируют, центрифугат отделяют, осадок промывают два раза небольшим количеством дистиллированной воды (каждый раз удаляя промывные воды после взмучивания и центрифугирования смеси) и прибавляют к нему 8-10 капель концентрированного раствора аммиака при перемешивании смеси. Затем смесь центрифугируют и отделяют раствор от оставшегося осадка. К раствору, который содержит аммиачные комплексы серебра, а также Cl- ,Br- ,SCN- иС1^ , прибавляют по каплям концентрированную HN03 до прекращения образования осадка, содержащего хлорид, бромид, тиоцианат и цианид серебра. Cмесь центрифугируют, осадок отделяют от центрифугата, переносят в фарфоровую чашку, прибавляют к нему 10-15 капель концентрированной HN03 и полученную смесь нагревают (под тягой!) на водяной бане около одного часа. К смеси, оставшейся после нагревания, добавляют 5-8 капель воды, перемешивают смесь, центрифугируют, отделяют осадок, состоящий из смеси AgCl и AgBr, от центрифугата, промывают 2-3 раза небольшим количеством воды (каждый раз центрифугируя смесь и отбрасывая промывные воды) и прибавляют к осадку 6-8 капель насыщенного раствора карбоната аммония (NH4)2C03 (или реактива Фаургольта) при перемешивании смеси. Раствор, в который перешел хлорид серебра, отделяют от осадка бромида серебра и обе фазы анализируют раздельно.
Раствор медленно, по каплям подкисляют концентрированной HN03. Выделение белого осадка AgCl или помутнение раствора указывают на присутствие хлорид-ионов в исходном анализируемом растворе.
К осадку бромида серебра прибавляют 2-3 капли разбавленной H2S04, 8-10 капель хлорной воды, 3-4 капли хлороформа и энергично встряхивают смесь. Если в исходном анализируемом растворе содержались бромид-ионы, то хлороформный слой принимает желто-бурую или желто-оранжевую окраску (цвет Br2), переходящую затем в светло-желтую (цвет BrCl). Если такое изменение окраски (с желто-бурой на светло-желтую) не произошло, то следует добавить еще несколько капель хлорной воды при встряхивании смеси до изменения окраски органической фазы.
Открытие бромид- и йодид-ионов. В присутствии ионов SCN- ,Cl- бромид- и йодид-ионы открывают одновременно с этими анионами, как описано выше. Однако их можно открыть и в отдельной пробе анализируемого раствора реакцией с окислителями - обычно с хлорной водой или хлорамином (см. выше «Аналитические реакции йодид-иона»).
Для этого к пробе анализируемого раствора прибавляют свежеприготовленную хлорную воду, разбавленную серную кислоту и хлороформ. Вначале йодид-ионы окисляются до свободного йода:
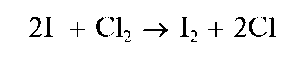
Йод переходит в органическую фазу и окрашивает ее в фиолетовый цвет. По мере дальнейшего прибавления хлорной воды йод окисляется до бесцветных йодат-ионов IO2:
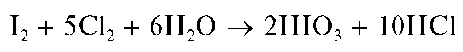
Фиолетовая окраска органической фазы исчезает. При этом бромид-ионы также окисляются хлорной водой до брома. Образовавшийся бром окрашивает хлороформный слой в желто-бурый цвет. При избытке хлорной воды образуется желтый BrCl, и органическая фаза изменяет окраску от желто-бурой до светло-желтой, как было описано ранее.
Методика. В пробирку вносят 5-6 капель анализируемого раствора, 1-2 капли разбавленной H2SO4, 4-5 капель хлороформа, 1-2 капли свежеприготовленной хлорной воды и энергично встряхивают смесь. Если органический слой окрасился в фиолетовый цвет, то это свидетельствует о присутствии йодид-ионов в исходном анализируемом растворе. Продолжают прибавлять по каплям хлорную воду при встряхивании смеси. Фиолетовая окраска органического слоя исчезает. Если после этого органический слой окрасился в желто-бурый, а затем в светло-желтый цвет, то это указывает на присутствие бромид-ионов в исходном анализируемом растворе.
Открытие бромат-иона. Бромат-ион открывают в отдельной пробе анализируемого раствора по выделению свободного брома при реакции с бромид-ионами в кислой среде (см. выше «Аналитические реакции бромат-иона BrO2»:
Образующийся бром обнаруживают по выделению бурых паров брома и по окрашиванию в желто-бурый цвет прибавленного органического экстрагента (например, хлороформа).
Методика. В пробирку вносят 3-4 капли анализируемого раствора, 2-3 капли раствора HCl, 5-6 капель хлороформа, прибавляют 4-5 капель раствора бромида калия KBr и встряхивают смесь. Если после расслаивания смеси органический слой окрасился в желто-бурый
цвет, то это указывает на присутствие бромат-иона в исходном анализируемом растворе.
Открытие цианид-иона (в обычной учебной контрольной задаче цианид-ионы отсутствуют). Цианид-ионы CN- открывают в отдельных пробах анализируемого раствора двумя способами.
а) Первый способ. ^нильная кислота HCN - очень слабая кислота, поэтому вытесняется из своих солей уже в очень слабокислой среде, например, при реакции с NaHCO3 в уксуснокислой среде. Выделяющуюся парообразную синильную кислоту (ее выделение ускоряется при нагревании раствора) идентифицируют в приборе для обнаружения газов по помутнению азотнокислого раствора AgNO3 впробир-ке-приемнике 2 вследствие образования осадка цианида серебра
AgCN:
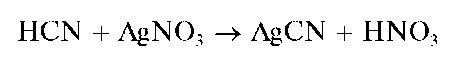
Методика. Все операции проводятся только под тягой! В пробирку 1 прибора для обнаружения газов вносят 3-5 капель анализируемого раствора, прибавляют очень небольшое количество твердого бикарбоната натрия NaHCO3, 3- 4 капли 30 % уксусной кислоты CH3COOH и быстро закрывают пробкой с газоотводной трубкой, свободный конец которой погружен в азотнокислый раствор AgNO3 в пробирке-приемнике 2. Осторожно нагревают пробирку 1. Помутнение раствора в пробирке-приемнике 2 (вследствие образования малорастворимого AgCN) указывает на присутствие цианид-ионов в исходном анализируемом растворе.
б) Второй способ. Цианид-ионы открывают также реакцией образования синего осадка берлинской лазури по методике, описанной выше (см. «Аналитические реакции цианид-иона CN- »), заменяя только раствор KCN на анализируемый раствор.
Открытие нитрит-иона. Нитрит-ион NO2 открывают в отдельных пробах анализируемого раствора реакциями с реактивом Грисса-Илошвая и с антипирином по методикам, описанным ранее (см. «Аналитические реакции нитрит-иона NO22»).
Если нитрит-ион открыт, то его обычно удаляют (разрушают), поскольку он мешает открытию нитрат-иона NO32. Для удаления нитрит-иона небольшое количество анализируемого раствора нагревают с солью аммония (например, с NH4Cl); при этом нитрит-ионы разрушаются: 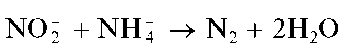
Методика удаления нитрит-ионов была описана ранее (см. «Аналитические реакции нитрит-иона N03 »).
Раствор после удаления нитрит-ионов используют для открытия нитрат-ионов.
Открытие нитрат-иона. В пробе, полученной после удаления нитрит-ионов, открывают нитрат-ион N03 реакциями с антипирином и дифениламином по методикам, описанным ранее (см. выше «Аналитические реакции нитрат-иона N03»), используя анализируемый раствор вместо растворов NaN03 или KN03.
Открытие ацетат-иона. Ацетат-ион СН3С00-открывают в отдельной пробе раствора реакцией образования уксусноэтилового эфира, обладающего характерным приятным запахом (см. выше «Аналитические реакции ацетат-иона CH3C00- »).
Методика. В пробирку вносят 6-8 капель анализируемого раствора, 4-5 капель концентрированной H2S04, 6-8 капель этанола и 1-2 капли раствора AgN03 (катализатор). Осторожно нагревают смесь на водяной бане. Ощущается характерный приятный запах уксусноэтило-вого эфира.
При отсутствии мешающих анионов ацетат-ион открывают также реакцией с хлоридом железа(Ш) FeCl3 (см. выше «Аналитические реакции ацетат-иона CH3C00- »).
2. Систематический анализ смеси анионов
Эту схему анализа рекомендуется использовать только при углубленном изучении качественного анализа (в курсовых и элективных работах).
Не существует такая схема систематического анализа смеси анионов в растворе, которая была бы общепринятой и детально отработанной, в отличие от систематического анализа смеси катионов. Предложены различные варианты систематического хода анализа смеси анионов. В любом из этих вариантов часть анионов открывают дробным методом в отдельных пробах анализируемого раствора. Групповые реагенты и в этих случаях чаще всего применяют не столько для полного разделения групп анионов, сколько для обнаружения их присутствия в растворе и частичного разделения.
В фармацевтическом анализе, включая весь фармакопейный анализ, систематический ход анализа смеси анионов практически никогда не применяется - анионы открывают отдельными аналитическими реакциями.
Последовательность операций при систематическом анализе смеси анионов в растворе в общих чертах заключается в следующем. Вначале
проводятся предварительные испытания, затем дробным методом в отдельных пробах анализируемого раствора открывают некоторые анионы, после чего уже осуществляют разделение анионов с использованием групповых реагентов с последующим открытием каждого аниона в разделенных осадках и растворах.
1. Предварительные испытания
Эти испытания проводят так же, как и при анализе смеси анионов дробным методом (см. выше). Устанавливают присутствие или отсутствие анионов неустойчивых кислот, разлагающихся в кислой среде, окислителей и восстановителей, анионов первой и второй аналитических групп, сульфат-аниона.
2. Дробное открытие некоторых анионов
C учетом сведений, полученных при предварительных испытаниях, намечается конкретный план дальнейшего анализа.
В отдельных порциях анализируемого раствора открывают те анионы, обнаружению которых не мешают другие анионы, которые могут присутствовать в растворе (либо их мешающее действие может быть устранено). При этом используют аналитические реакции и методики, описанные в предыдущем разделе, а также - при необходимости - другие аналитические реакции анионов. Обычно на данном этапе анализа открывают анионы S04~ ,S02_ ,S202_ ,С02_ ,B4073 (B03), P04-,As03r,As03-,CN-,SCN-,N03,N0^,CH3C00- и, возможно, некоторые другие.
3. Cистематический ход анализа
При систематическом ходе анализа для частичного или полного отделения анионов первой аналитической группы используют насыщенный раствор либо ацетата кальция (CH3C00)2Ca, либо нитрата стронция Sr(N03)2, либо нитрата бария Ba(N03)2. Для осаждения анионов второй аналитической группы применяют раствор AgN03 вазот-нокислой среде. Для одновременного отделения анионов первой и второй аналитических групп от анионов третьей аналитической группы действуют раствором Ag2S04 в нейтральной или слабощелочной среде. При этом осаждаются все анионы первых двух аналитических групп в виде их серебряных солей (в отличие от кислых растворов, в которых соли серебра анионов первой аналитической группы растворяются). В растворе остаются анионы третьей аналитической группы.
Рассмотрим кратко один из вариантов, в котором в качестве осади-теля части анионов первой аналитической группы используется насыщенный раствор ацетата кальция в слабощелочной среде.
Пусть в исходном анализируемом растворе могут присутствовать все анионы всех трех аналитических групп, за исключением F- ,CN- , SCN-иBr03.
К части анализируемого раствора (рН = 9-10; если рН < 9, то прибавляют по каплям раствор аммиака до достижения указанного значения рН) добавляют по каплям насыщенный раствор ацетата кальция (CH3C00)2Ca до прекращения образования осадка. Полученный белый осадок (обозначим его «осадок 1») может содержать смесь CaC03, CaS04,Ca3(P04)2,Ca3(As04)2,Ca3(As03)2,Ca(B02)2,CaC204 В растворе («раствор 1») остаются все остальные анионы: S02~ ,S2- ,S203~ ,Cl- , Br- ,I- ,N03 ,N03 ,CH3C00-.
Cмесь осадка 1 с раствором 1 центрифугируют, осадок 1 отделяют от раствора 1, промывают 2-3 раза дистиллированной водой, переносят в пробирку 1 прибора для открытия карбонат- и сульфит-ионов, растворяют, прибавляя разбавленную HCl в пробирку 1,иоткрывают карбонат-ион (по помутнению известковой или баритовой воды в пробирке 3) и сульфит-ион (по обесцвечиванию раствора KMn04 впро-бирке 2), как было описано ранее (см. выше «Открытие карбонат-иона»).
В отдельных пробах раствора, оставшегося в пробирке 1 после растворения осадка 1 в хлороводородной кислоте, открывают фосфат-, арсенат-, арсенит-, борат- и оксалат-ионы дробным методом, как было описано выше, или несколько модифицируя приведенные ранее методики.
Раствор 1 после отделения кальциевых солей используют для открытия других анионов.
Cульфид-ион открывают в отдельной пробе раствора 1 реакцией с солью цинка в аммиачной среде - выпадает белый осадок сульфида цинка ZnS. Если сульфид-ион открыт (таким способом), то его отделяют в оставшейся части раствора 1 от других анионов в виде осадка ZnS, действуя аналогично аммиачным раствором соли цинка. Осадок сульфида цинка отделяют центрифугированием. Отбирают 2-3 капли центрифугата (раствора 2), подкисляют разбавленной HCl и осторожно нагревают на водяной бане до помутнения раствора (образование элементной серы), что свидетельствует о присутствии тиосульфат-иона в исходном растворе.
Йодид-ион открывают в отдельной пробе раствора 2 дробным методом, как было описано ранее.
Если йодид-ион и тиосульфат-ион открыты, то их удаляют из раствора 2, действуя азотной кислотой и насыщенным раствором нитрита
натрия NaN02. Йодид- и тиосульфат-ионы окисляются. Раствор мутнеет вследствие выделения элементной серы и окрашивается в буро-желтый цвет за счет образования йода.
Cмесь нагревают для удаления йода I2 (йод при нагревании улетучивается). Полноту удаления йода контролируют раствором крахмала. Cмесь центрифугируют, осадок серы отделяют от центрифугата. Последний обрабатывают азотнокислым раствором AgN03 до прекращения образования осадка AgCl и AgBr. Этот осадок отделяют центрифугированием, промывают водой и открывают в нем анионы Cl- иBr-, какбылоописановыше.
Для открытия анионов третьей аналитической группы (N03 ,N0^, CH3C00- ) часть исходного анализируемого раствора (нейтрального или слабощелочного) обрабатывают раствором сульфата серебра Ag2S04. Анионы первой и второй аналитических групп переходят в осадок в виде солей серебра, малорастворимых в нейтральной или слабощелочной среде. В растворе остаются анионы третьей аналитической группы. Раствор после отделения от осадка центрифугированием анализируют на присутствие в нем ионов N03 ,N0^ иCH3C00- по методикам, описанным ранее.
Контрольные вопросы
1. Какие индифферентные анионы можно обнаружить дробным методом при анализе смеси анионов?
2. Почему нельзя открывать карбонат-ион в присутствии сульфит- и тиосульфат-ионов? Напишите уравнения соответствующих реакций.
3. Какой групповой реакцией можно обнаружить присутствие сульфид-, сульфит- и тиосульфат-ионов?
4. Как проводят обнаружение карбонат-иона: а) в отсутствие мешающих ионов; б) в их присутствии?
5. Как проводят обнаружение тиосульфат-иона в смеси анионов S02,3 иS202- ?
6. Как проводят обнаружение оксалат-иона: а) в отсутствие мешающих анионов; б) в присутствии мешающих анионов?
7. Как проводят обнаружение тиоцианат- и йодид-ионов при совместном присутствии?
8. Как проводят обнаружение йодид- и бромид-ионов при совместном присутствии?
9. Какую реакцию используют для обнаружения бромат-ионов в присутствии нитрат-ионов?
10. Как обнаруживают хлорид-ион в смеси галогенид-ионов?
11. Какие реакции позволяют обнаружить нитрит-ион в присутствии нитрат-иона?
12. Как открывают сульфат-ион в присутствии сульфит- и тиосульфат-ионов?
13. Предложите схему анализа смеси йодид-, тиоцианат и ацетат-ионов.
Примеры тестовых пунктов текущего контроля по теме IV
I. Задания на установление соответствия
Инструкция. Установите соответствие. Каждый ответ может быть использован один раз, несколько раз или не использован совсем.
II. Тестовые пункты с одним правильным ответом Инструкция. Из следующих за утверждением ответов выберите один правильный.
11. Для обнаружения тетраборат-иона используют реакцию
A. C хлоридом бария в нейтральной или слабощелочной среде
B. Окрашивание пламени горелки сложными эфирами борной кислоты
C. C нитратом серебра в кислой среде
D. C нитратом серебра в нейтральной среде Напишите уравнение соответствующей реакции. Ответ:В
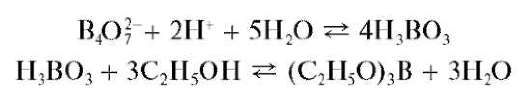
III. Задания с выбором одного или нескольких правильных ответов Инструкция. Для каждого незаконченного утверждения один или
несколько ответов являются правильными. Выберите номера правильных ответов.
12. Анализируемый раствор имеет рН менее 2. Не могут присутствовать в растворе анионы:
1. сульфит-ион
2. тиосульфат-ион
3. карбонат-ион
4. нитрит-ион Ответ:1,2,3,4
IV. Тестовые пункты на определение причинно-следственных взаимосвязей
Инструкция. Вопрос состоит из двух утверждений, соединенных союзом «потому что». Проверьте, верно или неверно каждое утверждение в отдельности, а затем связь между ними. Для выбора ответов используйте приведенную ниже схему.
Ответ Утверждение I Утверждение II Связь
А верно верно верно
В верно верно неверно
C верно неверно неверно
D неверно верно неверно
Е неверно неверно неверно
13. При добавлении к раствору, содержащему тиоцианат-ионы, хлорида железа(Ш) в присутствии разбавленной азотной кислоты раствор обесцвечивается, потому что тиоцианат-ионы образуют с солями железа(Ш) комплексные соединения.
Ответ'D
Содержание письменной контрольной работы по теме IV
1. Теоретические основы качественного анализа.
1.1. Применение закона действующих масс к гомогенным равновесиям в окислительно-восстановительных системах.
Обратимые окислительно-восстановительные системы. Уравнение Нернста. Окислительно-восстановительные электродные потенциалы (условный, реальный, стандартный, формальный).
Электродвижущая сила раствора. Влияние концентраций ионов и рН на значения потенциалов окислительно-восстановительных пар и на направление протекания реакций в растворах.
Константы равновесия окислительно-восстановительных реакций. Глубина протекания реакций.
Использование окислительно-восстановительных реакций в химическом анализе.
1.2. Применение закона действующих масс к равновесиям в растворах комплексных соединений.
Общая характеристика комплексных (координационных) соединений.
Типы комплексных соединений, используемых в аналитической химии. Устойчивость, растворимость, окраска комплексных соединений.
Константы устойчивости и константы нестойкости комплексных соединений.
Комплексные соединения металлов с органическими реагентами. Функционально-аналитические, хромофорные и ауксохромные группы в органических реагентах.
Основные типы соединений с органическими реагентами, применяемые в анализе: внутрикомплексные соединения, хелаты, ионные ассоциаты.
Важнейшие органические реагенты, применяемые в анализе: диме-тилглиоксим, 1-нитрозо-2-нафтол, ализарин, дитизон, 8-оксихино-лин, купрон, магнезон, дифенилкарбазид и др.
Использование комплексных соединений с неорганическими и органическими лигандами в анализе.
2. Анализ анионов.
2.1. Аналитическая классификация анионов, основанная на образовании малорастворимых соединений. Групповые реагенты и состав аналитических групп анионов.
2.2. Аналитическая классификация анионов, основанная на их окислительно-восстановительных свойствах. Групповые реагенты и состав аналитических групп.
2.3. Аналитические реакции анионов первой, второй и третьей групп.
2.4. Анализ смеси анионов.
3. Вычислительные задачи.
3.1. Расчет реального потенциала редокс-пары.
3.2. Определение направления окислительно-восстановительных реакций в стандартных состояниях веществ.
3.3. Определение направления окислительно-восстановительных реакций в реальных условиях.
3.4. Расчет глубины протекания окислительно-восстановительных реакций.
3.5. Расчет концентрации ионов металла-комплексообразователя и лигандов в растворах комплексных соединений.
3.6. Расчет возможности осаждения ионов металла-комплексообра-зователя при добавлении ионов, образующих с ним малорастворимые соединения.
Пример билета письменной контрольной работы по теме IV (дневное отделение)
1. Общая характеристика комплексных (координационных) соединений.
2. Дробный анализ и аналитические реакции смеси анионов: P043, Cl- ,N03.
3. Вычислите условный окислительно-восстановительный потенциал редокс-пары Fe3+ |Ре2+,если a (Fe3+): a (Fe2+)=10:1.
4. Образуется ли осадок йодида серебра, если к 2 мл 2 моль/л раствора [Ag(NH3)2]N03 прилить равный объем 1 моль/л раствора KI?
Пример билета письменной контрольной работы по теме IV (вечернее отделение)
1. Направление протекания окислительно-восстановительных реакций в стандартных состояниях веществ и в реальных условиях.
2. Дробный анализ и аналитические реакции смеси анионов: Cl-, As03f ,S02-.
3. Как изменится равновесная концентрация ионов кадмия(П) в 0,5 моль/л растворе комплексного иона [CdI5]3- , если в этот раствор добавить калия иодид до концентрации 1,0 моль/л? Влиянием ионной силы пренебречь.