Клиническая фармакология. Общие вопросы клинической фармакологии. Практикум: учебное пособие. Сычев Д.А., Долженкова Л.С., Прозорова В.К. и др. / Под ред. В.Г. Кукеса. 2013. - 224 с.: ил.
|
|
|
|
МОДУЛЬ 8 КЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ. ДОКАЗАТЕЛЬНАЯ МЕДИЦИНА. ФАРМАКОЭКОНОМИКА. КЛИНИКО-ФАРМАКОЛОГИЧЕСКАЯ СЛУЖБА СТАЦИОНАРА. ВРАЧ И ФАРМАЦЕВТИЧЕСКИЙ БИЗНЕС*
После освоения темы студент должен знать
1. Этапы и принципы проведения клинических исследований
ЛС.
2. Понятие доказательной медицины, уровни доказательности по отношению к применению ЛС.
3. Понятие о метаанализе.
4. Понятие о фармакоэкономике.
5. Виды фармакоэкономического анализа.
6. Задачи клинико-фармакологической службы в стационаре.
7. Методы влияния фармацевтического бизнеса на принятие решение врачом о применении ЛС.
После освоения темы студент должен уметь
1. Использовать результаты клинических исследований, метаанализа, фармакоэкономического анализа в своей практической деятельности для принятия решения о выборе и применении ЛС.
2. Определять показания для консультации врача - клинического фармаколога.
3. Анализировать рекламные материалы фармацевтических компаний, статьи и доклады, спонсируемые фармацевтическими компаниями.
* В подготовке модуля принимал участие докт. мед. наук, проф. В.В. Архипов.
Литература, необходимая для освоения темы
Основная
Кукес В.Г. Клиническая фармакология. - М.: ГЭОТАР-Медиа, 2008. - С. 238-262.
Дополнительная
Мелихов О.Г. Клинические исследования. - М.: Атмосфера,
2003. - 200 с.
Петров В.И., Недогода С.В. Медицина, основанная на доказательствах. - М.: ГЭОТАР-Медиа, 2009. - 141 с.
Власов В.В. Введение в доказательную медицину. - М.: Медиа
Сфера, 2001. - 392 с.
Петров В.И. Прикладная фармакоэкономика. - М.: ГЭОТАР-
Медиа, 2005. - 336 с.
Воробьев П.А., Авксентьева М.В., Юрьев А.С., Сура М.В. Клиникоэкономический анализ. - М.: Ньюдиамед, 2004. - 403 с.
Служба клинической фармакологии в лечебном учреждении / под общ. ред. В.Г. Кукеса, Ю.Б. Белоусова, Ю.Н. Чернова. - Воронеж: Истоки, 2005. - С. 32.
Справочник-путеводитель практикующего врача: лекарственные средства / под общ. ред. Р.В. Петрова, Л.Е. Зиганшиной. - М.:
ГЭОТАР-Медиа, 2003. - 800 с.
Доказательная медицина. Ежегодный справочник. - М.:
МедиаСфера, 2002. - вып. 1. - 1400 с.
Доказательная медицина. Ежегодный справочник. - М.: МедиаСфера, 2003. - вып. 2. - части 1-7.
Доказательная медицина. Ежегодный справочник. - М.:
МедиаСфера, 2004. - вып. 3. - 694 с.
Лекция, которую необходимо прослушать для освоения темы
Архипов В.В. Фармакоэкономика.
Архипов В.В. Доказательная медицина.
http://lech.mma.rU/clinpharm/ucheb/pharm/lekt/1
Выполните тестовые задания для самоконтроля
Выберите один или несколько правильных ответов
I. Относительный риск (RR) развития хронической почечной недостаточности при приеме ЛС, равный 1,4, означает:
A. 1,4% случаев заболеваемости ХПН в популяции обусловлено приемом данного ЛС.
Б. У лиц, принимающих ЛС, заболеваемость ХПН возрастает в 1,4 раза по сравнению с лицами, не принимающими данное ЛС.
B. Заболеваемость ХПН, обусловленная приемом данного ЛС, в популяции составляет 1,4 случая на 1000 человек в год.
II. Установите соответствие между видами клинических исследований ЛС и их определением:
A. Когортные исследования.
Б. Рандомизированные контролируемые исследования.
B. Описание серии случаев.
Г. Исследования «случай-контроль».
1. Исследования, в которых группу пациентов с уже развившимся исходом сравнивают с контрольной группой, не имеющей данного исхода, оценивают частоту приема соответствующего ЛС в каждой из групп. Данный вид исследований предполагает изучение редких по частоте развития эффектов ЛС при частом применении ЛС в популяции больных.
2. За группой пациентов, использующих определенный вид лечения, ведется наблюдение до развития интересующего исхода; частота развития исхода сравнивается с таковым в контрольной группе; данный вид исследований проводится для изучения эффектов ЛС, применяемых очень редко.
3. Предусматривают наличие контроля или контрольной группы, испытуемые попадают в группу методом случайной выборки.
4. Сообщение о группе сходных клинических наблюдений (исходов) у пациентов, принимавших препарат.
III. Расположите виды исследований по убыванию силы доказательности:
A. Нерандомизированные контролируемые испытания. Б. Неконтролируемые испытания.
B. Рандомизированные контролируемые испытания (РКИ). Г. Систематический обзор, метаанализ РКИ.
Д. Описательные исследования, мнения специалистов.
Зачем врачу необходимо знать о методологии проведения клинических исследований лекарственных средств?
Клиническое исследование (КИ) - это любое исследование с участием людей в качестве испытуемых (не только ЛС), в частности проводящееся для выявления или проверки клинических, фармакологических и/или фармакодинамических свойств одного или нескольких исследуемых медицинских продуктов, и/или нежелательных реакций на один или несколько медицинских продуктов, и/или изучение всасывания, распределения, метаболизма и выведения одного или нескольких медицинских продуктов с целью подтверждения его/их безопасности и/или эффективности. Таким образом, целями КИ лекарственных средств считаются оценка терапевтической или профилактической эффективности и переносимости нового ЛС, установление наиболее рациональных доз и схем его применения, а также сравнительная характеристика с уже существующими препаратами. Таким образом, при проведении КИ оцениваются эффективность и безопасность ЛС и других лечебных вмешательств. В КИ для оценки эффективности ЛС используются так называемые конечные точки. Первичные конечные точки - это основные показатели, связанные с возможностью удлинения жизни больного. В клинических исследованиях к ним относят такие показатели, как общая смертность, смертность от сердечно-сосудистых заболеваний и т.д. Вторичные конечные точки отражают улучшение качества жизни либо вследствие снижения заболеваемости нелетальным инфарктом миокарда, либо из-за облегчения симптомов заболевания, например бронхиальной астмы (уменьшение частоты приступов). В некоторых КИ могут оцениваться третичные (суррогатные) конечные точки - показатели любых лабораторных исследований или физикальных данных, которые используются в качестве основы для клинического выражения конечной точки (например, уровень холестерина ЛНП). Результаты клинических исследований ЛС лежат в основе разработки всех разделов инструкции и ТКФС.
Выполните задание для самостоятельной работы
Задание 8.1. Проведите анализ характеристик каждой фазы клинических исследований ЛС, заполнив табл. 8.1.
Таблица 8.1. Фазы клинических испытаний
Фазы клинического исследования | Цель клинического исследования | Характеристика участников клинического исследования | Раздел инструкции, для которого по результатам исследования получают информацию |
Фаза Ι | |||
Фаза ΙΙ | |||
Фаза ΙΙΙ | |||
Фаза ГУ |
Данные об эффективности ЛС при тех или иных заболеваниях (состояниях, синдромах, при наличии симптомов), которые фигурируют в разделе «Показания» инструкции и ТКФС, могут быть получены в КИ различных видов. В соответствии с этим обозначают так называемые уровни доказательности (рейтинги доказательности) эффективности совокупности данных в отношении определенного применения ЛС. Как правило, уровень доказательности обозначается латинскими буквами от A до D, где А соответствует самому высокому уровню (данные нескольких рандомизированных клинических исследований), а D - самому низкому уровню (отдельные клинические наблюдения, мнения экспертов или консенсус экспертов). Существуют и другие классификации уровней доказательности (по классам от I до IV, по буквам от A до E;
эти классификации доказательности применяются в отдельных программах и не различаются по принципу). Наличие в разделе «Показания» инструкции или ТКФС заболевания не означает, что эффективность ЛС при нем соответствует самому высокому уровню доказательности.
Самому высокому уровню доказательности соответствуют результаты нескольких рандомизированных клинических исследований, включающих большое количество пациентов, выполненных в соответствии с международными стандартами, именуемыми как GCP (Good Clinical Practice), которые приняты и в России.
Полезная интернет-ссылка
ГОСТ GCP на русском языке доступен по адресу: http://gosts. skgvh.ru/Index/2/2925.htm
Выполните задание для самостоятельной работы
Задание 8.2. Охарактеризуйте основные требования к клиническим исследованиям, результаты которых соответствуют уровню доказательности А, заполнив табл. 8.2.
Таблица 8.2. Требования к клиническим исследованиям
Требования, предъявляемые к клиническому исследованию | Что это означает? |
Контролируемое | |
Рандомизированное | |
Проспективное | |
Слепое Одинарное слепое Двойное слепое |
Также самому высокому уровню доказательности соответствуют результаты метаанализов рандомизированных клинических исследований и так называемые систематические обзоры. Цель систематических обзоров (по Дж. Ласту): «...критический обзор публикаций по конкретной проблеме, связанных со здоровьем; в нем используют точные, стандартизированные методы отбора и оценки статей». Главным «генератором» систематических обзоров считается так называемое Кокрановское сотрудничество - международная некоммерческая организация, члены которой отыскивают и обобщают результаты всех когда-либо проведенных рандомизированных клинических испытаний лечебных и диагностических вмешательств с целью объективной оценки эффективности диагностических вмешательств и методов лечения. Организация названа в честь английского эпидемиолога Арчи Кокрана, впервые призвавшего оценить эффективность всех лечебных вмешательств путем обобщения (систематического обзора) результатов всех клинических испытаний. Систематические обзоры, созданные экспертами Кокрановского сотрудничества, собраны в так называемой Кокрановской библиотеке, которая периодически обновляется и выпускается на дисках.
Полезная интернет-ссылка
Сайт Кокрановского сообщества, на котором доступны резюме систематических обзоров: http://www.cochrane.org
Что такое доказательная медицина?
Предложенная в начале 90-х годов XX в. концепция доказательной медицины (evidence-based medicine, дословно - медицина, основанная на доказательствах) подразумевает добросовестное, точное и осмысленное использование лучших результатов клинических исследований для выбора лечения конкретного больного. Подобный подход позволяет уменьшить число врачебных ошибок, облегчить процесс принятия решения для практических врачей, администрации лечебных учреждений и юристов, а также снизить расходы на здравоохранение. Концепция доказательной медицины широко используется при выборе ЛС в конкретных клинических ситуациях. Современные руководства по клинической практике, предлагая те или иные рекомендации, снабжают их рейтингом доказательности, которые были описаны выше. При выборе ЛС наряду с рекомендациями лекарственного формуляра используются международные или национальные руководства по клинической практике (guideline), т.е. систематически разработанные документы, предназначенные для того, чтобы помочь практикующему врачу, юристу и пациенту в принятии решений в определенных клинических обстоятельствах. Однако исследования, проведенные в Великобритании, продемонстрировали, что врачи общей практики далеко не всегда склонны следовать национальным рекомендациям в своей работе. Кроме того, создание четкой системы рекомендаций вызывает критику со стороны специалистов, полагающих, что рекомендации ограничивают свободу клинического мышления. Однако использование подобных руководств стимулировало отказ от рутинных и недостаточно эффективных методов диагностики и лечения и в конечном счете повысило уровень медицинской помощи больным.
Одной из целей доказательной медицины считается представление результатов исследований в едином, простом и понятном для врачей виде. Это позволяет:
• оценить реальный эффект терапевтического воздействия (препарата, профилактической программы, хирургического вмешательства);
• легко сравнивать данные об эффективности вмешательств, полученные в ходе разных исследований.
Подобная система основана на расчете нескольких показателей эффективности, которые приведены ниже. Вычисление этих показателей лучше рассмотреть на примере.
Допустим, в ходе сравнительного клинического исследования в группе больных, получавших препарат А, у 76 больных были обострения заболевания, а у 399 больных не было (таким образом, в этой группе обострения наблюдались у 16% больных). В контрольной группе обострения отмечались существенно чаще - у 128 больных (28,6%), а у 322 больных обострений не было. Сравнение при помощи теста Фишера выявили статистически значимые различия между группами по частоте обострений (р <0,0001). Как оценить эффективность вмешательства (применение препарата А) по сравнению с контролем (табл. 8.3).
Таблица 8.3. Эффективность вмешательства А по сравнению с контролем
Вмешательство | Обострения в ходе наблюдения | |
нет | есть | |
Препарат А | 76 (16%) | 399 |
Контроль | 129 (28,6%) | 322 |
Относительный риск (Relative Risk или Risk Ratio, RR). Данный показатель отображает отношение риска в лечебной группе к риску в контрольной. Он показывает, во сколько раз чаще достигается выбранная конечная точка при применении ЛС по сравнению с плацебо или ЛС-сравнения (группа контроля). Чем ближе величина относительного риска к 1, тем меньше различий в эффективности изучаемого ЛС и плацебо или ЛС-сравнения. Относительный риск вычисляется с использованием так называемой таблицы сопряженности (табл. 8.4).
Таблица 8.4. Таблица сопряженности для расчета показателя относительного
риска
Количество пациентов, у которых не достигнута конечная точка | Количество пациентов, у которых достигнута конечная точка | |
Лечебная группа (пациенты принимали исследуемое ЛС) | a | b |
Группа сравнения (пациенты принимали плацебо или ЛС-сравнения) | c | d |
RR = [a / (a + b)] / [c/ (c + d)].
В нашем примере риск обострения в лечебной группе составляет 76/(76+399), а в контрольной группе - 128/(128+322). Таким образом, относительный риск в нашем примере составит 0,559, т.е. каждый больной, получающий препарат А, имеет только 56% шансов на неудачу (обострение) по сравнению с шансами больного из группы контроля.
Обычно вычисляется не просто величина относительного риска, но и 95% доверительный интервал. Размер 95% доверительного интервала указывает, что величина RR составляет в среднем 0,559 (или 56%), однако с вероятностью в 95% снижение риска может составлять только 33% (100-77) или же может быть существенно выше: 59% (100-41).
Снижение абсолютного риска (Absolute Risk Reduction или Risk Difference, ARR). Снижение абсолютного риска указывает на абсолютные различия в вероятности изучаемого явления между группами. В нашем примере снижение абсолютного риска составляет:
АRR = 0,286 - 0,16 = 0,126.
На столько риск обострения при терапии препаратом А ниже, чем в контрольной группе. Однако наиболее часто результаты исследования представляются не в виде снижения абсолютного риска (ARR), а в виде снижения относительного риска (RRR, см. ниже), что считается более наглядным.
Снижение относительного риска обозначает степень снижения риска в экспериментальной группе по сравнению с контрольной. Этот показатель отображает, на сколько относительный риск достижения конечной точки при применении ЛС выше или ниже, чем при применении плацебо или ЛС-сравнения (группа контроля), обычно он выражается в процентах. Для его вычисления также составляется таблица сопряженности (см. табл. 8.4), затем применяется формула:
RRR = [c / (c + d) - a / (a + b)] /[c /(c + d)].
В нашем примере снижение относительного риска составляет
0,441.
Таким образом, можно утверждать, что лечение препаратом А снижает риск на 44% по сравнению с контролем.
Важно измерять не только относительное снижение риска, но и абсолютное. Допустим, есть два исследования, в которых отмечалось снижение риска летальных исходов (табл. 8.5).
Таблица 8.5. Снижение риска летальных исходов в группах лечения и кон-
троля
Заключение | Риск | ARR | RRR |
Смертность в группе лечения | 0,001% | 0,0001% | 10% |
Смертность в группе контроля | 0,0009% | ||
Смертность в группе лечения | 50% | 5% | 10% |
Смертность в группе контроля | 45% |
В первом исследовании снижение риска летального исхода (ARR) оказалось ничтожным - на 0,0001%, в то время как во втором исследовании лечение снижало летальность на 5%, но относительное снижение риска (RRR) в обоих случаях составило 10%. Таким образом, нельзя строить объективное суждение о выраженности эффекта только лишь по величине относительного снижения риска, при анализе результатов клинических исследований необходимо обращать внимание на снижение абсолютного риска (ARR).
NNT (Number Needed to Treat, NNT). Этот показатель показывает, сколько больных должны получать изучаемое вмешательство по сравнению с контролем, чтобы дополнительно избежать одного неблагоприятного исхода. В нашем примере:
NNT = 1 τ ARR = 1 τ 0,126 = 8.
Таким образом, если вместо препарата контроля назначить у 8 больных препарат А, тем самым получится избежать одного случая обострения. Чем меньше величина NNT, тем выше эффективность лечения. Этот показатель особенно полезен для практикующих врачей, которые хотели бы знать, насколько вероятные выгоды от новых методов лечения будут целесообразны для их пациентов.
В тех случаях, когда показатель эффективности зависит от времени (летальность, заболеваемость), вместо относительного риска (RR) применяется отношение риска или коэффициент риска (hazard ratio). То есть вероятность исхода (например, смерти) за фиксированный промежуток времени;
В ретроспективных исследованиях создается не относительный риск, а отношение шансов (Odds ratio, OR). Шансы исхода оцениваются как отношение числа больных, у которых исход наступил, к числу больных, у которых данного исхода нет, а шансы, как отношение числа больных, у которых исход наступил, к общему числу больных.
Как врачу принимать решение о применении лекарственных средств в соответствии с принципами доказательной медицины?
В клинической практике чаще всего возникают вопросы, связанные с выбором наиболее эффективного и безопасного ЛС у конкретного пациента. Таким образом, выбор ЛС должен основываться не только на обсуждаемом ранее принципе совпадения «профиля» пациента и «профиля» ЛС, но и на основе принципов доказательной медицины. Как указывалось выше, самым простым способом получения информации, для того чтобы принять решение о применении ЛС на основе принципов доказательной медицины, остается использование врачом клинических рекомендаций (guidelines) профессиональных сообществ (национальных или международных) по лечению тех или иных заболеваний (см. модуль 1). В них приводятся рекомендации по применению ЛС при том или ином заболевании с указанием соответствующего уровня доказательности. Кроме того, уровни доказательности приводятся в некоторых справочниках ЛС (например, ежегодные выпуски «Доказательной медицины», 1-й выпуск (2002), 2-й выпуск (2003), 3-й выпуск (2004) издательства «Медиа-Сфера», переведенные на русский язык). Руководствуясь этой информацией, врач принимает решение о применении ЛС у конкретного пациента. Однако в настоящее время клинические рекомендации созданы «не на все случаи жизни», они нередко носят общий характер, может отсутствовать указание на уровень доказательности рекомендаций, рекомендации могут быть устаревшими или подготовленными организациями, находящимися под влиянием производителя определенного ЛС. Вот почему врачу приходится оценивать рекомендации и иногда самому выступить в роли эксперта по оценке результатов клинических исследований, для того чтобы принять решение о применении ЛС на основе принципов доказательной медицины. При этом общий алгоритм использования принципов доказательной медицины в клинических ситуациях для выбора ЛС выглядит следующим образом:
1. Правильно сформулировать вопрос о применении ЛС. Вопрос должен включать четыре основных части: клиническую ситуацию, вмешательство, сравниваемое вмешательство, исход.
2. Выбрать адекватные источники информации об эффективности и безопасности ЛС. Как указывалось выше, наибольшей силой доказательности обладают систематические обзоры и метаанализ, данные
рандомизированных клинических исследований, тогда как мнения экспертов (например, ваших старших коллег) «замыкают» иерархию доказательности. Поиск результатов клинических исследований следует поводить с помощью электронных интернет-баз данных, таких, например, как MEDLINE (PubMed).
3. Проанализировать полученные результаты:
• исключить исследования, не соответствующие клинической ситуации;
• исключить исследования с низким уровнем доказательности;
• оценить, насколько велик терапевтический эффект и насколько объективной была оценка эффекта, в том числе и с позиции конечных точек исследования.
4. Принять решение.
Полезная интернет-ссылка
Более подробно алгоритм использования принципов доказательной медицины в клинических ситуациях изложен в статье: Rosenberg W., Donald A. BMJ. Evidence based medicine: an approach to clinical problem-solving. - 1995. - Apr. 29. - 310(6987). - 1122-6. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2549505/pdf/bmj00590- 0046.pdf
Доступ к ресурсам MEDLINE (PubMed) возможен с сайта Национальной медицинской библиотеки США (представлены резюме статей, а в некоторых случаях и полные их тексты): www. pubmed.com
База отечественных медицинских публикаций (представлены резюме статей): http://ucm.sibtechcenter.ru/
Разберем пример принятия решения о применении ЛС на основе принципов доказательной медицины.
К врачу общей практики обращается женщина 54 лет. Ее отец умер от инфаркта миокарда в возрасте 50 лет. Она обеспокоена возможным развитием у нее инфаркта миокарда и спрашивает о мерах профилактики и необходимости приема ацетилсалициловой кислоты. Пациентка не курит, не страдает артериальной гипертензией, имеет нормальную массу тела и нормальные уровни глюкозы и липидов в крови. Врач оценивает риск развития сердечнососудистых осложнений у данной пациентки как низкий. Можно ли
считать целесообразным назначение пациентке ацетилсалициловой кислоты? Воспользуемся описанным выше алгоритмом.
1. Формулировка вопроса. Очевидно, что целью применения ЛС в данном случае будет считаться первичная конечная точка - увеличение продолжительности жизни пациентки, поэтому вопрос можно сформулировать следующим образом: «Приведет ли назначение ацетилсалициловой кислоты (вмешательство) женщине с низким риском развития сердечно-сосудистых осложнений (клиническая ситуация) к увеличению продолжительности жизни/выживаемости (исход) по сравнению с пациентками, не получающими ацетилсалициловую кислоту (сравниваемое вмешательство)? Также вопрос можно сформулировать, опираясь на вторичные или третичные конечные точки - развитие сердечно-сосудистых осложнений (инфаркта миокарда, инсульта) и задать следующий вопрос: «Какова частота развития сердечно-сосудистых осложнений (исход) у женщин с низким риском сердечно-сосудистых событий, принимающих ацетилсалициловую кислоту (вмешательство), по сравнению с пациентками, не получающими данное ЛС (сравниваемое вмешательство)»?
2. Поиск источников информации. Обратимся к электронной базе MEDLINE. Поисковыми критериями будут: acetylsalicylic acid, women, trial, primary prevention (первичная профилактика). Получаем около 45 результатов поиска, т.е. 45 публикаций, в резюме которых встречается искомая комбинация слов.
3. Анализ полученных результатов:
• отсеиваем ненужные (например, исследования, посвященные заместительной гормональной терапии, сахарному диабету, витамину Е, к поисковому запросу добавляем NOT «diabetes» NOT «hormones», NOT «vitamin E» и др.);
• анализируя уровень доказательности, приходим к выводу, что нашему запросу соответствует одно крупное исследование «Women's Health Study», анализ результатов исследования представлен в табл. 8.6;
• поскольку большинство исследований применения ацетилсалициловой кислоты для первичной профилактики сердечно-сосудистых событий проводилось с участием мужчин или не осуществлялся половой анализ, целесообразно сопоставить данные метаанализов исследований с участием как мужчин, так и женщин (см. табл. 8.6).
4. Принятие решения.
Таблица 8.6. Результаты поиска клинических исследований по запросу в базе MEDLINE
Публикация | Тип исследования | Характеристика испытуемых | Доза АСК | Результат сравнения |
Ridker Р., 2005 «Women's Health Study» | Двойное слепое, рандомизированное, плацебо контролируемое испытание | 39 876 здоровых женщин старше 45 лет, период наблюдения 10 лет | 100 мг | Достоверных различий в общей частоте развития сердечно-сосудистых осложнений не выявлено (RR - 0,91; 95% ДИ - [0,80-1,03]; Ρ = 0,13). В группе АСК - снижение относительного риска развития инсульта (RR - 0,83; 95% ДИ [0,69-0,99]; Ρ = 0,04), преимущественно ишемического (RR - 0,76; 95% ДИ [0,63-0,93]; Ρ = 0,009). Достоверных различий в развитии инфаркта миокарда (RR - 1,02; 95% ДИ - [0,84-1,25]; Ρ = 0,83) и смертности от сердечно-сосудистых заболеваний (RR - 0,95; 95% ДИ - [0,74-1,22]; Ρ = 0,68) не выявлено. В группе АСК выше частота ЖКК, требующих трансфузий (RR - 1,40; 95% ДИ - [1,07-1,83]; Ρ = 0,02). В группе АСК - снижение риска развития сердечнососудистых событий у женщин старше 65 лет |
Antithrombotic Lrialists' Att Collaboration, 2009 | Метаанализ 6 исследований первичной профилактики сердечнососудистых событий | 95 000 лиц (мужчины и женщины) с низким риском сердечнососудистых событий | - | Группа АСК - снижение относительного риска (RRR) развития серьезных сердечно-сосудистых осложнений на 12% (р = 0,0001). Смертность от сердечно-сосудистых осложнений не различалась (р = 0,7). Назначение АСК приводило к увеличению риска развития серьезных желудочно-кишечных и экстракраниальных кровотечений (0,10% в группе АСК и 0,07% в группе плацебо в год, ρ <0,0001) |
Примечание. ДИ - доверительный интервал, RR - относительный риск, АСК - ацетилсалициловая кислота, ЖКК - желудочно-кишечные кровотечения.
Анализируя показатель относительного риска в результатах найденных исследований (см. табл. 8.6), видим, что применение ацетилсалициловой кислоты не влияет на уровень сердечно-сосудистой смертности у пациентов (как женщин, так и мужчин) моложе 65 лет, но значительно повышает риск серьезных кровотечений. Можно сделать вывод о том, что назначение ацетилсалициловой кислоты в конкретном клиническом случае не оправдано.
Выполните задание для самостоятельной работы
Задание 8.3. В таблице 8.7 приведены результаты исследования. Два противовирусных препарата сравнивались по частоте возникновения рецидива. Вычислите для этого исследования показатели относительного риска, абсолютного снижения риска, относительного снижения риска, NNT.
Таблица 8.7. Сравнение противовирусных препаратов
Вмешательство | Число больных | ||
Рецидив | Нет рецидива | Всего | |
Препарат A | 200 (20%) | 800 | 1000 |
Препарат В | 300 (30%) | 700 | 1000 |
В таблице 8.8 приведена схема анализа публикации, в которой описывается результат клинического исследования на примере рандомизированного клинического исследования VALIANT.
Таблица 8.8. Характеристика рандомизированного клинического исследования VALIANT
Выходные данные статьи | Pfeffer M. et al. Valsartan, Captopril, or Both in Myocardial Infarction Complicated by Heart Failure, Left Ventricular Dysfunction, or Both // N Engl J Med. - 2003. - Vol. 349. - P. 1893- 1906. |
Рандомизация, метод | Интерактивные компьютерные технологии (automated, interactive voice-response system) |
«Ослепление» | Двойное |
Контролируемое | + |
Окончание табл. 8.8
в | Сравнительное (с чем сравнивали) | 1. Каптоприл 2. Валсартан + каптоприл |
Количество больных основной/контрольной группах | Основная группа n = 4909 Контрольная группа 1 (каптоприл + валсар- тан) n = 4885 Валсартан n = 4909 | |
Первичные | Смерть от кардиоваскулярных причин, смерть от других причин | |
Вторичные | Повторный инфаркт миокарда, инсульт, развитие сердечной недостаточности, внезапная остановка сердца с успешной реанимацией | |
Третичные Повторная госпитализация | ||
Конечные точки | Методы статистической обработки | Определение коэффициента риска (hazard ratio), 97,5% доверительного интервала. Модель Кокса, Каплана-Майера |
Результаты | Коэффициент риска смертности: 1. Валсартан + каптоприл/каптоприл 0,98 [0,89-1,09], p = 0,73. 2. Валсартан/каптоприл 1,0 [0,9-1,1], P = 0,98. В группе валсартан + каптоприл наблюдалось наибольшее число НПР | |
Уровень доказательности | Высокий | |
Принятое решение | Валсартан и каптоприл обладают равной эффективностью у пациентов, перенесших инфаркт миокарда, добавление валсартана к каптоприлу приводит к увеличению побочных эффектов, не влияя на выживаемость | |
Выполните задание для самостоятельной работы
Задание 8.4. Проанализируйте оригинальную статью в медицинском журнале, в которой отражены результаты клинического исследования (по вашей будущей специальности или предложенной преподавателем), заполнив таблицу по аналогии с табл. 8.8. Примите решение о применении ЛС в клинической практике на основании проанализированной вами публикации.
Как врачу интерпретировать результаты метаанализа для принятия решения о применении лекарственного средства в соответствии с принципами доказательной медицины?
Иногда, осуществляя поиск информации о ЛС, можно найти публикации, в которых отражены результаты не клинического исследования, а так называемого метаанализа. Метаанализ - статистический анализ совокупности результатов клинических исследований со схожим дизайном с целью интеграции полученных в них данных для получения более достоверного результата. Разберем на примере правила интерпретации метаанализа (рис. 8.1).
Представленный метаанализ отвечает на вопрос, существуют ли достоверные различия в частоте возникновения инфарктов миокарда у пациентов, принимающих НПВС из группы селективных ингибиторов циклоокигеназы-2 (коксибов), по сравнению с плацебо. Мы обсуждаем два вида вмешательства - назначение коксибов и плацебо (табл. 8.9). В столбце «Coxibs» на рис. 8.1 представлено соотношение (n/N), где n - количество пациентов в группе с ожидаемым исходом (инфаркт миокарда), а N - общее число больных. Например, в группе рофекоксиба это соотношение 54/6638. В столбце «Placebo» представлены аналогичные данные по группе плацебо. Внизу каждого столбца дана заболеваемость инфарктом миокарда пациентов из группы коксибов (0,6% в год) и группы плацебо (0,3% в год).
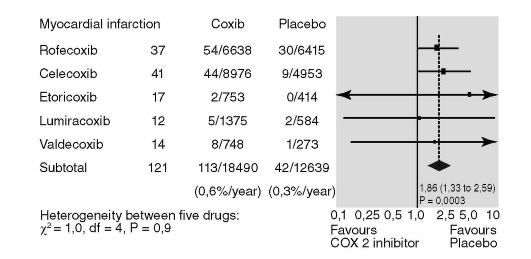 Рис. 8.1. Метаанализ результатов исследования по влиянию коксибов на развитие инфарктов миокарда
Рис. 8.1. Метаанализ результатов исследования по влиянию коксибов на развитие инфарктов миокарда
Таблица 8.9. Таблица сопряженности метаанализа влияния коксибов на раз-
витие инфаркта миокарда
Пациенты, у которых развился инфаркт миокарда, n | Пациенты, у которых не было инфаркта миокарда, (N-n) | |
Лечебная группа (коксибы) | а = 113 | b = 18490 - 113 = 18 377 |
Контрольная группа (плацебо) | с = 42 | d = 12639 - 42 = 12 597 |
По горизонтальной оси откладывается показатель отношения шансов (OR) развития инфаркта миокарда в группе приема коксибов по сравнению с плацебо. Показатель OR вычисляется следующим образом:
• составляется таблица сопряженности (см. табл. 8.9);
• далее OR вычисляется по формуле:
OR = a х d / c х b.
В нашем случае OR = 113 х 12597 / 42 х18337 = 1,86, следовательно, риск развития инфаркта миокарда выше в группе коксибов по сравнению с плацебо, а значит, от их применения следует воздержаться у больных с высоким риском сердечно-сосудистых осложнений. Если бы показатель OR был равен единице, что соответствует вертикальной линии, следовательно, риск для двух групп был бы одинаков. Если бы показатель OR находился в интервале от 0 до 1, следовательно, риск развития исхода для лечебной группы был бы ниже. Особенное значение имеют границы 95% доверительного интервала, что соответствует границам ромба, отражающего результаты метаанализа. Если ромб пересекает вертикальную линию, а границы 95% доверительного интервала включают единицу, результаты сравнения недостоверны. В нашем случае результаты достоверны, так как 95% доверительный интервал находится в пределах от 1,33 до 2,59 (не включает единицу).
Выполните задание для самостоятельной работы
Задание 8.5. Проанализируйте результаты исследований, представленных в виде метаанализа на рис. 8.2. Определите значение показателя отношения шансов (OR), доверительного интервала, сделайте вывод о достоверности результатов. Будете ли вы выбирать респираторные фторхинолоны при внебольничной пневмонии на основании результатов метаанализа?
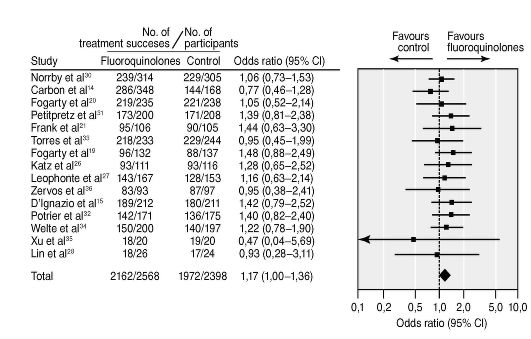 Рис. 8.2. Метаанализ эффективности назначения респираторных фторхинолонов при внебольничной пневмонии по сравнению с макролидами и β-лактамами
Рис. 8.2. Метаанализ эффективности назначения респираторных фторхинолонов при внебольничной пневмонии по сравнению с макролидами и β-лактамами
Для чего врачу необходимо уметь интерпретировать результаты фармакоэкономического анализа?
Особое значение для выбора ЛС, как для отдельного пациента, так и ЛПУ, системы здравоохранения региона и страны в целом, имеет стоимость ЛС. Фармакоэкономика - направление экономики здравоохранения, которая оценивает результаты использования и стоимости ЛС для принятия решения о его применении и определении политики ценообразования. Главной предпосылкой появления фармакоэкономики стало увеличение общих затрат на здравоохранение, которые в развитых странах достигают десятков и сотен миллиардов долларов. На сегодняшний день ни одно государство, даже с наиболее развитой экономической системой, не в состоянии полностью обеспечить все потребности национального здравоохранения, поэтому проведение фармакоэкономической оценки эффективности отдельных методов диагностики и лечения считается необходимым для принятия решения о финансировании перспективных программ и всей экономики здравоохранения в целом. Фармакоэкономический анализ включает в себя несколько этапов. На первом этапе определяется стоимость заболевания и связанные с лечением расходы. В экономике здравоохранения стоимость заболевания складывается из следующих составляющих:
• прямые затраты включают расходы, непосредственно связанные с оказанием медицинской помощи (стоимостью лекарственной терапии, стоимостью пребывания пациента в стационаре и т.д.);
• косвенные затраты включают расходы вследствие утраты трудоспособности, затраты самого пациента, его родственников;
• нематериальные затраты - затраты, которые трудно оценить в денежном выражении (боль, беспокойство, снижение интереса к окружающему миру и т.д.).
При проведении фармакоэкономического анализа необходимо учитывать все затраты, связанные с проведением данного лечения. Фармакоэкономический анализ можно проводить с точки зрения интересов пациента, лечебного учреждения, организации, оплачивающей лечение исходя из социальных интересов (перспектива фармакоэкономического анализа). Например, оказывается, что применение вакцинации против детских инфекций малоэффективно с точки зрения организаций, оплачивающих лечение, или стационаров, так как основная масса больных лечится дома и не требует стационарной помощи. Вместе с тем с социальной точки зрения применение
вакцин у детей обеспечивает значительные преимущества в виде сокращения потери рабочих дней родителями и уменьшения других нематериальных расходов. Источниками данных о потреблении медицинских ресурсов могут быть амбулаторные карты, истории болезни, индивидуальные регистрационные карты. Для регистрации затрат самого пациента разрабатываются специальные анкеты. Перевод медицинских ресурсов в денежные единицы осуществляется на основании стоимости медицинского обслуживания. Источниками информации о стоимости считаются оптовые цены на ЛС, тарифы отдельного лечебного учреждения или административной области. Фармакоэкономическое исследование обязательно должно иметь сравнительный характер, так как без сравнения с показателями стоимости/эффективности других ЛС или методов лечения нельзя сделать вывод о фармакоэкономической целесообразности применения исследуемого режима терапии.
Какие виды фармакоэкономического анализа существуют и когда они применяются?
Существуют четыре основных вида фармакоэкономического анализа.
1. Анализ «минимизации затрат» по сравнению с другими методами фармакоэкономического анализа остается самым простым. Для его проведения необходимо достоверное доказательство отсутствия различий в клинической эффективности и безопасности сравниваемых ЛС. В ходе данного анализа сравнивается стоимость исследуемых методов лечения с целью определения наименее дорогого. Примерами, когда проведение данного анализа считается обоснованным, может служить сравнение препаратов генериков с оригинальными препаратами или сравнение различных путей введения одного и того же ЛС. Во всех случаях для проведения анализа «минимизации затрат» необходимо доказать отсутствие различий в эффективности исследуемых препаратов.
Следует отличать анализ «минимизации затрат» от анализа затрат (стоимости), при котором не проводится сравнение клинических результатов исследуемых вмешательств. Анализ затрат (стоимости) имеет две разновидности: анализ стоимости заболевания и анализ стоимости фармакотерапии. В первом случае определяют затраты, связанные с конкретным заболеванием: стоимость лекарственной терапии, госпитализации, диагностических исследований, диспан-
серного наблюдения и т.д. Анализ затрат (стоимости) фармакотерапии включает только стоимость ЛС на курс лечения и стоимость его введения.
2. Анализ «затраты (стоимость)-эффективность» - это метод экономического анализа, целью которого считается сравнение не только стоимостей, но и результатов использования сравниваемых ЛС. Стоимость выражается в денежном эквиваленте, а результаты в общепринятых в медицинской практике показателях (количество случаев клинической эффективности, число лет сохраненной жизни и т.д.).
Например, необходимо провести сравнение двух препаратов А и Б для лечения заболевания, где клиническим результатом считается число случаев выздоровления.
В группе лечения с применением препарата А клинический результат составляет Х, ав группе Б - Y, стоимость соответственно - МиN Для фармакоэкономического сравнения в каждой группе определяют коэффициент «затраты (стоимость)-эффективность», который для препарата А составляет - M/Χ, для препарата Б - N/Υ. Коэффициент «затраты (стоимость)-эффективность» показывает среднюю стоимость лечения при клинической эффективности. В случае, если препарат А превосходит по стоимости и по эффективности препарат Б, определяют инкрементальный коэффициент «затраты (стоимость)-эффективность». Он определяется как отношение разницы в стоимости между препаратами А и Б к разнице в эффективности между препаратами А и Б - (М - N) / (X - Υ) и позволяет проанализировать возможность дополнительных финансовых вложений для достижения более высокой клинической эффективности.
Заключение о том, что исследуемая терапия (А) более целесообразна по показателю затраты (стоимость)/эффективность в сравнении с альтернативным режимом (Б), может означать, что: терапия А стоит меньше, чем терапия Б, и превосходит терапию Б по эффективности; терапия А стоит больше и превосходит по эффективности терапию Б, причем высокая эффективность терапии А оправдывает разницу в стоимости; терапия А уступает в эффективности и меньше по стоимости терапии Б, где высокую стоимость терапии Б можно считать неоправданной с точки зрения эффективности.
3. Анализ «затраты-выгода» («стоимость-преимущество») предназначен для сравнения стоимости исследуемой лекарственной терапии, которая складывается из затрат на лечение и преимущества, которые
несет в себе исследуемое лечение. Оба показателя - стоимость и преимущество - выражаются в денежном эквиваленте. Самым трудным методологическим этапом анализа «затраты-выгода» считается перевод результатов применения исследуемых препаратов в денежный эквивалент.
4. Анализ «затраты-полезность» («стоимость-польза») часто рассматривается как разновидность анализа «затраты (стоимость)- эффективность». Принципиальное отличие заключается в оценке клинических результатов. В анализе «затраты-полезность» при оценке результатов используют показатели качества жизни, и часто результаты выражаются в количестве лет сохраненной качественной жизни.
В сравнении с другими методами фармакоэкономического анализа анализ «затраты-полезность» остается наиболее сложным и дорогостоящим. Выделяют четыре ситуации, когда необходимо его проведение. Во-первых, когда динамика качества жизни является важным показателем эффективности терапии заболевания. Например, при ревматоидном артрите или бронхиальной астме. Во-вторых, когда динамика качества жизни является важным показателем результата лечения. Например, химиотерапия при онкологическом заболевании может увеличивать продолжительность жизни и одновременно снижать качество жизни за счет НПР. В-третьих, когда программа оказывает влияние на заболеваемость и смертность. Например, гормональная терапия в постменопаузальный период, с одной стороны, уменьшает симптомы климактерического периода, риск остеопороза и перелома костей, с другой стороны, может увеличивать риск рака эндометрия. В-четвертых, когда программа имеет многосторонние результаты, например программа, направленная на расширение блока интенсивной терапии новорожденных, или создание отделения для лечения больных с артериальной гипертензией.
Фармакоэкономика остается специфичной для каждой страны. Специфика заключается не в различной методологии проведения фармакоэкономических исследований, она обусловлена различиями в эпидемиологии заболеваний, стоимости ЛС, стоимости медицинских услуг, источников финансирования системы здравоохранения. Вышеуказанные факторы часто ограничивают экстраполяцию зарубежных фармакоэкономических данных и требуют проведения локальных фармакоэкономических исследований.
Как врачу использовать результаты
фармакоэкономического анализа для принятия решения о выборе и применении лекарственного средства?
Рассмотрим схемы принятия решений о применении ЛС на основе результатов фармакоэкэномического анализа.
Пример 1.
Препарат А стоит 2 тыс. рублей и излечивает 44% больных. Препарат Б стоит 3 тыс. рублей, но излечивает 68% больных. Применение какого препарата будет наиболее выгодно?
Рассчитаем коэффциент CER для препаратов А и Б по формуле:
CER = C / Ef,
где CER - коэффициент эффективности затрат;
С - стоимость препарата;
Ef - эффективность лечения препаратом. Для препарата А:
CER = 2000 / 0,44 = 4545 руб.
Для препарата Б:
CER = 3000 / 0,68 = 4411 руб.
CER препарата А больше CER препарата Б, а эффективность препарата А меньше, чем Б, следовательно, применение препарата Б будет более эффективно и экономически выгодно, несмотря на то, что его стоимость выше.
Пример 2.
Препарат X стоит 5 тыс. руб. на курс лечения и приводит к излечению 53% больных, препарат Z стоит 20 тыс. руб. на курс лечения и приводит к излечению 95% больных. Применение какого препарата будет экономически целесообразным?
Рассчитаем коэффициент CER для препаратов X и Z по формуле:
Для препарата X:
CER = 5000 / 0,53 = 9434 руб. Для препарата Z:
CER = 20 000 / 0,95 = 21052 руб.
Следовательно, с экономической точки зрения более выгодно применять препарат X, однако эффективность препарата Z значительно выше, чем у X.
В таких случаях рассчитывают, какова будет дополнительная стоимость излечения одного больного при использовании препарата E вместо препарата С, т.е. показатель приращения эффективности затрат (ICER) по формуле:
ICER = (Сх - СZ) / (Efx - Efz),
где ICER - показатель приращения эффективности затрат, или инкрементальная стоимость; Сх - стоимость препарата X; Сz - стоимость препарата Z; Efx - эффективность лечения препаратом X; Efz - эффективность лечения препаратом Z.
ICER = (5000 - 20 000) /(0,53 - 0,95) = 15 000 / 0,42 = 35 714 руб.
Таким образом, при использовании препарата Z вместо препарата X эффективность лечения возрастет на 42%, при этом затраты на излечение одного дополнительного пациента составят 35 714 рублей. Затем решается вопрос, приемлема ли такая стоимость лечения в конкретном случае (в зависимости от тяжести заболевания, бюджета ЛПУ, системы здравоохранения и т.д.).
Согласно рекомендациям ВОЗ медицинское вмешательство признается рентабельным, если показатель ICER ниже, чем утроенный валовой национальный доход на душу населения (для России утроенный валовой национальный доход на душу населения составляет примерно 700 000 руб.), и применение препарата Z будет экономически целесообразным в условиях России.
Выполните задание для самостоятельной работы
Задание 8.6 (адаптировано из статьи Колбина А.С., Королевой О.А., Климко Н.Н. Оценка эффективности затрат применения вориконазола для лечения инвазивного аспергиллеза // Фармакоэкономика. - 2009. - ? 3. - С. 46-55). Авторы сравнивали клинико-экономическую эффективность различных противогрибковых средств для лечения инвазивного аспергиллеза.
Стоимость лечения (включая стоимость госпитализации, лабораторных исследований и др.) для амфотерицина В составила 901 245 руб., а для вориконазола 1 021 984 руб., при этом эффективность амфотерицина В составила 57%, а вориконазола - 69%. Какой препарат вы предпочтете?
Что такое концепция QALY и как ее использовать для принятия решения о выборе и применении лекарственного средства?
Частным случаем анализа «затраты (стоимость)-эффективность» считается анализ «затраты-полезность» («стоимость-полезность»), при котором учитывается не только клиническая эффективность метода, но и субъективное восприятие пациентом результатов лечения с точки зрения улучшения качества жизни, для чего используется концепция QALY. QALY (Quality-adjusted life years) - количество сохраненных в результате медицинского вмешательства лет качественной жизни, или год жизни с поправкой на его качество. Для расчета показателя QALY применяются стандартные опросники качества жизни, где ответу на каждый вопрос присваивается ранговая величина и подсчитывается совокупность рангов ответов. При определении весовых категорий рангов учитываются пожелания пациента относительно возможных последствий и исходов своего заболевания. Несмотря на универсальность, методология QALY имеет ряд допущений, например не учитываются возраст, пол, социальный статус пациентов, а также продолжительность состояния, достигаемого с помощью лечения.
В некоторых исследованиях используется показатель DALY (Disability-adjusted life years) - количество утраченных в результате нетрудоспособности или преждевременной смерти лет здоровой жизни. Этот показатель делает поправку на возраст и вводит понятие эквивалентных лет жизни. Одно и то же состояние, например утрата зрения в возрасте 20 или 65 лет, оценивается по-разному.
Основные положения концепции QALY следующие:
• QALY принимает значения от 0 до 1, где 0 соответствует смерти, а 1 - состоянию полного здоровья;
• один год абсолютно здоровой жизни оценивается как 1,0 QALY;
• год жизни, прожитый с проблемами со здоровьем, оценивается меньше 1,0;
• два года жизни, оцененные как 0,5 QALY, равняются одному году здоровой жизни, т.е. 1,0 QALY, и т.д.;
• определяется прибавка показателя QALY в результате лечения;
• далее рассчитывается стоимость года лечения в расчете 1,0 QALY. Например, стоимость лечения «А» составляет 300 тыс. руб. в год.
Лечение «А» улучшает качество жизни с 0,4 до 0,5 QALY. За 10 лет лечения больной приобретает 10 [(0,5 - 0,4) = 1,0 QALY.
Стоимость в расчете на 1,0 QALY составляет 300 тыс. руб. В настоящее время для США и стран Евросоюза приняты следующие градации экономической эффективности лечения, рассчитанной на основании показателя QALY:
• стоимость лечения менее $20 тыс./QALY считается экономически эффективной;
• стоимость от $20 тыс./QALY до $40 тыс./QALY - приемлемой (большинство методов лечения имеют именно такую стоимость);
• от $40 тыс./QALY до $60 тыс./QALY - пограничной;
• от $60 тыс./QALY до $100 тыс./QALY - дорогой. Стоимость лечения более $100 тыс./QALY пока считается слишком дорогой.
Также в некоторых исследованиях используется величина добавочного (incremental) QALY по сравнению со стандартным лечением.
Приведем пример использования концепции QALY для выбора ЛС. Пациенту 65 лет с диагнозом полиостеоартроз требуется длительная терапия НПВС. Пациент также страдает стенокардией напряжения, для лечения которой он принимает метопролол, ацетилсалициловую кислоту 125 мг в сутки, симвастатин (в связи с сопутствующей гиперлипидемией). Известно, что использование селективных ингибиторов ЦОГ-2 сопряжено с меньшим риском желудочно-кишечных осложнений, однако данная группа препаратов значительно дороже по сравнению с традиционными НПВС и может повысить риск развития инфаркта миокарда. Оправданы ли будут затраты на селективные ингибиторы ЦОГ-2 при их использовании у пациента в условиях стационара и в амбулаторных условиях?
Итак, в данной клинической ситуации возможно несколько вариантов лечения:
A) селективные ингибиторы ЦОГ-2 (коксибы, мелоксикам); Б) традиционные НПВС;
B) традиционные НПВС + ингибиторы H+, К+-АТФазы.
1. В первую очередь необходимо сравнить клиническую эффективность и безопасность возможных вариантов лечения. Отметим,
что в данном случае у пациента имеются факторы риска желудочнокишечных осложнений (возраст, прием ацетилсалициловой кислоты), а также инфаркта миокарда (пациент страдает ИБС с сопутствующей гиперлипидемией). Обратимся к систематическому обзору, посвященному селективным ингибиторам ЦОГ-2. По болеутоляющему действию селективные ингибиторы ЦОГ-2 и традиционные НПВС обладают примерно одинаковой эффективностью. Коксибы и мелоксикам значительно реже вызывают желудочно-кишечные осложнения. Однако назначение коксибов сопряжено с большим риском развития кардиоваскулярных осложнений (в частности, инфаркта миокарда) по сравнению с плацебо и некоторыми традиционными НПВС, такими, как ибупрофен и напроксен. Четких данных об увеличении риска развития инфаркта миокарда при приеме мелоксикама не получено. Также известно, что комбинация традиционного НПВС с ингибитором H+, К+-АТФазы обладает приблизительно одинаковой степенью риска развития желудочно-кишечных осложнений по сравнению с селективными ингибиторами ЦОГ-2.
2. Анализ данных фармакоэкономических исследований. В фармакоэкономическом анализе проводилось сравнение стоимости и эффективности селективных ингибиторов ЦОГ-2 целекоксиба и рофекоксиба по сравнению с напроксеном (традиционным НПВС). Оказалось, что у лиц с низким и средним риском развития желудочнокишечных осложнений стоимость прибавки 1,0 QALY при применении коксибов составляет $275 800, а с учетом кардиоваскулярных осложнений - $395 тыс., тогда как в группе пациентов с высоким риском желудочно-кишечных осложнений стоимость прибавки 1,0 QALY составила $55 803. Стоимость в $275 800 считается слишком дорогой, а $55 803 - пограничной. Таким образом, назначение коксибов оправдано у пациентов с высоким риском желудочно-кишечных кровотечений. В ряде других исследований, посвященных сравнению экономической эффективности целекоксиба и традиционных НПВС (ибупрофена, диклофенака), получены сходные результаты - стоимость прибавки 1,0 QALY у лиц со средним риском развития желудочно-кишечных осложнений превышает $150 тыс. Стоимость прибавки 1,0 QALY при приеме высоких доз мелоксикама составила 17 800 английских фунтов, что составляет около $30-40 тыс. Однако при сравнении комбинации традиционного НПВС (диклофенака, ибупрофена) с ингибитором H+, К+-АТФазы и селективных ингибиторов ЦОГ-2 величина добавочной QALY оказалась отрицательной
(т.е. селективные ингибиторы ЦОГ-2 улучшают качество жизни в меньшей степени при более высокой стоимости).
3. Принятие решения: назначение коксибов в данной ситуации не оправдано как с клинической точки зрения (повышают риск развития инфаркта миокарда), так и с экономической - высокая стоимость 1,0 QALY. Приемлемым можно считать назначение мелоксикама или комбинации ибупрофена с ингибитором H+, К+-АТФазы.
Зачем в лечебно профилактическом учреждении нужен врач - клинический фармаколог?
Специальность «врач - клинический фармаколог» относительно молодая, она была введена приказом МЗ РФ ? 131 от 05.05.1997. Служба клинической фармакологии призвана решать проблемы эффективной и безопасной фармакотерапии, оптимизации использования средств на лекарственное обеспечение, проведения контроля и коррекции НПР. Клинический фармаколог должен обеспечивать рациональное использование ЛС.
Основные направления деятельности врача - клинического фармаколога:
1. Подготовка лекарственного формуляра.
2. Оценка рациональности и эффективности лекарственного обеспечения путем проведения ABC/VEN анализа.
3. Экспертиза рациональной фармакотерапии в ЛПУ, включающая:
• ретроспективный анализ историй болезни с оформлением «Карты экспертной оценки качества фармакотерапии» (форма 131у);
• экспертизу фармакотерапии при разборе на врачебной комиссии;
• экспертизу фармакотерапии случаев с летальным исходом.
4. Консультативная работа при назначении ЛС в случаях:
• назначения антиконвульсантов, антибиотиков резерва, препаратов железа для внутривенного введения, потенциально опасных комбинаций ЛС;
• заболеваний почек, печени, изменяющих фармакокинетику ЛС;
• при наличии фармакогенетических особенностей у пациента.
5. Мониторинг НПР.
6. Участие в проведении конференций, консилиумов и др.
Роль клинического фармаколога в фармакоэкономических исследованиях:
• оценка фармакоэпидемиологических данных о структуре лекарственного обращения и частоты развития НПР;
• анализ доказательной базы для конкретного заболевания;
• экспертиза международных и национальных клинических руководств и рекомендаций, стандартов лечения конкретного заболевания;
• критический анализ «реальной» клинической практики;
• разработка критериев безопасности и переносимости лекарственных средств:
- с учетом реальной клинической ситуации;
- с привлечением международного опыта;
- анализ причин появления НПР;
- фармакоэкономический анализ стоимости лечения НПР;
- стоимость лечения самой НПР;
- стоимость смены терапии;
- стоимость удлинения лечения;
- оценка качества жизни.
Полезная интернет-ссылка
Правовая база (приказы Министерства здравоохранения и социального развития РФ) о деятельности врачей - клинических фармакологов доступна на сайте: http://farmsgmu.narod.ru/prikas. htm
Выполните задание для самостоятельной работы
Задание 8.7. Приведите примеры возможных клинических ситуаций (из вашей будущей специальности), при которых необходима консультация врача - клинического фармаколога. Заполните
табл. 8.10.
Таблица 8.10. Клинические ситуации, требующие консультации врача - кли-
нического фармаколога
Показание для консультации врача - клинического фармаколога | Примеры |
Назначение потенциально опасных комбинаций лекарственных средств | |
При выявлении генетических особенностей у больного по результатам фармакогенетического тестирования |
Окончание табл. 8.10
Показание для консультации врача - клинического фармаколога | Примеры |
При выявлении особенностей фармакокинетики ЛС у больного по результатам терапевтического лекарственного мониторинга | |
Назначение антибиотиков II ряда (резерва) | |
Назначение антиконвульсантов | |
Назначение препаратов железа для парентерального введения |
Выполните задание для самостоятельной работы
Задание 8.8. Приведите примеры возможных клинических ситуаций (из вашей будущей специальности), при которых необходимо участие врача - клинического фармаколога в консилиуме. Заполните табл. 8.11.
Таблица 8.11. Участие врача - клинического фармаколога в консилиуме
Показание для участия врача - клинического фармаколога в консилиуме | Примеры |
Развитие серьезных нежелательных побочных реакций | |
Резистентность к проводимой лекарственными средствами терапии | |
При сопутствующих заболеваниях печени и почек | |
При назначении лекарственных средств беременным (кроме акушерско-гинекологических ЛПУ) | |
При назначении лекарственных средств лактирующим женщинам |
Как фармацевтический бизнес влияет на принятие решения врачом о выборе и применении лекарственного средства?
В мире существуют тысячи фармацевтических компаний (фармкомпаний), цели, бизнес и стратегия которых существенно отличаются. Среди них можно привести примеры компаний с много-
летней историей, отмеченной открытиями принципиально новых препаратов, появление которых означало революцию в лечении. Конкурентоспособность таких компаний обеспечивается за счет миллиардных вложений в научные разработки и высокие технологии, а также благодаря многоступенчатому контролю качества продукции и ее безопасности для пациентов. Начиная с 1940-х годов практически все новые лекарственные средства были созданы именно такими компаниями. Причем на сегодняшний день только клинические испытания новых препаратов обходятся создателям примерно в 2 млрд долларов и требуют не менее 10-15 лет исследований. Деятельность фармацевтических компаний не ограничивается сугубо производственной частью, но имеет также важный социальный аспект: фармкомпании несут ответственность перед обществом за качество своей продукции и полноту информации о ней. В то же время фармкомпании остаются коммерческими предприятиями, целью которых является получение прибыли. Не секрет, что в ряде случаев специалисты фармкомпаний намеренно искажают информацию о своем продукте или используют недопустимые с точки зрения этики способы его продвижения. Вот почему врач должен уметь противостоять агрессивному продвижению ЛП, избегать конфликта между профессиональными обязанностями и экономическими интересами, отличать собственно информацию о ЛП от маркетинговых ходов, научные симпозиумы и публикации от мероприятий по продвижению ЛП и т.п.
Именно для продвижения своих ЛП фармкомпании вступают во взаимоотношение с врачами, но врач должен разделять этичные и неэтичные отношения. Основные этические нормы продвижения ЛС изложены в специально разработанном в 1988 г. Руководстве ВОЗ. Крупные компании - лидеры рынка - объединены в Международную федерацию производителей фармацевтической продукции (IFPMA - www.ifpma.org). Члены этой организации обязаны соблюдать достаточно жесткие правила этичного продвижения своей продукции на рынке. Разумеется, далеко не всегда реальная политика компаний полностью соответствует декларируемым принципам, однако на Западе случаи нарушения этических норм, как правило, быстро предаются огласке и могут причинить серьезный вред репутации компании. В развитых странах представители фармацевтической индустрии под давлением общества еще в середине прошлого столетия начали принимать нормы, регламентирующие маркетинговую деятельность
компаний в рамках саморегулирования. В 1981 г. IFPMA, объединявшая в то время 50 национальных ассоциаций, приняла «Кодекс маркетинговой практики фармацевтических производителей», соблюдение которого с 1988 г. стало условием членства для национальных ассоциаций и соответственно требованием к входящим в их состав компаниям. Ассоциация международных фармацевтических производителей (AIPM), некоммерческая организация - член IFPMA, действующая на территории Российской Федерации и в настоящее время представляющая интересы 47 ведущих международных фармацевтических компаний, в 1998 г. приняла Кодекс маркетинговой практики AIPM, имеющий целью «установление минимальных требований, которым должны следовать фармацевтические компании на территории РФ». Современная редакция принята в 2006 г. Важно, что оба документа описывают лишь минимальные требования к средствам продвижения препаратов.
Полезная интернет-ссылка
Руководство ВОЗ «Этические критерии продвижения лекарственных средств» на русском языке доступно на сайте: http://www. apteka.ua/article/4324
Этический кодекс AIPM доступен на сайте: http://aipm.org/ publication/codecrus/
Выполните задание для самостоятельной работы
Задание 8.9. Укажите, какие виды отношений между фармацевтической компанией и врачом этичны согласно руководству ВОЗ и кодексу AIPM, а какие неэтичны (при условии, что врач не является научным консультантом компании и не участвует в клиническом исследовании), заполнив табл. 8.12: отметьте значком «+» в соответствующих столбцах.
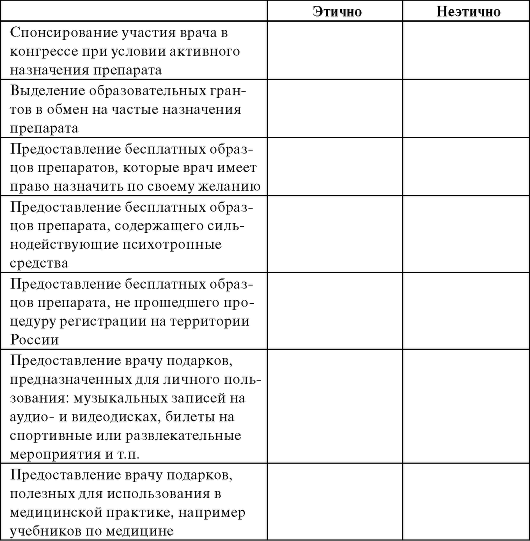
Таблица 8.12. Виды отношений между врачом и фармацевтической компанией
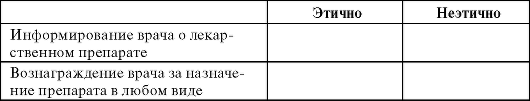 Окончание таблицы 8.12
Окончание таблицы 8.12
 Кроме того, важными методами воздействия на врачей со стороны фармацевтического бизнеса являются:
Кроме того, важными методами воздействия на врачей со стороны фармацевтического бизнеса являются:
• визиты медицинских представителей фармкомпаний;
• печатные рекламные материалы о ЛП;
• сателлитные симпозиумы, конференции, семинары, финансируемые фармкомпаниями;
• статьи в периодических медицинских изданиях (журналах), профинансированные фармкомпаниями.
Как врачу общаться с медицинскими представителями фармацевтических компаний?
Общение с медицинским представителем может быть полезным для врача: он получает информацию о новейших ЛС, имеет возможность задавать вопросы. С другой стороны, общение с медицинским представителем может обернуться пустой тратой времени, если вместо добросовестного изложения информации врача вынуждают выслушивать малоубедительные аргументы рекламного характера и необоснованную критику в адрес препаратов-конкурентов. Наконец, медицинские представители ряда компаний могут убеждать врачей использовать свою продукцию вопреки показаниям, извращать научные данные, скрывать информацию о побочных эффектах или даже убеждать врачей выписывать препарат своей компании за материальное вознаграждение. Врач сам решает, встречаться ему с медицинским представителем фармкомпании или нет. В настоящее время порядок посещения медицинскими представителями фармкомпании врачей ЛПУ находится в стадии регулирования на законодательном уровне. Следует помнить, при контакте с медицинским представителем врачу рекомендуется соблюдать ряд правил:
• врач не должен встречаться с медицинскими представителями в рабочее время (во время приема пациентов, планового обхода и т.д.);
• врач должен получить разрешение от администрации ЛПУ на встречу с медицинскими представителями.
Именно при встрече с медицинским представителем фармкомпании чаще всего врач соглашается на те или иные (этичные или не этичные) отношения с фармацевтическим бизнесом, изложенные в задании 8.10. Врач должен уметь выявить незаконные или неэтичные отношения, которые ему предложены и категорически отказаться от них.
Во время визита медицинский представитель применяет ряд психологических приемов, располагающих врача к себе, конечной целью которых является принятие решение врачом о рекомендации ЛП (выписке рецепта) пациенту. Знание этих приемов помогает врачу свести к минимуму субъективные факторы при анализе предложенной медицинским представителем информации о ЛП.
Полезная интернет-ссылка
Более подробно о методах воздействия медицинских представителей на врачей можно узнать из монографии С. Паукова «Руководство медицинского представителя фармацевтической компании», которая находится в свободном доступе: http://medpred.ru
С этой целью ниже изложены некоторые рекомендации для врача при его общении с медицинским представителем.
• Не давайте медицинскому представителю личную информацию о себе (о семье, домашних животных, личных и семейных проблемах, хобби и увлечениях и т.д.). Эта информация может служить медицинскому представителю для лучшего «вхождения в доверие». Среди медицинских представителей распространена практика ведения карточек на всех врачей, которых они посещают, куда эта информация вносится.
• Контролируйте беседу: будет лучше, если вы сами будете активно задавать вопросы, вместо того, чтобы выслушивать банальные фразы, часть которых вам и так давно известна.
• Не давайте медицинскому представителю обещаний выписывать или рекомендовать рекламируемый им ЛП, особенно если вас просят вести количественный учет выписанных упаковок, пациентов, которым выписаны рецепты и т.д. Это возлагает на вас обязательства перед медицинским представителем.
• Не соглашайтесь участвовать в «бонусных» и «поощрительных» программах для врачей, часто рекомендующих рекламируемый ЛП (в качестве поощрений и бонусов могу выступать поездки на научные конференции, посещение ресторанов и развлекательных мероприятий, ценные подарки и даже денежные вознаграждения в зависимости от активности врача), что считается неэтичным.
• Не соглашайтесь выписывать рецепт на бланке, на котором уже вписаны ЛП и его доза, а также на котором указана ваша фамилия или ваш идентификационный номер, по которому в аптеке можно понять, какой врач выписал рецепт.
• Не принимайте от медицинских представителей приглашения на конференции, семинары, «круглые столы», организуемые одной фармкомпанией.
• Не принимайте от медицинских представителей никаких подарков (в том числе и денежные вознаграждения, посещение развлекательных мероприятий, ресторанов и т.д.), а также научные статьи и медицинскую литературу за обещание рекомендовать рекламируемый ЛП (особенно если это обещание оформляется в письменной форме).
• Не принимайте от медицинского представителя промоционные материалы с нанесенными на них названиями ЛП или фармкомпании, которые могут быть заметны вашим пациентам, особенно медицинские халаты, стетоскопы. Это может вызвать у пациента подозрение на существование у вас заинтересованности в рекомендации рекламируемого ЛП. Если вы по каким-то причинам вынуждены пользоваться такими приборами и материалами, удалите с них название спонсора.
• Не принимайте от медицинского представителя промоционные материалы (особенно по рецептурным ЛП) с нанесенными торговыми названиями ЛП, которые могут попасть к вашим пациентам:
- бланки дневников самонаблюдения;
- бланки диетических рекомендаций и других немедикаментозных мероприятий при заболеваниях, являющихся показанием для назначения рекламируемого ЛС.
• Критически относитесь к статьям в периодической медицинской печати (журналах), которые предлагаются медицинским представителем для ознакомления, если:
- в статьях нет информации о наличии или отсутствии конфликта интересов у авторов статьи и источника финансирования исследования. Конфликт интересов (по Дж. Ласту) - неполнота объективности человека, заинтересованного в исходе исследования, происходит в случаях, когда человек может извлечь финансовую или другую выгоду (продвижение по службе и т.д.) из какого-либо аспекта исследования;
- в названии статьи упоминается торговое название ЛП, а не его международной непатентованное название. Торговое название ЛП в статьях, в которых описывается клиническое исследование, должно упоминаться только один раз в разделе «Материалы и методы»;
- они опубликованы в журналах, распространяемых среди врачей бесплатно. В них печатаются только статьи, оплаченные размещенной в них рекламой, возможно, необъективные.
• Не принимайте от медицинских представителей рекламные предметы и плакаты, замаскированные под информационные и просветительские издания для пациентов. Обычно медицинскими представителями становятся бывшие врачи, поэтому в общении с ними старайтесь поддерживать коллегиальность и доброжелательность, но при этом жестко обрывайте любые попытки подменить рассказ о реальных особенностях препаратов пустой болтовней. Крупные компании уделяют большое внимание профессиональной подготовке своих представителей, но, как и в любой другой области, профессионализм отдельных специалистов может отличаться как в лучшую, так и в худшую сторону. Следует отметить, что если вас интересует какой-либо ЛП, то совершенно не нужно ждать, пока вас посетит медицинский представитель. В любую компанию, соблюдающую правила этического продвижения своих ЛП, можно обратиться по телефону и попросить, чтобы ее медицинский представитель специально встретился с вами. Выбирайте тот ЛП, который вам интересен, и ограничивайте разговор именно этим ЛП. Помимо медицинских представителей в состав любой фармацевтической компании входит так называемый медицинский отдел. Сотрудник этого отдела (медицинский советник) обязан обладать полной информацией о ЛП (как правило, каждый советник курирует 1-2 ЛП своей компании), кроме того, он принимает участие в сборе информации по безопасности, а также обязан отвечать на любые вопросы врачей и пациентов, связанных с применением ЛП. В распоряжении медицинского советника имеется полная информация по ЛП, в том числе результаты всех публикаций. Если вам нужны более глубокие сведения: данные исследований, описания редких побочных эффектов, режимы дозирования в трудных случаях (гемодиализ, ХПН), имеет смысл связаться с медицинским советником компании. Ответ на все подобные вопросы входит в компетенцию этого сотрудника.
Выполните задание для самостоятельной работы
Задание 8.10. Определите свою тактику в отношении аргументов, высказываемых медицинским представителем о ЛП, заполнив табл. 8.13.
Таблица 8.13. Тактика отношений с фармацевтическим представителем
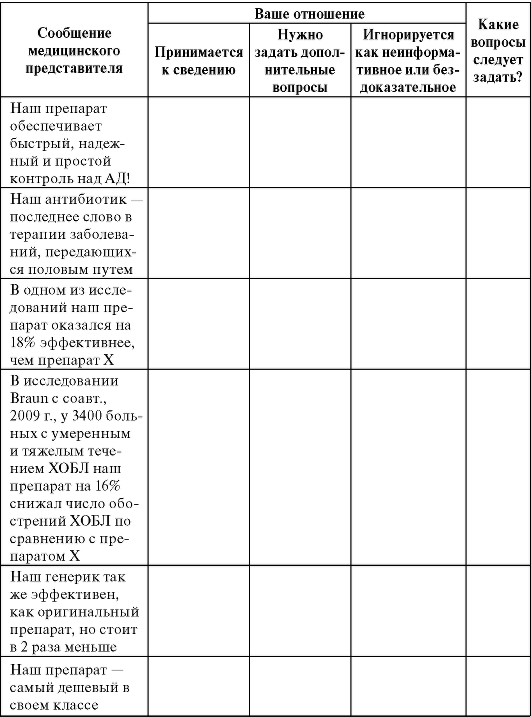 Продолжение табл. 8.13
Продолжение табл. 8.13
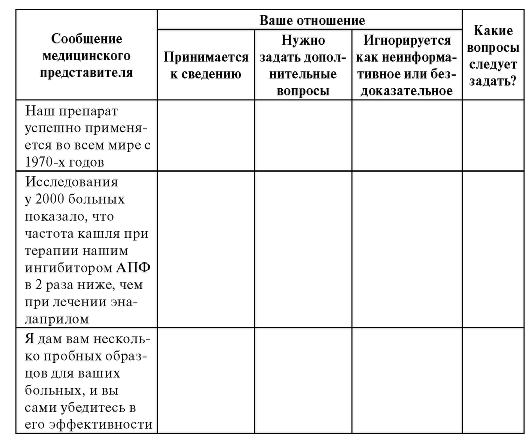
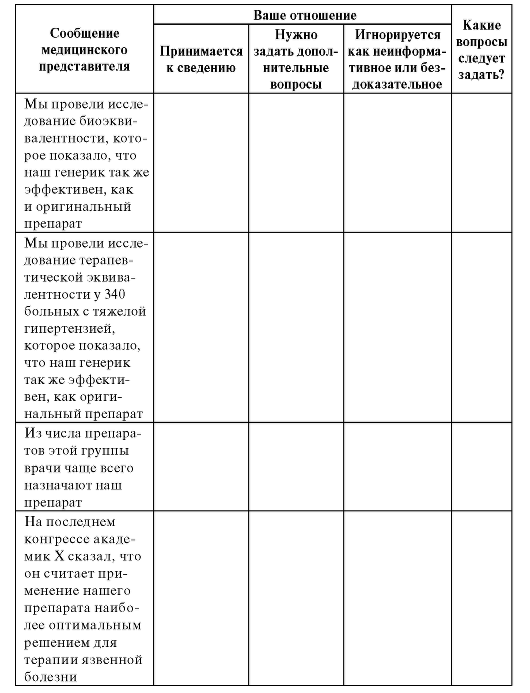 Окончание табл. 8.13
Окончание табл. 8.13
 Как врачу объективно оценивать печатные рекламные материалы о лекарственном препарате?
Как врачу объективно оценивать печатные рекламные материалы о лекарственном препарате?
Печатные рекламные материалы о ЛП должны отвечать требованиям действующего российского законодательства о рекламе (брошюры, проспекты, листовки). Информация о ЛП в них должна содержать объективную, достоверную и актуальную информацию, основанную на инструкции по медицинскому применению. Фармкомпании должны стремиться к наиболее полному отражению основных характеристик, касающихся безопасности применения ЛП, в печатных рекламных материалах: нельзя рассматривать только вопросы эффективности, забывая про безопасность, или говорить о переносимости в отрыве от терапевтического эффекта. Требуйте информации по всем этим пунктам: эффективность, переносимость, безопасность. Информация должна быть ясной, разборчивой, точной,
взвешенной, честной, объективной и достаточно полной, чтобы у ее читателя могло быть сформировано объективное мнение об эффективности и безопасности ЛП. Информация должна быть основана на современной оценке всех значимых фактов (без утаивания «неудобных» фактов). Информация не должна вводить врачей в заблуждение путем искажения, преувеличения, умолчания или иных приемов. При этом производители должны избегать двусмысленности, утверждений абсолютного или всеохватывающего характера. Сравнительная реклама в материалах должна проводиться по идентичным характеристикам и не должна вводить в заблуждение врачей в связи с умалчиванием части существенной информации. Вся информация о ЛП должна подтверждаться соответствующими научными данными (прежде всего опубликованными статьями и т.д.). Не принимайте рекламных материалов, в которых утверждения не подкреплены ссылкой на литературные источники - статьи в авторитетных журналах. Каждое ответственное заявление медицинского представителя («наш препарат более эффективен, чем препарат конкурентов!», «у нашего препарата отсутствуют такие побочные эффекты») должно подкрепляться ссылками на литературные источники. Материал должен быть основан на современной оценке всех значимых фактов (без утаивания «неудобной информации») и изложен четко и последовательно. Обращайте внимание на качество доказательств: проведение рандомизации, «ослепления». На небольшом числе пациентов или без группы контроля следует отвергать. Не принимайте в качестве доказательств аргументы общего порядка («это всем известно», «такие исследования есть») и ссылки на авторитеты («на последнем конгрессе академик N. сказал...»). Помните, что производителям запрещено рекламировать применение ЛС по показаниям, для которых ЛС не зарегистрировано (т.е. их нет в инструкции по медицинскому применению ЛП).
Выполните задание для самостоятельной работы
Задание 8.11. Проанализируйте качество информации, изложенной в печатном рекламном материале о ЛП (брошюра, проспект, листовка и т.д.), который предложен преподавателем или вы нашли сами по вашей будущей специальности. По некоторым характеристикам (табл. 8.14) сопоставьте информацию из рекламного материала с ТКФС Государственного реестра ЛС (www.regmed.ru).
Таблица 8.14. Анализ качества рекламного материала о лекарственном препарате
Характеристика материала | Что написано в материале? |
Торговое название | |
МНН | |
Информация о том, является ли ЛП оригинальным или генериком | |
Показание к применению | По данным рекламного материала: |
По ТКФС: | |
Противопоказания | По данным рекламного материала: |
По ТКФС: | |
Неблагоприятные побочные реакции | По данным рекламного материала: |
По ТКФС: | |
Взаимодействие с другими ЛС | По данным рекламного материала: |
По ТКФС: | |
Ссылки на источник информации по параметрам эффективности и безопасности рекламируемого ЛП (статьи), указать какие | |
Информация о сопоставлении рекламируемого ЛП с другими ЛП | |
Наличие утверждений об исключительности, безальтернативности ЛП | |
Информация о производителе: название фармкомпании, адрес Российского представительства, телефоны, e-mail |
Как врачу объективно оценивать симпозиумы, семинары, «круглые столы», финансируемые фармацевтическими компаниями?
Врач, посещающий данные мероприятия, должен относиться к информации, которая на них представляется, с большой долей скепсиса. Обязательным считается информирование врачей о том, что данное мероприятие профинансировано фармацевтическими компаниями, однако это происходит не всегда, что является не этич-
ным. Также врачу нежелательно посещать подобные мероприятия, если они спонсируются только одной фармацевтической компанией. При организации и проведении симпозиумов, семинаров и «круглых столов» фармацевтические компании могут применять этичные и неэтичные методы продвижения ЛП.
Выполните задание для самостоятельной работы
Задание 8.11. Укажите этичные и неэтичные методы продвижения ЛП при проведении симпозиумов, семинаров, «круглых столов» согласно руководству ВОЗ и кодексу AIPM (при условии, что врач не является научным консультантом компании и не участвует в клиническом исследовании). Заполните табл. 8.15: отметьте значком «+» в соответствующих столбцах.
Таблица 8.15. Методы продвижения лекарственных препаратов фармацевти-
ческими компаниями
Организация мероприятий вне страны проживания приглашенных специалистов | ||
Оплата транспортных расходов, питания, проживания | ||
Выплаты, компенсирующие затраты времени, связанные с посещением мероприятия | ||
Выплата вознаграждений за выступления и презентации | ||
Проведение мероприятия в Доминиканской республике | ||
Предоставление прохладительных напитков и закусок | ||
Привлечение знаменитых артистов, попзвезд | ||
Осмотр достопримечательностей |
Полезная интернет-ссылка
О состоянии проблемы взаимоотношения врачей и фармацевтического бизнеса за рубежом вы можете узнать из статьи: Белялов Ф.И. Фармацевтическая индустрия, медицинская наука
и практика: проблемы и решения // Кардиологическая наука и практика. - Иркутск, 2009. - C. 18-26. http://therapy.irkutsk.ru/my/pharm.pdf
Ресурс «Здоровый скептицизм: противостояние недобросовестной промоции лекарств»: http://www.healthyscepticism.org/