Военная токсикология, радиобиология и медицинская защита - Учебник Под редакцией профессора С.А. Куценко
|
|
|
|
Глава 10. Отравляющие и высокотоксичные вещества общеядовитого действия
Общеядовитым называется действие химических веществ на организм, сопровождающееся повреждением биологических механизмов энергетического обеспечения процессов жизнедеятельности.
Как указывалось ранее (см. раздел “Общая токсикология”), основным содержанием биоэнергетических процессов в организме является непрерывный синтез в клетках и поддержание на постоянном уровне концентрации богатых энергией (макроэргических) соединений, в частности, аденозинтрифосфорной кислоты (АТФ). Источником, запасаемой в форме АТФ энергии, является биологическое окисление субстратов, образующихся в ходе метаболизма питательных веществ, поступающих из окружающей среды (рис. 24).
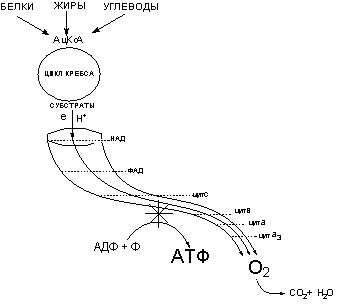
Рисунок 24. Модель процесса клеточного дыхания
Энергия, запасенная в субстратах, образуемых в цикле Кребса, при их окислении (движение электронов и протонов по цепи дыхательных ферментов к кислороду), обеспечивает работу сопряженного механизма синтеза макроэргов путем фосфорилирования их предшественников (в частности, превращение аденозиндифосфорной кислоты в аденозинтрифосфорную)
Практически любой токсикант, вызывая тяжелую, острую интоксикацию, в той или иной степени нарушает энергетический обмен, то есть оказывает общеядовитое действие. Однако в большинстве случаев нарушение биоэнергетики является лишь звеном в патогенезе токсического процесса, инициированного за счет иных механизмов. Вместе с тем имеются вещества, способные первично повреждать систему энергообеспечения клеток, нарушая (рис. 25):
- механизмы транспорта кислорода кровью;
- механизмы биологического окисления;
- механизмы сопряжения биологического окисления и синтеза макроэргов (фосфорилирования).
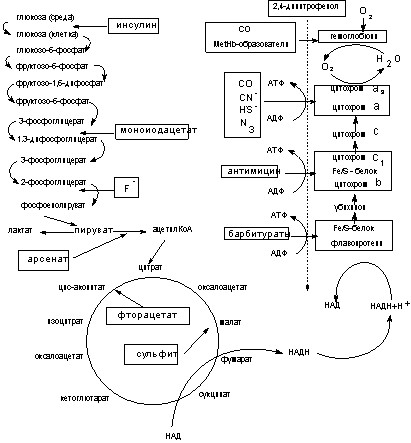
Рисунок 25. Механизмы действия некоторых токсикантов на биоэнергетические процессы
Токсиканты, основным (первичным) механизмом повреждающего действия которых на организм является нарушение биоэнергетики, могут быть объединены в группу веществ общеядовитого действия.
Важными особенностями токсического процесса, развивающегося при отравлении такими веществами, являются:
- быстрота развития острой интоксикации (короткий скрытый период, бурное течение токсического процесса);
- функциональный характер нарушений со стороны вовлеченных в токсический процесс органов и систем, отсутствие грубых структурно-морфологических изменений в тканях отравленных;
- вовлечение в патологический процесс преимущественно органов и систем с интенсивным энергообменом и, прежде всего, центральной нервной системы;
- закономерный характер развития нарушений со стороны ЦНС: возбуждение, переходящее в состояние гиперактивации, а затем глубокого угнетения (изменение сознания, судороги, кома и т.д.).
Ряд веществ-ингибиторов энергетического обмена при экстремальных ситуациях могут стать причиной групповых и массовых поражений людей и потому представляют интерес для военной медицины.
Классифицировать ОВТВ рассматриваемой группы можно в соответствии с особенностями механизма их токсического действия:
1. ОВТВ, нарушающие кислородтранспортные функции крови:
1.1. Нарушающие функции гемоглобина:
1.1.1. Образующие карбоксигемоглобин (монооксид углерода, карбонилы металлов).
1.1.2. Образующие метгемоглобин (оксиды азота, ароматические нитро- и аминосоединения, нитриты и др.).
1.2. Разрушающие эритроциты (мышьяковистый водород).
2. ОВТВ, нарушающие тканевые процессы биоэнергетики:
2.1. Ингибиторы ферментов цикла Кребса (производные фторкарбоновых кислот).
2.2. Ингибиторы цепи дыхательных ферментов (синильная кислота и ее соединения).
2.3. Разобщители тканевого дыхания и фосфорилирования (динитроортокрезол, динитрофенол).
Наряду с общими чертами, патологические процессы, развивающиеся при острых отравлениях ОВТВ с различными механизмами общеядовитого действия, имеют и свою специфику.
10.1. ОВТВ, нарушающие кислородтранспортные функции крови
10.1.1. ОВТВ, нарушающие функции гемоглобина
Одна из важнейших функций крови - транспорт кислорода от легких к тканям. Транспорт кислорода осуществляется двумя способами:
- гемоглобином - в форме соединения;
- плазмой - в форме раствора.
В растворенном состоянии плазмой крови переносится около 0,2 мл О2 на 100 мл крови. В связанной с гемоглобином форме эритроциты переносят в 100 раз больше кислорода (20 мл на 100 мл крови). 1 г гемоглобина способен обратимо связать около 1,5 мл О2, а в 100 мл крови содержится около 14 - 16 г гемоглобина.
В результате взаимодействия кислорода с гемоглобином образуется нестойкое соединение оксигемоглобин (HbO) (рис. 26).
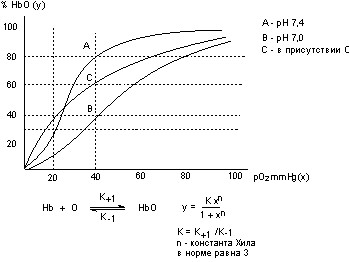
Рисунок 26. Кривая насыщения гемоглобина кислородом
При повышении парциального давления кислорода (сатурация крови в легких) содержание НbО увеличивается и при 100 mmHg О2 приближается к 100%. При понижении парциального давления О2 (в тканях) НbО распадается, при этом выделяющийся кислород утилизируется тканями организма. Процесс насыщения гемоглобина О2 и рассыщения оксигемоглобина описывается S-образной кривой (рисунок 3). Такая форма зависимости между рО2 и %НbО есть следствие явления взаимодействия четырех субъединиц гемоглобина в молекулярном комплексе (гем-гем взаимодействие). Физиологический смысл явления - обеспечение максимально возможного выделения кислорода в ткани при незначительном различии парциального давления газа в крови и тканях (при рО2 крови около 40 mmHg и рО2 тканей около 20 mmHg гемоглобин высвобождает около 50% связанного кислорода).
В норме на сродство кислорода к гемоглобину влияют многочисленные факторы. Среди основных: рН, рСО2 (эффект Бора), биорегуляторы процесса диссоциации оксигемоглобина (2,3-дифосфоглицерат и др.). При повышении рН, рСО2 и содержания 2,3-дифосфоглицерата в эритроцитах сродство гемоглобина к кислороду снижается - отдача кислорода тканям возрастает.
Из сказанного ясно, что вещества, взаимодействующие с гемоглобином и нарушающие его свойства, будут существенно изменять кислородтранспортные свойства крови, вызывая развитие гипоксии гемического типа.
Кислородное голодание плохо переносится человеком и другими млекопитающими, и в тяжелых случаях может привести к серьезным нарушениям со стороны различных органов и систем. Особенно чувствительными к гипоксии являются клетки органов с интенсивным энергообменом: сердечной мышцы, почек и головного мозга (табл. 27).
Таблица 27.
Потребление кислорода различными органами крысы (по Field et al., 1939)
Орган |
Скорость потребления кислорода, мл/г ткани мин |
Скелетная мускулатура |
0,875 |
Кожа |
0,416 |
Кости |
0,153 |
Кровь |
0,025 |
Печень |
2,010 |
Почки |
4,120 |
Мозг |
1,840 |
Легкие |
1,250 |
Сердце |
1,930 |
Функциональная состоятельность мозга целиком зависит от непрерывного снабжения его кислородом. Так, при полной аноксии “местных” запасов кислорода (7-10 мл) хватает лишь на 10 секунд. Мозг, составляя по массе 2-3% от массы тела, потребляет около 20% всего потребляемого организмом кислорода. Нормальная скорость кровотока составляет 50-60 мл/мин/100 г ткани, а скорость поглощения О2 – 3,5 мл/мин/100 г ткани. Собственно нервные клетки составляют 5% от общей массы мозга, но потребляют 25% О2, потребляемого мозгом (нейрон - 350-450 мкл О2/мин; глиальные клетки - 60 мкл О2/мин). До 90% вырабатываемой и потребляемой энергии расходуется на поддержание электрохимического градиента возбудимых мембран и метаболизм биологически активных веществ, участвующих в передаче нервных импульсов. Неудивительно, что сознание, как функциональный феномен, утрачивается уже в течение несколько секунд полной аноксии мозга. Необратимые изменения нейронов наступают позже, спустя 4 - 5 минут после полного прекращения снабжения мозга кислородом. Другие органы и ткани, расходующие энергию в основном на обеспечение пластического обмена (процессы синтеза и разрушения структурных элементов живого), способны переживать (хотя и с нарушениями функций) нехватку кислорода в течение нескольких часов.
Токсиканты, избирательно нарушающие кислородтранспортные функции крови, обладают высокой токсичностью.
10.1.1.1. ОВТВ, образующие карбоксигемоглобин
Карбоксигемоглобин образуется при действии на организм монооксида углерода (СО), так называемого угарного газа, а также при отравлении некоторыми карбонилами металлов, которые, попав в организм, разрушаются с образованием СО. В недалеком прошлом тетракарбонил никеля (Ni(CO)4) и пентакарбонил железа (Fe(CO)5) изучались на предмет возможности создания на их основе боевых отравляющих веществ.
10.1.1.1.1. Карбонилы металлов
Соединения металлов с СО называются карбонилами металлов. Их применяют в некоторых областях химической промышленности. Из множества соединений особый интерес представляют пентакарбонил железа и тетракарбонил никеля – вещества, легко разлагающиеся с образованием СО. Оба токсиканта представляют собой бесцветные летучие жидкости (максимальная концентрация в воздухе - более 300 г/м3), пары которых, примерно в 6 раз тяжелее воздуха (могут образовывать нестойкие зоны заражения). Легко разрушающиеся с образованием СО. Плохо растворяются в воде; хорошо - в липидах.
Действуют как ингаляционно, так и через неповрежденную кожу (в крови разрушаются с образованием СО).
В зонах заражения возможны два варианта поражения - собственно веществами и продуктами их разложения. Собственно вещества обладают свойствами пульмонотоксикантов (см. выше). Тяжелое поражение сопровождается развитием (в течение 10 - 15 часов) токсического отека легких. Токсичным продуктом разложения веществ является оксид углерода, особенности действия которого представлены ниже.
10.1.1.1.2. Оксид углерода (СО)
Оксид углерода является продуктом неполного сгорания углерода. Он образуется в качестве примеси везде, где происходит горения углеродсодержащего топлива (топка печей, эксплуатация двигателей внутреннего сгорания и т.д.). Массовые поражение угарным газом возможны в очагах пожаров и при накоплении вещества в плохо вентилируемых пространствах: помещениях, туннелях, шахтах и т.д., где действует источник его образования.
Физико-химические свойства
СО – бесцветный газ, не имеющий запаха, с низкой плотностью по воздуху (0,97). Кипит при –191,5 0С и замерзает при –205,1 0С. В воде и плазме крови растворяется мало (около 2% по объему), лучше в спирте. Смесь СО с воздухом способна взрываться. Плохо сорбируется активированным углем и другими пористыми материалами. Оксид углерода как соединение с двухвалентным атомом углерода является восстановителем и может вступать в реакции окисления. На воздухе горит синим пламенем с образованием диоксида углерода. При нормальной температуре превращение СО в СО2 идет при участии катализаторов, например гопкалита (смеси двуокиси марганца (60%) и окиси меди (40%)). Поскольку газ легче воздуха зоны нестойкого химического заражения на открытом пространстве могут формироваться лишь в очагах обширных пожаров.
Токсичность
Чувствительность людей к оксиду углерода колеблется в довольно широких пределах. Она зависит от многих факторов: от длительности экспозиции, степени физической нагрузки в момент действия яда, от температуры внешней среды и состояния организма. Отравление наступает быстрее и протекает тяжелее при анемиях, авитаминозах, у истощенных людей. Пребывание в атмосфере, содержащей 0,01 объемный % СО (0,2 мг/л) при физической нагрузке допустимо не долее 1 часа. После этого появляются признаки отравления. Отчетливая клиника острого поражения развивается при содержании СО в воздухе более 0,1 объемного %.
Токсикокинетика
Единственный способ поступления газа в организм - ингаляционный. Оксид углерода, при вдыхании зараженного им воздуха, легко преодолевает легочно-капиллярную мембрану альвеол и проникает в кровь. Скорость насыщения крови оксидом углерода увеличивается при повышении его парциального давления во вдыхаемом воздухе, усилении внешнего дыхания и интенсификации легочного кровообращения (увеличиваются при физических нагрузках). По мере увеличения концентрации яда в крови скорость резорбции замедляется. При достижении равновесия в содержании СО в альвеолярном воздухе и в крови дальнейшее поступление его в организм прекращается.
Выделение оксида углерода из организма при обычных условиях происходит в неизмененном состоянии также через легкие. Период полувыведения составляет 2 - 4 часа.
Основные проявления интоксикации
Раздражающим действием оксид углерода не обладает. Контакт с веществом проходит незамеченным. Тяжесть клинической картины отравления угарным газом определяется содержанием СО во вдыхаемом воздухе, длительностью воздействия, потребностью организма в кислороде, интенсивностью физической активности пострадавшего. По степени тяжести интоксикации принято делить на легкие, средние и тяжелые.
Легкая степень отравления формируется при действии относительно невысоких концентраций яда. Она развивается медленно (порой в течение нескольких часов) и характеризуется сильной головной болью, головокружением, шумом в ушах, потемнением в глазах, понижением слуха, ощущением “пульсации височных артерий”, тошнотой, иногда рвотой. Нарушается психическая деятельность: пораженные теряют ориентировку во времени и пространстве, могут совершать немотивированные поступки. Отмечается повышение сухожильных рефлексов. У отравленного развивается тахикардии, аритмии, повышается артериальное давление. Возникает одышка - признак компенсаторной реакцией организма на развивающуюся гипоксию. Однако в результате одышки увеличивается количество выдыхаемого диоксида углерода (СО2), развивается газовый алкалоз. Кроме того, учащение дыхания при нахождении человека в отравленной зоне является дополнительным фактором, ускоряющим поступление оксида углерода в организм.
Легко пораженный СО утрачивает боеспособность. Однако при прекращении поступления яда в организм все перечисленные симптомы отравления в течение нескольких часов проходят без каких-либо последствий.
При продолжительном поступлении оксида углерода в организм или при действии его в более высоких концентрациях развивается отравление средней степени тяжести, характеризующееся более выраженными проявлениями интоксикации, большей скоростью их развития. Нарушается координация движений. Сознание затемняется, развивается сонливость и безразличие к окружающей обстановке, появляется выраженная мышечная слабость. Слизистые оболочки и кожа приобретают розовую окраску. Могут развиваться фибриллярные подергиваний мышц лица. Возможно повышение температуры тела до 38-40 0С. Одышка усиливается, пульс учащается. Артериальное давление после кратковременного подъема, связанного с возбуждением симпатико-адреналовой системы и выбросом катехоламинов из надпочечников, снижается. Этот эффект объясняют прямым действием СО и рефлекторной реакцией (с хеморецепторов каротидного синуса) на центры регуляции сосудистого тонуса.
Прогрессирующая гипоксия активирует процессы анаэробного гликолиза, о чем свидетельствует активация ряда ферментов (альдолазы, дегидрогеназы-3-фосфоглицеринового альдегида, лактатдегидрогеназы). В результате в организме накапливаются молочная и пировиноградная кислоты. Это способствует развитию метаболического ацидоза, который приходит на смену газовому алкалозу.
При отравлении средней степени тяжести в большинстве случаев через несколько часов (до суток) после прекращения действия яда состояние пострадавших существенно улучшается, однако довольно долго сохраняется тошнота, головная боль, сонливость, склонность к головокружению, шаткая походка.
Тяжелое отравление характеризуется быстрой потерей сознания, появлением признаков гипертонуса мышц туловища, конечностей, шеи и лица (ригидность затылочных мышц, тризм жевательной мускулатуры). На высоте токсического процесса могут развиться судороги клонико-тонического характера. Кожные покровы и слизистые оболочки приобретают ярко-розовый цвет (признак высокого содержания карбоксигемоглобина в крови). Если в этот период пострадавший не погибает, судороги прекращаются, но развивается кома: утрачиваются рефлексы, мышцы расслабляются. Дыхание становится поверхностным, неправильным. Зрачки расширены, на свет не реагируют. Пульс частый, слабого наполнения, артериальное давление резко снижено. При регистрации биоэлектрической активности сердца на электрокардиограмме определяются экстрасистолия, нарушение внутрисердечной проводимости, признаки диффузных и очаговых мышечных изменений, острой коронарной недостаточности. Изменения в мышце сердца, регистрируемые на ЭКГ, отчасти обусловлены изменением электролитного состава крови: увеличивается содержание кальция и магния, уменьшается содержание натрия и калия. В связи с сужением периферических сосудов происходит переполнение кровью внутренних органов и полых вен. Развиваются застойные явления, затрудняющие работу сердца.
В крови, вследствие рефлекторного сокращения селезенки, увеличивается до 6-7.1012/л количество эритроцитов, развиваются лейкоцитоз со сдвигом формулы крови влево, относительная лимфопения и эозинопения. Растет содержание мочевины в крови. В таком состоянии отравленный может пребывать несколько часов, и при нарастающем угнетении дыхания с прогрессирующим падением сердечной деятельности наступает смертельный исход. При благоприятном течении отравления и своевременном оказании медицинской помощи симптомы интоксикации исчезают, и через 3-5 дней состояние пострадавшего нормализуется. Изменения ЭКГ при тяжелых отравлениях порой выявляются в течение нескольких недель и даже месяцев.
В случае высокого содержания во вдыхаемом воздухе оксида углерода (до нескольких процентов) на фоне пониженного парциального давления О2 (до 17-14%) при выполнении физической нагрузки, сопровождающейся усиленным газообменом, (ситуация, возникающая при пожарах, взрывах боеприпасов в замкнутых пространствах и т.д.) развивается молниеносная форма отравления (Ю.В. Другов, 1959). Пораженные быстро теряют сознание. Возможны кратковременные судороги, за которыми наступает смерть или развивается тяжелая кома. Прогноз неблагоприятный, если коматозное состояние продолжается более двух суток.
Выделяют также синкопальную форму интоксикации. По данным Б.И. Предтеченского, эта разновидность поражения составляет до 10-20% всех случаев отравления и развивается у лиц с нарушенными механизмами регуляции гемодинамики. При этом варианте течения отравления наблюдается резкое снижение артериального давления, сознание быстро утрачивается, кожные покровы и слизистые оболочки становятся бледными (“белая асфиксия”). Развившееся коллаптоидное состояние может продолжаться несколько часов. Возможен смертельный исход от паралича дыхательного центра.
Осложнения острой интоксикации
При отравлениях тяжелой степени могут наблюдаться осложнения, которые снижают дееспособность или полностью лишают человека работоспособности в течение длительного времени. Чаще эти осложнения развиваются не сразу после отравления, а по прошествии несколько дней или даже недель. К таким осложнениям относятся деструктивные процессы в ткани мозга, приводящие к формированию стойких нарушений функций центральной нервной системы (ослабление памяти, неспособность к умственному напряжению, изменения психической деятельности). Нарушения со стороны периферической нервной системы характеризуются невритами, радикулитами, парестезий. Иногда развиваются параличи и парезы конечностей. Возможны расстройства зрения, слуха, обоняния и вкуса. Тяжелое отравления часто осложняется пневмонией и отеком легких, вследствие нарушения легочного кровообращения и сердечной недостаточности, а также рабдомиолизом с последующей острой почечной недостаточностью.
Механизм токсического действия
Оксид углерода in vitro активно взаимодействует с многочисленными гем-содержащими протеидами (гемоглобин, миоглобин, цитохромы и т.д.) при условии, что железо, входящее в структуру порфиринового кольца их простетической группы, находится в двухвалентном состоянии. Связь двухвалентного железа с СО - обратима. С трехвалентным железом вещество не взаимодействует.
Оксид углерода, проникший в кровь, вступает во взаимодействие с гемоглобином (Hb) эритроцитов, образуя карбоксигемоглобин (HbCO), не способный к транспорту кислорода. Развивается гемический тип гипоксии. Оксид углерода способен взаимодействовать как с восстановленной (Hb), так и с окисленной (HbO) формой гемоглобина, поскольку в обеих формах железо двухвалентно.
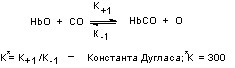
Степень сродства токсиканта к гемоглобину может быть охарактеризована константой равновесия реакции взаимодействия (константа Дугласа). Установлено, что у человека, хотя скорость присоединения CO к гемоглобину в 10 раз ниже скорости присоединения кислорода, скорость диссоциации карбоксигемоглобина приблизительно в 3600 раз меньше соответствующей скорости для оксигемоглобина. Поэтому относительное сродство Hb к CO примерно в 300 раз выше, чем к кислороду. Величина константы Дугласа у животных разных видов различна (у лошади – 240, канарейки – 100, кролика – 40). В состоянии равновесия СО, в концентрации 1 объемная часть на 1000 объемных частей воздуха, превращает 50% гемоглобина крови человека в карбоксигемоглобин. Как правило, в реальных условиях, концентрация 0,1% СО во вдыхаемом воздухе обусловливает образование около 10% карбоксигемоглобина в крови.
Количество карбоксигемоглобина, образовавшегося в крови в начале воздействия яда, может быть рассчитано по формуле Лилиенталя (1946):
% НbСО = (рСО t МОД) 0,05 , где
pСО – парциональное давление СО во вдыхаемом воздухе;
t – время экспозиции в минутах;
МОД – минутный объем дыхания в литрах.
Поскольку карбоксигемоглобин не в состоянии переносить кислород от легких к тканям существует тесная корреляция между его уровнем в крови и выраженностью клинической картины отравления. Экспозиция 0,5% СО в течение часа при умеренной физической активности сопровождается образованием 20% карбоксигемоглобина, при этом пострадавший начинает испытывать неприятные ощущения, предъявляет жалобы на головную боль. Интоксикация средней степени тяжести развивается при содержании крабоксигемоглобина 30 - 50%, тяжелая - около 60% и выше. Смертельные исходы при отравлении СО в эксперименте на животных наблюдаются при уровне HbСО в крови - 60-70%. Вместе с тем механическое удаление 70% гемоглобина или ингаляция воздуха с пониженным парциальным давлением О2 (и снижение тем самым содержания HbО до уровня 30%) к смерти экспериментальных животных не приводят. Это наблюдение косвенно указывает на наличие дополнительных механизмов токсического действия СО. По существующим представлениям они состоят в следующем.
Во-первых, оксид углерода не только выключает из транспорта О2 часть гемоглобина, но также нарушает явление гем-гем взаимодействия, затрудняя тем самым процесс диссоциации HbО в крови отравленного и передачу транспортируемого кислорода тканям (Л.А. Тиунов, В.В. Кустов, 1969). Эффект еще более усиливается по мере развития интоксикации и понижения парциального давления СО2 в крови и тканях (эффект Бора).
Во-вторых, СО взаимодействует не только с гемоглобином, но также с целым рядом различных цитохромов (цитохромом “а”, цитохромом “С”, цитохромом Р-450 и т.д.), угнетая тем самым биоэнергетические процессы в тканях (развивается гистотоксический тип гипоксии - см. ниже). Поскольку валентность железа тканевых цитохромов переменна, они становятся уязвимыми для действия токсиканта при переходе в состояние Fe+2. Это состояние наиболее вероятно в условиях снижения парциального давления кислорода в тканях (при гипоксии). Так, установлено, что экспериментальные животные, находящиеся под воздействием газовой смеси 3 атм. кислорода и 1 атм. оксида углерода, не погибают, хотя при этих условиях практически весь Hb превращается в HbCO. Тем не менее, тканевые цитохромы резистентны к действию СО (железо находится преимущественно в трехвалентной форме), а растворенного в плазме крови кислорода оказывается достаточно, чтобы удовлетворить потребность в нем тканей. При изменении соотношения газовой смеси 3 атм. кислорода и 2 атм. оксида углерода животные погибают, несмотря на то, что количество растворенного в плазме крови кислорода остается таким же, как в первом опыте. Развитие интоксикации в этом случае можно объяснить угнетением системы цитохромов – нарушением тканевого дыхания.
Наконец, СО активно взаимодействует с миоглобином (сродство в 14 - 50 раз выше, чем к кислороду), пероксидазой, медь-содержащими ферментами (тирозиназа) тканей. Миоглобин (мышечный пигмент - аналог гемоглобина, состоящий из одной молекулы глобина, связанной с гемом) в организме выполняет функцию депо кислорода, а также значительно ускоряет диффузию кислорода в мышечной ткани. Взаимодействие оксида углерода с миоглобином приводит к образованию карбоксимиоглобина. Нарушается обеспечение работающих мышц кислородом. Этим отчасти объясняют развитие у отравленных выраженной мышечной слабости.
Определение карбоксигемоглобина в крови
Для уточнения диагноза отравления оксидом углерода – производится определение HbCO в крови различными физико-химическими и химическими методами.
Существуют довольно простые экспресс-методы определения содержания HbCO в крови: проба с разведением, проба с кипячением, проба со щелочью, проба с медным купоросом, проба с формалином. Принцип методов основан на большей устойчивости HbCO (сохраняет розовую окраску в растворе), в сравнении с HbO к денатурирующим воздействиям. Их чувствительность находится в пределах 25-40% HbCO.
Количественное определение содержания HbCO в крови производят спектрометрическими, фотометрическими, колориметрическими и газоаналитическими методами. Наиболее чувствительны фотометрический и спектрофотометрический методы, позволяющие определять HbCO в крови, начиная с 0,5-1%.
При необходимости направления проб в лабораторию для определения наличия HbCO необходимо исключить контакт содержимого пробирок с воздухом, например, путем наслаивания вазелинового масла.
Мероприятия медицинской защиты
Специальные санитарно-гигиенические мероприятия:
- использование индивидуальных технических средств защиты (средства защиты органов дыхания; при применении карбонилов металлов - средства защиты органов дыхания и кожи) в зоне химического заражения;
Специальные профилактические медицинские мероприятия:
- применение антидота перед входом в зону пожара;
- проведение санитарной обработки пораженных карбонилами металлов на передовых этапах медицинской эвакуации.
Специальные лечебные мероприятия:
- своевременное выявление пораженных;
- применение антидотов и средств патогенетической и симптоматической терапии состояний, угрожающих жизни, здоровью, дееспособности, в ходе оказания первой (само-взаимопомощь), доврачебной и первой врачебной (элементы) помощи пострадавшим.
- подготовка и проведение эвакуации
Медицинские средства защиты
Срезу после удаления пораженного из зараженной атмосферы начинается процесс спонтанного выведения СО из организма, постепенно восстанавливаются свойства гемоглобина и тканевых ферментов. Специфическими противоядиями при отравлении СО являются вещества, ускоряющие этот процесс: кислород (Н.Н. Савицкий и др.) и ацизол (Л.А. Тиунов и соавт.).
Кислород. В связи с тем, что СО обратимо связывается с гемоглобином, и при этом конкурирует за участок связывания (двухвалентное железо гема) с кислородом, увеличение парциального давления последнего во вдыхаемой смеси (вдыхание чистого кислорода), способствует ускорению диссоциации образовавшегося карбоксигемоглобина и усиленному выведению яда из организма отравленного (скорость элиминации возрастает в 3 - 4 раза). При ингаляции О2 под повышенным давлением (0,5 - 2 атмосферы избыточной), кроме того, увеличивается количество кислорода, транспортируемого плазмой крови в форме раствора, снижается чувствительность тканевых цитохромов к ингибиторному действию СО, что также способствует устранению явлений кислородного голодания, нормализации энергетического обмена.
Ингаляцию кислорода (или кислородо-воздушных смесей) с помощью имеющихся на снабжении технических средств (кислородные ингаляторы) следует начинать как можно раньше. В первые минуты рекомендуют вдыхать 100% кислород, затем, в течение 1 - 3 часов - 80 - 90% кислородо-воздушную смесь, затем 40 - 50% смесь кислорода с воздухом. Продолжительность мероприятия определяется степенью тяжести пострадавшего.
Бессознательное состояние, признаки ишемии миокарда, уровень карбоксигемоглобина в крови выше 60%, дыхательная недостаточность - показания к проведению гипербарической оксигенации (при наличии технических средств).
Ацизол - бис-(1-виниламидазол)-цинкдиацетат - комплексное соединение цинка, которое при действии на гемоглобин уменьшает его сродство к оксиду углерода (константа Хила процесса взаимодействия уменьшается с 2,3 до 1,8). Препарат рекомендуют применять внутримышечно в форме 6% раствора на 0,5% растворе новокаина в объеме 1,0 мл на человека в возможно более ранние сроки после воздействия СО. В случае тяжелого отравления допускается повторное введение ацизола в той же дозе не ранее, чем через 1 час после первой инъекции.
Симптоматические средства. При легких и средней степени тяжести поражениях позитивный эффект на состояние пострадавших оказывает назначение, наряду с ингаляцией кислорода, средств, возбуждающих дыхание и сердечную деятельность: кордиамин - 1 мл (п/к), кофеин - 10% 1 - 2 мл (п/к), вдыхание паров нашатырного спирта. Применение таких средств у тяжело пораженных без одновременно проводимой кислородотерапии - противопоказано.
При поражении карбонилами металлов, кроме указанного выше, при угрозе развития токсического отека легких, необходимо использование средств и методов, применяемых при отравлениях ОВТВ удушающего действия (см. раздел “ОВТВ пульмонотоксического действия”).
10.1.1.2. ОВТВ, образующие метгемоглобин
Как уже указывалось, железо, входящее в структуру гемоглобина – двухвалентно, не зависимо от того, связан пигмент крови с кислородом (HbO) или нет (Hb). Более того, только находясь в двухвалентном состоянии Fe+2 обладает необходимым для осуществления транспортных функций сродством к кислороду.
В нормальных условиях спонтанно и под влиянием различных патогенных факторов, в том числе химической природы, двухвалентное железо гемоглобина окисляется, переходя в трёхвалентную форму. Образуется так называемый метгемоглобин (MetHb). Метгемоглобин не участвует в переносе кислорода от легких к тканям, поэтому значительное повышение его содержания в крови представляет опасность. Эволюционно сформировались механизмы обратного превращения метгемоглобина в гемоглобин. Благодаря этим механизмам у здорового человека уровень метгемоглобина в крови не превышает 0,5 - 2%. Существуют два основных пути, защиты железа гемоглобина от окисления.
Первый связан с “обезвреживанием” проникающих в эритроциты ксенобиотиков-окислителей до момента их действия на гемоглобин. Так, в присутствии энзима глутатионпероксидазы (ГПО) восстановленный глутатион взаимодействует с молекулами-окислителями, попавшими в клетки крови, предотвращая их метгемоглобинобразующее действие. Несостоятельность этого механизма (снижение активности глутатионпероксидазы, содержания восстановленного глутатиона в эритроцитах), может привести к умеренной метгемоглобинемии и появлению в крови телец Гейнца (продукты денатурации гемоглобина).
Второй механизм обеспечивает восстановление уже образовавшегося в крови метгемоглобина при участии двух ферментативных систем: НАДН-зависимой и НАДФН-зависимой метгемоглобинредуктаз. В одной из них донорами электронов (восстанавливающие агенты) являются продукты анаэробного этапа метаболизма глюкозы (НАДН), в другой - гексозомонофосфатного превращения (НАДФН) (рис. 27):
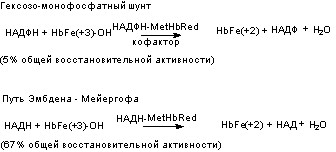
Рисунок 27. Механизмы восстановления метгемоглобина
В количественном отношении более значимым является механизм, связанный с гликолизом. Однако в процессе гексозомонофосфатного превращения под влиянием гексозо-6-фосфатдегидрогеназы (Г-6ф-ДГ) образуется восстановленный никатинамидадениндинуклеотд фосфат (НАДФН), который не только участвует в превращении метгемоглобина в гемоглобин в присутствии НАДФН-метгемоглобинредуктазы, но и в восстановлении окисленного глутатиона при участии НАДФН-зависимой глутатионредуктазы. Поэтому значение этого пути “защиты” гемоглобина также велико. По этой причине лица с врожденной недостаточностью Г-6Ф-ДГ весьма чувствительны даже к относительно невысоким дозам целого ряда токсикантов.
Основной причиной массивного образования метгемоглобина в крови до уровня, порой угрожающего жизни человека, является действие на организм химических веществ, так называемых метгемоглобинообразователей (оксидов азота, органических и неорганических нитро- и аминосоединений, фенолов, хлоратов, сульфонов и т.д.). Наряду с MetHb при интоксикациях подобными веществами в крови нередко появляется и другой продукт повреждения гемоглобина - сульфгемоглобин. В отличие от MetHb, который легко восстанавливается в организме за счет редуктазных ферментных систем обратно до гемоглобина, сульфгемоглобин представляет собой необратимый дериват Hb. Он никогда не встречается в нормальной крови и также не способен обратимо присоединять кислород, хотя и содержит двухвалентное железо.
Наиболее токсичные метгемоглобинообразователи относятся к одной из следующих групп:
1. Соли азотистой кислоты (нитрит натрия)
2. Алифатические нитриты (амилнитрит, изопропилнитрит, бутилнитрит)
3. Ароматические амины (анилин, аминофенол)
4. Ароматические нитраты (динитробензол, хлорнитробензол)
5. Производные гидроксиламина (фенилгидроксиламин)
6. Производные гидразина (фенилгидразин).
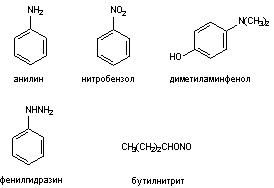
Некоторые из указанных веществ могут представлять интерес для военной медицины либо как возможные диверсионные агенты (нитрит натрия), либо как промышленные агенты весьма опасные в плане образования зон химического заражения при авариях и катастрофах (анилин, динитробензол).
Попав в организм, мегемоглобинообразователи либо непосредственно активируют процессы, приводящие к окислению железа гемоглобина, либо первоначально метаболизируют с образованием реактивных продуктов, которые обладают этим свойством. Тяжесть развивающейся при этом патологии определяется дозой и скоростью поступления токсиканта в организм, а затем в эритроциты, их окислительно-восстановительным потенциалом, скоростью элиминации. Если действующим агентом является не исходное вещество, а продукт его метаболизма, то глубина патологического процесса зависти также от интенсивности процесса биоактивации ксенобиотика в организме. Поэтому у различных экспериментальных животных при введении им веществ, подвергающихся биоактивации, скорость образования метгемоглобина, как правило, существенно различается (табл. 28).
Таблица 28.
Способность некоторых ароматических аминов вызывать образование метгемоглобина у разных экспериментальных животных
Вещества |
Максимальный уровень МеtHb в крови, % |
|
Кролик |
Собака |
|
Анилин |
5 |
63 |
4-аминобифенил |
40 |
85 |
п-аминофенол |
1 |
60 |
Фенилгидроксиламин |
47 |
40 |
В организме человека с большой скоростью вызывают метгемоглобинообразование соли азотистой кислоты (нитриты), алкиламинофенолы (диэтил-, диметиламинофенол). Медленно нарастает содержание MetHb при отравлении анилином, нитробензолом.
Проявления метгемоглобинемии
Выраженность симптомов отравления метгемоглобинообразователями определяется глубиной формирующейся гипоксии (гемический тип), которая, в свою очередь зависит от содержания метгемоглобина в крови. Симптомы, развивающиеся на фоне метгемоглобинообразования, представлены на таблице 29.
Таблица 29.
Проявления метгемоглобинемии различной степени выраженности
Содержание метгемоглобина, % |
Проявления |
0 - 15 |
Отсутствуют |
15 - 20 |
Цианоз, возбуждение, состояние, напоминающее опьянение, головная боль |
20 - 45 |
Беспокойство, тахикардия, одышка при физической нагрузке, слабость, утомляемость, состояние оглушенности |
45 - 55 |
Угнетение сознания, ступор |
55 - 70 |
Судороги, кома, брадикардия, аритмии |
> 70 |
Сердечная недостаточность, смерть |
Ранним проявлением интоксикации является цианоз кожных покровов и видимых слизистых. Цвет кожи - от синеватого до шоколадного; слизистые более коричневого, чем синего цвета. Цианоз развивается при содержании в крови метгемоглобина в количестве более 1,5 г на децилитр (около 10% Hb). Наличие сульфгемоглобина резко усиливает цианоз, поскольку он в 3 раза темнее MetHb (артериальная кровь приобретает коричневатый оттенок). Поэтому изменение цвета кожных покровов и слизистых отмечается уже при содержании сульфгемоглобина в крови около 0,5 г на децилитр (около 3% Hb). На фоне даже выраженного цианоза, вызванного сульфгемоглобинемией, отмечается лишь незначительные признаки гипоксии. Как правило, сульфгемоглобинемия не достигает уровня опасного для жизни. Дифференцировать сульфгемоглобинемию от метгемоглобинемии можно с помощью спектрофотометрических методов исследования крови.
Цианоз при отравлении метгемоглобинообразователями, иногда называют “центральным”, поскольку, развиваясь, он сразу и относительно равномерно охватывает все участки кожных покровов, т.к. вся циркулирующая в организме отравленного кровь изменяет цвет. Необходимо отличать “центральный” цианоз от “периферического”. Последний является признаком сердечной недостаточности и формируется вследствие нарушения гемодинамики и неадекватной гемоперфузии периферических органов. Наиболее ранние проявления такого цианоза - синюшная окраска носа и ногтевых лож. Причина “периферического” цианоза - избыточное содержание восстановленного гемоглобина вследствие усиленной экстракции кислорода тканями, плохо снабжаемыми кровью. Разлитой цианоз в таком случае развивается при содержании восстановленного гемоглобина в крови более 5 г на децилитр (около 30% Hb).
При периферическом цианозе и повышенном содержании восстановленного гемоглобина в крови показана ингаляция кислорода. При наличии метгемоглобина или сульфогемоглобина в крови оксигенотерапия не приводит к устранению цианоза. Более того, назначение кислорода отравленным метгемоглобинообразователями может сопровождаться повышением уровня метгемоглобина в крови.
Определение метгемоглобина
Ряд простейших методических приёмов позволяет иногда выявить наличие метгемоглобина в крови.
Если пигмента в крови более 15%, капля крови окрашивает фильтровальную бумажку в “шоколадный” цвет, хорошо выявляемый при сравнении с цветом нормальной крови.
Пропускание кислорода через венозную кровь изменяет её вишневый цвет на алый. Кровь, содержащая метгемоглобин, не меняет при этом окраску. Наконец, добавление к разведённой в 100 раз крови, содержащей метгемоглобин, кристаллика цианистого калия приводит к её окрашиванию в розовый цвет вследствие образования цианметгемоглобина.
Диагностическими признаками массивного метгемоглобинообразования является коричнево-черное окрашивание мочи, а также появления в ней белка.
С помощью спектрофотометрических исследований можно отличить метгемоглобин от сульфгемоглобина, а также определить процентное содержание метгемоглобина в крови. Если время, прошедшее от момента забора крови до исследования, продолжительное, результат может оказаться ложным, так как процессы окисления и восстановления гемоглобина проходят и in vitro. Необходимо помнить, что у больных с выраженной анемией даже незначительное содержание метгемоглобина в крови может вызвать глубокую гипоксию. Поэтому обследование крови отравленного должно обязательно сопровождаться подсчетом эритроцитов и определением общего количества гемоглобина.
10.1.1.2.1. Нитро- и аминосоединения ароматического ряда
Нитро- и аминосоединения ароматического ряда, характерными представителями которых являются соответственно нитробензол и анилин, по механизму действия и картине острого отравления весьма сходны. Действие на кровь сопровождается появлением в эритроцитах метгемоглобина, сульфгемоглобина, телец Гейнца. Спустя несколько суток после воздействия развивается гемолиз. Кроме того, для веществ характерно действие на центральную нервную систему (наркотический эффект), поражение печени и почек.
Включение хлора в бензольное кольцо анилина или нитробензола приводит к усилению действия веществ на кровь. Введение алкильной группы - уменьшает острую токсичность. Присутствие карбоксильной группы, сульфогруппы резко уменьшает токсичность аналогов анилина и нитробензола.
Анилин
Физико-химические свойства
Анилин представляет собой вязкую бесцветную, маслянистую жидкость, темнеющую на воздухе и на свету. Плохо растворяется в воде (до 4% при 200С), хорошо - в органических растворителях, спирте, жирах. Летуч: насыщающая концентрация паров в воздухе при 250С - 1,8 г/м3. Имеет характерный запах. Горюч. Взрывоопасен при температуре выше 400С.
Анилин - один их наиболее крупнотоннажных продуктов органического синтеза. Мировое производство - более 1 млн. тонн в год. Применяется в производстве лекарственных веществ, антиоксидантов, фотоматериалов, красителей и др. Ряд продуктов на основе анилина используются в качестве ракетных топлив.
При авариях анилин будет образовывать зоны стойкого химического заражения территории.
Токсичность
Чувствительность людей к анилину варьирует в широких пределах. Концентрация паров в воздухе 0,3 - 0,6 г/м3, как правило, переносится в течение часа без последствий. Действие вещества в более высоких концентрациях приводит к отравлению. При приеме через рот анилина в количестве 1 грамма может развиться смертельное отравление. При поступление через кожу, вещество еще более опасно.
Токсикокинетика
В виде паров действует через кожу с такой же скоростью, как и через дыхательные пути. В жидком виде всасывается через кожу в 1000 раз быстрее, чем в парообразном состоянии, при этом в организм проникает более 90% апплицированного вещества (высокая опасность кожной резорбции). Хорошо всасывается слизистой желудочно-кишечного тракта. Попав в кровь, достаточно равномерно распределяется в органах и тканях.
Анилин, как и другие ароматические амины, подвергается биотрансформации. Процесс, проходит в два этапа, главным образом, в печени. На первом - происходит окислительное гидроксилирование бензольного кольца или N-гидроксилирование аминогруппы при участии монооксигеназной системы эндоплазматического ретикулума гепатоцитов. В результате гидрокислирования ароматического кольца в орто- или пара-положении по отношению к аминогруппе образуются о- и п-аминофенолы. Образующиеся аминофенолы по-видимому способны превращаются в хинонимины. В результате N-гидроксилирования образуются промежуточные продукты - фенилгидроксиламин и нитрозобензол, способные к взаимному превращению по типу обратимой реакции.
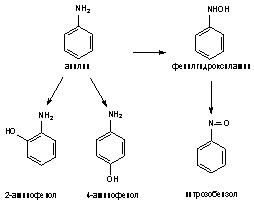
Рисунок 28. Схема метаболизма анилина
Образовавшиеся в печени промежуточные продукты могут поступать в кровь и оказывать токсическое действие на эритроциты.
На втором этапе, промежуточне продукты биопревращения, за счет главным образом фенольных групп, вступают в реакции конъюгации с глюкуроновой, серной кислотами и глутатионом, а также в реакцию N-ацетилирования. Конъюгаты - высоко полярные, нетоксичные соединения выводятся из организма с мочой. За сутки из организма в форме метаболитов выводится около 98% от введенного количества анилина (период полуэлиминации - 3,5 часа).
Нитробензол
Физико-химические свойства
Бесцветная или слегка желтоватая жидкость с характерным запахом горького миндаля (порог восприятия - 0,01 г/м3), плохо растворимая в воде (до 0,2% при 200С), хорошо - в органических растворителях, спирте, жирах. Нитробензол медленно испаряется при температуре окружающего воздуха более 200С. Смесь паров с воздухом взрывоопасна (нижний предел взрывоопасности смеси 1,8%).
При авариях нитробензол будет образовывать зоны стойкого химического заражения территории.
Токсичность
Ингаляция паров в концентрации 0,5 г/м3 и выше в течение часа может привести к развитию острой интоксикации. При нанесении на кожу смертельная доза вещества для кошек составляет 0,5 г/кг. Человек более чувствителен к нитробензолу, чем лабораторные животные. Токсические дозы вещества для человека при приеме через рот неизвестны. Имеются данные, согласно которым несколько капель нитробензола, принятого внутрь, могут оказать смертельное действие.
Токсикокинетика
Нитробензол в виде пара и аэрозоля способен проникать в организм через органы дыхания и неповрежденную кожу. Высокая температура окружающего воздуха повышает вероятность ингаляционного отравления. Вещество хорошо всасывается в желудочно-кишечном тракте. После поступления в кровь относительно равномерно распределяется между тканями.
Нитросоединения, и в их числе нитрбензол, восстанавливаются в организме до аминосоединений при участии ферментов растворимой фракции митохондрий и гладкого эндоплазматического ретикулума печени. Восстановление нитрогруппы протекает через ряд стадий с промежуточным образованием нитрозо- и гидрокисламинпроизводных: ArNO2 - ArNO - ArNHOH - ArNH3. В результате одновременно протекающего гидрокислирования ароматического кольца в орто- или пара-положении по отношению к нитрогруппе образуются о- и п-аминофенолы. Последние вступают в реакцию конъюгации с глюкуроновой и серной кислотой и в форме конъюгатов выводятся с мочой из организма.
Механизм токсического действия
Механизм действия нитро- и аминосоединений неразрывно связан с их метаболизмом. По-видимому, образование метгемоглобина является следствием активации свободнорадикальных процессов в эритроцитах, “запускаемых” метаболитами нитро- и аминосоединений, включающимися в клетках-мишенях в окислительно-восстановительный цикл.
Свободные радикалы, такие как ArNO*, ArNHOH*, образующийся в процессе восстановления нитрозогруппы в гидроксиламиногруппу, хинонимины, возникающие при окислении аминофенолов и др., могут активировать молекулярный кислород путем одновалентного восстановления последнего до супероксид-аниона (О2-*). Супероксид при взаимодействии с водой с большой скоростью дисмутирует с образованием перекиси водорода (Н2О2). Действие супероксидного радикала и перекиси водорода на железо гемоглобина приводит к его окислению (метгемоглобинообразование):
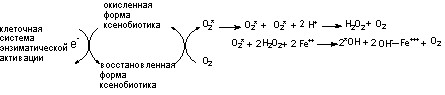
Очевидно, что если действие ксенобиотика продолжается в течение достаточно длительного времени, механизмы антирадикальной защиты истощаются, и происходит значительное повреждение гемоглобина. Наряду с другими компонентами противорадикальной защиты в эритроцитах отравленных снижается уровень восстановленного глутатиона. Поскольку этот трипептид выполняет функцию стабилизатора эритроцитарных мембран, истощение его пула сопровождается развитием гемолиза.
Полагают, что с учетом скорости накопления каждого из упомянутых выше активных метаболитов в организме и их активности, относительное значение фенилгидроксиламина, о-аминофенола и п-аминофенола в образовании метгемоглобина, при отравлении в частности анилином, может быть оценено, соответственно, как 100:4:1.
Кроме метгемоглобинобразующих свойств метаболиты анилина и нитробензола рассматриваются и как мутагены, тератогены и канцерогены, вызывающие рак мочевого пузыря.
Считается, что бластомогенный и мутагенный эффекты, а также специфические очаговые некрозы печени, развивающиеся под влиянием веществ, обусловлены ковалентным связыванием активных радикалов веществ с молекулами ДНК, белками гепатоцитов, а также элементами микросомальной системы клеток.
Алкоголь значительно усиливает острую токсичность анилина и его производных. Это связывают со способностью этилового спирта индуцировать образование активных метаболитов (преимущественно N-гидроксилирование) в первой фазе биопревращения анилина и угнетать вторую фазу его метаболизма.
10.1.1.2.2. Нитриты
Нитриты - это производные азотистой кислоты: либо ее соли (неорганические производные: азотистокислый натрий), либо простые эфиры спиртов, содержащие в молекуле одну или несколько нитритных групп (R-О-N=О) (органические производные: изопропилнитрит, бутилнитрит). По механизму действия и картине острого отравления различные представители группы во многом сходны. Однако неорганические производные азотистой кислоты обладают более выраженной метгемоглобинобразующей активностью. Органические производные обладают более сильным расслабляющим действием на стенки кровеносных сосудов.
Азотистокислый натрий
Физико-химические свойства
Бесцветные или желтоватые кристаллы, хорошо растворимы в воде (при 200С в 100 г воды растворяется 82 г вещества), солоноватые на вкус.
Применяется в производстве органических красителей, в пищевой, текстильной промышленности, производстве резины, гальванотехнике.
Поскольку по органолептическим свойствам вещество чрезвычайно похоже на поваренную соль не исключено его использование в качестве диверсионного агента.
Токсичность
Ингаляция экспериментальными животными аэрозоля азотистокислого натрия в концентрации 0,008 г/м3 в течение 4 часов сопровождается гибелью. Прием человеком менее 3 г вещества с зараженной пищей вызывает головокружение, рвоту, бессознательное состояние.
Токсикокинетика
Основной путь поступления токсиканта в организм - через рот с зараженной водой и пищей. Вещество быстро всасывается в кровь слизистой желудочно-кишечного тракта и равномерно распределяется в организме. Некоторое количество вещества окисляется до нитратов (затем вновь восстанавливается до NO2- при участии редуктаз - вступает в окислительно-восстановительный цикл), часть восстанавливается до оксида азота, часть - превращается в нитрозамины. Значительная часть токсиканта выводится с мочой в неизмененном виде.
Определённую опасность (хотя и меньшую, чем NaNO2) представляют также нитраты - производные азотной кислоты, и в частности, азотнокислый натрий (NaNO3). Попав в организм, нитраты могут превращаться в нитриты. В печени это превращение активирует глутатион-зависимая нитратредуктаза. Обитающие в желудочно-кишечном тракте микроорганизмы (Escherichia coli, Pseudomonas aurogenosa и др.) также обладают способностью восстанавливать нитраты до нитритов.
Особенно чувствительны к нитратам дети. Причины высокой чувствительности обусловлены низкой кислотностью желудка детей (вплоть до 4 месячного возраста), высокой активностью нитрат-редуцирующей флоры кишечника, пониженной активностью НАДН-метгемоглобинредуктазы.
Изопропилнитрит
Физико-химические свойства
Желтоватая жидкость с резким запахом, летуча - температура кипения около 400С. Плохо растворяется в воде, хорошо - в спирте. Водный раствор быстро гидролизуется с выделением оксидов азота.
Применяется в органическом синтезе, а также как компонент топлива для реактивных двигателей и как добавка к горючему.
Токсичность
Максимально переносимая концентрация лабораторными животным - около 1 г/м3. При 20 - 25 г/м3 смерть развивается практически мгновенно. Как и другие алкилнитриты обладает умеренной способностью образовывать МеtHb. Так, ингаляция вещества в течение 1 минуты вызывает у людей образование в крови лишь около 5 % МеtHb. Периодическое вдыхание паров (из флакона) добровольцами в течение 12 минут приводило к появлению в крови 18% МеtHb. Действие вещества в более высоких концентрациях сопровождается тяжелыми сердечно-сосудистым расстройствам.
Расчетная смертельная доза для человека при приеме через рот - около 9 мг/кг.
Токсикокинетика
Действует в виде пара через легкие. Возможно поступление через рот (с зараженными спиртными напитками). Быстро всасывается в кровь. Спонтанно и при участии ферментных систем может разрушаться с отщеплением оксида азота или нитритной группы. Нитритная группа подвергается как окислительным (с образованием нитрат-иона), так и восстановительным (с образованием NO) превращениям. В опытах на животных установлено, что уже через 30 - 150 минут после воздействия в плазме крови свободные нитриты практически не определяются, но увеличивается содержание нитратов, а также изопропилового спирта.
Основные проявления интоксикации
Помимо способности вызывать быстрое (но умеренное) образование в крови метгемоглобина, и обусловленные этим действием проявления интоксикации (см. выше), для веществ характерно возбуждающее действие на ЦНС и специфическое расслабляющее действие на гладкую мускулатуру кровеносных сосудов. При действии на сосуды снижается тонус как артериального, так и венозного отделов сосудистой системы, однако вены - более чувствительны к веществам, чем артерии. При интоксикациях, в результате выраженного расслабления больших вен со значительным увеличением емкости сосудистого русла, снижается системное артериальное давление. На этом фоне кровоток в сердечной мышце, центральной нервной системе первоначально усиливается. Развивается головная боль, появляется чувство пульсации в висках, головокружение, тошнота, двигательные расстройства. Кожа лица краснеет. Нарушается зрение, слух. Острая реакция на умеренные дозы веществ быстро проходит. При более высоких дозах и продолжительном воздействии давление резко падает, сознание утрачивается, постепенно появляется цианоз, как следствие метгемоглобинообразования. Таким образом, для отравления нитритами характерен смешанный тип развивающейся гипоксии: гемический (за счет метгемоглобинообразования) и циркуляторный (за счет расслабления сосудов).
Встречаются токсикомании, обусловленные пристрастием к ингаляции амилнитрита, бутилнитрита и других летучих нитросоединений. По свидетельству токсикоманов эти вещества вызывают длительно продолжающееся ощущение оргазма. У таких лиц имеется реальная угроза смертельной интоксикации нитритами.
Механизм токсического действия
Механизм токсического действия нитритов связан со способностью быстро выделять в организме оксид азота и нитритную группу. NO, который и в норме постоянно образуется в организме и выполняет функцию регулятора сосудистого тонуса, действует на соответствующие рецепторы. Возбуждение NO-рецепторов вызывает расслабление сосудистой стенки и в тяжелых случаях приводит к коллапсу.
Нитрит-ион вызывает метгемоглобинообразование. Механизм действия сложен и вероятно связан с формированием окислительно-восстановительной пары “нитрит-нитрат”, активирующей свободно-радикальный процесс в эритроцитах, а также с угнетением активности метгемоглобинредуктаз, супероксиддисмутазы и каталазы.
Мероприятия медицинской защиты
от поражающего действия метгемоглобинообразователей
Специальные санитарно-гигиенические мероприятия:
- использование индивидуальных технических средств защиты (средства защиты кожи; средства защиты органов дыхания) в зоне химического заражения;
- участие медицинской службы в проведении химической разведки в районе расположения войск; проведение экспертизы воды и продовольствия на зараженность ОВТВ;
- запрет на использование воды и продовольствия из непроверенных источников;
- обучение личного состава правилам поведения на зараженной местности.
Специальные профилактические медицинские мероприятия:
- проведение санитарной обработки пораженных на передовых этапах медицинской эвакуации.
Специальные лечебные мероприятия:
- своевременное выявление пораженных;
- применение антидотов и средств патогенетической и симптоматической терапии состояний, угрожающих жизни, здоровью, дееспособности, в ходе оказания первой (само-взаимопомощь), доврачебной и первой врачебной (элементы) помощи пострадавшим.
- подготовка и проведение эвакуации
Медицинские средства защиты
Оказания неотложной помощи пострадавшим осуществляется в соответствии с общими принципами (см. раздел “Общие принципы оказание первой, доврачебной и первой врачебной помощи при острых интоксикациях ”)
Антидотом метгемоглобинообразователей является метиленовый синий (рис. 29).
Рисунок 29. Структура метиленового синего
Препарат назначают лицам с уровнем метгемоглобинемии более 30%. В случае сопутствующей анемии, показатель может быть значительно ниже. Метиленовый синий играет роль дополнительного кофактора, передающего электрон от НАДФН на метгемоглобин, восстанавливая последний, в течение 1 - 2 часов, до гемоглобина (рис. 30). В процессе реакции образуется лейкоформа (бесцветная) препарата.

Рисунок 30. Восстановление метгемоглобина при участии метиленового синего и метгемоглобинредуктазы
Окислительно-восстановительная система, формируемая метиленовым синим и его лейкоформой действует обратимо и при избытке окисленной формы (введение необоснованно высокой дозы препарата) может произойти дополнительное метгемоглобинообразование.
Для того, чтобы вещество выполняло функции антидота, необходимо нормальное содержание НАДФН в эритроцитах, оптимальная активность НАДФН-метгемоглобинредуктазы. При назначении препарата лицам с дефицитом Г-6Ф-ДГ и низким содержанием НАДФН в эритроцитах, также возможно усиление метгемоглобинообразования и гемолиз.
Метиленовый синий вводят внутривенно в количестве 0.1 - 0.2 мл/кг 1% раствора (1 - 2 мг/кг). Если симптомы интоксикации не устраняются, через час следует повторить введение. Рекомендуется перед повторным введением определить уровень метгемоглобина в крови. Наиболее частой причиной резистентности патологии к препарату является дефицит Г-6Ф-ДГ, НАДФН-метгемоглобинредуктазы, а также сулфметгемоглобинемия. У леченых больных в течение некоторого времени после исчезновения симптоматики может сохраняться цианоз, что обусловлено способностью препарата окрашивать кожу. Токсичными дозами метиленовой сини являются 7 - 15 мг/кг. Как уже указывалось, причина токсического действия состоит в способности окисленной формы вещества окислять гемоглобин (выступать в качестве метгемоглобинообразователя). Побочные эффекты, иногда развивающиеся при использовании метиленового синего, включают беспокойство, головную боль, спутанность сознания, тошноту, рвоту, абдоминальные боли, тремор, учащение сердцебиений.
Непосредственно взаимодействовать с токсикантами-окислителями в эритроцитах способна аскорбиновая кислота. Пострадавшим ее вводят внутрь в количестве 1 – 2 г или внутривенно – 50 мл 5% раствора. Однако скорость процесса “нейтрализации” ксенобиотиков низка, и в этой связи эффективность препарата невелика.
10.1.1.2.3. Взрывные (пороховые) газы
При стрельбе, взрывах, запуске ракет, оснащенных двигателями, работающими на твердом ракетном топливе, образуются токсические вещества, получившие название взрывных, или пороховых, газов. Содержание отдельных компонентов, входящих в состав взрывных газов, зависит от условий, в которых протекает реакция горения или детонация порохов.
Если количества кислорода недостаточно для окисления всех способных к сгоранию элементов, входящих в состав рецептуры порохов, то в ходе реакции наряду с диоксидом углерода, водой, азотом и метаном образуются такие продукты, как оксид углерода и оксиды азота. Количество образующихся ядовитых газов меняется в зависимости от степени разложения взрывчатых материалов. При детонации количество оксида углерода в газовой смеси может достигнуть 30-60%. При сгорании или воспламенении возрастает содержание оксидов азота до 20-40%. Во всех случаях количество образовавшегося диоксида углерода будет тем больше, чем интенсивнее идет окисление. Наибольшее токсикологическое значение в составе взрывных газов имеют оксид углерода, оксиды азота и диоксид углерода. Отравление взрывными газами можно рассматривать как комбинированное отравление этими тремя газами. Особенности течения интоксикации в каждом отдельном случае будут зависеть от доли участия каждого из компонентов смеси газов. Все эти вещества могут действовать одновременно и в различных соотношениях в зависимости от создавшихся условий.
Течение отравлений
Известны следующие формы течения отравлений взрывными газами:
а) по типу интоксикации оксидом углерода;
б) по типу интоксикации оксидами азота;
в) “опьянение от пороха”;
г) атипические, или смешанные, формы, не имеющие определенной дифференцированной картины отравления.
Симптомокомплекс поражения может меняться в зависимости от вида и свойств вдыхаемых веществ, содержания кислорода в воздухе, а также таких малоактивных газов, как азот, водород, метан.
Если отравление взрывными газами протекает по типу интоксикации оксидом углерода, наблюдается симптомокомплекс, обусловленный кислородным голоданием (см. “Оксид углерода”). В крови обнаруживается карбоксигемоглобин.
Оксиды азота вызывают раздражение глаз и дыхательных путей, обладают удушающим действием, могут вызвать развитие токсического отека легких (см. “ОВТВ пульмонотоксического действия”). В некоторых случаях оксиды азота приводят к развитию кислородного голодания гемического типа вследствие образования метгемоглобина (см. “Метгемоглобинообразователи”).
Комбинированное действие оксида углерода и нитрогазов характеризуется потенцированием токсического эффекта этих ядов. Диоксид углерода в составе взрывных газов может также оказывать влияние на течение интоксикации. СО2 обладает большей плотностью (1,52), чем СО (0,97), и скапливается в глубине и на дне плохо вентилируемых пространств и помещений. При отравлении в таких условиях, наряду с токсическим действием оксида углерода, оксидов азота и других газов, может наблюдаться “пороховое опьянение”. Диоксид углерода обладает наркотическим действием. В относительно малых концентрациях (3-6%) он возбуждает дыхательный центр, приводя к углублению и учащению дыхания, что способствует увеличению абсорбции и других токсических веществ, входящих в состав взрывных газов. При более высоких концентрациях (8% и выше) диоксид углерода раздражает слизистые оболочки глаз и дыхательных путей, вызывая слезотечение и кашель. По мере нарастания концентрации диоксид углерода вызывает психическое возбуждение, шум в ушах, головокружение, ощущение тепла в груди, сердцебиение, тошноту и другие симптомы, дающие повод заподозрить алкогольное опьянение. Развитие такого состояния было экспериментально показано на добровольцах, вдыхающих воздух, содержащий диоксид углерода в концентрациях от 12 до 25%. Во время боевых действий такое ложное опьянение, получившее название “опьянение от пороха”, может наблюдаться у людей, укрывающихся в задымленных укрытиях, воронках, образовавшихся при взрывах снарядов, и у артиллеристов, обслуживающих орудия.
Эдере и Истен (1935) весьма образно характеризуют симптоматологию “порохового опьянения”: “У отравленных красное, опухшее лицо. Они находятся в подавленном или возбужденном состоянии, жестикулируют, много говорят, жалуются на головокружение, шум в ушах, головную боль, тошноту. Подкошенные усталостью, они погружаются, подобно пьяным, в тяжелый сон, полный кошмаров. При пробуждении у них наблюдается замедленное мышление, ослабление памяти; иногда все эти симптомы выражены так резко, что вызывают сомнение в трезвости субъекта и могут привести к неправильным заключениям”.
Методы профилактики и оказания помощи
Изолирующие противогазы надежно защищают от поражений взрывными (пороховыми) газами. Фильтрующий противогаз хорошо задерживает только оксиды азота. Для защиты от оксида углерода к фильтрующему противогазу необходимо присоединить гопкалитовый патрон. При этом нужно учитывать, что фильтрующий противогаз может быть использован только в том случае, если парциальное давление кислорода в отравленной атмосфере достаточно для сохранения нормального газообмена.
Во всех случаях отравлений с остановкой дыхания для спасения жизни пораженных необходимы искусственная вентиляция легких и ингаляция кислорода. Последующее оказание медицинской помощи должно проводиться с учетом особенностей развившейся (развивающейся) формы поражения взрывными газами: явления раздражения, гемическая гипоксия в результате образования в крови карбокси- или метгемоглобина, нарушение гемодинамики, надвигающийся токсический отек легких.
10.1.2. ОВТВ, разрушающие эритроциты (гемолитики)
Вещества, вызывающие внутрисосудистый гемолиз можно разделить на три группы:
1. Разрушающие эритроциты (при определённой дозе) у всех отравленных;
2. Гемолизирующие форменные элементы только у лиц с врождённой недостаточностью Г-6Ф-ДГ;
3. Вызывающие иммунные гемолитические анемии.
Наибольшую опасность представляют вещества первой группы (табл. 30).
Таблица 30.
Вещества, вызывающие гемолиз
Анилин Арсин (мышьяковистый водород) Бензол Динитробензол Гидрохинон Нафтален Нитраты Нитриты Нитробензол Сульфоны |
Стибин (сурмянистый водород) Толуол Трибромметанол Тринитробензол Тринитротолуол Фенол Хлорат калия (натрия) Хлористый метил Хлороформ Яды змей (кобра) |
Для большинства облигатных гемолитиков характерна двухфазность в действии на эритроциты. Первая фаза характеризуется появлением в крови метгемоглобина (метгемоглобинобразующее действие), и только затем, во второй фазе развивается гемолиз (гемолитическое действие). Некоторые токсиканты (арсин, стибин) обладают только гемолитическим действием.
Гемолитики разрушают эритроциты, в результате чего гемоглобин выходит в плазму крови. Растворенный в плазме гемоглобин способен связывать кислород в такой же степени, как и заключенный в эритроциты. Поэтому в первые часы после острого воздействия клиника гипоксии практически не выражена. Вместе с тем гемолиз сопровождается:
- существенным нарушением коллоидно-осмотических свойств крови (содержание белка в плазме возрастает с 7 до 20%) и, следовательно, нарушением циркуляции крови;
- затруднением диссоциации оксигемоглобина в тканях. Одна из причин явления - существенно более низкое содержание в плазме крови, в сравнении с эритроцитами, основного биорегулятора сродства кислорода к гемоглобину - 2,3-дифосфоглицерата;
- ускоренным разрушением гемоглобина. Так, в эритроцитах гемоглобин сохраняется в среднем около 100 дней, т.е. весь период жизни клетки. В случае тяжелого гемолиза, когда содержание эритроцитов падает до 800 тыс. в мм3 крови, уже через сутки уровень Нb составляет менее 30% от нормы.
Указанные особенности действия веществ лежат в основе патогенеза острых интоксикаций гемолитиками. Гемолиз провоцирует реакции лишь умеренной интенсивности со стороны специализированных структур, регулирующих энергетический обмен в организме (каротидный клубочек и др.), и к нарушениям биоэнергетики в тканях, несовместимым с жизнью, приводит чрезвычайно редко. Значительно более тяжелыми являются последствия гистотоксического действия свободно циркулирующего в крови гемоглобина на почечную ткань. Повреждение гемоглобином почек приводит к острой почечной недостаточности, в тяжелых случаях – уремии и смерти через несколько дней от момента поступления гемолитического яда в организм. Из сказанного ясно, почему вещества этой подгруппы можно лишь с большой долей условности назвать общеядовитыми.
Определенный интерес с позиций военной токсикологии представляет мышьяковистый водород.
10.1.2.1. Мышьяковистый водород (Арсин - AsH3)
Арсин – соединение мышьяка, в котором элемент имеет валентность минус 3; бесцветный газ, практически без запаха.
Физико-химические свойства и токсичность соединения представлены в таблице 31.
Таблица 31.
Физико-химические свойства и токсичность арсина
Арсин |
(AS) |
Формула |
AsH3 |
Молекулярный вес |
77,93 |
Плотность пара (по воздуху) |
2,69 |
Плотность жидкости |
1,34 при 200С |
Температура кипения |
-62,50С |
Температура разрушения |
2800С |
Скорость гидролиза |
Высокая. При определенных условиях АsH3 образует с водой твердое соединение, разрушающееся при 300С |
Стабильность при хранении |
Не стабильное вещество. Металлы катализируют разрушение |
Запах |
Слабый, чесночный |
Среднесмертельная токсодоза |
5 г мин/м3. Полагают, что летальной для человека дозой является 2 мг/кг |
Средняя непереносима доза |
2,5 г мин/м3 |
Проявления интоксикации |
Гемолиз эритроцитов с последующим поражением почек и других органов-мишеней |
Скорость развития интоксикации |
От 2 часов до 11 суток |
Перед второй мировой войной мышьяковистый водород рассматривали как возможное отравляющее вещество. Однако физико-химические свойства и умеренная токсичность не позволили использовать его с этой целью. В настоящее время арсин достаточно широко используется в химическом синтезе при производстве анилиновых красителей, бензидина и т.д. Выделяется как побочный продукт при взаимодействии с кислотами металлов (свинец, цинк, железо), содержащих в качестве примеси мышьяк (травление металлов, получение водорода, зарядка аккумуляторных батарей и т.д.). Неправильные условия транспортировки и использования мышьяк-содержащих инсектицидов могут создавать условия для отравления арсином. В ходе различных аварий на производствах отравление AsH3 получили несколько сот человек.
Токсикокинетика
Единственный способ поступления в организм - ингаляционный. Поступив в кровь, вещество проникает в эритроциты и клетки других органов и тканей (печени, почек, нервной системы и т.д.). Частично AsH3 выделяется через легкие в неизмененном состоянии, частично вступает в метаболические превращения, при этом образуются продукты его окисления (элементарный мышьяк, мышьяковистый и мышьяковый ангидриды и т.д.). Окисление арсина может проходить и в эритроцитах при участии кислорода. Образовавшиеся продукты окисления повторно восстанавливаются при участии глутатиона, а затем подвергается метилированию и в форме метил-производных выделяются из организма с мочой.
Течение отравления
В период воздействия арсин не оказывает раздражающего действия на слизистые оболочки и контакт с токсикантом может пройти незамеченным.
Мышьяковистый водород является типичным представителем гемолитических ядов. Гемолитическое действие вещества и обусловливает клиническую картину острых отравлений.
В зависимости от концентрации токсиканта во вдыхаемом воздухе и продолжительности действия выделяют легкую, средней степени и тяжелую форму интоксикации. Появлению симптомов предшествует скрытый период, продолжительность которого при легких формах поражения составляет до 24 часов, а при тяжелых около 30 - 60 минут. Ранними признаками отравления являются жалобы на сильную головную боль, слабость, головокружение, беспокойство, тошноту, чувство жажды, озноб. Позже (при отравлении средней степени тяжести через 6 - 24 часа после воздействия) отмечается изменение окраски кожных покровов, приобретающих желтушный оттенок. Желтуха достигает наибольшей выраженности к 3 - 4 дню заболевания, а затем начинает исчезать. Нормальный цвет кожных покровов при благоприятном течении интоксикации восстанавливается на второй - четвертой неделе. При крайне тяжелых формах отравления наряду с желтухой развивается цианоз видимых слизистых, кожа при этом приобретает своеобразный бронзовый цвет. Одновременно с желтухой выявляется гемоглобинурия - выделение с мочой свободного, не связанного с эритроцитами, гемоглобина. Моча приобретает от ярко-красного до черно-красного цвет.
Уже в ближайшие часы после воздействия яда отмечается уменьшение количества эритроцитов в крови. При тяжелых интоксикациях через сутки количество эритроцитов уменьшается до 600000 - 800000 в 1 мм3 крови. При средней степени тяжести интоксикации количество эритроцитов составляет 2 - 2,5 млн в 1 мм3 крови. Явления анемии продолжают нарастать в течение 5 - 10 дней. В этот период в периферической крови появляются патологические клеточные элементы: эритробласты, микробласты, возрастает число ретикулоцитов, отмечается анизоцитоз клеток. Со стороны белой крови отмечается нейтрофильный лейкоцитоз и умеренная лимфопения.
В результате разрушения протеолитическими энзимами гемоглобина, выходящего в плазму крови при гемолизе, количество его в крови уменьшается. Причем если в первые часы интоксикации содержание гемоглобина находится в пределах нормы, то уже через сутки - при отравлении средней тяжести оно составляет 30 - 50% от нормы, а при тяжелой - менее 30%.
Результатом понижения уровня гемоглобина является нарушение кислородтранспортных функций крови. Кислородная емкость крови понижается (в зависимости от тяжести отравления) на 15 - 80%. Формируется гемический тип гипоксии со всеми сопутствующими ей проявлениями (см. выше).
В периоде выраженной анемии в патологический процесс вовлекаются почки. В тяжелых случаях на 4 - 6 день отравления развивается олигурия, а затем и анурия. Появляются признаки уремии: запах мочи изо рта, рвота, расстройства сознания, судороги. В ряде случаев в клинической картине отравления появляются признаки печеночной недостаточности: увеличение размеров печени, ее болезненность и т.д. При патологоанатомическом исследовании лиц, погибших в этом периоде, отмечается характерная картина изменения почек. Они увеличены в размерах, мягкие, приобретают цвет спелой сливы. На разрезе выявляются кровоизлияния и инфильтраты, рисунок почки сглажен, ткань ее буро-красного цвета. Полости боуменовых капсул растянуты и заполнены мелкозернистым содержимым. Просветы извитых и прямых канальцев выполнены бурой массой, дающей положительную реакцию на железо. Налицо признаки механического повреждения органа гемглобином и продуктами его разрушения, содержащимися в огромных количествах в плазме крови отравленных.
При средней степени тяжести признаки отравления исчезают через 2 - 4 недели, при благоприятном течении тяжелой интоксикации полное восстановление трудоспособности наблюдается через 2 - 3 месяца. Прогноз в значительной мере определяется функцией почек. Летальность составляет более 20%. Последствия перенесенной интоксикации могут проявиться длительным нарушением функций печени и почек. К числу отдаленных последствий относятся полиневриты, сопровождающиеся нарушением чувствительности.
Механизм токсического действия
Кривая токсичности арсина характеризуется большой крутизной, это означает, что различия доз, вызывающих пороговое действие и смертельное поражение, малы. Так, в опытах на животных показано, что ингаляционное воздействие токсикантом в течение 28 дней в концентрации 5 объемных частей газа на миллион частей воздуха (ppm - pars per million) переносится практически бессимптомно. Вместе с тем ингаляция в течение 4 суток вещества в концентрации 10 ppm приводит к 100% гибели животных. Такая закономерность соответствует представлениям о механизме токсического действия вещества. Во всех случаях воздействия арсином, сопровождавшихся гемолизом, отмечали существенное истощение содержания глутатиона в эритроцитах. Экспериментально установлено, что гемолитический эффект по всей видимости и обусловлен снижением содержания этого трипептида в клетках крови. Глутатион, как известно, необходим для поддержания целостности мембраны эритроцитов. Если скорость его синтеза превышает скорость истощения, наступающего под влиянием арсина, гемолиз не развивается. Напротив, если истощение превалирует над синтезом, развивается острая гемолитическая реакция. Наконец, в тех случаях, когда воздействие AsH3 не сопровождается полным истощением запасов восстановленного глутатиона, гемолитический эффект носит дозо-зависимый характер.
Мероприятия медицинской защиты
Специальные санитарно-гигиенические мероприятия:
- использование индивидуальных технических средств защиты (средства защиты органов дыхания) в зоне химического заражения;
Специальные лечебные мероприятия:
- своевременное выявление пораженных;
- применение средств патогенетической и симптоматической терапии состояний, угрожающих жизни, здоровью, дееспособности пораженного, в ходе оказания первой (само-взаимопомощь), доврачебной и первой врачебной (элементы) помощи пострадавшим.
- подготовка и проведение эвакуации
Медицинские средства защиты
Специфические противоядия токсиканта отсутствуют. Использование хелатирующих агентов, успешно используемых для оказания помощи отравленным соединениями мышьяка иного строения, (препаратов из группы моно-, дитиолов и др.) при отравлении арсином оказывается малоэффективным. Имеются данные о способности 2,3-димеркаптосукцината in vitro полностью предупреждать гемолитическое действие мышьяковистого водорода. Однако in vivo этот комплексон оказывается также практически неэффективным. В этой связи, целью медицинской защиты, направленной на спасение жизни и минимизацию ущерба, наносимого токсикантом здоровью пораженного, применяют симптоматические средства борьбы с развивающимися анемией, кислородным голоданием и поражением почек: обильное питье, кровопускание (300 - 400 мл), внутривенное введение 40% раствора глюкозы, физиологического раствора, других кровезаменяющих жидкостей, ингаляция кислорода (см. выше). Важным мероприятием медицинской защиты является скорейшее выявление пораженных, до развития у них выраженного гемолиза, и скорейшая эвакуация их в лечебные учреждения.
10.2. ОВТВ, нарушающие тканевые процессы биоэнергетики
10.2.1. Ингибиторы ферментов цикла Кребса
В результате гликолиза в клетках накапливается пировиноградная кислота, превращение которой при участии ферментов пируватоксидазного комплекса приводит к образованию уксусной кислоты. Последняя, в активированной форме ацетил-КоА, вступает в превращения, называемые циклом трикарбоновых кислот (цикл Кребса). Эти превращения, проходящие исключительно в митохондриях клеток, приводят к синтезу изоцитрата, α-кетоглютарата, сукцината, малата - непосредственных субстратов следующего этапа энергетического обмена - их биологического окисления. Угнетение ферментов цикла Кребса и истощение образующихся субстратов сопровождается острым нарушением энергообеспечения клеток.
Ингибиторы цикла трикарбоновых кислот – это, прежде всего, F- и Cl-уксусная кислота и вещества, метаболизирующие в организме с образованием этих соединений. Будучи аналогами ацетата, рассматриваемые вещества в форме F- и Сl-ацетил-КоА вступают в метаболические превращения в цикле Кребса. На одном из этапов биотрансформации образуется субстрат, блокирующий всю цепь взаимозависимых реакций цикла. Чувствительность энзимов цикла трикарбоновых кислот к F-ацетату очень высока, ниже к Cl-ацетату. С этим связана высокая токсичность F-уксусной кислоты и ее производных для человека (около 0,1 мг/кг), токсичность Cl-уксусной кислоты в 10-15 раз меньше.
Для военной токсикологии особый интерес представляют фторорганические соединения.
10.2.1.1. Фторорганические соединения
Синтез фторорганических соединений явился в середине ХХ века необходимым элементом крупномасштабного производства пластмасс, хладоагентов, пестицидов, красителей, смазочных материалов и т.д. Высокая токсичность некоторых представителей этого класса соединений стала поводом для их пристального изучения, в том числе и с военными целями.
Фторорганические соединения значительно различаются по токсичности. По данным Б. Сондерса (1957) решающим фактором, определяющим их биологическую активность, является способность метаболизировать в организме с образованием фторуксусной кислоты. Именно это соединение ответственно за инициацию токсического процесса при поступлении в организм токсичных аналогов. Согласно данным автора, в ряду производных фторкарбоновых кислот (F(CH2)nCOOR) ядовиты лишь соединения с нечетным числом метиленовых групп в молекуле. Чередование токсичности в пределах гомологического ряда объяснимо с позиций теории β-окисления жирных кислот в организме, согласно которой последние ступенчато расщепляются, последовательно отделяя от исходной структуры молекулы уксусной кислоты. Если число метиленовых групп в молекуле исходного агента (n) - четное, то в результате такого расщепления, последним метаболитом окажется относительно малотоксичная 3-фторпропионовая кислота (ЛД50 для мышей при внутрибрюшинном способе введения - 60 мг/кг), если n - нечетное - фторуксусная.
Помимо фторкарбоновых кислот высокой токсичностью обладают некоторые производные эфиров фторкарбоновых кислот - F(СН2)nCOOR и фторированных спиртов F(СН2)nCOН. Эти вещества также метаболизируют (гидролизуются, окисляются) с образованием фторуксусной кислоты. Метиловый эфир фторуксусной кислоты и 2-фторэтанол в середине 20 века рассматривались как возможные ОВ (З. Франке, 1973), однако в качестве таковых не производились.
Понятно, что наиболее токсичным представителем группы является сама фторуксусная кислота.
10.2.1.2. Фторуксусная кислота
Фторуксусная кислота, по мнению специалистов, почти идеально соответствует требованиям, предъявляемым к диверсионным ядам. Она сильно ядовита, устойчива в водных растворах, органолептически не обнаруживается, затруднено ее химико-аналитическое определение, действие проявляется после скрытого периода.
Вещество впервые синтезировано Свартсом в 1900 году. Позже кислота была выделена из листьев Южноафриканских растений Dichapetalum cymosum, D. veneatum и др. Несколько листьев этих растений достаточно для приготовления снадобья, способного умертвить лошадь.
Физико-химические свойства. Токсичность
Фторуксусная кислота - кристаллическое вещество, хорошо растворимое в воде. Стойкое при кипячении. Токсичность её неодинакова для разных видов живых существ. Летальная доза для мышей составляет около 0,6 мг/кг, для овец - 0,7 мг/кг, для лошадей - 1,0 мг/кг, собак - 0,1 мг/кг. Средняя смертельная доза для человека определяется, как 2 - 5 мг массы.
Токсикокинетика
Вещество хорошо всасывается в желудочно-кишечном тракте и быстро распределяется в организме. Проницаемость через гематоэнцефалический барьер умеренная. Вещество медленно метаболизирует в организме. Метаболиты выделяются с мочой и через легкие.
Проявления интоксикации
У грызунов интоксикация протекает очень бурно. Уже через несколько минут после введения смертельной дозы развиваются судороги и через минуту - полторы после их начала у отдельных особей регистрируют смерть. Если смертельный исход не наступает, нормализацию состояния отмечают уже через 20 минут после прекращения судорог.
У человека, в зависимости от принятой дозы, действие на организм проявляется спустя 0,5 - 6 часов. Такое отсроченное начало отравления можно связать с прохождением во времени этапов метаболизма ксенобиотика в цикле Кребса, и постепенным истощением субстратов биологического окисления, которые в норме присутствуют в клетке в некотором избытке. Появляются тошнота, боли в животе, оглушенность, спутанность сознания, чувство страха выраженная одышка. Затем пострадавший теряет сознание, появляются приступы клонико-тонических судорог. Смерть наступает от остановки дыхания и нарушения сердечной деятельности, сопровождающейся фибрилляцией желудочков. Если на высоте интоксикации пострадавший не погибает, формируется затяжная кома, в которой пострадавший может оставаться в течение до 6 суток.
Механизм токсического действия
Еще в 1947 году Бартлет и Баррон, а позже Лиебиг и Питерс показали способность фторуксусной кислоты блокировать в организме окисление ацетата. В настоящее время полагают, что в основе механизма токсического действия вещества лежит его способность в форме FАцКоА проникать в митохондрии, и вступать в метаболические превращения в цикле Кребса. Установлено, что продукт превращения фторацетата - фторцитрат, ковалентно связывается с ферментом транслоказой внутренней мембраны митохондрий, участвующим в переносе цитрата через митохондриальную мембрану, нарушая этот процесс. Ко-фактором транслоказы является глютатион, который также связывается с фторцитратом. Известно, что синтез АцКоА и его утилизация идет только при условии трансмембранного тока из митохондрий цитрата, поэтому блокада транслоказы угнетает превращение ацетата в цикле Кребса. Кроме того, блок цикла трикарбоновых кислот развивается на этапе превращения цитрата в цис-аконитат в результате конкурентного обратимого ингибирования образующимся фторцитратом фермента аконитатгидратазы. Поскольку in vivo, вводимый в избытке цитрат существенно не облегчает течение интоксикации, этот механизм нарушения митохондриальных процессов не считают основным. В результате такого комплексного действия фторуксусной кислоты повреждаются митохондриальные процессы, лежащие в основе образования субстратов аэробной фазы дыхания - нарушается синтез макроэргов.
Мероприятия медицинской защиты
Специальные санитарно-гигиенические мероприятия:
- участие медицинской службы в проведении химической разведки в районе расположения войск; проведение экспертизы воды и продовольствия на зараженность ОВТВ;
- запрет на использование воды и продовольствия из непроверенных источников;
- применение средства защиты органов дыхания в очагах поражения летучими соединениями (фторэтанол, эфиры фторуксусной кислоты и т.д.).
Специальные лечебные мероприятия:
- применение средств патогенетической и симптоматической терапии состояний, угрожающих жизни, здоровью, дееспособности, в ходе оказания первой (само-взаимопомощь), доврачебной и первой врачебной (элементы) помощи пострадавшим.
- подготовка и проведение эвакуации
Медицинские средства защиты
Оказания неотложной помощи пострадавшим осуществляется в соответствии с общими принципами (см. раздел “Общие принципы оказание первой, доврачебной и первой врачебной помощи при острых поражениях ОВТВ”).
В эксперименте на лабораторных животных показано, что при раннем введении ацетата натрия (2 - 3 г/кг), наблюдается снижение тяжести интоксикации, вызванной фторуксусной кислотой. При одновременном введении этанола (5% раствор на 5% глюкозе: из расчета - 1 мл 960 спирта на 1 кг массы) защитная эффективность препарата увеличивается более чем в два раза. Показано также, что известными антидотными свойствами обладают вещества, содержащие SH-группы, в частности ацетилцистеин. Данные об использовании препаратов в условиях клиники отсутствуют.
10. 2.2. Ингибиторы цепи дыхательных ферментов
Процесс биологического окисления состоит в отщеплении с помощью соответствующих энзимов (дегидрогеназ) от изоцитрата, α-кетоглютарата, сукцината, малата, синтезируемых в цикле трикарбоновых кислот, атомов водорода (Н), и переносе их в форме протонов (Н+) и электронов (е-) по цепи дыхательных ферментов на кислород. Дыхательная цепь – это последовательность связанных друг с другом окислительно-восстановительных пар молекул-переносчиков протонов, электрохимический потенциал которых постепенно понижается (рис. 1,2). При таком «постепенном» окислении организму удается обеспечить очень высокий КПД утилизации химической энергии, запасенной в окисляющихся субстратах (в форме АТФ утилизируется около 42% энергии; около 58% рассеивается в форме тепла). Естественно процесс должен идти непрерывно; «выход из строя» любого из звеньев мгновенно приводит к восстановлению всей цепи дыхательных ферментов «выше» выведенного из строя звена. При этом транспорт е- и Н+ по цепи переносчиков прекращается, – нарушается процесс синтеза макроэргов.
Токсичность различных веществ рассматриваемой группы определяется их сродством к дыхательным ферментам, особенностями токсикокинетики. Наиболее токсичный агент из известных веществ общеядовитого действия – синильная кислота. Это вещество обладает и максимальным быстродействием. Аналогично синильной кислоте действуют на организм многочисленные ее производные, а также сульфиды (сероводород - H2S) и азиды (азид натрия - NaN3).
10.2.2.1. Синильная кислота и ее соединения
Синильная кислота (цианистоводородная кислота) впервые синтезирована шведским ученым Карлом Шееле в 1782 г. Ядовитые свойства кислоты были известны давно. Еще в период наполеоновских войн ею предлагали наполнять артиллерийские снаряды. В качестве отравляющего вещества синильная кислота впервые применена 1 июля 1916 г. на р. Сомме французскими войсками против немецких войск. Выраженный боевой эффект получить не удалось, так как относительная плотность паров HCN по воздуху меньше 1. Попытки утяжелить пары синильной кислоты путем добавления треххлористого мышьяка, хлорного олова и хлороформа также не привели к созданию боевых концентраций ядовитых паров в атмосфере.
Сама кислота и ее соли получили широкое применение в сельском хозяйстве (в качестве средств борьбы с вредителями плодовых деревьев), в промышленности (для извлечения золота и серебра из руд), в химическом синтезе нитрильного каучука, синтетических волокон, пластмасс и т.д.
В качестве ОВ применение маловероятно. Возможно использование производных синильной кислоты в качестве диверсионных агентов.
В настоящее время известны различные группы химических соединений, содержащих группу CN в молекуле. Среди них: нитрилы - R-CN (синильная кислота - HCN, дициан - CN-CN, цианистый калий - KCN, хлорциан - Cl-CN, пропионитрил - С3Н7-СN и т.д.); изонитрилы - R-NC+ (фенилизонитрилхлорид); цианаты - R-O-CN (фенилцианат); изоцианаты - R-N=C=O (метилизоцианат, фенилизоцианат); тиоцианаты - R-S-CN (роданистый калий); изотиоцианаты - R-N=C=S (метилизотиоцианат). Наименее токсичными (ЛД50 более 500 мг/кг) являются представители цианатов и тиоцианатов. Изоцианаты и изотиоцианаты обладают раздражающим и удушающим действием (см. разделы «ОВТВ раздражающего действия» и «ОВТВ пульмонотоксического действия»). Общеядовитое действие (за счет отщепления в организме от исходного вещества иона CN-) проявляют нитрилы и в меньшей степени изонитрилы. Высокой токсичностью отличается, помимо самой синильной кислоты и ее солей, хлорциан, бромциан, а также пропионитрил, лишь в 3 - 4 раза уступающий по токсичности цианистому калию.
Синильная кислота встречается в растениях в форме гетерогликозидов. Около 2000 видов растений содержат CN-содержащие гликозиды. Например, в виде амигдалина HCN содержится в семенах горького миндаля (2,5-3,5%), в косточках персиков (2-3%), абрикосов и слив (1-1,8%), вишни (0,8%) и др.
Физико-химические свойства. Токсичность
Синильная кислота – бесцветная прозрачная жидкость с запахом горького миндаля (при малых концентрациях). Характерный запах ощущается при концентрации в воздухе 0,009 мг/л. Синильная кислота кипит при +25,7 0С, замерзает при –13,4 0С. Относительная плотность ее паров по воздуху равна 0,93. Пары синильной кислоты плохо поглощаются активированным углем, но хорошо сорбируются другими пористыми материалами.
При взаимодействии со щелочами HCN образует соли (цианистый калий, цианистый натрий и т.д.), которые по токсичности мало уступают самой синильной кислоте. В водных растворах кислота и ее соли диссоциируют с образованием иона CN-. Синильная кислота является слабой кислотой и может быть вытеснена из своих солей другими, даже самыми слабыми, кислотами (например, угольной). Поэтому соли синильной кислоты необходимо хранить в герметически закрытой посуде.
Отравление синильной кислотой возможно при ингаляции ее паров. LCt50 составляет 2 г мин/м3. Смертельное отравление солями синильной кислоты возможно при проникновении их в организм с зараженной водой или пищей. При отравлении через рот смертельными дозами для человека являются: HCN – 1 мг/кг; КCN – 2,5 мг/кг; NaCN – 1,8 мг/кг.
Синильная кислота относится к некумулятивным ядам. Это подтверждается тем, что в концентрации менее 0,04 г/м3 HCN не вызывает симптомов интоксикации при длительном (более 6 ч) пребывании человека в зараженной атмосфере.
Токсикокинетика
Основным путем проникновения паров синильной кислоты в организм является ингаляционный. Не исключается возможность проникновения яда через кожу при создании высоких концентраций ее паров в атмосфере. При приеме внутрь кислоты и ее солей всасывание начинается уже в ротовой полости и завершается в желудке. Попав в кровь, вещество быстро диссоциирует и ион CN- распределяется в организме. Благодаря малым размерам он легко преодолевает различные гистогематические барьеры.
Некоторая часть синильной кислоты выделяется из организма в неизмененном виде с выдыхаемым воздухом (поэтому от отравленного пахнет горьким миндалем). Большая часть яда подвергается метаболическим превращениям: частично окисляется через циановую кислоту НСNО до СО2 и аммиака, но в основном вступает в реакцию конъюгации с эндогенными серусодержащими веществами с образованием малотоксичных роданистых соединений (CNS-), выделяющихся через почки и со слюной. Как полагают, донорами серы в клетках могут являться тиосульфитные ионы (S2O3-), цистеин, тиосульфаны (RSnSH). Превращение идет при участии тканевых ферментов (главным образом печени и почек) тиосульфат-тиотрансферазы (роданеза) и β-меркаптопируват-цианидсульфотрансферазы. Максимум выделения роданистых соединений из организма отравленного отмечается на вторые сутки.
Основные проявления интоксикации
В результате тканевой гипоксии, развивающейся под влиянием синильной кислоты, в первую очередь нарушаются функции центральной нервной системы. У животных цианиды даже в малых дозах приводят к нарушению условнорефлекторной деятельности. Действуя в больших дозах, вещества вызывают вначале возбуждение центральной нервной системы, а затем ее угнетение.
При действии сверхвысоких доз токсиканта развивается молниеносная форма отравления. Пострадавший, через несколько секунд после воздействия, теряет сознание. Развиваются судороги. Кровяное давление после кратковременного подъема падает. Через несколько минут останавливается дыхание и сердечная деятельность.
При замедленном течении в развитии интоксикации можно выделить несколько периодов.
Период начальных явлений характеризуется легким раздражением слизистых оболочек верхних дыхательных путей и конъюнктивы глаз, неприятным жгуче-горьким вкусом и жжением во рту. Ощущается запах горького миндаля. Наблюдаются слюнотечение, тошнота, иногда рвота, головокружение, головная боль, боль в области сердца, тахикардия (иногда брадикардия), учащение дыхания. Нарушается координация движений, ощущается слабость, возникает чувство страха. Перечисленные признаки появляются почти сразу после воздействия яда. Скрытого периода практически нет.
Диспноэтический период характеризуется развитием мучительной одышки. Наблюдается резко выраженное увеличение частоты и глубины дыхания. Развивающуюся одышку, видимо, следует рассматривать как компенсаторную реакцию организма на гипоксию. Первоначальное возбуждение дыхания по мере развития интоксикации сменяется его угнетением. Дыхание становится неправильным – с коротким вдохом и длительным выдохом. Нарастают боль и чувство стеснения в груди. Причинами этих нарушений являются тканевая гипоксия и истощение энергетических ресурсов в центрах продолговатого мозга. Сознание угнетено. Наблюдаются выраженная брадикардия, расширение зрачков, экзофтальм, рвота. Кожные покровы и слизистые оболочки приобретают розовую окраску. В легких случаях отравление синильной кислотой этими симптомами и ограничивается. Через несколько часов все проявления интоксикации исчезают.
Диспноэтический период сменяется периодом развития судорог. Судороги носят клонико-тонический характер с преобладанием тонического компонента. Сознание утрачивается. Дыхание редкое, но признаков цианоза нет. Кожные покровы и слизистые оболочки розовые. Первоначально наблюдавшееся замедление сердечного ритма, повышение артериального давления и увеличение минутного объема сердца, сменяется падением артериального давления, учащением пульса, его аритмичностью. Развивается острая сердечно-сосудистая недостаточность. Возможна остановка сердца. Корнеальный, зрачковый и другие рефлексы снижены. Тонус мышц значительно повышен.
Вслед за коротким судорожным периодом, если не наступает смерть, развивается паралитический период. Он характеризуется полной потерей чувствительности, исчезновением рефлексов, расслаблением мышц, непроизвольной дефекацией и мочеиспусканием. Дыхание становится редким, поверхностным. Кровяное давление падает. Пульс частый, слабого наполнения, аритмичный. Развивается кома, в которой пострадавший, если не наступает смерть от остановки дыхания и сердечной деятельности, может находиться несколько часов, а иногда и суток. Температура тела у пораженных в паралитическом периоде снижена.
Угнетение тканевого дыхания приводит к изменению клеточного, газового, и биохимического состава крови. Содержание в крови эритроцитов увеличивается вследствие рефлекторного сокращения селезенки и выхода клеток из депо. Парциальное давление кислорода в венозной крови возрастает. Цвет венозной крови становится ярко-алым за счет избыточного содержания оксигемоглобина (HbO). Артерио-венозная разница по кислороду резко уменьшается. Содержание СО2 в крови снижается вследствие меньшего образования и усиленного выделения при гипервентиляции легких. Такая динамика газового состава первоначально приводит к газовому алкалозу, который затем сменяется метаболическим ацидозом. В крови накапливаются недоокисленные продукты обмена: увеличивается содержание молочной кислоты, нарастает содержание ацетоновых тел (ацетон, ацетоуксусная и β-оксимасляная кислоты), повышается содержание сахара (гипергликемия).
Продолжительность течения всего отравления, как и отдельных периодов интоксикации, колеблется в значительных пределах (от нескольких минут до многих часов). Это зависит от количества яда, попавшего в организм, предшествующего состояния организма и других причин.
Последствия интоксикации
Выраженность, характер осложнений и последствий отравления во многом зависят от продолжительности гипоксического состояния, в котором пребывает отравленный. Особенно частыми являются нарушения функций нервной системы. После перенесения острого отравления в течение нескольких недель наблюдаются головные боли, повышенная утомляемость, нарушение координации движений. Речь затруднена. Иногда развиваются параличи и парезы отдельных групп мышц. Возможны нарушения психики.
Наблюдаются стойкие изменения функций сердечно-сосудистой системы вследствие ишемии миокарда.
Нарушения дыхательной системы проявляются функциональной лабильностью дыхательного центра и быстрой его истощаемостью при повышенных нагрузках.
Механизм токсического действия
Цианиды угнетают окислительно-восстановительные процессы в тканях, нарушая последний этап передачи протонов и электронов цепью дыхательных ферментов от окисляемых субстратов на кислород.
Как известно, на этом этапе переносчиками протонов и электронов является цепь цитохромов (цитохромы b, С1, С, a и a3). Последовательная передача электронов от одного цитохрома к другому приводит к окислению и восстановлению находящегося в них железа (Fe3+ ↔ Fe2+). Конечным звеном цепи цитохромов является цитохромоксидаза. Установлено, что энзим включает 4 единицы гема “a” и 2 единицы - “a3”. Именно с цитохромоксидазы электроны передаются кислороду, доставляемому к тканям кровью. Установлено, что циан-ионы (CN-), растворенные в крови, достигают тканей, где вступают во взаимодействие с трехвалентной формой железа цитохрома а3 цитохромоксидазы (с Fe2+ цианиды не взаимодействуют). Соединившись с цианидом, цитохромоксидаза утрачивает способность переносить электроны на молекулярный кислород.
Вследствие выхода из строя конечного звена окисления блокируется вся дыхательная цепь и развивается тканевая гипоксия. Кислород с артериальной кровью доставляется к тканям в достаточном количестве, но ими не усваивается и переходит в неизмененном виде в венозное русло. Одновременно нарушаются процессы образования макроэргов (АТФ и др.). Активируется гликолиз, то есть обмен с аэробного перестраивается на анаэробный.
Помимо непосредственного действия цианидов на ткани, существенную роль в формировании острых симптомов поражения, имеет рефлекторный механизм.
Организм располагает специализированными структурами, чувствительность которых к развивающемуся дефициту макроэргов на много превосходит все другие ткани. Наиболее изученным из этих образований является каротидный клубочек (glomus caroticum). Каротидный клубочек расположен в месте бифуркации общей сонной артерии на внутреннюю и наружную. Через него за минуту протекает около 20 мл крови на 1 г ткани (через головной мозг – 0,6 мл). Он состоит из двух типов клеток (по Гессу): I типа, богатых митохондриями гломусных клеток, и II типа, капсулярных клеток. Окончания нерва Геринга, связывающего структуру с ЦНС, пронизывают тела клеток II типа и приходят в соприкосновение с клетками I типа. М.Л. Беленький показал, что рефлексы с гломуса возникают при изменениях РаО2, рН, других показателей обмена, которые отмечаются уже при минимальных нарушениях условий, необходимых для осуществления процесса окислительного фосфорилирования. Сильнейшим возбуждающим агентом этой структуры является цианистый калий. Был сделан вывод, что основная физиологическая роль каротидного клубочка – сигнализировать ЦНС о надвигающемся нарушении энергетического обмена. Есть предположение, что пусковым звеном формирующихся в гломусе рефлекторных реакций, является понижение в клетках I типа уровня АТФ. Понижение уровня АТФ провоцирует выброс гломусными клетками химических веществ, которые и возбуждают окончания нерва Геринга. Хорошо известна чувствительность гломуса к ряду нейроактивных соединений, например, Н-холиномиметиков, катехоламинов (Аничков С.В.). Однако известно также и то, что ни одно из них не изменяет чувствительности структуры к цианиду. Действие адекватных раздражителей на гломус сопровождается возбуждением ЦНС, повышением АД, брадикардией, учащением и углублением дыхания, выбросом катехоламинов из надпочечников и, как следствие этого, гипергликемией и т.д. То есть всеми теми реакциями, которые отмечаются на ранних стадиях интоксикации веществами обещядовитого действия. Каким бы образом не нарушали токсиканты механизмы энергообеспечения, реакция организма во многом однотипна. Проявления интоксикации – это эффекты, формирующиеся сначала как следствие возбуждения и перевозбуждения специализированных регулирующих систем (например, гломуса), а затем – нарушение биоэнергетики непосредственно в тканях, и, прежде всего, быстро реагирующих на дефицит макроэргов (мозг).
Особенности действия галогенпроизводных синильной кислоты
Замещение атома водорода в синильной кислоте галоидами ведет к образованию галоидцианов.
Хлорциан (ClCN) как отравляющее вещество впервые был применен в период первой мировой войны в октябре 1916 г. французскими войсками. Хлорциан – бесцветная прозрачная жидкость, кипит при 12,6 0С и замерзает при – 6,5 0С. Обладает раздражающим запахом (запах хлора). Плотность пара по воздуху 2,1.
Бромциан (BrCN) впервые применен в годы первой мировой войны (1916) австро-венгерскими войсками в виде смеси: 25% бромциана, 25% бромацетона и 50% бензола. Бромциан – бесцветное или желтое кристаллическое вещество, очень летучее, с резким запахом. Температура кипения + 61,3 0С, плавления + 52 0С. Плотность паров по воздуху №.7.
Оба соединения (особенно ClCN) по токсичности близки к синильной кислоте.
Хлорциан и бромциан, действуя подобно HCN, обладают и раздражающим действием. Они вызывают слезотечение, раздражение слизистых носа, носоглотки, гортани и трахеи. В больших концентрациях могут вызывать токсический отек легких.
Мероприятия медицинской защиты
Специальные санитарно-гигиенические мероприятия:
- использование индивидуальных технических средств защиты (средства защиты органов дыхания) в зоне химического заражения;
- участие медицинской службы в проведении химической разведки в районе расположения войск; проведение экспертизы воды и продовольствия на зараженность ОВТВ;
- запрет на использование воды и продовольствия из непроверенных источников;
Специальные лечебные мероприятия:
- применение антидотов и средств патогенетической и симптоматической терапии состояний, угрожающих жизни, здоровью, дееспособности, в ходе оказания первой (само-взаимопомощь), доврачебной и первой врачебной (элементы) помощи пострадавшим.
- подготовка и проведение эвакуации.
Медицинские средства защиты
Известные в настоящее время антидоты цианидов либо обладают химическим антагонизмом к токсикантам, либо ускоряют их метаболизм.
Химически связывать ион CN- способны вещества, содержащие альдегидную группу в молекуле (глюкоза), а также препараты кобальта (гидроксикобаламин, Со-ЭДТА и т.д.). Метгемоглобинообразователи, окисляющие железо гемоглобина до трехвалентного состояния (см. выше), также являются антагонистами цианидов в действии на организм, поскольку циан-ион связывается, образующимся при метгемоглобинемии, трехвалентным железом пигмента крови. Усиление элиминации цианидов достигается путем назначения веществ, ускоряющих их превращение в роданистые соединения (тиосульфат натрия).
Глюкоза. Антидотный эффект препарата связывают со способностью веществ, содержащих альдегидную группу в молекуле, образовывать с синильной кислотой стойкие малотоксичные соединения – циангидрины:
Вещество вводят внутривенно в количестве 20 - 25 мл 25 - 40% раствора.
Помимо способности связывать токсикант, глюкоза оказывает благоприятное действие на дыхание, функцию сердца и увеличивает диурез.
Препараты, содержащие кобальт. Известно, что кобальт образует прочные связи с циан-ионом. Это дало основание испытать соли металла (хлорид кобальта) в качестве антидота при отравлении цианидами (Мерис, 1900). Был получен положительный эффект. Однако неорганические соединения кобальта обладают высокой токсичностью, следовательно малой терапевтической широтой, что делает сомнительной целесообразность их применение в клинической практике. Ситуация изменилась после того, как в опытах на животных была показана эффективность гидроксикобаламина (витамина В12а) для лечения отравлений цианистым калием. Препарат весьма эффективен, мало токсичен, но дорог, что потребовало поиска других соединений. Среди испытанных средств были: ацетат, глюконат-, глутамат-, гистидинат кобальта и кобальтовая соль этилендиаминтетраацетата (ЭДТА). Наименее токсичным и эффективным оказался последний препарат (Paulet, 1952), который и используется в некоторых странах в клинической практике (рис. 31).
Рисунок 31. Взаимодействие Со-ЭДТА с циан-ионом
В нашей стране препараты кобальта в качестве антидотов не применяются.
Метгемоглобинообразователи. Как и прочие метгемоглобинообразователи, антидоты цианидов окисляют двухвалентное железо гемоглобина до трехвалентного состояния.
Как известно, попав в организм, с железом гемоглобина, находящимся в двухвалентном состоянии, цианиды не взаимодействуют, и, проникнув в ткани, связываются с трехвалентным железом цитохромоксидазы, которая утрачивает при этом свою физиологическую активность. Если отравленному быстро ввести в необходимом количестве метгемоглобинообразователь, то образующийся метгемоглобин (железо трехвалентно) будет вступать в химическое взаимодействие с ядами, связывая их и препятствуя поступлению в ткани. Более того, концентрация свободных токсикантов в плазме крови понизится, и возникнут условия для разрушения обратимой связи циан-иона с цитохромоксидазой (рис. 32).
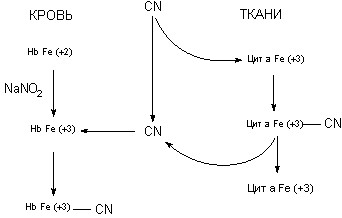
Рисунок 32. Механизм антидотного действия метгемоглобинообразователей (NaNO2) при отравлении цианидами
Образованный комплекс циан-метгемоглобин – соединение непрочное. Через 1-1,5 ч этот комплекс начинает постепенно распадаться. Однако поскольку процесс диссоциации CNMtHb растянут во времени, медленно высвобождающийся циан-ион успевает элиминироваться. Тем не менее при тяжелых интоксикациях возможен рецидив интоксикации.
К числу метгемоглобинообразователей - антидотов цианидов, относят: азотистокислый натрий, амилнитрит, 4-метиламинофенол, 4-этиламинофенол (антициан), метиленовый синий. Следует помнить, что метгемоглобин не способен связываться с кислородом, поэтому необходимо применять строго определенные дозы препаратов, изменяющие не более 25-30% гемоглобина крови.
Наиболее доступным метгемоглобинообразователем является нитрит натрия (NaNO2). Водные растворы препарата готовятся ex tempore, так как при хранении они нестойки. При оказании помощи отравленным нитрит натрия вводят внутривенно (медленно) в виде 1-2% раствора в объеме 10-20 мл.
Амилнитрит предназначен для оказания первой медицинской помощи. Ампулу с амилнитритом, которая находится в ватно-марлевой обертке, следует раздавить и заложить под маску противогаза. При необходимости его можно применять повторно. В настоящее время антидотные свойства препарата склонны объяснять не столько его способностью к метгемоглобинообразованию (которая выражена слабо), сколько усилением мозгового кровотока, развивающегося в результате сосудорасширяющего действия вещества (см. выше «Нитриты. Органические производные»).
Антициан (диэтиламинофенол) является еще одним веществом, которое можно использовать в качестве антидота. При отравлении синильной кислотой первое введение антициана в виде 20% раствора производится в объеме 1,0 мл внутримышечно или 0,75 мл внутривенно. При внутривенном введении препарат разводят в 10 мл 25-40% раствора глюкозы или 0,85% раствора NaCl. Скорость введения 3 мл в минуту. При необходимости через 30 мин антидот может быть введен повторно в дозе 1,0 мл, но только внутримышечно. Еще через 30 мин можно провести третье введение в той же дозе, если к тому есть показания.
Частичным метгемоглобинообразующим действием обладает метиленовый синий (см. выше). Основное же действие этого препарата заключается в его способности активировать тканевое дыхание. Препарат вводят внутривенно в виде 1% раствора в 25% растворе глюкозы (хромосмон) по 50 мл.
Тиосульфат натрия (Na2S2O3). Как уже указывалось, одним из путей превращений цианидов в организме является образование роданистых соединений при взаимодействии с эндогенными серусодержащими веществами. Образующиеся роданиды, выделяющиеся из организма с мочой, примерно в 300 раз менее токсичны, чем цианиды.
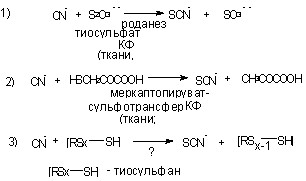
Рисунок 33. Предполагаемые механизмы образования роданистых соединений в организме отравленных цианидами
Истинный механизм образования роданистых соединений до конца не установлен (рис. 33), но показано, что при введении тиосульфата натрия скорость процесса возрастает в 15 - 30 раз, что и является обоснованием целесообразности использования вещества в качестве дополнительного антидота (помимо препаратов, рассмотренных выше) при отравлениях цианидами. Препарат вводят внутривенно в виде 30% раствора по 50 мл. Тиосульфат натрия потенцирует действие других антидотов. Оказание неотложной помощи целесообразно начинать с метгемоглобинообразователей, а затем переходить на введение других препаратов.
В процессе оказания помощи отравленным предусматривается применение и других средств патогенетической и симптоматической терапии. Положительный эффект оказывает гипербарическая оксигенация пораженных.
10.2.3. Разобщители тканевого дыхания
Известны вещества, способные разобщать процессы биологического окисления и фосфорилирования. Такими свойствами обладают, как правило, липофильные соединения, содержащие фенольную группировку в молекуле и являющиеся слабыми органическими кислотами. Наиболее известными и широко используемыми в хозяйственной деятельности представителями группы являются 2,4-динитрофенол (ДНФ), динитро-о-крезол (ДНОК), пентахлорфенол (рис. 34). При авариях на промышленных объектах и других чрезвычайных ситуациях эти вещества могут стать причиной массового поражения людей.
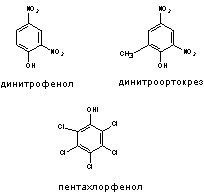
Рисунок 34. Структура некоторых разобщителей процесса окислительного фосфорилирования
In vitro “разобщители” стимулируют скорость потребления кислорода митохондриями и индуцируют активность АТФазы. In vivo в результате их действия значительно активируются процесс биологического окисления и потребления кислорода тканями, однако содержание АТФ и других макроэргов в клетках при этом снижается. Развиваются типичные для отравления веществами общеядовитого действия признаки интоксикации (см. выше). Образующаяся в ходе окисления субстратов энергия рассеивается в форме тепла, температура тела отравленного резко повышается, что является характерным признаком острого отравления “разобщителями”.
10.2.3.1. Динитроортокрезол
Физико-химические свойства. Токсичность
Динитроортокрезол - кристаллическое вещество, относительно легко диспергирующееся в воздухе. Температура плавления +850С. Растворяется в органических растворителях, например бензоле, спирте, хуже - в воде. При заражении территории динитро-орто-крезолом возможно его испарение. Вещество применяется для борьбы с вредителями сельского хозяйства (входит в состав инсектицидов динозал, дитрол, крезонит и т.д.).
Описаны случаи смертельного поражения людей, находившихся в атмосфере, зараженной аэрозолем ДНОК в концентрации около 3 г/м3. При пероральном приеме 3 - 5 мг/кг массы развиваются признаки острого отравления.
Токсикокинетика
Вещество способно проникать в организм ингаляционно (в виде пара и аэрозоля), через желудочно-кишечный тракт с зараженной водой и продовольствием и через неповрежденную кожу. Попав в кровь, распределяется в организме, достаточно легко преодолевая гистогематические барьеры, в том числе и гематоэнцефалический. В печени метаболизирует с образованием нетоксичного амино-орто-крезола.
Основные проявления интоксикации
При контакте вызывает легкое раздражение кожи, слизистой желудочно-кишечного тракта, глаз или дыхательных путей (в зависимости от пути поступления в организм). Выделяют легкую, средней степени тяжести и тяжелую форму отравления. При легкой интоксикации примерно через час после воздействия развиваются признаки общего недомогания: головная боль, вялость, понижение работоспособности, головокружение, тошнота. Характерными проявлениями интоксикации являются выраженная потливость и повышение температуры тела до 380С. Эти нарушения сохраняются в течение суток. При интоксикации средней степени тяжести к описанным явлениям присоединяются одышка, чувство стеснения в груди, учащение пульса. Появляется чувство тревоги, беспокойство, бессонница. Температура тела повышается до 390С. При тяжелом отравлении клиника развивается довольно быстро. Пострадавший испытывает чувство жажды. Отмечается выраженная одышка, нарушение сердечного ритма, повышение артериального давления. Появляется цианоз кожных покровов. Температура тела повышается до 40 - 420С (“тепловой взрыв”). Сознание утрачено, зрачки расширены, развивается судорожный синдром. Смерть может наступить от остановки дыхания или сердечной деятельности.
Механизм токсического действия
Как указывалось, окислительное фосфорилирование – это процесс, при котором энергия, выделяющаяся при постепенном окислении субстратов, запасается в форме макроэргических соединений (главным образом - АТФ). В настоящее время имеется несколько гипотез о механизме поддержания процесса образования АТФ в митохондриях за счет окислительно-восстановительных реакций. Одна из них, химико-осмотическая, предложена Нобелевским лауреатом П. Митчелом. Согласно этой гипотезе, движущей силой процесса фосфорилирования АДФ до АТФ является перманентный протонный градиент (Н+) по обе стороны мембраны митохондрии, поддерживаемый движением электронов и ионов водорода по цепи дыхательных ферментов. “Откачка” протонов из митохондрий за пределы мембраны обеспечивает течение реакции фосфорилирования, иными словами энергетически обеспечивает сдвиг вправо следующего равновесного процесса
АДФ + Н3РО4 ↔ АТФ + Н+ + ОН-
In vitro, без притока энергии, эта реакция практически полностью смещена в сторону образования АДФ (АТФ в растворе немедленно подвергается гидролизу).
По существующим представлениям “разобщители”, будучи липофильными соединениями накапливаются в митохондриальной мембране и за счет относительно легко диссоциирующей группы -ОН облегчают трансмембранный перенос протонов в соответствии с градиентом их концентрации. Вследствие такого повреждения мембраны и увеличения ее проницаемости для протонов, Н+ устремляются во внутренние среды митохондрий, градиент протонов исчезает, синтез макроэргов прекращается. При этом вся энергия запасенная в субстратах, при их биологическом окислении рассеивается в форме тепла.
Мероприятия медицинской защиты
Специальные санитарно-гигиенические мероприятия:
- использование индивидуальных технических средств защиты (средства защиты органов дыхания) в зоне химического заражения;
- участие медицинской службы в проведении химической разведки в районе расположения войск; проведение экспертизы воды и продовольствия на зараженность ОВТВ;
- запрет на использование воды и продовольствия из непроверенных источников.
Специальные профилактические медицинские мероприятия:
- проведение санитарной обработки пораженных на передовых этапах медицинской эвакуации.
Специальные лечебные мероприятия:
- своевременное выявление пораженных;
- применение средств патогенетической и симптоматической терапии состояний, угрожающих жизни, здоровью, дееспособности, в ходе оказания первой (само-взаимопомощь), доврачебной и первой врачебной (элементы) помощи пострадавшим.
- подготовка и проведение эвакуации
Медицинские средства защиты
Оказание помощи пострадавшим направлено на удаление вещества с кожных покровов, из желудочно-кишечного тракта, борьбу с гипертермией, обезвоживанием, нарушением водно-электролитного баланса, профилактику дыхательной и сердечно-сосудистой недостаточности. Помощь оказывается в соответствии с общими принципами (см. раздел “Общие принципы оказание первой, доврачебной и первой врачебной помощи при острых поражениях ОВТВ”). Специфические противоядия отсутствуют.