Медицинская микробиология, вирусология и иммунология: том 2 : учебник / Под ред. В.В. Зверева, М.Н. Бойченко 2010.
|
|
|
|
ГЛАВА 19 ЧАСТНАЯ ПРОТОЗООЛОГИЯ
19.1. Саркодовые (амебы)
Большинство амеб (от греч. amoibe - изменение) обитают в окружающей среде, некоторые виды - в организме человека и животных. Амебы передвигаются с помощью изменяющихся выростов клетки - псевдоподий, а питаются бактериями и мелкими простейшими. Размножаются бесполым способом (делением надвое). Жизненный цикл включает стадию трофозоита (растущая, подвижная клетка) и стадию цисты. Из трофозоита образуется циста, устойчивая к внешним факторам. Попав в кишечник, она превращается в трофозоит.
Различают патогенные и непатогенные амебы. К патогенным амебам относят дизентерийную амебу (Entamoeba histolytica) и свободноживущие патогенные амебы: акантамебы (род Acanthamoeba) и неглерии (род Naegleria). Naegleria fowleri является жгутиконосной амебой. Она вызывает амебный менингоэнцефалит. В толстой кишке человека обитают непатогенные амебы - кишечная амеба (Entamoeba coli), амеба Гартманна (Entamoeba hartmanni), йодамеба Бючли (Iodamoeba buetschlii) и др. Оказалось, что иногда эти амебы могут вызывать за- болевания. Во рту часто обнаруживают ротовую амебу (Entamoeba gingivalis), особенно при заболеваниях полости рта.
19.1.1. Возбудитель амебиаза (Entamoeba histolytica)
Амебиаз - антропонозная болезнь, вызванная амебой Entamoeba histolytica, сопровождающаяся
(в клинически выраженных случаях) язвенным поражением толстой кишки,
частым жидким стулом, тенезмами и дегидратацией (амебная дизентерия), а
также развитием абсцессов в различных органах. Возбудитель открыт в
Морфология. Различают три формы дизентерийной амебы: малую вегетативную, большую вегетативную и цистную (рис. 19.1). Малая вегетативная (просветная) форма Entamoeba histolytica forma minuta имеет размер 15-20 мкм, малоподвижна, обитает в просвете верхнего отдела толстой кишки как безвредный комменсал, питаясь бактериями и детритом. Большая вегетативная форма Entamoeba histolytica forma magna (патогенная, тканевая форма размером около 30 мкм) образуется из малой вегетативной формы, имеет псевдоподии, обладает толчкообразным поступательным движением, может фагоцитировать эритроциты. Обнаруживается в свежих испражнениях при амебиазе. Цистная форма (покоящаяся стадия) представлена цистой диаметром 9-16 мкм. Зрелая циста содержит 4 ядра (у непатогенной Entamoeba coli циста содержит 8 ядер).
Резистентность. Вегетативные формы возбудителя вне организма быстро погибают. Цисты сохраняются в фекалиях и воде при температуре 20 ?С в течение 2 нед. В продуктах питания, на овощах и фруктах цисты сохраняются в течение нескольких дней. При кипячении они погибают.
Эпидемиология. Источник инфекции - человек, т.е. амебиаз является антропонозной болезнью. Механизм передачи амеб фекально-оральный, пути передачи алиментарный, водный и
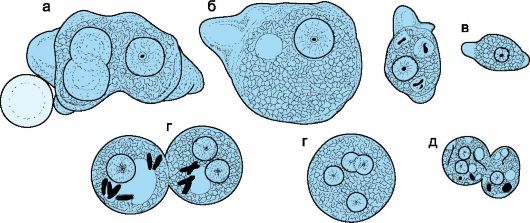
Рис. 19.1. Морфология амеб: а, б - трофозоиты Entamoeba histolitica, один из которых поглощает эритроциты; в - Entamoeba hartmani - трофозоит с пищевой вакуолью; г - цисты с 1, 2 и 4 ядрами; д - двуядерная (слева) и одноядерная (справа) прецисты Entamoeba hartmani
контактно-бытовой. Заражение происходит при занесении цист с продуктами питания, особенно овощами и фруктами, реже с во- дой, через предметы домашнего обихода. Распространению цист способствуют мухи и тараканы. Чаще болеют дети старше 5 лет. Наибольшая заболеваемость наблюдается в регионах тропического и субтропического климата.
Патогенез и клиническая картина. Из цист, попавших в кишечник, образуются просветные формы амеб, которые обитают в толстой кишке, не вызывая заболевания. Просветные формы ведут себя как комменсалы кишечника, питаясь его содержимым, не оказывая вредного воздействия. Такой человек является здоровым носителем E. histolytica, выделяющим цисты. Широко распространено бессимптомное носительство Е. histolytica. При снижении иммунитета организма просветные формы амеб внедряются в стенку кишки и размножаются в виде тканевых форм. Развивается кишечный амебиаз, которому способствуют некоторые представители микрофлоры кишечника. Трофозоиты тканевой формы подвижны за счет формирования псевдоподий. Они проникают в стенку толстой кишки, вызы- вая коагуляционный некроз, способны фагоцитировать эритроциты (эритрофаги, гематофаги), могут обнаруживаться в свежевыделенных фекалиях человека. При некрозе образуются кратерообразные язвы с подрытыми краями. Клинически кишечный амебиаз проявляется в виде частого жидкого стула с кровью («малиновое желе»), сопровождающегося тенезмами, лихорадкой и дегидратацией. В фекалиях обнаруживаются гной и слизь, иногда с кровью.
Внекишечный
амебиаз развивается при проникновении амеб с током крови в печень,
легкие, головной мозг и другие органы. Образуются единичные или
множественные амебные абсцессы размером от едва заметных глазом до
Иммунитет при амебиазе нестойкий. Антитела образуются только к тканевым формам Е. histolytica. Активируется преимущественно клеточное звено иммунитета.
Микробиологическая диагностика. Основным методом является микроскопическое исследование испражнений больного, а также содержимого абсцессов внутренних органов. Мазки окрашивают раствором Люголя или гематоксилином. E. histolytica дифференцируют по цистам и трофозоитам от других кишечных простей-
ших типа E. coli, E. hartmanni, E. polecki, E. gingivalis, Endolimax nana, Iodamoeba buetschlii и др. Антитела к возбудителю выявляют в РНГА, ИФА, непрямой РИФ, РСК и др. Наиболее высокий титр антител в сыворотке крови выявляют при внекишечном амебиазе. Молекулярно-биологический метод (ПЦР) позволяет определять в фекалиях маркерные участки ДНК Е. histolytica.
Лечение. Применяют метронидазол, тинидазол, мексаформ, осарсол, ятрен, дийодохин, делагил, дигидроэмитин и др.
Профилактика. Выявление и лечение цистовыделителей и носителей амеб, а также проведение общесанитарных мероприятий.
19.2. Жгутиконосцы
К жгутиконосцам относятся лейшмании, трипаносомы, лямблии и трихомонады. Они имеют один или несколько жгутиков. У основания жгутика расположен блефаропласт, у некоторых простейших рядом имеется кинетопласт - ДНК-содержащий органоид митохондриального происхождения, способствующий движению жгутика.
19.2.1. Лейшмании (род Leischmania)
Лейшманиозы - протозойные болезни животных и человека, вызываемые лейшманиями и передающиеся москитами; поражаются внутренние органы (висцеральный лейшманиоз) или кожа и слизистые оболочки (кожный, кожно-слизистый лейшманиоз).
Возбудитель кожного лейшманиоза был открыт в
Заболевание у людей вызывают свыше 20 видов лейшманий, инфицирующих млекопитающих: L. donovani-комплекс с 3 видами (L. donovani, L. infantum, L. chagasi); L. mexicana-комплекс с 3 главными видами (L. mexicana, L. amazonensis, L. venesuelensis); L. tropica; L. major; L. aethiopica; подрод Viannia c 4 главными видами [L. (V.) braziliensis, L. (V.) guyanensis, L. (V.) panamensis, L. (V.) peruviana]. Все виды лейшманий морфологически неразличимы. Их дифференцируют с помощью моноклональных антител или молекулярно-генетическими методами.
Характеристика возбудителей. Лейшмании - внутриклеточные паразиты, развивающиеся в макрофагах или клетках ретикулоэн-
дотелиальной системы. Размножаются простым делением. Имеют жгутиковый (промастиготный) и безжгутиковый (амастиготный) циклы бесполого развития.
В жгутиковом цикле паразиты развиваются на питательных средах или в кишечнике москита, зараженного при сосании крови больных людей или животных. В кишечнике москита-амастиготы превращаются в промастиготы (рис. 19.2), размножаются продольным делением и на 6-е сутки накапливаются в глотке москита. Возбудитель имеет удлиненную веретенообразную форму (10- 20x4 мкм). Протоплазма содержит ядро, цитоплазму, зерна волютина и кинетопласт. Жгутик, отходящий от заостренного конца, способствует перемещению лейшманий.
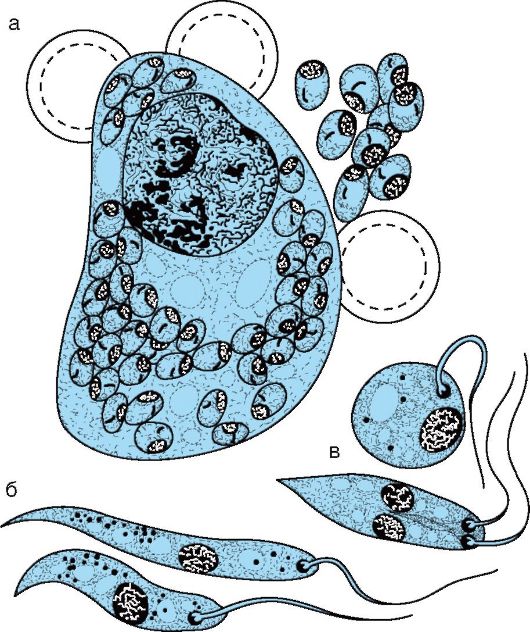
Рис. 19.2. Leishmania donovani: а - большая ретикулоэндотелиальная клетка селезенки с амастиготами; б - промастиготы, наблюдаемые в москитах и при культивировании на питательной среде; в - делящиеся формы
Безжгутиковый цикл проходит в ретикулоэндотелиальных клетках печени, селезенки, лимфатических узлов, в макрофагах инфицированного организма. Паразиты имеют округлую форму (2-5 мкм), без жгутиков; при окраске по Романовскому-Гимзе цитоплазма приобретает серовато-голубой цвет, а ядро и кинетопласт - красновато-фиолетовый.
Культивирование. Лейшмании культивируют на среде NNN (авторы - Николь, Нови, Нил), содержащей агар с дефибринированной кровью кролика. Их можно выращивать на хорионаллантоисной оболочке куриного эмбриона, в культурах клеток или на белых мышах, хомяках и обезьянах.
Эпидемиология. Лейшманиозы распространены в странах теплого и тропического климата. Механизм передачи возбудителей трансмиссивный через укус москитов.
Основными источниками заражения являются: при кожном антропонозном лейшманиозе люди; при кожном зоонозном лейшманиозе песчанки и другие грызуны; при висцеральных лейшманиозах люди (при индийском висцеральном лейшманиозе) или собаки, шакалы, лисы, грызуны (при средиземноморско-среднеазиатском висцеральном лейшманиозе); при кожно-слизистом лейшманиозе грызуны, дикие и домашние животные.
Патогенез и клиническая картина. Антропонозный кожный лейшманиоз вызывает L. tropica. Заболевание имело различные названия: поздно изъязвляющийся лейшманиоз, городская форма, аш- хабадская язва, «годовик». Заболевание чаще встречается в городах и характеризуется длительным инкубационным периодом - от 2-4 мес до 1-2 лет. На месте укуса москитом появляется бугорок, который увеличивается и через 3-4 мес изъязвляется. Язвы чаще располагаются на лице и верхних конечностях, рубцуясь к концу года (отсюда народный термин «годовик»).
Зоонозный кожный лейшманиоз (рано изъязвляющийся лейшманиоз, пендинская язва, сельская форма) вызывает L. major. Заболевание протекает более остро. Инкубационный период составляет 2-4 нед. Мокнущие язвы чаще локализуются на нижних конечностях. Продолжительность болезни 2-6 мес.
Индийский висцеральный лейшманиоз (антропонозный висцеральный лейшманиоз (кала-азар, черная болезнь)) вызывается лейшманиями комплекса L. donovani; встречается в основном в Европе, Азии и Южной Америке. Инкубационный период в среднем
5-9 мес. У больных поражаются селезенка, печень, лимфоузлы, костный мозг и пищеварительный тракт. Развиваются гипергам- маглобулинемия, дистрофия и некроз органов. Из-за поражения надпочечников кожа темнеет, на ней появляются высыпания - лейшманоиды.
Средиземноморско-среднеазиатский висцеральный лейшманиоз (возбудитель L. infantum) имеет сходную клиническую картину, кроме изменений со стороны кожи, которая бледнеет. Инкубационный период от 1 мес до 1 года. Чаще болеют дети.
Бразильский кожно-слизистый лейшманиоз (эспундия) вызывает L. braziliensis; развивается гранулематозное и язвенное поражение кожи носа, слизистых оболочек рта и гортани. Инкубационный период от 2 нед до 3 мес. Изменяется форма носа (нос тапира). Встречается в основном в Центральной и Южной Америке, как и сходные болезни, вызываемые L. mexicana (мексиканский лейшманиоз), L. peruviana (перуанский лейшманиоз), L. panamensis (панамский лейшманиоз) и др.
Иммунитет. У переболевших людей остается стойкий пожизненный иммунитет.
Микробиологическая диагностика. Мазки из бугорков, содержимого язв или пунктатов из органов окрашивают по Романовскому- Гимзе. При микроскопии обнаруживаются внутриклеточно расположенные амастиготы. Чистую культуру возбудителя выделяют на среде NNN: инкубация посева 3 нед при комнатной температуре. Заражают также белых мышей, хомячков. Из серологических методов применяют РИФ, ИФА. Кожно-аллергический тест (тест Монтенегро) на ГЗТ к лейшманину (препарат из убитых промастигот) используют при эпидемиологических исследованиях лейш- маниоза. Он положителен после 4-6 нед заболевания.
Лечение. При системном лечении назначают инъекции препаратов окиси 5-валентной сурьмы - стибоглюконат (пентостам). При кожном лейшманиозе местно применяют мази хлорпромазина, паромомицина или клотримазола.
Профилактика основана на уничтожении больных животных, борьбе с грызунами и москитами. Иммунопрофилактику кожного лейшманиоза осуществляли «прививкой» живой культуры L. major, однако высокая частота осложнений ограничивает ее применение. Этот способ «прививки» предложил русский паразитолог Е.И. Марциновский в начале ХХ века.
19.2.2. Трипаносомы (род Trypanosoma)
Трипаносомы вызывают трансмиссивные болезни - трипаносомозы. Tripanosoma brucei gambiense и Trypanosoma brucei rhodesiense (разновидности T. brucei) вызывают африканский трипаносомоз, или сонную болезнь, а Trypanosoma cruzi - американский трипаносомоз (болезнь Шагаса). Возбудители были открыты в
Характеристика возбудителей. По размерам трипаносомы более крупные (1,5-3x15-30 мкм), чем лейшмании. Они имеют узкую продолговатую форму, жгутик и ундулирующую мембрану (рис. 19.3). Размножаются бесполым путем (продольное деление). Источником инфекции являются домашние и дикие животные, инфицированный человек. Переносчиками африканского трипаносомоза являются кровососущие мухи цеце, а болезни Шагаса - триатомовые клопы. Возбудители имеют различные стадии раз- вития: амастиготы, эпимастиготы, трипомастиготы. Амастиготы имеют овальную форму и не имеют жгутика. Такая стадия характерна для Т. cruzi, обитающей в мышцах и других тканевых клетках человека. Эпимастиготы растут в кишечнике переносчиков и на питательных средах. Жгутик отходит от середины удлиненной клетки (около ядра). Трипомастиготы находятся в крови животных и человека. Жгутик отходит от задней части удлиненной клетки. Ундулирующая мембрана резко выражена.
Патогенез и клиническая картина. Гамбийская форма африканского трипаносомоза, вызываемая Т. gambiense, протекает хронически, а родезийская форма, вызываемая Т. rhodesiense, является более острой и тяжелой формой болезни. В месте укуса переносчиком - мухой цеце - к концу недели развивается изъязвляющаяся
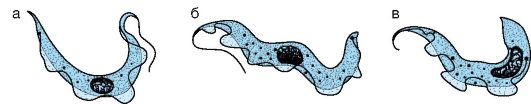
Рис. 19.3. Морфология трипаносом: а, б - трипомастиготы в крови; в - эпимастигота в кишечнике переносчиков
папула (трипаносомный шанкр), откуда размножающиеся паразиты попадают в кровь (паразитемия), где продолжают размножение. Возбудитель обнаруживается также в лимфатических узлах, цере- броспинальной жидкости. Развиваются лихорадка, менингоэнцефалит, сонливость, утомляемость, истощение и нарушения внутренних органов, приводящие к смертельному исходу. Возможно бессимптомное носительство возбудителя. В случае Т. gambiense человек является основным хозяином, а свиньи - дополнительным. Основными хозяевами Т. rhodesiense являются антилопы, крупный рогатый скот, козы и овцы, реже - человек.
Американский трипаносомоз развивается через 1-3 нед после попадания T. cruzi в результате укуса триатомовыми клопами. Возбудитель передается через инфицированные фекалии клопов. В участке внедрения паразита образуется плотный инфильтрат темно-красного цвета. Паразит, попав в кровоток, циркулирует в виде трипомастиготы, которая, внедрившись в тканевую клетку, превращается в безжгутиковую форму - амастиготу, размножающуюся бинарным делением. Клетки, содержащие большое количество амастигот, разрываются, освобождая многочисленные трипомастиготы, которые вторгаются в другие клетки. Болезнь протекает остро или хронически.
У больных развиваются лимфаденит, миокардит, лихорадка. Поражаются ЖКТ, печень, селезенка, головной мозг. Характерен длительный латентный период, вплоть до нескольких десятилетий.
Иммунитет. В ответ на инвазию образуются в большом количестве IgM-антитела. В хронической фазе преобладают IgG-антитела. Трипаносомы способны образовывать новые антигенные варианты, изменяющие иммунный ответ. Развиваются аутоиммунные процессы.
Микробиологическая диагностика. Мазки из крови, пунктата шейных лимфатических узлов, цереброспинальной жидкости красят по Романовскому-Гимзе или по Райту. Для выделения возбудителя можно заражать белых мышей или крыс, а также делать посев на питательные среды с кровью. При серологическом методе с помощью ИФА, РСК или непрямой РИФ определяют IgM- антитела.
Лечение. Для лечения африканского трипаносомоза назначают сурамин или пентамидин, а при поражении ЦНС - меларсопрол.
Лечение американского трипаносомоза возможно только в острой фазе бензнидазолом или нифуртимоксом.
Профилактика неспецифическая. Ликвидируют места выплода переносчиков возбудителя, уничтожают инфицированных животных. Выявляют и лечат инфицированных лиц. Применяют репелленты и защитную одежду.
19.2.3. Лямблии, или жиардии (род Lamblia, или Giardia)
Лямблиоз (жиардиоз) - болезнь, вызванная Lamblia intestinalis (Giardia lamblia), протекающая
в латентной или манифестной форме в виде дисфункции кишечника с
явлениями энтерита. Возбудитель открыт Д.Ф. Лямблем в
Характеристика возбудителя. Вегетативная клетка лямблий плоская грушевидной формы (5-10x9-20 мкм), содержит два ядра (рис. 19.4) и 4 пары жгутиков. Лямблии размножаются путем продольного деления. Они прикрепляются к эпителиоцитам кишечника с помощью присасывательного диска и за счет адгезии микровыростов плазмолеммы трофозоита. Обитают лямблии в верхних отделах кишечника, а в менее благоприятных нижних отделах кишечника образуют овальные четырехядерные цисты (6-10x12- 14 мкм), окруженные толстой двухконтурной оболочкой.
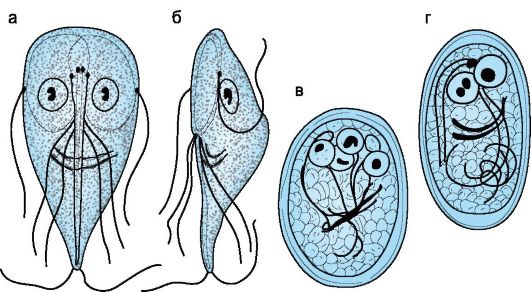
Рис. 19.4. Giardia lamblia. Вегетативные формы: а - спереди; б - сбоку; в, г - цисты
Резистентность. Цисты лямблий устойчивы к низким температурам и хлорированной воде. Мгновенно погибают при кипячении. В почве и воде они сохраняются более 2 мес.
Эпидемиология. Источником инфицирования цистами являются люди, реже собаки, крупный рогатый скот, бобры, ондатры, олени. Механизм заражения фекально-оральный: через загрязненные воду, пищу, руки и предметы обихода. Возможны водные вспышки диареи.
Патогенез и клиническая картина. Лямблии обитают в двенадцатиперстной и тощей кишке. Размножаясь в большом количестве, они блокируют слизистую оболочку, нарушая пристеночное пищеварение и моторику кишечника. Развитие лямблиоза зависит от степени резистентности организма. Лямблии могут вызывать диарею, энтероколиты и нарушения обмена веществ. Возможно развитие гастроэнтероколитического, холецистопанкреатического и астенического синдромов.
Микробиологическая диагностика. В мазках из кала выявляют цисты (окраска раствором Люголя). При диарее и дуоденальном зондировании в нативных препаратах обнаруживают вегетативные формы (трофозоиты). Типичным является их движение в виде падающего листа. Серологическим методом возможно определение нарастания титра антител в ИФА и непрямой РИФ.
Лечение. Применяют метронидазол, тинидазол, фуразолидон.
Профилактика сходна с таковой при амебиазе. Важно соблюдать правила личной гигиены.
19.2.4. Трихомонады (род Trichomonas)
Трихомоноз - антропонозная болезнь, вызываемая мочеполовой трихомонадой (Trichomonas vaginalis); сопровождается поражением мочеполовой системы. Другая трихомонада - кишечная - называется Pentatrichomonas (Trichomonas) hominis. Она вызывает у ослабленных лиц кишечный трихомоноз - антропоноз в виде колита и энтерита. Различают также ротовую трихомонаду (T. tenax), являющуюся комменсалом рта.
Характеристика возбудителя. Trichomonas vaginalis существует только как трофозоит, размножается делением. Цист не образует. Имеет грушевидную форму, размер 8-40x3-14 мкм. Пять жгутиков расположены на переднем конце клетки. Один из них соединен с
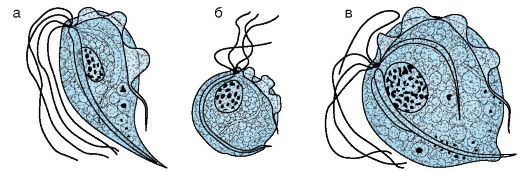
Рис. 19.5. Trichomonas vaginalis: а - нормальный трофозоит; б - округлая форма после деления; в - форма, наблюдаемая после окраски препарата
клеткой ундулирующей мембраной, доходящей до середины клетки. Через клетку проходит осевая нить (гиалиновый аксостиль), выходящая из заднего конца клетки в виде шипа (рис. 19.5). Цитостом (клеточный рот) имеет вид небольшой щели на передней части тела. Размножается продольным делением.
Резистентность. В окружающей среде быстро погибает, на губках и мочалках сохраняется 10-15 мин, а в слизи, сперме и моче -
24 ч.
Эпидемиология. Источником инвазии является человек. Заболевание передается половым путем, через родовые пути (младенцу), редко через предметы личной гигиены. Инкубационный период 7-10 дней, иногда 1 мес.
Патогенез и клиническая картина. Trichomonas vaginalis, прикрепляясь к слизистой оболочке, вызывает вагинит, уретрит, простатит. Воспалительный процесс сопровождается болью, зудом, гнойно-серозными выделениями. Возбудитель может фагоцитировать гонококки, хламидии и другие микробы, что осложняет патологический процесс. Часто трихомонада вызывает бессимптомную инфекцию.
Микробиологическая диагностика. Трихомонады выявляют микроскопическим методом в нативных и окрашенных мазках из свежей капли вагинальных выделений, отделяемого мочеиспускательного канала, секрета предстательной железы или осадка мочи. Мазки окрашивают метиленовым синим или по Романовскому-Гимзе. При фазово-контрастной или темнопольной микроскопии натив-
ных препаратов наблюдается подвижность трихомонад. Нативный препарат готовят на предметном стекле, смешивая отделяемое с каплей теплого изотонического раствора хлорида натрия. Мазки накрывают покровным стеклом и микроскопируют (увеличение x400). Трихомонады обладают характерными толчкообразными движеними ундулирующей мембраны и жгутиков. По размеру они более мелкие, чем клетки эпителия, но крупнее лейкоцитов. Могут встречаться крупные атипичные амебовидные формы трихомонад. Ведущим методом диагностики хронических форм заболевания является выращивание трихомонад на питательных средах, например СКДС (солевой раствор с гидролизатами казеина, дрожжей и с мальтозой). Помогает диагностике серологический метод с применением ИФА или непрямой РИФ. Ставят также ПЦР.
Лечение. Применяют орнидазол, ниморазол, метронидазол, ти- нидазол.
Профилактика, как при венерических заболеваниях. Профилактику у женщин можно проводить вакциной солкотривак, которую готовят из Lactobacillus acidophilus.
19.3. Споровики
Среди споровиков имеются кровяные паразиты (плазмодии малярии и бабезии), кишечные и тканевые паразиты (токсоплазмы, криптоспоридии, саркоцисты, изоспоры и циклоспоры).
19.3.1. Плазмодии малярии (род Plasmodium)
Малярия - антропонозная болезнь, вызываемая простейшими рода Plasmodium; сопровождется приступами лихорадки, анемией, увеличением печени и селезенки. У человека малярию вызывают 4 вида: Plasmodium vivax, Plasmodium ovale, Plasmodium malariae и Plasmodium falciparum. Впервый возбудитель малярии (P. malariae) был обнаружен в
Характеристика возбудителей. Жизненный цикл плазмодиев происходит со сменой хозяев: в комаре рода Anopheles (окончательный хозяин) осуществляется половое размножение, или спорогония (образование вытянутых клеток - спорозоитов), а в организме человека (промежуточный хозяин) происходит бесполое размножение - шизогония, точнее мерогония, при которой образуются мелкие клетки, называемые мерозоитами.
Спорозоиты, проникнув из слюнных желез комара в кровоток, быстро попадают в клетки печени (гепатоциты), где проходит первый этап размножения - тканевая (экзоэритроцитарная) шизогония. Она протекает бессимптомно. В гепатоцитах спорозоиты превращаются в тканевые трофозоиты (растущие клетки), которые переходят в стадию тканевых шизонтов (делящихся клеток). Тканевые шизонты делятся (меруляция) с образованием тканевых мерозоитов, поступающих в кровь. Из одного спорозоита образуется 2000-40 000 тканевых мерозоитов (микромерозоитов). Мерозоиты попадают в кровь и внедряются с помощью эндоцитоза в эритроциты, в которых совершается несколько циклов эритроцитарной шизогонии. Из мерозоита в эритроците развиваются трофозоит - растущая форма паразита: кольцевидный юный трофозоит, полувзрослый, взрослый трофозоит. Они содержат желтовато-коричневые гранулы, образующиеся из гемоглобина эритроцитов. Взрослый трофозоит превращается в многоядерный шизонт, из которого образуются от 6 до 24 мерозоитов (в зависимости от вида плазмодия), внедряющихся затем в другие эритроциты. Этот процесс повторяется многократно.
Продолжительность цикла развития в эритроцитах у P. vivax, P. ovale, P. falciparum составляет 48 ч, у Р. malariae - 72 ч. В некоторых эритроцитах мерозоиты дают также начало образованию половых незрелых форм - мужских и женских гамет (гамонтов, гаметоцитов). Гаметы имеют овальную форму, кроме бананообразных гамет P. falciparum. С началом эритроцитарной шизогонии размножение возбудителей в печени прекращается, кроме P. vivax и Р. ovale, у которых часть спорозоитов (дремлющие, так называемые гипнозоиты, или брадизоиты) остается в гепатоцитах на недели или месяцы, что обусловливает появление поздних, отда- ленных рецидивов болезни. При укусе больного малярией самкой комара в ее желудок вместе с кровью попадают незрелые половые формы возбудителя. В комаре начинается гаметогония. Гамонты дозревают и оплодотворяются, образуя зиготу, превращающуюся в удлиненную подвижную форму - оокинету. Оокинета проникает через стенку желудка и образует на наружной поверхности желудка ооцисту, в которой завершается спорогония с образованием до 10 000 спорозоитов. Часть спорозоитов (2%) затем попадает с током гемолимфы в слюнные железы переносчика. Различные виды возбудителя вызывают болезнь с отличающимися клинической картиной и морфологическими изменениями в мазках крови.
P. vivax - возбудитель трехдневной малярии, открыт в
P. ovale - возбудитель малярии типа трехдневной, открыт в
P. malariae - возбудитель четырехдневной малярии открыт в
P. falciparum - возбудитель тропической малярии, открыт в
Эпидемиология. Источником инфекции является человек (больной или паразитоноситель). Основной механизм заражения трансмиссивный через укус самки комаров рода Anopheles. Возможен парентеральный путь передачи при гемотрансфузии и использовании необеззараженных медицинских инструментов. Восприимчи-
вость людей высокая. Малярией болеют сотни милионов людей, живущих в странах тропического и субтропического климата: в тропиках основной возбудитель - Р. falciparum; спорадически - Р. ovale; в регионах умеренного климата малярию чаще вызывает Р. vivax, реже - Р. malariae. Очаги малярии имеются в южных регионах России.
Патогенез и клиническая картина. Инкубационный период при малярии колеблется от недели до года (при трехдневной малярии до 20 мес) и заканчивается с момента появления паразитов в крови. Клинические проявления связаны с эритроцитарной шизогонией. Малярии свойственно приступообразное течение: озноб с сильной головной болью сменяется подъемом температуры до 39-40 ?С и выше, после чего происходит быстрое снижение температуры с обильным потоотделением и выраженной слабостью. Приступы могут быть ежедневными или повторяться через 1-2 дня и приводить при длительном течении к поражению печени, селезенки и почек. Приступ малярии вызван выбросом пирогенных веществ из разрушенных эритроцитов, мерозоитов и продуктов их метаболизма. Длительность течения нелеченой трехдневной малярии может достигать 3 лет, а тропической малярии - до 1,5 лет. У больных, особенно нелеченных, могу развиваться рецидивы. Эритроцитарные рецидивы возникают в результате усиленного размножения сохранившихся эритроцитарных форм паразитов. Экзоэритроцитарные рецидивы связаны с активацией в печени дремлющих тка- невых форм паразита, называемых гипнозоитами. Эти рецидивы могут быть только при малярии, вызванной P. vivax или Р. ovale.
Наиболее тяжело протекает тропическая малярия, при которой плазмодии P. falciparum размножаются в эритроцитах (любого возраста) мелких сосудов внутренних органов, вызывая внутрисосудистый гемолиз, закупорку капилляров, гемоглобинурийную лихорадку. Этот процесс усиливается в результате иммунопатологического гемолиза неинфицированных эритроцитов. Нарушение микроциркуляции крови и гемолиз приводят к поражению мозга (малярийная кома), развитию острой почечной недостаточности. Летальность около 1%.
Иммунитет. При заболевании формируется нестойкий видо- специфический, стадиоспецифический, нестерильный иммунитет. Возможны повторные заболевания. Из-за антигенной изменчивости и наличия разных стадий развития паразита существует
феномен иммунологического уклонения. Антитела способствуют фагоцитозу пораженных эритроцитов и мерозоитов. Повышенный уровень противомалярийных IgG-антител месяцами и годами сохраняется после заболевания. Внутриклеточно расположенные формы паразита уничтожаются факторами клеточного иммунитета. Естественную резистентность отмечают у лиц, в эритроцитах которых нет антигенов группы Duffy, а также у людей с врожденным дефицитом глюкозо-6-фосфатдегидрогеназы, с гемоглобинопатиями (например, при серповидно-клеточной анемии).
Микробиологическая диагностика. Диагностика основана на микроскпическом исследовании препаратов крови: «толстой капли» и мазков из крови, окрашенных по Романовскому-Гимзе или по Райту, и обнаружении различных форм возбудителя (красное ядро, голубая цитоплазма). Препарат «толстая капля» окрашивают без предварительной фиксации, поэтому эритроциты разрушаются и паразиты выходят из них. Таким образом, возможность обнаружения возбудителя значительно повышается. Если паразиты не обнаружены в крови, взятой на высоте лихорадки, то через каждые 8 ч повторяют исследование мазков крови. При исследовании на P. falciparum анализы следует повторять каждые 6 ч. В препаратах крови с неосложненной тропической малярией обнаруживаются только кольцевидные трофозоиты, а через 1-2 нед выявляются гамонты полулунной формы; шизонты развиваются в капиллярах внутренних органов.
Для обнаружения ДНК паразита в крови используют ДНКгибридизацию и ПЦР. В серологическом методе применяют не- прямую РИФ, РПГА, ИФА.
Лечение. К основным противомалярийным препаратам относятся: хинин, мефлохин, хлорохин, акрихин, примахин, бигумаль, пириметамин и др. Противомалярийные препараты оказывают различное действие на бесполые и половые стадии плазмодиев. Различают препараты шизонтоцидного (гисто- и гематошизонто- тропного), гамонтотропного и спорозоитотропного действия.
Профилактика направлена на источник возбудителя (выявление и лечение больных малярией и паразитоносителей), а также на уничтожение переносчиков возбудителя - комаров. В неблагополучных регионах проводится индивидуальная химиопрофилактика разными препаратами: мефлохином (при риске заражения хлорохинустойчивыми штаммами Р. falciparum), саварином (комбинация
прогуанила и хлорохина), хлорохином и примахином. Разрабатываются генно-инженерные вакцины против различных стадий развития паразита (антиспорозоитная, антимерозоитная, антигамонтная).
19.3.2. Бабезии (род Babesia)
Бабезиоз (пироплазмоз) - болезнь человека и животных, вызванная простейшими рода Babesia, напоминающая у человека малярию (озноб, лихорадка и гемолитическая анемия). В США бабезиоз чаще вызывается B. microti (паразит грызунов), а в Европе - B. divergens.
Характеристика возбудителей. Бабезии являются внутриклеточными паразитами эритроцитов. Иногда они находятся в лейкоцитах и плазме крови. Они внешне похожи на юные кольцевидные формы плазмодиев. Чаще размножаются парами (несинхронное почкование) по периферии эритроцита. В эритроците они распо- лагаются в виде тетрад из трофозоитов. Имеют округлую, грушевидную форму, размер 2-3 мкм; иногда принимают кольцевидную форму с двумя ядрами, напоминая Plasmodium falciparum.
Эпидемиология. Бабезии - паразиты домашних и диких животных, передаются иксодовыми и аргасовыми клещами. У клещей возможна трансовариальная передача. Хозяева паразита: мышиполевки и другие грызуны, собаки, кошки и крупный рогатый скот. Человек заражается редко. Возможно инфицирование чело- века через перелитую кровь.
Патогенез. Инкубационный период около 2-4 нед. Паразиты могут поражать до 10-15% эритроцитов с развитием гемоглобинурии и летальным исходом.
Клиническая картина. Заболевание
протекает обычно бессимптомно. Наиболее тяжело и чаще заболевание
развивается у людей с недостаточностью селезенки и после спленэктомии.
Первый случай болезни у человека был описан в Югославии в
Микробиологическая диагностика. Используют микроскопический метод исследования мазка или «толстой капли» крови, окрашенных по Романовскому-Гимзе: цитоплазма бабезий окра-
шивается в голубой цвет, а ядро - в красный. Характерно расположение паразита в эритроците в виде тетрад из трофозоитов. В серологическом методе (непрямой метод РИФ, ИФА) антитела в диагностических титрах можно выявить через 3-8 нед от начала болезни. Однако коммерческие тест-системы находятся в стадии разработки.
Лечение. Рекомендуется комбинация хинина с клиндамицином.
Профилактика. Проводятся борьба с переносчиками-клещами и защита от них.
19.3.3. Токсоплазмы (род Toxoplasma)
Токсоплазмоз - зоонозная болезнь, вызванная простейшими рода Toxoplasma, сопровождающаяся
паразитемией и поражением ЦНС, печени, почек, легких, сердца, мышц и
глаз (хориоретинит). У человека заболевание протекает хронически, часто
бессимптомно. Возбудитель - Toxoplasma gondii, выделен в
Характеристика возбудителей. Toxoplasma gondii является облигатным внутриклеточным паразитом, жизненный цикл которого включает морфологические формы в виде ооцист, псевдоцист, цист и тахизоитов.
Ооцисты образуются при половом размножении паразита в клетках слизистой оболочки кишечника кошки и представителей семейства кошачих - окончательных хозяев токсоплазм: разнополые гаметоциты сливаются с образованием ооцисты овальной формы (диаметр 10-12 мкм). Ооцисты содержат по 2 спороцисты, каждая из которых содержит по 4 спорозоита размером 8-2 мкм. Ооцисты выделяются с фекалиями кошки и через 3 дня созревают в окружающей среде. Попав в кишечник человека (например, с немытыми овощами и фруктами), они освобождают спорозоиты, которые распространяются по лимфатическим сосудам, размножаются внутриклеточно бесполым путем (шизогония). Размножившиеся паразиты (тахизоиты) внедряются затем в другие клетки. Они обнаруживаются при острой стадии инфекции.
Тахизоиты (трофозоиты) образуются при размножении спорозоитов в эпителиальных клетках. Они имеют характерную форму
апельсиновой дольки или полумесяца (4-7x1,5-2 мкм) с закругленным задним концом. При окраске по Романовскому-Гимзе цитоплазма голубого, а ядро рубиново-красного цвета. Часто тахизоиты скапливаются по 10-30 особей в клетках лимфатических узлов, печени и в макрофагах легких. В клетках они окружены мембраной паразитоформной вакуоли, представляя собой псевдоцисты. Псевдоцисты не имеют оболочки; они образуются в пораженных клетках, макрофагах и содержат скопления трофозоитов (эндозоитов). Обнаруживаются, как и тахизоиты, при острой инфекции.
Цисты (размер 10-1000 мкм) также образуются внутри клеток хозяина. Они имеют плотную оболочку и содержат более сотни паразитов (брадизоиты, или цистозоиты). Цисты сохраняются десятилетиями (хроническая инфекция). Тахизоиты и брадизоиты, кроме общих антигенов, имеют отличающиеся антигены: брадизоиты имеют антигены SAG4(p18) и BSR4(p36), а тахизоиты - SAG1, SAG2 и др.
Культивирование.Токсоплазмы культивируют в куриных эмбрионах и на культурах тканей, а также путем заражения белых мышей и других животных.
Резистентность. Ооцисты могут в течение года сохранять жиз- неспособность в окружающей среде. Токсоплазмы быстро погибают при 55 ?С, высокочувствительны к 50% спирту, 5% раствору NH4OH.
Эпидемиология. Заболевание распространено повсеместно, но чаще встречается в теплых регионах с влажным климатом, с большим распространением кошек. Люди заражаются алиментарным путем через пищу и воду, содержащих ооцисты, выделяемых кошками, или при употреблении недостаточно термически обра- ботанных мяса, молока, яиц, содержащих псевдоцисты и цисты. Животные и человек также могут заражаться через пищу и воду, содержащих ооцисты, выделяемые кошками. Реже токсоплазмы попадают контактным (через поврежденную кожу и слизистые оболочки) или воздушно-пылевым путем. При врожденном токсоплазмозе возбудитель проникает в плод через плаценту. Иногда заражение происходит в результате гемотрансфузии, трансплантации органов.
Патогенез и клиническая картина. Токсоплазмы попадают в тонкую кишку, достигают с током лимфы регионарных лимфоузлов,
размножаются в них (тахизоиты), проникают в кровь, распространяются по всем органам, попадая в клетки ретикулоэндотелиальной системы органов, где образуют псевдоцисты и цисты. Первоначальная инфекция (в том числе у беременных) бессимптомная в 90% случаев. У 10% клинические проявления неспецифичны: увеличиваются затылочные лимфатические узлы, может быть миалгия, иногда развиваются миокардит, гепатит, пневмония или энцефалит. Токсоплазмы поражают нервные клетки, печень, почки, легкие, сердце, мышцы, глаза. При острой фазе инвазии наблюда- ются паразитемия и скопления токсоплазм в тканях в виде псевдоцист. Хроническая фаза инвазии характеризуется образованием тканевых цист.
Инкубационный период составляет около 2 нед. Клинические проявления разнообразны: от умеренной лимфаденопатии до ли- хорадки, сыпи, гепатоспленомегалии, фарингита, менингоэнцефалита, пневмонии и др. Они зависят от локализации возбудителя и поражаемого органа. При инфицировании беременной (чаще в I триместр беременности), особенно при развитии паразитемии, возможны плацентит, инвазия токсоплазмами плода и его гибель или самопроизвольный выкидыш, рождение детей с дефектами развития. Поражаются селезенка, печень, лимфоузлы, ЦНС на фоне выраженной интоксикации и лихорадки. Развиваются хориоретинит, энцефаломиелит, гидроцефалия и микроцефалия.
Иммунитет нестерильный. При заболевании развивается клеточный и гуморальный иммунитет. Развивается аллергия (ГЗТ). При врожденном токсоплазмозе в крови матери и ребенка выявляется высокий уровень специфических антител.
Микробиологическая диагностика. Микроскопируют мазки из биоптатов, биологических жидкостей (кровь, цереброспинальная жидкость, пунктаты лимфоузлов, плодных оболочек и др.), окрашенных по Романовскому-Гимзе или по Райту.
Серологический метод является основным в диагностике токсоплазмоза: появление IgM-антител свидетельствует о ранних сроках заболевания; уровень IgG-антитела достигает максимума на 4-8-й нед болезни. Применяются ИФА, РИФ, РНГА, РСК, а также реакция Сейбина-Фельдмана, или красящий тест (при этом методе возбудитель, в зависимости от свойств антител исследуемой сыворотки крови, по-разному окрашивается метиленовым синим). Используют также аллергологический метод - внутрикожную про-
бу с токсоплазмином, которая положительна с 4 нед заболевания и далее в течение многих лет. Биологический метод применяется реже; после парентерального введения мышам инфицированного материала (кровь, цереброспинальная жидкость, биоптаты органов и тканей) они погибают через 7-10 дней. Токсоплазмы можно культивировать на клетках HeLa или на 7-8-дневных куриных эмбрионах. Возможно применение ПЦР.
Лечение. Наиболее эффективна комбинация пириметамина с сульфаниламидами. При беременности рекомендуется вместо пириметамина применять спирамицин, который не проходит через плаценту.
Профилактика. Для профилактики врожденного токсоплазмоза следует обследовать на антитела женщин, планирующих беременность. Осуществляется неспецифическая профилактика токсоплазмоза, включающая соблюдение правил личной гигиены, в частности мытье рук перед едой; необходима тщательная термическая обработка мяса. Следует избегать общения с животными семейства кошачьих. Имеет также значение уничтожение грызунов, мух и тараканов - потенциальных механических переносчиков ооцист.
19.3.4. Криптоспоридии (род Cryptosporidium)
Криптоспоридиоз - болезнь, вызванная простейшими рода Cryptosporidium (главным образом C. parvum), сопровождающаяся поражением слизистых оболочек кишечника, гастроэнтеритом и диареей.
Характеристика возбудителей. Криптоспоридии распространены среди млекопитающих, птиц, рептилий и рыб. Паразит размножается половым (гаметогония) и бесполым (шизогония) путями в ЖКТ животных. В кишечнике хозяина образуются ооцисты (диа- метр 4-6 мкм), которые выделяются с фекалиями. После заглатывания ооцист в тонкой кишке из них высвобождаются 4 червеобразных спорозоита, которые прикрепляются к эпителиоцитам, окружаясь мембранами клеток с образованием внутриклеточной паразитоформной вакуоли. Затем спорозоиты превращаются во внутриклеточные трофозоиты. Трофозоиты размножаются путем множественного деления (шизогония, или мерогония) с образованием из многоядерной клетки - меронта (шизонта) 8 мерозоитов,
которые, попадая в просвет кишки, прикрепляются к эпителиоцитам, повторяя новый цикл бесполого размножения. Затем цикл шизогонии повторяется с выходом из эпителиальной клетки новых мерозоитов, которые превращаются в половые формы - гаметы. После оплодотворения образуется зигота, превращающаяся в ооцисту, покрытую плотной оболочкой. В ооцисте образуются спорозоиты (споруляция). Ооцисты имеют толстую оболочку и, выживая в окружающей среде, способны заразить нового хозяина. Некоторые (тонкостенные) ооцисты высвобождают в просвете кишечника спорозоиты, дающие начало новому циклу мерогонии (аутосуперинвазия).
Резистентность. Ооцисты сохраняются в окружающей среде несколько месяцев и резистентны к дезинфицирующим веществам, хлорированию воды, озону. Они чувствительны к 10% формалину, 5% раствору аммиака и температуре (погибают при 65 ?С).
Эпидемиология. Люди
и животные заглатывают ооцисты с пищей или водой. Источником инфекции
служат люди или животные (кошки, собаки, ягнята, поросята, телята,
кролики, грызуны, птицы). Криптоспоридии передаются фекально-оральным
механизмом, при контакте, иногда аэрогенным механизмом. Криптоспоридии
частично разрушают ворсинки эпителиоцитов и вызывают нарушения
всасывания жидкости в кишечнике с развитием водянистой диареи. Первый
случай криптоспоридиоза у человека был описан в
Клиническая картина. Инкубационный период колеблется от 2-7 дней до 2 нед. Клинические проявления разнообразны: от острой диареи с тошнотой и болями в животе до хронических поражений ЖКТ. При извращенных контактах у гомосексуалистов возбудитель попадает не только в пищеварительный тракт, но и в дыхательную систему партнера.
Микробиологическая диагностика. Ооцисты обнаруживают микроскопическим методом в фекалиях, иногда в мокроте, бронхиально-альвеолярном лаваже или в биоптатах кишечника и др. Для этого мазки красят в модификации по Цилю-Нильсену (кислотоустойчивые ооцисты красного цвета, другая микрофло-
ра синего или зеленого цвета) или по Романовскому-Гимзе. Возможны применение ПЦР и выявление антигенов криптоспоридий в кале и бронхиально-альвеолярном лаваже с помощью ИФА и
РИФ.
Лечение симптоматическое. Возможно применение аромомицина.
Профилактика. Проводят общегигиенические мероприятия. Це- лесообразна также обработка против ооцист в животноводческих фермах, больницах и детских учреждениях. Для задержки простейших воду рекомендуется фильтровать через системы, задерживающие частицы размером 1 мкм и менее. Положительный эффект дает обработка воды УФ-лучами или озоном.
19.4. Реснитчатые
Реснитчатые представлены балантидиями, которые поражают толстую кишку человека (балантидиазная дизентерия). Они имеют реснички - органоиды движения, покрывающие клетку и клеточный рот (цитостом), два ядра (макро- и микронуклеус).
19.4.1. Балантидии (род Balantidium)
Балантидиаз (дизентерия инфузорная) - зоонозная болезнь, вызываемая Balantidium coli, характеризующаяся общей интоксикацией и язвенным поражением толстой кишки. Возбудитель открыт в
Характеристика возбудителя. Паразит распространен широко, являясь обитателем кишечника свиней (основной источник инвазии), обезьян, грызунов, собак и крупного рогатого скота, однако редко вызывает заболевание. Он имеет вегетативную и цистную стадии развития. В вегетативной стадии клетка паразита (трофозоит) овальная, крупная (30-100x30-50 мкм), с ресничками; на переднем конце имеется щелевидное отверстие - перистом с ротовым отверстием - цитостомом. Края цитостома покрыты более длинными ресничками. Задний конец имеет анальную пору - цитопрокт. Клетка содержит крупное бобовидное ядро - макронуклеус, микронуклеус, пищевые и сократительные вакуоли. Размножение - поперечным делением и половым путем (конъюгацией между большими и малыми формами паразита). Клетка может за-
глатывать микробы и другие клетки, в том числе форменные элементы крови.
Цисты - округлые, диаметром 40-65 мкм, с толстой оболочкой, через которую просматривается ядро. Они попадают в окру- жающую среду с фекалиями и длительно в ней сохраняются. Заражение цистами происходит фекально-оральным механизмом через рот с загрязненной водой и пищей. Балантидии могут длительно существовать в кишечнике человека, не оказывая болезнетворных воздействий. Часто развивается бессимптомная инфекция. Пато- генез сходен с таковым при амебиазе. Простейшие продуцируют гиалуронидазу, способствующую проникновению паразита в ткани кишки. При определенных условиях развивается колит, возникают язвы и абсцессы в толстой кишке.
Микробиологическая диагностика. Для микроскопии каплю свежего жидкого кала помещают в изотонический раствор хлорида натрия и многократно исследуют препарат «раздавленная капля» под малым увеличением микроскопа, наблюдая активное движение крупных балантидий. Цисты в кале человека выявляются редко.
Лечение. Применяют метронидазол, окситетрациклин и другие препараты, назначаемые при амебиазе.
Профилактика. Соблюдение правил личной гигиены, особенно для работников свиноводства. Предупреждение загрязнения окружающей среды калом свиней и других животных.
19.5. Микроспоридии (тип Microspora)
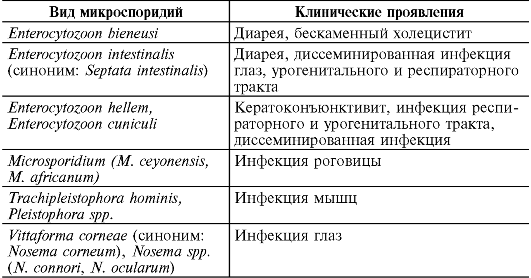
Микроспоридии вызывают микроспоридиоз в виде хронической диареи, гнойно-воспалительных заболеваний, кератита, дис- семинированной инфекции у иммунодефицитных лиц (табл. 19.1). Они широко распространены среди животных, которые выделяют резистентные споры с калом и мочой. Микроспоридии не имеют четкого таксономического положения и относятся к типу Microspora. Описано 140 родов и около 1300 видов микроспоридий. Патогенные для человека виды представлены 8 родами (Enterocytozoon, Encephalitozoon, Nosema, Pleistophora, Vittaforma, Microspoidium, Brachiola, Trachipleistophora) и неклассифицированными микроспоридиями.
Таблица 19.1. Поражения, вызываемые микроспоридиями
Характеристика возбудителей. Микроспоридии - мелкие (0,5- 2,5 мкм) округлые примитивные эукариотические микроорганизмы с чертами простейших и грибов. Являются облигатными внутриклеточными паразитами. Обычно инфицирование происходит фекально-оральным механизмом в результате заглатывания спор, которые проходят в двенадцатиперстную кишку. Спора содержит спороплазму с ядром и выталкивающим аппаратом, который состоит из полярной трубки, поляропласта, полярного диска и задней вакуоли. При контакте с клеткой полярная трубка выбрасывается, пробивая стенку клетки хозяина, и по ней внутрь клетки впры- скивается спороплазма. Микроспоридии размножаются в клетке путем повторных делений надвое (мерогония) и спорообразования (спорогония). Паразиты размножаются при прямом контакте с цитоплазмой клетки-хозяина (например, E. bieneusi) или внутри паразитоформной вакуоли (например, E. intestinalis). В обоих случаях в результате спорогонии созревают споры. Вокруг споры формируется плотная стенка, обеспечивающая устойчивость к окружающей среде. Споры выходят из клетки при ее разрушении. Созревшие споры вновь инфицируют новые клетки, повторяя цикл развития. Развивается локальное воспаление. После спорогонии зрелые споры, содержащие спороплазму, выделяются в окружающую среду. Споры (грамположительные кислотоустойчивые) имеют размеры от 0,8 до 1,4 мкм у E. bieneusi и от 1,5 до 4 мкм у Enterocytozoon spp.
Эпидемиология. Микроспоридии широко распространены среди беспозвоночных и позвоночных животных, выделяясь в виде спор с калом и мочой. Они передаются фекально-оральным механизмом. Возможно инфицирование через респираторный тракт и контактным путем (при конъюнктивитах).
Клиническая картина. Микроспоридии Enterocytozoon bieneusi и Enterocytozoon intestinalis (ранее Septata intestinalis) вызывают хроническую диарею у больных СПИДом и гнойно-воспалительные процессы (синусит, бронхит, пневмонию, нефрит, уретрит, цистит и др.) у людей с иммунодефицитами. Другие микроспоридии - Encephalitozoon hellem, Nosema ocularum и Vittaforma corneae (ранее Nosema corneum) вызывают кератит и диссеминированные инфекции. Диссеминированные инфекции, вызванные Encephalitozoon hellem, Nosema connori, Encephalitozoon cuniculi и Pleistophora spp., а также миозит, вызванный Nosema-подобными и другими микроспоридиями, описаны у иммунодефицитных лиц. Микроспоридии в ослабленном организме могут поражать миоциты, эпителиоциты, нервные клетки и кератоциты.
Микробиологическая диагностика проводится путем микроскопического изучения мазка кала или мазков из цереброспинальной жидкости, бронхоальвеолярной жидкости, осадка мочи, смыва конъюнктивы, биоптатов кишечника, мочевого пузыря. Присут- ствие характерных грамположительных спор диаметром 1-3 мкм выявляют при окраске мазков по Граму. Споры окрашиваются также по Гомори, Гудпасчеру или по Веберу.
Лечение проводится с помощью метронидазола. При кератоконъюнктивите возможно местное применение фумагилина.
Профилактика неспецифическая, сходная с мероприятиями при кишечных инфекциях, при криптоспоридиозе.
19.6. Бластоцисты (род Blastocystis)
Бластоцисты (Blastocystis hominis) - своеобразные кишечные амебы. Ранее предполагали, что бластоцисты (Blastocystis hominis) являются дрожжами. Недавно их включили в новое царство Chromista (хромовики). У инфицированных лиц развивается бессимптомное носительство или бластоцистоз, характеризующийся диарейным синдромом. Их обнаруживают в кале при диарее. В тропических странах бластоцистами инфицировано до 40% на- селения. Механизм передачи фекально-оральный.
Бластоцисты могут образовывать псевдоподии; как и все простейшие, не имеют клеточной стенки. Питаются бактериями. Раз- множаются бинарным делением или споруляцией. Патогенность не изучена. В кале имеют сферическую форму, размер 5-30 мкм. Цитоплазма и ядро клетки паразита оттеснены на периферию крупной центральной вакуолью.
Диагностика основана на микроскопии мазка из кала, окрашенного раствором Люголя.
Лечение проводят метронидазолом.
Профилактика аналогична мероприятиям при кишечных инфекциях.
Задания для самоподготовки (самоконтроля) (к главам 18, 19)
A. Грибы рода Candida являются:
1. Гифомицетами.
2. Зигомицетами.
3. Условно-патогенными грибами.
4. Дрожжеподобными грибами. Б. Афлотоксикоз вызывают:
1. Грибы рода Mucor.
2. Грибы рода Candida.
3. Грибы рода Aspergilues.
4. Грибы рода Fusarium.
B. Возбудителями эпидермофитий являются:
1. Грибы рода Microsporum.
2. Грибы рода Trichophyton.
3. Грибы рода Epidermophyton.
4. Грибы рода Pneumocystis.
5. Грибы рода Penicillium.
Г. Видовые дифференциальные признаки плазмодиев малярии:
1. Количество молодых трофозоидов.
2. Количество мерозоидов в моруле.
3. Форма и размер эритроцитов.
4. Форма гамонтов.
Д. Ооцисты токсоплазм образуются:
1. При половом размножении паразита в слизистой оболочке
кишечника кошки.
2. При проникновении в кровь человека.
3. При переносе паразита через плаценту.
4. При попадании паразита в мозг.
Е. Для зрелых цист дизентерийной амебы характерно:
1. Наличие 4 ядер.
2. Наличие жгутиков.
3. Наличие ЛПС.
4. Наличие кинетосомы.
Ж. Назовите возбудителей, которые вызывают ВИЧ-ассоциированные инфекции:
1. Токсоплазма.
2. Криптоспоридии.
3. Малярийный плазмодий.
4. Лейшмании.