Медицинская микробиология, вирусология и иммунология: том 2 : учебник / Под ред. В.В. Зверева, М.Н. Бойченко 2010.
|
|
|
|
ГЛАВА 17 ЧАСТНАЯ ВИРУСОЛОГИЯ
17.1. РНК-содержащие вирусы 17.1.1. Пикорнавирусы (семейство Picornaviridae)
Picornaviridae (от исп. pico - малый, rna - РНК) - семейство безоболочечных вирусов, содержащих однонитевую плюс РНК. Семейство насчитывает более 230 представителей и состоит из 9 родов: Enteroviras (111 серотипов), Rhinoviras (105 серотипов), Aphtovirus (7 серотипов), Hepatoviras (2 серотипа: 1 человека, 1 обезьяны), Cardiovirus (2 серотипа); Parechovirus, Erbovirus, Kobuvirus - названия новых родов. Роды состоят из видов, виды - из серотипов. Все эти вирусы способны инфицировать позвоночных.
Структура. Пикорнавирусы относятся к мелким просто организованным вирусам. Диаметр вируса около 30 нм. Вирион состоит из икосаэдрического капсида, окружающего инфекционную однонитевую плюс РНК с протеином VPg. Капсид состоит из 12 пятиугольников (пентамеров), каждый из которых, в свою очередь, состоит из 5 белковых субъединиц - протомеров. Протомеры образованы 4 вирусными полипептидами: VP1, VP2, VP3, VP4. Белки VP1, VP2 и VP3 располагаются на поверхности вириона, а VP4 - внутри вирусной частицы.
Репродукция. Вирус взаимодействует с рецепторами на поверхности клетки. С помощью этих рецепторов осуществляется перенос вирусного генома в цитоплазму, сопровождающийся потерей VP4 и освобождением вирусной РНК из белковой оболочки. Геном вируса может поступить в клетку путем эндоцитоза с последующим выходом нуклеиновой кислоты из вакуоли или путем инъекции РНК через цитоплазматическую мембрану клетки. На конце РНК имеется вирусный протеин - VPg. Геном используется, как и РНК, для синтеза белка. Один большой полипротеин транслируется с
вирусного генома. Затем полипротеин расщепляется на индивидуальные вирусные протеины, включая РНК-зависимую полимеразу. Полимераза синтезирует минус-нить матрицу с поверхности плюс-нити и реплицирует геном. VPg ковалентно присоединяется к 5'-концу вирусного генома. Структурные белки собираются в капсид, в него включается геном, образуя вирион. Время, необходимое для прохождения полного цикла размножения, - от заражения до окончания сборки вируса - обычно составляет 5-10 ч. Его величина зависит от таких факторов, как pH, температура, тип вируса и клетки-хозяина, метаболическое состояние клетки, число частиц, заразивших одну клетку. Вирионы освобождаются из клетки посредством ее лизиса. Репродукция происходит в цитоплазме клеток и сопровождается цитопатическим действием. В культуре клеток под агаровым покрытием вирусы образуют бляшки.
17.1.1.1. Энтеровирусы
Энтеровирусы (от греч. enteron - кишка) - группа вирусов, обитающая преимущественно в кишечнике человека и вызывающая разнообразные по клиническим проявлениям болезни человека.
Энтеровирусы - РНК-содержащие вирусы семейства Picornaviridae рода Enterovirus. Род включает вирусы полиомиелита, Коксаки А и В (по названию населенного пункта в США, где они были впервые выделены), ECHO (от англ. Enteric cytopathogenic human orphan viruses - кишечные цитопатогенные человеческие вирусы-сироты), энтеровирусы типов 68, 69, 70, 71 и др. В настоящее время имеются другие варианты классификации рода Enterovirus, например энтеровирусы человека представлены видом энтеровируса А, а также видами В, С и D, состоящими из серотипов.
Морфология и химический состав. Энтеровирусы - мелкие и наиболее просто организованные вирусы, имеют сферическую форму, диаметр 20-30 нм, состоят из одноцепочечной плюснитевой РНК и капсида с кубическим типом симметрии. Вирусы не имеют суперкапсидной оболочки. В их составе нет углеводов и липидов, поэтому они нечувствительны к эфиру и другим растворителям жира.
Культивирование. Большинство энтеровирусов (за исключением вирусов Коксаки А) хорошо репродуцируется в первичных и перевиваемых культурах клеток из тканей человека и сопровождается цитопатическим эффектом. В культурах клеток под агаровым покрытием энтеровирусы образуют бляшки.
Антигенная структура. Энтеровирусы имеют общие для всего рода группоспецифический и типоспецифические антигены.
Резистентность. Энтеровирусы устойчивы к факторам окружающей среды в широком диапазоне рН - от 2,5 до 11,0, поэтому они длительно (месяцами) сохраняются в воде, почве, некоторых пищевых продуктах и на предметах обихода. Многие дезинфектанты (спирт, фенол, поверхностно-активные вещества) малоэффективны в отношении энтеровирусов, однако последние погибают при действии УФ-лучей, высушивания, окислителей, формалина, при температуре 50 ?С в течение 30 мин, а при кипячении в течение нескольких секунд.
Восприимчивость животных. Энтеровирусы различаются по патогенности для лабораторных животных. Вирусы Коксаки по патогенности для новорожденных мышей разделены на группы А и В. При инфицировании мышей вирусами Коксаки А возникает диффузный паралич, тогда как при заражении мышей вирусами Коксаки В - спастические параличи. Вирусы ECHO непатогенны для всех видов лабораторных животных.
Эпидемиология и патогенез. Заболевания, вызываемые энтеровирусами, распространены повсеместно, отличаются массовым характером с преимущественным поражением детей. Источником инфекции являются больные и носители. Из организма больного возбудители выделяются с носоглоточной слизью и фекалиями, из организма вирусоносителя - с фекалиями. Энтеровирусы передаются через воду, почву, пищевые продукты, предметы обихода, загрязненные руки, через мух. Водные и пищевые эпидемические вспышки энтеровирусных инфекций регистрируются в течение всего года, но наиболее часто в летние месяцы. В первые 1-2 нед болезни энтеровирусы выделяются из носоглотки, обусловливая воздушно-капельный путь передачи. Возбудители инфекции проникают в организм человека через слизистые оболочки носоглотки и тонкой кишки, размножаются в их эпителиальных клетках и регионарных лимфатических узлах, затем попадают в кровь. Последующее распространение вирусов определяется их свойствами и состоянием больного.
Клинические проявления. Энтеровирусы вызывают заболевания, характеризующиеся многообразием клинических проявлений, так как могут поражать различные органы и ткани: центральную нервную систему (ЦНС), сердце, органы дыхания, пищеварительный тракт, кожные и слизистые покровы.
Иммунитет. После перенесенной энтеровирусной инфекции формируется стойкий, но типоспецифический иммунитет.
Микробиологическая диагностика. Применяют вирусологический и серологический с парными сыворотками больного методы. Вирусы выделяют из носоглоточной слизи в первые дни болезни, из кала, цереброспинальной жидкости. У погибших больных ви- русы выделяют из пораженных органов. При серологической диагностике характерно нарастание титров антител к энтеровирусам в 4 раза и более с 4-5-го до 14-го дня болезни.
Лечение патогенетическое. Применяют препараты интерферона в первые дни заболевания и другие противовирусные препараты.
Профилактика. Для профилактики энтеровирусных инфекций (за исключением полиомиелита) специфические средства не применяют. Большое значение имеет неспецифическая профилактика: своевременное выявление и изоляция больных, санитарный надзор за работой пищевых предприятий, водоснабжением, удалением нечистот и отбросов. Детям, общавшимся с больными, рекомендуют препараты интерферона.
17.1.1.1.1. Вирусы полиомиелита
Полиомиелит - острое лихорадочное заболевание, которое иногда сопровождается поражением серого вещества (от греч. polios - серый) спинного мозга и ствола головного мозга, в результате чего развиваются вялые параличи и парезы мышц ног, туловища, рук.
Таксономия. Полиомиелит известен с глубокой древности. Вирусную этиологию болезни доказали К. Ландштайнер и Э. Поппер в
Структура. По структуре полиовирусы - типичные представители рода Enterovirus.
Антигенные свойства. Различают три серотипа внутри вида: 1, 2, 3, не вызывающие перекрестного иммунитета. Все серотипы патогенны для обезьян, у которых возникает заболевание, сходное по клиническим проявлениям с полиомиелитом человека.
Патогенез и клиническая картина. Естественная восприимчивость человека к вирусам полиомиелита высокая. Входными воротами служат слизистые оболочки верхних дыхательных путей и пищеварительного тракта. Первичная репродукция вирусов происходит в лимфатических узлах глоточного кольца и тонкой кишки. Это обусловливает обильное выделение вирусов из носоглотки и
с фекалиями еще до появления клинических симптомов болезни. Из лимфатической системы вирусы проникают в кровь (виремия), а затем в ЦНС, где избирательно поражают клетки передних рогов спинного мозга (двигательные нейроны). В результате этого возникают параличи мышц. В случае накопления в крови вируснейтрализующих антител, блокирующих проникновение вируса в ЦНС, ее поражения не наблюдается.
Инкубационный период продолжается в среднем 7-14 дней. Различают клинические формы полиомиелита: паралитическую (1% случаев), менингеальную (без параличей), абортивную (легкая форма, инаппарантная инфекция без клинически выраженных симптомов). Заболевание начинается с повышения температуры тела, общего недомогания, головных болей, рвоты, болей в горле. Полиомиелит нередко имеет двухволновое течение, когда после легкой формы и наступившего значительного улучшения развивается тяжелая форма болезни. Паралитическую форму чаще вызывает вирус полиомиелита серотипа 1.
Иммунитет. После перенесенной болезни остается пожизненный типоспецифический иммунитет. Иммунитет определяется в основном наличием вируснейтрализующих антител, среди которых важная роль принадлежит местным секреторным антителам слизистой оболочки глотки и кишечника (местный иммунитет). Эффективный местный иммунитет играет важнейшую роль в прерывании передачи диких вирусов и способствует вытеснению их из циркуляции. Пассивный естественный иммунитет сохраняется в течение 3-5 нед после рождения ребенка.
Микробиологическая диагностика. Материалом для исследования служат кал, отделяемое носоглотки, при летальных исходах кусочки головного и спинного мозга, лимфатические узлы. Вирусы полиомиелита выделяют путем заражения исследуемым материалом первичных и перевиваемых культур клеток. О репродукции вирусов судят по цитопатическому действию. Идентифицируют (типируют) выделенный вирус с помощью типоспецифических сывороток в реакции нейтрализации в культуре клеток. Важное значение имеет внутривидовая дифференциация вирусов, которая позволяет отличить дикие патогенные штаммы от вакцинных штаммов, выделяющихся от людей, иммунизированных живой полиомиелитной вакциной. Различия между дикими и вакцинными штаммами выявляют с помощью ИФА, реакции нейтрализации
цитопатического действия вируса в культуре клеток со штаммоспецифической иммунной сывороткой, а также в ПЦР.
Серологическая диагностика основана на использовании парных сывороток больных с применением эталонных штаммов виру- са в качестве диагностикума. Содержание сывороточных иммуноглобулинов классов IgG, IgA, IgM определяют методом радиальной иммунодиффузии по Манчини.
Лечение патогенетическое. Применение гомологичного иммуноглобулина для предупреждения развития паралитических форм весьма ограничено.
Эпидемиология и специфическая профилактика. Эпидемии полиомиелита охватывали в 1940-1950 гг. тысячи и десятки тысяч человек, из которых 10% умирали и примерно 40% становились инвалидами. Основной мерой профилактики полиомиелита является иммунизация. Массовое применение вакцины против полио- миелита привело к резкому снижению заболеваемости.
Первая инактивированная вакцина для профилактики полиомиелита была разработана американским ученым Дж. Солком в
Естественно аттенуированные штаммы вирусов полиомиелита всех трех типов получил в
ВОЗ в
Использование оральной поливакцины привело практически к полному исчезновению случаев полиомиелита в развитых странах Европы и в Америке и резкому снижению заболеваемости в развивающихся странах. В России случаи полиомиелита не регистрируются с 1.07.02 г.
У живой полиомиелитной вакцины имеются некоторые недостатки, наиболее серьезным из которых является возникновение
вакциноассоциированного полиомиелита у привитых и контактных лиц, инфицированных вирусами, выделяемыми привитыми детьми. Контактное инфицирование происходит обычно вирусом одного серотипа.
Показано, что у иммунокомпетентных лиц отсутствует длительное носительство поливируса после вакцинации, в то время как у лиц с иммунодефицитами вакцинный штамм может выделяться в течение 7-10 лет. Риск развития вакциноассоциированного паралитического полиомиелита у лиц с иммунодефицитами, особенно с нарушениями В-клеточного иммунитета, выше, чем у иммунокомпетентных лиц.
Неспецифическая профилактика сводится к санитарно-гигиеническим мероприятиям: обеспечению населения доброкачествен- ными водой, пищевыми продуктами, соблюдению личной гигиены, выявлению больных и подозрительных на заболевание лиц.
17.1.1.1.2. Вирусы Коксаки А и В
Вирусы Коксаки А и В названы по населенному пункту в США, где они были впервые выделены. По патогенности для новорож- денных мышей вирусы разделены на группы А и В.
Вирусы Коксаки А (24 серотипа) не размножаются в культуре клеток, у новорожденных мышей вызывают диффузный миозит, сопровождающийся развитием трофических параличей.
Вирусы Коксаки В хорошо размножаются в культурах клеток обезьяньего и человеческого происхождения (HeLa, почка обезьяны). У новорожденных мышей вызывают спастические параличи.
Единственным хозяином вирусов в природе является человек. Основной механизм передачи фекально-оральный, возможен воздушно-капельный путь передачи. Вирусы обладают высокой резистентностью во внешней среде, выживают в канализационных водах, на предметах обихода и пищевых продуктах. Неделями сохраняются при 4 ?С.
Вирусы Коксаки А вызывают у человека герпангину (герпетиформные высыпания на задней стенке глотки, сопровождающиеся дисфагией, лихорадкой, анорексией), пузырчатку в полости рта и конечностей, полиомиелитоподобные заболевания. Вирус Коксаки А24 вызывает геморрагический конъюнктивит. Инкубационный период 2-21 день.
Вирусы Коксаки В вызывают полиомиелитоподобные заболевания, энцефалит, миокардит, пери- и эндокардиты, спорадические параличи. Инкубационный период 5 дней.
Микробиологическая диагностика. Используют вирусологический метод, выделяя вирус из фекалий, отделяемого носоглотки путем одновременного заражения культур клеток и мышей-сосунков. Вирусы идентифицируют в РТГА, РСК, РН, ИФА, учитывая также характер патологических изменений у зараженных мышей.
17.1.1.1.3. Вирусы группы ECHO
Вирусы группы ECHO - РНК-содержащие вирусы семейства Picornaviridae рода Enterovirus, насчитывают более 30 типов. Вирусы ECHO непатогенны для всех видов лабораторных животных. Хорошо размножаются в культурах клеток обезьяньего и человеческого происхожения. Резервуар в природе - человек. Вирусы выделяются из организма человека с фекалиями. Обнаруживаются в сточных водах, водных источниках и водопроводной воде. Передаются фекально-оральным механизмом и воздушно-капельным путем. Вызывают ОРВИ, асептический менингит, полиомиели- топодобные заболевания, фульминантный энцефаломиокардит у новорожденных.
Микробиологическая диагностика проводится вирусологическим и серологическим методами. Вирус выделяют из цереброспинальной жидкости, фекалий, отделяемого носоглотки, заражая культуры клеток почек обезьян. Идентификацию вируса проводят в РТГА, РСК, РН, ИФА. Серологическую диагностику проводят, определяя в парных сыворотках крови нарастание титра антител, используя РТГА, РСК, РН, ИФА. Поскольку иммунитет при инфекциях ECHO и Коксаки является типоспецифическим, создание вакцин из многих типов вирусов является трудноосуществимой задачей. Поэтому основные меры профилактики связаны с мероприятиями санитарного характера.
17.1.1.2. Риновирусы
Риновирусы - РНК-содержащие вирусы семейства Picornaviri- dae рода Rhinovirus. Последний представлен двумя видами, состоя- щими из 100 серотипов, наиболее часто вызывающих ОРВИ. Рецептором риновирусов является межклеточная адгезивная молекула I (ICAM-I), которая экспрессируется на эпителиальных клетках, фибробластах и эндотелиальных клетках. Риновирусы могут пере-
даваться двумя механизмами: аэрозольным и контактно-бытовым. Проникают в организм через нос, полость рта, конъюнктиву. Процесс начинается в верхних дыхательных путях.
Микробиологическая диагностика проводится вирусологическим методом. Выделяют вирус из культур клеток с последующей идентификацией в РИФ, а также определяют нарастание титра антител в парных сыворотках с помощью РН.
17.1.1.3. Вирусы ящура
Вирусы ящура - РНК-содержащие вирусы семейства Picornaviridae рода Aphtovirus, состоящего из одного вида, представленного 7 серотипами. Вызывают ящур - зоонозную инфекционную бо- лезнь, характеризующуюся лихорадочным состоянием, язвенными (афтозными) поражениями слизистой оболочки рта, кожи кистей и стоп у человека. Вирусы ящура по морфологии и химическому составу сходны с другими пикорнавирусами. Обладают высокой вирулентностью и дерматотропностью. Вирус может длительно (несколько недель) выживать в объектах окружающей среды, в пищевых продуктах; чувствителен к дезинфектантам. Естественным резервуаром вируса служат больные животные, особенно крупный рогатый скот. От больных животных вирус выделяется с молоком, слюной и мочой. Человек заражается при уходе за больными животными, а также при употреблении сырого молока и молочных продуктов. Восприимчивость человека к ящуру невысокая.
Микробиологическая диагностика. Вирус выявляют в содержимом афт, слюне и крови путем заражения морских свинок, мышейсосунков или культур клеток. Для серологической диагностики исследуют парные сыворотки крови в РСК, РН, РПГА, ИФА.
Профилактика ящура у человека неспецифическая.
17.1.1.4. Вирус гепатита А
Вирус гепатита А открыт в
Таксономия, морфология и антигенная структура. Вирус гепатита А относится к семейству Picornaviridae роду Hepatovirus. Типовой вид - вирус гепатита А - имеет один серотип. Это РНКсодержащий вирус, просто организованный, имеет диаметр 27-28 нм и один вирусоспецифический антиген. Установлено 6 генотипов вируса гепатита А. Вирус, подобный вирусу гепатита А, обнаружен у обезьян семейства игрункообразных. Этот вирус генотипически отличается от вируса гепатита А человека.
Культивирование. Вирус выращивают в культурах клеток. Цикл репродукции более длителен, чем у энтеровирусов, цитопатический эффект не выражен.
Резистентность. Вирус гепатита А отличается большей, чем у энтеровирусов, устойчивостью к нагреванию; он сохраняется при 60 ?С в течение 12 ч, инактивируется при кипячении в течение 5 мин. Относительно устойчив во внешней среде (воде, выделениях больных). При pH 1,0 вирус сохраняет жизнеспособность, в то время как другие пикорнавирусы инактивируются. Эти свойства вируса основные в эпидемиологии гепатита.
Восприимчивость животных. Экспериментальную инфекцию можно воспроизвести на обезьянах мармозетах и шимпанзе.
Эпидемиология. Источником инфекции являются больные как с выраженными, так и с бессимптомными формами инфекции. Механизм заражения фекально-оральный. Вирусы выделяются с фекалиями, начиная со второй половины инкубационного периода и в начале клинических проявлений; в это время они наиболее опасны для окружающих. С появлением желтухи интенсивность выделения вирусов снижается. Вирусы гепатита А передаются через воду, пищевые продукты, предметы обихода, грязные руки, в детских коллективах - через игрушки, горшки. Вирусы способны вызывать водные и пищевые эпидемические вспышки.
Гепатит А распространен повсеместно, но особенно в местах с дефицитом воды, плохими системами канализации и водоснаб- жения и низким уровнем гигиены населения. Болеют преимущественно дети в возрасте от 4 до 15 лет. Подъем заболеваемости наблюдается в летние и осенние месяцы.
Патогенез. Первичным местом размножения вируса является эндотелий тонкой кишки. Оттуда он попадает в портальный кровоток и печень, так как обладает гепатотропизмом. Повреждение гепатоцитов возникает не за счет прямого цитотоксического действия, а в результате иммунопатологических механизмов.
Клиническая картина. Инкубационный период составляет от 15 до 50 дней, чаще около 1 мес. Начинается остро с повышения температуры и явлений со стороны ЖКТ (тошноты, рвоты и др.). Возможно появление желтухи на 5-7-й день. Клиническое течение заболевания, как правило, легкое, без особых осложнений, у детей до 5 лет обычно бессимптомное. Продолжительность заболевания 2-3 нед. Хронические формы не развиваются.
Иммунитет. После инфекции формируется стойкий пожизненный иммунитет, связанный с IgG. В начале заболевания в крови появляются IgM, которые сохраняются в организме 4-6 мес и имеют диагностическое значение. У детей первого года жизни обнаруживают антитела, полученные от матери через плаценту. Помимо гуморального, развивается местный иммунитет в кишечнике.
Микробиологическая диагностика. Материалом для исследования служат сыворотка и испражнения. Диагностика основана главным образом на определении в крови IgM с помощью ИФА, РИА и иммунной электронной микроскопии. Этими же методами можно обнаружить вирусный антиген в фекалиях. Вирусологическое исследование не проводят из-за отсутствия методов, доступных для практических лабораторий.
Лечение симптоматическое.
Профилактика. Неспецифическая профилактика должна быть направлена на повышение санитарной культуры населения, улучшение водоснабжения и условий приготовления пищи. Для специфической пассивной профилактики используют иммуноглобулин по эпидемиологическим показаниям. Иммунитет сохраняется около 3 мес. Для специфической активной профилактики разработана и применяется инактивированная культуральная концентрированная вакцина. Разработана также рекомбинантная генноинженерная вакцина.
17.1.2. Реовирусы (семейство Reoviridae)
Реовирусы - безоболочечные вирусы семейства Reoviridae (от англ. respiratory, enteric, orphan viruses - респираторные кишечные вирусы; orphan - сирота, поскольку первоначально роль вирусов в патологии была неизвестна), содержащие двунитевую фрагментированную РНК. Семейство включает более 500 представителей и содержит 12 родов, из которых медицинское значение имеют Orthoreovirus, Orbivirus, Coltivirus, Rotavirus и Seadornavirus. Среди них имеются кишечные и респираторные вирусы, а также некоторые арбовирусы.
Род Orthoreovirus представлен вирусами 5 серотипов. Они широко распространены, выделяются от людей, млекопитающих в норме или при инфекциях ЖКТ и респираторного тракта. Род Orbivirus получил свое название из-за кольцевидной формы капсомеров вирионов (orbis - кольцо). Он включает арбовирусы Кемерово (пере-
носится клещами, вызывает лихорадку Кемерово) и вирус синего языка овец (переносится мокрецами). Род Coltivirus включает арбовирус колорадской клещевой лихорадки (переносится клещами). Род Seadornavirus включает вирус Банна, впервые выделенный в
Структура. Вирусы имеют сферическую форму диаметром 70- 85 нм, 2-3-слойный капсид икосаэдрического типа симметрии; оболочки нет. Геном представлен сегментированной (10-12 сегментов) линейной двунитевой РНК. Вирион содержит транскриптазу (РНК-зависимую РНК-полимеразу). Сердцевина вириона состоит из внутреннего капсида и геномной РНК. Внутренний капсид содержит систему транскрипции; белки λ1, λ3, μ2. От сердцевины отходят шипы, представленные белком λ2. Внутренний капсид ротавирусов включает белки VP1, VP2, VP3 и VP6.
Наружный капсид реовирусов состоит из белков σ1 (гемагглютинин и прикрепительный белок), σ3, μ1с, а также белков λ2, отходящих от сердцевины и выступающих в виде шипов. Белок μ1С, определяет способность реовирусов заражать клетки кишечника и впоследствии поражать ЦНС. Наружный капсид ротавирусов включает белок VP4 (шипы на поверхности вириона, являющиеся гемагглютинином и прикрепительным белком) и белок VP7 - ти- поспецифический антиген, основной компонент наружного капсида. Ротавирусы и ортореовирусы активизируются протеолизом с увеличением их инвазионной способности (инфекционные субвирусные частицы - ИСЧ).
Репродукция. Реовирусы с помощью белка σ1 могут адсорбироваться на клетке и проникать путем рецепторопосредованного эндоцитоза в цитоплазму, где под влиянием ферментов лизосом происходит разрушение наружного капсида с образованием субвирусных частиц. Реовирусы также могут проникать в клетку в виде инфекционных субвирусных частиц, не содержащих белка σ1. Инфекционные субвирусные частицы ротавирусов проникают через клеточную мембрану и освобождают сердцевину в цитоплазме; ферменты сердцевины инициируют продукцию иРНК. С каждого фрагмента геномной РНК считывается индивидуальная иРНК. Транскрипция генома проходит в раннюю и позднюю фазы. Минус-нить РНК используется как матрица. Вирионы собираются в цитоплазме клетки и выходят при ее лизисе.
17.1.2.1. Ротавирусы (род Rotavirus)
Ротавирусы человека вызывают ротавирусный гастроэнтерит у детей. Ротавирусы являются РНК-содержащими вирусами рода Rotavirus, семейства Reoviridae. Свое название они получили из-за строения вириона, по форме похожего на зубчатое колесо (от лат. rota - колесо).
Структура (рис. 17.1). Вирион ротавирусов сферический (70 нм), содержит двунитевую фрагментированную (11 сегментов) минуснегативную РНК. Трехслойный капсид имеет форму колеса с отходящими внутрь короткими «спицами». Вирион имеет 13 белков. Внутренний капсид включает белки VP1, VP2, VP3, VP6. Наружный капсид включает: 1) белок VP4 - шипы вириона (гемагглютинин и прикрепительный белок); 2) белок VP7 - основной компонент наружного капсида (типоспецифический антиген). VP4 может расщепляться на VP5 и VP8, что активирует инфекционность вируса. Имеются неструктурные белки: NSP1, NSP2, NSP3, NSP4, NSP5, NSP5А, из которых NSP4 - первый вирусный энтеротоксин, который вызывает секреторную диарею.
По антигенной структуре различают 7 серогрупп (А, B, C, D, E, F, G). У человека и животных обнаружены серогруппы A, B и C, а остальные серогруппы - только у животных.
Репродукция. Вирионы проникают путем рецепторопосредованного эндоцитоза в клетку, где под влиянием ферментов лизосом
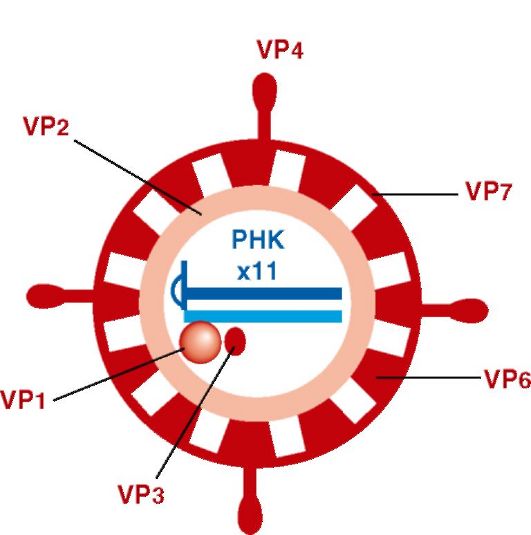
Рис. 17.1. Строение ротавируса. Показаны только 4 из 60 шипов VP4 и 1 из 11 сегментов РНК (обозначения в тексте)
происходит частичная депротеинизация - разрушение наружного капсида с образованием субвирусных частиц. Другой механизм проникновения заключается в активации вирионов протеазами (например, в ЖКТ) и превращении их в инфекционные субвирусные частицы, которые пенетрируют клеточную мембрану и в цитоплазме под действием лизосом утрачивают наружный капсид, освобождая сердцевину. Ферменты сердцевины инициируют продукцию иРНК, используя в качестве матрицы минус-нить РНК. Белки VP7 и NS28 синтезируются как гликопротеины и экспрессируются в эндоплазматическом ретикулуме. Плюс РНК является иРНК. Она включена внутрь капсидов как матрица для репликации +/--сегментированного генома. Капсиды ротавирусов агрегируют, связываются с белком NS28 в эндоплазматическом ретикулуме и приобретают белок VP7 наружного капсида. Выход вирионов из клетки происходит при ее лизисе.
Эпидемиология, патогенез и клиническая картина. Источник инфекции - больные или вирусоносители, выделяющие ротавирусы с калом (фекально-оральный механизм передачи). Пути передачи водный (основной), пищевой, контактно-бытовой. Инкубационный период 1-3 сут. Ротавирусы поражают людей в основном в зимний период. Они вызывают гастроэнтериты, главным образом у детей (часто в возрасте от 3 мес до 2 лет), являются причиной смерти около 1 млн людей из-за ротавирусной диареи. Размножаются в эпителиоцитах двенадцатиперстной кишки, вызывая их гибель. Возможна локализация вирусов в других внутренних органах. Заболевание протекает с рвотой, болями в животе и диареей в течение 1-2 сут. Частота стула 10-15 раз в сутки.
Микробиологическая диагностика. Вирус обнаруживают в фильтрате кала (концентрация вирионов в кале 1010/мкл на 3-8-й нед болезни) с помощью иммунной электронной микроскопии, ИФА, иммунодиффузионной преципитации в агаре, РСК, РН, РИФ, реакции коагглютинации, клонированных РНК-зондов. В сыворотке крови определяют нарастание титра антител с помощью
ИФА, РСК, РПГА, РН, РИФ. Возможно применение ОТ-ПЦР.
Лечение симптоматическое.
Профилактика. Неспецифическая профилактика основана на соблюдении санитарно-гигиенических правил, санитарных норм водоснабжения и канализации. Для специфической профилактики разработаны живые пероральные вакцины из аттенуированных штаммов вируса.
17.1.3. Буньявирусы (семейство Bunyaviridae)
Таксономия и классификация. Семейство Bunyaviridae насчитывает более 250 серотипов вирусов, входящих в состав 5 родов. Патогенные для человека буньявирусы относятся к 4 родам: Orthobunyavirus, Phlebovirus, Nairovirus и Hantavirus.
Прототипом вирусов данного семейства является впервые выделенный в Центральной Африке и переносимый комарами вирус Буньямвера. Название вируса дано по местности Буньямвера в Уганде.
Морфология. Вирионы имеют овальную или сферическую форму, диаметр 80-120 нм. Это сложные РНК-геномные вирусы, содержащие три внутренних нуклеокапсида со спиральным типом симметрии. Каждый нуклеокапсид состоит из нуклеокапсидного белка N, уникальной одноцепочечной минус-РНК и фермента транскриптазы (РНК-зависимой РНК-полимеразы). Три сегмента РНК, связанные с нуклеокапсидом, обозначают по размерам как L (long) - большой, M (medium) - средний и S (short) - малый. Буньявирусы не содержат M-белка, поэтому они более пластичны. Сердцевина вириона, содержащая рибонуклеопротеид (РНП), окружена липопротеидной оболочкой, на поверхности которой находятся шипы - гликопротеины Gn и Gc, которые кодируются M сегментом РНК.
Антигены. Белок N является группоспецифическим антигеном, который выявляется в РСК. Гликопротеины (Gn и Gc) - типоспецифические антигены, выявляемые в РН и РТГА. Это протективные антигены, индуцирующие образование вируснейтрализующих антител. Они также являются гемагглютинами. Гликопротеины - основные детерминанты патогенности, обусловливающие клеточную органотропность вирусов и эффективность их передачи членистоногими. Репродукция буньявирусов происходит в цитоплазме клетки. Выход вирусных частиц происходит путем экзоцитоза, а иногда лизиса клетки.
Устойчивость к действию физических и химических факторов. Буньявирусы чувствительны к действию эфира и детергентов, инактивируются при нагревании при 56 ?С в течение 30 мин и почти мгновенно при кипячении, но длительно сохраняют инфекционную активность при замораживании. Буньявирусы стабильны при pH 6,0-9,0, инактивируются обычно применяемыми дезинфицирующими средствами.
Эпидемиология, патогенез и клиническая картина. Буньявирусы широко распространены на всех континентах, а вызываемые ими заболевания относятся к зоонозным природно-очаговым инфекциям. Большая часть вирусов данного семейства относится к экологической группе арбовирусных инфекций (от англ. arthropod-borne viruses - вирусы, рожденные или передаваемые членистоногими), так как они передаются кровососущими членистоногими насекомыми (полный текст «Арбовирусные инфекции» изложен в материалах диска). Последние являются не только их переносчиками, но и основным резервуаром и постоянными хозяевами в природных очагах. Буньявирусы, как и другие представители арбовирусов, обладают способностью размножаться при двух температурных режимах: 36-40 ?С и 22-25 ?С, что позволяет им репродуцироваться в организме не только позвоночных, но и переносчиков. Большинство буньявирусов передается комарами. Наировирусы большей частью передаются клещами, а флебовирусы - москитами и комарами. Некоторые флебовирусы и буньявирусы могут передаваться мокрецами Culicoides.
Для заболеваний, вызванных данными вирусами, характерна сезонность. На территории России основное значение имеют клещи. Позвоночными хозяевами буньявирусов являются грызуны, птицы, зайцеобразные, жвачные животные, приматы. Заражение людей может происходить не только трансмиссивно через укусы кровососущими членистоногими, но и при контакте с больными людьми в результате попадания на поврежденную кожу и слизистые оболочки крови, а также других биологических выделений, содержащих вирус.
Вирусы рода Хантаан составляют исключение из правила в данном семействе, так как их основными хозяевами являются грызу- ны. Вместе с аренавирусами и филовирусами они выделены в экологическую группу нетрансмиссивных геморрагических лихорадок или робовирусов (от англ. rodent-borne viruses - вирусы, рожденные грызунами). Свидетельств участия в их передаче членистоногих не обнаружено (подробнее «Робовирусные инфекции» см. на диске).
Большинство буньявирусов вызывают лихорадочные заболевания, геморрагические лихорадки и энцефалиты. Наибольшее медицинское значение имеют вирус геморрагической лихорадки Крым-Конго (род Nairovirus) и вирусы геморрагической лихорадки с почечным синдромом (род Hantavirus), которые наиболее патогенны для человека.
Иммунитет. После перенесенных заболеваний остается стойкий иммунитет.
Лабораторная диагностика буньявирусных инфекций основана на выделении вирусов и обнаружении антител к ним в парных сыворотках, а также проведении ПЦР. Эти вирусы относятся к возбудителям особо опасных инфекций, поэтому выделение их проводится лишь в режимных лабораториях. Материалом для исследования служат кровь, взятая в остром периоде заболевания (при москитных лихорадках не позже 24-48 ч от начала заболевания), или кусочки тканей и органов (мозг, печень, селезенка, легкие и почки), полученные на аутопсии. Вирус может быть выявлен в организме кровососущих членистоногих переносчиков и во внутренних органах погибших инфицированных животных.
Для культивирования вирусов применяют культуры клеток из переносчиков, почки эмбрионов человека, ВНК-21, фибробласты куриного эмбриона, где они не оказывают выраженного цитопатического действия. Вирусы можно культивировать в куриных эмбрионах. К буньявирусам восприимчивы новорожденные белые мыши, белые крысы и хомячки. Универсальной моделью для вы- деления арбовирусов является интрацеребральное заражение новорожденных белых мышей, у которых они вызывают развитие энцефалита, заканчивающегося летально. Индикацию вирусов осуществляют на основании развития заболевания и гибели жи- вотных. Также заражают культуру клеток с последующей индикацией в РИФ, так как для буньявирусов нехарактерно развитие выраженного цитопатогенного действия. Идентификацию вирусов проводят в РН на мышах-сосунках, РСК, РТГА, РНГА, а также с помощью РИФ, ИФА и РИА.
Лечение и профилактика. Препараты для специфического лечения не разработаны. В ряде случаев применяют иммунные сыворотки переболевших лиц, рибавирин, интерферон и реаферон. Профилактика основана на защите от комаров, клещей и других кровососущих насекомых. Для создания искусственного активного приобретенного иммунитета применяют убитые вакцины.
17.1.3.1. Вирус геморрагической лихорадки Крым-Конго (ГЛКК)
Таксономическое положение и биологические свойства. Вирус ГЛКК относится к роду Nairovirus, антигенной группе ГЛКК. Обладает биологическими свойствами, характерными для вирусов
семейства Bunyaviridae. Это вазотропный арбовирус. Большинство штаммов вируса ГЛКК не обладает гемагглютинирующей активностью.
Эпидемиология, патогенез и клинические проявления. Заболевание впервые было выявлено в Крыму в
ГЛКК относится к арбовирусным природно-очаговым заболеваниям. В России это заболевание встречается на территории южных регионов. Резервуаром вируса в природе и источником инфекции являются многие виды пастбищных клещей, в основном гиаломовые клещи. Животные - прокормители клещей служат временным резервуаром вируса, у них ГЛКК протекает в основном в виде бессимптомной инфекции. Человек чаще всего заражается в природных очагах трансмиссивно через укусы клещей и является тупиком в эпидемической цепи в природных очагах. Вирус также попадает через микроповреждения кожи и слизистые оболочки при контакте с кровью больного или инфицированными кровью предметами. Возможно заражение при раздавливании инфицированных клещей. Кровь больных в острую фазу заболевания содержит вирус в высоких концентрациях, в связи с чем возможно заражение при проведении медицинских манипуляций. Большинство заболеваний, возникших контактным путем, протекает тяжело. Это обусловлено наличием «эффекта пинг-понга», т.е. усилением вирулентности вируса после пассажа через организм человека. Аэрогенный механизм заражения возможен при авариях в вирусо- логических лабораториях.
Выделяют две клинические формы болезни: с геморрагическими проявлениями и без геморрагических проявлений. При ге- моррагической форме заболевания вирус проникает в организм и в течение инкубационного периода, длящегося от 1 до 14 дней, размножается в макрофагах, затем поступает в кровь. Он обладает вазотропностью, что ведет к развитию генерализованного капилляротоксикоза. В типичном случае заболевание характеризуется острым началом, лихорадкой, выраженной интоксикацией,
тяжелыми геморрагическими проявлениями. Летальность до 40%. Смерть наступает от инфекционно-токсического шока, массивных кровотечений, печеночно-почечной недостаточности. Заболевание без геморрагических проявлений протекает легче, чем первая форма заболевания. Иммунитет напряженный. Антитела у переболевших сохраняются свыше 5 лет.
Лабораторная диагностика основана на выделении вируса из крови больных и внутренних органов погибших путем заражения новорожденных белых мышей и культур клеток с идентификацией в РИФ, а также обнаружении антител в парных сыворотках с помощью серологических реакций, постановки ПЦР. Разработана лантанидная иммунофлюоресцентная система для обнаружения специфических IgM и IgG, а также антигенов вируса ГЛКК. Экспресс-диагностика вируса в крови, аутопсийном материале и переносчиках осуществляется с помощью РНГА или РИФ с флюоресцирующей моноклональной мышиной сывороткой к вирусу
ГЛКК.
Лечение и профилактика. Применяют реаферон, рибавирин. В течение первых 3 дней вводят гетерогенный специфический лошадиный иммуноглобулин, а также иммунную сыворотку, плазму или специфический иммуноглобулин, полученные из сыворотки крови реконвалесцентов или привитых лиц. Специфический иммуноглобулин используется для экстренной профилактики у лиц, соприкасающихся с кровью больного.
17.1.3.2. Вирусы - возбудители хантавирусных инфекций: геморрагической лихорадки с почечным синдромом (ГЛПС) и хантавирусного легочного синдрома
Таксономическое положение и биологические свойства. Возбудители ГЛПС и хантавирусного легочного синдрома относятся к вирусам семейства Bunyaviridae роду Hantavirus антигенному комплексу Hantaan. Типовой представитель данного рода - вирус Хантаан. Вирус был выделен из легочной ткани и экскрементов корейской полевки в
ными способами, но самый лучший из них внутрилегочный способ заражения. Хантавирусы неоднородны в антигенном отношении. Возбудителями ГЛПС являются 4 серотипа вируса: Хантаан, Пуумала, Сеул и Добрава/Белград. Антигенная вариабельность вируса связана главным образом с различной видовой принадлежностью его основных хозяев - грызунов.
Эпидемиология, патогенез и клиническая картина. ГЛПС относится к природно-очаговым заболеваниям. В России наиболее высокие показатели ежегодной заболеваемости ГЛПС отмечаются на территориях Уральского, Поволжского и Волго-Вятского регионов.
Резервуаром и источником инфекции при ГЛПС являются мышевидные грызуны лесного комплекса, а при легочных поражениях - мышевидные грызуны степного комплекса. У грызунов эта инфекция протекает в виде бессимптомного вирусоносительства. Грызуны выделяют вирус в окружающую среду с калом, мочой и слюной. Основной механизм заражения человека аэрогенный с со- ответствующим ему воздушно-пылевым путем передачи. Возможен фекально-оральный механизм заражения алиментарным путем при употреблении продуктов, инфицированных выделениями зараженных грызунов или контактно-бытовым путем через грязные руки во время еды. Восприимчивость людей к инфицированию высо- кая. При аспирационном механизме заражения инфицируются большинство лиц, находящихся в зараженном помещении. Инфицированный человек эпидемической опасности не представляет.
В основе патогенеза лежит системное поражение стенки мелких сосудов, обусловленное вазотропным действием вирусов. Изменения наиболее выражены при ГЛПС в почках, надпочечниках, гипоталамусе, миокарде и кишечнике. При хантавирусном легочном синдроме наиболее выраженные изменения отмечаются в легких. Вирусемия длится 4-7 дней. Инкубационный период при ГЛПС 7-45 дней, чаще 2-3 нед. Заболевание начинается остро с повышения температуры и характеризуется симптомами поражения почек. Летальность до 1-2% в европейских и до 5-10% в дальневосточных районах России.
Инкубационный период при хантавирусном легочном синдроме 6 нед. Заболевание сопровождается развитием сердечно-легочной недостаточности с тяжелыми поражениями легких (пневмония). Летальность до 50-60%. В случае благоприятного исхода наступает период реконвалесценции.
Иммунитет у переболевших лиц стойкий, пожизненный. Повторные заражения гомологичным серотипом вируса отсутствуют.
Лабораторная диагностика хантавирусных инфекций основана на выделении вирусов из крови и мочи в острый период заболевания, а также обнаружении антител в парных сыворотках и моче больных. Вирусы чаще выделяют у мышей, так как в культуре клеток они не вызывают цитопатического действия. Индикацию ви- русного антигена в легких мышей осуществляют с помощью РИФ, ИФА. Идентификацию вирусов проводят с помощью РИФ, ИФА и РНГА. Для серологической диагностики заболеваний применяют РИФ, ИФА, РТНГА, РНГА, РИА. Раннюю диагностику заболе- вания проводят, обнаруживая антигены вирусов в моче с помощью РИФ и ИФА. Применяют также ПЦР.
Специфическое лечение и профилактика. Применяют рибовирин и амиксин. В настоящее время для лечения и экстренной профилактики против вируса Хантаан разработан специфический иммуноглобулин человека жидкий направленного действия. В России разработана убитая вакцина против ГЛПС на основе штамма К-27 вируса Пуумала, которую применяют по эпидемиологическим показаниям. Необходимо соблюдать осторожность при работе с исследуемым материалом и кровью больных.
17.1.4. Тогавирусы (семейство Togaviridae)
Название семейства Togaviridae происходит от лат. toga - плащ или накидка, что отражает сложное строение вириона, наличие у вирусов внешней липидсодержащей оболочки (суперкапсида), окружающей РНП наподобие плаща. Семейство состоит из 4 родов, два из которых - род Alphavirus и род Rubivirus - играют роль в патологии у человека. Альфавирусы относятся к экологической группе арбовирусов. Типовым представителем рода является вирус Синдбис (SIN). Род Rubivirus включает вирус краснухи, который передается воздушно-капельным путем и не относится к арбови- русам.
17.1.4.1. Вирусы рода Alphavirus
Морфология, химический состав и особенности репродукции.
Альфавирусы - это сложно устроенные гетерогенные по размерам вирусы. Геном их состоит из линейной однонитевой плюс-РНК, обладающей инфекционной активностью, окруженной капсидом
(C-белок) с кубическим типом симметрии. Нуклеокапсид окружен наружной двухслойной липопротеидной оболочкой, на поверхности которой располагаются гликопротеины E1, E2 и E3. Диаметр вирионов 65-70 нм. М-белок отсутствует.
Репродукция вирусов происходит в цитоплазме клетки, куда они проникают путем рецепторного эндоцитоза. Сборка и почкование вирионов путем экзоцитоза происходят на плазматической мембране зараженных клеток.
Устойчивость к действию физических и химических факторов. Вирусы чувствительны к эфиру и детергентам. Они легко разрушаются при 56 ?С, устойчивы к pH 6,0-9,0, сохраняют инфекционную активность при замораживании. Вирусы высокочувствительны к УФ-облучению, действию формалина и хлорсодержащих дезинфектантов.
Антигенная структура. Основным протективным, видоспецифическим антигеном является гликопротеин E2, выявляемый в РН. Он индуцирует синтез антител, нейтрализующих инфекционные свойства вируса, а также участвует в прикреплении вируса к клетке. Гликопротеин E1 обладает гемагглютинирующей активностью (агглютинирует эритроциты гусей и цыплят), но не обладает протективными свойствами. Он ответствен за подгрупповую специфичность и выявляется в РТГА. Белок C нуклеокапсида обеспечивает родовую специфичность альфавирусов. По данным РТГА альфавирусы образуют 4 антигенных комплекса: венесуэльского (ВНЭЛ), западного (ЗЭЛ) и восточного (ВсЭЛ) энцефаломиелита лошадей, комплекс вирусов леса Семлики и негруппированные вирусы.
Особенности культивирования вирусов. Альфавирусы культивируют в культурах клеток фибробластов куриного эмбриона и др., где они оказывают выраженное цитопатическое действие. В культурах клеток под агаровым покрытием альфавирусы образуют бляшки. В культурах клеток из переносчиков альфавирусы цитопатическое действие не вызывают. К альфавирусам восприимчивы новорожденные белые мыши (1-3-дневного возраста) при интрацеребральном, подкожном и внутрибрюшинном заражении. Вирусы ВсЭЛ, ЗЭЛ, ВНЭЛ патогенны также для взрослых крыс, морских свинок и кроликов. Возможно заражение куриных эмбрионов в желточный мешок. Гибель куриных эмбрионов наступает через 2-3 дня.
Эпидемиология, патогенез и клинические проявления. Альфавирусы чаще встречаются в южных широтах. Они вызывают природно-
очаговые зоонозные инфекции. Почти все альфавирусы экологически связаны с комарами, являющимися не только их переносчиками, но и источником и резервуаром альфавирусов в природе. Резервуаром вирусов в природных очагах являются также позвоночные: птицы, грызуны, приматы и другие прокормители комаров. Основной механизм заражения трансмиссивный. Природные очаги поддерживаются за счет циркуляции вирусов между членистоногими и позвоночными. Человек, попадая в природный очаг заболевания, заражается при укусах инфицированными членистоногими. При высокой плотности населения и большой численности комаров человек становится источником-накопителем альфавирусов и они могут передаваться трансмиссивно от человека к человеку. Эпидемии заболевания обрываются тогда, когда создается большая иммунная прослойка населения в результате перенесенного заболевания и вакцинации.
Альфавирусы относятся к возбудителям особо опасных инфекций. В лабораторных условиях заражение людей может произойти в результате вдыхания аэрозолей при создании высоких концентраций вирусных частиц, поэтому работа с альфавирусами может проводиться лишь в специальных режимных лабораториях.
Патогенез альфавирусных инфекций состоит из стадий, характерных для всех арбовирусных заболеваний. Вирусы размножаются в тканях и органах членистоногих, в том числе в слюнных железах. При последующем укусе человека или животного при кровососании они проникают в кровь, кровью заносятся во внутренние органы, где размножаются в эндотелии капилляров, откуда снова поступают в кровь. Эта вторичная вирусемия сопровождается появлением лихорадки. Вазотропные вирусы поражают эндотелий капилляров внутренних органов, а нейротропные вирусы проникают в ЦНС, где вызывают гибель клеток.
У человека альфавирусы могут вызвать заболевания, сопровождающиеся лихорадкой, высыпаниями на коже, развитием эн- цефалита и артрита. Основными представителями альфавирусов, патогенных для человека, являются вирусы Синдбис, лихорадки леса Семлики, Чикунгунья, О Ньонг-Ньонг, ВсЭЛ, ЗЭЛ и ВНЭЛ. (Полный текст изложен в материалах диска.)
ВсЭЛ, ЗЭЛ, ВНЭЛ, Чикунгунья, О Ньонг-Ньонг вызывают эпидемии заболеваний, проявляющиеся энцефалитом или системной лихорадкой.
Иммунитет. В результате перенесенных заболеваний появляется стойкий иммунитет. Вируснейтрализующие антитела сохраняются в течение многих лет.
Лабораторная диагностика. Выделение вирусов из крови и цереброспинальной жидкости проводят путем заражения новорожденных белых мышей интрацеребрально, а также заражения культур клеток, где они оказывают цитопатическое действие, и бляшек под агаровым покрытием. Идентификацию вирусов проводят в РН на мышах или культурах клеток, в РТГА с эритроцитами гусей, РСК, РИФ и ИФА.
Серодиагностика основана на обнаружении антител в парных
сыворотках с помощью РН, РСК, РТГА, РРГ, РНГА, РИФ, ИФА.
Экспресс-диагностика альфавирусных инфекций основана на обнаружении антигенов в исследуемом материале с помощью РНГА, РИФ, ИФА, а также использовании молекулярно-генетических методов исследования (молекулярная гибридизация нуклеиновых кислот, ПЦР).
Специфическое лечение и профилактика. Применяют рибавирин, интерферон и реаферон. В ряде случаев для специфического лечения используют сыворотки реконвалесцентов и гетерогенные иммуноглобулины. Для создания активного искусственного при- обретенного иммунитета в целях профилактики применяют убитые формолвакцины. Вакцинация необходима для персонала, работающего с вирусами.
17.1.4.2. Вирус краснухи
Вирус краснухи, помимо приобретенной краснухи, вызывает врожденную краснуху и прогрессирующий краснушный панэнце- фалит.
В
Таксономическое положение вируса. Вирус краснухи относится к семейству Togaviridae, роду Rubivirus. Название происходит от лат. rubrum - красный, что связано с покраснением кожи у больных в связи с появлением на ней пятнисто-папулезной сыпи.
Морфология и химический состав вируса. Вирион вируса краснухи имеет сферическую форму, диаметр 60-70 нм. Геном вируса состоит из однонитевой плюс-нитевой РНК, окруженной капсидом с кубическим типом симметрии и внешней липидсодержащей оболочкой, на поверхности которой находятся шипы. В структуре вириона три белка - C, E1 и E2, два последние из них - гликопротеины, расположенные во внешней оболочке вириона.
Устойчивость к действию физических и химических факторов. Вирус краснухи чувствителен к эфиру и детергентам. Он малоустойчив к действию физических и химических факторов, неустойчив в окружающей среде. Вирус инактивируется при 100 ?С за 2 мин. Разрушение вируса происходит под действием органических рас- творителей, хлорактивных соединений, формалина, УФ-лучей, солнечного света. При низких температурах в замороженном состоянии он сохраняет свою активность годами.
Антигенная структура. Вирус краснухи представлен одним серотипом. Он имеет внутренний нуклеокапсидный антиген C, выявляемый в РСК. Протективным антигеном является Е2, к которому вырабатываются вируснейтрализующие антитела. E2 также является гемагглютинином, агглютинируя эритроциты голубей, гусей и 1-3-дневных цыплят. E1 участвует в прикреплении вируса к клетке и формировании димера с E2.
Особенности культивирования. Вирус краснухи вызывает развитие цитопатического действия и образование бляшек под агаровым покрытием лишь в некоторых перевиваемых культурах клеток: ВНК-21, Vero и др., а также в первичных культурах клеток из тканей человеческого плода, в которых он вызывает очаговую деструкцию клеточного монослоя и образование цитоплазматических эозинофильных включений. Культивирование в других культурах клеток не вызывает развития цитопатического действия. Поэтому в них вирус обнаруживают по феномену интерференции, при этом в качестве индуктора для суперинфекции используют вирус ECHO-11 и вирус везикулярного стоматита, размножение которых в культурах клеток всегда сопровождается развитием цитопатического действия. К вирусу чувствительны куриные и утиные эмбрионы.
Эпидемиология. Краснуха - антропонозное заболевание. Источниками вируса являются человек, больной клинически выраженной или бессимптомной формой краснухи, представляющий
эпидемическую опасность со второй половины инкубационного периода и в течение 7 дней с момента появления сыпи, а также дети с врожденной краснухой, выделяющие вирус в окружающую среду с носоглоточным секретом, а также с мочой и испражнениями в течение многих месяцев (до 2 лет). Отличительной чертой заражения вирусом является наличие двух самостоятельных путей передачи: воздушно-капельного у лиц, общавшихся с источником инфекции, и трансплацентарного от матери к плоду. При этом трансплацентарная передача вируса является связующим звеном в цепи аэрогенного механизма заражения, так как дети с врожденной краснухой передают вирус окружающим воздушно-капельным путем. Вирус, персистирующий в организме больного врожденной краснухой, обладает повышенной вирулентностью.
Патогенез и клинические проявления. Различают две формы болезни: приобретенную и врожденную краснуху, которые имеют существенные различия в клинических проявлениях и механизмах заражения. Входными воротами инфекции при приобретенной краснухе являются слизистые оболочки верхних дыхательных путей, откуда вирус проникает в регионарные лимфатические узлы, где размножается и поступает в кровь. С током крови вирус разносится по органам и оседает в лимфатических узлах и эпителиальных клетках кожи, где и развивается иммунная воспалительная реакция, сопровождающаяся появлением пятнисто-папулезной сыпи. Инкубационный период 11-24 дня, в среднем 16-21 день. Заболевание начинается с незначительного повышения температуры и легких катаральных симптомов, конъюнктивита, а также увеличения заднешейных и затылочных лимфатических узлов. В последующем появляется пятнисто-папулезная сыпь, расположенная по всему телу. Вирус выделяется из организма больных с секретом слизистых оболочек верхних дыхательных путей, а также с мочой и фекалиями. Он исчезает из крови через 2 суток после появления сыпи, но сохраняется в секрете слизистых оболочек верхних дыхательных путей в течение 2 нед. У детей краснуха, как правило, протекает легко.
Иммунитет. Независимо от формы заболевания у переболевших лиц остается стойкий, напряженный иммунитет.
Врожденная краснуха - факультативная медленная вирусная инфекция, развивающаяся в результате внутриутробного трансплацентарного заражения плода, персистенции вируса в его тка-
нях, где он оказывает тератогенное действие. Она характеризуется развитием катаракты, глухоты и пороков сердца, а также других аномалий развития. Слепота в сочетании с глухотой и поражением ЦНС приводят к умственной отсталости. Особую опасность представляет заражение краснухой в I триместре беременности, так как в этом периоде происходит формирование всех основных тканей и органов плода. Около 1/4 детей, зараженных в этот период, рождаются с симптомами врожденной краснухи, а у 85% детей регистрируются другие формы патологии развития. Тератогенное действие вируса обусловлено торможением митотической активности клеток, ишемией плода в результате поражения сосудов плаценты, иммуносупрессивного действия избыточной антигенной нагрузки на развивающуюся иммунную систему, а также прямым цитопа- тогенным действием вируса на клетки плода. У новорожденных с врожденной краснухой определяются IgM как показатель внутриутробной инфекции. Иммунитет после врожденной краснухи менее стоек, так как формирование его происходит в условиях незрелой иммунной системы плода. У лиц с врожденной краснухой в течение второго десятилетия жизни может развиться прогрессирующий краснушный панэнцефалит (ПКПЭ) - медленная вирусная инфекция, характеризующаяся комплексом прогрессирующих нарушений двигательной и умственной функции ЦНС и завершающаяся летальным исходом.
Лабораторная диагностика краснухи основана на выделении вируса из смывов со слизистой оболочки носа и зева, крови, мочи, реже испражнений, а также внутренних органов погибших детей и обнаружении антител в парных сыворотках и цереброспинальной жидкости при врожденной краснухе и ПКПЭ, а также по- становке ПЦР. Так как вирусологический метод сложен и трудоемок, основной комплекс методов диагностики краснухи включает определение специфических антител к вирусу в ИФА: обнаружение специфических IgM или нарастание IgG в парных сыворотках, определение индекса авидности IgG и выявление РНК вируса краснухи.
Специфическое лечение и профилактика. Первоочередной задачей профилактики является защита беременных от внутриутробного инфицирования плода, а не предохранение от краснухи детских контингентов. С этой целью применяют живую вакцину из аттенуированных штаммов. В национальный календарь профилак-
тических прививок включены вакцинация против краснухи у детей в 12-15 мес, а также ревакцинация детей в возрасте 6 лет и им- мунизация девочек в возрасте 13 лет, а также выборочную вакцинопрофилактику у серонегативных женщин детородного возраста. Иммунитет у привитых сохраняется в течение 20 лет. Заболевание краснухой в I триместре беременности является показанием к прерыванию беременности.
17.1.5. Вирусы семейства Flaviviridae
Название семейства Flaviviridae происходит от лат. flavus - желтый по названию заболевания «желтая лихорадка», которое вызывает вирус данного семейства. Патогенные для человека вирусы входят в состав двух родов: рода Flavivirus, в состав которого входят возбудители арбовирусных инфекций, и рода Hepacivirus, в состав которого входят вирус гепатита C (HCV) и вирус гепатита G (HGV) (см. раздел 17.3).
Типовым представителем семейства Flaviviridae является вирус желтой лихорадки, относящийся к роду Flavivirus.
Морфология, химический состав, особенности репродукции. Это сложные вирусы сферической формы, диаметром 40-60 нм. Геном вирусов состоит из линейной однонитевой плюс-нитевой РНК, окруженной капсидом с кубическим типом симметрии. Нуклеокапсид окружен суперкапсидом, который содержит на своей поверхности 2 гликопротеина. При репродукции вирусы проникают в клетку путем рецепторного эндоцитоза, взаимодействуя с поверхностными фосфо- и гликолипидами. В последующем происходит слияние вирусной оболочки со стенкой вакуоли. Вирусы реплицируются в цитоплазме, сборка происходит во внутриклеточных вакуолях. В полости вакуолей вирусные частицы часто образуют кристаллоподобные образования, формируемые вирусными белками.
Устойчивость к физическим и химическим факторам. Вирусы чувствительны к действию эфира, детергентов и формалина. Устойчивость флавивирусов к действию физических и химических факторов такая же, как и у альфавирусов.
Антигенная структура. Гликопротеин, являющийся гемагглютинином, содержит видо- и родоспецифические антигенные детерминанты. Характерной особенностью флавивирусов является их способность образовывать в инфицированных клетках растворимый антиген, обладающий активностью в РСК и РИД. Антитела
к нему обладают нейтрализующей активностью. Представители флавивирусов внутри семейства и рода по антигенному родству в РТГА сгруппированы в 15 антигенных комплексов или групп: комплекс вирусов клещевого энцефалита, японского энцефалита, лихорадки денге и т.д. Вирус желтой лихорадки стоит вне этих комплексов.
Особенности культивирования. Вирусы культивируют во многих первичных и перевиваемых культурах клеток, цитопатическое действие хорошо проявляется в культурах клеток СПЭВ, ВНК-21. Универсальной моделью для выделения флавивирусов является интрацеребральное заражение новорожденных белых мышей, а также 3-4-недельных белых мышей, у которых отмечается развитие параличей. В качестве экспериментальной модели используют обезьян. Вирусы культивируют также путем заражения куриных эмбрионов на ХАО и в желточный мешок. Гибель куриных эмбрионов отмечается через 72 ч. Для вирусов лихорадки денге вы- сокочувствительной моделью является интраторакальное и интракапутальное заражение комаров.
Эпидемиология, патогенез и клинические проявления. Флавивирусы широко распространены в природе и, как и другие арбовирусы, вызывают природно-очаговые заболевания с трансмиссивным механизмом заражения. Основным резервуаром и источником флавивирусов в природе являются кровососущие членистоногие переносчики, у которых доказано наличие трансфазовой и транс- овариальной передачи флавивирусов. Большая часть флавивирусов распространяется комарами (вирусы лихорадки денге, вирус желтой лихорадки, японского энцефалита, лихорадки Западного Нила), некоторые передаются клещами (вирусы клещевого энцефалита, омской геморрагической лихорадки, вирус болезни леса Киассанур и др.). Комариные флавивирусные инфекции распространены преимущественно в южных широтах, в то время как клещевые встречаются повсеместно. Важную роль в поддержании флавивирусов в природе играют прокормители кровососущих членистоногих переносчиков - теплокровные позвоночные животные: грызуны, птицы, летучие мыши, приматы и т.д., у которых инфекция обычно протекает бессимптомно, но сопровождается выраженной вирусемией, что способствует трансмиссивному механизму заражения. Человек - случайное, тупиковое звено в экологии флавивирусов, однако для лихорадки денге и городского
типа желтой лихорадки больной человек также является основным резервуаром и источником вируса.
Помимо основного трансмиссивного механизма заражения и пути передачи, заражение флавивирусами может происходить кон- тактным, аэрогенным и пищевым путями.
Патогенез сходен с патогенезом заболеваний, вызываемых другими арбовирусами (см. патогенез буньявирусных и альфавирусных инфекций). Флавивирусы более патогенны, они вызывают тяжело протекающие заболевания, сопровождающиеся поражением печени и геморрагическим синдромом (желтая лихорадка, лихорадка денге, омская геморрагическая лихорадка, болезнь леса Киассанур) или развитием энцефалитов (клещевой энцефалит, японский энцефалит).
Иммунитет после перенесенных заболеваний напряженный, повторные заболевания не наблюдаются.
Лабораторная диагностика основана на выделении вирусов путем интрацеребрального заражения мышей, культур клеток, куриных эмбрионов и заражения комаров, а также обнаружении антител в парных сыворотках. Материалом при проведении вирусологического исследования служат кровь, взятая в первые дни заболевания и в период повторного приступа лихорадки, цереброспинальная жидкость, секционный материал (мозг, печень, селезенка, лимфатические узлы), внутренние органы погибших диких животных, переносчики - клещи, комары, москиты, а также молоко коз, коров и овец (вирус клещевого энцефалита), озерная вода, в которой находились тушки павших животных (вирус омской геморрагической лихорадки). Индикация вирусов проводится на основании гибели мышей и куриных эмбрионов, в культурах клеток с помощью РГА с эритроцитами гусей, по обнаружению цитопатического действия и бляшкообразованию. Идентификация проводится с по- мощью РН, РТГА, РСК, РНГА, РИД, РИФ, ИФА. По сравнению с
РСК и РТГА РН наиболее специфична при работе с арбовирусами, позволяет осуществлять их типовую дифференциацию.
Обнаружение антител в парных сыворотках проводят с помощью РТГА, РТНГА, РСК, РРГ, РН, РнИФ, ИФА. Диагностическим считается нарастание титров антител более чем в 4 раза. Обнаружение IgM свидетельствует о свежем инфицировании. При энцефалитах важную роль играет обнаружение антител в цереброспинальной жидкости, так как их раннее обнаружение свидетельствует о текущей инфекции.
Экспресс-диагностика флавивирусных инфекций осуществляется на основании обнаружения антигенов с помощью РНГА, РИФ, ИФА и РИА. Из молекулярно-генетических методов диагностики применяют молекулярную гибридизацию нуклеиновых кислот и ПЦР.
Лечение и профилактика. Из противовирусных препаратов для лечения применяют рибавирин, интерферон, реаферон, биназу. Для экстренной профилактики и лечения используют гетерогенные и гомологичные иммуноглобулины. При проведении вакцинопрофилактики для создания активного искусственного приобретенного иммунитета применяют в основном убитые формалином вакцины, за исключением живой вакцины против желтой лихорадки.
17.1.5.1. Вирус желтой лихорадки
Таксономическое положение и биологические свойства. Возбудитель желтой лихорадки был открыт в
Эпидемиология, патогенез и клинические проявления. Заболевание распространено в тропических и субтропических странах Центральной и Южной Америки, Африки. Различают две эпидемиологические формы желтой лихорадки - джунглевая (зоонозная) и городская (антропонозная). При джунглевой природно-очаговой зоонозной форме вирус циркулирует главным образом между обе- зьянами и комарами, которые могут нападать на людей. Главную роль в возникновении эпидемий играет городская форма желтой лихорадки, при которой вирус циркулирует между человеком и синантропными комарами A. aegipti. Вирусы активно размножаются в комарах, достигая определенных критических концентраций в слюнных железах комаров, что необходимо для инфицирования человека. Вспышки этого заболевания соответствуют ареалу распространения переносчиков вируса: от 42? северной широты до 40? южной широты.
Желтая лихорадка не только относится к особо опасным инфекциям, но и является единственной карантинной арбовирусной
инфекцией. Механизм заражения трансмиссивный. Вирус попадает в организм человека при укусе его комарами и последующем кровососании. Инкубационный период 3-6 дней. Вирус проникает в регионарные лимфатические узлы, где происходит его размножение в течение всего инкубационного периода. Затем он попадает в кровь; вирусемия продолжается 3-4 дня. Распространяясь гематогенно и обладая вазотроизмом, вирус попадает в печень, почки, костный мозг, селезенку, а также головной мозг. Развиваются дистрофия и некроз гепатоцитов, поражаются клубочковый и канальцевый аппараты почек. Заболевание может возникнуть также при попадании крови больного или погибшего человека на поврежденную кожу или слизистые оболочки. Клинически заболевание проявляется лихорадкой, интоксикацией, геморрагическим синдромом, поражением печени и почек. Летальность до 20-50%. Иммунитет напряженный.
Лабораторная диагностика основана на выделении вируса из крови не позднее 3-4-го дня болезни, а в летальных случаях - из печени путем заражения новорожденных белых мышей, комаров и культур клеток и определения нарастания титров антител в парных сыворотках с помощью РТГА, РСК, РН и ИФА. Экспресс- диагностика проводится индикацией вирусного антигена в крови больных или печени умерших с помощью ИФА. Для ускоренной диагностики определяют IgM в сыворотках крови с помощью ИФА, что говорит о текущей инфекции.
Специфическое лечение и профилактика. Специфическое лечение желтой лихорадки не разработано. Всем лицам, выезжающим в неблагополучные по желтой лихорадке регионы, а также лицам, проживающим на эндемичных по желтой лихорадке территориях, для профилактики применяют вакцину желтой лихорадки живую (штамм 17D). Вакцина создает напряженный иммунитет с 10-го дня после первичной вакцинации на протяжении 10 лет.
17.1.5.2. Вирус клещевого энцефалита
Таксономическое положение и биологические свойства. Вирус клещевого энцефалита (ВКЭ) выделен в
ствам и в антигенном отношении вирусы. Это типичный арбовирус умеренного пояса, он включает три подтипа: европейский, дальневосточный и сибирский.
Геном ВКЭ представлен однонитевой плюс-РНК. Зрелый вирус содержит три структурных белка: капсидный белок C, мембранный белок М и поверхностный белок Е. Белок Е обусловливает тропизм вирусов к клеткам. На его поверхности располагаются детерминанты висцеротропности и нейровирулентности. В геноме ВКЭ закодированы неструктурные белки NS1-NS5 и вирусная РНК-полимераза. Они участвуют в репликации вируса. Несмотря на небольшую устойчивость вируса к действию физических и химических факторов, в организме переносчиков он сохраняет свою жизнеспособность в широком диапазоне температур - от -150 ?С до 30 ?С, что способствует его широкому распространению. Вирус проявляет высокую резистентность к действию кислых значений pH, что важно при алиментарном пути заражения.
Эпидемиология. Переносчиком и основным долговременным резервуаром вируса являются иксодовые клещи (таежный - I. persulcatus и лесной - I. ricinus). Поддержание длительной циркуляции вируса осуществляется за счет грызунов, птиц, диких и домашних животных. Для клещевого энцефалита характерна весенне-летняя сезонность.
Основной механизм заражения трансмиссивный. Человек заражается при укусе инфицированным клещом. Нередко для развития заболевания достаточно лишь наползания на кожу клещей и нимф. Проникновение вируса в организм возможно также контактным путем через мелкие повреждения кожи. Доказан и алиментарный путь заражения при употреблении сырого молока коз и овец (молочная лихорадка или двухволновый менингоэнцефалит).
Патогенез и клиническая картина. Инкубационный период 8-23 дня. Различают висцеральную и невральную стадии клещевого энцефалита. Вирус размножается в месте входных ворот инфекции под кожей, откуда он попадает в кровь, вызывая первичную вирусемию. Далее вирус проникает в лимфатические узлы, селезенку, эндотелий кровеносных сосудов, где активно размножается. При пищевом пути заражения входными воротами является слизистая оболочка глотки и тонкой кишки. В конце инкубационного периода в результате активного размножения вируса возникает вторичная вирусемия, длящаяся 5 дней. Вирусы гема-
тогенно, а возможно, и периневрально проникают в головной и спинной мозг. Процесс носит чрезвычайно диффузный характер, поражая все отделы ЦНС. Особенно страдают крупные двигательные клетки в сером веществе спинного мозга и ядрах двигательных черепно-мозговых нервов в стволе головного мозга. Здесь отмечается наибольшее скопление вирусов, вызывающих некроз клеток. Несмотря на вирусемию, больной человек является «тупиком» для вируса, так как не может быть донором для клещей.
Различают три клинические формы клещевого энцефалита: лихорадочную, менингеальную и очаговую, которая протекает наи- более тяжело и сопровождается развитием параличей шеи и верхних конечностей.
Иммунитет. После перенесенного заболевания остается стойкий иммунитет. ВКЭ относится к факультативным возбудителям медленных вирусных инфекций. В ряде случаев у 2-12% больных отмечается прогредиентное течение заболевания (от лат. gradatio - постепенное усиление, неуклонное прогрессирование) с переходом в хроническую форму на фоне активного антителообразования. Персистирующий ВКЭ меняет свои свойства. Он не экспрессирует антигены на поверхности клеток и не оказывает цитопатического действия.
Лабораторная диагностика клещевого энцефалита основана на обнаружении вируса и его антигенов в исследуемом материале, постановке ПЦР, а также обнаружении антител. Вирус выделяют из крови и цереброспинальной жидкости больных, а также внутренних органов и мозга умерших путем интрацеребрального заражения новорожденных белых мышей и культур клеток. Идентификацию вируса проводят в РТГА, РН и РСК, а в монослое культур клеток в РИФ. Обнаружение антител в парных сыворотках и цереброспинальной жидкости проводят с помощью РСК и РТГА. Для обнаружения специфических IgM и IgG к белку E ВКЭ применяют ИФА. Разработана лантанидная иммунофлюоресцентная система для выявления специфических антител классов M и G, а также антигенов ВКЭ. Обнаружение антигенов в исследуемом материале, в том числе в клещах, снятых с укушенных людей, проводят с помощью ИФА-Е. Экспресс-диагностика клещевого энцефалита основана на обнаружении вирусного антигена в крови с помощью РНГА и ИФА, выявлении IgM-антител на первой неделе заболевания в цереброспинальной жидкости и обнаружении РНК
вируса с помощью ПЦР в крови и цереброспинальной жидкости у людей.
Специфическое лечение и профилактика. Для лечения и экстренной профилактики клещевого энцефалита применяют специфический гомологичный донорский иммуноглобулин против клещевого энцефалита. При отсутствии данного препарата назначают специ- фический гетерологичный лошадиный иммуноглобулин. При невозможности введения иммуноглобулина используют индуктор интерферона (йодантипирин). Серотерапию необходимо начинать не позднее 3-4-го дня заболевания. Для вакцинации лиц, проживающих на эндемичных по клещевому энцефалиту территориях, а также выезжающих на эти территории в весенне-летний период используют убитые культуральные вакцины.
Для исключения пищевого пути заражения в природных очагах клещевого энцефалита необходимо потреблять только кипяченое молоко.
17.1.5.3. Вирус лихорадки Западного Нила
Таксономическое положение. Вирус лихорадки Западного Нила (ЛЗН) является представителем антигенного комплекса вирусов японского энцефалита. Вирус имеет 4 генотипа.
Эпидемиология, патогенез и клинические проявления. Возбудитель ЛЗН распространен во многих странах. В России заболевание встречается в Западной Сибири и Краснодарском крае. Резервуаром и источником вируса являются дикие и домашние птицы, главным образом водного и околоводного экологического комплекса, комары и клещи. Клещи играют особую роль в его сохранении в зимних условиях. Он циркулирует также среди домашних животных. Механизм передачи вируса трансмиссивный, переносчики - комары рода Culex, а также аргасовые и иксодовые клещи. Восприимчивость у людей высокая. Инкубационный период 2-8 дней. Заболевание сопровождается высокой лихорадкой в течение 3-12 дней, головными болями, болями в суставах, скарлатиноподобной сыпью и полиаденитом. В большинстве случаев заболевание протекает доброкачественно. Тяжелые случаи заболевания сопровождаются развитием менингита и энцефалита с парезами, параличами и летальным исходом. После перенесенного заболевания формируется напряженный иммунитет.
Лабораторная диагностика заключается в выделении вируса путем заражения новорожденных белых мышей и культур клеток, а
также обнаружения антител в парных сыворотках с помощью РН,
РСК, РТГА, РИФ и ИФА.
Специфическое лечение и профилактика не разработаны.
17.1.6. Ортомиксовирусы (вирусы гриппа)
Таксономия. Ортомиксовирусы (семейство Orthomyxoviridae, от греч. orthos - прямой, правильный, туха - слизь) - РНК-содержащие сложноорганизованные вирусы. Семейство включает в себя 5 родов: род Thogotovirus (передаваемые клещами арбовирусы), род Isavirus (вирус инфекционной анемии лосося) и три рода вирусов гриппа - Influenzavirus А, Influenzavirus В и Influenzavirus С.
Наибольшее значение в патологии человека имеют вирусы гриппа, среди которых наибольшим антигенным разнообразием и эпидемической опасностью обладают вирусы гриппа А.
Грипп (от старофранц. Grippe -
схватывать, царапать) - острое инфекционное вирусное заболевание
человека, характеризующееся поражением респираторного тракта,
лихорадкой, общей инток- сикацией, нарушением деятельности
сердечно-сосудистой и нервной систем. Впервые симптомы болезни описали
Гиппократ и Тит Ливий в
История выделения возбудителя. Вирус гриппа от человека был впервые выделен в
Строение и репродукция вирусов. Вирион имеет сферическую форму, могут встречаться нитевидные формы значительной длины. Диаметр вирусной частицы 80-120 нм. Вирион представляет собой нуклеокапсид (имеющий спиральный тип симметрии), по- крытый липопротеиновой оболочкой.
Нуклеокапсид вирусов гриппа содержит однонитевую сегментированную минус-нитевую РНК (вирусы А и В имеют 8 сегмен- тов, вирус С - 7) в комплексе с белком нуклеопротеином (NP), причем каждый сегмент еще соединен с тремя белками полимеразного комплекса (РВ1, РВ2, РА). На основе каждого из сегментов создается комплементарная мРНК для синтеза вирусных белков.
Первый сегмент кодирует полимеразный белок PB1 и благодаря дополнительной рамке считывания белок PB1-F2, который имеет сродство к митохондриям и участвует в запуске апоптоза инфицированной клетки. Второй и третий сегменты кодируют белки PB2 и РА соответственно. Данные белки полимеразного комплекса необходимы для осуществления транскрипции и репликации вирусного генома. Четвертый сегмент вирусной РНК кодирует ге- магглютинин, который синтезируется сначала в виде единой полипептидной цепи, а затем подвергается химическим модификациям, расщепляется на две субъединицы и в результате приобретает способность осуществлять слияние вирусной оболочки с клеточной мембраной. Пятый сегмент РНК вируса гриппа кодирует NP- белок, некоторые участки которого способны связываться с РНК. Шестой сегмент у вирусов гриппа А и В кодирует нейраминидазу (а у вирусов В еще и гликопротеин NB, участвующий в транспорте ионов). Седьмой сегмент у вируса гриппа А кодирует белки М1 и М2. Белок М1 образует внутренний слой оболочки вириона, а белок М2 своей центральной трансмембранной частью формирует канал для транспорта ионов внутрь вирусной частицы. Формирование таких каналов является необходимым условием для отделения нуклеокапсида от белка М1 при проникновении вирусного генома в клетку. У вирусов гриппа В и С седьмой сегмент кодирует белки ВМ2 и СМ2 соответственно, а также белок М1. Белки ВМ2 и СМ2 отличаются по своей структуре от белка М2 у вируса гриппа А. Восьмой сегмент кодирует белки NS1 и NS2 (или NEP), которые защищают вирусы от воздействия интерферона (NS1) и участвуют в транспорте синтезированных в ходе репродукции нуклеокапсидов из ядра клетки в цитоплазму (NS2). Сегментированная РНК вирусов предрасположена к генетическим рекомбинациям.
Нуклеокапсид у вирусов гриппа окружен слоем белков М1, которые составляют внутренний слой липопротеиновой оболочки. Липопротеиновая оболочка (суперкапсид) имеет клеточное происхождение. Суперкапсид включает в себя вирусные трансмембранные белки (такие, как М2, NB, ВМ2, СМ2) и несет на своей поверхности шипики, образованные двумя сложными белкамигликопротеинами - гемагглютинином (НА) и нейраминидазой (NА). В каждом вирионе количество гемагглютинина во много раз больше, чем нейраминидазы. У вирусов типа С нейраминидазы нет. Шипики - это выросты длиной около 10 нм, шип гемагглю-
тинина - тример, т.е. состоит из 3 молекул белка, соединенных вместе, шип нейраминидазы - тетрамер, т.е. состоит из 4 молекул белка. На поверхности обоих гликопротеинов есть специальные области для связывания с рецепторами на чувствительных клетках. Для вирусов гриппа специфическими рецепторами являются соединения, содержащие сиаловую кислоту. Так как на мембранах клеток состав сиалоолигосахаридов разный, существует видовая и тканевая специфичность клеточных рецепторов, кроме того, у молекул гемагглютинина разных вирусов может быть разное строение «рецепторного кармана», что ограничивает круг хозяев разных вариантов вирусов гриппа А.
Взаимодействие вирусов гриппа с клеткой начинается с того, что гемагглютинины связываются с рецепторами, а затем нейраминидаза отщепляет от них сиаловую кислоту и затем вирус проникает в клетку путем эндоцитоза. Далее происходят слияние оболочки вируса с мембраной эндосомы, частичная депротеинизация вируса и нуклеокапсид выходит в цитоплазму, а затем транспортируется в ядро клетки. В ядре клетки происходит транскрипция генов, в которой участвуют белки полимеразного комплекса. Синтез и процессинг клеточных мРНК представляют собой сложный процесс, в результате которого минус-нить каждого сегмента вирусной РНК трансформируется в комплементарные плюс-нити. мРНК транспортируются в цитоплазму, где и кодируют синтез соответствующего белка на рибосомах. При репликации генома вируса, которая идет в ядре клеток, транскрибируется вся нить сегмента РНК. Сначала образуется плюс-нить, затем на матрице образуется минус-нить РНК для дочерних вирусов. Сборка нуклеокапсида происходит в ядре, куда к этому времени транспортируются синтезированные капсидные белки (NP и белки полимеразного комплекса).
Гемагглютинин, нейраминидаза, а также М-белки в процессе репродукции вирусов встраиваются в мембрану клетки-хозяина, а так как формирование вирусных частиц идет на клеточных мембранах, в которые к этому времени уже встроены гемагглютинин и нейраминидаза, то, выходя из клетки путем почкования, вирусы покрываются оболочкой, уже содержащей НА-, NА- и М-белки. При выходе вирусов из клетки проявляется еще одна важная функция нейраминидазы - она препятствует аггрегации новых вирионов. Кроме того, она снижает вязкость секретов, и вирусы легче проникают в нижние отделы респираторного тракта.
Антигенная структура. Вирусы гриппа имеют внутренние и поверхностные антигены. Внутренние типоспецифические антигены представлены нуклеопротеином (NP-белком) и М-белками. Поверхностные антигены - это гемагглютинин и нейраминидаза. Антитела к поверхностным антигенам обладают защитным свойством при гриппе. Структура поверхностных антигенов вирусов гриппа А постоянно изменяется, причем изменения НА- и NА-белков происходят независимо друг от друга. В настоящее время известны более 15 подтипов гемагглютинина и 9 подтипов нейраминидазы, но от человека стабильно выделяются только Н1, Н2, Н3 и N1, N2. Вирус гриппа В более стабилен, хотя все же имеет несколько разновидностей. Наиболее стабильной антигенной структурой обладает вирус гриппа С.
Изменчивость вирусов гриппа А, приводящая к образованию все новых антигенных вариантов, объясняется двумя процессами, которые получили названия «антигенный дрейф» и «антигенный шифт».
Антигенный дрейф - это незначительные изменения структуры гемагглютинина и/или нейраминидазы, которые происходят часто и обусловлены точечными мутациями в тех участках генома вируса, которые отвечают за синтез и структуру детерминант поверхностных антигенов. В результате в популяции вирусов постоянно появляются новые антигенные варианты, которые и обусловливают периодические эпидемии гриппа, потому что через несколько лет циркуляции любого штамма вируса гриппа среди людей структура его поверхностных протективных антигенов так изменяется, что выработанный ранее иммунитет только частично защищает от заболевания.
Антигенный шифт (shift - скачок) - это появление новой разновидности гемагглютинина и/или нейраминидазы, которое обусловлено пересортировкой (реассортацией) и полной заменой гена, кодирующего или гемагглютинин, или нейраминидазу определенной разновидности. Шифт происходит редко и обычно является результатом рекомбинаций, возникающих при заражении одной клетки двумя разными вирусами одного и того же рода (например, от человека и от животных). В результате полностью изменяется структура антигена и образуется гибридный вирус-реассортант. Если возникший в результате шифта новый штамм вируса гриппа адаптируется к существованию в организме человека, то он ста-
новится причиной пандемии, так как человеческая популяция не имеет к нему иммунитета.
Резистентность. В окружающей среде устойчивость вирусов средняя. Вирусы гриппа чувствительны к высоким температурам (выше 60 ?С), УФ-облучению, жирорастворителям, но могут некоторое время сохраняться при низких температурах - в течение недели не погибают при температуре около 4 ?С. Вирусы чувстви- тельны к табельным дезинфектантам.
Эпидемиология. Грипп - антропонозная инфекция. Основной механизм передачи - аэрогенный, путь передачи воздушнокапельный (при кашле, чиханье и т.п.). Также возможна контактная передача (например, при прикосновении к слизистой оболочке носа пальцами, контаминированными вирусом).
Грипп - высококонтагиозное заболевание и часто протекает в виде эпидемий и даже пандемий, восприимчивость людей очень высокая. Чаще и тяжелее болеют дети, как не имеющие стойкого противогриппозного иммунитета. Но смертность выше среди взрослых, особенно из так называемой группы риска (пожилые люди, больные с хроническими заболеваниями органов дыхания и сердечно-сосудистой системы, лица с ослабленной резистент- ностью и т.д.). Вспышки инфекции легко возникают в замкнутых коллективах.
Наибольшее
эпидемиологическое значение имеют вирусы гриппа А: они поражают и
людей, и животных (в том числе птиц), вызы- вают эпидемии и даже
пандемии с высокой смертностью. В ХХ веке наиболее известны три
пандемии гриппа А: в
В последние годы в эпидемическом процессе одновременно участвуют вирусы гриппа А (Н3N2 и Н1N1), а также вирус гриппа типа В. Поэтому именно такие разновидности вирусов включены в состав современных вакцин для профилактики гриппа.
Однако, несмотря на создание профилактических средств, грипп относят к числу неуправляемых инфекций, поэтому так важна соз- данная ВОЗ программа глобального эпидемиологического надзора за гриппом, в которой участвует и Россия.
Патогенез. Обычно входные ворота инфекции - это верхние дыхательные пути, но вирус может проникнуть сразу в альвеолы, что вызывает развитие пневмонии. Первичная репродукция вирусов происходит в клетках эпителия респираторного тракта. Инфицированные клетки начинают вырабатывать интерферон, оказывающий неспецифическое противовирусное действие. Развиваются воспаление, отек, набухание базальной мембраны, происходит десквамация клеток поверхностного эпителия. Через поврежденные эпителиальные барьеры вирус гриппа А проникает в кровоток и вызывает виремию. Всасывание продуктов распада клеток также оказывает токсическое и сенсибилизирующее действие на организм. Вирус активирует систему протеолиза и вызывает повреждение эндотелия капилляров. Это повышает проницаемость сосудов и серозных оболочек, что вызывает геморрагии и нарушение гемодинамики с расстройствами микроциркуляции. При гриппе также развивается транзиторный вторичный иммунодефицит, что предрасполагает к развитию вторичной бактериальной инфекции.
Клиническая картина. Инкубационный период 1-2 дня. Клинические проявления в течение 3-7 дней, реконвалесценция - 7-10 дней. При гриппе А начало болезни острое, у больного обычно наблюдается интоксикация (высокая лихорадка с ознобом, суставные и мышечные боли, сильная головная боль). Вирус гриппа А нейротропен, поэтому возможно развитие нейротоксикоза, в результате чего может наступить смерть (чаще у детей). Развивается катар верхних дыхательных путей (саднящий сухой кашель, боли за грудиной, нарушение фонации, ринит и ринорея). Характерен геморрагический синдром - кровоизлияния в кожу, серозные и слизистые оболочки и внутренние органы, повышенная кровоточивость. Опасное осложнение - геморрагическая пневмония и отек легких. Редко и чаще у детей бывает абдоминальный синдром (боли в животе, тошнота, рвота, диарея). Осложнения при гриппе проявляются в виде бактериальной суперинфекции. Грипп А также может осложняться нарушениями функций нервной, сердечнососудистой систем, печени, почек и др. Грипп В обычно протекает легче, чем грипп А, и может сопровождаться такими симптомами,
как конъюнктивит, глазная боль или фотофобия. Кроме того, вирус гриппа В не обладает нейротропностью. Заболевание, вызван- ное вирусами гриппа С, чаще протекает легко.
Иммунитет. Во время заболевания в противовирусном ответе участвуют факторы неспецифической защиты организма, α-интерферон, специфические IgA в секретах респираторного тракта, которые обеспечивают местный иммунитет. Протективные вируснейтрализующие специфические сывороточные антитела появляются на 7-8-й день болезни и достигают максимального уровня через 2-3 нед. В ходе реконвалесценции важна роль клеточного иммунитета (NK-клетки и специфические цитотоксические T-лимфоциты). Постинфекционный иммунитет достаточно длителен и прочен, но высокоспецифичен.
Микробиологическая диагностика. Если целью диагностики является обнаружение возбудителя или его генома, то материалом для исследования служит носоглоточное отделяемое, мазки-отпечатки со слизистой оболочки носа. Возможно постмортальное исследование аутопсийного материала (кусочки пораженной легочной ткани, соскобы со слизистой оболочки бронхов и трахеи). При отборе материала важно получить пораженные вирусом клетки, так как именно в них происходит репликация вирусов, а также правильно организовать транспортировку в лабораторию для сохранения жизнеспособности инфицированных вирусом клеток. Если цель диагностики заключается в поиске вирусспецифических антител, то материалом для исследования являются парные сыворотки больного.
Экспресс-диагностика. Обнаруживают вирусные антигены в исследуемом материале с помощью РИФ (прямой и непрямой варианты) и ИФА. Можно обнаружить в носовых смывах вирусную РНК с помощью ПЦР.
Вирусологический метод. Вирусы гриппа можно выделять в курином эмбрионе, культуре клеток (например, в культуре клеток почек обезьян, почек собак-MDCK и т.п.), а также в организме лабораторных животных. Индикацию вирусов проводят в зависимости от лабораторной модели (по гибели, клиническим и патоморфологическим изменениям, цитопатическому действию, образованию бляшек, цветовой пробе, РГА и гемадсорбции). Идентифицируют вирусы по антигенной структуре. Применяют РСК, РТГА, ИФА, реакцию биологической нейтрализации вирусов и др.
Серологический метод. Диагноз подтверждают при четырехкратном увеличении титра антител в парных сыворотках от больного, полученных с интервалом 10-14 дней. Применяют РТГА, РСК, ИФА, РБН вирусов. Метод часто используют для ретроспективной диагностики.
Лечение. В большинстве случаев течение гриппа доброкаче- ственное и требует только симптоматического/патогенетическо- го лечения (применяют жаропонижающие, сосудосуживающие, антигистаминные препараты, витамины, детоксикацию, иммуномодуляторы, ангиопротекторы, ингибиторы протеолиза и т.д.). Противовирусным действием обладает α-интерферон, препараты которого применяют интраназально. Можно использовать препараты - индукторы эндогенного интерферона. Для этиотропного лечения в первые 48 ч применяют различные противовирусные химиотерапевтические препараты: ремантадин (препятствует репродукции только вирусов гриппа А, блокируя ионные каналы белка М2), арбидол - препарат, который действует на вирусы гриппа А и В, ингибиторы нейраминидазы, например озельтамивир, который связывается со стабильными (консервативными) участками нейраминидазы, одинаковыми у всех типов вирусов гриппа. При тяжелых формах гриппа, которые чаще развиваются у пациентов группы риска, можно применять также противогриппозный донорский иммуноглобулин и нормальный человеческий иммуноглобулин для внутривенного введения. Если присоединяется бактериальная инфекция, назначают антибиотики.
Профилактика. Для неспецифической профилактики гриппа проводят противоэпидемические мероприятия, ограничивающие распространение вирусов гриппа аэрогенно и контактно (изоляция больных, карантин в детских коллективах и лечебных учреждениях, дезинфекция белья и посуды, ношение марлевых повязок, тщательное мытье рук и т.п.). Большое значение имеет повышение общей сопротивляемости организма. Для экстренной химиопрофилактики во время эпидемии гриппа можно применять ингибиторы нейраминидазы, а также арбидол и ремантадин. Для неспецифической противовирусной профилактики используют интраназально препараты α-интерферона и оксолина.
Специфическая плановая профилактика состоит в применении вакцин. Вакцинацию проводят не менее чем за месяц до начала эпидемического сезона (сентябрь-октябрь), чтобы успел сформи-
роваться активный иммунитет. Вакцинирование рекомендовано прежде всего детям, лицам из группы высокого риска, персоналу лечебных учреждений и т.п. Разработано несколько разновидностей вакцин для профилактики гриппа А и В, приготовленных на основе штаммов, прогностически актуальных в данный эпидемический сезон. Вакцинные штаммы обновляются раз в 2-3 года. Для поддержания напряженного иммунитета требуется ежегодная ревакцинация, однако следует помнить, что имеются противопоказания. В настоящее время в России для профилактики гриппа разрешены к применению живые аллантоисные вакцины (интраназальная и подкожная), инактивированные цельновирионные вакцины (интраназальная и парентеральная подкожная), химические (в том числе полимерсубъединичная) и сплит-вакцины. Живые вакцины создают наиболее полноценный, в том числе местный, иммунитет. Однако они и инактивированные цельновирионные или убитые вакцины могут вызывать аллергию у лиц с повышенной чувствительностью к куриному белку. Сплит-вакцины, т.е. так называемые расщепленные, содержат полный набор вирусных антигенов, но из них удалены липиды внешней оболочки, чтобы уменьшить пирогенный эффект. Субвирионные или химические вакцины содержат только протективные антигены - гемагглютинин и нейраминидазу.
17.1.7. Парамиксовирусы (семейство Paramyxoviridae)
Парамиксовирусы (Paramyxoviridae от лат. para - около, myxa - слизь) - семейство оболочечных РНК-содержащих вирусов. Включает два подсемейства: Paramyxovirinae, которое содержит 5 родов - Morbillivirus, Respirovirus, Rubulavirus, Avulavirus и Henipavirus, подсемейство Pneumovirinae, которое содержит 2 рода - Pneumovirus, Metapneumovirus. В
семейство входят респираторно- синтициальный вирус, вирусы кори,
паротита, парагриппа, метапневмовирус человека и др. (табл. 17.1).
Парамиксовирусы передаются респираторным механизмом. В последние годы
открыты новые представители семейства. Недавно открытый (в
рус Нипах и вирус Хендра, вызвавшие эпидемические вспышки тяжелых энцефалитов у людей в странах Юго-Восточной Азии и Австралии.
Таблица 17.1. Классификация парамиксовирусов человека
Структура. Вирион парамиксовирусов имеет сферическую, реже полиморфную или нитевидную форму (диаметр 150-300 нм), окружен оболочкой с гликопротеиновыми шипами. Под оболочкой находится спиральный нуклеокапсид, состоящий из нефраг- ментированной линейной однонитевой минус-РНК, связанной с белками: нуклеопротеином (NP, или N), стабилизирующим геном; полимеразой-фосфопротеином (P) и большим L-белком- полимеразой. Под оболочкой вириона находится матриксный (M) белок. Оболочка вириона содержит шипы - два гликопротеина: белок слияния (F - от англ. fusion), который вызывает слияние мембран вируса и клетки; прикрепительный белок, обозначаемый по-разному для представителей семейства (гемагглютининнейраминидаза - гемагглютинин - Н или гликопроте-
ин - G-белок). F-белок активируется расщеплением клеточной протеазой на 2 субъединицы (F1 и F2). Вирусы рода Rubulavirus, кроме белков F и содержат трансмембранный белок SH
Репродукция парамиксовирусов инициируется связыванием НN-, Н- или G-белков оболочки вириона с сиаловой кислотой поверхности клетки. Клеточным рецептором для вируса кори является кофактор комплемента CD46. За счет F-белка (а у некоторых представителей и белка происходит слияние оболочки вируса с плазмолеммой клетки. В клетку проникает нуклеокапсид
без образования эндосом. Парамиксовирусы индуцируют слияние клеток, образуя поликарионы - синцитий. Вирус Сендай мышей (с расщепленным F-белком) часто используют для слияния клеток при получении клеточных гибридов. Репликация генома сходна с репликацией минус-РНК-геномных вирусов (например, вируса бешенства): РНК-полимеразный комплекс вируса вносится в клетку с его нуклеокапсидом. Репродукция вируса происходит в цитоплазме. Геном транскрибируется в отдельные иРНК и полноценную плюсматрицу для геномной РНК. Нуклеокапсиды, сформированные из новых геномов и белков капсида (L-, N- и NP), связываются с М-белком и окружаются оболочкой из модифицированной плазмолеммы клетки. Вирионы выходят из клетки почкованием.
Резистентность. Парамиксовирусы чувствительны к высокой температуре (50 ?С), детергентам, дезинфицирующим веществам и другим факторам. Большая устойчивость отмечается к низким температурам.
17.1.7.1. Вирусы парагриппа
Парагрипп - острая инфекционная болезнь, характеризующаяся катаральными проявлениями верхних дыхательных путей; раз- виваются ларинготрахеобронхит, бронхиолит, пневмония.
Вирусы парагриппа (ВПГЧ) человека были открыты в
Структура и антигенные свойства. ВПГЧ сходны с другими представителями семейства. Однонитевая, нефрагментированная минус-РНК вируса кодирует 7 белков. Нуклеокапсид является внутренним антигеном. Оболочка вируса содержит гликопротеиновые шипы и F). По антигенным свойствам НH-, NP- и F-белков различают 4 основных серотипа вирусов парагриппа (ВПГЧ-1, ВПГЧ-2, ВПГЧ-3, ВПГЧ-4). У ВПГЧ-1, ВПГЧ-2, ВПГЧ-3 имеются общие антигены с вирусом эпидемического паротита. Гемагглютинин вирусов отличается по спектру действия: ВПГЧ-1 и ВПГЧ-2 склеивают разные эритроциты (человека, кур, морской свинки и др.), ВПГЧ-3 не агглютинирует эритроциты кур, ВПГЧ-4 склеивает только эритроциты морской свинки.
Культивирование вирусов осуществляется на первичных культурах клеток.
Резистентность ВПГЧ не отличается по резистентности от других представителей семейства.
Эпидемиология. Источник парагриппа - больной человек, особенно на 2-3-и сутки болезни. Заражение происходит аэрогенно. Основной путь передачи вируса воздушно-капельный. Возможен также контактно-бытовой путь. Заболевание отличается широким распространением и контагиозностью. Чаще от больных выделяют ВПГЧ-1, ВПГЧ-2 и ВПГЧ-3.
Патогенез и клиническая картина. Входные ворота инфекции - верхние дыхательные пути. Вирусы адсорбируются на клетках цилиндрического эпителия слизистой оболочки верхних дыхательных путей, внедряются в них и размножаются, разрушая клетки. Развивается отек слизистой оболочки гортани. Патологический процесс быстро спускается в нижние отделы респираторного тракта. Вирусемия кратковременна. Вирусы вызывают вторичный иммунодефицит, способствующий развитию бактериальных осложнений.
После инкубационного периода (3-6 дней) повышается температура, появляются слабость, насморк, боль в горле, охриплость и сухой грубый кашель. Лихорадка длится от 1 до 14 сут. ВПГЧ-1 и ВПГЧ-2 являются частой причиной крупа (острого ларинготрахеобронхита у детей). ВПГЧ-3 вызывает очаговую пневмонию. Менее агрессивен ВПГЧ-4. У взрослых заболевание обычно протекает, как ларингит.
Иммунитет после перенесенного заболевания обусловлен при- сутствием сывороточных IgG и секреторных IgA, однако он непрочный и непродолжительный. Возможны реинфекции, вызванные теми же типами вируса.
Микробиологическая диагностика. От больного берут слизь или смыв из дыхательных путей и мокроту. С помощью РИФ в эпителиальных клетках носоглотки выявляют антигены вируса. Вирус выделяют на культуре клеток Hep-2. Индикацию проводят по цитопатическому действию вирусов, РГА и по реакции гемадсорбции, наиболее выраженной у ВПГЧ-1,2,3 (их раньше называли гемадсорбирующими). Идентификацию осуществляют с помощью РТГА, РСК, РН. С помощью серологического метода, применяя РТГА, РСК или РН, можно выявлять как антигены вируса, так и антитела в парных сыворотках больного.
Лечение. Проводят симптоматическую терапию. Возможно ис- пользование арбидола, интерферона, других иммуномодуляторов.
17.1.7.2. Вирус эпидемического паротита
Эпидемический
паротит (свинка) - острая детская высококонтагиозная антропонозная
инфекция, характеризующаяся пораже- нием околоушных слюнных желез, реже
других органов. Возбудитель - вирус паротита из семейства Paramyxoviridae. Вирусная природа болезни установлена в
Структура и антигенные свойства. Строение вируса паротита сходно с другими парамиксовирусами: он полиморфный, но чаще имеет сферическую форму, диаметр 150-200 нм. Вирион содержит NP- белок, соединенный с геномом - однонитевой нефрагментированной линейной минус-РНК. Снаружи вирион покрыт оболочкой с гликопротеиновыми шипами (HN- и F-белки). Вирус агглютинирует эритроциты кур, морских свинок и других животных. Проявляет нейраминидазную и симпластообразующую активность.
Культивирование вирусов производят на культуре клеток и курином эмбрионе. Экспериментальная инфекция возможна при инфицировании обезьян вируссодержащим материалом.
Резистентность. Возбудитель паротита чувствителен к факторам окружающей среды. Он инактивируется при нагревании и действии УФ-облучения.
Эпидемиология. Источник инфекции - больной человек, выделяющий вирус за 2 дня до начала болезни и в течение 9 дней болезни. Возбудитель передается воздушно-капельным путем или через загрязненные слюной предметы. Наиболее восприимчивы дети от 5 до 15 лет, но могут болеть и взрослые.
Патогенез и клиническая картина. Входные ворота инфекции - верхние дыхательные пути. Инкубационный период составляет 14-21 день. Вирусы размножаются в эпителии слизистых оболочек верхних дыхательных путей и, возможно, в околоушных железах. Затем они поступают в кровь и разносятся по организму, попадая в яички, поджелудочную и щитовидную железы, мозговые оболочки и другие органы, вызывая их воспаление. Болезнь продолжается около недели. Она начинается с повышения температуры, головной боли, недомогания. Воспаляются одна или обе околоушные железы; могут вовлекаться в патологический процесс другие слюнные железы. Развиваются осложнения - орхит (что приводит к бесплодию), менингит, менингоэнцефалит, панкреатит. Нередко наблюдается бессимптомное течение.
Иммунитет после перенесенной болезни вырабатывается по- жизненный.
Микробиологическая диагностика. Материалом для исследования служат слюна, цереброспинальная жидкость, моча, сыворотка крови. Вирусы культивируют на культуре клеток куриных фибробластов или куриного эмбриона и идентифицируют с помощью РТГА, РИФ, РН, РСК. При серологическом методе в парных сыворотках больного с помощью реакций иммунитета (ИФА, РСК, РТГА) определяют IgM- и IgG-антитела.
Лечение и профилактика. Для лечения и поздней профилактики можно использовать специфический иммуноглобулин. Активный иммунитет у детей старше 1 года создают введением живой вакцины (против кори, паротита и краснухи).
17.1.7.3. Вирус кори и подострого склерозирующего панэнцефалита
Корь
- острая антропонозная инфекционная болезнь, характеризующаяся
лихорадкой, катаральным воспалением слизистых оболочек верхних
дыхательных путей и глаз, а также пятнистопапулезной сыпью на коже.
Вирус кори относится к семейству Paramyxoviridae, роду Morbillivirus (лат. название болезни morbilli). Выделен в
Структура и антигенные свойства. Морфология вируса кори типична для парамиксовирусов. Диаметр вириона 150-250 нм. Геном вируса - однонитевая, нефрагментированная минус-РНК. Кроме нуклеокапсидного белка, имеются матриксный (М) и поверхност- ные гликозилированные белки липопротеиновой оболочки - гемагглютинин (Н) и белок слияния (F), гемолизин. Вирус обладает гемагглютинирующей и гемолитической активностью; нейраминидазы нет. Он имеет общие антигены с вирусом чумы собак и крупного рогатого скота.
Культивирование. Корь воспроизводится только на обезьянах с развитием у них клинических проявлений. Вирус кори культивируют на первично-трипсинизированных культурах клеток почек обезьян и человека, перевиваемых культурах клеток HeLa, Vero. При его репродукции образуются гигантские многоядерные клетки - симпласты; появляются цитоплазматические и внутриядерные включения. Белок F вызывает слияние клеток.
Резистентность. Вирус кори нестоек в окружающей среде, чувствителен к детергентам и дезинфектантам. При комнатной темпе-
ратуре он инактивируется через 3-4 ч и быстро гибнет от солнечного света, УФ-лучей.
Эпидемиология. Корь распространена повсеместно. Восприимчивость человека к вирусу кори чрезвычайно высока. Болеют в основном дети в возрасте 4-5 лет и значительно реже взрослые, не переболевшие корью в детском возрасте. Источник инфекции - больной человек, выделяющий вирус в последние 2 дня инкубационного периода и далее до первых 4 дней после появления сыпи. Основной путь инфицирования воздушно-капельный, реже контактный.
Патогенез. Входные ворота для возбудителя - слизистые оболочки верхних дыхательных путей и глаз. После репродукции в эпителиальных клетках и региональных лимфатических узлах он поступает в кровь (вирусемия) и поражает эндотелий кровеносных капилляров, что сопровождается появлением сыпи. Развиваются отек и некротические изменения тканей.
Клиника. Инкубационный
период составляет 8-17 сут. Вначале (катаральный период) отмечаются
интоксикация, ринит, фарингит, конъюнктивит, фотофобия и повышение
температуры тела (38-39 ?С). За сутки до появления сыпи на слизистой
оболочке щек появляются мелкие пятна Бельского-Филатова-Коплика
(диаметр
Редко развиваются энцефалит и подострый склерозирующий панэнцефалит (ПСПЭ) - медленная вирусная инфекция с летальным исходом в результате поражения ЦНС, гибели нейронов. Развиваются двигательные и психические растройства. Заболевание развивается в возрасте 2-30 лет. Оно связано с персистенцией вируса в клетках нейроглии без образования полноценных вирионов. В дефектных вирионах нарушается формирование оболочки, изменяется F-белок и отсутствует М-белок. В крови и цереброспинальной жидкости больных обнаруживаются противокоревые антитела
в высоких титрах (до 1:16 000), а в клетках мозга - вирусные нуклеокапсиды. Вместе с тем показано, что возбудитель ПСПЭ по своим свойствам ближе к вирусу чумы собак.
Иммунитет. У больных через 1-2 дня появляются антивирусные антитела IgM, а в дальнейшем - IgG. После перенесенной кори развивается стойкий пожизненный иммунитет. Повторные заболевания редки. IgG-антитела, передаваемые плоду через плаценту, защищают новорожденного в течение 6 мес после рождения (пассивный иммунитет).
Лабораторная диагностика. Вирус кори можно обнаружить в патологическом материале (смыв с носоглотки, соскобы с элементов сыпи, кровь, моча) и в зараженных культурах клеток с помощью РИФ, РТГА, РН и ОТ-ПЦР. Характерно наличие многоядерных клеток и антигенов вируса в них. Для серологической диагностики
применяют РСК, РТГА и РН.
Лечение. Применяют иммуномодуляторы и рибавирин.
Специфическая профилактика. Детям первого года жизни подкожно вводят живую вакцину из аттенуированных штаммов вируса (Л-16) или ассоциированную вакцину (против кори, паротита, краснухи). В очагах кори ослабленным детям вводят нормальный иммуноглобулин человека, который эффективен при введении не позднее 7-го дня инкубационного периода.
17.1.7.4. Респираторно-синцитиальный вирус человека
Респираторно-синцитиальный
вирус (РСВ) вызывает заболевания нижних дыхательных путей у
новорожденных и детей раннего возраста. РСВ относится к семейству Paramyxoviridae. Он был выделен от больных детей Р. Ченоком в
Структура и антигенные свойства. Вирионы РСВ полиморфны: кроме обычной сферической формы, встречаются и нитевидные формы. РСВ, как все парамиксовирусы, имеет однонитевую спиральную минус-РНК. На липопротеиновой оболочке расположены гликопротеиновые шипы, отвечающие за связь с рецепторами клетки (гликопротеин G) и слияние с мембранами клетки (гликопротеин F). В результате вызванного вирусом слияния клеток образуется синцитий. Поэтому из-за формирования характерного цитопатического действия в виде симпластов - синцития РСВ и получил свое название. Гемагглютинин отсутствует. По поверхностному антигену можно различить три серотипа РСВ.
Культивирование. РСВ культивируют на перевиваемых культурах клеток и первичных культурах почек обезьян. В качестве модели можно использовать обезьян.
Резистентность. РСВ, как и многие парамиксовирусы, очень чувствителен к факторам окружающей среды, где они погибают через 6 ч.
Эпидемиология. Источником заражения является больной или вирусоносители. Механизм инфицирования респираторный. Пути передачи воздушно-капельный (при кашле, чиханье) и контактнобытовой (через руки, белье, игрушки и другие предметы). Заболевание широко распространено (особенно среди детей) и высококонтагиозно. Наиболее опасен РСВ для детей первых 6 мес жизни - у них развиваются тяжелые бронхиолиты и пневмония. Старшие дети и взрослые болеют нетяжело.
Патогенез и клиническая картина. Инкубационный период составляет 4-5 сут. Вирусы, проникнув в эпителиальные клетки верхних дыхательных путей, вызывают их гибель. Развивается отек, утолщается стенка бронха, закупоривается просвет бронхов слизью и клетками слущенного эпителия. Образуются иммунные комплексы, обусловливающие иммунопатологические реакции. Патологический процесс быстро распространяется на нижние дыхательные пути. Развиваются вторичные бактериальные инфекции с признаками трахеобронхита и пневмонии. Наиболее тяжело заболевание протекает при преобладании Тh2-иммунного ответа с высоким уровнем в крови IgA и IgE.
Иммунитет. У переболевших развивается непродолжительный иммунитет. Возможны рецидивы, но с более легким течением. Защитное значение имеют IgA слизистых оболочек, сывороточные антитела и Т-лимфоциты.
Микробиологическая диагностика. Исследуют отделяемое носоглотки, ткань легких (исследуемый материал нельзя замораживать). Вирусы выделяют из культуры клеток (образуется синцитий). Идентификация вирусов проводится с помощью РН, РСК, ОТ-ПЦР и др. Возможно применение серологического метода, направленного на обнаружение специфического антигена с помощью РИФ, ИФА (экспресс-диагностика); реже, используя РСК, РН, выявляют антитела в сыворотке крови больного. Антитела матери, присутствующие у грудного ребенка, могут затруднять выявление у него нарастания титра антител.
Лечение. При РСВ-инфекции применяют иммуномодуляторы и рибавирин. Для пассивной иммунизации возможно применение анти-РСВ-иммуноглобулина.
17.1.8. Рабдовирусы (Rhabdoviridae)
Рабдовирусы (Rhabdoviridae) - семейство РНК-содержащих оболочечных вирусов, включающее около 180 вирусов животных и растений; род Lyssavirus содержит вирус бешенства, род Vesiculovirus - вирус везикулярного стоматита, а род Ephemerovirus - вирус эфемерной лихорадки крупного рогатого скота и др.
Структура. Размер вирионов 120-350x60-80 нм. Они имеют пулеили конусообразную форму (рис. 17.2). Для вирусов, поражающих позвоночных, характерна пулевидная форма, а для вируса везикулярного стоматита - бациллярная с закругленными с обеих сторон концами. Отсюда и название Rhabdoviridаe (от греч. rhabdos - прут, палка).
Рабдовирусы имеют двуслойную липопротеиновую оболочку и рибонуклеопротеин (нуклеокапсид) спиральной симметрии. Изнутри оболочка выстлана М-белком (от англ. matrix), а снаружи от нее отходят шипы гликопротеина G (длина 5-10 нм, диаметр 3 нм).
Репродукция. Рабдовирусы связываются гликопротеинами оболочки с рецепторами клетки и проникают в нее путем клатринопосредованного эндоцитоза. Затем формируются ранняя и поздняя эндосомы. Из последней рибонуклеопротеин попадает в цитоплазму клетки, где с помощью РНК-зависимой РНК-полимеразы син- тезируются неполные плюс-нити РНК (5 индивидуальных иРНК для синтеза вирусных белков) и полные плюс-нити РНК, являю-
Рис. 17.2. Строение вируса бешенства (обозначения в тексте)
щиеся матрицей для синтеза геномной РНК. Преобразованные в аппарате Гольджи вирусные белки включаются в плазмолемму клетки. Рибонуклеопротеин образуется путем взаимодействия геномной (минус-нити) РНК с белками N, P и L. Вирусы выходят из клетки почкованием (рис. 17.3).
Рис. 17.3. Репродукция вируса бешенства: 1 - прикрепление; 2 - проникновение в клетку; 3 - транскрипция; 4 - трансляция; 5 - репликация генома; 5а - вторичная транскрипция; 6 - сборка; 7 - выход вируса из клетки; RI - промежуточная репликация
17.1.8.1. Вирус бешенства
Вирус бешенства вызывает бешенство (Rhabies, синонимы:
водобоязнь, гидрофобия) - зоонозную инфекцию, развивающуюся после
укуса или ослюнения раны животным, инфицированным возбудителем. В
результате поражаются нейроны ЦНС с развитием симптомов возбуждения,
параличом дыхательной и глотательной мускулатуры. Болезнь заканчивается
летально. Вирусная этиология бешенства доказана П. Ремленже в
торый включает также другие вирусы, сходные с вирусом бешенства (лиссавирус австралийских летучих мышей, лиссавирусы евро- пейских летучих мышей типа 1 и 2, Дувенхаге, Лагос-бат, Мокола и др.), выделенные от различных животных, насекомых в Африке.
Морфология и антигенные свойства. Вирион имеет форму пули (см. рис. 17.2), размер 75-180 нм. Он состоит из сердцевины (спирального рибонуклеопротеина и матриксного белка), окруженной липопротеиновой оболочкой с гликопротеиновыми шипами. Гли- копротеин G отвечает за адсорбцию и внедрение вируса в клетку, обладает антигенными и иммуногенными свойствами. Рибонуклеопротеин состоит из геномной однонитевой линейной минус-РНК и белков: N-белка, укрывающего, как чехол, геномную РНК, L-белка и P-белка, являющиеся полимеразой (транскриптазой) вируса. Рибонуклеопротеин является группоспецифическим антигеном.
Различают два идентичных по антигенам вируса бешенства: дикий (уличный) вирус и фиксированный (virus fixe). Дикий (уличный) вирус циркулирует среди животных и патогенен для человека. Фиксированный вирус получен Л. Пастером в виде антирабической вакцины многократным пассированием дикого вируса через мозг кроликов. Он утратил патогенность для человека, не образует включений и не выделяется со слюной.
Культивирование вируса осуществляют путем внутримозгового заражения лабораторных животных (кроликов, белых мышей, крыс, морских свинок, хомячков, овец и др.) и в культуре клеток почек хомячка, нейробластомы мыши, фибробластов человека, куриного эмбриона и др. В нейронах головного мозга зараженных животных образуются цитоплазматические включения вируса овальной формы, впервые описанные В. Бабешем (1892) и А. Негри (1903). Они получили название телец Бабеша-Негри (эозинофильные включения размером 1-15 мкм, состоящие из вирусного рибонуклеопротеина).
Резистентностъ. Вирус бешенства быстро погибает под действием солнечных и УФ-лучей, а также при нагревании до 60 ?С. Он чувствителен к жирорастворителям, дезинфицирующим веществам, пропиолактону, щелочам и протеолитическим ферментам; сохраняется при низких температурах (от -20 до -70 ?С).
Эпидемиология. Бешенство широко распространено, кроме островных государств, осуществляющих карантинные и профилактические мероприятия. Резервуар и источник инфекции в
природных очагах - лисы, волки, енотовидные собаки, песцы, еноты, шакалы, ежи, грызуны, насекомоядные, летучие мыши, а в антропургических очагах - обычно собаки и кошки. У собаки после инкубационного периода (14-16 дней) появляются возбуждение, обильное слюнотечение, рвота, водобоязнь. Она грызет место укуса, посторонние предметы, бросается на людей, животных. Возбудитель накапливается в слюнных железах больного животного и выделяется со слюной. Через 1-3 дня наступают паралич и смерть.
Механизм передачи возбудителя контактный при укусах, реже при обильном ослюнении поврежденных наружных покровов. Возможен аэрогенный механизм передачи вируса, например в пещерах, населенных летучими мышами, которые многомесячно могут выделять вирус бешенства со слюной.
Патогенез и клиническая картина. Инкубационный период у человека при бешенстве от 10 дней до 3 мес, иногда до года и более, что зависит от характера и локализации повреждения. Короткий инкубационный период отмечается при множественных укусах в голову, более продолжительный - при укусах в конечности. Инкубационный период при передаче вируса летучими мышами более короткий (не более 3-4 нед). После попадания вируса в поврежденные наружные покровы он реплицируется, персистируя в месте внедрения. Затем возбудитель распространяется по аксонам периферических нервов и достигает клеток головного и спинного мозга, где размножается. В цитоплазме нейронов мозга, чаще в гипокампе, обнаруживаются тельца Бабеша-Негри. Размножившийся вирус попадает из мозга по центробежным нейронам в различные ткани, в том числе в слюнные железы. Выделяется вирус со слюной за 8 сут до начала и в течение всей болезни.
Заболевание начинается с недомогания, беспокойства, бессонницы. Затем развиваются рефлекторная возбудимость, спазматические сокращения мышц глотки и гортани; дыхание шумное, судорожное. Судороги усиливаются при попытке пить, при виде льющейся воды (гидрофобия), от дуновения (аэрофобия), яркого света (фотофобия), шума (акустофобия) и при других воздействиях. Развиваются галлюцинации, а в конце болезни (на 3-7-й день) - параличи мышц конечностей и дыхания. Реже болезнь протекает без возбуждения и водобоязни; развиваются паралич и слюнотечение (тихое бешенство). Летальность около 95%.
Иммунитет. Чувствительность человека к бешенству варьирует: при укусах бешеным волком заболевают около 50% непривитых людей, а бешеной собакой - около 30%. Постинфекционный иммунитет не изучен, так как больной обычно погибает. Иммунизация инактивированной антирабической вакциной вызывает активацию клеточного иммунитета, выработку антител и интерферонов.
Лабораторная диагностика. При постмортальной диагностике обнаруживают цитоплазматические включения (тельца Бабеша-Негри) в мазках-отпечатках или срезах из ткани гиппокампа, пирамидальных клеток коры большого мозга и клеток Пуркинье мозжечка. Включения выявляют методами окраски по Романовскому-Гимзе, Манну, Туревичу, Муромцеву и др. Вирусные антигены в клетках обнаруживают с помощью РИФ. Кроме этого выделяют вирус из мозга и подчелюстных слюнных желез: мышей-сосунков заражают интрацеребрально. Срок наблюдения до 28 дней. Обычно зараженные животные погибают через неделю. Вирусы идентифицируют с помощью ИФА, а также в РН на мышах.
Для прижизненной диагностики исследуют отпечатки роговицы, биоптаты кожи с помощью РИФ; выделяют вирус из слюны, цереброспинальной и слезной жидкости путем интрацеребрального инфицирования мышей-сосунков. Возможно определение антител у больных с помощью ИФА, непрямой РИФ, РСК, РН, РНГА.
Профилактика. Выявляют, изолируют или уничтожают возможные источники инфекции: бродячих собак, кошек и других животных. Важно соблюдение правил содержания домашних животных. Проводятся карантинные мероприятия при импорте животных. Иммунизируют антирабической вакциной служебных и домашних собак. Пострадавшему промывают рану водой с мылом, обрабатывают спиртом или препаратами йода. Края раны иссекают и в первые 3 дня не зашивают. Специфическую профилактику проводят антирабической вакциной и антирабической сывороткой или иммуноглобулином.
Первую вакцину против бешенства получил Л. Пастер путем пассирования возбудителя бешенства через мозг кролика. К 133- му пассажу уличного вируса бешенства, т.е. заражения от кролика к кролику, первоначальный инкубационный период снизился с 15-20 до 7 дней. В последующем инкубационный период не из-
менялся.
Полученный вирус с постоянным инкубационным периодом Л. Пастер назвал
фиксированным, в отличие от уличного. Фиксированный вирус утратил
вирулентность для других видов животных. Кроме этого Л. Пастер
высушивал инфицированный мозг над едким калием. Первая вакцинация была
проведена им в
Проводят активно-пассивную иммунизацию. При пассивной иммунизации вводят антирабический иммуноглобулин или антирабическую сыворотку. При активной иммунизации вводят концентрированную культуральную антирабическую вакцину, инактивированную УФили γ-лучами: условный курс прививок 2-4 инъекции вакцины (с 10-дневным наблюдением за укусившим животным); безусловный курс согласно инструкции. Разрабатывается генно-инженерная вакцина, содержащая гликопротеин G вируса.
17.1.9. Филовирусы (семейство Filoviridae)
Название семейства происходит от лат. filum - нить и отражает морфологию вирионов. В состав семейства входят два рода: Mar- burgvirus и Ebolavirus. Вирусы этого семейства вызывают тяжелые геморрагические лихорадки, часто со смертельным исходом.
Морфология и антигенные свойства. Вирион филовирусов имеет липидную оболочку и форму закрученных нитей длиной 600- 800 нм и толщиной 50 нм. Нуклеокапсид представляет собой комплекс вирусной РНК и 4 структурных белков: NP (нуклеопротеид), VP30 (кофактор вирусной полимеразы), VP35 (фосфопротеин) и L (вирусная РНК-зависимая РНК-полимераза). С мембраной вируса ассоциированы 3 структурных белка. Два из них - VP24 и VP40 - расположены с внутренней стороны мембраны и играют роль матриксных белков, а поверхностный GP-комплекс, состоя- щий из двух субъединиц (GP1 и GP2), формирует внешние шипы вириона.
Геном филовирусов - одноцепочечная РНК негативной полярности размером около 19 000 пар оснований, фланкированная консервативными некодирующими участками. Геном содержит 7 открытых рамок считывания - по одной на каждый ген.
Культивирование. Филовирусы культивируют на культурах клеток Vero, MA104 и SW13. Для изучения репликации филовирусов также с успехом использовали человеческие микроваскулярные
эндотелиальные клетки и периферические клетки крови (моноциты и макрофаги).
Резистентность. Филовирусы сохраняют инфекционность при комнатной температуре, но разрушаются при 60 ?С в течение 30 мин. Теряют свою инфекционность при обработке УФ-, γ-излучением, детергентами.
Репродукция. Клетками-мишенями филовирусов являются клетки миелоидного ряда (моноциты/макрофаги, гепатоциты, дендритные клетки) и клетки эндотелия, содержащие на своей поверхности специфические лектины, с которыми связывается субъединица GP1. Вирион проникает в клетку в эндосомах. После слияния мембран вириона и эндосомы в цитоплазму клетки высвобождается нуклеокапсид. Репликация вирусного генома происходит в цитоплазме. Белки GP и NP синтезируются на рибосомах шероховатого ретикулума, остальные вирусные белки - на свободных рибосомах. Сборка вирионов происходит на цитоплазматической мембране.
Эпидемиология. Природный
резервуар филовирусов не установлен. Распространение вирусов
происходит воздушно-капельным и контактным путем, особенно при
контактах с кровью и выделениями больного. В лабораторных условиях
основным источником заражения служат медицинские колюще-режущие
инструменты. Первые случаи заболеваний, вызываемые вирусом Марбург, были
зарегистрированы в Югославии и Германии в связи с завозом
инфицированных зеленых мартышек из Уганды в
Клиническая картина. Основные симптомы заболевания: лихорадка, озноб, головная боль, миалгия, анорексия. Основные проявления геморрагической лихорадки наступают на 5-7-й день заболевания. В это время развиваются симптомы геморрагического поражения тех или иных систем организма. Прогноз зависит от типа вируса и скорости манифестации геморрагических проявлений. Смертность составляет 22-88%.
Иммунитет. Механизмы выздоровления и формирования иммунного ответа изучены плохо. Показано, что одним из основных факторов в патогенезе этой вирусной инфекции является иммуносупрессия, механизм возникновения которой неизвестен. Показано, что нейтрализующие антитела к белку GP в экспериментах на животных обладают защитным свойством.
Микробиологическая диагностика. Материалом для исследования служит кровь. Основным методом лабораторной диагностики является ИФА для определения отдельных антигенов вируса и антител к ним. Вирусные антигены определяются начиная с 3-го дня после начала заболевания до 7-16-го дня после исчезновения симптомов болезни. IgM-антитела к вирусным белкам появляются в крови между 2-12-м днем, а IgG-антитела - между 6-18-м днем после появления симптомов болезни. Для выявления генома вирусов используют метод ОТ-ПЦР со специфическими праймерами.
Лечение симптоматическое.
Специфическая профилактика. Разработана убитая вакцина против болезни Марбург и Эбола. Однако, поскольку ее безопасность до конца не изучена, она применяется только для вакцинации медицинского персонала в очагах заболевания и сотрудников научных лабораторий, работающих с филовирусами.
17.1.10. Коронавирусы (семейство Coronaviridae)
Семейство Coronaviridae включает род Coronavirus и род Torovirus и
содержит 24 вируса, вызывающих широко распространенные заболевания у
человека и животных. На поверхности вирусной частицы расположено кольцо
из специфических выступов, придающее вирусу характерный вид (от лат. corona - венец). Вирус впервые был выделен в
Морфология и антигенные свойства. Вирионы крупного размера - частицы диаметром 60-130 нм, сферической формы. Нуклеокапсид спиральной симметрии, содержит однонитевую РНК-плюс, покрыт липидной оболочкой - суперкапсидом. На суперкапсиде наблюдаются характерные булавовидные выступы в виде солнечной короны - пепломеры, на которых располагаются антигенные
детерминанты. В месте прикрепления к вирусной оболочке пепломеры образуют узкий перешеек.
С геномом вируса связан основной фосфопротеин N, формирующий нуклеокапсидную структуру. В мембране обнаруживаются мультимембранный протеин М и гликопротеин S, в оболочке - протеин Е. У некоторых коронавирусов отмечается наличие гемагглютининэстеразы. Гликопротеин S - сигнальный протективный антиген при SARS, является индуктором вируснейтрализующих антител. При попадании коронавирусов в организм вырабатываются агглютинирующие, преципитирующие антитела.
Культивирование. Коронавирусы репродуцируются в цитоплазме клеток человека и животных - их естественных хозяев. Возможно использование культур клеток эмбриона человека и первичных эпителиальных клеток. Оптимальная температура культивирования 33-35 ?С. Внутриклеточные включения не образуются.
Резистентность. Вирусы относительно устойчивы, во внешней среде сохраняются до 3 ч, в моче и фекалиях - до 2 сут, чувствительны к нагреванию, действию жирорастворителей, детергентов, формальдегида, окислителей.
Репродукция. Коронавирусы проникают в клетку путем эндоцитоза и репродуцируются в цитоплазме. В инфицированных клетках вирусы находятся в вакуолях вблизи мембран эндоплазматической цепи, где осуществляется сборка вириона. Выход вируса из инфицированных клеток происходит путем экзоцитоза.
Эпидемиология. Коронавирусы вызывают у человека заболевания дыхательных путей, в том числе бронхиолит и пневмонию, а также диарейный синдром и, возможно, поражения нервной системы. Источником инфекции является больной человек, основной путь передачи аэрогенный. Заболевания чаще наблюдаются в зимне-весенный период.
Клиническая картина. Инкубационный период 3-4 дня. Первичная репродукция вируса происходит в клетках слизистой оболочки носоглотки, при этом отмечаются насморк и чиханье, как правило, без повышения температуры. Могут наблюдаться симптомы гастроэнтерита. В случае развития SARS повышается температура, появляются признаки поражения нижних дыхательных путей.
Иммунитет. После перенесенного заболевания формируется гу- моральный иммунитет.
Микробиологическая диагностика. Материалом для исследования служит смыв из носоглотки. В качестве экспресс-диагностики
для обнаружения антигена в клетках слизистой оболочки используют РИФ. Выделение вируса затруднено, поэтому основным ме- тодом диагностики является серологический (ретроспективный). С помощью непрямого РИФ - с 10-го дня от начала заболевания можно определить нарастание титра IgG в парных сыворотках. В ИФА начиная с 3-й нед определяют IgM и IgG.
Лечение симптоматическое.
Специфическая профилактика не разработана.
17.1.11. Вирус иммунодефицита человека
Вирус
иммунодефицита человека (ВИЧ) вызывает ВИЧинфекцию, заканчивающуюся
синдромом приобретенного иммунодефицита (СПИД). СПИД характеризуется
тяжелым поражением иммунной системы, длительным течением,
полиморфностью клинических симптомов, абсолютной летальностью, быстрым
эпидемическим распространением. Типичный антропоноз. ВИЧ - лимфотропный
вирус, относится к семейству Retroviridae, роду Lentivirus. Выделяют два типа вируса: ВИЧ-1 и ВИЧ-2, которые отличаются по структурным и антигенным характеристикам. ВИЧ-1 был открыт в
Происхождение и эпидемиология. Вопрос
о происхождении ВИЧ-1 и ВИЧ-2 был и остается предметом многочисленных
дискуссий. В настоящее время считается, что в человеческую популяцию
ВИЧ-1 и ВИЧ-2 проникли от обезьян - шимпанзе и дымчатых мангобеев
соответственно. Вирусы имеют принципиально общую структуру вирионов и
геномов, но значительно (25%) различаются последовательностями РНК и
белков. Вопрос о том, каким образом и когда произошло проникновение
вируса в человеческую популяцию, остается открытым. Предполагают, что
это было связано не с мутационными изменениями вирусного генома, а с
передачей отдельно взятой популяции вируса в отдельную группу людей в
результате изменения их сексуального поведения, миграции и т.д. В
настоящее время эпидемия ВИЧ-инфекции в той или иной степени охватила
все континенты. Эпицентром эпидемии ВИЧ-1 яв- ляется Восточная Африка, а
ВИЧ-2 преимущественно распространен в Западной Африке. По данным ВОЗ,
на конец
умерли от этой инфекции. Эпидемия ВИЧ в РФ продолжает развиваться. К концу
Основные способы передачи ВИЧ-инфекции характерны для всех парентеральных инфекций и включают гетеро- и гомосек- суальные контакты, переливание крови и кровепродуктов, внутривенное употребление наркотиков, пересадка органов и тканей, вертикальная передача (от матери к ребенку во время беременности, родов, кормления грудью), профессиональные заражения (укол или порез инфицированными медицинскими инструментами). Основными причинами быстрого распространения ВИЧинфекции являются многообразие естественных путей передачи, высокая общая восприимчивость людей к этой инфекции, высокая инфекционность вируса, длительный период заразности инфицированных, отсутствие надежных методов лечения и специфической профилактики.
Морфология и антигенная структура. Вирусная частица имеет сферическую форму, диаметр около 100 нм. Вирус имеет липидную оболочку, состоящую из двойного слоя липидов, пронизанную гликопротеиновыми шипами. Липидная оболочка происходит из плазматической мембраны клетки, в которой реплицируется вирус, а гликопротеиновые шипы представлены вирусными белками gp120 и gp41, которые имеют общий предшественник gp160. При этом гликопротеин gp120 располагается на поверхности оболочки вируса, гликопротеин gp41 - внутри ее. Сердцевина вируса состоит из капсидных белков p24, матриксных белков р6 и р7 и протеазы. Геном ВИЧ представлен двумя нитями РНК (7900-9800 п.н.) и состоит из 3 основных структурных генов (gag, pol, env) и 7 регуляторных и функциональных генов (tat, rev, nef, vif, vpr, vpu, vpx). Для процесса репродукции вирус имеет обратную транскриптазу (ревертазу). Ген gag (от англ. group antigen - групповой антиген) кодирует матриксные, капсидные, нуклеокапсидные белки и белки
протеазы. Ген pol кодирует ревертазу, интегразу и РНКазу. Ген env кодирует поверхностный гликопротеин gp120 и трансмембранный gp41. Функциональные гены выполняют регуляторные функции и обеспечивают процесс репродукции и участие вируса в инфекционном процессе.
Жизненный цикл ВИЧ включает 4 стадии:
• адсорбция и проникновение вируса в клетку путем эндоцитоза;
• высвобождение вирусной РНК, синтез ДНК провируса и интеграция его в геном клетки-хозяина;
• синтез РНК вируса, трансляция и формирование вирусных белков;
• сборка, созревание и высвобождение из клетки путем почкования вновь сформированных вирионов.
Полный жизненный цикл вируса реализуется за 1-2 сут, причем за это время формируется более 1 млрд вирусных частиц.
ВИЧ инфицирует клетки, несущие на своей поверхности CD4- рецептор и хемокиновые рецепторы CCR5 CXCR4: Th (helper)-лим- фоциты, макрофаги, фолликулярные дендритные клетки, клетки островков Лангерганса, клетки микроглии мозга.
Вирус также инфицирует широкий спектр CD4-негативных клеток, обладающих хемокиновыми рецепторами: астроциты мозга, эпителий шейки матки, почечный эпителий, эпителий кишечника, эндотелиальные клетки капилляров мозга и шейки матки, клетки роговицы глаза.
Вначале вирус связывается с CD4-рецептором. Взаимодействие с корецепторами CCR5 CXCR4 необходимо для слияния вириона с клеточной мембраной, обеспечивающего проникновение ВИЧ в клетку.
Взаимодействие с CD4 и корецепторами приводит к конформационным изменениям в оболочке вируса, активируя gp41 (фактора слияния), запуская слияние мембран (рис. 17.4).
В результате взаимодействия с ВИЧ гибнут: Th-лимфоциты, клетки нейроглии мозга (астроциты).
В-лимфоциты подвержены неспецифической поликлональной активации.
Моноциты, макрофаги, клетки островков Лангерганса, фолликулярные дендритные клетки в результате взаимодействия с ВИЧ не деградируются, действуя потенциально как резервуар инфекции
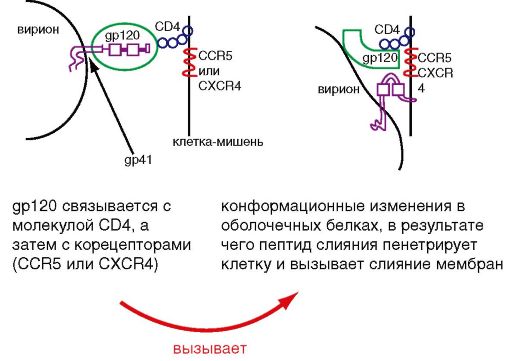
Рис. 17.4. Взаимодействие ВИЧ-1 с CD4 и корецепторами
для заражения других клеток. Дендритные клетки являются первыми клетками, с которыми ВИЧ взаимодействует при сексуальной передаче, поэтому они играют важную роль в передаче вируса Т-хелперам при сексуальных контактах.
Изменчивость ВИЧ. ВИЧ-1 и ВИЧ-2 относятся к ретровирусам С-типа. Репликация этих вирусов подвержена ошибкам на стадии обратной транскрипции и характеризуется высокой частотой спонтанных мутаций. Из-за высокой скорости репликации вируса возникает большое количество мутаций, что приводит к тому, что у одного больного накапливается множество близких вариантов вируса, называемых квазивидами. Изменчивость ВИЧ в сотни и тысячи раз превосходит изменчивость вируса гриппа. Это сильно затрудняет диагностику ВИЧ-инфекции и создание вакцины против ВИЧ. Выделяют два типа вируса: ВИЧ-1 и ВИЧ-2, которые различаются по структурным и антигенным характеристикам. В частности, геном ВИЧ-2 отличается от генома ВИЧ-1 структурой гена env и заменой гена vpu геном vpx. Так, ВИЧ-2 вместо белков gp120, gp41, gp160, p24 у ВИЧ-1 содержит белки gp140, gp105, gp36, p26.
ВИЧ-1 наиболее распространен в мире и в силу своей изменчивости имеет не менее 10 генотипов (субтипов): А, В, С, D, Е
и т.д., отличающихся по аминокислотному составу друг от друга на 25-30%. Внутри субтипа вариабельность составляет 5-20%.
В
настоящее время ВИЧ-1 делят на три группы: M, N и О. Большинство
изолятов относится к группе М, в которой выделяют 10 подтипов: A, B, C,
D, F-1, F-
Патогенез. При ВИЧ-инфекции снижаются количество Т4- лимфоцитов, а также соотношение Т4/Т8, нарушается функция В-лимфоцитов, подавляются функция естественных киллеров и ответ на антигены и митогены, снижается и нарушается продукция комплемента, лимфокинов и других факторов, регулирующих иммунные функции, в результате происходят дисфункция иммунной системы и расстройство всей ее деятельности. Поражение иммунных и других клеток приводит к развитию иммунодефицитов и проявлению вторичных заболеваний инфекционной и неинфекци- онной природы, а также злокачественных опухолей.
Клиническая картина. Клиническая классификация ВИЧинфекции (по В.И. Покровскому) включает следующие стадии:
• инкубационный период - от момента заражения до появления реакции организма в виде клинических проявлений острой инфекции и/или выработки антител; продолжительность от 3 нед до 3 мес;
• стадия первичных проявлений продолжительностью около года с момента появления симптомов острой инфекции или сероконверсии;
• субклиническая, характеризующаяся медленным развитием иммунодефицита, длительностью 6-7 лет;
• стадия вторичных заболеваний, связанная со значительным иммунодефицитом и заканчивающаяся через 10-12 лет после начала заболевания;
• терминальная, проявляющаяся необратимым течением вторичных заболеваний (СПИД).
Основные проявления ВИЧ-инфекции и СПИДа связаны с развитием оппортунистических заболеваний, к которым относятся инфекции (пневмоцистная пневмония, токсоплазмоз, криптоспоридиоз, кандидоз, гистоплазмоз, герпесвирусная инфекция, гепатиты В и С), опухоли (саркома Капоши, злокачественная лимфома), неврологические нарушения.
Микробиологическая диагностика. Основанием для диагноза ВИЧ-инфекции служит обнаружение ВИЧ-специфических антител в сыворотке крови, которые имеются у всех ВИЧ-инфицированных. Для этого используют метод ИФА. В случае положительного ре- зультата используют повторный ИФА-тест и подтверждающий тест с применением иммуноблоттинга. В ранние сроки заболевания в сыворотке крови методом ИФА можно определить вирусный белок р24. Разработан метод ПЦР для определения вирусного генома.
Лечение. В настоящее время для лечения ВИЧ-инфекции ис- пользуют 4 группы антиретровирусных препаратов: нуклеозидные и нуклеотидные ингибиторы обратной транскриптазы, ненуклеозидные ингибиторы обратной транскриптазы, ингибиторы протеазы и ингибиторы слияния вирусной и клеточной мембран. Проходят испытания ингибиторы интегразы, блокаторы корецепторов и ингибиторы прикрепления (рис. 17.5). Полного излечения все эти препараты не дают, но часто позволяют продлить жизнь больных ВИЧ-инфекцией. При лечении необходимо использовать не один препарат, а комбинацию препаратов. К сожалению, при лечении противовирусными препаратами часто возникают устойчивые варианты вируса, что делает лечение малоэффективным.
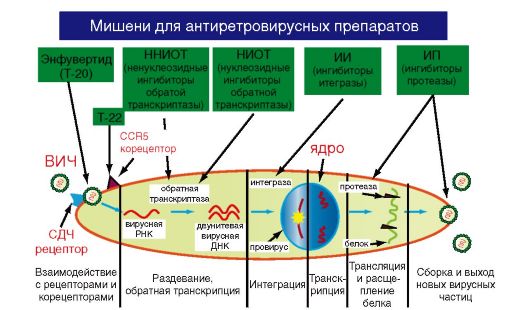
Рис. 17.5. Мишени для действия антивирусных препаратов: ННИОТ - ненуклеозидные ингибиторы обратной транскриптазы; НИОТ - нуклеозидные ингибиторы обратной транскриптазы; ИИ - ингибиторы интегразы; ИП - ингибиторы протеазы
Профилактика. Специфическая профилактика не разработана. Все попытки создать эффективную вакцину пока потерпели неудачу. Однако и в России, и за рубежом проводятся интенсивные исследования по созданию таких препаратов.
Профилактика ВИЧ-инфекции сводится к социальным и противоэпидемическим мероприятиями: пропаганде безопасного сек- са с использованием презервативов, использованию одноразовых шприцев и других медицинских инструментов, контролю крови и кровепродуктов, созданию банков крови и др. Важное значение имеют своевременное выявление ВИЧ-инфицированных, борьба с проституцией, наркоманией, гомосексуализмом, распущенностью, половое воспитание, просветительская работа среди населения. В России действует закон, предусматривающий уголовную ответственность за заведомую постановку другого лица в опасность заражения ВИЧ или умышленное заражение ВИЧ.
17.1.12. Аренавирусы (семейство Arenaviridae)
Аренавирусы - РНК-содержащие оболочечные вирусы семейства Arenaviridae (от греч. arenosa - песчаный, поскольку вирусы включают клеточные рибосомы, похожие на песчинки при элек- тронной микроскопии). Семейство представлено родом Arenavirus, который включает вирус лимфоцитарного хориоменингита, а также вирусы, вызывающие тяжелые геморрагические лихорадки: вирусы Ласса, Хунин, Мачупо, Гуанарито, Сабиа.
Структура и репродукция. Вирион сферической или овальной формы (диаметром около 120 нм) имеет оболочку с булавовидными гликопротеиновыми шипами GP1 и GP2. Под оболочкой расположены 12-15 клеточных рибосом, похожих на песчинки, что отражено в названии семейства. Капсид спиральный. Геном представлен двумя сегментами (L, S) однонитевой амбиполярной РНК, которая кодирует 5 белков, в частности L-, Z-, N-, G-белки. Вирион содержит транскриптазу (LP-белок, РНК-полимераза). Вирус репродуцируется в цитоплазме и выходит из клетки почкованием через ее плазматическую мембрану.
Резистентность. Аренавирусы чувствительны к действию детергентов, УФ-, γ-излучению и нагреванию. Устойчивы к замораживанию и лиофилизации.
Культивирование. Аренавирусы культивируются при заражении куриного эмбриона, грызунов и культур клеток (например, Vero- культуры клеток почек зеленых мартышек).
Эпидемиология, патогенез и клиническая картина. Аренавирусы распространяются с выделениями грызунов (моча, кал, слюна), загрязняющих продукты питания, воду и воздух. Люди заражаются алиментарным путем или аэрогенным механизмом, реже контактным путем. Инкубационный период составляет 1-2 нед. Возможна передача вируса через плаценту. Вирусы, попав в кишечный или респираторный тракт, размножаются в регионарных лимфатических узлах. Они распространяются в ретикулоэндотелиальной системе и циркулируют в крови. Вирусинфицированные клетки и ткань разрушаются цитотоксическими Т-лимфоцитами. При геморрагических лихорадках образуются иммунные комплексы антиген-антитело, откладывающиеся на базальных мембранах клеток. Развиваются некротические изменения печени и селезенки, гломерулонефрит, миокардит и сосудистые изменения. Заболевания протекают в виде гриппоподобных проявлений или более тяжело с развитием лихорадки, сыпи, отеков, острого асептического менингита, геморагических изменений, пневмонии, почечной недостаточности. После перенесенного заболевания формируется длительный иммунитет.
17.1.12.1. Вирусы лимфоцитарного хориоменингита, Ласса, Хунин, Мачупо, Гуанарито, Сабиа
Вирус лимфоцитарного хориоменингита вызывает заболевание в виде гриппоподобного синдрома или тяжелых форм с развитием серозного менингита или менингоэнцефалита с лейко- и тромбоцитопенией. Вирусы распространяются с выделениями домашних мышей или от содержащихся в неволе сирийских хомяков, загрязняющих продукты питания, воду и воздух. Лимфоцитарный хориоменингит отмечается в Европе и Америке, чаще возникая в зимне-весенний период.
Вирус
Ласса вызывает геморрагическую лихорадку Ласса, сопровождающуюся
интоксикацией, лихорадкой, поражением ЦНС и геморрагическими
высыпаниями. У больных появляются рвота, диарея, боли в животе и груди,
кашель, макулопапулезная и петехиальная сыпь на коже лица, туловища,
конечностей; отмечаются кровохарканье и кишечные кровотечения. Первая
вспышка была выявлена в
отмечается в странах Западной и Центральной Африки (в Верхней Вольте, Нигерии, Сенегале, Гвинее, Заире и др.). Заражение человека в природных очагах происходит респираторным механизмом, алиментарным, контактно-бытовым путями и парентерально. Инкубационный период в среднем 7-10 дней. Болезнь характеризуется высокой летальностью (20-47% у нелеченых больных).
Вирусы Хунин и Мачупо вызывают американские геморрагические лихорадки. Резервуаром этих вирусов являются грызуны. Вирус Хунин - возбудитель аргентинской геморрагической лихорадки, а вирус Мачупо - возбудитель боливийской геморрагической лихорадки.
Вирус Гуанарито вызывает венесуэльскую геморрагическую лихорадку, сопровождающуюся токсикозом, гриппоподобными яв- лениями, диареей. Резервуар вируса - хлопковые крысы и другие дикие грызуны.
Вирус Сабиа выделен в
Микробиологическая диагностика. Вирусы выделяют из крови, отделяемого глотки, плевральной, цереброспинальной жидкости, мочи: заражают культуры клеток или мышей-сосунков, хомячков. Идентификация вирусов проводится с помощью РСК, РН, РИФ, ИФА и ПЦР. Антитела в сыворотке крови выявляют в РСК, ИФА, непрямой РИФ.
Лечение и профилактика. В начале болезни возможно применение лечебных специфических иммунных сывороток или плазмы крови реконвалесцентов. Для специфической профилактики разрабатываются живые вакцины. Неспецифическая профилактика предусматривает борьбу с грызунами, проведение карантинных мероприятий.
17.1.13. Вирус гепатита Е
Вирус гепатита Е (HEV) вызывает гепатит Е - инфекцию с фекально-оральным механизмом передачи. Вирус был открыт в
Структура. Вирус не имеет липидной оболочки. Нуклеокапсид сферической формы размером 27-34 нм. Геном вируса представлен однонитевой плюс-РНК, которая кодирует РНК-зависимую РНК-полимеразу, папаиноподобную протеазу и трансмембранный белок, обеспечивающий проникновение вируса в клетку.
Эпидемиология и клиническая картина. Источник инфекции - больные люди. Главный путь передачи инфекции водный. Инкубационный период от 2 до 6 нед. Заболевание сопровождается умеренным поражением печени, интоксикацией и желтухой. Про- гноз, как правило, благоприятный, за исключением беременных, у которых смертность от гепатита Е составляет 16-20%. В последнее время вирус гепатита Е был выделен у некоторых животных (свиней, оленей, крупного рогатого скота, птиц и др.), что предполагает возможность передачи вируса от животных человеку.
Иммунитет. После перенесенного заболевания формируется стойкий иммунитет.
Микробиологическая диагностика. Применяют серологический метод. В сыворотке и плазме крови определяют IgG- и IgM- антитела к вирусу. Кроме того, методом ПЦР определяют вирусную РНК в сыворотке крови во время острой фазы инфекции.
Лечение и профилактика. Лечение симптоматическое. Беременным вводят специфический иммуноглобулин. Неспецифическая профилактика направлена на улучшение санитарно-гигиенических условий и снабжение качественной питьевой водой. Создана неживая цельновирионная вакцина. Испытываются живая и генно- инженерная вакцины.
17.2. ДНК-содержащие вирусы
17.2.1. Аденовирусы (семейство Adenoviridae)
Семейство Adenoviridae включает в себя 4 рода: Mastadenovirus (вирусы млекопитающих), Aviadenovirus (вирусы птиц), Atadenovirus (геном представителей этого рода обогащен А-Т-парами) и Siadenovirus (содержит ген сиалидазы). Медицинское значение имеет только род Mastadenovirus. Впервые аденовирусы выделил в
инфекций человека. Наиболее типично субклиническое и инаппарантное течение аденовирусной инфекции, связанное с поражением респираторной, гастроинтестинальной и зрительной систем. Некоторые типы аденовирусов вызывают онкогенную трансформацию (опухоли грызунов).
Структура и репродукция. Вирион аденовирусов массой 150-180 МДа не имеет липидной оболочки. Капсид состоит из 252 капсомеров и построен по икосаэдрическому типу симметрии. Геном состоит из линейной двунитевой ДНК (26-45 т.п.н.), которая, связываясь с белками, образует плотную сердцевину вируса и кодирует структурные и неструктурные вирусные белки. Репродуктивный цикл аденовирусов приводит либо к лизису пораженных клеток либо к латентной инфекции (в лимфоидных клетках).
Эпидемиология. Источником инфекции являются больные люди с острой или латентной формой заболевания. Механизмы распространения респираторный и контактный. Кишечные аденовирусы имеют фекально-оральный механизм передачи. Заболеваемость имеет осенне-зимнюю сезонность. Отмечаются вспышки и спора- дические случаи инфекции.
Во внешней среде аденовирусы более устойчивы, чем большинство других вирусов человека. Они выдерживают прогревание до 50 ?С, 2 мес сохраняют активность при 4 ?С, сохраняются при замораживании и лиофилизации. Устойчивы при рН 5,0-9,0.
Патогенез. Инкубационный период 4-5 дней. Первичная репродукция аденовирусов происходит в эпителиальных клетках слизистой оболочки дьгхательньгх путей и кишечника, конъюнктиве глаза, лимфоидной ткани. После появления первых симптомов заболевания отмечается короткая вирусемия. По типу поражений чувствительных клеток различают три типа инфекционного процесса.
• Продуктивная инфекция - сопровождается гибелью клетки после выхода из нее следующей популяции вирионов (до 1 млн вирионов). Однако инфекционностью обладает только 1-5% вирионов общей популяции. У некоторых хозяев выход вирионов низкий (низкопродуктивная инфекция). При заражении малочувствительных клеток выход вирионов может отсутствовать (абортивная инфекция).
• Персистирующая инфекция - бывает при замедленной репродукции вируса, что позволяет клеткам исправлять повреждения, нанесенные вирусом, а тканям - восполнить потерю
• погибших клеток. Такая форма инфекции протекает хронически и бессимптомно. Трансформирующая инфекция - описана при заражении новорожденных грызунов аденовирусами человека. При этом у них возникают различные опухоли. По способности вызывать опухоли аденовирусы человека можно разделить на 6 групп (A-G).
Клиническая картина аденовирусных инфекций очень разнообразна. Чаще всего регистрируются ОРВИ, протекающие как гриппоподобные заболевания с осенне-зимней сезонностью. У детей раннего возраста наблюдают кератоконъюнктивиты. Возможны тяжелые воспаления роговицы с потерей зрения. Наиболее тяжелые поражения вызывают аденовирусы серотипов 1, 2, 5. Возможны эпидемические вспышки в закрытых организованных коллективах (школьники, военные) с тяжелыми осложнениями (пневмония, энцефалиты). У детей младшего возраста могут возникать гастроэнтериты с последующей инвагинацией и непроходимостью кишечника. К редким проявлениям аденовирусной инфекции относятся менингоэнцефалиты и геморрагические циститы.
Иммунитет. Перенесенное заболевание оставляет непродолжительный типоспецифический иммунитет, который носит клеточногуморальный характер.
Микробиологическая диагностика. Возможно выделение аденовирусов из культуры эпителиальных клеток человека. Исследуют отделяемое носоглотки, зева, конъюнктивы, фекалии в зависимости от клинической формы заболевания. Для идентификации вируса используют ИФА, РИА, РТГА. Разработан метод ПЦР для идентификации и типирования вирусной ДНК.
Лечение и профилактика. Лечение симптоматическое. Применяются препараты интерферона и его индукторов. Разрабатывались вакцины для специфической профилактики, однако практического применения они не получили из-за онкогенных свойств и других возможных осложнений.
17.2.2. Герпесвирусы (семейство Herpesviridae)
Герпесвирусы (от греч. herpes - ползучий) поражают ЦНС, кожу, слизистые оболочки и внутренние органы (табл. 17.2). Они относятся к семейству Herpesviridae, которое представлено крупными оболочечными ДНК-содержащими вирусами и включает
8 вирусов герпеса, патогенных для человека. Семейство состоит из 3 подсемейств, отличающихся по структуре генома, тканевому тропизму, цитопатологии и локализации латентной инфекции.
Таблица 17.2. ГВЧ и заболевания, вызываемые ими
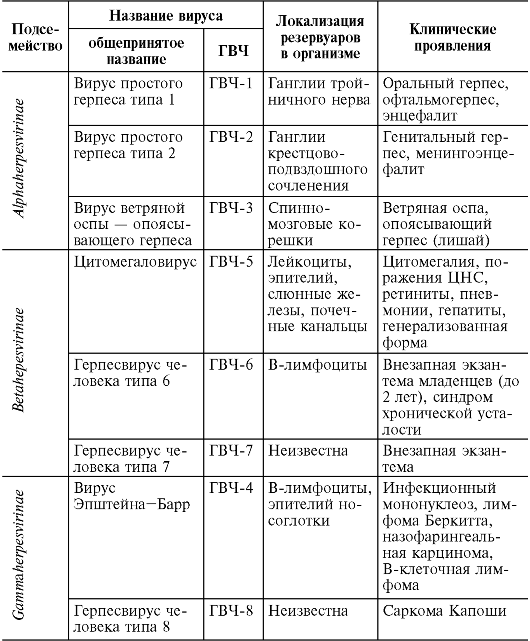
• Подсемейство Alphaherpesvirinae включает вирусы простого герпеса (ВПГ) типов 1 и 2 (Herpes simplex virus-1, 2 - HSV-1, 2), вирус ветряной оспы - опоясывающего герпеса (Varicellazoster virus - VZV) а также церкопитековый (обезьяний) вирус герпеса типа В Старого Света, вызывающий у человека летальное неврологическое поражение. Для этих вирусов характерен быстрый рост. Вирусы размножаются в эпителиальных клетках, оказывая цитолитическое действие. В нейронах вызывают латентную персистирующую инфекцию.
• Подсемейство Betaherpesvirinae включает цитомегаловирус (ЦМВ), герпесвирус человека типов 6 и 7. Для этих вирусов характерен медленный рост (латентная инфекция) в клетках эпителия слюнных желез, в гландах, почках, лимфоцитах. Вирусы оказывают цитомегалическое и лимфопролиферативное действие.
• Подсемейство Gammaherpesvirinae включает вирус Эпштейна- Барр (ВЭБ) (Epstein-Barr virus - EBV) и герпесвирус человека типа 8 (ГВЧ-8). Они вызывают латентную инфекцию в лимфоидной ткани, лимфоцитах, эпителиальных клетках рта и глотки, слюнных желез. Вирусы растут в лимфобластоидных клетках, оказывают лимфопролиферативное действие. ВЭБ вызывает размножение В-лимфоцитов и персистирует в них.
Морфология. Вирус (рис. 17.6) имеет овальную форму, диаметр 150-200 нм. Он покрыт оболочкой с гликопротеиновыми шипами, сформированными из внутреннего слоя ядерной мембраны клет-
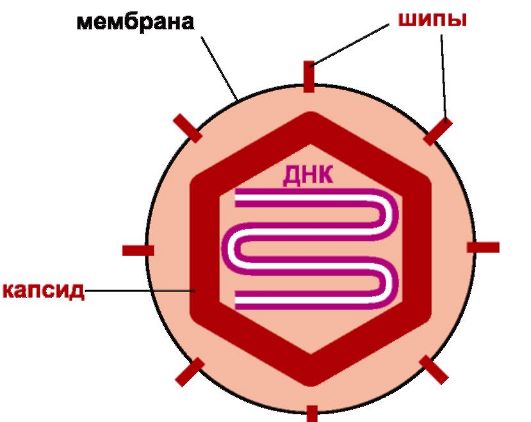
Рис. 17.6. Строение герпесвируса
ки. Вирус содержит ДНК, окруженную икосаэдрическим капсидом, состоящим из 162 капсомеров. Между капсидом и оболочкой находится тегумент, содержащий вирусные белки для инициации репликации. Двунитевая линейная ДНК вириона состоит у ВПГ и ЦМВ из двух фрагментов (короткого S и длинного L). У ВПГ каждый фрагмент заключен между двумя наборами инвертированных повторов, позволяющих геному рекомбинировать с образованием 4 изомеров; у VZV ДНК также состоит из двух фрагментов (короткого S и длинного L), но содержит один набор инвертированных повторов, поэтому формируется две изомерные формы.
Репродукция. Оболочка вириона, прикрепившись к рецепторам клетки, сливается с клеточной мембраной. Освободившийся нуклеокапсид доставляет в ядро клетки ДНК вируса. Далее происходит транскрипция части вирусного генома (с помощью клеточной ДНК-зависимой РНК-полимеразы); образовавшиеся иРНК про- никают в цитоплазму, где транслируются самые ранние α-белки, регулирующие собственный синтез. Затем синтезируются ранние β-белки - ферменты, включая ДНК-зависимую ДНК-полимеразу и тимидинкиназу, участвующие в репликации геномной ДНК вируса. Поздние γ-белки являются структурными белками, включая капсид и гликопротеины (А, В, С, D, E, F, G, Х) вируса. Гликопротеины диффузно прилегают к ядерной оболочке. Формирующийся капсид заполняется вирусной ДНК и почкуется через модифицированные мембраны ядерной оболочки. Перемещаясь через цитоплазму, вирионы выходят из клетки путем экзоцитоза или лизиса клетки.
17.2.2.1. Вирус простого герпеса
ВПГ вызывает простой герпес (Herpes simplex), характеризующийся везикулезными высыпаниями на коже, слизистых оболочках, поражением глаз, ЦНС и внутренних органов, а также пожизненным носительством (персистенцией) и рецидивами болезни.
Различают
два типа вируса - ВПГ-1 и ВПГ-2, которые повсеместно распространены и
поражают большую часть населения зем- ли. ВПГ-1 чаще поражает слизистые
оболочки ротовой полости и глотки, глаза, вызывает энцефалиты, а ВПГ-2
- половые органы, за что и получил название генитального штамма. ВПГ
относится к роду Simplexvirus, семейству Herpesviridae. Открыт У. Грютером в
Структура ВПГ сходна с другими герпесвирусами. На поверхности вириона расположены гликопротеины gA, gB, gC, gD, gH, gF.
Различают структурные белки, белки слияния (gB), иммунные белки уклонения (gC, gE, gI) и др. Например, СЗ-компонент комплемента связывается с gC, а Fc-фрагмент IgG - с gE/gI-комплексом, маскируя вирус и вирусинфицированные клетки. Некоторые гликопротеины имеют общие антигенные детерминанты (gB и gD) для HSV-1 и HSV-2 и типоспецифические - gC.
Репродукция и культивирование. ВПГ может инфицировать большинство типов клеток человека, вызывая литические инфекции фибробластов, эпителиальных клеток и латентные инфекции нейронов. При культивировании на курином эмбрионе на хорио- наллантоисной оболочке образуются мелкие плотные бляшки. В культуре клеток ВПГ вызывает цитопатический эффект в виде появления гигантских многоядерных клеток с внутриядерными включениями. В естественных условиях животные не болеют. При экспериментальном заражении кроликов в роговицу глаза ВПГ вызывает кератит, а при введении в мозг - энцефалит.
Резистентность. Вирус погибает через несколько часов на поверхности предметов обихода, чувствителен к солнечным и УФлучам, жирорастворителям, детергентам. Длительно сохраняется при низких температурах.
Эпидемиология. Источник инфекции - больной или носитель. Оба типа вирусов могут вызывать оральный и генитальный герпес. Вирусы передаются контактным путем (с везикулярной жидкостью, при поцелуях со слюной, при половых контактах с секретами слизистых оболочек, спермой), через предметы обихода, реже воздушно-капельным путем, через плаценту при рождении ребенка. У 80-90% взрослых людей обнаруживаются антитела к ВПГ. Герпес широко распространен в виде спорадических случаев и небольших вспышек в детских коллективах, больницах. Возможна реактивация вируса при снижении иммунитета (рецидивирующий герпес). Начальное инфицирование ВПГ-2 происходит в жизни позже, чем инфицирование ВПГ-1, и коррелирует с возрастанием половой активности.
Патогенез. Основные входные ворота для вируса - кожа и сли- зистые оболочки.Чаще вирус вызывает бессимптомную или латентную инфекцию. Различают первичный и рецидивирующий простой герпес.
При первичной инфекции инкубационный период составляет 2-12 сут. Обычно появляются везикулы с дегенерацией эпители-
альных клеток. Основу везикулы составляют многоядерные клетки. Пораженные ядра клеток содержат тельца Каудри (эозинофильные включения). Верхушка везикулы через некоторое время вскрыва- ется, образуется язвочка, которая вскоре покрывается струпом, корочкой. Далее наступает заживление.
При инфицировании вирусы, минуя входные ворота эпителия, проходят через чувствительные нервные окончания с дальнейшим передвижением нуклеокапсидов вдоль аксона к телу нейрона в чувствительных ганглиях. Репликация вируса в нейроне приводит к его гибели. Некоторые вирусы герпеса вызывают латентную инфекцию, при которой нейроны содержат в себе вирусный геном, но не погибают.
Латентная инфекция чувствительных нейронов - характерная особенность нейротропных герпесвирусов ВПГ и VZV. Большинство людей (70-90%) являются пожизненными носителями вируса, который сохраняется в ганглиях, вызывая в нейронах латентную персистирующую инфекцию. Наиболее изучена латентная инфекция, вызванная ВПГ-1. В латентно инфицированных нейронах около 1% клеток в пораженном ганглии несет вирусный геном. При этом вирусная ДНК существует в виде свободных циркулярных эписом (около 20 копий в клетке). ВПГ-1 обнаруживается в узлах тройничного и обонятельного нервов, а ВПГ-2 - в сакральных ганглиях.
Реактивация герпесвирусов и обострение (рецидив) вызываются различными факторами, снижающими иммунитет (переохлаждение, лихорадка, травма, стресс, сопутствующие заболевания, УФоблучение, лечение иммунодепрессантами и др.). В результате геном герпесвирусов проходит обратно по аксону к нервному окончанию, что способствует репликации вируса в эпителиальных клетках.
Клиническая картина. Болезнь начинается с появления на пораженных участках зуда, отека и пузырьков, заполненных жидкостью. При образовании везикулы ощущается жгучая боль. После подсыхания пузырьков и отторжения корочек рубцы не образуются. ВПГ поражает кожу (везикулы, экзема), слизистые оболочки рта, глотки (стоматит) и кишечника, печень (гепатиты), глаза (кератит и др.) и ЦНС (энцефалит, менингоэнцефалит). Рецидивирующий герпес обусловлен реактивацией вируса, сохранившегося в ганглиях. Он характеризуется повторными высыпаниями и поражением органов и тканей.
Генитальный герпес - результат аутоинокуляции из других пораженных участков тела, но наиболее часто встречается половой путь заражения. Образуются быстро изъязвляющиеся везикулы. У мужчин чаще поражаются головка и тело полового члена, а у женщин - половые губы и вагина, иногда шейка матки. Ранее предполагали, что ВПГ-2 может вызывать рак шейки матки, однако доказано, что эта роль принадлежит папилломавирусам.
Вирус простого герпеса, в основном ВПГ-2, проникает во время прохождения новорожденного через родовые пути матери, вызы- вая неонатальный герпес (герпес новорожденных), который обнаруживается на 6-й день после родов, т.е. с момента заражения. Вирус диссеминирует во внутренние органы с развитием генерализованного сепсиса. Основой предупреждения развития неонатального герпеса являются выявление и лечение генитального герпеса матери или кесарево сечение при наличии выраженных клинических симптомов инфекции.
Иммунитет в основном клеточный. Развивается ГЗТ. Организм человека реагирует на гликопротеины вируса, продуцируя цитотоксические Т-лимфоциты (CD8+), а также T-хелперы (CD4+), активирующие В-лимфоциты с последующей продукцией специфических вируснейтрализующих антител. Важную роль в ранней защите играют NK-клетки. Антитела матери, передающиеся через плаценту, смягчают последствия неонатального герпеса.
Лабораторная диагностика. Исследуют содержимое герпетических везикул, слюну, соскобы с роговой оболочки глаз, кровь, спинно-мозговую жидкость и мозг при летальном исходе. В мазках, окрашенных по Романовскому-Гимзе, наблюдают гигантские многоядерные клетки (синцитий), клетки с увеличенной цитоплазмой и внутриядерными включениями Каудри. Для идентификации вируса используют также ПЦР. Вирус выделяют, заражая клетки HeLa, Hep-2, человеческие эмбриональные фибробласты. Цитопатический эффект становится видимым через сутки после заражения: клетки округляются с последующим прогрессирующим поражением всей культуры клеток. Заражают также куриные эмбрионы или мышей-сосунков, у которых после внутримозгового заражения развивается энцефалит. Вирус идентифицируют в РИФ и ИФА с использованием моноклональных антител.
Серологическую диагностику проводят с помощью РСК, РИФ, ИФА и реакции нейтрализации по нарастанию титра антител больного. Возможно применение иммуноблоттинга.
Лечение. Применяют противовирусные химиотерапевтические препараты (ацикловир, фамцикловир, валацикловир, идоксуридин, видарабин, теброфеновую и флореналевую мазь и др.), препараты интерферонов и индукторы интерферонов.
Профилактика. Специфическая профилактика рецидивирующего герпеса осуществляется в период ремиссии многократным введением инактивированной культуральной герпетической вакцины из штаммов ВПГ-1 и ВПГ-2.
17.2.2.2. Вирус ветряной оспы и опоясывающего герпеса
Вирус вызывает ветряную оспу и опоясывающий герпес. Ветряная оспа (varicella) встречается
в основном у детей, протекает с лихорадкой, интоксикацией, сыпью в
виде везикул с прозрачным содержимым. Опоясывающий герпес, или
опоясывающий лишай, герпесзостер (от греч. herpes - ползучий, zoster -
пояс) - эндогенная инфекция взрослых, перенесших в детстве ветряную
оспу. Болезнь проявляется в виде везикулезной сыпи вокруг туловища по
ходу нервов. Вирус получил название Varicella-zoster virus (VZV), или герпесвирус человека 3 типа (ГВЧ-3). Открыт Б.Э. Арагао в
Культивирование. VZV для животных непатогенен. Он размножается в человеческих диплоидных фибробластах с образованием внутриядерных включений. Вызывает цитопатический эффект, об- разует гигантские многоядерные клетки - симпласты. Вирус размножается более медленно, чем ВПГ.
Резистентность. Вирус малоустойчив в окружающей среде, чувствителен к жирорастворителям и дезинфицирующим средствам; инактивируется при 60 ?С в течение 30 мин.
Эпидемиология. Заболевания относятся к антрапонозам. Ветряной оспой переболевает большинство населения. Источник инфекции - больной ветряной оспой или вирусоноситель. Чаще болеют дети в возрасте от 2 мес до 10 лет. Период заразительности длится с конца инкубационного периода и в течение 5 дней с момента появления сыпи; больной опоясывающим герпесом иногда бывает заразен. Вирус передается воздушно-капельным путем, через контакт с везикулами кожи, возможна трансплантационная передача. Латентная инфекция обусловлена длительной персистенцией вируса в клетках человека. Опоясывающим герпесом болеют в основ-
ном взрослые результате реактивации вируса, персистирующего в организме, т.е. вируса, сохранившегося после перенесенной в детстве ветряной оспы.
Патогенез. Возбудитель проникает через слизистые оболочки верхних дыхательных путей, накапливается и током крови (вирусемия) заносится главным образом в эпителий кожи и слизистых оболочек. В шиповидном слое эпидермиса формируются везикулы. Сформированные везикулы кожи и слизистых оболочек со- держат серозный экссудат и небольшое количество лимфоцитов. Образуются гигантские многоядерные клетки, ядра которых содержат включения. После первичной инфекции вирус сохраняется в заднем корешке или ганглии черепно-мозгового нерва.
Клиническая картина. Инкубационный период при ветряной оспе составляет 11-23 дня. Болезнь характеризуется лихорадкой, появлением папуловезикулярной сыпи на коже лица, шеи, туловища и конечностей, иногда в области половых органов и полости рта. Сыпь похожа на высыпания при натуральной оспе (отсюда произошло название болезни). Образовавшиеся круглые пузырьки через 1-3 дня лопаются и подсыхают. Через 10-12 сут корки отпадают. При этом, в отличие от натуральной оспы, рубцы не образуются. У детей в возрасте от 2 мес до 1 года и у взрослых ветряная оспа протекает тяжело, с развитием иммунодефицита; возможны пневмонии, гепатиты, энцефалиты, отиты, пиодермии и другие осложнения. Опоясывающий герпес может развиться в результате реактивации вируса, длительно сохраняющегося в нервных клетках спинного мозга. Этому способствуют различные заболевания, стресс, переохлаждение, травмы и другие факторы, снижающие иммунитет.
Вирус проникает через кожу и слизистые оболочки, поражая в дальнейшем спинальные и церебральные ганглии, что сопро- вождается болевым синдромом, характерным для опоясывающего герпеса. Вокруг туловища по ходу пораженных межреберных нервов появляется сыпь в виде обруча; возможны высыпания по ходу тройничного нерва, на ушной раковине, а также гангренозная (некротическая) форма поражения.
Иммунитет. У переболевших формируется пожизненный клеточно-гуморальный иммунитет. Однако это не мешает длительному сохранению вируса в организме и возникновению рецидивов опоясывающего герпеса.
Лабораторная диагностика. Исследуют содержимое высыпаний, отделяемое носоглотки и кровь. Вирус можно выявить в мазкахотпечатках, окрашенных по Романовскому-Гимзе, по образованию синцития и внутриядерных включений (тельца Липшютца). Вирус выделяют при культивировании на культуре клеток эмбриона человека. Идентификация вируса и определение антител в сыворотке крови больных проводят с помощью РИФ, ИФА и реакции нейтрализации.
Лечение. Элементы сыпи смазывают 1-2% водным раствором перманганата калия или 1-2% водным или спиртовым раствором бриллиантового зеленого. Применяют ацикловир, видарабин, а также интерфероны, интерфероногены и другие иммуномодуляторы.
Специфическая профилактика. В очагах ветряной оспы ослабленным детям можно вводить препараты иммуноглобулина. Разработана живая ослабленная вакцина для VZV.
17.2.2.3. Вирус Эпштейна-Барр
ВЭБ вызывает инфекционный мононуклеоз, а также лимфопролиферативные болезни. Инфекционный мононуклеоз протекает с интоксикацией, поражением нёбных и глоточных миндалин, увеличением лимфатических узлов, печени, селезенки, изменениями в крови. ВЭБ относится к роду Lymphocryptovirus, семейству Herpesviridae.
Структура. Вирус имеет ядерные антигены - nuclear antigens (EBNAs) 1, 2, ЗА, ЗВ,
Эпидемиология. Антитела к вирусу имеются у большинства населения. Источником инфекции является больной человек или вирусоноситель. Вирус передается воздушно-капельным путем, при контакте через слюну.
Патогенез и клиническая картина. После первичного размножения в эпителии носоглотки ВЭБ взаимодействует с молекулой CD21 В-лимфоцита и, проникнув в клетку, вызывает размноже-
ние В-лимфоцитов, персистирует в них. Особенно много инфицированных В-лимфоцитов находится в нёбных миндалинах. ВЭБ обусловливает латентную инфекцию в лимфоидной ткани, эпителиальных клетках рта и глотки, слюнных желез. Он вызывает бессимптомную, хроническую или острую инфекцию (в виде инфекционного мононуклеоза), а также лимфопролиферативные болезни.
Инфекционный мононуклеоз характеризуется высокой лихорадкой, недомоганием, лимфаденопатией, фарингитом, спленомегалией и изменениями крови. Мононуклеоз обусловлен появлением многочисленных бластоподобных мононуклеаров. Хроническая инфекция может развиваться как циклическая рекуррентная болезнь, которая сопровождается низкой лихорадкой, повышенной утомляемостью, головной болью и воспалением горла.
ВЭБ также может индуцировать лимфопролиферативные болезни и способствать развитию опухолей. Люди с дефектом Т-клеточного иммунитета вместо инфекционного мононуклеоза могут страдать поликлональной лейкемияподобной В-клеточной пролиферативной болезнью и лимфомой. У реципиентов трансплантата после иммуносупрессивной терапии может развиться посттранспланта- ционная лимфопролиферативная болезнь вследствие контакта с ВЭБ или реактивации латентного вируса. Подобные болезни развиваются у больных с ВИЧ-инфекцией. У ВИЧ-инфицированных часто возникает волосистая оральная лейкоплакия - характерное для СПИДа поражение слизистой оболочки рта. Источником лимфомы Беркитта (эндемическая лимфома) - опухоли верхней челюсти - являются трансформированные В-лимфоциты. Лимфома Беркитта ассоциирована с малярией в Африке. Большой процент больных с лимфомой Ходжкина также содержат последовательности ДНК ВЭБ. Аналогично последовательности ДНК ВЭБ содержат и опухолевые клетки назофарингеальной карциномы, эндемичной на Востоке. В отличие от лимфомы Беркитта, в которой опухолевые клетки получены из лимфоцитов, опухолевые клетки носоглоточной карциномы, вызываемые ВЭБ, имеют эпителиальное начало.
Иммунитет клеточный (действие CD8+-цитотоксических лимфоцитов) и гуморальный, обусловленный действием антител. Повторные заболевания не описаны.
Диагностика. Для инфекционного мононуклеоза характерны наличие атипичных лимфоцитов, лимфоцитоз (моноциты состав-
ляют 60-70% белых кровяных клеток с 30% атипичных лимфоцитов). Ранее применяли вспомогательные реакции, выявляющие гетерофильные антитела (агглютинация эритроцитов барана сывороткой крови больного и др.).
Свежая ВЭБ-инфекция выявляется в ИФА по различным показателям: появляются IgM-антитела к вирусному капсидному анти- гену (VCA), повышается титр EBNA и др. Затем при развитии кли- нических проявлений повышается уровень IgG-антител к VCA.
Лечение и специфическая профилактика не разработаны.
17.2.2.4. Вирус цитомегалии
Вирус цитомегалии (от греч. cytos - клетка, megas -
большой) вызывает поражение многих органов и тканей. Цитомегалия
протекает разнообразно - от пожизненной латентной инфекции до тяжелой
острой генерализованной формы с летальным исходом. Он вызывает
латентную инфекцию в мононуклеарных лимфоцитах, клетках стромы костного
мозга и других клетках. Вирус цитомегалии относится к роду Cytomegalovirus, семейству Herpesviridae. Он был впервые выделен Г. Смитом в
Структура. Вирус имеет самый большой ДНК-геном среди гер- песвирусов.
Культивирование. Вирус реплицируется только в клетках человека (макрофагах, фибробластах и эпителиоцитах). Он культивируется в культуре фибробластов и диплоидных клетках легких эмбриона человека с образованием гигантских (цитомегалических) клеток с внутриядерными включениями. Патогенен для обезьян.
Резистентность. Вирус термолабилен, чувствителен к дезинфектантам и жирорастворителям.
Эпидемиология. Цитомегаловирус распространен широко. Более 60% населения имеют антитела к цитомегаловирусу. Источник инфекции - человек, больной острой или латентной формой. Входными воротами являются слизистые оболочки, кожа, дыхательные пути и плацента (врожденная цитомегалия). Механизмы передачи вируса контактно-бытовой, респираторный, кровяной, иногда фекально-оральный. Заражение возможно через слюну, кровь, мочу, сперму и грудное молоко. Вирус может передаваться вертикально от матери к плоду. Инфицирование может быть при половых контактах, переливании крови и трансплантации органов. Острая инфекция проявляется у 95% лиц со СПИДом.
Патогенез и клиническая картина. Инкубационный период не установлен, так как инфекция чаще протекает в латентной форме. Клинические проявления развиваются при первичном инфицировании цитомегаловирусом, но чаще формируется латентная инфекция, сохраняющаяся на протяжении всей жизни. Вирус обладает выраженным тропизмом к эпителию слюнных желез и канальцев почек, где происходит его репродукция. Из организма вирус выделяется со слюной и мочой. Реактивация вируса нередко происходит у беременных, у лиц после переливания крови, транс- плантации органов и при других состояниях, сопровождающихся снижением иммунитета. Вирус вызывает латентную инфекцию в почках и слюнных железах, иммунодефицит, пневмонию, нарушение зрения, слуха и умственной деятельности. Цитомегаловирусная инфекция может осложнять течение ряда сопутствующих заболеваний, в том числе способствовать развитию синдрома Гийена-Барре в виде парезов и параличей конечностей в результате демиелинизирующего поражения нервных корешков. Наибольшую опасность представляет врожденная цитомегаловирусная инфекция. Около 1% новорожденных инфицируются через пла- центу. У них развиваются гепатоспленомегалия, желтуха, кахексия, поражение органов зрения, микроцефалия и другие пороки, приводящие к смерти. Потенциально вирус может вызывать опухоли (аденокарциному предстательной железы и др.).
Иммунитет. Формируется гуморальный и клеточный иммунитет, однако вируснейтрализующие антитела не препятствуют сохранению вируса в организме.
Лабораторная диагностика. Исследуют кровь, грудное молоко, мочу, слюну, отделяемое цервикального канала и цереброспинальную жидкость. Пораженные клетки имеют увеличенные размеры (25-40 мкм) и внутриядерные включения в виде «глаза совы» (окраска гематоксилином и эозином). Вирус выделяют в культуре фибробластов легких человеческого эмбриона. Идентификацию проводят с помощью ПЦР, а также в РИФ и ИФА с использованием моноклональных антител. Антитела (IgM, IgG) к вирусу в сыворотке крови больных определяют в ИФА, РСК, реакции нейтрализации и др.
Лечение. Применяют аналоги нуклеозидов (ацикловир, ганци- кловир, фоскарнет и др.), иммуномодуляторы (интерферон, левамизол и др.), индукторы интерферона (полудан и др.), а также нормальный иммуноглобулин человека.
Профилактика. Необходимо оберегать лиц с ослабленным иммунитетом от контактов с инфицированными лицами, детьми с врожденной цитомегалией, которые могут до 5 лет выделять вирус в окружающую среду. При рождении ребенка с врожденной цитомегалией повторная беременность может быть рекомендована не ранее чем через 2 года (срок персистенции вируса). Для про- филактики ЦМВ-инфекции при пересадке органов реципиентам наряду с ацикловиром назначают антицитомегаловирусный иммуноглобулин.
17.2.2.5. Герпесвирус человека типов 6, 7 и 8
ГВЧ-6 и ГВЧ-7 относятся к роду Roseolovirus. Они являются лимфотропными вирусами, инфицируют Т-лимфоциты. ГВЧ-6 был выделен в
ГВЧ-6 (Herpes lymphotropic virus) вызывает внезапную экзантему - exanthema subitum у младенцев (0,5-3 лет жизни) или roseola infantum с внезапным подъемом температуры (40 ?С) и таким же спадом через 3 дня на фоне неяркой розовой папуломакулезной сыпи; синдром хронической усталости с субфебрильной температурой, потливостью, артралгией и слабостью. Возможны лимфаденопатия и неврологические нарушения.
ГВЧ-7 был выделен в
ГВЧ-8 относится к роду Rhadinovirus. Он известен как герпесвирус, ассоциированный с саркомой Капоши. Обладает нейроинвазивными свойствами, определяясь в дорсальных спинальных ганглиях у больных саркомой Капоши и в цереброспинальной жидкости у ВИЧ-инфицированных.
Лабораторная диагностика. ГВЧ-6 или ГВЧ-7 выделяют при кокультивировании лимфоцитов периферической крови с митогенактивированными лимфоцитами. В культуре образуются большие многоядерные клетки. Вирионы можно выделить из слюны.
В диагностике, в том числе ГВЧ-8, определяют маркерные гены возбудителя в ПЦР.
Лечение. Для лечения применяют аналоги нуклеозидов (ганци- кловир, фоскарнет и др.), иммуномодуляторы (интерфероны).
17.2.3. Поксвирусы (семейство Poxviridae)
Поксвирусы (Poxviridae от англ. pox - пустула + вирусы) - семейство крупных ДНК-содержащих вирусов, состоящее из двух подсемейств: Chordopoxvirinae, содержащее вирусы оспы позвоночных (вирусы натуральной оспы, вакцины, оспы обезьян и др.) (табл. 17.3), Entomopoxvirinae, включающее вирусы оспы насекомых.
Таблица 17.3. Характеристика подсемейства Chordopoxvirinae*
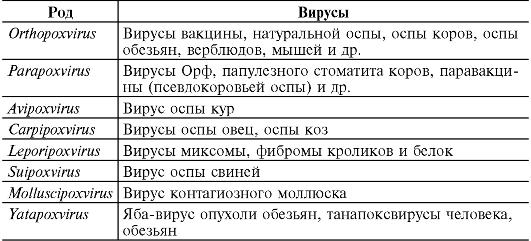
* Два представителя подсемейства, вируса натуральной оспы и вирус контагиозного моллюска - облигатные патогены человека; другие представители могут передаваться от животных к человеку как возбудители зоонозных инфекций.
17.2.3.1. Вирус натуральной оспы
Натуральная оспа - высококонтагиозная
особо опасная инфекция, характеризующаяся тяжелым течением, лихорадкой
и обильной пустулезно-папулезной сыпью на коже и слизистых оболочках.
Относилась к конвенкционным (карантинным) инфекциям. Была ликвидирована
на земном шаре в
Морфология и антигенная структура. Поксвирусы - самые крупные вирусы; имеют овоидную форму (230x400 нм).
Вирионы видны
при специальных методах окраски в виде так называемых элементарных
телец Пашена (окраска серебрением по Морозову). Впервые вирусы
обнаружены в световом микроскопе Е. Пашеном в
Вирусы имеют нуклеопротеиновый и растворимые антигены, а также гемагглютинин; имеются общие антигены с вирусом вакцины.
Репродукция вируса. Вирион проникает в клетку в результате слияния наружной оболочки с клеточной мембраной. После удаления наружной мембраны происходит транскрипция ранних генов с помощью ферментов вируса. Образуются иРНК, кодирующие ранние ферменты: «раздевающий белок», удаляющий мембрану сердцевины и освобождающий вирусную ДНК в цитоплазму; появляется вирусная ДНК-полимераза, реплицирующая геном. При поздней транскрипции ДНК и белки вируса собираются в сердцевину с сердцевинной мембраной. Формирующиеся вирионы покрываются модифицированными мембранами аппарата Гольджи. Наружная мембрана окутывает сердцевину, латеральные тела и ферменты; вирионы почкуются через плазматическую мембрану и выходят при лизисе клетки.
Культивирование. Вирус
натуральной оспы образует на хорио- наллантоисных куриных эмбрионах
белые бляшки. В цитоплазме культивируемых клеток формируются
характерные околоядерные включения (тельца Гварниери), впервые
описанные в
Резистентность. Вирусы устойчивы к высушиванию и низким температурам, длительно сохраняются в корочках оспенных пустул. Они нечувствительны к эфиру, моментально погибают при 100 ?С, а при 60 ?С - через 15 мин; при обработке хлорамином погибают через несколько часов.
Эпидемиология. Источником инфекции является больной человек, который заразен с последних дней инкубационного периода и до отпадения корочек высыпаний (около 3 нед). Инфицирование происходит воздушно-капельным, воздушно-пылевым, а также контактно-бытовым путями при соприкосновении с вещами больного, загрязненными слизью, гноем, корочками с пораженных наружных покровов, калом и мочой, содержащими вирус.
В связи с высокой контагиозностью, тяжестью течения и высокой летальностью натуральная оспа относится к особо опасным конвенционным (карантинным) инфекциям. До глобальной ликвидации она была широко распространена в странах Азии, Африки, Южной Америки (XVI век и последующие) и Европы (VI век и последующие), унося в отдельные годы жизнь 2 млн человек.
В
Патогенез. Вирус натуральной оспы проникает через слизистые оболочки верхних дыхательных путей, реже через кожу. После размножения в регионарных лимфатических узлах он попадает в кровь, из которой заносится в кожу и лимфоидные ткани, где происходит дальнейшее размножение вирусов, формируются очаги поражения в коже (дерматотропные свойства), слизистых оболоч- ках и паренхиматозных органах. Образуются характерные папулезные, а затем везикуло-пустулезные высыпания. Для большинства животных вирус натуральной оспы малопатогенен. Клиническую картину можно воспроизвести у обезьян.
Клиническая картина. После 7-17 дней инкубационного периода температура тела повышается, появляются рвота, головная и поясничная боли и сыпь, возникают розовые пятна, которые затем переходят в папулы размером с горошину, а затем в пузырьки (везикулы) и пустулы (гнойнички), подсыхающие и превращающиеся в корки. После отпадения корок на коже (на 30-40-й день болезни) остаются рубцы (рябины), особенно выраженные на лице.
Различают тяжелую форму оспы (пустулезно-геморрагическая, или черная оспа, сливная оспа) со 100% летальностью, средне-
тяжелую форму (рассеянная оспа), легкую (вариолоид, оспа без сыпи, оспа без повышения температуры тела).
Иммунитет. У переболевших формируется стойкий пожизненный иммунитет, обусловленный появлением вируснейтрализующих антител, интерферонов и активацией факторов клеточного иммунитета.
Лабораторная диагностика. При диагностике соблюдают правила предосторожности, разработанные для особо опасных инфекций. Исследуют содержимое элементов сыпи, отделяемое носоглотки, кровь, пораженные органы и ткани. Вирус выявляют при электронной микроскопии, в РИФ, РП, по образованию телец Гварниери. Вирус культивируют на куриных эмбрионах и культурах клеток с последующей идентификацией в РН, РТГА, РСК. Серологическую диагностику проводят в РТГА, РСК, РПГА, РН.
Лечение симптоматическое. Целесообразно назначение индукторов интерферона и противовирусных препаратов.
Специфическая профилактика. Применяют
живую оспенную вакцину, которую готовят из соскобов сыпи телят или при
культивировании вируса вакцины (осповакцины) на куриных эмбрионах.
Вакцину вводят скарификационным способом или накожно с по- мощью
безыгольного инжектора. Она создает прочный иммунитет. Разработана
оральная таблетированная вакцина, не уступающая по эффективности
накожной, но менее реактогенная (А.А. Воробьев и соавт.). В связи с
ликвидацией оспы обязательная ранее вакцинация отменена с
Первая вакцина была получена английским врачом Э. Дженнером, который привил против оспы мальчика (ввел вирус коровьей оспы, поражающий кожу пальцев рук после доения инфицированных коров), а затем показал его невосприимчивость к вирусу натуральной оспы.
17.2.3.2. Другие поксвирусы, поражающие человека
Вирус оспы коров ранее считался профессиональной инфекцией доярок, заразившихся от больных коров. Оказалось, что люди также могут заражаться от других больных животных (крыс, кошек, диких грызунов). Заболевание протекает доброкачественно; из одиночных папул образуются везикулы, пустулы, которые под- сыхают, а после отпадения корок остаются дефекты-рубцы. Генерализация заболевания редка.
Вирус вакцины использовался в качестве живой вакцины при ликвидации оспы на земле. Происхождение вируса вакцины неизвестно; он является самостоятельным вирусом, отличающимся от возбудителя оспы коров, хотя полагают, что он произошел от последнего. Возможно, вирус вакцины существует только в виде лабораторных штаммов. Вирус вакцины вызывает оспоподобные локальные поражения, иногда генерализованную папулезную сыпь.
Вирус контагиозного моллюска вызывает появление эритематозных узелков, превращающихся в жемчужно-розовые капсулы; возбудитель передается контактно через микротравмы кожи и слизистых оболочек. Очаги поражения могут распространяться в результате самозаражения. Поражает детей и взрослых. У взрослых поражения чаще локализуются в области гениталий.
Вирус оспы обезьян выделен в
Танапоксвирусы человека вызывают лихорадку и образование на коже одного везикулярного очага. Вирус оспы Тана встречается среди племен в Кении, проживающих в долине реки и озера Тана.
Вирус Орф вызывает контагиозную эктиму (болезнь Орф) - ин- фекционный пустулезный дерматит в виде лихорадки и везикулярных высыпаний на лице и руках. Основным резервуаром вируса являются овцы.
17.2.4. Гепаднавирусы (семейство Hepadnaviridae)
Вирус гепатита В (ВГВ) относится к семейству Hepadnaviridae, роду Orthohepadnavirus. Впервые был обнаружен под электронным микро- скопом в
Морфология. ВГВ - сложноорганизованный, ДНК-содержащий вирус сферической формы, диаметром 42-47 нм. Он состоит из сердцевины (core), построенной по кубическому типу симметрии, состоящей из 180 белковых частиц, составляющих сердцевинный НВс-антиген, диаметром 28 нм, и липидной оболочки, содержащей поверхностный HBs-антиген. Внутри сердцевины находятся ДНК-полимераза, обладающая ревертазной активностью, протеинкиназа и концевой белок НВе-антигена. ДНК-полимераза является полифункциональным ферментом, она вовлекается во многие функции жизненного цикла вируса: способна синтезировать новые цепи ДНК, на матрице как ДНК, так и РНК, обладая как полимеразной, так и ревертазной активностью. Нуклеазная активность деградирует РНК-цепь в гибриде РНК-ДНК.
Антигенная структура. ВГВ обладает сложной антигенной структурой. В оболочке вируса находится HBs-антиген, который локализован в гидрофильном слое на поверхности вириона. В формировании HBs-антигена участвуют 3 полипептида в гликозированной форме: preS1- большой полипептид (L - large), preS2 - средний полипептид (M - middle), S - малый мажорный (S - small).
Классическим
антигеном, обладающим специфичностью, является S - малый мажорный
полипептид, который входит во все 3 оболочечных белка, которые
различаются протяженностью N-терминального пептидного конца (preS). Так, L-белок содержит preS1, preS2 и S-полипептиды. M-полипептид состоит из preS2 и S-полипептидов. Впервые HBs-антиген был обнаружен и описан Б. Блумбергом в
4 главных подтипа: adw, ayw, adr и ayr, которые распространены в различных географических зонах. Связи между клиническим течением и подтипом не наблюдается. Защита против одного подтипа обеспечивает защиту и против других за счет наличия общей детерминанты. Сердцевинный НВс-антиген никогда не присутствует в свободной форме в крови, являясь внутренним компонентом вирусной частицы. Его можно обнаружить в зараженных вирусом гепатоцитах.
НВе-антиген также является сердцевинным антигеном, производным НВс-антигена, его также называют растворимым анти- геном. Появление НВе-антигена в крови связано с репликацией вируса.
НВх-антиген - трансактиватор, является еще одним антигеном ВГВ, накопление которого в крови связывают с развитием первич- ного рака печени.
Геном представлен двухнитевой ДНК кольцевой формы с молекулярной массой 1,6x106 Д, у которой плюс-цепь укорочена на 1/3 длины. Вирусный геном записан на минус-цепи и состоит из 4 открытых частично перекрывающихся рамок считывания: Р, С, S и X. Рамка считывания Р кодирует вирусную полимеразу и терминальный белок, найденный на минус-цепи ДНК. Рамка считывания С кодирует структурные белки нуклеокапсида и НВе-антиген. Рамка считывания S кодирует вирусные поверхностные гликопро- теины. Продукт гена Х усиливает транскрипцию гомологичных и гетерологичных клеточных генов, участвуя в процессе развития гепатоцеллюлярной карциномы.
Полноценная минус-цепь ковалентно связана с ДНК-полимеразой, которая достраивает плюс-цепь до полноценной структуры.
Экспрессия генома осуществляется с 4 промоторов: геномного, экспрессирующего полимеразу, рreC и C-белки; осуществляющего экспрессию L-белка; экспрессирующего M- и S-белки, экспресси- рующего Х-белок.
Культуральные свойства. ВГВ не культивируется на куриных эмбрионах, не обладает гемолитической и гемагглютинирующей активностью. Культивируется только в культуре клеток, полученной из ткани первичного рака печени в виде персистирующей инфекции, без оказания цитопатического и цитолитического действий и с малым накоплением вирионов. К вирусу чувствительны приматы: гориллы, шимпанзе, африканские зеленые мартышки.
Репликативный цикл. ВГВ связывается с рецептором на поверхности гепатоцита, возможно, при посредничестве сывороточного альбумина, рецепторы к которому обнаружены как на preS2- антигене, так и на гепатоците и с помощью эндоцитоза проникает в гепатоцит. Проникнув в клетку, вирусный нуклеокапсид достигает ядра, где вирусный геном освобождается. В ядре ДНК-полимераза достраивает брешь плюс-цепи ДНК, в результате формируется двунитевая, суперспирализованная циркулярная молекула ДНК, после чего возможно развитие двух типов инфекции: продуктивной и интегративной.
Интегративная инфекция характеризуется амплификацией генома вируса с помощью ковалентносвязанной с ним ДНКполимеразы вируса, в результате образуется внутриядерный вирусный геномный пул, который интегрирует в геном клетки с образованием провируса. При этом наблюдается синтез HBs-антигена. Клинически это проявляется вирусоносительством, показателем которого является обнаружение в крови HBs-антигена.
В процессе продуктивной инфекции происходит формирование новых вирусных частиц. Минус-цепь вирусной ДНК служит матрицей для транскрипции 4 вирусных РНК длиной 3,5, 2,4, 2,1 и 0,7 килобаз (тысяч пар оснований). Транскрипты длиной 2,2, 2,1 и 0,7 килобаз являются субгеномными РНК, выполняющими функцию иРНК. Они транспортируются в цитоплазму, где транс- лируются с образованием также оболочечных большого (L), среднего (M) и малого (S) белков и продукта гена Х. Белки оболочки внедряются как интегральные белки в липидную мембрану эндоплазматического ретикулума. 3,5-килобазная РНК представляет полный геном и обозначается как прегеномная РНК. Она обладает бифункциональной активностью, выполняя, с одной стороны, функции иРНК для трансляции белков сердцевины (pre core): preHBc-аг, HBc-аг и полимеразы. Кроме того, она служит матрицей для синтеза полноценной минус-цепи ДНК. Она упаковывается совместно с ДНК-полимеразой и протеинкиназой в сердцевину, где и выполняет роль матрицы для синтеза негативной нити ДНК с помощью ревертазной активности ДНК-полимеразы. Этот процесс протекает внутри формирующейся сердцевины. РНКцепь в гибриде РНК-ДНК деградируется с помощью нуклеазной активности ДНК-полимеразы. Сформировавшийся нуклеокапсид
достигает эндоплазматического ретикулума, где связывается с поверхностными белками и почкуется в тоннель эндоплазматическо- го ретикулума, по которому секретируется через аппарат Гольджи из клетки. Precore полипептид также транспортируется в канал эндоплазматического ретикулума, где происходит отделение карбокситерминального конца, который секретируется из клетки в виде НВе-антигена. Маркером репликации вируса является появление в крови НВе-антигена. Клинически продуктивная инфекция проявляется активным инфекционным процессом в виде острого или хронического гепатита, маркером острого и хронического гепатита является появление антител к НВс-антигену (рис. 17.7).
Особенностью продуктивной вирусной инфекции при ВГВ является то, что ВГВ сам не обладает цитолитическим эффектом и не разрушает гепатоциты. Повреждение опосредуется цитотоксическими CD8 Т-лимфоцитами, которые узнают инфицированные клетки по накопившимся на поверхности гепатоцита принадлежащим НВс-антигену вирусным олигопептидам, локализованным совместно с молекулами 1-го класса главного комплекса гистосовместимости, и удаляют их. Удаление клеток провоцирует клеточное воспаление и вызывает острый гепатит. Когда инфекция сама раз-
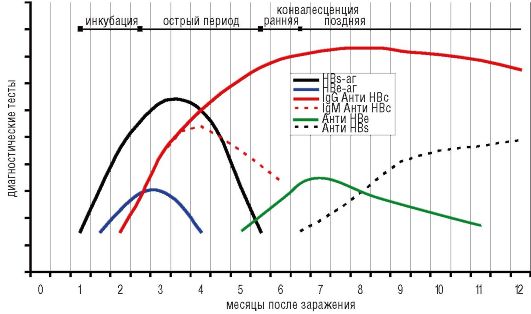
Рис. 17.7. Диагностические маркеры при гепатите В
решается, формируется иммунитет. Если вирус не элиминируется, тонкий баланс между вирусной репликацией и иммунной защитой нарушается, что приводит к развитию хронического гепатита и цирроза. В хронически инфицированных клетках вирусная ДНК может интегрировать в ДНК клетки-хозяина. Результатом этой интеграции может быть развитие гепатоцеллюлярной карциномы.
Иммунитет. Гуморальный иммунитет представлен антителами к НВs-антигену, которые защищают гепатоциты от вируса, элиминируя его из крови. Помимо полноценных вирионов, в формировании гуморального иммунитета принимают участие «пустые» неинфекционные частицы, состоящие из НВs-антигена. В осво- бождении гепатоцитов от ВГВ основная роль принадлежит клеточному иммунному ответу, опосредованному CDS-лимфоцитами, в активации которого ведущая роль принадлежит НВс-антигену. У больных с острой формой этого заболевания отмечается сильный Th1- и CD8-клеточный иммунный ответ против НВс-антигена. Переход острой формы в хроническую обеспечивается нарушениями Т-клеточного иммунитета, а также дефектами образования интерлейкина-1 и α-интерферона. Сероконверсия, характеризующаяся исчезновением из крови НВе-антигена и появлением к нему антител, имеет положительное прогностическое значение, так как коррелирует с активацией Т-клеточного иммунного ответа. При хронической форме заболевания продукция γ-интерферона, цитокина Th1-лимфоцитов, и CD8-ответ слабые или отсутствуют совсем.
Диагностика. Диагноз подтверждается обнаружением в сыворотке антигенов и антител, а также вирусной ДНК. В течение инфекции происходит изменение серологических маркеров в зависимости от того, является ли инфекция острой или хронической (см. рис. 17.7) Три системы антиген-антитело имеют значение при постановке диагноза: HBs-aг/анти-HBs; IgM-анти-НВс и IgG-анти- НВс; НВе-аг/анти-НВе.
HBs-аг определяется в сыворотке за несколько дней до начала появления симптомов и присутствует в течение острой инфекции. Его присутствие при хронической инфекции показывает, что пациент инфекционен. НВе-аг и ВГВДНК определяются позже. Присутствие НВе-аг связано с высокой инфекционностью крови. Анти-НВс-антитела появляются первыми. Они не обладают про-
тективными свойствами. Их присутствие свидетельствует о наличии гепатита в данный момент или ранее. IgM-анти-НВс присутствуют в высоком титре в течение острой инфекции и исчезают через 6 мес. IgG-анти-НВс определяются в течение всей жизни после перенесенного заболевания.
Анти-НВе появляются после анти-НВс, и их появление является благоприятным фактором, свидетельствующим о выздоров- лении.
Анти-HBs заменяют HBs-аг при разрешении острой инфекции. Они персистируют в течение жизни, обеспечивая протективный иммунитет.
Если у больного с острой формой гепатита В HBs-аг персистирует более 8 нед после исчезновения симптомов, то он становится, вероятно, носителем и имеется риск развития хронической инфекции.
У HBs-аг/НВе-аг-положительных пациентов в сыворотке обнаруживают ВГВДНК (HBVDNA). У пациентов, которые излечились от острого гепатита, ДНК в сыворотке не определяется.
Профилактика. С
Согласно рекомендациям ВОЗ, вакцинации в первую очередь должны подвергаться новорожденные, особенно родившиеся у HBs-положительных матерей, а также дети и лица из группы риска заражения ВГБ, в первую очередь работники здравоохранения. Предложенная схема иммунизации состоит из 3 инъекций с интервалом между первым и вторым введением 1 мес; а между вторым и третьим введением 4-6 мес (т.е. 0-1-4-6). Третья инъекция является очень существенной, так как она вызывает возрастание титра антител от 10 до 100 раз. Продолжительность иммунитета составляет 5-7 лет.
Примерно у 10-15% здоровых лиц отмечена толерантность на введение вакцины.
17.3. Возбудители парентеральных вирусных гепатитов D, C, G
17.3.1. Вирус гепатита D
Вирус гепатита D (ВГО) впервые был обнаружен в
Культивирование. Вирус не культивируется на известных клеточных линиях. Экспериментальной моделью являются шимпанзе и лесные сурки, которые заражаются ВГD совместно с ВГВ и вирусом гепатита лесных сурков соответственно.
Эпидемиология. Резервуаром ВГD в природе являются носители ВГВ. Заражение ВГD аналогично инфицированию ВГВ. Одновременное инфицирование ВГВ и ВГD (коинфекция) приводит к развитию умеренной формы болезни. Инфицирование ВГD больных с хронической формой гепатита В утяжеляет течение инфекции, приводя к развитию острой печеночной недостаточности и цирроза печени.
Диагностика осуществляется серологическим методом путем определения антител к ВГD методом ИФА. В биоптатах печени методом ПЦР можно обнаружить в гепатоцитах РНК вируса.
Профилактика и лечение. Для профилактики гепатита D проводят все те мероприятия, которые используют для профилактики гепатита В. Для лечения применяют препараты интерферона. Вакцина против гепатита В защищает и от гепатита D.
17.3.2. Вирус гепатита С
Вирус гепатита С (ВГС) относится к семейству Flaviviridae, роду Hepacivirus.
Морфология. ВГС является сложноорганизованным РНКсодержащим вирусом сферической формы, диаметром 55-65 нм.
Капсид построен по кубическому типу симметрии, содержит структурный белок сердцевины (core), НСс-антиген и неструктурные белки: NS2, NS3, NS4, NS5, которые являются ферментами, необходимыми для репродукции вируса. Белки NS2-NS4 участвуют в процессинге NS-района, синтезированного в результате трансляции вирусной РНК полипептида. Белок NS3 является бифункциональным белком, обладающим протеолитической и хеликазной активностью. NS5-белок является РНК-зависимой РНКполимеразой.
Капсид окружен липопротеиновой оболочкой с гликопротеиновыми шипами gp Е1 и gp E2/NS1.
Антигенная структура. Антигенами вируса являются НСсантиген (core-антиген); неструктурные белки NS2-NS5; гликопротеины оболочки gp Е1 и gp E2/NS1.
Геном представлен плюс-цепью РНК. Геном высокоизменчив. Особой гипермутабельностью обладает район, детерминирующий синтез гликопротеинов Е1 и Е2, которые обладают В-эпитом и на которые вырабатываются вируснейтрализующие антитела. Замена аминокислот в гликопротеинах изменяет антигенные свойства вируса, позволяя ему избегать нейтрализующего действия антител. Известно около 14 генотипов вируса. Наибольшее распространение имеют генотипы 1-3, наиболее вирулентным является генотип 1b.
Культуральные свойства. ВГС не культивируется на куриных эмбрионах, не обладает гемолитической и гемагглютинирующей активностью. Экспериментальной моделью является шимпанзе. Трудно адаптируется к культивированию в культуре клеток.
Резистентность. Относительно нестабилен при хранении при комнатной температуре. ВГС чувствителен к эфиру, детергентам, формальдегиду, УФ-лучам; нагревание при 60 ?С инактивирует вирус в течение 10 ч, при 100 ?С в течение 2 мин.
Эпидемиология. Заражение ВГС аналогично заражению ВГВ. Однако для заражения ВГС требуется большая заражающая доза, чем при гепатите. Наиболее часто ВГС передается при перелива-
ниях крови (2/3 случаев), половым путем, при использовании загрязненных инструментов. Трансплацентарная передача возможна только в случае высокой вирусемии. Вирус широко распространен. В мире более 1/3 населения инфицировано ВГС.
Клиническая картина. Инкубационный период 6-8 нед. Клиническое течение острого гепатита С более легкое, чем гепатита В. Часто встречаются безжелтушные формы, выявить заболевание при которых можно по повышению активности аланинаминотрансаминазы в крови. Однако в 60% случаев процесс переходит в хроническое состояние с развитием цирроза и первичного рака печени. Переход в хроническое состояние в 50% случаев связан, с одной стороны, с отсутствием выраженного CD4-клеточного иммунного ответа, а также возможностью вируса избегать нейтрализующего действия антител вследствие большой изменчивости генома. Предполагается, что ВГС представляет собой персистирующую вирусную инфекцию, при которой вирус персистирует в лимфатических узлах. При ослаблении CD4-иммунного ответа происходит реактивация вируса. Выраженный CD4-иммунньIЙ ответ, направленный против эпитопа на NS3-белке, обусловливает выздоровление.
Диагностика. Используются ПЦР и серологическое исследование. Материалом для исследования является кровь. Обнаружение в крови ВГС (РНК) возможно уже через несколько дней после заражения вирусом. Антитела к ВГС появляются только через 12 нед после заражения, создавая окно серонегативности и потенциальной инфекционности. Поэтому ПЦР является методом выбора для ранней диагностики гепатита С. Серологическое исследование проводят методом парных сывороток.
Профилактика и лечение. Для неспецифической профилактики проводят те же мероприятия, что и при гепатите В. Для лечения применяют интерферон и рибовирин. Специфическая профилактика не разработана.
17.3.3. Вирус гепатита G
Малоизученный вирус, предположительно относящийся к семейству Flaviviridae, роду Hepacivirus. Для его репликации требуется ВГС. Считается, что вирус гепатита G обладает лимфотропностью, вызывает персистирующие формы инфекции.
17.4. Онкогенные вирусы
Впервые этиологическая роль вирусов в развитии опухолей была продемонстрирована П. Раусом в
В настоящее время установлена связь вирусной инфекции и последующей трансформации клетки для вирусов, входящих в сле- дующие семейства:
- РНК-содержащие: семейство Retroviridae, вирус гепатита С;
- ДНК-содержащие: семейства Papillomaviridae, Polyomaviridae, Adenoviridae 12,18,31, Hepadnaviridae, Herpesviridae, Poxviridae.
17.4.1. РНК-содержащие онкогенные вирусы
Семейство Retroviridae включает 7 родов, из которых 5 родов (α - ε retrovirus) составляют группу онковирусов. Онковирусы являются сложноорганизованными вирусами. Вирионы построены из сердцевины (диаметр 70-80 нм), окруженной липопротеиновой оболочкой с шипами. Размеры и формы шипов, а также локализация сердцевины служат основой для подразделения вирусов на 4 морфологических типа (A, B, C, D), а также вирус бычьего лейкоза.
Большинство онкогенных вирусов относится к типу С, который распространен среди рыб, пресмыкающихся, птиц, млекопитающих, включая человека. К типу В относятся вирусы, вызывающие рак молочной железы у мышей, а некоторые онковирусы обезьян принадлежат к типу D.
Капсид онковирусов построен по кубическому типу симметрии. В него заключены нуклеопротеин и фермент ревертаза (обратная
транскриптаза). От наличия этого фермента, осуществляющего обратную (лат. retro - обратный) транскрипцию, произошло название семейства. Ревертаза обладает способностью транскрибировать ДНК на матрице как РНК, так и ДНК, а также нуклеазной активностью.
Геном представлен двумя идентичными позитивными цепями РНК, т.е. является диплоидным. Обе молекулы связаны на 5- конце водородными связями. С 5'-концом каждой цепи связана тРНК клеточного происхождения, которая служит затравкой при транскрипции генома.
Геном состоит из структурных и регуляторных генов. Последовательность структурных генов от 5'-конца к 3'-концу следующая: gag-pol-env.
Gag кодирует синтез группоспецифических антигенов капсида, основными из которых являются белки капсида с р27-р30. Pol кодирует ревертазу. Env кодирует белки шипов оболочки.
Структурные гены с двух сторон ограничены длинными концевыми повторами, получившими название LTR (от англ. long terminal repeat), которые выполняют регуляторную функцию. В их состав входят сайты, связывающие затравку, которой является тРНК, и клеточные полимеразы. Кроме того, имеется ген-трансактиватор, являющийся усилителем транскрипции.
По краям LTR ограничены повторяющимися последовательностями, которые представляют участки узнавания в процессе инте- грации провируса в геном клетки.
Культивирование вирусов. Не культивируются в куриных эмбрионах, культивируются в культурах клеток и в организме чувствительных животных.
Репродукция вирусов. В клетку проникают путем эндоцитоза. После освобождения из вакуоли нуклеокапсида начинает функционировать ревертаза. Этот процесс включает три этапа:
• синтез ДНК на матрице РНК при использовании тРНК в качестве затравки;
• ферментативное расщепление матричной РНК;
• синтез комплементарной нити ДНК на матрице первой нити
ДНК.
Все три этапа осуществляются ревертазой. Благодаря наличию на LTR инвертированных повторов линейная двухцепочечная ДНК замыкается в кольцо и интегрирует в ДНК клетки.
Транскрипция участков хромосомы, соответствующих геному провируса, осуществляется с помощью клеточной РНК-полиме- разы-II. Существуют две большие группы онковирусов: эндогенные и экзогенные.
Эндогенные онковирусы являются составными элементами генома всех органов и тканей организма человека и животных и передаются потомству от одного поколения к другому, т.е. вертикально, подобно обычным клеточным генам. Эндогенные онковирусы не являются онкогенными для представителей того вида животных, в клетках которого они находятся в виде постоянного генетического элемента.
Экзогенные онковирусы распространяются горизонтально от одной особи к другой в форме вирионов.
Механизм онкогенеза, вызываемого онковирусами, связан с функционированием onc-генов, которые имеются в геноме всех клеток человека и животных. В нормальных здоровых тканях этот onc-ген находится в неактивном состоянии, в так называемой форме протоонкогена. В настоящее время известно более 20 onc-генов, функционирование которых приводит к трансформации клетки. Например, src-ген связан с развитием саркомы Рауса у кур, ras-ген опосредует развитие саркомы у крыс.
Включение в геном клетки ДНК-провируса может приводить к активации onc-гена, результатом чего будет развитие трансформации клетки. Кроме того, в процессе исключения ДНК-провируса из хромосомы клетки onc-ген может встроиться в вирусный геном и в составе вирусного генома попасть в новые клетки в активном состоянии.
Последовательность одного и того же протоонкогена может определять трансформирующую активность онковирусов разных животных.
Активация протоонкогена может быть результатом увеличения транскрипционной активности вследствие действия трансактиватора, расположенного на LTR генома провируса, а также результатом перестройки генетического материала как следствие включения провируса в геном клетки.
Помимо онковирусов, активацию протоонкогена могут вызвать мутагены, подвижные генетические элементы.
Онковирусы чувствительны к эфиру, детергентам, формалину, инактивируются при 56 ?С. Устойчивы к УФ-лучам и низким температурам.
К семейству Retroviridae относится примерно 150 видов вирусов, вызывающих развитие опухолей у животных, и только 2 вида вызывают опухоли у человека: HTLV-1, HTLV-2
Вирусы Т-клеточного лейкоза человека
К семейству Retroviridae, роду Deltaretrovirus относятся вирусы, поражающие CD4 Т-лимфоциты, для которых доказана этиологическая роль в развитии опухолевого процесса у людей: HTLV-1, HTLV-2.
Вирус HTLV-1 (human T-lymphotropic virus) является возбудителем Т-клеточного лимфолейкоза взрослых. Вирус был изолирован в
Продукт гена tax действует на терминальные повторы LTR, стимулируя синтез вирусной иРНК, а также образование ИЛ-2 рецепторов на поверхности зараженной клетки.
Продукт гена rex определяет очередность трансляции вирусных
иРНК.
HTLV-2 был изолирован от больного волосисто-клеточным лейкозом. Отличается от HTLV-1 по группоспецифическим антигенам.
Оба вируса передаются половым, трансфузионным и трансплацентарным путями. Заболевания, вызываемые вирусами, характе- ризуются медленным развитием (инкубационный период до 20 лет с момента заражения) и летальным исходом. Патогенез и течение инфекции напоминают таковые ВИЧ-инфекции, так как при обеих инфекциях поражается иммунная система. В крови больных можно обнаружить антитела к вирусам. Заболевания встречаются среди населения определенных географических регионов: в Сахаре, на Антильских островах, островах Юга Японии, а также в России (Восточная Сибирь, Дальний Восток). Эпидемиология Т-клеточного лейкоза изучена недостаточно. Специфическая профилактика и лечение не разработаны.
17.4.2. ДНК-содержащие онкогенные вирусы
Для многих онкогенных ДНК-содержащих вирусов механизмы вызываемого ими онкогенеза схожи. Это связано с тем, что боль- шинство таких вирусов вызывают трансформацию непермиссивных клеток, т.е. тех клеток, в которых они не реплицируются с формированием нового поколения вирионов.
Существенным шагом в осуществлении онкогенеза ДНКсодержащими вирусами является экспрессия так называемых ранних генов. Эти гены кодируют набор белков, называемых Т-антигенами (от англ. tumor - опухоль), большинство из которых локализуется в ядре, но некоторые - в клеточной мембране.
В механизм онкогенеза, вызываемого ДНК-содержащими вирусами, также вовлечены клеточные белки, являющиеся продуктами опухольсупрессирующих генов: p53 и Rb.
Белок p53 является супрессором опухолевого роста. Он представляет собой фосфопротеин, синтез которого усиливает в от- вет на поврежденную ДНК. р53 активирует транскрипцию белка (WAFI), который, в свою очередь, связывает и инактивирует два важных циклина, усиливающих клеточное деление. Результатом деятельности белка p53 является ограничение деления клеток. Если же происходит репарация поврежденной ДНК, уровень р53 падает и клеточное деление восстанавливается.
Rb- (от англ. retinoblastome - ретинобластома) ген кодирует белок, который осуществляет контроль клеточной пролиферации.
Семейство Papillomaviridae включает в себя вирусы папилломы человека, кроликов, коров, собак.
Папилломавирусы являются просто организованными вирусами. Вирион состоит из капсида, построенного по кубическому типу симметрии, диаметром 55 нм, в который заключена двухцепочеч- ная ДНК кольцевой формы. Геном включает 8 ранних Е-генов (от англ. еarly) и 2 поздних гена, детерминирующих синтез капсидных белков.
В искусственных условиях вирусы не культивируются.
Папилломавирусы, в том числе и вирусы папилломы человека (ВПЧ), вызывают продуктивную инфекцию только в дифферен- цированных клетках плоского эпителия. Размножающиеся клетки базального слоя не способны к поддержанию полного репродуктивного цикла.
Насчитывается более 1000 типов ВПЧ, большинство из которых вызывают образование доброкачественных бородавок, папиллом и кондилом в области половых органов, ануса, на слизистых оболочках дыхательных путей, пищеварительного тракта и коже. В клетках этих образований ДНК вируса находится в ядре в виде независимой от генома клетки плазмидной формы кольцевой двухцепочечной ДНК.
В раковых клетках вирусная ДНК интегрирована в клеточную. Канцерогенез связан с экспрессией белков ранних генов Е6 и Е7, которые инактивируют супрессирующие опухолевый рост белки
p53 и Rb.
Определенные типы ВПЧ, в частности типы 2, 5, 8, способны вызвать рак кожи, злокачественные опухоли в полости рта, гортани.
Типы 16 и 18 ВОЗ в
В связи с тем что ВПЧ не культивируются в искусственных условиях, диагностика рака шейки матки и других новообразова- ний, вызванных ВПЧ, осуществляется различными модификациями ПЦР; методом гибридизации in situ, который представляет сочетанный метод молекулярной гибридизации и гистохимического анализа, позволяющий не только определить наличие вирусной ДНК в клетке, но и выявить ее локализацию в клетке.
Семейство Polyomaviridae (от лат. рoly - много, oma - опухоль), а также вакуолизирующий вирус обезьян SV-40 различаются между собой по антигенным свойствам. Полиомавирусы и вирус SV-40 имеют одинаковый механизм онкогенеза. Эти вирусы вызывают продуктивную инфекцию в клетках природных хозяев. При инфицировании новорожденных животных других видов или гетероло- гических культур клеток они стимулируют образование опухолей широкого гистологического спектра.
В трансформированных клетках вирусная ДНК интегрирована в клеточную и экспрессирует только ранние белки. Некоторые из них, в частности Т-антиген, препятствует связыванию белка р53 с клеточной ДНК.
Известны два вируса полиомы человека: ВК, изолированный из мочи больного с трансплантацией почки, и JC.
Вирус JC был выделен из мозга человека, страдающего прогрессирующей многоочаговой лейкоэнцефалопатией - заболеванием, характеризующимся демиелинизацией белого вещества мозга и встречающийся у лиц с пониженным Т-клеточным иммунитетом. Этот вирус способен вызывать образование опухолей у обезьян, новорожденных хомячков.
Вакуолизирующий вирус SV-40 был обнаружен в культуре клеток почки макаки-резуса, в которой он не вызывал ни цитопатиче-
ского эффекта, ни трансформации. При заражении этим вирусом культуры клеток из почки зеленой мартышки он вызывал вакуолизацию и гибель клеток. SV-40 вызывает также развитие опухолей у хомяков, крыс и обезьян-мармозеток.
Вирус SV-40 не обладает онкогенным эффектом в отношении человека. Об этом свидетельствуют наблюдения за десятками миллионов лиц, которым в детстве (в первые годы массовых прививок против полиомиелита) был введен этот вирус, так как им были контаминированы культуры клеток почки макаки-резуса, на которых получали вакцину. Тщательное наблюдение за этим контингентом, а также за добровольцами из США, которые были инфицированы SV-40, показали, что вирус вызывает у человека бессимптомное носительство, стимулирует образование антител, но не вызывает онкогенного эффекта.
Семейство Adenoviridae. Некоторые аденовирусы человека, особенно серотипы 12, 18 и 31, индуцируют саркомы у новорожденных хомячков и трансформируют культуры клеток грызунов. Механизм онкогенеза аналогичен таковому у полиовирусов, за исключением того факта, что в непермиссивных клетках не вся ДНК вируса, а только 10% генома интегрируется в ДНК-клетки, экспрессируя при этом Т-антиген.
Данные о способности аденовирусов вызывать онкогенез у человека отсутствуют.
ВГВ вызывает развитие первичного рака печени. Опухоль развивается у хронических носителей вируса, у которых вирусная ДНК интегрирована в геном гепатоцита. Онкогенез связывают с возможностью интеграции вирусной ДНК в район сильного промотора, в результате чего начинаются синтез и накопление НВхантигена, который обладает способностью связывать супрессор опухолевого роста р53.
Семейство Poxviridae. В состав семейства входят вирусы фибромы-миксомы кролика, вирус Ябы, вызывающий развитие опухолей у обезьян, и вирус контагиозного моллюска, патогенный для человека. Этот вирус вызывает образование эритематозных узелков, локализующихся на коже лица, шеи, век, половых органов. Болезнь передается при прямом и половом контакте.
Семейство Herpesviridae. Различные представители семейства вызывают лимфомы у обезьян, карциному почки лягушки (болезнь Люке), нейролимфому у цыплят (болезнь Марека).
Онкогенез у человека связан с вирусами герпеса человека типов 6 и 8 (ВГЧ-6 и ВГЧ-8) и вирусом Эпштейна-Барр (ВЭБ).
С ВЭБ связывают лимфому Беркитта - опухоль верхней челюсти, встречающаяся у детей и юношей в странах Африки, и кар- циному носоглотки, которая в основном поражает мужчин в некоторых районах Китая. В клетках этих опухолей обнаруживаются множественные копии интегрированного генома вируса. В ядрах пораженных клеток выявляется ядерный антиген ВЭБ. В крови больных вначале появляются антитела к капсидному антигену, а позже - к мембранному и ядерному антигенам ВЭБ.
ВГЧ-6 связывают с развитием non-Hodgkin лимфомы, а ВГЧ-8 - с саркомой Капоши.
17.5. Медленные вирусные инфекции и прионные болезни
Медленные вирусные инфекции характеризуются особыми признаками:
• необычно длительным инкубационным периодом (месяцы, годы);
• своеобразным поражением органов и тканей, преимущественно ЦНС;
• медленным неуклонным прогрессированием заболевания;
• неизбежным летальным исходом.
Некоторые возбудители острых вирусных инфекций могут вызывать также и медленные вирусные инфекции. Например, ви- рус кори иногда вызывает ПСПЭ, а вирус краснухи - прогрессирующие врожденную краснуху и краснушный панэнцефалит (табл. 17.4).
Типичную медленную вирусную инфекцию животных вызывает вирус висна/мэди, относящийся к ретровирусам. Он является возбудителем медленной вирусной инфекции и прогрессирующей пневмонии овец. Разрушается белое вещество головного мозга, развиваются параличи (висна - чахнущий); происходит хроническое воспаление легких и селезенки, поэтому название болезни «мэди», что означает одышка.
Таблица 17.4. Причины развития прионных болезней человека
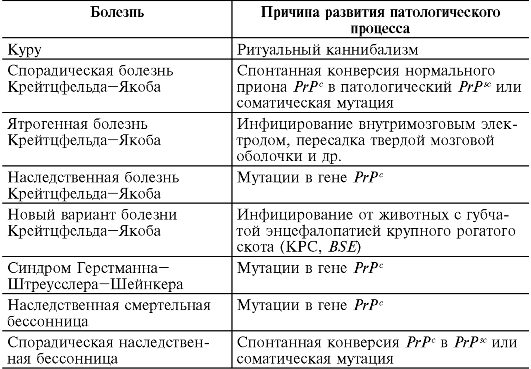
Сходные по признакам медленных вирусных инфекций заболевания вызывают прионы - возбудители прионных инфекций. Прионные болезни - группа прогрессирующих нарушений ЦНС человека и животных. У людей нарушается функция ЦНС, наступают изменения личности, расстройства движений. Симптомы болезни обычно продолжаются от нескольких месяцев до нескольких лет, заканчиваясь летально. Ранее прионные инфекции рассма- тривались вместе с так называемыми возбудителями медленных вирусных инфекций.
Прионами заражаются per os. Некоторые агенты, вызывающие прионные болезни, накапливаются сначала в лимфоидных тка- нях. Прионы, попадая в мозг, накапливаются в нем в больших количествах, вызывая амилоидоз (внеклеточный диспротеиноз, характеризующийся отложением амилоида с развитием атрофии и склероза ткани) и астроцитоз (разрастание астроцитарной нейроглии, гиперпродукция глиальных волокон). Образуются фибриллы, агрегаты белка или амилоида и губкообразные изменения мозга (трансмиссивные губкообразные энцефалопатии). В резуль-
тате изменяется поведение, нарушается координация движений, развивается истощение со смертельным исходом. Иммунитет не формируется. Прионные болезни относятся к конформационным болезням, которые развиваются в результате неправильного сворачивания (нарушения правильной конформации) клеточного белка, необходимого для нормального функционирования организма. Пути передачи прионов разнообразны:
• алиментарный путь - инфицированные продукты животного происхождения, пищевые добавки из сырых бычьих органов и др.;
• передача при гемотрансфузии, введении препаратов животного происхождения, пересадке органов и тканей, использовании инфицированных хирургических и стоматологических инструментов;
• передача через иммунобиологические препараты (известно заражение PrP sc 1500 овец мозговой формолвакциной от больных овец).
Патологические прионы, попав в кишечник, транспортируются в кровь и лимфу. После периферической репликации в селезен- ке, аппендиксе, миндалинах и других лимфоидных тканях, они переносятся в мозг через периферические нервы (нейроинвазия). Возможно прямое проникновение прионов в мозг через гематоэнцефалический барьер. Ранее считалось, что ЦНС - единственная ткань, в которой накапливаются патологические прионы, однако появились исследования, изменившие данную гипотезу. Оказалось, что накопление PrP sc в селезенке связано с увеличением и функционированием фолликулярных дендритных клеток.
Свойства прионов. PrP c (cellular prion protein) - клеточная нормальная изоформа прионного белка с молекулярной массой 33- 35 кД, детерминируется геном прионного белка (прионный ген - PrNP находится на 20-й хромосоме человека). Нормальный PrP c появляется на поверхности клетки (заякорен в мембрану глико- протеином молекулы), чувствителен к протеазе. Он регулирует передачу нервных импульсов, суточные циклы, процессы окисления, участвует в метаболизме меди в ЦНС и в регуляции деления стволовых клеток костного мозга. Кроме этого PrP c обнаружен в селезенке, лимфатических узлах, коже ЖКТ и фолликулярных дендритных клетках.
PrP sc (scrapie prion protein - от названия прионной болезни овец: скрепи - scrapie) и др., например PrP cjd (при болезни Крейтц-
фельда-Якоба), - патологические измененные посттрансляционными модификациями изоформы прионного белка. Такие прионы устойчивы к протеолизу (протеаза К вызывает ограниченный протеолиз только до устойчивого к протеазе фрагмента с молекулярной массой 27-30 кД), излучениям, высокой температуре, формальдегиду, глутаральдегиду, β-пропиолактону; не вызывают воспаления и иммунного ответа. Отличаются способностью к агрегации в ами- лоидные фибриллы, гидрофобностью и вторичной структурой в результате повышенного содержания β-складочных структур. PrPsc накапливается в плазматических везикулах клетки.
Пролиферация патологических прионов. Превращение PrPc в измененные формы (PrPsc и др.) происходит при нарушении кинетически контролируемого равновесия между ними. Процесс усиливается при возрастании количества патологического (PrP) или экзогенного приона. PrP c является нормальным белком, заякоренным в мембрану клетки. PrP sc - глобулярный гидрофобный белок, образующий агрегаты с собой и с PrP c на поверхности клетки: в результате PrP c преобразуется в PrP sc и далее цикл продолжается. Патологическая форма PrP sc накапливается в нейронах, придавая клетке губкообразный вид.
Куру - прионная болезнь, ранее распространенная среди папуасов (в переводе означает дрожание или дрожь) в восточной части острова Новая Гвинея. Инфекционные свойства болезни доказал К. Гайдушек. Возбудитель передается пищевым путем в результате ритуального каннибализма - поедания недостаточно термически обработанного, инфицированного прионами мозга погибших сородичей. В результате поражения ЦНС нарушаются движения, походка, появляются озноб, эйфория («хохочущая смерть»). Инкубационный период длится 5-30 лет. Через год больной погибает.
Болезнь Крейтцфельда-Якоба (БКЯ) - прионная болезнь, протекающая в виде деменции, зрительных и мозжечковых нарушений и двигательных расстройств со смертельным исходом через 4-5 мес болезни при классическом варианте БКЯ и через 13-14 мес при новом варианте БКЯ. Инкубационный период может достигать 20 лет. Возможны различные пути инфицирования и причины развития болезни:
• при употреблении недостаточно термически обработанных продуктов животного происхождения, например мяса, мозга коров, больных губкообразной энцефалопатией крупного рогатого скота;
• при трансплантации тканей, например роговицы глаза, переливании крови, применении гормонов и других биологических активных веществ животного происхождения, использовании кетгута, контаминированных или недостаточно простерилизованных хирургических инструментов, прозекторских манипуляциях;
• при гиперпродукции PrP и других состояниях, стимулирующих процесс преобразования PrP c в PrP sc.
Заболевание может также развиваться в результате мутации или вставки в области прионного гена. Распространен семейный характер болезни в результате генетической предрасположенности к БКЯ. При новом варианте БКЯ нарушения развиваются в более молодом возрасте (средний возраст 28 лет), в отличие от классического варианта (средний возраст 68 лет). При новом варианте БКЯ анормальный прионный протеин накапливается не только в ЦНС, но и в лимфоретикулярных тканях, в том числе в гландах.
Синдром Герстманна-Штреусслера-Шейнкера - наследственное прионное заболевание, протекающее с деменцией, гипотонией, нарушением глотания, дизартрией. Нередко носит семейный характер. Инкубационный период от 5 до 30 лет. Болезнь возникает в 50-60 лет, ее продолжительность колеблется от 5 до 13 лет.
Наследственная смертельная бессонница - аутосомнодоминантное заболевание с прогрессирующей бессонницей, симпатической гиперреактивностью (гипертензия, гипертермия, гипергидроз, тахикардия), тремором, атаксией, миоклониями, галлюцинациями. Резко нарушается сон. Смерть происходит при прогрессировании сердечно-сосудистой недостаточности.
Скрепи (от англ. scrape - скрести) - прионная болезнь овец и коз (чесотка), протекающая с поражением ЦНС, прогрессирующим нарушением движений, сильным кожным зудом (чесоткой) и заканчивающаяся гибелью животного.
Губкообразная энцефалопатия крупного рогатого скота - прионная болезнь крупного рогатого скота, характеризующаяся поражением ЦНС, нарушением координации движений и неизбежной гибелью животного. Впервые эпидемия болезни вспыхнула в Великобритании. Она была связана с кормлением животных мясокост- ной мукой, содержащей патологические прионы. Инкубационный период колеблется от 1,5 до 15 лет. Наиболее инфицированы головной, спинной мозг и глазные яблоки животных.
Лабораторная диагностика. При диагностике отмечают губкообразные изменения мозга, астроцитоз (глиоз), отсутствие инфильтратов воспаления. Мозг окрашивают на амилоид. В цереброспинальной жидкости выявляют белковые маркеры прионных мозговых нарушений (с помощью ИФА, иммуноблоттинга с моноклональными антителами). Проводят генетический анализ прионного гена, ПЦР.
Профилактика. Для обезвреживания инструментов и объектов окружающей среды рекомендуются автоклавирование (при 134 ?С 18 мин; при 121 ?С 1 ч), сжигание, дополнительная обработка отбеливателем и однонормальным раствором NaOH на 1 ч. Для неспецифической профилактики введены ограничения на исполь- зование лекарственных препаратов животного происхождения и запрещено производство гормонов гипофиза животного происхождения. Ограничивают трансплантацию твердой мозговой оболочки. При работе с биологическими жидкостями больных используют резиновые перчатки.
Задания для самоподготовки (самоконтроля) к главе 17
A. Отметьте свойства, характерные для вирусов герпеса:
1. Сложноорганизованные вирусы.
2. Имеют плюс-РНК.
3. Капсид построен по спиральному типу симметрии.
4. Вызывают латентную инфекцию. Б. Вирусы оспы образуют:
1. Цитоплазматические включения.
2. Внутриядерные включения.
3. Бляшки на хорионаллантоисной оболочке куриного эмбриона.
4. Вызывают образование симпласта в культуре клеток.
B. Вирус Эпштейна-Барр вызывает:
1. Саркому Капоши.
2. Инфекционный мононукулеоз.
3. Опоясывающий лишай.
4. Цитомегалию.
Г. Арбовирусами являются отдельные представители семейств:
1. Rhabdoviridae.
2. Reoviridae.
3. Flaviviridae.
4. Bunyaviridae.
Д. К робовирусам относятся:
1. Вирус эпидемического паротита.
2. Вирус лимфоцитарного хориоменингита.
3. Вирус клещевого энцефалита.
4. Вирус желтой лихорадки.
Е. Маркерами острого гепатита В являются:
1. Анти-HBs-антитела.
2. IgM анти-НБс-антитела.
3. IgG анти-НВс-антитела.
4. НБе-антиген.
Ж. В культуре клеток размножаются с образованием цитопатического действия следующие представители семейства Picornaviridae:
1. Вирусы полиомиелита.
2. Вирусы Коксаки А.
3. Вирусы Коксаки В.
4. Вирусы ECHO.
З. Среди вирусов, передающихся фекально-оральным путем, отметьте те, которые вызывают системную инфекцию:
1. Вирус полиомиелита.
2. Ротавирусы.
3. Вирусы Коксаки А.
4. Вирусы ECHO.
И. Отметьте вирусы, которые передаются воздушно-капельным путем:
1. Вирус кори.
2. Вирус гепатита А.
3. Вирусы Коксаки В.
4. Вирус краснухи.
К. Отметьте вирусы, заражение которыми опасно для беременных в отношении возникновения уродства у плода:
1. Вирус краснухи.
2. Вирус кори.
3. Цитомегаловирус.
4. Вирус ветряной оспы.
Л. Укажите ферменты, входящие в состав вириона ВИЧ:
1. Ревертаза.
2. Протеаза.
3. Нейраминидаза.
4. Интеграза.
М. Назовите клетки, которые представляют резервуар ВИЧ в организме инфицированного этим вирусом:
1. Т-киллеры.
2. Дендритные клетки.
3. В-лимфоциты.
4. Макрофаги.
Н. Отметьте группы препаратов, которые используются для лечения ВИЧ-инфицированных лиц:
1. Нуклеозидные ингибиторы ревертазы.
2. Ненуклеозидные ингибиторы ревертазы.
3. Ингибиторы тимидинкиназы.
4. Ингибиторы интегразы.
О. Прионы являются возбудителями:
1. Медленной вирусной инфекции.
2. Конформационных болезней.
3. Вироидных инфекций.
4. Микозов.
П. Отметьте типоспецифический антиген вируса гриппа:
1. Нуклеокапсидный.
2. Гемагглютинин.
3. Нейраминидаза.
4. Главный неструктурный белок.
Р. Назовите антигены вируса гриппа, с которыми связано изменение подтипов в результате дрейфа и шифта, приводящее к возникновению новых эпидемий:
1. М-протеин.
2. Гемагглютинин (Н).
3. Нейраминидаза (N).
4. Нуклеокапсид.
С. Отметьте вирусы, которые вызывают развитие опухолей у человека:
1. Вирус гепатита В.
2. Вирусы папилломы человека.
3. Вирус простого герпеса II типа.
4. HTLV 1, 2.
Т. Обследование беременной на 3 мес беременности выявило у нее антитела к ВИЧ. Назовите вероятность рождения ВИЧинфицированного ребенка и срок точного установления наличия ВИЧ-инфекции у ребенка.
У. Вирусы папилломы человека могут вызывать образование как злокачественных, так и доброкачественных опухолей. Назовите локализацию вирусного генома в доброкачественных образованиях. Объясните механизм канцерогенеза, вызываемого этими вирусами.
Ф. Что такое арбовирусы?
1. Вирусы, образующие отдельное семейство.
2. Вирусы, передающиеся кровососущими членистоногими на-
секомыми.
3. Относятся к робовирусам.
4. Экологическая группа вирусов. Х. К арбовирусам относятся.
1. Вирус клещевого энцефалита.
2. Вирус краснухи.
3. Вирус карельской лихорадки.
4. Вирус хантаан.
Ц. К особоопасным карантинным арбовирусным инфекциям относится.
1. Лихорадка Денге.
2. Лихорадка долины Рифт-Валли.
3. Лихорадка Скалистых гор.
4. Желтая лихорадка.
Ч. К хантанвирусным инфекциям относится.
1. Геморрагическая лихорадка Крым-Конго.
2. Лихорадка долины Рифт-Валли.
3. Японский энцефалит.
4. Геморрагическая лихорадка с почечным синдромом. Ш. Вирус краснухи вызывает.
1. Панэнцефалит.
2. Острую респираторную инфекцию.
3. Врожденную патологию.
4. Острую кишечную инфекцию.
Щ. Женщина со сроком беременности 12 нед, находясь в гостях около 2 нед назад, имела контакт с ребенком, больным краснухой. Гинеколог направил пациентку на исследование крови с целью обнаружения специфических антител к вирусу краснухи и их авидности. Поясните действия врача.