Медицинская микробиология, вирусология и иммунология: том 2 : учебник / Под ред. В.В. Зверева, М.Н. Бойченко 2010.
|
|
|
|
ГЛАВА 16 ЧАСТНАЯ БАКТЕРИОЛОГИЯ
16.1. Кокки
Кокки (coccus - зернышко, ягода) - микроорганизмы со сферической формой клетки. Сферическая форма определяет наименьшую площадь поверхности, что обеспечивает коккам большую устойчивость к факторам окружающей среды. Кокки широко распространены и являются частыми возбудителями гнойновоспалительных заболеваний, поэтому их называют гноеродными кокками. Кокки вызывают сепсис, являются причиной госпитальных и оппортунистических инфекций.
Таксономия кокков разнообразна. Они классифицируются на грамположительных и грамотрицательных аэробов (факульта- тивных анаэробов) и анаэробов. Грамположительные аэробные кокки включают роды: Staphylococcus, Micrococcus, Streptococcus, Enterococcus, Rhodococcus, Planococcus, Deinococcus и др., грамположительные анаэробные кокки - Coprococcus, Peptococcus, Peptosteptococcus, Ruminococcus, Sarcina и др. грамотрицательные аэробные кокки - Neisseria (менингококки, гонококки), Moraxella, Morococcus и др., грамотрицательные анаэробные кокки - Acidaminococcus, Megαsphαеra, Veillonella и др.
16.1.1. Аэробные грамположительные кокки
16.1.1.1. Стафилококки (род Staphylococcus)
Открыты Пастером и Огстоном в
Классификация. Род Staphylococcus включает более 32 видов, из них клинически значимых для человека около 8 видов: S. aureus, S. epidermidis, S. haemolyticus, S. saprophyticus, S. intermedius и др.
Видовая классификация построена на основании изучения фенотипических свойств (около 50 тестов: биохимические, на пато- генность, культуральные свойства) и генотипических (фрагменты хромосомного ограничения, риботипы) признаков. Патогенетически и клинически значима классификация по признакам: продукция плазмокоагулазы - коагулазоположительные стафилококки (КПС) (S. aureus, S. intermedius и др.) и коагулазоотрицательные стафилококки (КОС) (S. epidermidis, S. saprophyticus и др.). КПС рассматриваются как наиболее опасные и частые возбудители болезней, хотя тяжесть течения болезни зависит как от патогенно- сти возбудителя, так и от уровня защитных механизмов организма человека; устойчивость к новобиоцину (S. saprophyticus), устойчивость к полимиксину (S. aureus, S. epidermidis). Существует внутривидовая дифференциация S. aureus на фагогруппы и фаговары, что используется в реакции фаготипирования для выяснения источника заражения и путей передачи инфекции.
Морфология. Стафилококки - грамположительные кокки, которым в чистой культуре свойственно скопление в виде гроздьев винограда (характерно деление в разных плоскостях). Неподвижные, не образуют спор, могут образовывать микрокапсулу.
Культуральные и биохимические свойства. Стафилококки растут на простых питательных средах (мясопептонный агар - МПА, мясопептонный бульон - МПБ), однако являются галофильными: хорошо размножаются при высоких концентрациях NaCl (10-15%), что используется при изготовлении элективной среды - желточносолевого агара (ЖСА). Стафилококки чувствительны к анилиновым красителям (кристаллическому фиолетовому, бриллиантовому зеленому), йоду, что используется в местном лечении стафилококковых пиодермий (антисептики), а также эти красители входят в состав элективных сред для выделения энтеробактерий (среды Эндо, Плоскирева) для подавления роста грамположительных кокков.
Стафилококки продуцируют каталазу, что защищает их от губительного действия производных кислорода. Синтезируют ка- ротиноидные пигменты (определяют золотистый, белый и другие цвета колоний), которые также защищают от оксидантов. Антиоксидантная активность стафилококков - один из механизмов их защиты в условиях пиогенных инфекций. Стафилококки часто характеризуются множественной устойчивостью к антибиоти- кам: β-лактамам, эритромицину, тетрациклинам, хлорамфениколу
и др. Устойчивость к антибиотикам контролируется R-плазмидами (синтез β-лактамаз) или хромосомными мутациями (метициллинорезистентные стафилококки - MRS-штаммы).
Антигены. Антигенными свойствами обладают структуры клеточной стенки: тейхоевые кислоты, пептидогликан и белок А, расположенный снаружи пептидогликана. Капсульный антиген находится в микрокапсуле. Антигены определяют видовую и типовую специфичность стафилококков.
Факторы патогенности. Основные группы факторов патогенности стафилококков: адгезины, микрокапсула, белок А, медиаторы межмикробного взаимодействия, секретируемые вещества. Адгезины обеспечивают способность стафилококков прикрепляться к различным клеткам и веществам организма. Тейхоевые кислоты ответственны за адгезию к эпителиальным клеткам. У S. aureus обнаружены белки-адгезины, которые взаимодействуют с различными протеинами: лектинами, фибронектином, муцином и др. Из S. epidermidis выделен специфический полисахарид, обеспечивающий прикрепление стафилококка к протезам, ортопедическим стержням и другим трансплантатам, что создает условия для раз- вития инфекции. Микрокапсула полисахаридной природы подавляет фагоцитоз и способствует адгезии.
Белок А (протеин А) - компонент клеточной стенки стафилококков - связывает Fс-фрагменты антител, блокируя их опсони- ческую активность. Медиаторы межмикробного взаимодействия - факторы колонизации патогенным стафилококком определенного биотопа: бактериоцины (стафилококкцины) подавляют рост непатогенных стафилококков, заселяющих биотоп в норме; бактериолизины (лизостафин, лизоцим и др.) разрушают пептидогликан клеточной стенки грамположительных бактерий; феромоны - сигнальные белковые молекулы, регулирующие плотность популяции (кворум-сенсинг), формирование и функцию адгезинов и другие свойства; β-лактамаза защищает стафилококки от антибио- тиков. Стафилококки секретируют в окружающие ткани разнообразные группы факторов патогенности: внеклеточные полисахариды, инактиваторы защитных механизмов хозяина, экзотоксины, ферменты патогенности. Внеклеточные полисахариды образуют слизистый слой на твердых поверхностях (биопленку), что способствует колонизации стафилококка на медицинском оборудовании, в биотопах человека, защищает от фагоцитоза. Обнаружена
большая группа секретируемых стафилококком факторов, инактивирующих защиту хозяина. Благодаря этим факторам стафило- кокки способны длительно выживать (персистировать) в клетках и тканях организма. Антилизоцимная активность (АЛА) - способность инактивировать лизоцим клеток и тканей. Антиинтерфероновая активность (АИА) - способность подавлять антибактериальное действие интерферона. Антикомплементарная активность (АКА) - специфическая инактивация системы комплемента. Ан- тикарнозиновая активность (АКрА) - способность инактивировать карнозин - регулятор регенерационных и иммунных реакций. Антилактоферриновая активность (АЛфА) - инактивация лактоферрина - регулятора метаболизма железа в организме. Антигемоглобиновая активность (АНbА) - инактивация кислородсвязывающей функции гемоглобина.
Особое место в ряду факторов патогенности стафилококков занимают экзотоксины. Гемолизины α, β, δ, γ повреждают мембраны клеток (мембранотоксины). Они образуют каналы в цитоплаз- матической мембране эритроцитов, лейкоцитов и других клеток, нарушая их осмотическое давление и приводя к лизису. Лейкоцидин избирательно действует на лейкоциты, разрушая их. Энтеротоксины (А-F) относятся к гистотоксинам, вызывают пищевую интоксикацию. Энтеротоксины характеризуются высокой термостабильностью (выдерживают кипячение) и устойчивостью к про- теолитическим ферментам. Энтеротоксины являются суперантигенами - вызывают поликлональную стимуляцию Т-лимфоцитов с последующей гиперсекрецией цитокинов и вторичной интоксикацией. Экзотоксин, вызывающий синдром токсического шока (СТШ), является суперантигеном, что определяет механизм его токсического действия. Его продукция связана с наличием профага (лизогенная конверсия). Эксфолиативный токсин (А и В) разрушает межклеточные контакты в эпидермисе, что ведет к отслоению поверхностных структур эпидермиса (эксфолиации) и образованию изъязвляющихся пузырей - синдрому «ошпаренной кожи». Чаще встречается у новорожденных и детей младшего возраста.
Стафилококки обладают большим арсеналом экзоферментов защиты и агрессии. Плазмокоагулаза вызывает свертывание плазмы крови. Сгусток фибрина, покрывая бактериальную клетку (псевдокапсула), защищает ее от фагоцитоза и бактерицидности сыворотки. Каталаза защищает стафилококк от действия кисло-
родзависимых бактерицидных механизмов фагоцитоза. Лецитовителлаза (липаза) разрушает оболочки клеток, жировые пробки в устье волосяных фолликулов, подавляет фагоцитоз. Гиалурони- даза разрушает гиалуроновую кислоту («цемент» соединительной ткани), способствует распространению возбудителя, расширению зоны поражения (фактор проницаемости). Фибринолизин (стафилокиназа) разрушает фибриновые сгустки с образованием инфицированных микротромбов и способствует генерализации инфекции. ДНКаза расщепляет ДНК, понижает вязкость окружающей среды, разжижает гной. Мурамидаза (лизоцим) растворяет клеточные стенки (пептидогликан) бактерий, являясь одним из факторов антагонизма стафилококков в микробиоценозе; подавляет фагоцитоз. Нейраминидаза расщепляет сиаловые кислоты (нейраминовую кислоту и др.) в слизи, оболочках клеток, способствуя проникновению в клетки и распространению в межклеточном пространстве.
S. saprophyticus обладает ферментом уреазой и способен под влиянием мочевины образовывать капсулу. Он является одним из основных возбудителем инфекции мочевого тракта (цистита, пиелонефрита).
Экология стафилококков. Стафилококки широко распространены в природе, обнаруживаются на коже и слизистых оболочках человека, паразитируют у животных. На коже человека доминирующей микрофлорой являются стафилококки, особенно S. epidermidis. Колонизируют слизистую оболочку носа, зева, ротовой полости и других органов, являясь представителями нормальной микрофлоры человека. Устойчивы во внешней среде: хорошо переносят высушивание, длительное время сохраняются в пыли. Техногенные загрязнения внешней среды (сероводородсодержащий газ и др.) повышают патогенность стафилококков, в частности его персистентную активность.
Эпидемиология стафилококковых инфекций. В современной медицинской практике большую опасность представляют экзогенные стафилококковые инфекции для больных в стационарах - внутри- больничные (госпитальные) инфекции. Основными возбудителями являются S. aureus, S. epidermidis. Источники заражения - здоровые носители госпитальных штаммов, а также больные со стертыми формами стафилококковой инфекции.
Наибольшую эпидемическую опасность представляет медицинский персонал лечебно-профилактических учреждений - постоян-
ные (резидентные) носители госпитальных штаммов. Механизмы, пути и факторы передачи стафилококка разнообразны: аэрогенный (воздушно-капельный, воздушно-пылевой), фекально-оральный (пищевой), артифициальный (через нестерильные медицинские инструменты) и др. Восприимчивость к стафилококкам высокая, так как поражаются больные с иммунодефицитом, вызванным разными причинами (операция, травма, сахарный диабет и т.д.).
Кроме экзогенной, не меньшую опасность представляет эндогенная, оппортунистическая (от англ. оpportunity - удобный случай) инфекция, которая вызывается стафилококками - предста- вителями собственной нормальной микрофлоры. При снижении иммунного статуса организма аутоштаммы повышают свою вирулентность и вызывают патологический процесс как в исходном биотопе, так и в других биотопах организма за счет миграции и транслокации.
Патогенез стафилококковых инфекций. Стафилококки поражают любые органы и системы организма, вызывают сепсис, септикопиемию, токсинемию.
Иммунитет по механизму клеточный и гуморальный, по напря- женности - нестойкий. Узкоспецифический (против определенных штаммов). По направленности антитоксический, антиферментный, антибактериальный. Возможен переход острой инфекции в хроническую с развитием аллергии.
Микробиологическая диагностика. Ведущим методом является бактериологический. Взятие исследуемого материала зависит от предполагаемой локализации с учетом патогенеза и клинической картины болезни. Главное значение в диагностике имеют идентификация возбудителя, его дифференциация от нормальной, сопутствующей стафилококковой микрофлоры. Экспресс-диагностика направлена на обнаружение серологическими реакциями антигенов ферментов патогенности и токсинов стафилококка, а также определения tox-гена в ПЦР. Бактериологический метод включает, кроме видовой идентификации стафилококков по ферментативным свойствам (стафилококковые тесты), определение у чистой культуры факторов патогенности, фаговара (выявление госпитальных штаммов, источника и путей передачи инфекции), антибиотикограммы.
Важное значение имеет выявление секретируемых факторов персистенции (АЛА, АИА, АКрА и др.) для диагностики резидентного носительства и прогнозирования осложнений, хронизации процесса.
Серологический метод, как правило, применяется в диагностике затяжных, хронических форм заболевания. Информативными показателями является обнаружение антител к факторам патогенности стафилококков: токсинам, ферментам, тейхоевой кислоте и др.
Профилактика и лечение. Антибиотики следует назначать по результатам антибиотикограммы выделенного возбудителя. В связи с внутриклеточным паразитированием стафилококка при выборе антибиотика для лечения или средства для санации бактерионосителя следует оценить способность препарата в субингибиторной концентрации подавлять факторы персистенции возбудителя, та- ким образом изгоняя его из клеток хозяина и повышая эффект терапии, профилактики осложнений. В связи с широким распространением среди стафилококков множественной антибиотикорезистентности следует назначать комбинированные препараты, содержащие блокаторы β-лактамазы. Для этого при хронических инфекциях применяют в лечебных целях убитую корпускулярную вакцину. Для профилактики госпитальной инфекции необходимо соблюдать строгий противоэпидемический режим: выполнение правил асептики, антисептики, дезинфекции, стерилизации, своевременное выявление больных стафилококковой инфекцией, их изоляция в специальное отделение или палату, плановое обследо- вание медицинского персонала на стафилококковое носительство. Профилактика стафилококковой инфекции у новорожденных - актуальная проблема. Проводят иммунизацию рожениц стафилококковым анатоксином или стафилококковым иммуноглобулином (экстренная профилактика), определяют показатель микробной обсемененности и наличие стафилококка в молоке родильниц, на пеленках (пеленочный тест).
16.1.1.2. Стрептококки (род Streptococcus)
Открыты Билротом в
Таксономия и классификация. Род Streptococcus включает более 50 видов. Внутри рода на основании произвольно выбранных критериев (пиогенность для животных и человека, особенности метаболизма, экологические признаки) дифференцированы 4 группы видов стрептококков: пиогенные, оральные, анаэробные и другие стрептококки. Клинически значимые для человека виды: S. pyogenes, S. agalactiae, S. mitis, S. pneumoniae, S. mutans, Peptostreptococcus anaerobius и др. Видовая классификация построе-
на на основании изучения фенотипических свойств (около 30 тестов: биохимические, на патогенность, культуральные свойства). Для определенных видов стрептококков характерны различные антигены полисахаридной природы, связанные с серологическими группами (Lancefield, 1933), которые определяют для точной идентификации стрептококков. Известно 20 серологических групп: А, В, С, G и др. Штаммы S. pyogenes относятся к серогруппе А, S. agalactiae - к серогруппе В. Серогруппа С включает два вида: S. dysgalactiae и S. equi и т.д. Внутри серогрупп стрептококки разделяют на серовары. Так, внутри серогруппы А по М-белку определено до 80 сероваров. Имеется определенная связь между принадлежностью стрептококков к серогруппе, серовару и спецификой их патогенного действия: стрептококки серогруппы А вызывают скарлатину, рожу, ревматизм, нефрит, серовары ? 1, 3, 5, 6, 18 чаще вызывают ревматизм, а ? 12, 17, 19, 24, 49 - гломерулонефрит.
Морфология. Стрептококки - грамположительные кокки круглой или овальной формы, располагаются парами или цепочками. Длинные цепочки могут образовываться при росте микроба в жидкой питательной среде. Неподвижны, спор не образуют. Некоторые виды (S. pneumoniae) имеют капсулу полисахаридной природы.
Культуральные и биохимические свойства. Факультативные анаэробы, каталазоотрицательные. Растут на питательных средах с добавлением крови, сыворотки, углеводов. При росте на плотной среде образуют мелкие сероватые или бесцветные колонии. По характеру роста на кровяном агаре различают α-гемолитические стрептококки (частичный гемолиз и позеленение среды вокруг колоний), β-гемолитические стрептококки (полная зона гемолиза) и γ-гемолитические (не изменяющие кровяной агар).
Антигенная структура. Полисахариды клеточной стенки (С-антигены) определяют групповую специфичность. Белки клеточной стенки (М-, Р-, Т-антигены) дифференцируют стрептококки внутри серогрупп на серовары. Белок М у S. pyogenes (серогруппа А) является суперантигеном. S. pneumoniae дифференцируется на серовары по полисахаридам капсулы.
Факторы патогенности. Основные группы факторов патогенности стрептококков: белок М, капсула, липотейхоевая кислота, пептидогликан, секретируемые факторы персистенции, экзотоксины, ферменты. М-белок - один из важнейших факторов патогенности S. pyogenes (группа А). М-белок по структуре напоминает пили
(ворсинки) грамотрицательных бактерий, участвует в процессе адгезии стрептококков к эпителию слизистых оболочек. М-белок в комплексе с другими поверхностными белками клеточной стенки стрептококка блокирует комплемент, иммуноглобулины, связывает фибриноген и фибрин, обладает антифагоцитарным свойством. Капсула у стрептококков групп А и С образована гиалуроновой кислотой, а у пневмококков - полисахаридом. Капсула обладает антифагоцитарным свойством, участвует в процессах колонизации и персистенции (экранизация пептидогликана). Липотейхоевая кислота в комплексе с М-белком способствует адгезии стрептококков. Пептидогликан стрептококков по свойствам напоминает эндотоксин грамотрицательных бактерий: пирогенная активность, дермонекротическое действие, кардит, токсическое действие на соединительную ткань и печень.
Среди медиаторов межмикробного взаимодействия важнейшими являются бактериоцины стрептококков - стрептоцины, которые участвуют в экологии стрептококков, являясь факторами колонизации патогеном определенного биотопа. Так, на слизистой оболочке миндалин больных хроническим тонзиллитом стрептоциногенные штаммы S. pyogenes встречались в 1,7-1,9 раза чаще, чем у здоровых бактерионосителей. Секретируемые факторы персистенции: АЛА и АКА стрептококков обнаружена у возбудителей хронических форм стрептококковой инфекции, эти факторы способствуют внутриклеточному паразитированию стрептококков. Стрептококки группы А (S. pyogenes) продуцируют большую группу экзотоксинов: эритрогенин, стрептолизины, лейкоцидин, цитотоксины. Эритрогенин (эритрогенный, пирогенный, скарлатинозный токсин) обладает нейротоксическим (гипоталамус), некротическим (эндотелий, миокард, печень) свойствами. Является суперантигеном, индуцируя массивный выход цитокинов, вызывает лихорадку, синдром токсического шока. Стрептолизин S (stable) устойчив к кислороду, лизирует эритроциты. Повреждает мембраны клеток почек, сердца, легких за счет связывания с фосфолипидами клеточных мембран. Ревматоидный фактор.
Стрептолизин О (oxygen-sensitive) чувствителен к кислороду. Кроме гемолитической активности, обладает кардиотропностью, иммуногенностью. Нарушает процессы окислительного фосфорилирования в митохондриях. Лейкоцидин лизирует лейкоциты, подавляя фагоцитоз. Цитотоксины - пептиды, повреждающие клет-
ки. Нефритогенные штаммы (S. pyogenes, серогруппа А, серовар 12) выделяют цитотоксин, повреждающий ткань почек.
Стрептококки обладают арсеналом ферментов патогенности, к которым относятся гиалуронидаза, ДНКаза, мурамидаза (лизо- цим), фибринолизин (стрептокиназа), никотинамидадениндинуклеатидаза (НАДаза). Гиалуронидаза - фактор инвазии, способствует распространению стрептококков по соединительной ткани. ДНКаза (стрептодорназа) играет роль в инвазивности стрептококка. Лизоцим стрептококков рассматривается как антифагоцитарный фактор, его продукция коррелирует с гемолитической активностью и капсулообразованием у пневмококков. Стрептокиназа активирует растворение фибриновых волокон. Смесь стрептокиназы и стрептодорназы используется в клинике для рассасывания тромбов. НАДаза обладает кардиотоксическим и лейкотоксическим свойством.
Экология стрептококков. Стрептококки широко распространены в природе, обнаруживаются на коже и слизистых оболочках человека и животных. S. pyogenes (серогруппа А) паразитирует на слизистой оболочке переднего отдела носа, носоглотки, миндалин, на коже. S. agalactiae (серогруппа В) колонизирует слизистую оболочку влагалища, S. pneumoniae обнаруживается на слизистой оболочке верхних отделов респираторного тракта. Известно около 20 видов стрептококков, обитающих на слизистой оболочке ротовой полости (на эпителии щек, в десневых карманах, на поверхности зубов): S. mitis, S. mutans, S. oralis и др. Во внешней среде стрептококки сохраняются в течение нескольких дней.
Эпидемиология стрептококковых инфекций. Основными источниками заражения являются больные и бактерионосители. Путь распространения инфекции воздушно-капельный, реже контактнобытовой. Большинство стрептококков являются представителями нормальной условно-патогенной микрофлоры, поэтому наиболее восприимчивы к инфекции лица с иммунодефицитом (эндогенная, оппортунистическая инфекции). Возможны случаи госпитальной (внутрибольничной) инфекции.
Патогенез стрептококковых инфекций. Стрептококки, как и стафилококки, вызывают острые и хронические гнойно-воспалительные поражения различных органов вплоть до развития сепсиса, септикопиемии и токсинемии. Вместе с тем стрептококки могут быть главными или единственными возбудителями ряда инфекционных
заболеваний. Контагиозный импетиго - поражение поверхностных слоев кожи, чаще развивается у детей, обычно смешанной этиологии (S. pyogenes, S. aureus). Флегмона - диффузное гнойное воспаление соединительной ткани, в отличие от ограниченного гнойника - абсцесса, вызываемого стафилококком. Стрептококковая ангина (острый тонзиллит) - диффузное поражение зева и миндалин. Пневмококки могут вызывать средний гнойный отит и менингит. Пневмококк - типичный возбудитель крупозной (лобарной) пневмонии, однако может вызывать бронхопневмонию как вторичную инфекцию у ослабленных больных. S. agalactiae (серогруппа В), колонизируя слизистую оболочку влагалища у беременных, опасен для новорожденных, вызывает пневмонию, сепсис, менингит. Оральные стрептококки (S. mutans и др.) вызывают наиболее частые поражения в ротовой полости - кариес, пародонтит. Стрептококки из локального очага инфекции способны быстро проникать в кровь и вызывать сепсис (сепсис рожениц, новорожденных). Скарлатина вызывается S. pyogenes (серогруппа А), характеризуется ангиной, интоксикацией, характерной сыпью на коже. Основной фактор патогенеза - эритрогенный токсин, синтез которого опосредован конвертирующим бактериофагом. Рожа (возбудитель S. pyogenes, серогруппа А) - острое хроническое воспаление кожи с преимущественной локализацией в области лица и нижних конечностей. В этиологии гломерулонефрита и ревматизма ведущая роль принадлежит S. pyogenes (серогруппа А). Заболевания развиваются как осложнение хронического фарингита или тонзиллита стрептококковой этиологии, в патогенезе ведущую роль играют иммуноопосредованные механизмы (гиперчувствительность иммунокомплексного типа). Подострый септический эндокардит вызывается α-гемолитическими зеленящими стрептококками ро- товой полости (S. mitis и др.), которые могут транслоцировать в кровь из естественного биотопа по разным причинам (микротравмы, экстракция зуба, очаг воспаления).
Иммунитет клеточный и гуморальный, нестойкий (кроме анти- токсического после скарлатины), типоспецифический. По направленности антитоксический, антиферментный, антибактериальный. Возможен переход острой инфекции в хроническую (тонзиллит, рожа, ревматизм).
Микробиологическая диагностика. Ведущим методом является бактериологический. При идентификации возбудителя, кроме
определения вида, серогруппы и серовара, важное значение имеет выявление факторов патогенности и персистенции для подтверждения этиологического диагноза, прогнозирования течения процесса, а также выбора эффективных антибактериальных препаратов. При серологической диагностике ведется поиск антител к токсинам и ферментам патогенности стрептококка.
16.1.1.3. Энтерококки (род Enterococcus)
Таксономия и классификация. Выделены в самостоятельный род Enterococcus из группы стрептококков (Берджи. Определитель бактерий, 1994). Род Enterococcus включает около 20 видов, из них клинически значимые для человека Е. faecalis, E. faecium, E. durans и др. Видовая идентификация построена на изучении биохимических свойств. По антигенным свойствам относятся к серологической группе D.
Морфология и физиология энтерококков не отличаются от таковых других стрептококков, кроме способности расти на средах, содержащих 6,5% NaCl. На кровяном агаре могут вызывать α-гемолиз.
Факторы патогенности. Условно-патогенные виды, факторы патогенности аналогичны представителям вида Streptococcus: структуры клеточной стенки, токсины, ферменты, факторы персистенции
(АЛА, АКА и др.).
Экология энтерококков. Основной биотоп - кишечник человека и животных, входят в состав микрофлоры ротовой полости и мочеполовой системы.
Эпидемиология и патогенез аналогичны таковым стрептококковых инфекций. Играют роль в развитии пищевых токсикоинфекций, дисбактериозов кишечника.
Микробиологическая диагностика. Основным методом является бактериологический.
Лечение и профилактика стрептококковых и энтерококковых инфекций. Этиотропная терапия проводится антибиотиками, в основном пенициллином и его производными (оксациллин, бициллин-5 и др.). В связи с ростом частоты антибиотикорезистентности следует определять антибиотикограмму, а также осуществлять выбор препарата по оценке его антивирулентного действия в субингибиторных концентрациях.
Вакцины для профилактики стрептококковых и энтерококковых инфекций находятся в стадии разработки.
16.1.2. Аэробные грамотрицательные кокки
16.1.2.1. Нейссерии (род Neisseria)
Род Neisseria включает более 10 видов, из них 2 вида (N. meningitidis и N. gonorrhoeae), патогенные для человека, а остальные (N. sicca, N. flavescens, N. mucosa и др.) представляют нормальную микрофлору слизистых оболочек человека и животных, однако могут вызывать гнойно-воспалительные заболевания у лиц с им- мунодефицитом. Представители рода Neisseria часто располагаются парами (соприкасающиеся стороны клеток уплощены), могут образовывать капсулу и фимбрии, неподвижны, оксидазо- и каталазоположительные. Дифференцируются по морфологическим, культуральным и биохимическим свойствам.
16.1.2.1.1. Менингококки
Открыты Вексельбаумом в
Классификация и идентификация. На основании структуры капсульного полисахаридного антигена менингококки классифицируются на 13 серологических групп (А, В, С, D и др.), а внутри групп по белковым антигенам наружной мембраны клеточной стенки - на серовары.
Морфология. Менингококки - грамотрицательные диплококки округлой формы. Неподвижны. Спор не образуют. Имеют пили 4 типа. Образуют нежную капсулу полисахаридной природы.
Культуральные и биохимические свойства. Строгие аэробы, капнофилы. Растут на средах с добавлением белка (сыворотка, кровь). На плотной среде образуют нежные бесцветные округлые мелкие колонии. На кровяном агаре не дают гемолиза. Растут при 37 ?С , 5% СО2 стимулирует их рост. Биохимическая активность низкая. Протеолитическими свойствами не обладают. Оксидазо- и катала- зоположительны. Ферментируют глюкозу и мальтозу.
Антигенная структура. Обладают
сложной антигенной структурой. По капсульным полисахаридным антигенам
делятся на 13 серогрупп. Наиболее важные серогруппы, связанные с
заболеванием у человека, - A, B, C, D и X, Y, Z, W-135,
мическом подъеме заболеваемости принадлежит менингококкам серогруппы А. Менингококки, содержащие серовар 2, чаще вы- деляются при генерализованных формах инфекции.
Факторы патогенности. Основные факторы патогенности: капсула, эндотоксин, пили IV типа, белки наружной мембраны, ферменты агрессии. Капсула - важный фактор патогенности менингококков, полисахаридной природы, нейтрализует фагоцитарную активность клеток, способствуя внутриклеточной персистенции. Фимбрии (пили) обеспечивают адгезию менингококков к клеткам эпителия носоглотки. Белки наружной мембраны - комплекс множества белков на поверхности клеточной стенки, которые участвуют в прикреплении менингококка с клетками хозяина, способствуют проникновению менингококка внутрь клетки и участвуют в обменных процессах между паразитом и клеткой хозяина (метаболизм железа, меди, цинка и т.д.). Колонизации менингококка на слизистой оболочке способствуют факторы микробного антагонизма: бактериоцины, оксидаза и каталаза. Важная роль во внутриклеточной персистенции менингококка отводится АЛА возбудителя. Эндотоксин менингококков представляет собой липополисахаридный комплекс, который индуцирует синтез цитокинов, проявляет пирогенность, имеет сходство с гликолипидами человека (антигенная мимикрия), обладает летальными свойствами (развитие токсического шока и диффузной внутрисосудистой коагуляции). Патогенное действие менингококка определяется продукцией ряда ферментов: гиалуронидазы - фактора распространения, нейрамини- дазы и фибринолизина - факторов инвазии, оксидазы и суперок- сиддисмутазы - факторов микробного антагонизма.
Эпидемиология менингококковых инфекций. Природный резервуар менингококков - слизистая оболочка носоглотки человека. Менингококки паразитируют как на поверхности слизистой оболочки, так и внутри эпителиоцитов. Во внешней среде менингококки не выживают, погибая от высушивания, охлаждения, температуры выше 50 ?С. Чувствительны к дезинфицирующим средствам. Основной источник инфекции - здоровые бактерионосители, а также больные менингококковым назофарингитом, редко - больные с генерализованной формой инфекции. Механизм передачи аэрогенный, путь передачи воздушно-капельный. Восприимчивы в основном дети и лица юношеского возраста. Заболеваемость возрастает в осенне-зимний период. Возникнове-
нию вспышек способствует скученность детей, учащихся в организованных коллективах.
Патогенез менингококковых инфекций. Менингококковая инфекция протекает в двух формах: локализованной и генерализованной. При локализованной форме менингококки проникают в клетки слизистой оболочки носоглотки и могут вызывать либо бактерионосительство, либо ограниченный биотопом воспалительный процесс в виде назофарингита. Если менингококк проникает в кровь, то развиваются генерализованные формы инфекции: менингококкемия (сепсис), эпидемический цереброспинальный гнойный менингит, менингоэнцефалит, эндокардит, артрит, по- лиартрит, иридоциклит, пневмония.
Иммунитет после генерализованных форм инфекции напряженный, антибактериальный, преобладают гуморальные механизмы защиты (бактерицидные антитела). Иммунитет носит группоспецифический характер.
Микробиологическая диагностика. Ведущим является бактериологический метод. Материалом для исследования являются ликвор, кровь, носоглоточная слизь с задней стенки глотки, сыворотка крови. Выбор исследуемого материала обусловлен формой инфекции. Поскольку менингококки очень неустойчивы вне организма человека, материал транспортируется в лабораторию в утепленных контейнерах при 35-37 ?С.
Вспомогательное значение имеют серологическое исследование, которое направлено на определение в ликворе и моче группо- специфических антигенов с помощью ИФА и реакции коагглютинации, а также обнаружение в парных сыворотках специфических антител.
Профилактика и лечение. Для лечения менингококковых инфекций применяют бензилпенициллин и его производные (ампициллин, оксациллин). При непереносимости пенициллинов назначают левомицетин или рифампицин. С целью специфической профилактики по эпидемиологическим показаниям применяют полисахаридные вакцины против менингококков групп А и С. Для экстренной профилактики контактным детям дошкольного возраста вводят противоменингококковый иммуноглобулин.
16.1.2.1.2. Гонококки
Открыты Нейссером в
Морфология. Грамотрицательные диплококки, имеют форму кофейных зерен или почек, сложенных вогнутыми сторонами друг к другу. Неподвижны, спор не образуют, имеют нежную капсулу, пили IV типа.
Культуральные и биохимические свойства. Гонококки принадлежат к наиболее прихотливым бактериям. Оптимальный рост на средах с нативным сывороточным белком во влажной среде с содержанием в воздухе 3-10% СО2. Характеризуются низкой са- харолитической активностью - ферментируют только глюкозу. Оксидазо- и каталазоположительны. Легко подвергаются аутолизу. На плотной среде образуют мелкие бесцветные колонии. Дифференцируют 4 типа гонококков (I, II, III, IV) по морфологии колоний при боковом освещении в стереоскопическом микроскопе. Гонококки I типа выделяются при острой гонорее, образуют колонии ярко-оранжевого цвета. Гонококки II типа выделяются при бессимптомном течении болезни, образуют колонии голубоватозеленого цвета. Только у гонококков I и II типов обнаружены пили. Гонококки III и IV типов - это музейные штаммы, образуют тусклые колонии без четкого разделения цветных полос.
Антигенные свойства. Обладают сложной антигенной структурой. Антигенной специфичностью обладают пили, пориновый белок, белки наружной мембраны, липоолигосахарид. По сравнению с другими грамотрицательными бактериями гонококки не имеют типичного ЛПС с длинной О-специфической полисахаридной цепью, а имеют короткий гликолипид, который называется липоолигосахаридом (см. раздел 2.2.2). Структура гонококкового липоолигосахарида напоминает структуру гликосфинголипида цитоплазматической мембраны человека, поэтому присутствие на поверхности микроба структуры, идентичной структуре клетки человека, мимикрирует микроб, позволяя ему избегать иммунного распознавания.
Факторы патогенности. Основные факторы патогенности: капсула, пили IV типа, эндотоксин, белки наружной мембраны, секретируемые факторы персистенции, бактериоцины, ферменты. Капсула (микрокапсула), в структуре которой важная роль отводится сиаловой кислоте, блокирует активацию комплемента, защищает от фагоцитоза, способствует внутриклеточной локализации гонококка. Ворсинки (пили, фимбрии) IV типа - факторы адгезии го- нококка к поверхности клеток слизистой оболочки мочеполового
тракта. Кроме адгезии, пили способствуют внутриэпителиальной инвазии и повышают устойчивость гонококка к фагоцитозу. Важную роль как факторы колонизации гонококка играют белки наружной мембраны (Ора, Орс, рП и др.). Они усиливают адгезию, внутриклеточную инвазию, антифагоцитарную активность, устойчивость к бактерицидности сыворотки. Один из факторов колонизации - бактериоцины гонококков (гоноцины). Установлена корреляция между лизоцимной и бактериоциногенной активностью гонококков, что подтверждает роль бактериоцинов, как и лизоцима, в формировании микробного биоценоза. Важными факторами персистенции гонококка являются АЛА и АКА. Штам- мы гонококка с высокой АЛА и АКА чаще выделялись от больных с хронической формой гонореи. Эндотоксин гонококков - комплекс белка и липоолигосахарида - участвует в деструктивном действии патогена на эпителий слизистых оболочек. Из ферментов патогенности у гонококков следует отметить гиалуронидазу, протеазы, супероксиддисмутазу, каталазу, мурамидазу (лизоцим). Гиалуронидаза - фактор распространения гонококка в межклеточном пространстве, что приводит к поражению органов малого таза (восходящая гонорея). Протеазы разрывают клеточные связи, нарушают целостность мембран, разжижают слизь; IgA-протеаза разрушает секреторные антитела. Ферменты лизоцим, каталаза, супероксиддисмутаза, β-лактамаза - факторы микробного антагонизма. Определенный процент штаммов гонококка устойчив к антибиотикам за счет наличия R-плазмид, продукции β-лактамазы и других факторов антибиотикорезистентности.
Эпидемиология гонококковых инфекций. Гонококки очень неустойчивы во внешней среде, чувствительны к антисептикам и дезинфектантам. Типичным биотопом паразитирования гонококка являются клетки эпителия слизистой оболочки мочеполовых путей человека. Источник инфекции - больной острой и хронической, особенно бессимптомной (торпидной) формой гонореи. Пути передачи половой, контактно-бытовой. Восприимчивость высокая.
Патогенез гонококковых инфекций. При острой гонореи развивается гнойное воспаление слизистой оболочки уретры, шейки матки. Возможны осложнения в виде воспаления внутренних половых органов: эндометрит, аднексит, простатит и т.д. Участились случаи экстрагенитальной формы гонореи: фарингит, проктит, конъюнктивит (бленнорея у новорожденных) и т.д. Заболевание
протекает часто бессимптомно, возможно развитие хронической формы гонореи.
Иммунитет не формируется, часто регистрируется реинфекция.
Микробиологическая диагностика. При острой форме гонореи ведущим является бактериологический метод, возможен бактериоскопический метод, при хронической - поиск антител к возбудителю. При диагностике хронической и торпидно протекающей формах гонореи выделить возбудителя трудно, так как гонококк паразитирует внутри клеток эпителия. Поэтому существует метод выделения внутриклеточно паразитирующих патогенных нейссерий (менингококков и гонококков). Сущность метода заключает во взятии в качестве исследуемого материала клеток от больного, в которых паразитирует патоген. Клетки подращивают в среде 199 или среде Игла, затем делают высев на элективные среды, содержащие лизоцим.
Лечение и профилактика. Против β-лактамазоактивных штаммов гонококков применяют цефалоспорины, макролиды и др. Осуществляют выбор антибиотиков, которые в субингибиторных концентрациях подавляют факторы персистенции гонококков. При лечении хронической гонореи используют убитую вакцину. Специфическая профилактика гонореи отсутствует. Проводятся противоэпидемические мероприятия.
16.1.3. Анаэробные кокки
Таксономия и классификация. Анаэробные кокки делятся на две группы: грамположительные (Coprococcus, Peptococcus, Peptostreptococcus, Ruminococcus) и грамотрицательные (Acidaminococcus, Megasphaera, Veillonella). Среди этих родов есть паразиты человека, которые могут вызывать заболевания.
Морфология и физиология анаэробных кокков
Род Coprococcus. Кокки образуют пары или короткие цепочки. На кровяном агаре образуют мелкие беловатые колонии, иногда с α-гемолизом. Каталазоотрицательные. Типовой вид - С. entactus.
Род Peptococcus. Кокки расположены парами, тетрадами, группами. Каталазоотрицательные. На кровяном агаре образуют колонии черного цвета. Единственный вид - Р. niger.
Род Peptostreptococcus. Кокки расположены парами, тетрадами, цепочками. Как правило, каталазоотрицательные. Типовой вид - Р. anaerobius.
Род Ruminococcus. Клетки сферические, слегка удлиненные, располагаются в парах и цепочках. Могут быть подвижными. Каталазоотрицательные. Типовой вид - R. flavefaciens.
Род Acidaminococcus. Часто овальные или почковидные диплококки. Единственный вид - А. fermentans.
Род Megasphaera. Крупные кокки в парах или в цепочках. Типовой вид - М. elsdenii.
Род Veillonella. Диплококки или кокки в виде скопления и коротких цепочек. Каталазоотрицательные. Типовой вид - V. pаrvula.
Факторы патогенности. У штаммов Peptostreptococcus обнаружены факторы патогенности: эндотоксин (цитотоксин), протеазы, уреаза, β-лактамаза, гликозидазы.
Штаммы Coprococcus характеризуются факторами патогенности: эндотоксином (цитотоксином), Fc-связывающими рецепторами, продукцией гликозидаз и уреазы.
Факторы патогенности штаммов Ruminococcus: адгезины, уреаза, гликозидазы (муциназы). У штаммов Veillonella обнаружен фактор деградации IgА. Гликолитические ферменты анаэробных кокков (гликозидазы) деградируют гликопротеины слизистых оболочек. Бактериальная уреаза может играть роль в патогенезе мочевых инфекций.
Экология анаэробных кокков и их роль в инфекционной патологии. Представители рода Peptostreptococcus обитают на коже, слизистых оболочках ротовой полости, кишечника, гениталий. Могут вызывать поражения корневого канала зуба, периодонтит, инфекции генитального тракта, тромбофлебиты, раневые инфекции, менингит, цистит, абсцессы, сепсис.
Ruminococcus паразитирует в кишечнике человека, рубце, толстой и слепой кишке млекопитающих. Вызывает мочевые инфекции, болезнь Крона.
Coprococcus обитает в кишечнике человека, вызывает болезнь Крона, язвенный колит, артриты.
Peptococcus niger паразитирует на слизистых оболочках человека, выделен от больных перитонитом, из субдуральной эмпиемы.
Veillonella является представителем нормальной микрофлоры ротовой полости, кишечника, верхних дыхательных путей. Вызывает абсцессы, пневмонии, нагноения ран и ожоговой поверхности, синуситы.
Анаэробные кокки часто вызывают заболевания в ассоциации между собой и аэробами (смешанные инфекции). Инфекции имеют эндогенный характер.
Микробиологическая диагностика. Ведущим методом диагностики является бактериологический. При взятии проб на исследование важно исключить их контаминацию посторонней аэробной микрофлорой. В связи с этим материалы, полученные при бронхоскопии или взятые с поверхности ран, а также мокрота, смывы из верхних дыхательных путей, естественно выпущенная моча, не подлежат исследованию на анаэробы. Транспортировать исследуемый материал следует в закрытой резиновой пробкой пробирке (флаконе) или непосредственно в герметически закрытом шприце (резиновый колпачок на игле и т.п.). Для качественной транспортировки пробирка, флакон заполняется бескислородной газовой смесью: 80% азота, 10% водорода, 10% двуокиси углерода. Сроки доставки материала не должны превышать 1 ч. Кровь следует засевать непосредственно у постели больного.
Лечение и профилактика. Специфическая профилактика анаэробных кокковых инфекций не разработана. Лечение анаэробных инфекций проводится антибиотиками: метронидазолом (трихопол), клиндамицином, линкомицином, левомицетином, цефокси- тином и др. Необходим контроль антибиотикограмм.
16.2. Палочки грамотрицательные факультативно-анаэробные
16.2.1. Энтеробактерии (семейство Enterobacteriaceae)
Общая характеристика. Семейство Enterobacteriaceae является самым многочисленным семейством, объединяющим более 40 родов и как следствие имеющим большую степень гетерогенности. Процент ГЦ-пар в ДНК, определяющих степень гетерогенности, варьирует от 36-42% (роды Proteus, Providencia) до 52-60% (роды Klebsiella, Enterobacter). Центральное место занимает род Escherichia (50-52% ГЦ-пар), который является типовым родом. Близкородственное к нему положение занимают роды Shigella (50-52% ГЦпар) и Salmonella (50-53% ГЦ-пар).
Морфология и физиология. Представители семейства являются грамотрицательными палочками размером 1-5x0,4-0,8 мкм. Спор
не образуют, за исключением родов Shigella и Klebsiella, подвижны за счет перитрихиально расположенных жгутиков. Некоторые образуют капсулу. Растут на простых питательных средах, большинство, за исключением рода Yersinia, хорошо культивируются при 37 ?С. Факультативные анаэробы. Обладают оксидативным и бродильным метаболизмом. Оксидазоотрицательны. Обладают нитратредуктазой. Глюкозу ферментируют муравьино-кислым брожением с образованием как большого количества кислот, выявляемых реакцией метиленового красного, так и 2,3-бутандиола, который определяют в реакции Фогеса-Проскауэра. Некоторые представители семейства при ферментации глюкозы образуют газ. Энтеробактерии обладают широким спектром биохимической активности, которая служит основой для подразделения внутри семейства на роды, а внутри некоторых родов на виды. Ключевыми тестами при первичной идентификации энтеробактерий являются (рис. 16.1):
• способность образовывать газ при ферментации глюкозы;
• способность расщеплять лактозу;
• продукция сероводорода.
Для родовой идентификации также определяют продукты, образующиеся при ферментации глюкозы (реакции с метиленовым красным и Фогеса-Проскауэра), способность продуцировать индол, расщеплять мочевину, утилизировать цитрат, вырабатывать

Рис. 16.1. Дифференциация представителей семейства Enterobacteriaceae на среде Клиглера: 1 - среда до посева; 2 - Salmonella; 3 - Escherichia; 4 - Shigella; 5 - Salmonella Typhi
ферменты, превращающие аминокислоты - декарбоксилазы лизина и орнитина, дезаминазу фенилаланина, а также способность использовать различные моно-, олиго- и полисахариды в качестве энергетического источника.
Антигенная структура. Дифференциация бактерий внутри рода на виды в основном проводится по антигенным свойствам. Энтеробактерии обладают соматическим О-антигеном, могут встречаться жгутиковый Н-антиген и поверхностный К-антиген. Представители некоторых родов, в частности рода Yersinia, имеют дополни- тельные видоспецифические антигены. Антигенной специфичностью обладают также пили IV типа.
Распространение в природе. Энтеробактерии разнообразны по экологии и кругу хозяев. Они распространены повсеместно: в почве, воде, входят в состав микрофлоры различных животных и человека. Могут вызывать заболевание у человека, различных животных, птиц, насекомых, растений.
Представители родов Escherichia, Salmonella, Shigella являются возбудителями острых кишечных инфекций, энтеропатогенные иерсинии Y. pseudotuberculosis и Y. enterocolitica вызывают у человека псевдотуберкулез и кишечный иерсиниоз соответственно, а Y. pestis - чуму. Представители родов Klebsiella, Proteus, Providencia, Serratia являются возбудителями внутрибольничных инфекций, а некоторые из них вызывают пищевые токсикоинфекции, заболевания органов респираторного и мочевыделительного трактов.
Факторы патогенности. Представители семейства обладают разнообразными факторами патогенности, которые в различных комбинациях присутствуют в определенных видах. Среди большого разнообразия патогенных факторов можно выделить основные, которые в тех или иных комбинациях присутствуют у патогенных энтеробактерий, обеспечивая развитие патогенеза вызываемого ими заболевания. К ним относятся: эндотоксин, пили IV типа, ТТСС, белковые токсины специфического действия (цито- и энтеротоксины). Следует отметить, что синтез факторов патогенности опосредован генами, локализованными на островках патогенности, плазмидах, конвертирующих бактериофагах.
Эндотоксин играет важную роль в развитии лихорадки, эндо- токсического шока, сопровождающегося лихорадкой, ознобом, гипотензией и тахикардией, принимает участие в развитии диареи через процесс активации каскада арахидоновой кислоты и последующего синтеза простагландинов.
Начальные этапы инфекции связаны со структурами, обеспечивающими взаимодействие бактерий с поверхностным эпителием кишечника. Этот процесс обеспечивается поверхностными структурами клетки: пилями IV типа, филаментозными структурами, составляющими ТТСС (см. раздел 3.1.5).
Установлено 4 типа механизма взаимодействия возбудителей острых кишечных инфекций с поверхностным эпителием кишечника (табл. 16.1).
Таблица 16.1. Механизмы взаимодействия возбудителей острых кишечных инфекций с поверхностным кишечным эпителием
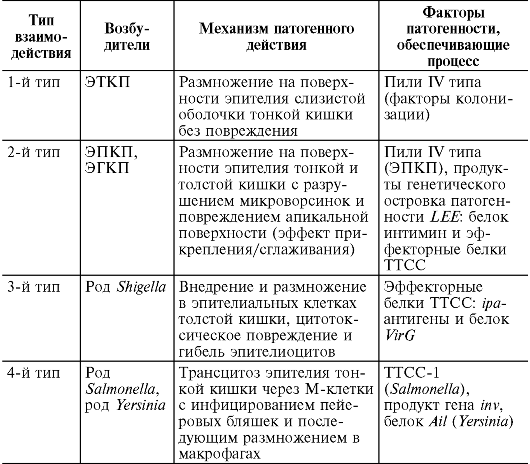
Пили IV типа, присутствуя у некоторых бактерий (энтеротоксигенные - ЭТКП, энтеропатогенные - ЭПКП, энтероагрегативные ЭАКП кишечные палочки), обеспечивают их прикрепление к эпителиальным клеткам слизистой оболочки кишечника.
ТТСС представляет шприцеобразную систему белков, через которую в цитозоль клетки-хозяина транспортируются эффекторные молекулы, индуцирующие инвазию бактерии клеткой хозяина и развитие энтерита. ТТСС имеется у родов Shigella, Salmonella, Yersinia, некоторых E. coli (ЭПКП, энтероинвазивные - ЭИКП, энтерогеморрагические - ЭГКП кишечные палочки). Экспрессия белков, составляющих ТТСС, происходит при попадании микроба в организм хозяина.
Следует отметить, что одним из основных симптомов заболеваний, вызываемых энтеробактериями, является диарея. По ме- ханизму развития различают два типа диареи: воспалительную и секреторную.
Воспалительная диарея характеризуется присутствием нейтрофилов в испражнениях и связывается с возбудителями, вызывающими инвазию слизистой оболочки кишечника (Shigella, нети- фоидными Salmonella, ЭИКП). В ее развитии принимают участие эффекторные белки ТТСС.
Секреторная диарея характеризуется отсутствием нейтрофилов в фекалиях, связана с неинвазивными возбудителями (ЭТКП, V. cholerae), которые вырабатывают белковый энтеротоксин.
Цитотоксины (Shigella, ЭГКП) вызывают повреждение клеток, нарушая синтез белка.
Белковые токсины у энтеробактерий в основном накапливаются в периплазматическом пространстве клетки, попадая во внешнюю среду после гибели бактериальной клетки.
Антифагоцитарная активность обеспечивается факторами, присущими определенным видам. К ним относятся капсула, Vi- антиген у S. Typhi, компоненты ТТСС, ферменты аденилатциклаза и супероксиддисмутаза, специфические антигены.
Микробиологическая диагностика. Основу микробиологической диагностики инфекционных процессов, вызванных представителями семейства Enterobacteriaceae, составляет бактериологический метод исследования. Используются также серологический метод и ПЦР.
16.2.1.1. Эшерихии (род Escherichia)
Род Escherichia включает несколько видов, из которых в патологии человека и животных основное значение имеет вид E. coli, впервые описанный в
Морфология. Прямые грамотрицательные палочки размером 0,4-0,6x2-6 мкм, подвижные за счет перитрихиально расположенных жгутиков. Культуральные свойства. На плотных средах образуют колонии в R- и S-формах. Колонии в S-формах гладкие, блестящие, полупрозрачные. На жидких средах образуют диффузное помутнение и придонный осадок. Биохимические свойства. Обладают выраженной биохимической активностью. Биохимическими свойствами, составляющими основу дифференциальной диагностики при бактериологическом исследовании, являются:
• продукция кислоты и газа при ферментации глюкозы;
• ферментация лактозы;
• отсутствие продукции сероводорода;
• продукция индола.
Антигенная структура. E. coli обладает сложной антигенной структурой. Имеет соматический О-антиген, определяющий серогруппу. Известно около 171 разновидностей этого антигена.
Поверхностный К-антиген может быть представлен 3 антигенами: А, В и L, отличающимися по чувствительности к температуре и химическим веществам. У эшерихий встречается более 97 разновидностей К-антигена преимущественно В-типа. К-антиген обладает способностью маскировать О-антиген, вызывая феномен О-инагглютинабельности. В этом случае О-антиген можно выявить только после разрушения К-антигена кипячением. Типоспецифическим антигеном является Н-антиген, определяющий серовары, которых насчитывается более 57. Антигенная структура определяется формулами серогруппы как О:К:, серовара как О:К:Н:, например О12В6Н2.
Резистентность. В течение нескольких месяцев сохраняется в воде и почве. Будучи неприхотливыми к питательным средам, быстро размножаются в пищевых продуктах, особенно молочных. Погибают при нагревании при 55 ?С в течение 60 мин, при 60 ?С - в течение 15 мин. В окружающей среде способны переходить в некультивируемую форму.
Экология и особенности распространения. Вид E. coli не является однородным, среди них выделяют условно-патогенные и патогенные эшерихии.
Условно-патогенные эшерихии. Основная масса эшерихий является облигатным представителем микрофлоры кишечника и влагалища человека. E. coli также составляют микрофлору кишечни-
ка млекопитающих, птиц, рептилий, рыб. В составе микрофлоры толстой кишки они выполняют много полезных функций: явля- ются антагонистами патогенных кишечных бактерий, гнилостных бактерий и грибов рода Candida. Участвуют в синтезе витаминов, группы В, Е и К, частично расщепляют клетчатку. Эти эшерихии рассматриваются как непатогенная флора, хотя в редких случаях (у лиц с иммунодефицитом) при попадании в другую экологиче- скую нишу они могут вызывать инфекционное заболевание, протекающее в виде сепсиса, вторичной пневмонии, нагноения ран.
С испражнениями эти эшерихии выделяются в окружающую среду. Присутствие кишечной палочки в воде, почве, продуктах, предметах обихода является показателем фекального загрязнения.
Патогенные эшерихии отличаются от условно-патогенных возможностью синтеза факторов патогенности, которые генетически связаны с наличием островков патогенности, конвертирующих фагов и плазмид вирулентности. Патогенные эшерихии подразделяются на возбудителей парентеральных эшерихиозов и диареегенные. Среди возбудителей парентеральных эшерихиозов выделяют уропатогенные эшерихии, являющиеся возбудителями воспалительных процессов мочевыводящей системы. Некоторые из них обладают гемолитическими свойствами. Другие возбудители парентеральных эшерихиозов способны вызвать генерализованные процессы в виде сепсиса и менингита. Около 80% менингитов связаны с E. coli, которой новорожденный заражается при прохождении через родовые пути. E. coli, вызывающая менингит у новорожденных, обладает микрокапсулой, состоящей из гомополимера сиаловой кислоты. Наличие микрокапсулы придает возбудителю антифагоцитарные свойства, так как микрокапсула перестает опсонизироваться из-за потери способности активировать комплемент.
Диареегенные эшерихии также не являются однородной группой,
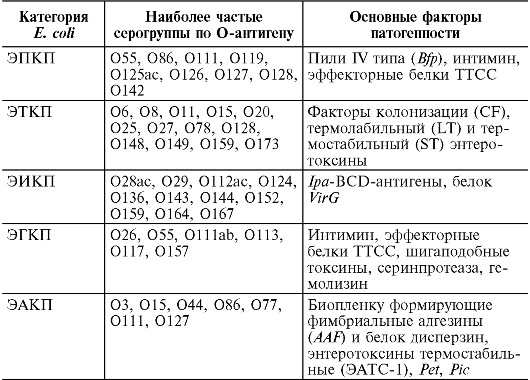
они подразделяются на ЭПКП, ЭГКП, ЭТКП, ЭИКП, ЭАКП.
Кроме вышеперечисленных, имеется еще 3 разновидности в настоящее время недостаточно хорошо изученных кишечных пало- чек. Эти группы различаются по экологии, путям передачи, патогенезу и клиническим проявлениям вызываемого ими заболевания. Это обусловлено различиями в наличии факторов патогенности и их генетической детерминации. В пределах каждой категории имеется определенный состав О-серогрупп (табл. 16.2) или О:Н-
сероваров. Именно по составу О-серогрупп и проводится первичная дифференциация диареегенных эшерихий.
Таблица 16.2. Классификация энтеровирулентных (диареегенных) E. coli
ЭПКП вызывают диарею у детей первого года жизни. Заболевание может также протекать как внутрибольничная инфекция в отделениях для новорожденных и грудных детей, находящихся на искусственном вскармливании. Заболевание передается контактнобытовом путем. С ЭПКП связаны серогруппы О55, О11, О26, О18 (всего 13). ЭПКП обладают способностью размножаться на поверхности эпителия тонкой кишки, разрушая микроворсинки и повреждая апикальную поверхность эпителия. Этот процесс известен под названием «прикрепление и сглаживание» (А/E - attaching and effacing). В результате этого процесса в участке прикрепления бактерий к эпителию тонкой кишки происходит дегенерация эпителиальной поверхности, сопровождающаяся потерей эпителиальных микроворсинок и сборкой пьедесталоподобной актиновой структуры, следствием чего является уменьшение всасывающей поверхности кишечника. Этот процесс обеспечивается кодируемы-
ми плазмидой 60 МД пилями IV типа, которые у ЭПКП называются пучокформирующими пилями, а также белком-интимином и эффекторными белками ТТСС, которые экспрессируются генами островка патогенности, известного как локус сглаживания энтероцитов (от англ. LEE - locus of the enterocyte effacing), локализованного на хромосоме.
Пили и белок-интимин обеспечивают тесное взаимодействие бактериальной клетки с эпителиоцитом, а в результате действия эффекторных белков секреторной системы в месте прикрепления бактериальной клетки к эпителиоциту формируется пьедестал, который является результатом реорганизации клеточного цитоскелета эффекторными белками, представляя собой полимеризованный актин.
Некоторые серовары, например О55:Н10, O111H2, O26HNM, продуцируют шигаподобные токсины.
ЭГКП способны вызывать у людей кровавый понос (геморрагический колит) с последующим осложнением в виде гемолитического уремического синдрома и тромботической тромбоцитопенической пурпуры. Наибольшее эпидемиологическое значение имеют серовары О157:Н7 и О157 НNМ. Источником инфекции являются крупный рогатый скот и овцы. Основной путь передачи алиментарный, через мясо, не прошедшее достаточную термическую обработку. Поражаются слепая, восходящая и поперечная толстая кишки.
Механизм взаимодействия ЭГКП с энтероцитами происходит аналогично таковому у ЭПКП благодаря наличию на хромосоме островка патогенности LEE.
Развитие гемолитического колита и уремического гемолитичского синдрома связано со способностью продуцировать шигапо- добные токсины (см. раздел 16.2.1.3), синтез которых опосредуется конвертирующими бактериофагами. В этом процессе принимают участие также кодируемые плазмидой О157 серинпротеаза, которая нарушает процесс свертывания крови, действуя на V фактор, и гемолизин, который также способствует нарушению барьерной функции кишечника. У ЭГКП обнаруживаются два типа шигаподобных токсина. Серовар О157 Н7 может синтезировать как один, так и оба типа. Серовар О157 не обладает способностью утилизировать сорбит, что используется при проведении бактериологического исследования.
ЭИКП способны внедряться и размножаться в эпителиальных клетках слизистой оболочки толстой кишки, вызывая их деструкцию. Это обусловлено наличием плазмиды 140 МД, идентичной таковой у шигелл (см. раздел 16.2.1.3), которая кодирует синтез поверхностных белков, IPA-антигенов, опосредующих процесс инвазии в клетки слизистой оболочки толстой кишки, и белок VirG, обеспечивающий сборку актина. Результатом действия этих факторов патогенности является развитие дизентериеподобного заболевания (рис. 16.2). Заражение ЭИКП происходит водным и элементарными путями, возможны вспышки внутрибольничных инфекций, вызванных ЭИКП. С ЭИКП связаны серогруппы О124, О144, О152 (более 9 серогрупп).
ЭАТКП являются преобладающим этиологическим агентом персистирующей диареи в развивающихся странах и медленно текущей диареи в индустриально развитых странах. Особенность возбудителя заключается в том, что они прикрепляются к эпителиальным клеткам в характерной манере, напоминающей укладку кирпичей. Прикрепляясь к слизистой оболочке кишечника, они стимулируют продукцию слизи, приводя к образованию толстой слизистой биопленки, инкрустированной ЭАГКП. Образование биопленки уси-
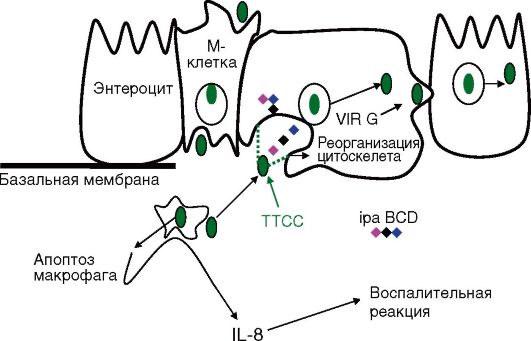
Рис. 16.2. Инфекционный цикл Shigella (ЭИКП)
ливает персистенцию микроба и создает барьер, препятствующий проникновению антибиотиков и антибактериальных факторов хо- зяина. В развитии заболевания участвуют: фимбриальные адгезины (AAF), синтез которых опосредуется плазмидой 65 МД, высокоиммуногенный белок дисперзин, который, связываясь с клеточной поверхностью, принимает участие в образовании биопленки, а также термостабильный энтеротоксин-1 и токсины с цитотоксическим эффектом.
ЭТКП являются возбудителями холероподобного заболевания у детей и взрослых, известного под названием «диарея путешественников». Патогенность связана с выработкой 2 энтеротоксинов, которые вызывают развитие секреторной диареи: термолабильного (LT), структурно и функционально связанного с холерным ток- сином, и термостабильного (ST) энтеротоксинов. Синтез обоих токсинов детерминируется плазмидой. Факторами патогенности также являются пили IV типа, которые называются факторами колонизации CF (от англ. colonization factors). Их синтез контролируется второй плазмидой. Факторы колонизации CF являются пилями IV типа. Они различаются по антигенной специфичности, их иначе называют колонизационными антигенами, которых насчитывается более 21. Наиболее часто встречаются CF1 и CF2.
Благодаря CF ЭТКП прикрепляются и размножаются на поверхности эпителия тонкой кишки. Колонизация поверхности тонкой кишки обеспечивает массивный выброс энтеротоксинов, которые нарушают водно-солевой обмен в кишечнике, приводя к развитию водянистой диареи. Механизм развития диареи связывают с активацией аденилатциклазы LT кишечника, а гуанилатциклазы - ST. С ЭТКП связано 17 серогрупп, среди них серовары О6Н16, О8Н9, О78:Н11, О148:Н28. Заражение ЭТКП происходит водным и алиментарным путями.
Иммунитет. При кишечных эшерихиозах вырабатывается местный иммунитет, опосредованный секреторными IgA. После кишечного эшерихиоза, вызванного ЭТКП, происходит выработка антител к субъединице В LT, иммунологически родственной субъединице В холерного энтеротоксина.
У детей первого года жизни пассивный трансплацентарный иммунитет к ЭПКП обеспечивается проходящими через плаценту IgG. Естественный иммунитет детей первого года жизни обеспечивают бифидобактерии, которые колонизируют кишечник к 5-му дню жизни, и антитела, находящиеся в материнском молоке.
Надежный иммунитет к возбудителям парентеральных эшерихиозов не вырабатывается.
Специфическая профилактика не разработана.
Неспецифическая профилактика сводится к соблюдению санитарно-гигиенических правил, санитарному контролю за источниками водоснабжения, пищевыми предприятиями, продуктами питания.
Микробиологическая диагностика осуществляется бактериологическим методом. Материалом для исследования при кишечных эшерихиозах служат испражнения, при парентеральных - материал из соответствующего инфекционного очага (моча, отделяемое раны, кровь, ликвор). Исследуемый материал (кроме крови и ликвора) засевается на дифференциальные лактозосодержащие среды, после инкубации при 37 ?С в течение 18 ч отбираются колонии, агглютинирующиеся поливалентной ОВ-агглютинирующей сывороткой, которые подвергаются идентификации до вида по биохимическим тестам с последующим определением их серологического варианта.
16.2.1.2. Клебсиеллы (род Klebsiella)
Род получил название по имени Э. Клебса, который впервые в
Морфология. Неподвижные грамотрицательные палочки размером 0,3-1,5x0,6-0,8 мкм, имеющие капсулу. Располагаются единично, парами или цепочками.
Культуральные свойства. За исключением вида K. granulomatis, который на искусственных питательных средах растет плохо, и его культивируют в желточном мешке куриного эмбриона, остальные виды клебсиелл нетребовательны к питательным средам. На жидких средах вызывают диффузное помутнение. На плотных образуют блестящие выпуклые слизистые колонии.
Биохимические свойства. Способны расщеплять лактозу, поэтому относятся к группе колиформных бактерий. Дифференциация внутри рода на виды и внутри вида. Разделение K. pneumoniae на подвиды производится на основе биохимических свойств. Для клебсиелл характерно отсутствие продукции сероводорода. Они
способны утилизировать цитрат, малонат, расщеплять мочевину. В отличие от других видов, K. oxytica продуцирует индол.
Антигенная структура. Обладают О-антигеном (более 12 серогрупп) и полисахаридным капсульным антигеном (более 85 групп).
Факторы патогенности. Полисахаридная капсула обеспечивает устойчивость к фагоцитозу и действию комплемента. Большинство клебсиелл обладают пилями III типа, продуцируют термостабильный и термолабильный энтеротоксины, а также ферменты патогенности: нейраминидазу, ДНКазу, фосфатазу.
Экология и распространение. Благодаря наличию капсулы клебсиеллы устойчивы в окружающей среде, длительное время сохраняются в почве, воде, помещениях. Чувствительны к кипячению и дезинфектантам. K. pneumoniae входит в состав факультативной флоры кишечника, верхних дыхательных путей, влагалища. Обнаруживается на коже и слизистых оболочках.
Патогенез и заболевание у человека. K. pneumoniae подвид pneumoniae является возбудителем неспецифических инфекций дыха- тельных путей, органов мочевыводящей системы, пищевой токсикоинфекции. Особенно опасны штаммы, обладающие фактором множественной лекарственной устойчивости, так как они являются одними из ведущих возбудителей внутрибольничных инфекций, которые протекают с поражением дыхательных и мочевыводящих путей. Этот микроб вызывает также гнойные послеродовые осложнения и неонатальную инфекцию новорожденных, которая протекает в виде пневмонии, кишечных расстройств и токсикосептических состояний, заканчивающихся летально.
Возбудитель подвида ozaenae вызывает озену - атрофический зловонный ринит. Клебсиелла подвида rhinoscleromatis вызывает риносклерому - хроническое деструктивно-грануломатозное заболевание носоглотки. K. oxytica является возбудителем внутрибольничных инфекций в урологических клиниках. K. granulomatis является возбудителем донованоза - венерической паховой гранулемы, которая проявляется грануломатозными изъязвлениями на коже и в подкожной клетчатке. Заболевание передается половым, реже бытовым путем, для него характерна эндемичность распространения, в основном в странах тропического климата.
Иммунитет. Гуморальный иммунитет протективными свойствами не обладает. Антитела являются свидетелями инфекционного процесса. Процесс выздоровления связан с активацией фагоцитоза.
Микробиологическая диагностика. Используют бактериологический метод исследования. Материал для исследования, выбор которого зависит от локализации инфекционного процесса, засевают на лактозосодержащие дифференциальные питательные среды с последующим выделением чистой культуры возбудителя и ее идентификацией до вида и подвида. Серологическая диагностика проводится постановкой РСК с О-антигенами. Диагностику донованоза проводят бактериоскопическим методом путем обнаруже- ния телец Донована в мазках из биоптата гранулем, окрашенных по Романовскому-Гимзе.
Лечение и профилактика. Средств специфической профилактики не существует. Лечение проводят клебсиеллезным бактериофагом и антибиотиками. Необходим контроль антибиотикограмм.
16.2.1.3. Шигеллы (род Shigella)
Род получил название по имени К. Шига, который в
Род Shigella включает 4 вида, которые различаются по биохимическим свойствам и антигенной структуре: S. dysenteriae - 12 сероваров; S. flexneri - 9 сероваров; S. Boydii - 18 сероваров; S. sonnei - 1 серовар.
Морфология. Шигеллы - неподвижные палочки размером 0,5- 0,7x2-3 мкм, спор и капсулу не образуют.
Культуральные свойства. Хорошо культивируются на простых питательных средах. На плотных средах образуют мелкие гладкие блестящие полупрозрачные колонии, на жидких - диффузное помутнение. Жидкой средой обогащения является селенито- вый бульон. У S. sonnei отмечена при росте на плотных средах S-, R-диссоциация.
Биохимические свойства. Шигеллы обладают слабой биохимической активностью по сравнению с родами Escherihia и Salmonella.
Основные биохимические признаки, необходимые для идентификации при выделении чистой культуры:
• не образуют газ при ферментации глюкозы;
• не расщепляют лактозу;
• не продуцируют сероводород.
S. dysenteriae не расщепляет маннитол. S. sonnei способен фер- ментировать лактозу медленно, в течение 72 ч. Является наибо-
лее биохимически активным видом, по биохимической активности подразделяется на хемовары. От других видов шигелл S. sonnei можно отличить по биохимическим свойствам.
Резистентность. В зависимости от температуры, влажности, рН и вида возбудителя выживаемость шигелл во внешней среде, на предметах обихода колеблется от нескольких дней до нескольких месяцев. Наиболее неустойчив во внешней среде вид S. dysenteriae. Шигеллы хорошо переносят высушивание, низкие температуры, но быстро погибают под воздействием прямых солнечных лучей и нагревании (при 60 ?С - через 30 мин, при 100 ?С мгновенно). Благоприятной средой для шигелл являются пищевые продукты. S. sonnei в молоке и молочных продуктах способны не только длительно переживать, но и размножаться. Дезинфицирующие средства (гипохлориты, хлорамин, лизол и др.) в обычных концентрациях убивают шигеллы. У некоторых видов, в частности у S. dysenteriae, отмечен переход в некультивируемую форму.
Антигенная структура. Все шигеллы обладают соматическим О-антигеном, в зависимости от строения которого происходит подразделение на серовары, а S. flexneri внутри сероваров подразделяется на подсеровары. Серовароспецифические О-антигены S. flexneri детерминируются конвертирующими бактериофагами. S. sonnei обладает антигеном фазы 1, который является К-антигеном.
Факторы патогенности. Все виды шигелл инвазируют слизистую оболочку толстой кишки с последующим межклеточным распространением. Эта способность связана с функционированием крупной плазмиды инвазии, которая имеется у всех 4 видов шигелл. В отличие от других видов шигелл, у которых эта плазмида имеет молекулярную массу 140 МД, у S. sonnei эта плазмида составляет 120 МД и добавочно детерминирует синтез антигена фазы 1. Плазмида инвазии детерминирует синтез ТТСС, через которую проникают в клетку эффекторные белки-инвазины, ipa-BCD (invasion plasmid antigens), которые чувствительны к трипсину. Поэтому процесс инвазии шигелл в эпителий кишечника происходит в толстой кишке.
Ipa-BCD обеспечивают процесс инвазии эпителия слизистой оболочки толстой кишки через М-клетки и последующее проникновение шигелл в эпителиоциты слизистой оболочки с базальной стороны. Помимо ipa-BCD-инвазинов, в патогенезе играют роль белки внутриклеточного распространения, которые вызывают ли-
зис мембраны эукариотической клетки, обеспечивая внутриклеточное и межклеточное распространение. После проникновения в эпителиоциты шигеллы лизируют окутывающую их мембранную вакуоль, проникают в цитозоль клетки, где покрываются филаментами актина, формируя актиновый хвост, который способствует продвижению бактерии по клеточному цитозолю и проникновению в прилегающие клетки в результате полимеризации актина. Этот процесс происходит при участии белка внутриклеточного распространения (VirG), синтез которого также детерминируется плазмидой. Этот белок вызывает лизис мембран клеток хозяина, обеспечивая тем самым внутриклеточное и межклеточное распространение шигелл. Плазмидные гены начинают экспрессироваться при 37 ?С, в условиях осмотического давления кишечника.
Шигеллы продуцируют шига (ST)- и шигаподобные (SL-T) токсины. Шигатоксин продуцируется S. dysenteriae серовара 1, остальные шигеллы продуцируют шигаподобные токсины. Это белковые токсины, состоящие из 1 энзиматической субъединицы А и 5 рецепторных субъединиц В, имеющих сродство к рецептору Gb3 (globotriasylceramide), который локализуется на мембранах эндотелия капилляров. Субъединица А, проникнув в клетку, взаимодействует с 60S-субъединицей рибосом, необратимо блокируя синтез белка. Эти токсины не имеют гомологии ни с холерным токсином, ни с LT-токсином ЭТКП. Шига- и шигаподобные токсины накапливаются в периплазматическом пространстве клетки и выделяются в окружающую среду после гибели шигелл. У шигелл, отличных от S. dysenteriae серовара 1, шигаподобных токсинов вырабатывается в 1000 раз меньше, поэтому ареал действия токсина ограничивается стенкой кишечника. У S. dysenteriae серовара 1 токсин попадает в кровь и наряду с эндотелием подслизистой оболочки поражает также гломерулы почки, вследствие чего, помимо кровавого поноса, развивается гемолитический уремический синдром с почечной недостаточностью.
Эндотоксин защищает шигеллы от действия низких значений рН и желчи.
Эпидемиология. Шигеллы вызывают заболевания, называемые шигеллезами (старое название - бактериальная дизентерия), которые являются антропонозными инфекциями с фекально-оральным механизмом передачи. В развивающихся странах наиболее частыми возбудителями являются S. flexneri и S. dysenteriae серовара 1.
В отличие от других шигелл, S. dysenteriae вызывает длительные пролонгированные эпидемии шигеллеза. Передается в основном контактно-бытовым путем. Заболевание протекает с тяжелой клинической картиной и часто заканчивается летально. К тому же отмечено более быстрое формирование антибиотикорезистентности у S. dysenteriae, чем у других видов шигелл. Для S. flexneri характерен водный путь передачи. S. sonnei вызывает шигеллез в легкой форме, часто в виде бактерионосительства. Передается в основном алиментарным путем через молочные продукты. Осложнениями шигеллезов может быть развитие кишечного дисбактериоза. Летальность при шигеллезах достигает 0,3%.
Патогенез и клиническая картина. Шигеллезы - это инфекционные заболевания, характеризующиеся поражением толстой кишки с развитием колита и интоксикацией организма. Заболевание характеризуется сложными начальными этапами патогенеза. Проникнув через М-клетки в подслизистую оболочку, шигеллы взаимодействуют с макрофагами, вызывая их апоптоз. В результате происходит выделение цитокинов ИЛ-8, который инициирует развитие воспалительного процесса в подслизистой оболочке и как следствие воспалительной диареи (см. рис. 16.2).
Апоптоз фагоцитов позволяет шигеллам проникнуть в эпителиальные клетки с базальной стороны. Межклеточное распространение шигелл приводит к развитию эрозий. При гибели шигелл происхо- дит выделение шига- и шигаподобных токсинов, действие которых вызывает появление крови в испражнениях. Патологический процесс ограничивается толстой кишкой. Бактериемия при шигеллезах не наблюдается. При шигеллезе, вызванном S. dysenteriae серовара 1, шигатоксин попадает в кровь, вызывая поражения гломерулов почки. При этом воспаленный эндотелий сужает сосуды, увеличивая скорость кровотока. Это приводит к повышению динамического давления, вызывая обнажение рецепторов для мультимерного фактора Виллебранда, который вызывает аггрегацию тромбоцитов, приводящую к окклюзии сосудов и развитию уремии.
Иммунитет. В защите от инфекции основная роль принадлежит секреторным IgA, предотвращающим адгезию, и цитотоксической антителозависимой активности интраэпителиальных лимфоцитов, которые вместе с секреторным IgA уничтожают шигеллы.
Микробиологическая диагностика. Основным методом является бактериологический, материалом для исследования служат испраж-
нения. Для посева отбирают гнойно-слизисто-кровяные образования из средней порции кала, которые непосредственно высевают на ряд разных лактозосодержащих и других дифференциальноэлективных плотных питательных сред. В случае выявления бак- терионосителей посев испражнений обязательно проводится в селенитовый бульон с последующим выделением возбудителя на плотных дифференциально-элективных питательных средах. Среди выросших на этих средах колоний отбирают лактозоотрицательные, которые идентифицируют до вида и серовара, выделенные культуры S. flexneri - до подсероваров, а S. sonnei - до хемоваров. В качестве вспомогательного используют серологический метод с постановкой РНГА.
Профилактика и лечение. Для лечения по эпидемическим показаниям используют бактериофаг орального применения, антибиотики после определения антибиотикограммы. В случае возникновения дисбактериоза применяют пробиотики для коррекции микрофлоры. Неспецифическая профилактика сводится к соблюдению санитарно-гигиенических правил приготовления, хранения и реализации пищевых продуктов, при водоснабжении, правил личной гигиены и других мероприятий, аналогичных таковым при кишечном эшерихиозе.
16.2.1.4. Сальмонеллы (род Salmonella)
Род получил название по имени Сальмона, который в
Морфологические и культуральные свойства. Подвижные грамотрицательные палочки размером 0,7-1,5x2-5 мкм. Капсулу не образуют. Хорошо растут на простых питательных и желчесодер- жащих средах. На плотных средах могут образовывать колонии в R- и S-формах, на жидких - диффузное помутнение. Колонии в S-форме средних размеров, гладкие, блестящие, полупрозрачные с голубоватым оттенком. Серовар S. Schottmuelleri (S. Paratyphi B) при росте на плотных средах образует слизистые валики. Жидкими средами обогащения при посеве крови являются триптозосоевый бульон, бульон с сердечно-мозговой вытяжкой, желчный бульон, при посеве содержащие дополнительную флору материалов (фекалии, желчь, мочу, пищевые продукты) - селенитовый бульон, а также тетратионатовый бульон, и среда Раппопорт-Василиади
(последняя среда не используется для выделения S. Typhi). На лактозосодержащих дифференциальных средах образуют бесцветные колонии, на висмут-сульфитном агаре - колонии черного цвета, на среде BGA - розовые колонии.
Биохимические свойства. Обладают выраженной биохимической активностью. Основные биохимические свойства, необходимые для идентификации:
• ферментация глюкозы до кислоты и газа (S. Typhi не продуцируют газ);
• отсутствие ферментации лактозы;
• продукция сероводорода (за исключением S. Paratyphi A);
• отсутствие индолообразования;
• декарбоксилирование лизина (за исключением S. Paratyphi A);
• отсутствие расщепления мочевины;
• отрицательный тест Фогеса-Проскауэра.
Антигенная структура и классификация. Сальмонеллы обладают соматическим О-антигеном, жгутиковым Н-антигеном. Некоторые сальмонеллы обладают К-антигеном. В связи с тем что по основным биохимическим свойствам представители рода Salmonella однотипны, дифференциация внутри рода проводится по антигенной структуре.
Имеется несколько классификаций сальмонелл, наиболее старой является классификация по Кауфману-Уайту, разработанная в
О-антиген состоит из R-ядра и боковой S-цепи. К S-цепи присоединяются сахара, которые называются рецепторами и обо- значаются цифрами. Критерием для объединения сальмонелл в серогруппу является общность конечного сахара, который по химической природе является 3', 6'-дидезоксигексозой.
Н-антиген является двухфазным. Это связано с тем, что его синтез кодируется двумя независимыми генами, работа одного из которых исключает работу другого. Поэтому в каждой клетке может быть синтезирован только один белок (фаза). Первая фаза обозначается буквами, она считается специфической, вторая фаза - цифрами, ее принято считать неспецифической.
Таблица 16.3. Классификация сальмонелл по антигенной структуре по Кауфману-Уайту

В таблице Кауфмана-Уайта (см. табл. 16.3) серогруппы обозначаются цифрами согласно номеру группового рецептора. (А) - 2; (В) - 4: (С1-С4) - 6, 7; (D1) - 9. Внутри серогруппы серовары расположены в алфавитном порядке. В прежних классификациях каждый серовар соответствовал виду.
В настоящее время род Salmonella состоит из двух видов: S. enterica и S. bongori.
S. enterica состоит из 6 подвидов: enterica, palamae, arizonae, diarizonae, hoitanae, indica. В него включены все сальмонеллы, являю- щиеся возбудителями человека и теплокровных животных. Имена сероваров подвида enterica пишутся с прописной буквы, они соответствуют прежним видовым названиям, например S. typhi - S. Typhi. Вид S. bongori подразделяется на 21 серовар и включает в себя сальмонеллы, изолированные из холоднокровных животных.
Некоторые серовары сальмонелл, в частности S. Typhi, имеют полисахаридньгй Vi-антиген, являющийся разновидностью К-антигена. Vi-антиген по химической структуре является поли-
мером N-ацетилгалактозоаминоуроновой кислоты. Этот антиген является рецептором для бактериофагов. По спектру чувствитель- ности к набору Vi-фагов устанавливается фаговар S. Typhi, который необходим для эпидемиологического анализа вспышек брюшного тифа с целью определения источника инфекции. Vi-антиген может придавать бактериям явление О-инагглютинабельности.
Факторы патогенности сальмонелл. Вид S. enterica является факультативным внутриклеточным паразитом, способным инвазировать нефагоцитирующие клетки эпителия слизистой оболочки кишечника и размножаться в макрофагах. Это связано с тем, что, в отличие от вида S. bongori, вид S. enterica имеет в геноме 6 так называемых островков патогенности (pathogenicity island) SPI, де- терминирующих синтез факторов патогенности, среди которых наибольшее значение в развитии патогенеза заболевания принадлежит двум: SPI-1 и SPI-2. Первый из них детерминирует синтез секреторной системы третьего типа (ТТСС-1), эффекторные белки которой вызывают инвазию эпителия слизистой оболочки кишечника путем реорганизации цитоскелета клетки хозяина и участвуют в развитии воспалительной диареи. SPI-2 контролирует синтез ТТСС-2, обеспечивающую размножение S. enterica в макрофагах и развитие системной инфекции. Эффекторные белки ТТСС-2 ингибируют процесс созревания фаголизосомы, т.е. слияние вакуоли, содержащей сальмонеллу, с лизосомой, в результате чего предотвращается убивание сальмонеллы НАДФН-оксидазой фагоцита. Помимо функциональной активности SPI-2, на способность Salmonella сохраняться и размножаться в макрофагах влияет фермент супероксиддисмуаза, синтез которой кодируется ламбдаподобным конвертирующим фагом.
Экспрессия генов SPI-1 регулируется высоким осмотическим давлением и низкой концентрацией кислорода, которые наблюдаются внутри кишечника. На активацию SPI-2 влияет низкий рН внутри- фагосомального окружения. Все сальмонеллы обладают эндотоксином, который вызывает в случае бактериемии развитие лихорадки. При достижении критической концентрации в тканях кишечника эндотоксин активирует каскад арахидоновой кислоты, в результате чего увеличивается синтез простагландинов и как следствие повышается уровень цАМФ, приводящий к нарушению водно-солевого баланса кишечника и развитию диареи. Попав после перорального заражения в тонкую кишку, сальмонеллы инвазируют трансцитозом
через М-клетки слизистую оболочку тонкой кишки без ее повреждения. Через М-клетки сальмонеллы транспортируются в субэпителиальное пространство, где захватываются макрофагами и дендритными клетками и привносятся ими в прилегающие к М-клеткам пейеровые бляшки, в них сальмонеллы, размножаясь в макрофагах, формируют первичный очаг инфекции.
Резистентность. Сальмонеллы устойчивы к воздействию факторов внешней среды. Выдерживают рН 4,0-9,0; в водоемах, сточных водах, почве сохраняют жизнеспособность до 3 мес, в комнатной пыли - от 80 до 550 дней. Хорошо переносят низкие температуры. Сохраняются в зараженных продуктах: в колбасе 3 мес, в замороженном мясе и яйцах до 1 года; на овощах и фруктах 5-10 дней. При нагревании до 56 ?С сальмонеллы гибнут в течение 45-60 мин, при 100 ?С погибают мгновенно. Растворы дезинфицирующих веществ (5% фенол, 3% хлорамин, 3% лизол) убивают сальмонеллы в течение 2-3 мин. При неблагоприятных условиях сальмонеллы могут переходить в некультивируемую форму.
Вызываемые заболевания. В зависимости от источника инфекции, путей передачи, особенностей патогенеза и форм проявления инфекционного процесса среди заболеваний, вызываемых сальмонеллами, различают системные инфекции (брюшной тиф и паратифы), сальмонеллезные гастроэнтериты и госпитальный (нозоко- миальный) сальмонеллез.
Возбудители брюшного тифа и паратифов
Брюшной тиф - острое антропонозное инфекционное заболевание с фекально-оральным механизмом передачи. Протекает в генерализованной форме с поражением лимфатического аппарата кишечника, мезентериальных лимфоузлов, паренхиматозных органов, с бактериемией. Характеризуется циклическим течением. Клинически проявляется выраженной интоксикацией с лихорадкой, развитием гепатолиенального синдрома, в ряде случаев розеолезной сыпью и энтеритом.
Название болезни введено Гиппократом, оно происходит от греческого слова typhos (туман, спутанное сознание).
Этиология. Возбудителем
брюшного тифа является S. Typhi. Впервые возбудитель заболевания
обнаружили в органах умерших людей Т. Брович (1874), Н.И. Соколов
(1876) в России и К. Эберт (1880) в Германии. В
описанная А. Брионом и Х. Кайзером, S. Paratyphi B, описанная Г. Шоттмюллером, и S. Paratyphi С.
По данным ВОЗ, ежегодно на земном шаре заболевает брюшным тифом 16 млн человек, смертность от него достигает 600 000 случаев в год. Возбудители паратифов S. Paratyphi А, В, С выделяются реже, чем S. Typhi.
Возбудители брюшного тифа и паратифов являются сероварами подвида enteric, обладающими следующей антигенной структурой: S. Typhi O: 9, 12 Vi, H: d, S. Paratyphi A O: 1, 2, 12, H: a (1,5); S. Paratyphi B O: 1,4 (5)12, H:b,1,2, S. Paratyphi С: О: 6,7(Vi) Н: с, 1,5. S. Typhi, S. Paratyphi С имеют полисахаридный Vi-антиген.
Морфологические и культуральные свойства типичны для рода Salmonella. Серовар S. Schottmuelleri (S. Paratyphi B) при росте на плотных средах образует слизистые валики. Жидкими средами обогащения при посеве крови являются триптозосоевый бульон, бульон с сердечно-мозговой вытяжкой, желчный бульон, при посеве содержащих дополнительную флору материалов (фекалии, желчь, мочу, пищевые продукты) - селенитовый бульон, а также тетратионатовый бульон. На лактозосодержащих дифференциальных средах образуют бесцветные колонии.
Биохимические свойства в основном типичны для рода Salmonella. Отличительными особенностями являются: отсутствие газообразования при ферментации S. Typhi, неспособность S. Paratyphi A продуцировать сероводород и декарбоксилировать лизин.
Эпидемиология. Брюшной тиф и паратифы являются антропонозами, т.е. вызывают заболевание только у человека. Источником инфекции являются больной или бактерионоситель, которые выделяют возбудитель во внешнюю среду с испражнениями, мочой, слюной. Возбудители этих инфекций, как и другие сальмонеллы, устойчивы во внешней среде, сохраняются в почве, воде. S. Typhi может переходить в некультивируемую форму. Благоприятной для их размножения средой являются пищевые продукты (молоко, сметана, творог, мясной фарш, студень). Передача возбудителя осуществляется водным путем, играющим в настоящее время существенную роль, а также алиментарным и контактно-бытовым путями. Заражающая доза равна приблизительно 1000 клеткам. Естественная восприимчивость людей к этим инфекциям высокая.
Патогенез и клиническая картина. Попав в тонкую кишку, возбудители тифа и паратифов инвазируют слизистую оболочку при
помощи эффекторных белков ТТСС-1, формируя первичный очаг инфекции в пейеровых бляшках. Следует отметить, что в под- слизистой оболочке осмотическое давление по сравнению с просветом кишечника ниже. Это способствует интенсивному синтезу Vi-антигена, который увеличивает антифагоцитарную активность возбудителя и подавляет выброс провоспалительных тканевых медиаторов клетками подслизистой оболочки. Следствием этого яв- ляются отсутствие развития воспалительной диареи на начальных этапах инфекции и интенсивное размножение микробов в макрофагах, приводящее к воспалению пейеровых бляшек и развитию лимфаденита, следствием чего являются нарушение барьерной функции мезентериальных лимфатических узлов и проникновение сальмонелл в кровь, в результате чего развивается бактериемия. Это совпадает с концом инкубационного периода, который длится 10-14 сут. Во время бактериемии, которая сопровождает весь лихорадочный период, возбудители тифа и паратифов с током крови разносятся по организму, оседая в ретикулоэндотели- альных элементах паренхиматозных органов: печени, селезенки, легких, а также в костном мозгу, где они размножаются в макрофагах. Из купферовских клеток печени сальмонеллы по желчным протокам, в которые они диффундируют, попадают в желчный пузырь, где они также размножаются. Накапливаясь в желчном пузыре, сальмонеллы вызывают его воспаление и с током желчи реинфицируют тонкую кишку. Повторное внедрение сальмонелл в пейеровы бляшки приводит к развитию в них гиперергического воспаления по типу феномена Артюса, их некрозу и изъязвлению, что может привести к кишечному кровотечению и прободению кишечной стенки. Способность возбудителей брюшного тифа и паратифов сохраняться и размножаться в фагоцитирующих клетках при функциональной недостаточности последних приводит к формированию бактерионосительства. Сальмонеллы также могут длительное время сохраняться в желчном пузыре, выделяясь с фекалиями в течение длительного времени, и контаминировать окружающую среду. К концу 2-й нед заболевания возбудитель начинает выделяться из организма с мочой, потом, материнским молоком. Диарея начинается в конце 2-й или начале 3-й нед заболевания, с этого время возбудители высеваются из фекалий.
Клиническая картина брюшного тифа и паратифов характеризуется циклическим течением и проявляется лихорадкой (по-
вышение температуры до 39-40 ?С), интоксикацией, появлением розеолезной сыпи, нарушениями со стороны нервной и сердечнососудистой систем.
Иммунитет после перенесенного заболевания напряженный и длительный. Протективный иммунный ответ обеспечивается синергическим действием клеточного иммунного ответа, в котором ведущая роль принадлежит активированным макрофагам. Гуморальный иммунитет самостоятельно не обладает протективной активностью, а является свидетелем инфекционного процесса. Первыми к концу 1-й нед заболевания появляются антитела к О-антигену, которые достигают максимальных титров к разгару заболевания, а потом исчезают. Антитела к Н-антигену появляются в период реконвалесценции, а также у привитых лиц и длительно сохраняются. У бактерионосителей брюшного тифа обнаруживают антитела к Vi-антигену.
Микробиологическая диагностика. Учитывая цикличность течения заболеваний, материал для исследования и метод исследования определяются стадией течения болезни. Основным методом диагностики является бактериологический. Используют также се- рологическое исследование. На 1-й нед заболевания и в течение всего лихорадочного периода S. Typhi и возбудители паратифов выделяют из крови. С конца 2-й нед заболевания производят выделение копро-, били- и уринокультур, т.е. материалом для исследования являются испражнения, желчь, моча. В 90% случаев возбудитель удается выделить из костного мозга даже тогда, когда из других материалов для исследования выделить возбудителя не удается, особенно если больной принимает антибиотики.
Посев крови осуществляют в соотношении 1:10 в желчный бульон или другие жидкие среды обогащения с последующим пересевом на плотные дифференциально-элективные среды (Эндо, Плоскирева, Мак-Конки). Остальные материалы для исследования высевают непосредственно на плотные дифференциальноэлективные среды. Выделенную культуру возбудителя идентифи- цируют по биохимическим свойствам и антигенной структуре, а выделенную культуру S. Typhi типируют Vi-фагами для определения источника инфекции.
Начиная со 2-й нед заболевания проводят серологическое исследование для определения наличия и типа антител с помощью РНГА с О-, Н- и Vi-диагностикумами. Положительным считают
диагностический титр 1:200. В эндемичных по брюшному тифу регионах исследование рекомендуется проводить с использованием парных сывороток.
Профилактика и лечение. Для специфической профилактики брюшного тифа используют брюшнотифозную сорбированную и брюшнотифозную спиртовую, обогащенную Vi-антигеном вакцины. Для профилактики по эпидемиологическим показаниям ли- цам, которые проживают совместно с больным и которые употребляли продукты и воду, зараженные или подозрительно на заражение S. Typhi, назначают брюшнотифозный бактериофаг. Проводят этиотропную антибиотикотерапию.
Неспецифическая профилактика включает санитарнобактериологический контроль за системами водоснабжения, соблюдение санитарно-гигиенических правил при приготовлении пищи, выявление бактерионосителей среди работников пищеблоков, торговли, своевременное выявление и изоляцию больных.
Сальмонеллез - острая кишечная зоонозная инфекция, вызываемая различными сероварами S. enterica, за исключением сероваров S. Typhi, S. Paratyphi A, B, C, характеризующаяся преимущественным поражением ЖКТ и протекающая чаще в виде локальной инфекции в форме гастроэнтерита, реже в виде генерализованных форм - тифоподобной или септикопиемической.
Этиология и эпидемиология. Возбудителями сальмонеллеза являются различные серовары S. enterica, чаще входящие в подвид enterica, которые вызывают заболевание как у животных, так и у человека. Наиболее часто возбудителями сальмонеллеза у человека являются серовары S. Typhimurium, S. Dublin, S. Choleraesuis, доминирующим в настоящее время является серовар S. Enteritidis.
Основным резервуаром возбудителей в природе являются сельскохозяйственные животные. Развитие промышленного живот- новодства способствует распространению сальмонелл среди животных (крупного и мелкого рогатого скота, свиней), у которых сальмонеллез протекает как в форме клинически выраженной системной инфекции, так и в форме бактерионосительства, при этом животные выделяют возбудителя с мочой, испражнениями, молоком, околоплодными водами. Резервуаром сальмонелл являются также птицы (водоплавающие) и куры, у которых происходит трансовариальная передача возбудителя. Основные факторы передачи - молоко, мясо, яйца, субпродукты, особенно печень свиней
и крупного рогатого скота, а также вода. Заражение происходит алиментарным и водным путями. Заражающая доза значительно больше, чем при брюшном тифе и паратифах: от 106 до 108 микробных клеток.
Патогенез и клиническая картина. Заболевание чаще протекает в локальной форме гастроэнтерита, ведущим синдромом которого является развитие воспалительной диареи. Инкубационный период 12-72 ч. Инвазировав слизистую оболочку тонкой кишки через М-клетки и проникнув в подслизистую оболочку, сальмонеллы захватываются макрофагами. Некоторые макрофаги под действием эффекторных молекул ТТСС-1 (sopB) подвергаются апоптозу, выделяя при этом провоспалительные медиаторы IL-8 и IL-1b, которые, стимулируя развитие воспалительной реакции, вызывают приток полиморфно-ядерных клеток. Последние выделяют простагландины, которые повышают уровень цАМФ, что влечет за собой поступление в просвет кишечника ионов Na, Cl и как следствие потерю воды клетками слизистой оболочки и развитие диареи (рис. 16.3). В результате того факта, что в подслизистой оболочке осмотическое давление ниже, чем в просвете кишечника, экспрессия эффекторных молекул ТТСС-1 снижается. Поэтому для развития симптомов заболевания требуется попадание в организм большой инфицирующей дозы сальмонелл. Добавочным накоплением простагландинов и активации ими аденилатциклазы клеток lamina propria является активация каскада арахидоновой кислоты эндотоксином, который накапливается в результате гибели сальмонелл.
Кроме того, некоторые сальмонеллезные серовары вырабатывают белковый энтеротоксин, который непосредственно активи- рует Са-зависимую аденилатциклазу эпителиальных клеток крипт тонкой кишки, вызывая повышение уровня цАМФ, нарушение водно-солевого баланса и развитие диареи.
Клиническая картина сальмонеллеза характеризуется лихорадкой, поносом, рвотой, приводящих к обезвоживанию организма, абдоминальными болями, которые являются результатом возникающего воспаления.
При нарушении барьерной функции лимфатического аппарата кишечника происходит генерализация процесса и возникает бактериемия, в результате которой сальмонеллы заносятся в различные внутренние органы и костный мозг, формируя вторичные гной-
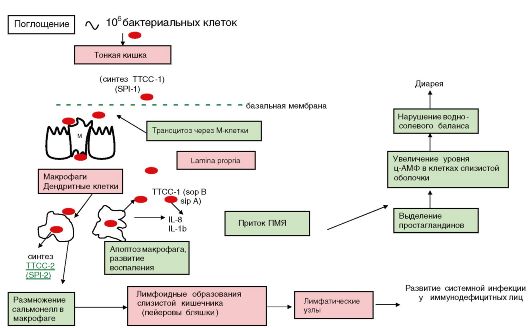
Рис. 16.3. Механизм развития воспалительной диареи при сальмонеллезе
ные очаги (септико-пиемическая форма). Патогенез возникновения тифоподобной формы аналогичен патогенезу брюшного тифа и паратифов. Системная инфекция возникает в 5-10% случаев и встречается в основном у иммунодефицитных лиц.
Иммунитет ненапряженный, серовароспецифический, опосредованный секреторным IgA, который предотвращает процесс пенетрации сальмонеллами слизистой оболочки тонкой кишки. В крови могут определяться антитела, которые являются свидетелями инфекционного процесса.
Микробиологическая диагностика проводится бактериологическим и серологическим методами. Бактериологическому исследованию подвергают испражнения, рвотные массы, промывные воды желудка, желчь, костный мозг, кровь (при системных формах заболевания).
Серологическое исследование включает РПГА и ИФА. Важное диагностическое значение имеет нарастание титра антител в дина- мике заболевания.
Профилактика. Основную роль играет специфическая профилактика среди сельскохозяйственных животных и птиц. Большое значение имеет неспецифическая профилактика, включающая проведение ветеринарно-санитарных мероприятий, направленных на предупреждение распространения возбудителей среди сельскохозяйственных животных и птиц, а также соблюдение санитарно- гигиенических правил на мясоперерабатывающих предприятиях, при хранении мяса и мясных продуктов, приготовлении пищи, правильная кулинарная и термическая обработка пищевых продуктов.
Лечение. Проводится патогенетическая терапия, направленная на нормализацию водно-солевого обмена, при системных формах - этиотропная антибиотикотерапия.
Внутрибольничный (нозокомиальный) сальмонеллез
Этиология. Возбудителями внутрибольничного сальмонеллеза являются полиантибиотикорезистентные штаммы различных сероваров S. enterica, среди которых наиболее часто встречаются S. Typhimutium, S. Enteritidis, S. Virhov, S. Infants, S. Haife.
Госпитальные штаммы сальмонелл представляют собой особую биологическую разновидность. Для них характерны наличие крип- тической плазмиды с характерной для определенного серовара молекулярной массой, отсутствие типируемости типовыми бактериофагами, изменение биохимических свойств.
Эпидемиология. Источником инфекции и основным резервуаром возбудителей являются дети и взрослые (больные и бактерионосители), находящиеся или поступающие в стационар. В эпидемический процесс вовлекаются прежде всего дети в возрасте до 1 года, особенно новорожденные, а также взрослые пациенты хирургических и реанимационных отделений, перенесшие обшир- ные оперативные вмешательства, лица пожилого и старческого возраста, больные с тяжелой соматической патологией, сопровождающейся иммунодефицитом.
Передача сальмонелл при внутрибольничном сальмонеллезе осуществляется воздушно-пылевым (при вдыхании воздуха, со- держащего пылевые частицы с адсорбированными на них сальмонеллами), контактно-бытовым (через предметы обихода, посуду, грязные руки персонала), алиментарным путями. Заражающая доза - от 1000 до 10 000 микробных клеток.
Клиническое течение. Характеризуется длительным инкубационным периодом - от 8 до 43 сут. Проявление болезни варьирует от бессимптомного носительства до выраженных кишечных расстройств с развитием системной инфекции, осложненной септикопиемией.
Иммунитет не формируется. Профилактика осуществляется поливалентным бактериофагом. Проводят этиотропную антибиоти- котерапию.
16.2.1.5. Протеи (род Proteus)
Род Proteus включает 5 видов, из которых в патологии человека наибольшее значение имеют два вида: P. vulgaris и P. mirabilis, которые впервые были выделены Г. Хаузером в
Морфология. Палочки размером 0,4-0,6x1-3 мкм, располагающиеся попарно или цепочками, не образуют капсулу, подвижны.
Культуральные свойства. Хорошо растут на обычных питательных средах. На плотных средах образуют два типа колоний. В Н-форме (от нем. Hauch - дыхание) колонии роятся, образуя дочерние отростки. Это типичная форма роста. При неблагоприятных условиях, в частности при росте на средах с добавлением желчи, образуют О-формы (от нем. ohne Hauch - без дыхания) колоний: крупные, с ровными краями.
Физиология. Обладают выраженной биохимической активностью. Являются гнилостными микроорганизмами, способными окислять белки до α-кетокислот и аммиака. Основными биохимическими признаками, отличающими от других представителей семейства Enterobacteriaceae, являются:
• продукция фенилаланиндезаминазы;
• расщепление мочевины;
• продукция сероводорода;
• отсутствие расщепления лактозы;
• разжижение желатины.
Внутри рода подразделяются на виды на основе биохимических свойств. P. mirabilis, в отличие от P. vulgaris, утилизирует цитрат, не продуцирует индол и обладает орнитиндекарбоксилазой.
Антигенная структура. Обладают О- и Н-антигенами.
Резистентность. Устойчивы к воздействию факторов окружающей среды. Переносят нагревание до 60 ?С в течение 1 ч. Длительно сохраняется жизнеспособность в слабых растворах фенола и других дезинфицирующих веществ.
Экология. Входят в состав факультативной микрофлоры толстой кишки и влагалища. Можно обнаружить в сточных водах.
Патогенез. Вызывают гнойно-септическую инфекцию, дисбактериоз кишечника, внутрибольничную инфекцию. Наиболее часто протей вызывает инфекцию мочевыводящей системы. В патогенезе инфекции мочевыводящих путей, вызванных протеем, важную роль играет продуцируемая им уреаза, которая, расщепляя мочеви- ну, вызывает высвобождение аммиака, что повышает рН. Защелачивание мочи снижает растворимость кальция и магния, создавая благоприятные условия для отложения кальциевых и магниевых солей и образования почечных камней. Помимо уреазы в развитии инфекционной патологии принимают участие гемолизин, гиалу- ронидаза, фимбрии. Перитрихиальные фимбрии протея, которых насчитывается 6 типов, вызывают колонизацию мочевого тракта, приводящую к развитию пиелонефрита, а также колонизацию с образованием биопленки мочевыводящих катетеров.
Профилактика и лечение. Специфическая профилактика не разработана. Для лечения используют колипротейный бактериофаг и проводят этиотропную антибиотикотерапию.
Иммунитет. Протективный иммунитет не формируется.
Микробиологическая диагностика. Используют бактериологический метод исследования. Посев материала производят на лакто-
зосодержащие дифференциальные среды и на скошенный агар по методу Щукевича (в конденсационную воду, в месте скоса агара). Выделенную культуру идентифицируют по биохимическим свойствам.
16.2.1.6. Иерсинии (род Yersinia)
Род Yersinia включает 11 видов, из которых в патологии человека основное значение имеют 3 вида: возбудитель чумы Y. pestis и энтеропатогенные иерсинии, возбудитель псевдотуберкулеза Y. pseudo- tuberculosis и возбудитель кишечного иерсиниоза Y. enterocolitica.
Род получил название по имени А. Иерсена, который в
Замечательное свойство иерсиний - их способность размножаться при различных температурах, что позволяет им приспосабливаться к меняющимся внешним условиям. Так, Y. pestis раз- множается в организме блохи при температуре внешней среды, а в организме млекопитающих при 37 ?С. Еще более выражена факультативная психрофильность у энтеропатогенных иерсиний, Y. pseudotuberculosis и Y. enterocolitica, они способны размножаться в различных почвах, водоемах и на овощах при 4 ?С.
Все виды иерсиний независимо от путей проникновения в организм хозяина обладают способностью сохраняться в лимфо- идной ткани, размножаясь в макрофагах. Эта способность обеспечивается плазмидой, pYV (pCad), кодирующей ТТСС, которая секретирует белки, вовлеченные в процесс экскреции эффекторных белков (Ysc), эффекторные белки, Yops (от англ. Yersinia outermembrane proteins), обладающие антифагоцитарной активностью, и белок-регулятор их экспрессии LCR, ранее обозначавшийся как Vi-антиген. Среди белков, обладающих антифагоцитарной актив- ностью, различают YopH, который, являясь тирозинфосфатазой, ингибирует респираторный взрыв, YopT, разрушающий актиновые филаменты фагоцита, и YopP, вызывающий апоптоз.
Y. pestis, Y. pseudotuberculosis серовара О1 и Y. enterocolitica биотипа 1В обладают островком высокой патогенности, функционирование которого связано с утилизацией железа и необходимо для экспрессии вирулентности.
В связи со своей способностью размножаться при различных температурах и в различных местах обитания иерсинии выработа-
ли два механизма, контролирующих экспрессию генов, кодирующих факторы патогенности. Один механизм реагирует на изме- нение температуры, другой - на концентрацию ионов кальция. Плазмида pYV функционирует при 37 ?С и низкой концентрации ионов Са.
16.2.1.6.1. Возбудитель чумы (Y. pestis)
Чума - острая природно-очаговая инфекция, относящаяся к группе карантинных (конвенционных), характеризующаяся тяжелой интоксикацией, лихорадкой, поражением лимфатических узлов, легких, сепсисом и высокой летальностью.
Морфология. Y. pestis является неподвижной палочкой размером 1,5x0,7 мкм, овоидной формы, с биполярным окрашиванием анилиновыми красителями, напоминающей по форме английскую булавку. Имеет нежную капсулу.
Культуральные свойства. Факультативный анаэроб. Растет на простых питательных средах. Оптимальная температура роста 28 ?С, но может расти в широком диапозоне температур от 2 до 40 ?С. Для ускорения роста в питательные среды добавляют стимуляторы, сульфит натрия и гемолизированную кровь. При росте на плотных питательных средах через 8-12 ч появляются колонии в виде битого стекла. Через 18-20 ч инкубации вирулентные бактерии образуют колонии в R-форме, которые имеют форму кружевных платочков со светлым центром и фестончатыми края- ми. Бактерии с пониженной вирулентностью образуют колонии в S-форме. На жидких средах растут в виде пленки, от которых спускаются нити, напоминающие пещерные сталактиты; на дне образуется хлопьевидный осадок.
Биохимическая активность достаточно выражена. Основные биохимические свойства, использующиеся для дифференциации внутри рода: не ферментируют рамнозу, сахарозу, не расщепляют мочевину, ферментирует декстрин.
По отношению к утилизации глицерина подразделяется на хемовары.
Антигенная структура. Обладает комплексом антигенов, многие из которых относятся к факторам патогенности. Имеет термостабильный О-антиген и термолабильный капсульный антигены. Протективной активностью обладает F1-антиген и LCR-белок. Имеет антигены, общие с антигенами эритроцитов 0-группы крови человека.
Резистентность. Микроб обладает психрофильностью. При понижении температуры увеличиваются сроки выживания бактерий. При -22 ?С бактерии сохраняют жизнеспособность 4 мес, в замороженных трупах и блохах - до 1 года. При нагревании до 50 ?С гибнет в течение 10 мин, до 100 ?С - в течение 1 мин. Чувствителен к сулеме в концентрации 0,1%, к 3-5% растворам лизола и фенола, УФ-облучению.
Эпидемиология. Чума относится к природно-очаговым инфекциям. Природные очаги чумы существуют на всех континентах, кроме Австралии и Антарктиды. В России такими очагами являются регионы Закавказья и Поволжья. Основными носителями возбудителя чумы в природных очагах являются грызуны (суслики, сурки, песчанки, тарбаганы, около 300 видов животных). У грызунов, впадающих зимой в спячку, чума протекает в хронической латентной форме. Эти животные являются источником инфекции в межэпидемический период. Вторичные очаги, связанные с деятельностью человека, обнаруживаются в географических зонах между 35? северной широты и 35? южной широты. В них источниками и хранителями возбудителя служат домовые виды крыс и мышей, от них заражаются некоторые виды домашних животных, в частности верблюды и, возможно, кошки.
Специфическими переносчиками в обоих типах очагов служат блохи вида Xenopsylla cheopsis. В инфицированной блохе возбуди- тель размножается в преджелудке, а при кровососании человека попадает в его кровь. Человек может заражаться:
• в очаге трансмиссивно через укусы инфицированных блох вида Xenopsylla cheopsis;
• при контакте с инфицированными животными (разделка шкур и мяса зараженных животных);
• алиментарным путем (редко) при употреблении в пищу продуктов, обсемененных чумным микробом;
• аэрогенно от больного с легочной формой чумы. Восприимчивость людей к чуме очень высокая. Эпидемии чумы
обычно следуют
за эпизоотиями. В истории человечества известны три пандемии чумы.
Первая, «юстинианова чума», свирепствовала в странах Ближнего Востока,
Египта в VI веке и вызвала гибель около 100 млн человек. Вторая
пандемия, известная под названием «черная смерть», была занесена из
Азии в Европу в
Европы. Третья пандемия началась в
Вследствие своей контагиозности, возможности аэрогенного инфицирования человека и устойчивости в аэрозоле Y. pestis вхо- дит в 1-ю группу потенциальных агентов биологического терроризма.
Патогенность. Y. pestis обладает многочисленными факторами патогенности, генетическая детерминация которых осуществляется как хромосомой, так и тремя плазмидами. Плазмида pYV де- терминирует синтез ТТСС (Ysc-Yops), эффекторные белки которой обладают антифагоцитарной активностью. Антифагоцитарная активность обеспечивается также факторами патогенности, гены которых имеют хромосомную локализацию: внеклеточной аденилатциклазой, супероксиддисмутазой и белком рН6.
Крупная плазмида pFra детерминирует синтез F1-антигена, капсульного белка, препятствующего поглощению микроба фагоцитами, и F2-фракции мышиного токсина, который не играет роли в патогенезе чумы у людей, но необходим в процессе колонизации кишечника блохи.
Синтез ферментов патогенности: плазмокоагулазы (активирующей плазминоген протеазу), обеспечивающую резистентность к действию комплемента, фибринолизина и пестицина, - регулиру- ется малой плазмидой pPst.
Патогенез и клиническая картина. Инкубационный период 3- 7 дней. Заболевание характеризуется острым началом, лихорадкой, ознобом, сильной головной болью, тошнотой и рвотой. Клинические проявления зависят от способа заражения. Различают бубонную, септическую и легочную формы. Редко встречаются кожная и кишечная формы заболевания.
Бубонная форма возникает при укусе блох и прямом контакте с зараженным животным. От места внедрения возбудитель с током лимфы заносится в регионарные лимфатические узлы, где происходит его интенсивное размножение. В результате незавершенности фагоцитоза в лимфатических узлах развивается серозно-геморрагическое воспаление с образованием увеличенного в размерах очень болезненного лимфатического узла - бубона. Вследствие утраты лимфатическим узлом барьерной функции микроб попадает в кровяное русло и разносится кровью по организ-
му, поражая другие лимфатические узлы с развитием вторичной бубонной формы, а также различные органы и ткани, где формируются септико-пиемические очаги. Септическая форма заболевания может развиться непосредственно после укуса блохи или прямого контакта с инфицированным материалом. Наиболее тяжелой является легочная форма заболевания, которая может возникнуть как в результате гематогенного заноса в легкие возбудителя из бубона, так и при аэрогенном заражении от больного с легочной формой чумы или в результате использования возбудителя в качестве агента биологического терроризма. При легочной форме развивается пневмония, сопровождающаяся серозно-геморрагическим экссудатом, содержащим большое число микробов, «кровавым» кашлем и легочной недостаточностью. При прогрессировании заболевания у больного развивается помрачение сознания, он может впасть в кому. При нелеченой бубонной форме летальность составляет около 60%, нелеченая легочная форма характеризуется высокой - до 95-100% - летальностью.
Иммунитет. Протективная активность обеспечивается главным образом клеточным иммунным ответом, реализующимся через иммунные макрофаги. Иммунитет ограничен по длительности и напряженности. Описаны случаи повторных заболеваний.
Микробиологическая диагностика проводится в специальных лабораториях, работающих в соответствии с инструкциями о режиме работы противочумных учреждений. Для диагностики используют бактериологический, биологический, бактериоскопический и серологические методы исследования. Материалом для исследования являются пунктаты бубона, мокрота, отделяемое кожных язв, рвотные массы, кровь, трупный материал. Материал засевается на жидкие и плотные питательные среды, которые инкубируют при 28 ?С в течение 12-20 ч. Биопробу ставят на морских свинках пу- тем втирания исследуемого материала в скарифицированную кожу брюшной стенки животного. В качестве экспресс-диагностики используют РИФ, ПЦР, фагодиагностику. Серологическое исследование проводится постановкой ИФА, РНГА с применением парных сывороток.
Профилактика и лечение. Специфическая профилактика осуществляется живой вакциной из штамма EV. Поствакцинальный иммунитет непродолжительный, около 6 мес. Вакцина вводится однократно накожно или подкожно. Для массовой иммунизации вакцина вводится при помощи безыгольного инжектора. Имеется
таблетированная форма вакцины из штамма EV для перорального применения (А.А. Воробьев, Е.М. Земсков).
Неспецифическая профилактика включает надзор за эпизоотиями среди грызунов в природных очагах, борьбу с синантропными грызунами и блохами в городах, предупреждение завоза чумы на территорию страны, которое осуществляется согласно международным санитарным правилам. Вся работа с заразным Y. pestis материалом и в госпиталях для больных чумой проводится в защитных противочумных костюмах с соблюдением строгого порядка их надевания и снятия. В случае появления больного чумой проводятся карантинные мероприятия. Проводят этиотропную антибиотикотерапию.
16.2.1.6.2. Энтеропатогенные иерсинии1
Возбудители псевдотуберкулеза - Y. pseudotuberculosis и кишечного иерсиниоза - Y. enterocolotoca являются энтеропатогенными иерсиниями.
Будучи сапронозами, энтеропатогенные иерсинии распространены в природе. Они не только выживают во внешней среде, но и размножаются в различных ее объектах, воде, почве, растениях, в которые они через корневую систему попадают из почвы.
Обладают выраженной факультативной психрофильностью. Оптимум роста при 22-25 ?С. Сохраняют жизнеспособность при диапазоне температур от -15 до -25 ?С. Размножаются при 4 ?С. Размножение при низких температурах сопровождается продолжительностью стационарной фазы до 6 мес, что способствует накоплению большой биомассы бактерий. Популяция иерсиний во внешней среде поддерживается свободноживущими инфузориями вида Tetrahymena pyriformis. При этом происходит селекция устойчивых к фагоцитозу бактерий. Основными носителями возбудителей псевдотуберкулеза и кишечного иерсиниоза среди животных являются грызуны и отчасти птицы, выделяющие иерсиний с экскрементами. Остро болеют кишечным иерсиниозом домашние свиньи, в связи с этим считают, что свиное мясо может быть фактором передачи Yersinia enterocolitica.
Температурная регуляция экспрессии генов факторов патогенности обеспечивает возможность перехода энтеропатогенных иер- синий из внешней среды к существованию внутри организма.
Совместно с В.Б. Сбойчаковым.
Заражение человека иерсиниями в основном происходит алиментарным и водными путями. Факторами передачи являются пи- щевые продукты, вода. Сезонность связана со значительным накоплением иерсиний в овощах за время длительного их хранения при относительно низких температурах. Роль грызунов при этом ничтожна, так как овощи могут быть первично инфицированы иерсиниями через корневую систему.
Начальные этапы инфекции характеризуются проникновением микробов через М-клетки слизистой оболочки кишечника путем трансцитоза. В этом процессе участвуют продукт гена inv хромосомной локализации, который экспрессируется при температуре ниже 37 ?С, а также белок Ail, который обеспечивает резистентность к сыворотке. Попадание внутрь организма с температурой 37 ?С приводит к экспрессии генов плазмиды pYV, среди эффекторных белков ТТСС (Ysc-Yop) которой, помимо белков Yops с антифагоцитарной активностью, имеется цитотоксин (YopE), повреждающий стенки кишечника. Проникновение в регионарные лимфатические образования кишечника и размножение в них приводят к развитию мезентериального лимфаденита, который на- блюдается при обоих заболеваниях.
Иммунитет непрочный, нестерильный, сопровождающийся развитием ГЗТ. Антитела не обладают протективной активностью.
Микробиологическая диагностика. Применяют бактериологический и серологические методы исследования. Возбудители иерсиниозов выделяются из организма главным образом с испражнениями, где они обнаруживаются как во время болезни, так и в период рецидивов. В зависимости от формы заболевания могут быть исследованы также удаленные мезентериальные лимфатические узлы, аппендикс, гной из полостей и абсцессов, моча и смывы из зева, суставная и бронхиальная жидкость. Материал для исследования помещают в 1/15 М фосфатный буферный раствор и подвергают холодовому обогащению при 4 ?С в течение 21 дня, производя каждые 3 сут пересев на плотные среды (Эндо, Серова, Мак-Конки). Выросшие колонии идентифицируют по биохимическим свойствам, антигенной структуре и чувствительности к бак- териофагам.
Для выявления специфических антител в сыворотке крови и их динамики традиционно используют развернутую РА. Минимальный диагностический титр равен 1/160-1/200. Следует отметить,
что РА выявляет антитела лишь со 2-й нед болезни, поэтому гораздо большее диагностическое значение имеет динамика титров антител.
В то же время РНГА выявляет антитела в более ранние сроки, однако динамика увеличения титров антител здесь менее на- глядна. Для дифференцировки специфического иммунного ответа, возникающего в острой фазе болезни, от имеющихся в сыворотке так называемых фоновых антител наиболее целесообразно использовать ИФА для определения специфических иммуноглобулинов различных классов - М и G. Наличие IgM-антител свидетельству- ет об острой инфекции.
Профилактика и лечение. Специфическая профилактика не разработана. Проводится этиотропная антибиотикотерапия.
Возбудитель псевдотуберкулеза (Y. pseudotuberculosis) впервые был описан в
Биохимически внутри вида возбудитель однороден. Отличительными признаками являются ферментация рамнозы и отсут- ствие ферментации сахарозы.
По строению О-антигена подразделяется на 8 сероваров. Имеет Н-антиген.
Псевдотуберкулез - инфекционное заболевание, характеризующееся полиморфностью клинической картины, затяжным течением, аллергизацией организма. Резервуаром возбудителя в природе являются многие виды млекопитающих, в основном грызуны, выделяющие микроб с испражнениями, а также вода, почва, растения, в которых накапливается микроб. Человек заражается водным и алиментарным путями. Основными факторами передачи являются вода и сырые овощи. Заражения человека от больного или носителя не происходит. Болезнь распространена повсеместно, возникает в виде спорадических или эпидемических вспышек. Инкубационный период 3-10 дней. Заболевание протекает в локальной форме мезентериального лимфаденита или генерализованной форме, которая возникает при прорыве лимфатического
барьера и развитии бактериемии, в результате которой микроб разносится по организму, вызывая образование гранулем в суставах, печени, селезенке, легких. Генерализованная форма протекает в виде скарлатиноподобной, абдоминальной, желтушной, артралгической и смешанной форм. Наблюдается сильная аллергизация организма. Возможен летальный исход.
В отличие от Yersinia enterocolitica возбудитель псевдотуберкулеза имеет дополнительные факторы патогенности: антифагоцитар- ный фактор рН6 и суперантиген YPM, с которым связывают генерализацию процесса, аллергизацию организма, развитие узловой эритемы.
Возбудитель кишечного иерсиниоза (Yersinia enterocolitica) впервые описан Дж. Шлейфстейном и М. Калеманом в
Обладает выраженной биохимической активностью. Внутри вида по спектру биохимической активности (индолообразование, утилизация эскулина, реакция Фогеса-Проскауэра) подразделяется на 5 хемоваров. В отличие от Y. pseudotuberculosis, ферментирует сахарозу, продуцирует ортнитиндекарбоксилазу, не ферментирует рамнозу.
По строению О-антигена подразделяется более чем на 70 сероваров. Наиболее часто заболевание у человека вызывают серовары
О3, О5, О9, О8.
Резервуаром возбудителя в природе являются вода, почва, растения. Инфицированные вода и растения способствуют распро- странению инфекции среди сельскохозяйственных животных, крупного рогатого скота, свиней. Основные пути передачи водный и алиментарный через воду, молоко, овощи.
Кишечный иерсиниоз - инфекционное заболевание с поражением тонкой и толстой кишки и развитием мезентериального лимфаденита.
Инкубационный период составляет в среднем 2-3 сут. Различают гастроинтестинальную, абдоминальную, генерализованную и вторично-очаговую формы болезни. У иммунодефицитных лиц может возникнуть сепсис. Болезнь может протекать хронически в виде «здорового бактерионосительства» до 1,5-2 лет. В развитии кишечной симптоматики и диареи принимают участие цитотоксин (YopE) и детерминируемый хромосомным геном термостабильный энтеротоксин (Yst).
16.2.2. Вибрионы (семейство Vibrionaceae)
Семейство Vibrionaceae включает 3 рода: Vibrio, Aeromonas, Plesiomonas. Они являются обитателями водных поверхностей земного шара как морских, так и пресноводных, являясь во многих случаях симбионтами водной фауны. Морфологически представляют грамотрицательные изогнутые палочки, не образующие спор, подвижные за счет полярно расположенных жгутиков. Большинство из них оксидазоположительны. Обладают как ферментативным, так и окислительным типом метаболизма. Неприхотливы к питательным средам. В связи с тем что большинство из них являются естественными обитателями морей, для их культивирования следует в питательные среды добавлять от 0,5-2% NaCl.
16.2.2.1. Возбудитель холеры (Vibrio cholerae)
Холера - острая инфекционная болезнь, характеризующаяся поражением тонкой кишки, нарушением водно-солевого обмена и интоксикацией. Это особо опасная карантинная инфекция. Возбудителем холеры являются представители вида Vibrio cholerae серогрупп О1 и О139.
Возбудители холеры относятся к роду Vibrio, семейства Vibrionaceae. Внутри вида Vibrio cholerae различают два основных биовара: биовар cholerae classic, открытый Р. Кохом в
Морфология. Холерный вибрион - грамотрицательная палочка в форме запятой, длиной 2-4 мкм, толщиной 0,5 мкм. Не образует спор и капсулы, монотрих, чрезвычайно подвижен.
Культуральные свойства. Является факультативным анаэробом, но предпочитает аэробные условия роста, поэтому на поверхности жидкой питательной среды образует пленку. Холерный вибрион неприхотлив в росте и может расти на простых средах. Оптимальная температура роста 37 ?С и рН 8,5-9,0. Для оптимального роста требует присутствия в среде 0,5% натрия хлорида. Средой накопления является 1% щелочная пептонная вода, на которой он образует пленку в течение 6-8 ч. Элективной средой является TCBS-среда (тиосульфат-цитратный сахарозо-желчесодержащий агар), на котором образует колонии желтого цвета. Щелочной агар и триптонсоевый агар (ТСА) используют для субкультивирования.
Биохимические свойства. Биохимически активен. Оксидазоположителен. Обладает протеолитическими и сахаролитическими свойствами: продуцирует индол, лизиндекарбоксилазу, разжижает в воронковидной форме желатин, сероводород не продуцирует. Ферментирует глюкозу, сахарозу, маннозу, крахмал, лактозу (мед- ленно). Не сбраживает рамнозу, арабинозу, дульцит, инозит, инулин. Обладает нитратредуктазной активностью.
Холерные вибрионы различаются по чувствительности к бактериофагам. Классический холерный вибрион лизируется бактериофагами IV группы по Mukerjee, вибрион биовара Эль-Тор - бактериофагами V группы. Дифференциация среди биоваров возбудителей холеры проводится по биохимическим свойствам, а также по способности гемолизировать эритроциты барана, агглютинировать куриные эритроциты; чувствительности к полимиксину и чувствительности к бактериофагам. Биовар El-Tor резистентен к полимиксину, агглютинирует куриные эритроциты и гемолизирует эритроциты барана, дает положительный результат в реакции Фогеса-Проскауэра и гексаминовом тесте. V. diolerae О139 по фенотипическим признакам относится к биовару El-Tor.
Антигенная структура. Холерный вибрион обладает О- и Н-антигенами. В зависимости от строения О-антигена различают более 200 серогрупп, среди которых возбудителями холеры являются серогруппы О1 и О139. Внутри серогруппы О1 в зависимости от сочетания А-, В- и С-субъединиц происходит подразделение на серовары: Огава (АВ), Инаба (АС) и Гикошима (АВС). Вибрионы серогруппы О139 агглютинируются только сывороткой О139. Н-антиген является общеродовым антигеном.
Факторы патогенности. Главными факторами патогенности являются холерный энтеротоксин (СТ), токсинкорегулируемые пили (Тср), нейраминидаза и растворимая гемагглютининпротеаза.
Токсинкорегулируемые пили являются пилями IV типа, которые обеспечивают колонизацию микроворсинок тонкой кишки, участвуют в образовании биопленок на поверхности панциря гидробионтов, а также являются рецепторами для конвертирующего бактериофага СТХ.
Холерный энтеротоксин - белок с молекулярной массой 84 000 Д, синтез которого осуществляется геном, локализованном на бактериофаге СТХ. Только серогруппы О1 и О139 лизогенизированы этим бактериофагом. Токсин состоит из 1 субъединицы А и 5 субъединиц
В. Субъединица А состоит из 2 полипептидных цепочек А1 и связанных между собой дисульфидными мостиками. В субъединичном комплексе В 5 одинаковых полипептидов соединены друг с другом нековалентной связью в виде кольца. В-субъединицы ответственны за связывание всей молекулы токсина с клеточным рецептором, которым является моносиаловый ганглиозид GM1, им очень богаты эпителиальные клетки слизистой оболочки тонкой кишки. Для того чтобы В-субъединицы могли взаимодействовать с рецептором GM1, от него должна быть отщеплена сиаловая кислота, что осуществляется ферментом нейраминидазой, которая способствует реализации действия токсина. Прикрепление В-субъединичного комплекса к мембране кишечного эпителия позволяет субъединице А1 проникнуть в клетку, где она активирует аденилатциклазу, переводя ее в постоянное активное состояние, следствием чего является усиление синтеза цАМФ. Под влиянием цАМФ в кишечнике изменяется активный транспорт ионов. В области крипт эпителиоцитами усиленно выделяются ионы Cl-, а в области ворсинок затрудняется всасывание Na и Cl, что составляет осмотическую основу для выделения в просвет кишечника воды.
Растворимая гемагглютининпротеаза играет важную роль в откреплении возбудителя от поверхности кишечника в результате ее деструктивного действия на рецепторы кишечного эпителия, ассоциированные с вибрионами, давая возможность возбудителю инфицировать новые участки тонкой кишки. Кроме того, у холерного вибриона имеется эндотоксин, который, активируя каскад арахидоновой кислоты, запускает синтез простагландинов, результатом действия которых являются сокращение гладкой мускулатуры кишечника и развитие тенезм, а также добавочные белковые токсины (zonulo и энтеротоксины), которые участвуют в увеличении проницаемости стенки кишечника.
Отношение к факторам окружающей среды. Возбудители холеры чувствительны к УФ-лучам, высушиванию, дезинфектантам (за исключением четвертичных аминов), кислым значениям рН, нагреванию. Источниками инфекции являются больной человек, бактерионосители, а также водная среда и гидробионты. Носительство вибриона Эль-Тор встречается чаще, чем классического вибриона (на 1 больного холерой приходится 10-1000 носителей). Возбудитель холеры, особенно биовар Эль-Тор, способен к существованию в воде в симбиозе с гидробионтами, водорослями,
в неблагоприятных условиях может переходить в некультивируемую форму. Эти свойства позволяют отнести холеру к антропонозно- сапронозным инфекциям.
Эпидемиология. Холера
известна с древних времен. Но до начала XIX века она встречалась
только в Индии, где в устье рек Ганг и Брахмапутра расположен
гиперэндемический очаг этого заболевания. В
Клиническая картина. Инкубационный период от 2 ч до 6 дней. Болезнь развивается остро с повышения температуры тела до 38-39 ?С, рвоты, поноса, болей в животе, тенезм. Стул имеет вид рисового отвара. Резкое обезвоживание приводит к нарушениям деятельности сердечно-сосудистой и дыхательной систем, развитию почечной недостаточности. При отсутствии лечения болезнь может перейти в стадию холерного алгида (от лат. algidus - холодный), характерным признаком которого является снижение температуры тела до 34 ?С. При отсутствии лечения холерный алгид заканчивается летально.
Иммунитет непрочный, непродолжительный.
Микробиологическая диагностика. Основу микробиологической диагностики составляют выделение и идентификация возбудителя. Материалом для исследования служат испражнения, рвотные массы, пищевые продукты, вода, гидробионты, смывы с объектов окружающей среды. Материал засевается на элективную питательную среду, TCBS-агар с последующим субкультивированием на неселективных средах и идентификацией по антигенной структуре и биохимическим свойствам. Дополнительно факультативно можно сделать посев и на щелочную пептонную воду с последующим субкультивированием на TCBS-агаре. Для экспресс-диагностики используют РИФ и ПЦР.
Профилактика холеры направлена главным образом на выполнение санитарно-гигиенических требований и проведение карантинных мероприятий. Для специфической профилактики, имеющей вспомогательное значение, применяют холерную убитую вакцину и комплексный препарат, состоящий из холерогена-анатоксина и О-антигена сероваров Огава и Инаба. Для лечения проводится патогенетическая терапия, направленная на нормализацию водно- солевого обмена, и этиотропная антибиотикотерапия.
16.2.2.2. Другие вибрионы
Негалофильные патогенные вибрионы. V. cholerae non O1/O139 являются естественными обитателями пресных и умеренно соленых водоемов. Наиболее часто их обнаруживают в Юго-Восточном и Юго-Западном регионах с жарким тропическим климатом. По строению О-антигена определено более 200 серологических групп. Они вызывают заболевания от диарей, которые носят спорадический характер или проявляются в виде групповых вспышек, до системных заболеваний с внекишечной локализацией, включая септицемии. Холерные вибрионы не О1 и не О139 способны продуцировать термолабильный токсин, сходный, но не идентичный холерному энтеротоксину, цитолизин, гемолизин, термостабильные токсины, ответственные за развитие диарей.
Помимо вида V. cholerae, еще 12 видов рода Vibrio способны вызвать заболевание у человека. Вибрионы многих видов являются галофильными, они обитают в морях, концентрация соли в воде которых колеблется от 5 до 30%, поэтому при культивировании в искусствен- ных условиях они требуют присутствия в питательных средах 2-3% концентрации NaCl. Они обладают выраженной биохимической активностью, их дифференциация проводится по биохимическим свойствам и тесту тяжа (string-test). Среди галофильных вибрионов по частоте и тяжести вызываемых ими заболеваний особое место занимают парагемолитические вибрионы. V. parahaemolyticus явля- ется обитателем акваторий, омывающих Японию, Юго-Восточную Азию, Латинскую Америку. Заражение происходит при использовании в пищу термически не обработанных обитателей моря. Больной человек не представляет опасности для окружающих, если исключена возможность инфицирования им пищевых продуктов. Отличительными биохимическими признаками V. parahaemolyticus является неспособность ферментировать сахарозу, целлобиозу, салицин. Возбудитель обладает лизиндекарбоксилазой. Патогенность обусловле-
на продукцией энтеротоксина, термолабильного и прямого термостабильного гемолизина, который обладает кардиотоксическим и энтеротоксическим свойством. Антигенная структура представлена О-антигеном (12 сероваров) и К-антигеном (66 сероваров). Каждый К-антиген сочетается с определенным О-антигеном, образуя ту или иную серогруппу. К группе галофильных вибрионов, которые вызывают преимущественно септицемии или раневые инфекции, относят V. vulnificus, V. damsela, V. alginolyticus. V. vulnificus обитает в прибрежных водах и устьях рек Тихоокеанского и Атлантического побережья. Микроб вызывает у людей первичный сепсис, раневые инфекции, в основном у лиц, занимающихся ручной разделкой продуктов моря. Синдром первичного сепсиса может развиться после употребления в пищу сырых моллюсков, как правило, у лиц с иммунодефицитом. V. vulnificus продуцирует лизиндекарбоксилазу, ферментирует целлобиозу, салицин, лактозу. Патогенность связана с наличием капсулы, выработкой коллагеназы, фосфолипазы, цитотоксина.
Среди вибрионов известна также группа способных к биолюминесценции вибрионов (V. phosphorescens, V. albensis).
Для микробиологической диагностики используют бактериологический метод. Для идентификации галофильных вибрионов применяют те же среды, что и для возбудителей холеры, но с увеличением до 1,5% натрия хлорида. Материалом для исследования в зависимости от характера заболевания являются испражнения, рвотные массы, желчь, раневое отделяемое, кровь, спинномозговая жидкость.
16.2.2.3. Аэромонады (род Aeromonas)
Род Aeromonas включает 12 видов, из которых в патологии человека имеют значение A. hydrophila, A. caviae, A. veronii подвида sobria.
Морфология. Аэромонады являются грамотрицательными палочками, подвижные, имеют капсулу. Подвижность связана с наличием полярного жгутика. Некоторые виды при росте на плотных питательных средах образуют пучок жгутиков.
Культуральные свойства. Факультативные анаэробы. Оксидазо- и каталазоположительны. Растут на простых питательных средах, на щелочной пептонной воде. На кровяном агаре образуют прозрачный гемолиз. На лактозосодержащих дифференциальных средах образуют лактозоотрицательные колонии. Обладают при-
родной устойчивостью к β-лактамным антибиотикам и вибрионоцидам. Поэтому средой для их выделения является кровяной агар с добавлением 15 мг/л ампициллина.
Биохимические свойства. Биохимически активны. Продуцируют индол, разжижают желатин. Дифференциация их проводится по биохимическим тест-системам для представителей Enterobacteriaceae.
Антигенная структура. По строению О-антигена подразделяются на 44 серогруппы. В патологии человека важную роль играют серогруппы О11, О16, О34.
Факторы патогенности. Адгезины: филаментозные адгезины, белковый S-слой, белки наружной мембраны. Токсические субстанции: цитотоксин (аэролизин, цитолизин), термолабильный энтеротоксин, не имеющий антигенного перекреста с холерным токсином, термостабильный энтеротоксин, имеющий антигенный перекрест с холерным токсином гемолизин, термостабильная серинпротеаза, 2 термостабильных металлопротеазы, фосфолипаза, хитиназа.
Эпидемиология. Естественная среда обитания - водная система. У человека вызывают гастроэнтериты, раневую инфекцию, септицемию (у иммунодефицитных лиц).
Диагностика. Проводят бактериологическое исследование. При выделении возбудителя из фекалий посев производят на щелочную пептонную воду. После ночной инкубации делают пересев на кровяной агар с ампициллином. При выделении из раны: мазок из гноя непосредственно засевают на кровяной агар с ампициллином и параллельно на щелочную пептонную воду. Колонии, выросшие на кровяном агаре, окруженные зоной гемолиза, исследуют на наличие оксидазы и каталазы и проводят биохимическую идентификацию для энтеробактерий.
Лечение. Этиотропная антибиотикотерапия.
16.2.3. Гемофильные бактерии (род Haemophilus)
Таксономическое положение. Бактерии рода Haemophilus относятся к семейству Pasteurellaceae.
В названии рода Haemophilus (от греч. haima - кровь, philos - любить) отражена зависимость этих бактерий от крови или ее производных при росте на искусственных питательных средах. Среди представителей рода описано около 20 видов бактерий. Гемофильные бактерии - это мелкие грамотрицательные палочки,
которые культивируют на обогащенных питательных средах, содержащих кровь или ее компоненты в качестве факторов роста (см. ниже). Многие микроорганизмы этого рода в норме обитают на слизистых оболочках дыхательных путей человека. Наиболее важная роль в патологии человека принадлежит бактериям вида Haemophilus influenzae, преимущественно типа b. Они вызывают инфекции с респираторным механизмом заражения (менингиты, синуситы, бронхиты и др.), преимущественно у детей. Кроме того, патогенным для человека является возбудитель мягкого шанкра H. ducreyi.
Haemophilus influenzae
Гемофильные палочки были впервые выделены русским бактериологом М.И. Афанасьевым в
Морфология и тинкториальные свойства. Гемофильные бактерии - мелкие грамотрицательные сферические, овоидные или палочковидные бактерии, которые располагаются парами в виде коротких цепочек или нитей. Они неподвижны, спор не образуют, имеют пили. Наличие капсулы является непостоянным признаком, и ее обнаружение может служить маркером вирулентности штамма (см. далее).
Культуральные свойства. Факультативные анаэробы, но лучше растут в аэробных условиях. Гемофилы не способны синтезировать гем, входящий в состав ферментов дыхательной цепи, и/или НАД (НАДФ), являющийся кофактором окислительно- восстановительных ферментов, поэтому они нуждаются в факторах роста, присутствующих в крови: Х-факторе (протопорфирин IX в составе гематина или гемина), а также V-факторе (НАД или
НАДФ).
Для культивирования гемофильной палочки применяют шоколадный агар - питательную среду коричневого цвета, которую получают путем прогревания кровяного агара при 80 ?С в течение 15 мин. Оптимальная температура роста бактерий 35-37 ?С. Колонии появляются через 36-48 ч. Для H. influenzae характерна R-, S-диссоциация, т.е. способность к образованию R- и S-форм
колоний.
Слизистые, более крупные (диаметр 3-4 мм) радужные S-формы колоний
характерны для капсульных вирулентных штам- мов. Слабовирулентные
бескапсульные варианты гемофильной палочки образуют R-колонии - более
мелкие (около
Характерной особенностью гемофильных бактерий является «феномен кормушки» или «феномен сателлита»: они могут расти на кровяном агаре вокруг колоний стафилококков или других бактерий, вызывающих гемолиз или продуцирующих НАД. Гемофильные бактерии гемолитической активностью не обладают.
Биохимическая активность. Идентификация гемофильных палочек основана на их потребности в факторах роста (табл. 16.4 и 16.5) и некоторых биохимических тестах.
Таблица 16.4. Характеристика потребности бактерий рода Haemophilus в факторах роста
Примечание. + - наличие признака; - - отсутствие признака; X-фактор - гемин; V-фактор - НАД (НАДФ).
Таблица 16.5. Дифференциация биоваров H. influenzae
Гемофильные бактерии ферментируют глюкозу до кислоты, восстанавливают нитрат до нитрита. H. influenzae подразделяют на 8 биоваров (I-VIII) в зависимости от их способности продуцировать индол, уреазу, орнитиндекарбоксилазу. Кроме того, вид H. influenzae включает биовар aegyptius (см. табл. 16.4 и 16.5). Каталазная и оксидазная активность различны у разных видов гемофильных бактерий.
Антигенные свойства. H. influenzae обладают соматическим О-антигеном и капсульным полисахаридным К-антигеном, в за- висимости от особенностей строения которого H. influenzae делят на 6 серотипов (а, b, c, d, e, f). Капсульный антиген наиболее важного в патологии человека серотипа b гемофильной палочки представляет собой полимер рибозы и рибитола - полирибозорибитолфосфат (PRP).
Капсульные варианты гемофильных бактерий могут быть идентифицированы с помощью теста набухания капсулы или РИФ со специфическими сыворотками. Большинство вариантов H. influenzae, представителей нормальной микрофлоры верхних отделов респираторного тракта, являются бескапсульными формами, которые принято называть нетипируемыми.
Факторы вирулентности. Ведущим фактором вирулентности H. influenzae является капсула, которая защищает бактерии от фагоцитоза. Штаммы, имеющие капсулу (преимущественно серотипа b), вызывают наиболее тяжело протекающие инфекции.
Гемофильные палочки могут также продуцировать IgA-протеазу, инактивирующую секреторные антитела. IgA-протеаза и пили (фим- брии) возбудителя играют ведущую роль в прикреплении микроорганизмов к эпителию респираторного тракта и его колонизации.
ЛПС наружной мембраны H. influenzae играет роль эндотоксина, участвуя также в процессах адгезии и инвазии гемофильной палочки. Эндотоксин может также вызывать паралич ресничек мер- цательного эпителия респираторного тракта человека, способствуя тем самым микробной колонизации верхних дыхательных путей.
Резистентность. Бактерии малоустойчивы в окружающей среде. Гемофильные бактерии довольно чувствительны к нагреванию и обычным дезинфицирующим средствам. H. influenzae может продуцировать β-лактамазу, придающую ей устойчивость к некоторым β-лактамным антибиотикам.
Эпидемиология. H. influenzae патогенны только для человека.
Источник инфекции - больной человек или бактерионоситель. Ведущий механизм заражения гемофильной инфекцией - респи- раторный, путь передачи воздушно-капельный (при распылении капель секрета верхних дыхательных путей при кашле, разговоре, чиханье).
Гемофильные палочки вызывают пневмонии, средние отиты (поражение среднего уха), синуситы (воспаление придаточных пазух носа), ларинготрахеиты, бронхиты и другие инфекции дыхательных путей. Наиболее опасны менингиты и септицемии гемофильной этиологии, которым чаще подвержены дети в возрасте от 2 мес до 6 лет. Встречается гемофильная инфекция и у пациентов старшего возраста, в особенности у больных с хрони- ческой легочной патологией, сниженным иммунитетом, а также у курильщиков.
Патогенез и клиническая картина. Проникая через верхние дыхательные пути, H. influenzae прикрепляется к мерцательному эпителию и колонизирует его. Затем бактерии проникают в подслизистый слой и с помощью эндотоксина вызывают местные гнойно-воспалительные процессы.
H. influenzae, преимущественно типа b, может распространяться в организме гематогенно, вызывая септицемию, септический артрит, эндокардит. После проникновения через гематоэнцефалический барьер капсульные варианты гемофильной палочки вызывают тяжелые гнойные менингиты. Воспалительный экссудат накапливается в спинно-мозговом канале и желудочках мозга и служит хорошей питательной средой для гемофильной палочки, способствуя ее размножению. Нарушение оттока жидкости из субарахноидального пространства приводит к повышению внутричерепного давления, субдуральному отеку, а васкулит и тромбофлебит мягкой мозговой оболочки - к некротическим изменениям мозговой ткани. Гнойный менингит, вызванный H. influenzae типа b, заканчивается летально в 5% случаев даже при проведении адекватной терапии. Гнойные поражения твердой и мягкой мозговых оболочек могут приводить к тяжелым осложнениям: потере зрения, глухоте, гидроцефалии, слабоумию. H. influenzae типа b является также возбудителем острого бактериального эпиглоттита (воспаление надгортанника) у детей 2-5 лет, который приводит к нарушению проходимости дыхательных путей и асфиксии.
Иммунитет. В течение первых 3-6 мес жизни дети защищены от инфекции материнскими антителами класса IgG, полученными через плаценту. Поэтому в этом возрасте заболевания редки. PRP капсульного антигена типа b является Т-независимым антигеном, антитела к которому образуются без участия Т-хелперов. У младенцев способность синтезировать антитела к таким антигенам снижена, поэтому они не способны синтезировать необходимое количество антител к этому антигену и пик заболеваемости гемофильной инфекцией (в особенности типа b) приходится на возраст от 6 мес до 2 лет, когда концентрация материнских антител заметно снижается.
Иммунитет после перенесенной гемофильной инфекции мало изучен. Однако известно, что к 5-6 годам в сыворотке крови мно- гих детей (даже невакцинированных и непереболевших) имеются естественно приобретенные протективные антитела к капсульному антигену H. influenzae типа b (анти-PRP-антитела). Тем не менее пневмония и артрит, вызванные H. influenzae, могут развиваться у взрослых даже при наличии таких антител.
Диагностика. Симптомы гемофильных инфекций обычно определяются локализацией воспалительного процесса, а не этиологическим агентом, поэтому их диагностика базируется главным образом на выделении и идентификации возбудителя.
Материалом для исследования служат мазок из носоглотки, кровь, мокрота или ликвор, гнойное отделяемое (при отитах и синуситах), суставная жидкость (при септических артритах). Бактериоскопиче- ский метод применяют при гнойном менингите (изучение мазков из цереброспинальной жидкости, окрашенных по Граму). Для ускоренной диагностики и дифференциации гемофильной палочки от других возбудителей менингита используют тесты для обнаружения b-капсульного антигена H. influenzae: встречный иммуноэлектрофорез, прямую РИФ или реакцию латекс-агглютинации с анти-b- антителами. При высокой концентрации возбудителя в исследуемом материале возможна также постановка теста набухания капсулы.
Бактериологический метод исследования применяют для выделения и идентификации возбудителя из исследуемого материа- ла. Для дифференциации H. influenzae от других родственных им грамотрицательных палочек определяют их потребность в Х- и V-факторах роста, отсутствие гемолиза на кровяном агаре и пр. (см. табл. 16.4 и 16.5).
Лечение проводят с помощью антибиотиков. При отсутствии адекватного лечения летальность от гемофильного менингита и септицемии составляет около 90%, причем смерть может наступить в первые 24 ч от начала заболевания. Поэтому лечение назначают эмпирически до получения результатов антибиотикограммы. Препаратами выбора являются цефалоспорины III поколения (например, цефтриаксон, цефотаксим).
При синуситах, отитах и других инфекциях дыхательных путей гемофильной этиологии назначают β-лактамные антибиотики с ингибиторами β-лактамазы (например, амоксициллин с клавулановой кислотой) или бисептол.
Профилактика. Для профилактики гемофильной инфекции типа b разработана субкорпускулярная вакцина, содержащая очищенный капсульный антиген (RPR). Вакцинацию проводят по эпидемиологическим показаниям детям старше 1,5 лет из-за ее низкой иммуногенности. В России плановая вакцинация против гемофильной инфекции не проводится.
Для повышения эффективности вакцинации против H. influenza типа b предложено использовать конъюгированные вакцины, содержащие RPR-антиген на белке-носителе, например в составе комбинированной вакцины для профилактики менингококкового и гемофильного менингитов. Применение вакцины не защищает от носительства гемофильных палочек.
Haemophilus influenzae биовар aegyptius
H. influenzae биовар aegyptius (прежнее название H. aegyptius) был выделен Р. Кохом в
Морфологические, тинкториальные и культуральные свойства гемофильных бактерий биовара aegyptius не отличаются от таковых H. influenzae. Биохимические признаки, применяемые для их дифференциации, приведены в табл. 16.5.
H. influenzae биовар aegyptius вызывает гнойный конъюнктивит с высокой контагиозностью, который распространен повсеместно. Передается от человека к человеку контактным путем через грязные руки, полотенце, контактные линзы, косметику (тушь для ресниц), а также иногда респираторно. Инкубационный период составляет 1-3 дня.
Полагают также, что гемофильные палочки биовара aegyptius вызывают пурпурную (красную) бразильскую лихорадку - тяжелое инфекционное заболевание детей, которое характеризуется лихорадкой, пурпурой, шоком и заканчивается гибелью больного. Механизм заражения бразильской лихорадкой респираторный.
С целью постановки микробиологического диагноза при конъюнктивите исследуют мазок со слизистой оболочки глаз или гнойное отделяемое. Для диагностики бразильской лихорадки берут кровь пациента. Применяют бактериоскопический и бактериологический методы исследования. Идентификацию возбудителя проводят по биохимическим свойствам и с помощью реакции агглютинации со специфической сывороткой.
Лечение проводят антибиотиками. При конъюнктивите антибиотики назначают местно в форме мази или глазных капель с тетрациклином, аминогликозидами и сульфаниламидами. Специфическая профилактика не разработана.
Haemophilus ducreyi
Возбудитель мягкого шанкра был выделен русским врачом О.В. Петерсоном (1887), а подробно описан итальянским венеро- логом А. Дюкре (1890), чье имя и закреплено в названии вида.
Возбудитель мягкого шанкра Haemophilus ducreyi - типичная гемофильная бактерия (см. табл. 16.4).
Мягкий шанкр (синоним: шанкроид) - это венерическое (сексуально-трансмиссивное) заболевание, симптомы которого напоминают сифилис.
Источником инфекции является больной человек. Механизм заражения контактный, путь инфицирования половой и контактно- бытовой. Заболевание распространено в странах Африки и Южной Америки.
Инкубационный период составляет 3-5 дней, однако первые симптомы заболевания (красное пятно в месте проникновения возбудителя) можно наблюдать уже в первые сутки после инфицирования. Локально процесс представляет собой мягкую шероховатую язву со значительным отеком. Регионарные лимфоузлы увеличены и болезненны. Мягкий шанкр отличается от твердого шанкра при сифилисе болезненностью при пальпации и кровоточивостью. Язва заживает медленно, и существует риск проникновения возбудителя в кровоток. Заболевание необходимо дифференцировать с сифилисом, простым герпесом и венерической лимфогранулемой.
Иммунитет после перенесенного заболевания не вырабатывается.
Микробиологическая диагностика основана на обнаружении мелких грамотрицательных палочек в отделяемом из язвы, обычно в ассоциации с другими гноеродными микробами. При бактериологическом исследовании определяют потребность H. ducreyi в факторах роста (требует Х-фактор, но не нуждается в добавлении V-фактора; см. табл. 16.4). Растет на шоколадном агаре с добавлением ванкомицина (3 мкг/мл) при 33 ?С в атмосфере 10% СО2. На кровяном агаре H. ducreyi образуют мелкие сероватые колонии без гемолиза.
В некоторых странах для идентификации возбудителя применяют ПЦР.
Лечение проводят с помощью антибиотиков: специфическая профилактика не разработана.
Другие виды бактерии рода Haemophilus
H. parainfluenzae напоминает H. influenzae и является обычным обитателем респираторного тракта человека. Не нуждается в Х-факторе для роста (см. табл. 16.4). Вирулентность значительно ниже, чем у H. influenzae, но иногда этот возбудитель выделяется от больных пневмонией, при инфекционном эндокардите и уретрите.
H. haemoglobinophilus нуждается в Х-факторе и не требует V-фак- тора; вызывает заболевание у собак, для человека непатогенна.
H. haemolyticus встречается в норме в носоглотке человека и может вызывать инфекции верхних дыхательных путей у детей.
H. aprophilus является представителем нормальной микрофлоры полости рта и респираторного тракта и иногда обнаруживается в материале от больных при инфекционном эндокардите и пневмонии. По своим свойствам напоминает бактерии рода Actinobacillus, которые также относятся к семейству Pasteurellaceae. Эти бактерии вызывают заболевание, симптомы которого напоминают актино- микоз.
16.3. Палочки грамотрицательные аэробные
16.3.1. Бордетеллы (род Bordetella)
Бордетеллы - мелкие грамотрицательные бактерии, которые обитают в респираторном тракте человека и некоторых видах жи- вотных. Bordetella pertussis и B. parapertussis вызывают коклюш и паракоклюш у человека.
Возбудитель коклюша был открыт бельгийским бактериологом Ж. Борде и французским ученым О. Жангу в
Возбудители коклюша и паракоклюша
Таксономическое положение. Возбудители коклюша Bordetella pertussis и паракоклюша Bordetella parapertussis относятся к роду Bordetella семейству Alcaligenaceae классу Alphaproteobacteria.
Морфология и тинкториальные свойства. B. pertussis - очень мелкие короткие грамотрицательные палочки или коккобактерии, размером 0,2-0,3x0,5-1,0 мкм. B. parapertussis немного крупнее - 0,3-0,5x0,6-2,0 мкм. Бордетеллы неподвижны, спор не образуют, могут иметь капсулу или микрокапсулу.
Культуральные свойства. Все бордетеллы - строгие аэробы. B. pertussis особенно требовательны к условиям культивирования: для их выделения используют сложные питательные среды, содержащие пролин, метионин, никотиновую кислоту, глютамин и цистеин. В процессе жизнедеятельности бордетеллы выделяют ненасыщенные жирные кислоты, сульфиды и перекиси, способные ингибировать их собственный рост, поэтому в сложные питательные среды для их культивирования добавляют сорбенты (активированный уголь, кровь, альбумин). Обычно для выделения бордетелл применяют казеиново-угольный агар (КУА) или среду Борде-Жангу (картофельно-глицериновый агар с добавлением 25-30% дефибринированной крови человека и пенициллина). Посевы инкубируют при 35-37 ?С в течение 3-7 дней при высокой влажности воздуха (например, в запечатанном пластиковом пакете).
На среде Борде-Жангу B. pertussis образуют мелкие (диаметром около
Для бордетелл характерна R-S-трансформация. Свежие изоляты бордетелл, т.е. чистая культура бактерий, выделенная от больного,
представляет собой вирулентную S-форму (I фаза), продуцирующую токсины. В процессе культивирования бордетелл на питательных средах они проходят ряд промежуточных стадий (фазы II и III) и превращаются в авирулентную R-форму (IV фаза), которая не образует факторов патогенности, типичных для возбудителя коклюша.
Биохимическая активность бордетелл очень низкая. Они расщепляют глюкозу и лактозу до кислоты без газа, имеют пероксидазу, цитохромоксидазу, каталазу и некоторые другие ферменты. B. parapertussis имеет также уреазу и тирозиназу.
Антигенная структура бордетелл довольно сложная. Они имеют 14 агглютиногенов, являющихся поверхностными термолабильными капсульными К-антигенами, которые принято называть факторами. Фактор 7 является общим для всех бордетелл, т.е. родоспецифическим антигеном. Фактор 1 - видоспецифический антиген B. pertussis, агглютиноген 14 видоспецифичен для B. parapertussis, а фактор 12 является основным у B. bronchiseptica. Обнаружение агглютиногенов бордетелл имеет значение при диагностике коклюша и паракоклюша, так как позволяет проводить идентификацию этих бактерий по антигенным свойствам с помощью агглютинирующих К-сывороток. Авирулентные R-формы бордетелл утрачивают капсулу и не агглютинируются К-сыворотками.
Бактерии рода Bordetella также имеют соматический термостабильный родоспецифический О-антиген, обнаруживаемый у вирулентных S-форм бордетелл всех видов.
Факторы патогенности. B. pertussis обладает большим набором факторов патогенности, которые участвуют в развитии коклюша.
Фимбрии (пили), филаментозный гемагглютинин (ФГА), пертактин (белок наружной мембраны клеточной стенки) и капсульные агглютиногены участвуют в процессе адгезии бактерий к мерцательному эпителию верхних дыхательных путей (бронхов, трахеи). Ведущая роль в процессе адгезии бордетелл принадлежит филаментозному гемагглютинину; он же участвует в индукции синтеза факторов гуморального иммунитета - секреторных иммуноглобулинов IgA и IgG. Пертактин - белок наружной мембраны бордетелл, участвует в процессах адгезии и инвазии этих микробов и индуцирует иммунный ответ.
Среди токсичных субстанций, продуцируемых бордетеллами, выделяют коклюшный токсин (синонимы пертуссис-токсин, пер-
туссин, лимфоцитозстимулирующий фактор, гистаминсенсибилизирующий фактор), трахеальный цитотоксин, дерматонекротиче- ский токсин (синоним термолабильный токсин), термостабильный эндотоксин.
Коклюшный токсин представляет собой фермент, который относится к АДФ-рибозилтрансферазам. Он состоит из двух основных субъединиц: А-протомера, обусловливающего токсичность, и B-олигомера, способствующего прикреплению коклюшного токсина к клеткам-мишеням. Коклюшный токсин индуцирует в ор- ганизме сенсибилизацию к гистамину и серотонину, лейкоцитоз, гиперсекрецию инсулина, ГЗТ, повышает проницаемость сосудов. К коклюшному токсину в организме вырабатывается специфический защитный антитоксический иммунитет.
Трахеальный цитотоксин играет важную роль в возникновении местных поражений дыхательного тракта при коклюше, повреждая эпителиоциты. С воздействием этого фактора связывают развитие приступообразного конвульсивного кашля.
Дерматонекротический термолабильный токсин вызывает воспаление и некроз эпителия дыхательного тракта, обусловливает спазм периферических кровеносных сосудов, геморрагии. Описано неблагоприятное воздействие этого токсина на печень, селезенку и лимфатические узлы. Инактивируется при нагревании.
Термостабильный эндотоксин - липополисахарид клеточной стенки бордетелл, который обладает пирогенным, адъювантным свойством, активирует комплемент, индуцирует выработку цитокинов, ФНО.
Внеклеточная аденилатциклаза подавляет хемотаксис и функциональную активность фагоцитов.
Резистентность. Вне человеческого организма бордетеллы быстро погибают. Они довольно чувствительны к дезинфектантам, быстро инактивируются при нагревании и высушивании.
Эпидемиология. Коклюш и паракоклюш - антропонозные инфекции: источником возбудителя является больной человек (особенно в катаральном периоде заболевания). Возбудитель проникает в организм через дыхательные пути при кашле, разговоре, чиханье (респираторный механизм заражения, путь передачи инфекции воздушно-капельный). Коклюш встречается повсеместно, заболевание очень контагиозно. Чаще болеют дети дошкольного возраста. Наиболее опасен коклюш для детей первого года жизни,
у которых из-за развития осложнений заболевание может закончиться летально.
Паракоклюш встречается значительно реже, носит эпизодический характер и, как правило, протекает легче коклюша.
Патогенез. Входными воротами инфекции являются слизистые оболочки дыхательных путей. После прикрепления к поверхности эпителия бронхов и трахеи возбудители коклюша и паракоклюша размножаются, выделяют токсины и ферменты агрессии. В результате воздействия факторов вирулентности микробов развиваются воспаление и отек слизистой оболочки, может развиться некроз от- дельных участков эпителия, из-за чего оголяется подслизистый слой. Вследствие постоянного раздражения рецепторов дыхательных путей у больного возникает сухой приступообразный кашель. Позднее в дыхательном центре формируется очаг возбуждения и приступы кашля могут быть вызваны даже неспецифическими раздражителями (по типу безусловного рефлекса). В кровь бактерии не поступают.
Факторы вирулентности возбудителей, вызывающие подавление иммунного ответа, приводят к развитию вторичного иммунодефицита. Вследствие этого присоединяется вторичная инфекция бактериальной или вирусной этиологии.
Клиническая картина. Парадокс заболевания заключается в том, что характерные симптомы коклюша появляются тогда, когда возбудитель уже практически не выделяется из организма.
Инкубационный период при коклюше составляет 7-14 дней, после чего начинается катаральный период, который характеризуется насморком и легким сухим кашлем. Температура тела повышается незначительно. В этом периоде возбудитель выделяется в большом количестве с каплями слизи и больной является опасным источником инфекции. Во время следующего, пароксизмального, периода кашель усиливается и приобретает характер петушиного крика, проявляясь рядом быстро следующих друг за другом выдыхательных толчков, которые сменяются свистящим вдохомрепризой. Приступообразный спазматический кашель сопровождается тяжелой гипоксией с цианозом лица, судорожным синдромом и заканчивается отделением вязкой прозрачной мокроты и нередко рвотой. Частые продолжительные приступы сухого кашля могут приводить к перевозбуждению дыхательного центра, развитию апноэ и энцефалопатии вследствие гипоксии. Болезнь протекает длительно - от 2 до 5 мес.
Иммунитет. После перенесенного заболевания формируется прочный антибактериальный и антитоксический иммунитет, сохраняющийся в течение всей жизни. Повторные случаи заболевания встречаются редко и протекают легко. Большое значение имеют антитела (IgA), препятствующие прикреплению возбудителя к реснитчатому эпителию верхних дыхательных путей.
Иммунитет после болезни видоспецифический, поэтому антитела к B. pertussis не защищают от заболеваний, вызванных B. parapertussis или B. bronchiseptica.
Микробиологическая диагностика. Основным методом лабораторной диагностики является бактериологическое исследование, которое необходимо проводить в возможно более ранние сроки. Его проводят в течение 5-7 дней, делая посев на плотные пита- тельные среды, описанные выше.
Материал для исследования - слизь с задней стенки глотки - отбирают методом «кашлевых пластинок», при котором посев де- лают во время приступа кашля непосредственно на чашку Петри с питательной средой, держа ее перед лицом пациента. Заднеглоточными тампонами исследуемый материал берут редко, так как возбудитель коклюша быстро погибает на ватном тампоне при высушивании (хлопок подавляет рост бордетелл). Для идентифика- ции возбудителя применяют реакцию агглютинации на стекле с К-сыворотками.
Для ускоренной диагностики применяют прямую РИФ со специфической флюоресцентной сывороткой и материалом из зева больного, а также ИФА и ПЦР.
Для серологической диагностики используют развернутую РА, РПГА, РСК или непрямую РИФ с парными сыворотками. Диа- гностически значимым является четырехкратное нарастание титра антител.
Лечение. B. pertussis чувствительна ко многим антимикробным препаратам, кроме пенициллина. Для лечения коклюша у детей в возрасте до 1 года и при тяжелом течении применяют антибиотики (эритромицин, ампициллин), назначение которых в катаральном периоде заболевания способствует элиминации микроба. Лечение антибиотиками после начала пароксизмальной стадии заболевания редко ускоряет выздоровление. Для лечения тяжелых и осложненных форм коклюша также показан нормальный человеческий иммуноглобулин.
Кислородные ингаляции, антигистаминные или седативные препараты, а также прогулки на свежем воздухе, проветривание помещений - все эти мероприятия снижают частоту приступов кашля у заболевших.
Профилактика. В основе профилактики коклюша в России в настоящее время лежит активная иммунизация детей вакциной АКДС, в состав которой входят убитые формалином или мертиолатом B. pertussis фазы 1 (цельные микробные клетки) в комбинации с дифтерийным и столбнячным анатоксинами. Вакцинацию проводят в соответствии с календарным планом профилактических прививок.
Однако реактогенность вакцины АКДС явилась причиной поиска новых вакцин для профилактики коклюша. В настоящее время разработаны и применяются бесклеточные (ацеллюлярные вакцины), содержащие очищенные антигены возбудителя коклюша (ФГА, пертактин, агглютиногены, пертуссис-анатоксин) в различных комбинациях. Эти вакцины обладают протективными свойствами, но утратили реактогенность. Кроме того, имеются вакцины III поколения, полученные генно-инженерным путем.
Для экстренной профилактики коклюша у контактировавших неиммунизированных лиц назначают нормальный человеческий иммуноглобулин и/или эритромицин в первые 5 дней после контакта с заболевшим.
Bordetella bronchiseptica. Bordetella avium
B. bronchiseptica и B. avium представляют собой мелкие гра- мотрицательные палочки, имеющие жгутики, которые являются паразитами млекопитающих и птиц. Они локализуются и размножаются среди ресничек эпителия дыхательного тракта. B. bronchiseptica крайне редко вызывает у людей заболевание, напоминающее паракоклюш. Она может обнаруживаться в носоглотке людей со сниженным иммунитетом, а также людей, содержащих домашних животных (кроликов, собак и др.). Возможно бессимптомное носительство у человека. Патогенность B. avium для человека пока не доказана.
16.3.2. Бруцеллы (род Brucella)
Бруцеллы являются возбудителями бруцеллеза - острого или хронического антропозоонозного инфекционного заболевания,
которое характеризуется интоксикацией, преимущественным поражением опорно-двигательного аппарата, нервной, сердечно- сосудистой, мочеполовой систем и других органов, аллергизацией организма, затяжным течением, приводящим, как правило, к инвалидизации.
Возбудители бруцеллеза относятся к роду Brucella с неясным систематическим положением, который включает в себя следующие виды: B. melitensis, B. abortus, B. suis, B. ovis, B. canis, B. neotomae, относящиеся ко II группе патогенности. Название рода связано с именем Д. Брюса, открывшего в
Морфология. Бруцеллы - мелкие грамотрицательные микробы (0,4-0,6x0,5-3 мкм) шаровидной, овоидной или палочковидной формы. Спор не образуют, неподвижны. При действии специфического бактериофага или при культивировании на среде с 10% иммунной сывороткой образуют нежную капсулу. Способны образовывать стабильные и нестабильные L-формы.
Культуральные свойства. Аэробы, капнофилы. Требовательны к питательным средам, на простых питательных средах не растут, растут на сложных питательных средах (сывороточно-декстрозный и кровяной агар). Характеризуются медленным ростом на питательных средах, посевы инкубируют не менее 3 нед. В жидких средах вызывают равномерное помутнение с небольшим осадком, но без пленки на поверхности. На плотных средах формируют очень мелкие круглые выпуклые гладкие прозрачные голубовато-серые колонии. Гемолиза не дают, пигмента не образуют. Температурный оптимум роста 37 ?С, оптимум рН 6,6-7,4. Под действием антибиотиков превращаются в L-формы. Хорошо культивируются в желточном мешке куриного эмбриона.
Биохимическая активность очень низкая: бруцеллы содержат каталазу и оксидазу, нитраты редуцируют в нитриты, цитраты не утилизируют, реакция Фогеса-Проскауэра отрицательная, продуцируют сероводород, разлагают мочевину.
Антигенная структура сложная и близкая у разных видов бруцелл. Имеют соматический О- и капсульный Vi-антигены. Различные виды бруцелл различаются количественным соотношением А- (абортус) и М- (мелитензис) антигенов; имеются G- и R-антигены.
Факторы патогенности. Бруцеллы являются факультативными внутриклеточными паразитами млекопитающих, включая челове-
ка. Обладают высокой инвазивной способностью, образуют фермент агрессии гиалуронидазу. Основными факторами вирулентности являются эндотоксин и капсула.
Устойчивость в окружающей среде и к антимикробным препаратам. Бруцеллы длительно сохраняются в окружающей среде: в молоке - до 45 дней, в масле, сливках, простокваше и свежих сырах - в течение всего периода их пищевой ценности, в брынзе - до 60 дней, в замороженном мясе - свыше 5 мес, в засоленных шкурах - 2 мес, в шерсти - до 3-4 мес, в воде - до 5 мес, в почве - до 3 мес. Малоустойчивы к высокой температуре, при кипячении погибают моментально, при 60 ?С - в течение 30 мин.
Чувствительны к большинству антибиотиков, действию обычно применяемых антисептиков и дезинфектантов в обычных концен- трациях.
Эпидемиология. Резервуаром возбудителя в природе являются сельскохозяйственные и домашние животные - крупный и мелкий рогатый скот, свиньи, реже олени, лошади, собаки, кошки.
Бруцеллез распространен на всех континентах, особенно в странах с развитым животноводством. Источник инфекции - больные сельскохозяйственные и домашние животные. Возбудителями бруцеллеза крупного рогатого скота являются B. abortus, мелкого рогатого скота - B. melitensis, свиней - B. suis, оленей - B. neotomae, собак - B. canis, баранов - B. ovis. Наибольшее эпидемическое значение для человека имеют B. melitensis, B. abortus и B. suis. Больной человек не заразен, является биологическим тупиком. Больные животные выделяют бруцеллы с молоком, мочой, калом, околоплодными водами и др. Человек заражается главным образом алиментарным путем (сырое молоко, молочные продукты, мясо и др.) и контактно при уходе за больными животными и т.п. Восприимчивость человека к бруцеллам высокая. Заболевание носит спорадический характер или возникает в виде отдельных вспышек, что зависит от видовой принадлежности возбудителей. От человека к человеку заболевание не передается.
Патогенез. Бруцеллы проникают в организм через кожу или сли- зистые оболочки и распространяются по лимфатическим путям. В отличие от туляремии, сибирской язвы, при бруцеллезе на месте внедрения не развивается первичный аффект. Иногда наблюдается увеличение регионарных лимфатических узлов. Дальнейшая судьба возбудителя зависит от вирулентности, величины инфици-
рующей дозы, иммунореактивности организма. При попадании в организм больших доз вирулентных бруцелл очень быстро может наступить диссеминация возбудителя. При малых инфицирующих дозах и пониженной вирулентности бруцеллы могут длительно задерживаться в регионарных лимфатических узлах, фаза генерализации запаздывает или вообще отсутствует. В основе развивающихся в ранний период бруцеллеза диффузных изменений сосудов и паренхиматозных органов лежит токсическое действие бруцелл. Из кровотока бруцеллы оседают в воспалительных очагах, лимфатических узлах, селезенке и костном мозгу, где длительно могут сохраняться, располагаясь внутриклеточно. При обострениях процесса бруцеллы вновь усиленно размножаются, попадают в кровоток, вызывая повторные волны генерализации. Длительное пребывание возбудителя в организме приводит к его аллергизации. Со 2-3 нед, а иногда и с самого начала заболевания на первый план в патогенезе выдвигаются аллергические поражения. Аллергия при бруцеллезе играет двоякую роль. С одной стороны, аллергическое воспаление лежит в основе большинства клинических проявлений болезни, особенно в хронической стадии. С другой стороны, аллергическая реакция препятствует распространению бруцелл в организме, что имеет большое значение для предупреждения повторной генерализации процесса.
Клиническая картина. Инкубационный период колеблется в пределах 1-3 нед, но может затягиваться и до нескольких месяцев. Болезнь начинается постепенно, иногда остро. Болезнь протекает с длительной лихорадкой, ознобом, потливостью, болями в суставах, мышцах, с симптомами поражения сердечно-сосудистой, нервной, мочеполовой систем, опорно-двигательного аппарата и др. Клиническая картина бруцеллеза характеризуется большим полиморфизмом и зависит от характера пораженного органа.
Иммунитет при бруцеллезе клеточно-гуморальный, в основном нестерильный и относительный. После выздоровления иммунитет угасает, возможна реинфекция. Ввиду относительности иммунитета большие инфицирующие дозы бруцелл могут вызвать его прорыв у больных хроническим или латентным бруцеллезом, что ведет к тяжелому течению болезни.
Лабораторная диагностика. Для диагностики используют методы: бактериологический, серологический, биологический, аллергологический. Серодиагностику и аллергические пробы проводят в
базовых лабораториях, чистую культуру бруцелл выделяют и идентифицируют в специальных лабораториях с соблюдением правил техники безопасности.
Материалом для исследования служат кровь, пунктат красного костного мозга, моча, молоко и молочные продукты, кусочки ор- ганов.
Посев крови для выделения гемокультуры проводят в первые дни болезни при наличии лихорадки, при отрицательных резуль- татах исследование многократно повторяют (бактериемия может наблюдаться в течение года и более). Учитывая медленный рост бруцелл, посевы выдерживают в термостате до 1 мес. Пунктат костного мозга засевают на те же среды; миелокультуру при бруцеллезе удается получить в 1,5-2 раза чаще, чем гемокультуру. Миелокультуры могут быть получены в остром, подостром и даже хроническом периоде заболевания. Мочу для выделения уринокультуры предварительно центрифугируют и из осадка делают посевы. Уринокультуры выделяют как при остром бруцеллезе, так и в период реконвалесценции.
Биологический метод исследования используется для выделения бруцелл из материалов, контаминированных посторонней ми- крофлорой или содержащих небольшое количество возбудителей.
Для биопробы используют белых мышей и морских свинок. Животных заражают кровью внутрибрюшинно, осадком мочи и молока - подкожно. Через 20-30 дней у зараженного животного берут кровь и ставят с ней реакцию агглютинации. Затем животных забивают, вскрывают и делают посевы крови из сердца, взвеси внутренних органов и лимфатических узлов.
Выделенные чистые культуры бруцелл дифференцируют по способности роста при отсутствии повышенной концентрации углекислого газа, по выделению сероводорода, чувствительности к бруцеллезному фагу и бактериостатическому действию анилиновых красителей (фуксина и тионина).
В сыворотке больных бруцеллезом накапливаются агглютинирующие (вначале IgM, затем IgG); неполные блокирующие (IgA, IgG) антитела. Для их выявления с диагностической целью используют реакцию Райта (развернутая агглютинация) и Хеддельсона (пластинчатая агглютинация), РПГА, ИФА, реакцию Кумбса. Реакция агглютинации - один из основных диагностических методов при бруцеллезе у людей и сельскохозяйственных животных.
Агглютинины, как правило, появляются в крови в ранние сроки после заражения, поэтому наибольшую диагностическую ценность реакция агглютинации представляет при остром бруцеллезе. При остром бруцеллезе высокий титр антител определяется также в РПГА и ИФА. Реакция Кумбса рекомендуется в качестве диагностического метода при хронических и латентных формах бруцеллеза. В условиях массового обследования на бруцеллез применяют пластинчатую реакцию агглютинации Хеддельсона в сочетании с кожно-аллергической пробой Бюрне.
Аллергологический метод применяют для выявления ГЗТ к бруцеллам, наблюдающееся у больных бруцеллезом, инфициро- ванных бруцеллами лиц и привитых живой бруцеллезной вакциной. Ее ставят с 15-20-го дня болезни. Аллергическая реакция бывает положительной в течение многих лет после перенесенного заболевания и у привитых. Серологические реакции и кожноаллергическая проба по своему диагностическому значению не- равноценны, вследствие чего не могут заменить друг друга. Это обусловливает необходимость применения комплексного сероаллергического метода, являющегося наиболее надежным способом диагностики бруцеллеза.
Лечение. При остром и хроническом бруцеллезе с выраженными признаками активности необходимо назначение антибиотиков широкого спектра (эритромицин, рифампицин). Антибиотики не действуют на бруцеллы, расположенные внутриклеточно, поэтому их можно назначать только при наличии бактериемии, а при хроническом бруцеллезе они неэффективны. Кроме того, антибиотики не предупреждают рецидивов бруцеллеза, поэтому широко применяется специфическая иммунотерапия убитой лечебной бруцеллезной вакциной (5-7 внутривенных вливаний в нарастающих дозах 1-2 раза в неделю) или бруцеллина (внутримышечно 2 раза в неделю). При острых и рецидивирующих формах назначают бруцеллезный иммуноглобулин.
Профилактика. Для специфической профилактики применяют живую бруцеллезную вакцину, предложенную П.А. Вершиловой из штамма ВА-19А, полученную из B. abortus и создающую перекрестный иммунитет по отношению к другим видам бруцелл. Вакцинацию проводят по эпидемиологическим показаниям. Неспе- цифическая профилактика такая же, как и при других зоонозах, и сводится в основном к санитарно-ветеринарным мероприятиям.
16.3.3. Франциселлы (род Francisella)
Francisella tularensis - возбудитель туляремии - острого или хронического системного природно-очагового заболевания человека и животных, которое характеризуется лихорадкой, интоксикацией и поражением лимфатических узлов.
Возбудитель туляремии Francisella tularensis открыт в провинции Туляре (США, штат Калифорния) в
Морфология. Возбудитель туляремии представляет собой очень мелкие (0,1-0,3x1,5 мкм) полиморфные (могут быть представлены кокками, овоидами, мелкими зернами, шарами или образованиями неправильной формы) грамотрицательные палочки, спор не образует, неподвижен, может образовывать слизистую капсулу. Размножение делением или почкованием. Почки образуются в ре- зультате асимметричного деления клетки (зона деления закладывается ближе к одному из полюсов клетки) путем врастания внутрь клетки цитоплазматической мембраны без вовлечения в этот процесс клеточной стенки или внутривакуолярно.
Культуральные свойства. Аэроб. На простых питательных средах не растет. Культивируются на желточных средах или на средах с добавлением крови и цистеина. Оптимальная температура роста 37-38 ?С. На плотных средах образует мелкие колонии молочнобелого цвета. Хорошо культивируется в желточном мешке куриного эмбриона. При культивировании на искусственных питательных
средах происходят аттенуация бактерий и превращение их из вирулентной S-формы в авирулентную и неиммуногенную R-форму. Вакцинные штаммы бактерий представляют собой промежуточную форму изменчивости, которую обозначают как S-R-вариант.
Биохимическая активность очень низкая, ферментируют до кислоты глюкозу и мальтозу, непостоянно ферментируют маннозу, левулезу, образуют сероводород.
Антигенная структура: содержит соматический О- и поверхностный Vi-антигены. Имеют антигенную близость с бруцеллами. В R-форме теряют Vi-антиген, а вместе с ним вирулентность и иммуногенность.
Факторы патогенности. Неарктический подвид обладает высокой патогенностью для человека при кожном пути заражения, голарктический и среднеазиатский умеренно патогенны. Вирулентными являются S-формы колоний. Патогенные свойства связаны с оболочечным антигенным комплексом и токсичными веществами типа эндотоксина. Возбудитель патогенен для млекопитающих многих видов, но степень патогенности различна. Из лабораторных животных к нему высокочувствительны морские свинки и белые мыши.
Экологическая ниша: резервуаром возбудителя в естественных условиях являются дикие животные (около 50 видов), главным образом мелкие грызуны и зайцы, среди домашних животных - овцы, свиньи, крупный рогатый скот.
Устойчивость в окружающей среде. В окружающей среде бактерии могут долго сохраняться при низкой температуре, особенно в зерне и соломе. Они нестойки к высоким температурам и УФлучам. При 60 ?С гибнут через 5-10 мин, а при кипячении - через 1-2 мин. При 0-4 ?С сохраняются в воде и фураже до 6 мес. Чувствительны к большинству антибиотиков (стрептомицин, тетрациклин, левомицетин, эритромицин и др.). Высокочувствительны к обычно применяемым антисептикам и дезинфектантам (лизол, хлорамин убивают через 3-5 мин).
Эпидемиология. Туляремия - природно-очаговое заболевание. Источником инфекции в естественных условиях являются главным образом мелкие грызуны (полевые мыши, водяные крысы, ондатра, хомяки) и зайцы. На территории природных очагов туляремией могут заражаться овцы, свиньи, крупный рогатый скот. Пе- редача возбудителя среди млекопитающих чаще всего происходит
через кровососущих членистоногих: иксодовых клещей, комаров, в меньшей степени блох, слепней и гамазовых клещей. Человек заражается контактным, алиментарным, аэрозольным и трансмиссивным путями. Восприимчивость человека очень высока.
Туляремия распространена в Европе, Азии, Северной Америке, в России - встречается в виде спорадических случаев или эпидемических вспышек. Болеют чаще жители сельской местности и лица, имеющие профессиональный контакт с грызунами (сельскохозяйственные работы, охота и т.д.).
Патогенез. Возбудитель туляремии попадает в организм человека через кожу, слизистые оболочки глаз, дыхательных путей, желудочно-кишечного тракта. В патогенезе туляремии выделяют несколько фаз: внедрение и первичную адаптацию возбудителя, лимфогенное распространение, первичные регионарно-очаговые и общие реакции организма, гематогенные метастазы и генера- лизацию, вторичные очаги, реактивно-аллергические изменения, обратный метаморфоз и выздоровление. Ведущее значение в патогенезе имеет фаза лимфогенного распространения возбудителя. В месте его внедрения нередко развивается первичный аффект с регионарным первичным лимфаденитом. Периаденит выражен умеренно. Микроб и его токсины проникают в кровь, что приводит к бактериемии и генерализации процесса, метастазированию и развитию вторичных туляремийных бубонов.
Иммунитет после перенесенной инфекции сохраняется длительно, иногда пожизненно; развивается аллергизация организма к антигенам возбудителя.
Клиническая картина. Инкубационный период длится от нескольких часов до 3 нед, в среднем 3-7 дней. Болезнь начинается остро, внезапно, без продрома, с повышения температуры тела до 38-39 ?С; появляются озноб, резкая головная боль, интоксикация. Клиническая картина обусловлена характером пораженных органов. Различают бубонную, язвенно-бубонную, глазобубонную, абдоминальную, легочную и генерализованную (септическую) клинические формы туляремии. Болезнь протекает длительно (около месяца). Летальность при заражении неарктическим подвидом около 6%, при заражении другими подвидами - 0,1% и ниже.
Лабораторная диагностика. Для диагностики применяют все микробиологические методы. Исследование проводят в режимных лабораториях.
Материал для исследования - кровь, пунктат из бубона, соскоб из язвы, отделяемое конъюнктивы, налет из зева, мокрота и др. - определяется клинической формой болезни. Кроме того, на исследование можно брать воду и пищевые продукты. В природных очагах туляремии проводят плановые систематические исследования для выделения возбудителя туляремии от грызунов.
Бактериологический метод диагностики туляремии у человека редко дает положительные результаты. Чистую культуру, как правило, выделяют после накопления ее на восприимчивых лабораторных животных. Для биопробы используют белых мышей и морских свинок. Мышей заражают подкожно, морских свинок - внутрибрюшинно; животные погибают на 3-6-е сутки, иногда позднее. Зараженных животных содержат в особых условиях (как при диагностике чумы) и наблюдают за ними в течение 6-14 дней. Если экспериментальные животные на протяжении 7-15 дней не погибают, их забивают на 15-20-й день и трупы вскрывают. При наличии туляремии обнаруживают патолого-анатомические изменения в виде продуктивного процесса с некрозом. Чистую культуру выделяют из внутренних органов на желточной среде, глюкозоцистеиновом кровяном агаре и др. При идентификации опираются на морфологию и тинкториальные свойства возбудителя, отсутствие роста на МПА, агглютинацию гомологичной сывороткой, патогенность для белых мышей и морских свинок. Чистую культуру можно выделить, заражая 12-дневные куриные эмбрионы в желточный мешок. Для выделения чистой культуры возбудителя из воды ее центрифугируют или фильтруют через бактериальные фильтры и осадком заражают лабораторных животных. При исследовании пищевых продуктов их промывают МПБ, центрифугируют и осадком заражают лабораторных животных.
Одновременно с бактериологическим исследованием из исследуемого материала готовят мазки-отпечатки и окрашивают их по Романовскому-Гимзе. В мазках из органов можно обнаружить мелкие кокковидные и палочковидные бактерии, которые располагаются внутриклеточно и в виде скоплений, образуя нежную капсулу.
Для серодиагностики используют развернутую реакцию агглютинации, РПГА, РИФ.
Аллергические пробы применяют для ранней диагностики туляремии (с 5-го дня от начала болезни). Используют два вида ту-
лярина
и соответственно два способа их введения: накожный и внутрикожный. Так
как концентрация аллергена в обоих видах тулярина различная,
недопустимо использовать накожный тулярин для внутрикожной пробы и
наоборот. Результаты аллергической реакции учитывают в динамике через
24, 36, 48 ч. За положительный результат принимают инфильтрат диаметром
не менее
Лечение. Для лечения применяют антибиотики аминогликозиды, макролиды и фторхинолоны. При затяжном течении проводят комбинированную антибиотикотерапию и вакцинотерапию с применением убитой лечебной вакцины, которую вводят различными путями в дозах от 1 до 15 млн микробных тел с интервалом 3-6 дней. Курс лечения 6-10 инъекций.
Профилактика. Для специфической профилактики применяют живую туляремийную вакцину, полученную в
Неспецифическая профилактика такая же, как при других зоонозах, и направлена в первую очередь на борьбу с грызунами.
16.3.4. Легионеллы (род Legionella)
Легионеллы входят в класс γ-Proteobacteria, порядок Legionellales, семейство Legionellaceae, в который входит только один род Legionella. В
настоящее время известно более 50 видов легионелл, в патологии
человека пока показана роль 22 видов. 95% случаев заболеваний связано с
видом L. pneumophila, который является типовым. Его название
связано с первыми жертвами вызванного им заболевания среди участников
конгресса «Американский легион», проходившего в Филадельфии летом
Среди других видов легионелл заболевание у человека чаще связано с L. micdadei, L. dumoffui, L. bozemanii, L. longbeachae.
Морфология. Грамотрицательные палочки размером 0,5- 0,7x2-5 мкм, встречаются и нитевидные формы до 20 мкм в длину. Спор и капсул не образуют, подвижны.
Культуральные свойства. Аэробы. Размножаются только на сложных питательных средах (буферно-угольный дрожжевой агар) с обязательным добавлением цистеина, пирофосфата железа и кетоглутаровой кислоты в связи с потребностями в этих веществах. Культивирование проводят при 35 ?С в атмосфере 2,5-3% СО2 в течение 3-6 сут. Выросшие на питательной среде колонии имеют вросший центр с образованием коричневого пигмента, за исключением вида L. micdadei. Могут быть культивированы в желточном мешке куриного эмбриона и культурах клеток, в организме морской свинки.
Биохимические свойства. Каталазоположительны. Не ферментируют углеводы, не продуцируют уреазу, не восстанавливают нитраты. Некоторые виды разжижают желатин. L. pneumophila от других видов легионелл отличается способностью гидролизовать гиппурат натрия.
Антигенная структура. Сложная. Вид L. pneumophila подразделяется на 16 серогрупп, специфичность которых опосредована липополисахаридным антигеном.
Резистентность. Как и другие споронеобразующие бактерии, чувствительны к УФ-лучам, этиловому спирту, фенолу, 3% раствору хлорамина.
Эпидемиология. В природных условиях легионеллы обитают в пресноводных водоемах, где они являются симбионтами синезеленых водорослей, водных и почвенных амеб и других простейших. Высокие адаптационные способности легионелл позволяют им успешно колонизировать искусственные водоемы, системы водоснабжения и кондиционирования воздуха, медицинскую аппаратуру. На синтетических и резиновых поверхностях водопроводного, промышленного и медицинского оборудования легионеллы образуют биопленку, в составе которой они становятся более устойчивыми к действию дезинфицирующих веществ.
Механизм передачи легионеллезной инфекции аспирационный. Основной фактор передачи - мелкодисперсный аэрозоль, содержащий легионеллы, образуемый бытовыми, медицинскими
или промышленными водными системами. От человека к человеку заболевание не передается. Болезнь распространена повсеместно, в том числе и в России. Пик заболеваемости приходится на летние месяцы. Предрасполагающим фактором является иммунодефицитное состояние.
Факторы патогенности и патогенез заболевания. Легионеллы - факультативные внутриклеточные паразиты. В организме человека они размножаются преимущественно в альвеолярных макрофагах, в которые они попадают вследствие ингаляции микробного аэрозоля, а также в полиморфно-ядерных и моноцитах крови. Легионеллы активно размножаются в макрофагах, что приводит к разрушению последних и выходу большого количества бактерий в легочную ткань. Этот процесс обеспечивается следующими факторами патогенности: цитотоксином и супероксиддисмутазой, подавляющими респираторный взрыв фагоцита; цитолизином, являющимся ферментом металлопротеазой, предотвращающим образование фаголизосомы, а также вызывающим геморрагический эффект; при гибели бактерий освобождается эндотоксин, обусловливающий интоксикацию.
Многократно повторяемый цикл взаимодействия легионелл с макрофагами легких приводит к накоплению возбудителя в высокой концентрации и развитию острого воспалительного процесса.
Клинические проявления. Известны три клинические формы легионеллеза: болезнь легионеров (филадельфийская лихорадка) и лихорадка Понтиак, лихорадка Форт-Брагг.
Инкубационный период при болезни легионеров 2-10 суток. Заболевание сопровождается лихорадкой, ознобом, болями в груди, одышкой. В 20-30% случаев развивается острая дыхательная недостаточность. Могут развиться инфекционно-токсический шок, почечная недостаточность, поражение центральной нервной системы. Летальность 8-25%, у больных с иммунодефицитом 60%.
Лихорадка Понтиак представляет собой острое респираторное заболевание без пневмонии. Инкубационный период 36-48 ч. За- болевание характеризуется 1-2-дневной лихорадкой, катаральными явлениями в носоглотке, сухим кашлем. Летальные исходы не регистрируются. Болезнь поражает 95-100% лиц, находящихся в зоне распространения аэрозоля.
Лихорадка Форт-Браг - острое лихорадочное заболевание с экзантемой. Риск возникновения внутрибольничного легионеллеза
связан с возможностью контаминации легионеллами систем водоснабжения, кондиционирования воздуха и медицинского оборудования, а также наличием лиц, чувствительных к инфекции, с нарушением клеточного иммунитета. Помимо L. pneumophila, внутрибольничную инфекцию нижних дыхательных путей вызывает L. micdadei.
Иммунитет клеточный. Антитела протективной активностью не обладают.
Лабораторная диагностика проводится бактериологическим, серологическим и экспресс-методами.
Материалом для выделения легионелл служат мокрота, материал бронхоскопии, плевральный экссудат, биопсийный материал легких, который хранят не более 1 сут при 4 ?С.
Серологическое исследование проводят определением 4-кратного нарастания титра антител в парных сыворотках методом ИФА или непрямой РИФ.
Также проводят определение на 2-10-е сутки растворимого антигена в моче с помощью ИФА или иммунохроматографического метода.
Прямую РИФ и ПЦР используют в качестве экспрессдиагностики. Однако специфический достоверный результат получается только в том случае, если материалом для исследования являются материалы бронхоскопии и биопсии, а не мокрота.
Лечение. Используют антибиотики, способные к внутриклеточной пенетрации: макролиды (эритромицин, кларитромицин, азитромицин) и фторхинолоны.
Профилактика. Методы специфической профилактики не разработаны. Неспецифическая профилактика сводится к периодической очистке водных систем, выявлению водного резервуара возбудителя и его оздоровлению.
16.3.5. Коксиеллы. Возбудитель лихорадки Ку (Coxiella burnetii)
Возбудителем лихорадки Ку являются бактерии вида Coxiella burnetii, которые входят в класс Gammaproteobacteria, порядок Legionellales, семейство Coxiellaceae, род Coxiella. Возбудитель был выделен в
Морфология. Коксиеллы - короткие грамотрицательные кок- кобактерии, размером 0,2x0,7 мкм, плеоморфны. По Здродовскому и Романовскому-Гимзе окрашиваются в красный цвет.
Культуральные свойства. Облигатные внутриклеточные паразиты. Культивируются в культурах клеток, желточном мешке куриных эмбрионов, организме морской свинки. В клетках размножаются в цитоплазматических вакуолях, могут размножаться в фаголизосомах.
Антигенная структура и патогенность. Коксиеллы подвержены фазовым вариациям, которые различаются морфологией и антигенной специфичностью. Коксиеллы, находящиеся в фазе 1, имеют в клеточной оболочке структурный полисахарид, гидрофильны, обладают большей иммуногенностью, не поглощаются фагоцитами при отсутствии антител. Коксиеллы, находящиеся в фазе 2, менее вирулентны, чувствительны к фагоцитозу. Переход в фазу 2 происходит после повторных культивирований в курином эмбрионе. В инфицированных клетках коксиеллы образуют спороподобные формы, которые наиболее патогенны для человека.
Резистентность. Высокоустойчивы в окружающей среде. Устойчивы к действию формалина, фенола. Устойчивость к высоким температурам и низким значениям рН, к высушиванию связана со способностью образования эндоспороподобных форм. Месяцами сохраняются в воде и на контаминированных микробом предметах. До 2 лет сохраняются в высохших фекалиях.
Эпидемиология. Резервуаром в природе являются крупный и мелкий рогатый скот, лошади, грызуны, дикие птицы. Поддержание микроба в природе осуществляется благодаря циркуляции возбудителя между животными и птицами с участием множественных видов иксодовых и аргасовых клещей. Артропоидный вектор не играет роли в передаче возбудителя человеку. У животных заболевание может протекать бессимптомно, возбудитель выделяется в больших количествах с мочой, испражнениями, околоплодными водами, молоком. Человек в основном заражается, вдыхая аэрозоли мочи и испражнений зараженных животных, а также употребляя молоко от зараженных животных, зараженную воду. Зараженные аэрозоли и пыль могут инфицировать конъюнктиву. Возможно заражение через поврежденную кожу при контакте с зараженными околоплодными водами животных. Выброшенные в атмосферу инфицированные коксиеллами аэрозоли могут вызвать инфекционный процесс на расстоянии в несколько километров от источника инфекции. Поэтому Coxiella burnetii рассматривается как один из агентов биотеррора, входит в группу В агентов биотерроризма. Передача заболевания от человека к человеку не отмечена.
Клиническая картина. Инкубационный период 18-21 день. Заболевание сопровождается лихорадкой, головной болью, симптомами острого респираторного заболевания, которое протекает как атипичная пневмония. Могут наблюдаться тошнота и рвота. У половины больных пневмонией, вызванной Coxiella burnetii, наблюдается поражение печени с развитием гепатолиенального синдрома. Иногда заболевание сопровождается эндокардитом. Летальность не более 1%.
Иммунитет. В начале заболевания в крови появляются антитела к фазе 2, а в разгаре заболевания и у реконвалесцентов обнаруживаются антитела к фазе 1.
Диагностика проводится серологическим методом исследования совместно с диагностикой других атипичных пневмоний (хламидиозной, легионеллезной и микоплазменной этиологии), с помощью РСК, ИФА, непрямой РИФ.
Лечение антибиотиками тетрациклинового ряда и фторхинолонами.
Профилактика. Живая вакцина из штамма М-44 (П.Ф. Здродовский, В.А. Гениг) используется по эпидемиологическим показаниям. Неспецифическая профилактика сводится к санитарноветеринарным мероприятиям.
16.3.6. Бартонеллы (род Bartonella)
Бартонеллезы - заболевания, которые вызываются бактериями, относящимися к роду Bartonella семейства Bartonellaceae, входящего в класс Alphaproteobacteria.
Морфология. Бартонеллы - грамотрицательные палочки, обладающие плейоморфностью, подвижны (имеют однополюсной жгутик или пучок жгутиков).
Культуральные и биохимические свойства. Культивируются на сложных питательных средах, содержащих кровь, для этих целей может использоваться шоколадный агар, при температуре 37 ?С, в атмосфере 5% СО2 в течение 7 сут. Культивируются также в куриных эмбрионах. Протеолитическая и сахаролитическая активность не выражена.
Факторы патогенности и патогенез заболеваний. Факторы патогенности изучены недостаточно. Бартонеллы являются эритроцитарными паразитами, а также паразитами кожи и костной ткани.
Клетками-мишенями для бартонелл являются эритроциты и эндотелий сосудов. В месте прикрепления бартонелл к чувствительным клеткам происходит скопление микробов и возникает воспалитель- ная реакция с развитием ангиоматоза или лимфаденопатии. В процессе инвазии микроба в эритроциты принимает участие водорастворимая фракция, выделяемая бартонеллами, - деформин-фактор. Деформин-фактор вызывает деформацию и инвагинацию мембраны эритроцитов и принимает участие в образовании внутриклеточной вакуоли. B. bacilliformis обладает гемолитической активностью. В пораженных тканях бартонеллы располагаются цепочками.
Эпидемиология. Резервуаром и источником инфекции является больной или носитель. Для возникновения заболевания необходимо проникновение возбудителя в кровяное русло в результате нарушения целостности кожных покровов (болезнь кошачьих царапин) или через укусы кровососущих членистоногих (волынская лихорадка, болезнь Карриона).
Клиническая картина. Клиническая картина разнообразна в зависимости от возбудителя и вызываемого им заболевания. B. henselae вызывает болезнь кошачьих царапин, источником инфекции при которой являются кошки. Человеку заболевание передается контактным путем через нанесенные кошкой укусы или царапины или укусы кошачьих блох. В патологический процесс вовлекаются кожные покровы и периферические лимфатические узлы с развитием локального лимфаденита. B. quintana является возбудителем окопной (синонимы: траншейной, волынской) лихорадки. Источник инфекции - человек. Передача осуществляется фекалиями платяных вшей через расчесы. Клиническая картина характеризуется чередующимися приступами лихорадки, сыпью, неврологическими симптомами, головной болью, миалгией. После перенесенного заболевания наблюдается длительное носительство возбудителя. Прогноз при этих заболеваний благоприятный. B. bacilliformis - возбудитель болезни Корриона, которая распространена в странах Южной Америки. Болезнь протекает в двух клинических формах: лихорадки Оройя - острого заболевания, характеризующегося развитием тяжелой анемией с летальностью до 40% и перуанской бородавки, которая возникает через 1-2 мес после острой формы и характеризуется появлением на коже мно- жественных кровоточащих папул. Резервуар возбудителя - мышевидные грызуны. Переносчики - москиты.
Диагностика. Используют бактериологический, серологический, гистологический методы и ПЦР. Основным является серологический метод (непрямая РИФ, ИФА). Бактериологический метод можно использовать в лихорадочный период, проводя посев крови больных на специальные питательные среды. При гистологическом исследовании биопсийного материала в пораженных тканях можно при окраске по Романовскому-Гимзе обнаружить ярко-красные бартонеллы, расположенные цепочками.
Лечение антибиотиками тетрациклинового ряда, макролидами, фторхинолонами.
Профилактика. Специфическая профилактика не разработана. Неспецифическая профилактика сводится к санации кошек и уничтожению переносчиков (блох, вшей, москитов) и санитарногигиеническим мероприятиям.
16.3.7. Аэробные неферментирующие грамотрицательные палочки
16.3.7.1. Псевдомонады (род Pseudomonas)
Таксономическое положение. Псевдомонады - грамотрицательные неферментирующие бактерии, к которым относятся представители рода Pseudomonas, типовой вид - Pseudomonas aeruginosa (синегнойная палочка), которая является возбудителем многих гнойно-воспалительных заболеваний, а также некоторые другие виды.
Pseudomonas aeruginosa (синегнойная палочка)
Свое
название бактерии получили за характерное сине-зеленое окрашивание
гнойного отделяемого, которое было впервые описано А. Люкке в
Морфологические и тинкториальные свойства. Псевдомонады - грамотрицательные подвижные прямые палочки размером 1-3 мкм, расположенные одиночно, попарно или в виде коротких цепочек. Подвижность синегнойных палочек обеспечивается на- личием одного, редко двух полярно расположенных жгутиков (они монотрихи или амфитрихи). Спор не образуют, имеют пили IV типа (фимбрии). При определенных условиях могут продуцировать капсулоподобную внеклеточную слизь полисахаридной природы.
Встречаются также так называемые мукоидные штаммы, образующие повышенное количество слизи. Такие бактерии выделяются чаще всего из мокроты больных муковисцидозом.
Культуральные свойства. Все псевдомонады - облигатные аэробы, которые хорошо растут на простых питательных средах. На жидкой питательной среде бактерии образуют характерную серовато-серебристую пленку на поверхности. На кровяном агаре вокруг колоний синегнойной палочки наблюдаются зоны гемолиза. Для выделения чистой культуры синегнойной палочки применяют селективные или дифференциально-диагностические питательные среды с добавлением антисептиков - малахитового агара с добавлением бриллиантового зеленого или ЦПХ-агара с ацетамидом. Оптимальная температура роста 37 ?С, однако синегнойная палочка способна расти и при 42 ?С, что позволяет отличать ее от других псевдомонад. Колонии синегнойной палочки гладкие округлые суховатые или слизистые (у капсульных штаммов).
При культивировании на плотных питательных средах P. aeruginosa продуцирует триметиламин, придающий культурам своеобразный сладковатый запах жасмина, земляничного мыла или карамели. Характерным биологическим признаком бактерий вида P. aeruginosa является также их способность синтезировать водорастворимые пигменты, окрашивающие в соответствующий цвет повязки больных или питательные среды при их культивировании. Чаще всего они вырабатывают феназиновый пигмент - пиоцианин сине-зеленого цвета, но могут образовывать и зеленый флюоресцирующий в УФ-лучах пигмент флюоресцеин (пиовердин), а также красный (пиорубин), черный (пиомеланин) или желтый (α-оксифеназин).
Биохимические свойства. Синегнойная палочка не ферментирует глюкозу и другие углеводы, однако для получения энергии способна их окислять. Для дифференциальной диагностики, позволяющей отличать псевдомонады от других грамотрицательных палочек, применяют OF-тест (тест окисления/фермента- ции глюкозы) на специальной среде. Для этого чистую культуру псевдомонад засевают в две пробирки, одну из которых затем инкубируют в аэробных условиях, а другую - в анаэробных. Псевдомонады способны только окислять глюкозу, поэтому цвет индикатора меняется только в пробирке, выдержанной в аэробных условиях. P. aeruginosa восстанавливает нитраты в нитриты,
а также обладает протеолитической активностью: разжижает желатин, гидролизует казеин. Синегнойная палочка имеет каталазу и цитохромоксидазу.
Многие штаммы синегнойной палочки продуцируют бактериоцины, называемые пиоцинами, которые обладают бактерицидными свойствами. Пиоцинотипирование штаммов синегнойной палочки применяют для эпидемиологического маркирования и внутривидовой идентификации P. aeruginosa. С этой целью определяют спектр пиоцинов, выделяемых исследуемым штаммом, или его чувствительность к пиоцинам других псевдомонад.
Антигенные свойства. Синегнойная палочка имеет сложную антигенную структуру, обусловленную наличием у нее О- и Н-антигенов. ЛПС клеточной стенки является типоспецифическим термостабильным О-антигеном и используется для серотипирования штаммов P. aeruginosa. Термолабильный жгутиковый Н-антиген является протективным, и на его основе получены вакцины. На поверхности клеток синегнойной палочки обнаружены также антигены пилей (фимбрий). Кроме того, P. aeruginosa продуцирует целый ряд внеклеточных продуктов, обладающих антигенными свойствами: экзотоксин А, протеазу, эластазу, внеклеточную слизь.
Факторы патогенности. P. aeruginosa обладает разнообразными факторами патогенности, которые вовлечены в развитие сине- гнойной инфекции. Среди наиболее важных из них выделяют следующие.
Факторы адгезии и колонизации - пили IV типа (фимбрии) и внеклеточная (экстрацеллюлярная слизь) P. aeruginosa.
Токсины. ЛПС наружной мембраны клеточной стенки P. aerugi- nosa обладает свойствами эндотоксина и участвует в развитии ли- хорадки, олигурии, лейкопении у больных.
Экзотоксин А синегнойной палочки является цитотоксином, который вызывает глубокие нарушения клеточного метаболизма в результате подавления синтеза белка в клетках и тканях. Подобно дифтерийному токсину, он является АДФ-рибозилтрансферазой, которая ингибирует фактор элонгации EF-2 и поэтому вызывает нарушение синтеза белка. Также доказано, что экзотоксин А наряду с протеазой подавляет синтез иммуноглобулинов и вызывает нейтропению. Экзотоксин А продуцируется в неактивной форме в виде протоксина и активируется при участии различных фер-
ментов внутри организма. Экзотоксин А обладает протективными свойствами, т.е. антитела к нему защищают клетки хозяина от его повреждающего действия, а также препятствуют развитию бактериемии и синегнойного сепсиса.
Экзотоксин S (экзоэнзим S) обнаруживается только у высоковирулентных штаммов синегнойной палочки. Механизм его повреждающего действия на клетки пока неясен, однако известно, что инфекции, обусловленные экзоэнзим-S-продуцирующими штаммами синегнойной палочки, нередко заканчиваются летально. Экзотоксины А и S нарушают также активность фагоцитов.
Лейкоцидин также является цитотоксином с выраженным токсическим воздействием на гранулоциты крови человека.
Энтеротоксин и факторы проницаемости играют определенную роль в развитии местных тканевых поражений при кишечных формах синегнойной инфекции, вызывая нарушения водно-солевого обмена.
Ферменты агрессии. P. aeruginosa продуцирует гемолизины двух типов: термолабильную фосфолипазу С и термостабильный гликолипид. Фосфолипаза С разрушает фосфолипиды в составе сурфактантов на альвеолярной поверхности легких, вызывая развитие ателектазов (бронхоэктазов) при патологии респираторного тракта.
Нейраминидаза также играет важную роль в патогенезе бронхолегочных заболеваний синегнойной этиологии и муковисцидоза, так как участвует в колонизации муцина респираторного тракта.
Эластаза, а также другие протеолитические ферменты синегнойной палочки и экзотоксин А вызывают кровоизлияния (геморрагии), деструкцию тканей и некроз в очагах поражения при инфекциях глаз, пневмонии, септицемии синегнойной этиологии.
Резистентность. P. aeruginosa характеризуется довольно высокой устойчивостью к антибиотикам, что объясняется плохой прони- цаемостью наружной мембраны этих бактерий вследствие врожденного дефекта поринов, а также способностью бактерий синтезировать пенициллиназу.
P. aeruginosa сохраняет жизнеспособность в условиях почти полного отсутствия источников питания: она хорошо сохраняется в пресной, морской и даже дистиллированной воде. Доказано также, что культуры синегнойной палочки могут сохраняться и даже размножаться в растворах дезинфицирующих средств (например,
фурациллина), предназначенных для хранения катетеров и различных медицинских инструментов, промывания ран в ожоговых и хирургических стационарах.
В то же время P. aeruginosa чувствительна к высушиванию, действию хлорсодержащих дезинфицирующих препаратов и легко инактивируется при воздействии высоких температур (при кипячении, автоклавировании).
Эпидемиология. Заболевание синегнойной этиологии может развиться в результате аутоинфицирования (эндогенное заражение) или экзогенно. Источником инфекции являются люди (больные или бактерионосители), а также различные естественные резервуары природы (почва и различные пресные и соленые водоемы). Установлено, что около 5-10% здоровых людей являются носителями различных штаммов P. aeruginosa (они в норме колонизируют кишечник) и около 70% пациентов, находящихся в стационаре. Псевдомонады также встречаются повсеместно: в водопроводных и вентиляционных системах, на фруктах и овощах, комнатных растениях, на поверхности мыла, щетках для мытья рук, полотенцах, в дыхательных аппаратах и т.д. Поэтому синегнойную инфекцию можно считать сапроантропонозом. Механизмы и пути заражения при инфекциях, вызванных синегнойной палочкой, - контактный, респираторный, кровяной, фекально-оральный.
Синегнойная инфекция может возникнуть как у иммунодефицитных лиц с тяжелой сопутствующей патологией (диабет, ожоговая болезнь, лейкоз, муковисцидоз, иммуносупрессия при онкологических заболеваниях и трансплантации органов), так и на фоне нормальной иммунологической реактивности организма. Известно, что адгезивная активность P. aeruginosa усиливается при повышении температуры окружающей среды, поэтому посещение бассейна, бани, принятие лечебных ванн также могут спровоцировать синегнойную инфекцию.
Синегнойная палочка является возбудителем внутрибольничных (госпитальных) инфекций, т.е. заболеваний, возникающих у людей, находящихся на лечении в стационаре. Заражение синегнойной инфекцией в клинике может быть связано с медицинскими манипуляциями (катетеризация мочевого пузыря, эндоскопическое исследование, промывание ран, перевязка, обработка антисептиками ожоговой поверхности, применение аппарата для искусственной вентиляции легких и др.), когда инфицирование
происходит через грязные руки персонала, инструменты, на поверхности которых микроб образует биопленку, или с использованием контаминированных растворов.
Патогенез. Синегнойные палочки обычно проникают в организм человека через поврежденные ткани. Прикрепляясь, они заселяют раневую или ожоговую поверхность, слизистые оболочки или кожу человека и размножаются. При отсутствии у человека иммунных механизмов против синегнойной инфекции локаль- ный процесс (инфекция мочевыводящих путей, кожи, респираторного тракта) может стать распространенным (генерализованным). Бактериемия приводит к распространению возбудителя и развитию сепсиса, часто вызывающего формирование вторичных гнойных очагов инфекции. При воздействии факторов патогенности (экзотоксинов, ферментов агрессии) происходит нарушение функционирования органов и систем и могут развиться тяжелые осложнения - синдром диссеминированного внутрисосудистого свертывания, шок, а также респираторный дистресс-синдром.
Клиническая картина. Синегнойная палочка вызывает гнойновоспалительные заболевания различной локализации: раневые инфекции, ожоговую болезнь, менингиты, инфекции мочевыводящих путей, кожи, заболевания глаз, некротическую пневмонию, сепсис и др. Летальность от синегнойного сепсиса достигает 50%.
Иммунитет. В сыворотке крови здоровых людей, а также пе- реболевших инфекциями синегнойной этиологии обнаруживают антитоксические и антибактериальные антитела, однако их роль в защите от повторных заболеваний мало изучена.
Микробиологическая диагностика. Основным методом диагностики является бактериологическое исследование. Материалами для исследования служат кровь (при септицемии), спинно-мозговая жидкость (при менингите), гной и раневое отделяемое (при инфицированных ранах и ожоговых поражениях), моча (при инфекциях мочевыводящих путей), мокрота (при инфекциях респираторного тракта) и др. Бактериоскопия мазков из исследуемого материала малоинформативна. При идентификации P. aeruginosa учитывают характер их роста на ЦПХ-агаре, пигментообразование, наличие характерного специфического запаха культуры, положительный цитохромоксидазный тест, выявление термофильности (рост при 42 ?С), способность окислять глюкозу в OF-тесте. Для внутривидовой идентификации бактерий проводят серотипирование, пиоцинотипирование, фаготипирование.
Серологический метод исследования направлен на обнаружение специфических антител к антигенам синегнойной палочки (обычно экзотоксину А и ЛПС) с помощью РСК, РПГА, опсонофагоцитарной реакции и некоторых других тестов.
Лечение. Для лечения синегнойной инфекции применяют анти- биотики, причем рекомендуется комбинирование препаратов из разных групп. Антимикробную терапию назначают только после определения антибиотикограммы. В экстренных случаях антибиотики применяют эмпирически.
Для лечения тяжелых форм синегнойной инфекции используют также гипериммунную плазму, полученную из крови добровольцев, иммунизированных поливалентной корпускулярной синегнойной вакциной.
При местном лечении инфекций кожи (трофических язв, эктиме, ожоговых ран), вызванных P. aeruginosa, применяют антисинегнойный гетерологичный иммуноглобулин, получаемый из сыворотки крови баранов, гипериммунизированных взвесью культур синегнойных палочек 7 различных иммунотипов, убитых формалином.
Кроме того, для лечения гнойных инфекций кожи, абсцессов, термических ожогов, осложненных синегнойной инфекцией, ци- ститов, маститов и других заболеваний синегнойной этиологии (кроме сепсиса) можно применять синегнойный бактериофаг (бактериофаг пиоцианеус) или поливалентный жидкий пиобактериофаг.
Профилактика. Эффективная стерилизация, дезинфекция и антисептика, а также соблюдение правил асептики являются основными мерами неспецифической профилактики синегнойной инфекции в стационаре. План профилактических мероприятий обязательно должен включать контроль за обсемененностью внешней среды (воздух, различные предметы, инструменты и аппаратура), соблюдение правил личной гигиены.
С целью неспецифической профилактики гнойно-воспалительных заболеваний пациентам с ослабленным антиинфекционным иммунитетом рекомендуется назначать иммуномодуляторы.
Для создания активного иммунитета против синегнойной инфекции применяют вакцины. В настоящее время разработаны вакцины из ЛПС синегнойной палочки, полисахаридные субкорпускулярные (химические) вакцины, рибосомные вакцины, пре-
параты из жгутиковых антигенов P. aeruginosa и компонентов внеклеточной слизи, а также анатоксины из внеклеточных протеаз и экзотоксина А. В России применяются поливалентная корпу- скулярная синегнойная вакцина (из 7 штаммов P. aeruginosa) и стафилопротейно-синегнойная вакцина.
Активная иммунизация против инфекций, вызываемых P. aeruginosa, показана больным из групп риска (больным с муковисци- дозом, диабетом, а также иммунодефицитным лицам). Однако в связи с тем, что иммунный ответ на вакцинные препараты у людей с иммунодефицитами бывает поздним и не всегда полноценным, большое значение придается комбинированию методов активной и пассивной иммунизации.
16.3.7.2. Буркхольдерии (род Burkholderia)
Бактерии рода Burkholderia относятся к семейству Burkholderiaceae и насчитывают 29 видов, из которых три вида имеют наибольшее значение в патологии человека: Burkholderia mallei, ко- торый является возбудителем сапа, B. pseudomallei - возбудитель мелиоидоза и B. cepacia - возбудитель гнойно-воспалительных за- болеваний.
Возбудитель сапа Burkholderia mallei
Возбудитель сапа Burkholderia mallei был открыт Ф. Леффлером и Х. Шутцем в
Биологические свойства. Возбудители сапа - мелкие грамотрицательные палочки, неподвижные, спор и капсул не образуют. Аэробы. Хорошо растут на простых питательных средах, в отличие от псевдомонад, пигмента не образуют. Штаммы возбудителя сапа различаются по антигенной структуре. Ведущим фактором пато- генности является эндотоксин (маллеин), который действует на клетки гладкой мускулатуры различных органов, вызывает симптомы лихорадки и снижение массы тела.
Резистентность. B. mallei чувствительны к высушиванию и нагреванию. Во влажной среде и гниющих материалах возбудите- ли сапа сохраняются около месяца. Большинство дезинфектантов (кроме лизола) убивают эти бактерии.
Эпидемиология. Сап - зооантропонозная особо опасная инфекция. Основным резервуаром возбудителя и источником инфекции являются парнокопытные животные (лошади, ослы, мулы, верблюды, зебры), а также хищники, поедающие мясо этих жи-
вотных. Случаи заражения человека от животных обычно связаны с его профессиональной деятельностью (ветеринарные врачи, работники животноводства). Заболевание может передаваться от человека к человеку, однако заболеваемость людей обычно носит спорадический характер. Описаны случаи внутрисемейного заражения сапом.
Механизм заражения чаще всего контактный (при уходе за больными животными), возможны также фекально-оральный (с пищевыми продуктами) и респираторный механизмы передачи возбудителя.
Сап встречается в странах Средиземноморья, Юго-Восточной Азии. В России существует опасность завоза инфекции из-за ру- бежа.
Патогенез и клиническая картина. Входными воротами инфекции являются слизистые оболочки глаз, носа, верхних дыхательных путей, травмированные кожные покровы. На месте проникновения возбудителя образуются папулы, которые затем превращаются в пустулы и язвы. Инфекционный процесс редко носит локальный характер - при сапе наблюдаются бактериемия, септицемия с образованием вторичных гнойных очагов в мышцах и внутренних органах. Инкубационный период составляет в среднем 1-5 дней. Заболевание протекает тяжело. Во внутренних органах формируются гранулемы и абсцессы. Острая форма сапа длится 7-14 дней и в 100% случаев заканчивается летально.
Иммунитет изучен плохо.
Микробиологическая диагностика. Материалом для исследования служат отделяемое из носа, содержимое гнойных язв, мокрота или кровь, секционный материал после смерти больного. Исследование проводят только в специализированных лабораториях с соблюдением правил работы с возбудителями особо опасных инфекций. Применяют бактериоскопический (ориентировочный), бактериологический (выделение и идентификация возбудителя) и серологический (РСК, реакция агглютинации) методы. Кожноаллергическая проба с маллеином (фильтратом бульонной культуры возбудителя) также позволяет подтвердить диагноз сапа.
Лечение. Применяют антибиотики - аминогликозиды, тетра- циклины.
Профилактика. Специфическая профилактика не разработана. Неспецифическая профилактика включает тщательное соблюдение
правил индивидуальной защиты при уходе за больными животными и при работе с инфекционным материалом, а также ветеринар- ный надзор с целью выявления больных животных и инфицированных продуктов животного происхождения с обязательным их уничтожением.
Возбудитель мелиоидоза Burkholderia pseudomallei
Возбудитель мелиоидоза (ложного сапа) - Burkholderia pseudomallei - был выведен в
Биологические свойства. Burkholderia pseudomallei - мелкая подвижная грамотрицательная палочка. Окрашивается биполярно. Спор и капсул не имеет. Аэроб. Хорошо растет на простых питательных средах, образует кремовые или оранжевые, гладкие или шероховатые колонии. Растет медленно (около 72 ч). Подобно синегнойной палочке, может расти при 42 ?С. Окисляет глюкозу, лактозу и некоторые другие углеводы. Имеет О- и Н-антигены. Имеет факторы патогенности - летальный и дерматонекротиче- ский токсины, ЛПС, протеазы и гемолизин.
Резистентность. B. pseudomallei довольно устойчива в окружающей среде: в отличие от возбудителя сапа сохраняет жизнеспособность при высушивании, в течение месяца сохраняется в моче и фекалиях, а также в трупах животных. Вместе с тем возбудитель довольно чувствителен к различным дезинфектантам.
Эпидемиология. Возбудитель мелиоидоза распространен в природе - его выделяют из образцов почвы, воды, на рисовых полях, с поверхности овощей и фруктов.
Мелиоидоз - зоонозное инфекционное заболевание, протекающее по типу септикопиемии. Источником инфекции являют- ся различные сельскохозяйственные (свиньи, лошади, крупный и мелкий рогатый скот) и дикие животные, а также грызуны. Случаев заражения человека от человека не описано. Возбудитель попадает в организм человека через поврежденную кожу (контактный механизм), слизистые оболочки (респираторный и фекально-оральный механизмы). Не исключается также заражение через переносчиков (кровяной механизм, путь передачи инфекции трансмиссивный). Естественная восприимчивость людей невысокая.
Мелиоидоз - эндемичное заболевание, встречается преимущественно в странах Юго-Восточной Азии и Австралии.
Патогенез и клиническая картина. Патогенез мелиоидоза мало изучен. Из первичного очага возбудитель быстро попадает в кровь,
вызывая бурную интоксикацию. Оседая в различных внутренних органах, он вызывает возникновение множественных абсцессов.
Инкубационный период составляет в среднем 2-3 дня. Заболевание протекает остро, однако возможно и латентное течение. Болезнь в большинстве случаев заканчивается летально.
Иммунитет не изучен.
Микробиологическая диагностика. Материалом для исследования служат кровь, моча, мокрота, испражнения, рвотные массы, гной, секционный материал. Для постановки диагноза применяют бактериоскопический (обнаруживают биполярно окрашенные палочки), бактериологический (выделение и идентификация возбудителя), биологический (биопроба на мышах или морских свинках) и серологический (реакция агглютинации, РСК, РПГА) методы исследования.
Лечение. Применяют антибиотики и сульфаниламидные препараты.
Профилактика. Специфическая профилактика не разработана. Основные профилактические мероприятия сводятся к ветеринарному надзору и санитарно-разъяснительной работе в очагах возникновения болезни.
16.4. Палочки грамотрицательные анаэробные
16.4.1. Общая характеристика грамотрицательных бесспоровых анаэробных бактерий
Таксономия. Грамотрицательные бесспоровые анаэробные бактерии (ГОБАБ) представляют собой обширную группу анаэробных микробов, относящихся к различным таксонам, не образующих споры и способных удовлетворять свои энергетические потребности только при отсутствии кислорода (в пределах до 0,5-0,8% для строгих анаэробов и от 1 до 8% - для умеренных).
Основные представители, имеющие медицинское значение, относятся к семействам Acidаminococcaceae (ацидаминококки и вейллонеллы), Bacteroidaceae (бактероиды), Prevotellaceae (пре- вотеллы), Porphyromonadaceae (порфиромонады), Fusobacteriaceae (фузобактерии), а также к Desulfobacteriaceae, Lachnospiriaceae, Succinovibrionaceae и другим извитым формам (анаэробные вибрионы, спириллы и трепонемы).
Классификация анаэробных бактерий базируется на принципах генотипической гомологии, позволяющей определить филогенети- ческое родство ГОБАБ.
Морфология ГОБАБ очень разнообразна. Они представлены тремя известными морфологическими группами: кокками, палочками и извитыми формами. Характерной чертой, затрудняющей диагностику, является полиморфизм в пределах одного рода и даже вида.
Многие ГОБАБ имеют жгутики. Спор не образуют. Имеют хорошо развитый адгезивный аппарат (разнообразные пили, микроворсинки и везикулы), позволяющий анаэробным бактериям колонизировать различные биотопы организма. Некоторые виды способны образовывать капсулу в организме человека, выполняю- щую адгезивную и протективную функции.
Физиология. Основная характеристика - отсутствие толерантности к кислороду ввиду недостаточности ферментных систем (каталаз, пероксидаз, супероксиддисмутаз), нейтрализующих токсичные продукты окислительного метаболизма (перекись водорода, гидроксильные радикалы, одноатомный кислород, супероксидные анионы). Однако у разных видов анаэробов этот признак варьиру- ет. Так, многие ГОБАБ под действием кислорода начинают продуцировать индуцибельные супероксиддисмутазы, что является их важным преимуществом перед многими грамположительными анаэробами. Продукция каталаз широко варьирует у разных видов и не коррелирует с устойчивостью к кислороду. Пероксидазная активность не выявлена.
Микробиологическая диагностика. До настоящего времени морфология ГОБАБ и отношение к окраске по Граму являлись основой лабораторной диагностики. Однако недостатки такой систематики очевидны, поскольку размеры и форма клеток у анаэробных бак- терий вариабельны не только в пределах рода, но и вида, а вариант и интенсивность окраски (впрочем, так же как и морфология) нередко зависят от возраста культуры и условий культивирования. Идентичные по морфологии и окраске по Граму анаэробы могут принадлежать не только к разным семействам и порядкам, но даже и к разным классам бактерий. Поэтому основными методами являются бактериологический с расширенной идентификацией по биохимическим свойствам, а также газовая хроматография (хемотаксономия) и ПЦР (генодиагностика).
Экология и патогенность для человека. К грамотрицательным палочковидным бактериям относятся представители 33 родов, объединенных в 16 семейств (включая и извитые формы), а кокковидным - 5 родов, объединенных в 2 семейства. Среди палочковидных ГОБАБ особое место занимают 5 родов (из 5 разных семейств), являющихся сульфатредуцирующими бактериями, у которых форма клеток варьирует от овальной до нитевидной.
Местом обитания большинства видов ГОБАБ являются ротовая полость, кишечник, мочеполовые пути. Они могут вызывать неспецифические воспалительные процессы разной локализации. Однако патогенность разных видов, так же как и генетическая восприимчивость человека к разным видам, существенно варьирует. Известно, что наиболее частыми возбудителями оппортунистической гнойной инфекции являются бактероиды, превотеллы, пор- фиромонады, фузобактерии и анаэробные спириллы.
В последние годы установлена высокая инфективность и вирулентность у представителей ряда видов, колонизирующих полость рта, которые получили название пародонтопатогенных. К ним от- носятся, в частности, Prevotella intermedia, Porphyromonas gingiva- lis, Tannerella forsythensis. Исследователи приходят к выводу, что эти бактерии являются патогенами и способны передаваться от человека к человеку. Носительство данных видов в человеческой популяции варьирует от 6-8 до 12%. Возможно, что аналогичные патогенные виды (которые в настоящее время считаются представителями нормальной флоры) существуют также и в других биотопах организма человека.
Ниже рассмотрены представители основных таксономических групп ГОБАБ, имеющих важное медицинское значение.
16.4.2. Вейллонеллы (род Veillonella)
Veillonella являются одним из доминирующих (количественно) обитателей полости рта и слизистой оболочки желудочнокишечного тракта. Представляют собой облигатно-анаэробные грамотрицательные мелкие коккобактерии. Неподвижные, спор не образуют. В мазке из чистой культуры располагаются как сферические диплококки, скоплениями в виде гроздьев или короткими цепочками.
Изолированные колонии вейллонелл на лактат-агаре достигают 1-3 мм в диаметре, гладкие, выпуклые, чечевицеобразной или
ромбовидной формы, опалового или желто-белого цвета, мягкие по консистенции.
В полости рта встречаются представители двух видов: V. parvula и V. alcalescens. Они населяют слизистую оболочку полости рта, нёба, являются доминирующими в слюне и протоках слюнных желез.
Благодаря особенностям биохимической активности - вейллонеллы хорошо ферментируют уксусную, пировиноградную и молочную кислоты - играют важную роль в полости рта, нейтрализуя кислые продукты метаболизма других бактерий. Это позволяет рассматривать вейллонеллы как антагонистов кариесогенных стрептококков и важнейший фактор резистентности человека к кариесу зубов. Патогенная роль вейллонелл в развитии воспалительных процессов полости рта не доказана, хотя они нередко выделяются из гнойного экссудата в ассоциации с другими анаэробными бактериями.
16.4.3. Бактероиды (род Bacteroides), превотеллы (род Prevotella), порфиромонады (род Porphyromonas)
Bacteroides - группа грамотрицательных анаэробных бактерий, которых в настоящее время насчитывают свыше 30 видов, объединенных в три основных рода: Prevotella, Porphyromonas и собственно Bacteroides.
В полости рта встречаются пигментообразующие и непигментированные виды, относящиеся в основном к родам Prevotella (P. melaninogenica P. nigrescens, P. intermedia, P. heparinolytica), Porphyromonas (Porphyromonas gingivalis). Такое деление основано на том, что из пародонтальных карманов и полости рта выделяют пигментообразующие виды. Бактерии данной группы in vitro продуцируют различные ферменты агрессии: коллагеназу, гиалуронидазу, хондроитинсульфатазу, гепариназу, IgA-, IgG-, IgM- протеазы, что позволяет рассматривать их как важнейших потенциальных возбудителей одонтогенной инфекции.
В бронхиальном дереве, урогенитальном тракте и особенно в толстой кишке типичными обитателями являются представители собственно рода Bacteroides - Bacteroides fragilis, B. ruminicola, B. thetaiotaomicton, B. uniformis.
Бактероиды, как правило, являются доминирующей флорой в гнойном экссудате при абсцессах, флегмонах, остеомиелитах челюстно-лицевой области, содержимом пародонтального карма-
на при пародонтите и гингивите. К основным пародонтопатогенным видам относят B. forsithus (выделен в новый род - Tannerella), Prevotella nigrescens, P. intermedia, Porphyromonas gingivalis. При инвазии в ткани пародонта они обычно окружены капсульным слоем.
16.4.4. Фузобактерии (род Fusobacterium), лептотрихии (род Leptotrichia)
Анаэробные неспорообразующие грамотрицательные с заостренным концом палочки. Они представляют собой парные палочки, что придает им вид веретена. Fusobacterium были впервые отмечены в 80-х годах XIX века при язвенном гингивите, а позже было обнаружено, что их присутствие связано с наличием спирохет при ангине Венсана. Первоначально в полости рта было выделено 2 вида Fusobacterium: Fusobacterium nucleatum и Fusobacterium plauti. Первые образуют полупрозрачные колонии на агаре, а вторые - серо-белые колонии.
В настоящее время выделяется несколько видов фузобактерий. Fusobacterium nucleatum может быть изолирован из верхних дыхательных путей, где он является самым распространенным видом. Увеличение числа Fusobacterium nucleatum в полости рта связывают с пародонтитом. При наличии спирохет Fusobacterium nucleatum быстро размножаются и занимают доминирующее положение в микрофлоре полости рта. Фузобактерии F. nucleatum, F. necrophorum, F. mortiferum продуцируют мощные гистолитические ферменты - гиалуронидазу, хондроитинсульфатазу, лейцтиназу, имеют эндотоксин.
Наряду с бактероидами и пептострептококками считаются основными возбудителями разнообразных гнойно-воспалительных процессов в полости рта, абсцессов легких, мозга, печени, холецистита и перитонитов, включая быстропрогрессирующие формы (в ассоциации с извитыми микробами).
Ранее существовали проблемы относительно классифицирования лептотрихий, вызванные неправильным употреблением терми- нов (нередко их совершенно неправильно путали с сапрофитными бактериями водоемов - Leptotrix). Длительное время считалось, что этот род представлен одним видом - Leptotrichia buccalis. Согласно прежней классификации, его рассматривали как грамотрицательный микроорганизм, его структура и липополисахариды свойственны таким микроорганизмам. Характерно, что в различ-
ных исследованиях Leptotrichia описывалась как неразветвленные, неподвижные, неспорообразующие прямые или слегка изогнутые палочки, с одним или двумя заостренными концами в молодых культурах и, наоборот, в виде изогнутых, перекручивающихся нитей и цепочек в старых культурах. В культурах возраста менее 6 ч микроорганизмы показывают грамположительную реакцию, но к 24 ч реакция становится грамотрицательной. Хотя этот микроорганизм рассматривается как анаэробный, 5% СО2 необходимо для изоляции и оптимального роста. Ферментирование углеводов подобно ферментированию углеводов гомоферментными лактобактериями полости рта. Как полагают, лептотрихии не способны вызывать серьезные заболевания и относятся к основным стабилизирующим видам. Поэтому нозологическая форма заболевания, известная в России как лептотрихиоз, на самом деле не имеет научного обоснования и должных доказательств.
16.5. Палочки спорообразующие грамположительные
16.5.1. Сибиреязвенные бациллы (род Bacillus)
Сибирская язва (anthrax - злокачественный карбункул) - острая антропозоонозная инфекционная болезнь, вызываемая Bacillus anthracis, которая характеризуется тяжелой интоксикацией, поражением кожи, лимфатических узлов и других органов и высо- кой летальностью.
Заболевание
сибирской язвой известно с глубокой древности, со времен Гиппократа,
Галена и Цельса заболевание известно под названием «священный огонь»
или «персидский огонь». Болезнь впервые описана русским врачом С.С.
Андриевским в
Морфология. Сибиреязвенные бациллы - очень крупные (5-10*1-2 мкм) грамположительные палочки с обрубленными концами, в мазке из чистой культуры располагаются в виде длинных цепочек (стрептобациллы), слегка утолщенных на концах и образующих сочленения («бамбуковая трость»). Неподвижны. Образуют расположенные центрально споры, а также капсулу. В клиническом материале располагаются парами или короткими цепочками, окру-
женными общей капсулой. Капсулы образуются только у бактерий, выделенных из организма либо выращенных на питательной среде, содержащей животный белок (кровь, нативная сыворотка). Капсулы более устойчивы к действию гнилостной микрофлоры, чем бактериальные клетки, и в материале из гнилых трупов нередко можно обнаружить лишь пустые капсулы («тени» микробов). Для обнаружения капсул мазки окрашивают метиленовым синим Леффлера (клетки синие, капсулы малиново-красные). Споры сибиреязвенных бацилл овальной формы размером 0,8-1,0x1,5 мкм, располагаются центрально или субтерминально, не превышают диаметра клетки, сильно преломляют свет (могут быть выявлены в нативном виде при фазово-контрастной микроскопии). Спорообразование зависит от влажности, температуры (12-42 ?С), наличия свободного кислорода, рН среды. Переход из бациллярной в споровую форму происходит при попадании микробов в окружающую среду. В живом организме и невскрытом трупе споры не образуются, что обусловлено поглощением свободного кислорода в процессе гниения. На питательных средах массовое появление спор наблюдается к концу первых суток культивирования.
Культуральные свойства. Аэробы. Хорошо растут на простых питательных средах, бактерии можно выращивать на сыром или вареном картофеле, настое соломы, экстрактах злаков и бобовых в диапазоне температур от 12 до 45 ?С, температурный оптимум роста на плотной среде 35-37 ?С, на жидкой 32-33 ?С. Оптимум рН 7,2-8,6. На жидких средах дают придонный рост в виде комочка ваты, не вызывая помутнения среды; на плотных средах образуют крупные, с неровными краями, шероховатые матовые колонии (R-форма). Под лупой колонии имеют коричневый бугристый центр и более светлую периферию, по краям окруженную светлой зернистой каймой, которая образована пучками нитей клеток. Напоминают гриву льва или голову медузы. На свернутой лошадиной сыворотке растут в виде гладких прозрачных S-форм колоний, тянущихся за петлей. R-форма патогенна для человека, S-форма авирулентна. На средах, содержащих 0,05-0,5 ЕД/мл пе- нициллина, сибиреязвенные бациллы через 3-6 ч роста образуют сферопласты, расположенные цепочкой и напоминающие в мазке жемчужное ожерелье (тест «жемчужное ожерелье»).
Биохимическая активность достаточно высокая: обладают выраженной сахаролитической, протеолитической и липолитической
активностью. Гидролизуют крахмал, образуют ацетилметилкарбинол. Выделяют желатиназу, в отличие от почвенных бацилл об- ладают слабой гемолитической, лецитиназной и фосфатазной активностью.
Антигенная структура. Содержит родовой соматический полисахаридный антиген и видовой белковый капсульный антиген. Образует белковый экзотоксин, обладающий антигенными свойствами. Капсульные антигены и экзотоксин кодируются плазмидами, потеря которых делает бактерии авирулентными. Капсульные анти- гены представлены полипептидами, соединенными с молекулами D-глутаминовой кислоты. По капсульным антигенам выделяют единственный серовар, антитела к капсульным антигенам не обладают протективным свойством. Соматический антиген представлен полисахаридами клеточной стенки, антитела к нему не обладают протективным свойством. Сибиреязвенный экзотоксин имеет сложную структуру и включает в себя протективный антиген.
Факторы патогенности. Патогенен для человека и многих животных (крупный и мелкий рогатый скот, лошади, свиньи, дикие животные). Вирулентные штаммы в воспримчивом организме синтезируют большое количество капсульного вещества, обладающего выраженной антифагоцитарной активностью, и сложный экзотоксин, который представляет собой белковый комплекс, состоящий из вызывающего отек отечного фактора (проявляет эффект аденилатциклазы, повышает концентрацию цАМФ и вызывает отеки), протективного и летального компонентов (проявляет цитотоксический эффект и вызывает отек легких). Эти компоненты по отдель- ности не способны проявлять токсическое действие. Эти факторы в основном и определяют вирулентность возбудителя.
Экологическая ниша: крупный рогатый скот, овцы, козы, лошади, олени, буйволы, верблюды и свиньи.
Устойчивость в окружающей среде. Вегетативная форма неустойчива к факторам окружающей среды, однако споры чрезвычайно устойчивы и сохраняются в окружающей среде десятки лет (в воде до 10 лет, в почве до 30 лет), выдерживают кипячение и автоклавирование.
Чувствительность к антибиотикам. Сибиреязвенные бациллы чувствительны к пенициллину и другим антибиотикам.
Чувствительность к антисептикам и дезинфектантам. Вегетативные формы чувствительны к действию обычно применяемых
антисептиков и дезинфектантов, споры устойчивы к обычно применяемым антисептикам и дезинфектантам в обычных концентрациях. Спороцидным эффектом обладают активированные растворы хлорамина, горячего формальдегида, перекиси водорода.
Эпидемиология. Сибирская язва распространена повсеместно, особенно в районах с развитым животноводством. Источник инфекции - больные животные, чаще всего крупный рогатый скот, овцы, козы, лошади, олени, буйволы, верблюды и свиньи. Человек является биологическим тупиком. Как и для всех зоонозов, для сибирской язвы характерна множественность механизмов, путей и факторов передачи. Человек заражается чаще всего контактным путем, реже алиментарно, аэрогенно и другими путями, при уходе за больными животными, убое, переработке животного сырья, употреблении мяса и других животноводческих продуктов. Восприимчивость к возбудителю относительно невысокая.
Патогенез. Входными воротами возбудителя сибирской язвы в большинстве случаев являются поврежденная кожа, значительно реже - слизистые оболочки дыхательных путей и желудочнокишечного тракта. В основе патогенеза лежит действие экзотоксина возбудителя, отдельные фракции которого вызывают коагуляцию белков, отек тканей, приводят к развитию токсикоинфекционного шока. На месте внедрения возбудителя в кожу развивается сибиреязвенный карбункул - очаг геморрагическинекротического воспаления глубоких слоев дермы на границе с подкожной клетчаткой, сопровождающийся отеком и деструкцией тканей, в центре очага - некроз кожи с образованием буро-черной корки (anthrax - уголь), сопровождающейся отеком. Возбудитель из входных ворот заносится макрофагами в регионарные лимфатические узлы, в которых развивается воспаление без серьезных нарушений барьерной функции, в силу чего генерализация процесса не наступает или наступает в относительно поздние сроки от начала воспалительного процесса. При вдыхании пылевых частиц, содержащих сибиреязвенные споры, макрофаги захватывают возбудителя со слизистой оболочки дыхательных путей и заносят в трахеобронхиальные лимфатические узлы, в которых развивается воспаление с исходом в тотальный некроз, способствующий гема- тогенной генерализации инфекции.
Иммунитет. После перенесенного заболевания развивается стойкий перекрестный клеточно-гуморальный иммунитет, хотя отмечаются отдельные случаи повторного заболевания.
Клиническая картина. Продолжительность инкубационного периода сибирской язвы от нескольких часов до 12 дней, в среднем 2-3 дня. Клиническая картина обусловлена характером пораженных органов. Различают кожную, легочную и кишечную клинические формы сибирской язвы, которые могут закончиться сеп- сисом. Генерализованные формы в 100% случаев заканчиваются летально; при кожной форме летальность не превышает 5%.
Лабораторная диагностика. Материалом для исследования служат содержимое карбункула и пузырьков, мокрота, испражнения, кровь и моча. При патолого-анатомическом исследовании забирают кусочки органов или целые органы. По эпидемиологическим показаниям исследуют различные объекты внешней среды, а также шерсть и щетину животных. Все образцы помещают в герметичные сосуды и транспортируют закупоренными в опломбированных боксах или деревянных ящиках в лаборатории особо опасных инфекций (см. главу 15).
Микробиологическую диагностику проводят с соблюдением правил техники безопасности при особо опасных инфекциях. Для диагностики применяют все 5 методов микробиологической диагностики.
Первоначально из материала готовят мазки, которые окрашивают по Граму, а также по Романовскому-Гимзе и метиленовой синькой для выявления капсулы. Наличие в мазках крупных грамположительных стрептобацилл, окруженных капсулой, дает возможность поставить предварительный диагноз. Люминесцентная микроскопия применяется как дополнительный метод диагностики сибирской язвы, при этом сибиреязвенные бациллы, обработанные люминесцирующей сывороткой, выглядят как палочки с ободком, светящиеся зеленоватым светом.
Для выделения чистой культуры исследуемый материал засевают на МПА и МПБ, а также заражают лабораторных животных (белые мыши, морские свинки). Выделенную чистую культуру идентифицируют по следующим тестам: характер роста на МПА и МПБ, разжижение желатина в виде перевернутой елочки, отсутствие подвижности, по тесту «жемчужное ожерелье» и лизису сибиреязвенным бактериофагом ВА-9 и «Саратов». Дополнительно определяют лецитиназную, фосфотазную и гемолитическую активность.
В биопробе патологический материал или испытуемую культуру вводят подкожно морским свинкам в паховую область, мышам в
корень хвоста. Наблюдение за животными продолжают в течение 10 дней. У павших животных исследуют печень, селезенку, лимфа- тические узлы, почки, кровь из полостей сердца, места введения исследуемого материала. О наличии возбудителя сибирской язвы свидетельствует типичная патолого-анатомическая картина у подопытных животных: отек в месте введения исследуемого материала, темная несвернувшаяся кровь, кровоизлияния в клетчатке, рыхлая селезенка и плотная красная печень. В мазках-отпечатках из органов и крови имеются грамположительные капсулированные палочки.
Серодиагностика проводится в тех случаях, когда не удается обнаружить возбудителя в материале. Для определения антител в сыворотке крови больного используют реакцию латексной агглютинации или РПГА с протективным сибиреязвенным антигеном. Сибиреязвенные антигены определяют в РИФ, ИФА, РСК, РНГА, РП в геле и реакции термопреципитации по Асколи. Реакция Асколи имеет большое значение, так как позволяет обнаружить возбудитель при отрицательных результатах бактериологического исследования. Наличие сибиреязвенного антигена в разложившемся или мумифицированном трупе животного, коже (свежей, сухой, выделанной) и изделиях из нее, шкурках, мехе, шерсти определяют с помощью реакции термопреципитации по Асколи. Однако для прижизненной диагностики она не дает серьезных преимуществ перед бактериологическим и серологическим методами.
Для ретроспективной диагностики
при эпидемиологических исследованиях ставят кожные аллергические пробы
с антраксином. Антраксин вводят внутрикожно в количестве 0,1 мл,
результаты учитывают через 24-48 ч. Пробу считают положительной при
наличии гиперемии диаметром более
Лечение. Для лечения применяют антибиотики и сибиреязвенный иммуноглобулин. Для антибактериальной терапии препарат выбора - пенициллин, при его непереносимости - тетрациклин.
Профилактика проводится в направлении всех трех звеньев эпидемического процесса: мероприятия 1-й группы направлены на источник инфекции, мероприятия 2-й группы - на разрыв механизма и путей передачи и мероприятия 3-й группы - на восприимчивый коллектив. Для специфической профилактики применяется живая сибиреязвенная вакцина СТИ (Санитарно-технический институт). Вакцина получена Н.И. Гинсбургом и А.Л. Тамариным
в
• Изоляция больных и подозрительных животных.
• Сжигание трупов погибших животных и зараженных объектов (подстилка, навоз).
• Обеззараживание мест содержания больных животных.
• Очистка водопоев.
• Осушение заболоченных участков (перепахивание, хлорирование).
•
Организация скотомогильников. При невозможности сжигания трупов
их хоронят на отдельных сухих и пустынных участках; глубина ямы должна
быть не менее
• Санитарный надзор за предприятиями, занятыми переработкой животного сырья. Все поступающее сырье проверяют в реакции термопреципитации по Асколи, меховые изделия изготовляют из сырья, давшего отрицательный результат в реакции термопреципитации по Асколи.
16.5.2. Спорообразующие бактерии рода Clostridium
Еще в
Это явление Пастер назвал анаэробиозом, что означает жизнь при отсутствии воздуха. Годы Первой мировой войны стали годами интенсивного изучения анаэробных инфекций. В результате были изучены основные возбудители газовой гангрены, унифицирована и упрощена методика работы с ними.
Спорообразующие анаэробы рода Clostridium принадлежат к семейству Bacillaceae и насчитывают свыше 150 видов. Эти бактерии при наличии благоприятных условий способны вызывать у человека газовую гангрену, столбняк, ботулизм, псевдомембранозный язвенный энтероколит, пищевые отравления и другие заболевания,
связанные с клостридиальным поражением различных органов и систем.
Рис. 16.4. Clostridium botulinum
споры округлой или овальной формы, располагаются в центре клетки субтерминально или терминально в зависимости от видовой принадлежности микроба (рис. 16.4). Поперечник споры обычно больше поперечника клетки, поэтому клетка, содержащая спору, выглядит раздутой и напоминает веретено (от лат. clostridium - веретено). Форма бактерий может сильно изменяться под влиянием различных факторов вплоть до появления клостридий в форме кокков, нитевидных бактерий и т.д. Все они, кроме C. perfringens, подвижны, перитрихи, имеют 15-20 жгутиков. C. perfringens в организме человека или животных может образовывать капсулы.
Патогенные клостридии - грамположительные палочки. Большинство патогенных клостридий способны продуцировать истинные экзотоксины очень большой силы. Например, ботулотоксин не имеет себе равных по силе среди природных биологических ядов.
Биохимические свойства патогенных клостридий различны. Некоторые виды отличаются очень высокой сахаролитической активностью, другие обладают большой протеолитической активностью. Есть патогенные клостридии, которые в биохимическом отношении малоактивны.
16.5.2.1. Возбудители газовой гангрены
Возбудителей газовой гангрены по степени патогенности принято делить на три группы. Первая группа включает наиболее патогенные виды, каждый из которых может вызывать газовую гангрену (C. perfringens, С. novyi и С. septicum). Во вторую группу входят клостридии, обладающие менее патогенными свойствами (С. histolyticum, С. bifermentans, С. sporogenes, C. fallax). Каждый из них также способен самостоятельно вызывать газовую гангрену, но чаще при этом заболевании они встречаются в ассоциации с другими анаэробами. Третья группа представлена маловирулент-
ными клостридиями, не способными вызывать развитие газовой гангрены, однако, присоединяясь к возбудителям первой или вто- рой группы, они существенно ухудшают течение болезни. К ним относятся C. tertium, С. butiricum, C. sordellii и некоторые другие. Газовая гангрена - полимикробное заболевание, в патогенезе которого важную роль играет и сопутствующая микрофлора (стафилококки, стрептококки, энтеробактерии и другие возбудители). Обнаружение патогенных клостридий в раневом отделяемом далеко не всегда свидетельствует о развитии соответствующего заболевания, поэтому правильный этиологический диагноз должен быть основан на совокупности клинических и микробиологических данных.
Клостридии обитают в почве и попадают в рану из внешней среды с инородными телами - пулями, осколками, обрывками одежды, занозами и т.д. Для заболевания характерны быстрое распространение болезненного отека мягких тканей с их разрушением, а также общая интоксикация пораженного организма. Очень часто в погибшей ткани накапливаются газообразные продукты, раневое отделяемое имеет зловонный запах.
Чаще всего газовая гангрена развивается после обширных и глубоких проникающих ранений мягких тканей. В мирное время это следствие автомобильной или железнодорожной катастрофы, травм на производстве, в сельском хозяйстве или в быту, внебольничных абортов, ожогов, обморожений, хирургических операций на желудочно-кишечном тракте, ампутаций, инъекций различных лекарственных препаратов и т.д.
C. perfringens - длинная грамположительная палочка (рис. 16.5). Имеет серовары A, B, C, D и F. В жидких питательных средах, приготовленных из гидролизатов мяса или казеина (рН 7,4), при 37-43 ?С растет быстро (3-8 ч) с бурным газообразованием и изменением рН в кислую сторону. Смесь газов (водород, углекислый газ, аммиак, сероводород, летучие амины, альдегиды, кетоны), выделяющихся из больших объемов растущей культуры, в присутствии огня может дать взрыв. Существует три устойчивых варианта колоний C. perfringens: гладкий (S), слизистый (М) и шероховатый (R), однако при определенных условиях могут появляться колонии смешанного (О) варианта. Колонии, выросшие на поверхности кровяного агара, часто окружены одной или двумя зонами гемолиза и при выдерживании на воздухе приобретают зеленоватую окра-
Рис. 16.5. Clostridium perfringens
ску. Вокруг колоний, вырабатывающих α-токсин (лецитиназу), в желточном агаре образуется зона перламутрового преципитата.
Большинство штаммов обладает протеолитическими свойствами, медленно расплавляя свернутую сыворотку (вареные кусочки мяса) на 2-7-й день. Многие штаммы вырабатывают ферменты, расплавляющие через 24 ч 7% желатин. Характерной для C. perfringens является способность свертывать лакмусовое молоко с образованием сгустка кирпичного цвета и полным просветлением молочной сыворотки. Все штаммы сбраживают с образованием кислоты и газа глюкозу, галактозу, мальтозу, лактозу, левулезу, сахарозу и не ферментируют маннит и дульцит. Некоторые штаммы разлагают глицерин и инулин.
С. septicum -
полиморфная грамположительная палочка с суб- терминальными спорами. В
зависимости от состава среды она может превращаться в короткие вздутые
формы и длинные нити. Последние часто обнаруживаются в трупах животных
на поверхности печени, прилегающей к диафрагме. Строгий анаэроб. На
поверхности плотных питательных сред только через 48 ч образует
блестящие полупрозрачные колонии диаметром до
лактозу, галактозу, фруктозу, салицин и не разлагает глицерин и маннит, разжижает желатин и свертывает лакмусовое молоко с образованием кислоты и газа. Очень редко разлагает сахарозу. Не образует индол, не восстанавливает нитраты в нитриты и не вырабатывает большого количества сероводорода.
C. fallax - грамположительная прямая, иногда инкапсулированная палочка с закругленными концами, редко образующая овальные центральные или субтерминальные споры. Перитрих, подвижна в молодых культурах. Строгий анаэроб. На поверхности агара через 1-2 сут образует плоские прозрачные колонии с не- ровным краем диаметром 1-2 мм, которые затем становятся матовыми, с возвышением в центре. На агаре с кровью лошади вокруг колоний имеется узкая зона гемолиза. В глубине агара колонии напоминают мелкие чечевицы, иногда с выростами на краю. Ферментирует глюкозу, мальтозу, лактозу, сахарозу, маннит, салицин, не разлагает крахмал и глицерин, не сбраживает молоко с образованием кислоты. Не образует сероводород, индол, не восстанавливает нитраты в нитриты. Выделяется из ран в 1-4% случаев.
C. sordellii - грамположительная палочка, образующая овальные, центральные и субтерминальные споры на обычных средах. Перитрих, подвижна в свежих культурах. Анаэроб нестрогий. На поверхности питательных сред через 1-2 сут образует слабовыпуклые серовато-белые колонии с неровным краем. На кровяном агаре (эритроциты лошади) колонии окружены узкой зоной гемолиза. В глубине агара колонии имеют форму чечевиц или сердца с выростами по краю.
Ферментирует мальтозу, глюкозу и фруктозу, не разлагает лактозу и сахарозу. Разжижает желатин и свернутую сыворотку, вы- рабатывает сероводород и индол.
Деление патогенных клостридий на варианты связано с их способностью вырабатывать различные по антигенным свойствам ле- тальные и некротические токсины. Например, C. perfringens вырабатывает более десятка различных токсинов и ферментов (α, β, γ, δ, ε, ζ, η, θ, ι, κ, λ, μ).
В развитии типичной картины газовой гангрены наибольшую роль играет лецитиназа (α-токсин), которая обладает летальны- ми, гемолитическими и дермонекротическими свойствами. Этот токсин вызывает не только местные изменения в мышечной ткани - коагуляционный и колликвационный некроз здоровой ткани
(рис. 16.6), но и тяжелую интоксикацию организма больного с выраженным нарушением кровообращения, гемолитической анемией, угнетением эритро- и лейкопоэза, поражением паренхиматозных органов и костного мозга. Некоторую роль в этом разрушительном процессе могут играть другие ферменты (коллагеназа - летальный и некротический фактор, гемолизин, гиалуронидаза, ДНКаза и др.).
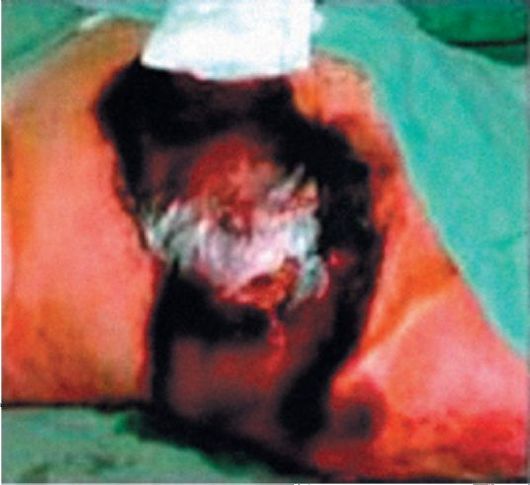
Рис. 16.6. Некроз при газовой гангрене
Главные летальные и некротические факторы и токсины типов В, С, D, E и F изучались главным образом в связи с энте- ротоксемиями у человека и животных, а их роль в патогенезе газовой гангрены почти не исследовалась. Типы А и В образуют термолабильный летальный и некротический α-токсин. β-токсин в больших количествах выделяют типы D, в меньших - В (это некротический, гемолитический - лецитиназа С).
Помимо указанных токсинов и ферментов, описаны γ-гемолизин, который вырабатывает только штаммы типа А, δ-токсин, представляющий собой легкоокисляемый кислородом гемолизин, который обнаруживают у некоторых штаммов типа А, и некоторые других.
Особенностью является то, что тип С не вырабатывает ни один из вышеуказанных ферментов. Фильтраты токсигенных штаммов С. septicum содержат по крайней мере несколько активных субстанций, природа и химическая структура которых еще далеко не изучены.
Основной летальный, некротический и гемолитический фактор С. septicum - это кислородостабильный α-токсин. При внутривенном введении его мышам он вызывает быструю гибель животных с явлениями судорог и параличей. Этот фермент не относится к лецитиназам. Кроме α-токсина, штаммы С. septicum вырабатывают β-токсин (ДНКаза), γ-токсин (гиалуронидаза), кислородостабильный δ-гемолизин, имеющий общие антигены с θ-гемолизином C. perfringens.
Все 6 типов C. perfringens способны вызывать газовую гангрену у человека и животных в том случае, если возбудитель вырабатывает
лецитиназу. В экспериментальных условиях весьма чувствительны к заражению голуби, воробьи, тогда как другие животные (кролики, свинки, мыши и т.д.) более устойчивы к заражению. Типичную картину изменения тканей, вызываемых C. perfringens, можно получить при внутримышечной инъекции морской свинке 0,5 мл свежей культуры гладкой формы этого микроба. Смерть животного наступает в сроки от нескольких часов до нескольких суток.
C. fallax обнаружены при аппендиците, ранениях, хроническом артрите у людей и при гангрене скота. Свежие культуры, изолированные из ран, в первых генерациях бывают патогенными для мышей и морских свинок, однако вирулентность штаммов быстро теряется.
C. sordellii в эксперименте на животных способен вызвать за- болевание, похожее на газовую гангрену, с подкожным желатинозным отеком, иногда розово-красного цвета. Смерть животных происходит обычно за счет действия летального токсина в течение 1-2 дней после введения культуры. Описаны случаи смертельных кишечных заболеваний у человека и рогатого скота.
Среди других клостридий, относительно часто изолируемых из ран, следует упомянуть C. tertium, C. butyricum, которые непатогенны для лабораторных животных, но могут оказывать некоторое влияние на течение газовой гангрены, находясь в ассоциациях с патогенными клостридиями.
Лечение заключается в обработке ран, раннем введении с профилактической целью поливалентной антитоксической очищенной концентрированной сыворотки по 10 тыс. МЕ. С лечебной целью эту дозу увеличивают в 5 раз (по 50 тыс. МЕ каждой сыворотки) и применяют антибиотики. Лечение только одной сывороткой в ряде случаев не дает нужного эффекта, в то время как комплексное применение антитоксической сыворотки антибиотиков сопровождается значительным снижением летальности.
16.5.2.2. Возбудитель столбняка Clostridium tetani
Столбняк
(от греч. тетанус - оцепенение, судорога) - острое инфекционное
заболевание с преобладанием симптомов токси- коза, проявляющееся
судорогами поперечно-полосатых мышц вследствие поражения токсином
двигательных клеток центральной нервной системы. Возбудитель столбняка
обнаружен А. Николайером в
Заболевание возникает в результате загрязнения ран почвой, содержащей споры столбнячной палочки. В естественных условиях столбняком поражаются человек и лошадь, однако восприимчивы и другие животные: козы, собаки, кошки, из лабораторных животных - морские свинки, мыши, кролики. Нечувствительны к столбнячному токсину птицы
и холоднокровные животные. Однако при переохлаждении птиц и перегревании холоднокровных животных можно получить сим- птом столбняка и у них.
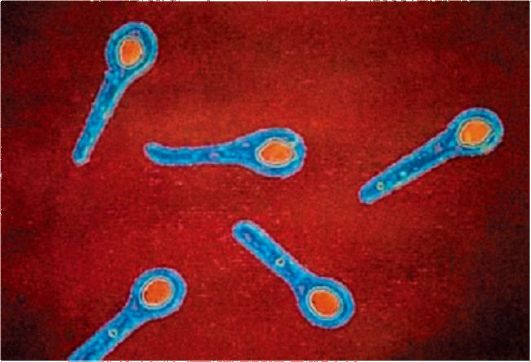
Рис. 16.7. Возбудитель столбняка Clostridium tetani
C. tetani - подвижная палочка с закругленными концами (рис. 16.7). Образует круглые терминальные споры, в результате чего приобретает вид барабанной палочки. Имеет перитрихиально расположенные жгутики, хорошо окрашивается всеми анилиновыми красителями, грамположительна, хотя в старых культурах могут встречаться и грамотрицательные особи.
Возбудитель столбняка - строгий анаэроб, чрезвычайно чувствительный к кислороду. Хорошо растет в глубине жидких пита- тельных сред, налитых в высокие пробирки, флаконы или бутылки при наличии в них редуцирующих веществ (глюкоза, кусочки печени или мышц, вата и др.). Питательные среды должны иметь нейтральную или слабокислую реакцию (рН 6,8-7,4). Жидкие среды после посева в них материала необходимо заливать слоем вазелинового масла, а перед посевом удалять из них кислород путем кипячения на водяной бане в течение 10-15 мин, после чего охлаждать до 40-50 ?С. Оптимальной температурой при выращивании посевов является 35-37 ?С.
На плотных питательных средах - кровяном или печеночном агаре - столбнячная палочка хорошо растет только при полном удалении кислорода. На чашках с кровяным агаром через 2-4 сут вырастают отдельные прозрачные или слегка сероватые колонии диаметром 2-5 мм с неровной зернистой поверхностью, края колонии шероховатые, ветвящиеся. Более старые колонии имеют желтоватый плотный центр и совершенно прозрачные бесцветные
неровные ветвящиеся края. На кровяном агаре каждая колония окружена зоной гемолиза. При посеве в конденсационную жидкость скошенного агара в пробирках C. tetani растет в виде едва заметных нитевидных отростков, вползающих на поверхность агара. Эту особенность микроба можно использовать при выделении чистой культуры. При этом пробирки со скошенным агаром следует помещать в анаэростат. В высоком столбике агара через 1-2 сут вырастают плотные колонии, напоминающие чечевичное зерно или диск (R-форма) либо пушинку с плотным центром (S-форма). В столбике желатина через 5-6 дней столбнячная палочка растет в виде елочки, желатин при этом разжижается.
C. tetani обладает слабыми протеолитическими свойствами: при выращивании в жидкой среде, содержащей кусочки печени или сваренного вкрутую яичного белка, их протеолиза не происходит даже через длительное время. Микроб не сбраживает моносахариды и многоатомные спирты. Только отдельные штаммы ферментируют глюкозу. Все штаммы медленно сбраживают молоко с образованием очень мелких хлопьев.
Наиболее характерной особенностью возбудителя столбняка является его способность продуцировать экзотоксины, которые и обусловливают специфику как патогенеза, так и клинической картины столбнячной инфекции. Столбнячный токсин состоит из двух фракций: нейротоксина, или тетаноспазмина, который действует на нервную систему, вызывая тоническое сокращение поперечно- полосатой мускулатуры и обусловливая специфический симптомокомплекс столбняка (рис. 16.8); тетаногемолизина, растворяющего эритроциты. Тетаноспазмин обнаруживают в культурах на 2-3-и сутки, а максимальное его накопление наблюдается на 5-7-е сутки. Он быстро разрушается при хранении в обычных лабораторных условиях под влиянием света и кислорода и при сравнительно невысокой температуре (55-56 ?С), хорошо сохраняется в высушенном состоянии. Тетаногемолизин в культуре обнаруживается через 8-10 ч, максимальное его накопление заканчивается через 20-30 ч. Столбнячный нейротоксин состоит из 13 аминокислот и оказывает сильное токсическое действие: в 1 мл культуральной жидкости содержится от 100 тыс. до 1-4 млн смертельных доз для белых мышей массой 15-18 г. Количество минимальных летальных доз для морских свинок примерно в 8-10 раз меньше, чем для мышей. Столбнячный токсин не всасывается слизистыми обо-

Рис. 16.8. Клиническая картина столбняка (Bell С., 1809)
лочками кишечника, поэтому не вызывает гибели животных при введении через рот.
Антигенная структура C. tetani неоднородна и определяется наличием термолабильных жгутиковых Н-антигенов и групповых соматических О-антигенов. По типовому Н-антигену выделяют 10 сероваров. Штаммы всех сероваров вырабатывают один и тот же специфический токсин, который полностью нейтрализуется противостолбнячной сывороткой, полученной при иммунизации животных токсином любого штамма.
Вегетативные формы возбудителя столбняка гибнут и обезвреживаются от действия всех применяющихся дезинфицирующих средств. Споры же обладают большей устойчивостью. Они длительно сохраняются при кипячении в течение 10-90 мин, а споры некоторых штаммов - через 1-3 ч, 5% раствор фенола вызывает их гибель через 8-10 ч, 1% раствор формалина - через 6 ч; действие прямого солнечного света споры выдерживают 3-5 сут.
Клиническая картина столбняка у мелких лабораторных животных развивается по типу так называемого восходящего столб- няка. При введении токсина под кожу задней конечности мыши сначала обнаруживается явление местного столбняка - лапка мыши вытягивается и делается несгибаемой, хвост становится ригидным. Мышечный спазм затем распространяется на мускулатуру туловища с той стороны, с которой был введен токсин, и наступает искривление туловища. Позднее спазм распростра-
няется на всю мускулатуру, и животное погибает при явлениях общего столбняка.
У человека и крупных животных поражение мышц не связано с местом первичной локализации токсина и протекает по типу нис- ходящего столбняка. Процесс начинается с жевательных и мимических мышц лица, а затем распространяется на мышцы всего тела и нижних конечностей.
Источником заражения являются животные и человек, которые выделяют клостридии с испражнениями в почву. Споры клостри- дий столбняка обнаруживаются в почве в 50-60% исследованных проб, а в некоторых почвах - даже в 100% случаев. Особенно богата спорами унавоженная почва. Споры могут разноситься с пылью, проникать в жилище, попадать на верхнюю одежду, белье, обувь и другие объекты.
Около 2/3 заболевших - работники сельского хозяйства, более 1/3 - дети от 1 года до 15 лет. Больше половины заболеваний столбняком возникает в результате ранений нижних конечностей лопатой, гвоздем, стерней во время работы на огороде или в поле. У новорожденных возбудитель может проникать через пупочный канатик, у рожениц - через нарушенную слизистую оболочку матки.
Попавшие в рану микробы не всегда размножаются и не всегда вызывают заболевание. Заболевание возникает только в том случае, когда имеются условия для образования токсина - широкие рваные раны, содержащие сгустки и некрозы тканей. Инкубационный период при столбняке составляет от 3 дней до 1 мес, причем длительность его зависит главным образом от быстроты образования и количества токсина, а также от скорости его поступления в центральную нервную систему.
Первыми симптомами столбняка являются мышечные боли и напряженность мышц на месте ранения или травмы, затем насту- пают напряжение и тризм жевательных и мимических мышц лица. Лицо больного приобретает особый вид из-за так называемой сардонической улыбки. Постепенно нарастают ригидность, спазмы и судороги мышц грудной стенки, живота и конечностей (нисходящий столбняк). Все мышцы резко напряжены, тело вытягивается, становится совершенно прямым и неподвижным - отсюда и название «столбняк».
Наряду со спазмом мускулатуры развиваются судороги мышц, которые возникают при малейшем раздражении: легком стуке,
вспышке света, дуновении ветра и т.д. Температура тела повышается до 39-42 ?С. Смерть чаще всего наступает при явлениях асфиксии. Основные симптомы столбняка представляют собой прямое следствие поражения двигательных нервных центров, спинного и головного мозга. Столбнячный токсин поступает в центральную нервную систему по периферическим двигательным нервам, передвигаясь от места образования по осевым цилиндрам, периневральным и эндоневральным периферическим сосудам.
После перенесенного столбняка иммунитет непродолжителен, а его напряженность в полной мере соответствует наличию в кро- ви антитоксина. При вакцинации и последующей ревакцинации удается создать довольно стойкий и напряженный иммунитет, сохраняющийся в течение многих лет.
Для профилактики столбняка применяют активную и пассивную иммунизацию. Активная иммунизация проводится очищенным концентрированным и адсорбированным столбнячным анатоксином. Сначала анатоксин вводят подкожно в дозе 0,5 мл двукратно с интервалами между прививками 30-40 дней. Через 10-12 мес применяют ревакцинацию в дозе 0,5 мл. В дальнейшем ревакцинацию проводят каждые 5-10 лет.
В настоящее время адсорбированный анатоксин вводят в ассоциации с другими антигенами в составе кишечно-тифозных вакцин или с противококлюшной вакциной и дифтерийным анатоксином (АКДС). Полианатоксин сухой содержит анатоксины перфрингенс, оедематиенс, а также столбнячный и ботулинический типов А, В, Е. Высокий уровень иммунитета после прививок сохраняется в течение 3-5 лет. Если вакцинированный подвергается ранению, особенно при загрязнении ран, ему вводят ревакцинирующую дозу концентрированного анатоксина в количестве 0,5 мл.
При тяжелых ранениях и серьезных травмах одновременно с анатоксином в другой участок тела вводят противостолбнячную сыворотку в дозе 3 тыс. АЕ. Ее вводят также в тех случаях, когда нет данных о вакцинации пострадавшего. Однако следует иметь в виду, что серопрофилактика может дать эффект, если она применяется не позднее 12 ч после ранения. В целях профилактики осложнений применяют также антибиотики. Важное значение в профилактике и лечении столбняка имеет хирургическая обработка ран.
16.5.2.3. Возбудители ботулизма Clostridium botulinum
Термин «ботулизм» происходит от лат. botulus - колбаса (колбасное отравление). Это заболевание возникает в результате употребления в пищу продуктов (колбаса, рыбные и мясные консервы, ветчина и др.), контаминированных спорами возбудителя.
Впервые возбудитель был выделен бельгийским бактериологом Э. Ван Эрменгеном в
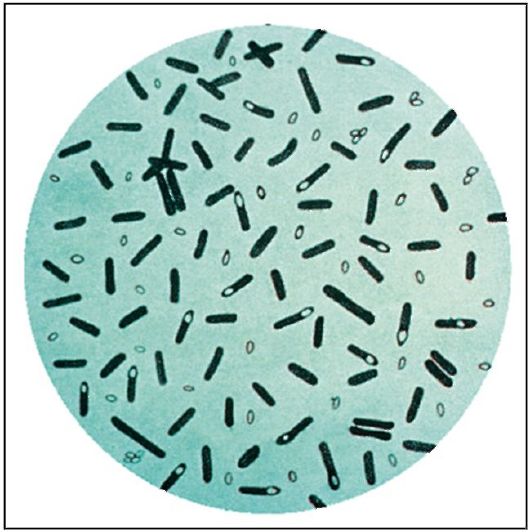
Рис. 16.9. Возбудитель ботулизма
C. botulinum - грамположительная палочка с закругленными концами размерами 4-8 мкм в длину и 0,6-0,8 мкм в поперечни-
ке. Спора располагается субтерминально, отчего под микроскопом C. botulinum выглядит в форме теннисной ракетки (рис. 16.9). Перитрих, число жгутиков от 3 до 20. Строгий (облигатный) анаэроб. Температурный оптимум 35 ?С. На среде Китта-Тароцци образует муть с последующим выпадением осадка, культура издает запах прогорклого масла. На кровяном агаре формируются колонии неправильной формы с отростками, окруженные зоной гемолиза. На желатине возбудители ботулизма образуют
круглые прозрачные колонии, окруженные зонами разжижения, в дальнейшем колонии становятся мутными с отростками в виде шипов.
Главный фактор патогенности C. botulinum - экзотоксин (один из самых сильных ядов, известных человечеству), поскольку в организме возбудитель практически не размножается. Смертельная доза для человека 1 мкг. Токсин состоит из двух субъединиц: одна отвечает за адсорбцию на рецепторах чувствительных клеток, другая - за проникновение внутрь путем эндоцитоза. Проникнув из кишечника в кровь, токсин поступает в периферические нервные
окончания, где блокирует слияние синаптических пузырьков с мембраной. Токсин термолабилен и легко разрушается при кипячении.
Клинические проявления заболевания зависят от вида пищевого продукта, ставшего причиной отравления, и от резистентности макроорганизма. Начало клинической картины протекает по типу пищевой интоксикации, в дальнейшем поражаются бульбарные нервные образования, нарушается зрение, возникает асфиксия. Летальность при ботулизме может достигать 60%. При попадании C. botulinum в рану возникает раневой ботулизм, который проявляется по типу пищевой интоксикации. Различают также ботулизм новорожденных, когда возбудитель проникает через пупочный канатик.
Постинфекционный иммунитет отсутствует. Для специфической профилактики лиц повышенного риска заражения используют экспериментальный препарат Botox?. Антибиотики неэффективны.
Для идентификации токсина используют классическую реакцию нейтрализации на мышах и РНГА с антительным диагностикумом (РОНГА) и ИФА. Методы выделения культур C. botulinum принципиально сходны с таковыми при выделении других патогенных клостридий. Бактериологическая диагностика клостридиозов изложена в материалах диска.
16.5.2.4. Возбудители псевдомембранного колита (Clostridium difficili)
C. difficili. Является этиологическим фактором псевдомембранного колита, который возникает на фоне лечения антибиотиками. Возможны случаи и внутрибольничного заражения.
C. difficili обитает в толстой кишке у 3% людей, в почве, сточных водах. Нерациональное применение антибиотиков вызывает подавление микрофлоры кишечника, приводя к избыточному размножению C. difficili, которые обладают природной устойчивостью к широкому спектру антибиотиков.
C. difficili продуцирует два типа токсинов. Токсин А, обладая энтеротоксичностью, является причиной развития диареи. Токсин В - цитотоксин, вызывающий воспаление тканей в кишечнике.
Микробиологическая диагностика. Материалом для исследования являются фекалии. Проводят бактериологическое исследование, выделяя возбудителя в чистую культуру; а также определяют наличие токсинов А и В в фекалиях методом ИФА.
Для лечения используют ванкомицин. Специфическая профилактика отсутствует, неспецифическая профилактика сводится к проведению рациональной антибиотикотерапии и предупреждению развития дисбактериоза кишечника.
16.6. Палочки грамположительные правильной формы
16.6.1. Лактобациллы (род Lactobacillus) См. главу 4.2.
16.6.2. Листерии (род Listeria)
Листерии - бактерии, вызывающие инфекционную болезнь листериоз. Листерии получили свое название в честь шотландского хирурга Д. Листера.
По современной классификации листерии относятся к типу Firmicutes, классу Bacilli, роду Listeria, который включает в себя несколько видов, из которых в патологии человека наибольшее значение имеет вид Listeria monocytogenes, впервые описанный в
Морфология. Листерии - мелкие грамположительные палочки размером 0,5-2x0,4-0,5 мкм, обладающие плеоморфностью. В мазках из чистой культуры располагаются под углом друг к другу, формируя структуры, напоминающие иероглифы. Подвижные, спор не образуют, могут образовывать капсулу.
Культуральные свойства. Являясь микроаэрофилами, хорошо растут на кровяном агаре в атмосфере 5% СО2, образуя мелкие полупрозрачные колонии, окруженные зоной гемолиза; могут размножаться и на простом агаре. Некоторые штаммы образуют желтый или красноватый пигмент. Температура культивирования 37 ?С.
Физиология. Листерии могут ферментировать глюкозу и некоторые другие сахара с образованием кислоты. Сероводород и индол не продуцируют, желатин не разжижают. Каталазоположительны.
Антигенная структура. Листерии обладают О и Н антигенами. Установлено 7 сероваров L. monocytogenes.
Факторы патогенности. Листерии являются факультативными внутриклеточными паразитами. Они способны вызывать незавершенный фагоцитоз, причем они могут захватываться как профессиональными фагоцитами, так и непрофессиональными - клетка-
ми эндотелия, эпителиальными клетками, М-клетками кишечника, гепатоцитами, нейронами, в которых микроб реплицируется в цитозоле, освобождаясь из фагосомы. Этот процесс обеспечивают следующими факторами патогенности:
• связанный с клеткой белок интерналин и внеклеточный главный белок обеспечивают проникновение в эпителиальные и эндотелиальные клетки, а также поглощение микроба фагоцитами;
• листериолизин, являющийся ферментом металлопротеазой, разрушает мембраны фагосомы;
• поверхностный белок Act A, участвующий в полимеризации актина, обеспечивая передвижение бактерий по цитоплазме и проникновение бактерий в соседнюю клетку;
• фосфолипазы С разрушают клеточные мембраны, вызывая лизис фагосомы, способствуя репликации листерий в цитоплазме клетки хозяина и позволяя микробу распространяться по тканям организма;
• гемолизин вызывает гемолиз эритроцитов;
• лецитиназа обеспечивает выживание и размножение листерий в процессе внутриклеточной инфекции.
Все факторы патогенности контролируются генами, расположенными на островке патогенности, экспрессия которого бло- кируется ауторепрессором, накапливающемся в процессе роста и размножения бактерий. Удаление ауторепрессора из среды с помощью адсорбентов приводит к индукции экспрессии факторов патогенности: листериолизина, фосфолипаз, лецитиназы. Вышеописанное явление используется для идентификации вида L. monocytogenes от непатогенных для человека листерий методом неспе- цифической индукции лецитиназной активности путем добавления в питательную среду активированного угля.
Благодаря действию факторов патогенности, микроб преодолевает барьеры кишечника. Попав в кровяное русло, возбудитель способен к транслокации, поражая преимущественно клетки нервной ткани мозга и плаценту.
Распространение в природе. L. monocytogenes широко распространен в природе. Микроб является сапронозом, способным к свободному существованию в почве, воде, где он может находиться в симбиотических связях с простейшими или в некультивируемом состоянии. Способность находиться в почве и воде в некультиви-
руемом состоянии приводит к формированию эндемических очагов инфекции. Установлено, что L. monocytogenes способна заражать через корневую систему растения, делая их инфицированными.
Многие животные, а также птицы заражаются листериями через инфицированную воду и корма. У большинства диких животных листериоз протекает доброкачественно. При этом инфицированные листериями животные выделяют возбудитель с испражнениями и мочой, контаминируя окружающую среду.
Эпидемиология. Листерии хорошо переносят низкие температуры, замораживание, высушивание. В молоке и мясе при температуре 4 ?С не только не гибнут, но и размножаются. Чувствительны к дезинфицирующим веществам и кипячению.
Человек заражается в основном алиментарным путем через инфицированные овощи, некипяченое молоко, сыры и другие мо- лочные продукты, недостаточно термически обработанное мясо, а также через зараженную воду.
Возможны контактный путь заражения при уходе за больными животными и воздушно-пылевой при вдыхании инфицированной пыли. Заражение человека от человека не установлено. Возможно заражение плода от больной матери трансплацентарно и во время родов.
Патогенез. Листериоз - инфекция, характеризующаяся поражением мононуклеарных фагоцитов и различными вариантами течения.
Из входных ворот листерии распространяются лимфогенным и гематогенным путями. Диссеминация во внутренние органы (цен- тральную нервную систему, миндалины, печень, селезенку, легкие, лимфоузлы) приводит к размножению в них листерий с образованием некротических узелков - листериом, представляющих собой скопление пораженных клеток соответствующего органа, мононуклеарных фагоцитов и возбудителя. Образование листериом в тка- нях нервной системы обусловливает картину менингита, энцефалита и менингоэнцефалита. Транслокация микроба по организму наступает при дефиците Т-клеточного иммунитета. Поэтому системное заболевание с развитием, как правило, менингоэнцефалита наблюдается у иммунодефицитных лиц и новорожденных.
У беременных гранулемы образуются в плаценте, оттуда возбудитель попадает в плод, вызывая внутриутробную инфекцию и перинатальный врожденный листериоз. Врожденный листери-
оз характеризуется образованием листериом в печени, селезенке, центральной нервной системе и заканчивается гибелью плода и спонтанным абортом, преждевременными родами, аномалиями развития плода.
При заражении плода во время родов процесс затрагивает центральную нервную систему и характеризуется развитием менин- гита у новорожденного в течение первых 3 нед жизни, который в 54-90% случаев заканчивается летально.
Иммунитет. У переболевших в сыворотке крови образуются ан- титела, которые не обладают протективной активностью.
Наибольшее значение имеет клеточный иммунный ответ, который сопровождается аллергизацией организма.
Диагностика. Используют бактериологический, серологический методы, аллергическую пробу и ПЦР. Материалом для исследования при бактериологическом методе служат ликвор, кровь, пунктат лимфоузлов, слизь из носоглотки, отделяемое влагалища, околоплодные воды, плацента, трупный материал, из которых выделяют чистую культуру возбудителя. В этих материалах листерии можно обнаружить с помощью ПЦР.
Для серологической диагностики используют РСК, РПГА, ИФА, исследуя нарастание титра антител в парных сыворотках или определяя наличие IgM.
Профилактика неспецифическая. Молоко и мясо животных в очагах инфекции можно употреблять только после термической обработки. Беременных следует переводить на работу, где исключен контакт с животными.
Лечение антибиотиками.
16.7. Палочки грамположительные неправильной формы, ветвящиеся
16.7.1. Коринебактерии (род Corynebacterium)
Данные микроорганизмы относятся к роду Corynebacterium, который включает более 60 видов. Они представляют собой грампо- ложительные прямые или слегка изогнутые, неправильной формы тонкие палочки с заостренными или иногда булавовидными концами размером 0,3-0,8x1,5-8,0 мкм. В микропрепаратах коринебактерии располагаются поодиночке или парами, часто V-образной конфигурации либо стопками в виде частокола из нескольких па-
раллельно лежащих клеток. Внутри клеток, как правило, образуются метахроматиновые гранулы полиметафосфата (зерна волютина). Коринебактерии неподвижны, спор не образуют, некислотоустойчивые. Факультативные анаэробы при культивировании обычно нуждаются в богатых питательных средах, таких, как сывороточная или кровяная среда. Хемоорганотрофы с метаболизмом бродильного типа, каталазоположительные. Широко распространены на растениях; у животных и человека они преимущественно являются нормальными обитателями кожи и слизистых оболочек верхних дыхательных путей, желудочно-кишечного тракта и мочеполовых путей. Типовой вид Corynebacterium diphtheriae является патогенным для человека.
16.7.1.1. Возбудитель дифтерии Corynebacterium diphtheriae
Дифтерия - острое антропонозное инфекционное заболевание, вызываемое токсигенными штаммами Corynebacterium diphtheriae, передающееся преимущественно воздушно-капельным путем, характеризующееся местным фибринозным воспалением преимущественно зева и носа, а также явлениями общей интоксикации и поражением сердечно-сосудистой, нервной и выделительной си- стем. Название заболевания происходит от греческого слова diphthera - пленка, перепонка, кожа, что обусловлено клиническими проявлениями данного заболевания.
Таксономическое положение возбудителя. Возбудитель дифтерии относится к роду Corynebacterium, виду C. diphtheriae. Название микроба происходит от греческих слов koryne - булава и bacteria - палочка, что связано с его морфологическими особенностями, а также греческого слова diphthera. Возбудитель дифтерии впервые был описан Э. Клебсом в
Тинкториальные и морфологические свойства. C. diphtheriae - прямые или слегка изогнутые тонкие грамположительные неподвижные полиморфные палочки с заостренными или булавовидными концами размером 0,3-0,8x1,5-8,0 мкм. Спор и капсул не образуют. Они утолщены на концах за счет наличия зерен волютина (зерен Бабеша-Эрнста), что придает им вид булавы или булавки. Зерна волютина воспринимают анилиновые красители более интенсивно, чем цитоплазма клетки. Вследствие метахромазии они приобретают необычный цвет. Зерна волютина выявляют
при окраске препаратов по Леффлеру метиленовым синим, а также при окраске по Нейссеру. При люминесцентной микроскопии они окрашиваются корифосфином в оранжево-красный цвет, в то время как тела бактерий окрашиваются в желто-зеленый цвет. При окраске по Граму зерна волютина не выявляются.
Дифтерийная палочка не обладает кислотоустойчивостью. Она имеет микрокапсулу с входящим в ее состав корд-фактором. В состав клеточной стенки входит большое количество липидов, в том числе некислотоустойчивые коринеформные миколовые кислоты.
Для C. diphtheriae характерен полиморфизм размеров и формы. В мазках возбудители дифтерии располагаются под углом, напоминая латинские буквы L, X, V, Y или растопыренные пальцы рук. Эта особенность, связанная со способом деления клетки, отличает возбудителей дифтерии от других коринебактерий, которые в микропрепаратах чаще располагаются в виде частокола из нескольких параллельно лежащих клеток, зерен волютина не имеют или содержат их в большом количестве.
Культуральные свойства. Возбудитель дифтерии относится к факультативным анаэробам, в отличие от коринеформных бактерий, являющихся облигатными аэробами, культивируется при 37 ?С. Требователен к условиям культивирования. В отличие от коринеформных бактерий, C. diphtheriae на простых питательных средах не растет. Для первичного посева материала используют дифференциально-диагностические среды, содержащие гемолизированную кровь (барана, лошади и др.) и 0,03-0,04% теллурита калия или натрия, которые подавляют рост сопутствующей микрофлоры (среду Клауберга), на которых C. diphtheriae образуют колонии черного или черно-серого цвета в течение 24-48 ч. В качестве элективных сред для накопления чистой культуры используют агар с добавлением 10% нормальной лошадиной сыворотки (элективная среда Ру) или свернутую кровяную сыворотку с добавлением сахарного бульона (элективная среда Ру-Леффлера). На элективных средах возбудитель дифтерии опережает в росте банальную микрофлору, и через 8-14 ч вырастает в виде изолированных то- чечных, выпуклых желтовато-кремовых колоний с гладкой или слегка зернистой поверхностью.
Биохимические свойства. Возбудитель дифтерии обладает высокой ферментативной активностью. Все штаммы C. diphtheriae ферментируют глюкозу и мальтозу с образованием кислоты и не разлагают сахарозу, не продуцируют уреазу и не образуют индол.
Отсутствие способности ферментировать сахарозу и разлагать мочевину (отрицательная проба Закса, цвет бульона с мочевиной и феноловым красным не изменяется) является важным дифференциально-диагностическим признаком, отличающим C. diphtheriae от сходных микроорганизмов.
Другим важным дифференциально-диагностическим признаком является способность C. diphtheriae продуцировать фермент цистиназу (цистинсульфатгидразу), расщепляющую цистин или цистеин до сероводорода, который, реагируя с уксуснокислым свинцом, вызывает почернение столбика сывороточного агара в результате образования в нем сернистого свинца (положительная проба Пизу).
Вид C. diphtheriae по культурально-биохимическим свойствам можно подразделить на 4 биовара: gravis, mitis, intermedius и belfanti, что важно с эпидемиологической точки зрения. В связи с тем что наиболее стабильным дифференцирующим признаком является тест на крахмал, по этому показателю в практических лабораториях все возбудители дифтерии делятся на два биовара: gravis (тяжелый) и mitis (облегченный). Все штаммы, не ферментирующие крахмал, относятся к биовару mitis, а ферментирующие крахмал - к биовару gravis.
На дифференциально-диагностических кровяных теллуритовых средах бактерии биовара gravis образуют сухие, матовые, размером 2-3 мм (крупные) плоские серовато-черные колонии, приподнятые в центре. Периферия колоний светлая с радиальной исчерченностью и изрезанным, волнистым краем (R-форма колоний). Такие колонии напоминают цветок маргаритку. На жидкой среде данные микроорганизмы образуют пленку на поверхности, а также крошковидный или крупнозернистый осадок. Жидкость остается прозрачной.
Бактерии биовара mitis образуют мелкие (1-2 мм) гладкие блестящие черные полупрозрачные колонии с ровными краями (S-формы колоний), окруженные зоной гемолиза. На жидкой среде они дают равномерное помутнение и порошкообразный осадок.
Вид C. diphtheriae подразделяется также на серовары, фаговары и корициновары, что не нашло широкого применения для их эпидемиологического маркирования. Наиболее перспективным является генотипирование, что используется эпидемиологами для
выявления эпидемических штаммов и связи между инфицированными людьми.
Факторы патогенности. Основными факторами патогенности возбудителей дифтерии являются поверхностные структуры липидной и белковой природы, к которым относятся корд-фактор, вместе с К-антигенами и коринеформными некислотоустойчи- выми миколовыми кислотами, входящий в состав микрокапсулы, ферменты и токсины. Поверхностные структуры способствуют адгезии микробов в месте входных ворот инфекции, препятствуют фагоцитозу бактерий, оказывают токсическое воздействие на клетки макроорганизма, разрушают митохондрии.
C. diphtheriae образуют ферменты агрессии и инвазии: нейраминидазу и N-ацетилнейрамиатлиазу, гиалуронидазу, а также гемолизин и дермонекротоксин.
Нейраминидаза и N-ацетилнейрамиатлиаза действуют на эстафетной основе. Нейраминидаза является фактором распростране- ния, способствуя отщеплению от поверхностных рецепторов клеток сиаловых кислот. Это модифицирует клеточную поверхность, подготавливая ее рецепторы для прикрепления дифтерийного токсина. Лиаза расщепляет N-ацетилнейраминовую кислоту на пируват, который стимулирует рост C. diphtheriae, и N-ацетилманнозамин.
Гиалуронидаза расщепляет гиалуроновую кислоту соединительной ткани. Одним из последствий ее действия являются повышение проницаемости кровеносных сосудов и выход плазмы за их пределы, что ведет к отеку окружающих тканей.
Дермонекротоксин вызывает некроз клеток в месте локализации возбудителя. Вышедший за пределы сосудов фибриноген плазмы, контактируя с тромбокиназой некротизированных клеток макроорганизма, превращается в фибрин, что и является сущностью дифтеритического воспаления. Находясь внутри дифтеритической пленки, C. diphtheriae находят отличную защиту от действия эффекторов иммунной системы макроорганизма. Размножаясь, они образуют в большом количестве основной фактор патогенности - дифтерийный гистотоксин.
Дифтерийный гистотоксин синтезируется в виде единой полипептидной цепи (протоксина), который активируется под действием протеолитических ферментов, что ведет к образованию А-В-фрагментов токсина. Фрагмент В отвечает за специфическое взаимодействие с ганглиозидными рецепторами клетки и
участвует в образовании транспортного канала для фрагмента А. Активированный фрагмент А отвечает за токсичность. Внутри пораженных клеток фрагмент А обладает ферментативной АДФрибозилтрансферазной активностью. Его мишень - фактор элонгации EF-2 (трансфераза 2), необходимый для построения пептидных цепей на рибосомах эукариотической клетки. Блокада фермента ведет к нарушению синтеза белка на стадии элонгации и гибели клеток в результате некроза. Дифтерийный гистотоксин обладает специфичностью действия, поражая клетки сердечнососудистой, нервной систем, почек и надпочечников.
Способность к продукции дифтерийного гистотоксина детерминирована tox-геном, локализованным в ДНК лизогенного фага. Заболевание вызывают только токсигенные штаммы C. diphtheriae. Нетоксигенные штаммы не вызывают дифтерии, хотя способны длительно персистировать в респираторном тракте человека.
Из лабораторных животных к дифтерийному гистотоксину чувствительны морские свинки, кролики, обезьяны. Определение токсигенности C. diphtheriae проводят также на куриных эмбрионах и культурах клеток.
Устойчивость в окружающей среде. Благодаря наличию липидов C. diphtheriae обладают значительной устойчивостью к воздействию факторов окружающей среды. В капельках слюны, прилипших к стенкам стакана, на ручках дверей и детских игрушках они могут сохраняться до 15 дней. Выживаемость их на предметах окружающей среды может достигать 5,5 мес и не сопровождаться утратой или снижением вирулентности. Данные микроорганизмы размножаются в молоке. Это имеет эпидемиологическое значение. К числу неблагоприятных факторов, действующих на C. diphtheriae, относятся прямые солнечные лучи, высокая температура и химические агенты. При кипячении C. diphtheriae погибают в течение 1 мин, в 10% растворе перекиси водорода - через 3 мин, в 5% карболовой кислоте и 50-60% алкоголе - через 1 мин.
Эпидемиология, патогенез и клинические проявления заболевания. Дифтерия - это антропонозное заболевание. Источником инфекции являются больные и носители токсигенных штаммов C. diphtheriae. Заражение происходит воздушно-капельным путем. Не исключены контактно-бытовой и алиментарный пути передачи инфекции. Наиболее восприимчивы к данному заболеванию дети ясельного и школьного возраста. Среди взрослых к профессио-
нальной группе повышенного риска относятся работники общественного питания и торговли, школ, детских дошкольных и ме- дицинских учреждений.
Патогенез и клинические проявления заболевания. Входными воротами инфекции служат слизистые оболочки ротоглотки (нёбные миндалины и окружающие их ткани), носа, гортани, трахеи, а также слизистые оболочки глаз и половых органов, поврежденные кожные покровы, раневая или ожоговая поверхность, опрелости, незажившая пупочная ранка. Наиболее часто встречается дифтерия ротоглотки (90-95%), чему способствуют воздушно-капельный путь передачи, тропизм микробов к слизистой оболочке и барьерная функция лимфоидного глоточного кольца.
Инкубационный период при дифтерии от 2 до 10 дней. Дифтерия относится к токсинемическим инфекциям, при которых микроб остается в месте входных ворот инфекции, а основные клинические проявления заболевания связаны с действием белкового бактериального токсина.
Начальным этапом инфекционного процесса являются адгезия микроба в месте входных ворот инфекции за счет поверхностных структур бактериальной клетки (корд-фактор и миколовые кислоты) и их колонизация. Размножаясь в месте входных ворот инфекции, C. diphtheriae образует дифтерийный гистотоксин, который оказывает местное воздействие на клетки тканей, а также поступает в кровь, что ведет к возникновению токсинемии. При наличии антитоксического иммунитета процесс может ограничиться легкой формой заболевания или формированием бактерионосительства.
В области входных ворот инфекции развивается воспалительная реакция, сопровождающаяся некрозом эпителиальных клеток, отеком, выходом фибриногена из сосудистого русла в окружающие ткани и превращением его в фибрин под действием тромбокиназы, освободившейся при некрозе эпителиальных клеток. Это ведет к образованию налетов белого цвета с сероватым или желтоватым оттенком, содержащих большое количество микробов, продуцирующих токсин. Фибринозная пленка - характерный признак дифтерии. Фибринозное воспаление при дифтерии может быть дифтеритическим или крупозным.
Дифтеритическое воспаление возникает на слизистых оболочках с многослойным плоским эпителием, все клетки которого прочно связаны как между собой, так и с подлежащей соединительноткан-
ной основой. Фибринозная пленка плотно спаяна с подлежащей тканью и не снимается тампоном при осмотре. При попытке снять ее слизистая оболочка кровоточит.
При дифтерии ротоглотки, помимо изменения нёбных миндалин, отмечаются отек окружающих мягких тканей и увеличение региональных лимфатических узлов. Патологический процесс может распространяться как в вышележащие отделы, поражая слизистую оболочку носа и среднего уха, так и в нижележащие отделы.
Крупозное воспаление возникает при локализации патологического процесса в нижних дыхательных путях, где слизистые оболочки содержат железы, выделяющие слизь и покрытые однослойным цилиндрическим эпителием. Здесь фибринозная пленка располагается поверхностно и легко отделяется от подлежащих тканей. В связи с легкостью отторжения поврежденных тканей, содержащих микробы, токсические формы дифтерии при таких поражениях не возникают. Такие больные часто откашливают целые слепки из различных отделов дыхательных путей. При распространении процесса из ротоглотки вниз по дыхательным путям в виде нисходящего крупа (от шотландского croak - карканье) крупозное воспаление последовательно захватывает трахею и бронхиальное дерево до его мельчайших разветвлений, что ведет к развитию ас- фиксии.
Локализация процесса при дифтерии определяется входными воротами инфекции. Возможны возникновение дифтерии носа, гортани, трахеи, глаз, уха, половых органов у девочек, дифтерии кожи и ран. При одновременном поражении двух органов и более диагностируется комбинированная форма дифтерии. Наиболее тяжело протекает гипертоксическая форма дифтерии, которая может привести к смерти в течение первых суток. В благоприятных слу- чаях заболевание заканчивается полным выздоровлением.
Иммунитет. После перенесенного заболевания формируется длительный и напряженный гуморальный антитоксический иммунитет. В отличие от него, антибактериальный иммунитет при дифтерии ненапряженный и серовароспецифичный. Наличие антитоксического иммунитета не препятствует формированию носи- тельства токсигенных штаммов C. diphtheriae.
Микробиологическая диагностика. Основным является бактериологический метод. При наличии клинических симптомов заболевания выделение токсигенных штаммов C. diphtheriae является
абсолютным подтверждением диагноза дифтерии, а при их отсутствии свидетельствует о бактерионосительстве. Бактериологи- ческому исследованию в обязательном порядке подвергаются все больные с острыми воспалительными явлениями в носоглотке, а также больные с подозрением на дифтерию. Материалом для исследования служат слизь и пленки из очагов воспаления, а также секрет из очагов патологического процесса. Сбор материала необходимо проводить в течение 3-4 ч (не позже 12 ч) с момента обращения больного. Для взятия материала используют сухие ватные тампоны, если посев будет проведен не позднее 2-3 ч после сбора материала. При транспортировке на дальние расстояния можно использовать тампоны, предварительно смоченные 5% раствором глицерина. При исследовании на дифтерию во всех случаях, в том числе и при экстрафарингеальной локализации, материал для исследования берут раздельными тампонами одновременно из зева и носа, а при необходимости и из других мест локализации воспаления. Посев делают раздельно на поверхность одной из рекомендованных инструкцией сред. Бактериологическая лаборатория через 48 ч выдает ответ об отсутствии в анализах C. diphtheriae или при наличии положительных результатов исследования на токсигенность (не более 6 колоний) и пробы на цистиназу выдает ответ о выделении токсигенных штаммов C. diphtheriae.
Для оценки антитоксического иммунитета у отдельных лиц или всего коллектива, дифференциации заболевания дифтерией от других заболеваний применяют серологические методы диагностики. Для этого применяют РНГА (РПГА) с антигенным эритроцитарным диагностикумом и ИФА. Защитный титр антител в РНГА равен 1:40. РНГА применяют также для обнаружения антибактериальных антител в острый период заболевания, на содержание которых не влияет применение антитоксической сыворотки в лечебных целях.
Для ускоренного обнаружения дифтерийного токсина как в бактериальных культурах, так и в биологических жидкостях (сы- воротка крови) применяют РНГА с антительным эритроцитарным диагностикумом и ИФА.
Из молекулярно-генетических методов исследования применяют ПЦР, что позволяет определять tox-ген в минимально короткие сроки (4-5 ч). Для установления источников и путей распространения дифтерийной инфекции, слежения за структурой популя-
ции возбудителя и прогнозирования эпидемиологического процесса используют риботипирование.
Лечение и профилактика дифтерии. Дифтерия - это токсинемическая инфекция. Поэтому в целях нейтрализации дифтерийного гистотоксина применяют специфическую противодифтерийную лошадиную сыворотку. Специфическое лечение противодиф- терийной сывороткой начинают немедленно при клиническом подозрении на дифтерию, так как антитела не нейтрализуют токсин, проникший в ткани. Для предотвращения возможных аллергических реакций перед введением сыворотки обязательно ставят кожную пробу с лошадиной сывороткой в разведении 1:100 для определения чувствительности больного к белкам сыворотки лошади. Введение сыворотки после 3-го дня болезни считается поздним. Помимо лошадиной сыворотки, для лечения применяют иммуноглобулин человека противодифтерийный для внутривенного введения. Разработана лечебная противодифтерийная вакцина «Кодивак». Она представляет собой дезинтеграт дифтерийных палочек.
Одновременно с введением антитоксической противодифтерийной сыворотки больным необходимо назначать этиотропную антибиотикотерапию. При лечении бактерионосителей необходимо проводить стимуляцию антибактериального иммунитета.
Для специфической профилактики дифтерии применяют дифтерийный анатоксин, который входит в состав ассоциированных вакцин: адсорбированной коклюшно-дифтерийно-столбнячной вакцины (АКДС-вакцина), адсорбированного дифтерийно-столбнячного анатоксина (АДС-анатоксин), адсорбированного дифтерийно-столбнячного анатоксина с уменьшенным содержанием антигенов (АДС-М-анатоксин и его французский аналог Имовакс Д. Т. Адюльт), адсорбированного дифтерийного анатоксина с уменьшенным содержанием антигена (АД-М-анатоксин) и др.
Базисный иммунитет создается у детей согласно календарю прививок полноценными в антигенном отношении препаратами (АКДС, АДС, тетракок и др.). Для ревакцинации детей старше 6 лет, подростков и взрослых применяют препараты с уменьшенным содержанием антигена: АДС-М-анатоксин или его французский аналог Имовакс Д. Т. Адюльт, а также трехкомпонентный препарат Бубо-М, состоящий из АДС-М-анатоксина и HbsAg. Уменьшение количества дифтерийного анатоксина обусловле-
но предупреждением развития побочных реакций, которые могут иногда появляться при повторном введении препаратов.
Дифтерия относится к контролируемым инфекциям, но только 95% охват населения прививками гарантирует эффективность вакцинации. Если у привитых лиц и возникает заболевание, то, как правило, оно протекает легко. В любом очаге дифтерии необходимо проводить экстренный контроль состояния иммунитета, и выявленные восприимчивые к этой инфекции лица должны быть незамедлительно вакцинированы (защитный титр в РНГА 1:40 и выше).
16.7.1.2. Коринеформные бактерии
Некоторые виды коринебактерий - непатогенные в норме обитатели кожи человека или патогенные для животных, тоже могут вызвать заболевания у людей, но преимущественно у лиц с нарушениями иммунитета. Такие микроорганизмы называют коринеформными бактериями или дифтероидами.
С. pseudodiphthericum (С. hoffmani) - является постоянным нормальным обитателем зева и носа человека; образует прямые короткие клетки, часто без зерен волютина, располагающиеся в виде «частокола»; биохимически инертны, но обладают уреазой. С. pseudodiphthericum редко выделяют от больных из мокроты при трахеобронхитах и из легочных абсцессов.
С. ulcerans является патогеном крупного рогатого скота, про- дуцирует токсин и вызывает маститы у коров, но в редких случаях является причиной дифтериеподобных заболеваний у человека. По своим морфологическим свойствам представляет собой овоидные клетки, беспорядочно расположенные в мазках. Биохимически близок с C. diphtheriae gravis.
С. xerosis относится к сапрофитным микроорганизмам человека, населяет слизистые оболочки верхних дыхательных путей и связанных с ними полостей. Выделяется при конъюнктивитах и гнойно-септических поражениях.
С. pseudotuberculosis - поражает людей в редких случаях, в основном при соприкосновении с овцами и козами, вызывая септические лимфадениты.
С. jcikeium - входит в состав нормальной флоры кожи, паховой и подмышечной области, но считается и возбудителем гнойносептических заболеваний, эндокардитов, пневмоний, менингита у больных с иммунодефицитными состояниями.
16.7.2. Микобактерии (семейство Mycobacteriaceae)
Микобактерии относятся к семейству Mycobacteriaceae, роду Mycobacterium (от греч. myces - гриб и bacteria - палочка), в состав которого входит более 160 видов микобактерий. Это полиморфные микроорганизмы, образующие прямые или слегка изогнутые палочки размером 0,2-0,7x1-10 мкм, иногда ветвящиеся; возможно образование нитей наподобие мицелия, легко распадающихся на палочки или кокки. Родовой признак микобактерий - кислото-, спирто- и щелочеустойчивость, что обусловлено наличием большого количества липидов в клеточной стенке. Они плохо воспринимают анилиновые красители, по Граму окрашиваются с трудом, обычно слабогрампо- ложительны. Неподвижные, спор и капсул не образуют, аэробы и хемоорганотрофы. Растут медленно или очень медленно. Каталазо- и арилсульфотазоположительные, устойчивы к лизоциму.
Все микобактерии разделяют на патогенные для человека и условно-патогенные. Классификация проводится двумя способами: по скорости и оптимальной температуре роста, способности к образованию пигмента; по клинически значимым комплексам, которые объединяют виды микобактерий с одинаковой клинической значимостью. Для идентификации видов внутри групп и комплексов используют биологические, биохимические и молекулярные методы исследования.
Данные микроорганизмы являются возбудителями микобактериальных заболеваний: туберкулеза, лепры, язвы Бурули и мико- бактериозов.
16.7.2.1. Возбудители туберкулеза
Туберкулез (от лат. tuberculum - бугорок) - первичнохроническое заболевание человека и животных, сопровождающееся поражением различных органов и систем (органов дыхания, лимфатических узлов, кишечника, костей и суставов, глаз, кожи, почек и мочевыводящих путей, половых органов, центральной нервной системы). Основу патологического процесса составляет образование специфических гранулем (от лат. granulum - зернышко и греч. oma - обозначающего окончание в названии опухолей), представляющих собой воспалительную реакцию тканей, имею- щую вид узелка или бугорка.
Бактериальная природа туберкулеза установлена в
В настоящее время в мире зарегистрировано 30 млн больных активным туберкулезом, ежегодно выявляется 10 млн новых случаев заболевания, каждый год 3 млн человек умирают от туберкулеза.
Таксономия. Вызывающие туберкулез виды микобактерий объединены в комплекс Mycobacterium tuberculosis, включающий M. tuberculosis - человеческий вид, M. bovis - бычий вид, M. africanum - промежуточный вид, Mycobacterium bovis BCG, M. microti и M. canettii. M. tuberculosis вызывает туберкулез у человека в 92% случаев, M. bovis - в 5% случаев, M. africanum - в 3% случаев. M. microti является вариантом M. tuberculosis, адаптированным к организму мышей-полевок. M. canettii - вариант M. tuberculosis, образующих гладкие колонии. Они считаются непатогенными для человека, однако могут обнаруживаться при инфекциях у лиц с иммунодефицитами.
Морфология и тинкториальные свойства. Особенности культивирования. Возбудители туберкулеза характеризуются выраженным полиморфизмом. Они имеют форму длинных, тонких (M. tuberculosis, M. africanum) или более коротких толстых (M. bovis) прямых или слегка изогнутых палочек с гомогенной или зернистой цитоплазмой, содержащей от 2 до 12 зерен различной величины, состоящих из липидов или метафосфатов и играющих важную роль в клеточном метаболизме бактерий. Зернистость у M. bovis менее выражена. Грамположительны, неподвижны, спор не образуют.
Клеточная стенка микобактерий имеет сложное строение. Первичный каркас клеточной стенки образуют перекрестно связанные пептидогликаны. Его дублирует слой арабиногалактанов, формирующий полисахаридную строму клетки, характеризующуюся относительно постоянным составом. Он имеет точки связывания с пептидогликаном, а также миколовыми кислотами и их произ- водными. Наружные слои представлены в основном липидами и имеют меняющийся химический состав. Миколовые кислоты присутствуют в виде свободных сульфолипидов и корд-фактора, благодаря которому они растут в виде кос или жгутов. Уникальность миколовых кислот делает их мишенью для химиопрепаратов. Поверхностный слой гликолипидов называют микозидами. Это ви- доспецифические соединения, определяющие антигенные свойства микобактерий. Подобно корд-фактору и сульфолипидам они токсичны и вызывают образование гранулем. Важным компонентом клеточной стенки является липоарабиноманан. Он заякорен на
плазматической мембране, пронизывает клеточную стенку и выходит на ее поверхность. Его терминальные фрагменты, а именно маннозные радикалы, подавляют активацию Т-лимфоцитов, что ведет к нарушению иммунного ответа на микобактерии. Клеточная мембрана и слои клеточной стенки пронизаны каналами или порами, обеспечивающими транспорт веществ.
Из-за большого количества липидов в клеточной стенке, содержащих миколовую кислоту, они плохо воспринимают анилиновые красители. Для их выявления применяют окраску кислото-, спирто- и щелочеустойчивых бактерий по Цилю-Нельсену, в основу которой положен принцип термокислотного протравливания. В препаратах микобактерии обнаруживаются в виде ярко-красных кислотоустойчивых палочек, расположенных поодиночке или небольшими скоплениями из 2-3 клеток в виде римской цифры пять.
Полиморфизм возбудителей туберкулеза проявляется в образовании различных морфоваров: фильтрующихся и ультрамелких, зернистых и кокковидных, нитевидных, а также L-форм бактерий, которые обладают низкой метаболической активностью и длительно персистируют в макроорганизме внутриклеточно в макрофагах. Они нечувствительны к противотуберкулезным препаратам. Реверсия этих дремлющих форм в вирулентные бациллярные формы ведет к возникновению рецидивов и обострению заболевания.
M. tuberculosis относится к строгим аэробам. Они размножаются крайне медленно, требовательны к питательным средам, глицеринозависимые. Им нужны факторы роста: витамины группы B, аспаргиновая и глютаминовая аминокислоты. Стимулятором их роста является лецитин. Для подавления токсического действия образуемых в процессе метаболизма жирных кислот к средам добавляют активированный уголь, сыворотки животных и альбумин. Для подавления роста сопутствующей микрофлоры к средам добавляют красители (малахитовый зеленый) и антибиотики, не действующие на микобактерии. Оптимальная температура культивирования 37-38 ?С. Наилучший рост отмечается при pH 6,8-7,2. На плотных средах рост отмечается на 15-20-й день в виде светлокремового, белого или бледно-желтого чешуйчатого налета с неровными краями (R-форма колоний), который по мере роста принимает бородавчатый вид, напоминая цветную капусту. На жидких средах через 5-7 дней дает рост в виде толстой твердой сухой бугристо-морщинистой пленки кремового цвета (цвет слоновой
кости). К M. tuberculosis наибольшей восприимчивостью обладают морские свинки. M. bovis - микроаэрофилы, растут на средах медленнее, чем M. tuberculosis, пируватзависимые. При росте на плотных средах на 21-60-й день образуют мелкие шаровидные влажные, почти прозрачные колонии серовато-белого цвета (S-форма колоний). При культивировании на жидких средах сначала растут в глубине среды, образуя в последующем тонкую влажную пленку на поверхности среды. Высокопатогенны для кроликов.
M. africanum малопатогенны для человека, выделяются от больных туберкулезом людей в тропической Африке.
Для культивирования возбудителей туберкулеза, определения чувствительности к антибиотикам и выделения чистой культуры ВОЗ рекомендует использовать среду Левенштейна-Йенсена и среду Финна 2 в качестве стандартных сред.
При внутриклеточном размножении, а также при росте на жидких питательных средах и микрокультивировании на стеклах в жидкой среде (метод микрокультур Прайса) через 48-72 ч у вирулентных штаммов выявляется корд-фактор (от англ. cord - жгут, веревка), благодаря которому микобактерии склеиваются и растут в виде переплетенных девичьих кос или жгутов. Корд-фактор - это гликолипид, состоящий из трегалозы и димиколата, относится к факторам патогенности микобактерий. Авирулентные штаммы возбудителей туберкулеза и нетуберкулезные микобактерии при микрокультивировании не образуют корд-фактора и растут беспорядочно. В отличие от возбудителей туберкулеза, растущих в культуре клеток HeLa в виде кос, условно-патогенные микобактерии дают ветвистый рост, а сапрофитные не размножаются.
Биохимические свойства. В отличие от нетуберкулезных микобактерий, у возбудителей туберкулеза каталаза термолабильна (инактивируется при 68 ?С в течение 30 мин).
Дифференциация M. bovis, M. tuberculosis от нетуберкулезных микобактерий проводится также по способности образовывать в большом количестве никотиновую кислоту (ниацин), которая накапливается в жидкой питательной среде и дает с раствором цианида калия и хлорамином Б ярко-желтое окрашивание (ниациновая проба Конно).
Дифференциация M. tuberculosis от M. bovis осуществляется по способности M. tuberculosis редуцировать нитраты в нитриты (положительный нитратредуктазный тест).
Химический состав, антигенная структура и факторы патогенности.
Основными химическими компонентами микобактерий являются белки (туберкулопротеины), углеводы и липиды. К ним образуются антифосфатидные, антипротеиновые и антиполисахаридные антитела, определение которых свидетельствует об активности инфекционного процесса и имеет прогностическое значение. Туберкулопротеины составляют 56% сухой массы вещества микробной клетки. Они являются основными носителями антигенных свойств микобактерий, высокотоксичны, вызывают развитие реакции гиперчувствительности IV типа. На долю полисахаридов приходится 15% сухой массы вещества микобактерий. Это родоспецифические гаптены. В отличие от других бактерий, на долю липидов приходится от 10 до 60% сухой массы вещества микобактерий. Ви- рулентные микобактерии содержат липидов больше, чем кислотоустойчивые сапрофиты. Миколовая кислота, входящая в состав липидных комплексов и находящаяся в соединении с высокомолекулярным спиртом фтиоциролем, обусловливает кислото-, спирто- и щелочеустойчивость данных микроорганизмов.
Основные патогенные свойства возбудителей туберкулеза обусловлены прямым или иммунологически опосредованным действием липидов и их комплексов с туберкулопротеинами и полисахаридами.
Эти медленно размножающиеся, «бронированные» микробы поражают долгоживущие клетки - макрофаги. Они обладают способностью подавлять фагоцитоз. Микроб чаще всего выбирает макрофаги легких, обладающих низкой микробоцидной активностью. Проникновение микобактерий в макрофаги не сопровождается активацией последних вследствие особенности строения клеточной стенки микобактерии. Это ведет к тому, что фагоцитоз не сопровождается образованием перекисных радикалов кислорода и азота и носит неагрессивный характер. Проникнув внутрь макрофага, микобактерии включают механизмы (продукцию аммония, синтез сульфолипидов), препятствующие образованию фаголизосомы. Если все же фаголизосома образовалась, то микобактерии благода- ря мощной клеточной стенке, аммонию, сульфолипидам, а также ферментам с каталазной и пероксидазной активностью подавляют кислородозависимую и кислородонезависимую киллерную активность макрофагов. Используя железосодержащие соединения макрофагов для своих ферментных систем, микобактерии блокируют
иммуноспецифические функции макрофагов (снижение антигенпредставляющей функции, ослабление чувствительности к активирующим сигналам Т-лимфоцитов). Миколовые арабинолипидные кислоты вызывают апоптоз макрофага, поражая его митохондрии, что приводит к энергетическому голоду макрофага.
Устойчивость в окружающей среде. Благодаря наличию липидов микобактерии обладают гидрофобной клеточной стенкой, что делает их более устойчивыми в окружающей среде к действию неблагоприятных факторов, чем другие неспорообразующие бак- терии. Высушивание мало влияет на их жизнеспособность в патологическом материале (мокроте и др.). Возбудитель сохраняет свою жизнеспособность в сухом состоянии до 3 лет. Возбудители туберкулеза устойчивы к органическим и неорганическим кислотам, щелочам, многим окислителям и некоторым антисептикам, губительно действующим на другие патогенные бактерии. Они устойчивы к действию спиртов и ацетона. Облученная солнечным светом культура микроорганизмов погибает в течение 1,5 ч, а под воздействием УФ-лучей - через 2-3 мин, поэтому распространение инфекции редко происходит вне помещения в дневное время, а наиболее действенными мерами, позволяющими снизить степень инфицированности того или иного помещения, являются адекватная вентиляция и воздействие УФ-лучей. При кипячении они погибают через 5 мин, а при пастеризации - в течение 30 мин. Для дезинфекции используют активированные растворы хлорамина и хлорной извести, вызывающие гибель возбудителей туберкулеза в течение 3-5 ч.
Эпидемиология, патогенез и клиническая картина туберкулеза. Росту заболеваемости туберкулезом способствуют неблагоприятные социально-экономические факторы, а также высокая выживаемость микобактерий в окружающей среде и широкое распространение штаммов с множественной лекарственной устойчивостью к антибиотикам и химиопрепаратам, а также лекарственно-зависимых форм возбудителей туберкулеза («штаммы-убийцы»). Они могут длительно персистировать в макроорганизме и реактивироваться через неограниченное время.
Эпидемический процесс при туберкулезе характеризуется наличием двух форм - антропонозной и зоонозной. Основным ис- точником инфекции является больной туберкулезом органов дыхания, выделяющий микробы в окружающую среду с мокротой.
Больные сельскохозяйственные животные, главным образом крупный рогатый скот, верблюды, свиньи, козы и овцы, а также люди, страдающие внелегочными формами заболевания и выделяющие возбудителей туберкулеза с мочой и калом, играют второстепенную роль.
Основной механизм заражения при туберкулезе аэрогенный с соответствующими ему воздушно-капельным и воздушно-пылевым путями передачи инфекции. Входными воротами при этом могут быть слизистая оболочка полости рта, миндалины, бронхи и легкие. Реже заражение туберкулезом может происходить пищевым путем при употреблении термически не обработанных мясомолоч- ных продуктов, что особенно характерно для заболеваний, вызванных M. bovis, чаще поражающих детей. При этом кислотоустойчивость микобактерий способствует преодолению такого барьера неспецифической защиты макроорганизма, как повышенная кислотность желудка. Возможен контактный путь передачи инфекции от больных туберкулезом через поврежденные кожные покровы и слизистые оболочки при использовании инфицированной одежды больных, игрушек, книг, посуды и других предметов. Известны случаи заражения людей при уходе за больными животными. Трансплацентарный путь передачи возможен, но, как правило, не реализуется вследствие тромбоза кровеносных сосудов плаценты в местах поражения. Внутриутробное заражение плода может происходить не только через пупочную вену и плаценту, но и при заглатывании амниотической жидкости, содержащей микобактерии.
Несмотря на высокую инфицированность людей возбудителями туберкулеза, лишь у 10% из них развивается первичный туберку- лез, что свидетельствует о генетической предрасположенности к заболеванию. У остальных лиц первичная туберкулезная инфекция протекает без клинических признаков, проявляясь лишь в вираже туберкулиновых проб.
Инкубационный период длится от 3-8 нед до 1 года и более (до 40 лет). Возбудитель в течение длительного времени сохраняется в дремлющем состоянии в фагоцитирующих клетках регионарных лимфатических узлов, прежде чем развитие фазы логарифмического роста и размножения возбудителя не приведет к возникновению болезни. В развитии заболевания выделяют первичный туберкулез, диссеминированный и вторичный туберкулез, который, как правило, является следствием активации старых эндогенных оча-
гов. Развитие вторичного туберкулеза возможно также в результате нового экзогенного заражения возбудителями туберкулеза (суперинфекция) в результате тесного контакта с больным, что вполне вероятно при неблагоприятных социально-экономических условиях. Первичный туберкулез выявляется у ранее неинфицированных людей и характеризуется выраженными токсико-аллергическими осложнениями и некротическими изменениями в тканях, возникающими на фоне высокой чувствительности макроорганизма к возбудителям туберкулеза. Для него характерна гематогенная диссеминация. Вторичный туберкулез возникает в иммунном организме у ранее инфицированных людей, поэтому процесс локализуется, как правило, в каком-либо одном органе. Для него нехарактерна гематогенная диссеминация.
При первичном попадании возбудителей туберкулеза в легкие или другие органы ранее не инфицированного макроорганизма макрофаги поглощают микобактерии и переносят их в регионарные лимфатические узлы, где они долго сохраняются, так как фагоцитоз носит незавершенный характер. В результате бактериемии возбудители туберкулеза разносятся по макроорганизму, что ведет к сенсибилизации тканей и органов. В ряде случаев данный процесс может сопровождаться развитием первичной туберкулезной интоксикации у детей и подростков.
При попадании больших доз высоковирулентного микроба в месте входных ворот инфекции (органы дыхания и другие органы) или в местах, куда они проникают через лимфу и кровь, происходит развитие специфического туберкулезного воспаления. Воспаление сопровождается образованием первичного туберкулезного комплекса (ПТК), состоящего из первичного аффекта или воспалительного очага (в легких это пневмонический очаг под плеврой), воспаленных лимфатических сосудов (лимфангит), идущих от первичного аффекта, и пораженных региональных лимфатических узлов (лимфаденит). Первоначально может формироваться не только ПТК, как считали ранее, но и туберкулез внутригрудных лимфатических узлов, плеврит, туберкулома, очаговый процесс. Из ПТК может происходить бронхогенная, лимфогенная, а также гематогенная диссеминация микобактерий с образованием очагов в других органах и тканях (диссеминированный легочный и внелегочный туберкулез). Распространение микобактерий на соседние ткани может происходить также по контакту. В последую-
щем происходит заживление очага, воспаление рассасывается, а некротические массы уплотняются и обызвествляются вследствие отложения солей кальция (происходит образование петрификата). Образуются очаги Гона (A.Chon), окруженные соединительнотканной капсулой. При формировании очага Гона происходит морфологическая трансформация микобактерий в L-формы, длительно сохраняющиеся в макроорганизме. При снижении резистентности макрорганизма происходит активация данных очагов, сопрово- ждающаяся трансформацией L-форм в высоковирулентные палочковидные формы, что ведет к активации процесса и развитию вторичного туберкулеза.
В основе специфической воспалительной реакции при туберкулезе лежит реакция гиперчувствительности IV типа, сопровождающаяся образованием эпителиоидно-клеточных гранулем. Гранулемы состоят из очага казеозного некроза в центре, содержащего микобактерии и окруженного эпителиоидными и гигантскими клетками Пирогова-Лангханса, образовавшимися из гистиоцитов и макрофагов при их пролиферации. Таким образом, гранулема - это специфическая реакция макроорганизма, направленная на ограничение распространения микроба по организму.
Клинические проявления туберкулеза разнообразны. Различают три клинические формы заболевания: первичная туберкулезная интоксикация у детей и подростков, туберкулез органов дыхания, туберкулез других органов и систем. Чаще всего возникает туберкулез органов дыхания (легких и внутригрудных лимфатических узлов). Он проявляется субфебрильной температурой тела, кашлем с мокротой, кровохарканьем, одышкой и другими симптомами. Симптомов, характерных только для туберкулеза, нет.
Противотуберкулезный иммунитет формируется в ответ на проникновение в организм микобактерий в процессе инфекции или вакцинации и носит нестерильный, инфекционный характер, что обусловлено длительной персистенцией L-форм бактерий в макроорганизме. Он проявляется через 4-8 нед после попадания микробов в макроорганизм. Решающую роль играют клеточные факторы иммунитета. Исход заболевания определяется активностью Т-хелперов, которые активируют фагоцитарную активность макрофагов и активность Т-киллеров. Интенсивное размножение микобактерий ведет к гибели фагоцитирующих клеток и активации супрессоров, что вызывает развитие вторичного иммунодефицита и иммунной толерантности.
Необходимо помнить, что, несмотря на клиническое или рентгенологическое выздоровление, с микробиологических позиций выздоровления от туберкулеза не происходит.
Микробиологическая диагностика. Основными или обязательными методами микробиологической диагностики туберкулеза являются бактериоскопическое и бактериологическое исследования, биологическая проба, а также туберкулинодиагностика. Материалом для исследования служат мокрота, промывные воды бронхов и желудка, плевральная и цереброспинальная жидкости, моча, мен- струальная кровь, асцитическая жидкость, а также кусочки тканей и органов, взятые на исследование во время операции или биопсии. Чаще всего исследуют мокроту. Обнаружение в патологическом материале возбудителей туберкулеза является прямым доказательством активности инфекционного процесса.
Бактериоскопическое исследование заключается в многократном проведении прямой микроскопии мазков из исследуемого материала, окрашенных по Цилю-Нельсену. В препаратах можно обнаружить единичные микроорганизмы, если в 1 мл мокроты их содержится не менее 100 000 бактериальных клеток. При получении отрицательных результатов прибегают к методам обогащения материала: флотации и гомогенизации. Широкое распространение получил высокочувствительный метод люминесцентной микроскопии, основанный на способности липидов микобактерий воспринимать люминесцентные красители и светиться при облучении УФ-лучами. Бактериоскопическое исследование относится к ориентировочным методам исследования, так как не позволяет определить видовую принадлежность микобактерий, и должно сочетаться с другими методами диагностики.
Бактериологическое исследование более чувствительно, чем бактериоскопическое. Метод позволяет выявить возбудителей туберкулеза при наличии в исследуемом материале всего нескольких десятков жизнеспособных микроорганизмов. Помимо определения видовой принадлежности выделенной чистой культуры микобактерий, обязательно определяют чувствительность микобактерий к антибиотикам. Недостатком метода является его длительность
(3-8 нед).
В качестве ускоренных методов бактериологической диагностики применяют: метод микрокультур (метод Прайса), а также полностью автоматизированные методы, основанные на радиоме-
трическом или флюорометрическом определении накопившегося в процессе размножения микобактерий СО2 или убывании используемого бактериями О2. Данные способы предназначены также для определения чувствительности к антибиотикам.
Биологическая проба позволяет обнаружить от 1 до 5 микробных клеток в исследуемом материале. Метод имеет большое значение при исследовании одноразового материала (кусочки тканей и органов, взятые во время операции, биопсийный материал). Он является основным дифференциально-диагностическим тестом при определении видовой принадлежности и вирулентности патогенных и условно-патогенных микобактерий. Туберкулинодиагностика заключается в определении повышенной чувствительности макроорганизма к туберкулину, наступившей вследствие заражения возбудителями туберкулеза или вакцинации БЦЖ с помощью кожных аллергических проб. В основе данных проб лежит развитие реакции гиперчувствительности IV типа, что свидетельствует об инфицировании. Туберкулин представляет собой автоклавированный фильтрат культур микобактерий туберкулеза. В настоящее время в России выпускают следующие формы туберкулина: ППД-Л (отечественный очищенный туберкулин Линниковой), сухой очищенный туберкулин для накожного, подкожного и внутрикожного применения (порошкообразный препарат, который растворяется в специальном растворителе).
Внутрикожная проба Манту с 2 туберкулиновыми единицами (ТЕ) ППД-Л является ведущим методом диагностики туберкулеза у детей и подростков. Она используется при проведении массового обследования населения с целью своевременного выявления первичного инфицирования детей и подростков, а также отбора для ревакцинации БЦЖ неинфицированных лиц. Проба свидетельствует не о заболевании, а об инфицировании. Интенсивность туберкулиновой реакции определяется степенью специфической сенсибилизации организма, его реактивностью.
Широкое распространение в диагностике туберкулеза и микобактериозов получили молекулярно-генетические методы исследования, в том числе ПЦР и метод гибридизации ДНК с применением микробиочипов.
К альтернативным методам диагностики туберкулеза относится выявление антител к антигенам микобактерий туберкулеза в РНГА и тест-системах ИФА. Они позволяют определить степень актив-
ности процесса, оценить эффективность лечения и решить вопрос о проведении иммунокоррекции.
Экспресс-диагностика туберкулеза основана на применении РИФ, а также метода лазерной флюоресценции. Новым направлением является комплексное использование бактериоскопического метода и ПЦР. Получение положительного ответа бактериоскопическим методом и в ПЦР позволяет диагностировать туберкулез и рекомендовать немедленное назначение противотуберкулезных препаратов по классической схеме. Отрицательный результат ПЦР при наличии кислотоустойчивых микобактерий в мазках позволяет исключить присутствие возбудителей туберкулеза и рекомендовать назначение препаратов, активных в отношении нетуберкулезных микобактерий. В других ситуациях рекомендуется ожидать результатов бактериологического исследования.
Лечение. Противотуберкулезные препараты разделяют на две основные группы (классификация ВОЗ, 1998). К первой группе относят изониазид, рифампицин, пиразинамид, этамбутол, стрептомицин. Их называют основными, или препаратами первого ряда. Эти препараты используют в основном для лечения больных, у которых туберкулез был выявлен впервые, а возбудитель чувствителен к данным препаратам. К препаратам второго ряда относят протионамид, этионамид, рифабутин, аминосалициловую кислоту, циклосерин, фторхинолоны, офлоксацин, ломефлоксацин, левофлоксацин, канамицин, капреомицин. Препараты второго ряда называют резервными. Их применяют для лечения больных туберкулезом в случаях, когда возбудитель устойчив к препаратам первого ряда или при непереносимости этих препаратов.
Помимо антибиотиков и химиопрепаратов, комплексная терапия больных туберкулезом включает специфические для тубер- кулезного воспаления и неспецифические иммуномодуляторы. В специфическую иммунотерапию входят туберкулинотерапия и БЦЖ-терапия.
Специфическая профилактика. Для создания активного искусственного приобретенного иммунитета в России применяют два препарата: БЦЖ и БЦЖ-м. Вакцины представляют собой живые микобактерии вакцинного штамма БЦЖ-1, полученного А. Кальметтом и К. Гереном путем длительного культивирования M. bovis на картофельно-глицериновом агаре с добавлением бычьей желчи. Вакцинацию БЦЖ проводят у здоровых новорожденных в роддо-
ме внутрикожно с последующей ревакцинацией в соответствии с утвержденным календарем прививок. Ревакцинации подлежат только не инфицированные туберкулезом лица, у которых туберкулиновая проба отрицательная. Вакцина БЦЖ-м - препарат с уменьшенным вдвое содержанием микобактерий БЦЖ в прививочной дозе. Помимо туберкулеза, БЦЖ-иммунизация защищает организм человека от лепры и микобактериоза, вызванного M. ulcerans.
Химиопрофилактика заключается в применении противотуберкулезных препаратов для предупреждения инфицирования, развития заболевания и генерализации инфекции у лиц, подвергающихся наибольшей опасности заражения туберкулезом.
16.7.2.2. Возбудитель лепры
Лепра - генерализованное первично-хроническое заболевание человека, сопровождающееся гранулематозными поражениями кожи и слизистой оболочки верхних дыхательных путей, а также периферической нервной системы и внутренних органов. Это одно из древнейших заболеваний человека, которое ранее было описано под разными названиями, в том числе в Библии под названием «лепра» (от греч. lepros - чешуйчатый, шероховатый). Основу лепрозных поражений составляет специфическая гранулема.
Возбудитель заболевания Mycobacterium leprae был открыт норвежским врачом Г.А. Гансеном (G.A. Hansen) в
Заболевание регистрируется практически во всех странах мира и является одной из наиболее важных проблем мирового здраво- охранения. Лепра эндемична для стран Юго-Восточной Азии и Центральной Африки.
Таксономия. Возбудитель лепры относится к семейству Mycobacteriaceae, роду Mycobacterium, виду M. leprae.
Биологические свойства возбудителя лепры
Морфология и химический состав. M. leprae имеет вид прямой или изогнутой палочки с закругленными концами, длиной 1-7 мкм, диаметром 0,2-0,5 мкм. Грамположительные, спор и капсул не образуют, имеют микрокапсулу, жгутиков не имеют. Характерной особенностью M. leprae является кислото- и спиртоустойчивость, что обусловливает их элективную окраску по Цилю-Нельсену. Воздействие антилепрозных препаратов приводит к изменению их
морфологии, снижению и исчезновению кислото- и спиртоустойчивости.
M. leprae является облигатным внутриклеточным паразитом тканевых макрофагов; не культивируется на искусственных питательных средах. Разработаны культуры клеток для их культивирования. При бактериоскопии они обнаруживаются в цитоплазме клеток в виде шаровидных скоплений (globi), в которых отдельные микобактерии располагаются параллельно друг другу, напоминая сигары в пачке. В лепрозных поражениях M. leprae могут встречаться от единичных скоплений до 200-300 бактерий. Характерной особенностью лепрозных клеток, относящихся к макрофагам, являются наличие бледного ядра и пенистой цитоплазмы за счет содержания липидов - продуктов метаболизма микобактерий, а также явление незавершенного фагоцитоза. Образование фибронектинсвязывающего белка способствует их проникновению в клетку, а наличие микрокапсулы и клеточной стенки, богатой липидами, делает M. leprae устойчивой к действию фаголизосомных ферментов.
На долю липидов, представляющих собой фосфатиды, жиры, воски, у M. leprae приходится 25-40%. Кроме миколовой кислоты, они содержат воск-лепрозин и лепрозиновую кислоту, которая есть только у M. leprae.
Размножение возбудителя лепры происходит медленно путем поперечного деления. Время генерации составляет от 12 до 20- 30 дней. M. leprae обладает тропизмом к тканям с низкой температурой. Оптимальная для роста и размножения температура 34-35 ?С. Токсинов не образует. Эти свойства микроорганизма обусловливают длительный инкубационный период, поражение кожи, а также отсутствие интоксикации у больных.
M. leprae характеризуются значительным полиморфизмом. В лепрозных поражениях наряду с гомогенно окрашенными формами встречаются также фрагментированные и зернистые формы. В активных, прогрессирующих высыпаниях при клинически выраженной лепре преобладают гомогенные с наличием делящихся форм микобактерии, а в старых, регрессирующих высыпаниях - зернистые и фрагментированные формы. Переход M. leprae в зернистые формы и последующее разрушение до фуксинофильной пыли связывают с эффективным лечением. Однако вопрос о роли зернистых форм не решен окончательно, так как некоторые не-
гомогенно окрашивающиеся формы, аналогично с возбудителями туберкулеза остаются жизнеспособными и могут играть решающую роль в распространении лепры, возникновении обострений и рецидивов.
Биохимические свойства. M. leprae являются аэробами. Утилизируют глицерин и глюкозу в качестве источников углеводов и имеют специфический фермент О-дифенолоксидазу (ДОФА-оксидаза), отсутствующий у других микобактерий. Они обладают способностью продуцировать внеклеточные липиды.
Антигенная структура. M. leprae имеет общие для всех микобактерий антигены, в том числе с вакцинным штаммом БЦЖ, что используется для профилактики лепры. Показано наличие гетерогенных антигенов у M. leprae и лиц с группой крови 0(1), М+, Rh-, Р+. Эти люди более восприимчивы к данному заболеванию, так как антигенная мимикрия способствует персистенции M. leprae в макроорганизме.
Из экстрактов M. leprae выделен и идентифицирован видоспецифический фенольный гликолипид (ФГЛА). Антитела к ФГЛА обнаруживаются только у больных лепрой, что используется для активного выявления больных лепрой при обследовании больших групп лиц с помощью ИФА.
Восприимчивость лабораторных животных. В экспериментальных условиях к M. leprae восприимчивы мыши и девятипоясные броненосцы.
У мышей (метод Шепарда) происходит медленное локальное размножение M. leprae при заражении в подушечку лапки. Мед- ленное размножение в подушечке лапки мыши M. leprae и определение ДОФА-оксидазы применяются для их идентификации. Заражение мышей используют для определения жизнеспособности M. leprae при лечении лепры, испытании новых противолепрозных средств, а также для установления устойчивости M. leprae к действию физических и химических факторов. С помощью этого ме- тода было установлено, что M. leprae остаются жизнеспособными после 10-12 лет хранения лепром при комнатной температуре в 40% формалине.
Наилучшей экспериментальной моделью лепры человека является заражение девятипоясных броненосцев. Они имеют низкую температуру тела, что делает их восприимчивыми к возбудителю лепры. Клиническое течение заболевания и морфологические из-
менения у броненосцев соответствуют лепроматозному типу лепры у человека.
Эпидемиология, патогенез и клинические проявления заболевания.
Лепра относится к малоконтагиозным антропонозным заболеваниям, при которых пораженность населения зависит прежде всего от социально-экономических факторов, влияющих на состояние резистентности макроорганизма. Резервуаром и источником возбудителя является больной человек, который при кашле и чиханье, а также при разговоре выделяет в окружающую среду со слизью или мокротой большое количество бактерий. Особенно опасны больные с антибиотикоустойчивой лепроматозной формой лепры, у которых в носовом секрете содержится много M. leprae.
Основной механизм заражения аэрогенный, путь передачи воздушно-капельный. Возбудитель лепры обнаруживается в отделяемом язв, образовавшихся при распаде лепром, а также в других биологических жидкостях (семенная жидкость, менструальная кровь и т.д.), поэтому возможен контактный механизм заражения. Оба механизма заражения реализуются лишь при тесном и длительном контакте с больными лепрой, что ведет к массивному инфицированию.
Входными воротами инфекции служат слизистая оболочка верхних дыхательных путей и поврежденные кожные покровы. Возбу- дитель распространяется по макроорганизму лимфогематогенным путем, поражая клетки кожи и периферической нервной системы (леммоциты). M. leprae продуцирует фибронектинсвязывающий белок, способствующий их проникновению в клетки. Все последующие тканевые поражения при лепре являются результатом иммунных реакций организма, а развитие заболевания полностью определяется состоянием резистентности макроорганизма.
Инкубационный период длится в среднем от 3 до 5 лет, но может колебаться от 6 мес до 20-30 лет. Лишь у 10-20% инфициро- ванных развиваются малозаметные признаки инфекции, и только у половины из них, т.е. у 5-10% инфицированных, в дальнейшем формируется развернутая картина заболевания.
Различают несколько форм течения заболевания: ТТ (туберкулоидную), LL (лепроматозную) и промежуточные.
Туберкулоидная форма заболевания (TT-тип лепры) возникает при высокой устойчивости макроорганизма. Она имеет доброкаче- ственное течение и характеризуется появлением на коже гипопиг-
ментированных пятен или эритематозных бляшек с измененной тактильной, температурной и болевой чувствительностью. Грану- лема, образовавшаяся в тканях, имеет эпителиоидный характер. M. leprae выявляются только при гистологическом исследовании биоптатов, а в соскобах кожи и слизистой оболочки носа отсутствуют. Лепроминовая проба положительная. С эпидемиологической точки зрения данная форма заболевания неопасна.
Лепроматозная форма заболевания (LL тип лепры) возникает при низкой резистентности макроорганизма. Она характеризуется злокачественным течением и сопровождается длительной бактериемией, большим разнообразием кожных поражений (от эритематозных пятен до инфильтратов в виде апельсиновой корки на лице, в области которых появляются бугорки и узлы лепромы размером от 1-2 мм до 2-3 см. В патологический процесс рано вовлекаются слизистые оболочки верхних дыхательных путей (симптомы ринита) и внутренние органы (печень, селезенка и костный мозг). У 30% больных развиваются трофические язвы стоп. При бактериоскопическом исследовании во всех высыпаниях обнаруживается большое количество M. leprae. Гранулема состоит из макрофагов с вакуолизированной цитоплазмой и содержащих M. leprae в виде шаров. Лепроминовая проба отрицательная. Эта форма заболевания эпидемиологически опасна.
Иммунитет при лепре является относительным. В эндемичных зонах заболевание лепрой может быть вызвано на фоне существующего естественного и приобретенного иммунитета. Ведущую роль играют клеточные факторы иммунитета. У больных с LL-формой заболевания выявляется анергия к M. leprae. В результате наличия генетических дефектов макрофаги не ограничивают размножение M. leprae и их распространение по организму. Угнетение клеточных реакций иммунитета при LL-форме заболевания сочетается с высокими титрами гуморальных антител к ФГЛА и другим антигенам M. leprae. При TT-форме заболевания, наоборот, антитела обнаруживаются в низких титрах, а клеточные реакции иммуни- тета выражены.
Развитие анергии к M. leprae при LL-форме заболевания не сопровождается снижением общей реактивности макроорганизма по отношению к другим микробам.
Микробиологическая диагностика лепры. Лепра способна имитировать большинство дерматозов и заболеваний периферической
нервной системы, поэтому вполне оправдано проведение дополнительных обследований на лепру. Обследованию на лепру также подлежат лица с жалобами на снижение и исчезновение чувствительности в отдельных участках тела, парестезии, частые ожоги, ревматоидные боли в конечностях, нерезко выраженные контрактуры V, IV и III пальцев верхних конечностей, начинающуюся атрофию мышц, пастозность кистей и стоп, стойкие поражения носа, трофические язвы и др.
Применяют бактериоскопическое, серологическое исследования и ПЦР. Материалом для бактериоскопического исследования служат соскобы - иссечения с кожи и слизистых оболочек носа, мокрота, пунктаты лимфатических узлов и др. Мазки готовят не только из очагов поражения кожи, но и из соскобов надбровных дуг, мочек ушей, подбородка. Мазки окрашивают по Цилю-Нельсену. Раньше всего M. leprae обнаруживаются в соскобах кожи (ранняя диагностика лепры). В соскобах из слизистой оболочки носа они обнаруживаются лишь в далеко зашедших случаях заболевания. Наибольшее значение бактериоскопия соскобов имеет при LL- и пограничных с ней формах заболевания, при которых M. leprae выявляются во всех высыпаниях в больших количествах. При TT-форме заболевания M. leprae в соскобах выявляются очень редко, поэтому окончательную роль в диагностике заболевания имеет гистологическое исследование биоптатов кожи и слизистых оболочек.
В отличие от возбудителей туберкулеза, M. leprae не культивируются на искусственных питательных средах и непатогенны для морских свинок и кроликов.
Серологическая диагностика основана на обнаружении антител к ФГЛА в ИФА, что особенно важно при активном выявлении больных, в том числе с субклиническими формами заболевания. При LL-форме заболевания антитела определяются в 95% случаев, а при TT-форме - в 50% случаев. В настоящее время получены моноклональные антитела, которые позволяют определять лепрозные антигены в тканях, разрабатывается ПЦР.
Вспомогательное значение имеет изучение иммунного статуса больного, в том числе с помощью РБТЛ с ФГЛА и лепроминовой пробы. Для постановки лепроминовой пробы используют лепромин А, полученный из тканей зараженных лепрой броненосцев. Данная проба диагностического значения не имеет, она свидетельствует не об инфицировании, а о состоянии иммунологической
реактивности макроорганизма, его способности отвечать на лепромин А. Внутрикожное введение 0,1 мл лепромина А вызывает развитие как ранних (через 48 ч реакция Фернандеса на водорастворимые фракции лепромина), так и поздних (через 3-4 нед реакция Мицуды) реакций. Последняя реакция представляет собой гранулематозный ответ на лепрозный корпускулярный антиген и имеет большее значение в дифференциации типов лепры, а также в прогнозе течения заболевания. У больных с LL-формой заболевания лепроминовая проба отрицательная, а у больных TT-формой заболевания, а также у большинства здоровых лиц положительная.
Лечение. Основными противолепрозными средствами являются препараты сульфонового ряда: дапсон, солюсульфон, диуцифон и др., наряду с которыми применяются рифампицин, клофазимин (лампрен) и фторхинолоны (офлоксацин). Прогноз при данном заболевании благоприятный. В зависимости от формы и стадии заболевания комбинированное лечение больных лепрой продол- жается от 3 до 10 лет. При LL-форме заболевания амбулаторное противорецидивное лечение проводится в большинстве случаев в течение всей жизни больного, так как эта форма заболевания хуже поддается терапии.
Специфическая профилактика. Препараты для специфической профилактики лепры не разработаны. У населения эндемичных районов в целях относительного усиления иммунитета для профилактики лепры используется вакцина БЦЖ, составной частью которой является лепромин А (лепромин А + БЦЖ).
16.7.2.3. Нетуберкулезные микобактерии
Классификация и биологические свойства. Характеристика отдельных представителей. Нетуберкулезные микобактерии (НТМБ) самостоятельные виды, широко распространенные в окружающей среде, как сапрофиты, которые в некоторых случаях могут вызывать тяжело протекающие заболевания - микобактериозы. Их также называют микобактериями окружающей среды (environmental micobacteria), возбудителями микобактериозов, оппортунистическими и атипичными микобактериями. Существенным отличием НТМБ от микобактерий туберкулезного комплекса является то, что они практически не передаются от человека к человеку.
НТМБ делятся на 4 группы по ограниченному числу признаков: скорости роста, образованию пигмента, морфологии колоний и биохимическим свойствам.
1-я группа - медленнорастущие фотохромогенные (M. kansasii, M. marinum и др.). Главный признак представителей этой группы - появление пигмента на свету. Они образуют колонии от S- до RS-форм, содержат кристаллы каротина, окрашивающие их в желтый цвет. Скорость роста от 7 до 20 дней при 25, 37 и 40 ?С, каталазоположительны.
M. kansasii - желтые бациллы, обитают в воде, почве, чаще всего поражают легкие. Эти бактерии можно идентифицировать в мазках за счет их больших размеров и крестообразного расположения. Важным проявлением инфекций, вызванных M. kansasii, считается развитие диссеминированного заболевания. Возможны также поражения кожи и мягких тканей, развитие теносиновитов, остеомиелита, лимфаденитов, перикардитов и инфекций органов мочеполового тракта.
M. marinum морская - психрофильный микроорганизм. Он впервые был выделен из морской рыбы. Микроб обитает в соленой, а также пресной воде, поражая рыб. У человека инфекция обычно связана с какой-то деятельностью в воде (плавание, работа с аквариумами и др.). Микроорганизмы внедряются через повреж- денные кожные покровы, например при травме рук рыболовными крючками, и вызывают образование узелка («бассейновая гранулема», «гранулема купальщиков», «аквариумная гранулема»), инфекция может распространяться вдоль лимфатических сосудов. Диссеминированные процессы возникают у лиц с иммунодефицитами и сопровождаются развитием деструктивных процессов в тканях.
2-я группа - медленнорастущие скотохромогенные (M. scrofula- ceum, M. malmoense, M. gordonae и др.). Микроорганизмы образуют в темноте желтые, а на свету оранжевые или красноватые колонии, обычно S-формы колоний, растут при 37 ?С. Это самая многочисленная группа НТМБ. Они выделяются из загрязненных водоемов и почвы и обладают незначительной патогенностью для человека и животных.
M. scrofulaceum (от англ. scrofula - золотуха) - одна из основ- ных причин развития шейного лимфаденита у детей до 5 лет. При наличии тяжелых сопутствующих заболеваний они могут вызвать поражения легких, костей и мягких тканей. Помимо воды и почвы, микробы выделены из сырого молока и других молочных продуктов.
M. malmoense - микроаэрофилы, образуют серовато-белые гладкие блестящие непрозрачные куполообразные круглые колонии.
Первичные изоляты растут очень медленно при 22-37 ?С. Экспозиция их на свету не вызывает продукции пигмента. В случае не- обходимости экспозицию продолжают до 12 нед. У человека они вызывают хронические заболевания легких.
M. gordonae - самые распространенные общепризнанные сапрофиты, скотохромогены водопроводной воды, микобактериоз вызывают крайне редко. Помимо воды (известны как M. aquae) их часто выделяют из почвы, промывных вод желудка, бронхиального секрета или другого материала от больных, но в большинстве случаев они оказываются непатогенными для человека. В то же время имеются сообщения о случаях менингита, перитонита и кожных поражений, вызванных этим видом микобактерий.
3-я группа - медленнорастущие нехромогенные микобактерии (M. avium complex, M. gastri, M. terrae complex и др.). Они образуют бесцветные S- или SR- и R-формы колоний, которые могут иметь светло-желтые и кремовые оттенки. Выделяются от больных животных, из воды и почвы.
M. avium - M. intracellulare объединены в один M. avium complex, так как их межвидовая дифференциация представляет определен- ные трудности. Микроорганизмы растут при 25-45 ?С, патогенны для птиц, менее патогенны для крупного рогатого скота, свиней, овец, собак и непатогенны для морских свинок. Наиболее часто эти микроорганизмы вызывают у человека поражения легких. Описаны поражения кожных покровов, мышечной ткани и костного скелета, а также диссеминированные формы заболеваний. Они входят в число возбудителей оппортунистических инфекций, осложняющих синдром приобретенного иммунодефицита (СПИД). M. avium подвид paratuberculosis является возбудителем болезни Джонса у крупного рогатого скота и, возможно, болезни Крона (хроническое воспалительное заболевание желудочнокишечного тракта) у человека. Микроб присутствует в мясе, молоке и фекалиях инфицированных коров, а также обнаруживается в воде и почве. Стандартные методы очистки воды не инактивируют данный микроб.
M. xenopi вызывает поражения легких у человека и диссеми- нированные формы заболеваний, связанные со СПИДом. Они выделены от лягушек рода Xenopus. Бактерии образуют мелкие с гладкой блестящей поверхностью непигментированные колонии, которые в последующем окрашиваются в ярко-желтый цвет. Тер-
мофилы. Не растут при
M. ulcerans - этиологический агент микобактериальной кожной язвы (синоним: язва Бурули), растет только при 30-33 ?С. Рост колоний отмечается лишь через 7 нед. Выделение возбудителя производят также при заражении мышей в мякоть подошвы лапки. Данное заболевание распространено в Австралии и Африке. Источником инфекции служит тропическое окружение. Вакцинация БЦЖ защищает от этого микобактериоза.
4-я группа - быстрорастущие как ското-, так и фотохромогенные микобактерии (M. fortuitum complex, M. phlei, M. smegmatis и др.). Рост их отмечается в виде R- или S-форм колоний в течение от 1-2 до 7 дней. Они обнаруживаются в воде, почве, нечистотах и являются представителями нормальной микрофлоры тела человека. Бактерии этой группы редко выделяются из патологического материала от больных, однако некоторые из них имеют клиническое значение.
M. fortuitum complex включает M. fortuitum и M. chelonae, которые состоят из подвидов. Они вызывают диссеминированные процессы, кожные и послеоперационные инфекции, заболевания легких. Микробы данного комплекса высокоустойчивы к противотуберкулезным препаратам.
M. smegmatis - представитель нормальной микрофлоры, выделяется из смегмы у мужчин. Хорошо растет при 45 ?С. Как возбудитель заболеваний человека занимает второе место среди быстрорастущих микобактерий после комплекса M. fortuitum. Поражает кожу и мягкие ткани. Возбудителей туберкулеза необходимо дифференцировать от M. smegmatis при исследовании мочи.
Наиболее часто микобактериозы вызывают представители 3-й и 1-й групп.
Эпидемиология, патогенез и клиническая картина микобактериозов. Возбудители микобактериозов широко распространены в природе. Их можно обнаружить в почве, пыли, торфе, грязи, воде
рек, водоемов и плавательных бассейнов. Они обнаруживаются у клещей и рыб, вызывают заболевания у птиц, диких и домашних животных, являются представителями нормальной микрофлоры слизистых оболочек верхних дыхательных путей и мочеполового тракта у человека. Заражение НТМБ происходит из окружающей среды аэрогенно, контактным путем при повреждении кожных покровов, а также пищевым и водным путями. Передача микроорганизмов от человека к человеку нехарактерна. Это условнопатогенные бактерии, поэтому большое значение в возникновении заболевания имеют снижение резистентности макроорганизма, его генетическая предрасположенность. В пораженных участках образуются гранулемы. В тяжело протекающих случаях фагоцитоз носит незавершенный характер, бактериемия выражена, а в органах определяются макрофаги, заполненные НТМБ и напоминающие лепрозные клетки.
Клинические проявления разнообразны. Чаще всего поражается дыхательная система. Симптоматика легочной патологии сходна с таковой при туберкулезе. Вместе с тем нередки случаи внелегочной локализации процесса с вовлечением кожи и подкожной клетчатки, раневых поверхностей, лимфатических узлов, мочеполовых органов, костей и суставов, а также мозговых оболочек. Органные поражения могут начинаться как остро, так и скрыто, но почти всегда протекают тяжело.
Возможно также развитие смешанной инфекции (mixt- инфекции), в ряде случаев они могут быть причиной развития вторичной эндогенной инфекции.
Микробиологическая диагностика. Основной метод диагностики бактериологический. Материал на исследование берут, исходя из патогенеза и клинических проявлений заболевания. Первоначально решается вопрос о принадлежности выделенной чистой культуры к возбудителям туберкулеза или НТМБ. Затем применяют комплекс исследований, позволяющих установить вид микобактерий, степень вирулентности, а также группу по Раньону. Первичная идентификация основана на таких признаках, как скорость роста, способность к образованию пигмента, морфология колоний и способность роста при различных температурах. Для выявления этих признаков не требуется дополнительного оборудования и реактивов, поэтому они могут применяться в базовых лабораториях противотуберкулезных диспансеров. Окончательная
идентификация (референс-идентификация) с применением сложных биохимических исследований проводится в специализирован- ных лабораториях научных учреждений. В большинстве случаев предпочтение отдают их идентификации по биохимическим свойствам, так как современные молекулярно-генетические методы трудоемки, имеют много подготовительных стадий, требуют специального оборудования, дорогостоящие. Большое значение для лечения имеет определение чувствительности к антибиотикам выделенной чистой культуры. Выделение НТМБ может происходить в результате случайного загрязнения материала из окружающей среды, являться следствием носительства НТМБ или заболевания микобактериозом. Решающее значение для постановки диагноза микобактериоза имеет критерий одновременности появления клинических, рентгенологических, лабораторных данных и выделения чистой культуры НТМБ, проведение многократных исследований в динамике.
Вспомогательное значение в диагностике имеют определение антител с помощью РНГА, РП, иммуноэлектрофореза, РнИФ и ИФА, а также постановка кожных аллергических проб с сенситинами [PPD-Y к M. kansasii; PPD-B (MAC); PPD-G к M. scrofulaceum].
Лечение и специфическая профилактика. Все виды НТМБ, за исключением M. xenopi, устойчивы к изониазиду, стрептомицину и тиосемикарбазонам. Лечение микобактериозов противотуберкулезными и антибактериальными препаратами должно быть длительным (12-18 мес) и комбинированным. Обычно оно малоэффективно при МАС-инфекции и заболеваниях, вызванных быстрорастущими микобактериями. В ряде случаев применяется хирургическое лечение. Препараты для специфической профилактики не разработаны.
16.7.3. Актиномицеты (род Actinomyces)
Морфология. Ветвящиеся бактерии. Не содержат в клеточной стенке хитина или целлюлозы, в отличие от грибов, имеют строение грамположительных бактерий. Мицелий примитивен. Тонкие прямые или слегка изогнутые палочки размером 0,2-1,0x2,5 мкм, часто образуют нити длиной до 10-50 мкм. Способны образовывать хорошо развитый мицелий, у одних видов он длинный, редко ветвящийся, у других короткий и сильно ветвящийся, гифы мицелия не септированы. Палочковидные формы, часто с утол-
щенными концами, в мазке располагаются поодиночке, парами, V- и Y-образно либо в виде палисада. Все морфологические формы способны к истинному ветвлению, особенно на тиогликолевой полужидкой среде. По Граму окрашиваются плохо, часто образуют зернистые либо четкообразные формы, конидий не образуют, некислотоустойчивы. Типовой вид - Actinomyces bovis.
Культуральные свойства. Облигатные и факультативные анаэробы, капнофилы. Растут медленно, посевы следует культивировать 7-14 сут. Температурный оптимум роста 37 ?С. Некоторые штаммы дают гемолиз на средах с кровью. Некоторые виды формируют нитчатые микроколонии, напоминающие мицелий, а на 7-14-е сут образуют крошковатые S-формы колоний, иногда окрашенные в желтый или красный цвет. Actinomyces israelii склонен образовывать длинный ветвящийся мицелий, со временем распадающийся на полиморфные кокковидные, колбовидные и другие элементы. На простых питательных средах растет плохо, лучше растет на белковых средах, содержащих сыворотку; образует прозрачные бесцветные пастообразные, обычно гладкие колонии, плотно срастающиеся со средой. Воздушный мицелий скудный, пигментов не образует, на некоторых средах, например на кровяном агаре, может формировать белые бугристые колонии. A. odontolyticus на кровяном агаре образует красные колонии с зоной гемолиза.
Биохимическая активность. Хемоорганотрофы. Ферментируют углеводы с образованием кислоты без газа, продукты ферментации - уксусная, муравьиная, молочная и янтарная кислоты (но не пропионовая). Наличие каталазы и способность восстанавливать нитраты в нитриты вариабельны у разных видов, индол не обра- зуют. Видовая дифференциация основана на различиях в способности ферментировать углеводы и в некоторых других биохимических тестах.
Антигенная структура. В ИФА выделяют серогруппы A, B, C, D, E, F.
Экологическая ниша. Основная среда обитания - почва. Постоянно обнаруживаются в воде, воздухе, на различных предметах, покровах растений, животных и человека. Колонизируют слизистую оболочку полости рта человека и млекопитающих.
Устойчивость в окружающей среде. При попадании на воздух мгновенно погибают.
Чувствительность к антимикробным препаратам. Чувствительны к пенициллинам, тетрациклину, эритромицину и клиндамицину, но резистентны к антимикотикам. Чувствительны к действию обычно применяемых антисептиков и дезинфектантов.
Эпидемиология. Источник инфекции - почва. Характерна множественность механизмов, путей и факторов передачи, хотя чаще всего механизм передачи контактный, а путь передачи раневой. Восприимчивость к актиномицетам, как ко всем условнопатогенным микробам, низкая у лиц с нормальным иммунным статусом и повышенная у иммунодефицитных хозяев.
Патогенез. Вызывают оппортунистическую инфекцию.
Клиническая картина. Актиномикоз - хроническая оппортунистическая инфекция человека и животных, вызываемая анаэробными и факультативно-анаэробными актиномицетами, которая характеризуется гранулематозным воспалением с полиморфными клиническими проявлениями.
Заболевание проявляется формированием гранулемы, которая подвергается некротическому распаду с образованием гноя, выходящего через свищи на поверхность кожи и слизистых оболочек. Гной различной консистенции, желтовато-белого цвета, иногда с примесью крови, часто содержит друзы. Одновременно отмечается фиброз гранулемы. В зависимости от локализации различают шейно-лицевую, торакальную, абдоминальную, мочеполовую, костно-суставную, кожно-мышечную, септическую и другие формы болезни.
Иммунитет изучен недостаточно.
Лабораторная диагностика. Материалом для исследования служат мокрота, ликвор, гной из свищей, пунктаты невскрытых очагов размягчения, соскобы с грануляций, ткани, полученные при биопсии.
Для диагностики используют бактериоскопический, бактериологический, серологический и аллергологический методы.
Обычно диагноз ставят бактериоскопически по обнаружению в нативном исследуемом материале друз актиномицетов, имеющих вид мелких желтоватых или серовато-белых зернышек с зеленоватым отливом. Под малым увеличением видны образования округлой формы с бесструктурным центром и периферией радиального строения; под большим увеличением в центре видны сплетения тонких гиф с пигментированными зернами, по периферии от это-
го клубка мицелия отходят радиально в виде лучей гифы с колбовидными утолщениями на концах. По Граму споры окрашиваются в темно-фиолетовый, мицелий - в фиолетовый, а друзы - в розовый цвет. По Цилю-Нельсону мицелий окрашивается в синий, а споры - в красный цвет.
Окончательный диагноз устанавливают на основании выделения возбудителя. Для подавления роста сопутствующей микро- флоры гной и мокроту перед посевом центрифугируют в растворе пенициллина и стрептомицина, затем отмывают изотоническим раствором NaCl для удаления антибиотиков. Засевают на питательные среды (сахарный агар, среда Сабуро и др.) и культивируют в аэробных и анаэробных условиях. Выделяют и идентифицируют чистую культуру по общепринятой схеме. У выделенных культур определяют способность сворачивать и пептонизировать молоко - признак, характерный для актиномицетов. Выделение анаэробных видов подтверждает диагноз актиномикоза.
Для серодиагностики ставят РСК с актинолизатом. Реакция недостаточно специфична, поскольку положительные результаты могут отмечаться при раке легкого и тяжелых нагноительных про- цессах. Применение в качестве антигена вместо актинолизата внеклеточных белков актиномицетов повышает чувствительность РСК. Этот же антиген можно использовать и для постановки РНГА.
Аллергическую пробу проводят с актинолизатом. Диагностическое значение имеют лишь положительные и резко положительные пробы. При висцеральном актиномикозе аллергическая проба часто отрицательная.
Лечение. Удовлетворительных результатов можно достичь при- менением пенициллина, тетрациклина, эритромицина, клиндамицина.
Профилактика. Специфическая профилактика не разработана. Неспецифическая профилактика направлена на повышение иммунного статуса.
16.7.4. Нокардии (род Nocardia)
Нокардии впервые выделены Нокаром в
Морфология. На ранних стадиях роста образуют относительно развитый мицелий, растущий по поверхности и проникающий в
глубь среды. Клетки прямые или изогнутые с частым ветвлением. В первые часы роста мицелий несептированный и все сплетение одноклеточное. Диаметр нитей 0,3-1,3 мкм. С возрастом в нитях образуются септы, и мицелий фрагментируется на отдельные палочковидные или кокковидные элементы, которые размножаются бинарным делением или почкованием. В старых культурах можно обнаружить многоклеточные нити, образующиеся в результате неполного разделения фрагментирующегося мицелия. Образуют конидии. Окраска по Граму вариабельна: в патологическом материале представлены грамположительными короткими ветвящимися нитями и дифтероидными элементами, в старых культурах можно обнаружить грамотрицательные диссоциированные элементы. Относительно кислотоустойчивы, окрашиваются по Цилю-Нельсону. По форме мицелия и времени его диссоциации делятся на три группы: 1-я - мицелий ограниченный, не образует конидий, диссоциирует через 12-14 ч инкубации; в старых культурах обычны короткие палочки и кокковидные формы; 2-я - мицелий ограниченный, не образует конидий, диссоциирует через 20 ч инкубации; в старых культурах преобладают длинные фрагменты мицелия; 3-я - мицелий обильный с редкими конидиями; в ста- рых культурах преобладают длинные ветвящиеся нити.
Культуральные свойства. Хорошо растут на простых питательных средах (МПА, МПБ, среда Сабуро и др.). Температурный оптимум роста 28-37 ?С. На жидких средах образуют тонкую прозрачную пленку, напоминающую растекшуюся каплю жира; постепенно приобретают кремово-желтый цвет. Возможен придонный рост в виде комочков ваты или плотных зерен. На плотных средах через 48-72 ч образуют мелкие гладкие влажные колонии тестоватой консистенции. Через 72 ч поверхность колоний становится исчерченной, на 10-14-е сут принимают вид с приподнятым и извитым центром и фестончатыми краями. Продуцируют пигменты от кремового до красного, которые диффундируют в питательную среду. Бактерии 1-й группы образуют мягкие, пастообразные и слизистые колонии, 2-й - пастообразные или маслянистые, 3-й - сухие кожистые колонии.
Биохимическая активность достаточно высокая.
Экологическая ниша. Повсеместно распространены в почве и на разлагающихся органических субстратах. Не являются представителями нормальной микрофлоры организма человека, хотя их
иногда выделяют от клинически здоровых людей. Устойчивость в окружающей среде высокая.
Чувствительность к антимикробным препаратам. Чувствительны к гентамицину и левомицетину, обычно применяемым антисептикам и дезинфектантам.
Эпидемиология. Источник инфекции - почва. Механизм передачи контактный, путь передачи раневой. Возможны также аэрогенная передача возбудителя воздушно-капельным или воздушно-пылевым путем и передача алиментарным путем с контаминированной пищей через поврежденные слизистые оболочки желудочно-кишечного тракта. Восприимчивость к нокардиям, как ко всем условно-патогенным микробам, низкая у лиц с нормальным иммунным статусом и повышенная у иммунодефицитных хозяев.
Патогенез. Вызывают оппортунистическую инфекцию. Возбудитель захватывается альвеолярными макрофагами, в цитоплазме которых он сохраняет жизнеспособность, блокируя слияние фагосомы с лизосомами и ингибируя синтез лизосомальных ферментов. Персистенция возбудителя ведет к развитию воспаления с формированием множественных сливных абсцессов и гранулем. Инфекция подкожной клетчатки развивается при попадании в рану возбудителя и характеризуется развитием гнойного воспаления. У иммунодефицитных лиц возможно развитие диссеминированных инфекций.
Клиническая картина. Нокардиозы - оппортунистические инфекции человека, вызываемые нокардиями, которые характеризуются преимущественным поражением легких и подкожной клетчатки с развитием гнойно-гранулематозного воспаления.
Относятся к редким заболеваниям. Ежегодно в мире регистрируют 1,5-2 тыс. случаев заболевания, более половины из них у лиц с иммунодефицитами. Основные формы поражения - легочные и подкожные нокардиозы. Наиболее распространены легочное поражение, вызванное Nocardia asteroides, и подкожное поражение, вызванное Nocardia brasiliensis.
При легочном поражении в паренхиме легких формируются множественные сливные абсцессы и гранулемы. В воспалительный процесс часто вовлекаются органы средостения, мягкие ткани грудной клетки и др. Особую опасность заболевание представляет для лиц с иммунодефицитами, у которых часто развиваются диссеминированные инфекции, сопровождающиеся поражением
центральной нервной системы, менингеальными явлениями, парезами и параличами. При диссеминированных формах возможно поражение кожных покровов, лимфатических узлов, печени и почек.
Инфекция подкожной клетчатки характеризуется развитием неглубоких пустул в месте проникновения возбудителя. При про- грессировании болезни образуются абсцессы и гранулемы, которые напоминают кожный актиномикоз.
Иммунитет изучен недостаточно.
Лабораторная диагностика. Материалом для исследования служат мокрота, гной, биоптаты тканей. Для диагностики используют бактериоскопический и бактериологический методы. Обычно диагноз ставят бактериоскопически по обнаружению в исследуемом материале несептированных гиф. Окончательный диагноз устанавливают на основании выделения возбудителя.
Лечение. Удовлетворительных результатов можно достичь при- менением сульфаниламидов или комбинации их с гентамицином или левомицетином.
Профилактика. Специфическая профилактика не разработана. Неспецифическая профилактика направлена на повышение иммунного статуса.
16.7.5. Бифидобактерии, эубактерии, пропионобактерии, мобилункусы, гарднереллы
Бифидобактерии - см. раздел 4.2. Эубактерии - см. раздел 4.2.
Пропионобактерии
Морфология. Грамположительные неспорообразующие неподвижные палочки. Плеоморфные, дифтероидные или булавовидные с одним округленным концом и другим конусообразным или заостренным, окрашивающимся менее интенсивно. Клетки могут быть кокковидными, удлиненными, раздвоенными и даже разветвленными; располагаются поодиночке, парами, в виде букв V и Y, короткими цепочками или группами в виде китайских иероглифов. Типовой вид - Propionibacterium.
Культуральные свойства. Большинство штаммов наиболее быстро растет в анаэробных условиях, на специальных средах, с оптимум рН 7,0 при 25-45 ?С.
Биохимическая активность. Обладает бродильным метаболизмом. Продукты брожения включают комбинации пропионовой и уксусной кислот. Большинство штаммов образует аммиак из белковых веществ.
Экологическая ниша. Кожа человека, пищеварительный тракт человека и животных; встречаются в молочных продуктах.
Чувствительность к антимикробным препаратам. Чувствительны к действию обычно применяемых антисептиков и дезинфектантов.
Мобилункусы (род Mobiluncus)
Подвижные анаэробные грамотрицательные (или грамположительные) изогнутые палочки. Обладают бродильным метаболизмом, каталазоотрицательны. Выделяются из влагалища и прямой кишки. Являются одним из микробных компонентов, участвующих в развитии бактериального вагиноза.
Гарднереллы (род Gardnerella)
Gardnerella vaginalis относится к роду Gardnerella.
Морфология. Мелкие палочки или коккобациллы размером 1-2x0,3-0,6 мкм. В мазках клетки располагаются поодиночке или парами. Молодые 8-12-часовые культуры окрашиваются грамотрицательно, а культуры, выращенные на оптимальной среде, - грамположительны. Капсул, жгутиков и спор не имеют.
Культуральные свойства. Факультативные анаэробы, капнофилы. Требовательны к питательным средам, на простых питательных средах не растут или дают слабый рост на кровяном агаре. Растут на специальных сложных питательных средах с добавлением гемина и НАД при 35-37 ?С.
Биохимическая активность. Метаболизм бродильного типа. Расщепляют глюкозу и мальтозу до кислоты. Главный продукт брожения - уксусная кислота, некоторые штаммы способны образовывать янтарную и муравьиную кислоты. Ферментативная активность низкая: каталазу и оксидазу не образуют, разлагают гиппурат, ги- дролизуют крахмал.
Антигенная структура. Выделяют 7 серогрупп гарднерелл. Общий антиген, представляющий гликопептид, определяют в развернутой РА и ИФА. В РИФ выявлены общие антигены с Candida albicans.
Факторы патогенности. Некоторые штаммы гарднерелл продуцируют нейраминидазу, разрушающую гликопротеиды слизистой оболочки влагалища.
Устойчивость в окружающей среде невысокая. Гарднереллы чувствительны к метронидазолу и триметоприму, обычно применяемым антисептикам и дезинфектантам.
Патогенез. Экологической нишей является влагалище. Гарднереллы совместно с бактероидами, мобилункасами и другими анаэробами вызывают у женщин бактериальный вагиноз, характеризующийся нарушениями микробиоценоза влагалища. Предрасполагающими факторами служат сахарный диабет, беременность, применение гормональных противозачаточных средств, менопауза, эндокринные нарушения, приводящие к дисбалансу эстрогена и прогестерона в организме. Все это вызывает изменение концентрации сахара на слизистой оболочке влагалища и как следствие уменьшение количества лактобацилл, поддерживающих колонизацион- ную резистентность влагалища, в результате чего рН во влагалище становится выше 4,5, и гарднереллы в ассоциации с анаэробами, такими, как бактероиды, пептострептококки и мобилункусы, размножаются, вызывая развития бактериального вагиноза. Ни один из этих микробов в отдельности вагиноза не вызывает.
Клиническая картина характеризуется образованием пенистых влагалищных выделений белого или серого цвета с резким неприятным рыбным запахом, обусловленным образованием аномальных аминов. Признаки воспаления отсутствуют. У мужчин обычно развиваются балонит, неспецифический уретрит или воспалительные процессы полового члена. Бактериальный вагиноз может приводить к тяжелым последствиям, таким, как преждевременные роды, снижение массы тела новорожденных, преждевременный разрыв оболочек, воспалительные заболевания органов малого таза, патологические маточные кровотечения. До 1/3 женщин, предъявляющих различные жалобы на неприятные ощущения в области влагалища, страдают бактериальным вагинозом. При присоединении воспалительного компонента и появлении в отделяемом влагалища нейтрофилов развивается вагинозовагиниит.
Иммунитет после перенесенного заболевания не формируется.
Лабораторная диагностика. Материалом для исследования служат мазки из влагалища и шейки матки. Для диагностики используют бактериоскопический и бактериологический методы. Обычно диагноз ставят бактериоскопически по обнаружению ключевых клеток, т.е. клеток эпителия влагалища, покрытых большим количеством грамотрицательных и грамположительных бактерий.
Ключевые клетки покрыты огромным количеством тонких палочек или коккобактерий, что придает поверхности клетки зернистый вид и неясность очертаний. Лактобациллы в окрашенных по Граму мазках почти или полностью замещаются профузно растущей бактериальной флорой, состоящей из анаэробных бактерий.
Кроме того, используют следующие клинические признаки: выделения из влагалища имеют рН выше 4,5; повышение количества резко водянистых гомогенных выделений из влагалища, отсутствие лейкоцитоза влагалищных выделений; появление резкого запаха при добавлении к выделениям 10% раствора КОН.
Бактериологическое исследование проводят редко.
Лечение направлено на восстановление нормальной микрофлоры влагалища, для этого используют антибиотики, действующие на неспорообразующие анаэробы (метронидазол), и вагинальные пробиотики на основе лактобактерий.
Профилактика. Специфическая профилактика отсутствует.
16.8. Спирохеты и другие спиральные изогнутые бактерии
Таксономия. Относятся к порядку Spirochaetales типа Spirochaetes (от греч. speria - спираль, chaete - волосы).
Морфология. Подвижные извитые бактерии размером 0,1- 0,3x250 мкм, спирально закрученные с помощью осевых фибрилл, состоящих из сократительного белка флагеллина, который обеспечивает их извитую форму и высокую подвижность. Тело спирохет состоит из трехслойной наружной клеточной оболочки, покрывающей цитоплазматический цилиндр, который представляет собой цитоплазму, окруженную цитоплазматической мембраной. Между клеточной оболочкой и цитоплазматическим цилиндром располагается двигательный аппарат клеток - фибриллы, число которых колеблется от 2 до 20 и более. Фибриллы отходят навстречу друг другу от терминальных дисков (блефаропластов), расположенных с двух концов клетки между клеточной оболочкой и цитоплазматической мембраной. Они спиралевидно обвивают цитоплазматический цилиндр. Один конец каждой фибриллы закреплен, другой остается свободным. Фибриллы представляют двигательный аппарат спирохет, обеспечивая три типа движения в жидкой среде: перемещение, вращение вокруг продольной оси и изгибание.
По Граму спирохеты окрашиваются отрицательно. Дифференциальным методом окраски является метод Романовского-Гимзы, интенсивность окраски по которому является родоспецифичной. В живом виде спирохеты наиболее часто изучают методом темнопольной микроскопии, применяют также импрегнацию серебром и фазово-контрастную микроскопию.
Биохимические и культуральные свойства. Хемоорганотрофы. В качестве источника углерода и энергии могут использовать в зависимости от рода углеводы, аминокислоты и липиды. По типу получения энергии встречаются аэробы, микроаэрофилы, фа- культативные и строгие анаэробы. Способность размножаться на искусственных питательных средах зависит от таксономического положения и условий обитания. Культивируемые формы требуют присутствия в питательной среде сыворотки, тканевых экстрактов, растут медленно. В неблагоприятных условиях могут образовывать цисты и L-формы.
Распространение в природе. Встречаются как свободноживущие в воде и почве формы, так и ассоциированные с различными животными. В патологии человека имеют значение 3 рода: Treponema, Borrelia, Leptospira.
16.8.1. Трепонемы (род Treponema)
Род Treponema (от греч. трепо - вращаться и немо - нить) включает более 10 видов. Клетки трепонем - тонкие штопорообразно закрученные нити с 8-14 равномерными завитками. Двигательный аппарат представлен тремя идущими от каждого полюса фибриллами. Плохо окрашиваются по Граму и Романовскому-Гимзе. Выявляются при импрегнации серебром, а также с помощью фазовоконтрастной и темнопольной микроскопии.
Биохимические и культуральные свойства. Патогенные для человека виды - микроаэрофилы. Они не культивируются на искусственных питательных средах. Непатогенные трепонемы - строгие анаэробы. Растут на сложных питательных средах, содержащих сыворотку, кусочки почечной и мозговой ткани кролика, в анаэробных условиях при 35 ?С. Трепонемы являются хемоорганотрофами. Каталазо- и оксидазоотрицательны. Встречаются как ферментирующие, так и неферментирующие углеводы виды, не- которые виды продуцируют индол. При неблагоприятных условиях образуют цисты.
Распространение в природе. Свободноживущие формы не встречаются. У различных животных обитают в ротовой полости, пищеварительном тракте и половых органах. В состав микрофлоры ротовой полости человека входят T. denticola, T. macrodenticum, T. orale, T. vincentii. Последний вид в ассоциации с фузобактерия- ми вызывает развитие фузоспирохетоза - некротической ангины Венсана-Плаута.
В патологии человека имеют значения два вида T. pallidum, разделенный на три подвида: T. pallidum (возбудитель сифилиса), T. endemicum (возбудитель беджель) и T. pertenue (возбудитель фрамбезии) и T. carateum (возбудитель пинты).
16.8.1.1. Возбудитель сифилиса (T. pallidum)
Был открыт в
Морфология и тинкториальные свойства. Типичны для рода Treponema. T. pallidum обладает тремя типами движения: вращением вокруг прямой оси, изгибанием под углом и поступательным волнообразным (маятникообразным) перемещением. Сгибание клетки под прямым углом без потери спиралевидной формы является важным дифференциальным признаком рода Treponema.
Жизненный цикл возбудителя включает в себя спиралевидную форму, зернистую стадию, стадию кистоподобных сферических тел (цисты). Цисты являются формами устойчивого выживания в неблагоприятных условиях. Существуют также L-формы и фильтрующиеся формы T. pallidum/pallidum.
Биохимические и культуральные свойства. Возбудитель сифилиса относится к облигатным паразитам, поэтому он не культивируется на искусственных питательных средах. Биохимические свойства вследствие некультивируемости изучены плохо.
Антигенная структура. Обладает сложной антигенной структурой. Имеет специфический термолабильный антиген и неспецифический липоидный антиген. Последний по составу идентичен кардиолипину, экстрагированному из бычьего сердца. Представляет по химической структуре дифосфадил глицерин.
Факторы патогенности изучены плохо. В процессе прикрепления к клеткам участвуют адгезины, синтез которых происходит, возможно, при попадании возбудителя в организм человека. Липопротеины участвуют в развитии иммунопатологических процессов. T. pallidum/pallidum не продуцирует сильнодействующие эк-
зотоксины, обладая тем не менее цитотоксической активностью в отношении нейробластов и других клеток. Имеются протеины, сходные с бактериальными гемолизинами.
Резистентность. Чувствителен к высыханию, солнечным лучам, дезинфицирующим веществам, нагреванию. При нагревании до 55 ?С гибнет в течение 15 мин, при 100 ?С - мгновенно. На предметах домашнего обихода сохраняет заразительность до высыхания. Цисты и L-формы являются формами устойчивого выживания в неблагоприятных условиях.
Эпидемиология. Сифилис относится к строгой антропонозной инфекции - болеют только люди. Впервые врачами были установлены случаи заболевания сифилисом среди испанцев после открытия Колумбом Нового Света, а в результате войн оно широко распространилось в Европе и быстро достигло эпидемического уровня. Половой путь передачи инфекции был установлен достаточно быстро и был назван А. Паре «Lues Venerae» («любовная чума»). Сам термин «сифилис» предложил Д. Фракасторо (1525), который в стихотворной форме описал это заболевание у пастуха по имени Сифилус. Заражение происходит, как правило, контактнополовым, реже контактно-бытовым и трансплацентарным путями. Возможно заражение кровью, собранной у инфицированных лиц на раннем этапе инфекции. Поэтому для разрушения возбудителя кровь консервируют при -3 ?С в течение 5 дней.
Патогенез и клиническая картина. Сифилис (Lues) - хроническое венерическое заболевание с циклическим течением, затрагивающее в процессе развития инфекции все органы и ткани человека. Проникшие в организм трепонемы из места входных ворот попадают в регионарные лимфатические узлы, где размножаются. Из лимфатических узлов возбудитель попадает в кровяное русло, где прикрепляется к эндотелиальным клеткам, вызывая эндартериит, ведущий к развитию васкулитов и последующему тканевому некрозу. С кровью трепонемы разносятся по всему организму, обсеменяя различные органы и ткани: печень, почки, костную, нервную и сердечно-сосудистую системы.
Болезнь протекает в несколько циклов. Инкубационный период составляет 3-4 нед. Первичный период характеризуется появлением твердого шанкра (язвочки с твердыми краями на месте внедрения возбудителя - слизистых оболочках половых органов, рта, ануса), увеличением и воспалением лимфатических узлов. Его длительность
6-7 нед. Затем наступает вторичный период, который длится годами. Он характеризуется появлением на коже и слизистых оболочках папулезных, везикулярных или пустулезных высыпаний, в которых содержится большое количество живых трепонем, а также поражением печени, почек, костной, нервной и сердечно-сосудистой систем. В этот период больной наиболее заразен. Высыпания могут самопроизвольно исчезать, а при ослаблении защитных сил орга- низма появляться вновь. При отсутствии лечения наступает третичный период, который длится десятилетиями и характеризуется образованием сифилитических бугорков (гумм) как результат развития в организме иммунопатологического процесса. Гуммы склонны к распаду, вызывая деструктивные изменения в пораженных органах и тканях. Без лечения наступает четвертичный период - нейроси- филис, характеризующийся развитием прогрессирующего паралича вследствие поражения центральной нервной системы.
Иммунитет. Защитный иммунитет после перенесенной инфекции не формируется. В ответ на антигены возбудителя в организме образуются антитела, которые являются свидетелями инфекционного процесса, также развивается ГЗТ. Гуморальный иммунный ответ характеризуется первичным образованием неспецифических антител, исторически называемых реагинами, к липоидному антигену возбудителя. Титр этих антител в процессе уменьшения в организме количества трепонем падает. Специфические антитела на белковый антиген появляются позже. Они длительно сохраняются независимо от присутствия трепонем в организме.
Микробиологическая диагностика. Используют бактериоскопический и серологический методы в зависимости от стадии заболевания, а также ПЦР. Бактериоскопическое исследование проводят при первичном сифилисе (рис. 16.10) и в период высыпаний при вторичном сифилисе. Материалом для исследования служат отделяемое твердого шанкра, пунктаты лимфатических узлов, материал из кожных высыпаний.
Серологическое исследование включает комплекс серологических реакций, среди которых имеются отборочные неспецифические тесты, применяемые для обследования населения на сифилис, и диагностические тесты, подтверждающие диагноз.
Отборочные тесты ставят с кардиолипиновым антигеном, а диагностические тесты - с трепонемальным специфическим анти- геном.
К отборочным тестам относится реакция микропреципитации или ее аналоги: VDRL (от англ. veneral disease research laboratory), RPR (от англ. rapid plasma reagin) - флоккуляционные тесты и РПГА с кардиолипиновым антигеном. Эти реакции бывают положительными на ранних этапах заболевания. Ранее ставилась РСК (реакция Вассермана) с кардиолипиновым и трепонемальным антигенами. Отборочные тесты с кардиолипиновым антигеном в количественном варианте по- становки, при котором сыво-
ротка разводится, позволяя определить титр антител, использую для контроля эффективности лечения. Их недостатком являют ложноположительные результаты у лиц, страдающих заболевани ми, сопровождающимися деструкцией тканей организма (маляри онкологические заболевания, коллагенозы и др.).
Рис. 16.10. Treponema pallidum в отделяемом твердого шанкра при окраске по Романовскому-Гимзе
Высокочувствительными и высокоспецифичными реакциями на сифилис являются тесты, в которых в качестве антигена используется ультразвуковой экстракт трепонем, выращенных в яичке кролика. К ним относятся ИФА, РПГА, РИФ (непрямая) иммуноблот. Они являются диагностически подтверждающими тестами. В связи с длительным сохранением специфических антител в организме эти реакции не могут быть использованы для оценки эффективности лечения. Они также будут положительными у больных фрамбезией и беджель.
Из молекулярно-биологических методов чаще всего используют ПЦР, основанную на детекции ДНК T. pallidum/pallidum путем амплификации участка гена поверхностного антигена с молекулярной массой 47 кД, а также выявлении 16S РНК T. pallidum/ pallidum. Аналитическая чувствительность этого метода составляет 400 копий ДНК в 1 мл.
Лечение. Используют антибиотики пенициллинового ряда и висмутсодержащие препараты.
Профилактика. Специфическая профилактика не разработана. Неспецифическая профилактика заключается в пропаганде здорового образа жизни, санитарно-просветительной работе среди молодежи. Проводится обязательный серологический контроль доноров, беременных и больных, поступающих во все стационары, а также в группах риска (проститутки, гомосексуалисты, наркоманы) с целью своевременного выявления и эффективного лечения больных сифилисом.
16.8.1.2. Другие патогенные трепонемы и вызываемые ими заболевания
Основным отличием невенерических трепонематозов от сифилиса является доброкачественность течения. Клиническая картина здесь более стерта, на первый план выходят поражения кожи и слизистых оболочек. Эти заболевания передаются половым путем, хотя гораздо чаще имеет место контактно-бытовой путь передачи. Лабораторная диагностика (те же методы, что и при сифилисе) используется для того, чтобы дифференцировать трепонематозы от кожных заболеваний.
Возбудителем фрамбезии (тропической гранулемы) является T. рallidum (подвид pertenue). Эта трепонема не является патогенной для лабораторных животных, неустойчива во внешней среде. По морфологии практически не отличается от T. pallidum/pallidum. Заболевание распространено в странах Центральной Африки, Южной Азии и Латинской Америки. Путь передачи - контактнобытовой. Чаще болеют дети. В месте внедрения развивается первичный аффект - фрамбезиома (пустулезная бляшка). В дальнейшем могут развиться тяжелые язвенно-гуммозные поражения костей. Поскольку современные методы не позволяют дифференцировать это заболевание с сифилисом, диагноз ставится клинически.
Возбудителем пинты является T. carateum, которая по морфологическим свойствам не отличается от T. рallidum. Встречается в странах Латинской Америки, реже в Центральной Африке, передается контактным путем, а также насекомыми. Заболевание на- чинается с появления на коже красно-коричневой папулы, затем происходит генерализация процесса. Развивается гиперкератоз подошв и ладоней, выпадают волосы. Позднее на пораженных местах формируются участки депигментации. Возбудитель легко обнаружить в пораженных участках кожи методом темнопольной микро- скопии.
При эндемическом сифилисе - беджеле - возбудителем является T. pallidum, подвид endemicum. Морфология этой трепонемы также аналогична морфологии T. pallidum/pallidum. В виде эн- демических очагов беджель регистрируется в Северной Африке, Турции, Индии, Австралии. Основной путь передачи контактный. Чаще болеют дети.
Клиническая особенность беджеля состоит в отсутствии первичного аффекта. Вначале появляется сыпь, как при вторичном сифилисе, позднее развиваются гуммозные поражения, как при позднем сифилисе.
16.8.2. Боррелии (род Borrelia)
Род Borrelia включает более 30 видов спирохет. Непатогенный вид B. buccalia входит в состав постоянной микрофлоры полости рта. Патогенные виды рода Borrelia вызывают как антропонозные (возвратный тиф), так и зоонозные (эндемический возвратный тиф, болезнь Лайма) инфекционные заболевания с трансмиссивным путем передачи возбудителей через клещей и вшей. Боррелии обладают уникальным, не имеющим аналогов среди других бактерий генетическим аппаратом, который состоит из небольших размеров линейной хромосомы и набора циркулярных плазмид. Боррелии представляют собой тонкие спирохеты размером 0,3-0,6x20 мкм с 3-10 крупными завитками. Двигательный аппарат состоит из 15-20 фибрилл. Они хорошо воспринимают анилиновые красители, по Романовскому-Гимзе окрашиваются в сине-фиолетовый цвет. Боррелии могут культивироваться на сложных питательных средах, содержащих сыворотку, асцит, тканевые экстракты, при 28-35 ?С в атмосфере 5-10% СО2, а также в куриных эмбрионах при заражении в желточный мешок. Чувствительны к высыханию и нагреванию. При 45-48 ?С гибнут в течение 30 мин. Устойчивы к низким температурам и замораживанию.
16.8.2.1. Возбудители возвратных тифов
Возвратные тифы - группа острых инфекционных заболеваний, вызываемых боррелиями, характеризующихся острым началом, приступообразной лихорадкой, общей интоксикацией. Различают эпидемический и эндемический возвратные тифы.
Эпидемический возвратный тиф - антропонозная инфекция, возбудителем которой является B. recurrentis, впервые описанная в
Единственным источником возбудителя является лихорадящий больной, в периферической крови которого находятся боррелии. Переносчиком возбудителя являются вши (лобковые, платяные, головные), реже клопы, которые становятся заразными на 6-28-й день после инфицирующего укуса. Человек заражается при втирании гемолимфы раздавленных вшей в кожу, при расчесывании места укуса. Заболевание встречается во время социальных бедствий и войн. На территории РФ в настоящее время не регистрируется.
Эндемический (клещевой) возвратный тиф - зоонозное природноочаговое заболевание. Возбудители представлены более 20 видами боррелий, циркулирующих в различных природных очагах тропиков и субтропиков разных стран. Так, B. duttonii характерна для Африки, B. persica - для Азии, B. caucasica - для Кавказа, Закавказья, Украины. Резервуаром в природе являются грызуны, ряд других животных, а также аргасовые клещи, у которых микроб передается трансовариально. Человек заражается через укусы клещей рода Ornithodoros.
Возбудителей эпидемического и эндемического возвратных тифов дифференцируют в биологической пробе.
Патогенез и клиническая картина. Патогенез и клинические проявления обоих типов возвратных тифов схожи. Инкубационный период длится 3-14 дней. Попавшие в организм боррелии внедряются и захватываются клетками лимфоцитарно-макрофагальной системы, размножаются в них и попадают в большом количестве в кровь, вызывая лихорадку (повышение температуры тела до 39- 40 ?С), головную боль, озноб. Каждая такая атака заканчивается повышением титра антител. Взаимодействуя с ними, боррелии образуют агрегаты, которые нагружаются тромбоцитами, вызывая закупорку капилляров, вследствие чего происходит нарушение кровообращения в органах. Под влиянием антител большая часть боррелий погибает. Однако в связи с особенностью строения генетического аппарата происходит вариация антигенного состава боррелий. Это является результатом того, что часть генов, кодирующих антигены, локализована на разных плазмидах и находится периодически в неактивной молчащей форме. В результате межгенных перегруппировок происходят активация молчащего гена и появление нового антигенного варианта, а так как антитела были выработаны к одному определенному варианту, то новые антигенные варианты боррелий размножаются и вызывают рецидив за-
болевания. Это повторяется от 3 до 20 раз. Прогноз эндемического возвратного тифа благоприятный. Летальность при эпидемическом возвратном тифе не более 1%.
Иммунитет. Иммунитет к эпидемическому возвратному тифу гуморальный непродолжительный. В эндемических очагах коренное население к возбудителю эндемического возвратного тифа, циркулирующего в очаге, располагает иммунитетом.
Микробиологическая диагностика. Используют бактериоскопический метод: исследование крови больного на высоте приступа лихорадки путем окрашивания толстой капли крови по Романовскому-Гимзе или темнопольную микроскопию висячей капли крови. Биопробу ставят для дифференциации B. recurrentis от возбудителей эндемического возвратного тифа: морские свинки легко заражаются возбудителями клещевого возвратного тифа, а белые мыши и крысы - B. recurrentis. В качестве вспомогательного используют серологический метод с постановкой ИФА и непрямой РИФ.
Лечение. Применяют этиотропную антибиотикотерапию (анти- биотики тетрациклинового и пенициллинового ряда).
Профилактика включает борьбу с переносчиками и с завшивленностью населения. Специфическая иммунопрофилактика отсутствует.
16.8.2.2. Возбудители болезни Лайма (B. burgdorferi, B. garini, B. afzelii)
Болезнь
Лайма (синонимы: хроническая мигрирующая эритема, клещевой иксодовый
боррелиоз) является хронической инфекцией с поражением кожи, сердечной и
нервной систем, суставов. Впервые заболевание было описано в
Возбудителем болезни Лайма в Северной Америке является вид B. burgdorferi, который впервые был открыт в
Морфология и культуральные свойства. Возбудители болезни Лайма представляют типичные по морфологическим и тинктори-
альным свойствам боррелии, которые хорошо культивируются на питательных средах при выделении из клещей. Выделить возбуди- тель из материала от больного (крови, ликвора) удается редко.
Антигенная структура. Обладают сложной антигенной структурой. Имеют белковые антигены фибриллярного аппарата (р41) и цитоплазматического цилиндра (р93), антитела к которым появляются на ранних этапах инфекции, но не обладают защитными свойствами. Протективную активность имеют антигены, представленные липидомодифицированными интегральными белками наружной мембраны, обозначаемыми как Osp (outer surface protein) A, B, C, D, E, F, детерминация синтеза которых осуществляется группой плазмид. OspA-антиген обладает антигенной вариабельностью, подразделяясь на 7 сероваров, и является видоспецифическим.
Антигенный состав подвержен вариациям в процессе жизненного цикла боррелий. При культивировании на питательных средах и нахождении в организме человека на поздних стадиях заболевания у боррелий преобладает антиген OspА, тогда как при пребывании в клеще и в организме человека на ранних этапах заболевания преобладает антиген OspC
Факторы патогенности. Липидомодифицированные белки наружной мембраны обеспечивают способность боррелий прикрепляться и проникать в клетки хозяина. В результате взаимодействия с макрофагами происходит выделение ИЛ-1, индуцирующего воспалительный процесс. В процессе развития иммунопатологиче- ских реакций, приводящих к развитию артритов, принимают участие ОsрА - протеин и белок теплового шока, который идентичен по своей структуре и молекулярной массе таковому у человека. Он начинает синтезироваться при 37 ?С.
Распространение в природе и эпидемиология. Резервуаром возбудителей в природе являются мелкие млекопитающие, главным образом лесные белолапчатые мыши. Заболевание передается человеку через укусы клещей рода Ixodes и распространено в ареале обитания этих клещей на территории Северной Америки, Австралии, Европы и Азии. В России зарегистрировано 50 эндемических очагов. От человека к человеку заболевание не передается.
Патогенез и клиническая картина. После укуса клеща возбудитель локализуется в месте внедрения. После лимфогенной и гематогенной диссеминации он проникает в кровь и далее в ткани с клиническими проявлениями поражения сердца, центральной
нервной системы и суставов. Заболевание сопровождается развитием аутоиммунных и иммунопатологических процессов.
Инкубационный период 3-32 дня с момента укуса. На месте укуса образуется папула, совпадающая с началом заболевания.
Клиническая картина подразделяется на три стадии:
• I - мигрирующая эритема, которая сопровождается развитием гриппоподобных симптомов, лимфаденита и появлением в месте укуса клеща кольцевидной эритемы, которая быстро увеличивается в размерах;
• II - развитие доброкачественных поражений в сердце (миокардит) и центральной нервной системе (асептический менингит, мононевриты), которые появляются на 4-5-й нед заболевания и протекают в течение одного или нескольких месяцев;
• III - развитие артритов крупных суставов через 6 нед и более от начала заболевания.
Течение болезни доброкачественное, прогноз благоприятный.
Иммунитет гуморальный видоспецифический к антигенам клеточной стенки боррелий.
Микробиологическая диагностика. Используют бактериоскопический, серологический методы и ПЦР в зависимости от стадии заболевания. Материалами для исследования являются биоптаты кожи, синовиальная жидкость, ликвор, сыворотка крови. На I стадии заболевания проводят бактериоскопическое исследование биоптатов кожи из эритемы. Начиная со II стадии заболевания (3-6 нед) осу- ществляют серологическое исследование, определяя IgM или нарастание титра IgG с помощью ИФА или непрямой РИФ.
Лечение. Этиотропная антибиотикотерапия фторхинолонами или антибиотиками тетрациклинового ряда.
Профилактика. Специфическая профилактика не разработана. Неспецифическая профилактика сводится к использованию защитной одежды и борьбе с клещами.
16.8.3. Лептоспиры (род Leptospira)
Лептоспироз - острая зоонозная природно-очаговая инфекция, с преимущественным поражением капилляров печени, почек и центральной нервной системы, сопровождающаяся развитием интоксикации, геморрагического синдрома и желтухи.
Возбудителем лептоспироза являются различные серовары вида L. interrogans рода Leptospira семейства Leptospiraceae, класса Spirochaetes.
Морфология. Лептоспиры - тонкие спирохеты размером 0,07- 0,15x24 мкм с изогнутыми концами. Двигательный аппарат представлен идущими от каждого полюса клетки по одной фибрилле. Число завитков 20-40. Слабо окрашиваются анилиновыми красителями, поэтому трудноразличимы на препаратах, окрашенных по Романовскому-Гимзе. Легкоразличимы при микроскопии в темном поле и фазово-контрастной микроскопии. Обладают уникальным строением генома - наличием 2 кольцевых хромосом.
Культуральные и биохимические свойства. Аэробы. Источником углерода и энергии служат липиды. Каталазо- и оксидазоположительны. Культивируются на питательных средах, содержащих сыворотку или сывороточный альбумин, при 28-30 ?С. Растут медленно (лаг-фаза длится 2-8 сут, логарифмическая фаза роста - 3-8 сут). Делятся поперечным делением, цист не образуют.
Антигенная структура. Содержат общеродовой антиген белковой природы, выявляемый в РСК, а также вариантоспецифический поверхностный антиген липополисахаридной природы, выявляемый в реакции агглютинации. Таксономическим критерием для лептоспир служит антигенный состав. Основным таксоном является серовар. Известно 250 сероваров, которые объединены более чем в 25 серогрупп.
Факторы патогенности. Некоторые серовары обладают липазой, гемолитическими свойствами, продуцируют плазмокоагулазу, фибринолизин, цитотоксины.
Резистентность. Чувствительны к высыханию, нагреванию, низким значениям рН, дезинфицирующим веществам. При нагревании до 56 ?С погибают в течение 25-30 мин. Кипячение убивает микроб мгновенно. В водоемах сохраняется до 30 дней, во влажных и щелочных почвах - до 280 дней, на пищевых продуктах - 1-2 сут.
Эпидемиология. Резервуаром в природе является более 100 видов диких и домашних животных. Непрерывность процесса циркуляции патогенных лептоспир в природе обеспечивается их способностью к колонизации эпителия извитых канальцев коркового слоя почек животных, у которых формируется хроническое носительство. У грызунов лептоспироз протекает всегда бессимптомно,
у домашних животных лептоспироз протекает как бессимптомно, так и в хронически выраженной форме. Инфицированные леп- тоспирами животные выделяют их с мочой, контаминируя окружающую среду. Больной человек является тупиком инфекции и не имеет практического значения как ее источник. Основной путь передачи водный. Возможны также алиментарный и контактный пути передачи.
Патогенез и клиническая картина. Инкубационный период 7-10 дней. Входные вороты; слизистые оболочки желудочнокишечного тракта, полости рта, глаз, носа, поврежденные кожные покровы. Проникнув в организм, микроб с кровью разносится к органам ретикулоэндотелиальной системы (печень, почки), где размножается и вторично поступает в кровь, что совпадает с началом заболевания.
Возбудитель поражает капилляры почек, печени, центральную нервную систему, приводя к развитию геморрагий в этих органах. Болезнь сопровождается лихорадкой, интоксикацией, желтухой, развитием почечной недостаточности, асептического менингита. Летальность колеблется от 3 до 40%.
Иммунитет. После перенесенного заболевания формируется прочный гуморальный серовароспецифический иммунитет.
Диагностика. Материалом для исследования служат кровь, моча, сыворотка крови, ликвор в зависимости от стадии заболевания. Для диагностики используют бактериоскопический (обнаружение лептоспир в темнопольном микроскопе), бактериологический, серологический методы, биопробу на кроликах-сосунках и морских свинках и ПЦР. На 1-й неделе заболевания возбудитель можно обнаружить в крови, в период разгара заболевания - в моче и ликворе. В связи с тем что эффективность бактериологического метода ограничена из-за длительности проведения анализа (около 3 мес), ведущее место занимает серологический метод, при котором выявляют в крови антитела, а в биологических жидкостях - антигены лептоспир. Золотым стандартом метода является реакция микропреципитации с эталонным набором живых культур лептоспир по схеме, предложенной ВОЗ. Антитела можно определить с конца 1-й нед заболевания в диагностическом титре 1:100. В качестве экспресс-диагностики на 1-й нед заболевания определяют IgM ИФА и ДНК возбудителя ПЦР. Современными направлениями в лабораторной диагностики лептоспироза является обнаружение
антигенов возбудителя при помощи ИФА, РОНГА для ранней диагностики лептоспироза.
Лечение проводят введением гетерологичного противолептоспирозного иммуноглобулина совместно с этиотропной антибиотикотерапией.
Профилактика. Специфическая профилактика проводится вакцинацией по эпидемиологическим показаниям убитой нагреванием корпускулярной вакциной, содержащей 4 основные серогруппы возбудителя. Неспецифическая профилактика сводится к борьбе с грызунами, проведению зооветеринарных мероприятий и соблю- дению личной гигиены.
16.8.4. Кампилобактерии (род Campylobacter)
Таксономия. Род Campylobacter (от греч. campylos - кривой, изогнутый) включает 16 видов. В патологии человека наибольшее зна- чение имеют C. jejuni, C. coli, C. lari, C. fetus, C. intestinales.
Морфология, культуральные, биохимические и антигенные свойства. Грамотрицательные извитые подвижные бактерии, не образующие ни спор, ни капсулы. В мазках из патологического материала располагаются попарно в виде крыльев летящей чайки. Микроаэрофилы не ферментируют сахара, в качестве источника энергии используют аминокислоты, обладают окислительным метаболизмом. Растут при пониженном парциальном давлении кислорода в атмосфере 5-10% СО2 на сложных питательных средах с добавлением антибиотиков для удаления сопутствующей флоры: грамотрицательной - полимиксина, грамположительной - ванкомицина, грибов - амфотерицина. Большинство видов, за исключением C. intestinales, явля- ются терморезистентными, способными расти при 42 ?С. Обладают оксидазной и каталазной активностью. Дифференциация внутри рода проводится по способности гидролиза гиппурата и индоксилацетата и способности роста при 42 ?С. Имеет О- и Н-антигены, по которым подразделяются на 60 сероваров.
Резистентность. Чувствительны к нагреванию, дезинфектантам, кислороду воздуха.
Факторы патогенности. Эндо- и экзотоксины (энтеротоксин и цитотоксин), поверхностные структуры, обеспечивающие адгезию.
Эпидемиология, патогенез и клиническая картина. Кампилобактериоз - зооантропонозная инфекция с фекально-оральным ме-
ханизмом передачи, протекающая чаще всего в виде вспышек энтероколитов; у детей и иммунодефицитных лиц может протекать в виде системной инфекции. Имеются случаи внутрибольничной инфекции, вызванной C. intestinales.
Важнейший источник инфекции - сельскохозяйственные животные. Отмечена адаптации определенных видов возбудителя к определенным видам животных: C. jejuni, являющийся наибо- лее частым возбудителем энтероколитов у людей, выделяется от крупного рогатого скота и птицы; C. coli - от свиней, C. lari - из устриц. Пути передачи водный, алиментарный, контактнобытовой. Заболевание, протекающее в форме энтероколита, после инкубационного периода, равного 2-3 дням, начинается остро с водянистого поноса как следствие действия энтеротоксина, который сменяется кровавым стулом - результат действия цитотоксина. Расстройства кишечника сопровождаются лихорадкой и абдоминальными болями.
Микробиологическая диагностика. Основной метод - бактериологический. Материалом для исследования служат кровь, ликвор, испражнения, рвотные массы (в зависимости от формы заболевания); продукты питания, воду помещают в специальную среду накопления, содержащую соли железа, пируват, тиогликолят, лизированную лошадиную кровь, антибиотики, и инкубируют в СО2-инкубаторе в течение 24-46 ч. После этого делают пересев на специальные элективные среды, которые инкубируют в СО2- инкубаторе в течение 1-5 сут. После чего проводят межвидовую идентификацию по биохимическим свойствам и чувствительности к температуре.
В качестве дополнительных методов проводят серологическое исследование (РИФ, РПГА) и ПЦР. Экспресс-диагностику проводят с помощью РИФ.
Лечение - этиотропная антибиотикотерапия (эритромицин, ципрофлоксацин).
Специфическая профилактика не разработана. Проводятся противоэпидемические и противоэпизоотические мероприятия.
16.8.5. Хеликобактерии (род Helicobacter)
Таксономия. Род Helicobacter (от греч. helios - солнце) включает около 8 видов, из которых в патологии человека наибольшее значение имеет вид H. pylori.
Морфология, культуральные и биохимические свойства. Грамотрицательные извитые неспорообразующие подвижные бактерии, капсулу не образуют. Подвижность обеспечивается пучком жгутиков, расположенных на одном из полюсов клетки. В мазках из патологического материала располагаются попарно в виде крыльев летящей чайки. Микроаэрофилы. Растут на сложных питательных средах, содержащих лошадиную сыворотку, антибиотики для подавления роста сопутствующей флоры, крахмал, активированный уголь, при 37 ?С в атмосфере 5% СО2 в течение 3-5 суток.
Не ферментирует сахара. Родовым дифференцирующим признаком является способность расщеплять мочевину. Обладают оксидазной и каталазной активностью. Продуцирует липазу, в том числе фосфолипазу А.
Резистентность. Чувствителен к факторам внешней среды, рН ниже 6,0, нагреванию, дезинфектантам, антибиотикам метронидазолу и кларитромицину.
Факторы патогенности и антигенная структура. Факторы патогенности обеспечивают выживание микроба в кислой среде и колонизацию слизистой оболочки желудка. К ним относятся адгезины, фосфолипаза А, эндотоксин, фермент уреаза, в результате действия которого образуется большое количество аммиака, приводящее к понижению кислотности желудочного сока и повреждению слизистой оболочки. Цитотоксин участвует в развитии хронического атрофического гастрита и язвы желудка в результате вакуолизации и повреждения клеток эпителия желудка. Антигенной активностью обладают уреаза, цитотоксин, белки теплового шока (HSP A, B).
Эпидемиология. Источником инфекции является человек, который выделяет возбудитель с фекалиями. Инфекция передается фекально-оральным механизмом, пищевым, контактно-бытовым и водным путями. В воде микроб сохраняется в некультивированной форме. Возможно заражение через контаминированные медицинские инструменты при эндоскопических исследованиях. Отмечена передача возбудителя в пределах одной семьи.
Патогенез и клиническая картина. H. pylori представляет хроническую инфекцию, которая протекает в виде гастритов, язв желудка и двенадцатиперстной кишки. Играет роль в развитии рака желудка. Возбудитель вызывает интенсивную воспалительную реакцию в оболочке желудка и двенадцатиперстной кишки с нару-
шением целостности эпителиального слоя и образованием микроабсцессов.
Иммунитет. У инфицированных H. pylori лиц в сыворотке определяются специфические антитела. IgG, IgA персистируют в высоких титрах у лиц с хроническим течением инфекции.
Микробиологическая диагностика. Проводится гистологическое, бактериологическое исследование и ПЦР биопсийного материала, взятого при эндоскопии желудка и двенадцатиперстной кишки, а также серологическое исследование путем обнаружения методом ИФА антител к уреазе и цитотоксину. В качестве экспрессдиагностики ставится тест на обнаружение уреазы в биопсийном материале.
Лечение. Этиотропная терапия антибиотиками (метронидазол, кларитромицин) и солями висмута по определенной схеме. Специфическая профилактика не разработана.
16.9. Риккетсии (семейство Rickettsiaceae)
Порядок Rickettsiales класса Proteobacteria домена Bacteria объединяет α1-протеобактерии двух родов семейства Rickettsiaceae (Rickettsia и Orientia) и 4 родов семейства Anaplasmataceae (Anaplasma, Ehrlichia, Neorickettsia, Wolbachia).
Термин «риккетсии», введенный H. da Rocha-Lima (1916) в честь американского исследователя H. Ricketts, описавшего возбудитель лихорадки Скалистых гор, объединяет обширную группу грамотрицательных микроорганизмов, тесно связанных в своей жизнедеятельности с членистоногими. Риккетсии имеют ряд общих свойств:
• они являются облигатными внутриклеточными паразитами;
• риккетсии не способны к росту на питательных средах;
• их биологические свойства связаны с паразитизмом у членистоногих (клещи, вши, блохи);
• они имеют ряд особенностей в строении, размножении, биохимических, генетических и иммунобиологических характеристиках;
• вызываемые риккетсиями заболевания (риккетсиозы) характеризуются своеобразием клиники и эпидемиологии. Патологический процесс при риккетсиозах обусловлен размножением риккетсий главным образом в эндотелиальных клетках кро-
веносных сосудов, особенно мелких, и сосудорасширяющим действием токсичных субстанций, что вызывает значительные изменения центральной нервной системы и расстройства кровообращения;
• они требуют специальных (риккетсиологических) методов изучения.
Генетические исследования свидетельствуют об эволюционном родстве риккетсий и митохондрий эукариотов, наличии у них общего предшественника, давшего начало митохондриям, что сыграло определяющую роль в возникновении эукариотического мира. Митохондрии и современные риккетсии имеют ряд общих свойств (структура генома, морфология, аэробный тип дыхания и особен- ности метаболизма).
16.9.1. Семейство Rickettsiaceae
Семейство включает представителей двух родов - Rickettsia и Orientia.
Среди облигатных внутриклеточных микроорганизмов порядка Rickettsiales особое место занимают представители рода Rickettsia в связи с их эволюционным родством с митохондриями эукариотов. В состав рода входит 22 вида, которые выделены в две группы: клещевой пятнистой лихорадки (КПЛ) и сыпного тифа (СТ). Содержание Г-Ц в ДНК исследованных видов 30-32,5 мол.%. Типовой вид - Rickettsia prowazekii da Rocha-Lima, 1916 (риккетсия Провачека).
К группе СТ отнесены R. prowazekii - возбудитель эпидемического, передаваемого вшами сыпного тифа и болезни Брилла и R. typhi - возбудитель эндемического (крысиного или блошиного) сыпного тифа, остальные 18 видов - к группе КПЛ. Два вида входят в так называемую группу предшественников.
Возбудитель лихорадки цуцугамуши Orientia tsutsugamushi перенесен из группы цуцугамуши рода Rickettsia в самостоятельный род Orientia.
Микроэкология, круг хозяев и естественного обитания. Экологической микронишей представителей рода Rickettsia служит цитоплазма, для ряда из них (риккетсии группы КПЛ) - и ядро эукариотической клетки, где они размножаются свободно, без окружения паразитофорной вакуолью. Этим они отличаются от коксиелл Бернета, представителей семейства Anaplasmataceae и
хламидий, микронишей для которых являются фагосома и фаголизосома. Экологические особенности риккетсий обусловлены их облигатным внутриклеточным паразитизмом с широким кругом филогенетически далеко отстоящих друг от друга хозяев - кровососущих членистоногих (клещей, вшей, блох) и их теплокровных прокормителей - грызунов, насекомоядных, сумчатых, копытных и других млекопитающих и птиц.
Риккетсии и риккетсиоподобные микроорганизмы широко распространены среди членистоногих, в том числе у вшей, блох, ко- маров, клопов, клещей. Принято считать их эндосимбионтами, находящимися в мутуалистических отношениях с хозяевами - членистоногими. Высокая адаптация к организму членистоногих риккетсий, в том числе патогенных для позвоночных животных, позволяет рассматривать их в качестве первичных хозяев риккетсий. Вместе с тем многие виды риккетсий патогенны для человека и животных, что определяет их медицинское и ветеринарное значение.
Риккетсии имеют широкий диапазон патогенности и могут быть разделены по этому признаку на три группы: классические патогены, новые патогены и симбионты эукариотических клеток, преимущественно насекомых. К классическим патогенам относятся представители группы СТ (R. prowazekii, R. typhi), а также три наиболее значимых представителя группы КПЛ с широким географическим распространением: R. rickettsii - возбудитель пятнистой лихорадки Скалистых гор, R. conorii - возбудитель марсельской или средиземноморской лихорадки, R. sibirica - возбудитель клещевого сыпного тифа (клещевого риккетсиоза Северной Азии). Кроме того, некоторые патогены группы КПЛ имеют локальные ареалы (R. australis, R. japonica) или их распространение слабо изучено (R. akari).
Вторая группа (новые патогены) включает R. slovaca, R. helvetica, R. honei, R. africa, R. mongolotimonae, R. felis, R. aeschlimannii, R. canadensis, R. hulinii, R. heilongjiangensis; заболеваемость инфекциями, вызванными ими, связана с увеличением контактов населения с природными очагами, часто на фоне снижения иммунной резистентности.
Риккетсии группы КПЛ - клещевые микроорганизмы с эффективной трансовариальной и трансфазовой передачей. Основными хозяевами риккетсий этой группы являются клещи родов Dermacentor, Rhipicephalus, Haemaphisalis, Ixodes, Amblyomma.
Морфологические и тинкториальные свойства. Риккетсии - мелкие плеоморфные микроорганизмы от кокковидных до палочковидных, иногда нитевидные, однако чаще короткие палочки размером 0,3-0,6x0,8-2,0 мкм, у некоторых видов длиной до 4 мкм перед делением клеток. Размножение риккетсий происходит бинарным делением вегетативных форм. Жгутиков и капсул нет, но на электронных микрофотографиях клеток, подвергнутых минимальным лабораторным манипуляциям, виден внешний слой аморфного материала (микрокапсула). Риккетсии - грамотрицательные микроорганизмы, плохо окрашиваются обычными анилиновыми красителями. Удерживают основной фуксин. Наиболее часто применяют модификацию окраски по П.Ф. Здродовскому. При этом риккетсии окрашиваются в ярко-розовый или рубиново-красный цвет, цитоплазма клеток - в голубой цвет, ядра - в синий цвет.
Риккетсии имеют сходное с классическими грамотрицательными бактериями строение клетки. При изучении поверхностных структур риккетсий выявлены, как у многих бактерий, волосовидные придатки или фимбрии. С наличием жгутикоподобных образований (актиновых хвостов) связана подвижность. У ряда видов отмечают наличие вегетативных и покоящихся форм.
Культуральные свойства. Облигатный характер внутриклеточного паразитизма риккетсий требует для их развития компонентов клеток хозяина. Распространенными методами культивирования служат метод накопления в тканях желточного мешка развивающихся куриных эмбрионов по Коксу и культуры эукариотических клеток в условиях пониженного метаболизма. Для экспериментального воспроизведения инфекции и выделения штаммов патогенных риккетсий применяют различные виды чувствительных к определенным видам риккетсий животных, чаще морских свинок- самцов, хомячков, членистоногих.
Особенности физиологии. Риккетсии являются медленно растущими микроорганизмами, размножаются поперечным бинарным делением, время их генерации составляет не менее 8-9 ч. Риккетсии имеют осмотически активную клеточную мембрану, со- держащую специфические переносчики для транспорта субстратов. У риккетсий обнаружены ферментные системы, в частности трансаминазы, глютаматоксидазная система, с помощью которых осуществляется в клетке хозяина автономный метаболизм этих микроорганизмов.
Наличие системы транспорта АТФ-АДФ и собственного синтеза АТФ при окислении глютаминовой кислоты указывает на два типа использования риккетсиями АТФ. При размножении риккетсии получают АТФ от клетки-хозяина, в ее присутствии ингибируется цитратсинтаза - ключевой фермент цикла Кребса, что сопровождается снижением катаболизма глютаминовой кислоты. При выходе риккетсий из клеток в условиях дефицита АТФ активность цитратсинтазы усиливается, что ведет к активации цикла Кребса и генерации эндогенной риккетсиальной АТФ.
У риккетсий отмечается высокое содержание липидов (до 50%) и низкое - углеводов. По высокому содержанию нуклеиновых кислот (до 12%) и наличию в составе как ДНК, так и РНК риккетсии представляют бактериальные организмы. Сходны по химическому составу и клеточные стенки риккетсий и классических бактерий. В них выявлены диаминопимелиновая и мурамовая кислоты, белки, липиды, полисахариды. Однако у риккетсий содержится и глюкуроновая кислота, которая в оболочках бактерий обычно отсутствует.
Резистентность. Риккетсии малоустойчивы к нагреванию. Быстро инактивируются даже при 56 ?С (не более 30 мин), при 80 ?С - в течение 1 мин, при кипячении - практически мгновенно. Риккетсии нестабильны, когда отделены от компонентов клеток хозяина. Они более стабильны в средах с белками молока, альбумином плазмы, сахарозой, фосфатом калия, глутаматом, что используется при лиофильном высушивании культур. Риккетсии инактивируются различными дезинфицирующими средствами - 0,5% раствором формалина в течение 30 мин, 0,5% раствором фенола. Быстро погибают под действием жирорастворителей (спирта, эфира, хлороформа).
Будучи облигатными внутриклеточными паразитами, риккетсии тем не менее хорошо адаптированы к окружающим условиям. Яичные культуры риккетсий в лиофилизированном состоянии при 4 ?С можно сохранять в течение нескольких лет, наиболее эффективно хранение при низких температурах. Риккетсии Провачека длительно сохраняются в экскрементах переносчика (платяных вшей) при комнатной температуре (до 233 дней). Длительное сохранение риккетсий группы КПЛ в клещах и особенно риккетсий Провачека в фекалиях вшей может иметь значение в заражении людей путем контаминации содержащих риккетсии фекалий переносчиков при расчесах или аэрогенным путем.
Антигенная структура. Основными антигенными комплексами риккетсий являются группоспецифический (отличающийся у риккетсий групп КПЛ и СТ) термостабильный липополисахаридный комплекс и два протективных поверхностных белка - rOmpA и rOmpB. Эти протеины наружных мембран риккетсий характеризовались различной молекулярной массой для каждого вида.
Наличие на риккетсиальных протеинах rOmpA и OmpB видовых, субвидовых и субгрупповых антигенных детерминант по- зволяет дифференцировать большинство риккетсий. У ориенций цуцугамуши и риккетсий группы СТ rOmpB обладает свойствами адгезина.
Факторы патогенности. Риккетсии - особая экологическая группа облигатных внутриклеточных прокариотических микроорганизмов, имеющих ряд отличий от классических бактерий в отношениях паразит-хозяин, среди них эндоцитобиоз в эукариотических клетках позвоночных животных и членистоногих переносчиков, отсутствие четких критериев патогенности и классических эндотоксинов. Наряду с патогенными для человека видами риккетсий имеется целый ряд непатогенных видов или видов с неустановленной патогенностью. У риккетсий описана микрокапсула, с наличием которой связывают так называемый механизм реактивации риккетсий (восстановления вирулентности штаммов). Во взаимо- действии риккетсий с эукариотическими клетками придается значение фосфолипазе А2 и адгезинам риккетсий, которыми являются поверхностные белки rOmpA (имеют значение преимущественно для риккетсий группы КПЛ) и OmpB (для риккетсий группы СТ и ориенций), а также активной подвижности патогенных риккетсий, связанной с наличием актиновых хвостов. Риккетсии имеют субстанции, обладающие токсическими свойствами, в том числе липополисахарид, фосфолипидные фракции, специфический набор жирных кислот. Токсичность риккетсий и их пирогенное действие связаны преимущественно с поражением риккетсиями эндотелиальных клеток сосудистого русла. Риккетсии обладают гемолитическими свойствами в отношении эритроцитов кролика и барана, гемагглютинином. Риккетсии имеют также аллергенные субстанции, входящие в состав растворимых антигенных фракций.
Патогенез и клиническая картина. Заражение людей риккетсиями группы КПЛ обусловлено присасыванием клещей-переносчиков определенных видов. Во входных воротах (на месте присасыва-
ния) при большинстве риккетсиозов группы КПЛ (кроме пятнистой лихорадки Скалистых гор) происходит размножение воз- будителя в эпителиальных клетках с формированием первичного аффекта. Далее риккетсии распространяются лимфогенно, что может сопровождаться лимфангитом и регионарным лимфаденитом. Дальнейшее гематогенное распространение возбудителя сопровождается генерализованным поражением эндотелия сосудов, в том числе формированием различной выраженности эндоваскулитов и тромбангиитов в сосочковом слое кожи (сыпь). Патологический процесс при риккетсиозах обусловлен размножением риккетсий в клетках-мишенях (главным образом в эндотелиальных клетках кровеносных сосудов, особенно мелких) и сосудорасширяющим действием токсичных субстанций, что вызывает значительные изменения центральной нервной системы и расстройства кровообращения. Имеет место поражение сосудистого аппарата, преимущественно прекапилляров, капилляров и артериол с развитием десквамативно-пролиферативного тромбоваскулита и образованием специфических гранулем в местах паразитирования риккетсий. Этот процесс проявляется постепенным, по мере внутриклеточного размножения риккетсий и гибели инфицированных клеток, развитием инфекционно-токсического синдрома. Возможна не только длительная персистенция риккетсий в организме переболевшего, но и с учетом ангиотропизма риккетсий развитие сердечнососудистой патологии после перенесенного риккетсиоза. Для некоторых риккетсий характерно возникновение рецидивов инфекции, особенно для R. prowazekii (болезнь Брилла-Цинссера - рецидив сыпного тифа).
Риккетсии могут взаимодействовать с плазматическими мембранами различных по функциям клеток - эритроцитами, клетками млекопитающих и человека, не являющихся профессиональными фагоцитами (прежде всего эндотелиальными клетками сосудов), а также фагоцитирующими клетками. Взаимодействие риккетсий с непрофессиональными фагоцитами осуществляется в два основных этапа - индукции фагоцитоза и лизиса плазматической мембраны эукариотической клетки при метаболической активности как микроорганизма, так и клетки хозяина. В процессе принимает участие фосфолипаза А и холестеринсодержащие рецепторы клетки. Эндоцитированные риккетсии оказываются в фагосоме. Риккетсии обладают способностью разрушать фагосому до ее слия-
ния с лизосомой и тем самым избегают воздействия защитного механизма клетки, являются цитоплазматическими паразитами. На ранних стадиях заболевания макрофаги также колонизируются риккетсиями и участвуют в распространении возбудителя.
Иммунитет. У переболевших риккетсиозами лиц развивается стойкий антитоксический и антибактериальный иммунитет, при сыпном тифе он может быть нестерильным. При риккетсиозах группы КПЛ после перенесенной инфекции создается стойкий иммунитет не только к данному виду риккетсий, но и к другим возбудителям группы КПЛ.
При лихорадке цуцугамуши в связи с выраженной гетерогенностью генетических и антигенных свойств возбудителя иммунитет типоспецифический, нестойкий. Возможны повторные заболевания, связанные преимущественно с заражением другими серовариантами ориенций. При риккетсиозах группы КПЛ и СТ, лихорадке цуцугамуши доказано наличие стертых и бессимптомных форм инфекции, связанных как с гетерогенностью возбудителей, так и с неодинаковой резистентностью населения, в том числе наличием популяционного иммунитета.
В развитии специфической невосприимчивости ведущее значение имеет клеточный иммунитет в виде ГЗТ, выявляемой с помощью внутрикожных аллергических проб или методов аллергологической диагностики in vitro - реакции торможения миграции лейкоцитов (РТМЛ) и реакции бласттрансформации лимфоцитов (РБТЛ) на специфические риккетсиальные аллергены.
Микробиологическая диагностика. Лабораторная диагностика сыпного тифа и других риккетсиозов чаще осуществляется с использованием серологических (РСК, РНГА, реакции непрямой иммунофлюоресценции - РНИФ, ИФА) и молекулярногенетических (ПЦР, определение нуклеотидных последовательностей фрагментов генов) методов.
Методы выделения и последующей идентификации риккетсий требуют соблюдения режима (возбудители II-III группы патогенности). К возбудителям II группы патогенности относят R. prowazekii, R. rickettsii.
Эффективно риккетсиологическое исследование снятых с человека переносчиков классическими (выделение возбудителя) и экспресс (метод флюоресцирующих антител - МФА ИФА, РНГА с иммуноглобулиновыми диагностикумами для выявления антигенов риккетсий групп СТ и КПЛ)-методами.
Выделение возбудителей риккетсиозов от больных проводят в острый лихорадочный период до начала антибиотикотерапии. Основные риккетсиологические методы включают заражение, чаще интраперитонеальное, чувствительных животных (морские свинки, хомячки, хлопковые и белые крысы, белые мыши), развивающихся куриных эмбрионов (в желточный мешок по Коксу), перевиваемых культур клеток (Vero, HeLa, Hep-2), клеток членистоногих.
Развитие инфекции в клеточных культурах у разных видов родов Rickettsia и Orientia различается. Для риккетсий Провачека и ориенций цуцугамуши характерно накопление микроорганизмов в больших количествах в отдельных клетках. Дегенеративные изменения клеток вследствие перепроизводства возбудителя сопровождаются их разрывом и освобождением микроорганизмов с распространением инфекции на соседние клетки.
У риккетсий группы КПЛ накопление возбудителя в отдельных клетках не сопровождается их переполнением, риккетсии еще на ранней стадии выходят из клеток без существенных их повреждений с быстрым распространением инфекции клеточной культуры. Дегенеративные изменения клеток обусловлены преимущественно токсическим действием риккетсий.
Серологическая диагностика. РСК являлась базовым методом серологической диагностики риккетсиозов. Метод обладает высокой групповой специфичностью даже при низких (1:10-1:20) разведениях сывороток, однако недостаточно чувствителен в ранней фазе заболевания. Комплементсвязывающие антитела при большинстве риккетсиозов групп СТ и КПЛ выявляют в конце 1-й - начале 2-й нед инфекции, в некоторых случаях - в более поздние сроки. Наличие группоспецифического полисахаридного комплекса в составе препарата растворимого антигена для РСК приводит к отсутствию четкой видовой дифференциации внутри групп СТ и КПЛ, хотя титры антител обычно бывают выше к гомологичному антигену. Группоспецифическая диагностика риккетсиозов группы КПЛ в РСК в России осуществляется с растворимым антигеном R. sibirica. Более четкая видовая дифференциация внутри групп осуществляется с помощью корпускулярных антигенов.
РНГА применяют для диагностики риккетсиозов группы как СТ, так и КПЛ. В нашей стране метод применяется преимущественно для выявления антител к риккетсиям группы СТ. РНГА -
наиболее ранний чувствительный метод выявления текущей (острой) риккетсиозной инфекции, выявляет преимущественно IgM-антитела, быстро исчезающие после перенесения инфекции. Латекс-агглютинация в целом близка по своим параметрам к РНГА, используется как метод первичного тестирования сывороток крови, группоспецифична, выявляет как IgM-, так и IgG-антитела, в связи с высокой перекрестной реактивностью внутри группы СТ не позволяет дифференцировать эпидемический и эндемический сыпной тиф.
ИФА применяют для серодиагностики риккетсиозов групп СТ и КПЛ, лихорадки цуцугамуши. По чувствительности и специ- фичности ИФА сопоставима с РНИФ, однако имеет некоторые преимущества для выявления антител в низких титрах (у вакцинированных, в период поздней реконвалесценции), что можно использовать при ретроспективном эпидемиологическом анализе.
РНИФ является золотым стандартом серологической диагностики риккетсиозов. Метод обладает высокой специфичностью и чувствительностью, позволяет выявлять IgM- и IgG-антитела как суммарно, так и раздельно в зависимости от применяемых конъюгатов. При риккетсиозах группы КПЛ и лихорадке цуцугамуши диагностически значимые титры IgM-антител выявляют в конце 1-й нед, IgG-антител - в конце 2-й нед заболевания. Иммуноблот является методом подтверждения стандартных серологических методов диагностики.
У риккетсий и ориенций выявлено наличие перекрестно реагирующих эпитопов с протеями (реакция агглютинации Вейля-Феликса с протеями). Однако реакцию Вейля-Феликса с протейными антигенами и варианты реакции агглютинации со специфическими риккетсиальными антигенами в настоящее время не применяют в связи с недостаточной чувствительностью и специфичностью. Существует более чувствительный метод микроагглютинации с меченными флюорохромом риккетсиями для серологической диагностики риккетсиозов группы СТ.
В последние годы для диагностики риккетсиозов применяют генетические методы (ПЦР, рестрикционный анализ, определение нуклеотидных последовательностей фрагментов ДНК). Использование методов, основанных на ПЦР, является более рациональным. При этом не только не требуется длительное культивиро-
вание микроорганизмов, но часто эти варианты генетического анализа оказываются более чувствительными и специфичными.
Лечение. Наиболее эффективными средствами и антибиотико- терапии риккетсиозов, и лихорадки цуцугамуши являются препараты группы тетрациклинов и фторхинолонов.
Основные нозологические формы и особенности клинического и эпидемиологического проявления риккетсиозов описаны ниже.
16.9.1.1. Представители рода Rickettsia
16.9.1.1.1. Возбудитель сыпного тифа
Сыпной тиф
Антропоноз, при котором циркуляция возбудителя - Rickettsia prowazekii, происходит в паразитарной системе, включающей человека (резервуар) и платяную вошь (переносчик). В организме вши риккетсии размножаются в эпителии кишечника, вызывая его разрушение (несовершенная адаптация) и гибель инфицированных переносчиков. Риккетсии в высоких концентрациях содержатся в фекалиях вшей. Платяная вошь покидает больного хозяина при сыпнотифозной лихорадке и переходит к новому хозяину, что определяет ее роль как переносчика. Механизм передачи - транс- миссивный (контаминация инфицированных фекалий вшей при расчесах). Эпидемическая цепь при сыпном тифе: больной человек → вошь → здоровый человек.
Исторически эпидемический сыпной тиф - одна из наиболее значимых эпидемических инфекций, получавших наибольшее рас- пространение в период войн, других социальных и природных потрясений (т.е. на фоне увеличения вшивости населения). Кроме этого с R. prowazekii связана болезнь Брилла-Цинссера - рецидив эпидемического сыпного тифа, возникающий у переболевших через месяцы - десятки лет (эндогенная реактивация воз- будителя). При наличии платяных вшей больной болезнью Брилла может явиться исходным звеном эпидемической цепи вспышки сыпного тифа. Клинически острая инфекция носит циклический характер после инкубационного периода, длящегося в среднем 10-12 дней. Она проявляется длительной лихорадкой, появлением в разгар заболевания розеолезной, далее розеолезно-петехиальной или розеолезно-папулезной сыпи, резкими изменениями нервной (до менингоэнцефалита) и сердечно-сосудистой систем, тифозным статусом, наличием осложнений. Болезнь Брилла возника-
ет у ранее переболевших лиц как рецидив эндогенной инфекции. Клиническая картина аналогична таковой при острой форме, но клинические проявления менее выражены.
Для диагностики применяют преимущественно серологические методы (РА, РСК, РНГА, РНИФ, ИФА); выделение возбудителя можно проводить только в специализированных риккетсиологических лабораториях (II группа патогенности). Для исследования переносчиков можно применять экспресс-методы - МФА, РНГА с иммуноглобулиновым диагностикумом для выявления риккетсий группы СТ. ДНК возбудителя можно выявлять в ПЦР с последующей идентификацией путем определения нуклеотидных последовательностей ампликона.
В настоящее время выявляют преимущественно спорадические случаи болезни Брилла, вспышки возможны при наличии у больного болезнью Брилла и в его окружении платяных вшей (педикулеза).
Профилактика. Разработана живая сыпнотифозная вакцина. Однако наибольшее значение применительно к СТ имеют борьба с педикулезом, лабораторное обследование на сыпной тиф длительно лихорадящих больных, особенно из категории риска (завшивленные, бездомные, беженцы и др.).
16.9.1.1.2. Возбудители клещевых риккетсиозов
Клещевой риккетсиоз
Возбудитель - Rickettsia sibirica из группы КПЛ. Клещевой риккетсиоз - облигатно-трансмиссивная природно-очаговая инфекция, передаваемая человеку клещами преимущественно из родов Dermacentor (D. nuttalli, D. silvarum, D. marginatus, D. reticulatus) и Haemaphysalis (H. concinna). Природные очаги распространены в Сибири и на Дальнем Востоке России, в Казахстане, Монголии, Китае. Наиболее активны горно-степные очаги с переносчиком D. nuttalli и лесостепные очаги с переносчиками D. nuttalli, D. silvarum, D. marginatus, D. reticulatus. Более 80% заболеваний приходится на Алтайский и Красноярский края. Механизм передачи трансмиссивный (инокуляция при присасывании переносчика с инфицированной слюной). Клинически заболевание проявляется лихорадкой, первичным аффектом на месте присасывания клеща, регионарным лимфаденитом, розеолезно-папулезной полиморфной сыпью, относительной доброкачественностью течения. В отличие от сыпного тифа, поражаются преимущественно сосуды
кожи, а не головного мозга; деструкция эндотелиальных клеток сосудов менее выражена. В типичных случаях диагноз можно ставить клинически, из лабораторных методов чаще применяют РСК со специфическим антигеном. Марсельская лихорадка
Риккетсиоз из группы КПЛ, клиническая картина которого в целом схожа с таковой других риккетсиозов этой группы. Характерны относительная доброкачественность течения, появление пятнистой сыпи на ладонях и подошвах и черных пятен, образующихся обычно в месте присасывания клеща (первичный аффект). R. conorii - возбудитель марсельской лихорадки - экологически связан преимущественно с собачьими клещами Rhipicephalus san- guineus, различные фазы развития которых питаются на мелких млекопитающих, ежах, зайцах и собаках. Эпидемиологическое значение имеют контакт с собаками, присасывание клещей (дворовые, синантропные очаги). Марсельская лихорадка распространена преимущественно в Средиземноморском регионе, а также в бассейнах Черного и Каспийского морей, в Африке, Индии и Пакистане. Отмечены генетические и антигенные отличия возбудителя в пределах генокомплекса R. conorii, а также определенные особенности клинического течения вызываемых R. conorii в различных регионах пятнистых лихорадок.
Астраханская пятнистая лихорадка
Возбудитель астраханской пятнистой лихорадки - риккетсия, относящаяся к генокомплексу R. conorii из группы КПЛ. Переносчиками ее возбудителя являются иксодовые клещи Rhipicephalus pumilio, паразитирующие на различных животных (в том числе на собаках, кошках, ежах). Имаго и особенно нимфы этих иксодид способны присасываться к человеку и передавать возбудителя с пиком заболеваемости в июле-августе. Клинически существенных отличий от марсельской лихорадки не отмечено, преобладают формы средней тяжести, лихорадка, выраженная интоксикация, первичный эффект выявляется редко и с трудом, отмечается выраженная пятнисто-розеолезно-папулезная или геморрагическая сыпь. Для лабораторной диагностики могут быть использованы различные серологические реакции (РСК, РНИФ, ИФА), предпочтительной является РНИФ с высокоочищенными корпускулярными антигенами из штаммов риккетсий астраханской пятнистой лихорадки при начальном разведении сывороток крови 1:40. Очаги
эпидемически активны преимущественно в Астраханской области, их существование выявлено на смежных территориях юга России (в Калмыкии, Волгоградской области) и западной части Казахстана.
Профилактика. Применяют противоклещевую обработку территорий, меры личной защиты от нападения и присасывания клещей, превентивно назначают антибиотики.
16.9.1.2. Возбудители лихорадки цуцугамуши (род Orientia)
Orientia - отдельный род семейства Rickettsiaceae, который по ранее существовавшей таксономии входил в род Rickettsia на правах (серо)группы. Однако в последние годы установлено, что ориенции имеют ряд отличий от представителей рода Rickettsia.
Морфология и тинкториальные свойства. Эти плеоморфные грамотрицательные микроорганизмы, имеют форму коротких палочек, часто - диплобацилл. Характерно околоядерное расположение в цитоплазме эукариотических клеток. В связи с малой устойчивостью отдают фуксин при принятых в риккетсиологии методах окраски (по Здродовскому, Романовскому-Гимзе). В мазках, окрашенных по Романовскому-Гимзе, ориенции приобретают грубую темно-пурпурную окраску, плохо отличимую от цвета окружающих тканей. Наиболее пригоден для световой микроскопии метод Гименеса, при котором ориенции окрашены в темнорозовый цвет и дифференцируются малахитовым зеленым от окружающих тканей.
Наружная мембрана Orientia tsutsugamushi толще внутренней, в отличие от риккетсий. У ориенций отсутствуют ЛПС и пептидо- гликан и их основные компоненты. Отсутствие пептидогликана определяет нестойкость и низкую механическую резистентность ориенций, а также их высокую устойчивость к пенициллину.
Антигенная структура. Ориенции имеют видоспецифический и не менее 3 типоспецифических антигенов. Протективный иммунитет формируется преимущественно к типоспецифическому антигену, он нестойкий и непродолжительный, вследствие чего могут быть повторные заболевания. Ориенции не имеют антигенных связей с риккетсиями групп СТ и КПЛ. Имеются общие антиген- ные детерминанты с Proteus mirabilis OXK, выявляемые в реакции Вейля-Феликса.
Патогенез и клиническая картина. Orientia tsutsugamushi передается человеку в результате присасывания личинок краснотелковых клещей (Trombididae) и вызывает лихорадку цуцугамуши (другие
названия: тропический тиф, тиф джунглей, кустарниковый тиф) - острую инфекцию, характеризующуюся наличием лихорадки, первичного аффекта, регионарного лимфаденита, лимфаденопатии и макулопапулезной сыпи. Лихорадка цуцугамуши - природноочаговая инфекция, распространенная преимущественно в экваториальном, субэкваториальном и субтропическом климатическом поясах с высокой влажностью. Эндемична для стран ЮгоВосточной Азии и юго-восточной части Тихого океана. В России малоактивные очаги находятся на юге Приморского края, Сахалине и примыкающих к Японии островах. Естественными хранителями возбудителя являются краснотелковые клещи родов Leptotrombidium и Neotrombicula, личиночная стадия которых является кровососущей и нападает на людей. Летальность варьирует от 1 до 30% в разных регионах.
Микробиологическая диагностика. При постановке диагноза учитывают очаговость, эпидемиологический анамнез, наличие таких клинических проявлений, как первичный аффект, регионарный лимфаденит или лимфаденопатия, обильная розеолезно- папулезная сыпь и результаты серологических исследований. В случае необходимости проводят выделение возбудителя в биопробах из крови больных или личинок краснотелковых клещей. Для культивирования используют белых мышей, куриные эмбрионы, культуры клеток (лимфобласты, фибробласты, эпителиальные клетки почек).
Специфическая серологическая диагностика затруднительна в связи со сложной антигенной структурой и необходимостью ис- пользования антигенов из всех основных антигенных типов возбудителя. Проводят РСК, РНИФ и ИФА с определением титров антител в динамике инфекционного процесса с использованием антигенов, приготовленных из различных типов возбудителя.
Для лечения лихорадки цуцугамуши применяют антибиотики тетрациклинового ряда.
16.9.2. Возбудители анаплазмозов человека (семейство Anaplasmataceae)
Таксономия. Семейство Anaplasmataceae включает 4 рода - Anaplasma, Ehrlichia, Neorickettsia, Wolbachia. Родовое название Ehrlichia (эрлихии) предложено в честь немецкого микробиолога П. Эрлиха.
Наиболее тесные связи отмечены с родами Rickettsia и Orientia. Представители семейства Anaplasmataceae являются облигатными внутриклеточными α2-протеобактериями, размножающи-
мися в специализированных вакуолях эукариотических клеток и имеющими общие генетические, биологические и экологические характеристики. В патологии человека основное значение имеют Anaplasma phagocytophila - возбудитель гранулоцитарного анаплазмоза человека (ГАЧ) и Ehrlichia chaffeensis - возбудитель моноцитарного эрлихиоза человека (МЭЧ), меньшее - Neorickettsia sennetsu и E. ewingii.
Морфология и тинкториальные свойства. Эрлихии и анаплазмы - грамотрицательные, коккобациллярные бактерии небольшого размера (длина от 0,5 до 1,5 ммкм). Морфологически представляют плеоморфные кокковидные или овоидной формы микроорганизмы, приобретающие темно-голубой или пурпурный цвет при окраске по Романовскому. Их выявляют в специализированных вакуолях - фагосомах в цитоплазме инфицированных эукариотических клеток в виде компактных скоплений - морул, названных так за внешнее сходство с ягодами тутового дерева (рис. 16.11, 16.12).
Рис. 16.11. E. canis в культуре клеток ДН82: а - морулы содержат ретикулярные клетки (RC), плотные клетки (DC), б - выход DC из морулы (электронограмма В.Л. Попова, 1996)
Рис. 16.12. E. chaffeensis в культуре клеток vero (электронограмма В.Л. Попова, 1996)
Четко выделяются две различные морфологические формы эрлихий (аналогично хламидиям): большего размера ретикулярные клетки, характеризующие стадию вегетативного развития, и элементарные клетки меньшего размера, характеризующие стационарную стадию покоя.
Микроэкология возбудителя, круг хозяев и естественного обитания
Эрлихии и анаплазмы являются облигатными внутриклеточными паразитами, поражающими мезодермальные клетки млеко- питающих, прежде всего клетки крови и эндотелия сосудов. Их резервуаром являются различные виды теплокровных животных, а переносчиками возбудителей - иксодовые клещи, которые при питании кровью передают микроорганизмы своим хозяевам. По спектру поражаемых клеток человека различают возбудителей МЭЧ (поражают преимущественно моноциты периферической крови) и ГАЧ (поражают преимущественно гранулоциты, в основном нейтрофилы).
Физиология. Анаплазмы и эрлихии являются медленно растущими микроорганизмами, размножаются поперечным бинарным делением, с наличием вегетативных (ретикулярных) и покоящихся (элементарных) клеток, аналогично хламидиям. Представители родов Anaplasma, Ehrlichia, Neorickettsia и Wolbachia являются облигатными внутриклеточными протеобактериями, размножающимися в специализированных вакуолях (фагосомах или эндосомах) эукариотических клеток, обозначаемых как морулы. Возбудитель МЭЧ размножается в моноцитах и макрофагах, возбудитель ГАЧ - в гранулоцитах (нейтрофилах).
Антигенная структура. Показана перекрестная реактивность белков теплового шока HSP60 у риккетсий и анаплазм. У пред-
ставителей семейства Anaplasmataceae имеются общие антигенные детерминанты, обусловливающие наибольшую перекрестную ре- активность внутри геногрупп.
Факторы патогенности. У представителей семейства выявлены поверхностные белки, выполняющие функции адгезинов. Они взаимодействуют с лектинсодержащими Сd15-ассоциированными (для возбудителя ГАЧ) рецепторами клеток хозяина. Доказано наличие факторов, препятствующих фагосомно-лизосомальному слиянию и обеспечивающих возможность внутрифагосомного цикла развития. Anaplasma phagocytophila обладает механизмом задержки спонтанного апоптоза нейтрофилов, что способствует их размножению в них.
Патогенез и клиническая картина. Патогенез ГАЧ и МЭЧ в начальной стадии обусловлен процессом внедрения возбудителя через кожу и реализуется с участием клеща-переносчика. Первичный аффект на месте внедрения отсутствует. Возбудитель распространяется лимфогенно и далее гематогенно. Заражение чувствительных клеток-мишеней происходит в три стадии: проникновение в клетку (инициация фагоцитоза), размножение в ограниченных мембраной цитоплазматических вакуолях (фагосомах), выход из клетки. Инфекционный процесс при МЭГ сопровождается поражением макрофагов селезенки, печени, лимфатических узлов, костного мозга и других органов. При тяжелых поражениях развивается геморрагический синдром с кровоизлияниями внутренних органов, желудочно-кишечными кровотечениями, геморрагическими высыпаниями на кожных покровах.
Патогенез и патологическая анатомия ГАЧ изучены недостаточно.
Клиническая картина напоминает ОРВИ. Сыпь выявляют не более чем у 10% больных ГАЧ. У больных ГАЧ лихорадка и другие клинические проявления быстро проходят при лечении тетрациклинами, без антибиотикотерапии длительность заболевания может составлять до 2 мес.
Микробиологическая диагностика. Серологическая диагностика в настоящее время - наиболее распространенный подход для подтверждения диагноза ГАЧ и МЭЧ. Методы включают РНИФ, ИФА, иммуноблоттинг, основанный на рекомбинантных белках (ИФА/иммуноблоттинг). Эти методы высокочувствительны и достаточно специфичны. Сероконверсия - лучший метод подтверждения на 1-й (25% больных) - 2-й (75%) неделях заболевания.
Микроскопически исследуют тонкие мазки периферической крови на наличие скоплений небольших бактерий (морулы) внутри нейтрофилов. ПЦР позволяет выявлять E. phagocytophila в крови в острую фазу до применения антибиотиков. Можно также использовать выделение на культуре клеток HL-60.
Профилактика и лечение. Для лечения эффективен доксициклин 100 мг 2 раза в день в течение 10-21 дня. Как при других клещевых инфекциях, при ГАЧ и МЭЧ применяют меры неспецифической профилактики и противоклещевые мероприятия.
Род Neorickettsia
В состав рода включены 5 видов, из которых только Neorickettsia sennetsu вызывает заболевание у людей - лихорадку сеннетсу.
Лихорадка сеннетсу встречается на южных островах Японии. Возбудитель - Neorickettsia sennetsu был выделен из крови, лимфатических узлов и костного мозга больных. Его можно культивировать на культурах макрофагальных и эпителиальных клеток, в организме белых мышей при внутрибрюшинном заражении (накопление в перитонеальных макрофагах, селезенке). По морфологии неориккетсии, как и другие представители семейства Anaplasmataceae, представляют мелкие кокковидные или овоидные микроорганизмы, имеющие темно-голубой или пурпурный цвет при окраске по Романовскому-Гимзе. Их выявляют в вакуолях (эндосомах) клеток моноцитарного ряда в виде компактных скоплений (морулы).
Заболевания лихорадкой сеннетсу связаны с употреблением в пищу термически не обработанной рыбы. Предполагается зараже- ние человека и собак через метацеркарии трематод лососевых рыб. Попадание N. sennetsu через рот с входными воротами инфекции в области рта и глотки приводит к увеличению заднешейных и заднеушных лимфатических узлов на 5-7-й день болезни с последующей генерализацией инфекционного процесса с поражением костного мозга, лейкопенией и лимфаденопатией.
Для лихорадки сеннетсу наиболее характерны лихорадка, генерализованная лимфаденопатия, повышенное количество моноцитов в крови. Отмечают гепатоспленомегалию и увеличение активности печеночных ферментов - аспартатаминотрансферазы и аланинаминотрансферазы. Окончательный диагноз определяют с учетом клинических и эпидемиологических данных с исследованием сывороток крови больных и реконвалесцентов в РНИФ с
корпускулярным антигеном. Лечение проводят препаратами тетрациклинового ряда, прогноз благоприятный.
16.10. Хламидии (семейство Chlamydiaceae)
Хламидии - мелкие грамотрицательные кокковидные облигатно-паразитические бактерии, относящиеся к порядку Chlamydiales, семейству Chlamydiaceae. В настоящее время в это семейство входят два рода, которые различаются по антигенной структуре, внутриклеточным включениям и чувствительности к сульфонамидам: Chlamydia (C. trachomatis); Chlamydophila (C. pneumonia, С. рsittaci).
Название «хламидия» (от греч. chlamys - мантия) отражает наличие оболочки вокруг микробных частиц.
Все виды хламидий обладают общими морфологическими особенностями, общим групповым антигеном, разобщенным циклом размножения. Хламидии рассматриваются как грамотрицательные бактерии, которые потеряли способность синтезировать АТФ. Поэтому они являются облигатными внутриклеточными энергетическими паразитами.
C. trachomatis и C. pneumoniae отнесены к безусловно патоген- ным для человека микроорганизмам и являются возбудителями антропогенных хламидиозов. В зависимости от вида возбудителя и входных ворот (дыхательные пути, мочеполовая система) выделяют респираторные и урогенитальные хламидиозы.
Описано более 20 нозологических форм, вызванных C. trachomatis, среди них трахома, конъюнктивит, паховый лимфогранулематоз, синдром Рейтера, урогенитальные хламидиозы. Вызываемые C. trachomatis инфекции, по оценкам ВОЗ, занимают второе место среди заболеваний, передаваемых половым путем, после трихомонадных инфекций. Ежегодно во всем мире регистрируется около 50 млн заболевших.
Chlamydophila pneumonia вызывает тяжелую пневмонию, заболевание верхних дыхательных путей. Высказываются предположения об участии Chlamydophila pneumonia в развитии атеросклероза и бронхиальной астмы.
Chlamydophila psittaci является причиной орнитоза (пситтакоза) - зоонозного заболевания.
Морфологические и тинкториальные свойства. Хламидии - мелкие грамотрицательные бактерии шаровидной или овоидной формы. Не
образуют спор, не имеют жгутиков и капсулы. Основным методом выявления хламидий является окраска по Романовскому-Гимзе. Цвет окраски зависит от стадии жизненного цикла: элементарные тельца окашиваются в пурпурный цвет на фоне голубой цитоплазмы клетки, ретикулярные тельца окрашиваются в голубой цвет.
Строение клеточной стенки напоминает таковую грамотрицательных бактерий, хотя имеются отличия. Она не содержит типичного пептидогликана: в его составе полностью отсутствует N-ацетилмурамовая кислота. В состав клеточной стенки входит двойная наружная мембрана, которая включает в себя ЛПС и белки. Несмотря на отсутствие пептидогликана, клеточная стенка хламидий обладает ригидностью. Цитоплазма клетки ограничена внутренней цитоплазматической мембраной.
Анализ наружной мембраны (НМ) хламидий показал, что в ее состав входят ЛПС, основной белок наружной мембраны (МОМР), а также богатые цистеином белки Omp2 и Omp3, связанные с внутренней поверхностью НМ. ЛПС и МОМР C. psittaci и C. trachomatis, в отличие от МОМР C. pneumoniae, локализуются на наружной поверхности клетки. Здесь же располагаются белки Pomp C. psittaci и C. pneumoniae с молекулярной массой 90-100 кД.
Хламидии полиморфны, что связано с особенностями их репродукции. Уникальный (двухфазный) цикл развития хламидий характеризуется чередованием двух различных форм существования - инфекционной формы (элементарные тельца - ЭТ) и вегетативной формы (ретикулярные, или инициальные, тельца - РТ).
Микроорганизмы содержат РНК и ДНК. В РТ РНК в 4 раза больше, чем ДНК. В ЭТ их содержание эквивалентно.
РТ могут быть овальной, полулунной формы, в виде биполярных палочек и коккобацилл, размером 300-1000 нм. РТ не обладают инфекционными свойствами и, подвергаясь делению, обеспечивают репродукцию хламидий.
ЭТ овальной формы, размером 250-500 нм, обладают инфекционными свойствами, способны проникать в чувствительную клетку, где и происходит цикл развития. Они обладают плотной наружной мембраной, что делает их устойчивыми во внеклеточной среде.
Цикл развития хламидий продолжается 40-72 ч и включает две различные по морфологическим и биологическим свойствам формы существования.
На первом этапе инфекционного процесса происходит адсорбция ЭТ хламидий на плазмолемме чувствительной клетки хозяина при участии электростатических сил. Внедрение хламидий в клетку происходит путем эндоцитоза. Участки плазмолеммы с адсорбированными на них ЭТ инвагинируются в цитоплазму с образованием фагоцитарных вакуолей. Этот этап длится 7-10 ч.
Далее в течение 6-8 ч происходит реорганизация инфекционных ЭТ в метаболически активные неинфекционные, вегетативные, внутриклеточные формы - РТ, которые многократно делятся. Эти внутриклеточные формы, представляющие собой микроколонии, называются хламидийными включениями. В течение 18-24 ч развития они локализованы в цитоплазматическом пузырьке, образованном из мембраны клетки хозяина. Во включении может содержаться от 100 до 500 РТ хламидий.
На следующем этапе в течение 36-42 ч происходят созревание (образование промежуточных телец) и трансформация РТ путем деления в ЭТ. Разрушая инфицированную клетку, ЭТ выходят из нее. Находящиеся внеклеточно, ЭТ через 48-72 ч проникают в новые клетки хозяина, и начинается новый цикл развития хламидий.
Помимо такого репродуктивного цикла, в неблагоприятных условиях реализуются и другие механизмы взаимодействия хла- мидий с клеткой хозяина. Это деструкция хламидий в фагосомах, L-подобная трансформация и персистенция.
Трансформированные и персистирующие формы хламидий способны реверсировать в исходные (ретикулярные) формы с последующим преобразованием в ЭТ.
Вне клеток хозяина метаболические функции сведены к минимуму.
Культивирование хламидий. Хламидии, являясь облигатными паразитами, на искусственных питательных средах не размножаются, их можно культивировать только в живых клетках. Они являются энергетическими паразитами, так как не способны самостоятельно аккумулировать энергию и используют АТФ клетки-хозяина. Культивируют хламидии в культуре клеток HeLa, МсСоу, в желточных мешках куриных эмбрионов, организме чувствительных животных при температуре 35 ?С.
Факторы патогенности. Адгезивные свойства хламидий обусловлены белками наружной мембраны клеток, которые обладают также антифагоцитарными свойствами.
Кроме того, микробные клетки имеют эндотоксины и продуцируют экзотоксины. Эндотоксины представлены ЛПС, во многом аналогичными ЛПС грамотрицательных бактерий. Термолабильные субстанции составляют экзотоксины, они присутствуют у всех видов и вызывают гибель мышей после внутривенного введения.
У хламидий обнаружено наличие секреторной системы III типа, через которую происходит инъекция хламидийных белков в цито- золь клетки хозяина, как составной элемент инфекционного процесса.
Белок теплового шока (HSP) обладает свойствами вызывать аутоиммунные реакции.
Антигенная структура. Хламидии имеют антигены трех типов: ро- доспецифический антиген (общий у всех видов хламидий) - ЛПС; видоспецифический антиген (различный у всех видов хламидий) - белковой природы, расположенный в наружной мембране; типоспецифический (различный у сероваров C. trachomatis) - ЛПС, находящийся в клеточной стенке микроорганизма; вариантоспецифический антиген белковой природы.
По своей антигенной структуре вид C. trachomatis делится на 18 сероваров. Серовары А, В1, В2 и С называются глазными, так как они вызывают трахому, серовары D, Е, К, О, Н, I, J, К (генитальные) являются возбудителями урогенитального хламидиоза и его экстрагенитальных осложнений, серовары L1, L2, L2a, L3 - возбудители венерических лимфогрануломатозов.
Возбудитель респираторного хламидиоза C. pneumoniae имеет 4 серовара: TWAR, AR, RF, CWL. C. psittaci имеет 13 сероваров.
Экология и резистентность. Хламидии - весьма распространенные микроорганизмы. Они выявлены более чем у 200 видов животных, рыб, амфибий, моллюсков, членистоногих. Сходные по морфологии микроорганизмы обнаружены и у высших растений. Главные хозяева хламидий - человек, птицы и млекопитающие.
Возбудитель хламидиозов неустойчив во внешней среде, весьма чувствителен к действию высокой температуры и быстро погибает при высушивании. Инактивация его при 50 ?С наступает через 30 мин, при 90 ?С - через 1 мин. При комнатной температуре (18-20 ?С) инфекционная активность возбудителя снижается через 5-7 сут. При 37 ?С наблюдается падение вирулентности на 80% за 6 ч пребывания в термостате. Низкая температура (-20 ?С) способствует длительному сохранению инфекционных свойств
возбудителя. Хламидии быстро погибают под воздействием УФоблучения, от контакта с этиловым эфиром и 70% этанолом, под действием 2% лизола за 10 мин, 2% хлорамина.
Клеточный тропизм. C. trachomatis имеет тропизм к слизистой оболочке эпителия урогенитального тракта, причем может оставаться локально на ней или распространяться по всей поверхности ткани. Возбудитель венерической лимфогранулемы имеет тропизм к лимфоидной ткани.
C. pneumoniae размножается в альвеолярных макрофагах, моноцитах и эндотелиальных клетках сосудов; возможно также системное распространение инфекции.
C. psittaci вызывают инфекцию в различных типах клеток, включая мононуклеарные фагоциты.
16.10.1. Возбудители трахомы, конъюнктивита, урогенитального хламидиоза и др. (C. trachomatis)
В настоящее время известно 14 сероваров биовара C. trachomatis, которые вызывают более 20 нозологических форм:
• серовары А, В, Ва, С вызывают трахому и конъюнктивит с внутриклеточными включениями;
• серовары D, G, Н, I, J, K вызывают урогенитальный хламидиоз, конъюнктивит, пневмонию новорожденных, синдром Рейтера;
• серовары L1, L2, L2a, L3 - вызывают венерическую лимфогранулему.
Трахома - хроническое инфекционное заболевание, характеризующееся поражением конъюнктивы и роговицы, приводящее, как правило, к слепоте. При трахоме (от греч. trachys - шероховатый, неровный) поверхность роговицы выглядит неровной, бугристой в результате гранулематозного воспаления.
Возбудитель трахомы C. trachomatis открыт в клетках роговицы в
Эпидемиология. Трахома - антропоноз, передающийся контактно-бытовым путем (через руки, одежду, полотенца). Восприимчивость высокая, особенно в детском возрасте. Выявляются се-
мейные очаги заболевания. Трахома - заболевание эндемического характера. Заболевание встречается в странах Азии, Африки, Центральной и Южной Америки с низким уровнем жизни и санитарной культуры населения.
Патогенез и клиническая картина. Возбудитель в форме элементарных телец проникает через слизистые оболочки глаз и размножается внутриклеточно. Развивается фолликулярный кератоконъюнктивит, который прогрессирует на протяжении многих лет и заканчивается образованием рубцовой соединительной ткани, что приводит к слепоте. Часто при этом активизируется условнопатогенная флора, в результате чего воспалительный процесс приобретает смешанный характер.
Иммунитет после перенесенного заболевания не вырабатывается.
Микробиологическая диагностика. Для диагностики трахомы исследуют соскобы с конъюнктивы. Препараты окрашивают по Романовскому-Гимзе, при этом в мазках обнаруживаются цитоплазматические включения фиолетового цвета с красным центром, расположенные около ядра, - тельца Провацека- Хальберштедтера.
Для обнаружения антигена проводят РИФ и ИФА.
Возможно выделение возбудителя в культуре клеток in vitro. Для этой цели используют культуры клеток McCoy, HeLa-229, Л-929 и др.
Лечение. Применяют антибиотики группы тетрациклина, ин- терферон, индукторы интерферона и иммуномодуляторы.
Профилактика. Специфическая профилактика не разработана. Важны соблюдение мер личной гигиены и повышение санитарногигиенической культуры населения.
Урогенитальный хламидиоз (негонококковый уретрит) - острое или хроническое заболевание, передающееся половым путем, поражающее мочеполовую систему, характеризующееся малосимптомным течением с последующим развитием бесплодия.
С. trachomatis, серовары D-K, кроме патологии урогенитального тракта, способны вызывать поражения глаз (конъюнктивит с включениями), а также синдром Рейтера (триада уретрит- конъюнктивит-артрит).
Эпидемиология. Урогенитальный хламидиоз - антропонозная инфекция, источник заражения - больной человек. Путь заражения контактный, преимущественно половой. Возможны контактно-
бытовой путь (в таких случаях развивается семейный хламидиоз), а также заражение при попадании на слизистую оболочку глаз при купании (конъюнктивит бассейнов).
Заболевание встречается очень часто (до 40-50% всех воспалительных заболеваний мочеполовой системы вызываются хлами- диями), но может оставаться нераспознанным (в 70-80% случаев инфекция протекает бессимптомно).
Патогенез и клиническая картина. С. trachomatis поражает эпителий слизистой оболочки урогенитального тракта. У мужчин первично инфицируется уретра, у женщин - шейка матки. При этом могут отмечаться незначительный зуд, слизисто-гнойные выделения. В дальнейшем наблюдается восходящая инфекция. В результате воспалительных процессов развивается мужское и женское бесплодие.
Хламидиозы протекают в виде микст-инфекции, в ассоциации с гонококками и другими патогенными и условно-патогенными возбудителями. Инфицирование беременной представляет опасность как для матери, так и для плода: преждевременные роды, послеродовые осложнения, у новорожденных может наблюдаться конъюнктивит, менингоэнцефалит, сепсис, пневмонии. Возможно заражение при прохождении ребенка через родовой канал инфи- цированной матери.
Наряду с поражением отдельных органов для хламидиозов характерны также проявления системного типа (синдром Рейтера). Он характеризуется поражением мочеполовых органов (простатит), заболеванием глаз (конъюнктивит) и суставов (артрит). Болезнь протекает с ремиссиями и повторными атаками. Развитие заболевания связано с хламидийными антигенами, которые провоцируют иммунопатологические процессы у генетически предрас- положенных лиц (70% заболевших имеют антиген гистосовместимости HLA B27).
Иммунитет после перенесенной инфекции не формируется. В крови инфицированных людей обнаруживаются специфические антитела, которые не имеют защитной функции.
Микробиологическая диагностика. Материалом для исследования служат соскобы с эпителия уретры, цервикального канала, конъюнктивы. Возможен микроскопический метод исследования - препараты окрашивают по Романовскому-Гимзе и по Граму. С помощью РИФ и ИФА определяют антигены хламидий в
исследуемом материале. Комплексное определение иммуноглобулинов классов М, G, А в РНГА, РИФ и ИФА является наиболее достоверным методом и позволяет определить стадию развития за- болевания. Применяются ПЦР и метод ДНК-гибридизации.
При поражении урогенитального тракта используют культивирование возбудителя на культурах клеток.
Лечение. Применяют антибиотики тетрациклинового ряда, макролиды, фторхинолоны в течение длительного времени (14- 21 день), а также препараты интерферона, индукторов интерферона и иммуномодуляторов.
Профилактика. Специфическая профилактика не разработана. Важны меры неспецифической профилактики заболеваний, передающихся половым путем, своевременное выявление и санация больных урогенитальным хламидиозом.
Венерическая лимфогранулема - заболевание, характеризующееся поражением половых органов и регионарных лимфоузлов и симптомами генерализации инфекции. Заболевание вызывается С. trachomatis, серовары L1, L2, L2а, L3
Эпидемиология. Источник инфекции - больной человек. Путь заражения контактно-половой, значительно реже контактнобытовой. Инфекция эндемична в странах с жарким климатом - в Юго-Восточной Азии, Центральной и Южной Америке, единичные случаи встречаются повсеместно. Восприимчивость населения всеобщая.
Патогенез и клиническая картина. Входными воротами инфекции являются слизистые оболочки половых органов, где и размножаются хламидии. На половых органах появляются язвочки. Затем микробы проникают в регионарные (обычно паховые) лимфатические узлы. Воспаленные лимфоузлы вскрываются с образованием свищей с гнойным отделяемым. Через несколько месяцев появляются деструктивные изменения в окружающих тканях - проктиты, абсцессы прямой кишки.
Иммунитет. После перенесенного заболевания возникает стойкий иммунитет.
Микробиологическая диагностика. Материалом для исследования служат гной из бубонов, биоптат пораженных лимфоузлов. Проводят микроскопию мазков-отпечатков, выделяют возбудителя на культурах клеток и в куриных эмбрионах. Серологическим методом определяют антитела в реакции микроиммунофлюорес-
ценции. С помощью аллергической пробы устанавливают наличие ГЗТ к антигенам возбудителя (внутрикожная проба Фрея).
Лечение. Антибиотикотерапия с помощью препаратов тетраци- клинового ряда и макролидов.
Профилактика.Специфическая профилактика не разработана. Важны меры неспецифической профилактики инфекций, передающихся половым путем.
16.10.2. Возбудитель пневмонии (C. pneumoniae)
C. pneumoniae -
возбудитель респираторного хламидиоза, ха- рактеризующегося
пневмонией, бронхитом и общей интоксикацией. Микроб был впервые выделен
в
Эпидемиология. Человек - единственный источник инфекции. Механизм заражения воздушно-капельный. Восприимчивость людей к C. pneumoniae высокая. Заболевания чаще отмечаются в холодное время года и встречаются у лиц разного возраста. Возможно бессимптомное носительство.
Патогенез и клиническая картина. C. pneumoniae обладают выраженным тропизмом к эпителию дыхательных путей. Хламидии могут вызывать фарингит, ларингит, бронхит, а также тонзиллит, синуситы, отиты. Проявления респираторного хламидиоза разнообразны. Хламидийные пневмонии клинически мало отличаются от поражений легких, вызываемых микоплазмами, легионеллами, некоторыми вирусами.
Внедряясь в легочную ткань и размножаясь там, хламидии вызывают гибель клеток и тяжелое воспаление легких. Инфекция С. pneumoniae может проявляться как затяжное острое респираторное заболевание, сочетающееся с пневмонией, часто случайно выявляемой при рентгенологическом исследовании. Наблюдаются бессимптомные формы респираторного хламидиоза. Возможно реинфицирование. У пожилых людей, находящихся на стационар-
ном лечении, может развиваться хламидийная пневмония как внутрибольничная инфекция.
Наряду с симптомами поражения дыхательных путей при заражении С. pneumoniae описаны отдельные случаи внепульмональных проявлений: узловатая эритема, полирадикулоневрит, энцефалит.
Новое направление исследований инфекции С. pneumoniae возникло при установлении связи между наличием антител к хла- мидиям и частотой ишемической болезни сердца. У больных инфарктом миокарда IgA к хламидиям и иммунные комплексы с их участием обнаруживались в 2,9 раза чаще, чем у равноценных больных контрольной группы. Предполагается, что обменные нарушения, индуцируемые хламидийной инфекцией, способствуют накоплению в стенке сосуда триглицеридов, что является пусковым механизмом развития атеросклероза.
Иммунитет. После перенесенного заболевания иммунитет не формируется.
Микробиологическая диагностика. Основной метод диагностики серологический. Антитела в сыворотке крови можно обнаружить только спустя 3 нед от начала заболевания с помощью ИФА и РИФ. При первичной инфекции определяются IgM, при реинфи- цировании - IgG. Применяется ПЦР.
Возможно микроскопическое исследование мазков из мокроты, окрашенных по Романовскому-Гимзе. Бактериологическое исследование не проводится.
Лечение. Применяют антибиотики группы макролидов, фторхи- нолоны, препараты тетрациклинового ряда.
Профилактика. Специфическая профилактика не разработана.
16.10.3. Возбудитель орнитоза (С. psittaci)
С. psittaci вызывает антропозоонозные заболевания, развивающиеся в результате инфицирования человека при профессиональном, реже бытовом контакте с животными, птицами.
Орнитоз - заболевание, характеризующееся первичным поражением респираторных органов, а также нервной системы, паренхиматозных органов, с явлениями общей интоксикации.
Возбудитель был открыт в
попугаев, но и от других птиц, и заболевание получило название «орнитоз» (от лат. ornis - птица).
Эпидемиология. Источником инфекции являются дикие, домашние и декоративные птицы - инфицированные или бессимптомные носители. Возможно заражение и от эктопаразитов птиц и грызунов. От человека к человеку заболевание передается очень редко.
Механизм заражения респираторный, пути заражения воздушнопылевой и воздушно-капельный при вдыхании пыли, зараженной выделениями больных птиц.
Восприимчивость людей к орнитозу высокая. Заболевание носит профессиональный характер - чаще болеют люди, работающие на птицефермах, а также владельцы декоративных птиц.
Патогенез и клиническая картина. Входными воротами для возбудителя являются слизистые оболочки респираторного тракта. Возбудитель размножается в эпителии бронхиального дерева, в альвеолярном эпителии, а также в макрофагах. Развивается воспаление, происходит разрушение клеток, возникают бактериемия, токсинемия, аллергизация макроорганизма, поражение паренхиматозных органов. В клинической картине орнитоза симптомы поражения бронхов и легких имеют ведущее значение. Возникают осложнения со стороны сердечно-сосудистой (тромбофлебит, миокардит), центральной нервной систем и др. Возможна генерализованная форма хламидийной инфекции.
Иммунитет имеет нестерильный характер, преимущественно клеточный. Возможны повторные заболевания. Микроб способен персистировать в респираторных органах после клинического выздоровления. Длительно может сохраняться гиперчувствительность к антигенам возбудителя, которые выявляются при постановке внутрикожных проб.
Микробиологическая диагностика. Основной метод диагностики серологический. Определяют IgM с помощью РИФ и ИФА.
Выделение возбудителя из крови (первые дни заболевания) и мокроты применяется редко и возможно только в специализиро- ванных лабораториях.
Лечение. Применяют антибиотики тетрациклинового ряда и ма- кролиды.
Профилактика. Специфическая профилактика не разработана. Предупреждение заражения людей основывается на проведении
ветеринарно-санитарных и медико-санитарных мероприятий (своевременное выявление источников инфекции, дезинфекция поме- щений, автоматизация производства и т.д.).
16.11. Микоплазмы (семейство Mycoplasmataceae)
Микоплазмы - самые мелкие свободноживущие бактерии размером 0,3-0,8 мкм, не имеющие клеточной стенки и окруженные только цитоплазматической мембраной. В настоящее время микоплазмы относятся к классу Mollicutes, который подразделяется на 3 порядка, 4 семейства, 6 родов и около 100 видов. Наибольшее значение имеет подсемейство Mycoplasmataceae, которое включает 2 рода - род Mycoplasma и род Ureaplasma.
Болезни, вызываемые микоплазмами, называются микоплазмозами. В клинической практике выделяют микоплазмозы респираторные (M. pneumoniae - основной возбудитель респираторного микоплазмоза), урогенитальные (возбудители воспалительных заболеваний урогенитального тракта - M. hominis, M. genitalium, U. urealyticum). M. incognitos выделяется при генерализованном процессе, M. fermentas играет существенную роль в развитии клинических проявлений СПИДа. Микоплазмы являются мембранными паразитами, прикрепляясь к клетке хозяина, они могут длительное время размножаться и персистировать в макроорганизме, изменяя метаболизм инфицированных клеток. Длительное персистирование микоплазм в организме человека может проявиться процессами, инфекционная природа которых долгое время подвергалась сомнению (болезнь Крона, артриты, малигнизация и др.).
Морфологические и тинкториальные свойства. Микоплазмы - прокариотические микроорганизмы, имеющие лишь одну липопротеиновую мембрану, в которой содержатся стеролы. Поэтому микоплазмы требуют добавления в питательные среды в качестве фактора роста холестерола. Мембрана выполняет функции и клеточной стенки, и цитоплазматической мембраны. Отсутствие клеточной стенки определяет полиморфизм, осмотическую чувствительность, способность проходить через бактериальные фильтры, а также нечувствительность к лекарственным веществам, подавляю- щим синтез клеточной стенки (пенициллинам и др.).
Микоплазмы могут иметь палочковидную, кокковидную, нитевидную, а также ветвящуюся форму. По Граму окрашиваются отрицательно. Спор и капсул не образуют.
Культуральные свойства. Микоплазмы - факультативные анаэробы. Температурный оптимум 37 ?С. Очень требовательны к питательным средам, растут на сложных средах, содержащих дрожжевой экстракт, а также экстракты сердца и мозговой ткани, сыворотку, стеролы, углеводы и др. Микоплазмы растут медленно. На плотных средах через несколько дней образуют мелкие круглые колонии с приподнятым центром, напоминающие яичницуглазунью. Возможно культивирование на клеточных культурах и куриных эмбрионах. Рост ингибируется специфическими иммунными сыворотками.
Биохимическая активность у микоплазм низкая, некоторые виды способны ферментировать углеводы с образованием кислоты.
Факторы патогенности микоплазм весьма разнообразны. К ним относятся сложно устроенные полярные адгезиновые комплексы (белок Р1). Образование перекиси водорода и перекисных радикалов сопровождается повреждением мембраны клетки хозяина, что вызывает тесное слияние мембран при прикреплении микоплазм. При этом происходит подавление защитной функции мерцательного эпителия.
Выделение эндотоксина, гемолизинов, а также секреция ферментов (фосфолипаза, АТФаза, протеаза, нуклеаза) вызывают ло- кальные клеточные разрушения.
Также у микоплазм есть капсулоподобная оболочка, повышающая прочность микроба и придающая им иммуносупрессорную активность.
Антигенная структура. Антигенами являются мембранные белки, а также гликолипиды и полисахариды. По антигенной структуре микоплазмы разделяются на виды.
Экология и резистентность. Микоплазмы широко распространены в природе, могут находиться в почве, стоячей воде, паразитировать в организме животных и растений.
Устойчивость во внешней среде относительно невысока. Микоплазмы чувствительны к нагреванию, а также к воздействию анти- септиков и дезинфектантов в обычных концентрациях.
16.11.1. Возбудители респираторных микоплазмозов
М. pneumoniae, а также М. hominis - возбудители антропоноз- ной респираторной инфекции, при которой могут наблюдаться
поражения верхних дыхательных путей, а также глубоких отделов респираторного тракта. М. pneumoniae был открыт в
Эпидемиология. Источник инфекции - больные в остром периоде заболевания или носители, перенесшие острую или бессимптомную инфекцию. Путь передачи воздушно-капельный. Особенностями респираторного микоплазмоза являются относительно слабая контагиозность и высокая частота бессимптомных и легких форм инфекции.
Патогенез и клиническая картина. Возбудитель поражает клетки реснитчатого эпителия. Респираторный микоплазмоз может протекать по типу инфекции верхних дыхательных путей (фарингита, трахеобронхита) или по типу пневмонии. Адгезия микоплазм к эпителиальным клеткам приводит к инвагинации клеточных мембран и делает находящиеся в них микоплазмы недоступными воздействию антител, комплемента и других защитных факторов. Экзотоксин возбудителя оказывает токсическое действие на микроциркуляторное русло, нервную систему. Лихорадочный период длится до 4 нед, с умеренной интоксикацией, нередко больные переносят заболевание на ногах. Возможны гематогенная диссеминация в суставы, костный мозг, мозговые оболочки, а также развитие иммунопатологических процессов.
Иммунитет. После перенесенного заболевания формируется не- продолжительный иммунитет.
Микробиологическая диагностика. Материалом для исследования являются мазки из носоглотки, мокрота, лаважная жидкость, сыворотка. Возможно применение бактериологического метода. Для обнаружения антигенов М. pneumoniae используют прямую РИФ.
В качестве серологического метода исследуют парные сыворотки, взятые с интервалом 10-14 дней, в РНГА и ИФА. Диагностическим считается нарастание титра антител в 4 раза и более.
Диагноз может быть подтвержден с помощью молекулярногенетических методов - ПЦР, ДНК-гибридизации.
Лечение. Препаратами выбора в лечении микоплазменной инфекции являются макролиды, тетрациклины или фторхинолоны.
Профилактика. Специфическая профилактика не разработана. Важны меры неспецифической профилактики, общие для всех респираторных инфекций.
16.11.2. Возбудители урогенитальных микоплазмозов и уреаплазмоза
К возбудителям урогенитальных микоплазмозов относят Mycoplasma hominis, Ureaplasma urealyticum, Mycoplasma genitalium и Mycoplasma fermentans.
Эпидемиология. Источник инфекции - инфицированный человек. Микоплазмы, вызывающие урогенитальные заболевания, передаются половым путем. Возможны вертикальный путь передачи, а также инфицирование плода во время родов при прохождении через инфицированные родовые пути.
Патогенез и клиническая картина. Входными воротами инфекции является слизистая оболочка урогенитального тракта. Поражаются уретра, влагалище и другие органы мочеполовой системы.
Микоплазмы выявляются у 5-15% здоровых лиц. При воспалительных заболеваниях урогенитального тракта микоплазмы обна- руживаются в 60-90% случаев.
Иммунитет после перенесенной инфекции не формируется. Гу- моральные антитела, образующиеся в низких титрах, не являются протективными.
Микробиологическая диагностика. Материалом для исследования служат соскобы со слизистой оболочки уретры, влагалища, моча. Возможен бактериологический метод исследования. Принято считать, что микоплазмы причастны к развитию воспалительного процесса, если их титр в исследуемых пробах превышает 104 КОЕ/мл. Антигены микоплазм можно обнаружить в РИФ (прямой). Для определения антител в сыворотке крови используют серологический метод исследования - РПГА и ИФА. Также возможна постановка ПЦР.
Лечение. Применяются антибиотики - макролиды, тетрациклины, фторхинолоны.
Профилактика. Специфическая профилактика не разработана. Важны меры неспецифической профилактики.
Задания для самоподготовки (самоконтроля) к 16.1
А. Несмотря на сложную антигенную структуру N. gonorrhoeae, защитный иммунитет против гонореи не формируется. Назовите одну из причин этого явления.
Б. Из мочи больного пиелонефритом на кровяном агаре был выделен коагулазоотрицательный стафилококк, который не вы-
зывал гемолиз и был устойчив к антибиотику новобиоцину. Назовите возбудителя. В. Среди инфекций, вызванных S. pyogenes, защитный иммунитет формируется только после скарлатины. Объясните причину данного явления.
Задания для самоподготовки (самоконтроля) к 16.2
A. Среди нижеперечисленных родов семейства Enterobacteriaceae отметьте те, в которых имеются возбудители воспалительных заболеваний мочевого тракта:
1. Escherichia.
2. Klebsiella.
3. Proteus.
4. Salmonella.
Б. Отметьте факторы патогенности, которые принимают непосредственное участие в развитии воспалительной диареи:
1. Пили IV типа.
2. Энтеротоксин.
3. Эффекторые белки ТТСС.
4. Цитотоксин.
B. Среди перечисленных возбудителей острых кишечных инфекций отметьте те, которые не инвазируют кишечную стенку и вызывают развитие секреторной диареи:
1. Shigella.
2. V. cholerae.
3. ЭИКП.
4. ЭТКП.
Г. Среди перечисленных факторов патогенности возбудителей холеры отметьте те, которые не участвуют в развитии секреторной диареи:
1. Нейраминидаза.
2. Токсинкорегулируемые пили.
3. Энтеротоксин.
4. Гемагглютининпротеаза.
Д. Среди перечисленных представителей семейства Enterobacteriaceae отметьте те, которые могут передаваться трансмиссивно:
1. Klebsiella oxytoca.
2. Yersinia pestis.
3. Yersinia pseudotuberculosis.
4. Proteus vulgaris.
Е. Для диагностики брюшного тифа на 1-й нед заболевания материалом для исследования служит кровь больного, из которой выделяют возбудителя. На основании знаний о факторах патогенности S. typhi и механизме патогенеза брюшного тифа обоснуйте возможность выделения возбудителя из крови на 1-й нед заболевания.
Ж. В инфекционную больницу поступил больной с явлением гемолитического колита: частый жидкий стул с примесью крови до 10 раз в сутки. Также у него имелись клинические признаки уремического гемолитического синдрома. Посев испражнений на лактозосодержащие дифференциальные питательные среды не выявил роста лактозоотрицательных колоний. Назовите предполагаемого возбудителя. Ответ обоснуйте.
З. Одним из клинических признаков чумы является образование увеличенного в размерах очень болезненного лимфатического узла - бубона. Назовите факторы патогенности возбудителя чумы, обеспечивающие этот процесс. Ответ обоснуйте.
Задания для самоподготовки (самоконтроля) к 16.3
A. Отметьте возбудителей, которые передаются трансмиссивным путем:
1. B. melitensis.
2. B. quantana.
3. B. pertussis.
4. B. mallei.
Б. Отметьте возбудителей, которые невозможно непосредственно выделить от человека в чистую культуру на питательной среде:
2. B. abortus.
B. Отметьте возбудителей, для которых человек является источником инфекции:
2. B. abortus.
3. B. pertussis.
Г. Отметьте возбудителей, которые могут передаться человеку через молоко:
1. B. melitensis.
2. B. pertussis.
4. B. henselae.
Д. Важным фактором в патогенезе легионеллезов является:
1. Способность легионелл инвазировать капилляры легких, приводя к системной инфекции.
2. Способность легионелл благодаря цитолизину предотвращать образование фаголизосомы в альвеолярных макрофа- гах, вызывая незавершенный фагоцитоз.
3. Способность легионелл при помощи пилей прикрепляться к
легочной ткани.
4. Способность легионелл продуцировать экзотоксин. Е. Отметьте факторы патогенности P. aeruginosa:
1. Нейраминидаза.
2. Внеклеточная аденилатциклаза.
3. Пили IV типа.
4. Фосфолипаза.
Ж. Синегнойная палочка часто является возбудителем внутрибольничной пневмонии, сопровождающейся развитием ателектазов. Назовите факторы патогенности возбудителя, которые участвуют в их развитии.
Задания для самоподготовки (самоконтроля) к 16.4
А. Больной был прооперирован по поводу абсцесса кишечника. Из гнойного экссудата была выделена культура B. fragilis. Назовите факторы патогенности этого микроба, способствующие развитию этого процесса:
1. ЛПС.
2. Капсула.
3. Супероксиддисмутаза.
4. Пили.
Б. Отметьте патоодонтогенных возбудителей:
1. Porphyromonas gingivalis.
2. Leptotrichia buccalis.
3. Veillonella parvula.
4. Prevotella intermedia.
5. Tannerella forsythensis.
Задания для самоподготовки (самоконтроля) к 16.5, 16.6
A. Отметьте факторы патогенности возбудителя сибирской язвы:
1. Протективный антиген.
2. Отечный фактор.
3. Цитотоксин.
4. Лецитиназа.
5. Фосфатаза.
Б. Отметьте факторы патогенности листерий:
1. Фосфолипаза.
2. Металлопротеаза.
3. Лецитиназа.
4. Летальный токсин.
B. Студент во время купания в грязном пруду получил травму стопы с повреждением наружных покровов. Рану ушили, однако на следующие сутки вокруг хирургического шва появился отек. Кожа приобрела серо-синий цвет. Рана резко болезненна, края ее бледные, отечные, безжизненные, дно раны сухое. Окраска видимых в ране мышц напоминает вареное мясо. При надавливании на края раны из тканей выделяются пузырьки газа с неприятным сладковато-гнилостным запахом. Поставлен диагноз газовой гангрены. Назовите возбудителей газовой гангрены. Перечислите факторы, способствующие развитию газовой гангрены, назовите антисептик, которым необходимо промыть рану.
Г. При перекопке огорода мужчина 45 лет лопатой повредил себе ногу. С раной, загрязненной землей, он доставлен в стационар. В стационаре сделана операция и проведена экстренная профилактика столбняка. Назовите препараты, которыми целесообразно провести профилактику столбняка пациенту данного возраста.
Д. Через 10 ч после употребления в пищу консервированных огурцов домашнего приготовления у ребенка 7 лет появились рвота и диарея. На следующие сутки у ребенка появилась сухость во рту, он перестал четко видеть окружающие предметы. Появилась осиплость голоса, акт глотания стал затрудненным. С диагнозом ботулизма ребенок был госпитализирован в стационар. Назовите материал и метод проведения микробиологического исследования. Какое следует назначить лечение?
Е. Больному после оперативного вмешательства назначен курс антибиотикотерапии препаратом широкого спектра действия. Через 4 дня после окончания курса лечения у больного появились боли в брюшной полости, лихорадка, диарея. Назовите микроб, который мог вызвать осложнения. Какой метод исследования можно применить для подтверждения диагноза?
Ж. К факторам патогенности возбудителя сибирской язвы относят протективный антиген, отечный и летальный факторы. Каждый по себе эти факторы не оказывают токсического действия. Объясните причину.
З. Объясните причину опасности заболевания листериозом у беременных.
Задания для самоподготовки (самоконтроля) к 16.7
A. Заболевание дифтерией вызывают:
Б. Назовите биовары возбудителя дифтерии:
1. Gravis.
2. Xerosis.
3. Mitis.
4. Ovis.
B. Дифтерия относится к инфекциям:
1. Литическим.
2. Пиретическим.
3. Эндотоксическим.
4. Токсинемическим.
Г. Основной метод диагностики дифтерии:
1. Токсикологический.
2. Бактериологический.
3. Серологический.
4. Антитоксический.
Д. Для профилактики развития анафилактического шока противодифтерийную лошадиную сыворотку вводят:
1. По методу И. Мечникова.
2. По методу Р. Коха.
3. По методу А. Безредки.
4. По методу Г. Рамона.
Е. У гражданки М., 25 лет, при проведении медицинского обследования, необходимого для оформления на работу в детское дошкольное учреждение (ясли-сад), из материала со слизистой оболочки носоглотки выделена дифтерийная палочка, однако гражданка М. была принята на работу. Обоснуйте с микробиологических позиций допустимость принятия гражданки М. на работу.
Ж. Туберкулез вызывают:
З. Микобактерии относятся к бактериям:
1. Фототрофным бактериям.
2. Галофильным бактериям.
3. Анаэробным бактериям.
4. Кислотоустойчивым бактериям.
И. Для постановки пробы Манту применяют:
1. Лепромин.
2. Корд-фактор.
3. Альт-туберкулин.
4. Очищенный туберкулин.
К. Для специфической профилактики туберкулеза применяют:
1. АКДС.
2. ЖКСВ-Е.
3. БЦЖ.
4. БУБО-М.
Л. Что характерно для возбудителя лепры:
1. Растет на искусственных питательных средах.
2. Патогенен для кроликов.
3. Патогенен для морских свинок.
4. Кислотоустойчив.
М. Микобактериозы вызывают:
Н. У пациента 40 лет с подозрением на туберкулез при бактериологическом исследовании мокроты обнаружены кислотоустойчивые бактерии. Однако постановка ПЦР для выявления микобактерий, вызывающих туберкулез, дала отрицательный результат. Интерпретируйте полученные результаты исследования. Назовите метод диагностики, который позволит установить диагноз.
Задания для самоподготовки (самоконтроля) к 16.8
A. Больной сифилисом прошел курс лечения, после чего у него проведены анализ крови на обнаружение специфических антител с помощью реакции микропреципитации (МП) с кардиолипиновым диагностикумом и ИФА, в котором в качестве антигена использовался специфический белковый антиген. Результаты следующие: МП - отрицательный; ИФА - положительный. Оцените полученные результаты и эффективность проведенного лечения.
Б. Молодой человек доставлен в больницу с симптомами поражения печени и началом развития почечной недостаточности. До этого он отдыхал в селе, где купался в пруду недалеко от пастбища коров. Больному поставлен диагноз лептоспироза. На- зовите путь заражения больного лептоспирозом, лабораторные исследования, которые подтвердят диагноз, и мишень, которая поражается листериями в организме человека.
B. Клещевой иксодовый боррелиоз характеризуется развитием в организме аутоиммунных и иммунопатологических процессов. Назовите фактор патогенности возбудителей клещевого иксодового боррелиоза, который способствует их развитию.
Г. Больному с клинической картиной язвы желудка произведена гастроскопия со взятием биопсийного материала. Назовите экспресс-метод, позволяющий сделать предварительное заключение о наличии у больного H. pylori-инфекции.
Д. Отметьте свойства, характерные для C. jejini:
1. Рост в атмосфере 5% СО2.
2. Оксидазоположительный.
3. Расщепляет уреазу.
4. Продуцирует энтеротоксин.
5. Продуцирует фосфолипазу.
Задания для самоподготовки (самоконтроля) к 16.9
A. Назовите основные факторы патогенности риккетсий:
1. Микрокапсула.
2. Фосфолипаза А2.
3. Адгезины (OmpA, OmpB).
4. Экзотоксин.
Б. Назовите отличительные особенности риккетсий группы сыпного тифа:
1. Вызывают образование первичного комплекса.
2. Поражают капилляры мозга.
3. Отсутствие пептидогликана.
4. Существуют в вегетативных и покоящихся формах.
B. Назовите отличительные особенности ориенций:
1. Отсутствие пептидогликана.
2. Вызывают развитие первичного комплекса.
3. Передаются человеку через личинки краснотелковых клещей.
4. Передаются человеку через укусы иксодовых клещей. Г. Назовите основные особенности эрлихий:
1. Имеют вегетативные и покоящиеся формы.
2. Поражают лимфоциты.
3. Культивируются в курином эмбрионе.
4. Переносятся через иксодовых клещей.
Д. Какие положения характерны для возбудителя сыпного тифа?
1. Переносчики - вши.
2. Поражают эндотелий сосудов с развитием васкулитов.
3. Основной метод диагностики - серологический.
4. Источник инфекции - крысы.
Е. В инфекционную больницу поступил больной 75 лет с клинической картиной сыпного тифа. Педикулез отсутствовал. Из анамнеза известно, что в 40-годы больной перенес сыпной тиф. Больному поставлен диагноз: болезнь Брилла-Цинссера. Объясните патогенез этого заболевания. Назовите лабораторные тесты, позволяющие поставить диагноз.
Задания для самоподготовки (самоконтроля) к 16.10, 16.11
A. Отметьте возбудителей, вызывающие заболевание дыхательного тракта, при котором источником инфекции является человек:
Б. Отметьте возбудителей, которые вызывают заболевания урогенитального тракта:
4. U. urealiticum.
B. Отметьте возбудителей, для заболеваний вызываемых которыми источником инфекции являются птицы:
Г. C. neumoniae является возбудителем органов дыхательного тракта, способным вызвать пневмонию. Отметьте те характеристики, которые специфичны для этого возбудителя и вызываемого им заболевания:
1. Микроб обладает двухфазным циклом развития.
2. В состав цитоплазматической мембраны данного микроба входят стеролы.
3. Основным методом диагностики вызываемого заболевания является серологический.
4. Для специфической профилактики вызываемого заболева-
ния используют неживую вакцину. Д. При использовании серологического метода при скрининговом обследовании на урогенитальный хламидиоз важное значение имеет тип антигенного диагностикума. Назовите тип антигена, из которого будет приготовлен диагностикум, постановка серологического теста (ИФА) с которым исключит появление ложноположительных результатов. Ответ обоснуйте.