Иммунология : учебник. - Хаитов Р. М. - 2009. - 320 с. : ил.
|
|
|
|
ГЛАВА 9 ТОРМОЖЕНИЕ ИММУННОЙ СИСТЕМЫ
Для нормальной жизнедеятельности организма процессы торможения в иммунной системе так же необходимы, как и процессы её активации. Поясним на нескольких примерах: после уничтожения и выведения патогена из организма иммунный ответ естественным образом останавливается - развивается супрессия иммунного ответа, а иммунный ответ на собственные ткани организма предотвращает иммунологическая толерантность. Наконец, чрезвычайно важно торможение иммунной системы и при таких антропогенных вмешательствах, как трансплантация органов и тканей. Ключевые роли в торможении иммунной системы принадлежат двум механизмам: ингибирующим межклеточным взаимодействиям и апоптозу.
Ингибирующие рецепторы
Известно не менее 15 мембранных молекул, функционирующих как негативные корецепторы, т.е. способных модулировать (подавлять) активацию клетки, вызванную другими Рц. Ингибирующие Рц объединили в семейство молекул SIRP (Signal-Regulatory Proteins) надсемейства иммуноглобулинов.
• Тирозинсодержащие ингибирующие последовательности. Все Рц семейства SIRP в цитоплазматической их части содержат от 1 до 4 тирозинсодержащих аминокислотных ингибирующих последовательностей ITIM (Immunoreceptor Tyrosine-based Inhibitory Motif). Эти негативные корецепторы сопутствуют всем Рц для факторов роста, а также обнаружены при Рц для гормонов (например, инсулина), взаимодействующих внутри клетки с тирозинкиназами.
• Известны следующие ингибирующие рецепторы:
♦ PIR-B (Paired Immunoglobulin-like Receptor - парные Ig-подобные Рц B-лимфоцитов) на B-лимфоцитах и CTLA-4 на T-лимфоцитах связаны с ингибиторными фосфатазами SHP-1/2, которые блокируют активацию киназ семейства Tec и фосфолипазы PLCy.
♦ KIR (Killer cell Immunoglobulin-like Receptor - Ig-подобные Рц клеток-киллеров). Рц семейства KIR на ЦТЛ и NK распознают молекулы MHC-I и подавляют тот или иной тип цитотоксичности.
♦ FcyRIIB-1/2 на B-лимфоцитах и лейкоцитах миелоидного ряда распознают комплексы IgG с Аг и подавляют продукцию АТ и активацию лейкоцитов.
Апоптоз
Апоптоз (от греч. apoptosis - листопад) - программированная (регулируемая) гибель клеток путём деградации её компонентов (включая конденсацию хроматина и фрагментацию ДНК) с последующим фагоцитозом макрофагами. Необходимые для апоптоза гены («программа смерти») есть в каждой клетке, но их транскрипция начинается только при получении клеткой сигнала.
• Контроль апоптоза реализуется по двум путям:
♦ «Внешний» (рецепторный) путь запускает агонист рецептора смерти (например, Fas-лиганд - ФНОа). Опосредованная лигандом олигомеризация рецептора приводит к активации каспазы-8.
♦ «Внутренний» (митохондриальный) путь: большинство других проапоптозных стимулов инициирует активацию каспазы-9, что опосредует белок, именуемый фактором активации апоптозных протеаз, Apaf-1 (Apoptose protease activation factor 1). Эти стимулы действуют на митохондрии, из которых выделяется цитохром С.
• Апоптосома. Вместе с Apaf-1 и каспазой-9 цитохром С формирует комплекс активации (апоптосому).
• Эффекторные каспазы. Каспаза-8 и каспаза-9 активируют эффекторные каспазы (например, каспазу-3), которые участвуют в протеолизе и вызывают апоптоз.
• Иммунная система
♦ Апоптоз наблюдается при удалении аутореактивных клонов иммунокомпетентных клеток, регуляции численности пролиферирующих клеточных популяций, повреждении генома клеток.
♦ Аномально повышенная устойчивость (резистентность) клеток к апоптозу значима в патогенезе аутоиммунных нарушений и злокачественных новообразований вследствие подавления процесса гибели дефектных и мутантных клеток (например, при аутоиммунном лимфопролиферативном синдроме угнетён
апоптоз лимфоцитов вследствие мутации гена, кодирующего «рецептор смерти» - гликопротеин Fas).
♦ Аномально повышенная гибель клеток путём апоптоза сопровождает острые заболевания (инфекции, ишемические повреждения), а также ряд хронических патологий (нейродегенеративные заболевания, СПИД).
♦ В иммунной системе известны следующие Рц, связывание которых с лигандами индуцирует апоптоз в клетке-носителе Рц: - TNFR-1 (TNF Receptor-1) - Рц типа 1 для фактора некроза
опухоли и семейство родственных ему Рц TRAIL (TRAIL - TNF-Related Apoptosis-Inducing Ligand - родственный фактору некроза опухоли лиганд, индуцирующий апоптоз).
- CD95 - Рц Fas, лиганд которого - FasL - экспрессирован на дендритных клетках тимуса и индуцирует апоптоз при негативной селекции тимоцитов. Тот же лиганд присутствует на мембране ЦТЛ и NK и вызывает гибель клеток-мишеней.
- CD30 на тимоцитах или T-лимфоцитах, которые также участвуют в негативной селекции, связывая лиганд CD30L на эпителии и дендритных клетках мозговой зоны тимуса.
- Ядерный рецептор для глюкокортикоидных гормонов, индуцирующих апоптоз тимоцитов при позитивной селекции в тимусе и, вероятно, апоптоз активированных лимфоцитов в периферических тканях.
♦ Факторы транскрипции, образующиеся при активации лимфоцитов, - АP-1 (Activator Protein-1), NFAT (Nuclear Factor of Activated T-cells), NFkB (Nuclear Factor of κ-chain B-lymphocytes) - способствуют и экспрессии индуцирующих апоптоз Рц, что приводит к гибели лимфоцитов после выполнения ими своих функций. Этот феномен получил название «индуцированной активацией смерти клеток».
♦ Гены, продукты которых предотвращают апоптоз: Bcl-2, Bcl-x, Bcl-w, Mcl-1, ALG-3 и др. Транскрипция этих генов происходит при получении клеткой «сигнала на выживание». Для B-лимфоцитов таким сигналом является связывание BCR с Аг, для тимоцитов - удовлетворительное связывание TCR с MHC-I/II при позитивной селекции, для периферических T- лимфоцитов - непрерывное узнавание эндогенных пептидов в комплексе с MHC.
♦ Макрофаги и ДК сорбируют и поглощают апоптозные тельца с помощью интегринов, молекул CD36 и Рц для «мусора», а
затем разрушают их содержимое до мелких метаболитов. При этом ДК способны экспрессировать на мембране комплексы этих метаболитов с молекулами MHC-I и -II (это лежит в основе развития иммунного ответа на собственные повреждённые ткани и тканевые Аг чужеродных трансплантатов).
Супрессия иммунного ответа
• Супрессия иммунного ответа в норме развивается по мере элиминации причинного Аг из организма. Элиминация Аг означает устранение исходного причинного фактора активации лимфоцитов через TCR и BCR, в результате новые (неиммунные) лимфоциты становится «нечем» активировать. Супрессия лимфоцитов
♦ Терминально дифференцированные лимфоциты имеют ограниченное время жизни и погибают по механизму апоптоза, «отработав» свою программу. Это - феномен индуцированной активацией клеточной смерти. В таких лимфоцитах снижается экспрессия антиапоптозных генов, защищающих лимфоцит от апоптоза на время иммуногенеза, но экспрессируются индуцирующие апоптоз Рц, а именно: молекула Fas (CD95), Рц для глюкокортикоидных гормонов, Рц для TNFa. Следовательно, глюкокортикоидные гормоны, TNFa и FasL в определённое время от начала развития иммунного ответа становятся факторами физиологической иммуносупрессии.
♦ Механизмы торможения. Известно несколько конкретных механизмов торможения активности лимфоцитов.
о T-лимфоциты-регуляторы. В первую очередь это T-лимфоци- ты-регуляторы (Т.), т.е. CD4+ T-лимфоциты, продуцирующие значительные количества иммуносупрессорных цитокинов - ИЛ-10 и ТФРβ1.
о ИЛ-4 и ИЛ-13, продуцируемые тучными клетками, CD4/ CD8- T-лимфоцитами, а также дифференцированными Th2, ингибируют дифференцировку Th1 из Th0.
о ИФНу - продукт дифференцированных Th1 - ингибирует дифференцировку Th2 из Th0.
о АТ класса G (IgG), достигнув определённых концентраций в жидких средах организма, через специальный ингибирующий Рц FcyRIIB, экспрессированный на дифференцированных B-лимфоцитах, подавляют биосинтез иммуноглобулинов в данном лимфоците и его прогрессию в плазмоцит.
В клинической практике это явление используют для профилактики резус-конфликта: если резус-отрицательной женщине ввести антирезус-антитела до того, как эритроциты плода успеют попасть в кровь матери, то иммунный ответ матери на резус-антиген будет подавлен.
- Ингибирующие рецепторы
- На B-лимфоцитах есть ещё один ингибирующий Рц - CD22. Это димерная молекула, экспрессирующаяся только на зрелых B-лимфоцитах. - На T-лимфоцитах ингибирующими Рц являются CTLA-4 (лиганды B7.1 и B7.2) и на некоторых ЦТЛ - KIR-Рц (лиганды - молекулы MHC-I). На некоторых T-лимфоцитах выявляют FcγRIIB, несущий в цитоплазматическом участке ингибиторные ITIM-последовательности. - «Аутокиллеры». В нужное время созревают и в определённых местах в организме функционируют особые T-лимфоциты- киллеры с признаками NK, на которых экспрессировано много Fas-лиганда. Связывая Рц Fas на активированных T-лимфоцитах, эти «аутокиллеры» индуцируют апоптоз активированных T-лимфоцитов.
- Таких «аутокиллеров» много в печени. Вероятно, их природная роль - ликвидировать приносимые с кровью воротной вены лимфоциты, активированные в тканях кишки пищевыми Аг.
- Печень как иммуносупрессорный орган. В печени локализована большая часть всех NK организма, причём преобладает одна из двух больших субпопуляций NK, а именно CD56много/CD16-, тогда как в крови и красной пульпе селезёнки преобладают NK с фенотипом CD56мало/CD16+. На NK печени экспрессировано много Fas-лиганда, а на клетках эндотелия синусоидов печени - особого лектина, называемого галектин-1, который, возможно, также является индуктором апоптоза активированных лимфоцитов. Не исключено, это объясняет тот факт, что чужеродные трансплантаты печени не отторгаются. - T-супрессоры. Два типа лимфоцитов (если не все) в условиях внешней стимуляции системы начинают в какой-то момент времени в больших количествах продуцировать цитокины, ингибирующие пролиферацию или функциональную активность других клеток, участвующих в иммунном ответе.
В таком состоянии их можно называть T-супрессорами (хотя этот термин и считается устаревшим).
- Первый тип таких лимфоцитов - CD4+ Th3, продуцирующие много ТФРβ1.
- Второй тип «супрессоров» называют T-регуляторами типа 1 (Tr1) - это T-лимфоциты (вероятно, субпопуляция CD4+), развивающиеся в присутствии ИЛ-10 и продуцирующие его же в больших количествах. ИЛ-10 значительно снижает активность макрофагов, в том числе продукцию макрофагами ИЛ-12, без которого тормозится развитие CD4+ Th1 и, следовательно, развивается супрессия иммунного ответа Th1-типа.
• - Th1-лимфоциты могут убивать B-лимфоциты, активированные на тот же Аг через взаимодействие FasL-Fas. Супрессия лейкоцитов - исполнителей деструктивной фазы иммунного ответа - достигается теми же двумя путями, что и в случае лимфоцитов: апоптозом по мере «изношенности» и подавлением их активности при взаимодействии определённых Рц с определёнными лигандами.
♦ Самые короткоживущие лейкоциты - нейтрофилы. Они погибают физиологическим апоптозом через 4-12 ч после выхода из костного мозга в циркуляцию. В очагах воспаления в тканях нейтрофилы погибают ещё быстрее.
- Эозинофилы и базофилы погибают вскоре после дегрануляции.
- Другие клетки, особенно тканевые макрофаги, живут несколько дольше. Поэтому для них (по крайней мере, макрофагов и тучных клеток) предусмотрены биологические механизмы подавления активности. Но после активной деструктивной работы погибают и они, а их места занимают свежие одно- имённые клетки, пришедшие из костного мозга через кровь: в случае макрофагов - это моноциты, в случае тучных клеток - предшественники тучных клеток.
♦ Известны следующие факторы и механизмы подавления активности лейкоцитов.
- ИЛ-10, продуцируемый дифференцированными иммунными CD4+ Тr-лимфоцитами, ингибирует активность макрофагов. - ИЛ-4/STAT6 индуцирует в макрофагах биосинтез антагониста
Рц для ИЛ-1.
- Ингибирующие рецепторы. На тучных клетках выявлено по крайней мере 3 ингибирующих Рц. Один из них - gp49B1,
лиганд неизвестен (возможно MHC-I-подобные молекулы). Второй - уже известный по B-лимфоцитам FcγRIIB, лигандом для которого являются иммунные комплексы Аг с IgG. Третий - MAFA (Mast cell-Associated Function Antigen). Лиганд для MAFA неизвестен, но этот Рц конститутивно ассоциирован в мембране клетки с FcεRI - высокоаффинным активирующим Рц для IgE.
Иммунологическая толерантность
Иммунологическая толерантность - отсутствие активации лимфоцитов (и следовательно, продукции ими эффекторных молекул) при наличии в доступном им пространстве специфического Аг. В природе толерантность лимфоцитов (как отсутствие ответа на доступный Аг) нужна только по отношению к Аг собственных не- повреждённых тканей организма.
• Следует дифференцировать иммунологическую толерантность от супрессии уже состоявшегося иммунного ответа:
♦ супрессия: продуктивная активация клона начинается, реализуется, затем подавляется;
♦ толерантность: продуктивная активация Аг-специфичного клона лимфоцитов не начинается.
• Механизмы супрессии и толерантности одинаковы - апоптоз и подавление внутриклеточного метаболизма сигналами с ингибирующих Рц, но эти механизмы реализуются на разных этапах лимфопоэза и иммуногенеза лимфоцитов.
♦ Делеция клона. По механизму делеции клона, (т.е. путём апоптоза лимфоцитов, связавших Аг TCR/BCR) происходит элиминация аутореактивных B-лимфоцитов на ранних стадиях лимфопоэза и негативная селекция тимоцитов. Делеция же аутореактивных клонов на стадии лимфопоэза - установление центральной толерантности.
♦ Анергия клона. Анергией клона называют отсутствие полноразмерной активации лимфоцитов, связавших Аг TCR/BCR. Анергия, вероятно, имеет несколько разных механизмов реализации.
♦ Непродуктивная активация. Долгосрочное выживание лимфоцитов в периферических тканях обеспечивается частичной активацией, «тихой» базальной пролиферацией без продукции эффекторных молекул. Такая активация происходит, когда лимфоцит связывает комплексы собственных пептидов организма и молекул MHC.
♦ Продуктивная активация лимфоцита развивается, если он связывает комплексы чужих пептидов со «своими» MHC и получает корецепторные взаимодействия с активированной АПК. Сверхпороговый уровень экспрессии костимулирующих молекул достигается только в условиях их внешней стимуляции. Наиболее очевидным фактором такой внешней стимуляции АПК является доиммунное воспаление покровных тканей, повреждённых внедрившимся внешним патогеном (в естественных условиях - инфекционным). Таким образом, если организм чист изнутри, и ни травма, ни инфекция не инициирует доиммунного воспаления, то иммунологическая толерантность лимфоцитов (с любыми Рц) к своим тканям - единственно возможное состояние лимфоцитов.
Трансплантация
Трансплантацией называют пересадку тканей или органов, хирургически изъятых из одного организма (донора), во внутреннюю среду другого организма (реципиента). Если трансплантацию проводят между организмами одного вида, то это аллотрансплантация, а Аг тканей - аллоантигены, реакция иммунной системы - ответ на аллоантигены. Если же трансплантацию проводят между организмами разных видов, то это ксенотрансплантация.
Отторжение трансплантата
Трансплантация может быть успешной только при условии развития иммунологической толерантности организма реципиента к трансплантату (на практике это достигается путём медикаментозной иммунодепрессии - со всеми её побочными эффектами), в противном случае на тех или иных сроках после операции происходит отторжение трансплантата.
• Сверхострое отторжение происходит во время или вскоре после операции. При этом развивается окклюзия кровеносных сосудов, связывающих трансплантат с телом. Это случается, если организм реципиента уже был иммунизирован Аг донора или Аг, перекрёстно реагирующими с Аг донора, и у реципиента в крови есть достаточное количество АТ к тканевым Аг стенок сосудов или клеток крови донора. Эти АТ немедленно «садятся» на стенки сосудов трансплантата, активируют комплемент и систему коагуляции крови, что влечёт за собой быстрый тромбоз сосудов и
выключение органа из кровотока.
• Острое отторжение - нормальный первичный иммунный ответ на трансплантат при отсутствии медикаментозной иммуносупрессии. В деструкцию трансплантата могут быть вовлечены все известные эффекторные механизмы иммунного воспаления - антителозависимые (АЗКЦТ, активация комплемента иммунными комплексами и др.) и антителонезависимые (CD8+ ЦТЛ; Th1 → макрофаги/ГЗТ; Th2 → ИЛ-5 → эозинофилы).
• Отсроченное отторжение по механизмам аналогично острому, но в результате эффективной иммуносупрессии индукция иммунного ответа откладывается на несколько лет.
Главный комплекс гистосовместимости
Первоначально наличие MHC было постулировано в опытах по пересадке органов как некий значительный по размеру комплекс генов, от которых больше, чем от других генов, зависит скорость отторжения трансплантата.
• Законы трансплантации, которые в 1912 г. описал Георг Шёне в книге «Гетеропластическая и гомопластическая трансплантация», таковы:
♦ Аллогенные и ксеногенные трансплантаты всегда отторгаются;
♦ Аутологичные (донор и реципиент - один и тот же организм) и сингенные (Аг MHC донора и реципиента одинаковы) трансплантаты приживаются;
♦ Гибриды 1-го поколения - F1 (P1xP2) - не отторгают трансплантаты обеих родительских линий (P1, P2), но каждая из родительских линий отторгает трансплантат от гибрида (это свидетельствует о кодоминантности в гибридах экспрессии генов, кодирующих продукты, которые являются мишенью отторжения). Кодоминантность означает, что экспрессируются аллели обеих гомологичных хромосом (т.е. от каждого из родителей):
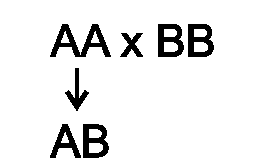 ♦
50% потомства от обратного скрещивания (F1xP1/2) быстро отторгают
трансплантат от второй родительской линии (в случае трансплантации
кожного лоскута быстрое отторжение наступает на 8-е сутки). Отсюда по
законам менделевской генетики сле-
♦
50% потомства от обратного скрещивания (F1xP1/2) быстро отторгают
трансплантат от второй родительской линии (в случае трансплантации
кожного лоскута быстрое отторжение наступает на 8-е сутки). Отсюда по
законам менделевской генетики сле-
дует, что быстрое отторжение контролирует один локус. Его-то и назвали главным комплексом гистосовместимости.
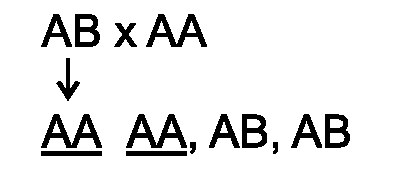 Подбор доноров и реципиентов. Отторжение
трансплантата осуществляют Tαβ-лимфоIrиты, хотя они и отобраны
позитивной селекцией в тимусе для распознавания Аг только в комплексе со
своими молекулами MHC, а на трансплантате экспрессированы чужие MHC. Дело в том, что 1-10% T-лимфоцитов ошибаются, принимая чужие молекулы MHC за свои (что называют перекрёстной реактивностью), и индуцируют продуктивный иммунный ответ.
Подбор доноров и реципиентов. Отторжение
трансплантата осуществляют Tαβ-лимфоIrиты, хотя они и отобраны
позитивной селекцией в тимусе для распознавания Аг только в комплексе со
своими молекулами MHC, а на трансплантате экспрессированы чужие MHC. Дело в том, что 1-10% T-лимфоцитов ошибаются, принимая чужие молекулы MHC за свои (что называют перекрёстной реактивностью), и индуцируют продуктивный иммунный ответ.
Методы подбора доноров и реципиентов по похожести их MHC либо несовершенны (если это серотипирование), либо более совершенные методы генотипирования показывают крайне низкую вероятность совпадения по MHC между неродственниками.
• Поликлональная активация. Активация T-лимфоцитов в этом случае поликлональна, так как MHC выступают здесь не в качестве «рамки» для Аг, а являются собственно объектом распознавания. Именно поэтому молекулы MHC были открыты как главные «виновники» отторжения трансплантата.
• Минорные Аг гистосовместимости. Существуют и так называемые минорные Аг гистосовместимости. Ими могут стать практические любые белки трансплантата, подвергнувшиеся катаболизму и представленные на мембране клеток в комплексе с молекулами MHC-I. Типирование по всем белкам организмов донора и реципиента
провести невозможно, поэтому даже при самом тщательном подборе донора и реципиента по MHC может встретиться такой минорный Аг (или несколько Аг), который вызовет отторжение трансплантата.
• Трансплантация костного мозга. Особым случаем является пересадка костного мозга или органов и тканей, содержащих много профессиональных АПК. На последних присутствуют все костимуляторные молекулы, необходимые и достаточные для продуктивной активации T-лимфоцитов. Поэтому в случаях пересадок кроветворных тканей отторжение MHC-совместимого трансплантата может произойти быстрее, чем MHC-несовместимого, потому что T-лимфоциты реципиента будут эффективнее работать с АПК донорского происхождения (как с «родными» по MHC).
Иммунологически привилегированные места
В организме есть такие анатомические места, в которых аккуратно вживлённый трансплантат при определённых условиях не отторгается. Эти места называют иммунологически привилегированными. У человека такими местами являются мозг, передняя камера глаза, беременная матка и яички.
Первоначальное предположение о том, что Аг этих тканей не покидают своих мест и недоступны для распознавания T-лимфоцитами, не подтвердилось: Аг тканей из привилегированных мест покидают их, но действительно не совсем так, как из всех остальных мест в организме. А именно: - они минуют классический лимфатический дренаж; - иммунологически привилегированные места отграничены особыми барьерами, клетки которых продуцируют иммуносупрессорные цитокины (ТФРβ) или экспрессируют много Fas-лиганда, убивающего приближающиеся активные лимфоциты.
С клинической точки зрения существенно, что именно ткани из иммунологически привилегированных мест чаще прочих становятся объектом аутоиммунного повреждения (например, демиелинизирующие заболевания мозга, включая рассеянный склероз; т.н. симпатическая офтальмия).
Иммунная система и глюкокортикостероиды
Не один десяток лет глюкокортикостероиды (ГКС) применяют в качестве противовоспалительных ЛС, причём при заболеваниях с очевидным вовлечением в патогенез иммунной системы (ревматические, аутоиммунные, аллергические болезни). ГКС облигатно вовлечены в лимфопоэз и иммуногенез.
Мишени глюкокортикостероидов
• Тимус. Источником ГКС, воздействующих на лимфоциты, являются не только надпочечниковые железы, ГКС синтезируют и эпителиальные клетки тимуса. Другими словами, в тимусе соз- даётся нужная локальная концентрация ГКС, необходимых для индукции апоптоза «95-99% тимоцитов, отсекаемых позитивной и негативной селекцией.
• Лимфоидная периферия. Главный эффект физиологических концентраций системных ГКС на лимфоциты в периферических тканях - тоже индукция апоптоза активированных лимфоцитов: ГКС являются исполнителями AICD-индуцированной активации клеточной смерти лимфоцитов (AICD - Activation-Induced Cell
Death).
Эффекты глюкокортикостероидов. В фармакологических концентрациях ГКС вызывают следующие эффекты:
• индуцируют в активированных лимфоцитах и эозинофилах эндонуклеазы, разрушающие ДНК в межнуклеосомных участках, что заканчивается апоптозом клеток;
• ингибируют биосинтез интерлейкинов 1, 3, 4, 5 и 8, TNFa, GM-CSF, что приводит к снижению воспалительных процессов, зависящих от этих цитокинов;
• ингибируют NO-синтазу; следовательно, снижают зависящую от оксида азота альтерацию тканей (включая стенку кровеносных сосудов);
• ингибируют фосфолипазу А2 и циклооксигеназу 2-го типа, которые необходимы для синтеза простагландинов и лейкотриенов; следовательно, угнетаются воспалительные процессы и спазмы гладкой мускулатуры, зависящие от этих липидных медиаторов;
• ингибируют экспрессию молекул межклеточной адгезии, что приводит к снижению экстравазации лейкоцитов в очаги воспаления.
Побочные эффекты. Наиболее очевидные побочные эффекты терапевтических доз глюкокортикоидов состоят в задержке в организме натрия (следовательно, и воды), увеличении массы тела, симптомах диабета, потере минеральных веществ из костей, истончении кожи (следовательно, ухудшении её барьерных свойств).