Гигиена с основами экологии человека : учебник - Архангельский В.И. и др.; под ред. П.И. Мельниченко. 2010. - 752 с.: ил.
|
|
|
|
ГЛАВА 5 РАДИАЦИОННАЯ ГИГИЕНА
Радиационная гигиена - это самостоятельная медицинская профилактическая наука, изучающая условия, виды и последствия воздействия источников ионизирующих излучений на организм и разрабатывающая меры радиационной безопасности и защиты окружающей среды, направленные на охрану здоровья человека.
Радиационная гигиена делится на радиационную гигиену труда, изучающую условия труда и разрабатывающую мероприятия по радиационной защите при работе на предприятиях и в учреждениях, в том числе медицинских, с источниками ионизирующих излучений, а также коммунальную радиационную гигиену, которая рассматривает все вопросы радиационной безопасности населения.
5.1. ОСНОВЫ ЯДЕРНОЙ ФИЗИКИ
Радиоактивность - это свойство ядер атомов определенных элементов самопроизвольно (т.е. без каких-либо внешних воздействий) превращаться в ядра атомов других элементов с испусканием при этом ионизирующих излучений. Превращение элементов в таких случаях называется радиоактивным распадом. Радиоактивные явления, встречающиеся у природных изотопов, называются естественной радиоактивностью, а происходящие в искусственно полученных изотопах химических элементов - искусственной радиоактивностью.
Для понимания явления радиоактивности необходимо вспомнить строение атома. Он состоит из положительно заряженного ядра и вращающихся вокруг него отрицательно зараженных электронов.
Ядро состоит из протонов и нейтронов, которые объединяются общим понятием - нуклоны. В нейтральном атоме число протонов в ядре равно числу электронов в оболочке. Нуклоны в ядре непрерывно обмениваются особыми частицами, которые называются π-мезонами, или квантами ядерного поля.
Атомный номер Z равен числу протонов в ядре, а следовательно, и заряду ядра. Атомы одного и того же химического элемента имеют
одинаковый атомный номер и массу. Масса нуклона примерно в 1840 раз больше массы электрона. В связи с незначительностью массы электрона его массу принято считать равной нулю, поэтому масса атома определяется массой ядра. Массовое число А равно числу нуклонов в ядре.
Массовое число атома указывается вверху слева от символа химического элемента. Атомный номер (заряд) элемента записывается внизу слева от символа элемента.
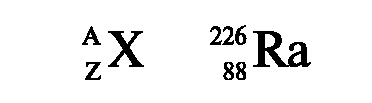 Атомы, ядра которых состоят из одинакового числа протонов, но различного числа нейтронов, называются изотопами (изо...+ гр. topos - место).
Атомы, ядра которых состоят из одинакового числа протонов, но различного числа нейтронов, называются изотопами (изо...+ гр. topos - место).
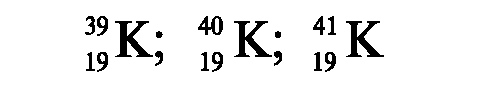 Различают несколько видов радиоактивных превращений ядер, сопровождающихся различными видами ионизирующих излучений.
Различают несколько видов радиоактивных превращений ядер, сопровождающихся различными видами ионизирующих излучений.
Альфа-распад. Характерен для ядер тяжелых элементов с малыми энергиями связи. В процессе внутриядерных превращений из ядра атома выбрасывается альфа-частица. Заряд ядра уменьшается на 2 единицы, а атомная масса - на 4 единицы.
Альфа-частица представляет собой ядро атома гелия. Ее атомная масса составляет 4 единицы. Заряд равен +2. При относительно крупных размерах и большом заряде частица обладает высокой энергией (3-10 Мэв), для нее характерны большая линейная передача энергии (ЛПЭ) и значительная линейная плотность ионизации (ЛПИ).
Размер, заряд и энергия альфа-частицы обусловливают ее многочисленные столкновения с атомами вещества. При увеличении плотности и атомной массы вещества повышается ЛПЭ. Одновременно увеличивается сила торможения частиц и повышается ЛПИ. Она максимальна в конце пути пробега частицы. Естественно, обладая большой массой, зарядом и энергией, альфа-частица не может иметь значительной проникающей способности, так как быстро тормозится веществом.
Так, в зависимости от энергии, пробег альфа-частиц в разных средах невелик: в воздухе он составляет 2-10 см, в алюминии - 15-70 мкм, в воде и биологических тканях - 30-130 мкм, т.е. в коже альфа-частицы
задерживаются эпидермисом, не достигая глубоких слоев эпителия. Обыкновенный лист бумаги является для них абсолютным экраном. Поэтому внешнее воздействие альфа-излучения на человека практически безопасно. Однако поступление альфа-частиц внутрь организма, например с пищей и, особенно, с воздухом в виде радона - крайне опасно, поскольку значительно повышается риск канцерогенного действия. Альфа-частицы в таких условиях легко проникают через слизистые оболочки и создают внутри тканей и органов высокую плотность ионизации, чем и обусловлен выраженный патогенный эффект.
Электронный бета-распад характерен для превращений естественных и искусственных радионуклидов. При данной схеме распада бета-излучение - это поток электронов. Электронный бета-распад возникает в тех случаях, когда в ядре неустойчивость вызвана превышением количества нейтронов над числом протонов. При этом в ядре появляется электрон, а один из нейтронов превращается в протон. Электрон выбрасывается из ядра, заряд ядра увеличивается на единицу, а массовое число остается без изменения.
Бета-излучение одного и того же элемента содержит электроны различной энергии - от самой малой до некоторой максимальной величины. Поэтому спектр излучения непрерывный или сплошной. Установлено, что вместе с бета-частицей из ядра выбрасываются нейтральные частицы ничтожно малой массы, составляющие с электронами некую постоянную величину. Эти частицы носят название антинейтрино. Возвращение возбужденного ядра в основное состояние сопровождается испусканием гамма-квантов.
Позитронный fi-распад наблюдается у некоторых искусственных радионуклидов. Позитрон - это элементарная частица, подобная электрону, но обладающая положительным зарядом. При выбросе позитрона один из протонов в ядре превращается в нейтрон. Вместе с позитронами выбрасываются нейтрино, которые вместе с позитроном составляют некоторую постоянную величину энергии. Спектр излучения, как и при электронном распаде, сплошной.
Позитронный бета-распад также сопровождается гамма-излучением. Удельная плотность ионизации для бета-частиц - в несколько сотен раз меньше, чем у альфа-частиц. При этом за счет меньшей массы, заряда и энергии у бета-частиц в 100 и более раз увеличивается длина пробега в веществе. Так, в воздухе она составляет от нескольких метров до нескольких десятков метров, а в биологических тканях - нескольких десятков сантиметров.
Бета-частицы имеют разную энергию, поэтому при защите от внешнего воздействия бета-излучения следует использовать экран, поглощающий бета-частицы с максимальной энергией. Применяются экраны из легких материалов с малым атомным номером, например из стекла, полимерных материалов, алюминия. При изготовлении экранов из тяжелых металлов бета-частицы будут генерировать тормозное рентгеновское излучение, от которого также необходима защита.
К-захват является еще одним видом радиоактивных превращений. При избытке протонов в ядре атома ядро захватывает электрон с ближайшей к ядру К-оболочки, а на его место переходит электрон с более дальних оболочек. Образуется частица нейтрино, которая является единственной частицей, вылетающей из ядра атома при К-захвате.
Поскольку энергия генерируется на электронных оболочках при переходах электронов, то возникает характеристическое рентгеновское излучение с дискретным линейчатым спектром, свойственным для тех уровней, на которых происходят переходы электронов в атоме данного вещества.
Деление ядер тяжелых элементов. Этот процесс характерен для ядер атомов элементов с большой атомной массой, таких как 235U, 239Pu и др. В результате ядерного превращения образуются ядра легких элементов с большими энергиями связи и избыточное количество нейтронов. Новые ядра нестабильны и могут превращаться в ядра более легких элементов. При этом выделяется большое количество энергии.
Образующиеся нейтроны используются в дальнейших повторных превращениях ядер тяжелых элементов. Подобный принцип получения энергии с помощью управляемой цепной реакции деления ядер тяжелых элементов лежит в основе работы энергетических ядерных реакторов. Если же эта реакция становится неуправляемой, то увеличение числа нейтронов и количества энергии происходит в геометрической прогрессии. Такая цепная реакция приводит к ядерному взрыву.
Термоядерные реакции. Кроме естественных ядерных превращений, возможно также искусственное превращение ядер легких элементов (изотопов водорода дейтерия и трития) в ядра более тяжелых элементов. Такая реакция используется при взрыве термоядерной (водородной) бомбы, где роль пускового механизма создания исходной высокой температуры, необходимой для придания большой кинетической энергии и сближения ядер легких элементов, принадлежит
плутониевому запалу. После запуска плутониевого запала создаются условия неуправляемой термоядерной реакции. Следует отметить, что и распад ядер тяжелых элементов, и термоядерные реакции сопровождаются выделением мощных потоков гамма-излучения.
Удельная плотность ионизации у гамма-квантов минимальная, заряд и масса отсутствуют, поэтому длина пробега у них довольно большая и может достигать в воздухе нескольких сотен метров. Биологические ткани практически не являются экранами. Поэтому гамма-излучение является весьма опасным источником внешнего облучения для человека. В связи с этим экраны для защиты от гамма-излучения должны быть из материалов с высокой плотностью, с большим количеством ядер и большими электронными оболочками атомов.
Количественная характеристика радиоактивности. Изучение скорости радиоактивного распада ядер радионуклидов позволило выявить определенную закономерность. Установлено, что распаду подвергаются не все атомы одновременно, а за каждый промежуток времени распадается строго постоянная доля атомов радиоактивного изотопа. Эта величина индивидуальна и постоянна для каждого радиоактивного элемента. Она называется постоянной распада и обозначается λ (1/сек = сек-1).
Постоянная распада показывает долю атомов, которые распадаются в массе радиоактивного вещества за единицу времени. Соответственно, закон радиоактивного распада может быть сформулирован следующим образом: за равные промежутки времени происходит превращение равных долей радиоактивных атомов изотопа. Математически его выражение выглядит следующим образом:
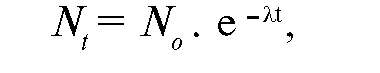 где N - количество активных атомов в изотопе через промежуток времени t; No -
количество активных атомов в изотопе в начальных условиях; λ -
постоянная распада изотопа; e - основание натуральных логарифмов.
где N - количество активных атомов в изотопе через промежуток времени t; No -
количество активных атомов в изотопе в начальных условиях; λ -
постоянная распада изотопа; e - основание натуральных логарифмов.
Зная постоянную распада, можно рассчитать время, за которое распадется половина атомов изотопа, т.е. период полураспада(Т):
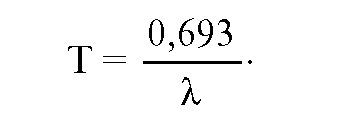 Графически эта зависимость выглядит в виде экспоненты, где количество активных атомов через каждый период полураспада
Графически эта зависимость выглядит в виде экспоненты, где количество активных атомов через каждый период полураспада
уменьшатся вдвое, а сама экспонента бесконечно приближается к горизонтальной линии, но никогда ее не пересекает. В радиационной гигиене принято, что активность радиоактивного элемента становится незначительной через 8-10 периодов полураспада.
Периоды полураспада значительно различаются у разных изотопов. Короткоживущими считаются такие изотопы, у которых период полураспада составляет от долей секунды до нескольких суток, долгоживущими - у которых этот период колеблется от нескольких месяцев до миллиардов лет. Например: для Т 24Na = 15,06 ч, 131I - 8,06 суток, 60Со - 5,3 года, 90Sr - 29 лет, 129I - 15,7 млн лет.
Активность радиоактивного вещества показывает скорость распада ядер в изотопе за единицу времени. Поэтому активность радиоактивного вещества возрастает с увеличением массы изотопа, а также с уменьшением атомной массы и периода полураспада.
За единицу активности радиоактивного вещества в системе СИ принят беккерель (Бк) - такая активность, при которой в источнике происходит одно превращение ядра за 1 с. Чтобы представить величину данной единицы, следует отметить, что допустимая радиоактивность питьевой воды по бета-излучению составляет 1 Бк/л, а по альфа-излучению - 0,1 Бк/л. Однако исторически сложилось так, что первой установленной единицей активности является кюри (Ки)1.
Она была впервые предложена Марией Кюри и названа в честь Пьера и Марии Кюри. Кюри - это очень большая единица по величине активности:
1 Ки = 3,7 х 1010 Бк.
5.2. ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ДЕЙСТВИЯ ИОНИЗИРУЮЩИХ ИЗЛУЧЕНИЙ НА ОРГАНИЗМ
ЧЕЛОВЕКА
Среди главных закономерностей можно выделить следующие: 1. Все ионизирующие излучения приводят к ионизации биосубстрата любого состава, т.е. все органы, системы и ткани в той или иной
1 С 1 января 1980 г. в России введено обязательное применение Международной системы единиц (СИ) на основе СТ СЭВ 1052-78. Употребление в тексте учебника внесистемных единиц радиометрических и дозиметрических величин обусловлено тем, что они встречаются в действующих документах, инструкциях по эксплуатации приборов.
степени подвержены разрушающему действию ионизирующего излучения.
2. Отмечается выраженное несоответствие между малой энергией поглощенной субстратом дозы и ее патогенным действием. Так, известно, что 6000 мЗв при остром воздействии является смертельной дозой. Вместе с тем энергии этой дозы хватит лишь для нагрева 1 см3 биологической ткани на 0,002 °С. Этот пример свидетельствует о том, что характеристики поглощенной дозы только с точки зрения ее энергии недостаточно для понимания развития патологических процессов в организме.
3. При большом повреждающем эффекте высоких доз ионизирующего излучения наблюдается незначительное число первично ионизированных молекул. Так, доза 6000 мЗв ионизирует в организме человека всего лишь 0,0001 часть всех молекул.
4. Важным аспектом характеристики биологического действия ионизирующего излучения на организм является отсутствие у человека органов чувств, способных реагировать на воздействие этой энергии. Человек субъективно органолептически не способен оценить ни время, ни характер, ни степень воздействия ионизирующего излучения, что с учетом конечного выраженного повреждающего действия делает этот вид излучения крайне опасным. Механизм развития лучевых поражений организма. В зависимости от
характера и локализации проявлений различают несколько этапов развития лучевых поражений.
Процессы первичных изменений при действии ионизирующих излучений. В процессе изучения биологических поражений учеными было предложено несколько теорий, объясняющих особенности первичных нарушений с той или иной степенью обоснованности.
Одной из теорий является теория мишени. Сущность теории заключается в разной чувствительности различных биоматериалов и структур организма к радиации. Предполагается, что в клетках организма имеются наиболее чувствительные объемы (мишени). Если в такую мишень попадает ионизирующее излучение, то клетка погибает. Если же в «мишень» излучение не попадает, то клетка остается живой. С точки зрения морфологии такими чувствительными «мишенями» можно считать те или иные важные клеточные структуры: ядро, ядрышко, хромосомы, гены.
Однако впоследствии было показано, что не ко всем биосубстратам применима эта теория. Ее механизм закономерен для быстро
размножающихся и растущих клеток: клеток крови, красного костного мозга, половых клеток и в значительно меньшей степени - для соматических клеток. Поэтому данная теория может быть применима лишь для частных условий.
Еще одной теорией, пытающейся объяснить характер развития лучевых поражений, является теория биологически активных веществ. Теория предполагает, что количество незначительных первичных повреждений лавинообразно увеличивается и приводит к тяжелейшим последствиям в результате разрушения некоторых клеток и субклеточных структур, например, макрофагов, лизосом и др., к выходу биологически активных веществ (гистаминоподобных веществ, ферментов и пр.) в межклеточное пространство, последующим проявлениям аутосенсибилизации, аутолизиса, вплоть до гибели организма. В настоящее время совершенно ясно, что указанные проявления являются лишь одним из этапов развития радиобиологических поражений.
Наиболее универсальной и общепринятой теорией механизма развития первичных поражений в биологических тканях является теория непрямого действия (теория «радиолиза воды»). Согласно этой теории, около 50% поглощенной дозы ионизирующего излучения в клетке приходится на воду. При этом происходит «выбивание» электронов из молекул воды с образованием высокоактивных токсичных нейтральных радикалов.
Наиболее высокоактивный радикал НО2 является очень сильным окислителем. Он образуется при облучении воды в присутствии избытка кислорода: Н + О2 - НО2. В связи с этим снижение парциального давления кислорода в тканях во время облучения является профилактическим мероприятием, направленным на уменьшение неблагоприятных проявлений острых лучевых поражений. Эта реакция получила название кислородного эффекта. Вместе с тем снижение парциального давления кислорода в тканях в последующие стадии развития лучевых поражений не имеет значения и никак не влияет на скорость и тяжесть последних.
Таким образом, на данном этапе изменения происходят на уровне физико-химических реакций с образованием первичных высокоактивных радикалов: Н, ОН, НО2 (гидропероксид), Н2О2 (перекись), которые не свойственны организму и очень токсичны. Они дают начало цепным реакциям и вторично-радикальным процессам. Наступает стадия биохимических превращений в клетке, в реакции вступают биологические субстраты. Изменениям подвергаются белки, углеводы, липиды.
Воздействие ионизирующего излучения на белки приводит к снижению уровня незаменимых аминокислот (триптофана, метионина), инактивируются сульфгидрильные группы, снижается активность ферментов, нарушается синтез нуклеиновых кислот. Нуклеопротеиновые комплексы обладают очень высокой чувствительностью к ионизирующему излучению. ДНК клеточного ядра и РНК высвобождаются из нуклеопротеидов и уже через несколько минут после облучения накапливаются в клеточной цитоплазме. Это ведет к необратимым изменениям и даже к гибели клеток.
Значительной чувствительностью в клетке к действию ионизирующего излучения обладает процесс окислительного фосфорилирования: исследования показали, что одно из самых первых нарушений - это повреждение синтеза АТФ, что приводит, в свою очередь, к изменению углеводного обмена и тканевого дыхания. Простые сахара окисляются и переходят в токсичные соединения - органические кислоты, формальдегид. Происходит нарушение свойств полисахаридов. Так, мукополисахарид гиалуроновая кислота снижает свою вязкость, гепарин теряет антикоагулянтные свойства.
Однако, как показали исследования, наиболее важным пусковым механизмом патологических процессов на данном этапе является образование перекисей из липидов: биологический субстрат в тканях соединяется с первичными радикалами, в результате чего образуются стойкие активные нетипичные для организма вторичные радикалы. В свою очередь, каждый из вторичных радикалов нарушает тысячи молекул субстрата липидов.
Действие ионизирующих излучений на клеточном уровне. Рассматривая происходящие процессы с точки зрения целой клетки, следует отметить ряд закономерностей происходящих процессов:
• изменившие свою активность ферменты легко проникают через мембраны клеточных структур (ядро, митохондрии, лизосомы и др.) и разрушают их;
• чем больше структур в клетке, тем больше их устойчивость к ионизирующему излучению. Так, например, диплоидные клетки более устойчивы, чем гаплоидные;
• наиболее чувствительными и быстро разрушаемыми клетками являются клетки, отличающиеся активными обменными процессами, ростом и размножением;
• на уровне клетки при воздействии ионизирующих излучений происходят как процессы повреждения, так и процессы восста-
новления. Поэтому потенциальные нарушения могут не проявляться при активных репаративных процессах в клетках.
Из вышеизложенного можно сделать вывод, что в связи с разным уровнем организации, активности обменных процессов, скорости роста и деления степень радиочувствительности клеток различна. Наиболее чувствительными и радиопоражаемыми являются клетки кроветворной и лимфатической систем, а также клетки половых желез. Наименее радиопоражаемыми и устойчивыми к действию радиации считаются клетки нервной, костной и хрящевой тканей.
При воздействии ионизирующих излучений важнейшее значение имеют не только структурные нарушения клеток в тканях и органах, проявляющиеся соматическими детерминированными изменениями в организме, но и генетические перестройки. Это в первую очередь генные или точечные мутации (нарушение молекулярной структуры генов) и хромосомные аберрации (структурные и численные нарушения хромосом). В отдельных случаях возможны геномные мутации, т.е. кратные изменения всего гаплоидного набора хромосом. В целом соотношение мутаций, обусловленных воздействием ионизирующих излучений, соответствует спектру спонтанных мутаций.
Исходы мутагенного действия различны в зародышевых и соматических клетках. В зародышевых клетках как генные, так и хромосомные мутации приводят к наследственным уродствам, а впоследствии - к нежизнеспособности особей новых поколений. Мутации в соматических клетках ведут либо к гибели этих клеток, либо к стойкому закреплению этих качеств. Наиболее характерно проявление новых свойств в виде малигнизации и онкологических заболеваний как у объекта воздействия, так и у последующих поколений.
Действие ионизирующих излучений на целостный организм. Рассматривая действие ионизирующих излучений на организм как единое целое, мы можем выделить ряд закономерностей в реакции организма:
• чувствительность к ионизирующему излучению увеличивается с повышением уровня организации организма, т.е. рептилии более чувствительны к действию ионизирующих излучений, чем насекомые, а млекопитающие превосходят по своей чувствительности пресмыкающихся;
• у низших организмов малая чувствительность к ионизирующим излучениям обусловлена наличием в организме ряда биохимических веществ и процессов, отсутствующих у млекопитающих и человека;
• у млекопитающих, в том числе и у человека, наиболее чувствительны к воздействию ионизирующих излучений новорожденные (в связи с повышенной митотической активностью) и старые организмы (в связи с ослаблением репаративных процессов).
Эффект воздействия ионизирующих излучений на млекопитающих зависит от целого ряда условий. Это дробность воздействия, вид животного, объем и локализация облучаемых органов и тканей, вид излучения. В связи с этим в радиобиологии вводится понятие относительная биологическая эффективность (ОБЭ), которая учитывает эффект биологического действия различных излучений в определенных условиях. ОБЭ определяют как отношение дозы рентгеновского или гамма-излучения к дозе любого другого вида ионизирующего излучения, вызывающей такой же эффект. При этом ОБЭ рентгеновского и гамма-излучения принимается за 1.
Действие ионизирующих излучений на человека. Эффекты биологического действия ионизирующих излучений можно рассматривать с 3 позиций. Они могут быть:
• детерминированные и стохастические;
• соматические и наследственные;
• острые (ранние) и отдаленные.
Детерминированные эффекты - это проявления, которые характеризуются наличием пороговой дозы воздействия излучения, а тяжесть поражения у конкретного человека увеличивается в зависимости от повышения дозы облучения. Примерами таких проявлений являются острая и хроническая лучевая болезнь, лучевые ожоги, лучевая катаракта, клинически регистрируемые нарушения гемопоэза, половая стерильность и др.
Стохастические эффекты - это проявления, которые не имеют дозового порога. Считается, что сколь угодно малая доза излучения может вызвать в организме изменения любой тяжести, вплоть до смертельного исхода. При этом большие дозы не приводят к увеличению тяжести заболевания, а ведут к повышению статистической вероятности частоты поражений в популяции. Эти нарушения обусловлены генетическими изменениями и проявляются как отдаленные эффекты. К подобным проявлениям относятся онкологические заболевания, лейкозы, а также наследственные нарушения у потомства.
Соматические эффекты - это эффекты, которые проявляются у самого субъекта воздействия. Например, детерминированные соматические
эффекты, лучевая болезнь, катаракта, клинически регистрируемые нарушения гемопоэза, половая стерильность, а также онкологические заболевания, стохастические соматические эффекты - лейкозы.
К наследственным проявлениям можно отнести все нарушения у потомства, обусловленные воздействием ионизирующих излучений на предыдущие поколения.
И, наконец, к острым (ранним) следует отнести эффекты, проявляющиеся в течение нескольких часов или суток после острого воздействия дозы ионизирующего излучения. При этом принято считать, что острым является воздействие фактора либо однократно, либо дробно в течение не более 4 суток. Это такие проявления, как острая лучевая болезнь и лучевые ожоги.
Отдаленными эффектами надо считать такие соматические патологические проявления, как хроническая лучевая болезнь, лучевая катаракта, клинически регистрируемые нарушения гемопоэза, половая стерильность, а также стохастические эффекты в виде канцерогенеза, лейкозов и наследственных нарушений.
Рассматривая проявления биологических реакций организма человека на воздействие ионизирующих излучений, необходимо дать характеристику некоторым детерминированным и стохастическим эффектам.
Детерминированные эффекты включают в себя только соматические поражения. Они развиваются на уровне целостного организма и связаны с координирующей деятельностью центральной нервной системы, которая быстро реагирует на воздействие радиации, мобилизует комплекс органов и систем и инициирует защитные функции. Вероятный механизм этого процесса можно представить следующим образом: воздействие ионизирующего излучения на организм «включает» центральную нервную систему, которая, в свою очередь, запускает компенсаторные механизмы, например гуморальные, что ведет к компенсации патологических процессов в организме в целом.
Пределом возможностей компенсаторных процессов, по-видимому, и объясняется наличие порога в детерминированных проявлениях. Превышение порога ведет к поломке компенсаторных механизмов. Нарушаются все виды обменных процессов: белкового, в том числе ферментного, нуклеопротеидного, углеводного (нарушение системы окислительного фосфорилирования), липидного. Особое значение имеет не столько глубина процессов поражения, сколько рассогласование видов обмена и функций
организма за счет нарушения координирующей роли центральной нервной системы.
Таким образом, если на уровне клетки любой акт ионизации биологически значим, что проявляется как беспороговость, стохастические эффекты, то на уровне системы, а тем более - всего организма в целом, возможна компенсация, выражающаяся в появлении порогового уровня дозы ионизирующего излучения.
Одним из наиболее известных детерминированных проявлений после воздействия ионизирующего излучения является острая лучевая болезнь (ОЛБ). Она относится к ранним соматическим эффектам. Острая форма лучевой болезни - это общее заболевание, вызываемое кратковременным (от нескольких минут до 4 сут) одномоментным или повторяющимся действием ионизирующего излучения либо поступлением радиоактивных веществ в организм, которые создают в короткий срок общую эквивалентную дозу в тканях свыше 1000 мЗв.
В зависимости от дозы облучения различают следующие степени тяжести ОЛБ:
• I степень (легкая) - доза облучения 1000-2000 мЗв;
• II степень (средней тяжести) - 2000-3000 мЗв;
• III степень (тяжелая) - 3000-5000 мЗв;
• IV степень (крайне тяжелая) - свыше 5000 мЗв.
Еще одним детерминированным ранним соматическим проявлением лучевого поражения являются лучевые ожоги. Они развиваются при локальном остром воздействии достаточно высоких доз ионизирующего излучения на кожные покровы. Выделяют 4 степени тяжести лучевых ожогов.
Ожог I степени развивается при дозе облучения до 5000 мЗв. Проявляется местным легким шелушением эпидермиса, пигментацией, зудом кожи, обратимым выпадением волос.
Ожог II степени возникает после воздействия дозы ионизирующего излучения до 8000 мЗв. В качестве основных симптомов следует назвать развитие эритемы через 10-14 дней после облучения, появление отечности, боли, выпадение волос. Волосяной покров восстанавливается через 3-4 мес.
Ожог III степени (уровень дозы облучения до 12 000 мЗв) характеризуется развитием выраженной эритемы, пузырей и некроза кожи уже через 6 дней после воздействия излучения. Восстановление тканей длительное, вялое.
Ожог IV степени развивается при дозе местного лучевого воздействия свыше 12 000 мЗв и более. Через 3-4 дня появляются выраженная эритема и отечность тканей, переходящие в глубокий некроз кожи и длительно не заживающие трофические язвы.
К общим закономерностям клиники лучевых ожогов следует отнести наличие латентного периода, тем более короткого, чем выше доза облучения; вялое и длительное течение процесса; быстрое изъязвление кожных покровов, плохую регенерацию тканей.
К детерминированным соматическим отдаленным эффектам относится хроническая форма лучевой болезни. Она развивается при длительном повторном воздействии относительно небольших, но превышающих допустимые пределы доз ионизирующего излучения. В зависимости от уровней поглощенных доз степень тяжести течения заболевания может быть легкой, средней тяжести и тяжелой.
Общими симптомами болезни, выраженность которых зависит от степени ее тяжести, являются жалобы астенического характера: головная боль, не поддающаяся лечению, расстройство сна, слабость, подавленное настроение, раздражительность и т.д. В крови отмечается снижение количества лейкоцитов, тромбоцитопения, анемия. Отмечается боль в трубчатых костях и по ходу нервов, нарушение координации движений и походки. В связи с нарушением состояния сосудистой стенки и свертываемости крови на коже возникают петехии, геморрагии, кровоточивость десен, внутренние кровотечения. Возможны трофические нарушения кожи. Из-за ослабления иммунитета повышен риск присоединения вторичной инфекции - в первую очередь респираторной. При этом ослабление иммунитета проявляется следующим образом:
• нарушением барьерных функций организма: снижением бактерицидности слизистых и кожи, резким угнетением фагоцитарной активности лейкоцитов, бактерицидности сыворотки крови, повышением проницаемости клеточных мембран по отношению к микробам;
• повышением вирулентности микроорганизмов в организме облученного;
• резким ослаблением способности выработки антител на введенный антиген, что делает практически невозможным создание искусственного иммунитета.
К детерминированным соматическим отдаленным эффектам относится лучевая катаракта. Показано, что для ее развития доста-
точно однократного воздействия дозы ионизирующего излучения, равной 0,5-2,0 Зв (помутнение хрусталика), либо до 5,0 Зв (выраженная катаракта). Однако заболевание развивается после скрытого периода, составляющего от 2 до 7 лет, что позволяет отнести его к отдаленным последствиям. Другой вариант развития катаракты обусловлен многоразовым хроническим воздействием в течение нескольких лет при ежегодной дозе 0,1-0,15 Зв.
К детерминированным соматическим отдаленным эффектам следует отнести также клинически регистрируемые нарушения гемопоэза и половую стерильность, поскольку эти эффекты проявляются в отдаленные сроки индивидуально у людей или животных, на которых воздействовали дозы, превышающие пороговые.
Все стохастические эффекты при действии ионизирующих излучений являются отдаленными. К этой группе эффектов относятся такие соматические проявления, как повышение количества новообразований и лейкозов, обусловленных воздействием излучений на генетический аппарат соматических клеток и их малигнизацию. Закономерность возникновения новообразований выявляется не в зависимости от повышения индивидуальной дозы, а в связи с воздействием самых минимальных дополнительных к фону доз на большом контингенте людей. То есть чем больше популяция, тем достовернее этот вид отдаленных последствий (популяционная доза).
Важными стохастическими проявлениями являются эффекты от воздействия ионизирующего излучения на ростковые клетки на разных этапах их развития. Подобные воздействия вызывают мутации в этих клетках. Вид мутаций приводит к различным последствиям. Так, при хромосомных мутациях не исключено бесплодие. При точечных мутациях зачатие возможно, но велика вероятность рождения неполноценного ребенка. При этом следует помнить, что мутации могут идти по рецессивному признаку. Поэтому нарушения могут проявиться в 3-4-м поколении. Подобные эффекты относятся к наследственным проявлениям.
Возможно непосредственное действие ионизирующего излучения на эмбрион и плод. Проявления в такой ситуации зависят от периода беременности. Так, яйцеклетка погибает, если действие ионизирующего излучения осуществляется в момент ее прикрепления к стенке матки. Если облучение дозой более 0,1 Зв происходит во время закладки органов на 4-12-й неделях беременности (период
органогенеза), то результатом могут быть самые тяжелые уродства у плода и родившегося ребенка. При облучении плода в утробе матери между 8-й и 15-й неделями беременности дозой более 0,2 Зв последствием может быть выраженная умственная отсталость у родившихся детей. Облучение на поздних стадиях имеет последствием гибель плода и мертворождение.
Следует отметить, что особенности и степень выраженности эффектов облучения зависят от 3 видов факторов:
1. От особенностей организма, которые определяются половыми, возрастными и индивидуальными характеристиками, а также чувствительностью органов, подвергшихся облучению. Так, известно, что яйцеклетки более чувствительны, чем сперматозоиды; человек вдвое чувствительнее к ионизирующему излучению, чем белые мыши; а чувствительность детей и стариков выше, чем взрослого организма (первых - в связи с большой митотической активностью клеток, вторых - в связи с нарушением процессов репарации и компенсации).
Установлено также, что индивидуальная чувствительность организма обусловлена в определенной мере состоянием центральной нервной системы и ее координирующей функцией, уровнем здоровья человека, функциональным состоянием эндокринной системы и т.д. Из органов и тканей наиболее чувствительны к облучению гонады, а наименее - костная и хрящевая ткани, клетки нервной системы. Это обусловлено активностью митоза клеток, уровнем биохимических процессов и учитывается соответствующим взвешивающим коэффициентом чувствительности.
Кроме того, различные органы и ткани в связи с особенностями обмена веществ избирательно депонируют те или иные радиоактивные вещества, а следовательно, наиболее радиопоражаемы. Щитовидная железа накапливает радиоактивный йод, костная ткань - радий и стронций, лимфатическая система - изотопы золота.
2. Сила воздействия обусловлена видом и характером ионизирующего излучения: чем выше проникающая способность и ионизационная активность, а также чем больше доза и энергия излучения, тем сильнее выражен эффект облучения.
3. И, наконец, эффект воздействия при облучении может зависеть от сопутствующих факторов и условий: тяжелой физической нагрузки, высокой температуры окружающей среды, одновременного влияния химических факторов и т.д.
5.3. ПРИНЦИПЫ ГИГИЕНИЧЕСКОГО
НОРМИРОВАНИЯ ИОНИЗИРУЮЩЕГО ИЗЛУЧЕНИЯ
Принципиальными задачами обеспечения радиационной безопасности и фундаментальной основой радиационной гигиены являются:
• предотвращение проявления любых детерминированных эффектов путем удержания доз облучения ниже соответствующих порогов;
• использование всех разумных мер и осуществление соответствующих мероприятий для того, чтобы максимально снизить вероятность проявления стохастических эффектов с учетом социальных и экономических условий.
Дозы ионизирующего излучения. При оценке условий радиационной безопасности, кроме характеристики активности источника ионизирующего излучения, необходимо знать, каковы степень и характер его воздействия на окружающую среду и человека.
При этом один и тот же источник может вызывать патологические изменения различной тяжести в зависимости от сопутствующих условий воздействия, например времени воздействия, расстояния до объекта, наличия защитных экранов, характера среды. В любом случае эффект воздействия определяется той энергией, которая передается от источника рассматриваемому объекту.
Результатом воздействия ионизирующих излучений на облучаемые объекты являются физико-химические или биологические изменения этих объектов. Примерами таких изменений могут служить нагрев тела, фотохимическая реакция рентгеновской пленки, изменение биологических показателей живого организма и т.д.
В связи с этим необходимо рассмотреть ряд энергетических характеристик ионизирующего излучения, которыми определяется эффект действия.
Характер лучевых поражений биологических объектов, в том числе и человека, при воздействии ионизирующих излучений в первую очередь зависит от поглощенной энергии. В связи с этим вводится такое понятие, как поглощенная доза. Поглощенная доза (H) - это величина энергии ионизирующего излучения, переданная веществу.
Единицами поглощенной дозы в системе СИ является грей (Гр). Внесистемной единицей поглощенной дозы является рад. 1 Гр = 100 рад.
Однако исторически первой эмпирически предложенной дозой, характеризующей только рентгеновское и гамма-излучение, была экспозиционная доза. Экспозиционная доза - количественная характеристика рентгеновского и гамма-излучения по их ионизирующему действию, выраженная электрическим зарядом одного знака, образованным в единице объема воздуха в условиях электронного равновесия.
В международной системе СИ единицей является кулон/кг - экспозиционная доза рентгеновского и гамма-излучения, которая создает в 1 килограмме сухого воздуха ионы, несущие заряд величиной в 1 кулон каждого знака. Внесистемной единицей является рентген (Р) - такая экспозиционная доза рентгеновского и гамма-излучения, которая создает в 1 см3 сухого воздуха ионы, несущие заряд в 1 электростатическую единицу каждого знака. 1 Р = 0,285 мКл/кг.
Поскольку для ионизации воздуха необходима определенная энергия, то между экспозиционной и поглощенной дозами существует численное соотношение: 1 Р = 0,877 рад, т.е. для создания в 1 см3 воздуха заряда в 1 электростатическую единицу необходима поглощенная доза в 0,877 рад. Определенное неудобство использования для расчетов экспозиционной дозы обусловлено ограничением ее применения только для рентгеновского и гамма-излучения. Поэтому при расчете доз всех видов ионизирующего излучения используются единицы поглощенной дозы.
Следует также отметить разную степень поражающего действия различных видов излучения на организм человека, обусловленную особенностями их физических свойств и прежде всего различным уровнем линейной передачи энергии (ЛПЭ). В радиационной защите поэтому используется взвешивающий коэффициент (WR), показывающий, во сколько раз надо уменьшить поглощенную дозу любого вида излучения, чтобы получить тот же биологический эффект для человека, что и от такой же поглощенной дозы рентгеновского или гамма-излучения.
Взвешивающие коэффициенты для отдельных видов излучения необходимы при расчете эквивалентной дозы:
• фотоны любых энергий, электроны и мюоны любых энергий -1;
• нейтроны энергий менее 10 кэВ, нейтроны более 20 МэВ, протоны, кроме протонов отдачи, энергии более 2 МэВ - 5;
• нейтроны энергий от 10 до 100 кэВ и от 2 до 20 МэВ - 10;
• нейтроны энергий от 100 кэВ до 2 МэВ, альфа-частицы, осколки деления, тяжелые ядра - 20.
Эквивалентная доза (HT R) - это поглощенная доза в органе или ткани, умноженная на соответствующий взвешивающий коэффициент для данного вида излучения.
Единица поглощенной дозы в системе СИ называется зиверт (Зв). Внесистемной единицей эквивалентной дозы является бэр.
При неравномерном облучении всего тела оценка ущерба здоровью проводится с помощью эффективной дозы. Эффективная доза (Е) - это величина, используемая как мера риска возникновения отдаленных последствий облучения всего тела человека и отдельных его органов и тканей с учетом их радиочувствительности. Она представляет собой сумму произведений эквивалентных доз в органах на соответствующие взвешивающие коэффициенты, характеризующие их радиочувствительность:
E = Σ WT . HT
где WT - взвешивающий коэффициент для органа или ткани Т, показывающий чувствительность последних к ионизирующему излучению; НТ - эквивалентная доза в органе или ткани Т.
Взвешивающие коэффициенты (WT) для различных органов и тканей составляют: гонады - 0,20; печень - 0,05;
костный мозг (красный) - 0,12;
пищевод - 0,05;
толстый кишечник - 0,12;
щитовидная железа - 0,05;
легкие - 0,12;
кожа - 0,01;
желудок - 0,12;
клетки костных поверхностей - 0,01; мочевой пузырь - 0,05; остальные - 0,05; грудная железа - 0,05.
Для оценки стохастических эффектов воздействия ионизирующих излучений на персонал или население используется понятие эффективная коллективная доза, которая определяется как сумма средних эффективных доз в подгруппе людей, умноженных на число людей в соответствующей группе. Единицей коллективной дозы является человеко-зиверт (чел-Зв).
Важной характеристикой влияния ионизирующего излучения на человека является мощность дозы, то есть доза, отнесенная к единице времени.
Для обеспечения радиационной безопасности при нормальной эксплуатации источников излучения необходимо руководствоваться следующими основными принципами:
• непревышение допустимого предела индивидуальных доз облучения граждан от всех источников ионизирующего излучения;
• запрещение всех видов деятельности по использованию источников ионизирующего излучения, при которых полученная для человека и общества польза не превышает риск возможного вреда, причиненного дополнительным к естественному радиационному фону облучением;
• поддержание на возможно низком и достижимом уровне с учетом экономических и социальных факторов индивидуальных доз облучения и числа облучаемых лиц при использовании любого источника ионизирующего излучения.
Гигиенические нормативы дифференцированы для разных групп облучаемых лиц (табл. 5.1). Выделяют следующие категории и группы лиц, подвергающихся облучению:
• категория «персонал» (группа А - лица, работающие с техногенными источниками; группа Б - лица, находящиеся по условиям работы в сфере воздействия техногенных источников);
• категория «все население», включая лиц из персонала, вне сферы и условий их производственной деятельности.
Для облучаемых предусмотрено 3 класса нормативов:
• основные пределы доз (ПД - величина годовой эффективной или эквивалентной дозы, которая не должна превышаться в условиях нормальной работы);
• допустимые уровни многофакторного воздействия (для одного радионуклида, пути поступления внутрь организма или одного вида внешнего излучения), являющиеся производными от основных пределов доз: пределы годового поступления (ПГП), допустимые среднегодовые объемные активности (ДОА), среднегодовые удельные активности (ДУА) и др.;
• контрольные уровни (дозы, уровни, активности, плотности потоков и др.), которые устанавливает администрация учреждения по согласованию с органами Роспотребнадзора. Их численные значения должны учитывать достигнутый в учреждении оптимальный
уровень радиационной безопасности и обеспечивать условия, при которых радиационное воздействие будет ниже допустимого предела доз и не будет повышаться в каждом следующем году по сравнению с предыдущим.
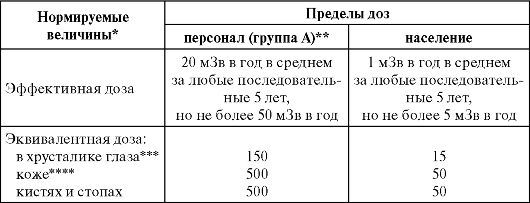
Таблица 5.1. Основные пределы доз, мЗв/год
 Примечание.
Примечание.
* Допускается одновременное облучение до указанных пределов по всем нормируемым величинам.
** Основные пределы доз, как и все остальные допустимые производные уровни персонала группы Б, равны 1/4 значений для персонала группы А. Эквивалентная доза в коже относится к среднему значению в слое толщиной 5 мг/см2 под покровным слоем толщиной 5 мг/см2. На ладонях толщина покровного слоя - 40 мг/см2. *** Относится к дозе на глубине 300 мг/см2.
**** Относится к среднему по площади в 1 см2 значению в базальном слое кожи толщиной 5 мг/см2 под покровным слоем толщиной 5 мг/см2. На ладонях толщина покровного слоя 40 мг/см2. Указанным пределом допускается облучение всей кожи человека при условии, что в пределах усредненного облучения любого 1 см2 площади кожи этот предел не будет превышен. Предел дозы при облучении кожи лица обеспечивает непревышение предела дозы на хрусталик от бета-частиц.
Сотрудники радиологических отделений больниц, работающие непосредственно с источниками ионизирующего излучения, а также рентгенологи относятся к категории «персонал», группа А. Вспомогательный персонал, работающий в сфере воздействия источников ионизирующего излучения, но непосредственно не контактирующий с ними, относится также к категории «персонал», но группа Б. Согласно этой классификации, для персонала группы
А допускается предел дозы 20 мЗв в год, для вспомогательного персонала (группа Б) - 5 мЗв в год.
В соответствии с целью медицинского облучения населения принципы контроля и ограничения радиационных воздействий в медицине основаны на получении необходимой и полезной диагностической информации или терапевтического эффекта при минимально возможных уровнях облучения. При этом не устанавливаются пределы доз, но используются принципы обоснования назначения радиологических медицинских процедур и оптимизации мер защиты пациентов.
При проведении профилактических медицинских рентгенологических исследований практически здоровых лиц годовая эффективная доза облучения этих лиц не должна превышать 1 мЗв.
5.4. ОБЕСПЕЧЕНИЕ РАДИАЦИОННОЙ БЕЗОПАСНОСТИ В МЕДИЦИНСКИХ УЧРЕЖДЕНИЯХ
Работы с использованием источников ионизирующих излучений (ИИИ) независимо от типа источника, объема и характера работ, специфики технологических процессов, средств и методов, используемых для обработки и удаления радиоактивных отходов, рассматриваются как потенциально опасные для здоровья персонала и населения. Обеспечение радиационной и ядерной безопасности осуществляется в соответствии с федеральными законами первого уровня, такими как «Об использовании атомной энергии»; «О радиационной безопасности населения».
В целях конкретизации отдельных положений закона РФ «О радиационной безопасности населения» в настоящее время введены в действие два основополагающих нормативных документа федерального уровня: «Нормы радиационной безопасности (НРБ-99)» и «Основные санитарные правила обеспечения радиационной безопасности (ОСПОРБ-99)». Они относятся к категории нормативных документов второго иерархического уровня и имеют общегосударственное значение.
При работе с ИИИ принимаются меры по обеспечению безопасности радиологических объектов, персонала и населения. Радиационная безопасность объекта включает планировочно-конструктивные меры (выбор участка, особенности внутренней планировки помещений, размещение специального оборудования, защитных устройств, конструкций); зонирование территории радиологичес-
кого объекта; радиационно-гигиеническую оценку и лицензирование деятельности с ИИИ.
Радиационная безопасность персонала обеспечивается: ограничениями допуска к работе с ИИИ; соблюдением установленных контрольных уровней; проведением радиационного контроля; организацией системы информации о радиационной обстановке; проведением эффективных мероприятий по защите персонала.
Радиационная безопасность населения обеспечивается: созданием условий жизнедеятельности людей, отвечающих требованиям закона «О радиационной безопасности населения»; установлением квот на облучения ИИИ; проведением радиационного контроля; организацией системы информации о радиационной обстановке; планированием и проведением мероприятий при нормальной эксплуатации ИИИ и в случае радиационной аварии.
Закрытые и открытые ИИИ. Конкретная система защиты от ИИИ будет зависеть от типа источника и вида излучения. Закрытый источник - источник радиоактивного излучения, устройство которого исключает попадание радиоактивных веществ в окружающую среду в условиях применения и износа, на которые он рассчитан. Открытый источник - источник радиоактивного излучения, при использовании которого возможно попадание содержащихся в нем радиоактивных веществ в окружающую среду, а следовательно, поступление в организм человека. Таким образом, основным поражающим фактором при работе с закрытыми источниками является внешнее излучение. При работе с открытыми источниками, кроме внешнего излучения, имеется опасность внутреннего облучения в результате попадания радиоактивных частиц в легкие и желудочнокишечный тракт.
Закрытые ИИИ. При работе с закрытыми источниками система радиационной защиты направлена на максимальное снижение внешнего излучения. Закрытые источники делятся на источники непрерывного и периодического действия. К источникам непрерывного действия относятся установки с гамма-, бета-излучателями и нейтронными излучателями, к источникам периодического действия - рентгеновские аппараты и ускорители заряженных частиц. В качестве гамма-источников непрерывного действия используются радиоактивные элементы (кобальт-60, кадмий-109, теллур-107, цезий-134, цезий-137 и т.д.), которые в порошкообразном виде или твердом состоянии помещаются в герметические стальные ампулы. В качестве бета-излучателей исполь-
зуются искусственные радионуклиды - фосфор-32, стронций-90, иттрий-90, золото-198, таллий-204 и др.
Нейтронные источники представляют собой смесь радия, полония и плутония с бериллием и бором, заключенную в герметические стальные ампулы.
Активность закрытых источников, используемых в медицинской практике, весьма различна. Это гамма-источники, используемые для дистанционной лучевой терапии, и нейтронные излучатели различной мощности. Для внутриполостной и внутритканевой терапии используют закрытые источники кобальта-60, золота-198 в виде бусинок, цилиндров, игл.
Источники периодического действия - рентгеновские аппараты, применяемые в диагностике и терапии, генерируют рентгеновское излучение с энергией от 40 до 250 кэВ. Система защитных мероприятий будет зависеть от активности излучателя, вида излучения, технологии работы с источниками. Надежность защиты персонала определяют дозы облучения, не превышающие уровня, установленного Нормами радиационной безопасности (НРБ-99).
Принципы защиты от ИИИ. Доза внешнего облучения пропорциональна активности источника и времени его действия и обратно пропорциональна квадрату расстояния от источника. Отсюда вытекают основные принципы защиты: «защита количеством»; «защита временем»; «защита расстоянием»; «защита экраном».
«Защита количеством» в медицинской практике не получила большого распространения, так как уменьшение активности источника неизбежно приводит к ослаблению лечебного эффекта и вынужденному увеличению времени контакта больного с излучателем.
«Защита временем» возможна при работе с источниками малой активности, при ручных манипуляциях с ними. Автоматизм рабочих операций и высокая квалификация медицинского персонала позволяют сократить время контакта с радиоактивными веществами (уменьшение «активного» времени).
«Защита расстоянием» чаще всего реализуется использованием дистанционных инструментов, что достаточно эффективно снижает дозу на руки персонала (рис. 5.1).
«Защита экраном». Лучшим материалом для ослабления гамма- и рентгеновского излучения являются материалы с большой атомной массой, в которых создаются благоприятные условия для процессов взаимодействия гамма-излучения и рентгеновского излучения
с веществом (рис. 5.2). На практике чаще используют свинец или уран. Если экранируются соседние помещения, то перекрытия помещения с гамма-излучателем делают из бетона, баритобетона, железобетона. Большая толщина таких строительных конструкций создает надлежащую защиту от излучения. Для защиты от бета-излучения используют более легкие материалы - алюминий, стекло, пластмассу.
Защита от бета-излучения свинцовым экраном опасна, так как в поле ядра атома свинца бета-частицы теряют энергию, способствуя выходу тормозного излучения. При мощных бета-излучениях используют комбинированные экраны из тяжелых и легких материалов.
 Рис. 5.1. Набор инструментов для нанизывания радиоактивных бус на нити
Рис. 5.1. Набор инструментов для нанизывания радиоактивных бус на нити
Для защиты от потока быстрых нейтронов применяют экраны из материалов с большим количеством атомов водорода (парафин, вода).
Поскольку поглощение нейтронов сопровождается излучением квантов энергии, необходимо предусмотреть для их ослабления экран из свинца в качестве второго слоя. Тепловые нейтроны эффективно поглощают вещества, содержащие бор и кадмий.
По своему назначению и конструкции защитные экраны могут быть условно разделены на 5 групп:
1. Экраны-контейнеры, в которые помещают радиоактивные препараты с целью их транспортировки и хранения в нерабочем положении.
2. Экраны для оборудования. Экранирование оборудования при положении радиоактивного препарата в рабочем состоянии или при включении высокого (или ускоряющего) напряжения на источники ионизирующих излучений.
 Рис. 5.2. Защитное оборудование для радиохирургических работ
Рис. 5.2. Защитное оборудование для радиохирургических работ
3. Передвижные защитные экраны, которые применяются для защиты рабочего места на различных участках рабочей зоны.
4. Строительные конструкции как защитные экраны (стены, перекрытия полов и потолков, специальные двери и т.д.) предназначены для защиты помещений, в которых постоянно находится персонал, и прилегающей территории.
5. Экраны индивидуальных средств защиты (щиток из органического стекла, смотровые стекла пневмокостюмов, просвинцованные
фартуки, накидки, воротники, юбки, передники, шапочки, очки, перчатки, пластины).
Радиационная безопасность в рентгенодиагностических кабинетах регламентирована в СанПиН 2.6.1.1192-03 «Гигиенические требования к устройству и эксплуатации рентгеновских кабинетов, аппаратов и проведению рентгенологических исследований». Источниками излучения являются различного типа рентгеновские аппараты, а приемниками изображения - усиливающие рентгеновские экраны или усилители рентгеновского изображения (УРИ), состоящие из электронно-оптического преобразователя, телевизионной системы и фото-, кинокамеры.
Радиационная безопасность при работе в кабинетах общего профиля (диагностические исследования с помощью флюорографии, рентгенографии, рентгеноскопии) обеспечивается планировочными решениями, защитой временем и экранами (просвинцованные фартуки, защитные ширмы), качеством применяемых УРИ и т.д.
Уровни облучения медицинского персонала рентгенодиагностических кабинетов колеблются в широких пределах. За последние 40 лет эффективная доза снизились более чем в 30 раз и в настоящее время сопоставима с пределом дозы для населения (табл. 5.2).
Таблица 5.2. Среднегодовые эффективные дозы облучения медицинского персонала рентгенодиагностических кабинетов общего профиля, мЗв
Годы | Врачи | Рентгенолаборанты |
1960 | 80,0 ± 15,0 | 40,0 ± 10,0 |
1961 | 80,0 ± 15,0 | 45,0 ± 15,0 |
1962 | 25,0 ± 5,0 | 25,0 ± 5,0 |
1964-1969 | 25,0 ± 5,0 | 10,0 ± 5,0 |
1970-1975 | 9,0 ± 1,0 | 3,0 ± 1,0 |
1976-1980 | 5,0 ± 1,0 | 2,5 ± 0,5 |
1981-1986 | 3,0 ± 1,0 | 2,0 ± 0,5 |
1987-2001 | 3,0 ± 1,0 | 1,5 ± 0,5 |
2002-2007 | 2,0 ± 0,7 | 1,3 ± 0,2 |
За последнее время увеличилось число сложных рентгенологических исследований с участием врачей различных специальностей. К таким исследованиям следует отнести бронхоскопию, бронхографию, ирригоскопию, ангиокардиографию, катетеризацию сердца,
травматологические исследования и др. Эти процедуры наряду с рентгенологами осуществляют хирурги, анестезиологи, операционные медсестры, которые относятся к категории «персонал», группа Б.
Рентгеновские процедуры по характеру участия в них врачей могут быть условно разделены на 3 группы: хирург - пассивный наблюдатель (консультант); хирург - принимающий участие в связи с оперативным вмешательством; анестезиолог и хирург - активные члены операционной бригады.
В первом случае хирурги находятся за спиной рентгенолога у экрана аппарата (при оценке правильности сопоставления костных отломков, рентгеноскопии пищевода, желудка и др.).
Во втором случае хирург может находиться в поле прямого пучка излучения при операциях на шейке бедра, на желчных путях и пузыре. Весь остальной медицинский персонал при оперативном вмешательстве (анестезиологи, ассистенты, медсестры) размещаются за передвижной защитной ширмой.
В третьем случае анестезиолог, хирург и медсестра выполняют функциональные обязанности, обусловленные проведением этих процедур (катетеризация полостей сердца, артерий и вен с последующим введением катетеров в нужную полость).
Индивидуальные дозы облучения специалистов первой группы зависят от частоты участия в процедурах просвечивания. Так, хирурги отделений общей хирургии, легочной хирургии, травматологии и нейрохирургии получают дозу порядка 1 мЗв/год.
При рассмотрении проблемы радиационной безопасности второй и третьей групп необходимо отметить, что применение рентгеновского излучения для контроля эффективности оперативного вмешательства или для диагностических целей непосредственно в процессе выполнения операций в основном имеет место при открытых репозициях костных отломков, переломах длинных трубчатых костей и внутрисуставных переломах с последующим остеосинтезом с помощью различных приспособлений (гвозди, пластик и др.) и операциях на желчных путях и пузыре (холангиография).
При рентгенографических исследованиях в процессе оперативного вмешательства применяются различные палатные (переносные) рентгеновские аппараты. Уровни облучения анестезиологов, хирургов-травматологов, хирургов-кардиологов в настоящее время колеблются от 3 (при применении автоматизированных комплексов (кардиология)) до 8 мЗв/год.
Особенно следует подчеркнуть, что при проведении сложных рентгенодиагностических исследований дозы облучения хирургов и анестезиологов могут превышать дозовые пределы для категории лиц облучения группы Б. При проведении этих исследований необходим постоянный дозиметрический контроль за облучением медицинского персонала - не рентгенологов, и нормирование числа сложных рентгенодиагностических процедур для каждого конкретного специалиста.
Уровни облучения персонала при проведении компьютерной томографии или использовании ядерно-магнитного резонанса не превышают 1 мЗв/год.
Радиационная безопасность при дистанционной гамма-терапии и терапии с помощью излучения высоких энергий. Лучевая терапия по применяемым ИИИ может разделяться на рентгеновскую, гамматерапию и терапию с помощью излучений высоких энергий.
Во всех установках используется мощный поток излучения, направленный на патологический очаг. Рентгенотерапевтические установки предназначены для глубокой или поверхностной терапии, например для лечения поражений кожи.
Гамма-терапевтические установки используются для статического облучения (пучок излучения и больной неподвижны относительно друг друга). Для подвижного облучения применяются ротационные и ротационно-конвергентные установки (пучок излучения движется по определенной траектории вокруг неподвижного больного).
При терапии с помощью ускорителей используются ускорители электронов с энергией от 4 до 50 МэВ (бетатроны, микротроны, линейные). Наибольшее распространение получили линейные ускорители с энергией излучения до 15 МэВ и бетатроны с энергией до 25 МэВ.
Для близкофокусной терапии с помощью рентгеновских аппаратов служат РУМ-7, Siemens, Philips; для длиннофокусных - РУМ-21, Stabilipan, Тoshiba и др. (рис. 5.3).
Основной профессиональной вредностью для персонала при работе с такими установками является внешнее облучение. Радиационная безопасность для персонала определяется в основном качеством стационарной защиты рабочих мест, продолжительностью работы установок в течение смены, надежностью системы по предупреждению аварийных ситуаций. Активность источников излучения в установках достигает больших величин, поэтому к конструктивным особенностям аппаратов, их размещению и эксплуатации предъявляются повышенные требования.
 Рис. 5.3. Аппарат «Рокус»
Рис. 5.3. Аппарат «Рокус»
Рентгеновские терапевтические аппараты должны иметь отдельное помещение для управления и процедурную с защищенным смотровым окном и защитной дверью между комнатой управления и процедурной. Площадь процедурной должна составлять от 24 до 40 м2 в зависимости от типа аппарата. Защита рабочих мест должна обеспечить условия, при которых мощность дозы внешнего излучения на любой точке не превышает 6,0 мкЗв/ч. Все ограждения процедурной и комнаты управления (стены, пол, потолок) должны быть усилены свинцом для защиты смежных помещений от излучения. Мощность дозы на наружных поверхностях здания и в проемах не должна превышать 1,2 мкЗв/ч.
Принципы стационарной защиты от излучения ускорителей медицинского назначения те же, но площадь процедурных увеличена до 45 м2
и выделяется комната для инженерного пульта управления площадью до 20 м2. В связи с большой проникающей способностью излучения ускорителей защита усиливается дополнительными стенами типа лабиринта, за больным наблюдают при помощи телевизионных устройств.
В кабинетах лучевой терапии защита должна обеспечить ослабление как прямого, так и рассеянного излучения до допустимых величин. Размеры процедурных комнат зависят от типа установки. При статическом облучении площадь процедурной должна составлять от 20 до 36 м2, при подвижном облучении она увеличивается до 36-45 м2. В процедурной в момент облучения больного создается высокий уровень как прямого, так и рассеянного излучения. Мощность дозы в комнате управления может резко возрасти при нарушении экранирования дверного проема между процедурной и комнатой управления, поэтому часто используют комбинированную защиту - лабиринт и защитную дверь. Обязательна автоблокировка, т.е. в момент облучения больного при заряде в положении «работа» дверь автоматически закрывается и открыть ее самостоятельно невозможно (рис. 5.4).
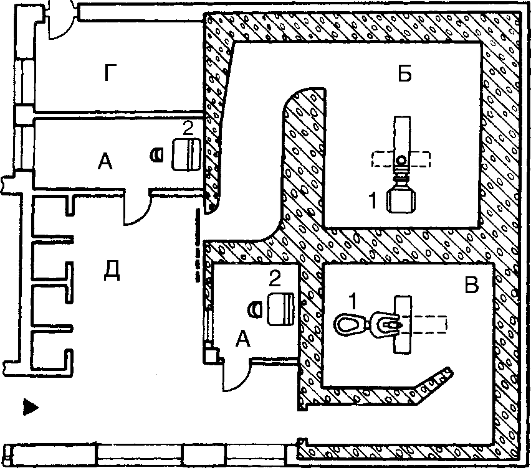 Рис. 5.4. Планировка основных помещений для глубокой и близкофокусной терапии.
Рис. 5.4. Планировка основных помещений для глубокой и близкофокусной терапии.
А - пультовая наблюдательная; Б - процедурный зал для длиннофокусной терапии; В - процедурный зал для короткофокусной терапии; Г - вентиляционная камера; Д - комната ожидания. 1 - гамма-аппарат; 2 - пульт управления.
Многолетние исследования отечественных и зарубежных авторов показали, что благодаря планировочным решениям обеспечена надежная защита персонала при эксплуатации радионуклидных терапевтических установок, рентгеновских аппаратов, ускорителей электронов, а уровни облучения не превышают 1 мЗв/год.
Радиационная безопасность при внутриполостной, внутритканевой и аппликационной лучевой терапии с помощью закрытых радиоактивных источников. В качестве закрытых источников гамма-излучения чаще всего используются препараты металлического кобальта-60, нейтронного источника калифорний-252, заключенные в оболочку из нержавеющей стали в виде игл, цилиндров, бусин. Внутриполостное облучение проводится для лечения злокачественных образований в полостных органах (матка, мочевой пузырь, пищевод и т.д.).
Активность препарата, вводимого больному, зависит от локализации и размеров поражения. Внутриполостная, внутритканевая и аппликационная терапия требует ручных манипуляций с самим препаратом (выемка из контейнера, подготовка, обвязывание марлей, стерилизация, введение препарата в полостной орган, его извлечение и т.д.).
Классическая планировка отделения закрытых радионуклидов (хранилище - манипуляционная - процедурная - палата) удлиняет транспортировку препарата, что создает возможность облучения персонала. Основной опасностью при внутриполостной терапии является внешнее гамма-излучение. Активность препаратов колеблется в широких пределах. Несмотря на то что активность источников по сравнению с активностью установок лучевой терапии очень мала, дозы, получаемые персоналом, проводящим внутриполостную терапию, выше, чем у медицинского персонала, обслуживающего гамма-установки. Эта диспропорция между активностью источников и лучевой нагрузкой персонала объясняется технологией лечебного процесса, т.е. ручными операциями с препаратом, трудностью использования экранов и защиты расстоянием и временем.
По данным индивидуально-дозиметрических измерений, персонал пяти крупнейших отделений закрытых источников ионизирующего излучения Москвы получает дозу не выше 1,2-2,3 мЗв/мес. Однако локальные дозы, в первую очередь на кончики пальцев персонала, проводящего «разрядку» и «зарядку» больных, составляют 40-100 мЗв/мес, т.е. близки к допустимым уровням и в 10-12% случаев их превосходят.
В настоящее время для полостной терапии стали применять методы последующего введения радиоизотопов. Больному в полость вводят фильтры без препаратов, представляющие собой трубку из металла или полимера. Фильтр фиксируется в полости. Затем в этот фильтр больному в палате с помощью специального препаратоводителя вводят радиоактивный изотоп. При введении препарата врач отделен от больного радиохирургической защитной ширмой. Таким же образом препарат извлекают.
Такая технология укорачивает транспортировку препарата, исключает многие радиоопасные манипуляции с ним, т.е. сокращает время введения и извлечения препарата, уменьшает число медицинского персонала, занятого в проведении этой процедуры, отпадает нужда в создании защитных стен в процедурной и манипуляционной. Дозы общего облучения врача в 5 раз, а облучения рук - в десятки раз ниже, чем при прежних способах введения препаратов.
Положительные результаты такой механизации радиотерапевтических процедур позволяют разрабатывать автоматические способы введения препаратов в полостные органы больных. В частности, созданы специальные шланговые гамма-терапевтические аппараты, при помощи которых радиоактивные препараты перемещаются сжатым воздухом из контейнера по гибким шлангам-ампулопроводам в полостные органы пациентов. После сеанса облучения препараты автоматически возвращаются в контейнер. При таком методе введения радиоактивных препаратов дозовые нагрузки на персонал будут незначительны.
Для внутритканевой лучевой терапии в пораженную ткань вводят активные препараты кобальта-60, иттрия-90, золота-198. Чаще такая терапия проводится при лечении опухолей мозга, губы, языка. Сравнительно невысокая активность используемых гамма-препаратов, кратковременность манипуляций с ними, соблюдение правил работы с радионуклидами полностью обеспечивают радиационную безопасность персонала.
Радиационная безопасность при аппликационной лучевой терапии. В качестве источников излучения используются бета-излучатели фосфор-32, прометий-147, таллий-204. Активность бета-аппликаторов, с помощью которых лечат онкологические заболевания кожи, колеблется в широких пределах и может достигать 3,7х1010 Бк. Защитные экраны для бета-излучения изготавливаются из легких материалов - оргстекла, алюминия и пр. Эти экраны обеспечивают защиту от бета-потоков, но при торможении бета-частиц в материале
экрана возникает тормозное излучение малоэнергетических квантов. Оно может вносить определенный вклад в облучение персонала. При работе с бета-излучателями целесообразно использовать комбинированные экраны, ближе к источнику они должны состоять из материалов с малым атомным номером, а дальше от источника - из материалов с большим атомным номером.
При использовании комбинированных экранов индивидуальные дозы очень малы - не превышают 4-5 мЗв/год. Опыт показывает, что простота защиты от бета-излучений часто провоцирует пренебрежительное отношение медицинского персонала к этой операции. Однако при наложении бета-аппликатора незащищенной рукой в течение 5 с доза на пальцы рук составляет 7-63 мЗв. У персонала, занимающегося лечением кожных поражений с помощью бета-аппликаторов, при несоблюдении условий защиты возможны лучевые поражения кожи рук. Использование защитных перчаток, комбинированных защитных экранов, дистанционных инструментов делает эту работу безопасной.
Принципы защиты при работе с открытыми радиоактивными источниками. Работа с открытыми радиоактивными источниками связана с опасностью воздействия проникающего излучения и попадания внутрь организма радиоактивных веществ, что приводит к возможности как внешнего, так и внутреннего облучения персонала. При работе с открытыми радиоактивными источниками возможны загрязнение рабочей обстановки, одежды и рук, попадание радиоактивных веществ в воздух, образование радиоактивных газов. Наиболее часто радиоактивные вещества поступают в организм ингаляционным путем, в меньшей степени - при загрязнении кожи рук и лица.
Наибольшую опасность представляют радиоактивные аэрозоли, которые образуются в результате радиоактивных превращений (эманация, образование активных атомов отдачи и т.д.). Важно, что образование радиоактивных аэрозолей происходит постоянно, даже тогда, когда не ведется работа, связанная с измельчением радиоактивных веществ. Низкие счетные и массовые концентрации аэрозоля в единице объема воздуха не являются гарантией отсутствия вредного биологического действия.
Задержка радиоактивных аэрозолей в легких зависит от дисперсности аэрозоля, электрозарядности частиц, химических свойств, растворимости и т.д. При работе с эманирующими веществами (радий,
торий) возможно образование радиоактивных газов, которые равномерно растворяются в крови и облучают организм.
Среди факторов радиационного воздействия при работе с открытыми источниками существенным является загрязнение кожи рук, одежды, оборудования, рабочих помещений. Некоторые радиоактивные вещества (стронций, торий, плутоний) могут проникать через неповрежденную кожу. Загрязнение рабочей зоны чаще всего происходит при нарушении правил работы с источником, а также в результате переноса загрязнения с одежды, рук, обуви на рабочие поверхности.
Многие строительные материалы (кирпич, бетон, дерево, асфальт) и покрытия (метлахская плитка, линолеум) хорошо адсорбируют радиоактивные вещества и плохо поддаются дезактивации, что усугубляет опасность лучевого воздействия на персонал.
Радионуклиды как потенциальные источники внутреннего облучения разделяются по степени радиационной опасности на 4 группы (А, Б, В, Г) в зависимости от минимально значимой активности (МЗА):
• группа А - радионуклиды с минимально значимой активностью
103 Бк (Th-природный, включая 232Th; U-природный; 240Pu) не используются в радионуклидной диагностике;
• группа Б - радионуклиды с минимально значимой активностью
104 и 105 Бк (24Na, 32P, 60Co, 90Sr, 90Y,129I);
• группа В - радионуклиды с минимально значимой активностью 106 и 107 Бк (14C, 57Co, 65Zn, 198Au);
• группа Г - радионуклиды с минимально значимой активностью 108 Бк и более (3H, 35S).
Минимально значимая активность - активность открытого источника ионизирующего излучения в помещении или на рабочем месте, при превышении которой требуется разрешение органов Роспотребнадзора на использование этого радионуклида.
Принадлежность изотопа к соответствующей группе радиационной опасности устанавливается в соответствии с Приложением П-4 НРБ-99. Короткоживущие радионуклиды с периодом полураспада менее 24 ч, не указанные в приложении, относятся к группе Г.
Все работы с использованием открытых радионуклидных источников ионизирующего излучения разделяются на три класса. Класс работ устанавливается в зависимости от группы радиационной опасности радионуклида и его активности на рабочем месте (табл. 5.3).
Таблица 5.3. Класс работ с открытыми источниками излучения
Класс работ | Суммарная активность на рабочем месте, приведенная к группе А, Бк |
I | Более 108 Бк |
II | от 105 до 108 |
III | от 103 до 105 |
Примечания:
1. При простых операциях с жидкостями (без упаривания, перегонки, барботажа и т.п.) допускается увеличение активности на рабочем месте в 10 раз.
2. При простых операциях по получению (элюированию) и расфасовке короткоживущих радионуклидов медицинского назначения из генераторов, имеющих нормативно-техническую и эксплуатационную документацию, допускается увеличение активности на рабочем месте в 20 раз. Класс работ определяется по максимальной одновременно вымываемой (элюируемой) активности дочернего радионуклида.
3. Для предприятий, перерабатывающих уран и его соединения, класс работ определяется в зависимости от характера производства и регламентируется специальными правилами.
4. При хранении открытых источников ионизирующего излучения допускается увеличение активности в 100 раз.
Предел годового поступления (ПГП) - допустимый уровень поступления данного радионуклида в организм в течение года, который при монофакторном воздействии приводит к облучению условного человека ожидаемой дозой, равной соответствующему пределу годовой дозы.
ПГП радионуклидов в организм зависит от степени опасности радиоактивных элементов при попадании внутрь и определяется радиотоксичностью.
Радиотоксичность - свойство радиоактивных изотопов вызывать большие или меньшие патологические изменения при попадании их в организм.
Основные принципы защиты при работе с открытыми радиоактивными источниками:
• при внешнем излучении используются все способы защиты, применяемые при работе с закрытыми веществами (защита количеством, временем, расстоянием, экранами);
• работа с открытыми радиоактивными веществами должна исключать их поступление в окружающую среду. Это достигается рациональной планировкой и оборудованием рабочих помещений, сани-
тарно-техническими устройствами по удалению и дезактивации жидких, твердых и газообразных радиоактивных отходов, максимальной механизацией и автоматизацией рабочих операций.
Необходимо исключить загрязнение кожи рук и лица персонала, а также рабочих поверхностей. Для этого используют средства индивидуальной защиты, санитарную обработку. Персонал должен соблюдать правила личной гигиены и техники безопасности.
При работе с открытыми радиоактивными веществами обязательны дозиметрический контроль и медицинское наблюдение за здоровьем персонала.
Планировочные мероприятия сводятся к строгому разделению помещений на радиационно «грязные» и «чистые», к созданию поточности помещений (хранилище - манипуляционная - процедурная - операционная - палаты). Для исключения загрязнения рабочей обстановки подбирают соответствующие покрытия, не адсорбирующие радиоактивные вещества, простую по конструкции, легко моющуюся мебель с гладкими поверхностями.
Герметизация аппаратуры и оборудования позволяет максимально ограничить поступление радиоактивных веществ в воздух рабочей зоны. Для этой цели используют различные камеры-боксы и вытяжные шкафы. Возможно применение средств малой механизации, автоматических пипеток, устройств для переливания жидкостей и т. д. Образующиеся радиоактивные отходы должны дезактивироваться: газообразные путем очищения через соответствующие фильтры, жидкие - выдержкой временем и разбавлением. Твердые отходы собирают в специальные емкости для отправки на централизованный пункт захоронения радиоактивных отходов.
В системе радиационной безопасности при работе с открытыми радиоактивными источниками большое значение имеют средства индивидуальной защиты. В медицинской практике используют халаты, шапочки, хлопчатобумажное белье, а также нарукавники и фартуки из эластичной и прочной пленки. Для защиты органов дыхания применяют фильтрующие респираторы типа «лепесток» из легкой синтетической ткани. Такие респираторы задерживают аэрозоли до 99,99% и могут быть одноразового пользования или кратковременного применения. После использования респиратор причисляют к твердым радиоактивным отходам.
Для защиты органов дыхания, особенно от бета-частиц и нейтронов, используют специальные щитки из оргстекла.
Все виды работ с открытыми радиоактивными источниками выполняют в резиновых перчатках. При работе перчатки не должны быть загрязнены радиоактивными веществами. Перчатки снимают с рук таким образом, чтобы их изнанка всегда оставалась внутри.
В рабочих помещениях запрещается принимать пищу, курить, пользоваться косметикой, хранить домашнюю одежду и обувь.
В случае загрязнения кожи, рабочей одежды и поверхностей необходимо немедленно вымыть руки теплой водой с хозяйственным мылом, провести дезактивацию поверхностей растворами поверхностно-активных веществ (стиральный порошок, сульфанол) или комплексообразующих соединений (аминополикарбоновые кислоты, лимонная, щавелевая кислоты и др.). Спецодежду стирают в специальных прачечных и затем подвергают дозиметрическому контролю.
Профилактика внутреннего облучения предполагает радиационный контроль, который осуществляет сотрудник радиологического отделения, прошедший специальную подготовку. Контролируют мощность дозы всех видов излучений на рабочих местах, в смежных помещениях и на территории учреждения, индивидуальные дозы облучения персонала, загрязнения рабочих поверхностей, оборудования, кожных покровов и одежды персонала, содержание радиоактивных газов и аэрозолей в воздухе. Также осуществляется наблюдение за сбором и удалением радиоактивных отходов. Применяют разнообразную дозиметрическую аппаратуру для измерения мощности доз ионизирующего излучения и уровня загрязнений, а также индивидуальные дозиметры для оценки доз облучения работающих с источниками ионизирующего излучения.
Цель медицинского контроля - выявление лиц, имеющих противопоказания для работы с ионизирующим излучением, а также обнаружение ранних признаков лучевого поражения.
Периодические медицинские осмотры проводятся не реже 1 раза в год, в случае переоблучения сотрудника или в аварийных ситуациях медицинское обследование осуществляется по показаниям.
В отделениях открытых радионуклидов широко используют меченые атомы для диагностических и лечебных целей. С помощью генераторов высокой активности получают различные меченые соединения короткоживущих радионуклидов непосредственно в медицинских учреждениях. Это позволяет исключить доставку радиоактивных веществ в больницу, не проводить некоторые радиационно опасные процедуры, сократить время на обследование больных. В настоящее
время объем радиодиагностических исследований с помощью генераторов короткоживущих радионуклидов увеличивается.
Короткоживущие радионуклиды получают в специальном генераторе, устройство которого весьма просто. В стеклянной колонке на алюминиевой подложке закрепляется радиоактивный нуклид-производитель, например молибден-99 или олово-113. Сверху в колонку нагнетают изотонический раствор хлорида натрия. Благодаря избыточному давлению происходит как бы вымывание короткоживущих радионуклидов в этот раствор (элюат). Затем элюат фильтруют, набирают в шприц и вводят больному. Вся конструкция генератора заключена в свинцовый футляр.
Элюат используется для диагностики нарушений кровообращения и визуализации полостей сердца. Можно использовать коллоидные соединения (меченый желатин, альбумин, железоаскорбиновый комплекс) для диагностики заболеваний внутренних органов и головного мозга.
Вклад в суммарную дозу облучения этой рабочей операции невысок. Дозы облучения врачей при эксплуатации генераторов в среднем составляют 1-2 мЗв/мес, медсестер - 2-2,5 мЗв/мес. Конструкция генераторов постоянно совершенствуется, что приводит к дальнейшему снижению мощностей доз на рабочих местах и сокращению длительности процедур.
В радиологических отделениях открытых радионуклидов велика доля диагностических процедур с использованием йода-131 и золота-198. Индивидуальная доза облучения медицинского персонала при манипуляциях с этими радионуклидами невелика, среднемесячные дозы облучения кистей рук персонала не превышают допустимых уровней. Однако в радиологических лабораториях отмечаются случаи радиоактивного загрязнения рабочих поверхностей и перчаток персонала. Поскольку коэффициент перехода радионуклидов с перчаток на кожный покров рук составляет 7-8% для индия-113м и до 20% для йода-131, возникает опасность внутреннего облучения персонала. Эта опасность потенциально увеличивается при использовании открытых радиоактивных источников для внутритканевой терапии. Чаще всего для этой цели используются растворы или коллоидные взвеси йода-131, золота-198 и фосфора-32.
Соединения радиоактивного йода и фосфора вводят внутрь в расчете на их накопление в критических органах. Коллоидные взвеси радиоактивного золота чаще вводят непосредственно в пораженную ткань или опухоль. В онкологических отделениях количество радионуклидов, вводимое одному больному, может достигать значитель-
ных величин. В общетерапевтических и специализированных отделениях (эндокринологические, гематологические) применяют только растворы йода-131 и фосфора-32 и в меньших количествах. Уровни облучения медицинского персонала разных отделений значительно колеблются, что определяется не только количеством радионуклида, но и видами рабочих операций с ним.
Все работы с открытыми радиоактивными источниками делятся на несколько этапов: выгрузка из машины доставленного в отделение транспортного контейнера с радиоактивным веществом, его перенос в хранилище, вскрытие транспортного контейнера, перегрузка первичной упаковки с радиоактивным веществом в рабочий контейнер, его транспортировка из хранилища в фасовочную, где проводится подготовка препарата к использованию (фасовка, стерилизация), далее транспортировка подготовленных препаратов из фасовочной в процедурную, где препарат вводят больному. Затем больного транспортируют в палату, где происходит его обслуживание, удаление радиоактивных биологических отходов, смена белья (белье доставляют в специальное помещение для выдержки в течение определенного времени в соответствии с периодом полураспада радионуклида и отправляют в прачечную). Персонал осуществляет также сбор твердых радиоактивных отходов, дезактивацию инструментария и рабочей обстановки. Все виды работ выполняют с использованием защитного оборудования, экранирующих устройств, контейнеров для сбора и хранения радиоактивных отходов, средств индивидуальной защиты и дозиметрической аппаратуры.
Величина дозовых нагрузок у персонала будет зависеть от вида рабочей операции и времени ее выполнения. Как показали исследования, среднемесячные дозы облучения всего тела у врачей в отделениях открытых радионуклидов составляют 0,3-1,5 мЗв. Локальные дозы облучения кистей рук колеблются от 10 до 14 мЗв/мес. Доза облучения глаз врачей за счет бета-потоков при работе с радиоактивным золотом может составить 0,7-1 мЗв/мес.
В лечебной практике широко используются радоновые ванны. В 60 физиотерапевтических отделениях больниц проводится радонотерапия. На курортах радоновые источники естественного происхождения, в городах используют искусственные радоновые ванны.
Радон является продуктом распада радия, его получают в специальных кустовых радоновых лабораториях. С этой целью раствор радия помещают в специальный барботер, где образуется радон, насыщающий определенный объем воды. Из барботера раствор радо-
на переливают в бутыли и встряхивают до полного растворения газа. Далее этот концентрированный раствор фасуют в порционные склянки, каждая из которых рассчитана на одну ванну. Эти склянки в специальной упаковке доставляют в учреждения, где отпускают радоновые ванны. Основным радионуклидом радоновой ванны является газ - радон-222, дающий альфа-излучение с периодом полураспада 3,8 дня. Кроме радона в воде содержатся дочерние продукты его распада с периодом полураспада не более 26,8 мин.
В радоновых лабораториях основную опасность для персонала представляет внешнее гамма-излучение от барботеров и бутылей с концентрированным раствором радона и внутреннее - в результате загрязнения воздуха альфа-активным радоном и продуктами его распада.
Мощность дозы гамма-излучения при приготовлении раствора радона различна, но не превышает допустимых величин.
Концентрация радона в воздухе также невысокая и обычно составляет 0,1-0,3 ПДК. Загрязненность альфа-активными радионуклидами рабочих поверхностей не превышают 3-5 альфа-частиц/(см2 мин). Кожные покровы рук персонала, как правило, не загрязнены.
Таким образом, при современных методах использования радиоактивных веществ в медицинской практике основную радиационную опасность представляет внешнее облучение. Известную опасность для окружающих могут представлять больные, получившие медицинские процедуры с радиоактивными веществами в поликлинических условиях.
Например, при амбулаторном лечении радиоактивным йодом мощность дозы гамма-излучения от щитовидной железы больного, получившего 3,7х107 Бк йода-131, на 2-е сутки составляет около 5 мкЗв/ч на расстоянии 0,5 м. С начала 2-х суток мощность дозы уменьшается и к 5-м суткам имеет практически незначительную величину. Это значит, что некая опасность внешнего облучения от такого больного может сохраняться лишь в течение первых 2 сут после приема радиоактивного йода. При большей активности принятого радиоактивного йода значительные уровни загрязнения отмечались на полу в санузлах и на одежде больных.
Амбулаторное лечение радиоактивным йодом возможно при назначении на курс строго регламентированного количества радионуклида, использовании индивидуальной постели и предметов туалета, исключении приготовления пищи для членов семьи и тесного контакта с маленькими детьми.
Сроки выписки больных должны быть приурочены к моменту, когда мощность дозы на расстоянии 1 м от больного не будет превышать допустимых уровней.
Радиологическое отделение открытых радионуклидов является источником образования сточных вод, в которых содержатся радиоактивный йод и фосфор. Известно, что с выделениями больного в 1-е сутки удаляется около 35-40% введенной активности. Один больной в течение 48 ч может выделить значительное количество радионуклида, для разведения которого до допустимых концентраций потребуется от 1000 до 38 000 м3 воды. В радиологических отделениях устраивают несколько отстойников-смесителей объемом, сопоставимым с суточным расходом воды в течение 2-4 сут, где сточные воды выстаиваются и разбавляются с целью снижения концентрации радиоактивных веществ до величин, приближающихся (в пределах одного порядка) к ПДК. После контрольных измерений сточные воды спускают в общегородскую канализацию.
5.5. ОРГАНИЗАЦИЯ МЕДИЦИНСКОГО ОБСЛУЖИВАНИЯ ЛИЦ, РАБОТАЮЩИХ С ИСТОЧНИКАМИ ИОНИЗИРУЮЩИХ ИЗЛУЧЕНИЙ
Предварительные и периодические медицинские осмотры лиц, работающих с источниками ионизирующих излучений
Эта деятельность регламентируется соответствующим законодательством: приказом Минздравмедпрома РФ от 14 марта 1996 г. ? 90 «О порядке предварительных и периодических медицинских осмотров работников и медицинских регламентах допуска к профессии»; приказом Минздравсоцразвития РФ 2004 г. ? 83 «Об утверждении перечня вредных и/или опасных производственных факторов и работ, при выполнении которых производятся предварительные и периодические медицинские осмотры (обследования)».
(Подробнее см. разд. 11.7.)
• При предварительном медицинском осмотре (медицинском освидетельствовании) в настоящее время решаются следующие задачи: сбор исходных данных о состоянии здоровья работающих, которые необходимы для получения информации о характере и причине возможных последующих отклонений от нормы;
• недопущение к работе лиц, контакт которых с источниками излучения может вызвать у них расстройство здоровья или обострить и ухудшить течение имеющегося заболевания.
Материалы предварительных медицинских осмотров, в которых принимают участие терапевт, невропатолог и окулист (могут привлекаться гинеколог, отоларинголог и др.), служат также исходными материалами при оценке возможных изменений в состоянии здоровья работающих в будущем.
Цели периодических медицинских осмотров следующие:
• раннее распознавание и профилактика различных общесоматических заболеваний, в том числе препятствующих работе с источниками ионизирующих излучений;
• клиническая оценка общего состояния работающих различных профессиональных групп, необходимая для обоснованной системы лечебно-профилактических мероприятий и организации диспансерного наблюдения и рационального трудоустройства;
• своевременное выявление начальных отклонений профессионального характера, выбор и проведение необходимых, в основном профилактических, мероприятий, предотвращающих их прогрессирование.
В соответствии с общей характеристикой условий труда (для работающих) и уровнями облучения (население) весь контингент может быть подразделен на несколько групп с определенным объемом медицинского наблюдения за каждой из них. Для оценки доз облучения от внешних источников и лиц, в организм которых могут поступать различные нуклиды, как правило, выделяют 3 группы работающих по уровню профессиональной лучевой нагрузки. Они в основном соответствуют прогнозируемой характеристике состояния их здоровья. Иногда по сочетанию или своеобразию условий труда формируют еще 1-2 группы.
При выявлении у работающих функциональных изменений, обусловленных специфическим фактором, в целях уточнения диагноза или проведения лечения обследуемые направляются в клиники институтов профзаболеваний, медицинских институтов и другие лечебные учреждения. Основные данные предварительных и периодических медицинских осмотров, а также результаты динамического наблюдения за состоянием здоровья работающих и другие сведения кратко регистрируют в амбулаторной карте.
Результаты динамического наблюдения за состоянием здоровья лиц, работающих с ионизирующими излучениями, врач обязан систе-
матически анализировать и не реже 1 раза в год представлять отчет на специальное совещание с участием администрации предприятия.
На основании данных проведенного периодического медицинского осмотра намечают лечебно-профилактические и санитарногигиенические мероприятия. Лечебно-профилактические мероприятия включают:
• диспансерное наблюдение за выделенной группой работников (или конкретно за 1 работником);
• рекомендации по поводу направления в санаторий, дом отдыха, профилакторий;
• рекомендации по поводу назначения диетического питания;
• указание о необходимости временного или постоянного изменения характера работы (с рекомендацией рационального трудоустройства); предоставления внеочередного отпуска;
• рекомендации по поводу режима труда и отдыха.
Целью санитарно-гигиенических мероприятий является улучшение условий труда на производстве.