Экология человека: учебник для вузов / Под ред. Григорьева А.И. 2008. - 240 с.
|
|
|
|
ГЛАВА 9. ЭНДОЭКОЛОГИЯ
В главе рассмотрен метаболический статус организма, участвующие в детоксикации органы и системы, основные механизмы детоксикации и фазы детоксикации в ЖКТ, печени, почках, лёгких.
Эндотоксемия - синдром, характеризующийся избыточным содержанием в крови токсичных продуктов и биологически активных веществ (БАВ). Эндотоксемия наблюдается и при нормальном физиологическом состоянии, связанном с транспортировкой эндотоксинов к органам детоксикации и выведения. Здоровый организм способен нейтрализовать действие эндогенных токсинов и не допустить клинических проявлений. К факторам, влияющим на развитие эндогенной интоксикации, относятся:
- недостаточность детоксикационной, экскреторной и синтетической функций печени; экскреторной функции почек и кишечника; нереспираторных функций лёгких;
- иммунологическая недостаточность;
- угнетение систем естественной резистентности и антиоксидантной защиты.
Классификация эндотоксинов, приводящих к развитию эндотоксемии, приведена на рис. 9-1.

Рис. 9-1. Классификация эндотоксинов (С.А. Симбирцев и Н.А. Беляков,
Метаболический статус определяется количественным и качественным соотношением веществ средней молекулярной массы, рас- пределённых в биологических средах организма.
К веществам средней молекулярной массы относят:
- регуляторные и нерегуляторные пептиды;
- вещества низкой и средней молекулярной массы небелкового происхождения - продукты метаболизма;
- вещества извращённого метаболизма;
- токсичные компоненты полостных сред организма.
• Концентрация веществ средней молекулярной массы в крови здоровых людей достаточно стабильна. Она значительно возрастает при многих патологических и предпатологических состояниях.
• Вещества средней молекулярной массы подразделяют на катаболическиие и анаболические. Они распределяются в крови между белками-носителями плазмы и гликокаликсом эритроцитов, способными транспортировать эти вещества. Основная масса среднемолекулярных веществ удаляется из организма через почки путём клубочковой фильтрации.
• Длительное увеличение пула веществ средней молекулярной массы приводит к повреждению клеток почечных канальцев и даже к их гибели.
• Проявления биологической активности веществ средней молекулярной массы весьма разнообразны:
- нейротоксическая активность;
- участие в развитии состояния вторичной иммунодепрессии (замедляют реакции бластотрансформации и розеткообразования лимфоцитов);
- токсическое действие на эритропоэз;
- угнетение синтеза белка;
- изменяют проницаемость мембран и мембранный транспорт;
- нарушают тканевое дыхание;
- вызывают нарушение микроциркуляции и лимфодинамики с развитием шокового лёгкого и отёка лёгких.
По мере нарастания интоксикации происходит значительное увеличение веществ катаболического пула (рис. 9-2).
Степень депонирования токсических метаболитов тем выше, чем ниже функциональная активность органов детоксикации и выведе- ния.
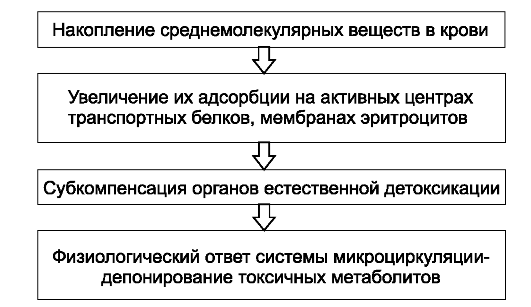
Рис. 9-2. Накопление веществ катаболического пула
МЕХАНИЗМЫ ДЕТОКСИКАЦИИ
В основе биологической детоксикации лежат три основных механизма.
• Биологическая трансформация токсичных субстанций - ведущее значение в её реализации имеет монооксигеназная система печени.
• Системы связывания и транспорта токсичных субстанций, обусловленные функционированием иммунной системы, адсорбционными возможностями эритроцитов и транспортными способностями сывороточных альбуминов.
• Элиминация токсичных субстанций, что обеспечивается функционированием почек, печени, лёгких, ЖКТ, кожи.
Стадии эндотоксемии
Определение степени и тяжести эндогенной интоксикации основано преимущественно на выраженности токсемии. Выделяют четыре стадии эндотоксемии.
• I стадия (лёгкая степень): начальная гиперкоагуляция, умеренное увеличение БАВ и активация ПОЛ, гиперактивация антиоксидантной активности супероксидисмутазы, активация системы кровообращения; компенсированный респираторный ацидоз; умеренное угнетение клеточного звена и умеренная активация гуморального звена иммунитета.
• II-IV стадии эндогенной интоксикации (от средней тяжести до крайне тяжёлой) характеризуются нарастанием гиперкоагуляции, сначала высоким ростом БАВ, затем их снижением, гиперактивацией ПОЛ с истощением антиокислительной активности, падением активности системы кровообращения, явлениями декомпенсированного метаболического ацидоза, угнетением клеточного и гуморального звеньев иммунитета. Развивающая эндогенная интоксикация ведёт к нарушению периферической микроциркуляции и предполагает задержку токсинов в тканях.
Факторы, способствующие и инициирующие развитие эндогенной интоксикации:
- ишемические нарушения в органах;
- нарушения функции органов детоксикации и экскреции (печень, почки, лёгкие, ретикуло-эндотелиальная система, кишечник);
- повреждения эпителиальных покровов и массивные разрушения тканей;
- экзотоксикозы;
- иммуносупрессия и недостаточность системы неспецифической резистентности, включая фагоцитоз;
- инфекции;
- свободно-радикальное окисление.
Свободные радикалы
В формирование процесса эндогенной интоксикации вносит существенный вклад такой неспецифический процесс, как свободно-радикальное окисление. В тканях организма постоянно образуются свободные радикалы, в высоких концентрациях оказывающие повреждающее действие на клеточные мембраны. Основным субстратом свободно-радикального окисления служат ненасыщенные липиды.
Нормальный уровень процессов свободно-радикального окисления регулируется антиоксидантной системой, обеспечивающей связывание и модификацию свободных радикалов.
В состав антиоксидантной системы входят витамины, ферменты, природные антиоксиданты и другие сложные вещества. Особое место в антиоксидантной системе занимают естественные антиоксидантные ферменты и соединения: супероксидисмутаза, каталаза, глутатионредуктаза, трасферрин, глутатион.
Процессы свободно-радикального окисления особенно усиливаются при действии на организм неблагоприятных факторов хими- ческой и физической природы, стрессовых ситуаций.
Пути снижения уровня эндотоксемии
Метаболический гомеостаз в организме человека обеспечивается общей системой естественной детоксикации организма, стимуляция которой наиболее эффективна на начальных стадия эндогенной интоксикации. Система естественной детоксикации включает:
- систему крови (белки и форменные элементы);
- детоксикационные системы печени (микросомальную - с участием ферментов Р450 и макросомальную в составе раз- личных неспецифических ферментов для биотрансформации гидрофобных и гидрофильных веществ);
- систему экскреторных органов (ЖКТ, почки, лёгкие, кожа), где также происходит частичная биотрансформация токсич- ных веществ.
Нормальная функция системы естественной детоксикации даёт достаточно надёжное очищение организма от токсичных экзогенных веществ при их концентрации в крови, не превышающей критический уровень. В противном случае происходит накопление молекул токсичного вещества на рецепторах токсичности с перегрузкой последних и развитием картины токсемии.
Одна из причин развития эндогенной интоксикации - поражение слизистых оболочек ЖКТ, отделяющих агрессивное содержимое от кровеносного и лимфатического сосудистого русла. Многокомпонентный, многоуровневый барьер слизистых оболочек представлен на рис. 9-3.
• 1 - просветный (надэпителиальный) уровень:
- секреты специализированных клеток Панета (пепсин, слизь, биологически активные вещества и др.);
- пристеночная микрофлора;
- фагоцитарная активность мигрировавших микро- и макрофагов.
Этот уровень обладает способностью к саморегуляции и зависит от состояния эпителиального уровня.
• 2 - эпителиальный уровень (структуры эпителиальной выстилки):
- многослойный плоский эпителий (механическая функция в полости рта, пищевода);
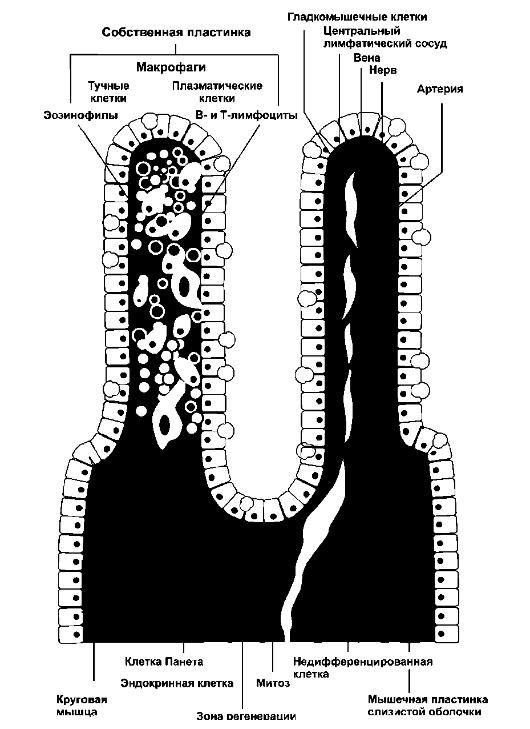
Рис. 9-3. Строение эпителия слизистой оболочки кишечника
- преимущественно секретирующий эпителий (желудок);
- преимущественно всасывающий эпителий (кишечник). Функционирование этого уровня зависит от состояния эпите-
• лиоцитов, а также состояния базальной мембраны, пропускающей различные вещества и микроорганизмы, и наличия внутриэпителиальных иммунокомпетентных клеток. 3 - соединительнотканный уровень:
- основное межклеточное вещество, волокна и синтезирующие клетки;
- иммунокомпетентные клетки:
■ фагоциты (микро-макрофаги);
■ клетки, секретирующие неспецифические факторы защиты и БАВ (тучные клетки, эозинофилы);
■ клетки, синтезирующие специфические факторы защиты (плазматические клетки);
■ структуры стенок сосудов микроциркуляторного русла (перициты, базальная мембрана, эндотелий).
Взаимосвязь этих трёх уровней осуществляется транспортом клеток и секретов: из 2-го в 1-й, а из 3-го во 2-й.
Полость рта и пищевод способны сохранять свои барьерные функции при условии механической непрерывности, что часто нарушает- ся при разрыхлении слизистой полости рта под влиянием различных патогенных факторов.
Желудок, как элемент пищеварительного барьера, весьма уязвим, так как его защитный слой представлен одним слоем секретирующего эпителия. В формировании барьерной функции кишечника играют роль, кроме слизистой, пристеночные микроорганизмы, которые тесно взаимодействуют с эпителиоцитами. Здесь все три уровня защиты наиболее лабильны.
Когда просветный барьер оказывается несостоятельным, микроорганизмы могут проникать в эпителиальный пласт, разрушая клеточные пространства.
Интенсивность воздействия токсичных веществ повышается при имеющихся преморбидных нарушениях функции основных систем детоксикации, особенно печени, почек и иммунитета (ситуационная токсичность), а также у больных пожилого и старческого возраста. Аналогичные токсические эффекты развиваются тогда при концентрации вещества в крови меньшей, чем пороговая. Во всех этих случаях возникает необходимость повышения эффективности и поддержки работы общей системы естественной детоксикации организма для ускоренного его очищения.
ПЕЧЕНЬ
Разработка проблемы увеличения хронических поражений печени химической этиологии в структуре общей заболеваемости и смертности имеет важное практическое значение.
Согласно материалам ВОЗ, частота токсических поражений печени в мире с
ДЕЗИНТОКСИКАЦИОННАЯ ФУНКЦИЯ ПЕЧЕНИ
В сложившихся условиях обитания организм человека приспосабливается к токсическому действию чужеродных веществ путём использования сформировавшихся в процессе эволюции барьерных механизмов (рис. 9-4).
Специальная ферментная система, при участии которой протекает биотрансформация жирорастворимых ксенобиотиков, попадаю- щих в организм через кровь, ЖКТ, лёгкие или кожу, получила название многоцелевых оксидаз (микросомальных монооксигеназ).
Процессы биотрансформации осуществляются главным образом с помощью энзимных систем печени, которые участвуют в обезвре- живании ксенобиотиков и встроены в мембраны гладкого эндоплазматического ретикулума гепатоцитов. Это позволяет рассматривать эндоплазматический ретикулум гепатоцитов в качестве метаболического барьера, играющего важную роль в защите внутренней среды организма.
Набор микросомальных ферментов печени обладает весьма большой мощностью и относительно невысокой специфичностью, что позволяет им участвовать также в процессах метаболизма биохими-
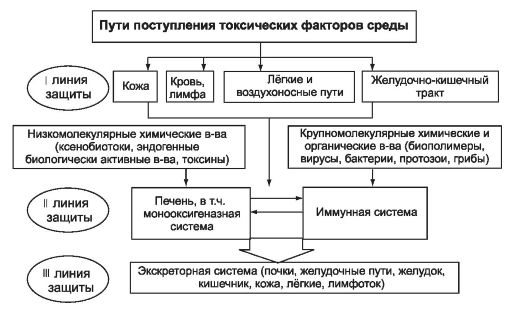
Рис. 9-4. Схема функционального взаимодействия основных барьерных систем, обеспечивающих охрану чистоты внутренней среды организма
ческих субстратов эндогенного происхождения: гормонов, жирных кислот, холестерина, жёлчных кислот, простагландинов. Химические вещества обезвреживаются в два этапа:
- путём ферментативного окисления, восстановления, метилирования, ацетилирования, гидролиза;
- последующей конъюгации с рядом веществ (глюкуроновой, серной и уксусной кислотами, глицином, таурином и др.).
Большинство реакций биотрансформации связано с процессами окисления, где главным ферментом является цитохром Р450. В фер- ментативном каскаде многоцелевых оксидаз он играет роль конечной оксидазы, принимающей электроны, необходимые для последующей активации кислорода, используемого для окисления метаболизируемых субстратов. Содержание данного фермента в организме составляет около 1% печёночных белков или 20% белка эндоплазматического ретикулума гепатоцитов.
Последовательность метаболических превращений чужеродных веществ в организме осуществляется следующим образом.
• В результате первой фазы биотрансформации ксенобиотиков образуются метаболиты, характеризующиеся большой полярностью за счёт содержания в них нуклеофильных группировок.
• Далее метаболиты ксенобиотиков могут вступать во вторую фазу биотрансформации - реакции конъюгации (глюкуронидизацию, сульфатирование, метилирование, ацетилирование и т.д.). Образующиеся при этом конъюгаты относительно легко растворимы в воде и быстро экскретируются из организма через почки и жёлчные пути. Они не проявляют физиологической активности, благодаря чему эту фазу биотрансформации называют истинной детоксикацией.
При биотрансформации ксенобиотиков происходит образование активной формы кислорода, что способствует возрастанию активности ПОЛ. Это может привести к нарушению структурно-функциональной целостности клеточных мембран.
В данном контексте важно выделить ещё одну функцию печени: депонирование и перераспределение эндогенных антиоксидантов, способствующих гашению процессов ПОЛ, о чём свидетельствует достоверное снижение показателей антиокислительной активности липидов на фоне ухудшения функционального состояния печени в процессе адаптации при её поражении.
Таким образом, поддержание химического гомеостаза организма осуществляется с помощью трёх взаимосвязанных механизмов:
- системы микросомальных монооксигеназ;
- реакций конъюгации;
- системы ферментативных и неферментативных антиоксидантов, обеспечивающих купирование токсического действия активных форм кислорода и перекисей липидов.
На фоне структурных повреждений паренхимы печени и её функциональной недостаточности активность микросомальных фермен- тов гепатоцитов снижается, что может привести к неполному обезвреживанию эндогенных продуктов метаболизма и, следовательно, к накоплению в органах и тканях организма соединений, предрасполагающих к возникновению токсических и аллергических поражений. Известно, что незавершённый метаболизм ряда белковых структур, фармакологических препаратов и других низкомолекулярных химических соединений в печени может вести к возникновению общих и местных аллергических реакций в организме и развитию интоксикации.
Длительное напряжение защитных биотрасформационных механизмов печени у лиц, постоянно контактирующих с вредными химическими веществами, может с течением времени создавать бла- гоприятную почву для срыва компенсаторно-приспособительных процессов в печени и развития в ней и в функционально взаимодействующих с нею органах патологических изменений.
Увеличение частоты нарушений функционального состояния печени наблюдают у лиц, работающих:
- на производстве стирола и метилметакрилата;
- акрилонитрильного каучука;
- в порошковой металлургии;
- в условиях повышенных концентраций сероуглерода;
- нефтехимических предприятий;
- у работников сельского хозяйства, контактирующих с кормовыми добавками, с пестицидами и ядохимикатами;
- у пилотов и техников, занятых на авиационно-химических работах;
- на других видах производств, связанных с воздействием на организм различных химических веществ.
Роль печени в компенсаторно-приспособительных реакциях организма
Участие печени в осуществлении и регулировании всех основных звеньев межуточного обмена определяет её важную роль в поддержании гомеостаза. Именно эта сторона деятельности печени пред- ставляется весьма значительной для функционирования организма в экстремальных условиях окружающей среды (рис. 9-5).
Факторы окружающей среды Химические Физические Психические Биологические
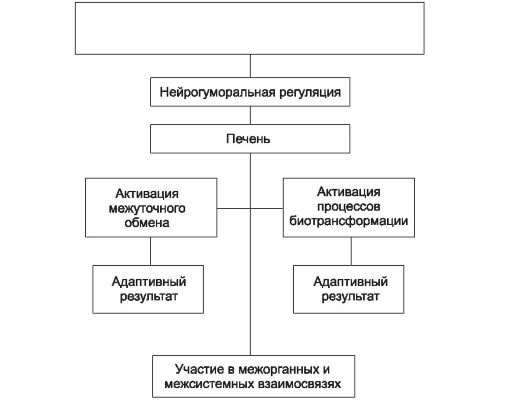
Рис. 9-5. Схема участия печени в компенсаторно-приспособительных реакциях организма
• Роль печени в обмене белков.
- В печени синтезируются 95% альбуминов, 85% глобулинов, 100% фибриногена, транскортин, трансферрин, церулоплазмин, важнейшие белки свёртывания крови.
- Большинство белков-ферментов, оказывающих регулирующее действие на многие стороны обменных процессов в организме, также синтезируется или активируется в печени. Кроме того, печени принадлежит ведущее место в синтезе гликопротеидов.
• Роль печени в углеводном и липидном обмене.
- Печень принимает участие в образовании глюкозы, в метаболизме жирных кислот (интенсивный синтез и окисление), в преобразовании жирных кислот в триглицериды и фосфолипиды.
- Печень является главным местом формирования основной транспортной формы липидов - липопротеидов, триглицеридов, в значительной мере хиломикронов, а также синтеза и регулирования активности ферментов, участвующих в метаболизме липопротеидов. Это относится к образованию как липопротеидов очень низкой плотности, так и липопротеидов высокой плотности.
- Все этапы обмена холестерина (синтез, ассимиляция, этерификация, окисление, распад и выделение из организма) осуществляются в печени. В печени также протекает синтез холестеринэстеразы и лецитин-холестерин-ацилтрансферазы, обеспечивающих процесс этерификации холестерина.
Таким образом, важное значение печени в межорганных и межсистемных взаимодействиях организма не подлежит сомнению, поскольку от характера протекания и надёжности осуществляемых в печени процессов функционального синтеза пластических и энергетических веществ в значительной мере зависит полноценное функционирование других органов и систем и приспособление организма к воздействию неблагоприятных факторов окружающей среды.
Роль печени в адаптационных реакциях
Процесс адаптации к экстремальным влияниям окружающей среды закономерно сопровождается увеличением потребности в энер- гетическом обеспечении функций организма. Энергообеспечение организма осуществляют несколько путей: распад гликогена, глюконеогенез и активизация липидного обмена.
Печень является единственным органом, который выделяет глюкозу для обеспечения энергией других органов и систем организма, в том числе скелетных и сердечной мышц, а также мозга и нервных структур, которые используют около 70% глюкозы, выделяемой печенью.
В аварийную фазу стрессорного напряжения происходит относительно быстрое повышение уровня глюкозы в крови, величина кон-
центрации которой зависит от запасов гликогена в печени. Фермент глюкозо-6-фосфатаза, регулирующий распад гликогена, содержится в основном в печени, где при его участии происходит образование глюкозы «на экспорт».
В печени осуществляется также пентозный цикл, который играет важную роль в пластическом и энергетическом обеспечении функ- ций организма. Активация углеводпродуцирующей функции печени - универсальный механизм энергообеспечения - закономерно наблюдается при адаптации организма к стрессу. Другой важный механизм обеспечения организма энергией - глюконеогенез.
В качестве дополнительных источников исходного материала для ресинтеза расходуемых организмом гликогена и глюкозы выступают цикл Кори (преобразование в печени в гликоген и глюкозу почти 80% молочной кислоты, накапливающейся в организме при интенсивной мышечной работе и при воздействии холода) и аланиновый цикл (из пирувата образуется аланин, который, как и лактат, используется в глюконеогенезе).
Печень принимает участие в регулировании и контроле соотношения между уровнем потребления и синтеза жиров в организме и процессами образования их резервов в других тканях. Важно подчеркнуть, что жир в организме человека - главный запасной источник энергии, а процессы адаптации организма к различным экстремальным факторам среды и длительным нагрузкам, как правило, сопровождаются активацией жирового обмена.
Роль синтетической деятельности печени существенно возрастает при следующей фазе стресса - фазе резистентности, когда значительно повышается потребность организма в структурных липидах и белках.
Эта фаза адаптационного синдрома, в противоположность первой, характеризуется усилением анаболических процессов. Для осуществления восстановительных процессов большое значение имеют синтезируемые в печени фосфолипиды и холестерин - важные структурные компоненты клеточных биомембран.
Пластическое
обеспечение реакций восстановления осуществляется посредством синтеза в
гепатоцитах белков, в частности, альбуминов. Этот резерв может быть
весьма значителен, если учесть, что печень человека в течение суток
способна синтезировать 40-
Особое значение печени в осуществлении компенсаторно-приспособительных реакции организма подчёркивается тем, что гепатоци-
ты, в отличие от клеток других органов, обладают полным набором ферментов, участвующих в обмене аминокислот.
В третью фазу адаптационного синдрома может возникать истощение и снижение обеспечивающей деятельности печени и тем самым создаются предпосылки для возникновения предпатологических изменений как в самой печени, так и других органах и тканях в результате длительно поддерживаемого напряжения синтетических функций печени.
ПОЧКИ
В процессе метаболизма белков и нуклеиновых кислот образуются различные продукты азотистого обмена (мочевина, мочевая кислота, креатинин и др.).
Экскреторная функция почек
Почки играют ведущую роль в выделении из крови нелетучих конечных продуктов обмена и чужеродных веществ, попавших во внутреннюю среду организма.
Мочевая кислота в почках фильтруется в клубочках, а затем реабсорбируется в канальцах; часть мочевой кислоты секретируется клетками в просвет нефрона.
Образующийся в течение суток креатинин, источником которого служит креатинфосфорная кислота, выделяется почками. Его суточная экскреция зависит не столько от потребления мяса с пищей, сколько от массы мышц тела. Креатинин, как и мочевина, свободно фильтруется в почечных клубочках, и с мочой выводится весь профильтровавшийся креатинин.
Помимо перечисленных, имеется много разнообразных веществ, постоянно удаляемых почками из крови: гормоны (глюкагон, паратгормон, гастрин), ферменты (рибонуклеаза, ренин), производные индола, глюкуроновая кислота и др.
Существенно, что физиологически ценные вещества при их избытке в крови начинают экскретироваться почкой. Это относится как к неорганическим, так и к органическим веществам - глюкозе, ами- нокислотам. Повышенная экскреция этих веществ может в условиях патологии наблюдаться и при нормальной концентрации в крови, когда нарушена работа клеток, реабсорбирующих то или иное профильтровавшееся вещество из канальцевой жидкости в кровь.
Метаболическая функция почек
Почки участвуют в обмене белков, липидов и углеводов. Данная функция обусловлена участием почек в обеспечении постоянства концентрации в крови ряда физиологически значимых органических веществ.
• В почечных клубочках фильтруются низкомолекулярные белки и пептиды. Клетки проксимального отдела нефрона расщепляют их до аминокислот или дипептидов и транспортируют через базальную плазматическую мембрану в кровь. Это способствует восстановлению в организме фонда аминокислот, что важно при дефиците белков в рационе. При заболеваниях почек эта функция нарушается.
• Почки способны синтезировать глюкозу путём глюконеогенеза. При длительном голодании почки могут синтезировать до 50% от общего количества глюкозы, образующейся в организме и поступающей в кровь.
• Почки синтезируют фосфатидилинозит - необходимый компонент плазматических мембран.
ЛЁГКИЕ
Кроме газообменной функции, лёгкие выполняют и ряд других, негазообменных функций. Через лёгкие проходит вся кровь, что обеспечивает им роль своеобразного фильтра БАВ в крови артериального русла. Важная роль в трансформации БАВ принадлежит эндотелию лёгочных капилляров, обладающему поглотительным и ферментным механизмами. Первый механизм обеспечивает поступление биологической субстанции в клетку, где эта субстанция депонируется, а затем подвергается инактивации ферментами. Второй механизм обеспечивает деградацию БАВ без стадии депонирования путём контакта их с фиксированными на поверхности эндотелия ферментами.
Недыхательные функции лёгких
• Выделительная - удаление воды и некоторых летучих веществ: ацетона, этилмеркаптана, этанола, эфира, закиси азота.
• Выработка БАВ. В эндотелии лёгочных сосудов сосредоточены ферменты, которые осуществляют синтез тромбоксана В2 и простагландинов. Лёгкие также играют важную роль в регуляции агрегатного состояния крови благодаря своей способности
синтезировать факторы свёртывающей и противосвёртываю- щей систем (тромбопластин, факторы VII, VIII, гепарин и др.). Лёгкие - основной источник тромбопластина: в зависимости от концентрации тромбопластина в крови они увеличивают или уменьшают его выработку.
• Инактивация БАВ. Эндотелий капилляров лёгких инактивирует за счёт поглощения и ферментативного расщепления многие БАВ, циркулирующие в крови: серотонин, ацетилхолин и норадреналин. Лёгкие обладают самой мощной ферментной системой, разрушающей брадикинин: более 80% брадикинина, введён- ного в лёгочный кровоток, разрушается при однократном прохождении крови через лёгкое. В лёгких инактивируется 90-95% простагландинов группы Е и F. В мелких углублениях (кавеолах) на внутренней поверхности лёгочных капилляров локализуется большое количество ангиотензинпревращающего фермента, который катализирует процесс превращения ангиотензина I в ангиотензин II.
Лёгкие обеспечивают как синтез, так и деструкцию белков и липидов с помощью ферментов. Здесь же подвергаются разрушению
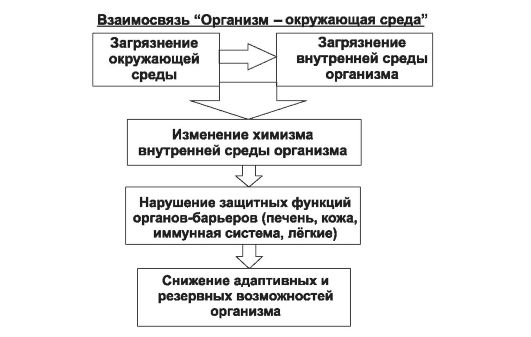
Рис. 9-6. Схематическое представление о последствиях загрязнения внутренней среды организма
содержащиеся в крови агрегаты клеток, капли жира, тромбоэмболы и бактерии.
В заключение следует сказать, что загрязнение внутренней среды организма в результате поступления подпороговых, но длитель- но действующих экзотоксинов приводит к снижению резервных возможностей организма. Это, в свою очередь, вызывает развитие различной патологии и снижает качество здоровья последующих поколений и продолжительность жизни (рис. 9-6).
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ
1. Дайте определение эндотоксемии.
2. Какие вещества являются эндотоксинами?
3. Какие механизмы биотрансформации вы знаете?
4. Назовите проявления биологической активности веществ средней молекулярной массы.
5. Какие существуют механизмы биологической детоксикации в организме человека?
6. Назовите фазы развития эндогенной интоксикации и стадии эндотоксемии.
7. Какие системы естественной детоксикации вы знаете?
8. В чём заключается дезинтоксикационная функция печени?
9. Каким образом печень участвует в компенсаторно-приспособительных реакциях организма?
10. В чём заключается экскреторная функция почек?