|
|
|
|
Глава 1. Общая физиология возбудимых тканей
Липиды
Липиды, широко представленные в клетках организма, это молекулы, состоящие преимущественно из атомов углерода и водорода. Поскольку эти атомы связаны нейтральными ковалентными неполярными связями, липиды неполярны и имеют очень низкую растворимость в воде, что является характерным свойством этого класса органических молекул. Основные подклассы липидов - жирные кислоты, нейтральные жиры (иначе, ацилглицерины или глицериды), стероиды. Наиболее распространенные липиды мембран - это глицеринзамещенные и сфингозинзамещенные липиды, а также гликолипиды и представители стероидов - стерины.
Жирные кислоты
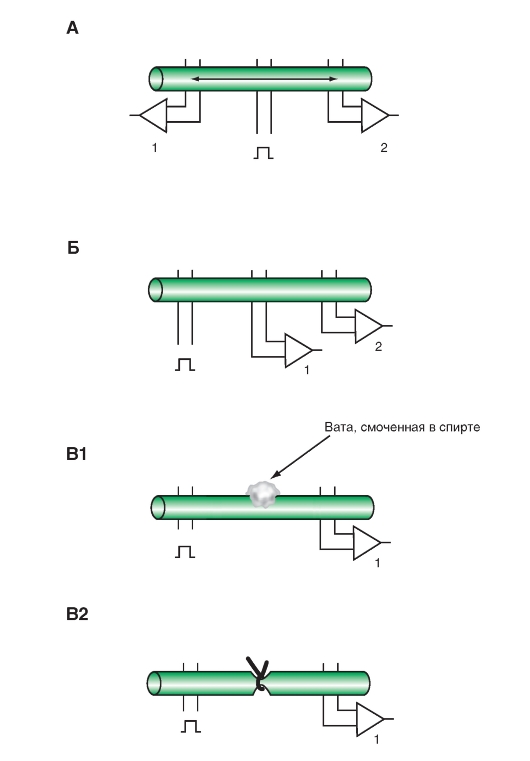
Молекулы жирных кислот - длинные углеводородные цепи с концевой карбоксильной группой. Типичный пример жирных кислот представлен на рис. 1-1, А, Б.
Вследствие того, что жирные кислоты в организме синтезируются путем соединения двухуглеродных фрагментов, большинство жирных кислот имеет четное число углеродных атомов, от 14 до 22.
Если все атомы углерода в жирных кислотах связаны одинарными ковалентными связями, то такая жирная кислота называется насыщенной жирной кислотой. Некоторые жирные кислоты содержат одну или больше двойных связей, и тогда они называются ненасыщенными. Если у жирной кислоты имеется одна двойная связь, то она называется мононенасыщенной кислотой. Когда таких связей более одной, то говорят о полиненасыщенной жирной кислоте.
Насыщенные и ненасыщенные жирные кислоты различаются по своей структурной конфигурации. В насыщенных жирных кислотах углеводородный
хвост может принимать множество конформаций вследствие свободы вращения вокруг каждой одинарной связи (рис. 1-1, В), однако наиболее вероятна конфигурация вытянутой формы, как энергетически наиболее выгодная.
В ненасыщенных жирных кислотах невозможно вращение вокруг двойной связи, и это обусловливает жесткий изгиб углеводородной цепи (рис. 1-1, Г, Д). В ненасыщенных жирных кислотах цис-конфигурация двойной связи создает изгиб алифатической цепи под углом примерно 30° (рис. 1-1, Г). При транс-форме двойной связи конформация углеводородной цепи мало отличается от конформации насыщенной цепи
(рис. 1-1, Д).
Нейтральные жиры
Глицериновые эфиры жирных кислот называют нейтральными жирами, ацилглицеринами или глицеридами. Они составляют главный компонент жиров, запасаемых в клетках. Структурной основой этих липидов служит замещенный трехатомный спирт глицерин (рис. 1-1, Е).
Если жирными кислотами этерифицированы все три гидроксильные группы глицерина, то такое соединение называется триацилглицерином (рис. 1-1, И). Три жирных кислоты в молекуле триацилглицерина бывают разными, и, таким образом, разные жиры могут включать жирные кислоты с цепочками различной длины и разной степенью насыщенности. Гидролиз триацилглиридов приводит к освобождению жирных кислот от глицерина, а эти продукты могут расщепляться дальше с выделением энергии, необходимой для функционирования клеток. Триацилглицерины представляют собой основную массу природных нейтральных жиров. Кроме триацилглицеринов встречаются диацилглицерины (рис. 1-1, З) и моноацилглицерины (рис. 1-1, Ж).
Рис. 1-1. Основные соединения, формирующие фосфолипиды.
А и Б - примеры молекул жирных кислот. Молекулы жирных кислот представляют собой длинные углеводородные цепи с концевой карбоксильной группой. Показаны (А) насыщенные (все атомы углерода в жирной кислоте связаны одинарными ковалентными связями) и (Б) полиненасыщенные (содержат одну или больше двойных связей) жирные кислоты. Далее на панелях В, Г, Д показана конфигурация связей жирных кислот: насыщенных (В), ненасыщенных с цис-связью (Г), ненасыщенных с транс-двойной связью (Д). Е - замещенный трехатомный спирт глицерин, структурная основа липидов. (Ж) 1-моноацилглицерин. (З) 1,2-диа- цилглицерин как основа фосфолипида. В положении 2 обычно находится ненасыщенная жирная кислота. (И) Триацилглицерин. Положения жирных кислот отмечены как R1 R2 и R3
Фосфоглицериды
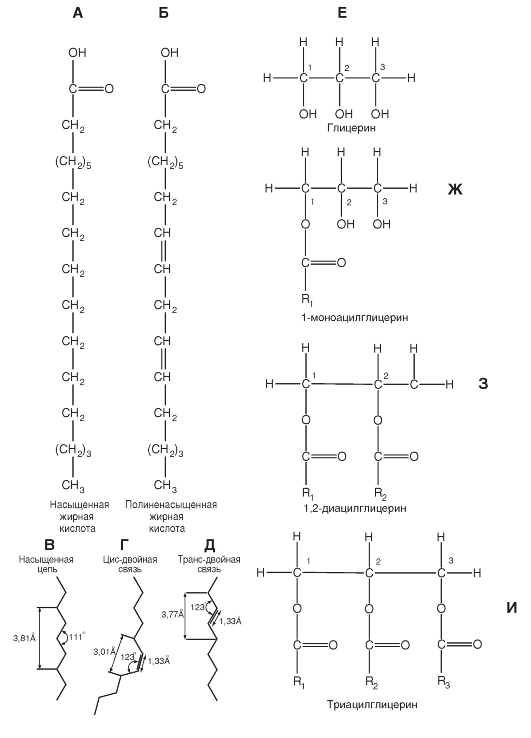
Структурной основой производных глицерина является замещенный трехатомный спирт глицерин. Фосфолипиды мембран представлены преимущественно фосфоглицеридами (рис. 1-2 А, Б). Интересно, что эти соединения в организме встречаются практически только в биологических мембранах. В фосфоглицеридах одна из первичных гидроксильных групп глицерина (группа 3 на рис. 1-2 Б) этерифицирована не жирной, а фосфорной кислотой. Другими словами, основой для их построения является не глицерин, а глицерофосфорная кислота. Если в положении 3 у глицерина находится остаток фосфорной кислоты, то соответствующее соединение называют фосфатидиловой кислотой.
Кроме того, к этому фосфату в ряде случаев присоединяется небольшая полярная ионизированная азотсодержащая молекула, например, как у фосфатидилсерина и фосфатидилхолина (рис. 1-2 Б). Эти группы составляют полярную (гидрофильную) область на одном конце фосфолипида. Две другие гидроксильные группы глицерина (группы 1 и 2) представляют собой остатки жирных кислот и обеспечивают образование неполярного (гидрофобного) участка на противоположном конце молекулы.
Таким образом, молекулы всех фосфоглицеридов содержат полярную голову и два неполярных углеводородных хвоста. Поэтому они называются амфипатическими, т. е. совмещающими свойства и гидрофильности, и гидрофобности. В воде они организуются в кластеры с полярными концами, которые притягивают молекулы воды.
Фосфоглицериды отличаются друг от друга главным образом по Х-группе полярной головы молекулы. Наиболее простой тип фосфоглицеридов - фосфатидная кислота, не имеющая Х-группы. В клетках она содержится в малом количестве и представляет собой промежуточный продукт в биосинтезе других фосфоглицеридов.
Исходя из изложенной структуры, фосфолипиды обычно обозначаются так, как это представлено на рисунке 1-2 В.
Свойства естественных мембран часто исследуют на их моделях, представляющих собой искусственные фосфолипидные мембраны. Техника получения искусственных липидных мембран была разработана Лэнгмюром в 1917 г. Если на поверхность воды нанести каплю растворенных в каком-либо летучем растворителе фосфолипидов или жирных кислот, то после распределения их молекул по водной поверхности и испарения растворителя образуется мономолекулярная пленка. Как установил Лэнгмюр, при полном насыщении поверхностного слоя адсорбированные молекулы липидов располагаются перпендикулярно к поверхности воды таким образом, что в воду погружается гидрофильная полярная группа, а неполярная углеводородная цепь направлена вертикально вверх. Такой ориентированный слой молекул называют «частоколом Лэнгмюра» (рис. 1-2 Г).
Если стеклянную пластинку опустить в воду, на поверхности которой находится мономолекулярная пленка липидов, то эту пленку можно перенести на поверхность пластинки. При повторных погружениях на пластинке возникают бимолекулярные пленки (рис. 1-2 Д).
Рис. 1-2. Фосфолипиды и принципы формирования мембраны.
А, Б - фосфолипиды мембран преимущественно представлены фосфоглицеридами. В фосфоглицеридах одна из первичных гидроксильных групп глицерина (группа 3) этерифицирована не жирной, а фосфорной кислотой, т. е. их основа не глицерин, а глицерофосфорная кислота. К фосфату присоединяется полярная ионизированная азотсодержащая молекула, как это показано для фосфатидилэтаноламина. Эта группа составляет полярную (гидрофильную) область на одном конце фосфолипида. Две другие гидроксильные группы глицерина (группы 1 и 2) представляют собой остатки жирных кислот и обеспечивают образование неполярного (гидрофобного) участка. В - обозначение фосфолипида. Г - монослой фосфолипидов на воде. Д - бислой фосфолипидов
Липиды мембран
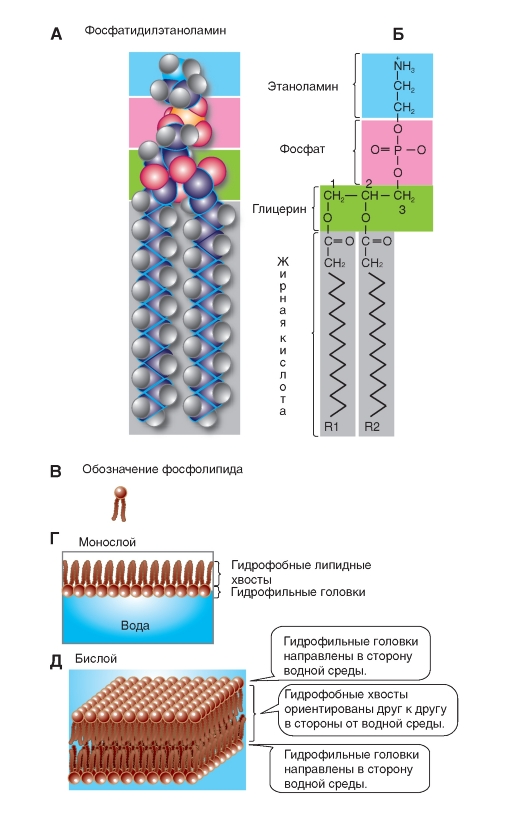
В наибольшем количестве в организме человека и животных встречаются такие фосфоглицериды (рис. 1-2 А), как фосфатидилэтаноламин. В дополнение, присутствуют фосфатидилсерин, фосфатидилинозитол и фосфатидилхолин (рис. 1-3 А). Они метаболически связаны друг с другом и содержат в качестве Х-группы аминоспирты этаноламин (остаток фосфоэтаноламина) и холин (остаток фосфохолина). В фосфатидилсерине фосфорная кислота этерифицирована гидроксильной группой серина фосфосерина. В фосфатидилинозите Х-группой служит шестиуглеродный сахароспирт инозит (остаток фосфорного эфира инозита). В фосфатидилглицерине роль Х-группы играет остаток эфира глицерофосфата.
Роль полярной Х-группы фосфатидов может играть также молекула сахара. Эти гликофосфоглицериды, или фосфатидилсахара, обнаружены в растениях и микроорганизмах. Их не следует путать с гликолипидами, в молекуле которых тоже находится сахар, но отсутствует фосфорная кислота.
Сфингозинзамещенные липиды
Структурная основа сфингозинзамещенных липидов - аминоспирт сфингозин. Сфинголипиды обнаружены в мембранах растительных и животных клеток; особенно богата ими нервная ткань, в частности мозг. В жировых отложениях сфинголипидов очень немного. При гидролизе сфинголипидов образуются одна молекула жирной кислоты, одна молекула ненасыщенного аминоспирта сфингозина или его насыщенного аналога дигидросфингозина, одна молекула фосфорной кислоты и одна молекула спирта (X-ОН). Глицерина сфинголипиды не содержат.
Наиболее распространен сфинголипид сфингомиелин (рис. 1-3 Б), содержащий в качестве Х-группы холин. Для сфингомиелина, так же как и для всех других сфинголипидов, характерно то, что одним из его углеводородных хвостов служит длинная алифатическая цепь сфингозина, а другим - этерифицированная жирная кислота. Таким образом, конформации сфинголипидов очень схожи с фосфоглицеридами, так как их молекулы также содержат полярную голову и два неполярных хвоста.
У гликолипидов голову молекулы образуют полярные гидрофильные углеводные группы, чаще всего D-галактоза. Однако в отличие от сфинголипидов, гликолипиды не содержат
фосфорной кислоты. К простейшим гликолипидам относятся гликозилдиацилглицерины, обнаруженные в растениях и микроорганизмах. Другая группа, цереброзиды, может быть отнесена как к гликолипидам, так и к сфинголипидам, поскольку эти соединения содержат и сахар, и сфингозин. Поэтому они называются цереброзиды, или гликосфинголипиды. Особенно велико содержание цереброзидов в мембранах нервных клеток, в частности в миелиновой оболочке. Обнаруженные в цереброзидах жирные кислоты необычны, так как содержат 24 атома углерода. Чаще всего встречаются нервоновая, цереброновая и лигноцериновая кислоты. Жирнокислотный эфир сфингозина, не содержащий сахара, называют церамид.
Стероиды
Стероиды резко отличаются по структуре от молекул других подклассов липидов. Стероиды - это производные пергидроциклопентан-фенантренового ядра, содержащего три конденсированных циклогексановых кольца, соединенных друг с другом. К этим структурам может быть присоединено несколько гидроксильных полярных групп, но число их недостаточно, чтобы сделать стероид водорастворимым.
К важным природным стероидам относятся желчные кислоты, мужские и женские половые гормоны, гормоны надпочечников, а также некоторые стероиды с высокой биологической активностью, к которым относятся, в частности, некоторые яды. В клетках эти соединения присутствуют большей частью в следовых количествах, и только представители одного класса стероидов, а именно стерины, составляют исключение. Стеринами клетки очень богаты. Эти соединения содержат спиртовую гидроксильную группу при С-3 и разветвленную алифатическую цепь из восьми или большего числа атомов углерода при С-17. Они существуют либо в виде свободных спиртов, либо в виде эфиров, у которых гидроксильная группа при С-3 этерифицирована жирной кислотой с длинной цепью.
Примеры стероидов: холестерин (рис. 1-3 Г), кортизол (синтезируется в надпочечниках), женские (эстрогены) и мужские (тестостерон) половые гормоны, секретируемые гонадами. Наиболее распространен холестерин, который содержится в организме как в свободной, так и в этерифицированной форме. Он входит в состав мембран.
Рис. 1-3. Наиболее часто встречающиеся липиды мембран.
А - примеры фосфолипидов; Б - пример сфинголипида; В - пример цереброзида (гликосфинголипида); Г - пример стероидов
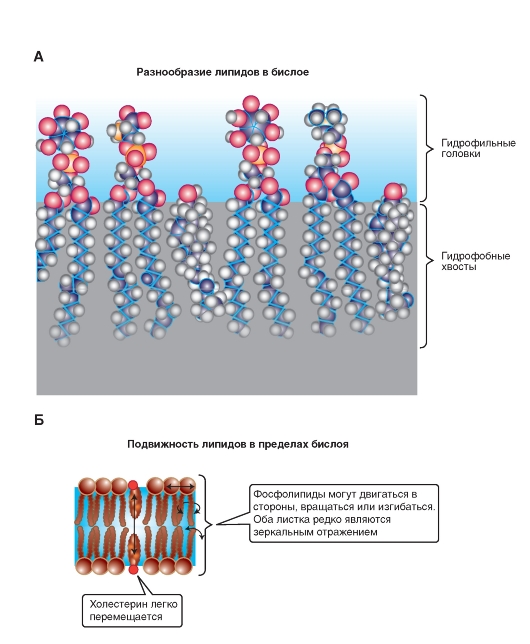
Липиды бислоя
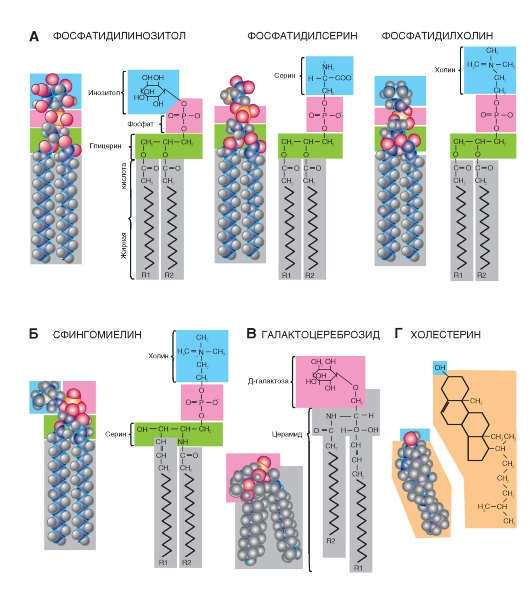
В физиологических условиях мембраны обладают динамическими свойствами. Липидный би слой (рис. 1-4 А) по существу представляет собой вязкую жидкость и характеризуется текучестью. Текучесть - это макроскопическая характеристика всего липидного бислоя; ее величина обратна вязкости. Поскольку липидный бислой обладает текучестью, он, следовательно, имеет низкую вязкость. В зависимости от температуры и химического состава мембраны текучесть может быть высокой или низкой. Текучесть липидного бислоя у теплокровных животных имеет небольшое значение, поскольку температура внутренней среды организма более или менее постоянна, однако у холоднокровных животных этот показатель имеет принципиальное значение, поскольку при понижении температуры вязкость липидного бислоя увеличивается и, следовательно, текучесть уменьшается. Такие изменения динамических свойств мембраны, наряду с рядом других, приводят к тому, что при низких температурах жизнь холоднокровных животных замирает.
Подвижность липидов
Вместе с тем вязкость фосфолипидного бислоя обусловлена двумя видами подвижности на уровне молекул фосфолипидов, которые обладают двумя
видами движений: внутримолекулярным и межмолекулярным (рис. 1-4 Б).
К внутримолекулярной подвижности относится подвижность цепей жирных кислот и участков полярной головки, связанная с гибкостью цепей. Гибкость, в свою очередь, связана с возможностью вращения химических группировок относительно одинарной связи. Это так называемая конформационная подвижность.
Вращательная диффузия - вращение молекулы вокруг своей продольной (длинной) оси, поскольку в вязкой среде «веретено» в плоскости мембраны легче вращается вокруг продольной оси, чем вокруг поперечной.
Вращение вокруг поперечной (короткой) оси теоретически возможно, но в этом случае центр вращения, присущий фосфолипидам, находится близко к поверхности. Вращение происходит как бы около «шеи» молекулы. В этой области молекулы стиснуты, и движение ограничено. Хвосты в этом случае могут совершать маятникообразные движения, но центр вращения будет находиться вверху. Именно поэтому центральная часть бислоя обладает большей текучестью, чем области цепей жирных кислот, расположенные ближе к полярной голове молекулы фосфолипида.
Межмолекулярное движение представляет собой латеральную диффузию целых фосфолипидных молекул и, по-видимому, происходит путем обмена двух молекул липидов местами.
Рис. 1-4. Формирование липидов в бислой.
А - пример фрагмента одного из листков бислоя, сформированного молекулами (слева направо) фосфатидилинозитолом, фосфатидилсерином, фосфатидилинозитолом, фосфатидилхолином, холистерином. Б - варианты подвижности липидов в бислое. Межмолекулярное движение происходит в виде обмена двух молекул липидов местами, а внутримолекулярное движение - в виде вращения молекулы вокруг своей продольной (длинной) оси и вращения вокруг поперечной (короткой) оси. Хвосты могут совершать маятникообразные движения
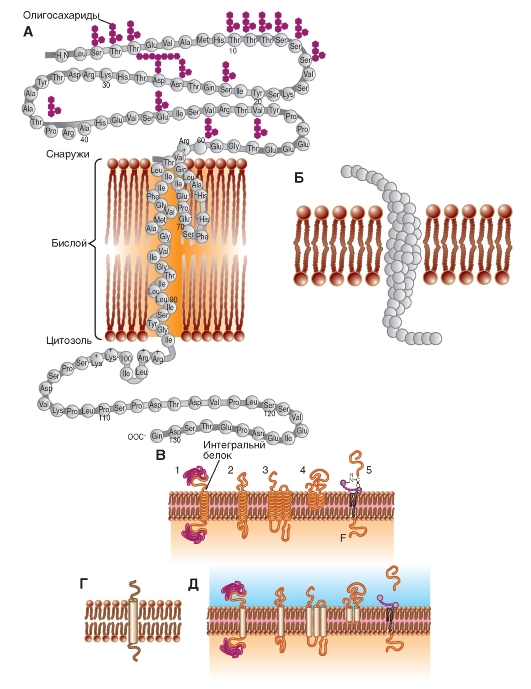
Белки мембран
Полипептидная цепь аналогична нитке бус (рис. 1-5 А): каждая «бусинка» представляет собой аминокислоту. Более того, так как аминокислоты могут вращаться вокруг пептидных связей, полипептидная цепочка способна изгибаться и укладываться в виде различных форм, подобно нитке бус, которая может быть закручена во многие конфигурации. Трехмерная форма молекулы известна как ее конформация. Конформации пептидов и белков играют главную роль в их функционировании.
Четыре фактора определяют конформацию полипептидной цепи после того, как образуется последовательность аминокислот:
• водородные связи между участками цепи или между участками цепи и окружающими молекулами воды;
• ионные связи, образующиеся между полярными и ионизированными участками вдоль цепи;
• ван-дер-ваальсовы силы, представляющие собой очень слабые силы притяжения между близко расположенными неполярными (гидрофобными) участками;
• ковалентные связи между боковыми цепями двух аминокислот.
Поскольку пептидные связи расположены вдоль цепи через равные интервалы, то водородные связи между ними имеют тенденцию придавать цепи пространственную организацию, известную как α-спираль. Водородные связи могут также образовываться между пептидными связями, когда выступающие участки полипептидной цепи идут примерно параллельно одна другой, образуя сравнительно прямые структуры типа складчатого слоя, которые известны как β-слой. Однако по разным причинам данные участки полипептидных цепей могут и не образовывать конформации в виде α-спирали или в виде β-слоя. Например, размеры боковых цепей и ионные связи между противоположно заряженными боковыми цепями могут препятствовать образованию повторяющихся водородных связей, необходимых для образования этих структур. Эти неупорядоченные
участки, называемые петлями, встречаются в местах, связывающих более регулярные α-спиральние и β-структурные участки.
Ковалентные связи между определенными белковыми цепями могут также искривлять регулярные складчатые слои. Например, боковая цепь аминокислоты цистеина содержит сульфгидрильную группу (R-SH), которая может взаимодействовать с сульфгидрильной группой в другой боковой цепи цистеина, образуя дисульфидную связь (R-S-S-R), которая связывает две аминокислотные цепи вместе. Такие дисульфидные ковалентные связи образуются между участками полипептидной цепи в противоположность более слабым водородным и ионным связям, которые легче разрушаются. Эти же связи вовлечены и в другие межмолекулярные взаимодействия, описанные ниже.
Большинство белков состоят не из одной, а из нескольких полипептидных цепей, и их называют мультимерными (олигомерными) белками. Те же факторы, которые влияют на конформацию одного полипептида, определяют взаимодействие между полипептидами в олигомерных белках. Таким образом, цепи могут поддерживаться вместе благодаря взаимодействию между разными ионизированными, полярными и неполярными боковыми радикалами цепи, а также за счет образования дисульфидных ковалентных связей между цепями.
Первичная структура (последовательность аминокислот) подавляющего количества белков известна, но трехмерная организация определена только для очень небольшого числа белков. Вследствие того, что многие факторы могут изменять упаковку полипептидной цепи, в настоящее время невозможно точно предсказать пространственную организацию белка на основе его первичной структуры.
На рис. 1-5 Б и рис. 1-5 В представлены модели интегральных белков, включенных в мембрану.
На рис. 1-5 Г показано стандартное обозначение интегрального белка, а рис. 1-5 Д дублирует рис. 1-5 В, но в виде стандартного обозначения.
Рис. 1-5. Схематическое изображение различных белков, по-разному встроенных в мембрану.
А - принципиальная схема полипептидной молекулы, встроенной в липидный бислой. Известными символами обозначены аминокислоты, входящие в состав белка. Б - модель полипептидной молекулы, встроенной в липидный бислой. Аминокислоты обозначены глобулами. В - модели полипептидных молекул, встроенных в липидный бислой. Трансмембранные фрагменты каждой молекулы обозначены спиралями. Г - основная используемая модель полипептидной молекулы, встроенной в липидный бислой. Трансмембранный фрагмент молекулы обозначен цилиндром. Д - модели полипептидных молекул, встроенных в липидный бислой. Трансмембранные фрагменты каждой молекулы обозначены цилиндрами
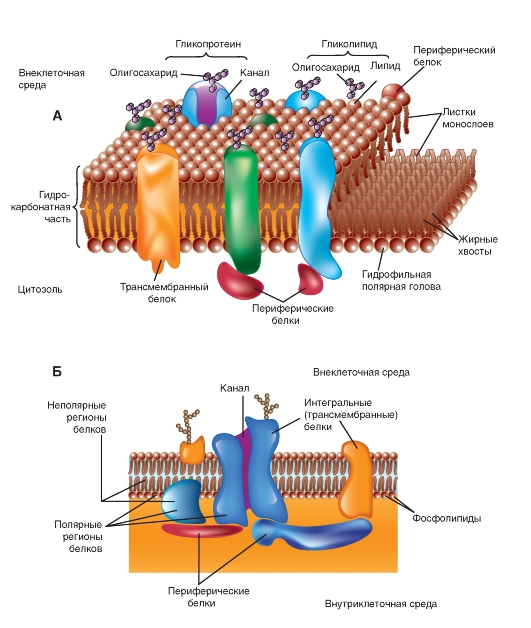
Интегральные мембранные белки в модели мембраны
Все мембраны, помимо фосфолипидов, содержат и белки. Хотя Дж. Даниэлли и Х. Давсон, обсуждая способ связывания белка с двойным слоем липидов, использовали термин «мозаичный», они отвергли предположение о том, что пленка растянутого белка покрывает ту или иную сторону мембранного бислоя липидов. Мысль о растянутых молекулах белка, находящихся в конфигурации β-слоя, стала составной частью гипотезы «элементарной мембраны», выдвинутой Дж. Робертсоном. Однако в дальнейшем было показано, что мембранный белок находится преимущественно в виде α-спирали, а не β-слоя. В настоящее время признано, что существуют белки и связанные с обеими сторонами мембраны, и пронизывающие насквозь двойной липидный слой.
В зависимости от метода, применяемого для отделения белков от мембран, мембранные белки причисляют к одной из двух обширных групп. Первая группа - периферические, или внешние, белки, переходящие в надосадочную жидкость при отмывании мембран буферными растворами с различными значениями рН или ионной силы либо растворами, содержащими комплексообразующие вещества, такие, как ЭДТА или ЭГТА. Вторая группа - интегральные, или трансмембранные, белки, сохраняющие связь с мембранами и после проведения указанных операций; поэтому для их освобождения необходимо
сначала разрушить структуру фосфолипидного двойного слоя.
В 1972 г. С. Сингер (S. Singer) и Г. Николсон (G. Nicolson) первыми описали интегральные белки (рис. 1-6 А,Б). В настоящее время показано, что эти белки чрезвычайно разнообразны по своей структуре. Они асимметрично распределены в бислое. Подавляющее большинство интегральных белков многократно пересекают липидный бислой - зигзагообразные белки. Они выполняют множество различных функций. Интегральные белки выступают в роли гидролитических ферментов, рецепторов клеточной поверхности, окислительно-восстановительных компонентов транспортной системы электронов и в качестве специфических белков-переносчиков.
Из гистологических исследований известно, что в гликозилированных интегральных белках область, содержащая углеводы, расположена либо на клеточной поверхности, либо внутри полости эндоплазматического ретикулума или комплекса Гольджи.
Многие интегральные белки содержат в своих полипептидных цепях последовательности гидрофобных аминокислот, однако некоторые связаны с липидным бислоем по иному механизму. Часть интегральных белков ковалентно связана с липидами.
В настоящее время большой интерес исследователей вызывает изучение конформации белков мембран. Многие важные процессы сопровождаются или вызываются изменением способа укладки полипептидной цепи, т. е. изменением конформации белковых молекул в мембранах.
Рис. 1-6. Модель мембраны. Показан липидный бислой со встроенными в него белками, выполняющими разнообразные функции
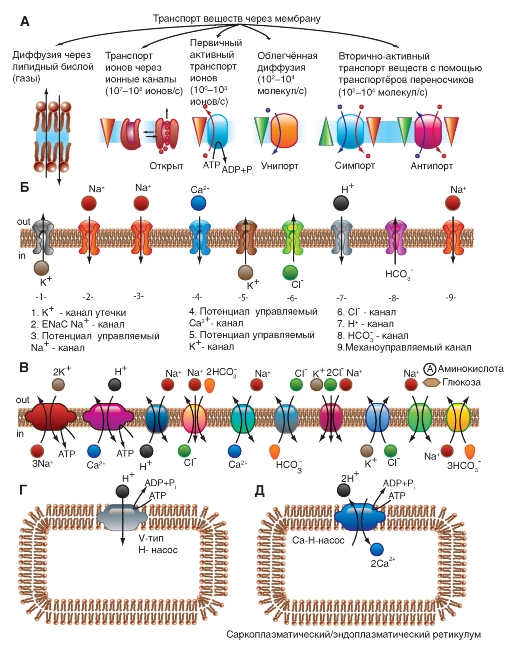
Транспорт через мембрану
При всем многообразии строения и физикохимических свойств молекул проникающих веществ можно выделить два механизма перемещения веществ через мембрану - посредством простой диффузии, т.е. без помощи специфического переносчика, и при помощи специфических переносчиков. В первом случае выделяют диффузию соединений непосредственно через липидный бислой мембраны (рис. 1-7 А) и ионов через ионные каналы (рис. 1-7 Б). Во втором случае выделяют так называемую облегченную диффузию, первично активный транспорт и, наконец, вторично активный транспорт.
Рассмотрим сначала простую диффузию. Посредством простой диффузии без помощи специального переносчика, во-первых, осуществляется транспорт соединений непосредственно через липидный бислой. В этом случае проникновение веществ в клетку идет путем их растворения в липидах клеточной мембраны, поэтому такой способ присущ водонерастворимым органическим соединениям и газам (например, кислороду и углекислому газу). Во-вторых, вещества перемещаются через ионные каналы клеточной мембраны, соединяющие цитоплазму клеток с внешней средой. Ионный канал - это белковая структура на основе мембранной α-субъединицы, образованная доменами и имеющая вид, подобный пончику с отверстием в середине - порой, через которую движутся ионы. Клетки используют этот путь для транспорта преимущественно ионов Na+, Ca2+, К+ (рис. 1-7 Б). Это пассивный ионный транспорт, который определяется градиентами концентрации и электрического поля (электрохимическим градиентом).
В данном случае понятие «градиент» отличается от его определения в математике или физике. В физико-химических или биологических системах используют термин «по градиенту», когда речь идет о движении от большего электрохимического
потенциала к меньшему, а при движении от меньшего электрохимического потенциала к большему применяют термин «против градиента».
Изменение электрохимического потенциала Δμ (без учета химической энергии, или химических потенциалов) можно записать в виде:
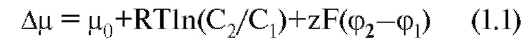
Это максимальная работа, которую можно совершить при переносе одного моля ионов. В таком случае RTln(C2/C1) равно работе по концентрированию раствора от C1 до C2, а zF(φ2-φ1) равно работе по преодолению сил электрического отталкивания, возникающих при разности потенциалов (φ2-φ1) между растворами.
При помощи специфических переносчиков осуществляется энергетически независимая облегченная диффузия ряда соединений (рис. 1-7 В, Г и Д).
Энергетически зависимый первично активный транспорт ионов Na+, Ca2+, K+ иН+ - это перенос веществ против их электрохимических градиентов с затратой энергии АТФ. Клетки в результате активного переноса ионов способны накапливать их в более высоких, по сравнению с окружающей средой, концентрациях и вопреки их заряду. Многие градиенты, возникающие на клеточной мембране и служащие необходимым условием для пассивного переноса ионов по ионным каналам, появляются именно в результате их активного транспорта. Так, градиенты концентрации K+ и Na+ возникают в результате активного переноса этих ионов, т.е. работы специального Na+/К+-насоса. За счет создающейся по обе стороны мембраны разности концентраций осуществляются диффузия этих ионов по градиентам и генерация потенциалов мембраны.
Наконец, вторично активный транспорт ряда ионов и молекул тоже использует энергию, накопленную за счет потребления АТФ и затраченную на создание градиента концентрации (что дает название виду транспорта).
Рис. 1-7. Основные принципы транспорта ионов и некоторых веществ через мембрану и некоторые транспортные системы в клеточной мембране и мембране органелл.
А - продемонстрированы основные пути транспорта веществ через мембрану. Б - показаны различные типы ионных каналов, обеспечивающие транспорт ионов по электрохимическому градиенту. В - насосы, обеспечивающие транспорт ионов против градиента концентрации, обменники и транспортеры. Г и Д - транспортные системы органелл
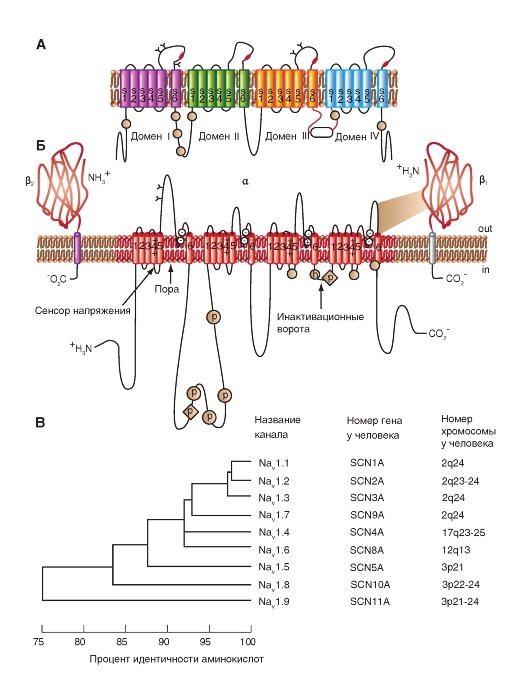
Na+-канал. Планометрическая организация
Прежде всего, рассмотрим модель молекулярной организации потенциалуправляемого Na+-канала.
Na+-канал состоит из широко разветвленной α-субъединицы, молекулярная масса которой приблизительно равна 260 кДа (рис. 1-8 А). Разветвленная α-субъединица связана с добавочными β-субъединицами (рис. 1-8 Б). Na+-каналы в клетках центральной нервной системы взрослых животных содержат β1- (или β3-) и β2-субъединицы, в то время как Na+-каналы в скелетных мышцах у взрослых животных имеют только β1- субъединицу. Порообразующая α-субъединица достаточна для обеспечения функции, но кинетика и потенциалзависимость воротного механизма канала модифицируется β-субъединицами. У Na+-канала α-субъединица организована в 4 гомологичных домена (I-IV), каждый из которых содержит 6 трансмембранных α-спиралей (S1-S6- сегменты), а добавочная петля поры локализована между S5- и S6-сегментами. Петля снаружи ограничивает узкий вход в пору, в то время как S5- и S6-сегменты ограничивают внутренний, более широкий, выход из поры. Сегменты S4 в каждом домене содержат положительно заряженные аминокислотные остатки в каждой третьей позиции, выступающие в качестве воротных зарядов и двигающихся через мембрану для инициирования канальной активности в ответ на деполяризацию мембраны. Короткая внутриклеточная
петля, соединяющая гомологичные домены III и IV, выступающая в роли инактивационных ворот, образует складку, внедряющуюся внутрь канальной структуры и блокирующую пору изнутри в течение длительной деполяризации мембраны.
В последние годы для Na+-каналов была разработана новая стандартная классификация (рис. 1-8 В), основыванная на сходстве между аминокислотными последовательностями каналов. В этой классификации индивидуальный канал представлен в виде химического символа, который показывает главный проходящий ион (Na) с главным физиологическим регулятором канала (потенциалом - «voltage gate chanels»), и это записывается вместе как NaV. Число после этих символов показывает генное подсемейство (в настоящее время это только NaV1.), а число, следующее за точкой, показывает специфическую канальную изоформу (например, NaV1.1). Это последнее число было предложено для того, чтобы показать порядок, в котором был идентифицирован каждый ген. Перекрещивающиеся варианты каждого члена семейства обозначаются маленькими буквами, следующими за номером (например, NaV1.1a).
Девять изоформ Na+-каналов млекопитающих, которые были идентифицированы, функционально более чем на 50% идентичны по своей аминокислотной последовательности в трансмембранных и экстрацеллюлярных доменах, где аминокислотная последовательность одинакова. Этого достаточно для четкого выстраивания в ряд всех Na+-каналов.
Рис. 1-8. Планометрическая модель молекулярной организации потенциалуправляемого Na+-канала.
А - порообразующая α-субъединица. Основные структуры α-субъединицы показаны как трансмембранные цилиндры, представляющие собой α-спиральные сегменты. Жирные линии демонстрируют цепи полипептида каждой субъдиницы с длиной, приблизительно пропорциональной числу остатков аминокислот. α-Субъединица состоит из четырех доменов (DI-DIV), каждый из которых состоит из шести сегментов (S1-S6). Сегмент S4 - предполагаемый сенсор напряжения. Б - полная структура канала, включающая α-субъединицу и β1-, β2-субъединицы. Внеклеточные участки β1-, β2-субъединиц показаны как складки. Ψ - участки вероятного гликозилирования; P - места фосфорилирования протеинкиназой А (круги) и протеинкиназой C (ромбы); h - инактивационная частица в петле инактивационных ворот. В - подобие последовательности аминокислот и филогенетические взаимоотношения α-субъединиц потенциалуправляемых Na+-каналов. Показано сравнение аминокислотной идентичности для Na+-каналов NaV1.1- NaV1.9. Даны номер гена и номер хромосомы у человека
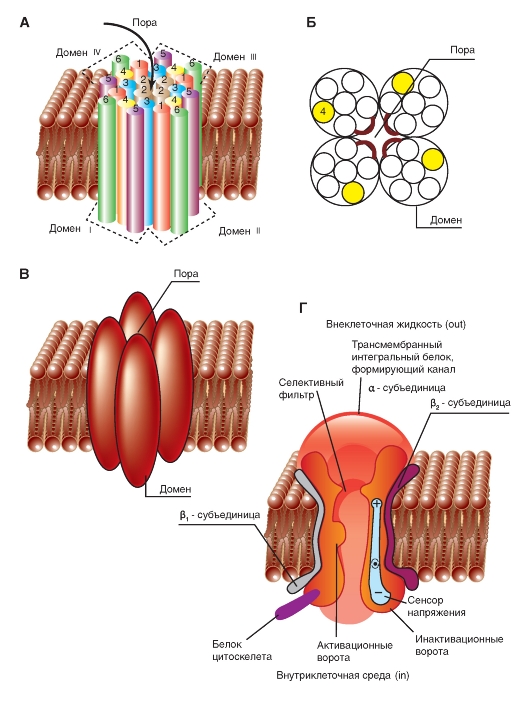
Na+-канал. Объемные модели
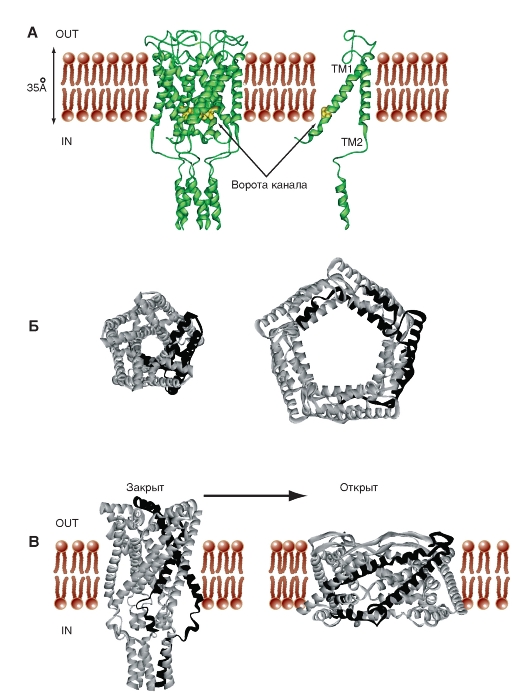
Диаметр пор Na+-канала очень маленький. Он только несколько больше, чем диаметр ионов, которые проходят через эти каналы, что предотвращает вход в них больших полярных органических молекул.
Трехмерное изображение упаковки четырех доменов порообразующей α-субъединицы потенциалуправляемого Na+-канала, каждый из которых содержит 6 пронумерованных трансмембранных сегментов (S1-S6), показано на рис. 1-9 А. Сама пора представлена полым цилиндрическим отверстием в центре упаковки. Связи между сегментами не показаны. Планометрическое изображение среза канала представлено на рис. 1-9 Б. В этом случае трехмерное изображение упаковки четырех доменов порообразую-
щей α-субъединицы потенциалуправляемого Na+-канала можно представить так, как это показано на рис. 1-9 В.
На рис. 1-9 Г канал представлен как трансмембранная макромолекула с отверстием, проходящим насквозь через центр. Ионный канал включает в себя несколько важнейших структур и в том числе устье канала, обращенное в сторону, откуда в него поступает ион (в данном случае внешняя сторона мембраны), селективный фильтр, оценивающий вид иона, активационные и инактивационные ворота, которые могут перекрывать канал для прохождения ионов, и, наконец, сенсор напряжения, управляющий работой канала. (Хотя для многих ионных каналов показано большее количество ворот канала, мы будем обсуждать их работу только с позиций активационных и инактивационных ворот.)
Рис. 1-9. Объемная модель молекулярной организации потенциалуправляемого Na+-канала.
А - структура всех четырех доменов. На схеме шесть трансмембранных сегментов каждого домена представлены в виде цилиндров и схематически объединены вместе, как это принято. Связи между сегментами и доменами не показаны. Один домен ионного канала, построенный интегральным мембранным белком, содержащим шесть трансмембранных сегментов (S1, S2, S3, S4, S5 и S6), каждый из которых имеет α-спиральную конфигурацию в пределах мембраны. Б - поперечный срез ионного канала, каждый из четырех доменов которого имеет шесть трансмембранных сегментов. В - модель объемного изображения четырех доменов с порой в середине. Г - физиологическая модель потенциалуправляемого Na+-канала
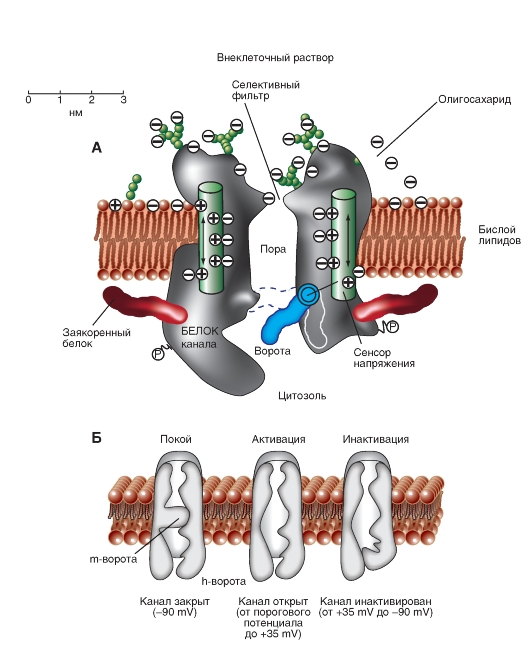
Модель работы Na+-канала
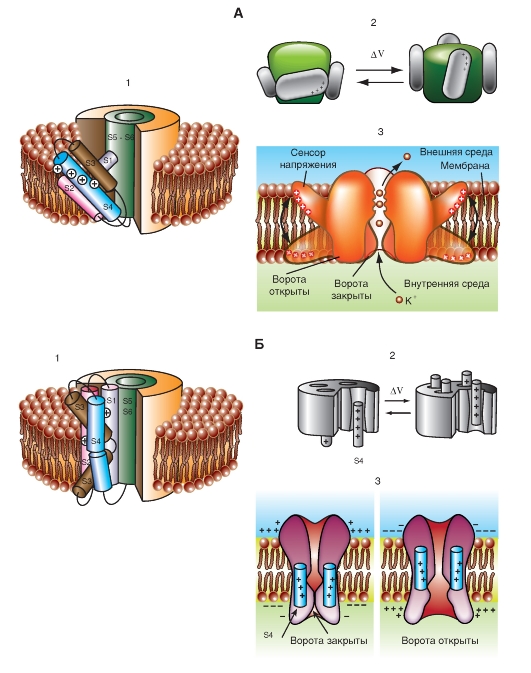
Наиболее простая и широко известная схема работы потенциалуправляемого Na+-канала показана на рис. 1-10 А. Канал представляет собой трансмембранный белок, находящийся в липидном бислое мембраны, прикрепленный к другим мембранным белкам или элементам внутриклеточного цитоскелета. Когда канал открывается, образуется водная пора, проходящая через мембрану. Устье поры намного шире, чем размер иона, только на небольшом участке в области селективного фильтра оно сужается до атомных размеров, где определяется природа иона. Гидрофильные аминокислоты формируют стенку поры, а гидрофобные аминокислоты связаны с липидным бислоем.
В настоящее время механизм работы ворот канала уже достаточно изучен. Одним из первых его попытался описать Б. Хилле. Согласно его точке зрения, основанной на экспериментах А. Ходжкина и А. Хаксли и собственных работах, в ответ на действие электрического раздражителя, т. е. на изменение трансмембранного потенциала, происходит изменение конформации белка потенциалуправляемого канала. Эти конформационные изменения регулируются электрическим полем внутри мембраны, носят стохастический характер и протекают за время от 30 мкс до 10 мс. Важно, что для открытия и закрытия канала не требуются высокоэнергетические химические соединения. Каналы открываются при одних и закрываются при других трансмембранных потенциалах. Было предположено, что электрическое поле действует на сенсор напряжения, который определяет трансмембранный потенциал. Затем сенсор напряжения должен передать эту информацию на саму канальную молекулу для ее конформационной перестройки и соответствующего изменения частоты открытия и закрытия канала.
В 1992 г. Б. Хилле предположил, что изменения конформации происходят в результате общего
перераспределения заряда в макромолекуле, образующей канал, и выражаются в виде открытия или закрытия ворот канала (рис. 1-10 А). Другими словами, возможность открытия и закрытия ворот канала контролируется сенсором напряжения. В случае потенциалуправляемых каналов сенсор должен включать много заряженных групп, которые двигаются под действием электрического поля. Необходимо заметить, что работа сенсора напряжения и ворот канала, показанная на рис. 1-10 А, представляла собой рабочую гипотезу Б. Хилле, высказанную на основании электрофизиологического изучения проводимости канала.
Рассматривая канал с позиций наличия только двух - активационных и инактивационных - ворот, можно представить следующую последовательность событий (рис. 1-10 Б). В ответ на деполяризацию мембраны происходят изменения конформации канальной молекулы: одновременно начинают смещаться активационные и инактивационные ворота, но с разной скоростью и в разных направлениях: активационные ворота стремятся открыть канал, а инактивационные - закрыть. Скорость смещения частиц, образующих активационные ворота, больше, и это приводит к открытию канала (переход из состояния покоя в состояние активации). В это время через канал проходят ионы натрия. Следующее за этим изменение трансмембранного потенциала приводит к закрытию инактивационных ворот. Это переводит канал из активированного состояния в инактивированное.
Когда канал открывается, ионный поток появляется сразу, а когда закрывается, поток ионов также сразу прекращается. На уровне одиночного канала воротные переходы стохастические; они могут быть описаны только в терминах вероятностей.
Потенциалуправляемый Na+-канал может находиться в трех состояниях: состоянии покоя, активации и инактивации, которые представлены в виде модели на рис. 1-10 Б.
Рис. 1-10. Схема работы потенциалуправляемого Na+-канала.
А - канал представляет собой трансмембранную макромолекулу с отверстием, проходящим насквозь через центр. Функциональные области ионного канала - селективный фильтр, ворота и сенсор напряжения - обнаружены в ходе электрофизиологических экспериментов. Б - модель работы потенциалуправляемого Na+-канала, имеющего активационные (или m-ворота) и инактивационные (или h-ворота). В состоянии покоя канал закрыт вследствие закрытия активационных ворот. Смещение мембранного потенциала в положительную область (до порогового значения) вызывает открытие активационных ворот. При достижении максимального для конкретной клетки потенциала канал инактивируется, т.е. происходит закрытие инактивационных ворот
Са2+-канал. Планометрическая организация
Потенциалуправляемые Са2+-каналы позволяют ионам Са2+ входить в клетки, когда мембрана деполяризована. Роль Са2+-каналов особенно значительна для взаимосвязи электрических потенциалов, возникающих на мембране клетки, с физиологическими процессами, происходящими внутри клетки. Повышение цитозольной концентрации Ca2+ вызывает различные клеточные реакции, например сокращение, секрецию, выброс медиатора, процессы транскрипции.
Са2+-каналы представляют собой комплекс белков, образованный из α1-субъединицы и вспомогательных α2δ-, β- и γ-субъединиц. Субъединица α1 формирует проводящую пору, она содержит сенсор напряжения и аппарат ворот канала. Петля между трансмембранными сегментами S5 и S6 в каждом домене определяет селективность и проводимость канала. Селективный фильтр Са2+-канала должен узнать ион Са2+ уже на входе в канал. Эти события достаточно редки по сравнению с входами ионов Na+, количество которых во внеклеточной среде примерно в 100 раз больше. Хотя ионы Са2+ и Na+ имеют идентичный диаметр (2 Ао), канал может выбирать Са2+ в большей степени, чем Na+, в соотношении 1000:1. Никакое сито не может так эффективно дифференцировать ионы идентичного размера. Скорее всего, пора содержит специфическое место,
которое способно связывать Са2+ при его очень низких концентрациях в растворе (10-6 M), а все другие физиологические ионы связывает в намного более высоких концентрациях.
Са2+-каналы были классифицированы на основе двух принципов:
• химический символ главного иона, для которого они проницаемы (в данном случае ионы
Ca2+);
• принцип физиологической регуляции работы канала, имея в виду, что эти каналы потенциалуправляемые (voltage gated calcium channels) Са2+-каналы, что позволило ввести обозначение СаV (рис. 1-11 В).
Первая цифра после обозначения соответствует в субъединице номеру генного подсемейства (от 1 до 3 в настоящее время), а вторая цифра, которая ставится после точки, соответствует порядку открытия оригинальной изоформы α1 субъединицы внутри этого подсемейства (от 1 до m). Соответственно этой номенклатуре, СаV1 подсемейство (от СаV1.1 до СаV1.4) включает каналы, содержащие α1S, α1C, α1D и α1F, для которых характерен L-тип кальциевых токов. Подсемейство СаV2 (от СаV2.1 до СаV2.3) включает каналы, содержащие α1Α, α1Β и α1Ε, для которых характерен P/Q-тип, N-тип и R-тип кальциевых токов соответственно. Подсемейство СаV3 (от СаV3.1 до СаV3.3) включает каналы, содержащие α1G, α1Η и α1I, для которых характерен T-тип кальциевых токов.
Рис. 1-11. Планометрическая модель молекулярной организации потенциалуправляемого Ca2+-канала.
А - основная α1-субъединица, формирующая пору. Основные структуры α1-субъединицы показаны как трансмембранные цилиндры, представляющие собой α-спиральные сегменты. Б - модель выполнена на основе экспериментальных данных изучения структуры Са2+-каналов, состоящих из пяти субъединиц. В дополнение к α1-субъединице представлена локализованная внутриклеточно β-субъединица и расположенная внеклеточно α2-субъединица, соединенная дисульфидной связью с δ-субъединицей в комплекс α2δ. Масштаб длины линий приблизительно соответствует длине полипептидных сегментов. Участки различий в α1-субъединице между некоторыми Са2+-каналами мембран клеток расположены в NH2-концевой части в гидрофобных сегментах DIS6 и DIVS3 и в линкере (цитоплазматическом связующем участке) между доменами I и II. AID (α1-interaction domain) - первичная область связывания для всех CaVα1-субъединиц с CaVβ-субъединицами, названная как α1-взаимодействующий домен. Символом «Р» обозначены места фосфорилирования разными протеинкиназами. В - последовательное сходство α1-субъединиц потенциалуправляемых Са2+-каналов. Продемонстрировано филогенетическое дерево первичных последовательностей Са2+-каналов. В результате сравнения пар последовательностей четко дифференцированы три семейства с межсемейственными последовательностями, идентифицированными более чем 80% (CaV1, CaV2, CaV3). Далее сходство последовательности было определено для каждого семейства, и эти три последовательности были сравнены одна с другой с межсемейственными последовательностями, идентифицированными на 52% (CaV1 по сравнению с CaV2) и на 28% (CaV3 по сравнению с CaV1 или с CaV2)
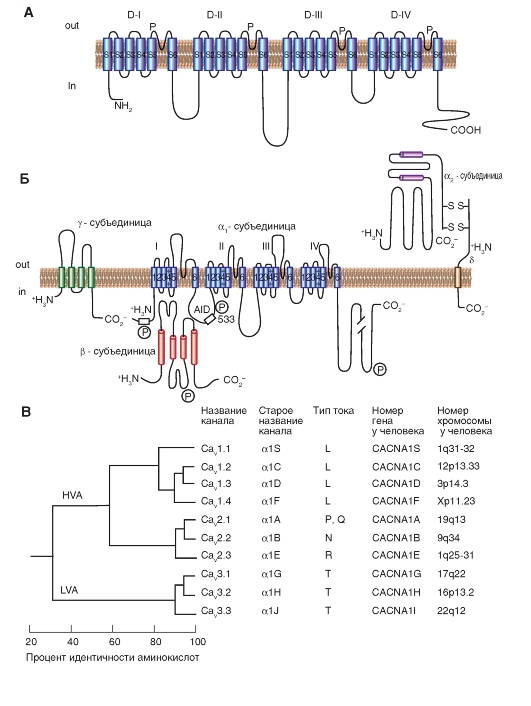
Кальциевые токи
Са2+-каналы были обнаружены практически во всех клетках. Са2+-токи, зарегистрированные в различных типах клеток, имеют определенные физиологические и фармакологические свойства. Изначальная буквенная номенклатура была предложена исходя из кинетик Са2+-токов. L-тип (от «long-lasting» - долго длящийся) Са2+-токов требует сильной деполяризации для активации, он долго длящийся и блокируется органическими антагонистами L-типа Са2+-каналов, включая дигидропиридины, фенилалкиламины и бензотиазепины. Са2+-токи L-типа являются главными в мышцах и эндокринных клетках, где они инициируют сокращение и секрецию. N-тип (от «neither long nor transient» - ни L, ни T), P/Q-тип и R-тип кальциевых токов также требуют сильной деполяризации для активации. Они относительно нечувствительны к антагонистами L-типа Са2+-каналов, но блокируются специфическими полипептидными токсинами из ядов улитки или паука. Эти токи в основном выражены в нейронах, где они инициируют нейротрансмиссию для большинства быстрых синапсов и также опосредуют вход Са2+ в клеточные тела и дендриты. T-тип (от «transient» - преходящий) Са2+-токов активируется слабой деполяризацией, и эти токи мимолетные (преходящие). Они нечувствительны к органическим антагонистам и токсинам змей и пауков, которые используются для определения N- и P/Q Са2+-токов. Са2+-токи T-типа выражены в большом спектре клеточных типов, где они вовлечены в развитие потенциала действия и важны в клетках и тканях, обладающих ритмической активностью.
Молекулярная организация кальциевого канала
Са2+-каналы, которые были охарактеризованы биохимическими методами, представляют собой комплекс белков, образованный из четырех или пяти определенных субъединиц, кодирующихся большим семейством генов.
На молекулярном уровне Са2+-канал составлен из формирующей пору трансмембранной α1-субъединицы и вспомогательных α2δ, β и γ-субъединиц (рис. 1-12 А). При этом α2-субъединица находится на внешней стороне мембраны, β-субъединица - на внутренней стороне мембраны, а δ- и γ-субъединицы представляют собой трансмембранные структуры. Структура Са2+-канала сердечной и гладкой мышцы - это структура с четырьмя субъединицами канала, и она напоминает Са2+-каналы нейрона. Вспомогательные α2δ- и β-субъединицы увеличивают транспорт ионов Са2+ через пору, образованную α1-субъединицей, и модулируют потенциалзависимую кинетику канала. Внутриклеточная β-субъединица и трансмембранный дисульфид-связанный комплекс α2δ-субъединиц являются компонентами большинства типов Са2+-каналов. В дополнение к роли β-субъединицы в транспорте ионов через канал, она также играет принципиальную роль в электромеханическом сопряжении в мышечных волокнах скелетных мышц. Взаимодействия субъединиц α2δ- и β-субъединицы в настоящее время хорошо изучены. Наличие субъединицы γ было также обнаружено в Са2+-каналах скелетных мышц, в кардиомиоцитах и нейронах головного мозга. Хотя эти добавочные субъединицы модулируют свойства ионного канала, фармакологические и электрофизиологические особенности Са2+-каналов в основном связаны с существованием α1-субъединиц.
β-субъединицы Са2+-каналов способны формировать гетерогенные комплексы in vivo и in vitro. β-субъединицы и α1-субъединица обладают консервативными областями взаимодействия, что способствует формированию гетерогенных комплексов канала. α2δ-субъединицы модулируют различные α1-субъединицы in vitro, и возможно, что эта гетерогенность распространяется на ситуации in vivo. Такое разнообразие взаимодействия субъединиц потенциально увеличило бы число возможных вариантов каналов с отличающимися биофизическими и физиологическими свойствами, что может обеспечивать разнообразие клеточных ответов.
Физиологическая модель потенциалуправляемого Na+-канала показана на рисунке (рис. 1-12 Б).
Рис. 1-12. Объемная модель взаимодействий субъединиц потенциалуправляемого Ca2+-канала.
А - γ-субъединица изображена как трансмембранный белок с четырьмя сегментами с внутриклеточным N- и C-концами. Первая половина γ-субъединицы взаимодействует с α1-субъединицей. Первая внеклеточная петля содержит заряженные остатки и участки гликозилирования. Определены взаимодействующие участки α2δ- и β-субъединица (β-взаимодействующий домен) с α1-субъединицей. Б - физиологическая модель потенциалуправляемого Na+-анала. Показана основная α1-субъединица, формирующая пору и дополнительные α2-, δ-, γ- и β-субъединицы
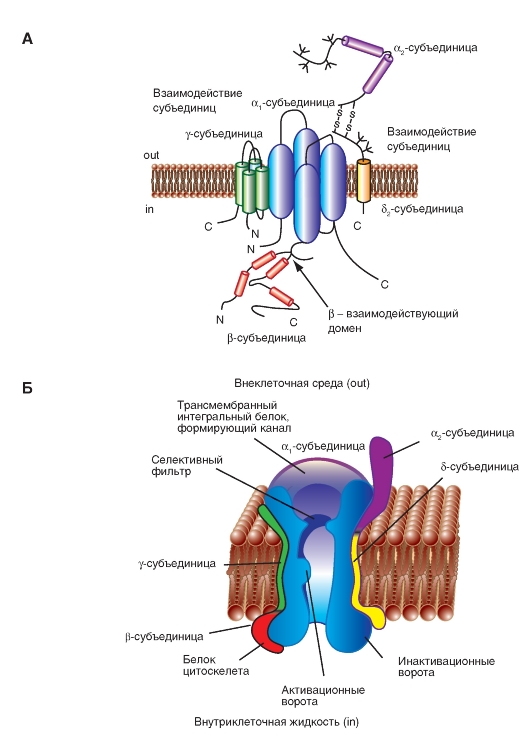
K+-канал. Простейшее строение
Принятая в настоящее время классификация делит все К+-каналы на:
• потенциалуправляемые К+-каналы (KV);
• Ca2+- активируемые К+-каналы (KCa);
• K+-каналы аномального выпрямления с током входящего направления (inward rectifier K+-channels) (Kir);
• K+-каналы с двумя петлями в домене (two-P K+-channels) (К2Р).
Описание молекулярной организации K+-каналов мы начнем с наиболее простой формы, представленной, например, в бактерии Streptomyces lividans. Модель молекулярной организации такого наиболее простого К+-канала бактерии Streptomyces lividans продемонстрирована на рис. 1-13.
Показанный на рис. 1-13 А К+-канал бактерий состоит из четырех одинаковых субъединиц, объединенных в единое целое тело канала.
На панелях Б, В и Г показано, что Р-петля локализована около внеклеточной поверхности мембраны и объединяет α-спирали обоих сегментов S5 и S6. Она состоит из неспиральной части, формирующей верхнюю часть поры, короткой α-спирали и удлиняющей петли, которая выдается в сужающуюся часть поры и формирует селективный фильтр. Этот фильтр позволяет проходить через канал только ионам К+, но не другим ионам. Ниже фильтра находится центральная часть поры, образованная α-спиралью сегмента S6. В тетрамерном К+-канале бактерии Streptomyces lividans сегменты S5 и S6 обозначены так, поскольку они представляют собой структурные эквиваленты сегментов S5 и S6 в потенциалуправляемом К+-канале (рис. 1-13).
На рисунке 1-13 Б показаны структурные детали канала. NH2-конец субъединицы начинается наружной спиралью (оранжевая), пронизывающей мембрану от цитоплазматической стороны до наружной поверхности. За наружной спиралью следует короткая спираль (красная), направленная в пору. Затем следует внутренняя спираль, которая возвращается к цитоплазматической стороне (оранжевая). Соединяющая петля между наружной и короткой спиралями образует структуру, формирующую наружное отверстие поры. Эта часть содержит центр связывания для неселективного блокатора К+-каналов тетраэтиламмония (ТЭА). Четыре таких петли каждой субъединицы формируют внешние стенки поры, а именно той ее части, которая ответственна за селективность канала - селективный фильтр.
Избирательность канала достигается как размером его поры, так и молекулярной организацией селективного фильтра. Диаметр селективного фильтра равен примерно 0,3 нм. Аминокислоты его стенки ориентированы так, что последовательные кольца, образованные четырьмя карбоксильными группами (по одной от каждой субъединицы), обращены внутрь поры. Диаметр поры достаточен для прохождения дегидратированного иона К+, имеющего диаметр 0,27 нм. Атомы кислорода в стенке поры заменяют гидратацию иона. Ионы меньшего размера, например Na+, с диаметром 0,19 нм, не могут проходить через K+-канал, поскольку они не могут сформировать тесную связь одновременно со всеми четырьмя кислородами стенки поры. Этот механизм в деталях представлен на рис. 1-19.
Рис. 1-13. Модель молекулярной организации наиболее простого К+-канала бактерии Streptomyces lividans.
А - этот К+-канал представляет собой тетрамер из идентичных субъединиц, каждая из которых содержит две сходные трансмембранные α-спирали, обозначаемые как S5 и S6, и короткую Р-петлю, формирующую пору. Б - организация одной из четырех субъединиц. Показаны S5 и S6 α-спирали (желтые на рисунке) и петля Р (розовая). В - тетрамерная организация канала. Вид сбоку. Г - тетрамерная организация канала. Вид сверху
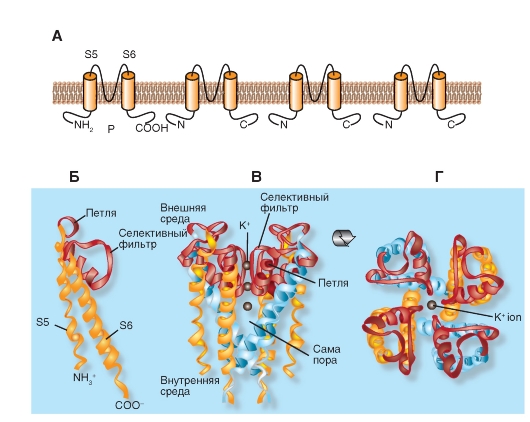
Потенциалуправляемые К+-каналы (Kv)
KV каналы образованы белковыми субъединицами двух типов: α-субъединицами, формирующими пору, и вспомогательными β-субъединицами. Субъединицы α формируют тетрамер, чтобы образовать функциональный канал, проводящий ионы K+.
Одна субъединица ΚV-канала - белок с шестью трансмембранными сегментами (S) α-спирали (S1-S6) и расположенными в цитоплазме N- и C-терминалями. Наиболее изучены внеклеточная петля P между 5S и 6S (формирует К+-селективный фильтр и пору канала) и 4S, который положительно заряжен и формирует сенсор напряжения белка (рис. 1-14 А). Кроме того, много функций обычно приписывали большим N- и С-концевым петлям. Они включают контроль за инактивацией каналов, белок-белковое взаимодействие (по типу тетрамеризации α-субъединиц, взаимодействие с цитоплазматическими β-субъединицами и сохранение последовательностей).
KV α-субъединицы могут формировать или гомотетрамеры (homotetramers), или гетеротетрамеры (heterotetramers), вероятно, ограниченные в том же самом подсемействе. Огромное разнообразие КV-токов in vivo есть следствие существования сплайсинговых вариантов (изоформ гена, кодирующих одну и ту же α-субъединицу), сборки тетрамера α-субъединиц с различными
вспомогательными субъединицами и гетеромеризация α-субъединиц.
Как известно, ионы К+ неэквивалентно распределены между внеклеточной средой и цитоплазмой, и это создает движущую силу для выхода ионов К+ в больших физиологических пределах мембранного потенциала. КV-каналы открыты при деполяризации трансмембранного потенциала, что способствует выходу ионов К+. Деполяризация может быть представлена как аккумуляция позитивных зарядов на внешней стороне мембраны. Однако выход позитивно заряженных ионов, таких, как ионы К+, сдвигает мембранный потенциал ниже потенциала покоя. Таким образом, КV-каналы чувствуют деполяризацию и, в свою очередь, действуют так, чтобы ее устранить. Одна из наиболее охарактеризованных ролей КV-каналов заключается в том, чтобы закончить сильную деполяризацию, вызванную активацией потенциалзависимого входа катионов (совместно образующих потенциал действия). Таким образом, можно постулировать, что любые увеличения КV-канальной активности будут приводить к более эффективному окончанию деполяризации (обычно укорачивая или убирая потенциал действия). Эта функциональная способность КV-каналов также лежит в основе формирования пачечной активности (взрывной). Таким образом, активность КV-каналов играет, например, роль в кодировании информации в нервной системе.
Рис. 1-14. Планометрическая модель молекулярной организации потенциалуправляемого К+-канала (КV-канала).
А - одна субъединица КV-канала представляет собой α-спираль с шестью трансмембранными сегментами (S1-S6) и расположенными в цитоплазме N- и C-терминалями. Внеклеточная P-петля между сегментами S5 и S6 формирует селективный фильтр для ионов К+ и пору канала, а положительно заряженный сегмент S4 формирует сенсор напряжения белка. Длинные N- и C-терминальные петли контролируют инактивацию каналов и белок-белковое взаимодействие. Б - ассоциация четырех субъединиц в КV-канал
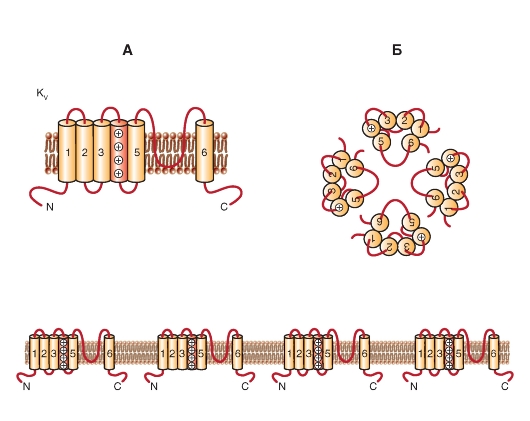
Семейство KV
До настоящего времени в геноме человека описаны 38 генов, кодирующих различные каналы суперсемейства KV. КV-каналы включают классические категории каналов: К+-каналы задержанного выпрямления (delayed rectifier K+-channels) и быстрые транзиторные К+-каналы выходящего тока (fast transient K+-channels: fast transient K+-current IA, или transient outward current Ito).
Название «delayed rectifier K+-channels» было первоначально дано потенциалуправляемым К+- каналам гигантского аксона кальмара из-за их отсроченной активации (по сравнению с быстро активизирующимися Na+-каналами). Члены всех KV подсемейств (включая KV1-4, EAG и KCNQ) могут формировать delayed rectifier K+-channels.
Fast transient K+-channels (формирующие fast transient K+-current: IA, или transient outward current Ito) - быстрые транзиторные ^-каналы выходящего тока представляют собой каналы, активируемые низким потенциалом (low voltage-activated). Они быстро инактивирующиеся (транзиторные, иначе - временные, мимолетные K+-каналы). Каналы этого типа обычно образованы из членов
KV1 и KV4 подсемейств и вспомогательной β-субъединицы, часто необходимой для феномена быстрой инактивации. Недавно была обнаружена новая вспомогательная субъединица - CD26, родственная дипептидил аминопептидазаподобному протеину (Dipeptidyl Aminopeptidase-подобный белок, DPPX), и это позволило присвоить каналу нейронов характеристику KV4-каналов.
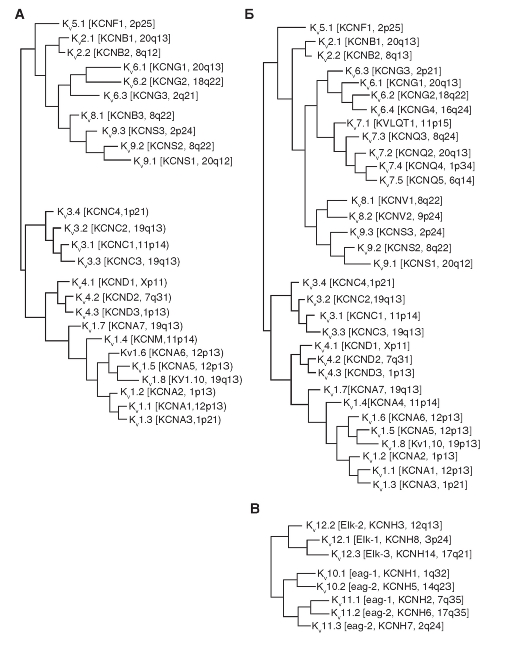
Филогенетические деревья KV-каналов продемонстрированы на рис. 1-15. На нем при филогенетической реконструкции, основанной на сходной аминокислотной последовательности, показаны потенциалуправляемые (voltagegated) K+-каналы семейств KV1-KV6, KV7 и KV8-KV9. Среди этой группы только KV1.8 в настоящее время испытывает недостаток в названии HGNC. Пять членов группы KV семейства KV7 (KCNQ1-KCNQ5) в настоящее время (с 2005 г.) могут быть внесены в союз с другими белками канала KV, и поэтому не показаны в отдельном филогенетическом дереве, как это представлялось ранее. Три оставшиеся семейства KV - KV10, KV11 и KV12 - достаточно близко связаны друг с другом, чтобы быть показанными в отдельном филогенетическом дереве.
Рис. 1-15. Филогенетические деревья для семейства KV.
А - филогенетическое дерево для семейства КV1-К^9-каналов. Аминокислотные последовательности KV-канала включают KV1-KV6 и KV8-KV9 семейства, которые были внесены до 2005 г. Б - последовательности KV7.1-KV7.5, KV6.4 и KV8.2 были добавлены к существующему филогенетическому дереву. Только гидрофобные ядра канала (S1-S6) использовались для анализа. В - филогенетическое дерево для семейств KV10-KV12-каналов
Группы Kir
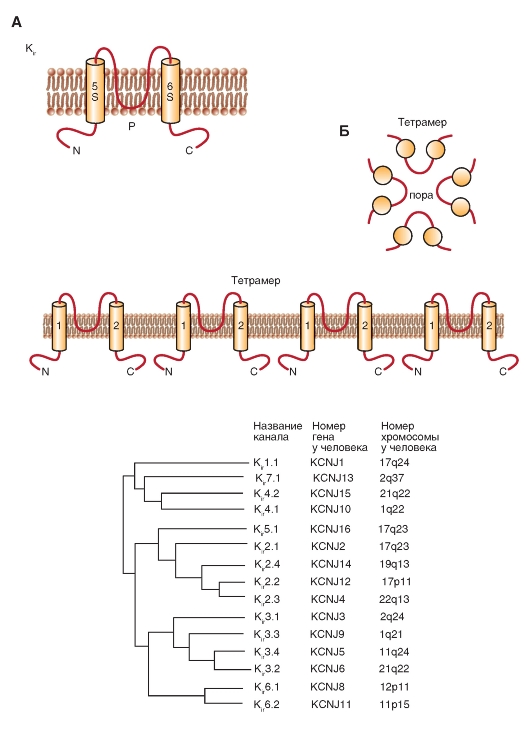
Следующий класс 2S-белков включает три группы каналов inward rectifiers channels (Kir), которые можно назвать, хотя и очень длинно, как «К+-каналы аномального выпрямления с током входящего направления». N- и С-терминали этих каналов также расположены в цитоплазме, P-петля между двумя трансмембранными доменами формирует пору, и функционирующий канал представляет собой тетрамер этих 2S/1P-субъединиц.
Клонирование первых inward rectifiers K+-channels - Kir1.1 (ROMK1) и Kir2.1 (IRK1) - было осуществлено в 1993 г., и последовательность новых членов этого семейства была идентифицирована, включая К-канал, связанный с G-белком, (Kir3) и АТФ-чувствительный К-канал (Kir6). Эти каналы играют важную физиологическую роль в функции многих органов, включая мозг, сердце, почки, эндокринные клетки, слуховые клетки и клетки сетчатки. Молекулярная организация этих каналов приведена на рис. 1-16 А. Филогенетическое дерево, показанное на рис. 1-16 Б, иллюстрирует родственные связи, основанные на последовательности аминокислотных остатков, между семью основными
подсемействами Kir. В настоящее время новые члены этого семейства не были идентифицированы. Поскольку это филогенетическое дерево появилось только в 2002 г. в издании IUPHAR, маловероятно, что какие-либо другие новые члены были обнаружены за это время.
В последнее время метод рентгеноструктурной кристаллографии дал возможность описать структуру цитоплазматического региона Kir3.1, полную структуру бактериальных Kir1.1 и цитоплазматическую область Kir2.1. Эти данные демонстрируют, что inward rectifiers K+-channels имеют длинную пору, уходящую в цитоплазму, и подчеркивают важность отрицательных зарядов аминокислотных остатков на стенке цитоплазматической части поры, которая играет важную роль аномального выпрямления. Эти исследования обеспечили понимание механизмов регулирования ворот канала посредством лигандов через G-белки и фосфатидилинозитол 4,5-бифос- фат. Информация, полученная благодаря анализу кристаллической структуры, чрезвычайно ценна, так как позволяет оценить структурно-функциональные отношения. Также примечательны издания, посвященные изучению динамических аспектов функции канала.
Рис. 1-16. Молекулярная организация inwardly rectifying potassium channels - K+-каналов аномального выпрямления с током входящего направления (Kir).
А - одна субъединица К1r-канала представляет собой α-спираль с двумя трансмембранными сегментами (S5 и S6), расположенными в цитоплазме N- и C-терминалями, и короткую Р-петлю, формирующую пору. Б - ассоциация четырех субъединиц в Кir-канал. В - филогенетическое дерево для Кir-каналов
K+-каналы с двумя петлями в домене (two-P potassium channels - К2Р)
Меньше чем за десятилетие, начиная с открытия K2Р-каналов, их изучение показало, что базовая утечка ионов K+ через специализированные пути представляет собой эффективно регулируемый механизм контроля возбудимости клеток. Пути утечки ионов K+, активные в покое, стабилизируют мембранный потенциал ниже порога генерации взрывной (пачечной) активности и ускоряют реполяризацию. Хотя существование токов утечки было предположено в 1952 г. Hodgkin и Huxley, они оставались биофизическим курьезом в течение пяти десятилетий. Идентификации первых молекулярных механизмов тока утечки ионов K+ способствовало клонирование K+- каналов с двумя пороформирующими петлями в каждой субъединице и четырьмя трансмембранными сегментами (или восемью трансмембранными сегментами) в Saccharomyces cerevisiae и Caenorhabditis elegans. После этого K2P был изолирован из нервно-мышечной ткани Drosophila melanogaster. Биофизические характеристики показали, что K2P должен быть K+-селективным каналом с определенными параметрами проводимости, т.е. с потенциалнезависимым воротным механизмом, и предсказанным Goldman, Hodgkin, Katz выпрямлением. Когда концентрация ионов K+ симметрична с двух сторон мембраны, K2Р-ток
и демонстрируют линейную зависимость от потенциала. При физиологических условиях (высокая концентрация ионов K+ внутри и низкая снаружи) K2P проводит более значительный ток из клетки, чем внутрь клетки. Наблюдается поток ионов, направленный в большей степени наружу, чем внутрь клетки.
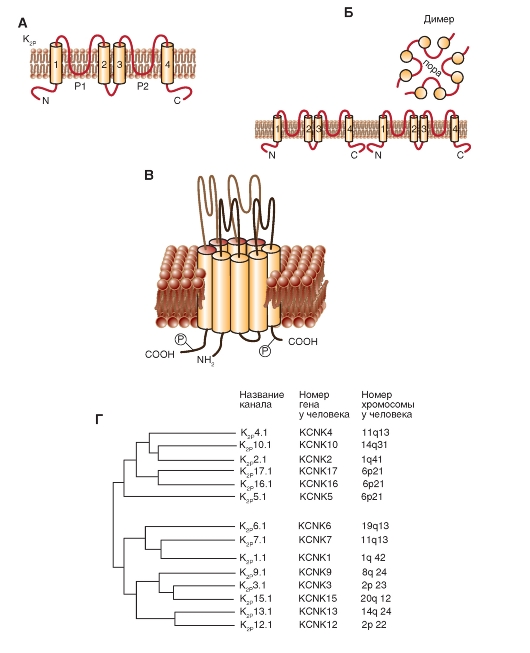
Поразительная черта K2Р-каналов - организация их субъединицы. Каждая имеет две P петли и четыре S сегмента (рис. 1-17 А). Эта отличающаяся топология (2P/4S) может быть найдена в более чем 70 предсказанных гомологах в базе данных, полученных при изучении генома. Пятнадцать генов млекопитающих в семействе обозначены как гены KCNK, кодирующие K2Р-каналы (рис. 1-17 Б и В). При экспрессии легко обнаруживается функция ионного канала. Как ожидалось, для регуляторов возбудимости K2Р-каналы находятся под сильным контролем множества химических и физических стимулов, включая напряжение кислорода, pH, липиды, механические растяжения, нейротрансмиттеры и рецепторы, связанные с G-белком. Каналы также служат молекулярными мишенями для некоторых летучих и местных анестетиков. Регуляция K2Р-каналов связана с изменениями в их свойствах, например вероятности открытия каналов. Тем не менее некоторые регуляторные изменения, например фосфорелирование K2P2, обеспечивает появление выпрямляющих свойств с чувствительностью к потенциалу.
Рис. 1-17. Молекулярная организация для two-P potassium channels - K+-каналов с двумя петлями в домене (К2Р). Обратите внимание, что этот канал выполняет функцию так называемого канала утечки.
А - одна субъединица К2Р-канала представляет собой α-спираль с четырьмя трансмембранными сегментами, расположенными в цитоплазме N- и C-терминалями, и двумя Р-петлями, формирующими пору. Б - ассоциация двух субъединиц в К2Р-канал. В - объемное изображение К2Р-канала. Г - филогенетическое дерево для К2Р-каналов
Ca2+-активируемые K+-каналы (KCa)
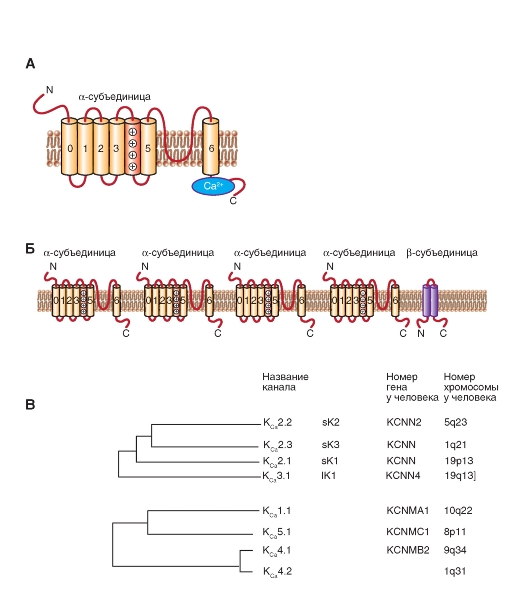
Молекулярная организация KCa-каналов представлена на рис. 1-18 А, Б. Филогенетическое дерево, представленное на рисунке, иллюстрирует факт, что эти каналы формируют две хорошо определенные, но только отдаленно связанные группы. Одна из этих групп включает три KCа-канала с низкой проводимостью (KCa2.1, KCa2.2 и KCa2.3), а также канал KCa3.1 с промежуточной проводимостью. Эти каналы не потенциалуправляемы и активизируются низкими концентрациями внутриклеточного Ca2+ (<1,0 μΜ), в отличие от KCа1.1 (KCNMA1, Slo1), который активизируется и потенциалом, и внутриклеточным Ca2+. Эти три KCа-канала с низкой проводимостью чувствительны к блокирующему действию апамина (100 пМ-10 нМ), что отличает их от всех других KCа-каналов. И KCа-каналы с низкой проводимостью, и каналы с промежуточной проводимостью играют важную роль во многих процессах, включающих Са2+-зависимый сигналлинг в электровозбудимых и электроневозбудимых клетках. Они не связывают свободные ионы Ca2+ непосредственно, а скорее, обнаруживают Ca2+ через кальмодулин, постоянно связанный с C-терминальным регионом. Связывание кальция с этим кальмодулином приводит к конформационным изменениям, которые, в свою очередь, ответственны за воротный механизм канала.
Филогенетическое дерево, показанное на рис. 1-18 В, иллюстрирует зависимость последовательностей группы KCа-каналов, которая включает KCа1.1 (Slo или Slo1), KCa4.1 (Slack или Slo2.2), KCa4.2 (Slick или Slo2.1) и KCa5.1 (Slo3). Каналы KCa1.1 изучали в клетках мозга, улитки и мышцах, и известно, что чередующиеся сплайсинги их мРНК ответственны за их значительные функциональные различия. В отличие от KCa2- и KCa3-каналов, связывание ионов Са2+-каналом
KCa1.1 не зависит от его ассоциации с кальмодулином, но полагают, что оно определяется, по крайней мере, тремя связывающими двухвалентные катионы участками в цитоплазматической карбоксильной области каждой субъединицы канала. Два независимых высоко чувствительных Ca2+-связывающих участка, названные «calcium bowl», сформированы отрицательно заряженными сегментами в дистальной карбоксильной терминали белка и внутри первой RCK области, кодирующей проксимальную C-терминаль белка. Третий низкоафинный участок, связывающий двухвалентные катионы, также найден в первый RCK области, которая способствует активации Mg2+ и Ca2+ при высоких концентрациях (>1 mM).
Три других члена этой группы (KCa4.1, 4.2 и 5.2) были включены в KCа-спецификацию, так как все они являются членами этой структурно связанной группы генов. Однако в настоящее время появилось больше информации о функциональных свойствах членов этого семейства генов, чем было известно несколько лет назад, когда эти наименования были предложены, и это представляет возможную задачу для спецификации, основанной, скорее, на функциональном сходстве, чем на структурном. В отличие от найденных членов KCa1.1, фактически активирующихся внутриклеточным Ca2+, ни один из других членов этой группы, по-видимому, не может быть также активирован Ca2+. Фактически, главным образом, эти три нечувствительных к внутриклеточному Ca2+ канала KCa4.2 и KCa4.1, активируются внутриклеточными ионами Na+ и Cl-, а KCа5.1 активизируется внутриклеточным защелачиванием (сдвигом рН в щелочную сторону). Таким образом, хотя они структурно связаны с KCa1.1, эти три канала не могут быть описаны правильно как «калиевые каналы, активируемые кальцием» на основе функциональных критериев. Это может быть темой для обсуждения среди исследователей данной области.
Рис. 1-18. Кальцийактивируемые К+-каналы.
А - одна субъединица KCа-канала представляет собой молекулу с семью трансмембранными сегментами (S0-S6) и расположенной в цитоплазме C-терминалью и во внеклеточной среде N-терминалью. Внеклеточная петля P между S5 и S6 формирует К+-селективный фильтр и пору канала, а положительно заряженный 4S формирует сенсор напряжения. Б - ассоциация четырех субъединиц в KCа-канал. В - филогенетическое дерево для KCа-каналов. Первая группа включает в себя KCа2-, KCаЗ-каналы. Вторая группа включает KCа1-, KCа4-, KCа5-каналы. До настоящего времени к этой топологии никакие новые каналы не добавлены
Механизмы ионной селективности
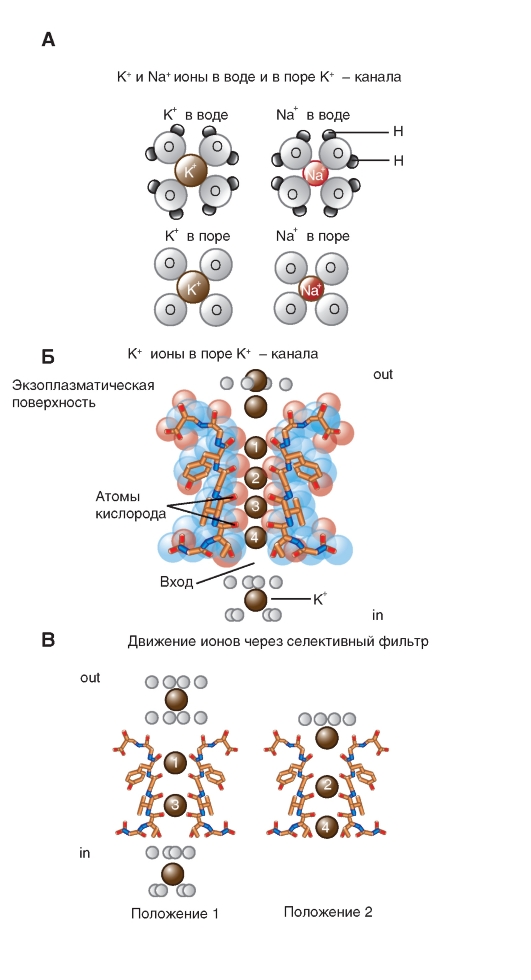
Механизмы ионной селективности и проведения ионов через пору каналы частично изучены. Общие представления сводятся к следующему. На рис. 1-19 А представлены гидратированные ионы К+ и Na+ и их состояние в растворе и в поре. Когда ионы К+ проходят через селективный фильтр, они теряют связанные с ними молекулы воды и вместо воды начинают кооперироваться с восемью атомами кислорода карбоксильных групп скелета основной цепи молекулы белка, четыре из которых показаны на рис. 1-19 Б. Это фрагмент аминокислотной последовательности каждой Р- петли. Меньшие по диаметру ионы Na+, вдобавок имеющие «более тесную рубашку» из молекул воды, не могут эффективно кооперироваться с атомами кислорода и поэтому проходят через K+- канал крайне редко.
На рис. 1-19 Б показаны только две находящиеся в противоположном положении субъединицы канала. Внутри селективного фильтра каждый обезвоженный ион K+ взаимодействует по длине поры с восемью атомами кислорода (красные
хвостики на схеме), два из каждой из четырех субъединиц, так чтобы заменить восемь молекул воды.
На рис. 1-19 В продемонстрированы два альтернативных состояния, при которых ионы K+ двигаются через канал. В состоянии (1), когда движение идет так, что мы его наблюдаем, глядя из экзоплазматической стороны внутрь канала, можно увидеть гидратированный ион K+ вместе с восемью связанными молекулами воды. Кроме того, показаны ионы K+ в позиции 1 и 3 внутри селективного фильтра, а также тот же полностью гидратированный ион K+ внутри устья канала.
В процессе движения ионов K+ каждый ион в состоянии (1) двигается одним шагом внутрь канала, образуя состояние (2). Таким образом, в состоянии (2) ион K+ на экзоплазматической стороне канала потерял 4 из 8 молекул воды, ион в позиции 1 в состоянии (1) перемещается в позицию 2, и ион в позиции 3 в состоянии (1) двинулся в позицию 4. Во время перемещения из состояния (2) к состоянию (1) ион K+ в позиции 4 двинулся в устье канала и приобрел восемь молекул воды, в то время как другой гидратированный ион K+ двинулся в канал.
Рис. 1-19. Механизмы ионной селективности и проведения ионов Na+ и K+ через K+-канал бактерии Streptomyces lividans.
А - схема гидратированных и дегидратированных ионов Na+ и K+ в растворе и в поре К+-канала. Б - схема электронной плотности, полученная с высоким разрешением методом рентгеновской кристаллографии, демонстрирует ионы K+, проходящие через селективный фильтр. С - интерпретация карты электронной плотности, демонстрирующая два альтернативных состояния, при которых ионы K+ двигаются через канал
Сенсор напряжения
Работа сенсора напряжения была изучена в основном на примере K+-канала. Как полагают в настоящее время, первые четыре (S1-S4) функционируют как сенсор напряжения, а последние два (S5-S6) формируют проводящую пору. В области сенсора напряжения сегмент S4 имеет последовательность из четырех или более остатков аргинина или остатков лизина, причем каждый отделен двумя гидрофобными остатками, которые перемещаются в электрическом поле мембраны при изменении потенциала на мембране. Движение этих заряженных аминокислотных остатков было зарегистрировано экспериментально (так называемый воротный ток). Более того, было показано, что открытие одного канала сопровождается движением части белка с общим зарядом 13 элементарных зарядов (e0).
После работ группы MacKinnon Katz была представлена оригинальная «модель весла», построенная на основе идеи о погруженных в липид сегменте S2 и S1-S2-петли. Структура позволяла допустить, что сенсор напряжения располагается на N-терминали, ограниченной петлей S3, и/или на их С-терминали, ограниченной острым поворотом на остатке глицина в S5. Первые несколько поворотов, соответствующие части C- терминали из традиционного определения S4, упомянуты здесь как S4-S5-линкер. Пластичность последнего позволяет «веслам» сенсора напряжения двигаться свободно относительно белкового
«тела» канала, расположенного внутри мембраны
(рис. 1-20 А).
Основные заключения последних исследований следующие:
• сегменты S1, S2, S3 и S4 спиральные трансмембранные;
• петли не защищены от водной среды;
• заряды, которые несет S4, не расположены в липидном слое (рис. 1-20 Б).
Результаты исследований дают неопровержимое доказательство того, что воротные заряды сегмента S4 частично «выставлены» во внеклеточный раствор. Это принципиально расходится с концепцией гидрофобного катиона, центрального пункта в «модели весла».
Другой спорный вопрос касается степени смещения сегмента S4 поперек мембраны после активации канала. Для «модели весла» перемещение должно быть не менее 15-20 Е, тогда как в традиционных моделях это перемещение не превышает 5 Е. Результаты исследований методом резонансного переноса энергии показали, что вертикальное смещение сегмента S4 не превышает 2 Е. Столь небольшое движение не соответствует «модели весла» и поддерживает альтернативную модель, в которой белок формирует профиль электрического поля, фокусируя его поперек узкого региона сегмента S4. Мощное, но локальное электрическое поле в непосредственной близости от воротных зарядов объясняет, почему требуется лишь маленькое движение, чтобы перенести 13 e0 через локальную разность потенциалов при открытии канала.
Рис. 1-20. Гипотеза воротного движения зарядов. Схематические представления оригинальной «модели весла» и топологическая модель Cuello et al. в открытоинактивированном состоянии. На каждой из двух панелей внутриклеточная часть расположена внизу, а внеклеточная часть - сверху.
А - (1) «модель весла», как ее представляли Jiang et al. Сегменты S1-S4, S5-S6 - пора. В этой модели S1- и S2-сегменты вложены в двойной слой, и заряды S4 обращены в бислой. (2) В «модели весла» воротные заряды (надписанный плюс) можно было бы переносить через мембрану от внутренней поверхности (низ) до внешней поверхности (верх) движением весел сенсора напряжения внутри липидного слоя мембраны, что, в свою очередь, могло открыть пору. (3) MacKinnon et al. нашли, что сенсоры напряжения в бактериальном калиевом канале - заряженные «весла», движение которых осуществляется через жидкую мембрану в сторону внутриклеточной среды. Четыре сенсора напряжения (два из которых показаны на рисунке) связаны механически с воротами канала. Каждый сенсор напряжения имеет четыре привязанных положительных заряда (аргининовые аминокислоты). Высокая чувствительность ворот канала к потенциалу объясняется фактом, что открытие канала сопровождается перемещением в общей сложности 16 зарядов поперек мембраны. Хотя в 2007 г. сами авторы опровергли теорию «весла», она вошла во все зарубежные учебники, изданные в 2008 г. Именно поэтому мы вынуждены привести теорию «весла», отмечая ее несостоятельность. В следующей части рисунка (Б) мы приводим классическую теорию. Б - (1) топология, как это предложено Cuello et al. Сегменты S1-S4, S5-S6 - пора. S1 и S2 - это трансмембранные сегменты, S1 окружен остальной частью белка. S4-сегмент расположен на периферии, но его заряды направлены от бислоя и в центр белка с более внеклеточным зарядом, экспонированным в регион перехода бислоя липида. Поскольку большинство зарядов прикрыто сегментом S4, показаны только первый и четвертый заряды. (2) Обычная модель voltagedependent gating устанавливает, что воротные заряды перемещаются через ядро белка трансляцией и/или вращением-ротацией S4 спиралей, которые двигаются независимо от других белковых сегментов в пределах ворот поры. (3) Модель перемещения S4 в канале, приводящего к открытию или закрытию ворот
Сl--канал
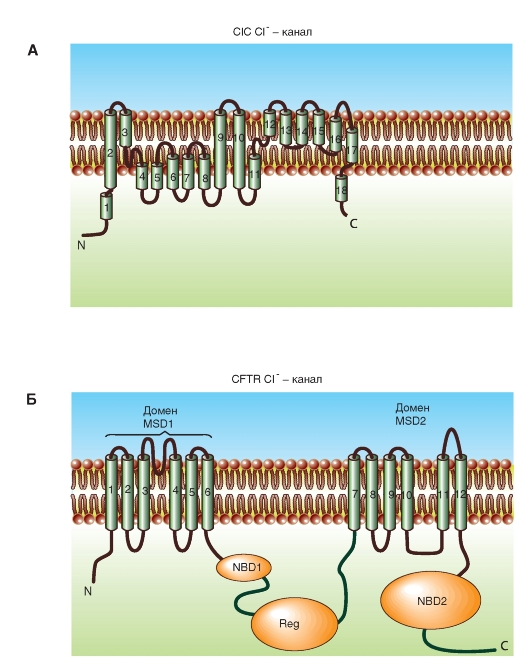
Потенциалуправляемые хлорные каналы ClC (рис. 1-21 А) были впервые клонированы в 1990 г. из электрического органа Torpedo. Эти клонированные каналы известны как ClC-0. Ген, кодирующий ClC-0, был впервые обнаружен в
мозге млекопитающих и относится к большому суперсемейству, включающему минимум восемь гомологичных генов.
Хлорный канал CFTR (рис. 1-21 Б) представляет собой гликопротеин с двумя находящимися в мембране доменами MSD1 и MSD2, причем каждый состоит из 6 трансмембранных сегментов.
Рис. 1-21. Молекулярная организация двух различных Сl--каналов.
А - потенциалуправляемые хлорные каналы ClC. Б - хлорный канал CFTR (cystic fibrosis transmembrane conductance regulator) эпителиальных клеток. В настоящее время он обнаружен в сердечных клетках
Механоуправляемые каналы
Механосенситивность представляет собой универсальное свойство практически всех клеток. Однако принцип передачи и преобразования механического стресса в ответную реакцию клетки до сих пор не ясен. Преобразование механического сигнала в клетке, по-видимому, должно реализовываться через:
• цитоскелет и его механохимические компоненты, такие, как актин и тубулин;
• клеточные поверхностные протеины, такие, как интегрины;
• механосенситивные ионные каналы (МСК). Из всех перечисленных структур, обеспечивающих механическую передачу в клетке, МСК наиболее просты в изучении, поскольку их ответ на механическое воздействие быстрый и легко оценивается. Наиболее важная информация относительно свойств МСК вначале была получена не от специальных механосенситивных клеток, а при изучении клеток, чья основная функция не связана с механочувствительностью. Это объясняется тем, что передача механического стресса в клетке тесно связана со структурными компонентами мембраны, натяжение которой они чувствуют, а получить изолированные клетки с неповрежденной мембраной достаточно сложно.
МСК отвечают на механический стресс мембраны изменением вероятности открытия канала. Эти каналы существуют в слуховых клетках, механорецепторах, мышечных веретенах, сосудистом эндотелии и нейросенсорной ткани, где их
физиологическая функция достаточно понятна. Однако менее понятно, почему электроневозбудимые клетки, такие, как клетки крови и эпителиальные клетки, нуждаются в каналах, которые отвечают на механические стимулы. По-видимому, это связано с тем, что все клетки должны сталкиваться с проблемой регуляции объема и электролитного гомеостаза. Регуляция клеточного роста также требует специфической механопередающей системы, которая определяет физические изменения клеточных размеров и формы. Таким образом, нельзя исключить, что нерегулируемый рост, характерный для раковых клеток, связан с поломкой такой механопередающей системы.
Определение канала как механосенситивного эмпирическое и означает изменение вероятности открытия канала в ответ на механическую деформацию мембраны. Механочувствительность определяется каналами, активирующимися при растяжении клетки, - stretch-activated channels (SAC). Определено, что изменение проницаемости МСК происходит в ответ на натяжение (tension) мембраны, которое «чувствует» канал или окружающие его липиды или связанный с ним цитоскелет мембраны.
На рисунке 1-22 А показаны молекулярная организация канала, активирующегося при растяжении клетки (SAC), и два основных сегмента канала: трансмембранный сегмент 1 (ТМ1) и трансмембранный сегмент 2 (ТМ2). Затем (рис. 1-22 Б, В) в двух плоскостях показан SAC в закрытом и открытом состоянии, при этом определено расположение всех сегментов канала.
Рис. 1-22. Молекулярная организация механосенситивного канала
Водный канал
На рис. 1-23 А представлена схематическая диаграмма топологии единичной субъединицы аквапорина с точки зрения ее положения в мембране. Три пары трансмембранных гомологичных альфа-спиралей (А и А', Б и Б', С и С) ориентированы в противоположные стороны с точки зрения плоскости мембраны и соединяются двумя гидрофильными петлями, содержащими короткие не пересекающие мембрану спирали и аспарагиновые (N) остатки. Эти петли изгибаются, образуя пору, окруженную шестью трансмембранными спиралями, которые встречаются в центре, образуя часть водно-селективных ворот.
На рис. 1-23 Б продемонстрирована структурная модель белка-тетрамера, состоящего из четырех одинаковых субъединиц. Каждая субъединица образует водный канал как видно в этой проекции при взгляде сверху на белок с экзоплазматической стороны. Один из мономеров показан
с молекулярной поверхностью в которой видна пора «вход» в устье канала.
На рис. 1-23 В показан вид поры сбоку в единичной аквапориновой единице в которой несколько молекул воды (кислород показан красным цветом и водород - голубым) видны в 2 нанометровых водно-селективных воротах, которые отделяют отделы водосодержащего цитозоля клетки и внеклеточной среды. Ворота содержат высоко стабильные (консервативные с точки зрения последовательности) аргининовые и гистидиновые последовательности, и две аспарагиновые (голубой цвет) последовательности, чьи боковые цепи образуют водородные связи с транспортируемой водой (ключевые последовательности ворот изображены синим цветом). Транспортируемая вода так же образует водородные связи с карбониловыми группами главной цепи цистеновой последовательности. Расположение этих водородных связей и узкий диаметр поры в 0.28 нанометра предотвращает прохождение через канал протонов (например H3O+) или других ионов.
Рис. 1-23. Молекулярная организация белка водного канала аквапорина.
А - планометрическая структура одной субъединицы аквапорина в мембране. Б - структурная модель белка-тетрамера. В - вид поры сбоку
Ионные насосы
АТФ-энергетические насосы определяют так называемый активный транспорт. Активный транспорт использует энергию для осуществления перемещения вещества через мембрану из области низкой концентрации в область высокой, т.е. против электрохимического градиента вещества.
Активный транспорт требует связывания транспортируемого вещества с переносчиком мембраны. Поскольку эти переносчики перемещают вещество против градиента концентрации, они называются «насосами». Насосы, обеспечивающие активный транспорт, специфичны для транспортируемого вещества и насыщаемы, т.е. их поток максимален, когда все специфические места связывания с переносимым веществом заняты.
Движение из области с более низкой концентрацией к области с более высокой и обеспечение поддержания установившейся концентрации на одной стороне мембраны могут быть достигнуты только непрерывным энергетическим обеспечением транспортного процесса. Эта энергия может:
• изменять аффинность центра связывания на транспортере так, чтобы аффинность связывания на одной стороне мембраны была более высокой, чем на другой;
• изменять скорости, с которыми центр связывания на переносчике сдвигается от одной поверхности до другой.
Активный транспорт должен быть связан с одновременным переходом некоторого источника энергии от более высокого энергетического уровня к более низкому энергетическому уровню. Для активного транспорта известно два варианта использования переносчиками энергии:
• прямое потребление АТФ в первично активном транспорте;
• использование градиента концентрации ионов относительно мембраны, созданного первично активным транспортом, для управления процессом вторично активного транспорта. Рассмотрим АТФ-энергетические насосы
(АТФазы), которые транспортируют ионы против их концентрационного градиента. Ионные насосы на основании особенностей их молекулярной организации могут быть сгруппированы в три класса (P, V и F). На рисунке 1-24 показаны
их основные структуры, а свойства коротко суммированы в табл. 1-1. Все три класса АТФаз имеют одно или более мест связывания с АТФ на цитозольной поверхности мембраны.
Ионные насосы класса Р самые простые по структуре и состоят из четырех трансмембранных полипептидных субъединиц - 2α и 2β. Большая α-субъединица фосфорилируется в течение процесса транспорта, сквозь нее перемещаются транспортируемые ионы.
Первый тип насосов класса Р - это несколько Са2+-ATФаз. Одна из Са2+-АТФаз расположена в плазматической мембране клетки и транспортирует ионы Са2+ из клетки во внеклеточную среду. Другие Са2+-ATФазы расположены в мембране внутриклеточных структур, например саркоплазматическом ретикулуме мышечных клеток. Они транспортируют ионы Са2+ из цитоплазмы в саркоплазматический ретикулум. Некоторые Са2+-ATФазы находятся в мембране ряда внутриклеточных органелл, в которые они транспортируют ионы Са2+. Благодаря работе Са2+- АТФаз концентрация ионов Са2+ в цитоплазме поддерживается на намного меньшем уровне, чем во внеклеточной среде.
Вторым типом насосов класса Р служит насос, сопрягающий транспорт Na+ и K+, который выкачивает три иона Na+ из клетки, одновременно вводя два иона K+ в клетку против его электрохимического градиента. Таким образом, возникнет негативный внутриклеточный потенциал мембраны клетки (потенциал покоя клетки). Такой электрогенный Na+/K+-насос основан на Na+/K+- ATФазе, расположенной исключительно в плазматической мембране клетки.
Третий тип насоса класса Р найден в некоторых секретирующих кислоту клетках. Он транспортирует протоны (ионы Н+) из клетки, а ионы К+ в клетку.
Ионные насосы классов V и F сходны по структуре друг с другом, но не гомологичны с классом Р. Все известные типы этих двух классов насосов транспортируют только протоны. Насосы класса F включают, по крайней мере, три вида трансмембранных белков, а насосы класса V - два вида. Оба класса содержат как минимум пять видов внеклеточных полипептидов. Две трансмембранные субъединицы и две внешние субъединицы в насосах класса F гомологичны с такими же класса V.
Рис. 1-24. АТФ-энергетические насосы
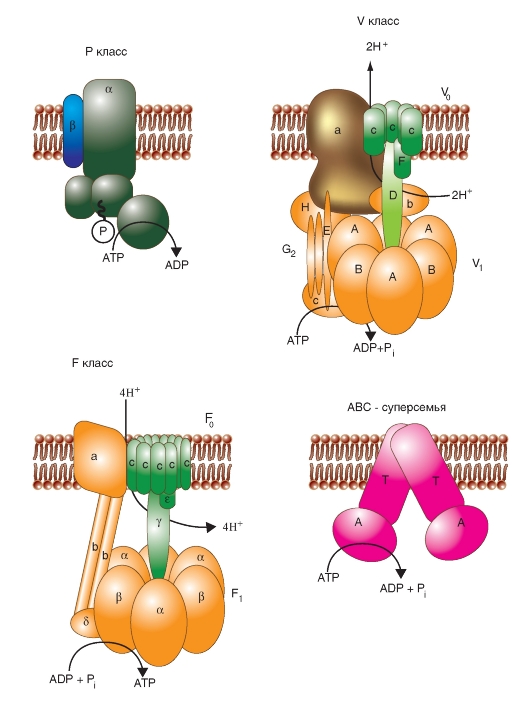
Са2+-АТФаза
Одним из типов класса Р является Ca2+- ATФаза, часто называемая Ca2+-насосом. Молекулярная организация Ca2+-ATФазы показана на рис. 1-25 А. Она поддерживает концентрацию свободных ионов Ca2+ в пределах от 10-7 до 2х10-7 М. Необходимо отметить, что не все цитозольные ионы Ca2+ свободны. Некоторые из них связаны с отрицательными зарядами молекул фосфатов, оксалатов или АТФ. Но главным для работы клетки служит концентрация свободных несвязанных ионов Ca2+.
У большинства клеток эукариотов Са2+-ЛТФаза, локализованная в плазматической мембране клеток, транспортирует Ca2+ из клетки против его концентрационного градиента, поскольку внеклеточная концентрация Ca2+ равна примерно 3х10-3 М.
Мышечные клетки содержат вторую, отличающуюся Ca2+-АТФазу, транспортирующую Са2+ из цитозоля в полость саркоплазматического ретикулума, внутриклеточной структуры, которая накапливает и хранит ионы Ca2+. Саркоплазматический ретикулум и его Ca2+-насос очень важны для сокращения и релаксации мышц. Освобождение ионов Ca2+ из саркоплазматического ретикулума в цитозоль мышечной клетки вызывает сокращение, а быстрое удаление ионов Ca2+ из цитозоля Ca2+-насосом - расслабление мышц.
Принцип работы Ca2+-ATФазы показан на рис. 1-25 Б.
Кальциевый насос в мышцах
Одиночный трансмембранный α-полипептид c молекулярной массой 100 000 обладает активностью Ca2+-ATФазы и транспортирует два иона Ca2+ при гидролизе одной молекулы АТФ до АДФ, причем для формирования комплекса с АТФ необходим Mg2+. (В большей части ферментативных реакций, в которых АТФ играет роль донора фосфата, участвует активная форма АТФ, а именно - комплекс Mg2+-АТФ.) Функции и даже существование β-субъединицы спорны.
Крайне высокая аффинность центров связывания этого фермента для ионов Са2+ (Km=10-7 M) на поверхности, обращенной в цитозоль, позволяет ему очень эффективно связывать и транспортировать Ca2+ из цитозоля, где концентрация свободного Ca2+ находится в диапазоне от 10-7 M (покоящиеся клетки) до более чем 10-6 M (сокращающаяся клетка), в полость саркоплазматического
ретикулума, где общая концентрация Ca2+ может быть высокой, достигая 10-2 M. Активность мышечной Ca2+-ATФазы регулируется концентрацией свободного Ca2+. Если эта концентрация становится слишком высокой, скорость закачивания Ca2+ увеличивается до тех пор, пока его концентрация не станет меньше чем 10-6 M.
Концентрация свободного Ca2+ внутри саркоплазматического ретикулума значительно меньше, чем его общая концентрация, максимально равная 10-2 M. Два растворимых протеина в полостях везикул саркоплазматического ретикулума связывают ионы Ca2+. Один, кальсеквестрин (calsequestrin) (молекулярная масса 44 000), с сильно выраженными кислотными свойствами: 37% его остатков это аспарагиновая и глутаминовая кислоты. Каждая молекула кальсеквестрина связывает 43 иона Ca2+ с величиной Km, примерно равной 1х10-3 M. Второй - высокоаффинный Са-связывающий протеин, - имеет более низкую «валентность» для ионов Ca2+, но высокую аффинность (Km=3x10-6-4x10-6 М) по сравнению с кальсеквестрином. Такие протеины работают как резервуары для внутриклеточного Ca2+, снижая концентрацию свободных ионов Ca2+ в везикулах саркоплазматического ретикулума и соответственно уменьшая энергию, необходимую для закачивания ионов Ca2+ внутрь этих везикул из цитозоля.
Кальциевый насос в плазматической мембране
Плазматическая мембрана животных, дрожжевых и, возможно, растительных клеток содержит Ca2+-ATФазы, транспортирующие ионы Ca2+ из цитозоля во внеклеточный раствор. Во многих случаях активность этих ферментов стимулируется повышением в цитозоле свободного Ca2+, вызванного, например, гормонной стимуляцией. Связывающий кальций регуляторный протеин кальмодулин (calmodulin) - существенная субъединица Са2+-АТФазы эритроцита и других Ca2+-ATФаз плазматической мембраны. Подъем цитозольного Ca2+ приводит к связыванию ионов Ca2+ с кальмодулином, запускающим аллостерическую активность Ca2+-АТФазы. Как результат этого экспорт ионов Ca2+ из клетки ускоряется, и восстанавливается исходно низкая концентрация свободного Ca2+ в цитозоле (примерно 1х10-6 M).
Рис. 1-25. Молекулярная организация Са2+-АТФазы.
А - молекулярная организация. Б - проведение ионов Са2+ через молекулу Са2+-АТФазы
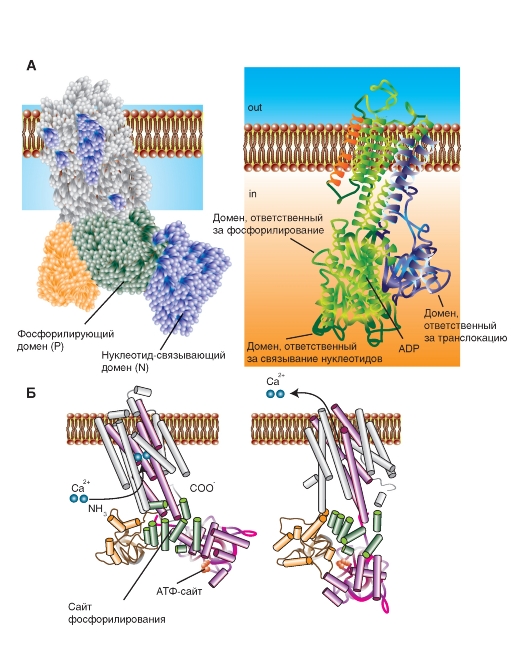
Работа Са2+-АТФазы
на молекулярном уровне
На предыдущем рисунке основное внимание уделялось структуре Ca2+-АТФазы. На рис. 1-26 представлен цикл работы насоса этого типа с позиций изменения конформаций отдельных доменов Ca2+-АТФазы. В виде схематических блоков на рисунке представлены нуклеотид-связывающий домен (NB), домен, ответственный за фосфорелирование (P), и структура, обеспечивающая транслокацию (ТА) - проталкивание двух ионов Ca2+ на другую сторону протеина и соответственно мембраны.
Цикл можно описывать со структуры насоса, связанного с АДФ. В этом состоянии 2 иона Са2+ изолированы в пределах мембранного региона насоса. Гипотетическая последовательность структурных изменений ассоциируется с транслокацией Са2+ кальциевым насосом. В основе транслокации лежат процессы фосфорилирования и дефосфорилирования которые вызывают
конформационные изменения (показанные стрелками), в результате чего происходит перемещение 2 ионов Са2+ через мембрану.
Когда протеин находится в исходной конформации два иона Ca2+ по очереди связываются с высокоаффинными участками поверхности протеина, обращенной в сторону цитозоля. Затем АТФ связывается с другим определенным участком поверхности протеина, обращенной в сторону цитозоля. Одновременное присутствие ионов Ca2+ и Mg2+-АТФ запускает гидролиз АТФ. При этом освобожденный фосфат (концевая фосфатная группа в АТФ) переносится от АТФ к карбоксильной группе остатка аспарагиновой кислоты протеина (фосфорилирование белка по карбоксильной группе аспарагиновой кислоты), формируя высокоэнергетическую ацилфосфатную связь. Происходит образование фосфорилированного протеина (или ферментфосфатного комплекса). Это изменение конформации протеина ведет к одновременному проталкиванию двух ионов Ca2+ на другую сторону протеина и соответственно мембраны.
Рис. 1-26. Молекулярный механизм работы Ca2+-АТФазы.
Обозначения: NB - домен, ответственный за связывание нуклеотидов; Р - домен, ответственный за фосфорилирование; ТА - домен, ответственный за транслокацию
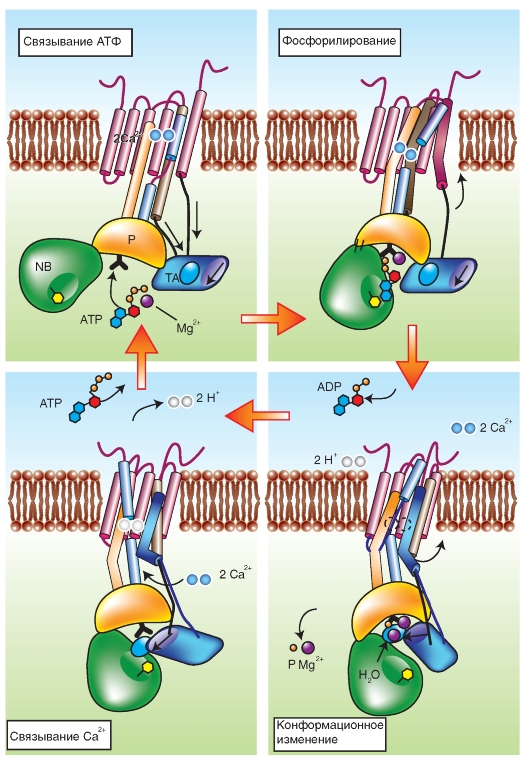
Схема работы Са2+-АТФазы
Когда протеин находится в исходной конформации E1, сначала один и затем второй ион Ca2+ связываются с высокоаффинными (Km=10-7 M) участками поверхности протеина, обращенной в сторону цитозоля (этап 1). Ионы Mg2+ не влияют на связывание ионов Ca2+, поскольку сродство к Ca2+ у центров связывания в 30 тыс. раз выше, чем у Mg2+.
После связывания ионов Ca2+, Mg2+-АТФ связывается с другим определенным участком поверхности протеина, обращенной в сторону цитозоля (Km=2x10-5 M) (этап 2). В интактной клетке лишь очень незначительное количество АТФ и АДФ содержится в виде свободных анионов. В основном эти соединения представлены комплексами Mg2+-АТФ и Mg2+-АДФ. При этом сродство Mg2+ к АТФ в 10 раз превышает сродство к АДФ.
Таким образом, оба лиганда (ионы Ca2+ и комплекс Mg2+-АТФ) присоединены к разным центрам на поверхности молекулы протеина, обращенной в сторону цитозоля. Низкое значение Km ионов Ca2+ (Km=10-7 M) свидетельствует о том, что даже при низкой концентрации ионов Ca2+ значительная часть их будет связана с насосом.
Одновременное присутствие на своих местах ионов Ca2+ и Mg2+-АТФ (этап 3) запускает следующий этап - гидролиз АТФ. При этом освобожденный фосфат (концевая фосфатная группа в АТФ) переносится от АТФ к карбоксильной группе остатка аспарагиновой кислоты протеина (фосфорилирование белка по карбоксильной группе аспарагиновой кислоты), формируя высокоэнергетическую ацилфосфатную связь. Происходит образование фосфорилированного протеина (или ферментфосфатного комплекса), отмеченного как Е1~Р (этап 4A). На этом этапе, однако, возможно обратное преобразование АДФ в АТФ. Константа Km образовавшегося АДФ с ферментфосфатным комплексом (Е1~Р) составляет примерно 5x10-5 М и практически совпадает с константой Km связывания АТФ с ферментом (Km=2x10-5 M). Свободная энергия гидролиза АТФ (около 40 кДж на 1 М) потратилась на образование комплекса Е1~Р (фосфорилирование фермента) с высокоэнергетической ацилфосфатной связью (символ «~Р» обозначает высокоэнергетическую ацилфосфатную связь). Таким образом, связь фосфата в фосфорилированном белке также богата энергией, которая высвобождается при ее гидролизе.
Фосфорилирование протеина запускает преобразование Е1 в Е2. (Протеин меняет свою
конформацию, и это дает возможность обозначить комплекс как E2-P, подразумевая, что Е2, по сравнению с Е1, имеет другую конформацию.) Процесс изменения конформации протеина происходит мгновенно после его фосфорилирования, поэтому мы выделяем его в этап 4Б для лучшего понимания процесса.
Это изменение конформации протеина ведет к одновременному проталкиванию двух ионов Ca2+ на другую сторону протеина и соответственно мембраны (транслокация). При переходе двух ионов Ca2+ высокоэнергетическая ацилфосфатная связь теряет макроэргическую энергию. Она превратилась в изменение сродства к Ca2+ (на четыре порядка). В результате этого изменения энергии фосфатной связи из АДФ уже не получить АТФ. Эта конформация протеина уже не имеет центров с крайне высокой аффинностью для ионов Са2+ на поверхности фермента, обращенной в цитозоль. При транслокации ионов к поверхности протеина, которая смотрит в полость саркоплазматического ретикулума, образуются два центра связывания со слабой аффинностью для ионов Ca2+. Одновременно с проталкиванием ионов Ca2+ через протеин в результате изменения конформации белка происходит отщепление АДФ.
Переход ионов на другую сторону протеина не завершает процесс. Необходима энергия, чтобы ионы оторвались от центров связывания. Она также обусловлена гидролизом АТФ. В результате гидролиза образуется комплекс Е1~Р с макроэргической фосфатной связью, а само высвобождение энергии происходит в результате изменения характера связи фосфатной группы с ферментом (т.е. перехода ~Р в -Р). Эта энергия, ранее сосредоточенная в макроэргической фосфатной связи, расходуется и на изменение константы связывания ионов Ca2+ с ферментом. Константа Km становится равной примерно 10-3 M. С энергетической точки зрения это означает изменение энергии связывания, т.е. два иона Са2+ уходят от поверхности протеина (этап 5).
Естественно, что для повторения цикла необходимо еще одно конформационное изменение протеина. Дефосфорилирование завершает переход Е2 в Е1. Изменение конформации вызывает образование высокоаффинных центров связывания с ионами Ca2+ на поверхности протеина, обращенной в сторону цитозоля. Низкоаффинные центры связывания с Ca2+ на противоположной стороне протеина в этой конформации отсутствуют (этап 6 = 1).
Рис. 1-27. Схема механизма работы Ca2+-АТФазы
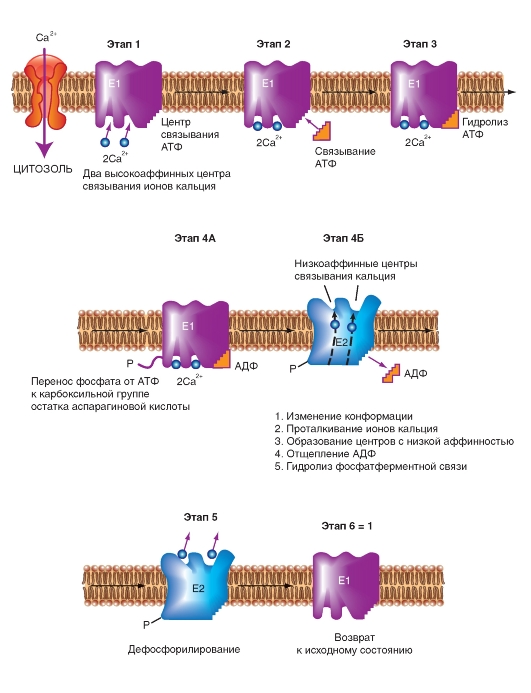
Nа+/К+-АТФаза
Второй тип насосов класса Р, который был изучен в деталях, это Na+/K+-ATФаза, присутствующая в плазматических мембранах (рис. 1-28 А). Она была растворена и очищена от мембранной фракции нескольких типов клеток животных, например клеток почек млекопитающих и электрических органов угря (тканей, очень богатых этим ферментом). Этот ионный насос представляет собой тетрамер 2α2β. Полипептид β (молекулярная масса 50 000) представляет собой трансмембранный гликопротеин, необходимый для того, чтобы заново синтезируемая α-субъединица свернулась должным образом. Но полипептид β, очевидно, не вовлекается впрямую в перенос ионов. Субъединица α (молекулярная масса 120 000) - это полипептид, у которого аминокислотная последовательность и предсказанная структура в мембране очень сходны с таковыми у Са2+-АТФазы саркоплазматического ретикулума в мышце. В частности, Na+/K+- ATФаза имеет «стебель» на цитозольной стороне, с которым связаны домены, содержащие связывающие АТФ участки и фосфорилированный аппарат. Общий процесс транспортного движения трех свободных ионов натрия из клетки и двух ионов калия в клетку на молекулу АТФ продемонстрирован на (рис. 1-28 Б).
Экспериментальные результаты свидетельствуют о том, что Na+/K+-ATФаза ответственна за взаимосвязанное движение ионов натрия и калия из клетки и в клетку. Например, четкая взаимосвязь между током ионов натрия и калия через плазматическую мембрану и активность Na+/K+-ATФазы наблюдалась в мембране различных тканей. Кроме того, вещество оуабаин, связывающее со специфическим регионом на экзоплазматической поверхности протеина, специфически ингибирует Na+/K+-ATФазу, а также предотвращает поддержание натриево-калиевого баланса клетками.
Механизм действия Na+/K+-ATФазы подобен механизму Са2+-ATФазы. Полный механизм переноса включает в себя несколько этапов работы, которые проходят в определенной последовательности, представленной на схеме (рис. 1-28 В).
На схеме показаны общие особенности механизма переноса. На внутриклеточной стороне мембраны Na+/K+-ATФаза находится в конформации, называемой Е1. Эта конформация имеет специфические катионсвязывающие центры, имеющие высокую аффинность и к ионам Na+, и к АТФ (приблизительно 0,2х10-6 M). Внутри клетки три иона Na+ связываются с белком в конформации Е1, предварительно связанным с Mg2+-АТФ с образованием комплекса [Е1АТФ3Na+]. Связывание ионов Na+ способствует фосфорилированию. Фосфорилирование переводит белок в форму E1P. В ней он может быть дефосфорилирован АДФ в обратимой реакции, описанный как обмен АТФ ↔ АДФ. Однако, когда АДФ уходит, ионы Na+, связанные с ферментом, остаются в нем «запечатаны» в форме [E1P(3Na+)]. Стехиометрическое «запечатывание» транспортируемых ионов - ключевой аспект активного катионного транспорта. Именно в таком виде в белке происходит конформационный переход, определяющий перенос ионов на противоположную сторону мембраны. Ионы Na+ покидают белок на внеклеточной поверхности (первый ион более быстро, а второй и третий более медленно), и ферментфосфатный комплекс [Е2Р] больше не чувствителен к добавлению АДФ, но чувствителен к водному гидролизу. Эта форма белка в виде [Е2Р] связывает два иона K+ на внешней поверхности с образованием комплекса [Е2Р2K+]. Связывание ионов приводит к дефосфорилированию фермента. На внутренней поверхности Pi освобождается, и ионы K+ становятся «запечатанными» [E2(2K+)], чтобы осуществился перенос. Освобождение ионов K+ во внутриклеточный раствор должно катализироваться АТФ, связывающейся с местом с низкой аффинностью (приблизительно 150х10-6 M) с образованием комплекса [E2АТФ(2K+)]. Фермент возвращается из E2 к форме E1 с низкой аффинностью к ионам K+ [E1АТФ(2K+)] (процесс, управляемый разницей в энергии связывания для АТФ). Ионы K+ покидают комплекс на внутренней поверхности, в результате чего образуется комплекс [Е1АТР]. Теперь белок готов начать новый цикл.
Рис. 1-28. Молекулярная организация Na+/K+-ATФаза.
А - молекулярная организация Са2+-АТФазы. Б - принцип работы Na+/K+-ATФаза. В - общие представления о механизме переноса
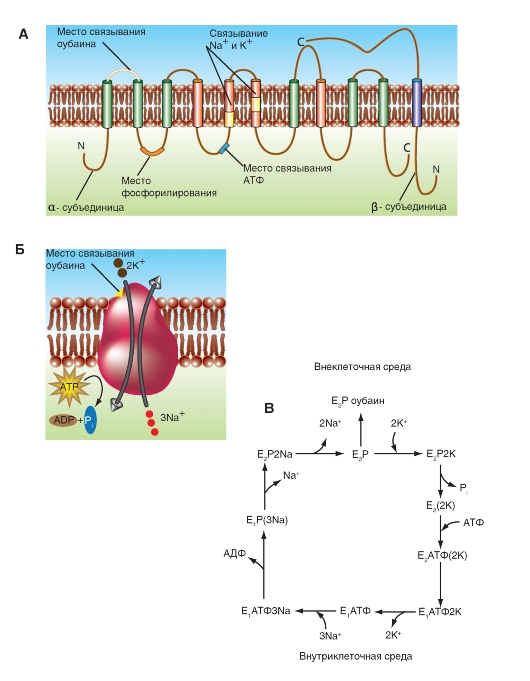
Схема работы Nа+/К+-АТФазы
В виде схемы молекулярный механизм работы Na+/K+-АТФазы представлен на рис. 1-29. Рассмотрим его детально. Когда протеин находится в исходной конформации, называемой Е1, его сторона, обращенная в цитозоль, имеет три высокоаффинных места для связывания ионов Na+. При этом другой определенный участок поверхности протеина, обращенной в сторону цитозоля, уже связан с Mg2+-АТФ (этап 1). Сначала один, а затем второй и третий ионы Na+ связываются с высокой аффинностью с определенными участками поверхности протеина, обращенной в сторону цитозоля (этапы 2 и 3). Константа связывания Km для Na+ этими центрами связывания равна 0,6х10-3 M, и эта величина значительно меньше, чем внутриклеточная концентрация Na+ (≈12 мМ). Это подчеркивает, что в норме ионы Na+ должны заполнять центры связывания (этап 3).
Одновременное присутствие на своих местах связывания ионов Na+ и Mg2+-АТФ (этап 3) запускает следующий этап - гидролиз АТФ (этап 4). Связанный с протеином Mg2+-АТФ гидролизуется до АДФ, а освобожденный фосфат (концевая фосфатная группа в АТФ) переносится от нее к карбоксильной группе остатка аспарагиновой кислоты протеина (фосфорилирование белка по карбоксильной группе аспарагиновой кислоты), формируя высокоэнергетическую ацилфосфатную связь, в результате чего происходит образование фосфорилированного протеина (или ферментфосфатного комплекса), отмеченного как Е1~ Р (этап 5). Далее отщепляется АДФ, и одновременно проталкиваются три иона натрия (этап 6). В белке происходит конформационный переход (от Е1 к Е2), определяющий перенос ионов и центров связывания на противоположную сторону мембраны, причем там ионы Na+ имеют низкоаффинную связь с центрами связывания. Далее на внеклеточной поверхности сначала один ион Na+ быстро покидает белок (этап 7), а затем, более медленно, два других (этап 8).
Одновременно с транслокацией ионов натрия на внеклеточную сторону белка переходят центры связывания для ионов К+, причем транслокация
приводит к тому, что эти центры приобретают высокую аффинность для ионов К+ (этап 7). Именно с ними (этап 8 и 9) связываются два иона К+. Km для связывания ионов К+ в этих местах равна примерно 0,2 мМ. Это значительно меньшая величина, чем внеклеточная концентрация ионов К+ (2+4 мМ). Это подчеркивает, что данные места будут заполнены ионами К+ (этап 8 и 9). На внутренней поверхности Pi освобождается, и ионы K+ «запечатываются», в результате чего осуществляется перенос (этап 10), и два связанных иона К+ движутся через протеин и становятся соединенными с низкоаффинными центрами связывания на цитозольной стороне. Далее АТФ связывается с местом с низкой аффинностью (приблизительно 150х10-6 M) с образованием комплекса (этап 11). При этом одновременно происходит изменение конформации протеина Е2 в Е1. Связывание АТФ способствует освобождению ионов K+ во внутриклеточную среду (этап 12). После этого ионы К+ диссоциируются в цитозоль, и протеин готов начать новый цикл.
Коэффициент сопряжения удаляемых ионов Na+ и поступающих ионов обычно равен трем к двум, т.е. насос является электрогенным, и его работа вызывает возникновение трансмембранной разности потенциалов, причем потенциал внутри клетки становится более отрицательным, чем он был бы без учета работы насоса, исходя только из градиентов концентраций ионов и относительных проницаемостей мембраны или только диффузионного потенциала. В нормальных условиях вклад потенциала, создаваемого Na+/K+-насосом, составляет несколько милливольт.
Блокада Na+/K+-АТФазы первое время незначительно влияет на потенциал покоя. Возникает небольшая деполяризация на 2-6 мВ, представляющая вклад Vp (потенциал насоса) в Vm (потенциал мембраны). Однако через несколько минут после блокады потенциал покоя медленно снижается вследствие постепенного уменьшения градиентов концентраций ионов. В результате увеличения деполяризации уменьшается скорость нарастания потенциала действия и, следовательно, скорость распространения возбуждения. В конце концов, происходит полная потеря возбудимости.
Рис. 1-29. Схема молекулярного механизма работы Na+/К+-АТФазы
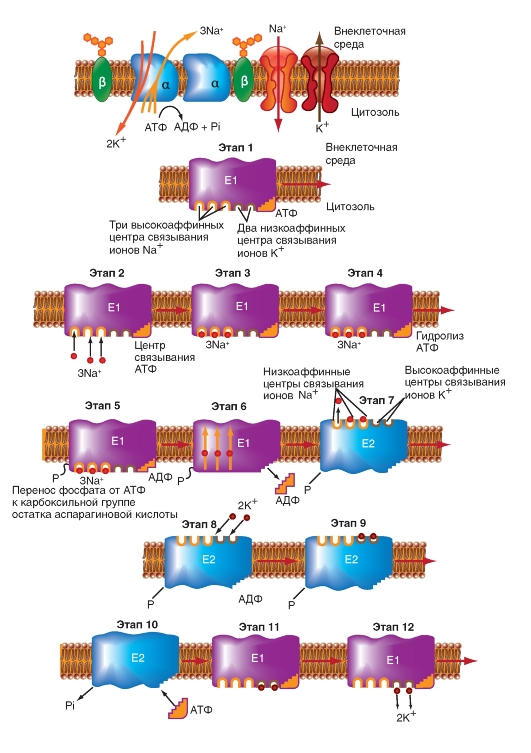
Обменники, транспортеры и ко-транспортеры
Вторично-активный транспорт отличается от первично-активного транспорта использованием градиента концентрации ионов относительно мембраны как источника энергии. Поток ионов от более высокой концентрации (более высокое энергетическое состояние) к более низкой концентрации (более низкое энергетическое состояние) обеспечивает энергию для движения активно транспортируемого вещества из области его низкой концентрации в область его высокой концентрации при вторично-активном транспорте.
В дополнение к наличию центра связывания для активно транспортируемого вещества, транспортный белок во вторично-активной транспортной системе также имеет центр связывания для иона. Этот ион - часто Na+, но в некоторых случаях, это может быть другой ион типа HCO3-, Cl- или K+. Связывание иона со вторично-активным транспортером вызывает изменения в транспортере, а именно (1) изменение афинности центра связывания на транспортере для транспортируемого вещества, или (2) изменения скорости, с которой центр связывания на транспортном белке перемещается от одной поверхности до другой. Обратите внимание, что при первично-активном транспорте транспортный белок изменен ковалентной модуляцией, как следствием ковалентной связи фосфата с транспортным белком; во вторично-активном транспорте, изменения вызваны аллостерической модуляцией в результате связывания иона.
Имеется очень важная непрямая связь между вторично-активными транспортерами, которые используют Na+ и первично-активным транспортером Na+ - Na,K-ATPазой. Напомним, что внутриклеточная концентрация Na+ намного ниже, чем внеклеточная концентрация Na+, потому что первично-активный транспорт Na+ при помощи Na,K-ATPазы выносит Na+ из клетки. Изза низкой внутриклеточной концентрации Na+, немногие центры связывания Na+ на вторичноактивном транспортном белке заняты на внутриклеточной поверхности транспортера. Это различие обеспечивает основание для асимметрии в транспортных потоках, ведя к движению против градиента концентрации транспортируемого
вещества. В то же самое время, ион Na+, который связывается с транспортером на внеклеточной поверхности движется по градиенту концентрации в клетку, когда меняется конформация транспортера.
В целом, создание градиента концентрации Na+ через плазматическую мембрану первичноактивным транспортом Na+ означает непрямое «сохранение» энергии, которая может затем быть использована, чтобы управлять вторично-активными транспортными системами, связанными с Na+. В конечном счете, энергия для вторичноактивного транспорта получена от ATP, который используется Na,K-ATPазой, чтобы создать градиент концентрации Na+. Если бы продукция ATP была бы ингибирована, первично-активный транспорт Na+ прекратился бы, и клетка больше не была бы способна поддержать градиент концентрации Na+ относительно мембраны. Это, в свою очередь, вело бы к отказу работы вторичноактивных транспортных систем, которые зависят от градиента Na+, как источника энергии. От 10% до 40% ATP, синтезированной клеткой в условии покоя используется Na,K-ATPазой, чтобы поддержать градиент Na+, который в свою очередь управляет множеством вторично-активных транспортных систем.
Движение натрия вторично-активным транспортным белком всегда идет от высокой внеклеточной концентрации в клетку, где концентрация натрия более низкая. Таким образом, во вторично-активном транспорте, движение Na+ - всегда идет по градиенту концентрации, в то время как движение активно транспортируемого вещества на том же самом транспортном белке всегда осуществляется против градиента концентрации, то есть перемещения проходят от более низкой до более высокой концентрации. Движение активно транспортируемого вещества при вторичноактивном транспорте может быть или в клетку (в том же самом направлении как Na+), тогда этот процесс называется ко-транспортом или из клетки (против направления движения натрия), тогда это называется противотранспортом.
На рис. 1-30, расположенном на двух страницах, показано 18 наиболее распространенных обменников, транспортеров, ко-транспортеров, расположенных в мембране различных клеток.
Рис. 1-30. Некоторые известные типы обменников (exchanger), транспортеров (transporter) и ко-транспортеров (co-transporter), расположенных в мембране различных клеток
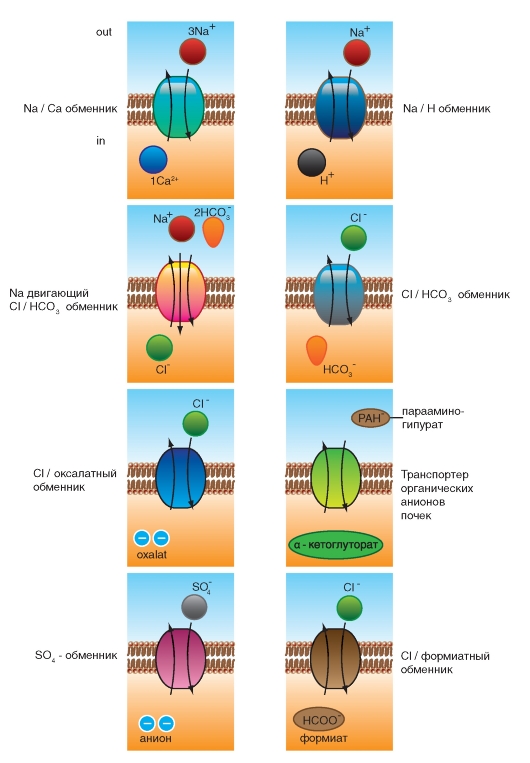
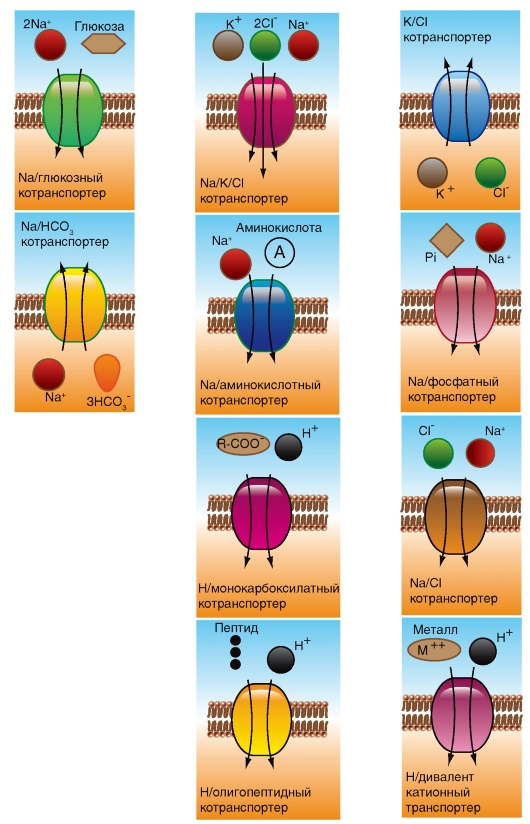
Аббревиатуры аминокислот
Рис. 1-31. Аббревиатуры различных аминокислот и свойства их концевых цепей
Индексы физических величин
Физические константы

Величины КT/F (or kвТ/qe)
Рис. 1-32.Физические единицы и константы
Электрохимический потенциал

Равновесный потенциал

Рис. 1-33. Электрохимический и равновесный потенциал
Расчет равновесного потенциала для ионов
Концентрации ионов в цитоплазме гигантского аксона кальмара, в крови кальмара
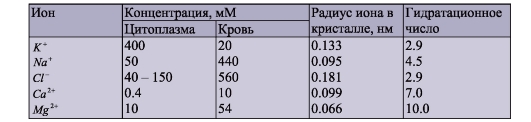
Расчет равновесного потенциала для основных ионов у гигантского аксона кальмара
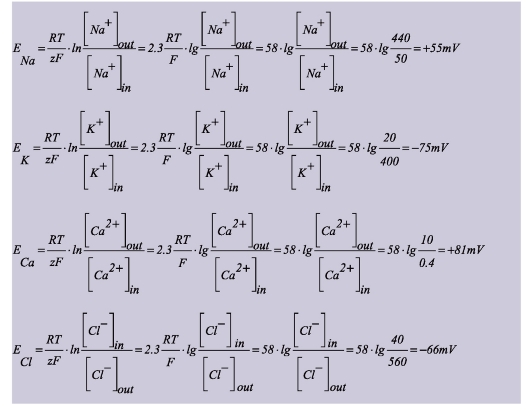
Рис. 1-34. Рассчет равновесного потенциала для ионов у гигантского аксона кальмара
Уравнение Д. Гольдмана (D.E. Goldman):
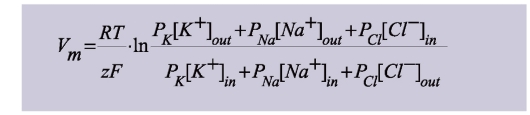
Поток ионов через мембрану

Рис. 1-35. Поток ионов через мембрану и формула Гольдмана
Электрические свойства клетки
Искусственные мембраны представляют собой только липидный бислой и не содержат белков (рис. 1-36 А1). Показанную на данном рисунке мембрану можно представить в виде эквивалентной электрической схемы (рис. 1-36 А2), включающей емкостной компонент мембраны (С) и резистивный компонент (R). Это связано с тем, что, во-первых, липидный бислой впрямую можно уподобить электрическому элементу конденсатору, а во вторых, электрическому элементу резистору (сопротивлению).
Простейший конденсатор представляет собой две обкладки, находящиеся на небольшом расстоянии друг от друга. Когда его подсоединяют к источнику постоянного тока, то одна его обкладка заряжается положительно, а другая - отрицательно. Емкость такого конденсатора зависит от площади обкладок (чем меньше площадь, тем меньше емкость) и от расстояния между ними (чем меньше расстояние, тем больше емкость). Напряжение V на зажимах элемента емкости и ток I, проходящий через элемент, связаны между собой соотношением:

Удельная емкость искусственных липидных мембран Мюллера и Мюллера-Рудина (С) равна около 0,4-1 μF/cm2. (Эта величина близка и для мембран клеток, поскольку и их емкость обусловлена исключительно липидным бислоем.)
Вместе с тем искусственный липидный бислой обладает крайне высоким сопротивлением (R), величина которого лежит в диапазоне 106-109 Ωхcm2 (поскольку жир, по существу, служит изолятором), что на несколько порядков выше сопротивления биологической мембраны
(Rm), величина которой около 103 Ωхcm2. Как было отмечено, столь высокое сопротивление липидного бислоя можно понизить добавлением белков (электрическое сопротивление которых значительно меньше электрического сопротивления липидов) или соединений, образующих ионные каналы.
В электротехнике напряжение V, приложенное к элементу активного сопротивления R, и ток I, проходящий через него, связаны между собой линейным соотношением, которое представляет собой запись закона Ома:

Рассмотрим теперь реальную мембрану клетки, представленную на рис. 1-36 Б1. Такая мембрана содержит липидный бислой, в который встроены различные белковые молекулы, выполняющие разнообразные функции, о чем речь пойдет в следующих разделах. Это и различные рецепторные белки, и белки ионных каналов, через которые ионыдвижутся пассивно, и, наконец, белки, ответственные за активный перенос ионов (например, показанная на рисунке Na+/K+-АТФаза).
Такую мембрану можно представить в виде эквивалентной электрической схемы (рис. 1-36 Б2), включающей емкостной компонент мембраны (Сm) и резистивный компонент (Rm). Емкостной компонент (Сm) реальной мембраны клетки обусловлен исключительно ее липидным бислоем, а резистивный компонент (Rm) белками, встроенными в липидный бислой, и, прежде всего, белками, образующими ионные каналы. Но в эту эквивалентную электрическую схему введена еще и батарея (Em), формирующая разность потенциалов относительно мембраны. Ее роль выполняет специфический белок мембраны - Na+/K+-АТФаза, создающая разность потенциалов относительно мембраны клетки.
Рис. 1-36. Пассивные электрические свойства клетки.
В части (А) представлены модель искусственной мембраны (А1) и ее эквивалентная электрическая схема (А2), состоящая из емкости (конденсатора) (С), роль которого играет липидный бислой, и сопротивления (R) этого липидного бислоя. В части (Б) представлены модель мембраны клетки (Б1) и ее эквивалентная электрическая схема (Б2), состоящая из конденсатора (Сm), роль которого играет липидный бислой, переменного сопротивления (Rm), при помощи которого моделируют ионные каналы, находящиеся в открытом или закрытом состоянии, и, наконец, батареи (Em), создающей разность потенциалов между внешней и внутренней средой клетки. Обратите внимание, что на эквивалентной электрической схеме мембраны элемент «батарея» последовательно соединен с элементом «сопротивление», что соответствует требованиям классической электроники. Однако роль батареи выполняет все та же мембрана, а ее разность потенциалов создает находящийся в мембране белок (фермент) Na+/К+-АТФаза, которая схематично представлена в круге
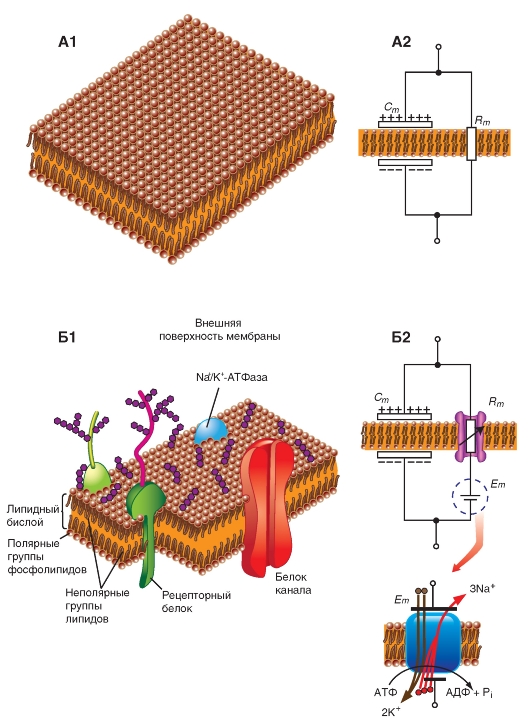
Сопротивление мембраны клетки
Для изучения мембран клеток применяются законы, используемые для описания элементов линейных цепей и их параллельного и последовательного соединений, рассмотренные выше. Обсудим их применительно к пассивным электрическим характеристикам клеток.
Одноизэтихпассивныхэлектрическихсвойств- отношение изменения мембранного потенциала (DVm) к току I, текущему через мембрану (рис. 1-37 А).
Это отношение называется сопротивлением мембраны (R) и измеряется в Омах. Сопротивление характеризует способность мембраны препятствовать протеканию тока. Поскольку ток течет не только через нее, но и через внутреннюю и наружную среды, а геометрия клетки часто неизвестна, суммарное сопротивление, преодолеваемое током, называется входным сопротивлением (Rinput или, сокращенно, - Rin). Закон Ома, описывающий соотношение между током, напряжением и сопротивлением в электрических цепях, полностью применим и к биологическим мембранам:

Величина, обратная сопротивлению (1/Rin), характеризует способность мембраны проводить ток. Это соотношение называется проводимостью (Gin). Уменьшение сопротивления мембраны эквивалентно увеличению проводимости.
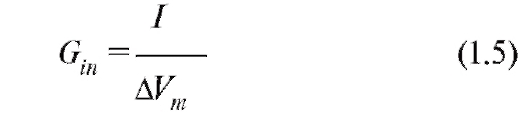
Рассмотрим идеализированное тело нейрона без аксонов и дендритов (рис. 1-39 Б).
Если с помощью внутриклеточного электрода пропускать ток силой 0,1 нА (1 нА = 10-9 А) наружу, то он равномерно протекает через всю поверхность клеточной мембраны (за счет эквипотенциальности поверхности шара идеализированной клетки). В результате деполяризационный сдвиг потенциала на 10 мВ, зарегистрированный в соседней точке внутри клетки, указывает на то, что в этой точке клетка (мембрана и аксоплазма) имеет сопротивление 100 MОм (1 MОм = 106 Ом):
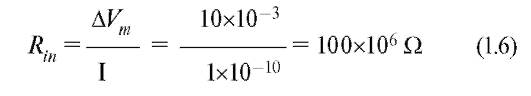
Такая величина типична, например, для нервных клеток моллюсков. В зависимости от геометрии клетки и свойств мембраны входные сопротивления нейронов могут варьировать в пределах
от 105 до 108 Ом; чем меньше клетка, тем выше ее входное сопротивление (при одинаковых свойствах мембраны). Сопротивление мембраны можно изобразить соединенным последовательно с батареей, создающей мембранный потенциал Em.
Поскольку при измерении Rin размеры и форма нейрона не учитываются, этот параметр не подходит для сравнения свойств мембраны у клеток различной величины и формы. Вместо этого применяют стандартизированный параметр - удельное сопротивление мембраны (Rm), соответствующее поперечному сопротивлению 1 см2 мембраны.
Таким образом, удельное сопротивление мембраны определяется двумя факторами:
• сопротивлением мембраны, являющимся мерой проводящих свойств мембраны, т.е. ее проницаемости для ионов;
• общей площадью поверхности мембраны.
Для клетки, имеющей входное сопротивление 100 MОм и радиус 100 мкм (площадь поверхности 1,26х10-3 или приблизительно 10-3 см2), получим:
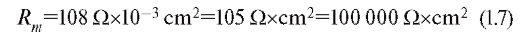
Эта величина также типична для тел нервных клеток моллюсков. У большинства других животных мембраны клеточных тел нейронов более проницаемы для ионов и обладают значительно меньшими величинами мембранного сопротивления - примерно от 20 Омхсм2 (перехваты Ранвье периферических аксонов лягушки) до 16 000 Омхсм2 (тела маутнеровских клеток миноги).
Однако в экспериментальной работе площадь поверхности клетки измерить крайне сложно, поэтому в исследованиях для нормирования используют емкость мембраны, так как она пропорциональна площади поверхности клетки.
Для сферической клетки без дендритов с радиусом r и поверхностью 4πr2 величина Rm определяется по формуле:
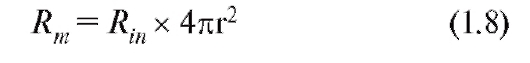
Кроме сопротивления мембраны Rm (Омхсм2), или иначе удельного сопротивления мембраны, используют следующие параметры:
Сопротивление мембраны на единицу длины волокна rm (Омхсм), равное Rm/πd, где d - диаметр волокна.
Сопротивление цитоплазмы (rin) на единицу длины для тока, текущего вдоль аксона, равное Rin/πr2. Для клетки с Rin, равным 50 Омхсм, и радиусом аксона 50 мкм, rin равно 6,3х105 Ом/см.
Кроме того, используют внеклеточное сопротивление rout (Ом/см) на единицу длины для тока, текущего вдоль аксона.
Емкость мембраны
Стимулируя клетку небольшими импульсами электрического тока, можно изучить еще одно свойство мембраны. Если даже импульсы тока (Im), вызывающие изменение мембранного потенциала (DVm), нарастают и спадают очень быстро (это прямоугольные импульсы), мембранный потенциал все равно будет нарастать и спадать медленно (рис. 1-37 В). Это обусловлено еще одним физическим свойством мембраны - ее емкостью. Емкость накапливает заряды на своей поверхности, и поэтому будет оказывать сопротивление любым изменениям потенциала. Ток может течь в емкость или из нее только тогда, когда напряжение на ней меняется. Как только емкость зарядится до потенциала, равного подаваемому на нее, емкостной ток прекратится. Таким образом, емкость не препятствует изменениям потенциала, а замедляет его увеличение и уменьшение.
Мембрана работает как емкость, потому что внутриклеточная и внеклеточная среды представляют собой электролиты, которые являются хорошими проводниками, тогда как имеющая высокое сопротивление мембрана служит хорошим изолятором. Благодаря своим емкостным свойствам клетки могут накапливать (или разделять) заряды. Например, если импульс постоянного электрического тока вызовет изменение мембранного потенциала, то на внутренней и наружной поверхностях мембраны возникнет заряд, пропорциональный DVm. . Входная емкость мембраны (Cin) будет определяться как отношение заряда q (Кл), возникшего на каждой стороне мембраны, к изменению мембранного потенциала:
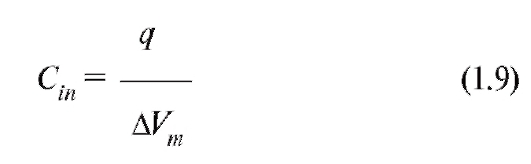
Емкость клетки прямо пропорциональна площади поверхности мембраны (большая площадь внешнего и внутреннего жидких проводников позволяет мембране удержать больший заряд) и обратно пропорциональна ее толщине (увеличение толщины мембраны уменьшает взаимодействие зарядов, находящихся на каждой из
проводящих поверхностей). Поскольку толщина всех клеточных мембран примерно одинакова (7,5 нм), емкость мембраны (Cm) зависит, главным образом, от площади поверхности и рассчитывается на 1 см2 поверхности мембраны. Мембранный потенциал клетки равен заряду мембраны, деленному на ее емкость (Vm=q/Cm). Емкость измеряется в фарадах: 1 Ф=1 Кл (6,24х1018 электронов) на 1 В.
Если бы мы пропустили прямоугольный импульс электрического тока только через сопротивление мембраны, он вызвал бы прямоугольный скачок напряжения. Но поскольку мембрана работает так же как и емкость, а та удерживает заряды, проходящему через мембрану току требуется некоторое время, чтобы изменить потенциал на мембране. Поскольку емкость и сопротивление мембраны соединены параллельно, напряжение на них будет одно и то же, так что в каждый данный момент емкость мембраны будет нести заряд, пропорциональный мембранному потенциалу. Для того чтобы импульс электрического тока смог полностью изменить мембранный потенциал до нового значения (определяемого силой тока и сопротивлением мембраны), ток сначала должен изменить заряд на емкости мембраны и сдвинуть его до уровня, соответствующего новому мембранному потенциалу. Таким образом, ток, подаваемый в клетку, сначала должен войти в емкость и выйти из нее, изменив ее заряд. По мере того как мембранный потенциал постепенно приближается к своему новому значению, все меньшая доля тока проходит через емкость и все большая доля начинает проходить через сопротивление. Когда емкость зарядится до конца, весь ток будет течь через сопротивление.
Таким образом, когда на мембрану подается импульс электрического тока, он идет по двум путям. Сначала ток протекает по емкости мембраны, изменяя заряд на ней. Этот компонент тока называется емкостным током (IC). По мере заряда емкости снижаются емкостная составляющая тока и основная часть оставшегося тока, та, которая шла через сопротивление. Этот второй компонент называется током сопротивления (IR), или ионным током (в клетках, где электричество переносится только ионами). Эти токи схематически представлены на рис. 1-37 А, В.
Итак, если мы подаем на мембрану ток, то протекание его через Rm описывается законом Ома:
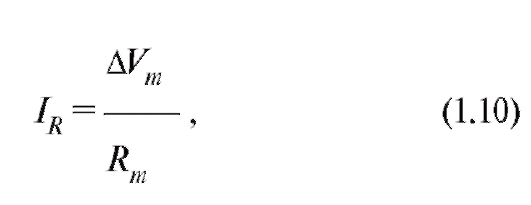
где ∆Vm - изменение мембранного потенциала, производимое током IR.
Протекание тока через емкость можно рассчитать следующим образом. Емкостной ток равен скорости изменения заряда, т.е. IC = dq/dt. Поскольку q=CmVm, величина емкостного тока определяется
величиной емкости Cm и скоростью изменения напряжения (dVm/dt):

Таким образом, общий ток через мембрану будет равен:
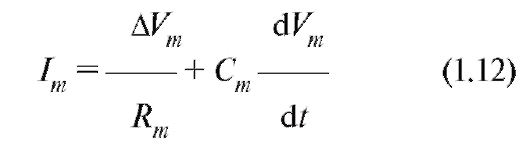
Временной ход IR можно оценить по записи мембранного потенциала, так как ∆Vm=lRm. Поскольку IR+IC=Im, ток через емкость (IC) можно получить, вычитая из Im величину IR.
Рис. 1-37. Сопротивление и емкость мембраны.
А - эквивалентная электрическая схема для участка мембраны, включающая только батарею (Em), формирующую мембранный потенциал и последовательно соединенное с ней электрическое сопротивление (rm). От генератора через мембрану пропускается постоянный электрический ток. Его величина регистрируется амперметром. Мембранный потенциал регистрируется тем или иным измерительным прибором (для простоты на схеме показан вольтметр). Зная величину подаваемого тока и величину зарегистрированного потенциала по закону Ома, можно рассчитать входное сопротивление мембраны клетки. Б - идеализированное тело клетки с эквипотенциальной поверхностью (например, нейрона без аксона и дендритов) при исследовании внутриклеточных потенциалов. Согласно классической схеме в клетку введен один микроэлектрод, регистрирующий ее потенциал, и второй микроэлектрод, соединенный с генератором прямоугольных импульсов электрического тока, используемый для смещения потенциала клетки в сторону деполяризации или гиперполяризации. В - эквивалентная электрическая схема для участка мембраны. (1) Если приложен прямоугольный импульс электрического тока Im (красная кривая), создающий небольшой (пассивный электротонический) потенциал ∆vm , то этот ток разлагается на резистивную (синяя кривая) и емкостную (голубая кривая) составляющие. Разностью im и ir является ic. (2) Цепь содержит батарею em, создающую потенциал покоя, соединенную последовательно с сопротивлением rm и параллельно с емкостью Cm. Эквивалентная электрическая схема моделирует небольшой участок мембраны. На схеме показано, как часть тока проходит через сопротивление (ir) и называется ионным током; другая часть течет к емкости и от емкости и называется емкостным током (IC)
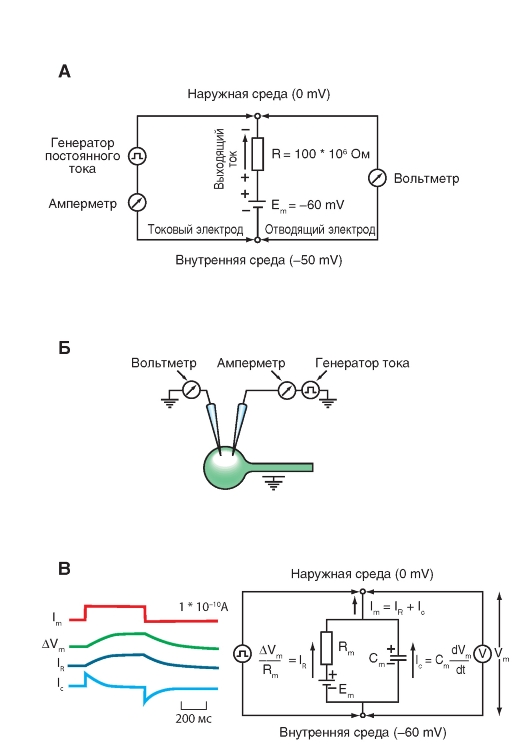
Постоянная времени мембраны
Постоянная времени мембраны (τm) - это время, необходимое для того, чтобы импульс постоянного тока зарядил емкость мембраны (сферической клетки) на 63% или, точнее, довел ее заряд до 1-1/е от его конечного значения, обусловленного величиной импульса электрического тока.
В фазе подъема (рис. 1-38 А2, А3) изменение потенциала Vm во времени при подаче импульса электрического тока описывается уравнением:
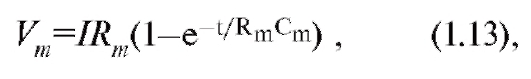
где I - величина ступеньки тока, пропускаемого через мембрану; IRm - конечное значение мембранного потенциала, обусловленного импульсом электрического тока. При t = τ = RmCm имеем:
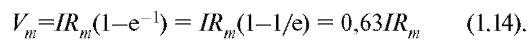
Постоянную времени мембраны (τ = RmCm) можно измерить непосредственно по записям напряжения (см. рис. 1-38 А2, А3). В приведенном примере для нейрона моллюска с Rm= 100 000 Омхсм2 типичное значение τm будет равно 100 мс. Для различных клеток значения τm варьируются от одной до нескольких сотен миллисекунд. У сферической клетки без аксона и дендритов постоянную времени можно представить как:

Таким образом, измерение τm важно также для оценки Cm. Пусть τm равно 100 мс, a Rm - 100 000 Омхсм2, тогда емкость Cm будет равна 1 мФ/см2:
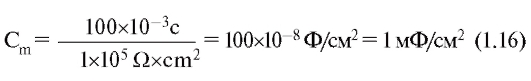
Постоянная длины мембраны
Постоянная длины мембраны (λ) - это расстояние от точки в нейроне, где при помощи внутриклеточного электрода был изменен мембранный потенциал, до той точки на аксоне, где этот потенциал потеряет 63% или иначе 1 = 1/e своей первоначальной величины.
Изменения потенциала в различных точках аксона можно измерить с помощью введения регистрирующих электродов (V1, V2, V3, V4) на различных расстояниях вдоль аксона (рис. 1-38 Б1). Пусть аксон имеет большой диаметр, сравнимый с размером клеточного тела. Тогда постоянная длины (в сантиметрах) будет определяться формулой:

где Rm - удельное сопротивление мембраны; rin - удельное сопротивление аксоплазмы; d - диаметр аксона. Мы приводим лишь конечную формулу, поскольку в основе ее вывода лежат те же принципы, что и для постоянной времени.
Постоянная длины мембраны - это расстояние, на которое вдоль аксона электротонически распространяются подпороговые сигналы. Если нейрон имеет сопротивление Rm= 100 000 Омхсм2 и rin= 50 Омхсм2, постоянная длины при диаметре аксона 20 мкм равна 1 см. Но для аксонов малого диаметра d постоянная длины может быть значительно меньше и достигать 0,1 см.
Рис. 1-38. Определение постоянных времени и длины.
А - постоянная времени. На панели А1 изображена схема эксперимента. Через стимулирующий внутриклеточный микроэлектрод на клетку подается импульс электрического тока, а изменения мембранного потенциала измеряют с помощью регистрирующего внутриклеточного микроэлектрода. На панели А2 показано изменение мембранного потенциала во времени (нижняя кривая) на фоне подачи длительного импульса постоянного электрического тока (верхняя кривая). Ток вызывает деполяризацию величиной 10 мВ и сдвигает мембранный потенциал с -60 до -50 мВ. Время, необходимое для достижения 63,2% этого изменения, называют постоянной времени клеточной мембраны. В данном примере она равна 100 мс. На панели А3 показано изменение мембранного потенциала во времени (нижняя кривая) на фоне подачи короткого импульса постоянного электрического тока (верхняя кривая). Б - постоянная длины. На панели Б1 изображен принцип эксперимента. Через стимулирующий внутриклеточный микроэлектрод, введенный в аксон, подается импульс электрического тока, который распространяется электротонически по аксону, а изменения мембранного потенциала измеряются внутриклеточными регистрирующими микроэлектродами в точке стимуляции (V1) и в различных точках вдоль аксона (V2, V3, V4, V5). На панели Б2 показаны изменения мембранного потенциала в зависимости от расстояния (сверху) и график уменьшения амплитуд. На панели Б3 изображена схема эксперимента. Через стимулирующий внутриклеточный микроэлектрод, введенный в тело нейрона, подается импульс электрического тока, который распространяется электротонически по аксону, а изменения мембранного потенциала измеряются внутриклеточными регистрирующими микроэлектродами у основания аксона (V1) и в различных точках вдоль него (V2, V3, V4, V5). Внизу показаны изменения мембранного потенциала в зависимости от расстояния. В теле клетки ток вызывает деполяризацию величиной 10 мВ и сдвигает мембранный потенциал с -60 до -50 мВ (V1). На расстоянии 1 см (V2) это изменение потенциала уменьшается на 63%, достигая 37% своего исходного значения (3,7 мВ). Это расстояние (1 см) называют постоянной длины мембраны аксона
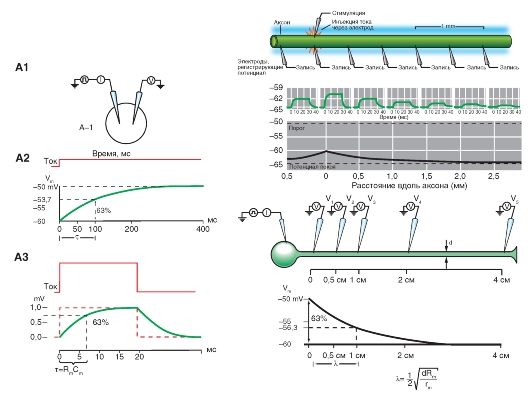
Потенциал покоя и его механизмы
Потенциал покоя клетки определяется работой Na+/K+-АТФазы и выходом ионов K+ по каналам утечки при очень незначительном входе ионов Na+ через них (рис. 1-39 А). Распределение ионов относительно мембраны, а именно внутри клетки, поддерживается механизмом активного транспорта Na+ и K+, или электрогенным Na+/K+-насосом, который удерживает внутри клетки концентрацию Na+ на низком, а концентрацию K+ на высоком уровнях, транспортируя Na+ из клетки наружу, а K+ из наружной среды внутрь. Поскольку равновесный потенциал для ионов Na+ равен +55 мВ, а потенциал мембраны клетки лежит в диапазоне от -60 до -80 мВ, существует движущая сила для ионов Na+, и они устремляются по каналам утечки вовнутрь клетки, что могло бы деполяризовать ее мембрану. Однако каналы утечки проницаемы и для ионов K+, для которых сохраняется электрохимический градиент, направленный из внутриклеточной области к внеклеточной среде. Так как равновесный потенциал ионов K+ равен примерно -90 мВ, через мембрану одновременно проходят и ионы K+ тем самым, противодействуя деполяризации, обусловленной входящим током
ионов Na+. При этом работа Na+/K+-АТФазы удерживает внутри клетки концентрацию Na+ на низком, а концентрацию K+ на высоком уровнях. Имеющуюся в клетке трансмембранную разность потенциалов можно зарегистрировать.
Если микроэлектрод, подключенный к предварительному усилителю, показанному на рис. 1-39 Б, подключить к измерительной схеме и ввести в физиологичский раствор, где расположены ткань или клетки, при этом замкнуть цепь через индифферентный электрод, то при сбалансированном усилителе и компенсации физико-химических свойств микроэлектрода на экране осциллографа мы будем регистрировать линию (рис. 1-39 В), соответствующую измерительному нулю, равному нулю при закороченных входах усилителя. Теперь если подвести при помощи микроманипулятора микроэлектрод вплотную к мембране клетки и проколоть ее, то на экране осциллографа можно зарегистрировать падение нулевого потенциала и разность потенциалов между внутренней и наружной средами клетки, величина которой для разных клеток лежит в диапазоне от -40 до -80 мВ. Именно эта разность, представленная на рис. 1-39 В, служит потенциалом покоя клетки.
Рис. 1-39. Потенциал покоя клетки и принцип его регистрации.
А - структуры мембраны, формирующие потенциал покоя. На панели А представлена мембрана клетки, канал утечки, Nа+-канал, К+-канал и -АТФаза, которая выкачивает ионы Na+ из клетки против его электрохимического градиента, одновременно вводя ионы K+ в клетку также против его электрохимического градиента. Каналы утечки, через которые осуществляется очень незначительный вход ионов Na+ в клетку и превышающий его в 100 раз выход ионов К+ из клетки. За счет каналов утечки и работы Na+/K+-АТФазы возникает негативный внутриклеточный потенциал мембраны клетки - потенциала покоя. Б - измерительная схема. В - потенциал покоя
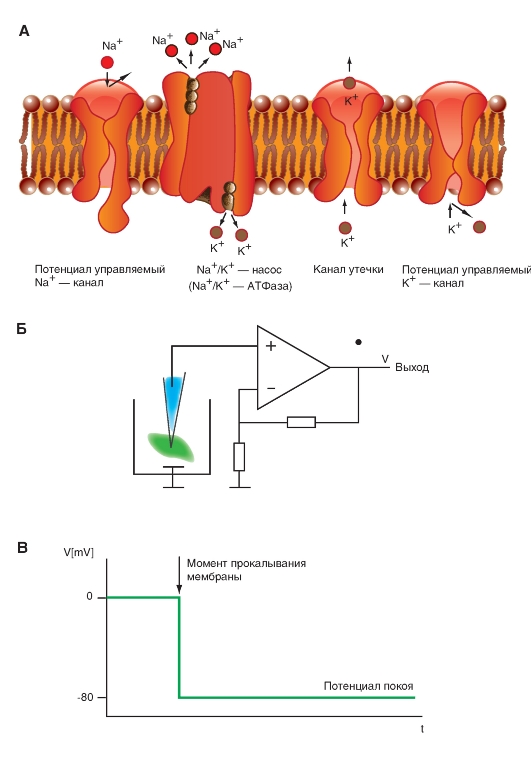
Потенциалы клетки, возникающие при деполяризации ее мембраны, и принцип искусственного смещения потенциала
Помимо потенциала покоя (рис. 1-40 А), пассивный транспорт ионов через ионные каналы мембраны определяет возникновение еще трех потенциалов, представленных на рисунке. К ним принадлежат пассивный электротонический потенциал (рис. 1-40 Б), локальный ответ (рис. 1-40 В) и потенциал действия (рис. 1-40 Г). Однако для их возникновения требуется поляризация мембраны клетки. Эта поляризация может осуществляться как внеклеточно, что обычно используют на нервных волокнах, так и внутриклеточно, что применяют на клетках. Пассивный электротонический потенциал зарождается при заведомо подпороговом смещении потенциала покоя. Локальный ответ возникает при подпороговом, но близком к порогу смещении потенциала покоя. Наконец, потенциал действия зарождается, когда смещение потенциала покоя доведено до пороговой величины.
Однако, чтобы зарегистрировать эти потенциалы, необходимо искусственное смещение потенциала покоя клетки. Возможность внутриклеточной поляризации мембраны, включающей деполяризацию и гиперполяризацию, крайне необходима
для изучения свойств мембраны. Искусственное смещение мембранного потенциала дает возможность не только изучать пассивные электрические характеристики клеток, но и исследовать межклеточные взаимодействия, осуществляемые непосредственно через высокопроницаемые контакты мембран клеток. Однако возможность внутриклеточной поляризации мембран должна непременно сочетаться с возможностью одновременной регистрации биоэлектрической активности клеток и тех изменений этой активности, которые возникают вследствие приложения электрического тока.
В наиболее примитивном виде принцип внутриклеточной поляризации мембран при возможности одновременной регистрации биоэлектрической активности клеток представлен на рис. 1-40 Д. В этом случае в клетку одновременно вводят два микроэлектрода, один из которых поляризующий, а другой - регистрирующий. На экране двухлучевого осциллографа можно видеть весь процесс: на первом канале регистрируется величина поляризующего сигнала, а на втором канале - мембранный потенциал и его искусственное смещение, вызванное поляризацией мембраны. Следует помнить, что прямое подключение поляризующего микроэлектрода к генератору невозможно, для этого существуют специальные схемы.
Рис. 1-40. Изменение мембранного потенциала в зависимости от силы раздражения.
А - потенциал покоя. Б - пассивный электротонический потенциал. В - локальный ответ. Г - потенциал действия. Д - выход
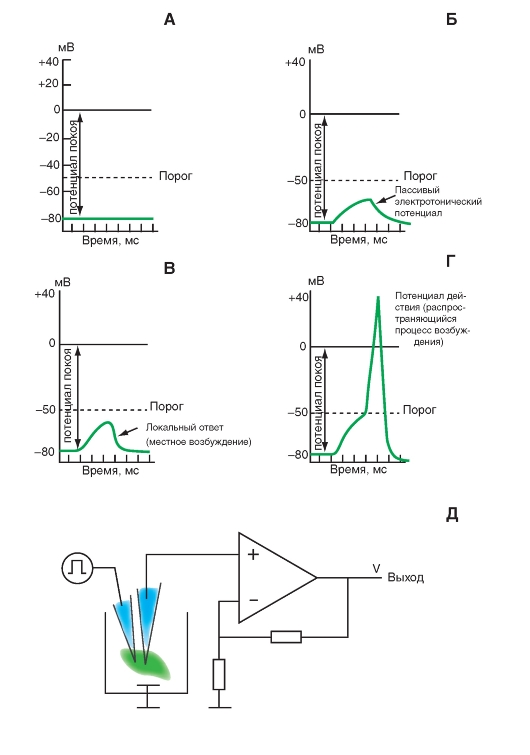
Пассивный электротонический потенциал
Пассивный электротонический потенциал можно зарегистрировать с помощью одного внутриклеточного микроэлектрода, если через второй микроэлектрод внутриклеточно поляризовать клетку прямоугольным импульсом электрического тока, не достигающим критического потенциала (подпороговым) (рис. 1-41 А).
Пассивный электротонический потенциал возникает в ответ на подпороговый импульс электрического тока, который не приводит к открытию потенциалуправляемых ионных каналов и определяется только емкостными и резистивными свойствами мембраны клетки. Емкостной компонент мембраны обусловлен исключительно липидным бислоем, а резистивный компонент - белками, образующими ионные каналы и встроенными в липидный бислой.
Липидный бислой можно уподобить конденсатору, две обкладки которого находятся на небольшом расстоянии друг от друга, и при подаче тока одна обкладка заряжается положительно, а другая - отрицательно. Ионные каналы липидного бислоя или в этом случае мембраны клетки обладают проводимостью, и, следовательно, мембрана характеризуется электрическим сопротивлением.
На рисунке 1-41 Б изображена эквивалентная электрическая схема мембраны клетки, а на рис. 1-41 В показана эквивалентная электрическая схема фрагмента мембраны. На подаваемый ток и изменения сопротивления и напряжения эта схема реагирует точно так же, как и сама мембрана.
Данная схема включает емкостной компонент мембраны (Сm) и резистивный компонент (Rm), а также учитывает сопротивления внешней среды rout и сопротивление цитозоля rin. Поскольку значения rout и rin малы, ими можно пренебречь, хотя это достаточно грубая аппроксимация. Кроме того, rout много меньше rin
Если на мембрану через один микроэлектрод подать подпороговый прямоугольный импульс электрического тока положительной полярности (рис. 1-41 Г - импульс красного цвета), то усилитель, подключенный ко второму микроэлектроду, зарегистрирует изменения мембранного потенциала, форма которого отличается от прямоугольника (зеленая кривая). Это и есть пассивный электротонический потенциал.
Если мы подаем на мембрану ток, то его протекание через Rm описывается законом Ома:

где Vm - потенциал на Rm.
Протекание тока через емкость можно рассчитать следующим образом:

Таким образом, для общего тока, текущего в покое через мембрану, получаем:
Емкостной компонент мембраны Сm обусловлен исключительно липидным бислоем, а резистивный компонент Rm - белками, образующими ионные каналы и встроенными в липидный бислой. Интегрируя выражение, получим:
где Rm Сm =τm , что называется постоянной време- ни (временем релаксации мембраны). Постоянная времени мембраны τ - одна из важнейших характеристик пассивного электротонического потенциала, которая отражает пассивные свойства мембраны. Последнее уравнение крайне важно, поскольку величины τm и Rm можно, в отличие от Cm, зарегистрировать экспериментально и, следовательно, таким образом рассчитать Cm. С помощью постоянной времени и Rm можно полностью описать пассивные свойства эквивалентной схемы (или мембраны).
Постоянная времени характеризует временной ход изменений мембранного потенциала, т.е. скорость, с которой он меняется при переходе от одного значения к другому. Постоянная времени мембраны - это время, необходимое для того, чтобы импульс постоянного тока зарядил емкость мембраны на 63% (см. рис. 1-41 Г).
Сходная картина возникает, если на мембрану через один микроэлектрод подать аналогичный по силе прямоугольный импульс электрического тока отрицательной полярности (рис. 1-41 Д - импульс красного цвета). В этом случае пассивный электротонический потенциал будет направлен в отрицательную область (зеленая кривая).
Рис. 1-41. Пассивный электротонический потенциал
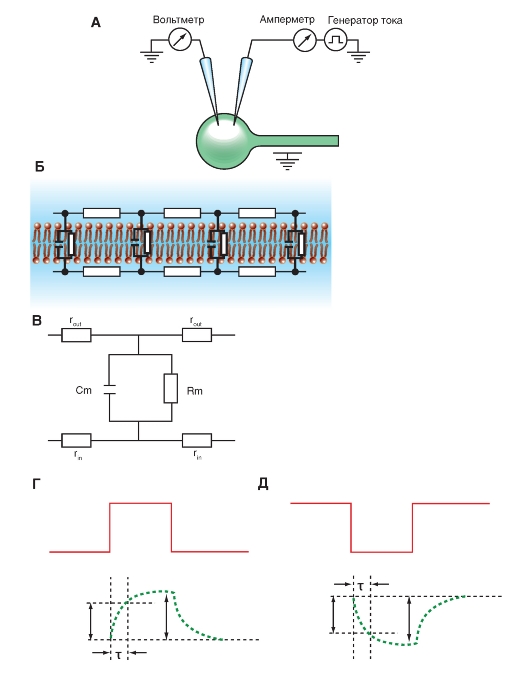
Механизм пассивного электротонического потенциала
Пассивный электротонический потенциал определяется только емкостными и резистивными свойствами мембраны клетки, но мы относим его к потенциалам клетки, связанным с пассивным ионным транспортом, т.е. транспортом через ионные каналы. Это обусловлено тем, что электрическая цепь, включающая положительный вход усилителя, микроэлектрод, клетку, индифферентный электрод и отрицательный вход усилителя, может быть замкнута только в том случае, если мембрана имеет возможность проводить через себя электрический ток, носителем которого в системе клетки и внеклеточного раствора служат ионы. Эту возможность дают постоянно открытые каналы утечки. Однако пассивный электротонический потенциал не приводит к открытию потенциалуправляемых ионных каналов. В том случае емкостные и резистивные свойства мембраны клетки достаточно постоянны. Емкость в основном определяется липидным бислоем, а сопротивление клетки зависит от сопротивления, которое определяется открытыми каналами утечки.
На рисунке 1-42 А показан пассивный электротонический потенциал, в котором мы искусственно выделяем отдельные фазы (0 - потенциал покоя, 1 - фаза нарастания, 2 - фаза падения), а также клетка в каждую из этих фаз. Из рисунка следует, что на фоне потенциала покоя, т.е. в фазу 0, открыты только каналы утечки, через которые ионы К+ выходят из клетки, а ионы Na+ в незначительном количестве входят в клетку. Это соотношение обычно принято как К+: Na+=100:1. При этом потенциалуправляемые Na+- каналы, обеспечивающие входящий ток, и потенциалуправляемые К+-каналы, обеспечивающие выходящий ток, закрыты (находятся в состоянии покоя). В фазу 1 и фазу 2 также открыты только каналы утечки, через которые ионы К+ выходят из клетки, а ионы Na+ в незначительном количестве входят в клетку. Соотношение K+:Na+=100:1 не меняется. При этом потенциалуправляемые Na+-каналы, обеспечивающие входящий ток, и потенциалуправляемые К+-каналы, обеспечивающие выходящий ток, также закрыты (находятся в состоянии покоя). При нарастании потенциала (фаза 1), как и при его падении (фаза 2) до уровня
потенциала покоя, не происходит никаких изменений ионных токов, поскольку, как отмечалось, пассивный электротонический потенциал определяется только емкостными и резистивными свойствами мембраны.
Характерная особенность пассивного электротонического потенциала состоит в равенстве скоростей нарастания и спада экспоненты.
Для различных клеток значения τm варьируют от одной до нескольких сотен миллисекунд, однако для одной и той же клетки эта величина равна вне зависимости от длительности и направления поляризующего импульса электрического тока. Это еще одна особенность пассивного электротонического потенциала.
Наконец, если дискретно увеличивать амплитуду поляризующего импульса электрического тока, оставаясь тем не менее в подпороговом диапазоне его силы (рис. 1-42 В1), то амплитуда каждого пассивного электротонического потенциала будет равна амплитуде импульса тока, его вызывающего. В этом проявляется строго линейная зависимость между амплитудами электрического стимула и пассивного электротонического потенциала (рис. 1-42 В2). Значительное увеличение длительности поляризующего импульса не меняет этой закономерности (рис. 1-42 Г1, Г2). Ранее мы обсуждали, что как только емкость зарядится до потенциала, равного подаваемому на нее, емкостной ток прекратится. Таким образом, она не препятствует изменениям потенциала, а только замедляет его нарастание и падение.
Наклеткуможноподатьпрямоугольныйимпульс электрического тока сверхпороговой амплитуды, т.е. величиной в несколько вольт или даже в несколько десятков вольт, без ущерба для данной клетки, если длительность этого импульса будет меньше значения τm для данной клетки. В этом случае емкость мембраны не успевает полностью зарядиться и, следовательно, клетка не набирает столь большой потенциал (рис. 1-42 Д1, Д2).
Наконец, последняя особенность пассивного электротонического потенциала заключается в том, что в волокне, например аксоне, он распространяется с затуханием, характеризующим постоянную длину мембраны λ, т.е. расстояние вдоль аксона, на котором напряжение, приложенное в одной точке нейрона, потеряет 63% (1-1/e) своей первоначальной величины.
Рис. 1-42. Влияние различных прямоугольных импульсов электрического тока на форму пассивного электротонического потенциала
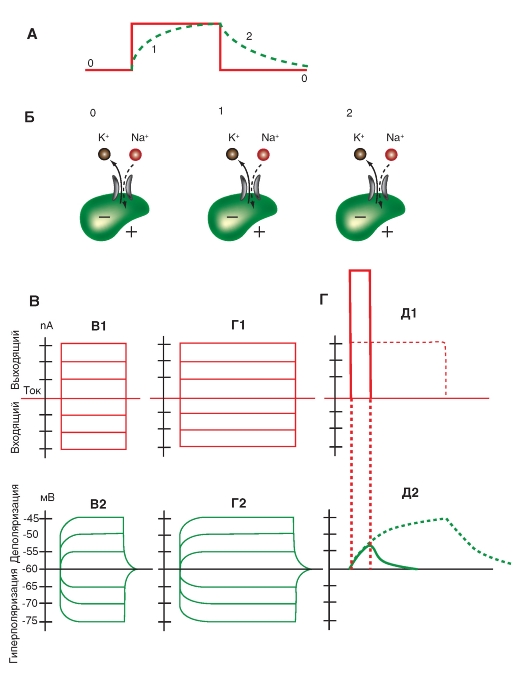
Метод фиксации тока
Были предложены три способа использования микроэлектродов, дошедшие до настоящих дней в той или иной технической модификации. Во-первых, внутриклеточная регистрация при помощи микроэлектрода биоэлектрических параметров мембран клеток. Во-вторых, поляризация через микроэлектрод мембран клеток электрическим током. В-третьих, подача через микроэлектрод ионов или биологически активных соединений, причем метод подачи веществ на поверхность мембраны клетки назван аппликацией, а метод введения веществ внутрь клетки - ионофорезом.
Стеклянная микропипетка становится микроэлектродом после заполнения ее сквозного продольного канала электролитом и образования контакта электролита с электронно-измерительной схемой. Контакт электролита и микроэлектрода может быть двух типов и зависит от того, какой биологический объект изучается. Первый тип - так называемая жесткая фиксация микроэлектрода - применяется для внутриклеточных исследований неподвижных тканей или клеток, например клеток нервной системы.
Второй тип - так называемый плавающий микроэлектрод - применяется для внутриклеточных исследований сокращающейся ткани, например, миокарда.
Для регистрации внутриклеточного потенциала мембраны применяют крайне простую измерительную аппаратуру, представляющую собой усилитель на основе микросхемы, имеющей высокое входное сопротивление, на несколько порядков превышающее сопротивление мембраны клетки, включенный в режиме повторителя, и микроэлектрод (рис. 1-43 А, Б). В этом случае мы будем иметь дело со следующей эквивалентной измерительной схемой (рис. 1-43 В), а регистрируемый внутриклеточный сигнал будет иметь вид, показанный на рис. 1-43 Г.
Если же нам надо внутриклеточно поляризовать клетку, то в наиболее примитивном виде принцип внутриклеточной поляризаций мембран при возможности одновременной регистраций биоэлектрической активности клеток представлен на рис. 1-43 Д. В этом случае в клетку вводят одновременно два микроэлектрода, один из которых поляризующий, а другой - регистрирующий. На экране двухлучевого осциллографа можно будет видеть процесс (рис. 1-43 З), когда на верхнем первом канале регистрируется величина поляризующего сигнала, а на нижнем втором
канале - мембранный потенциал и его искусственное смещение, вызванное поляризацией мембраны. Следует помнить, что прямое подключение поляризующего микроэлектрода к генератору, как это условно показано на рисунке, невозможно. Для этого существуют специальные схемы.
Вместе с тем даже при технически грамотном подходе использование двух микроэлектродов для введения в одну клетку - задача весьма сложная, даже если работа выполняется на гигантских нейронах беспозвоночных. Если же необходимо изучать межклеточное, например электротоническое, взаимодействие двух нейронов, то в препарат необходимо ввести четыре микроэлектрода (по два в каждую клетку), что практически невыполнимо. В то же время при изучении мелких клеток ввести два микроэлектрода в одну клетку просто невозможно. В этом случае необходимо, чтобы один микроэлектрод выполнял роль и регистрирующего, и поляризующего. Для этой цели была разработана схема, получившая название схемы фиксации тока в цепи измерений или current clamp схемы.
Метод current clamp представляет наибольший интерес, поэтому мы остановимся на нем подробно. Такая схема представлена на рис. 1-43 Е. Сопротивление R должно быть достаточно высоко и в 20-50 раз превышать входное сопротивление клетки. Сопротивление R должно быть также достаточно высоким, чтобы при подаче импульса стимуляции ток не зависел от сопротивления микроэлектрода. Для этого оно должно в 20-50 раз превышать сопротивление микроэлектрода. Обычно требуемая величина R лежит в диапазоне от 109 до 1010 Ом. Эти резисторы достаточно редки. Кроме того, они требуют специального обращения, так как любое повреждение центрального цветного кольца, пыль или отпечатки пальцев на поверхности и прочее существенно уменьшают их величину. Что же достигается этим принципом? Поскольку сопротивление R значительно превышает входное сопротивление клетки и сопротивления микроэлектрода, ток в цепи измерений будет определяться максимальным сопротивлением - сопротивление R - и не будет зависеть от изменений сопротивлений клетки и микроэлектрода, т.е. ток в цепи измерений будет равен const, и мы можем, внутриклеточно поляризуя клетку, измерять ее мембранный потенциал.
В этом случае мы будем иметь дело со следующей эквивалентной измерительной схемой (рис. 1-43 Ж), а регистрируемый внутриклеточный сигнал будет иметь вид, показанный на рис. 1-43 З.
Рис. 1-43. Принципы регистрации внутриклеточных потенциалов и внутриклеточной поляризации
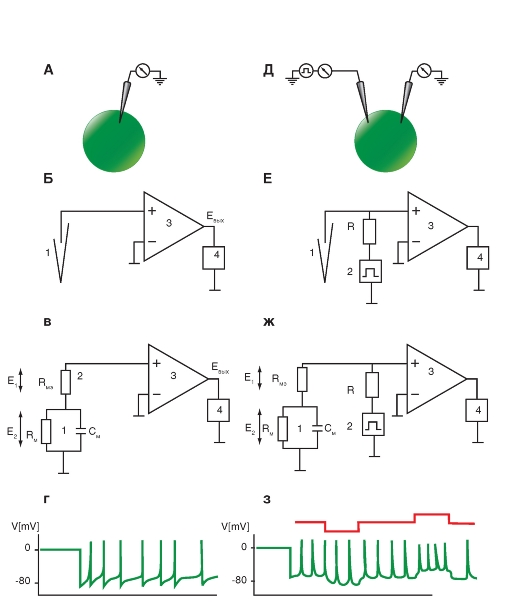
Локальный ответ
При увеличении силы раздражителя в виде электрического тока появляются признаки так называемого локального ответа мембраны, которые заключаются в изменении формы пассивного электротонического потенциала и появлении самостоятельно развивающегося пика относительно небольшой амплитуды, по форме напоминающего S-образную кривую. Это и есть локальный ответ (рис. 1-44 А). По мере усиления раздражающего тока амплитуда локального ответа увеличивается нелинейно и может не только достигать критического потенциала, но и превышать его, не перерастая, однако, в потенциал действия. Самостоятельное развитие локального ответа определяется уже не только каналами утечки, но и открытием потенциалуправляемых Na+- и K+-каналов. Таким образом, в своем развитии локальный ответ проходит две фазы: фазу пассивного электротонического потенциала; собственно фазу локального ответа (см. рис. 1-44 А).
Если дискретно увеличивать амплитуду поляризующего импульса электрического тока, оставаясь, однако, в подпороговом диапазоне, то амплитуда каждого пассивного электротонического потенциала будет пропорциональна амплитуде импульса тока, его вызывающего. В этом проявляется строго линейная зависимость между амплитудами электрического стимула и пассивного электротонического потенциала (рис. 1-44 Б, кривые 1 и 2). Однако при более сильной деполяризации появляются первые признаки локального ответа, заключающиеся в изменении формы пассивного электротонического потенциала и появлении самостоятельно развивающегося пика относительно небольшой амплитуды, по форме напоминающего S-образ- ную кривую. Первые признаки локального ответа возникают при действии стимулов, составляющих приблизительно 75% пороговой величины (рис. 1-44 Б, кривые 3-5). По мере дальнейшего усиления раздражающего тока амплитуда локального ответа увеличивается и может не только достигать критического потенциала, но и превышать его.
Таким образом, как было отмечено, можно условно говорить, что сам локальный ответ включает две фазы: фазу пассивного электротонического потенциала, при которой не происходит изменений потенциалуправляемых ионных токов через мембрану, и стадию собственно локального
ответа. В последнем случае в механизме деполяризации мембраны существенную роль играют также изменения ионного транспорта, которые и приводят к самостоятельному изменению потенциала, проявляющегося в форме локального ответа. Сам локальный ответ обусловлен повышением Na+-проницаемости мембраны через потенциалуправляемые Na+-каналы, обеспечивающие входящий ток, вызывающий фазу деполяризации. Однако при подпороговом стимуле такое повышение проницаемости недостаточно велико для того, чтобы вызвать процесс регенеративной деполяризации мембраны, поскольку открывается лишь небольшая часть потенциалуправляемых Na+-каналов. Именно поэтому начавшаяся деполяризация не развивается в потенциал действия, а уравновешивается увеличением К+-проводимости вследствие открытия опять-таки небольшого, но достаточного количества потенциалуправляемых К+-каналов. Далее за счет превалирующего выхода из клетки ионов К+ потенциал возвращается на уровень потенциала покоя.
Поскольку локальный ответ обусловлен открытием потенциалуправляемых Na+- и К+-каналов, то можно сказать, что он сходен с потенциалом действия. Однако эти две формы ответа имеют существенные различия. В отличие от потенциала действия локальный ответ не имеет четкого порога возникновения; он не подчиняется закону «все или ничего» - с увеличением силы раздражителя амплитуда локального ответа растет. Любое, даже незначительное, изменение потенциала клетки изменяет количество открытых Na+- и К+-каналов. Появление же характерного S-образного ответа означает только, что величина локального ответа превышает величину пассивного электротонического потенциала. При этом не следует забывать, что кинетика открывания быстрых потенциалуправляемых Na+-каналов и медленных К+-каналов различна. Именно поэтому при достижении определенного уровня деполяризации (порог генерации потенциала действия) и соответственно количества открытых Na+-каналов, ток через К+-каналы не «успевает» уравновесить Na+-ток, что приводит к дальнейшей деполяризации и открыванию большего количества Na+-каналов, т.е. возникает потенциал действия.
В естественных условиях организма локальный ответ представляет собой электрофизиологическое выражение местного возбуждения.
Рис. 1-44. Локальный ответ нервного волокна.
А - форма пассивного электротонического потенциала и локального ответа. Б - пассивный электротонический потенциал, перерастающий в локальный ответ и далее в потенциал действия, при увеличении силы раздражителя. Кривые 1 и 2 представляют собой пассивный электротонический потенциал, вызываемый увеличивающимися по амплитуде деполяризующими импульсами электрического тока. На кривых 3, 4 и 5 к пассивному электротоническому потенциалу присоединяется деполяризация в форме локального ответа. При пороговой силе тока локальный ответ перерастает в потенциал действия б. Ступеньки деполяризующих импульсов электрического тока отмечены красным цветом. В - механизм возникновения локального ответа
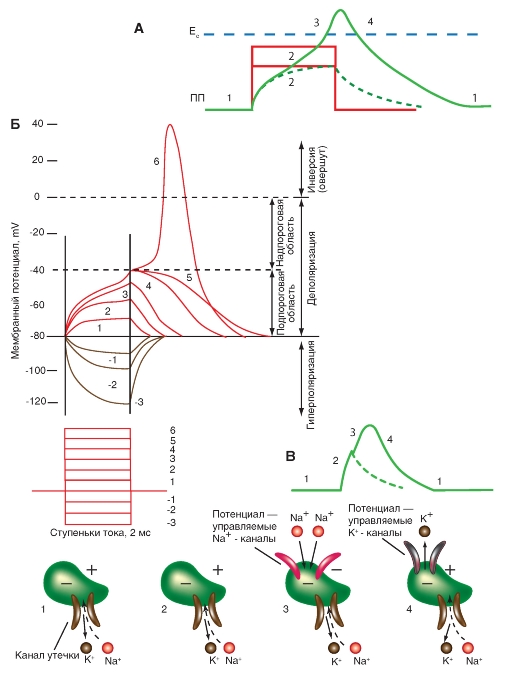
Потенциал действия
Если электровозбудимую клетку или нервное волокно подвергнуть действию электрического раздражителя пороговой величины, то возникает возбуждение этого участка, электрофизиологическим выражением которого является потенциал действия. Это возбуждение распространяется по всей мембране и называется распространяющимся.
На рисунке 1-45 А продемонстрирован потенциал действия и его фазы. Он начинается в результате смещения потенциала покоя (например, от -90 мВ) прямоугольным импульсом электрического тока до уровня критического потенциала (разного для разных типов клеток). После чего в результате изменения ионных токов меняется и сам потенциал клетки, быстро нарастая в положительную область и доходя до 0 мВ. Обычно эту фазу называют фазой деполяризации. Потенциал действия продолжает возрастать, пересекая 0 мВ и достигая значений, лежащих около +35 мВ (точнее, разных значений для разных типов клеток). По достижении пика величина потенциала падает в отрицательную область, вновь достигая 0 мВ. Превышение потенциала действия над нулевой линией называется овершутом. Далее потенциал действия пересекает 0 мВ и достигает значений потенциала покоя. Эту фазу обычно называют фазой реполяризации.
В процессе реполяризации потенциал действия может возвращаться на уровень потенциала покоя по двум разным ионным механизмам (рис. 1-45 Б). Первый механизм приводит к тому, что от уровня критического потенциала реполяризация медленно и плавно переходит в потенциал покоя. Это следовая деполяризация (фиолетовая кривая). При втором механизме реполяризация достигает величины потенциала покоя и продолжается дальше в более отрицательную область, после чего возвращается к уровню потенциала покоя. Это следовая гиперполяризация (красная кривая).
Типы биоэлектрической активности нервных клеток
Рассмотрим типы биоэлектрической активности на примере нервных клеток (рис. 1-45), поскольку данные об этом для клеток других
тканей изложены в соответствующих разделах. Часто потенциал действия возникает на фоне потенциала покоя под влиянием искусственной внутриклеточной деполяризации. Такой потенциал действия возникает у клеток с неменяющимся потенциалом покоя и, следовательно, такие клетки самостоятельно не генерируют потенциалы действия. Их называют «молчащими» (рис. 1-45 В). Это первый тип биоэлектрической активности нейронов.
Ко второму типу биоэлектрической активности клеток относятся нейроны, способные самостоятельно генерировать потенциалы действия. Механизмы этой генерации мы рассмотрим далее, а сейчас обратимся исключительно к феноменологической стороне вопроса. К этому типу относят клетки, генерирующие регулярную ритмическую активность (рис. 1-45 Г), нерегулярную ритмическую активность (рис. 1-45 Д), и регулярную пачечную (несколько потенциалов действия - «пачка», после чего наблюдается короткий период покоя) активность. При этом количество потенциалов действия в пачке и межпачечные интервалы одинаковые (рис. 1-45 Е). Наконец, это клетки, генерирующие нерегулярную пачечную активность. При этом количество потенциалов действия в пачке, частота их возникновения и межпачечные интервалы разные (рис. 1-45 Д).
К третьему типу биоэлектрической активности клеток относятся нейроны, способные самостоятельно генерировать флуктуации потенциала покоя, не достигающие критического потенциала (рис. 1-45 Ж). Обычно эти флуктуации бывают синусоидальной или пилообразной формы. Только редкие осцилляции могут достигнуть порога и вызвать генерацию одиночных потенциалов действия. Этот тип потенциалов называется пейсмекерным. К сожалению, как в отечественной, так и в зарубежной литературе этот термин несет две смысловые нагрузки. Во-первых, пейсмекерными называют клетки, генерирующие истинный пейсмекерный потенциал, показанный на рис. 1-45 З. Во-вторых, так называют клетки, способные к самостоятельной генерации потенциалов действия. В таком смысле этот термин особенно прижился в терминологии по электрофизиологии сердца, с чем читателю придется столкнуться далее.
Рис. 1-45. Потенциал действия и типы биоэлектрической активности на примере нервных клеток
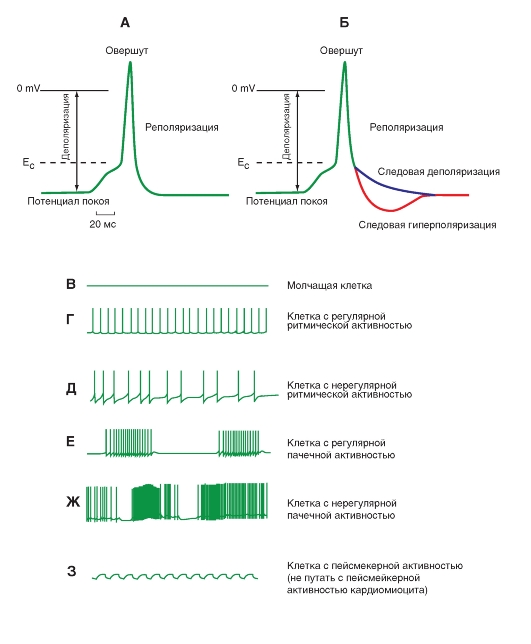
Действие электрического тока
К числу основных раздражителей клеток принадлежит электрический ток.
Введем обозначения: Em используется только для потенциала покоя клетки, Vm - для любых мембранных потенциалов, а ∆Vm означает любое изменение мембранного потенциала.
Если на мембрану клетки воздействовать импульсами электрического тока либо положительной, либо отрицательной полярности, то это воздействие вызовет смещение Em соответственно либо в положительную область (деполяризация мембраны), либо в отрицательную область (гиперполяризация мембраны). На рисунке 1-46 А показано влияние прямоугольных импульсов электрического тока различной силы и полярности на Em. Условие возникновения потенциала действия - критический потенциал Ес. Электрическое раздражение вызывает быстрое смещение мембранного потенциала до уровня Ес, при котором происходит активация потенциалуправляемых Na+-каналов, что и приводит к возбуждению мембраны в виде потенциала действия.
Величины Em, Ес и ∆Vm можно связать следующим выражением:
На рисунке 1-46 А1 показан прямоугольный импульс электрического тока положительной полярности, вызывающий смещение Em до величины Ec, что приводит к возникновению потенциала действия. В этом случае величина порогового потенциала станет равна ∆Vm,1.
Далее показан (рис. 1-46 А2) прямоугольный импульс электрического тока положительной полярности, причем первая ступень, смещая Em в более положительную область, не вызывает смещение мембранного потенциала до величины Ec, поэтому на фоне первой ступени потенциал действия не возникает. Но в таком случае величина порогового потенциала будет меньше, чем ∆Vm, 1 и равна ∆Vm,2. Вторая ступень вызывает смещение мембранного потенциала до величины Ec, что и приводит к возникновению потенциала действия.
На рисунке 1-46 А3 также показан прямоугольный импульс электрического тока, но его первая ступень имеет отрицательную полярность, а вторая ступень - положительную полярность. Первая ступень смещает Em в отрицательную область. На фоне этой первой ступени потенциал действия не возникает, и тогда величина
порогового потенциала будет больше, чем ∆Vm, 1, и равна ∆Vm,3. Вторая ступень вызывает смещение мембранного потенциала до величины Ec, что и приводит к возникновению потенциала действия.
Большинство нервных клеток отвечает на деполяризацию ритмическими разрядами потенциалов действия, и наоборот, аппликация постоянного гиперполяризующего электрического тока ингибирует возникновение потенциалов действия.
Рассмотрим сначала влияние деполяризующего тока, продемонстрированное на рис. 1-46 Б1. Как было показано выше, клетка отвечает генерацией потенциала действия на пороговый импульс раздражающего тока. Почему же на длительный деполяризующий импульс электрического тока возникает только один потенциал действия (см. рис. 1-46 Б1)? Дело в том, что порог для возникновения повторного ответа выше, чем для генерации одиночного потенциала действия. Основа механизма этого процесса в том, что после окончания первого потенциала действия сопротивление мембраны обычно снижено за счет высокой проводимости для ионов К+, поэтому раздражающий ток из порогового превращается в подпороговый. Кроме того, продолжающаяся деполяризация препятствует полному устранению инактивации Na+-каналов. Если эти изменения небольшие, они могут быть скомпенсированы увеличением силы тока раздражающего импульса (рис. 1-46 Б2), что приведет к появлению нескольких потенциалов действия. Еще большее повышение силы тока приведет к генерации ритмической активности (рис. 1-46 Б3). Дальнейшее дискретное увеличение силы деполяризующего тока до определенного предела приведет к учащению ритмического разряда и увеличению числа импульсов в нем (не показано). Однако при дальнейшем увеличении силы деполяризующего тока разряд потенциалов действия укорачивается и уменьшается по амплитуде (рис. 1-46 Б4 и 5) вплоть до полного прекращения генерации потенциалов действия (рис. 1-46 Б6). Причиной этого является инактивация Na+-каналов.
Влияние длительного гипероляризующего тока, продемонстрированное на рис. 1-46 В обычно рассматривают применительно к нейронам, обладающим спонтанной активностью. Увеличение гиперполяризации клетки (рис. 1-46 В1-3) приводит к уменьшению частоты спайковой активности и увеличению амплитуды потенциалов действия за счет удаления от величины критического потенциала вплоть до полного прекращения генерации этих потенциалов (рис. 1-46 В4).
Рис. 1-46. Влияние внутриклеточной поляризации на биоэлектрическую активность клеток.
А - соотношения между исходным уровнем потенциала покоя (Em), критическим уровнем деполяризации (Ес) и пороговым потенциалом (AVm) в норме (А1), при деполяризации (А2) и при гиперполяризации (A3). Б - влияние искусственной долго длящейся деполяризации различной силы на биоэлектрическую активность нервной клетки. В - влияние искусственной долго длящейся гиперполяризации различной силы
Механизм потенциала действия
При пороговой величине раздражающего электрического стимула возникает потенциал действия, состоящий из фаз деполяризации и реполяризации. На рисунке 1-47 А продемонстрирован потенциал действия и его фазы. Он начинается в результате смещения потенциала покоя (например, от -90 мВ) прямоугольным импульсом электрического тока до уровня критического потенциала (разного для разных типов клеток), после чего в результате изменения ионных токов меняется и сам потенциал клетки, быстро нарастая в положительную область и доходя до 0 мВ. Обычно эту фазу называют фазой деполяризации. Потенциал действия продолжает возрастать, пересекая 0 мВ и достигая значений, лежащих около +30 мВ (точнее, разных значений для разных типов клеток). По достижении пика величина потенциала падает в отрицательную область, вновь достигая 0 мВ. Превышение потенциала действия над нулевой линией называется овершутом. Далее потенциал действия пересекает 0 мВ и достигает значений потенциала покоя. Эту фазу обычно называют фазой реполяризации.
Рассмотрим в упрощенном виде связь потенциала действия с ионными токами на качественном уровне (рис. 1-47 Б).
Стадия 1 представляет собой потенциал покоя, механизм которого сводится к незначительному входу ионов Na+ в клетку и превышающему его примерно в 100 раз выходу ионов К+ по каналам утечки. При этом мембрана имеет внутри отрицательный заряд, а снаружи - положительный. Стадия 2 представляет собой проявление пассивного электротонического потенциала, который определяется только емкостными и резистивными свойствами мембраны и не связан с изменением ионных токов через мембрану. Стадия 3 связана с локальным ответом, при котором происходит некоторое увеличение входа ионов Na+ в клетку, но уже через потенциалуправляемые Na+-каналы, что на схеме отмечено сплошной стрелкой. Выход ионов К+ и незначительный вход ионов Na+ по каналам утечки остается без изменений. На этой стадии клетка имеет внутри отрицательный заряд, а снаружи - положительный. Стадия 4 начинается в тот момент, когда смещаемый потенциал мембраны достигает критического уровня. Активируются (открываются) все потенциалуправляемые
Na+-каналы, и возникает процесс, называемый активацией входящего Na+-тока. Ионы Na+ лавинообразно входят в клетку, что ведет к дальнейшему смещению мембранного потенциала, достигающего нуля. Все это время выход ионов К+ осуществляется только по каналам утечки и остается без изменений. Клетка имеет внутри отрицательный заряд, а снаружи - положительный. Отдельно рассмотрим стадию 5, т.е. ситуацию в нуле. В этот момент потенциалуправляемые Na+-каналы открыты, и ионы Na+ продолжают входить в клетку. Выход ионов К+, как было отмечено, остается без изменений, но в клетку вошло так много ионов Na+, что внутриклеточный отрицательный заряд скомпенсировался, и мембрана клетки становится электронейтральной. Тем не менее ионы Na+ продолжают входить в клетку и вносят положительный заряд - стадия 6. В это время мембрана внутри клетки становится более электроположительной, чем снаружи. Происходит реверсия потенциала, но не реверсия натриевого электрохимического градиента. Равновесный потенциал для Na+ равен +55 мВ. Потенциал смещается в положительную область и может достигнуть (у определенных клеток) величины, равной +30 мВ. Эта величина потенциала вызывает инактивацию потенциал-управляемых Na+-каналов и, соответственно, инактивацию входящего Na+-тока. Эти же величины потенциала вызывают активацию потенциалуправляемых К+-каналов и соответственно активацию выходящего К+-тока. Эти процессы знаменуют начало стадии 7. Поток ионов Na+ в клетку прекращается, но из клетки интенсивно через потенциалуправляемые К+-каналы выходят ионы К+ (стадия 8). На этой фазе мембрана клетки остается более электроположительной внутри клетки, чем снаружи, со стороны внеклеточной среды, хотя потенциал стремится в отрицательную область. В итоге выхода ионов К+ мембранный потенциал уменьшается до нуля - стадия 9. Благодаря интенсивному выходу ионов К+ мембрана клетки вновь становится электронейтральной. Далее начинается стадия 10, при которой выход ионов К+ приводит к тому, что потенциал клетки вновь приобретает электроотрицательность по отношению к внешней среде. Это продолжается до достижения потенциала покоя, величина которого приводит к закрытию К+-каналов и инактивации выходящего К+-тока. Клетка возвращается в исходное состояние.
Рис. 1-47. Потенциал действия нервной клетки, его главные фазы и механизм. Ес - критический потенциал
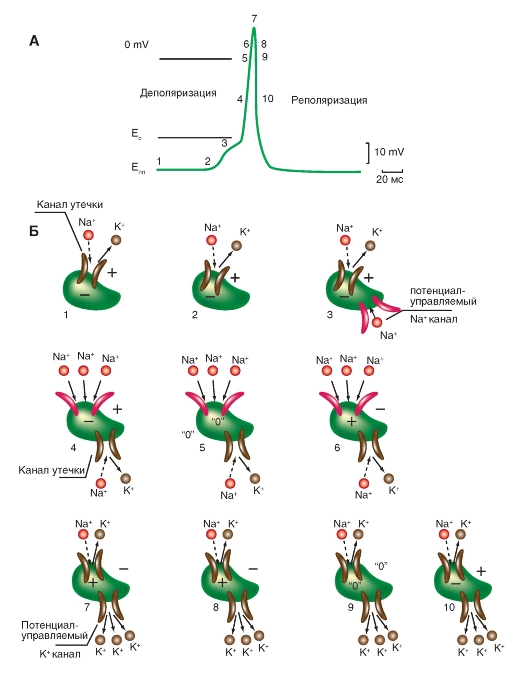
Фазовые изменения возбудимости
В процессе потенциала действия возбудимость любой клетки меняется, что определяется механизмами, лежащими в основе генерации потенциала действия. Обычно выделяют несколько фаз, отражающих изменения возбудимости клетки в данный момент времени потенциала действия. Это фаза нормальной возбудимости, характерная для периода покоя клетки, фаза повышенной возбудимости, фаза абсолютной рефрактерности, когда клетку возбудить невозможно, и, наконец, фаза относительной рефрактерности, когда клетка принципиально может быть возбуждена.
На рисунке 1-48 А в верхней части представлен потенциал, подобный потенциалу действия, а в нижней части синхронно показаны фазовые изменения возбудимости. Чтобы понять, как меняется возбудимость в разные фазы потенциала действия, удобно использовать тестовый импульс электрического тока прямоугольной формы и амплитудой, лежащей в диапазоне от величины потенциала покоя до критического потенциала. Если такой импульс подать на клетку на фоне потенциала покоя, ответом будет полноценный потенциал действия. Следовательно, на уровне потенциала покоя мембрана клетки имеет нормальную возбудимость (принятую условно за 100%). Далее, чтобы возбудить клетку на уровне фазы пассивного электротонического потенциала, необходим прямоугольный импульс меньшей амплитуды, а на уровне фазы локального ответа - еще меньшей амплитуды. Следовательно, синхронно с этими двумя фазами потенциала действия возбудимость станет увеличиваться. Затем начинается фаза деполяризации потенциала действия, в основе которой лежит открытие всех потенциалуправляемых Na+-каналов. В этот период, именно из-за активации всех потенциалуправляемых Na+-каналов, клетку невозможно вторично возбудить. То есть возбудимость сразу же падает до 0%, и начинается поддерживаемая фаза абсолютной рефрактерности. Эта фаза длится до того момента, пока фаза реполяризации потенциала действия не пересечет нулевую линю.
Чем ближе реполяризация потенциала действия подходит к уровню потенциала покоя, тем проще вторично вызвать процесс возбуждения мембраны клетки. Все это время мембрана клетка находится в фазе относительной рефрактерности. Наконец, реполяризация пересекает потенциал покоя. Если в этой точке подать тестовый импульс, ответом будет полноценный потенциал действия. Следовательно, при возврате к уровню потенциала покоя возбудимость станет вновь нормальной и равной 100%.
Далее для вызова процесса возбуждения на фоне нарастающей следовой гиперполяризации необходимы все большие и большие по амплитуде электрические импульсы. Следовательно, при нарастании следовой гиперполяризации возбудимость будет уменьшаться. При возврате следовой гиперполяризации к уровню потенциала покоя амплитуда импульсов, необходимых для возбуждения мембраны клетки, будет уменьшаться, пока не достигнет исходной в точке пересечения следовой гиперполяризации с уровнем потенциала покоя. Следовательно, возбудимость станет возрастать, пока не достигнет исходной величины в этой же точке.
Для того чтобы вызвать процесс возбуждения в фазу следовой деполяризации потенциала действия, необходимы все меньшие и меньшие по амплитуде электрические импульсы. Следовательно, возбудимость мембраны клетки будет повышенной. При возврате следовой деполяризации к уровню потенциала покоя амплитуда импульсов, требуемых для возбуждения мембраны клетки, станет увеличиваться, пока не достигнет исходной в точке пересечения следовой деполяризации с уровнем потенциала покоя.
Сходным образом можно описать фазовые изменения возбудимости поперечно-полосатой мышечной клетки (рис. 1-48 Б) и миокардиальной клетки (рис. 1-48 В). В последнем случае фаза относительной рефрактерности начинается позже, поскольку выход из инактивации Na+-каналов начинается приблизительно с -30 мВ. Разумеется, оба этих типа потенциалов действия на рисунках представлены схематично.
Рис. 1-48. Фазовые изменения возбудимости (синие кривые) и их связь с потенциалами действия (зеленые кривые) трех типов клеток: нервной (А), мышечной (Б) и миокардиальной (В). При потенциале покоя возбудимость принята за 100%. Во время фазы абсолютной рефрактерности возбудимость принята за 0%. Тестовый импульс электрического тока прямоугольной формы представлен красным цветом
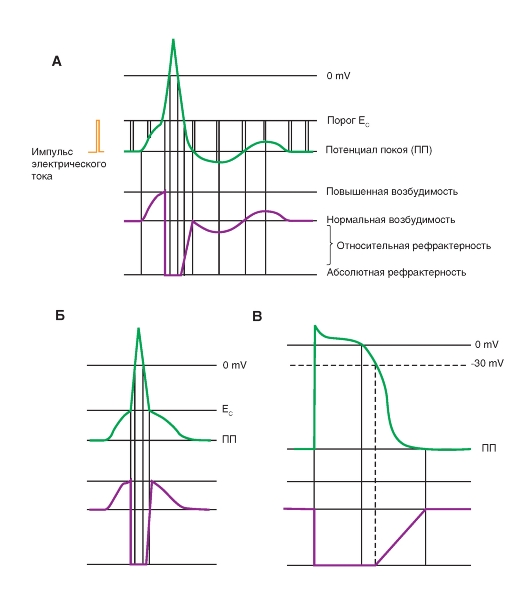
Метод фиксации потенциала
На рисунке 1-49 представлены основные схемы фиксации потенциала у аксона и клеток, применяя которые можно регистрировать ионный ток. Принцип фиксации потенциала основан на том, что в известном выражении
емкостной ток становится равным нулю, если Vm задать равным константе. При этом Im становится равным I , т. е. ионный ток оказывается выведенным во внешнюю измерительную цепь.
Техническая сторона метода, позволяющего регистрировать ионный ток у аксона, представлена в виде схемы на рисунке (рис. 1-49 А). Электроды С и D связаны с входом усилителя напряжения, и соединенный с ним осциллограф регистрирует мембранный потенциал. С помощью электронной схемы с обратной связью этот потенциал можно длительное время фиксировать (или поддерживать) на любом уровне путем пропускания тока необходимой величины между электродами А и В, поэтому он называется поддерживаемым потенциалом (holding potential). При помощи генератора прямоугольных импульсов электрического тока на участке мембраны его можно смещать до некоторой новой величины и удерживать на этом уровне также с помощью электронной схемы с обратной связью. Ток, протекающий через этот участок мембраны при поддерживаемом потенциале или под влиянием приложенного напряжения, измеряют отдельным усилителем тока, также подсоединенным к осциллографу. Эту характерную для экспериментов на аксонах схему применяют и в настоящее время.
Исследования методом фиксации потенциала были выполнены на изолированных клетках различных тканей. Изолированная клетка представляет собой эквипотенциальную сферу и не требует дополнительных устройств. Для осуществления такого метода применяли электронно-измерительную схему (рис. 1-49 Б) и два микроэлектрода, введенных в одну клетку. Мембранный потенциал регистрируют микроэлектродом и подают на
усилитель напряжения. С помощью электронной схемы с обратной связью его можно длительное время фиксировать (или поддерживать) на любом уровне путем пропускания тока через второй микроэлектрод, поэтому этот потенциал также называется поддерживаемым (holding potential). С помощью генератора прямоугольных импульсов электрического тока на мембране поддерживаемый потенциал можно смещать до некоторой новой величины и удерживать на этом уровне также с помощью электронной схемы с обратной связью. Ток, протекающий через этот участок мембраны при поддерживаемом потенциале или под влиянием приложенного напряжения, измеряют отдельным усилителем.
Большим шагом вперед было создание метода внутриклеточного диализа (рис. 1-49 В1). Он позволял осуществлять полную замену внутриклеточной среды в изолированных клетках. Экспериментальную камеру посредством полиэтиленовой перегородки делили на два отсека (рис. 1-49 В2). В перегородке с помощью иглы просверливали коническое отверстие, соответствующее по размерам изучаемой клетке. Стенки поры покрывали специальным составом, к которому приклеивали подведенную микропипеткой клетку. Резкое создание в нижнем отсеке отрицательного давления разрывало часть мембраны, находящуюся с этой стороны. Таким образом, с одной стороны перегородки находилась внешняя часть мембраны, а с другой - внутренняя (рис. 1-49 В1). Каждый отсек имел автономную систему перфузии и электронно-измерительную схему.
Позднее была разработана простая в изготовлении пластиковая микропипетка с отверстием нужного диаметра на вершине для внутриклеточного диализа (рис. 1-49 Г). В результате оказываются готовыми как отверстие подведения клетки, так и контур перфузии искусственного внутриклеточного раствора: перфузирующий клетку изнутри раствор подается в одно колено микропипетки, а выводится в другое. Присасывание к клетке осуществляется благодаря отрицательному гидростатическому давлению в пипетке по отношению к среде, в которой находятся клетки. Позднее для исследований клеток стали применять упрощенную схему (рис. 1-49 Д).
Рис. 1-49. Принципы фиксации потенциала у аксона и клеток.
А - схема регистрации ионного тока у аксона. Б - схема регистрации ионного тока у клетки микроэлектродами. В - упрощенная схема регистрации ионного тока у клетки микроэлектродами. Г - схема регистрации ионного тока у клетки методом диализа. Д - пора в разделительной мембране в увеличенном размере. Е - леточный диализ при помощи пластиковых трубочек
Patch-clamp
Расцвет исследований мембран клеток наступил с созданием метода patch-clamp. Этот метод позволяет регистрировать на изолированных клетках их потенциалы, токи или одиночные ионные каналы посредством специальной стеклянной пипетки (patch-пипетки), напоминающей микроэлектрод, но имеющей сопротивление от 2 до 10 МОм, в зависимости от типа исследуемых клеток. Кроме того, метод позволяет регистрировать ионные каналы в изолированном кусочке мембраны, который может быть расположен по отношению к отверстию пипетки либо внешней, либо внутренней стороной.
На рисунке 1-50 показаны различные конфигурации patch-clamp по отношению к клетке или фрагменту ее мембраны. Сначала пипетку подводят вплотную к мембране изолированной клетки (рис. 1-50 А) и получают конфигурацию low resistance seal. Далее в пипетке подсасыванием создают небольшое отрицательное давление (рис. 1-50 Б). Это приводит к тому, что мембрана плотно закупоривает отверстие пипетки и формируется высокоомный контакт - конфигурация cell-attached, или иначе - переход пипетка-мемб- рана с сопротивлением утечки более 10 ГОм (так называемый giga seal). После нормализации давления в пипетке конфигурация cell-attached близка к физиологической ситуации, поскольку зона мембраны, захваченная пипеткой, с внутренней стороны контактирует с внутриклеточной жидкостью, а с внешней стороны - со стандартным внеклеточным раствором, которым заполняют patch-пипет- ку. Эта конфигурация, с одной стороны, позволяет регистрировать одиночные ионные каналы под пипеткой, а с другой, является промежуточной для других конфигураций. Она позволяет изучать на одиночном канале роль вторичных мессенджеров, включающихся через рецепторы плазматической мембраны.
Конфигурация cell-attached позволяет двумя путями (в зависимости от задач исследователя) сформировать конфигурацию, называемую whole-cell. В одном случае для ее получения в пипетку необходимо резко и одномоментно подать небольшое отрицательное давление, разрывающее мембрану
под пипеткой и образующее низкоомный путь между внутренней средой клетки и раствором в пипетке. При этом в мембране возникает дырка, величина которой позволяет осуществлять обмен ионов и различных соединений между пипеткой и цитоплазмой (рис. 1-50 В). В другом случае низкоомный путь между внутренней средой клетки и раствором в пипетке формируется за счет влияния соединений, находящихся в пипетке и вызывающих образование в мембране пор, проницаемых для ионов, но не для молекул. Это перфоративный (perforated) patch. Эта методика позволяет исследовать ионные токи, протекающие через мембрану, идентифицировать и вычленить их.
Конфигурация whole-cell позволяет сформировать другую конфигурацию - outside-out patch. Оттягивание пипетки от клетки заставляет мембрану растягиваться до тех пор, пока она не отделится от клетки (рис. 1-50 Г) и не сошьется (рис. 1-50 Д). Теперь ее внутренняя часть будет контактировать с раствором в пипетке, а внешняя - с омывающим раствором в перфузионной камере. Эту конфигурацию используют для изучения вклада соединений внешней среды клетки в активность единичных каналов.
Конфигурация cell-attached позволяет сформировать другую конфигурацию, называемую «insideout patch». К ее образованию приводит резкое отрывание пипетки от клетки (рис. 1-50 Е), причем giga seal не меняется. В этом случае на пипетке находится лишь фрагмент мембраны (patch), внутренняя сторона которой смотрит в омывающий раствор перфузионной камеры, а внешняя контактирует с содержимым пипетки (рис. 1-50 Ж). Данную конфигурацию применяют для изучения вклада соединений цитоплазмы в канальную активность.
Конфигурация cell-attached позволяет сформировать и изучать везикулу. Для ее образования пипетку плавно и медленно оттягивают от клетки (рис. 1-50 З). Оттягивание пипетки от клетки заставляет мембрану растягиваться до тех пор, пока она не отделится от клетки и не сошьется, образовав везикулу (рис. 1-50 И). При помощи дальнейшей экспозиции пипетки в воздухе можно получить конфигурацию inside-out patch
(рис. 1-50 К, Л).
Рис. 1-50. Метод patch-clamp и его конфигурации
Сравнение методов
На рисунке 1-51 показаны микроэлектрод (рис. 1-51 А1) и patch-пипетка (рис. 1-51 Б1) и продемонстрированы их основные отличия. Во-первых, техническая поддержка метода patch-clamp позволяет исследовать клетки как в режиме фиксации тока, так и в режиме фиксации потенциала. Во-вторых, метод patch-clamp позволяет изучать мелкие клетки без существенного повреждения их мембран, тогда как даже один микроэлектрод, а тем более два существенно повреждают мембрану. Далее сопротивление утечки «микроэлек- трод-мембрана» не превышает 500 МОм, а при использовании метода patch-clamp и соответственно patch-пипетки - более 10 ГОм, что существенно влияет на качество регистрации. Наконец, микроэлектроды имеют сопротивление, достигающее 100 МОм, а patch-пипетки - от 2 до 10 МОм, что позволяет не только качественно регистрировать потенциалы и токи клетки, но и вводить в клетки без особых проблем любые соединения.
На рисунке показан принцип фиксации тока, или current clamp (рис. 1-51 А2), а также принцип фиксации потенциала, или voltage clamp (рис. 1-51 Б2).
Применительно к рисунку (рис. 1-51 А2) липидный бислой можно уподобить конденсатору, две обкладки которого находятся на небольшом расстоянии друг от друга, и при подаче тока одна обкладка заряжается положительно, а другая - отрицательно.
Итак, если мы подаем на мембрану ток (рис. 1-51 А3), то его протекание через Rm описывается законом Ома:

где Vm - потенциал на Rm.
Протекание тока через емкость можно рассчитать следующим образом:

Таким образом, для общего тока, текущего в покое через мембрану, получаем:
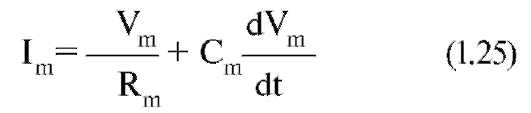
Емкостной компонент мембраны Сm обусловлен исключительно липидным бислоем, а резистивный компонент Rm - белками, образующими ионные каналы и встроенными в липидный бислой.
Если подать на мембрану прямоугольный импульс электрического тока, кривая изменения потенциала будет определяться RmxCm
Применительно к рис. 1-51 Б2 можно фиксировать потенциал и разрешить течь току.
Если внезапно менять напряжение от исходного значения до нового (в виде прямоугольного импульса; рис. 1-51 Б3), то быстро проходящий емкостной ток (Ic) течет по тому же принципу, как заряды текут на конденсатор. Ic максимален в начале прямоугольного импульса, когда заряд на конденсатор течет наиболее быстро, и затем уменьшается по экспоненте с постоянной времени RC. Если внезапно уменьшить напряжение до его исходного значения, Ic течет в противоположном направлении, по сравнению с регистрируемым в начале импульса. Таким образом, Ic появляется в виде коротких пиков в начале и в конце прямоугольного импульса. Изменение знака напряжения объясняется изменением направления тока в момент его прекращения, т.е. сначала происходит заряд, а затем разряд емкости, что связано с изменением на противоположное направление тока в цепи.
Итак, если Vm поддерживать постоянным, то Ic будет течь только очень короткое время, лишь в самый момент сдвига мембранного потенциала до нового значения. Затем этот ток прекратится, поскольку величина dVm/dt (скорость изменения мембранного потенциала) будет равна нулю. При этом мембранный ток становится простой функцией мембранной проводимости (gm) и напряжения (Vm):

Ток, который должен подаваться усилителем обратной связи для поддержания заданной величины мембранного потенциала, в точности равен общему мембранному току, протекающему при данном мембранном потенциале через участок мембраны, на котором напряжение фиксировано. Эти токи позволяют оценивать изменения общей ионной проводимости (а отсюда и специфических ионных проводимостей), вызываемые изменением мембранного потенциала.
В целом, метод был основан на том, что в известном выражении
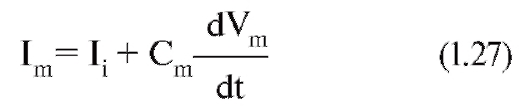
емкостной ток становится равным нулю, если Vm задать равным константе. При этом Im становится равным Ii, т.е. ионный ток оказывается выведенным во внешнюю измерительную цепь.
Рис. 1-51. Сравнение методов регистрации с помощью обычного микроэлектрода (А) и с помощью patch- пипетки (Б)
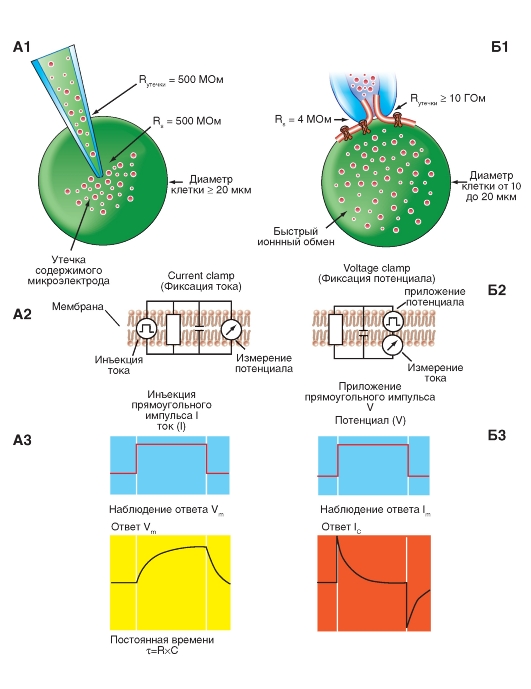
Ионные токи
Результат применения метода фиксации потенциала представлен на рис. 1-52 А. На мембране поддерживается определенный потенциал (holding potential), равный, например, -60 мВ. Если с помощью прямоугольного импульса электрического тока сместить мембранный потенциал (деполяризовать мембрану) до 0 мВ, то в зарегистрированном токе можно различить три отдельные фазы. Вначале наблюдается так называемый емкостной ток, т.е. мгновенный пик тока (выделен зеленым цветом), направленного наружу, который обусловлен разрядом мембранной емкости. Поскольку она оказывается полностью разряженной, последующий ток определяют ионы, проходящие через ионные каналы. Вторая фаза представляет собой ток, направленный внутрь клетки (входящий ток Iin), т.е. вход катионов в цитозоль через ионные каналы мембраны. Эта фаза относительно кратковременна и переходит в третью фазу тока,
который течет из клетки (выходящий ток Iout) до тех пор, пока импульс электрического тока поддерживает деполяризацию мембраны.
Если мембрана резко деполяризована (рис. 1-52 Б), общий ионный ток (т.е. текущий после почти мгновенного разряда емкости) состоит из двух фаз - входящего и выходящего токов (синяя кривая). Поскольку ионный ток определяется ионами Na+ иК+ и зависит от их концентраций, то, изменяя концентрацию этих ионов, его можно разделить на компоненты. Было установлено, что если все ионы Na+, находящиеся во внешней среде, заменить на холин, который не проходит через мембрану, то входящий ток будет отсутствовать (коричневая кривая). Следовательно, он обусловлен ионами Na+. В этом случае выходящий ток приписывали ионам К+. Сначала ионы Na+ движутся по концентрационному градиенту, создавая входящий ток. Однако эта компонента быстро уменьшается и сменяется выходящим К+-током.
Рис. 1-52. Ионные токи, зарегистрированные методом фиксации потенциала.
А - ток, протекающий через мембрану (синяя кривая) при смещении потенциала до 0 мВ относительно поддерживаемого потенциала, равного -60 мВ (поддерживаемый и стимулирующий ток выделен красным цветом). Б - разделение мембранного тока (Im) на калиевую и натриевую компоненты: 1 - аксон находится в физиологическом растворе, I = INa + IK; 2 - натрий заменен на холин, I = IK; 3 - разность между 1 и 2, I = INa. Отклонение кривой вниз соответствует входящему току, а вверх соответствует выходящему току. Поддерживаемый потенциал мембраны клетки и его смещение обозначены красной кривой
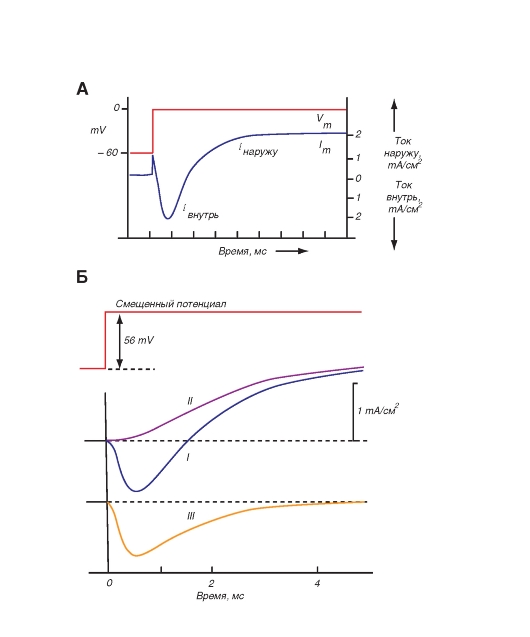
Регистрация ионных токов методом фиксации потенциала
На рисунке 1-53 А представлен принцип регистрации тока при фиксации потенциала на клетке. Мембранный потенциал регистрируется микроэлектродом и подается на усилитель напряжения. С помощью электронной схемы с обратной связью его можно длительное время фиксировать (или поддерживать) на любом уровне путем пропускания тока через второй микроэлектрод, поэтому этот потенциал также называют поддерживаемым (holding potential). При помощи генератора прямоугольных импульсов электрического тока на мембране поддерживаемый потенциал можно смещать до некоторой новой величины и удерживать на этом уровне также с помощью электронной схемы с обратной связью. Ток, протекающий через этот участок мембраны при поддерживаемом потенциале или под влиянием приложенного напряжения, измеряют отдельным усилителем.
На рисунке 1-53 Б показаны примеры регистрации при типичных экспериментах с фиксацией потенциала у ооцита, в который экспрессированы потенциалуправляемые Na+-каналы. В этих экспериментах потенциал поддерживается на уровне -80 мВ. В первой части экспериментов тестирующая ступенька длиной 10 мс смещает потенциал от -80 до -120 мВ и вновь возвращает его к -80 мВ. В этом случае регистрируют только короткие емкостные пики в начале и в конце прямоугольного импульса. В промежутке между емкостными
пиками, т.е. на фоне самой ступеньки, не регистрируются никакие другие токи. Во второй части экспериментов тестирующая ступенька длиной 10 мс смещает потенциал от -80 мВ до -40 мВ и вновь возвращает его к -80 мВ. В этом случае в промежутке между емкостными пиками, т.е. на фоне самой ступеньки, регистрируется входящий ток. Этот ионный ток, протекающий через экспрессированные в ооцит потенциалуправляемые №+-каналы. Часто этот ток называют макроскопическим, поскольку он протекает через большую популяцию каналов в целой клетке.
Для понимания механизма удобно рассмотреть электрическую модель аксона. На рисунке 1-53 В сопротивление r представляет собой сопротивление осевого электрода, связывающего разные участки мембраны. Предположим, что моделируемый аксон находится в большом объеме раствора, так что наружная жидкость эквипотенциальна и на схеме может быть представлена проводником без сопротивления. На рисунке показан один элемент мембраны, а следует представить себе большое число аналогичных элементов, связанных между собой и образующих непрерывный кабель. Каждый элемент содержит емкость мембраны С, калиевую и натриевую батареи Ек и ЕNa и сопротивления RK и RNa. Сопротивление утечки Rl и батарея Еl введены для учета движения ионов, проходящих по каналам, которые не изменяются во время активности. Однако ток утечки мал, и в первом приближении его можно не принимать во внимание.
Рис. 1-53. Двухэлектродный метод фиксации потенциала.
А - схема опыта. Б - регистрируемые токи на фоне гиперполяризации и деполяризации. В - эквивалентная электрическая схема элемента возбудимой мембраны аксона. Обозначения: r - сопротивление осевого электрода, введенного в аксон; С - емкость мембраны; VK - калиевая батарея; RK - сопротивление К+-канала; VNa - натриевая батарея; RNa - сопротивление Nа+-канала; Rl - сопротивление утечки; Vl - батарея утечки
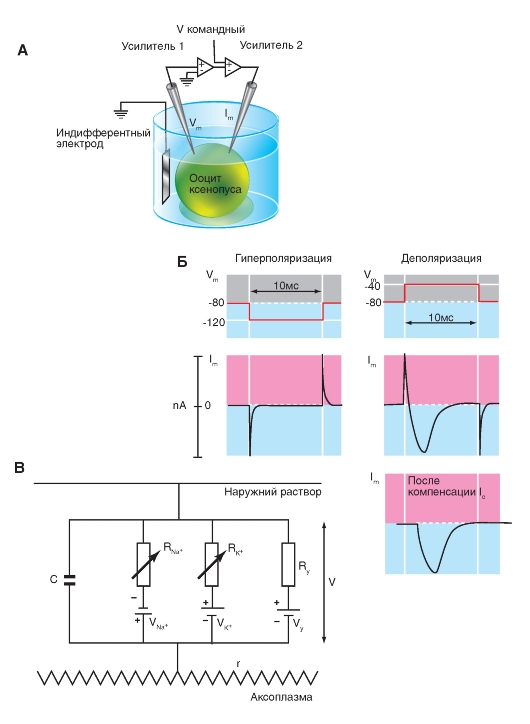
Na+- и К+- проводимость
Зная величину калиевого и натриевого тока, нетрудно оценить проводимость мембраны для каждого иона. При подпороговых значениях деполяризации выходящий калиевый ток больше входящего натриевого, что препятствует достижению мембранным потенциалом порога.
Как только входящий Na+-ток хотя бы слегка превысит выходящий К+-ток, мембранный потенциал неизбежно начнет смещаться регенеративным образом в сторону ENa .
Зная величину калиевого и натриевого тока, можно оценить проводимость мембраны для каждого иона. На рисунке 1-54 А показаны изменения проводимости, вызванные быстрым смещением потенциала внутри волокна до 0 мВ относительно поддерживаемого потенциала, равного -56 мВ. Смещение мембранного потенциала до нуля эквивалентно короткому замыканию мембраны. В этом случае конденсатор С сразу разряжается, и с этого момента ток создают только ионы, проходящие по каналам, имеющим сопротивление RNa и RK.
Натриевая проводимость (gNa) в ответ на смещение мембранного потенциала относительно поддерживаемого потенциала изменяется от крайне низкой величины и быстро нарастает, а затем экспоненциально уменьшается. Это экспоненциальное уменьшение gNa может быть быстрым или медленным, что определяется длительностью ступеньки деполяризации. Если смещение потенциала относительно поддерживаемого потенциала (например, потенциала покоя) было кратковременным (как это показано красной пунктирной линией; рис. 1-54 А, красная кривая, импульс 1), и потенциал покоя был быстро восстановлен, gNa быстро возвращается к состоянию покоя (пунктирная красная кривая). Если сразу же подать второй аналогичный импульс, вызывающий смещение потенциала относительно поддерживаемого потенциала, то это также вызывает аналогичное увеличение gNa. Если же деполяризация продолжительна (рис. 1-54 А, красная кривая, импульс 2 или 3), gNa быстро увеличивается, но уменьшается более медленно (рис. 1-54 А, сплошная кривая)
вследствие процесса, называемого инактивацией. В этом случае, чтобы второй импульс после инактивации натриевых каналов мог снова вызвать изменение проницаемости для натрия, мембрана в течение нескольких миллисекунд до нанесения этого импульса должна быть реполяризована. Что же касается калиевой проводимости (gK), то во всяком случае в аксоне кальмара не обнаружено инактивации, и высокая gK сохраняется все время, пока мембрана деполяризована. Так, если смещение потенциала относительно поддерживаемого потенциала было не очень длительным (рис. 1-54 А, красная кривая, импульс 2), высокая gK сохраняется до возвращения потенциала к поддерживаемому потенциалу (рис. 1-54 А, пунктирная коричневая кривая). Если же смещение потенциала относительно поддерживаемого потенциала было длительным (рис. 1-54 А, красная кривая, импульс 3), высокая gK сохраняется все время, пока мембрана деполяризована (рис. 1-54 А, сплошная коричневая кривая).
Калиевая проводимость (gK) нарастает от небольшой, но вполне определенной величины. Это изменение начинается не сразу. Кривая увеличения gK имеет S-образную форму, и проводимость выходит на постоянный уровень через 5-6 мс. Задержанный сдвиг gK достигает максимума, и это начинает возвращать мембранный потенциал к уровню потенциала покоя (а часто сдвигает его и несколько дальше этого уровня). Кроме того, приходит в действие другой независимый механизм: деполяризация мембраны вызывает также (с задержкой) инактивацию gNa, что тоже способствует возвращению мембранного потенциала к уровню потенциала покоя.
Таким образом, деполяризация гигантского аксона кальмара запускает три процесса:
быстрое нарастание gNa;
• задержанное нарастание калиевой проводимости, которая не инактивируется (но выключается при реполяризации мембраны);
• задержанную инактивацию gNa (рис. 1-54 А, Б). Рассчитанные значения потенциала действия
(А.Л. Ходжкин и А.Ф. Хаксли) были похожи на зарегистрированный потенциал действия (рис. 1-54 В).
Рис. 1-54. Натриевая и калиевая проводимости и теоретическая реконструкция потенциала действия.
А - изменения во времени gNa и gK при деполяризации на 56 мВ, т.е. от поддерживаемого потенциала, равного -56 мВ, до 0 мВ. Поддерживаемый потенциал мембраны клетки и его смещение обозначены красной кривой, gNa и gK - бордовой и коричневыми кривыми соответственно. Сплошными линиями обозначены продолжительная деполяризация и изменения gNa и gK в этом случае; пунктирными линиями показаны изменения gNa и gK в ответ на более короткие ступени деполяризации gNa и gK. Б - рассчитанные изменения gNa и gK при развитии потенциала действия (V). В - сравнение рассчитанного потенциала действия (В1) с реальным потенциалом действия, зарегистрированным в гигантском аксоне кальмара (В2). Рассчитанная скорость проведения потенциала действия составляла 18,8 м/с, а полученная в эксперименте - 21,2 м/с
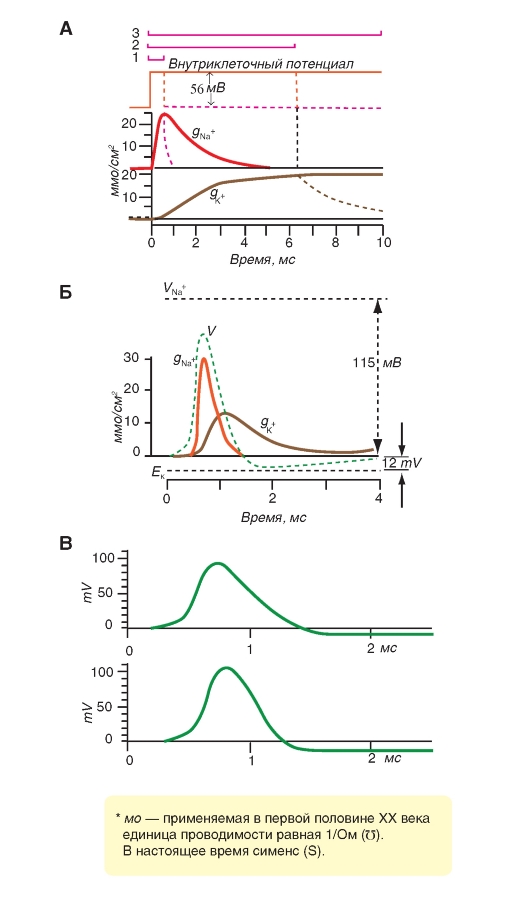
Токи при разных ступеньках потенциала
Рассмотрим ответ мембраны клетки на ступенчатое смещение мембранного потенциала относительно поддерживаемого потенциала (потенциала покоя). Пусть мембранный потенциал поддерживается на величине -60 мВ, равной величине потенциала покоя клетки. В этом случае мы не зарегистрируем ни входящего, ни выходящего тока, и прибор, регистрирующий ток, будет показывать нулевую линию. Теперь ступенчато сместим поддерживаемый потенциал на 20 мВ в сторону деполяризации (рис. 1-55 А - верхний фрагмент). На приборе, регистрирующем текущий через мембрану ток, можно будет увидеть осцилляцию нулевой линии, включающую отклонение тока в отрицательное направление (т.е. входящий ток) и последующее отклонение в положительном (т.е. выходящий ток) (рис. 1-55 Б - верхний фрагмент). Однако и входящий, и выходящий токи при подобном смещении мембранного потенциала малы. Теперь ступенчато сместим поддерживаемый потенциал на 40 мВ в сторону деполяризации. На приборе можно будет видеть увеличение амплитуд входящего и выходящего токов. Сместим поддерживаемый потенциал на 60 мВ, т.е. до 0 мВ. На приборе мы увидим максимальное увеличение амплитуды входящего и выходящего токов. При более высоких величинах деполяризации входящий ток становится меньше и при смещении мембранного потенциала от 110 до 120 мВ, сдвигающей потенциал мембраны в зону от +50 до +60 мВ, обращается в нуль (до потенциала реверсии). Если смещение потенциала будет еще больше (на 160 мВ), входящий ток изменит знак и будет течь наружу. Выходящий ток с увеличением ступенек ведет себя противоположным образом: по мере того как мембрана все больше деполяризуется,
он увеличивается. Выходящий ток уменьшается только тогда, когда мембранный потенциал изменяется в сторону гиперполяризации (после того как вначале он был быстро сдвинут в сторону деполяризации ступенькой порядка 84 мВ). Потенциал реверсии для выходящего тока равен около -80 мВ. Изменения входящего и выходящего токов в зависимости от мембранного потенциала легко представить в виде вольтамперных характеристик (рис. 1-55 В). На этих графиках пики входящего тока и установившиеся значения выходящего откладываются по оси абсцисс как функции смещения мембранного потенциала относительно поддерживаемого потенциала. Как видно из таких графиков, деполяризующие ступеньки активируют как входящий, так и выходящий токи. Вначале с увеличением деполяризации оба тока увеличиваются по амплитуде. Затем входящий ток уменьшается и при деполяризующих ступеньках более 110 мВ меняет знак.
Входящий ток объясняется тем, что в результате увеличения gNa, вызываемого деполяризацией, ионы Na+ устремляются внутрь клетки. Исходя из увеличения gNa, этот ток прекращается при +55 мВ - потенциале равновесия Нернста для Na+ (ЕNa). При ЕNa сила, обусловленная электрическим потенциалом, равна по величине и противоположна по направлению силе, создаваемой градиентом концентрации, так что суммарного натриевого тока нет. При еще большей деполяризации первая из этих сил становится больше второй, и ионы Na+ начинают выходить из клетки наружу, тем самым изменяя направление тока. Подобным образом особенности выходящего тока определяются тем, что его носителями служат ионы К+. По мере деполяризации мембраны силы электрического поля, стремящиеся удержать К+ внутри клетки, уменьшаются, приводя ко все большему преобладанию направленных наружу сил, обусловленных градиентом концентрации К+.
Рис. 1-55. Фиксация потенциала на гигантском аксоне кальмара.
А - смещения мембранного потенциала во времени относительно поддерживаемого потенциала. Б - ток через мембрану, регистрируемый одновременно со смещением потенциала. Показаны только смещения потенциала в положительную область от уровня поддерживаемого потенциала, равного -60 мВ (например, потенциала покоя). В - вольтамперные характеристики, полученные в результате экспериментов с фиксацией потенциала. По оси абсцисс - смещения мембранного потенциала относительно поддерживаемого потенциала (в данном случае потенциала покоя); по оси ординат - изменения входящего Na+-тока (фиолетовая кривая) и выходящего К+-тока (коричневая кривая)
Основные блокаторы Na+- и К+-токов ТТХ и ТЭА
Эксперименты с заменой ионов и полученные результаты требовали независимых исследований с селективным блокированием различных ионных каналов. Эти поиски увенчались успехом, и сходные кривые были получены, когда вместо замены ионов применяли высокоселективные соединения, блокирующие ионные каналы. Например, при введении в перфузионный раствор, окружающий клетку, тетродотоксина (TTX) - яда японской рыбы иглобрюха - он воздействует только на нарастание gNa, происходящее при деполяризации мембраны. Его эффект крайне специфичен. TTX не влияет на калиевую проводимость, более того, он даже не особенно подавляет функцию тех натриевых каналов, которые действуют в покоящейся мембране (а также каналов, активируемых медиаторами) (рис. 1-56 А). TTX блокирует только повышенную проводимость gNa, появляющуюся при деполяризации. Другое вещество - тетраэтиламмоний (ТЭА) - подавляет калиевую проводимость,
возрастающую при деполяризации, но только тогда, когда введено внутрь аксона (рис. 1-56 Б); оно не влияет на gNa. Избирательность действия фармакологических соединений позволила установить и другие детали. Например, когда внутрь аксона вводят проназу - фермент, расщепляющий белки, - она избирательно нарушает инактивацию gNa. После обработки аксона проназой натриевый ток нарастает обычным образом, но потом не спадает: он остается большим в течение всего времени деполяризации. Первый сделанный из этого вывод заключался в том, что включение и выключение gNa - это два независимых процесса. Второй вывод основывался на следующей дополнительной информации, известной биохимикам. Проназа представляет собой комплекс из 11 ферментов. Последовательное введение каждого из них в клетку показало, что к избирательному нарушению инактивации gNa приводит только введение В-щелочной протеазы. Поскольку она селективно отщепляет аргинин от белковой цепочки, было постулировано, что инактивационные ворота Na+-канала представляют собой аргинин.
Рис. 1-56. Избирательное блокирование натриевых и калиевых каналов с помощью тетродотоксина и тетраэтиламмония.
В первой части рисунка представлены наложенные друг на друга 7-9 записей, сделанных в условиях фиксации потенциала (на уровнях от 30 до 150 мВ) на одном перехвате Ранвье седалищного нерва лягушки. На записях цифрами показаны смещения мембранного потенциала от поддерживаемого потенциала (в данном случае потенциала покоя, равного около -75 мВ), кратные 15 мВ. Входящий ток направлен вниз, а выходящий вверх. Поскольку площадь мембраны перехвата, на которой фиксировали напряжение, нельзя определить точно, указана сила тока (в наноамперах), а не плотность тока. В нижней части рисунка представлены вольтамперные характеристики измеряемых токов. А - изменение тока во времени в опыте с обычным солевым раствором (А1) и в присутствии тетродотоксина (А2). Тетродотоксин блокирует ту часть общего мембранного тока, которая переносится ионами Na+, но не К+, т.е. входящий натриевый ток, оставляя без изменений выходящий калиевый ток (Hille, 1976). Б - изменение тока во времени в опыте с нормальным солевым раствором (Б1) и в присутствии тетраэтиламмония (Б2). Влияние тетраэтиламмония на ток показывает, что это соединение блокирует калиевый, но не натриевый ток. (По Hille, 1976, с изменениями) В - вольтамперные характеристики гигантского аксона Myxicola, показывающие INa (белые кружечки) и IK (белые треугольники) в контрольных условиях и демонстрирующие, что тетродотоксин (1 мкМ) блокирует INa (черные кружечки), но не IK (черные треугольники). Точки - ионные токи во время ступенек напряжения от уровня поддерживаемого потенциала до указанного уровня
Nа+-токи
Рассмотрим Na+-токи, зарегистрированные методом voltage-clamp. На рисунке 1-57 А продемонстрированы Na+-токи, зарегистрированные у ряда электровозбудимых клеток при различных величинах смещения мембранного потенциала относительно поддерживаемого потенциала. Величины поддерживаемых потенциалов в этом случае не приводятся, поскольку они различные для клеток разных тканей. Однако приводятся величины смещений мембранного потенциала относительно поддерживаемого потенциала, при которых входящий Na+-ток максимален, и величины, при которых максимален инвертированный Na+-ток (т.е. ток, изменивший свое направление). Разумеется, фаза деполяризации потенциала действия лежит в том диапазоне
потенциалов, при которых Na+-ток имеет входящее направление. Выходящее направление этого тока в естественных условиях не встречается, а присутствует только в условиях значительных смещений мембранного потенциала в эксперименте, что позволяет охарактеризовать проводимость каналов при всех возможных уровнях смещения потенциала.
На рисунке 1-57 Б представлена запись Na+- токов при смещении мембранного потенциала относительно величины поддерживаемого потенциала. Величина поддерживаемого потенциала Ehp равна -90 мВ. На основании результатов экспериментов по пиковым значениям и по стационарным значениям токов, представленных на рисунке 1-57 Б, были построены вольтамперные характеристики (рис. 1-57 В), типичные для Na+-токов.
Рис. 1-57. Na+-токи, зарегистрированные в конфигурации whole-cell у электровозбудимых клеток при различных величинахсмещения мембранного потенциалаотносительно поддерживаемогопотенциала. K+-каналы были ингибированы Cs, тетраэтиламмонием или 4-аминопиридином.
А - Na+-токи, зарегистрированные у разных электровозбудимых клеток. Б - Na+-токи, зарегистрированные при разных ступеньках относительно поддерживаемого потенциала. Величина поддерживаемого потенциала Eh равна -90 мВ. Величины ступенек тестирующих потенциалов указаны на рисунке. В - вольтамперные характеристики, построенные по пиковым значениям (о) и по стационарным значениям (∆)Na+-токов
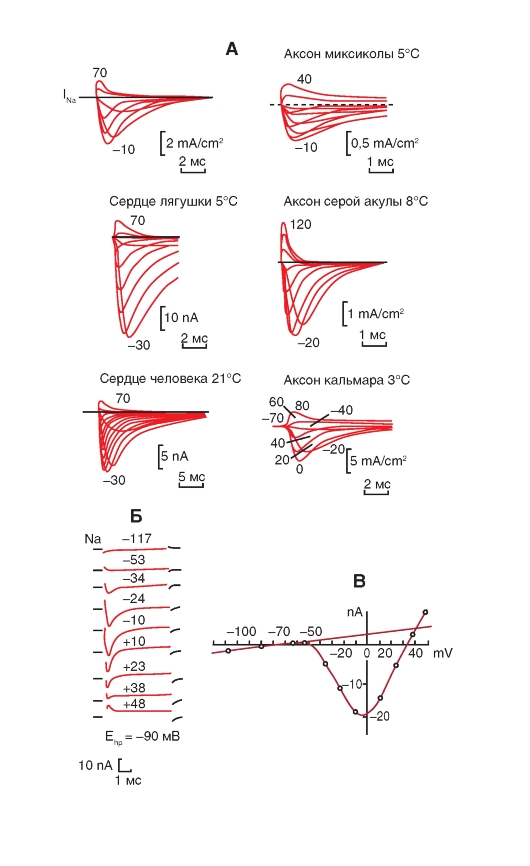
Активация и инактивация Na+-токов
Корректное описание инактивации входящих токов представляет определенные сложности, поскольку этот процесс развивается во времени параллельно с развитием выходящих K+-токов. Поэтому регистрируемый спад тока может быть не истинным, а определяться наложением на входящий ток одновременно развивающихся выходящих K+-токов. Для предотвращения подобных ошибок необходимо тщательно блокировать K+-токи. Их наличие в наиболее простой форме можно определить по амплитуде входящего тока в конце достаточно длинного по времени стимула. В этом случае она будет слегка превышать «нулевую» линию (Y0 >0). Здесь следует отметить, что превышение «нулевой» линии в конце стимула может также отражать очень медленную (константа времени значительно больше длительности стимула) инактивацию исследуемого входящего тока. Именно поэтому во избежании возможных ошибок сложный динамический процесс инактивации сводят к стационарной (steady-state) инактивации.
В этом случае измеряют уменьшение максимальной величины тока, вызванного тестирующими деполяризующими ступеньками в случае, если перед этим мембранный потенциал определенное (достаточно длинное по сравнению с длительностью инактивации) время поддерживался на сниженном уровне. Зависимость этого уменьшения от величины поддерживаемого потенциала носит S-образную форму. При этом для характеристики каналов помимо амплитуды тока (I) обычно рассматривают величину активации (Va) и величину инактивации (Vh). Если сущность постоянных времени активации и инактивации каналов достаточно понятна, то величины активации (Va) и инактивации (Vh) требуют пояснения.
На рисунке 1-58 показаны принципы исследования активации и инактивации тока.
На панели А данного рисунка представлены тестовые сигналы и steady-state активация IT. Мембрана клетки была на поддерживаемом потенциале -100 мВ в течение 1 с, и токи выявляли с помощью деполяризующих шагов-ступенек. На панели Б показана активационная кривая, полученная на основании уравнения Больцмана в следующей форме:
где I представляет собой амплитуду тока, Imax является максимальной амплитудой тока, V - тестовый потенциал, V0,5 - потенциал полуактивации или иначе Va. На панели В рисунка представлены тестовые сигналы и steady-state инактивация тока. Мембрана клетки была на поддерживаемом потенциале в диапазоне от -110 до -45 мВ в течение 1 с, и токи выявляли при помощи деполяризующих шагов-ступенек до -40 мВ. На панели Г показана инактивационная кривая, полученная на основании уравнения Больцмана в следующей форме:
где I представляет собой амплитуду тока, Imax является максимальной амплитудой тока, V - потенциал, V0,5 - потенциал полуинактивации или иначе Vh. И в случае (Б), и в случае (Г) константа k представляет собой наклон кривой (фактор крутизны) и отражает steady-state потенциалчувствительность каналов или «диапазон» потенциалов, в котором каналы функциональны. Чем больше k, тем уже диапазон. В части рисунка (Д) кривые на панелях Б и Г объединены вместе.
Рис. 1-58. Принципы регистрации и анализа активации и инактивации тока
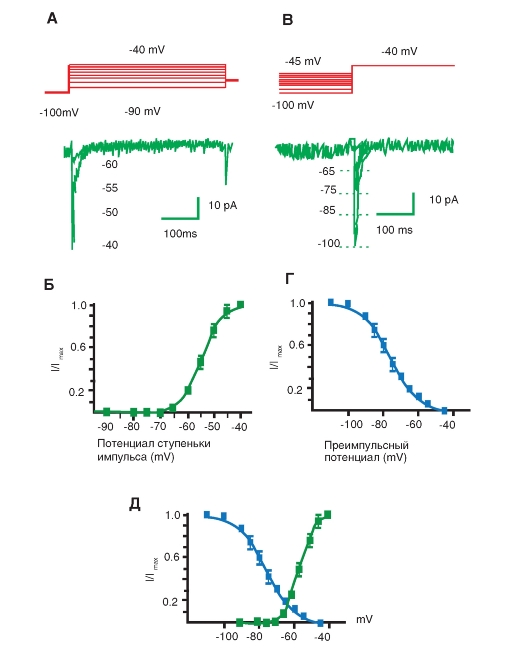
Na+-каналы
В настоящее время известно 9 типов Na+-каналов. Рисунок 1-59 А демонстрирует одиночные Na+- каналы, зарегистрированные методом patch-clamp в конфигурации cell-attached. Ток через канал возникает при смещениях мембранного потенциала от -80 мВ (поддерживаемый потенциал) до -40 мВ. Открытое состояние Na+-каналов характеризуется смещением нулевой линии вниз, и это свидетельствует о том, что через канал течет входящий Na+-ток. Рисунок 1-59 Б демонстрирует открытое состояние одного, двух или трех Na+-каналов.
На рис. 1-59 А показано 10 регистраций одиночного натриевого канала в ответ на стимуляцию деполяризационной тестовой ступенькой потенциала (цитозольная сторона patch электроотрицательна) в одном и том же эксперименте.
Н рис. 1-59 Б показано 8 регистраций одиночного натриевого канала в ответ на стимуляцию деполяризационной тестовой ступенькой потенциала (цитозольная сторона patch электроотрицательна) в одном и том же эксперименте, выполненном методом patch-clamp (записи одного и того же канала).
Рис. 1-59. Na+-ток через одиночный Na+-канал в мышечной клетке мыши. А - Регистрация методом patch-clamp в конфигурации cell-attached одиночных ионных каналов при смещениях мембранного потенциала от -80 до -40 мВ. Открытое состояние Na+-каналов представлено в виде смещения нулевой линии вниз, т.е. через канал течет входящий Na+-ток. Б - Регистрация методом patch-clamp в конфигурации outside-out одиночных ионных каналов при смещениях мембранного потенциала от -100 до -40 мВ
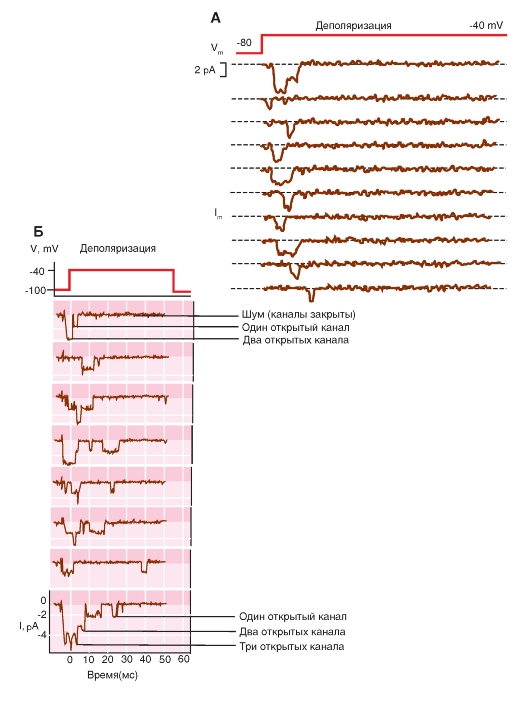
Параметры Na+-тока
Микроскопические механизмы, то есть механизмы на уровне токов, текущих через одиночные каналы, лежащие в основе макроскопических вольт-амперных характеристик, то есть процессов, происходящих на уровне токов, текущих через целую клетку.
На рис. 1-60 А линия обозначает вольт-амперную зависимость идеализированного открытого натриевого канала. Т.к. мы исходим из начальной предпосылки, что канал в нашем случае будет полностью открыт все время (т.е. что проводимость каналов не будет функцией напряжения) тогда ток, текущий через них, будет линейным или «омическим».
На рис. 1-60 Б представлена кривая, которая показывает вероятность того, что натриевый канал будет находиться в открытом состоянии (вероятность открытия натриевого канала). Уравнение, приведенное во вставке в рисунок, означает
приведенную кривую, если мы вставим значения
ZNa = 6.5 и V0.5= - 50 mV.
На рис. 1-60 В параметр m описывает вероятность того, что каждая из трех частей в натриевом канале находятся в необходимом состоянии для того, что бы канал открылся. Параметр h описывает вероятность того, что инактивирующая часть натриевого канала находится в необходимом состоянии для того, что бы канал открылся (т.е. не будет инактивировать его). Таким образом, высокие значения параметра h располагают к тому, чтобы канал был в открытом состоянии. Параметры, отложенные на рисунке - это значения m и h на бесконечном промежутке времени.
На рис. 1-60 Г представлена оценка макроскопического натриевого тока посредством умножения одноканальных токов из секции А рисунка на вероятность их открытия Ро из секции Б и на количество каналов (N). В данном случае мы устанавливаем количества каналов в 100 натриевых.
Рис. 1-60. Параметры Na+-тока, протекающего через целую клетку и через одиночные ионные каналы
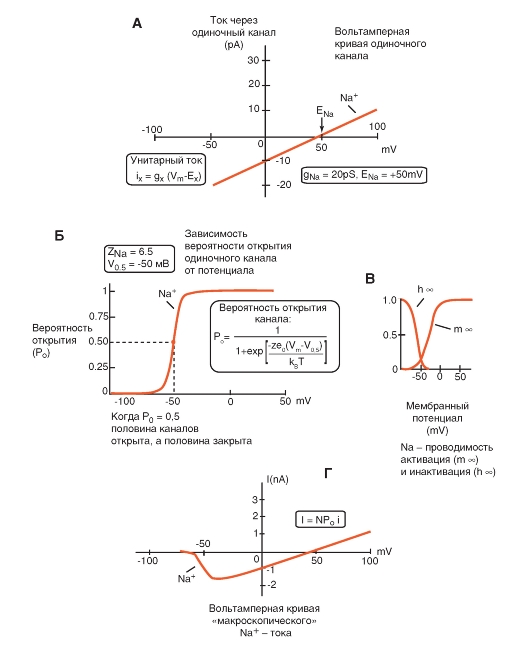
Места связывания токсинов у Na+-канала
Большое количество биологических токсинов оказывают свой токсический эффект, модифицируя свойства Na+-каналов. Они включают:
• растворимые в воде гетероциклические гуанидиновые соединения: ТТХ и сакситоксин (saxitoxin, STX);
• липидорастворимые полициклические соединения: вератридин, аконитин и батрахотоксин (batrachotoxin, BTX);
• яды, представляющие собой низкомолекулярные полипептиды, изолированные из скорпиона, морских анемон и многих других.
После появления данных об этих участках B. Hille предложил наглядную схему взаимодействия токсинов с белком канала (рис. 1-61). Эта схема и до настоящего времени позволяет читателям, не обладающим специальной молекулярно-биологической подготовкой, понять, в каком месте канала происходит взаимодействие с теми или иными токсинами.
Все фармакологические соединения, действующие на Na+-каналы, имеют места или участки связывания на α-субъединице. Были идентифицированы, по крайней мере, шесть отличающихся мест связывания для нейротоксинов и один участок связывания для местных анестетиков и сходных с ними веществ, которые представлены в таблице (рис. 1-61).
Место связывания 1 связывает непептидные блокаторы поры Na+-каналов - ТТХ, STX и пептидный блокатор поры μ-конотоксин. Рецепторные участки для этих токсинов сформированы аминокислотными остатками в петле поры и непосредственно на внеклеточной стороне петли поры с внешней стороны.
Место связывания 2 связывает семейство липидорастворимых токсинов, включающих аконитин (aconitine, AC), вератридин (veratridine, VER), BTX и граянотоксин (grayanotoxin, GTX), которые поддерживают активацию натриевых
каналов. Фотоафинная маркировка и исследования мутагенеза демонстрируют трансмембранные сегменты IS6 и IVS6 в рецепторном участке
для BTX.
Место связывания 3 связывает α-токсин скорпиона и токсины морских анемон, которые ингибируют инактивацию Na+-каналов, замедляя переход Na+-каналов, находящихся в активированном состоянии, к состоянию их инактивации. Эти пептидные токсины связываются в комплексном рецепторном участке, включающем петлю между сегментами S3-S4 на внешнем конце S4 сегмента в домене IV.
Место связывания 4 связывает β-токсины скорпиона, которые увеличивают активацию каналов. Рецепторный участок для β-токсина скорпиона включает петлю, соединяющую сегменты S3-S4 на внеклеточном конце сенсора напряжения сегмента S4 в домене II.
Место связывания 5 связывает комплекс полиэфирных токсинов - бреветоксинов (brevetoxin, PbTx) и CTX (ciguatoxin), которые продуцируют морские планктонные формы dinoflaggelates. В экспериментах с фотоафинной меткой было показано, что трансмембранные сегменты IS6 и IVS5 обеспечивают связывание PbTx.
Место связывания 6 связывает пиретроиды, представляющие собой аналоги природных нейротоксинов приретринов, 4,4-дихлордифенил- трихлорэтан и δ-конотоксины, которые замедляют скорость инактивации подобно α-токсину скорпиона. Местоположение нейротоксинового рецепторного участка 6 неизвестено.
Наконец, местные анестетики и вещества, родственные антиэпилептикам, и антиаритмические вещества связывают перекрывающиеся рецепторные участки, расположенные во внутренней полости поры натриевого канала. Аминокислотные остатки в сегментах S6, по крайней мере в трех из четырех доменов, вносят вклад в этот сложный комплекс рецепторного участка к соединению, при этом доминирующую роль играет IVS6-сегмент.
Рис. 1-61. Места связывания токсинов с различными доменами и сегментами потенциалуправляемых натриевых каналов, посредством которых реализуется физиологический эффект
Места связывания токсинов у потенциал-управляемых Na+-каналов
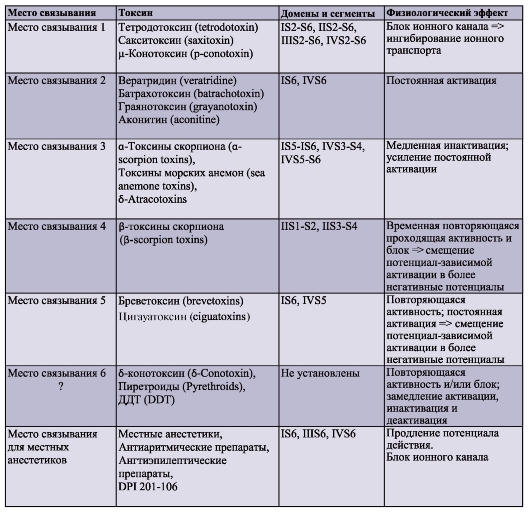
Центр связывания 1 у Na+-канала
Первые два (рис. 1-62 А) естественно встречающихся токсина, вероятно, лучше всего исследованы в качестве модификаторов Na+-каналов. TTX - сильнейший яд (LD50 0,1 мг/кг), найденный в яичниках и печени и в меньшем количестве в кишечнике и коже рыбы фугу и родственных ей рыб из семейства Tetraodontidae. Сама рыба не синтезирует TTX, но вместо этого концентрирует его из заглатываемых бактерий. Рестораны в Японии и Корее подают рыбу фугу как деликатес после удаления ядовитых органов. Однако много фатальных случаев происходит каждый год в пределах от Новой Гвинеи до Японии, Таиланда и Вьетнама. По некоторым оценкам, общее количество смертных случаев составляет 120 в год. Кроме того, есть интересная энтологически-фармакологическая связь между отравлением TTX и колдовским фольклором на Гаити. TTX представляет собой главный активный фармакологический компонент, ответственный за введение человека в состояние каталепсии - оцепенения. TTX был выделен из порошка, используемого в колдовских ритуалах, который был приготовлен методами экстракции из различных животных (рыбы, лягушки) и растений.
STX, подобно TTX, относится к блокаторам активации Na+-каналов и известен так же, как паралитический яд моллюска (PSP: paralytic shellfish
poison). Этот токсин, найденный в некоторых моллюсках, членистоногих, иглокожих и некоторых других морских животных, заглатывающих протистов (простейших одноклеточных организмов), главным образом Dinoflagellata - одноклеточный организм в морском планктоне, который содержит яд. Кроме того, STX представляет собой продукт некоторых пресноводных Cyanobacteria. Этим способом фильтрующие корм ракушки, рыбы или моллюски становятся ядовитыми и могут вызвать паралитическое ракушечно-рыбное отравление при потреблении пищи домашними животными и человеком.
TTX и STX, возможно, наиболее специфичные токсины для Na+-каналов. В большинстве случаев связывание быстро обратимо (секунды и минуты) и высокоафинно. Их равновесная константа диссоциации Kd лежит в диапазоне 1-10 нМ для изоформ скелетной мышцы или нервных клеток, а для менее чувствительных сердечных Na+- каналов - в диапазоне нескольких мкМ. Два гуанидиновых токсина и их структурные аналоги оказались ценными инструментами как для исследования формы и структуры внешнего устья, так и для моделирования TTX- и STX-связываю- щего участка. Изучение связывания с STX предполагает, что также β1-субъединица участвует в формировании TTX/STX связывающего участка. На рисунке 1-62 показано ингибирующее действие TTX на Na+-ток.
Рис. 1-62. Блокаторы участка связывания 1 тетродотоксин, сакситоксин и μ-конотоксин, блокирующие проводимость ионов.
А - химическая структура блокаторов поры Na+-каналов - тетродотоксина и сакситоксина. Б - типичное блокирующее действие тетродотоксина на Na+ток. Суммарный ток, включающий входящий Na+-ток и выходящий ток, возникающий при разных ступенях деполяризации относительно поддерживаемого потенциала (Б1). Полное ингибирование входящего Na+-тока тетродотоксином в концентрации 300 нМ (Б2)
Центр связывания 2 у Na+-канала
Представители группы липидорастворимых соединений могут получить доступ к определенному центру связывания Na+-канала, находящегося в плазматической мембране. Эта группа соединений включает алкалоиды подобно BTX, AC, VER и GTX. Они связываются с участком связывания 2 у Na+-каналов. Все эти токсины существуют в природе: BTX секретируется кожей колумбийской ядовитой лягушки рода Phyllobates, а другие три токсина имеют растительное происхождение. VER изолирован из алкалоидной смеси чемерицы - растения семейства Liliaceae. AC - алкалоид, вырабатываемый растением Aconitum napellus. GTX найден в рододендронах и других растениях семейства Вересковые (рис. 1-63 А).
Прежде всего, рассмотрим феноменологическую сторону нейротоксического действия BTX, VER, AC и GTX на мембраны клеток в виде первых наиболее простых экспериментов, выполненных с использованием этих соединений.
BTX можно рассматривать как полный агонист, так как при воздействии он вызывает одновременное изменение всех основных свойств Na+-каналов. Кроме двух выше упомянутых эффектов,
BTX ухудшает проводимость одиночных каналов и их селективность для ионов.
На рисунке 1-63 Б1 показано развитие во времени Na+-токов, текущих через Na+-каналы в клетках гибридной линии нейробластома-глиома, перфузируемых стандартным раствором, а затем (рис. 1-63 Б2) продемонстрированы Na+-токи, текущие через Na+-каналы в условиях перфузии клетки раствором, содержащим BTX в концентрации 5х10-6 М. Очевидно отсутствие фазы инактивации тока.
Далее показано (рис. 1-63 В) смещение влево примерно на 50 мВ активационной кривой под действием BTX в концентрации 5х10-6 М. Это смещение было меньше в клетках миокарда новорожденных крысят (приблизительно на 30 мВ).
На рисунке 1-63 Г представлены вольтамперные характеристики перехвата Ранвье, причем в первом случае перехват Ранвье находился в стандартном перфузионном растворе, а во втором случае - в растворе, содержащем BTX. Одна кривая построена по пиковым значениям интактного Na+-тока, а другая представляет собой вольтамперную кривую для модифицированных (треугольники) и интактных (кружочки) каналов.
Рис. 1-63. Блокаторы участка связывания 2 - батрахотоксин, вератридин, граянотоксин и аконитин, - эффект которых определяется постоянной активацией Na+-канала.
А - химическая структура токсинов, повышающих активацию натриевых каналов, - аконитина, вератридина, батрахотоксина и граянотоксина. Б - влияние батрахотоксина на Na+^оки у клеток нейробластомы. Б1 - Na+-токи, текущие через Na+-каналы в клетках нейробластомы, перфузируемых стандартным раствором. Поддерживаемый потенциал Ehp = -100 мВ. Тестируемые ступеньки деполяризации от Ehp до -45, -40, -35, -20, +15 мВ. Б2 - Na+-токи, текущие через Na+-каналы в клетках нейробластомы, перфузируемых стандартным раствором, содержащим батрахотоксин в концентрации 5х10-6 М через 30 мин после начала перфузии. Поддерживаемый потенциал Ehp = -110 мВ. Тестируемые ступеньки деполяризации от Ehp до -90, -85, -75, -65, -40, -35, -25 мВ. (Примечание: при экспериментах использовали гибридную линию нейробластомы-глиомы NG 108-15.) В - влияние батрахотоксина в концентрации 5х10-6 М через 30 мин на активационную кривую у клеток нейробластомы. Черные кружечки - контроль, белые кружечки - влияние соединения. Г - вольтамперные характеристики, полученные для перехвата Ранвье, находящегося в стандартном перфузионном растворе (Г1). Вольтамперные характеристики, полученные для перехвата Ранвье, находящегося в стандартном перфузионном растворе, содержащем 2х10-5 М батрахотоксина (Г2). В обоих случаях кривые построены по пиковым (кружочки) и стационарным (треугольники) значениям мембранных токов. Изменение тока утечки демонстрирует прямая линия
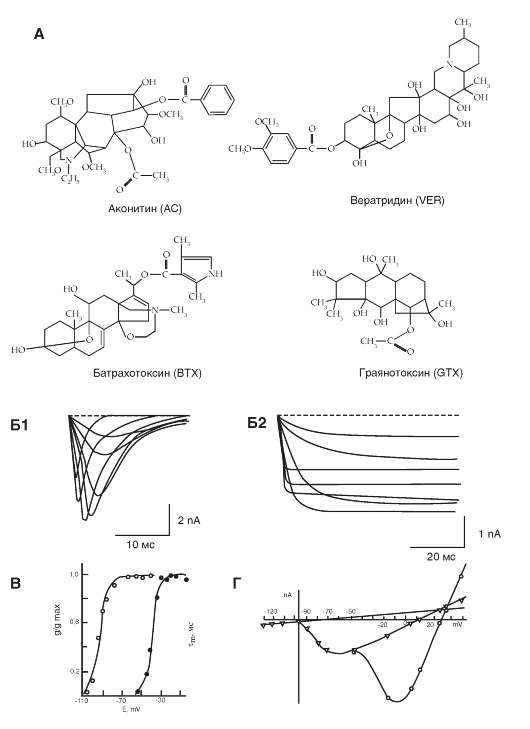
Центр связывания 3 у Na+-канала
Участок связывания 3 взаимодействует с полипептидами α-токсина скорпиона и токсинов морских анемон (ATX), выделенных приблизительно 25 лет назад. Сначала они были известны как сердечные стимуляторы и нейротоксины. Механизм их действия - связывание с Na+-каналами возбудимых тканей и селективное ингибирование их инактивации, преимущественно за счет ингибирования переходов канала от открытого состояния в инактивированное состояние.
Фармакологические свойства токсинов морских анемон (или актиний) хорошо изучены. Это полипептиды с молекулярной массой от 3 до 300 кДа, изолированные из щупальца морской анемоны. Токсины, изолированные из представителей родов Anthopleura (anthopleurin: Ap-A или Ap-B) и Anemonia (ATX I, II или V), представлены относительно большими белками, классифицируемыми как токсины типа I морской анемоны. Для проявления их действия на Na+-каналы они должны быть апплицированы с внеклеточной стороны. Как было обсуждено выше, согласно современным представлениям о структуре Na+-каналов домены, которые, как известно, связаны с инактивацией, в основном расположены внутриклеточно. Тот факт, что токсины
морской анемоны модифицируют инактивацию, хотя они действуют с внеклеточной стороны, делает их перспективными для использования в качестве зондов при исследовании Na+-каналов.
На рисунке 1-64 А продемонстрирован потенциал действия перехвата Ранвье миелинизированного нерва лягушки в стандартном перфузионном растворе (рис. 1-64 А1) и после применения скорпиона (Leiurus quinquestriatus) в концентрации 1 мкг/мл (рис. 1-64 А2).
Далее показан (рис. 1-64 Б) Na+-ток перехвата Ранвье до (Б1) и после (Б2) применения α-токсина скорпиона (Leiurus quinquestriatus). Наблюдается резкое замедление натриевой инактивации.
α-Токсины скорпиона вырабатываются североафриканскими скорпионами, относящимися к родам Androctonus, Buthus и Leiurus. α-Токсин V скорпиона, изолированный из яда Leiurus quinquestriatus, взаимодействует с нейротоксиновым рецепторным участком 3 у Na+-канала. Это связывание сильно зависит от потенциала и замедляет или блокирует инактивацию Na+-канала. α-Токсины скорпиона также аллостерически усиливают постоянную активацию теми нейротоксинами, которые связываются с участком 2, как, например, BTX. Структура нескольких токсинов из яда соответствующего скорпиона была определена методом рентгено-структурного анализа.
Рис. 1-64. Участок 3 связывает α-токсины скорпиона и токсины морских анемон, которые замедляют или блокируют инактивацию. Соединения, связывающиеся на этом участке, также увеличивают постоянную активации Na+-каналов, вызванную токсинами, действующими на рецептор участка 2.
А - влияние яда скорпиона (Leiurus quinquestriatus) на потенциал действия перехвата Ранвье. А1 - потенциал действия перехвата Ранвье миелинизированного нерва лягушки в стандартном перфузионном растворе. А2 - потенциал действия через 5 мин после применения 1 мкг/мл токсина. Потенциал действия был вызван дополяризационным током длительностью 100 мкс. Б - Na+-ток перехвата Ранвье до (Б1) и после (Б2) применения α-токсина скорпиона (Leiurus quinquestriatus)
Центр связывания местных анестетиков у Na+-канала
Местные анестетики (рис. 1-65) типа лидокаина и прокаина вызывают эффект, блокируя Na+-каналы. Показано, что, кроме Na+-каналов, местные анестетики действуют на несколько типов ионных каналов из числа К+-каналов и Ca2+-каналов, а также на рецепторы к нейротрансмиттерам. Все они представлены относительно небольшими липидорастворимыми молекулами, обычно содержащими аминогруппы, которые становятся положительно заряженными в кислой среде. Позднее информация относительно того, как работают местные анестетики, была получена на основании экспериментов с веществом QX-314, аналогом лидокаина, который всегда положительно заряжен и, следовательно, не растворим в липидах. Препарат QX-314В оказывает блокирующее действие на Na+-каналы клеток сердца при аппликации как с наружной, так и с внутренней стороны мембраны, но ингибирование Na+-каналов клеток мозга происходит только когда препарат апплицирован с внутриклеточной стороны. Различие в действии постоянно заряженных местных анестетиков, подобных QX-314, показано для Na+-каналов клеток сердца, мозга и для афферентных нейронов, расположенных в ганглиях задних корешков спинного мозга. Изучение широкого спектра разнообразных клеток in vitro с применением методов patch-clamp в конфигурации whole-cell, экспрессии α-субъединицы Na+-каналов в ооциты шпорцевой лягушки (Xenopus laevis) или клетки млекопитающих позволило обнаружить ингибирование Na+-каналов, когда они находятся в открытом состоянии (use(-state)-dependent). Действие местных анестетиков увеличивалось, когда поддерживаемые потенциалы устанавливали в области большей деполяризации, тогда как при поддерживаемых потенциалах, лежащих в области большей гиперполяризации, блокирующее действие уменьшалось.
Были многочисленные попытки охарактеризовать участок связывания местных анестетиков. В результате нескольких исследований было показано наличие дозозависимого эффекта при
связывании VER и BTX и местных анестетиков, что предлагает аллостерическое взаимодействие этих двух участков связывания. Вне участка связывания 2 нет взаимодействия местных анестетиков с местами связывания нейротоксинов на других участках рецептора. Например, местный анестетик PD85,639 не конкурирует за связывание с антиконвульсионными препаратами фенитоином и карбамазепином, связывающихся в Na+-каналах из синаптосом и синаптических мембран. Недавно опубликованные результаты показывают, что существует гидрофобный участок связывания, который отличается от участка связывания 2, но аллостерически с ним связанный. В нескольких исследованиях было показано предпочтительное взаимодействие соединений с Na+-каналом, находящимся в инактивированном состоянии. В противоположность этим результатам недавно были получены данные, что местный анестетик лидокаин не конкурирует с быстрой инактивацией. Результаты этих экспериментов свидетельствуют, что блокирующий эффект местных анестетиков не является результатом процесса медленного восстановления от быстрой инактивации и не вовлекает увеличение быстро инактивирующихся каналов, как это описано в других работах. Эти данные представляет новую модель, фокусирующуюся на процессах активации, как более уместных для механизма действия местных анестетиков.
Многие данные о мутациях поддерживают модель с отдельным участком связывания для QX-314. Подобные результаты получены и на скелетной мышце. Однако необходимо отметить, что направленные мутации аминокислот в других трех сегментах S6 в доменах DI-DIII, которые могут взаимодействовать с другими трансмембранными сегментами, до сих пор не были выполнены. Так как эти четыре домена канала, как полагают, должны располагаться вокруг поры канала, вероятно, что другие сегменты S6 могут также внести вклад в формирование рецептора для местных анестетиков. Аминокислотные остатки в петлях поры, которые формируют селективный фильтр, - также хорошие кандидаты для будущих экспериментов для определения мишени местного обезболивающего действия.
Рис. 1-65. Структура местных анестетиков, для которых обнаружен специфический участок связывания
Рис. 1-66. Структура пиретроидов и 4,4-дихлордифенил-трихлорэтана, взаимодействующих с участком связывания 6
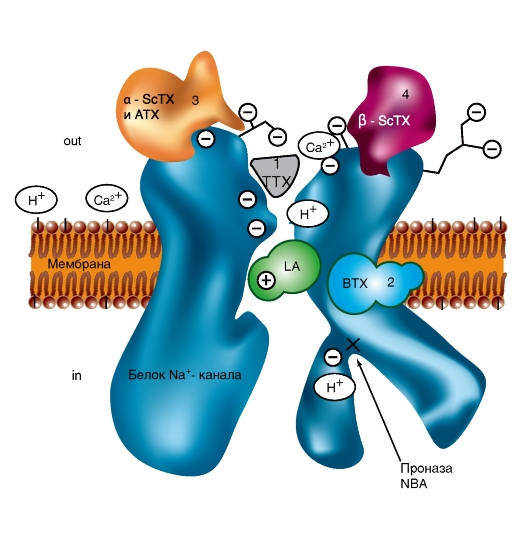
Рис. 1-67. Схема связывания токсинов с различными участками потенциал-управляемого Na+-канала
Са2+-ток и его характеристики
На рисунке 1-68 представлен типичный wholecell Ca2+-ток (ICa-L), определяемый наличием CaV1- каналов, зарегистрированный от изолированного вентрикулярного кардиомиоцита мыши. На панели А продемонстрирована оригинальная регистрация тока при ступенчатом смещении потенциала (-30, -10, 10, 30, 50 мВ) от поддерживаемого потенциала (holding potential: Vhl) = -50 мВ), а на панели Б представлена типичная вольтамперная характеристика, полученная на основе оригинальных регистраций от тех же клеток.
Корректное описание инактивации Ca2+-токов представляет определенные сложности, поскольку этот процесс развивается во времени параллельно с развитием выходящих K+-токов. Именно поэтому регистрируемый спад Ca2+-тока может быть не истинным, а определяться наложением на Ca2+-ток одновременно развивающихся выходящих K+-токов. Для предотвращения подобных ошибок необходимо тщательно блокировать K+-токи. Их наличие в наиболее простой форме можно определить по амплитуде Ca2+-тока в конце достаточно длинного по времени стимула. В этом случае она будет слегка превышать «нулевую» линию (Y0 >0). Следует отметить, что превышение «нулевой» линии в конце стимула может также отражать очень медленную (константа времени значительно больше длительности стимула) инактивацию исследуемого Са2+-тока, поэтому, чтобы избежать возможных ошибок, сложный динамический процесс инактивации сводят к стационарной (steady-state) инактивации.
В этом случае измеряют уменьшение максимальной величины тока, вызванного тестирующими деполяризующими ступеньками, в случае, если перед этим мембранный потенциал определенное время (достаточно продолжительное по сравнению с длительностью инактивации) поддерживался на сниженном уровне. Зависимость этого уменьшения от величины поддерживаемого потенциала носит S-образную форму. При этом для характеристики Ca2+-кана-
лов помимо амплитуды кальциевого тока (ICa) обычно рассматриваются величина активации (Va) и величина инактивации (Vh). Если сущность постоянных времени активации и инактивации Ca2+-каналов достаточно понятна, то величины активации (Va)и инактивации (Vh) требуют пояснения.
Принципы исследования активации и инактивации на примере I Ca,T тока показаны на панелях В, Г, Д, Е, Ж. На панели В представлены тестовые сигналы и steady-state активация ICa,T. Мембрана клетки была на поддерживаемом потенциале - 100 мВ в течение 1 си Ca2+-токи определяли при помощи деполяризующих шагов-ступенек. На панели Г показана активационная кривая, полученная на основании уравнения Больцмана в следующей форме:
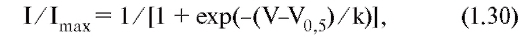
где I представляет собой амплитуду тока, Imax - максимальная амплитуда тока, V- тестовый потенциал, V0,5 - потенциал полуактивации или иначе Va. На панели Д представлены тестовые сигналы и steady-state инактивация ICa,T. Мембрана клетки была на поддерживаемом потенциале в диапазоне от -110 до -45 мВ в течение 1 с и Ca2+-токи определяли при помощи деполяризующих шагов-ступенек до -40 мВ. На панели Е показана инактивационная кривая, полученная на основании уравнения Больцмана в следующей форме:
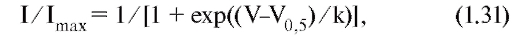
где I представляет собой амплитуду тока, Imax - максимальная амплитуда тока, V - потенциал, V0,5 - потенциал полуинактивации или иначе Vh. И в случае, представленном на панели Г, и в случае, продемонстрированном на панели Е константа к, представляет собой наклон кривой (фактор крутизны) и отражает steady-state потенциал-чувствительность каналов или «диапазон» потенциалов, в котором каналы функциональны. Чем больше к, тем уже диапазон. В части рисунка Ж кривые на панелях Г и Е объединены вместе.
Рис. 1-68. Типичный whole-cell Са2+-ток (ICa-L), зарегистрированный от изолированного кардиомиоцита желудочков мыши, мембрана которого имеет СаV1-каналы.
А - оригинальная регистрация тока при ступенчатом смещении потенциала от поддерживаемого потенциала (holding potential) Vh= -50 мВ. Величина ступенек деполяризации относительно поддерживаемого потенциала представлена в виде цифр -30, -10, 10, 30, 50 мВ. Б - вольтамперная характеристика, полученная на основе оригинальных регистраций от тех же клеток. В-Ж - принципы регистрации и анализа активации и инактивации тока
Са2+-каналы L-типа и N-каналы
На рисунке 1-69 А1 показана оригинальная регистрация тока, текущего через одиночный канал подсемейства CaV1 (тока L-типа) на фоне ступеньки деполяризации, равной +10 мВ от поддерживаемого потенциала, равного -40 мВ. Далее показано (рис. 1-69 А2) распределение амплитуд тока при +10 мВ. Обычно предполагают, что амплитуднаягистограммахорошоописываетсякривой Гаусса, если под пипеткой находится один канал и у него есть только одно открытое состояние, как это продемонстрировано на рис. 1-69 А1. Показана гауссовская кривая (см. рис. 1-69 А2), позволяющая оценить среднюю амплитуду тока (событий) и погрешность аппроксимации (стандартное отклонение), т.е. для данного случая это -1,21±0,02 пА при +20 мВ. По зависимости величин зарегистрированного тока от амплитуд ступенек деполяризации (рис. 1-69 А3) можно определить проводимость одиночного канала, т.е. наклон кривой (или иначе фактор крутизны). Амплитуда тока была-1,41±0,03 и -0,97+0,02 пА при 0 и +20 мВ соответственно, а проводимость одиночного канала в приведенном случае равна 22,0+1,1 pS.
Наконец, дополнительную информацию о механизмах функционирования каналов можно получить из анализа гистограмм распределения времен жизни открытого или закрытого состояния канала (рис. 1-69 А4). Интерпретация последних обычно довольно сложная. Распределение времен жизни открытого состояния канала CaV1 при +10 мВ было аппроксимировано одной экспонентой с τ0 = 5,60 мс (см. рис. 1-69 А4). Среднее времен жизни открытого состояния канала, рассчитанное как среднее арифметическое всех данных, было равно 5,95+0,24 мс.
Далее в качестве примера показаны (рис. 1-69 Б1) оригинальнаярегистрациятокаодиночногоканала CaV2 и распределение амплитуды тока при +20 мВ (рис. 1-69 Б2). Амплитуда тока была -1,09+0,02, -0,89+0,02 и -0,73+0,02 пА при +10, +20 и +30 мВ соответственно, а проводимость одиночного канала равна 18,0+1,1 pS (рис. 1-69 Б3). Распределение времен жизни открытого состояния канала CaV2 при +20 мВ было аппроксимировано одной экспонентой с τ0 = 1,04 мс (рис. 1-69 Б4). Среднее времен жизни открытого состояния канала, рассчитанное как среднее арифметическое всех данных, было равно 1,14+0,02 мс.
Рис. 1-69. Биофизические свойства CaV1-канала и CaV2.2-канала.
А - биофизические свойства CaV1-канала с L-типом Ca2+-тока, зарегистрированного в cell-attached patch у кортикальных астроцитов. А1 - регистрация тока одиночного канала подсемейства CaV1 (тока L-типа) на фоне ступени деполяризации, равной +10 мВ от поддерживаемого потенциала (holding potential) Vhp = -40 мВ. Раствор в patch-пипетке содержал 10 μΜ CTx-MVIIC и 5 μΜ Bay K 8644. А2 - распределение амплитуд тока L-типа при +10 мВ. А3 - наклон кривой - проводимость одиночного канала, рассчитанная по величине зарегистрированного тока L-типа. А4 - гистограмма распределения времен жизни открытого состояния канала подсемейства CaV1 при +10 мВ. (Распределение времен жизни в открытом состоянии) (В пипетку добавлен активатор Bay K 8644 для всех CaV1 каналов, продуцирующих L-тока и CTx-MVIIC). Б - биофизические свойства CaV2.2-канала N-типа Ca2+-каналов кортикальных астроцитов, зарегистрированных в cell-attached patch. Б1 - регистрация тока одиночного канала CaV2.2-канала (тока N-типа) на фоне ступени деполяризации, равной +20 мВ от поддерживаемого потенциала (holding potential) Vhp = -80 мВ. Раствор в patch-пипетке содержал 5 μΜ нифедипина и 100 нМ SNX-482. Б2 - распределение амплитуд тока N-типа при +20 мВ. Б3 - наклон кривой - проводимость одиночного канала, рассчитанная по величине зарегистрированного тока N-типа. Б4 - гистограмма распределения времен жизни открытого состояния канала CaV2.2 при +20 мВ. (Распределение времен жизни в открытом состоянии.)
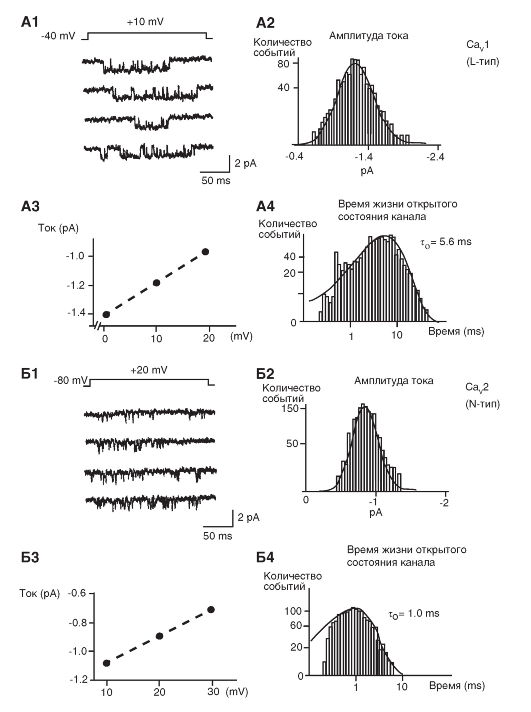
Са2+-каналы R-типа и T-типа
На рисунке 1-70 А1 в качестве примера показана оригинальная регистрация тока одиночного канала CaV2.3 и распределение амплитуды тока при +20 мВ со средней величиной -0,81+0,01 пA (рис. 1-70 А2). Амплитуда тока была -0,92+0,01 и -0,71+0,01 пA при +10 и +30 мВ соответственно, а проводимость одиночного канала равна 10,5+0,3 pS (рис. 1-70 А3). Распределение времен жизни открытого состояния канала CaV2.3 при +10 мВ было аппроксимировано одной экспонен-
той с τ0 = 0,80 мс (рис. 1-70 А4). Среднее времен жизни открытого состояния канала, рассчитанное как среднее арифметическое всех данных, было равно 0,88+0,02 мс.
На рисунке 1-70 Б1 в качестве примера показаны оригинальная регистрация тока одиночного канала CaV3.2, зарегистрированного в cell-attached patch, распределение амплитуд тока (рис. 1-70 Б2), активация (правая кривая) и инактивация (левая кривая) тока (рис. 1-70 Б3), гистограмма распределения времен жизни открытого состояния канала
(рис. 1-70 Б4).
Рис. 1-70. Биофизические свойства Сау2.3-канала и Сау3.2-канала.
А - биофизические свойства CaV2.3-канала с R-типом Ca2+-тока, зарегистрированного в cell-attached patch у кортикальных астроцитов. A1 - регистрация тока одиночного канала CaV2.3 (тока R-типа) на фоне ступени деполяризации, равной +20 мВ от поддерживаемого потенциала (holding potential) Vhp-80 мВ. Раствор в patch-пипетке содержал 5 μΜ нифедипина и 10 μΜ CTx-MVIIC. До регистрации клетки находились в течение 10 мин в растворе Тироде, содержащем 3 μΜ CTx-GVIA и 10 μΜ CTx-MVIIC. А2 - распределение амплитуд тока R-типа при +20 мВ. А3 - наклон кривой - проводимость одиночного канала, рассчитанная по величине зарегистрированного тока R-типа. А4 - гистограмма распределения времен жизни открытого состояния канала CaV2.3 при +10 мВ. (Распределение времени жизни в открытом состоянии.) Б - биофизические свойства канала подсемейства CaV3 на примере канала CaV3.2 с Т-типом Ca^-тока, зарегистрированного в cell-attached patch у HEK 293 клеток. Б1 - регистрация тока одиночного канала CaV3.2 (тока Т-типа) на фоне ступенек деполяризации, величина которых в цифровом виде представлена на картинке, от поддерживаемого потенциала (holding potential) Vhp -90 мВ. Б2 - распределение амплитуд тока Т-типа со средней величиной -0,41+0,01 пА. Б3 - исследования активации (правая кривая) и инактивации (левая кривая) тока через канал CaV3.2. Каждые 2 с от поддерживаемого потенциала величиной -90 мВ подавали деполяризационные ступеньки (для исследования процесса активации канала) или от различных величин поддерживаемого потенциала подавали ступеньку до -10 мВ (для исследования процессов инактивации канала). Б3 - гистограмма распределения времен жизни открытого состояния канала CaV3.2 при -10 мВ. (Распределение времени жизни в открытом состоянии.) Распределение времен жизни открытого состояния канала CaV3.2 при тестовом потенциале -10 мВ было аппроксимировано одной экспонентой с τ0 = 0,48 мс
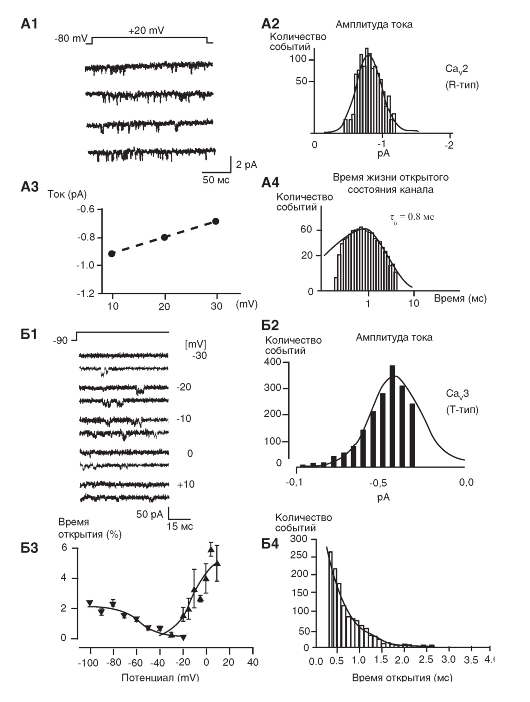
Блокаторы и активаторы Са2+-каналов
Фармакология трех семейств кальциевых каналов хорошо изучена. Каналы СаV1 служат молекулярной мишенью для органических блокаторов Са2+-каналов, широко применяемых в лечении сердечно-сосудистых заболеваний. Как полагают, эти вещества действуют на три отдельных, но аллостерически связанных, рецепторных участка.
Фенилалкиламины представляют собой блокаторы внутриклеточного участка поры. Полагают, что эти вещества входят в пору из цитоплазматических участков канала и осуществляют блокаду. Их рецепторные участки образованы аминокислотными остатками в S6-сегментах в домене III и IV по аналогии с рецепторным участком для анестетиков у Na+-каналов.
Дигидропиридины могут быть активаторами или ингибиторами Са2+-каналов и полагают, что они действуют аллостерически, сдвигая моду функционирования канала в направлении открытого или закрытого состояния, скорее, чем закупоривая пору. Их рецепторный участок включает аминокислотные остатки в S6-сегментах в домене III и IV и S5-сегменте домена III. Места связывания дигидропиридинов и фенилалкиламов связаны и частично перекрываются.
Бензодиазепины, представляющие собой группу синтетических веществ (один из которых дилтиазем), связываются с рецепторным участком,
который перекрывается с местом связывания фенилалкиламинов.
Семья СаV2 Са2+-каналов относительно нечувствительна к дигидропиридиновым блокаторам Са2+-каналов, но эти Са2+-каналы специфически блокируются пептидными токсинами пауков и морских улиток. СаV2.1-каналы блокируются специфически ω-агатоксин IVA яда из паутины паука. СаV2.2-каналы блокируются специфически ω-конотоксином GVIA и сопоставимы с токсинами улиток. СаV2.3-каналы блокируются специфически пептидным токсином SNX-482, выделенным из яда тарантулов. Эти пептидные токсины могут быть потенциальными блокаторами синаптической передачи, потому что их специфические эффекты реализуются через СаV2 семью Са2+-каналов.
Семья СаV,3 Са2+-каналов нечувствительна к обоим дигидропиридинам, блокирующим СаV1-каналы, и токсину паука или токсину конусной улитки, блокирующим СаV2. Специфические блокаторы СаV3-каналов пока не найдены. Органический блокатор Ca2+-каналов мибефрадил в какой то степени специфичен для СаV3 по сравнению с СаV1 Ca2+-токов (в три-пять раз). Пептид куртоксин ингибирует активационные ворота СаV3.1- и СаV3.2-каналов. Развитие более специфических и высокоафинных блокаторов СаV3 семьи Ca2+-каналов должно быть полезным для более детального анализа физиологической роли этих каналов.
Рис. 1-71. Фармакологические соединения, мишенью которых служат Са2+-каналы
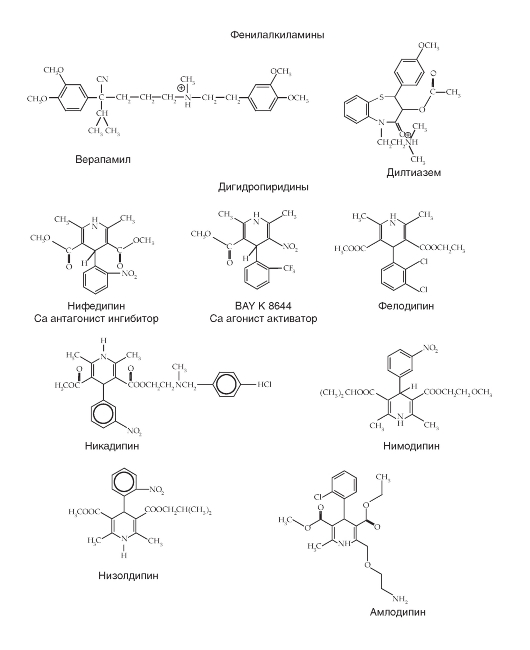
Изменение Са2+-токов под действием Са2+ агонистов и антагонистов
На рисунке 1-72 продемонстрированы примеры действия фармакологических препаратов на типичный whole-cell Ca2+-ток (ICa,L), определяемый наличием CaV1-каналов, зарегистрированный от изолированного вентрикулярного кардиомиоцита мыши. На панели Б представлены контрольная регистрация тока и регистрация после добавления 0,1 μΜ BAY K8644, а на панели В показаны две вольтамперные характеристики клетки: одна получена в стандартном
перфузионном растворе, а другая в том же растворе, но содержащем 0,1 μΜ BAY K8644. На панели Д показаны оригинальные кривые Ca2+-тока при отсутствии и присутствии 0,1 μΜ и 1 μΜ нифедипина, а на панели Е показаны три вольтамперные характеристики клетки: одна получена в стандартном перфузионном растворе, другая в том же растворе, но содержащем 0,1 μΜ нифедипина, а третья - 1 μΜ нифедипина.
Панель Ж демонстрирует регистрацию одиночного Ca2+-канала L-типа в контрольных условиях, а панель З показывает характер изменений того же канала при добавлении 5 μΜ BAY K8644.
Рис. 1-72. Примеры действия фармакологических препаратов на типичный whole-cell Са2+-ток (1Са,L), зарегистрированный от изолированного кардиомиоцита желудочков мыши, мембрана которого имеет СаV1-каналы. На панелях А и Г представлена структура действующих соединений BAY K8644 (А) и нифедипина (Г). На панелях Б и Д показаны оригинальные кривые Са2+-тока при отсутствии и присутствии этих соединений. Показано изменение Са2+-тока после добавления 0,1 μΜ BAY K8644 (Б) или 0,1 и 1 μΜ нифедипина (Д). Деполяризующие импульсы до 0 мВ (Б) или до +20 мВ (Д) были поданы от поддерживаемого потенциала (holding potential) Vhp = -50 мВ. На панелях В и Е показаны соответствующие рисункам Б и Д вольтамперные характеристики вентрикулярных миоцитов мыши при отсутствии и присутствии тестируемых соединений. Наконец, на панели Ж показан пример регистрации L-типа Са2+-канала в контроле, а на панели З при добавлении 5μΜ BAY K8644
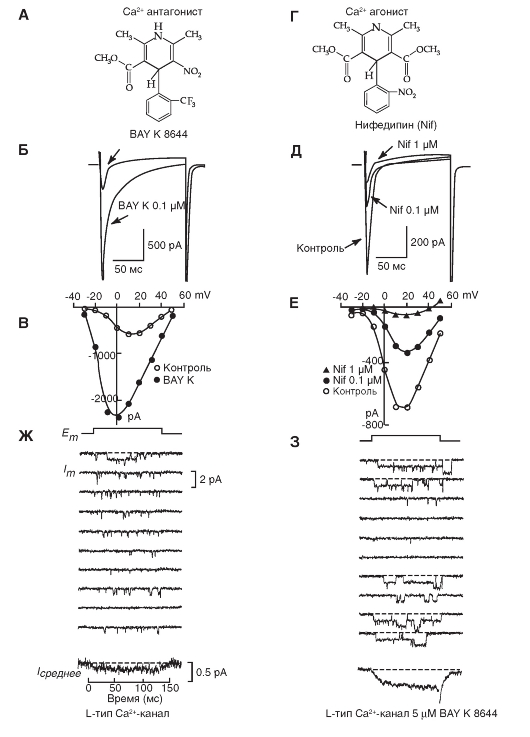
Модель Ca2+-поры
Модели двухмерной топографической карты поры с использованием предполагаемых «холмов» и «ям» химической потенциальной энергии, преодолеваемых ионом при прохождении через канал, объясняли проницаемость канала с позиций теории скоростей реакции. Первоначально с помощью них пытались объяснить проницаемость ионов. «Ямы» - места связывания; «холмы» - энергетические барьеры, препятствующие движению иона между местами связывания или его выходу из поры. На рисунке 1-73 показана модель, созданная на основе «теории скоростей реакции» для объяснения проницаемости Ca2+-канала. Каждая модель начинается с Ca2+-связывающего участка, имеющего константу диссоциации, величина которой измеряется в микромолях. Это соответствует «потенциальной яме» с энергией приблизительно 14 kT (∆G = kT*ln KD, где k - константа Больцмана и T - температура). Стрелка 1 на каждом рисунке обозначает энергетическую разницу, определяющую высокую афинность места связывания. Барьеры на внешней стороне поры должны быть достаточно высоки, чтобы ионы не входили быстрее реальной скорости диффузии. Это требует приблизительно 8 kT. Стрелка 2 показывает значение энергии, определяющей ограничивающую скорость (rate limiting step), т.е. наибольший энергетический барьер, препятствующий выходу иона из каждой модели поры.
Если бы был только один такой участок в поре (рис. 1-73 А1), то ион, проходящий эту пору, должен был бы преодолеть энергетический барьер в 22 kT, что соответствует скорости потока ионов через Са2+-каналы меньше чем 2000 ионов в секунду, т.е. приблизительно в 1000 раз меньше, чем величины регистрируемых пикоамперных токов. Это показывает, что селективность не может быть обеспечена тем, что пора становится «липкой» для специфического иона, потому что в этом случае ион перемещается через пору слишком медленно.
Теория скоростей реакции предлагает два независимых пути для обеспечения высокого потока ионов через «липкую» пору, но оба требуют, чтобы
пора могла удерживать больше одного иона Ca2+ одновременно. На рисунке 1-73 А2 продемонстрирован механизм, используемый двумя идентичными участками высокоафинного связывания. Один ион Ca2+ перебрасывается назад и вперед между ними с небольшим шансом для выхода. Поскольку в такой модели ионы не могут ни перепрыгнуть друг друга, ни войти в занятый участок связывания, один ион Ca2+ преграждает вход ионам другого сорта. Но можно предположить, что, когда два иона Ca2+ находятся в поре, они взаимодействуют, чтобы уменьшить афинность мест связывания для Ca2+. Эти более мелкие «колодцы» (стрелка 2) допускают больший поток ионов. Однако в поре обнаружен так называемый EEEE-локус, и только он может быть высокоафинным участком связывания, что противоречит представлениям о двух идентичных связывающих участках. Наличие EEEE- локуса опровергает детали модели, представленной на данном рисунке, но не ее основной принцип. Предполагается, что существуют еще два боковых низкоафинных участка с каждой стороны. Это привело к созданию модели, представленной далее (рис. 1-73 А3), на которой мелкие «колодцы» тесно примыкают с каждой стороны к одному глубокому «колодцу». В такой модели у ионов нет возможности взаимодействовать, поэтому при мультиионной оккупации поры энергетические колодцы и барьеры не изменяются. Но простое присутствие низко-афинных примыкающих участков означает, что ограничивающий скорость барьер для выхода (стрелка 2) имеет примерно такие же размеры, как в модели, где ионы имеют возможность взаимодействовать. Серия участков с уменьшающейся афинностью ускоряет поток ионов через химические потенциальные энергетические барьеры.
Пора имеет форму песочных часов (рис. 1-73 Б). Диаметр селективного фильтра равен 5,6 А, т.е. почти в 3 раза шире, чем диаметр иона Ca2+, поэтому селективность нельзя объяснить тесным совпадением диаметра иона и диаметра отверстия, что лежит в основе механизма селективности К+-каналов. Важно положение зарядов (квадратики) четырех глутаматов EEEE-локуса.
Рис. 1-73. Модели Са2+-канала, объясняющие его проницаемость и структуру поры.
А - теория скоростей реакции описывает поры, которые тесно связывают ионы Ca2+. Горизонтальная ось: фракция электрического поля через пору. Вертикальная ось: энергия химического потенциала для Ca2+, когда он проходит через пору. Стрелка 1 соответствует энергии, которая определяет Ca2+-блок для ионов другого сорта. Стрелка 2 указывает самый высокий прыжок энергии в каждой модели, который ограничивает скорость выхода иона Ca2+ из поры. Поток очень низок в поре с одним участком, потому что существует высокоэнергетический барьер для выхода (1); мультиионные поры представляют два различных механизма для уменьшения энергетического барьера, лимитирующего скорость потока; (2) взаимодействия иона c ионом (ion interaction) и (3) лестница шагов - «ступени» потенциальной энергии (stairsteps), - созданная низкоафинными участками связывания, и примыкающий селективный участок. Б - поперечный разрез поры. Показаны узкий и короткий селективный фильтр около внешней стороны и широкая область в центре мембраны
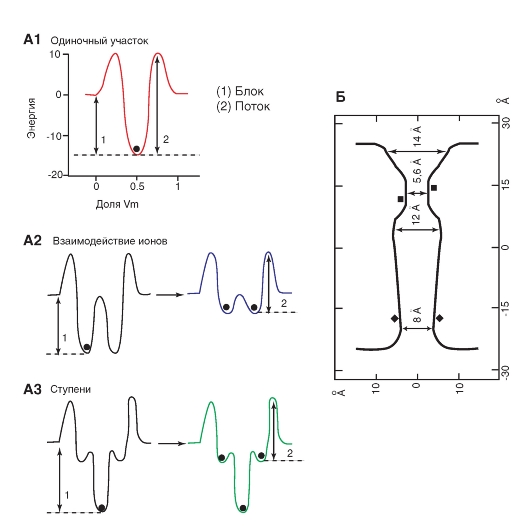
К+-токи и каналы
Калиевые каналы представляют собой наиболее обширное семейство ионных каналов (К+-каналов), генерирующих разнообразные калиевые токи (К+- токи). Эти токи можно регистрировать как от целой клетки методом patch-clamp в конфигурации wholecell (тогда жаргонно эти токи называют макроскопическими) или от одиночного канала, также методом patch-clamp, но в других конфигурациях (тогда их нередко называют микроскопическими токами). К+-токи можно зарегистрировать от клеток, у которых есть преимущественно К+-каналы (рис. 1-74 А). Обычно это экспрессированные в билипидные слои каналы. Можно и на любой клетке заблокировать работу всех каналов, кроме К+-каналов (рис. 1-74 Б). На этих двух рисунках представлены оригинальные кривые whole-cell K+-тока, созданного работой потенциалуправляемых К+-каналов при различных значениях смещаемого потенциала относительно поддерживаемого потенциала.
Обсудим некоторые данные, характеризующие работу абстрактных К+-каналов. На рисунке 1-74 В представлена вольтамперная кривая K+-каналов, рассчитанная при помощи уравнения Гольдмана- Ходжкина-Катца. Сплошная кривая отражает K+- ток, предсказанный на основании уравнения с допущением, что мембрана хорошо проницаема для ионов K+, причем [K+]in равна 155 мМ, а [K+]out равна 4,5 мМ. Величина -95 мВ - потенциал реверсии (reversal potential: Vrev), потому что при этом потенциале направление тока меняет значение, а в самой точке, равной -95 мВ, ток равен нулю. В физике направление тока всегда такое же, как и направление перемещения положительных зарядов. Ток ионов, текущий в клетку, будет, таким образом, называться inward current, а ток ионов, текущий из клетки, - всегда outward. Пунктирная линия демонстрирует ток, который можно ожидать, если [K+]in равна [K+]out и соответствует 155 мМ.
Наконец на рис. 1-74 Г показана регистрация одиночного канала К+-канала.
Традиционно K+-токи и соответственно K+-каналы вследствие их функции были описаны и классифицированы главным образом в возбудимых клетках. Они включали классические:
• K+-каналы задержанного выпрямления (delayed outward rectifier K+-channels (currents) - IK);
• быстрые транзиторные K+-каналы выходящего тока (fast transient K+-channels (currents) - IA, или transient outward current - Ito);
• K+-каналы аномального выпрямления с током входящего направления (inward rectifier K+- channels - IK1);
• Ca2+-активируемые K+-каналы (Ca2+ dependent K+-channels - KCa);
• каналы, через которые проходит ток утечки (leak currents), определяемый преимущественно ионами K+.
Чуть больше десятилетия назад была принята первая стандартная номенклатура для генов шести трансмембранных сегментов потенциалуправляемых K+каналов, названных KV-системой. В нее прежде всего вошли:
• K+-каналы задержанного выпрямления (delayed outward rectifier K+-channels - IK);
• быстрые транзиторные K+-каналы выходящего тока (fast transient K+-channels (currents) - IA, или transient outward current - It0).
Эта номенклатура была основана на выведенных филогенетических связях. Каналы, в составе которых обнаружено более 65% идентичных аминокислотных остатков, были объединены в одно подсемейство. В отдельную группу были выделены K+-каналы аномального выпрямления с током входящего направления (inward rectifier K+-channels), которая была названа Kir.
Таким образом, принятая в настоящее время классификация делит K+-каналы на:
• потенциалуправляемые К+-каналы (KV), которые включают:
- K+-каналы задержанного выпрямления (delayed outward rectifier K+-channels - IK);
- быстрые транзиторные ^-каналы выходящего тока (fast transient K+-channels (currents) - IA, или transient outward current - Ito);
• K+-каналы аномального выпрямления с током входящего направления (inward rectifier K+-channels - Kir);
• Ca2+-активируемые K+-каналы (KCa);
• K+-каналы с двумя петлями в домене (two-P K+-channels - К2Р).
Рис. 1-74. Примеры оригинальной регистрации whole-cell К+-тока, вольтамперной характеристики whole-cell К+-тока и активности одиночного канала
Характеристики К+-токов
Разлагая на компоненты ионные токи можно вычленить входящий Na+-ток и выходящий К+-ток, представив их отдельно. Анализ этих «макроскопических токов», т.е. токов, зарегистрированных методом voltage-clamp или patch-clamp в конфигурации whole-cell, обсуждался ранее. Этот анализ позволяет разделить К+-токи на потенциалуправляемые (включающие К+-токи задержанного выпрямления и быстрые транзиторные К+-токи выходящего направления), К+-токи аномального выпрямления входящего направления, Ca2+-активируемые К+-токи и токи утечки. Но детальную информацию дал анализ одиночных К+-каналов методом patch-clamp. Микроскопические механизмы, то есть механизмы на уровне токов, текущих через одиночные каналы, лежащие в основе макроскопических вольт-амперных характеристик, то есть процессов, происходящих на уровне токов, текущих через целую клетку.
На рис. 1-75 А линия обозначает вольт-амперную зависимость идеализированного открытого калиевого канала. Т.к. мы исходим из начальной предпосылки, что канал в нашем случае будет полностью открыт все время (т.е. что проводимость каналов не будет функцией напряжения) тогда ток, текущий через них, будет линейным или «омическим».
На рис. 1-75 Б представлена кривая, которая показывает вероятность того, что калиевый канал будет находиться в открытом состоянии (вероятность открытия калиевого канала). Уравнение, приведенное во вставке в рисунок, описывает приведенную кривую, если мы вставим значения zK = 5,3 и V0.5 = - 30 mV.
На рис. 1-75 В представлен отдельно макроскопический калиевый ток.
На рис. 1-75 Г представлена оценка макроскопического калиевого тока посредством умножения одноканальных токов из секции А рисунка на вероятность их открытия Ро из секции Б и на количество каналов (N). В данном случае мы устанавливаем количества каналов в 100 калиевых.
Рис. 1-75. Общая характеристика потенциалуправляемых K+-каналов иK+-токов. Описание в тексте
К+-каналы задержанного выпрямления
Обсудим некоторые данные, характеризующие работу первого типа потенциалуправляемых К+-каналов - К+-каналов задержанного выпрямления (delayed outward rectifier K+-channels - IK). Этот тип каналов отличается тем, что деполяризующие ступеньки активируют ток, но с задержкой, как это видно на рис. 1-76 А. Вольтамперная кривая, полученная на основе экспериментов, выполненных методом patch-clamp в конфигурации whole-cell, однозначно демонстрирует наличие К+-каналов задержанного выпрямления (delayed outward rectifier K+-channels - IK). Ток течет только в выходящем направлении, как это показано на рис. 1-76 Б. Для оценки тока, текущего через каналы этого типа из клеток мозга млекопитающих, различные каналы (KV1.1,
KV1.2, KV1.3 и KV1.4) экспрессировали в ооциты ксенопуса. Результаты экспериментов, в которых потенциал смещался от -80 мВ до 0 мВ, показаны на рис. 1-76 В. Левая панель, представленная с большой степенью разрешения времени, демонстрирует, что некоторые из этих каналов активировались более медленно, чем другие. Правая панель, ужатая во времени, позволяет увидеть, что инактивация ускорялась от канала KV1.1 к каналу KV1.4.
Транзиторные К+-каналы
Данные, характеризующие работу второго типа К+-каналов, - быстрых транзиторных K+-каналов выходящего тока (fast transient K+-channels (currents) - IA, или transient outward current - It0) представлены на рис. 1-76 Г. Показаны результаты экспериментов, позволяющие построить кривую активации этого тока и его инактивации.
Рис. 1-76. Потенциалуправляемые К+-каналы (KV), относящиеся к типу К+-каналов задержанного выпрямления (delayed outward rectifier К"-channels - IK) и к типу быстрых транзиторных К+-каналов выходящего тока fast transient К+-channels currents - IA, или transient outward current - Ito
Кir-каналы
Класс трансмембранных белков с двумя сегментами включает 2S белки, образующие inward rectifiers channels (Kir), которые можно назвать «K+-каналами аномального выпрямления с током входящего направления». Терминали N- и C- этих каналов расположены в цитоплазме, P-петля между двумя трансмембранными сегментами формирует пору, и функционирующий
канал представляет собой тетрамер этих 2S/1P субъединиц (рис. 1-77 А). Вольтамперные характеристики при различных величинах [K+]0, характерные для этого типа каналов, представлены на рис. 1-77 Б. Там же показано значение ЕК для каждой величины [K+]o. На рисунке 1-77 В изображена зависимость открытия каналов от потенциала, а на рис. 1-77 Г представлена вольтамперная характеристика этого типа каналов.
Рис. 1-77. К+-каналы аномального выпрямления с током входящего направления (inward rectifier K+-chnnels - Kir)
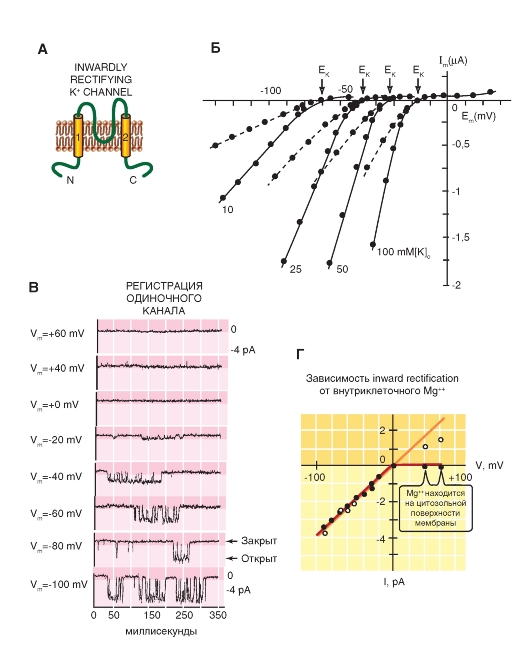
Са2+-активируемые К+-каналы
Еще один тип К+-каналов - так называемые Са2+-активируемые К+-каналы. Примером такого канала может служить, например, канал (Slo
или Slo1). Slo имеет 7S и кодирует высокопроводящий канал, Slo (0S-6S). В этом канале Р-область находится между SVI и SVII; функционирующий канал представляет собой тетрамер, но, в отличие от других каналов, Slo имеет N-терминаль, расположенную во внеклеточной среде (рис. 1-78 А).
Са2+-активируемые К+-каналы описаны достаточно давно и включают два подтипа. Одна из этих групп включает три KCa-канала с низкой проводимостью (KCa2.1, KCa2.2, и KCa2.3) и канал KCa3.1 с промежуточной проводимостью. Эти каналы непотенциалуправляемые и активируются низкими концентрациями внутриклеточного Ca2+ (<1,0 μΜ), в отличие от KCa1.1 (KCNMA1, Slo1), который активируется и потенциалом, и внутриклеточным Ca2+. Эти три KCa-канала с низкой проводимостью чувствительны к блокирующему действию апамина (100 пМ-10 нМ), что отличает их от всех других KCa-каналов. И KCa-каналы с низкой проводимостью, и каналы с промежуточной проводимостью играют важную роль во многих процессах, включающих Са2+-зависимый сигналлинг в электровозбудимых и электроневозбудимых клетках. Они не связывают свободные ионы Ca2+ непосредственно, а скорее, обнаруживают Ca2+ через кальмодулин, который постоянно связан с C-терминальным регионом. Связывание кальция с таким кальмодулином приводит к конформационным изменениям, ответственным за воротный механизм канала.
Вторая группа KCa-каналов включает KCа1.1 (Slo или Slo1), KCa4.1 (Slack или Slo2.2), KCa4.2 (Slick или Slo2.1) и KCa5.1 (Slo3). Каналы KCa1.1 изучали
в клетках мозга, улитки и мышцах, и известно, что варианты альтернативного сплайсинга их мРНК ответственны за их значительные функциональные различия. В отличие от KCa2 и каналов, связывание ионов Са2+ каналом KCа1.1 не зависит от его ассоциации с кальмодулином, но полагают, что определяется, по крайней мере, тремя связывающими двухвалентные катионы участками в цитоплазматической карбоксильной области каждой субъединицы канала. Два независимых высоко чувствительных Ca2+-связывающих участка, названных «calcium bowl», сформированы отрицательно заряженными сегментами в дистальной карбоксильной терминали белка и внутри первой RCK области (RCK: Regulator of Conductance for K+), кодирующей проксимальную C-терминаль белка. Третий низкоафинный связывающий двухвалентные катионы участок также найден в первой RCK области.
Хотя три других члена этой группы, KCa4.1, 4.2, и 5.2, были включены в KCa-спецификацию, так как все они являются членами этой структурно связанной группы генов, но в отличие от KCa1.1 активирующихся внутриклеточным Ca2+, ни один из вышеупомянутых каналов, повидимому, не может быть им активирован. Эти три нечувствительные к внутриклеточному Ca2+ канала активируются иначе. KCa4.2 и KCa4.1 активируются внутриклеточными ионами Na+ и Cl-, а KCa5.1 - внутриклеточным защелачиванием (сдвигом рН в щелочную сторону).
На рисунке 1-78 Б показаны токи через одиночные Са2+-активируемые К+-каналы, Вероятность открытия каналов значительно повышается с увеличением концентрации Са2+. На рис. 1-78 В показана зависимость вероятности открытия канала от потенциала на фоне различной концентрации Са2+.
Рис. 1-78. Са2+-активируемые K+-каналы (KCa)
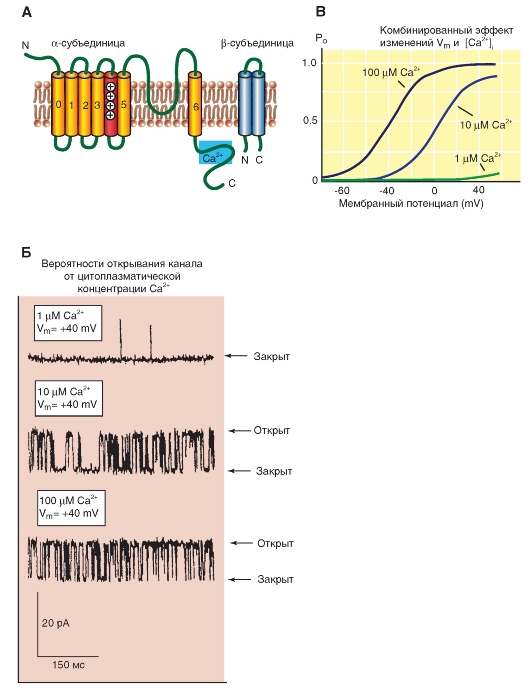
Канал утечки - K2P
Каналы утечки представляют собой особую группу ионных каналов. Это одни из немногих каналов, о которых около 50 лет, т.е. со времени возникновения представлений о них, было мало что известно. Они имеют потенциалнезависимую основу и калиево-натриевую проводимость. В работах Б. Хилле (B. Hille) отмечено, что уже А. Ходжкин и А. Хаксли на фоне потенциала покоя демонстрировали небольшой компонент тока, приписываемый ими так называемому току утечки Il (leak current). Этот ток был небольшим и имел потенциалнезависимый механизм ионной проводимости. А. Ходжкин и А. Хаксли не установили ионную основу тока утечки. Было только показано, что на фоне потенциала покоя мембрана клетки относительно проницаема для ионов калия, выходящих из клетки, и крайне плохо (в 100 раз меньше) проницаема для ионов натрия, входящих в клетку. Эту проницаемость традиционно считали потенциалнезависимой и нечувствительной к ТЕА утечкой. Ток утечки, активный в покое, стабилизирует мембранный потенциал ниже порога генерации потенциалов действия и ускоряет реполяризацию. Еще А. Ходжкин и А. Хаксли назвали эту структуру каналом утечки. С такими каналами связывают формирование потенциала покоя. Белковая структура, через которую осуществляется ток утечки, определена лишь несколько лет назад. Идентификация каналов, через которые осуществляется ток утечки, выявила, что это K+-каналы с двумя пороформирующими петлями в каждой субъединице и
четырьмя трансмембранными сегментами, как это показано на рис. 1-79 А. Две таких субъединицы формируют канал, названный K2P. Это K+-елективный канал с определенными параметрами проводимости, т.е. с потенциалнезависимым воротным механизмом, и предсказанным 50 лет назад выпрямлением. При физиологических условиях (высокая концентрация ионов K+ внутри и низкая снаружи) K2P проводит более значительный ток из клетки, чем внутрь клетки. Наблюдается поток ионов, направленный в большей степени наружу, чем внутрь клетки. Как ожидалось, для регуляторов возбудимости K2P-каналы находятся под сильным контролем множества химических и физических стимулов, включая напряжение кислорода в среде pH, липиды, механические растяжения, нейротрансмиттеры и рецепторы, связанные с G-белком. Каналы также служат молекулярными мишенями для некоторых летучих и местных анестетиков. Регуляция K2P-каналов связана с изменениями в их свойствах, например вероятности открытия каналов. Тем не менее некоторые регуляторные изменения, например фосфорилирование K2P, обеспечивают появление выпрямляющих свойств с чувствительностью к потенциалу.
На рисунке 1-79 Б представлена классификация K2P-каналов, причем часть из них, отмеченная на рисунке, проявляет механосенситивность. Наконец, на рис. 1-79 В показаны типичные вольтамперные характеристики, имеющие выпрямление. На нем представлено изменение вольтамперных характеристик в зависимости от величины рН для канала TASK-1, принадлежащего семье K2P-каналов.
Рис. 1-79. К+-каналы с двумя петлями в домене (two-P K+-channels - К2Р)
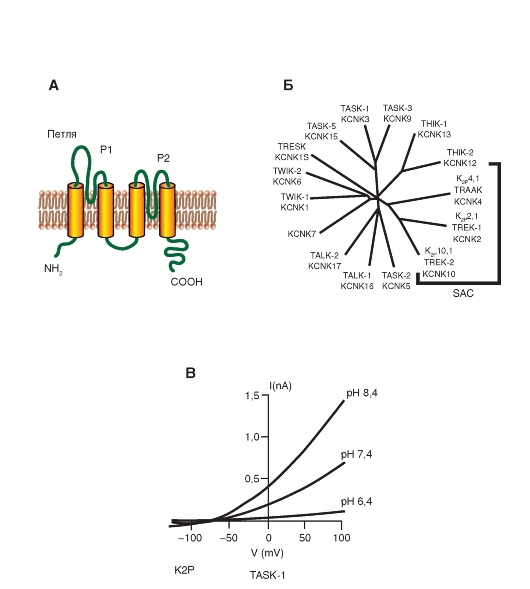
Потенциалы действия и токи, их формирующие
Рис. 1-80. Связь одиночного потенциала действия с основными ионными токами у разных клеток.
А - связь одиночного потенциала действия (А1) нервной клетки с ионными токами (А2). А1 - потенциал действия. Прямыми линиями помечены равновесный натриевый и калиевый потенциалы. А2 - две компоненты ионных токов, показанные через проводимость: входящий Na+-ток, осуществляемый через потенциалуправляемые Na+-каналы, и выходящий К+-ток, осуществляемый через потенциалуправляемые К+-каналы. На уровне критического потенциала наблюдается активация входящего Na+-тока, который инактивируется, когда мембранный потенциал достигнет положительных значений. Инактивация входящего Na+-тока происходит одновременно с активацией выходящего К+-тока. После достижения мембранного потенциала уровня потенциала покоя выходящий К+-ток инактивируется. Б - связь потенциала действия и самопроизвольного смещения мембранного потенциала до уровня критического потенциала с некоторыми ионными токами у нервной клетки с самопроизвольной ритмической активностью. Б1 - потенциал действия клетки с регулярной ритмической активностью. Б2 - компоненты ионных токов, формирующих этот потенциал действия. Показаны входящий Na+-ток (INa), создающий фазу деполяризации потенциала действия, выходящий К+-ток (IK), формирующий фазу реполяризации потенциала действия и быстрый временный выходящий К+-ток (Ito). Потенциал мембраны такой клетки определяется активностью 6 токов, которые были обнаружены у клеток с ритмической активностью. Во-первых, это, разумеется, ток, генерируемый электрогенным Na+, К+-насосом мембраны, и выходящий К+-ток утечки, создающие мембранный потенциал покоя. Кроме того, это входящий Na+-ток (или в отдельных случаях входящий - Са2+-ток), формирующий фазу деполяризации потенциала действия, и так называемый выходящий К+-ток (IK), формирующий фазу реполяризации потенциала действия. Наконец, это два типа ионных токов, смещающих мембранный потенциал до уровня критического потенциала в период между потенциалами действия. Первый тип - это сильный входящий Na+-ток, текущий по другим каналам, нежели вышеописанные и формирующие фазу деполяризации потенциала действия. Именно этот ионный ток смещает мембранный потенциал в сторону деполяризации к критическому потенциалу. К другому типу относится быстрый транзиторный выходящий К+-ток (fast transient K+-current - IA, или transient outward current - Ito), инактивация которого устраняется следовой гиперполяризацией и который активируется в промежутке между двумя потенциалами действия в подпороговой области мембранного потенциала. Кроме этих шести описанных ионных токов существуют еще два: медленный Na+-ток и медленный К+-ток. Эти медленные токи приводят к самоподдерживающимся осцилляциям мембранного потенциала, лежащим в основе периодических пачечных разрядов нейронов. В - связь потенциала действия клетки рабочего миокарда с ионными токами. В1 - форма потенциала действия рабочего кардиомиоцита. В2 - изменение во времени проводимости для деполяризующих (верхняя панель) или реполяризующих (нижняя панель) ионных токов во время потенциалов действия. Нарастание потенциала действия возникает, когда стимул выше порогового быстро деполяризует мембрану, активируя быстрые Na+-каналы, поэтому фаза быстрой деполяризации связана с входом Na+ в кардиомиоцит за счет резкого увеличения gNa. Входящий Na+-ток, осуществляемый через потенциалуправляемые Na+-каналы, не только очень быстро активируется, но и также быстро инактивируется. Инактивация Na+-каналов потенциалзависимая и происходит при достижении фазы деполяризации, достигает значений +25-30 мВ. Такая кинетика входящего Na+-тока определяет практически вертикальную форму фазы деполяризации потенциала действия. Фаза ранней или частичной реполяризации происходит за счет выхода K+ через ионные каналы мембраны, проводящие транзиторный выходящий ток (Ito). В результате такого транзиторного выхода положительно заряженных ионов клетка на короткое время частично реполяризуется. Эта частичная реполяризация активирует входящий Са2+-ток, и у потенциала действия начинается фаза плато. Г - связь потенциала действия узловой клетки сердца с ионными токами. В основе спонтанных изменений мембранного потенциала (Г1) в синоатриальном узле лежат три тока (Г2): неселективный входящий ток (If), который переносится катионами и не блокируется ТТХ, медленный входящий Са2+-ток (ICa) и выходящий К+-ток (IK)
Механосенситивные потенциалы
На рисунке 1-81 А показана непрерывная регистрация биоэлектрической активности изолированного кардиомиоцита левого желудочка мыши в условиях его растяжения на 6 и 8 μm, полученная методом patch-clamp в конфигурации whole-cell. Показано изменение потенциала покоя и потенциала действия клетки при ее дискретном растяжении. Кроме того, возникают экстра-потенциалы действия.
В нормальном растворе Тироде с использованием patch-clamp в конфигурации whole-cell изолированные кардиомиоциты здорового желудочка морской свинки отвечают на растяжение изменением величины потенциала покоя и длительности потенциала действия. Показано, что растяжение на 2 и 4 μm не меняет величину потенциала покоя и форму потенциала действия кардиомиоцитов. Растяжение на 6 μm деполяризует покоящуюся мембрану в среднем на 3 мВ (рис. 1-81 Б1), а растяжение на 8 μm деполяризует в среднем на 6 mV (рис. 1-81 Б2). Растяжение на 8 μм удлиняют средние значения APD90 (Action potential duration - длительность амплитуды потенциала действия на уровне 90% фазы реполяризации) от 360 до 502 мс. Кроме того, растяжение на 8 μm и далее на 10 μm запускает экстрапотенциалы действия, начинающиеся от диастолической деполяризации.
Далее представлена (рис. 1-81 В) динамика развития одного экстрапотенциала действия в правом предсердии крысы, перенесшей инфаркт миокарда, при увеличении степени растяжения
(1-5)препарата. Второй потенциал возникает при достижении SID (stretch-induced depolarization - механоиндуцированная деполяризация) критического уровня деполяризации (Ec = -66,6 мВ).
Механоиндуцированные экстрасистолы и фибрилляция связаны с развитием SID, которая появляется на уровне APD90. Показано, что растяжение ткани прямо вызывает аритмию. SID, возникающая на уровне APD90, соответствует поздней фазе реполяризации, когда инактивация потенциалуправляемых Na+-каналов уже исчезла. Относительно большие различия между мембранным потенциалом, принадлежащим APD90, и равновесным потенциалом для механосенситивных токов, могут способствовать генерации развития эффективной движущей силы для токов, входящих через МСК и соответственно способствовать развитию SID. SID на уровне APD90 может деполяризовать мембрану до порога вследствие активации быстрых Na+-токов и приводить к генерации дополнительных потенциалов действия. Снятие растяжения ткани полностью устраняло эти механоиндуцированные изменения потенциала действия.
На рисунке 1-81 Д также представлена динамика развития одного экстрапотенциала действия кардиомиоцита правого предсердия крысы, перенесшей инфаркт миокарда, при увеличении степени растяжения (1-5) препарата. Второй потенциал возникает после окончания периода абсолютной рефрактерности клетки при достижении в этот период SID критического уровня деполяризации (Ec = -67,7 мВ).
Рис. 1-81. Индуцированные механическим растяжением клетки потенциалы кардиомиоцитов.
А - влияние растяжения изолированного кардиомиоцита левого желудочка мыши на потенциал покоя и потенциал действия в условиях его растяжения. Запись получена методом patch-clamp в конфигурации whole-cell. Символ « » маркирует моменты увеличения растяжения клетки (на 6 μm и 8 μm), а символ « » - моменты возвращения к исходному растяжению. AP - потенциал действия, Em - потенциал покоя. Б - механоиндуцированная деполяризация мембраны изолированного кардиомиоцита, удлинение потенциала действия и возникновение экстрапотенциалов действия, зарегистрированные методом patch-clamp в конфигурации whole-cell. Б - кардиомиоцит правого желудочка морской свинки, растянутый на 6 μm. Показано изменение величины потенциала покоя и формы AP (красная кривая). B - кардиомиоцит правого желудочка морской свинки, растянутый на 8 μm. Продемонстрировано изменение величины потенциала покоя, формы AP и возникновение экстра-AP (красная кривая). Г - динамика преобразования механоиндуцированной деполяризации на уровне APD90 в потенциал действия (АР) при различных степенях (1-5) растяжения препарата. Ec - критический уровень деполяризации. Д - динамика появления механоиндуцированной деполяризации на уровне APD90 (Action potential duration - длительность потенциала действия на уровне 90% фазы реполяризации) и его роль в формировании потенциала действия (АР) при различных степенях (1-4) растяжения препарата. Ec - критический уровень деполяризации
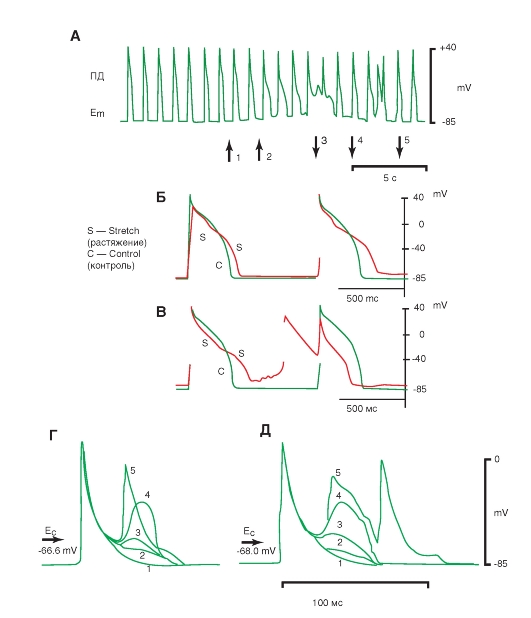
Механосенситивные токи
На рисунке 1-82 А показаны оригинальные кривые, полученные методом patch-clamp в конфигурации whole-cell на кардиомиоците желудочка до его растяжения (фиолетовая кривая) и после его растяжения (красная кривая). Из рисунка следует, что растяжение кардиомиоцита приводит к смещению в негативную область тока, возникающего при поддерживаемом потенциале. Это свидетельствует о наличии входящего тока через
МСК.
Далее (рис. 1-82 Б) представлен типичный пример изменения вольт-амперной кривой кардиомиоцита человека до растяжения (фиолетовые треугольники, объединенные кривой) и при его растяжении (красные треугольники, объединенные кривой). Смещение кривой в области отрицательных потенциалов свидетельствует о наличии входящего ионного тока через МСК.
На рис. 1-82 В показаны SAC клеток сердца, которые активируют его приложением давления в patch-пипетку, находящуюся в конфигурации cell-attached.
Рис. 1-82. Механосенситивные токи и каналы.
А - оригинальные кривые, полученные методом patch-clamp в конфигурации whole-cell на кардиомиоците левого желудочка морской свинки до (фиолетовая кривая) и после его растяжения (красная кривая). Смещение тока при поддерживаемом потенциале показано стрелкой. На рисунке показан L-тип Са2+-тока и поздний ток (IL), причем компонент К+-тока в позднем токе подавлен ионами Cs. Na+-ток подавлен поддерживаемым на уровне -45 мВ потенциалом. Мембранный потенциал смещался от поддерживаемого потенциала (-45 мВ) до 0 мВ. Б - активация неселективного катионного тока при растяжении на 4 μм кардиомиоцита левого желудочка человека в условиях подавленного ионами Cs калиевого тока. I-V кривые поздних токов, измеренных в конце 140 мс импульса (IL отмечены треугольниками), и I-V кривые, характеризующие работу L-типа Ca2+-каналов (ICa-L отмечены кружочками). I-V кривые мембранных токов до растяжения - фиолетовые кривые, а на фоне растяжения клетки на 4 μм - красные кривые. В - активируемые растяжением stretch-activated channels (SAC) клеток сердца. SAC активировался во время приложения негативного давления в patch-пипетку
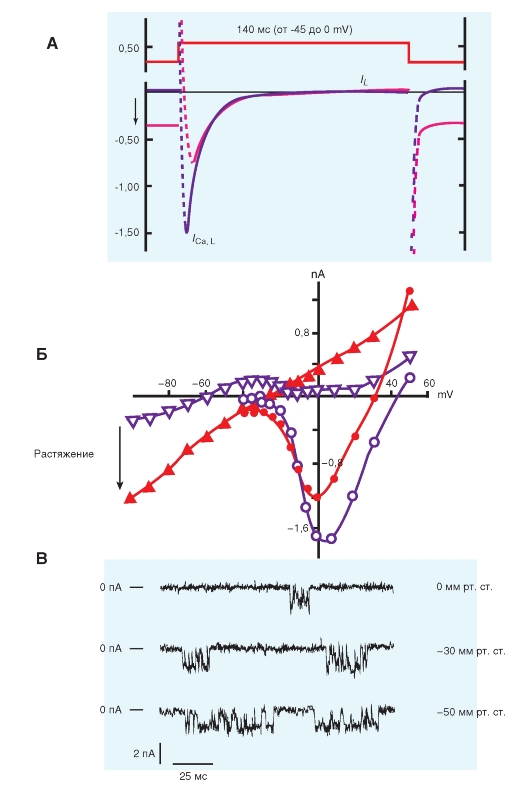
Миелинизированное волокно
Для понимания механизмов проведения по нервным волокнам возбуждения необходимо учитывать как электрические, так и морфологические особенности аксонов нервных клеток. Несмотря на все разнообразие нервных волокон, их можно разделить на два класса: немиелинизированные и миелинизированные волокна. Мембрана немиелинизированного нервного волокна напрямую контактирует с внешней средой, таким образом, обмен ионами между внутри- и внеклеточной средами (ионные токи через плазматическую мембрану) может происходить в любой точке немиелинизированного нервного волокна. В случае же миелинизированных нервных волокон большая часть мембраны аксона покрыта жировой оболочкой как изолятором, и лишь сравнительно небольшие участки мембраны, названные перехватами Ранвье, свободны от миелина. Миелинизированное нервное волокно контактирует с внешней средой только в области перехватов Ранвье.
Миелинизация нервного волокна играет огромную роль в нервной системе, а нарушение миелиновой оболочки приводит к фатальным патологическим процессам, механизм которых до настоящего времени подвергается интенсивному изучению, поэтому мы рассмотрим подробно миелиновую оболочку и ее формирование.
На рисунке 1.83 А представлен фрагмент миелинизированного аксона и выделен перехват Ранвье. Миелиновая оболочка создается в результате того, что шванновская клетка (или иначе миелоцит) многократно обертывает
аксон. При этом образуются слипающиеся слои и тем самым формируется миелиновая оболочка. Далее представлены структуры шванновской клетки (рис. 1-83 Б).
Миелин в периферической нервной системе конструируется другими уникальными протеинами мембраны. Миелин, окружающий каждый миелинизированный аксон, формируется из многих глиальных клеток. Каждый регион миелина формируется одиночной глиальной клеткой и отделен от следующего региона немиелинизированным участком, названным перехватом Ранвье. Только в этом участке аксональная мембрана напрямую контактирует с экстрацеллюлярной жидкостью
(рис. 1-83 В).
Миелиновая оболочка может быть достаточно толстой и состоять из 50-100 мембран, играющих роль электрического изолятора аксона, т.е. предотвращающего перенос ионов между цитозолем аксона и экстрацеллюлярной жидкостью. Как следствие электрическая активность в аксоне ограничена только зоной мембраны перехвата Ранвье, именно того места, где ионы могут проходить через мембрану. Этот участок мембраны имеет большую плотность потенциалуправляемых Na+-каналов, около 10 000 на 1 μм2 аксональной плазматической мембраны, тогда как участки аксональной мембраны между перехватами Ранвье имеют очень незначительное количество ионных каналов.
Суммарный диаметр аксона, покрытого миелиновой оболочкой, обычно составляет около 20 μм. Длина перехвата Ранвье достигает 2 μм, а миелинизированный промежуток между двумя перехватами Ранвье составляет около 2000 μм.
Рис. 1-83. Схема строения миелинизированного нервного волокна (А), шванновской клетки (Б) и структура перехвата Ранвье (В)
Шванновская клетка
Миелин представляет собой упаковку листков специфических плазматических мембран, продуцируемых глиальными клетками, которые обертываются вокруг себя и аксона (в определенном смысле в виде архимедовой спирали), что и показано на рисунке. В периферической нервной системе глиальные клетки называются шванновскими клетками.
На рисунке 1-84 А показано, как в процессе развития нервной системы большая шванновская клетка обертывает аксон нейрона. Дальнейший рост мембраны шванновской клетки вместе с ее вращением вокруг аксона образует слоистую спираль с двойной плазматической мембраной вокруг аксона. Таким образом, миелин представляет собой слой относительно богатых фосфолипидами плазматических мембран шванновской клетки. Далее (рис. 1-84 Б) показаны схема аксона, окруженного шванновской
клеткой, и профиль слоев мембраны, образующий миелин.
Часто несколько аксонов окружены глиальной клеткой (рис. 1-84 В). Как у позвоночных, так и у некоторых беспозвоночных животных глиальные клетки сопровождают аксоны по всей длине. Но специализация этих глиальных клеток в форме миелина преобладающе встречается у позвоночных. Глиальные клетки позвоночных, позднее формирующие миелин, имеют на своей поверхности миелинассоциированный гликопротеин и другие протеины, связывающиеся с соседними аксонами и вызывающими формирование миелина. Миелиновая мембрана, подобно всем мембранам, содержит бислой фосфолипидов, но миелин содержит только несколько типов протеинов. Основной протеин миелина и протеолипид обнаружили только в миелине в центральной нервной системе, и их наличие позволяет плазматическим мембранам плотно упаковываться вместе.
Рис. 1-84. Рост мембраны шванновской клетки и формирование миелиновой оболочки аксона.
А - рост мембраны шванновской клетки вместе с ее вращением вокруг аксона нерва. Б - профиль слоев мембраны, образующий миелин. В - формирование миелиновой оболочки аксона. Посредством вращательного движения вокруг близлежащих аксонов и вокруг себя мембрана одного олигодендроцита окружает несколько аксонов и, таким образом, формирует их миелиновую оболочку. Г - молекулярная структура упаковки миелина. Д - каждая молекула протеолипида (276 аминокислотных остатков) имеет две мембранных α-спирали, каждая из которых содержит около 30 аминокислотных остатков. Через них осуществляется протеолипид-протеолипид взаимодействия
Распространение по аксону пассивного электротонического потенциала
Пассивный электротонический потенциал распространяется по нервному волокну на небольшие расстояния, причем его амплитуда, скорость нарастания и падения с расстоянием уменьшаются, т.е. распространение происходит с затуханием. На рисунке 1-85 А представлена схема немиелинизированного волокна, которая для удобства обсуждения механизма распространения пассивного электротонического потенциала разбита на фрагменты, каждый из которых включает один потенциалуправляемый Na+-канал (показан розовым цветом), находящийся в состоянии покоя, один потенциалуправляемый К+-канал (показан желтым цветом), находящийся в состоянии инактивации, и один канал утечки (показан коричневым цветом), через который осуществляется выход ионов К+ во внешнюю среду.
Сопротивление аксоплазмы (rin) и наружной среды (rout) очень мало, и ими можно в определенном смысле пренебречь. Обычно рассматривают лишь один элемент мембраны, включающий ее емкость (Сm) и сопротивление (Rm), но надо помнить, что мембрана аксона состоит из огромного количества подобных элементов, связанных между собой и образующих непрерывный кабель (см. рис. 1-85 Б). Можно заметить, что реально каждый такой элемент имеет, помимо емкости мембраны (Сm), сопротивление потенциалуправляемого Na+-канала (RNa), натриевую батарею (VNa), сопротивление потенциалуправляемого К+-канала (RК), калиевую батарею (VK), сопротивление канала утечки - К2Р-канала (Rl), батарею канала утечки (Vl). Однако в покоящемся аксоне большинством этих элементов можно пренебречь, оставив лишь емкость мембраны (Сm) и сопротивление мембраны (Rm), которые будут определяться прежде всего сопротивлением открытых каналов утечки (Rl), как наиболее меньшим. Сопротивление канала утечки (Rl) можно оставить для демонстрации движения ионов по круговым локальным токам через эти каналы в невозбужденных участках мембраны аксона.
Аксоплазма и наружная среда клетки, будучи электролитами, оказываются хорошими проводниками. В покоящемся аксоне они становятся эквипотенциальными, т.е. разность потенциалов на мембране будет одинакова во всех фрагментах (точках) волокна (например, -65 мВ). Если в зону (точку 0) аксона ввести микроэлектрод и изменить разность потенциалов на мембране в этой зоне (рис. 1-85 В), тогда соседние зоны (1) и более удаленные зоны (2, 3, 4 и так далее) окажутся неэквипотенциальными, и между ними потечет ток. Этот ток станет уменьшать возникшую разность потенциалов и одновременно менять потенциал в соседних и близлежащих областях. Влияние тока будет уменьшаться по мере удаления от зоны (0).
Поскольку внутриклеточная среда служит проводником, входящий в зону 0 небольшой ток (смещающий потенциал покоя от -65 до -55 мВ, т.е. в подпороговой области) распространяется в обе стороны от этого участка. Так как мембрана нервного волокна не идеальный изолятор, распространяющиеся токи начнут покидать волокно через единственно открытые каналы утечки, т.е. возникнут выходящие токи. Если этот локальный, входящий в данном случае через микроэлектрод, ток подпороговый, он вызывает возникновение пассивного электротонического потенциала и распространяется с затуханием. Линии на рис. 1-85 В показывают части локальных кругов тока, текущего между слегка деполяризованной и недеполяризованной областями внутри и снаружи аксона и через зоны мембраны, находящиеся в покое (зоны 1), а также на большем удалении (зоны 2, 3, 4 и т.д.). Как будут замыкаться эти линии? Поскольку внешняя среда соединена так или иначе с минусом входа усилителя, то локальные круги тока замкнутся через электронно-измерительную схему на микроэлектроде.
Изменения мембранного потенциала (рис. 1-85 Г) измеряются регистрирующими электродами у основания аксона (V1) и в различных точках вдоль него (V2, V3, V4, V5, V6), а график этих изменений представлен на рис. 1-85 Д.
Рис. 1-85. Распространение пассивного электротонического потенциала на примере немиелинизированного волокна.
А - аксон в состоянии покоя. Потенциалуправляемые ^+-каналы (показаны розовым цветом) находятся в состоянии покоя, потенциалуправляемые К+-каналы (показаны желтым цветом) находятся в состоянии инактивации, работают только каналы утечки (показаны коричневым цветом), через которые осуществляется выход ионов К+ во внешнюю среду. Б -аксон представляет собой цилиндр («электрический кабель»), который заполнен электролитом. Электрические свойства аксона можно моделировать, используя радиоэлектронные элементы: Rm - сопротивление мембраны, Cm - емкость мембраны, rin - сопротивление цитоплазмы, rout - сопротивление жидкости внешней среды. Мембрана немиелинизированного нервного волокна напрямую контактирует с внешней средой, и таким образом в покое обмен ионами между внутри- и внеклеточной средами (ионные токи через плазматическую мембрану, прежде всего по каналам утечки) может происходить в любой точке немиелинизированного нервного волокна. В - через стимулирующий электрод подается подпороговый импульс электрического тока, который распространяется электротонически по аксону. Г - изменения мембранного потенциала измеряются регистрирующими электродами у основания аксона (V1) и в различных точках вдоль него (V2, V3, V4, V5, V6). В аксоне ток вызывает деполяризацию величиной 10 мВ и сдвигает мембранный потенциал с -65 до -55 мВ (V1). На расстоянии 1 см (V2) это изменение потенциала уменьшается на 63%, достигая 37% своего исходного значения (3,7 мВ). Это расстояние (1 см) называют постоянной длины мембраны аксона. Д - график изменения пассивного электротонического потенциала в зависимости от длины аксона
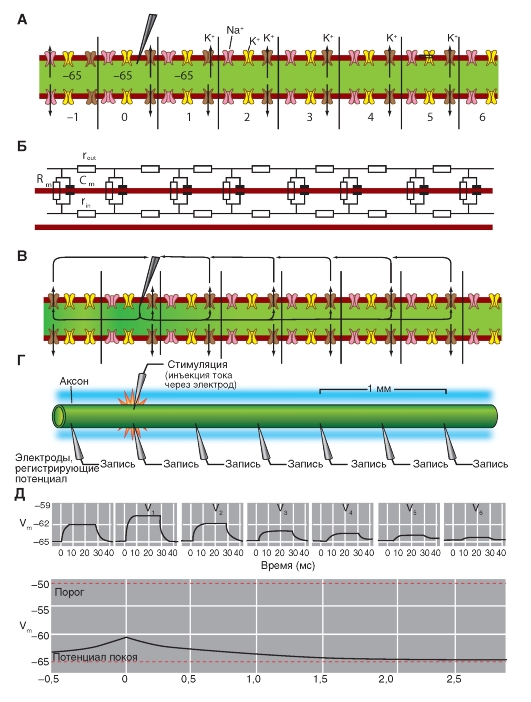
Распространение потенциала действия
Распространение возбуждения в форме потенциала действия принципиально отличается от распространения пассивного электротонического потенциала. Ни амплитуда, ни форма потенциала действия при его распространении по нервному волокну не меняются. Это обусловлено тем, что при пороговой деполяризации активируются потенциалуправляемые ионные каналы, чего не происходит при распространении пассивного электротонического потенциала. Благодаря специфическим свойствам каналов утечки и Na+ и К+ потенциалуправляемых каналов форма потенциала действия поддерживается неизменной.
На рисунке 1-86 А представлена схема немиелинизированного волокна, для удобства обсуждения механизма распространения потенциала действия разбитая на фрагменты, каждый из которых включает один потенциалуправляемый Na+-канал (показан розовым цветом), находящийся в состоянии покоя, один потенциалуправляемый К+-канал (показан желтым цветом), находящийся в состоянии инактивации, и один канал утечки (показан коричневым цветом), через который осуществляется выход ионов К+ во внешнюю среду.
Для понимания механизмов распространения потенциала действия необходимо учитывать как пассивные (емкость и сопротивление), так и активные (активация потенциалупраляемых каналов) свойства мембраны нервного волокна. Рассмотрим эквивалентную электрическую схему (рис. 1-86 Б), представляющую собой электрическую модель нервного волокна, удобную для рассматривания проведения потенциала действия. Сопротивлением аксоплазмы и наружной среды можно в определенном смысле пренебречь. На этой схеме представлен лишь один элемент мембраны.
Каждый элемент имеет емкость мембраны Сm (рис. 1-86 Б), сопротивление потенциалуправляемого Na+-канала (RNa), натриевую батарею VNa, сопротивление потенциалуправляемого К+-канала (RK, калиевую батарею сопротивление канала утечки, К2Р-канала (Rl), батарею канала утечки Vl. Сопротивление канала утечки и его батарея приведены для демонстрации движения ионов по круговым локальным токам через эти каналы в невозбужденных участках мембраны аксона, соседствующих с возбужденным.
Пространственное распределение потенциала по мембране определяется токами, протекающими через нее. Однако при распространении потенциала действия по аксону ток зависит от координаты (эта пространственная неоднородность зависит, например, от наличия открытых потенциалуправляемых каналов). Именно поэтому локальное изменение потенциала (его первая производная) определяется локальными токами (т.е. ток как функция координаты). В свою очередь, локальный ток через мембрану определяется локальным потенциалом, и изменение тока (его первая производная) зависит как от пространственного изменения потенциала (резистивный компонент), так и от временного изменения потенциала (емкостной компонент).
На рисунке 1-86 В показан аксон с введенным в него стимулирующим электродом и группой регистрирующих микроэлектродов. Потенциалы действия в каждой регистрируемой точке показаны на рис. 1-86 Г и измеряются регистрирующими электродами у основания аксона (V1), а также в различных точках вдоль него (V2, V3, V4, V5, V6); график этих изменений представлен на рис. 1-86 Д. Уже из этих последних рисунков видно, что при распространении потенциала действия по аксону ни его амплитуда, ни его форма не меняются. Механизм явления представлен на следующем рисунке.
Рис. 1-86. Распространение потенциала действия на примере немиелинизированного волокна.
А - аксон в состоянии покоя. Потенциалуправляемые Na+-каналы (показаны розовым цветом) находятся в состоянии покоя, потенциалуправляемые К+-каналы (показаны желтым цветом) находятся в состоянии инактивации, работают только каналы утечки (показаны коричневым цветом), через которые осуществляется выход ионов К+ во внешнюю среду. Б - электрические свойства аксона можно моделировать, используя радиоэлектронные элементы. Показана эквивалентная электрическая схема одного фрагмента мембраны аксона, где Cm - емкость мембраны, RNa - сопротивление потенциалуправляемого Na+-канала, VNa - натриевая батарея, RK - сопротивление потенциалуправляемого К+-канала, VK - калиевая батарея, Rl - сопротивление канала утечки (К2Р-канала), Vl - батарея канала утечки. Мембрана немиелинизированного нервного волокна напрямую контактирует с внешней средой и, таким образом, в покое обмен ионами между внутри- и внеклеточной средами (ионные токи через плазматическую мембрану, прежде всего по каналам утечки) может происходить в любой точке немиелинизированного нервного волокна. В - через стимулирующий электрод подается пороговый импульс электрического тока, вызывающий возникновение потенциала действия. Г - потенциал действия распространяется по волокну без затухания и измеряется регистрирующими электродами у основания аксона (V1), а также в различных точках вдоль него (V2, V3, V4, V5, V6). Д - график, демонстрирующий неизменную амплитуду потенциала действия на любом удалении от точки стимуляции
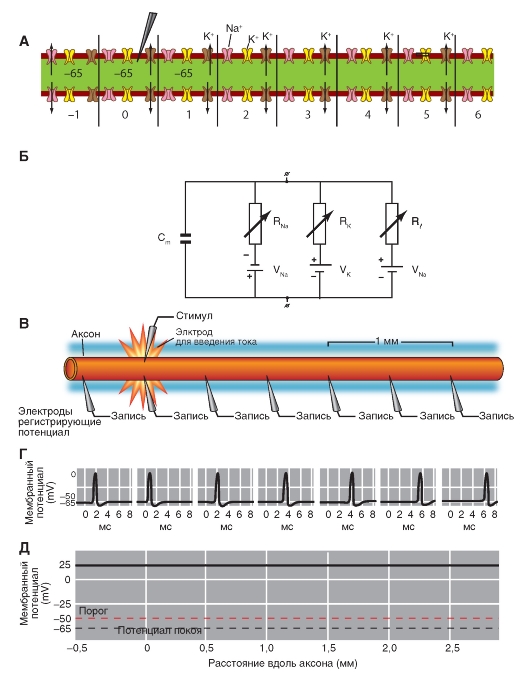
Механизм распространения потенциала действия по немиелинизированному волокну
Рис. 1-87. Механизм проведения потенциала действия в немиелинизированном волокне.
А - схема немиелинизированного нервного волокна в покое. Для описания механизма проведения возбуждения по немиелинизированному нервному волокну аксон разбит на условные фрагменты 0, 1, 2, 3...n, каждый из которых содержит потенциалуправляемые Na+- и К+-каналы и каналы утечки. Зеленый цвет всех фрагментов аксона соответствует состоянию покоя (рис. 1-86 А). А - раздражение фрагмента (0) нервного волокна приводит к открытию потенциалуправляемых Na+-ионных каналов, что ведет к возникновению входящего Na+-тока (фрагмент волокна окрашен красным цветом) и генерации фазы деполяризации потенциала действия на этом участке аксона. Поскольку внутриклеточная среда служит проводником, входящий в зону (0) ток распространяется в обе стороны от возбужденного участка. Так как мембрана нервного волокна не идеальный изолятор, распространяющиеся токи будут покидать волокно через единственно открытые каналы утечки, т.е. возникнут выходящие токи, протекающие через соседние участки мембраны (зоны 1, а также зоны 2, 3 и т.д.). Таким образом, локальный входящий ток всегда вызывает выходящие токи в прилегающих невозбужденных участках, т.е. возникают локальные круговые токи между возбужденным и прилегающими невозбужденными участками. Линии показывают локальные круги тока, текущего между деполяризованной и недеполяризованной областями внутри и снаружи аксона и через зоны мембраны, находящиеся в покое (зоны 1), а также на большем удалении. Б - токи, протекающие через зоны (1), электротонически изменяют их потенциал, приводя к разряду мембранной емкости и, следовательно, к деполяризации. Важно отметить, что эта фаза распространения потенциала действия опосредована пассивными свойствами мембраны нервного волокна (аналогично распространению пассивного электротонического потенциала). Однако в отличие от пассивного электротонического потенциала, деполяризация, возникающая в зонах (1), при распространении потенциала действия достигает порога открывания потенциалуправляемых Na+-каналов. Это приводит к лавинообразному открытию всех Na+-каналов в зонах (1), что сопровождается возникновением фазы деполяризации потенциала действия в этих зонах волокна. Входящий Na+-ток вызывает локальные круговые токи между возбужденными зонами (1) и прилегающими участками - невозбужденными зонами (2), а также зоной 0. Несмотря на то что в результате этого процесса зона (0) также частично деполяризуется, потенциалуправляемые Na+-каналы в ней находятся в состоянии инактивации, а вся зона - в состоянии рефрактерности (голубой цвет на рисунке). Именно поэтому здесь потенциал действия вновь не возникнет. В зонах (2), находящихся в состоянии покоя, локальные круговые токи электротонически сдвигают потенциал покоя в сторону деполяризации. Когда деполяризация достигает уровня критического потенциала, активируются потенциалуправляемые Na+-каналы и соответственно появляется входящий Na+-ток, формирующий в зонах (2) фазы деполяризации потенциалов действия. В - далее входящий Na+-ток, протекающий через мембрану в зонах 2, вызывает локальные круговые токи между возбужденными зонами 2 и невозбужденными зонами 3, а также зонами 1 и 0. Стрелки вновь показывают локальные круги тока. Хотя в результате этого процесса зоны 1 также частично деполяризуются, потенциалуправляемые Na+-каналы в них находятся в состоянии инактивации. Там регистрируются фазы реполяризации потенциала действия, а сами зоны находятся в состоянии рефрактерности (голубой цвет на рисунке). Именно поэтому в зонах 1 потенциал действия не возникнет. Его также не будет в зоне 0, поскольку она удалена от центров возбуждения. Вспомним, что пассивный электротонический потенциал распространяется с затуханием. Таким образом, электротоническая деполяризация, вызванная круговыми токами между возбужденными зонами 2, а также зонами 1 и 0, не достигает порога активации потенциалуправляемых Na+-аналов в зонах 1 и 0, и там потенциалы действия не возникают. В зонах 3 потенциал действия будет вызван. Г - Входящий Na+-ток, протекающий через мембрану в зонах 3, вызывает локальные круговые токи между возбужденными зонами 3 и невозбужденными зонами 4, а также зонами 2, 1 и 0. Стрелки вновь показывают локальные круги тока. Хотя в результате этого процесса зоны 2 также частично деполяризуются, потенциалуправляемые Na+-каналы в них находятся в состоянии инактивации. Там регистрируются фазы реполяризации потенциала действия, а сами зоны находятся в состоянии рефрактерности (голубой цвет на рисунке). Именно поэтому в зонах 2 потенциал действия не возникнет. Не возникнет потенциал действия и в зонах 1 и 0, поскольку они удалены от центров возбуждения. Вспомним опять, что пассивный электротонический потенциал распространяется с затуханием. Таким образом, электротоническая деполяризация, вызванная круговыми токами между зонами 3 и 2, 1, 0, не достигает порога активации потенциалуправляемых Na+-каналов, и потенциал действия там не возникает. В зонах 4 потенциал действия будет вызван
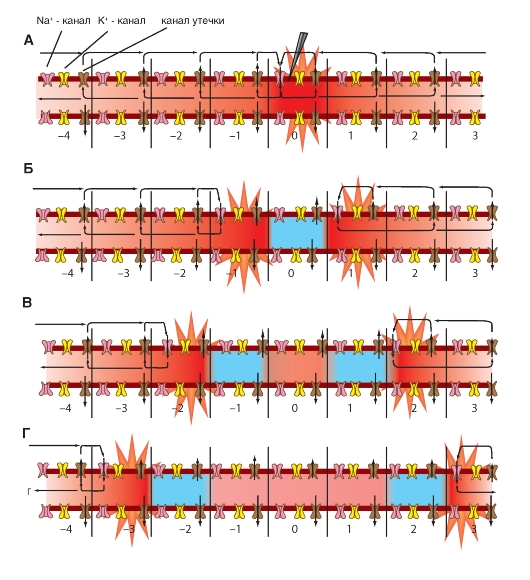
Механизм распространения потенциала действия по миелинизированному волокну
Рис. 1-88. Механизм проведения потенциала действия в миелинизированном волокне.
А - для описания механизма проведения возбуждения по миелинизированному нервному волокну аксон разбит на условные фрагменты 1, 2, 3...n, каждый из которых содержит 1 перехват Ранвье с потенциалуправляемыми Na+- и К+-каналами и каналами утечки. Внешняя поверхность мембраны перехватов Ранвье заряжена положительно, а внутренняя поверхность их мембраны заряжена отрицательно. Остальные области мембраны покрыты миелином. Зеленый цвет всех фрагментов аксона соответствует состоянию покоя. Электрическая активность в миелинизированном аксоне возможна только в области перехватов Ранвье, где ионы могут проходить через мембрану. Эти регионы мембраны имеют большую плотность потенциалуправляемых Na+-каналов. Участки нервного волокна, которые покрыты миелином, имеют значительно более высокое сопротивление, чем обычная плазматическая мембрана. Таким образом, локальные круговые токи, которые необходимы для генерации потенциала действия, на миелинизированных участках не возникают. Потенциалы действия возникают только в перехватах Ранвье. Миелинизированное волокно представляет собой значительно более качественный кабель по сравнению с немиелинизированным аксоном. Как следствие, электрические сигналы будут распространяться электротонически на большие расстояния. Б - схема состояния миелинизированного нервного волокна при действии на перехват Ранвье (0) порогового раздражителя. Вспомним, что у миелинизированных нервных волокон, вследствие высокой концентрации свободных ионов внутри и снаружи нервного волокна, внутри- и внеклеточная среды являются хорошими проводниками. Кроме того, ток может протекать через мембрану только в районах перехватов Ранвье. Раздражение перехвата Ранвье (0) нервного волокна приводит к открытию потенциалуправляемых Na+-ионных каналов, что ведет к возникновению входящего Na+-тока и генерации фазы деполяризации потенциала действия. В результате этого между возбужденным (0) и соседними перехватами Ранвье (1) и (2) возникает разность потенциалов, что вызывает локальный круговой ток, текущий между деполяризованной и недеполяризованной областями внутри аксона и замыкающегося через экстрацеллюлярную жидкость. Стрелки показывают локальный круг тока, текущего между деполяризованной и недеполяризованной областями внутри и снаружи аксона, проникая через покоящуюся зону перехвата Ранвье (1) мембраны и частично на большем удалении. В - раздражение перехватов Ранвье (1) нервного волокна приводит к открытию потенциалуправляемых Na+-ионных каналов, что ведет к возникновению входящего Na+-тока и генерации фазы деполяризации потенциалов действия на этих участках. В результате между возбужденными перехватами Ранвье (1) и между соседними перехватами Ранвье (2) возникает разность потенциалов, что вызывает локальные токи, текущие между деполяризованной и недеполяризованной областями. Такой же локальный ток течет и между перехватами Ранвье (1) и перехватом Ранвье (0), но, поскольку последний находится в стадии рефрактерности (Na-каналы находятся в состоянии инактивации и не могут быть открыты), перехват Ранвье (0) возбудиться не может. Г - раздражение перехватов Ранвье (2) нервного волокна приводит к открытию потенциалуправляемых Na+-ионных каналов, что ведет к возникновению входящего Na+-тока и генерации фазы деполяризации потенциалов действия (нижняя часть рисунка) на этих участках. В результате между возбужденными перехватами Ранвье (2) и соседними перехватами Ранвье (3) возникает разность потенциалов, что вызывает локальные токи, текущие между деполяризованной и недеполяризованной областями. Такой же локальный ток течет и между перехватами Ранвье (1) и перехватом Ранвье (0), но, поскольку перехваты Ранвье (1) находятся в стадии рефрактерности (Na-каналы находятся в состоянии инактивации и не могут быть открыты), они возбудиться не могут
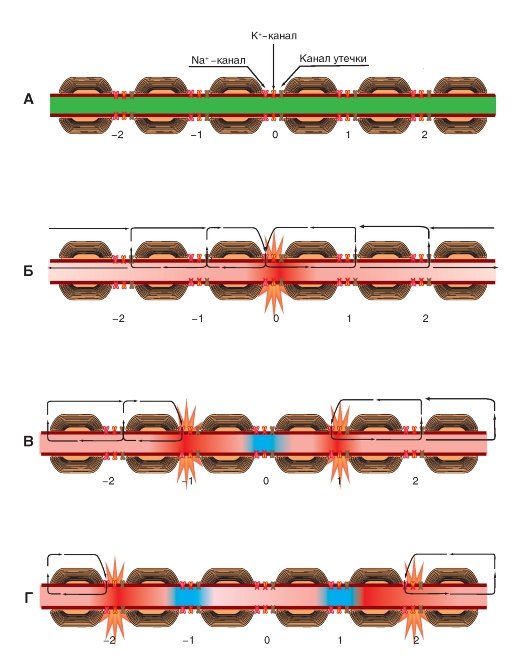
Проведение возбуждения по двум типам волокон
Распространение возбуждения в немиелинизированном и миелинизированном нервном волокне суммарно и схематически представлено на рис. 1-89. В отличие от немиелинизированного волокна, возбуждение передается от одного перехвата Ранвье к другому, и потенциалы действия возникают только в этих зонах. То есть происходит «перескакивание» возбуждения от одного перехвата Ранвье к другому. Такой механизм, характерный только для миелинизированных нервных волокон, называется сальтаторным проведением. Электрический ток течет через окружающую экстрацеллюлярную жидкость снаружи миелинового покрытия, так же как и через аксоплазму аксона от перехвата к перехвату, успешно возбуждая перехваты один за другим. Таким образом, нервный импульс «прыгает» по волокну, обусловливая наличие такого термина как «сальтаторное проведение». Пусть возбуждение возникло одновременно на двух типах волокон (рис. 1-89 А). Благодаря сальтаторному проведению у миелиновых волокон потенциал действия возникает сразу же на расстоянии в следующем перехвате Ранвье, тогда как в немиелинизированном волокне потенциал действия возникает только на соседнем участке (рис. 1-89 Б). Далее у миелиновых волокон потенциал действия возникает на следующем перехвате Ранвье, тогда как в немиелинизированном
волокне потенциал действия возникает только на следующем участке (рис. 1-89 В).
Сальтаторное проведение ценно по двум причинам. Во-первых, вызывая деполяризацию только перехватов Ранвье, возбуждение «прыгает» вдоль длинных участков оси нервного волокна, и этот механизм увеличивает скорость проведения возбуждения примерно в 5-50 раз. Во-вторых, сальтаторное проведение консервирует энергию у аксона, потому что деполяризуются только перехваты, позволяя при генерации потенциалов действия терять в 100 раз меньше ионов и, таким образом, требуя минимального метаболизма для восстановления натриевой и калиевой разностей концентраций относительно мембраны после серии нервных импульсов.
Другая любопытная черта сальтаторного проведения в больших миелиновых волокнах заключается в следующем. В конце потенциала действия, когда потенциалуправляемые Na+-каналы инактивируются, реполяризация развивается так быстро, что многие из К+-каналов даже не успевают открыться. Таким образом, проведение нервного импульса в миелинизированных волокнах опосредовано в основном ионной проводимостью через потенциалуправляемые Na+-каналы и каналы утечки. Вклад потенциалуправляемых К+-каналов незначителен. Этим объясняется тот факт, что потенциалы действия миелинизированных нервных волокон часто не имеют фазы следовой гиперполяризации.
Рис. 1-89. Сравнение общих принципов проведения возбуждения по немиелинизированному и миелинизированному нервному волокну
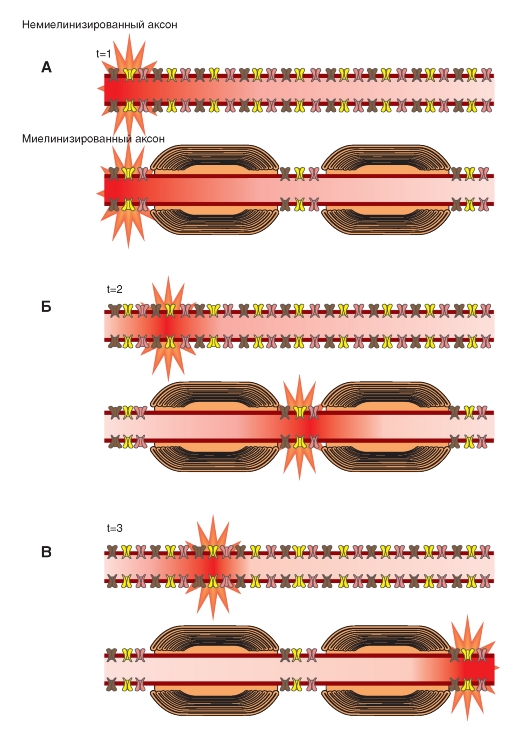
Внеклеточные потенциалы
В качестве предварительного усилителя обычно применяют усилитель постоянного тока с дифференциальным входом (рис. 1-90 А). Это связано с тем, что измеряется разность потенциалов между возбужденными и невозбужденными участками нерва.
Далее (рис. 1-90 Б) показаны записи внеклеточного потенциала нервного волокна на примере ответов седалищного нерва лягушки. Потенциал действия нерва во многом отличается от потенциала действия отдельных волокон. Он не подчиняется закону «все или ничего», поскольку при увеличении силы раздражающего импульса увеличивается число возбужденных аксонов и, следовательно, растет суммарная амплитуда самого потенциала действия. Сложный потенциал действия нерва отличается также своими порогом, формой и рядом других характеристик.
По скорости проведения возбуждения, длительности различных фаз потенциала действия и строению нервные волокна принято выделять три основных типа, обозначаемых буквами А, В и С (рис. 1-90 В).
Волокна типа А делятся на четыре подгруппы. Это α, β, γ и δ. Все они покрыты миелиновой оболочкой. Наиболее толстые из них, так называемые альфа-волокна (аА), у теплокровных животных и человека имеют диаметр 12-22 μм и характеризуются значительной скоростью проведения возбуждения: 70-120 м/с. Такие волокна проводят возбуждение от моторных нервных центров спинного мозга к скелетным мышцам и от рецепторов мышц к соответствующим нервным центрам. Пик потенциала действия аА волокон у теплокровных длится 0,4-0,5 мс. После его окончания развивается следовая деполяризация, которая продолжается 15-20 мс и переходит в следовую гиперполяризацию длительностью около 40-60 мс.
Три другие группы волокон типа А (β, γ и δ) имеют меньший диаметр, меньшую скорость проведения и более длительный потенциал действия. Это преимущественно чувствительные волокна, проводящие возбуждение от различных рецепторов в центральную нервную систему. Исключение составляют γА-волокна, значительная часть которых проводит возбуждение от клеток спинного мозга к так называемым интрафузальным мышечным волокнам, входящим в состав рецепторов мышц - мышечных веретен (см. раздел «Мышцы»).
К волокнам типа В относят миелинизированные, преимущественно преганглионарные, волокна автономной нервной системы. Скорость проведения возбуждения в этих волокнах у теплокровных животных составляет 3-18 м/с. Продолжительность потенциала действия волокон типа В примерно в 3 раза превышает длительность потенциала действия волокон типа А (она составляет 1-2 мс). Отличительная особенность этих волокон состоит в том, что в них не обнаруживается фаза следовой деполяризации, - нисходящее колено пика непосредственно переходит в следовую гиперполяризацию, которая в ряде случаев продолжается свыше 100 мс.
К волокнам типа С относят немиелинизированные нервные волокна очень малого диаметра (порядка 1 μм). Скорость проведения возбуждения в этих волокнах не более 3 м/с. Большинство С-волокон относится к постганглионарным волокнам симпатической нервной системы. К С-волокнам относят также нервные волокна, участвующие в проведении возбуждения от болевых рецепторов и некоторых рецепторов холода, тепла и давления. Потенциалы действия С-волокон характеризуются наибольшей продолжительностью (2 мс у теплокровных животных). Они имеют длительную фазу следовой деполяризации (50-80 мс), сопровождающуюся еще более продолжительной (300-1000 мс) следовой гиперполяризацией.
Рис. 1-90. Потенциалы нервного волокна и их регистрация.
А - дифференциальный усилитель для внеклеточной регистрации потенциалов нервного волокна. Б - записи внеклеточного потенциала нервного волокна на примере ответов седалищного нерва лягушки на электрические стимулы возрастающей силы. Показаны момент артефакта стимуляции и момент возбуждения нервных волокон. На фрагментах регистрации 5 и 6 видно, что, несмотря на двукратное увеличение амплитуды стимула, значение амплитуды возникающего возбуждения не изменяется. В - суммарный внеклеточный потенциал смешанного нервного волокна; α, β, γ, δ - потенциалы разных типов нервных волокон
Законы проведения возбуждения
Существует несколько необходимых условий проведения возбуждения по нерву, названных «законами» проведения возбуждения по нервному волокну.
Первый закон заключается в том, что при раздражении нервного волокна возбуждение по нерву распространяется в обе стороны. Для доказательства этого на разные концы нервного волокна накладывают две пары электродов, связанных с двумя дифференциальными усилителями, как это показано на рис. 1-91 А. Раздражение наносят в центре, между этими электродами. В результате двустороннего проведения возбуждения регистрирующая аппаратура, связанная с усилителями, зарегистрирует прохождение импульса как под электродами усилителя (1), так и под электродами усилителя (2).
Второй закон заключается в том, что распространение возбуждения в обе стороны происходит с одинаковой скоростью. Если расстояние между электродами усилителя (1) и раздражающими электродами равно расстоянию между электродами усилителя (2) и раздражающими электродами (рис. 1-91 А), то регистрирующая аппаратура зарегистрирует прохождение импульса как под электродами усилителя (1), так и под электродами усилителя (2) одновременно.
Третий закон заключается в том, что возбуждение по нерву распространяется без затухания или без «декремента». Для доказательства на одну сторону нервного волокна накладывают пару электродов, посредством которых наносят раздражение, а две пары электродов, связанных с двумя дифференциальными усилителями, располагают на удалении, как это показано на рис. 1-91 Б. В этом случае регистрирующая аппаратура, связанная с усилителями (1) и (2), продемонстрирует одинаковую амплитуду потенциала действия нервного волокна.
Четвертый закон заключается в том, что для проведения возбуждения по нервному стволу необходима анатомическая и физиологическая целостность нервного волокна. Проведение импульсов возможно лишь при условии анатомической целостности волокна, поэтому любая травма поверхности волокна нарушают его проводимость. Отсутствие проводимости наблюдается также при нарушении физиологической целостности волокна. В эксперименте на одну сторону нервного волокна накладывают пару электродов, посредством которых наносят раздражение, а пару электродов, связанных с дифференциальным усилителем, располагают на удалении, как это показано на рис. 1-91 В. В этом случае регистрирующая аппаратура, связанная с усилителями (1),
продемонстрирует в контрольных условиях потенциал действия нервного волокна. Достичь нарушения физиологической целостности нервного волокна можно, накладывая между раздражающими и регистрирующими электродами ватку, смоченную спиртом. Если перевязать лигатурой нервный ствол, проведение возбуждения по нему наблюдаться не будет из-за нарушения его анатомической целостности.
Пятый закон заключается в том, что возбуждение распространяется по нервным волокнам нервного ствола изолированно. В периферическом нерве импульсы распространяются по каждому волокну изолированно, т.е. не переходя с одного волокна на другое и оказывая действие только на те клетки, с которыми контактируют окончания данного нервного волокна. Изолированное проведение в отдельных волокнах смешанного нерва может быть доказано опытом на нервно-мышечном препарате скелетной мышцы, иннервированной смешанным нервом, в образовании которого участвует несколько спинно-мозговых корешков. Если раздражать один из этих корешков, сокращается не вся мышца, а только те группы мышечных волокон, которые иннервированы раздражаемым корешком. Более строгим доказательством изолированного проведения возбуждения служит отведение потенциалов действия от различных нервных волокон нервного ствола.
Шестой закон заключается в том, что нерв не утомляем. Это доказывается следующим экспериментом. На одну сторону нервного волокна накладывают пару электродов, посредством которых наносят раздражение, а две пары электродов, связанных с двумя дифференциальными усилителями, располагают на удалении, как это показано на рис. 1-91 Б. В этом случае регистрирующая аппаратура, связанная с усилителями (1) и (2), продемонстрирует одинаковую амплитуду потенциала действия нервного волокна в течение очень длительного времени.
Седьмой закон заключается в том, что в различных волокнах возбуждение распространяется с разной скоростью. Скорость проведения возбуждения зависит от сопротивления среды, окружающей волокно, от сопротивления аксоплазмы на единицу длины, сопротивления мембраны аксона и диаметра волокна. В миелинизированном волокне скорость проведения нервного импульса пропорциональна его диаметру. У немиелинизированного волокна скорость проведения возбуждения пропорциональна квадратному корню диаметра волокна. Таким образом, скорость проведения у миелинизированного волокна значительно выше.
Рис. 1-91. Законы проведения возбуждения по нервному волокну