Детские болезни в 2-х томах: том 1 : учебник / Под ред. И.Ю. Мельниковой, - 2009.
|
|
|
|
РАЗДЕЛ II НЕОНАТОЛОГИЯ
Неонатология - раздел педиатрии, касающийся вопросов физиологии и патологии развития ребенка в период новорожденности - самом важном периоде жизни человека, определяющем во многом его здоровье в последующие годы.
Неонатальный период, или период новорожденности, начинается от момента рождения и заканчивается через 28 полных дней после рождения. Кроме того, существует определение «перинатальный период». Согласно МКБ-Х, он начинается с 22 полных недель беременности (154 дня) и завершается на 7-й полный день после рождения. Выделен перинатальный период в связи с особой значимостью для здоровья человека заболеваний, возникающих в этом отрезке жизни вследствие воздействия патогенных факторов, связанных с экстрагенитальной и акушерской патологией матери. Перинатальный период разделяют на три периода: антенатальный, интранатальный и ранний неонатальный. Антенатальный период начинается с момента образования зиготы и заканчивается с началом родов. Интранатальный период исчисляют от начала родовой деятельности до рождения ребенка. Ранний неонатальный период - первые 7 суток от момента рождения ребенка.
В неонатологии существуют понятия, необходимые для оценки состояния здоровья и степени морфофункционального развития ребенка, его адаптивных возможностей.
Гестационный возраст ребенка - это продолжительность его внутриутробного развития, исчисляемая от первого дня последней нормальной менструации матери в полных днях или полных неделях. Доношенным считают ребенка, родившегося при сроке беременности 37-42 недели. Большинство доношенных детей имеют массу тела более
Независимо от гестационного возраста выделяют среди новорожденных детей:
- с низкой массой тела при рождении (менее
- с очень низкой массой тела (менее
- с экстремально низкой массой тела (менее
Важны определения живорождения и мертворождения. Живорожденным называют ребенка вне зависимости от его гестационного возраста при наличии в момент рождения хотя бы одного из призна- ков жизни: дыхания, сердцебиения, пульсации пуповины или явных движений произвольной мускулатуры. Мертворождением называют смерть продукта зачатия до его полного изгнания или извлечения из организма матери вне зависимости от продолжительности беременности.
Исходя из деления периода новорожденности рассчитывают показатели ранней неонатальной смертности (смертность на первой неделе жизни), поздней неонатальной (смертность на 2-4-й неделе жизни) и неонатальной смертности (в течение первых 28 дней жизни). В периоде новорожденности в России умирают около половины детей, умерших до года.
К моменту рождения ребенка формируется сложная система приспособительных механизмов, благодаря чему в сравнительно корот- кий промежуток времени новорожденный адаптируется к новым условиям жизни. В соответствии с новыми условиями питания и дыхания происходит метаболическая перестройка, во время которой имеет место катаболический характер обмена и наблюдается снижение массы тела в первые дни жизни. По мере завершения метаболической адаптации вновь устанавливается анаболическое направление обмена и идет развитие, присущее раннему детскому возрасту. Параллельно с этим проявляются специфические для этого периода жизни адаптивные реакции на клеточном, тканевом и системном уровнях, обеспечивающие перестройку функций всех систем организма, направленную не только на сохранение его жизнеде- ятельности, но и на дальнейшее развитие. У здорового доношенного ребенка процесс адаптации завершается к 7-10-му дню жизни, тогда как у недоношенного он протекает замедленно. Чем менее зрелым является ребенок, тем дольше он приспосабливается к новым условиям жизни.
В период адаптации новорожденного наблюдаются определенные функциональные состояния, которые принято называть переходными
(пограничными). Будучи физиологичными, они при определенных условиях могут принимать патологические черты и способствовать развитию осложнений (например, желтуха у глубоко недоношенных детей). Пререходными состояниями у новорожденных детей являются:
1) транзиторная потеря первоначальной массы тела, максимально выраженная на 3-4-й день жизни и не превышающая 6 %;
2) транзиторная гипотермия (в первые 30-60 мин жизни) и гипертермия (наблюдается у некоторых детей в момент максимальной потери массы тела на 3-4-й день жизни);
3) транзиторные изменения кожных покровов (физиологическая эритема, родовая опухоль, токсическая эритема - аллергоидная реакция на 3-5-й день жизни);
4) транзиторная гипербилирубинемия (желтуха появляется на 2 сутки жизни и постепенно исчезает к 5-7-му дню);
5) транзиторные особенности функции почек (олигурия в первые сутки жизни, протеинурия, мочекислый инфаркт, инфарктная моча);
6) гормональный криз (нагрубание молочных желез, метроррагии и др.);
7) транзиторный дисбактериоз и физиологическая диспепсия;
8) транзиторное состояние системы кровообращения в связи с постепенным закрытием фетальных шунтов;
9) транзиторные особенности гемостаза и гемопоэза.
Приспособительные возможности новорожденного зависят в значительной мере от условий, в которых протекало его внутриутробное развитие, так как они во многом определяют состояние морфоло- гической и функциональной зрелости различных органов и систем плода к моменту его рождения. Поэтому указанные переходные состояния бывают выражены в разной степени, в разных сочетаниях, а иногда наблюдаются лишь отдельные из них. В большинстве случаев переходные состояния у новорожденных проходят к концу раннего неонатального периода, их сохранение у детей старше 7-дневного возраста следует расценивать как симптом патологии и принимать меры для дополнительного обследования ребенка.
Дети с задержкой внутриутробного развития (ЗВУР) Шифр МКБ-Х - Р05 (замедленный рост и недостаточность питания плода).
Задержка внутриутробного развития ребенка - синдром, который появляется во внутриутробном периоде жизни и характеризуется
снижением показателей массы тела и роста новорожденного на два стандартных отклонения и более (или ниже 10-го центиля) по сравнению с должными для данного гестационного возраста.
Частота рождения детей с ЗВУР широко варьирует в разных странах (от 3 до 30 %), так как зависит от положенных в основу диагноза критериев, от генетического груза популяции, социально-экономи- ческих условий жизни, здоровья женщин репродуктивного возраста и других факторов. Частота ЗВУР в популяции новорожденных в г. Москве составляет 67,4 на 1000 детей, родившихся живыми в срок, и 179,5 на 1000, родившихся преждевременно.
Причины задержки внутриутробного развития ребенка.
1. Эндогенные: хромосомные заболевания, многоплодие, внутриутробные инфекции, врожденные пороки развития.
2. Экзогенные: социально-биологические, нарушающие нормальное течение беременности (плохое экономическое положение и недостаточное питание, профвредности, вредные привычки и т. д.), соматические заболевания матери и их обострения во время беременности, осложнения беременности и патология плаценты.
Срок беременности в момент воздействия неблагоприятного фактора и его продолжительность определяют форму ЗВУР.
Симметричная форма (гипопластический вариант) - масса тела, рост и окружность головы отстают от должных для данного гестационного возраста величин. Наблюдается у новорожденных, внутриутробное развитие которых протекало в неблагоприятных условиях с самых ранних сроков беременности. Часто при этой форме ЗВУР у ребенка имеются стигмы дизэмбриогенеза (диспластический вариант).
Асимметричная форма (гипотрофический вариант) - масса тела отстает от должной для данного гестационного возраста. Рост и окружность головы соответствуют возрасту. Наблюдается при неблагоприятных условиях внутриутробного развития во второй половине беременности.
Различают три степени ЗВУР:
I) легкая степень - гипотрофия I - дефицит 1,5 сигмы или от 25-го до 10-го центиля;
II) средняя степень - гипотрофия II - дефицит 2 сигмы или от 10-го до 3-го центиля;
III) тяжелая степень - гипотрофия III - дефицит более 2 сигм или менее 3-го центиля.
Наряду с отставанием физического развития у новорожденных может наблюдаться задержка формирования функций ЦНС - несо- ответствие постурального, пассивного тонуса и рефлекторных реакций гестационному возрасту. При этом выделяют равномерное отставание этих функций от должного развития на 2-4 недели или диссоциированное развитие, когда формирование безусловных рефлексов задерживается в большей степени, чем тонических реакций. Эти дети составляют наиболее тяжелый контингент, поскольку в большинстве своем имеют нарушение нейроиммуно-эндокринной регуляции на клеточном и тканевом уровнях, что определяет состояние полиорганной недостаточности и неустойчивость гомеостаза.
Процесс адаптации к новым условиям окружающей среды у новорожденных с ЗВУР затруднен, протекает медленно с большим напря- жением всех функциональных систем организма. При этом нередко возникают требующие немедленной коррекции нарушения гомеостатических функций, в развитии которых определенную роль могут играть связанные с ЗВУР особенности обменных процессов в организме ребенка и отсутствие индивидуального подхода к его вскармливанию.
Наиболее частые осложнения ранней неонатальной адаптации детей с ЗВУР.
1. Асфиксия при рождении.
2. Гипогликемия возникает в первые сутки и может иметь место в течение нескольких дней.
3. Полицитемия.
4. Неврологические нарушения.
5. Синдром аспирации околоплодных вод и/или мекония.
6. Легочные геморрагии.
7. Повышен объем плазмы при рождении и объем внеклеточной жидкости. Велика склонность к отекам.
8. Повышена теплоотдача и снижена теплопродукция.
9. Уменьшено число циркулирующих Т-лимфоцитов, тогда как В- клеток нормальное число.
10. Снижены процессы опсонизации, хемотаксиса, фагоцитоза.
11. Низкий уровень иммуноглобулина G.
12. Гипокальциемия, гиперфосфатемия, гипербилирубинемия у недоношенных детей с ЗВУР.
13. Задержка постнатальной перестройки гемодинамики. Выхаживание и вскармливание новорожденных с ЗВУР требует индивидуального подхода с учетом степени зрелости ребенка и
наличия сопутствующей патологии. ЗВУР новорожденного вносит существенный вклад в развитие хронических форм патологии и детской инвалидности, обусловленной тяжелыми повреждениями ЦНС (детский церебральный паралич, эпилепсия, прогрессирующая гидроцефалия, минимальные мозговые дисфункции).
Согласно концепции «фетального программирования» (Lucas А.,1991), в условиях дефицита нутриентов и кислорода у внутриутробного плода изменяется скорость клеточного деления, распределение типов клеток и их метаболическая активность, что определяет «программирование» структуры органов и особенности регуляции на клеточном уровне. Это детерминирует предрасположенность к сердечно-сосудистым, метаболическим и эндокринным заболеваниям в зрелом возрасте. Наблюдаются:
1) ишемическая болезнь сердца;
2) повышение артериального давления;
3) сахарный диабет II типа и инсулинорезистентность;
4) нарушение обмена холестерина и свертываемости крови (повышение уровня сывороточных ЛПНП и концентрации фибриногена в плазме крови);
5) синдром поликистозных яичников (повышение уровня андрогенов в период внутриутробного развития);
6) изменение метаболизма скелетной мускулатуры (сниженный уровень гликолиза и продукции АТФ, повышенное окисление жиров);
7) повышенная активность симпатической нервной системы. Профилактика ЗВУР плода заключается в оздоровлении женщин
репродуктивного возраста и в обеспечении адекватной помощи беременным: при постановке на учет в женской консультации выявление факторов риска развития плацентарной недостаточности и ЗВУР плода, динамический контроль за состоянием здоровья беременной и своевременная госпитализация в стационар.
Глава 1
Недоношенные дети
Недоношенным считается новорожденный, родившийся между 22-37-й неделями беременности (154-259 дней от первого дня последнего менструального цикла) с массой от 500 до
Шифр МКБ-Х-Р07.
Эпидемиология. Статистические показатели, касающиеся частоты рождения недоношенных детей, имеют существенные различия (4-16 %), поскольку в ряде стран не учитывают как новорожденных тех детей, которые родились до 28-й недели беременности. В России действует приказ Минздрава РФ ? 318 от 04.12.2002 г. «О переходе на рекомендованные Всемирной организацией здравоохранения (ВОЗ) критерии живорождения и мертворождения», согласно которому перинатальный период исчисляется с 28-й недели беременности. Частота рождения недоношенных детей, гестационный возраст которых составляет 28-36 недель, составляет 5,5-8 %. Среди недоношенных детей 80 % составляют дети, родившиеся при сроке беременности 32-36 недель.
Принято выделять четыре группы недоношенных детей в зависимости от массы тела при рождении:
I степень недоношенности - 2500-2001 г;
II степень недоношенности - 2000-1501 г;
III степень недоношенности - 1500-1001 г - очень низкая масса тела;
IV степень недоношенности - менее
Заболеваемость и смертность недоношенных детей, частота инвалидизации тем выше, чем меньше гестационный возраст ребенка. Выхаживание, лечение и реабилитация недоношенных детей требуют значительных финансовых затрат, поэтому профилактика преждевременных родов является не только важнейшей медицинской, но и социальной проблемой.
Причины, ведущие к рождению недоношенного ребенка
1. Социально-экономические и демографические факторы (доход семьи и жилищные условия, питание беременной, характер труда
женщины, образование, характер медицинского обслуживания и т. д.). В последние годы возросла роль курения, алкоголизма, наркомании.
2. Социально-биологические факторы (возраст родителей, порядковый номер беременности, интервал между родами, исход предыдущей беременности, многоплодная беременность и др.).
3. Клинические факторы: 1) инфекционные заболевания матери; 2) осложнения, связанные с беременностью (гестоз); 3) травматические повреждения матки (предшествующие аборты); 4) изосерологи- ческая несовместимость крови матери и плода; 5) аномалии развития женских половых органов; 6) заболевания матери, в том числе инфекции, передаваемые половым путем; 7) нейроэндокринная патология матери; 8) хромосомные аномалии ребенка.
В большинстве случаев совокупность неблагоприятных факторов, являющихся причиной преждевременного рождения ребенка, определяет его функциональную зрелость и темпы развития в пост- натальном периоде.
Анатомо-физиологические особенности недоношенного ребенка
Морфологические признаки: телосложение непропорциональное, нижние конечности и шея короткие, пупочное кольцо расположено низко, голова относительно большая. Кости черепа податливы, швы и роднички открыты. Ушные раковины мягкие, плотно прижаты к голове. На коже спины, в области плеч, на лбу, щеках и бедрах - обильное лануго, кожа тонкая, отчетливо выражена физиологическая эритема. Подкожно-жировой слой истончен или отсутствует, сохраняясь лишь в области щек. Ногти нередко не доходят до кончиков пальцев. Половая щель у девочек зияет, так как большие половые губы не прикрывают малые. Яички у мальчиков не опущены в мошонку.
Для недоношенных детей характерна анатомическая и функциональная незрелость ЦНС, что определяет их особенности: вялость, сонливость, снижение мышечного тонуса, слабый крик, недоразвитие глотательного и сосательного рефлексов, несовершенство терморегуляции. Степень выраженности симптомов зависит от гестационного возраста ребенка. Реакции на различные раздражения отличаются генерализованностью, слабостью активного торможения, иррадиацией возбуждения.
У недоношенных детей наблюдается супрессорная направленность реакций клеток системы иммунитета, что имеет большой биологический смысл: предотвратить развитие патологии при мощном потоке антигенных воздействий на организм сразу после рождения. Особенности неспецифической реакции иммунной системы: быстрая истощаемость костно-мозгового гранулоцитарного резерва, низкая хемотаксическая активность, недостаточность активации системы комплемента, несовершенный фагоцитоз, значительно снижена способность лейкоцитов продуцировать интерферон. Имеется незрелость межклеточных взаимодействий, которые определяют как первичную неспецифическую защитную реакцию, так и созревание В-лимфоцитов и специфический иммунный ответ. Чем меньше гестационный возраст, тем в большей мере снижены эти показатели. Гуморальные защитные реакции обеспечиваются в основном материнскими антителами, которые (IgG) в основном поступают к плоду в III триместре беременности. «Физиологический» иммунодефицит определяет низкую резистентность недоношенных детей к условно-патогенной флоре, склонность к генерализации инфекционного процесса, септическим состояниям, высокую чувствительность к вирусным инфекциям.
Эндокринные железы к моменту рождения структурно дифференцированы, однако их функциональные возможности в период адаптации ограничены. Воздействие вредных факторов приводит к перенапряжению, а затем - к истощению функции.
Частота дыхания недоношенного ребенка вариабельна (36-82 в минуту) тем больше, чем меньше масса тела ребенка. Дыхание отличается меньшей и неравномерной глубиной, удлинением отдельных вдохов и выдохов, появлением различной продолжительности респираторных пауз. Разнообразие ритма дыхательных движений определяется большой представленностью (80 %) у недоношенных детей активированной фазы сна (гомолога парадоксальной фазы сна у взрослых). Степень морфологической зрелости легких зависит от гестационного возраста ребенка и условий его внутриутробного развития. У родив- шихся до 28-30-й недели беременности не развиты альвеолы и капиллярная сеть легких, низка растяжимость легких, недостаточна продукция сурфактанта, что ведет к появлению дыхательных расстройств при переходе в новые условия окружающей среды.
Частота сердечных сокращений у недоношенных детей, так же как и дыхание, отличается вариабельностью (130-150 в минуту), артери-
альное давление более низкое в первые дни повышается к 3-4-му дню (85/40 мм рт. ст.). Перестройка гемодинамики после рождения, связанная с началом функционирования малого круга кровообращения, происходит тем медленней, чем меньше гестационный возраст ребенка и более выражена морфофункциональная незрелость легочной ткани. Все это предрасполагает к возникновению нарушений гемодинамики при появлении сопутствующей патологии.
Маленький объем желудка, преобладание тонуса пилорического сфинктера над кардиальным, слабая моторика кишечника определяют частые срыгивания и вздутия живота. Объем желудочного сока у недоношенных детей в 3 раза меньше, чем у доношенных, рН составляет 4,4-6,6. Снижено содержание гастрина, химозина, пепсина, мотилина, низкая активность ферментов трипсина и химотрипсина, лактазы, энтерокиназы, лейцинаминопептидазы, щелочной фосфатазы. У недоношенных детей снижена активность ферментов слизистой оболочки тонкой кишки, где происходит переваривание лактозы под влиянием лактазы, в связи с этим возможно неполноценное переваривание и ферментация. Активность ферментов тем ниже, чем больше степень недоношенности.
Суточный диурез колеблется от 60 до 130 мл, частота мочеиспусканий 8-13 раз в сутки, объем мочеиспускания от 1,5 до 15 мл. Функциональные особенности почек: низкий объем клубочковой фильтрации, пониженная канальцевая реабсорбция воды, почти полная реабсорбция поступающего в систему канальцев натрия, слабая реакция почек на введение диуретиков. У недоношенных детей менее совершенны, чем у доношенных концентрационная способ- ность почек, почечная осморегуляция и способность к поддержанию кислотно-основного состояния.
Водно-солевой гомеостаз
Содержание воды в организме новорожденного ребенка велико. У недоношенных детей при массе тела 1500-2000 г оно составля- ет 80-85 %. По мере роста ребенка содержание воды в организме снижается, что объясняется увеличением структурного клеточного материала, в первую очередь белка. Большую часть воды у новорожденных детей составляет внеклеточная жидкость. У недоношенных детей на ее долю приходится 42,5 % массы тела. Однако если рассчитать содержание воды в организме на единицу поверхности тела, то оказывается, что избыток воды не так велик. Это указывает на осо-
бую напряженность водного обмена и делает недоношенных детей особенно чувствительными к нарушению водного равновесия.
У недоношенных детей объем циркулирующей крови в расчете на килограмм массы тела при рождении выше, чем у доношенных детей. С первых минут после рождения начинается перераспределение вне- клеточной жидкости, происходит отток крови из сосудов в интерстициальное пространство, что при низком содержании в плазме белка ведет к распространенным отекам.
Судьба воды в организме и ее выделение связаны с электролитным составом жидкостей тела. Осмотическая концентрация плазмы колеблется в широких пределах и составляет от 252 до 354 мосм/л, наивысшие цифры наблюдаются у менее зрелых детей. Почти половину осмолярной концентрации плазмы определяет натрий, концентрация которого составляет 154-165 ммоль/л. Содержание калия в крови недоношенных детей колеблется от 3,5 до 6,5 ммоль/л.
В обычных условиях новорожденный ребенок путем перспирации теряет более чем 1-1,2 г/кг/час воды. Эксикоз развивается особенно легко и представляет большую опасность для недоношенного ребенка, так как одновременно с этим углубляется и ацидоз.
Кислотно-основное состояние (КОС) крови
КОС крови служит важным показателем процесса адаптации недоношенного ребенка к внеутробной жизни. Средняя величина рН крови сразу после рождения - 7,25, нормализация происходит лишь к 12-му часу жизни, но неустойчивость этого показателя сохраняется. При любом неблагоприятном воздействии легко возникает ацидоз.
Азотистый гомеостаз
В первые дни жизни, когда новорожденный не получает достаточного количества пищевого белка, преобладают процессы ката- болизма, что ведет к повышению содержания в крови азотистых продуктов, особенно у глубоко недоношенных детей. У них переход от катаболической фазы обмена белка к анаболической замедлен в результате того, что при недостатке в организме запасов жира и гликогена они начинают использовать белок в энергетических целях.
Углеводный гомеостаз
Энергетические потребности внутриутробного плода покрываются исключительно за счет глюкозы, поступающей из крови матери, а в
последние сроки внутриутробного развития в организме плода идет быстрое накопление гликогена. Чем менее зрелым рождается плод, тем меньше у него запасы гликогена. С первых часов после рождения содержание сахара в крови начинает быстро снижаться, достигая минимальных значений к концу 2-4-го часа жизни. Затем гликемия начинает постепенно возрастать к концу первых суток жизни. Недоношенные новорожденные имеют низкие запасы гликогена, поэтому увеличения гликемии к концу первых суток у них не происходит. Напротив, может наблюдаться гипогликемия, нередко сопровождаемая клиническими симптомами: беспокойство, тремор конечностей, тахикардия, расстройство дыхания и даже клонические судороги. Гипогликемия углубляет состояние ацидоза, поскольку при недостатке глюкозы тормозится окисление кетоновых тел до углекислоты и воды.
Липидный гомеостаз
В качестве источника энергии новорожденный организм использует собственный жир, запасы которого у недоношенных детей низки. При быстром истощении углеводных резервов окисление жирных кислот происходит не полностью. Поэтому уже в первые 12 часов жизни у недоношенных детей наблюдается значительное увеличение в крови кетоновых тел, концентрация которых возрастает вплоть до 2-й недели жизни, что усиливает и поддерживает метаболический ацидоз. Наряду с этим у них наблюдается дефицит полиненасыщенных жирных кислот, а именно линолевой и α-линоленовой (ω3 и ω6), а также длинноцепочечных полиненасыщенных жирных кислот (ДПНЖК), в осо- бенности арахидоновой (АА) и докозогексаеновой (ДГА). Последние входят в структурные липиды клеточных мембран мозга, сетчатки и других тканей, обеспечивая их нормальную функцию, и влияют на свойства рецепторов, активность ионных насосов, на синтез специфических белков и ферментов, перенос сигнальных молекул. ДПНЖК являются предшественниками эйкозаноидов, которые модулируют воспалительный и иммунный ответы организма.
Гипербилирубинемия
У недоношенных новорожденных в период адаптации наблюдается желтуха в связи с повышенным гемолизом эритроцитов и незрелостью энзиматической системы печени. Максимальная концентрация непрямого билирубина в крови достигается к 5-8-му дню жизни, желтуха сохраняется до трех недель и более. Непрямой билирубин не
растворяется в воде и поэтому не выводится с мочой. При избыточном образовании он накапливается в клеточных мембранах, особенно в нервных клетках, и нарушает процесс клеточного дыхания и мета- болизма. Развитию билирубиновой интоксикации у недоношенных детей может способствовать: 1) сниженная способность связывания белками плазмы из-за имеющейся у них гипоальбуминемии; 2) выраженная гипогликемия, поскольку глюкоза принимает участие в процессе трансформации непрямого билирубина в печеночных клетках; 3) гипоксия, при которой увеличивается проницаемость клеточных мембран для билирубина. Симптомы билирубиновой интоксикации: общая вялость ребенка, мышечная гипотония, снижение сосательного рефлекса, нарушение дыхания.
Терморегуляция
У недоношенных детей снижена способность к теплообразованию вследствие малых запасов бурого жира, низкого мышечного тонуса и недостаточного питания в первые дни жизни. В то же время теплоотдача повышена в связи с большой поверхностью тела и слабым развитием защитного жирового слоя, а также особенностями кровоснабжения кожи (поверхностное расположение сосудов) и превалированием сосудорасширяющих реакций. Все это создает возможность быстрого охлаждения тела недоношенного ребенка, при этом усиливаются ацидотические сдвиги, повышается проницаемость капилляров, возникают отеки. У недоношенных детей также имеется незрелость теплорегулирующих структур ЦНС, вследствие чего ребенок может страдать не только от охлаждения, но и от перегревания.
При соблюдении правильных условий ухода за недоношенным ребенком аксиллярная температура тела у него держится в пределах 36-37?. В первые дни жизни могут наблюдаться суточные колебания температуры (до 1?), но с течением времени они становятся незначительными (0,3-0,5?).
Таким образом, степень морфофункциональной зрелости недоношенного ребенка определяет способность к осуществлению адаптивных реакций и выживание в новых условиях окружающей среды.
Организация выхаживания недоношенных детей
В России предусмотрена двухэтапная система выхаживания недоношенных детей. Первый этап - это специализированный родиль-
ный дом по приему родов до срока или отдельные палаты для интенсивного ухода и терапии недоношенным детям в условиях обычного родильного дома. Второй этап - специализированная больница или отделение по лечению и выхаживанию недоношенных детей, переведенных из родильных домов. Перевод недоношенных детей на второй этап выхаживания определяется возрастом в днях, массой тела, клиническим состоянием и осуществляется не ранее 8-го дня жизни.
Основные принципы выхаживания: 1) обеспечение оптимальных для ребенка температурного режима и влажности окружающей среды (для этого предусмотрены специальные условия родильной комнаты и специальные кувезы); 2) в родильном зале и на последующих этапах должен строго соблюдаться принцип осторожности и бережности, количество манипуляций по отношению к ребенку должно быть сведено к минимуму; 3) соблюдение асептики в уходе, профилактика инфицирования; 4) своевременная и адекватная коррекция нарушений гомеостаза; 5) индивидуальный подход к выбору времени начала и способа вскармливания ребенка с использованием для этой цели материнского непастеризованного молока или при его отсутствии адаптированных молочных смесей. Вскармливание недоношенного ребенка является проблемой, успешное решение которой зависит от опыта и искусства врачей и среднего медицинского персонала. Поэтому выхаживание недоношенных детей (особенно с низкой и экстремально низкой массой тела) должно проводиться высококвалифицированным медицинским персоналом.
Многие недоношенные дети с первых часов жизни нуждаются в интенсивной терапии. Основные лечебные мероприятия у недоношенных новорожденных сводятся к борьбе с гипоксией, коррекции ацидоза, поддержанию водно-солевого гомеостаза, функции внешнего дыхания, сердечно-сосудистой системы, пополнению энергетических ресурсов. При наличии инфекционных процессов требуется применение антибиотиков с учетом этиологического фактора и иммуно- корригирующей терапии. Задача выхаживания и лечения недоношенного ребенка - сохранение жизни и профилактика неблагоприятных последствий, обусловленных патологией, явившейся причиной его преждевременного рождения и постнатального заболевания.
Глава 2
Синдром дыхательных расстройств (СДР) (болезнь гиалиновых мембран)
СДР - тяжелое нарушение функции внешнего дыхания в раннем неонатальном периоде у недоношенных детей, обусловленное незрелостью легких и первичным дефицитом сурфактанта.
Шифр МКБ-Х - Р 22.0.
Данная патология наблюдается у детей, гестационный возраст которых меньше 34 недель, а также у рожденных от больных сахарным диабетом матерей. Частота встречаемости тем выше, чем меньше гестационный возраст ребенка: 60-80 % - у родившихся ранее 30-й недели беременности и 25-35 % - у родившихся на 30-34-й неделе. Профилактическое применение беременными кортикостероидов снижает частоту СДР в 2 раза.
Патогенез
В основе развития СДР лежат: 1) морфологическая незрелость легочной ткани (недостаточное развитие альвеол и сосудистой системы); 2) незрелость и/или обусловленное гипоксией нарушение функции клеток, вырабатывающих поверхностно-активное вещество - сурфактант; 3) расстройство микроциркуляции в легких вследствие спазма сосудов и/или нарушения реологических свойств крови; 4) незрелость ЦНС и механизмов регуляции ритма и глубины дыхательных движений. В конечном итоге ведущий патофизиологический механизм развития СДР и его тяжесть зависят от степени нарушений перечисленных функций и их сочетаний.
Сурфактант - вещество, состоящее из фосфолипидов, нейтральных липидов и протеинов, вырабатывается альвеолоцитами II типа с 20-24-й недели внутриутробного развития и обеспечивает с началом первого вдоха ребенка снижение силы поверхностного натяжения в альвеолах и поддержание их стабильности в процессе дыхания. Кроме того, сурфактант обладает бактерицидной активностью и стимулирует функцию макрофагов в легких.
Недостаточность сурфактанта на фоне морфологической незрелости легочной ткани и сосудов ведет к спадению альвеол на выдохе,
что способствует образованию распространенных ателектазов. При этом нарушается газообмен, активируется анаэробный гликолиз, развивается метаболический ацидоз. Под влиянием ацидоза усиливается спазм легочных артериол, что ведет к нарушению перфузии легких и к внутрилегочному шунтированию крови, что усиливает гипоксемию. Одновременно в этих условиях увеличивается проницаемость легочных сосудов, проникновение белков плазмы в интерстициальное пространство и в просвет альвеол, что приводит к образованию гиалиновых мембран.
Изменения функции внешнего дыхания при СДР проявляются снижением растяжимости легких, функциональной остаточной емкости, дыхательного объема альвеолярной вентиляции и перфузии, увеличением сопротивления дыхательных путей на вдохе.
Клиническая характеристика СДР
СДР развивается в первые минуты и часы жизни ребенка. Наблюдается сохранение выраженного локального или общего цианоза, несмотря на наличие дыхания. При этом дыхание носит поверхностный затрудненный характер. В акте дыхания участвует вспомогательная мускулатура (втяжение уступчивых мест грудной клетки), наблюдается одышка (более 60 дыханий в минуту) и экспираторный стон («хрюкающий» выдох). Степень выраженности клинических сим- птомов, темп их нарастания коррелируют с аускультативными данными: ослаблением дыхательных шумов вплоть до полного их отсутствия в отдельных участках грудной клетки и появлением мелкопузырчатых хрипов в легких. Оценка нескольких клинических параметров в динамике позволяет получить объективное представление о темпах развития и тяжести дыхательных нарушений (модифицированная шкала Downes) (табл.).
Рентгенологическая картина зависит от времени прошедшего после рождения и степени тяжести заболевания: от небольшого снижения пневматизации до почти полного ее отсутствия («белые легкие»). Характерная картина болезни гиалиновых мембран легких: диффузное снижение прозрачности легочных полей, сетчатый рисунок, участки просветления в области корня легкого (воздушная бронхограмма).
Исследование КОС крови выявляет наличие некомпенсированного респираторного или респираторно-метаболического ацидоза и снижение напряжения кислорода (гипоксемия). Клинический анализ крови в первые часы жизни характерных особенностей не имеет.
Дифференциальная диагностика: транзиторное тахипноэ новорожденных, пневмония, синдром аспирации околоплодных вод.
Оценка тяжести СДР
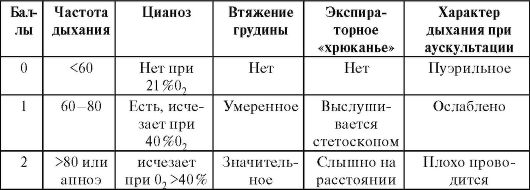
Примечание. Оценка 3-4 балла соответствует легкой степени тяжести СДР; 5-6 баллов - средней тяжести; более 6 баллов - тяжелому СДР.
Лечение
1. Обеспечение адекватного температурного режима, влажности и охранительного режима.
2. Мониторинг состояния жизненно важных функций (регистрация частоты сердечных сокращений, дыхания, артериального давления, насыщения крови кислородом).
3. Устранение дефицита сурфактанта путем введения препаратов сурфактанта: «Сурфактант HL», (Россия); «Сурфактант BL» (Биосурф, Россия); Куросурф (Chiesi Farmactutici Parma, Италия); Экзосурф неонатал (Glaxo Wellcome, Великобритания).
4. Оксигенотерапия с целью поддержания рО2 артериальной крови на уровне 50-80 мм рт. ст. путем создания постоянного положительного давления в дыхательных путях при спонтанном дыхании через носовые канюли или интубационную трубку при проведении ИВЛ.
5. Терапия, направленная на поддержание водно-электролитного баланса, коррекцию ацидоза, восполнение энергетических затрат организма. При наличии гиповолемии и артериальной гипотонии наряду с восполнением объема жидкости назначаются кардиотонические препараты (допамин, добутамин).
6. Антибактериальная терапия.
7. По мере улучшения состояния ребенка раннее начало энтерального питания.
Осложнения СДР
В остром периоде: интерстициальная эмфизема легких, пневмоторакс, пневмомедиастинум, функционирующий открытый артери- альный проток, внутрижелудочковые кровоизлияния, бактериальная инфекция. Отдаленные последствия: бронхолегочная дисплазия (5-30 % выживших), ретинопатия недоношенных, задержка психомоторного развития.
Летальность при СДР составляет в России 10-15 %.
ГЕМОЛИТИЧЕСКАЯ БОЛЕЗНЬ НОВОРОЖДЕННЫХ
Гемолитическая болезнь плода и новорожденного (ГБН) - форма патологии, обусловленная иммунологической несовместимостью крови матери и плода по различным эритроцитарным антигенам.
Шифр МКБ-Х.
Р55 Гемолитическая болезнь плода и новорожденного. Р55.0 Резус-изоиммунизация плода и новорожденного. Р55.1 АВО - изоиммунизация плода и новорожденного. Р56 Водянка плода, обусловленная изоиммунизацией. Р57.0 Ядерная желтуха, обусловленная изоиммунизацией.
Эпидемиология
В России ГБН диагностируют у 0,6 % новорожденных.
Классификация
В зависимости от формы конфликта выделяют несовместимость крови матери и ребенка по резус-фактору, по системе АВ0 и по редким факторам крови.
Клинические формы ГБН: анемическая, желтушная, отечная. По степени тяжести желтухи и анемии различают легкую, средней тяжести и тяжелую степень болезни. Осложнения ГБН: ядерная желтуха, синдром сгущения желчи.
Этиология
Конфликт возможен в случае резус-положительного (Rh+) плода у резус-отрицательной матери. При групповой несовместимости у матери преимущественно О (I) группа крови, а у плода А (II) или В (III). Значительно реже ГБН возникает при несовместимости крови
матери и плода по другим эритроцитарным антигенам. В настоящее время известно более 10 изосерологических систем эритроцитарных антигенов.
Частота ГБН вследствие несовместимости по системе АВО составляет 1:200-256 родов, возникает при нарушении барьерной функции плаценты уже при первой беременности.
Резус-фактор представлен системой антигенов (D, C, E, c, e), среди которых наиболее иммуногенным является антиген D. 85 % людей европейской расы являются Rh-положительными. Если Rh-отри- цательная женщина беременна от Rh-положительного мужчины, то плод имеет 50 % шансов быть Rh-положительным, как отец.
Групповые антигены системы АВО обнаруживаются в эритроцитах зародыша с 5-6-й недели, а резус-фактор - в 8 недель беременнос- ти. Эритроциты плода определяются в материнском кровотоке в III триместре беременности, но иммунизация при первой беременности наступает редко (примерно у 1 % резус-отрицательных женщин), чему способствует осложненное течение беременности. Наиболее часто первичный стимул к развитию изоиммунизации возникает в родах, особенно при наличии оперативных вмешательств, увеличивающих трансплацентарный переход эритроцитов плода в кровоток матери. После первой беременности резус-положительным плодом сенсибилизируется 10 % резус-отрицательных женщин.
В ответ на попадание антигена в организме матери образуются антитела, относящиеся к классу иммуноглобулинов М, G, A. На основании различия серологических свойств их делят на «полные» (IgM), агглютинины и «неполные» (IgG и IgA). IgG-антитела обладают меньшей молекулярной массой, чем «полные» антитела, и поэтому легко проникают через плаценту, являясь основной причиной развития у плода гемолитической болезни.
Патогенез
При проникновении материнских антител в организм плода происходит их связывание с содержащими антиген эритроцитами, что ведет к их гемолизу. В результате развивающейся анемии активируются компенсаторные механизмы, направленные на увеличение продукции эритроцитов. Стимулируется образование молодых форм эритроцитов в костном мозгу, возникают очаги экстрамедуллярного кроветворения в печени и селезенке, формируется гепатоспленомегалия. Преобладание процесса гемолиза эритроци-
тов над гемопоэзом ведет к развитию у плода анемии и гипоксии. В результате гемолиза эритроцитов происходит избыточное образование непрямого билирубина, выделение которого до определенного предела осуществляется через организм матери. При избыточном накоплении билирубина проявляется его токсичность, что ведет к нарушению тканевого метаболизма, функции печени, особенно синтеза белков. Развиваются гипопротеинемия, гипоальбуминемия, гипертензия в портальной и пуповинной венах, увеличивается проницаемость сосудистой стенки. В результате застоя в большом круге кровообращения происходит выпотевание жидкости в ткани и полости, развивается анасарка.
Клиническая картина
Гемолитическая анемия без желтухи и водянки - наименее распространенная и наиболее легкая форма заболевания. Отмечаются бледность кожных покровов, приглушенность тонов сердца, систолический шум, тахикардия. В крови снижено количество эритроцитов и гемоглобина.
Гемолитическая анемия с желтухой - наиболее частая и тяжелая форма заболевания. Желтуха может наблюдаться уже при рождении или появляется в первые 24 ч жизни. Характерно увеличение размеров печени и селезенки, некоторая бледность кожных покровов. В тяжелых случаях может наблюдаться желтушное окрашивание околоплодных вод, первородной смазки, оболочек пуповины. При конфликте по сис- теме АВО желтуха кожных покровов появляется позже - на 2-е сутки, но интенсивность ее быстро нарастает к 3-4-му дню жизни. В крови отмечается умеренно выраженная анемия нормохромного или гиперхромного характера, ретикулоцитоз, нормобластоз, а уровень непрямого билирубина превышает 51 мкмоль/л. Тяжесть развивающегося заболевания зависит от скорости гемолиза эритроцитов, накопления билирубина, скорости его конъюгации в печени, выведения через почки и желудочно-кишечный тракт. Интенсивность почасового прироста билирубина превышает 5,1 мкмоль/л/ч.
Гемолитическая анемия с желтухой и водянкой - наиболее тяжелая форма гемолитической болезни, при которой дети рождаются мертвыми или погибают вскоре после рождения. Наблюдаются резкая бледность кожных покровов с желтушным оттенком, общий отек, асцит, увеличение печени и селезенки, гемодинамические нарушения. Часто развиваются дыхательные расстройства и геморраги-
ческий синдром. В крови выявляют резкую анемию, нормобластоз, эритробластоз, гипопротеинемию, гипербилирубинемию.
Тяжесть гемолитической болезни определяют по выраженности основных симптомов при рождении (желтухи, анемии, увеличения размеров печени и селезенки, отека) и темпа их нарастания в последующие часы жизни ребенка. Тяжесть ГБН обусловлена степенью недоношенности ребенка, что определяет прогноз для жизни и развития осложнений. Наиболее тяжелое осложнение - ядерная желтуха - возникает в результате поражения ядерных образований ствола головного мозга, мозжечка хорошо растворимым в липидах клеточных мембран непрямым билирубином. Первые симптомы билирубиновой интоксикации: снижение активности сосания вплоть до полного исчезновения сосательного рефлекса, появление приступов апноэ, повышение температуры, вялость, развитие судорожного синдрома.
Диагностика гемолитической болезни
1. Оценка данных анамнеза матери (резус-отрицательная принадлежность крови, группа крови О (I), наличие в крови антител, указания на гемолитическую болезнь у ранее родившихся детей, выкидыши, мертворождения).
2. При физикальном обследовании новорожденного выявление клинических признаков гемолитической болезни и наблюдение за динамикой их нарастания.
3. Определение группы крови ребенка и резус-фактора, а также уровня билирубина в пуповинной крови. Постановка прямой и непрямой реакции Кумбса. При необходимости проведение дополнительных исследований для выявления несовместимости крови матери и ребенка по редким факторам.
4. Определение величины почасового прироста билирубина.
5. Оценка клинического анализа крови (количество эритроцитов, уровень гемоглобина, гематокрита, наличие нормобластоза и эритробластоза).
Лечение гемолитической болезни
В антенатальный период жизни ребенка лечебные мероприятия направлены на снижение степени гемолиза эритроцитов и профи- лактику развития тяжелой анемии. Используют лечебно-профилактические неинвазивные методы лечения (десенсибилизирующая терапия антигенами, плазмаферез, лимфоцитоиммунотерапия, про-
филактика плацентарной недостаточности). При выраженной сенсибилизации беременной и при определении у плода тяжелой формы гемолитической болезни используют инвазивный метод терапии - проводят внутрисосудистое переливание крови плоду.
После рождения ребенка основная цель - не допустить токсических концентраций непрямого билирубина в крови, чтобы избежать ядерной желтухи, приводящей к инвалидности. Используют следующие методы лечения непрямой гипербилирубинемии: 1) заменное переливание крови, при котором происходит выведение билирубина и антител; 2) фототерапию, направленную на превращение непрямого билирубина в водорастворимый фотоизомер люмирубин, не оказывающий нейротоксического действия; 3) внутривенное введение стандартных иммуноглобулинов, что способствует блокированию Fc-рецепторов клеток ретикулоэндотелиальной системы и торможению дальнейшего гемолиза эритроцитов; 4) применение сорбентов для связывания билирубина в желудочно-кишечном тракте.
Прогноз
Прогноз благоприятный при своевременном эффективном лечении. При развитии ядерной желтухи возможна смерть ребенка или формирование детского церебрального паралича. При тяжелой отечной форме прогноз неблагоприятный для жизни и последующего развития ребенка.
Профилактика резус-сенсибилизации
В женской консультации при взятии на учет беременных обязательно определение группы крови и резус-принадлежности. При резус-отрицательной крови у беременной и резус-положительной крови у ее мужа необходимо определить наличие у нее антител. При отсутствии антител повторный скрининг производят в 24 и 28 нед беременности. При отсутствии антител в 28 нед проводят профилактику резус-сенсибилизации с назначением анти-D иммуноглобулина. После родов (не позднее 72 ч) анти-D иммуноглобулин вводят в случае рождения резус-положительного ребенка. Необходимо введение анти-D иммуноглобулина всем резус-отрицательным несенсибилизированным женщинам после абортов и выкидышей на малом сроке беременности, при инвазивных процедурах во время беременности, при отслойках плаценты.
Глава 3
Внутриутробные инфекции
Внутриутробные инфекции - это инфекционные заболевания новорожденных детей, заражение которых произошло до рождения в результате проникновении возбудителя из организма матери. Срок беремен- ности, при котором это случилось, в значительной мере определяет характер инфекционного процесса. Так, при заражении в эмбриональном периоде формируются пороки развития или возникает гибель эмбриона. Инфекционные процессы в раннем фетальном периоде (4-6-й месяцы беременности) могут выражаться в нарушении нормального развития функциональных систем организма, главным образом ЦНС. При заражении после 27-й недели беременности инфекционное заболевание плода сопровождается такими же воспалительными реакциями и клиническими симптомами, какие наблюдаются у новорожденных. Исход инфекционных заболеваний в антенатальном периоде может быть различным: плод может погибнуть до рождения, рождаться больным или иметь при рождении остаточные явления болезни. Заражение плода может происходить и во время рождения контактным путем, а также путем аспирации и заглатывания инфицированной слизи родового канала или инфицированных околоплодных вод. При интранатальном заражении первые признаки заболевания могут появляться у ребенка в разные сроки после рождения (от нескольких часов до нескольких дней), что зависит от вирулентности возбудителя, массивности инфицирования и состояния плода к моменту рождения.
Пути передачи инфекции плоду
1. Трансплацентарный путь - непосредственное поступление возбудителя из крови матери в кровь плода или первичное поражение плаценты с последующим инфицированием околоплодных оболочек, пупочного канатика и околоплодных вод.
2. Восходящий путь - инфекционный агент поступает из вагинального канала или шейки матки, тогда воспалительные очаги у плода обнаруживаются чаще всего в легких и в желудочно-кишечном тракте в результате аспирации и заглатывания инфицированных околоплодных вод.
3. Проникновение возбудителя инфекции из брюшной полости матери по маточным трубам с поражением прилегающих к ним участков околоплодных оболочек и последующим инфицированием околоплодных вод.
На пути проникновения инфекционного агента из организма матери к плоду имеются защитные барьеры: плацента и иммунная система плода, эффективная защита которой зависит от гестационного возраста ребенка.
Любые возбудители острой или хронической инфекции матери способны вызвать внутриутробную инфекцию у ребенка - это виру- сы, бактерии, микоплазмы, хламидии, простейшие, грибы и др.
В МКБ-Х внутриутробные инфекции представлены по этиологическому принципу в классе XVI «Отдельные состояния, возникающие в перинатальном периоде» в блоках Р35-Р39 «Инфекционные болезни, специфичные для перинатального периода».
Инфекционные болезни, специфичные для перинатального периода (Р35 - Р39).
Р35 Врожденные вирусные болезни. Р35.0 Синдром врожденной краснухи. Р35.1 Врожденная цитомегаловирусная инфекция. Р35.2 Врожденная инфекция, вызванная вирусом простого герпеса (Herpes simplex).
Р35.8 Другие врожденные вирусные инфекции.
Р35.9 Врожденная вирусная болезнь неуточненная.
Р37 Другие врожденные инфекционные и паразитарные болезни.
Р37.0 Врожденный туберкулез.
Р37.1 Врожденный токсоплазмоз.
Р37.2 Неонатальный (диссеминированный) листериоз. Р37.3 Врожденная малярия, вызванная Plasmodium falciparum. Р37.4 Другая врожденная малярия.
Р39 Другие инфекционные болезни, специфичные для перинатального периода.
ВНУТРИУТРОБНЫЕ ВИРУСНЫЕ ИНФЕКЦИИ
Врожденная краснуха - Р35.0
PHK-содержащий вирус, относящийся к семейству Togaviridae, роду Rudivirus.
Инфицирование плода происходит при первичной инфекции во время беременности, так как ранее перенесенное заболевание остав- ляет стойкий иммунитет. Риск внутриутробного заражения вирусом краснухи в первые 2 нед беременности приближается к 100 %, но по мере увеличения срока беременности он снижается и составляет 30 % в 16-20 нед.
Классическая триада при заражении плода в I триместре беременности: врожденный порок сердца, поражение глаз (катаракта, глаукома, хориоретинит), нарушение слуха вследствие поражения слухового нерва. При более позднем заражении: ЗВУР, неврологические расстройства вследствие поражения ЦНС (менингоэнцефалит), анемия, тромбоцитопения, желтуха, множественные геморрагии.
Диагностика заключается в выделении вируса из мочи и фарингеального секрета и выявлении в крови низкоавидных противокраснушных антител IgG. Лечение симптоматическое, так как специфической антивирусной химиотерапии не существует. Больные дети нуждаются в изоляции, поскольку длительно выделяют вирус. Профилактика заключается в использовании профилактических прививок против краснухи. Беременным рекомендуют избегать контактов с детьми, больными краснухой, и лицами, общающимися с ними.
Герпетическая инфекция - Р35.2
ДНК-содержащий вирус семейства Herpesviridae.
Заболевание новорожденных вызывают, как правило, вирусы простого герпеса (ВПГ) 1- и 2-го типов, относящиеся к подсемейству Alphaherpesvirinae. Вирус герпеса обладает высокой нейротропностью.
Частота неонатального герпеса - 1 случай на 7500 родов. Заражение плода происходит в результате впервые возникшей у беременной инфекции, реже при обострении хронической инфекции. 30-40 % детей инфицируются при прохождении через родовые пути при наличии у матери проявлений генитального герпеса. При первичном заболевании матери в I триместре беременности вирус, проникая к плоду гематогенным путем, может привести к формированию пороков развития (микроцефалия, микрофтальмия, кальцификаты в ткани мозга). Герпетическая инфекция в более поздние сроки беременности ведет к мертворождению, а при заражении непосредственно перед родами или во время родов у детей наблюдается острое (генерализованная или локальная формы) или латентное течение инфекции.
Первые симптомы герпетической инфекции имеются уже при рождении или появляются на первой неделе жизни. Ребенок ста- новится вялым, плохо сосет. У него повышается температура тела, появляются одышка, тахикардия, желтуха. Иногда наблюдаются рвота и жидкий стул с примесью крови. Имеются симптомы поражения ЦНС (судороги, опистотонус) - менингоэнцефалит, энцефалит. Летальность составляет 80 %. У выживших детей развиваются микроцефалия, гидроцефалия, умственная отсталость и поражение глаз (хориоретинит, катаракта, слепота).
При локализованных формах герпетической инфекции возможны поражения кожи в виде везикулезной эритемы и заболевания глаз в виде конъюнктивита, кератоконъюнктивита, хориоретинита, кератита.
Латентное течение инфекции в раннем неонатальном периоде возможно у доношенных детей, что таит опасность формирова- ния хронической вялотекущей инфекции с постепенным развитием неврологических расстройств.
Диагностика внутриутробной герпетической инфекции осуществляется на основании клинической картины заболевания, дан- ных анамнеза матери и результатов лабораторных исследований. Используют следующие методы: 1) исследование содержимого везикул или соскоба с эрозированных участков кожи прямым иммунофлюоресцентным методом для обнаружения антигена вируса простого герпеса; 2) обнаружение генома вируса в крови и ликворе методом полимеразной цепной реакции (ПЦР).
Лечение противовирусное, проводится ацикловиром. Согласно рекомендациям Российской ассоциации специалистов перинатальной медицины (2002), при изолированном поражении кожи ацикловир применяют в дозе 45 мг/кг/сут в течение 10 дней. При генерализованной форме инфекции дозу ацикловира увеличивают до 60 мг/кг/сут. Длительность лечения составляет 14-21 день. При офтальмогерпесе используют содержащую ацикловир глазную мазь.
Профилактика осуществляется путем выявления беременных высокого риска вертикальной передачи инфекции, их лечения и выбора наиболее оптимального метода родоразрешения.
Цитомегаловирусная инфекция (ЦМВИ) - Р35.1
Возбудитель Cytomegalovirus hominis - ДНК-содержащий вирус семейства Herpesviridae, подсемейства Betaherpesviriaae.
Вирус цитомегалии широко распространен среди людей, поэтому число серопозитивных женщин детородного возраста достигает 90 %. Свойственные беременности изменения системы иммунитета могут способствовать реактивации персистирующей инфекции и атенатальному или интранатальному заражению плода. Однако наибольший риск внутриутробного инфицирования плода и развития тяжелых форм заболевания отмечается в случае первичного заболевания беременной ЦМВИ. Частота ЦМВИ у новорожденных составляет 0,2-2,5 %.
Проникая в клетку, в ее ядро, вирус цитомегалии начинает активно реплицироваться. При этом ядро увеличивается в размерах, в нем определяются включения, клетка гипертрофируется и приобретает типичный для цитомегалии признак - «совиный глаз». Своеобразные гигантские клетки локализуются главным образом в эпителиальной ткани различных органов, в первую очередь в протоках околоушной и других слюнных желез, а в тяжелых случаях - в печени, селезенке, легких, почках, поджелудочной железе, мозге.
При инфицировании плода цитомегаловирусом, так же как и при других вирусных инфекциях, проявления ЦМВИ зависят от срока беременности - инфекционные бластопатии, эмбриопатии, фетопатии.
У новорожденных наблюдается генерализованная форма инфекции или бессимптомное ее течение. Клинические признаки ЦМВИ: ЗВУР, микроцефалия, гепатоспленомегалия, желтуха, петехиальная сыпь и тромбоцитопения, хориоретинит, симптомы поражения ЦНС (беспокойство, тремор, судороги или, напротив, синдром глубокого угнетения функций), по данным УЗИ мозга выявляются гиперэхогенность перивентрикулярных зон, нередко наблюдается картина интерстициальной пневмонии.
Протекающая в раннем неонатальном периоде бессимптомно ЦМВИ у некоторых детей (5-17 %) может приводить к формированию в дальнейшем воспалительно-дегенеративного процесса в головном мозгу и являться одной из причин церебральной патологии в детском возрасте (сенсорная глухота, задержка психомоторного развития, минимальные мозговые дисфункции и т. д.).
Диагностика внутриутробной ЦМВИ осуществляется на основании данных анамнеза матери, клинической картины заболевания и результатов лабораторных исследований. Используют следующие методы: 1) обнаружение генома вируса в крови и ликворе при помощи ДНК- гибридизации и полимеразной цепной реакции (ПЦР), что достоверно указывает на клинически значимую активность репликации ЦМВ;
2) серологическое обследование - выявление в крови с помощью иммуноферментного анализа специфических IgG-антител, низкая авидность которых свидетельствует об активности процесса. На это указывает и выявление специфических IgM антител или 4-кратное нарастание титров анти-ЦМВ-IgG-антител в парных сыворотках при обследовании ребенка в динамике через 3-4 нед. Однако если титры анти-ЦМВ-IgG-антител при рождении равны материнским, а при повторном исследовании снижаются в 1,5-2 раза, то определяемые у ребенка антитела являются материнскими и поэтому не могут служить диагностически значимым признаком ЦМВИ у ребенка.
Лечение ЦМВИ у новорожденных проводится специфическим гипериммунным антицитомегаловирусным иммуноглобулином - НеоЦитотектом. Действие препарата основано на нейтрализации внеклеточно расположенных вирусов содержащимися в препарате анти- ЦМВ-IgG-антителами, что предотвращает инфицирование вирусом непораженных клеток и тем самым сдерживает распространение ЦМВ в организме. Проводятся исследования эффективности лечения внутриутробной ЦМВИ препаратами α-интерферонов. Вскармливание больного ребенка материнским непастеризованным молоком, содержащим анти-ЦМВ-антитела, препятствует активной репликации вируса и способствует развитию бессимптомной формы заболевания.
Дети с внутриутробной ЦМВИ могут являться источником заражения окружающих, поэтому не рекомендуется допускать к уходу за ними беременных.
Аденовирусная инфекция
Аденовирусы, ДНК-содержащие вирусы, составляют многочисленную группу, включающую 32 серологических типа, из которых внутриутробное заражение плода вызывают чаще вирусы типов 3 и 7. Аденовирусная инфекция у человека может протекать в латентной форме, с длительной персистенцией вируса в миндалинах и аденоидах. Если во время беременности происходит обострение инфекции, то может возникнуть заражение плода. Поскольку аденовирусы обладают цитопатическим действием, способствуя формированию внут- риядерных включений, изменению хромосомного аппарата клетки и угнетению процесса клеточного деления, то они могут вызвать у эмбриона аномалии развития.
У беременных инфекция чаще всего протекает в виде катара верхних дыхательных путей. Течение патологического процесса у плода
зависит от времени внутриутробного заражения, степени инфицированности и состояния плода. При тяжелом заболевании плод погибает до рождения или рождается в состоянии асфиксии. Аденовирусная инфекция у новорожденного проявляется в виде пневмонии, которая диагностируется уже при рождении или быстро развивается в первые часы жизни, протекает, как правило, тяжело с выраженными явлениями интоксикации и повышенной температурой. Для аденовирусной инфекции характерно поражение конъюнктивы глаз. При тяжелой генерализованной инфекции могут появляться пленчатые конъюнк- тивиты, симптомы поражения ЦНС типа энцефалита и диспептические расстройства. У выживших детей длительно сохраняется персистенция вируса.
Диагностика основывается на данных клинической картины заболевания (пневмония с поражением глаз) в сопоставлении с анамнезом матери и результатами исследования крови и ликвора с целью обнаружения вирусной ДНК.
Этиотропное лечение отсутствует, проводятся симптоматическая терапия и профилактика вторичной инфекции.
Гриппозная инфекция
Вирусы гриппа (А, В, С) содержат РНК, отличаются коротким циклом репродукции. Для них не характерно цитопатическое действие.
В периоды эпидемии гриппа среди населения не отмечено явного соответствия между частотой этой инфекции у беременных и частотой внутриутробной инфекции у плодов и новорожденных. Внутриутробное заражение плода вирусом гриппа незадолго до рождения вызывает чаще всего развитие пневмонии, которая может иметь геморрагический характер и осложняться отеком легких. У недоношенных детей инфекция носит генерализованный характер с поражением ЦНС и геморрагическим синдромом. Характерным морфологическим признаком гриппозной пневмонии у новорожденных является выраженная пролиферация бронхиального эпителия.
Этиотропное лечение отсутствует, проводятся симптоматическая терапия и профилактика вторичной инфекции.
Энтеровирусные инфекции
В группу энтеровирусов объединены вирусы Коксаки, ЕСНО (каждая группа содержит более 30 серологических типов) и полиомиелита.
Чаще плод поражается вирусами Коксаки В2, В3, В4 и А6, которые обладают цитопатическим действием и тератогенным эффектом.
Внутриутробная инфекция, вызванная вирусами Коксаки, у новорожденных протекает в виде миокардита, менингоэнцефалита и гепатита. Признаки заболевания могут быть при рождении или появляются в первые дни жизни.
Наряду с тяжелыми генерализованными формами инфекции, дающими высокую летальность, наблюдается субклиническое течение заболевания, которое в большинстве случаев диагностируются как затрудненная постнатальная адаптация. Клинически выраженная инфекция, вызванная вирусами ЕСНО, у новорожденных не наблюдается.
Этиотропное лечение отсутствует, проводятся симптоматическая терапия и профилактика вторичной инфекции.
Вирусный гепатит
Инфицирование новорожденных от HBgAg-положительных матерей происходит так же, как при другой вирусной инфекции. Поэтому проводится скрининг на HBSAg всех беременных, при рано появля- ющейся и упорно прогрессирующей желтухе у новорожденных. Если исключен иммунологический ее генез, следует подумать о врожденном гепатите, для которого характерно повышение активности АЛТ и АСТ, появление в крови высокой фракции прямого билирубина, умеренное обесцвечивание стула. Увеличиваются размеры печени и селезенки, ухудшается общее состояние ребенка, появляются сры- гивания, а при тяжелом течении заболевания - геморрагический синдром. Большинство детей с врожденным гепатитом выживают, но сохраняется носительство HBSAg, что представляет риск развития гепатоцеллюлярного рака. В раннем неонатальном периоде жизни ребенка возможно и бессимптомное течение заболевания.
Диагностика основана на обнаружении специфических антигена и антител.
Лечение врожденного вирусного гепатита симптоматическое, возможно использование специфического иммуноглобулина против гепатита В.
Профилактика гепатита В. Согласно рекомендациям Российской ассоциации специалистов перинатальной медицины новорожден- ным, матери которых являются носителями вируса гепатита В, проводится вакцинация в первые 12 ч жизни. В тех случаях, когда
новорожденный из-за тяжести состояния не может быть своевременно вакцинирован, показано однократное введение специфического иммуноглобулина против гепатита В с обязательной активной иммунизацией сразу после стабилизации состояния.
Новорожденные, получившие специфический иммуноглобулин против гепатита В или вакцину, должны в течение 1,5 лет наблю- даться педиатром и инфекционистом.
Внутриутробные бактериальные инфекции
Заболевания плода могут вызывать различные патогенные и условно-патогенные бактерии, среди которых ведущее место занимают стрептококки, листерии и кишечная палочка, вызывающие у беременной острые и хронические воспалительные процессы (тонзиллит, холецистит, пиелонефрит, цистит, эндоцервицит).
Стрептококковая инфекция
Частота внутриутробной стрептококковой инфекции составляет 1 случай на 1500-2000 живорожденных.
Стрептококки группы А часто вызывают у человека различные острые и хронические воспалительные процессы в верхних дыхательных путях. Стрептококков группы В находят во влагалищной флоре, в моче, причем они могут быть причиной послеродовых заболеваний. Стрептококки группы Д - обычные сапрофиты кишечного тракта человека, но могут вызывать воспалительные процессы в желчных и мочевых путях. Поэтому инфицирование ребенка может произойти при обострении хронической инфекции матери, стойкой бактериурии, длительном безводном промежутке в родах.
Генерализованная инфекция протекает с поражением легких (пневмония), мозга (менингит, менингоэнцефалит), мочевыводящих путей (пиелонефрит), сердца (миокардит), желудочно-кишечного тракта (гастропатия). Развитие клинической картины заболевания, вызванного стрептококком В, часто идет по типу персистирующей фетальной гипертензии или болезни гиалиновых мембран легких, так как стрептококк В поражает альвеолярные пневмоциты и эндотелиальные клетки капилляров и тем самым подавляет образование легочного сурфактанта. Характерны увеличение размеров печени и селезенки, геморрагические проявления, при исследовании крови - лейкоцитоз нейтрофильного характера, сдвиг лейкоцитарной формулы влево, тромбоцитопения.
Диагностика проводится с учетом анамнеза матери и результатов микробиологического обследования пары мать-ребенок.
Этиотропное лечение начинают с антибиотиков пенициллинового ряда, а далее с учетом чувствительности к антибиотикам выделенного возбудителя. Проводится иммунокорригирующая и симптоматическая терапия.
Профилактика заключается в санации хронических очагов инфекции у женщины на этапе планирования семьи и во время беременности.
Коли-бактериальная инфекция
Заражение плода кишечной палочкой происходит главным образом восходящим путем, что связано с частым присутствием микроба в вагинальной флоре у беременных, выделением микроба с мочой при пиелонефрите. При острых пиелитах и пиелоциститах у беременных иногда возникает бактериемия, и тогда кишечная палочка может вызвать в плаценте образование очагов воспаления и инфицирование околоплодных вод.
Заболевание плода чаще вызывается гемолизирующими штаммами Escherichia coli. Тяжесть течения внутриутробной инфекции зависит от массивности инфицирования ребенка и его гестационного возраста. У недоношенных детей могут наблюдаться менингиты и менингоэнцефалиты, тяжелое течение пневмонии. У доношенных детей наблюдаются более легкие формы заболевания: субфебрилитет, медленное рубцевание пупочной ранки, вялость, желтуха.
Диагностика проводится с учетом анамнеза матери и результатов микробиологического обследования пары мать-ребенок.
Этиотропное лечение начинают с использования аминогликозидов, а далее с учетом чувствительности к антибиотикам выделенного возбудителя. Проводится иммунокорригирующая и симптоматическая терапия.
Профилактика заключается в санации хронических очагов инфекции у женщины на этапе планирования семьи.
Листериоз
Заболевание вызывается грамположительной палочкой из семейства коринобактерий, выделены 4 серотипа листерий. Человек заражается при контакте с инфицированными животными или при употреблении зараженной пищи или воды. Листериоз беременных и
новорожденных - наиболее частая форма инфекции у человека (75 % от всех случаев заболевания). Листериозная инфекция у женщин может протекать без манифестации или с картиной хронического пиелоцистита, эндоцервицита. Обострение, возникшее во время беременности, протекает с лихорадкой, ознобом, головной болью, болями в области поясницы и катаральными явлениями, поэтому часто расценивается как вирусная инфекция. Заражение плода происходит гематогенным, трансплацентарным или восходящим путем. При этом внутриутробный плод становится источником массивного поступления листерий в организм матери. В результате происходит преждевременное прерывание беременности, смерть плода до рождения или рождение в состоянии тяжелой асфиксии. После рождения плода температура у матери быстро снижается. У ребенка вслед за бактериемией возникает септический процесс, заканчивающийся появлением в различных органах и тканях милиарных бактериально-токсических некрозов и пролиферативно-клеточных гранулем, наличие которых в органах умершего ребенка становится достоверным подтверждением диагноза заболевания.
Клиническая картина тяжелой листериозной инфекции у новорожденных не имеет специфических черт. Наблюдаются нарушения дыхания и сердечно-сосудистой деятельности, срыгивания, неврологические симптомы (гипервозбудимость или синдром угнетения ЦНС), увеличение размеров печени и особенно селезенки. У доношенных детей может иметь место повышение температуры тела, а у недоношенных - гипотермия. Обращают на себя внимание анемия и появление мелкоузелковой или мелкорозеолезной сыпи на коже живота, спины, конечностей, реже - на лице. Сыпь иногда принимает геморрагический характер. Летальность при генерализованной форме инфекции составляет 80 %, более благоприятный прогноз может быть при локализованных формах листериозной инфекции.
Диагноз листериоза подтверждают обнаружением возбудителя в крови, в моче, в меконии, в ликворе (посев на питательные среды).
Лечение включает антибиотики пенициллинового ряда в сочетании с симптоматическими средствами и иммуномодулирующей терапией.
Профилактика заключается в проведении ветеринарного и санитарно-гигиенического контроля при подозрении на листериозную инфекцию, а также в профилактическом лечении беременных при подозрении на листериоз.
Токсоплазмоз
Toxoplasma gondii - внутриклеточный паразит из класса Sporozoa, основным хозяином которого являются представители семейства кошачьих, в клетках кишечника которых происходит половое размножение паразита с образованием ооцист. Последние после созревания в земле попадают алиментарным путем в кишечник промежуточных хозяев - различных млекопитающих и человека. Токсоплазмы, попадая в организм, проникают в клетки различных органов, где, размножаясь, образуют псевдоцисты и цисты, окруженные оболочкой с отло- женными вокруг них солями кальция. Цисты токсоплазм чаще всего встречаются в головном мозгу, в ткани сердца, матки, глаз, легких.
Токсоплазмоз у новорожденных встречается только в тех случаях, когда женщина заболела во время беременности или менее чем за неделю до ее наступления. Риск трансплацентарной передачи инфекции возрастает от 17 % в первую треть беременности до 75 % в последнюю треть. Инфицируется 1 из 1000 плодов.
Клинические проявления внутриутробного токсоплазмоза в значительной мере определяются сроком заражения плода. Если заражение произошло в последнюю треть беременности, ребенок рождается в стадии генерализации процесса, и заболевание протекает с клинической картиной сепсиса. При более раннем заражении период генерализации инфекции у плода завершается внутриутробно, и после рождения преобладают симптомы энцефалита или уже имеются необратимые изменения со стороны ЦНС.
При токсоплазмозе у плода развивается некротический менингоэнцефалит: имеются милиарные гранулы в головном и спинном мозгу, некроз мозговой ткани, перивентрикулярные васкулиты и язвы на стенках желудочков, клеточная инфильтрация мягкой мозговой оболочки и обструкция сильвиева водопровода, мозговые кальцификаты. Клинические проявления: судороги, атония, арефлексия, нарушения терморегуляции и ритма дыхания, парезы, в более поздних стадиях процесса - микроцефалия, значительная задержка психомоторного развития.
Со стороны глаз отмечается некротический ретинохориоидит с последующим развитием атрофии зрительного нерва, псевдоколобомы, катаракты, пареза глазных мышц и микрофтальмии.
Иногда наблюдаются гепатоспленомегалия, жидкий стул, на коже - пятнистопапулезная и петехиальная сыпь, реже - желтуха с эритробластозом, интерстициальная пневмония, миокардит.
Диагноз устанавливают на основании клинических признаков и результатов лабораторных исследований. Наличие ксантохромной спинно-мозговой жидкости с белково-клеточной диссоциацией, внутримозговых кальцификатов, лейкоцитоза с атипичными лимфоцитами и эозинофилией в периферической крови существенно облегчают диагноз.
Для диагностики токсоплазмоза используют ИФА, с помощью которого выявляют специфические IgM.
Этиотропное лечение токсоплазмоза проводят не только при наличии клинических проявлений инфекции, но и при их отсутствии, при этом должна быть установлена острая инфекция у матери. Рекомендуется применение препаратов пириметамина (тиндурин, дараприм, хлоридин) в комбинации с сульфаниламидами. На втором месте по эффективности стоят макролиды, но их преимущество заключается в меньшей токсичности для новорожденных (сумамед, вильпрафен).
Профилактика врожденного токсоплазмоза сводится к лечению беременной при выявлении у нее острого токсоплазмоза.
Хламидиоз
Хламидии - облигатные внутриклеточные микроорганизмы порядка Chlamydiales, широко распространены в природе и практически выявлены у всех обследованных видов млекопитающих и птиц. Среди многочисленных видов хламидий, относящихся к семейству Chlamydiaceae и входящих в род Chlamydia и род Chlamydophila, первичными патогенами человека являются Ch. trachomatis и Ch. рneumoniae
Заболеваемость хламидийной инфекцией у детей тесно связана с таковой в популяции взрослых, у которых хламидиоз, вызванный Ch. trachomatis, является самым распространенным среди болезней, передаваемых половым путем. Частота инфекции у беременных колеблется от 10 до 40 % в зависимости от контингента обследованных. Все это определяет высокий риск инфицирования новорожденных, частота которого составляет 70 % при отсутствии лечения инфекции во время беременности и 12-14 % при ее лечении макролидами. Хламидийная инфекция, вызванная Ch. fneumoniae, является причиной вспышек респираторных заболеваний у взрослых в осенне-зимнее время.
Хламидии размножаются только внутри клеток организма хозяина, поэтому их присутствие в клинических пробах всегда оценивается как наличие инфекционного процесса. Инфекционная форма
хламидий - элементарное тельце (ЭТ), адаптировано к внеклеточному существованию, метаболически малоактивно. Клетка захватывает путем эндоцитоза не одно ЭТ, в результате чего в ее цитоплазме может оказаться несколько микроколоний хламидий. Через 4-6 часов после заражения хламидии реорганизуются через промежуточные тельца в вегетативные репродуцирующиеся неинфекционные формы - ретикулярные тельца (РТ). Последние вступают в клеточный цикл, делятся бинарно (всего 8-12 циклов), дочерние РТ преобразуются в промежуточные тельца и далее вновь в элементарные тельца - инфекционные формы нового поколения. Полный цикл развития занимает 48-72 часа, обычно завершается разрывом мембраны включения, выходом новых ЭТ во внеклеточную среду и инфицированием других клеток хозяина.
Цикл может тормозиться под влиянием традиционных трансформирующих агентов (например, при использовании антибиотиков - пенициллинов или цефалоспоринов), а также при неблагоприятных условиях на этапе функционирования РТ. В результате образуются L-подобные и аномальные формы хламидий с дефектами клеточной стенки, которые могут при делении клетки передаваться дочерним клеткам, что ведет к персистенции возбудителя и хроническому течению инфекции. При изменении условий окружающей среды (иммунные факторы, гормональные изменения в организме хозяина, воздействия факторов профессиональной вредности) возобновляется нормальная структура хламидий, что ведет к продолжению цикла их развития и активации инфекционного процесса. Таким образом, попадая в организм и размножаясь, хламидии одновременно могут существовать на различных стадиях развития, в том числе и в виде персистирующих форм, способных превращаться в любое время в нормальные формы репродуктивного цикла.
Источником внутриутробного хламидиоза, вызванного Ch. trachomatis и Ch. рneumoniae, является мать, перенесшая во время беременности острую форму инфекции или имеющая хроническую персистирующую хламидийную инфекцию. Инфицирование ребенка происходит антенатально или во время родов, что зависит от локализации и выраженности хламидийного воспалительного процесса. В большинстве случаев наблюдается вертикальная передача возбудителя, который попадает на слизистые оболочки конъюнктивы, вульвы или уретры, а также верхних дыхательных путей, желудочно-кишечного тракта при заглатывании и/или аспирации инфицированных околоплодных вод. Кроме
того, заражение ребенка может произойти трансплацентарным путем, в результате которого наблюдается генерализация процесса с поражением сосудистой системы плода. Легкие страдают реже и в меньшей степени, чем мозг и сердце. Однако если это происходит, то ребенок оказывается нежизнеспособным, умирает в родах или в первые часы и дни жизни. При заглатывании и аспирации околоплодных вод чаще всего инфицируются глотка, трахея, бронхи, альвеолы.
Внутриутробная хламидийная инфекция у новорожденных имеет острое или латентное течение, что зависит от срока беременности, при котором произошло инфицирование, его массивности, степени морфофункциональной зрелости ребенка и наличия сопутствующей патологии, связанной с неблагоприятными условиями внутриутробного развития. Острая хламидийная инфекция в раннем неонатальном периоде может иметь следующие клинические формы.
1. Генерализованная инфекция с тяжелым поражением головного мозга, легких, сердца, желудочно-кишечного тракта, печени и других органов, ведущим к нарушению их функции, рождению ребенка в тяжелой асфиксии и к гибели в первые часы и дни жизни.
2. Менингоэнцефалит с неоднократно повторяющимися приступами клонико-тонических судорог и апноэ.
3. Внутриутробная пневмония.
4. Синдром дыхательных расстройств (у недоношенных детей).
5. Гастроэнтеропатия.
6. Лимфаденит.
7. Конъюнктивит.
Следует подчеркнуть, что 10-15 % инфицированных хламидиями детей имеют асимметричную форму задержки внутриутробного развития (ЗВУР). Частота интранатальной гипоксии составляет 30-40 %, а частота рождения в асфиксии в 2-3 раза выше таковой в популяции доношенных и недоношенных детей.
У инфицированных хламидиями детей уже с первых часов жизни наблюдаются неспецифические признаки заболевания, свидетель- ствующие о нарушении гемодинамики. Прежде всего появляются симптомы поражения ЦНС не только у детей, перенесших асфиксию, но и у родившихся в удовлетворительном состоянии. Наблюдаются повышенное беспокойство и реактивность, расстройство сна, изменение мышечного тонуса, угнетение физиологических рефлексов, тремор конечностей, гиперестезия кожных покровов, срыгивания. Дети склонны к быстрому охлаждению. Длительно сохраняется
локальный цианоз, «мраморность» кожных покровов. В последующие дни жизни, несмотря на проводимую терапию, нарушения функционального состояния ЦНС приобретают устойчивый характер, а в ряде случаев наблюдается нарастание неврологических симптомов. При этом у доношенных детей чаще всего преобладает синдром гипервозбудимости ЦНС, могут возникать кратковременные тонико-клонические судороги, тогда как для недоношенных детей более характерен синдром угнетения функций ЦНС, исчезновение сосательного рефлекса и появление приступов апноэ. Результаты нейросонографического исследования головного мозга указывают на наличие длительно сохраняющейся гиперэхогенности перивентрикулярных зон. У недоношенных детей возможно появление эхографических признаков внутрижелудочкового кровоизлияния и умеренно выраженной вентрикуломегалии.
Вторым проявлением внутриутробной хламидийной инфекции, идущим параллельно с симптомами со стороны ЦНС или несколько запаздывающим, является нарушение центральной гемодинамики. Это выражается в приглушенности сердечных тонов и появлении систолического шума, наиболее интенсивного ближе к основанию сердца. По данным ЭКГ имеется неполная блокада правой ножки пучка Гиса, нарушение обменных процессов в миокарде, признаки перегрузки правых отделов сердца, а на рентгенограмме органов грудной клетки - усиление прикорневого сосудистого рисунка, «влажные» легкие, вздутие легких, увеличение размеров сердца за счет правых его отделов («шаровидное сердце»). Эхокардиогарфическое исследование также выявляет нарушение гемодинамики, повышение давления в малом круге кровообращения, признаки изменения состояния эндокарда и клапанного аппарата сердца в виде повышения акустической плотности створок, пролапса митрального и трикуспидального клапанов.
Недоношенные дети с внутриутробной хламидийной инфекцией имеют раньше клинические проявления синдрома дыхательных расстройств (уже с первых часов жизни), причем, как правило, наблюдается нарушение вентиляционно-перфузионных отношений в легких, что требует подачи все возрастающих концентраций кислорода с целью поддержания оксигенации тканей хотя бы на самых низких допустимых границах. Течение заболевания осложняется длительным сохранением фетальных шунтов и нередко нарастанием сердечно-легочной недостаточности. В наиболее тяжелых случаях присоединяются геморрагические явления по типу мелены или дис-
семинированного внутрисосудистого свертывания крови. У выживших глубоко недоношенных детей в дальнейшем развивается брон- холегочная дисплазия.
У большинства инфицированных хламидиями доношенных детей дыхательные нарушения в течение первой недели жизни отсутствуют или слабо выражены, главным образом в виде затруднения носового дыхания, незначительной одышки и ослабления дыхательных шумов. Лишь у детей, аспирировавших околоплодные воды, и у недоношенных новорожденных дыхательные нарушения в клинической картине заболевания выступают на первый план: одышка, участие вспомогательной мускулатуры в акте дыхания, мелкопузырчатые хрипы в легких. Воспалительная инфильтрация в легких, чаще справа, выявляется у 60 % больных детей к концу первой, а у остальных - на 2-3-й неделе жизни.
Выраженная желтуха, являющаяся характерным симптомом для большинства внутриутробных инфекций, наблюдается преиму- щественно у недоношенных детей, у которых гипербилирубинемия нередко требует проведения заменного переливания крови.
При поражении хламидиями желудочно-кишечного тракта наблюдаются срыгивания, вздутие живота, раннее появление опрелостей при нормальном характере стула. Увеличение размеров печени и селезенки выявляется у каждого третьего ребенка.
Конъюнктивит проявляется через 3-4 дня после рождения вначале слезотечением, незначительным покраснением и отеком конъ- юнктивы, затем - появлением слизисто-гнойного отделяемого и усилением воспалительной реакции глаз.
Изменения со стороны крови при хламидийной инфекции выражаются в умеренной анемизации, длительном сохранении относительного нейтрофилеза, увеличении к 7-10-му дню жизни числа эозинофилов (>7 %) и моноцитов (>10 %). У доношенных детей на первой неделе жизни может наблюдаться повышение температуры тела до 38-39?, не связанное с максимальной потерей массы тела.
В тех случаях, когда инфицирование плода происходит вертикальным путем незадолго до родов или во время родов, заболевание у доношенных детей в раннем неонатальном периоде жизни имеет латентное течение. Клинические симптомы появляются позже, чаще всего дети начинают болеть спустя 3-6 месяцев после рождения, когда утрачивается пассивно приобретенный иммунитет.
Инфекция, вызванная Chl. fneumoniae, может иметь место во время беременности. Наиболее частые ее проявления: слабость, повышенная утомляемость, ринит или фарингит, субфебрильная температура, непродуктивный упорный кашель. При заболевании беременной может произойти трансплацентарное инфицирование плода. У новорожденных наблюдается развитие внутриутробной пневмонии. Рентгенологическое обследование выявляет усиление легочного рисунка и прикорневую инфильтрацию. Наблюдаются замедленная постнатальная перестройка гемодинамики (открытое овальное окно) и перегрузка правых отделов сердца. Длительно сохраняется гиперэхогенность перивентрикулярных зон головного мозга. В крови отмечается нарастающий тромбоцитоз (>500х103/мм3), моноцитоз (10-14 %), эозинофилия (12-18 %).
Диагностика
Диагноз внутриутробной хламидийной инфекции устанавливают на основании клинических симптомов, серологических исследова- ний, эпидемиологических данных.
При отборе детей в группу риска внутриутробного инфицирования Chl. trachomatis нужно проанализировать анамнез матери. Учитывают диагностированный ранее урогенитальный хламидиоз, аутоиммунные болезни, хронические заболевания органов дыхания, желудочно- кишечного тракта, мочевыделительной системы, а также указания на хронический аднексит, внематочную беременность, воспалительные изменения после абортов или предыдущих родов, угрозу прерывания настоящей беременности, преждевременное излитие околоплодных вод, отслойку плаценты. Наличие в анамнезе указаний на хронические заболевания верхних дыхательных путей (синусит, тонзиллит), инфекционно зависимую и аспириновую бронхиальную астму, а также перенесенные во время беременности острые респираторные заболевания позволяет заподозрить возможность инфицирования Chl. pneumonia. Множественные стигмы дизэмбриогенеза у новорожденного, задержка его внутриутробного развития, симптомы гипоксии и замедленная перестройка гемодинамики в совокупности с данными анамнеза матери являются основанием для проведения лабораторной диагностики хламидийной инфекции
Материалами для исследования служат соскобы с конъюнктивы нижнего века, задней стенки глотки и вульвы, моча и кровь. Могут быть использованы промывные воды трахеобронхиального дерева, желудка.
Методы выявления хламидий: 1) «золотой стандарт» - выявление хламидий в культуре клеток L-929, McCoy, HeLa-920; 2) обнаружение антигена хламидий в исследуемом материале с помощью специфических антител, соединенных с какой-либо меткой: прямой или непрямой иммунофлюоресцентный методы (ПИФ, НИФ), иммунопероксидазный и иммуноферментный методы (ИФА - выявление родоспецифического липополисахарида), прямая и непрямая иммунофлюоресценция; 3) метод полимеразной цепной реакции (ПЦР) - выявление возбудителя путем многократного копирования (амплификации) специфичных для хламидий последовательностей ДНК - высоко чувствителен (80-95 %) и специфичен (около 92 %); 4) серологические методы, выявляющие наличие антихламидийных антител (ИФА с определением IgA, IgM, IgG).
Этиотропное лечение в острой фазе заболевания проводят макролидами (сумамед, вильпрафен). Для лечения латентно протекающей инфекции используют комбинацию Виферона-1 с Азитромицином (Сумамед, Плива).
Профилактика внутриутробного инфицирования ребенка хламидиями включает: 1) обследование всех женщин при постановке на учет по беременности, а также супружеских пар, обращающихся в клиники планирования семьи по поводу бесплодного брака; 2) при выявлении хламидийной инфекции во время беременности обязательное лечение супружеских пар; 3) профилактику конъюнктивита путем закладывания ребенку в конъюнктивальный мешок каждого глаза 1 % тетрациклиновой или 0,5 % эритромициновой глазной мази сразу при рождении и повторно через 2 часа.
Ранняя комплексная этиопатогенетическая терапия внутриутробной хламидийной инфекции является профилактикой формиро- вания хронической персистирующей инфекции и связанных с ней заболеваний у детей старшего возраста.
Микоплазменная инфекция
Микоплазмы - самые мелкие свободноживущие микроорганизмы, лишенные клеточной стенки и выделенные в отдельный класс бактерий Mollicutes («мягкокожий»). Человек является естественным хозяином по крайней мере 10 видов микоплазм, но наибольшее значение имеют Alycoplasma pneumoniae, Alycoplasma hominis, Ureaplasma urealyticum, Alycoplasma genitalium, Alycoplasma fermentans, Alycoplasma incognitis.
Источником инфекции является человек, больной микоплазмозом, или носитель микоплазм. Передача инфекции может осу- ществляться воздушно-капельным, половым путем, от матери плоду (внутриутробно или во время родов). Микоплазмы способны персистировать, вызывая хронические инфекции. Роль A. hominis при заболеваниях мочеполового тракта, септическом аборте, послеродовой лихорадке является общепризнанной. Установлена связь A. hominis и A. genitalium с патологией беременности, заканчивающейся выкидышами и преждевременными родами мертвым плодом и пороками развития у детей. Отмечают также значительную частоту обнаружения поражений респираторного тракта плода и новорожденных, инфицированных A. hominis.
Микоплазмы занимают особое место в ряду возбудителей заболеваний урогенитального тракта человека, передаваемых половым путем. В последние годы отмечается увеличение числа беременных (до 15 %), у которых при исследовании выявляют микоплазмы и уреаплазмы. Частота инфицирования детей, родившихся у матерей, половые пути которых были колонизированы микоплазмами и/или уреаплазмами, составляет 18-30 %. Существуют гематогенный и контактный пути передачи инфекции плоду. Входными воротами инфекции чаще всего является слизистая глаз, половых органов (у девочек) и дыхательных путей. Микоплазменная инфекция у ребенка может возникать на различных стадиях внутриутробного развития и нередко является причиной спонтанных абортов и преждевременного рождения.
Внутриутробная микоплазменная инфекция не имеет характерной клинической картины. Инфицирование ребенка во время родов может вызывать конъюнктивиты (в 1-2 % случаев), кожные поражения. Значительно реже наблюдается внутриутробная пневмония, которая носит интерстициальный характер и протекает с выраженной дыхательной недостаточностью (учащенное затрудненное дыхание, цианоз). При этом отчетливые физикальные явления со стороны легких отсутствуют. Лишь позднее, при развитии альвеолярного процесса, в легких выслушиваются мелкопузырчатые хрипы. У недоношенных детей микоплазменная пневмония может развиваться на фоне гиалиновых мембран легких. Иногда внутриутробная микоплазменная инфекция принимает генерализованный характер с поражением всех внутренних органов и ЦНС (менингоэнцефалит). Температурная реакция при микоплазменной инфекции не характерна, иногда имеется высокий лейкоцитоз.
Сочетание уреаплазменной инфекции с бактериальным инфицированием приводит к летальным исходам у детей с низкой массой тела при рождении (<
Наличие внутриутробного инфицирования микоплазмами или уреаплазмами в 83 % случаев приводит к раннему (до 3 лет) началу пиелонефрита, более частым рецидивам заболевания с высокой лей- коцитурией, микрогематурией и кристаллурией. Ассоциация микоплазм способствует раннему появлению аллергии.
Диагноз микоплазменной инфекции подтверждается обнаружением возбудителя в соскобах с конъюнктивы, задней стенки глотки, в моче с помощью полимеразной цепной реакции (ПЦР), чувствитель- ность и специфичность которой 92-98 %.
Для лечения микоплазменной инфекции используют макролиды: азитромицин (сумамед), рокситромицин (рулид).
После перенесенной острой инфекции может сохраняться персистенция микоплазм. Дети, инфицированные микоплазмами, часто имеют железодефицитную анемию, экссудативный диатез, ранние пиелонефриты и склонность к частым респираторным инфекциям.
Кандидоз
Кандидоз - инфекционно-воспалительное заболевание, вызываемое дрожжеподобными грибами рода Candida, из которых при внутриутробном инфицировании детей чаще всего выявляют Candida albicans.
Частота внутриутробной кандидозной инфекции у новорожденных в последнее время имеет тенденцию к росту (до 1 % от всех случаев кандидозной инфекции у детей раннего возраста) в связи с увеличением кандидоза половых органов у беременных, что обусловлено широким использованием антибиотиков и особенностями состояния иммунитета.
Инфицирование плода грибами рода Candida происходит трансплацентарным или восходящим путем. Гематогенным путем грибы попадают в организм плода при наличии кандидозного плацентита или при генерализованном микотическом заболевании беременной, что встречается крайне редко. Чаще всего ребенок инфицируется путем заглатывания и/или аспирации инфицированных околоплодных вод, а также контактным путем при прохождении через родовые пути при наличии у матери кандидоза половых органов.
Адгезивные свойства грибов, способность их к пролиферации и токсичности в условиях несовершенства защитных реакций у ново-
рожденных при наличии физиологических особенностей строения кожи и слизистых ведут к быстрому развитию инвазивного микотического процесса.
Различают следующие формы внутриутробной кандидозной инфекции: 1) кандидоз кожи и слизистых оболочек; 2) висцеральный кандидоз; 3) генерализованный кандидоз. Кандидоз кожи характеризуется наличием инфильтрации тканей кожи, сливающихся множественных папулезных элементов с неровными краями, обрамленными белым ободком отслоившегося эпидермиса. Типичная локализация - кожа вокруг анального отверстия, внутренняя поверхность бедер и паховая область. При кандидозе слизистых видны легко снимающиеся белые творожистые налеты на фоне умеренной гиперемии.
При висцеральном кандидозе у новорожденных диагностируют пневмонию, гастрит, энтероколит, цистит, пиелонефрит, для кли- нических проявлений которых не характерно наличие выраженного инфекционного токсикоза. Генерализованная форма кандидоза протекает с вовлечением в инфекционный процесс нескольких функциональных систем организма, в том числе и ЦНС (менингит, менингоэнцефалит). В анализах крови отмечают лейкоцитоз нейтрофильного характера со сдвигом лейкоцитарной формулы влево, эозинофилия. При исследовании ликвора выявляют белково-клеточную диссоциацию (резкое повышение содержания белка при незначительном увеличении клеточности), цитоз (не более 300-500 клеток в 3 мкл) нейтрофильно-лимфоцитарного характера.
Диагностика внутриутробной кандидозной инфекции, особенно при наличии висцеральной и генерализованной форм, пред- ставляет значительные трудности. Она основывается прежде всего на данных анамнеза матери и результатов бактериологического обследования пары мать-ребенок. Материалами для исследования служат соскобы с мест поражения кожи, слизистых, моча, промывные воды желудка, ликвор. Используют выделение грибов рода Candida в активном состоянии при микроскопическом иссле- довании и в посевах материала из патологического очага, а также методом ПЦР.
Для лечения внутриутробного кандидоза используют антимикотические препараты местного и системного действия в зависимости от установленной к ним чувствительности.
Наименьшими побочными эффектами у новорожденных обладает дифлюкан - представитель нового класса триазольных соединений, фунгицидная активность которого установлена при внутривенном и оральном применении в первую очередь при заболеваниях, вызванных грибами рода Candida. Для местного лечения эффективны препараты 1 % клотримазола, относящегося к имидазольным противогрибковым препаратам (Клотримазол, Канестен, Кандид, Микроспорин, Низорал). При тяжелом течении внутриутробной грибковой инфекции используют иммунокорригирующую и симптоматическую терапию.
Профилактика внутриутробного кандидоза у новорожденных основана на: 1) лечении генитального кандидоза у женщин фер- тильного возраста; 2) активном выявлении и лечении дисбиоценоза родовых путей у беременной; 3) обработке слизистой рта 2-4 раза в сутки нистатином у детей, относящихся к группе высокого риска внутриутробного инфицирования грибами рода Candida.
Асфиксия новорожденного
Код по МКБ-Х - Р21.
Асфиксия новорожденного - патологическое терминальное состояние, связанное с нарушением механизмов адаптации при переходе от внутриутробного существования плода к внеутробному.
В основе патогенеза асфиксии новорожденного лежит нарушение гемодинамики у плода, возникающее вследствие расстройства маточно-плацентарного кровообращения. В норме сразу после рождения ребенок делает интенсивный первый вдох, что ведет к заполнению воздухом альвеолярного пространства, падению сопротивления сосудов малого круга кровообращения, возрастанию кровотока в легких и увеличению системного артериального давления. Перфузия оксигенированной крови через артериальный кровоток приводит к закрытию фетальных шунтов и ускоряет постнатальную перестройку кровообращения. Кроме того, активизируется синтез сурфактанта, который необходим для расправления легких и их нормального функционирования.
Согласно международной классификации болезней X пересмотра, следует выделять две степени тяжести асфиксии новорожденных: тяжелую и легкую или средней тяжести. С этой целью всем новорожденным проводят оценку по шкале Апгар.
Карта оценки состояния новорожденных по шкале Апгар
Тяжелая асфиксия: оценка по шкале Апгар в первую минуту жизни 0-3 балла, к пятой минуте не становится выше 6-7 баллов.
Легкая или средней тяжести асфиксия: оценка по шкале Апгар в первую минуту жизни 4-6 баллов, через 5 минут 8-10 баллов.
Асфиксии новорожденного, как правило, предшествует гипоксия плода, которая возникает в результате нарушения доставки кислорода к тканям и/или его использования в них. В соответствии с этим различают:
1) гипоксическую гипоксию, когда насыщение гемоглобина кислородом ниже нормального уровня;
2) циркуляторную гипоксию, когда кислород не поступает к тканям в достаточном количестве, несмотря на нормальное его напряжение в артериальной крови;
3) гемическую (анемическую) гипоксию при значительном уменьшении количества эритроцитов или низком содержании гемоглобина в эритроцитах, а также при снижении способности гемоглобина связывать кислород;
4) тканевую гипоксию при нарушении клеточного гомеостаза, когда клетки не в состоянии в полной мере использовать кислород.
Плод может испытывать длительную (хроническую) или кратковременную (острую) гипоксию. Причины хронической гипоксии: 1) заболевания матери и неблагоприятные условия труда (профвред- ности), ведущие к развитию у нее гипоксии; 2) осложнения беременности и связанные с ними нарушения развития плаценты и расстройства маточно-плацентарного кровообращения; 3) заболевания плода.
Причины острой гипоксии: 1) неадекватная перфузия крови к плоду из материнской части плаценты (низкое давление у матери и др); 2) отслойка плаценты; 3) пережатие пуповины; 4) истощение компенсаторно-приспособительных реакций плода и неспособность переносить изменения оксигенации, связанные с сократительной деятельностью матки даже в условиях нормального родового акта.
Факторы, способствующие рождению ребенка в асфиксии
Состояние матери: 1) возраст первородящей >30 лет; 2) гипертоническая болезнь; 3) сахарный диабет; 4) анемия (гемоглобин менее 100г/л); 5) хронические заболевания почек, урогенитального тракта; 6) гестоз; 7) аномалии прикрепления плаценты; 8) многоводие; 9) изоиммунизация; 10) многоплодная беременность; 11) отслойка плаценты и кровотечение; 12) алкогольная интоксикация; 13) употребление наркотиков и психотропных препаратов; 14) инфекционные заболевания; 15) хронические инфекции.
Условия рождения и состояние плода: 1) аномалия положения плода; 2) ягодичное предлежание плода; 3) преждевременный разрыв плодовых оболочек; 4) длительные или стремительные роды; 5) осложнения со стороны пуповины; 6) наложение щипцов или вакуум-экстрактора на головку плода; 7) введение седативных средств внутривенно за час до рождения или внутримышечно за 2 часа; 8) задержка внутриутробного развития, макросомия, переношенность, недоношенность, уродства плода; 9) гипоксия плода до родов и в родах.
Патогенез гипоксии плода и асфиксии новорожденного
Гипоксия вызывает у плода включение механизмов компенсации, направленных на поддержание адекватной оксигенации тканей: стимулируется эритропоэз (активация эритропоэтина), возрастает продукция гемсодержащих белков (гемоглобина, миоглобина, нейроглобина, цитоглобина), растет уровень фетального гемоглобина, обладающего наибольшим сродством к кислороду, увеличива-
ется образование оксида азота (NO) за счет активации ферментов NO-синтаз, повышается продукция катехоламинов, глюкокортикостероидов, вазопрессина, серотонина, мелатонина и других нейро- пептидов.
В условиях продолжающейся гипоксии происходит: 1) увеличение интенсивности маточно-плацентарного кровотока; 2) повышение сосудистого тонуса в организме плода и за счет этого сокращение значительной части сосудистого русла; 3) депонирование крови в печени, что облегчает системное кровообращение плода; 4) возрастание систолического артериального давления и центрального венозного давления; 5) увеличение сердечного выброса; 6) перераспределение крови с преимущественным снабжением мозга, сердца, надпочечников и уменьшением кровотока в легких, почках, желу- дочно-кишечном тракте и мышцах плода. Включение этих процессов обеспечивает поддержание нормальной оксигенации мозга, при этом напряжение углекислого газа и рН крови сохраняются в пределах нормы (рН > 7,25).
При длительной гипоксии плода или при дополнительном резком уменьшении поступления кислорода в его кровоток наступает второй этап реакции: 1) усиливается анаэробный гликолиз; 2) происходит мобилизация гликогена из депо (печень, сердце, почки); 3) активируются фосфолипазы. Эти процессы способствуют поддержанию энергетических процессов в тканях, особенно в головном мозгу. Кроме того, усиливается выработка простагландинов, способствующих расширению мелких капилляров и улучшению микроциркуляции. Удлинение этого периода ведет к накоплению кислых продуктов обмена, пероксинитрита, СО2, способствующих развитию тканевой гипоксии и уменьшению потребления кислорода тканями плода. Характерной чертой этого этапа является респираторный ацидоз крови (рН = 7,2-7,24).
В условиях прогрессирующей гипоксии наблюдается отхождение мекония в околоплодные воды, возникает брадикардия плода, благодаря которой увеличивается продолжительность диастолы, что, в свою очередь, способствует улучшению наполнения левого желудочка и поддержанию силы сердечных сокращений. Это позволяет на время сохранить нормальный сердечный выброс и систолическое артериальное давление. В таких условиях мозговой кровоток еще достаточен для функции мозга, хотя уже возникает перераспределение крови в мозгу с преимущественным снабжением подкорковых отделов. При
этом мощным фактором регуляции локального кровотока и микроциркуляции является усиление продукции оксида азота.
На последнем этапе адаптации к гипоксии происходит истощение компенсаторно-приспособительных реакций, что ведет к значительному снижению напряжения кислорода и возрастанию напряжения углекислого газа и к развитию метаболического ацидоза (рН < 7,2). Происходит: 1) падение сосудистого тонуса; 2) снижение системного артериального давления; 3) повышение центрального венозного давления; 4) развитие сердечной недостаточности; 5) снижение мозгового кровотока и гипоперфузия мозга; 6) нарушение метаболизма в нервной ткани.
При нарушении метаболизма в нервной ткани протекают следующие процессы:
1) нарушение синтеза простагландинов, сопровождающееся повышением содержания тромбоксана и простагландина F2a, что ведет к сужению капилляров, усилению агрегации тромбоцитов и как следствие - к нарушению микроциркуляции, тромбообразованию и ишемии ткани мозга;
2) в условиях ишемии мозга увеличивается внеклеточная концентрация возбуждающих аминокислот (глутамата, аспартата), что способствует деполяризации цитоплазмы нейронов и повышению проницаемости клеточных мембран;
3) изменяется функциональная активность АТФаз, в результате увеличивается выход из клетки калия и повышается внутриклеточное содержание натрия, следствием чего становится отек;
4) повышается концентрация внутриклеточного кальция, растет активация фосфолипаз, перекисного окисления липидов;
5) гиперпродукция оксида азота и избыточное образование пероксинитрита способствуют развитию апоптоза нервных клеток.
Развивается тяжелый необратимый метаболический ацидоз (рН < 7,0), повышение проницаемости сосудистой стенки с выходом форменных элементов в межклеточное пространство (диапедезные кровоизлияния на вскрытии), необратимые изменения нервных клеток и их гибель.
Первичную реанимацию проводят всем живорожденным детям независимо от их гестационного возраста и массы тела (>
Сразу после рождения ребенка акушерка с помощью баллончика или катетера, подключенного через тройник к электроотсосу (разрежение не более
После отсечения пуповины новорожденного быстро переносят на теплый стол, обогреваемый источником лучистого тепла, укладывают со слегка запрокинутой головой, подложив под плечи и спину свернутую пеленку.
Ребенка необходимо быстро обтереть, так как потеря тепла испарением у него очень велика, а механизм теплообразования в условиях гипоксии нарушен. У детей, подвергшихся переохлаждению, усугубляется обменный ацидоз, гипоксия и может развиться гипогликемия.
Первый этап реанимации - быстрое восстановление вентиляции, перфузии легких и сердечного выброса.
При рождении ребенка врач должен отметить: появилось ли самостоятельное дыхание, а если нет - есть ли сердцебиение? С учетом трех признаков (сердцебиение, характер дыхания и цвет кожных покровов) он должен немедленно решить вопрос о необходимости проведения реанимационных мероприятий и начать их не позже 15-20 с от момента рождения ребенка. Шкалу Апгар следует использовать для оценки их эффективности в конце 1-й и 5-й минуты. Оценку необходимо повторять (только при возникновении самостоятельного дыхания) каждые 5 мин до 20-й минуты жизни.
При появлении самостоятельных, но неадекватных дыхательных движений (судорожные вдохи типа «гаспинг» или нерегулярное, затрудненное, поверхностное дыхание) следует сразу начать ИВЛ с помощью саморасправляющегося мешка (Ambu, Penlon и др.) или системы Айра через лицевую маску. Частота дыхания - 40 в минуту, концентрация кислорода - 90-100 %, поток О2 не более
Вентиляция 100 % кислородом через маску с помощью аппарата «Penlon» или системы Айра оказывается достаточно эффективной
при рождении ребенка в асфиксии средней тяжести и легкой. При этом коррекция ацидоза происходит за счет оксигенации и снижения РСО2, что способствует расширению сосудистого русла легких.
Интубацию трахеи следует проводить немедленно: 1) при отсутствии дыхательных движений и наличии разлитого цианоза; 2) при массивной аспирации окрашенных меконием околоплодных вод, требующей санации трахеи; 3) новорожденным, гестационный возраст которых менее 28 нед даже в случае наличия у них поверхностных дыхательных движений; 4) при подозрении на диафрагмальную грыжу; 5) при неэффективной масочной ИВЛ в течение 1-2 мин.
Попытка интубации не должна превышать 30 с. Если она безуспешна, то следует в течение 1 мин провести вентиляцию через маску с помощью системы Айра и только потом предпринимать 2-ю попытку интубации. Начать искусственную вентиляцию легких по системе Айра 100 % кислородом с частотой 40-50 в 1 минуту и давлением на первых 3-6-м вдохах - 30-35, а далее 20-25 см вод. ст. при потоке кислорода 8-10 л в минуту. При синдроме массивной аспирации перед ИВЛ необходимо провести санацию трахеобронхиального дерева 2 % раствором натрия гидрокарбоната и отсосать содержимое желудка.
Интубацию и ИВЛ легких должен осуществлять специалист, лучше всех владеющий методами реанимации. Одновременно второй врач (или опытная медсестра) должен прослушать дыхательные шумы, чтобы убедиться в правильном положении эндотрахеальной трубки и хорошем газовом обмене, а также оценить частоту сердцебиений. Если ЧСС превышает 80 ударов в минуту, следует продолжить ИВЛ до восстановления адекватного самостоятельного дыхания, после чего оценить цвет кожных покровов. В случае брадикардии (80 уд/мин и менее) помощник проводит массаж сердца с частотой 100-120 в минуту, координируя его с ИВЛ-100 % кислородом: 3 надавливания на грудину - 1 вдох. Массаж сердца продолжается до тех пор, пока собственный сердечный ритм ребенка не достигнет 100 ударов в минуту. Если через 30 с ЧСС продолжает оставаться менее 100 ударов в минуту, следует начать медикаментозную терапию. Для этого второй помощник катетеризирует пупочную вену и вводит 0,1-0,3 мл/кг приготовленного заранее 0,1% раствора адреналина. Последний можно ввести непосредственно в эндотрахеальную трубку. (Для точности дозирования 1 мл препарата разводят до 10 мл изотоническим раствором натрия хлорида и вводят 0,5-1 мл). Адреналин увеличивает частоту и силу сердечных сокращений и
способствует повышению артериального давления, вызывая вазоконстрикцию периферических сосудов.
Если через 30 с ЧСС восстанавливается и превышает 80 ударов в минуту, непрямой массаж сердца прекращают, но продолжают ИВЛ до восстановления самостоятельного адекватного дыхания. Если же ЧСС остается ниже 80 ударов в минуту, следует повторно ввести адреналин. При наличии сохраняющейся бледности кожных покровов (несмотря на адекватную оксигенацию) и слабого пульса (что является признаком гиповолемии или острой кровопотери) следует ввести для восполнения ОЦК 5% раствор альбумина или физиологический раствор (10 мл/кг).
В тех случаях, когда асфиксия новорожденного возникла на фоне длительной хронической внутриутробной гипоксии (на что указы- вает тяжелая экстагенитальная патология матери, осложнение беременности гестозом, перенашивание), для устранения возможного метаболического ацидоза ребенку после восстановления адекватного легочного дыхания следует ввести в вену 4 % раствор натрия бикарбоната из расчета 2 мэкв/кг или 4 мл на кг массы тела. Скорость введения - 1 мэкв/кг/мин. Однако следует помнить, что вливание натрия бикарбоната в дозе 3 мэкв/кг приводит к образованию такого количества СО2, которое образуется в организме за 1,5 мин. Поэтому для выведения СО2 требуется наличие хороших вентиляционно-перфузионных отношений, т. е. восстановление адекватного дыхания. Поскольку осмолярность 4 % раствора натрия бикарбоната составляет 952 мосм/л, быстрое струйное введение этого препарата может способствовать гипернатриемии, которая на фоне гипоксических изменений гемодинамики может привести к появлению внутрижелудочковых кровоизлияний, особенно у недоношенных детей.
Если через 5 мин после начала реанимационных мероприятий оценка новорожденного по шкале Апгар остается не выше 4-5 баллов, рекомендуется ввести внутривенно раствор преднизолона (1 мг/ кг) или гидрокортизона (5 мг/ кг).
Стимуляторы дыхания применяются только в том случае, если известно, что за час до рождения ребенка мать получала наркоти- ческие вещества. С целью борьбы с наркотической депрессией вводят внутривенно или эндотрахеально 0,01 мл/кг налоксона.
В процессе ИВЛ могут возникать осложнения: - гипероксия (необходимо уменьшить концентрацию О2 во вдыхаемом воздухе);
- гипокарбия, приводящая к снижению мозгового кровотока (необходимо уменьшить частоту дыхания);
- по мере улучшения легочной растяжимости давление на выдохе может стать избыточным и тогда возможны тампонада легочной циркуляции, возрастание давления в легочной артерии, появление шунта справа налево. Это проявляется клинически в снижении системного АД, возрастании флюктуации АД в период ИВЛ с повышенным давлением на выдохе. В этом случае необходимо быстро отсоединить эндотрахеальную трубку от воздуховода и сразу станет видно резкое возрастание артериального давления. В этом случае необходимо снизить давление на выдохе, чтобы уменьшить величину шунта;
- пневмоторакс может возникать как осложнение ИВЛ, чаще всего у детей с аспирацией мекония; напряженный пневмото- ракс требует быстрого лечения (торакоцентез).
В случае эффективности проводимых мероприятий частота сердечных сокращений и артериальное давление возрастают, увеличи- вается пульсовое давление, падает центральное венозное давление и ребенок розовеет.
Как только нормализуется РО2, РСО2, рН крови и гемодинамика, возникают спонтанные дыхательные движения. Предшествующий им период времени прямо пропорционален степени поражения мозга. Так, у детей, которые родились в тяжелой асфиксии (рН = 6,95-7,0), при появлении спонтанного дыхания на 10-20-й минуте реанимации в последующем не выявлялось тяжелое поражение мозга. Если же самостоятельное регулярное дыхание восстанавливалось позже 20-й минуты (Апгар 0-3 балла), то смертность новорожденных составляла 53 %, а у 57 % выживших детей отмечали детский церебральный паралич.
Если через 20 мин самостоятельное дыхание не восстанавливается, сердцебиение отсутствует, оживление ребенка следует пре- кратить. Труднее прийти к такому заключению при отсутствии самостоятельного дыхания, но наличии сердцебиения. Тогда вопрос следует решать индивидуально с учетом степени зрелости ребенка, условий его внутриутробного развития, наличия врожденных пороков развития.
Следующий этап реанимации включает переход на самостоятельное дыхание, профилактику вторичной гипоксии, коррекцию нарушений метаболизма.
Недоношенные дети с массой тела менее
При рождении в асфиксии глубоко недоношенных детей (гестационный возраст менее 30 нед, масса тела менее
Использование сурфактанта способствует увеличению растяжимости легких при нормальных значениях транспульмонального давления, повышает стабильность альвеол на выдохе и предотвращает образование ателектазов, снижает утечку белков и воды из сосудов легких.
С профилактической целью препараты сурфактанта (экзосурф неонатал, сурфактант-bl, куросурф) следует вводить в первые 2 ч жизни, причем ребенку следует проводить аппаратную ИВЛ.
После проведения реанимационных мероприятий ребенка помещают в кувез и сразу переводят в палату интенсивной терапии, где спустя 30-60 мин после относительной стабилизации его состояния акушерка производит обработку пуповинного остатка и кожи.
После завершения реанимационных мероприятий врач обязан заполнить «Карту первичной и реанимационной помощи новорожденному в родильном зале» - учетную форму 097-1/у-95. Следует подчеркнуть, что в организации реанимационной помощи важным является заблаговременное обучение персонала и оснащение родильного блока необходимым оборудованием.
Циркуляторные нарушения и глубокие метаболические сдвиги, возникающие в организме в результате гипоксии, определяют неврологическую симптоматику, которая напоминает клиническую картину постреанимационной болезни взрослых людей: начальная стадия угнетения функций сменяется стадией общего возбуждения,
для которой характерно расстройство сна, появление разгибательной гипертонии и различных двигательных автоматизмов. Длительное расстройство сна и судорожный синдром сами по себе значительно усугубляют метаболические нарушения в мозгу, приводят к накоплению токсических продуктов, что в известной степени определяет неблагоприятный исход заболевания. Поэтому необходимо использовать фармакологические средства, которые снимают судорожную готовность и способствуют наступлению сна (седуксен внутривенно или внутримышечно по 1 мг до достижения клинического эффекта, ГОМК по 100 мг/кг/24 ч).
В комплексе лечебных мероприятий важная роль принадлежит инфузионной терапии, основными задачами которой являются: нор- мализация гемодинамики, водно-электролитного баланса и кислотноосновного состояния крови, обеспечение диуреза и доставка ребенку энергетического и пластического материала. При определении объема вводимой жидкости следует исходить из минимальных потребностей организма новорожденных для покрытия нужд основного обмена и потерь влаги через кожу, легкие, кишечник и почки. Этим требованиям отвечает капельное введение в первые сутки 30-40 мл/кг жидкости. Объем инфузата на 3-й день жизни - 80-90 мл/кг, на 4-й - 100-110 мл. Основу инфузата составляет 10 % раствор глюкозы.
С целью дегидратации вводят плазму (10-15 мг/кг), альбумин (10 % раствор из расчета 7-10 мл/кг), маннитол (10 % раствор по 10 мл/кг), лазикс (0,2 мл 1 % раствора).
Для восполнения объема циркулирующей крови и улучшения ее реологических свойств и микроциркуляции назначают трентал. Помимо инфузионной терапии следует применять антиоксиданты (витамины А, Е, С), глютаминовую кислоту. При наличии метаболического ацидоза с целью ощелачивания крови используют кокарбоксилазу и/или 4 % раствор бикарбоната натрия.
Коррекцию содержания натрия, калия, кальция проводят при наличии лабораторных данных о составе электролитов крови. Для этого используют 10 % раствор хлорида натрия, 7,5 % раствор хлорида калия, 10 % раствор глюконата кальция.
С целью улучшения сократительной способности миокарда, ликвидации легочной гипертензии, гиповолемии и гипергидратации рекомендуются сердечные гликозиды. Для лечения гипотензии, улучшения сердечного выброса и почечной функции используют допамин.
Профилактика гипоксии плода и асфиксии новорожденного должна основываться на дородовой диагностике и состоять из следующих компонентов:
- своевременной госпитализации беременных групп повышенного риска развития гипоксии плода;
- интенсивной терапии акушерской и экстрагенитальной патологии беременных;
- досрочного родоразрешения при отсутствии эффекта от проводимой терапии гипоксии плода.