В 1976 г. в ретровирусе саркомы Рауса был обнаружен первый ген, ответственный за злокачественную трансформацию клетки. Это был src-онкоген. Экспериментально было установлено, что вирусы саркомы Рауса, лишенные src-онкогена, не способны вызывать развитие опухоли. В настоящее время уже известно более 100 генов вирусов, ответственных за развитие опухолей, которые называются вирусными онкогенами. Трансфекция вирусных онкогенов в клетки приводит к их злокачественной трансформации.
Полиэтиологическая теория канцерогенеза. Эта теория объединяет все другие, поскольку опухоли — это множество разных болезней, в развитии каждой из которой могут участвовать разные этиологические факторы. Кроме того, эффект всех известных канцерогенов может суммироваться и усиливаться.
Достижения экспериментальной и клинической онкологии XX века позволили установить, что развитие опухолей является результатом возникновения мутаций в соматических клетках, происходящих при повреждении молекул ДНК. Это заключение подтверждается тремя группами фактов: 1) наличием корреляций определенных хромосомных мутаций с некоторыми типами опухолей; 2) развитием опухолевого фенотипа в клетках при трансфекции в них онкогенных вирусов; 3) обнаружением мутагенных свойств у большинства известных канцерогенных агентов.
КЛЕТОЧНЫЕОНКОГЕНЫ, АНТИОНКОГЕНЫИСОВРЕМЕННЫЕПРЕДСТАВЛЕНИЯОКАНЦЕРОГЕНЕЗЕСхема 33. Механизмыактивациипротоонкогенов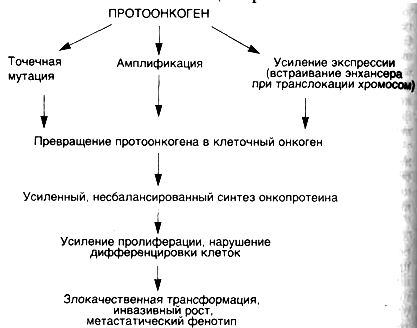
Рассматривая различные теории этиологии опухолей, поражаешься тому факту, что разнообразные канцерогенные агенты, отличающиеся по механизмам своего действия, приводят к одному и тому же результату — развитию опухолей, основными свойствами которых является нерегулируемый рост с нарушенной Дифференцировкой клеток. Объяснение этому феномену было дано лишь в последние десятилетия благодаря открытию клеточных онкогенов и антионкогенов. Современное представление о канцерогенезе связывается с возможностью различных канцерогенных агентов вызывать такие повреждения генома клеток, которые сопровождаются активацией клеточных онкогенов и/или инактивацией антионкогенов (схема 33). Связь канцерогенеза с данными генами клеток не случайна, так как именно эти гены могут запускать деление клеток, участвуют в контроле их пролиферации и дифференцировки.
В 1976 г. Stechellen и соавт. у птиц, а в 1978 г. Spector и соавт. у млекопитающих обнаружили участок ДНК, гомологичный вирусным онкогенам. В активном состоянии такие участки получили название
клеточных онкогенов, в неактивном —
протоонкогенов. Протоонкогены — это нормальные гены клеток. В зрелых тканях они, как правило, неактивны. Активация протоонкогенов и превращение их в клеточные онкогены происходит при опухолевом росте, а также в процессе эмбриогенеза. Некоторые из клеточных онкогенов активируются также при пролиферации и дифференцировке клеток в очагах репаративной регенерации.
Клеточные онкогены кодируют синтез белков, которые называются онкобелками, или онкопротеинами. Следует отметить, что все известные в настоящее время онкобелки принимают участие в передаче митогенетических сигналов от клеточной мембраны до ядра к определенным генам клеток. Это значит, что большинство факторов роста и других цитокинов в той или иной степени могут взаимодействовать с онкобелками.
По
функциональной активности и структурному сходству с элементами сигнальной митогенетической цепочки все онкобелки могут быть подразделены на следующие группы:
▲онкобелки — гомологи факторов роста (c-sis, int-r, k-fgt и др.);
▲онкобелки — голомоги рецепторов к факторам роста (с-erB, с-егbА и др.);
▲ онкобелки, связанные с работой рецепторов, — аналоги G-белка (c-ras) и протеинкиназные белки (c-src, c-fps, c-fes, c-abl, c-met);
▲ онкобелки, передающие ростовые сигналы на ДНК (c-fos, c-jun, c-myc и др.).
Для того чтобы стимулировать пролиферацию клеток, протоонкогены должны превратиться в клеточные онкогены. Известны
четыре основных механизма активации протоонкогенов: ▲инсерционная активация — активация под действием встроенных в геном генов (вирусных);
▲ активация при транслокации участка хромосомы с встроенным в него протоонкогеном;
▲ активация путем амплификации (умножении копий) протоонкогена;
▲ активация при точечных мутациях протоонкогенов (см. схему 33).
Инсерционная активация происходит при участии РНК- и реже ДНК-содержащих вирусов, которые могут встраиваться в геном клетки и своими генами модулировать активность близлежащих клеточных генов, среди которых могут оказаться протоонкогены. Ретровирусы могут быть носителями вирусного онкогена, или энхансера, выполняющего роль активатора онкогенов.
Транслокация участков хромосом в клетках может приводить к контакту протоонкогенов с сильными энхансерами, как это происходит при лимфоме Беркитта и хроническом миелолейкозе человека.
При лимфоме Беркитта наблюдается реципрокная транслокация участков хромосом 8 и 14. В результате участок хромосомы °q24, содержащий c-mic, транслоцируется на участок хромосом 14 14q32, в зону действия гена тяжелых цепей иммуноглобулинов. В Ю % случаев происходит другой вариант реципрокной транслокации с встраиванием участка 8q24, несущего c-myc в хромосому 2, вблизи генов легких цепей иммуноглобулинов. Активные гены иммуноглобулинов выступают в роли энхансеров по отношению к клеточному онкогену с-тус.
Хронический миелоидный лейкоз человека характеризуется специфическим генетическим дефектом — наличием филадельфийской хромосомы, которая образуется в результате реципрокной транслокации между хромосомами 9 и 22. Участок хромосомы 9, несущий протоонкоген c-abl, оказывается на фрагменте хромосомы 22, где формируется новый ген-гибрид c-abl-bcr, белковый продукт которого обладает тирозиназной активностью.
Амплификация клеточного онкогена проявляется в увеличении числа его копий и может захватывать как отдельные гены, так и целые участки хромосом. При этом могут появляться добавочные мелкие хромосомы. Амплификация описана для с-mус и c-ras семейств клеточных онкогенов при раке легкого, мочевого пузыря, толстой кишки, поджелудочной железы. Амплификация N-myc найдена в человеческой нейробластоме в 38 % случаев и коррелирует с плохим прогнозом жизни больных. Амплификация c-neu, онкобелок которого гомологичен рецепторам к эпидермоидному фактору роста, является плохим прогностическим фактором при раке молочной железы. Накопление в клетках карциномы онкобелка c-neu приводит к усиленному связыванию ростовых факторов, которые синтезируются самими же опухолевыми клетками (ФНО-а), что стимулирует рост опухоли по аутокринному механизму.
Антионкогены, или
гены — супрессоры рака. В геноме клеток обнаруживаются гены, которые, напротив, тормозят пролиферацию клеток и оказывают антионкогенное действие. Потеря клеткой таких генов может приводить к развитию рака. Наиболее изученными антионкогенами являются р53 и Rb (retinoblastoma gene). Потеря Rb обнаруживается в редко встречаемой детской опухоли ретинобластоме (частота ретинобластомы 1 на 20 000 детей). 60 % ретинобластом развиваются спорадически, а 40 % описываются как наследственные опухоли с аутосомно-до-минантным типом наследования. В случаях наследственного дефекта Rb нормальный ген отсутствует только на одной аллеле. Вторая аллель остается сохранной, поэтому опухоль может развиться только при одновременном повреждении второго сохранного гена Rb. В случае спонтанно развившейся ретинобластомы потеря Rb затрагивает сразу оба аллеля.
Молекулой 1995 года назван ген-супрессор р53. Существуют две формы антионкогена р53: "дикая" (неизмененная) и мутированная. В опухолевых клетках при многих типах рака обнаруживается накопление мутированной или "дикой" формы р53 в избыточном количестве, что оказывает отрицательное действие на регуляцию клеточного цикла, в связи с чем клетка приобретает способность к усиленной пролиферации.
Регуляция пролиферативной активности клетки с помощью п53 осуществляется через усиление или ослабление им апоптоза (см. лекцию 8 "Некроз" общего курса). Активация р53 на фоне активации клеточных онкогенов c-fos и с-mус приводит к смерти опухолевых клеток, что и наблюдается при действии на опухоль химиопрепаратов и радиации. Мутации р53 или инактивация его другими способами на фоне усиления экспрессии c-fos, c-myc и bcl-2, наоборот, заканчиваются усилением пролиферации клеток и злокачественной трансформацией.
ПАТОГЕНЕЗЗЛОКАЧЕСТВЕННЫХОПУХОЛЕЙПатогенез злокачественных опухолей в общих чертах может быть представлен как стадийный процесс, состоящий из следующих этапов:
1. Изменения в геноме соматической клетки под действием различных канцерогенных агентов и в ряде случаев при наличии определенных наследственных изменений генома.
2. Активация клеточных онкогенов и супрессия антионкогенов.
3. Экспрессия клеточных онкогенов, нарушения продукции регуляторных генов.
4. Злокачественная трансформация клеток с приобретением способности к автономному росту.
ОСНОВНЫЕСВОЙСТВАОПУХОЛЕЙВ зависимости от степени зрелости, темпов роста, характера роста, способности давать метастазы и рецидивировать различают два типа опухолей: доброкачественные и злокачественные.
Доброкачественные опухоли построены из зрелых, дифференцированных клеток, обладают медленным экспансивным ростом с формированием капсулы из соединительной ткани на границе с окружающей нормальной тканью (рост опухоли самой в себе), не рецидивируют после удаления, не дают метастазов. Названия доброкачественных опухолей образуются из корня названия исходной ткани с прибавлением окончания "ома".
Злокачественные опухоли построены из частично или вовсе недифференцированных клеток, растут быстро, прорастая окружающие ткани (инфильтрирующий рост) и тканевые структуры (инвазивный рост), могут рецидивировать и метастазировать. Злокачественные опухоли из эпителия называются
Раком, или
карциномой, из производных мезенхимной ткани — саркомы
. При разборе закономерности опухолевого роста нам Придется постоянно сравнивать эти два типа неоплазм.
Основными свойствами опухолей являются автономный рост, наличие атипизма, способность к прогрессии и метастазированию.
Автономный рост опухоли. Характеризуется отсутствием контроля за пролиферацией и дифференцировкой клеток со стороны организма-опухоленосителя. Это вовсе не означает, что опухолевые клетки находятся в каком-то пролиферативном хаосе. В действительности
клетки опухолей переходят на аутокринный или паракринный механизм регулирования своего роста. При аутокринной стимуляции роста опухолевая клетка сама продуцирует факторы роста или онкобелки, — аналоги факторов роста, а также рецепторы, или онкобелки, — аналоги рецепторов факторов роста. Так происходит, например, в мелкоклеточном раке легкого, клетки которого продуцируют ростовой гормон бомбезин и одновременно рецепторы к нему. При этом происходит и паракринная стимуляция, поскольку бомбезин может взаимодействовать и с соседними клетками. Ярким примером паракринной стимуляции опухоли может быть продукция инсулиноподобного фактора роста-2 фибробластами стромы рака легкого. При этом фактор роста взаимодействует с рецепторами на раковых клетках и стимулирует их пролиферацию. Автономный рост опухоли выражается в утрате контактного торможения и иммортализации (приобретение бессмертия) опухолевых клеток, что может быть объяснено переходом клеток на аутокринный и паракринный пути регулирования своего роста.
Автономность опухоли носит относительный характер, поскольку опухолевая ткань постоянно получает от организма различные питательные вещества, кислород, гормоны, цитокины, приносимые с током крови. Кроме того, она испытывает воздействия иммунной системы и прилежащей окружающей неопухолевой ткани.
■ Таким образом, автономность опухоли следует понимать не как полную независимость опухолевых клеток от организма, а как приобретение опухолевыми клетками способности к самоуправлению.
В злокачественных опухолях автономный рост выражен в значительной степени, и они растут быстро, прорастая прилежащие нормальные ткани. В доброкачественных опухолях автономный рост выражен крайне слабо, некоторые из них поддаются регуляторным воздействием, растут медленно, не прорастая соседние ткани.
Атипизм опухоли. Термин "атипизм" происходит от греч. atypicus — отклонение от нормы. Помимо термина "атипизм", используются также такие понятия, как "анаплазия" (возврат к эмбриональному этапу развития) и "катаплазия" (уподобление эмбриональной ткани). Последний термин более корректен, так как
при опухолевом росте никакого возврата к эмбриональной ткани „е происходит, хотя многие свойства опухолевой ткани сближает ее с эмбриональной. В опухолях выделяют 4 вида атипизма:
орфологический, биохимический, антигенный и функциональный-
Морфологический атипизм. Он также носит название атипизм структуры опухоли" и выражается в том, что ткань опухоли не повторяет строение аналогичной зрелой ткани, и клетки опухоли могут быть не похожи на зрелые клетки того же происхождения.
Морфологический атипизм представлен двумя вариантами: тканевым и клеточным. Тканевый атипизм выражается в изменении соотношения между паренхимой и стромой опухоли, чаще с преобладанием паренхимы; изменением величины и формы тканевых структур с появлением уродливых тканевых образований различной величины. Клеточный атипизм заключается в появлении полиморфизма клеток как по форме, так и по величине, укрупнении в клетках ядер, имеющих часто изрезанные контуры, увеличении ядерно-цитоплазматического соотношения в пользу ядра, появлении крупных ядрышек. В результате патологических митозов в опухолевых клетках обнаруживаются клетки с гиперхромными ядрами, гигантскими ядрами, многоядерные клетки и фигуры патологических митозов.
При электронно-микроскопическом исследовании клеточный атипизм опухолевой клетки проявляется также изменениями структуры ядра с маргинацией хроматина и наличием гетерохроматина, уменьшением количества ядерных пор, что может способствовать разобщению ядра и цитоплазмы опухолевой клетки. Кроме того, на ультраструктурном уровне становится отчетливо видна степень утраты специфической дифференцировки опухолевой клеткой.
Злокачественным опухолям присущи оба типа морфологического атипизма. Имеется определенная положительная корреляция между степенью их выраженности и злокачественностью опухоли. Доброкачественным опухолям свойствен только тканевый атипизм, поскольку они построены из зрелых, дифференцированных клеточных элементов.
Биохимический атипизм. Проявляется в метаболических изменениях в опухолевой ткани. Все перестройки метаболизма в опухоли направлены на обеспечение ее роста и приспособление к относительному дефициту кислорода, который возникает при быстром росте неоплазмы. В опухолевых клетках регистрируется усиленный синтез онкобелков, факторов роста и их рецепторов, уменьшение синтеза и содержания гистонов, синтез эмбриональных белков и рецепторов к ним, превращение опухолевых
клеток в факультативные анаэробы, снижение содержания
цАМФ. Биохимический атипизм может изучаться с помощью морфологических методов — гисто- и иммуногистохимических поэтому его еще называют гистохимическим атипизмом.
Антигенный атипизм. Г.И.Абелев (1963—1978) выделяет в опухолях 5 типов антигенов:
▲ антигены вирусных опухолей, которые идентичны для любых опухолей, вызванных данным вирусом;
▲ антигены опухолей, вызванных канцерогенами;
▲ изоантигены трансплантационного типа — опухолеспецифичные антигены;
▲ онкофетальные антигены — эмбриональные антигены (а-фетопротеин, раковоэмбриональный антиген и др.);
▲ гетероорганные антигены.
Наличие опухолеспецифических антигенов доказывается как экспериментальными, так и клиническими данными. Экспериментально показана возможность отторжения опухолевого трансплантата организмом животного-реципиента имбредных линий мышей, что исключает возможность отторжения за счет конфликта в антигенах гистосовместимости. Другим доказательством является обнаружение среди клеток воспалительного инфильтрата в опухолях цитотоксических Т-лимфоцитов, которые способны взаимодействовать с клеткой-мишенью только при наличии комплементарности по системе главного комплекса гистосовместимости. Аналогичные Т-клеточные инфильтраты были обнаружены в меланомах. В опухолях человека опухолеспецифические антигены обнаружены лишь в единичных неоплазмах — меланоме, нейробластоме, лимфоме Беркитта, остеогенной саркоме, раке толстой кишки, лейкозах. Идентификация этих антигенов иммунологическими и иммуногистохимическими методами широко используется в диагностике данных опухолей.
Таким образом, можно заключить, что антигенный атипизм опухолей проявляется в образовании опухолеспецифических антигенов, онкофетальных антигенов, а также в утрате некоторыми опухолями антигенов гистосовместимости, тканеспецифических антигенов, что приводит к развитию антигенонегативных опухолей и формированию к ним толерантности.
Функциональный атипизм. Характеризуется утратой опухолевыми клетками специализированных функций, присущих аналогичным зрелым клеткам, и/или появлением новой функции, не свойственной клеткам данного типа. Например, клетки низко-дифференцированного скиррозного рака желудка прекращают продуцировать секрет и начинают усиленно синтезировать коллаген стромы опухоли.
Прогрессия опухоли. Теория прогрессии опухолей разработана L.Foulds (1969) на основе данных экспериментальной онкологии. Согласно теории об опухолевой прогрессии, происходит постоянный стадийный прогрессирующий рост опухоли с прохождением опухолью ряда качественно отличных стадий. При этом проявляется автономность не только роста, но и всех других признаков опухоли, как полагал сам автор теории. С последней точкой зрения трудно согласиться, поскольку злокачественность опухоли всегда имеет материальную базу в виде существования активного синтеза определенных онкобелков, факторов роста,
их рецепторов, что накладывает отпечаток на проявления морфологического атипизма опухоли и используется в прогнозировании жизни онкологических больных.
Положение же о том, что опухоль постоянно изменяется и при этом происходит прогрессия, как правило, в сторону повышения ее злокачественности, одним из проявлений которой является развитие метастазов, справедливо и будет более подробно рассмотрено в лекции 21 "Морфологическая характеристика, морфогенез и гистогенез опухолей".