Лекция 9НАРУШЕНИЯ КРОВООБРАЩЕНИЯРасстройства кровообращения можно разделить на 3 группы: 1) нарушения кровенаполнения, представленные полнокровием (артериальным и венозным) и малокровием; 2) нарушение проницаемости стенки сосудов, к которым относят кровотечение (кровоизлияние) и плазморрагию; 3) нарушения течения (т.е. реологических свойств) и состояния крови в виде стаза, сладж-феномена, тромбоза и эмболии. Особое место среди расстройств кровообращения занимает шок.
НАРУШЕНИЯ КРОВЕНАПОЛНЕНИЯАртериальное полнокровие (гиперемия) — повышение кровенаполнения органа, ткани вследствие увеличенного притока артериальной крови. Оно может быть общим — при увеличении объема циркулирующей крови и местным, возникающим при действии различных факторов.
Исходя из особенностей этиологии и механизма развития, различают следующие виды артериальной гиперемии:
▲ ангионевротическую (нейропаралитическую) гиперемию, возникающую при нарушении иннервации;
▲ коллатеральную гиперемию, появляющуюся в связи с затруднением кровотока по магистральному артериальному стволу;
▲ гиперемию после ишемии, развивающуюся при устранении фактора (опухоль, лигатура, жидкость), сдавливающего артерию;
▲ вакатную гиперемию, возникающую в связи с уменьшением барометрического давления;
▲ воспалительную гиперемию;
▲ гиперемию на фоне артериовенозного шунта.
Венозное полнокровие — повышенное кровенаполнение органа или ткани в связи с уменьшением (затруднением) оттока крови; приток крови при этом не изменен или уменьшен. Застой венозной крови приводит к расширению вен и капилляров, замедлению в них кровотока, с чем связано развитие гипоксии, повышение проницаемости базальных мембран капилляров. Венозное полнокровие может быть общим и местным, острым и хроническим. Общее венозное полнокровие является морфологическим субстратом синдрома сердечной недостаточности, поэтому морфологическая картина и морфогенез изменений в органах при венозном полнокровии будут подробно изложены в следующей лекции "Сердечно-сосудистая недостаточность" (см. лекцию 10 "Морфология сердечно-сосудистой недостаточности").
Малокровие, или
ишемия, — уменьшение кровенаполнения ткани, органа, части тела в результате недостаточного притока крови.
Изменения ткани, возникающие при малокровии, обусловлены длительностью возникающей при этом гипоксии и степенью чувствительности к ней тканей. При остром малокровии обычно возникают дистрофические и некротические изменения. При хроническом малокровии возникают атрофия паренхиматозных элементов и склероз стромы.
В зависимости от причин и условий возникновения различают следующие виды малокровия:
▲ ангиоспастическое — вследствие спазма артерии;
▲ обтурационное — вследствие закрытия просвета артерии тромбом или эмболом;
▲ компрессионное — при сдавлении артерии опухолью, выпотом, жгутом, лигатурой;
▲ малокровие в результате перераспределения крови (например, малокровие головного мозга при извлечении жидкости из брюшной полости, куда устремляется большая часть крови).
НАРУШЕНИЯ СОСУДИСТОЙ ПРОНИЦАЕМОСТИКровотечение (геморрагия) — выход крови из просвета кровеносного сосуда или полости сердца в окружающую среду (наружное кровотечение) или в полости тела (внутреннее кровотечение).
Кровоизлияние — частный вид кровотечения, при котором кровь накапливается в тканях.
Существуют следующие виды кровоизлияния:
▲ гематома — скопление свернувшейся крови в тканях с нарушением ее целости и образованием полости;
▲ геморрагическое пропитывание — кровоизлияние при сохранении тканевых элементов;
▲ кровоподтеки (экхимозы) — плоскостные кровоизлияния;
▲ петехии — мелкие точечные кровоизлияния на коже и слизистых оболочках.
Причины кровотечения (кровоизлияния) могут быть следующие:
▲ разрыв стенки сосуда — при ранении, травме стенки сосуда или развитии в ней патологических процессов: воспаления, некроза, аневризмы;
▲ разъедание стенки сосуда, которое чаще возникает при воспалении, некрозе стенки, злокачественной опухоли;
▲ повышение проницаемости стенки сосуда, сопровождающееся
диапедезом эритроцитов (от греч. dia — через и ре-dao — скачу). Диапедезные кровоизлияния возникают из сосудов микроциркуляторного русла, имеют вид мелких, точечных.
Исход кровоизлияния: рассасывание крови, образование "ржавой" кисты (ржавый цвет обусловлен накоплением гемосидерина), инкапсуляция или прорастание гематомы соединительной тканью, присоединение инфекции и нагноение.
Плазморрагия - выход плазмы из кровеносного русла. Следствием плазморрагии является пропитывание плазмой стенки сосуда и окружающих тканей —
плазматическое пропитывание. Плазморрагия — одно из проявлений повышенной сосудистой проницаемости.
При микроскопическом исследовании вследствие плазматического пропитывания стенка сосуда выглядит утолщенной, гомогенной. При крайней степени плазморрагии возникает
фибриноидный некроз.Патогенез плазморрагии и плазматического пропитывания определяется двумя основными условиями — повреждением сосудов микроциркулярного русла и изменениями констант крови, что способствует повышению сосудистой проницаемости. Повреждение микрососудов обусловлено чаще всего нервно-сосудистыми нарушениями (спазм), тканевой гипоксией, иммунопатологическими реакциями, действием инфекционных агентов. Изменения крови, способствующие плазморрагии, сводятся к увеличению содержания в плазме веществ, вызывающих спазм сосудов (гистамин, серотонин), естественных антикоагулянтов (гепарин, фибринолизин), грубодисперсных белков, липопротеидов, появлению иммунных комплексов, нарушению реологических свойств. Плазморрагия встречается наиболее часто при гипертонической болезни, атеросклерозе, декомпенсированных пороках сердца, инфекционных, инфекционно-аллергических и аутоиммунных заболеваниях.
В исходе плазматического пропитывания могут развиться фибриноидный некроз и гиалиноз сосудов.
НАРУШЕНИЯ ТЕЧЕНИЯ И СОСТОЯНИЯ КРОВИСтаз•
Стаз (от лат. stasis — остановка) — резкое замедление и остановка тока крови в сосудах микроциркуляторного русла, главным образом в капиллярах.
Причиной развития стаза являются нарушения циркуляции крови, возникающие при действии физических (высокая и низкая температура) и химических (токсины) факторов, при инфекционных, инфекционно-аллергических и аутоиммунных заболеваниях, болезнях сердца и сосудов.
Механизм развития. В возникновении стаза большое значение имеют изменения реологических свойств крови, обусловленные развитием
сладж-феномена (от англ. sludge — тина), для которого характерно прилипание друг к другу эритроцитов, лейкоцитов или тромбоцитов и нарастание вязкости плазмы, что приводит к затруднению перфузии крови через сосуды микроциркуляторного русла. Развитию внутрикапиллярной агрегации эритроцитов способствуют следующие факторы:
▲ изменения капилляров, ведущие к повышению их проницаемости и плазморрагии;
▲ нарушение физико-химических свойств эритроцитов;
▲ изменение вязкости крови за счет грубодисперсных фракций
белков;
▲ нарушения циркуляции крови — венозное полнокровие (застойный стаз);
▲ ишемия (ишемический стаз) и др.
Стаз — явление обратимое. Длительный стаз ведет к необратимым гипоксическим изменениям — некробиозу и некрозу.
Тромбоз•
Тромбоз (от греч. thrombosis — свертывание) — прижизненное свертывание крови в просвете сосуда или полостях сердца. Образующийся при этом сверток крови называют тромбом.
Хотя тромбоз представляет собой один из важнейших механизмов гемостаза, он может стать причиной нарушения кровоснабжения органов и тканей с развитием инфарктов, гангрены.
Патогенез. Патогенез тромбоза складывается из участия как местных, так и общих факторов.
К местным факторам относят изменения сосудистой стенки, замедление и нарушение тока крови.
Среди
изменений сосудистой стенки особенно важно повреждение внутренней оболочки сосуда, чаще всего обусловленное атеросклеретическими и воспалительными поражениями ее. К повреждению стенки сосуда ведут и ангионевротические расстройства — спазмы артерий и артериол. Повреждение эндокарда при эндокардитах, инфарктах миокарда также сопровождается тромбообразованием.
Замедление и нарушение (завихрение) тока крови в артериях обычно возникают вблизи атеросклеротических бляшек, в полости аневризмы, при спазме; в венах — при варикозном расширении. Роль нарушений тока крови в развитии тромбоза подтверждается наиболее частой их локализацией на месте ветвления сосудов. О значении замедления тока крови для тромбообразования свидетельствует частое возникновение тромбов в венах при развитии сердечно-сосудистой недостаточности, при сдавлении вен опухолями, беременной маткой, иммобилизации конечности.
К общим факторам патогенеза тромбоза относят нарушение регуляции свертывающей и противосвертывающей систем крови и изменение состава крови. Главная роль принадлежит
нарушениям баланса между свертывающей и противосвертывающей системами в регуляции жидкого состояния крови в сосудистом русле. Состояния повышенной свертываемости (гиперкоагуляция) часто являются следствием обширных хирургических операций и травм, беременности и родов, некоторых лейкозов, сопровождающихся тромбоцитозом (истинной полицитемин и других миелопролиферативных заболеваний), спленэктомии, эндотоксемии, шока, реакций гиперчувствительности, злокачественных опухолей.
Среди изменений состава (качества) крови наибольшее значение имеет
повышение вязкости. Оно может быть обусловленс эритроцитозом или полицитемией, возникающими при дегидратации (чаще у детей), при хронических гипоксических состояниях (дыхательной недостаточности, цианотических врожденных пороках сердца), истинной полицитемии, увеличении содержания грубодисперсных фракций белков (например, при миеломной болезни).
С практической точки зрения важно выделить группы больных со склонностью к образованию тромбов. К ним можно отнести:
▲ больных, находящихся на длительном постельном режиме после операции;
▲ страдающих хронической сердечно-сосудистой недостаточностью (хроническим венозным полнокровием);
▲ больных с атеросклерозом;
▲ онкологических больных;
▲ беременных;
▲ больных с врожденными или приобретенными состояниями гиперкоагуляции, предрасполагающими к рецидивирующему тромбозу.
Механизм образования тромба. Инициальным моментом тромбообразования является повреждение эндотелия. Тромб образуется при взаимодействии тромбоцитов (кровяных пластинок), поврежденного эндотелия и системы свертывания крови (коагуляционного каскада).
Тромбоциты. Основная их функция — поддержание целости сосудистой стенки — направлена на прекращение или предотвращение кровотечения и является важнейшим звеном гемостаза. Тромбоциты осуществляют следующие функции:
▲ участвуют в репарации эндотелия посредством выработки PDGF (тромбоцитарный фактор роста);
▲ формируют тромбоцитарную бляшку на месте повреждения сосуда в течение нескольких минут — первичный гемостаз;
▲ участвуют в коагуляционном каскаде (вторичный гемостаз) путем активации фактора 3 тромбоцитов, что в конечном счете приводит к тромбообразованию.
Эндотелий. Для сохранения крови в своем обычном состоянии необходима целостность (структурная и функциональная) сосудистого эндотелия. Интактная эндотелиальная клетка модулирует некоторые звенья гемостаза и обеспечивает тромборезистентность, т.е. противостоит тромбообразованию в результате следующих процессов:
▲ продукция гепарансульфата — протеогликана, активирующего антитромбин III, который нейтрализует тромбин и другие факторы свертывания, включая IXa, Xa, XIa и ХПа;
▲ секреция естественных антикоагулянтов, таких как тканевый активатор плазминогена;
▲ расщепление АДФ;
▲ инактивация и резорбция тромбина;
▲ синтез тромбомодулина — поверхностноклеточного протеина, связывающего тромбин и превращающего его в активатор протеина С — витамин К-зависимый плазменный протеин, который ингибирует коагуляцию, лизируя факторы Va и VI—Иа;
▲ синтез протеина S — кофактора активированного протеина С;
▲ продукция PGI-2 — простациклина, обладающего антитромбогенным эффектом;
▲ синтез оксида азота (II) (NO), который действует аналогично PGI-2.
Понимание этих антитромбогенных механизмов, осуществляемых эндотелиальной клеткой на ее поверхности, позволяет понять значение дисфункции эндотелия как триггера тромбообразования.
Существуют также следующие факты, доказывающие про-тромбогенную функцию эндотелия:
• эндотелий синтезирует фактор Виллебранда, который способствует агрегации тромбоцитов и фактора V;
• эндотелий способен связывать факторы IX и X, что может вызвать коагуляцию на поверхности эндотелия;
• под воздействием интерлейкина-1 и фактора некроза опухоли (ФНО) эндотелий выбрасывает в плазму тромбопластин — потенциальный инициатор свертывания крови по внешней системе (внешнему пути).
Активация системы свертывания крови. Это решающий этап в прогрессировании и стабилизации тромба. Процесс завершается образованием фибрина —
вторичный гемостаз. Это многоэтапный каскадный ферментативный процесс — коагуляционный каскад, требующий довольно много времени; при этом последовательно активируются проферменты. В процессе свертывания прокоагулянты — тромбопластины, превращаются в активные ферменты — тромбины, способствующие образованию из циркулирующего в крови растворимого фибриногена нерастворимого фибрина. Образующиеся нити фибрина скрепляют агрегаты тромбоцитов, образовавшиеся при первичном гемостазе. Это имеет большое значение для предотвращения вторичного кровотечения из крупных сосудов, наступающего через несколько часов или дней после травмы.
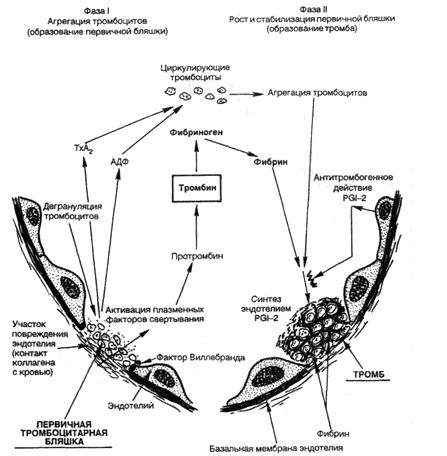
Механизм тромбообразования (тромбогенез) представлен следующими звеньями (рис. 4).
1. Адгезия тромбоцитов к обнаженному коллагену в месте повреждения эндотелиальной выстилки осуществляется с помощью фибронектина на поверхности тромбоцитов и стимулируется в большей степени коллагеном типа III, чем коллагеном базальной мембраны (IV тип). Медиатором является фактор Виллебранда, вырабатываемый эндотелием.
2. Секреция тромбоцитами АДФ и тромбоксана-А
2 (ТХ-А2). вызывающего вазоконстрикцию и агрегацию тромбоцитов (блокирование образования Тх-А
2 небольшими дозами аспирина лежит в основе превентивной терапии тромбообразования), гистамина, серотонина, PDGF и др.
3. Агрегация тромбоцитов — образование первичной тромбоцитарной бляшки.
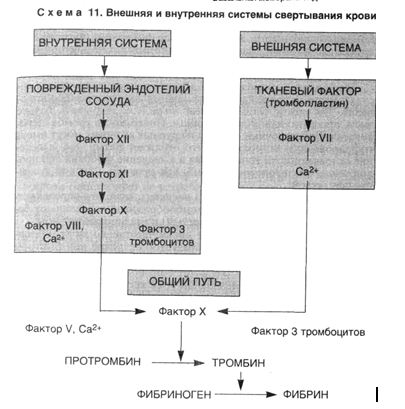
4. Активация процесса свертывания крови, или коагуляционного каскада (схема 11), с помощью следующих механизмов:
▲ внутренней системы свертывания, которая запускается контактной активацией фактора XII (Хагемана) коллагеном, фактора XI, прекалликреина, высокомолекулярного кининогена и усиливается фосфолипидом тромбоцитов (фактор 3), высвобождающимся при конформационных изменениях их мембраны;
▲ внешней системы свертывания, которая запускается тканевым тромбопластином, высвобождающимся из поврежденного эндотелия (тканей), и активирует фактор VII. В конечном итоге оба пути приводят к превращению протромбина (фактор II) в тромбин (фактор Па), который способствует превращению фибриногена в фибрин, а также вызывает дальнейшее выделение АДФ и Тх-А
2 из тромбоцитов, способствуя их агрегации.
5. Агрегация стабилизируется образующимися отложениями фибрина — стабилизация первичной бляшки. В дальнейшем фибриновый сверток захватывает лейкоциты, агглютинирующиеся эритроциты и преципитирующие белки плазмы крови.
Таким образом, можно выделить следующие стадии морфогенеза тромба: ▲агглютинация тромбоцитов; ▲ коагуяция фибриногена с образованием фибрина; ▲ агглютинация эритроцитов; ▲ преципитация плазменных белков.
Рис. 4. Механизм образования тромба (схема). Объяснение в тексте.
Система свертывания работает в тесной связи с фибринолитической системой, которая модулирует коагуляцию и препятствует тромбообразованию. Механизм Действия фибринолитической истемы складывается из следующих стадий:
▲ превращение проэнзима плазминогена в плазмин — наиболее важный фибринолитический фермент; ▲ растворение фибрина с помощью плазмина; ▲ взаимодействие фибринолитической системы с системой свертывания на уровне активации фактора XII в ХIIа связывает систему свертывания, систему комплемента и кининовую систему.
Морфология тромба. Тромб обычно прикреплен к стенке сосуда в месте ее повреждения, где начался процесс тромбообразования. Он может быть
пристеночным (т.е. закрывать только часть просвета) или
обтурирующим. Поверхность тромба шероховатая. Пристеночные тромбы в крупных артериях могут иметь гофрированную поверхность, что отражает ритмичное выпадение склеивающихся тромбоцитов и выпадение фибрина при продолжающемся кровотоке. Тромб, как правило, плотной консистенции, сухой.
В зависимости от строения и внешнего вида, что определяется особенностями и темпами тромбообразования, различают белый, красный, смешанный (слоистый) и гиалиновый тромбы.
Белый тромб состоит преимущественно из тромбоцитов, фибрина и лейкоцитов, образуется медленно при быстром токе крови (чаще в артериях). Красный тромб, помимо тромбоцитов и фибрина, содержит большое число эритроцитов, образуется быстро при медленном токе крови (обычно в венах). В наиболее часто встречающемся смешанном тромбе, который имеет слоистое строение (слоистый тромб) и пестрый вид, содержатся элементы как белого, так и красного тромба. В смешанном тромбе различают
головку (имеет строение белого тромба),
тело (собственно смешанный тромб) и
хвост (имеет строение красного тромба). Головка прикреплена к эндотелиальной выстилке сосуда, что отличает тромб от посмертного сгустка крови. Слоистые тромбы чаще образуются в венах, в полости аневризмы аорты и сердца. Гиалиновый тромб — особый вид тромбов, образующихся в сосудах микроциркуляторного русла; он редко содержит фибрин, состоит из разрушенных эритроцитов, тромбоцитов и преципитирующих белков плазмы, напоминающих гиалин. Увеличение тромба происходит путем наслоения тромботических масс на первичный тромб, причем рост тромба может происходить как по току крови, так и против тока.
Исход тромбоза. Может быть различен. К благоприятным исходам относят
асептический аутолиз тромба, возникающий под влиянием протеолитических ферментов и прежде всего плазмина. Установлено, что большинство мелких тромбов рассасывается в самом начале их образования. Другим благоприятным исходом является
организация тромба, т.е. замещение его соединительной тканью, которая может сопровождаться процессами канализации и васкуляризации (восстановление проходимости сосуда). Возможно
обызвествление тромба, в венах при этом возникают камни — флеболиты.
К неблагоприятным исходам относят
отрыв тромба с развитием тромбоэмболии и септическое расплавле ние тромба, которое возникает при попадании в тромботические массы гноеродных бактерий, что приводит к тромбобактериальной эмболии сосудов различных органов и тканей (при сепсисе).
Значение тромбоза. Определяется быстротой его развития локализацией и распространенностью. Обтурирующие тромбы в артериях — явление опасное, так как приводят к развитию ин фарктов и гангрены.