Физиология бактерий. Энергетический и конструктивный метаболизм. Пигменты бактерий.Энергетический метаболизм бактерий. Схема идентификации неизвестной бактерии. Экзэргонические реакции.Метаболизм [от греч. metahole, изменение] — совокупность всех химических превращений, происходящих в клетках. Этот термин объединяет два процесса: катаболизм (диссимиляция, или энергетический метаболизм) и анаболизм (ассимиляция, или конструктивный метаболизм). Первый процесс включает расщепление различных субстратов для получения энергии, второй — синтез высокомолекулярных соединений, используемых для образования клеточных структур. Промежуточный обмен веществ, превращающий низкомолекулярные фрагменты питательных веществ в ряд органических кислот и фосфорных эфиров, называют амфиболиэм. Различия в метаболизме у разных групп бактерий нередко используют в качестве фенотипических маркёров при идентификации микроорганизмов. На практике любая схема идентификации неизвестной бактерии включает исследование следующих параметров.
1. Способность к утилизации различных веществ в качестве источника углерода. 2. Способность к образованию специфических конечных продуктов в результате разложения субстратов. 3. Способность смешать рН среды культивирования в кислую или щелочную сторону. Метаболизм большинства бактерий осуществляется посредством биохимических реакций разложения органических (реже неорганических) веществ и синтеза компонентов бактериальной клетки из простых углеродсодержащих соединений. Для нормальной жизнедеятельности любому живому организму необходимы структурные фрагменты и энергия. Реакции, ведущие к синтезу различных компонентов бактериальных клеток (например, полимеризация аминокислот в белки), представляют собой эндэргонические процессы, то есть процессы, не протекающие самопроизвольно, поскольку изменение в них свободной энергии Гиббса (AG) положительно. Спонтанно в живой клетке могут происходить только экзэргонические реакции, сопровождающиеся снижением содержания в ней свободной энергии. Иными словами, для синтеза нового клеточного материала отдельные синтетические реакции должны быть сопряжены с реакциями, в результате которых высвобождается энергия, идущая на этот синтез. Реакции, связанные с затратой энергии, реализуются через специальные макроэргические соединения. У бактерий таковыми являются нуклеозидтрифосфаты, ацилфосфаты и ацилтиоэфиры. Среди них наиболее важен АТФ, играющий роль своеобразной «разменной монеты» энергетического метаболизма. АТФ — термодинамически неустойчивая молекула и последовательно отщепляет фосфат с образованием аденозиндифосфата (АДФ) или аденозин-монофосфата (АМФ). Именно эта неустойчивость позволяет АТФ выполнять функцию переносчика химической энергии, необходимой для удовлетворения большей части энергетических потребностей клеток. Энергия каждой из двух этих фосфатных связей приблизительно равна 7,5 ккал, тогда как у обычных фосфатных связей она не превышает 2 ккал. Иными словами, для образования фосфатных связей АТФ требуется больше энергии, но и при их разрыве она выделяется в больших количествах. Другие макроэргические соединения бактериальных клеток: гуанозинтрифосфат (ГТФ), уридинтрифосфат (УТФ), цитидинтрифосфат (ЦТФ), дезокситими-динтрифосфат (дТТФ), ацетилфосфат, фосфоенолпируват, креатинфосфат, ацетилкоэнзим А (аце-тил-КоА). Долгое время считали, что единственный тип энергетической валюты — высокоэнергетические химические соединения, а среди них прежде всего АТФ, однако последние работы биоэнергетиков опровергли эту догму. Оказалось, что клетка располагает тремя типами энергетической валюты: наряду с АТФ такую роль выполняют протонный и натриевый потенциалы на биологических мембранах.
Синтез ( регенерация ) АТФ. Получение энергии в процессе фотосинтеза. Бактерии фототрофы. Реакции фотосинтеза. Стадии фотосинтеза. Световая и темновая фаза фотосинтеза. Синтез АТФ осуществляется тремя способами: фотосинтетическое фосфорилирование, окислительное фосфорилирование (сопряжённое с транспортом электронов по дыхательной цепи) и субстратное фосфорилирование.
В первых двух процессах преобразование поступившей с потоком электронов энергии в энергию
фосфоэфирных связей АТФ осуществляет особый фермент — АТФ-синтетаза. Этот фермент присутствует во всех мембранах, участвующих в преобразовании энергии (мембраны бактерий, митохондрий и хлоропластов).
АТФ-синтетаза катализирует присоединение неорганического фосфата (Фн) к АДФ, образование которого осуществляет аде-нилаткиназа (АМФ + АТФ = 2 АДФ).
Активность АТФ-синтетазы можно обнаружить по обратной реакции гидролиза АТФ: АТФ + Н20 = АДФ + Фн + Н+. Благодаря обратимости реакции фосфорилирования, накопившийся АТФ может быть использован для создания протонного градиента, обеспечивающего энергией движение жгутиков и осмотическую работу. Энергия также направляется для обратного переноса электронов, необходимого для восстановления никотинамидадениндинуклеотида (НАД) при использовании бактериями неорганических доноров электронов (S03, N03, Fe2+ и др.).
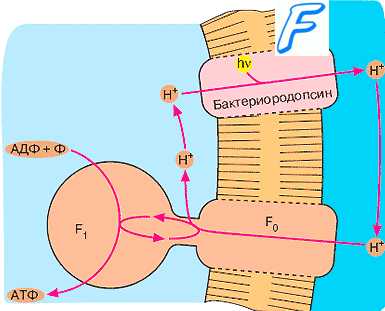 Получение энергии в процессе фотосинтеза. Бактерии фототрофы. Реакции фотосинтеза. Получение энергии в процессе фотосинтеза
Получение энергии в процессе фотосинтеза. Бактерии фототрофы. Реакции фотосинтеза. Получение энергии в процессе фотосинтеза. Основной источник энергии для жизни на Земле — Солнце, но непосредственно утилизировать энергию инсоляции в мире бактерий способны лишь немногочисленные
бактерии фототрофы [от греч. photos, свет, + trophe, питание]. Фотосинтезирующие бактерии, подобно растениям, превращают энергию видимого света в протонный потенциал на
энергопреобразующей мембране. В последующем с помощью
АТФ-синтетазы энергия консервируется в АТФ. Основной признак, отличающий фотосинтегические реакции у пурпурных и зелёных бактерий от таковых у растений и цианобактерий, — отсутствие выделения кислорода (так как в качестве донора электронов они используют не воду, a H2S или органические вещества). У бактерий аналог хлоропластов растительных клеток —
хроматофоры, содержащие
хлорофилл и каротиноидные пигменты.
Таким образом, под
фотосинтезом понимают происходящее в клетках фототрофных организмов преобразование световой энергии в биохимически доступную энергию (протонный градиент на мембране тилакоидов и хлоропластов, АТФ) и восстановительную силу НАДФН+, а также связанный с этим синтез клеточных компонентов.
Реакции фотосинтеза протекают в
две стадии (
световая и темновая фазы).
Световая фаза фотосинтеза. Под действием фотонов электрон хроматофора активируется, затем он возвращается в исходное состояние. При этом высвобождается энергия, используемая для создания протонного градиента, а затем синтеза АТФ и восстановления никотинамидадениндинуклеотидфосфата (НАДФ) до НАДФН+. Последнее может происходить за счёт обратного транспорта электронов с затратой АТФ.
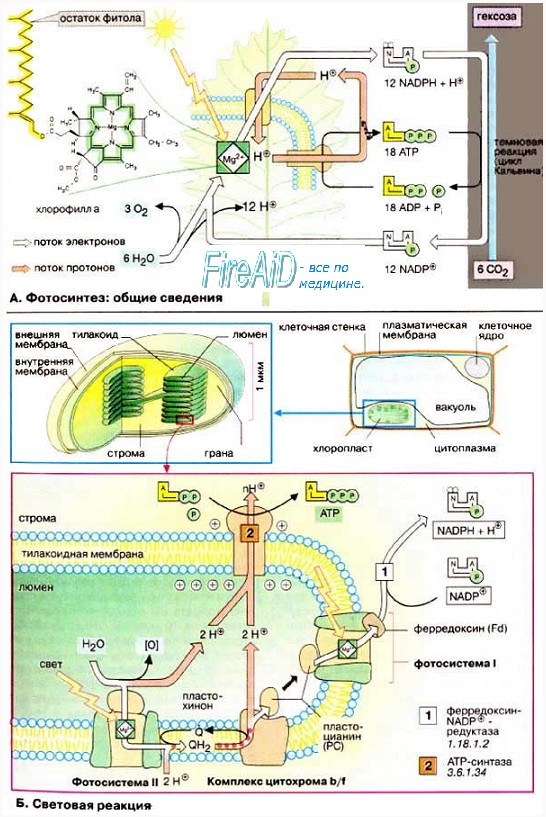 Темновая фаза фотосинтеза
Темновая фаза фотосинтеза. Образовавшиеся макроэргические соединения используются для ассимиляционного восстановления С02 в глюкозу. Глюкоза содержит значительное количество энергии (около 690 ккал/моль), что и используют гетеротрофные бактерии, разлагая глюкозу и запасая энергию в универсальном хранителе — АТФ.
Получение энергии при окислении химических соединений. Бактерии хемотрофы. Получение энергии субстратным фосфорилированием. Брожение. Преобладающую часть бактерий составляют
бактерии хемотрофы, получающие энергию в результате
окислительно-восстановительных реакций расщепления химических веществ, которые в ряде случаев служат для них также источником питания. Разные бактерии получают энергию либо в процессе брожения либо в процессе дыхания.
При брожении АТФ образуется исключительни путём
субстратного фосфорилирования, а в процессе дыхания преимущественно путём окислительного фосфорилирования за исключением начальных этапов превращения гексоз в триозы (гликолиз, см. ниже). Получение энергии субстратным фосфорилированием
Субстратное фосфорилирование может происходить при различных реакциях промежуточного метаболизма. При дегидрировании некоторых определённых субстратов часть энергии, освободившейся при окислении, сохраняется в форме высокоэнергетического фосфата. Богатая энергией фосфатная группа затем переносится на АДФ с образованием АТФ. Такой процесс называют фосфорилированием на уровне субстрата (
субстратное фосфорилирование).
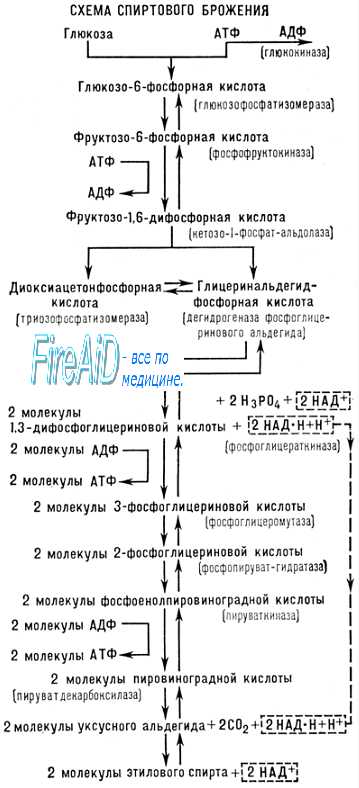
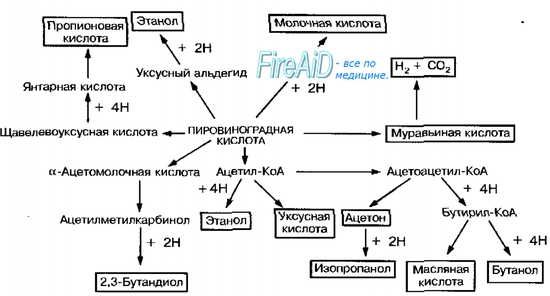 Рис. 4-7. Пути восстановления пирувата в процессе брожения.
Рис. 4-7. Пути восстановления пирувата в процессе брожения.В обмене углеводов важнейшие реакции, приводящие к регенерации АТФ, катализируют фосфоглицераткиназа (1,3-бифосфоглицерат + АДФ - 3-фосфоглицерат + АТФ), пируваткиназа (фосфоэнолпируват + АДФ = пируват + АТФ) и ацетаткиназа (ацетилфосфат или бутирилфосфат + АДФ = ацетат или бутират + АТФ). Бактерии и дрожжи,
сбраживающие сахара, располагают лишь тем
АТФ, который получается с помощью этих ферментов.
Брожение.
При брожении происходит анаэробное разложение углеводов и образование АТФ посредством субстратного фосфорилирования. Брожение характерно для факультативных и облигатных анаэробов. При брожении продукты расщепления органического субстрата могут служить одновременно и донорами и акцепторами водорода. Отдельные этапы окисления представляют собой дегидрирование, при котором водород переносится на НАД. Акцепторами водорода в составе НАДН+ служат промежуточные продукты расщепления субстрата. Кислород подавляет брожение, и оно у факультативных анаэробов сменяется дыханием.
По выходу энергии брожение уступает дыхательному метаболизму: при сбраживании микроорганизмами 1 моля глюкозы образуется от 1 до 4 молей АТФ. Для сравнения; у дрожжей на 1 моль сброженной глюкозы образуется 2 моля АТФ, а при дыхании — 38. При ферментации субстратов в среде накапливаются конечные продукты (лактат, бутират, ацетон, 2-пропанол, этанол, ацетоин и др.). Определение природы этих продуктов— важный момент для идентификация анаэробов. Например, образование ацетоина определяют в
реакции Фогеса-Проскауэра, кислотообразование — в тесте с метиловым красным, индолообразование —
по методу Грациана. Применяют и другие тесты, разработанные для идентификации бактерий.
Любое брожение проходит две стадии: первая (окисление) включает превращение глюкозы в пировиноградную кислоту, вторая (восстановление) — присоединение атомов водорода для восстановления пировиноградной кислоты (рис. 4-7). Сам процесс образования пировиноградной кислоты включает серию реакций, общих для брожения и аэробного дыхания. У микроорганизмов выделяют три пути образования триоз (пировиноградной кислоты и глицеральдегидфосфата) из углеводов: гликолитичес-кий (фруктозо-1,6-бифосфатный), пентозофосфатный и 2-кето-З-дезокси-б-фосфоглюконатный (КДФГ-путь, путь Энтнера-Дудорова-Парнаса). Согласно образующимся продуктам, брожение разделяют на следующие типы.
Спиртовое брожение. Гомоферментативное молочнокислое брожение. Гетероферментативное брожение. Муравьинокислое брожение. Спиртовое брожение включает превращение пирувата в С02 и этанол. В течение многих веков способность дрожжей (особенно Saccharomyces cerevisiae) утилизировать глюкозу в анаэробных условиях с высоким выходом этанола и углекислоты применяют в пивоварении и виноделии. Аналогично дрожжам образует этанол Sarcina ventriculi. Бактерии кишечной группы, молочнокислые бактерии и клостридии образуют этанол в качестве побочного продукта сбраживания сахаров.
 Гомоферментативное молочнокислое брожение
Гомоферментативное молочнокислое брожение (образуется практически только один продукт — молочная кислота) характерно для многих стрептококков и лактобацилл. Конечный продукт — молочная кислота — составляет не менее 90% всех продуктов брожения. В зависимости от стереоспецифичности лактатдегидрогеназы и наличия лактатрацемазы (фермент, переводящий один изомер в другой), могут образоваться различные изомеры молочной кислоты (D, L) или их смесь (DL-молочная кислота).
Гетероферментативное брожение (образуется смесь различных продуктов) характерно для бифидобактерий и молочнокислых бактерий, для рода Leuconostoc. Оно приводит к образованию молочной и уксусной кислот в ряде сходных процессов. Конечными продуктами могут быть дополнительно С02 и этанол, а при сбраживании фруктозы — маннитол.
 Гомоферментативное молочнокислое брожение
Гомоферментативное молочнокислое брожение (образуется практически только один продукт — молочная кислота) характерно для многих стрептококков и лактобацилл. Конечный продукт — молочная кислота — составляет не менее 90% всех продуктов брожения. В зависимости от стереоспецифичности лактатдегидрогеназы и наличия лактатрацемазы (фермент, переводящий один изомер в другой), могут образоваться различные изомеры молочной кислоты (D, L) или их смесь (DL-молочная кислота).
Муравьинокислое брожение. Этот тип брожения выделяют на том основании, что характерный, хотя и не главный продукт брожения — муравьиная кислота. Часто этот тип называют брожение смешанного типа, поскольку, кроме формиата, образуется ряд других органических кислот. Так, для большинства членов семейства Enterobacteriaceae характерно выделение муравьиной и других кислот. Индивидуальные признаки брожения, осуществляемого кишечной палочкой, — расщепление пирувата с образованием ацетил-КоА и формиата, разложение формиата на углекислоту и молекулярный водород, восстановление ацетил-КоА до этанола, и, в отличие от Enterobacter aerogenes, отсутствие способности образовывать из пирувата ацетоин и 2,3-бутандиол.
Катаболизм углеводов у бактерий. Гликолиз. Гликолитический путь окисления. Путь Эмбдена-Мейерхофа-Парнаса. Пентозофосфатный путь окисления. Схема Варбурга-Диккенса-Хореккера-Рэкера. В качестве источника питания и энергии при выращивании в искусственных условиях бакте рии наиболее часто используют
углеводы. Способность утилизировать различные
углеводы -важный диагностический признак. Базовый субстрат — глюкоза, которую бактерии разла гают в процессе дыхания либо брожения. Многие
реакции катаболизма глюкозы протекают одинаково у аэробных и анаэробных бактерий, в частности три пути превращения гексоз в триозы (гликолиз, пентозофосфатный путь и путь Энтнера-Дудорова).
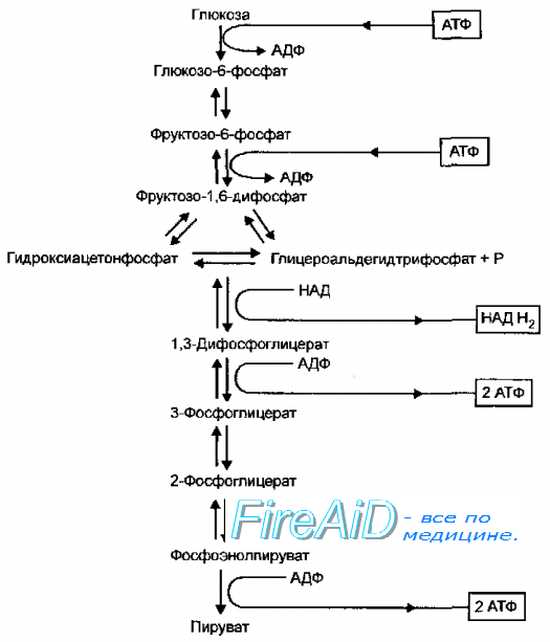 Рис. 4-8. Гликолиз (путь Эмбдена-Мейерхофа-Парнаса)
Рис. 4-8. Гликолиз (путь Эмбдена-Мейерхофа-Парнаса) Гликолиз. Гликолитический путь окисления. Путь Эмбдена-Мейерхофа-Парнаса.
Гликолитический путь (
гликолиз,
путь Эмбдена-Мейерхофа-Парнаса, фруктозо-1,6-дифосфатный путь) доминирует у большинства аэробных и анаэробных микроорганизмов — кишечной палочки, бацилл, пенициллов, дрожжей, стрептомицетов и многих других. Характерная реакция гликолиза — расщепление фруктозо-1,6-дифосфата альдолазой, в результате чего образуется смесь триозофосфатов, состоящая из дигидрооксиацетонфосфата и глицероальдегидтрифосфата, которые затем превращаются в пируват (рис. 4-8). Фермент обратной связи, лимитирующий скорость процесса, — фруктозо-6-фосфат дегидрогеназа (фосфофруктокиназа). В этом процессе образуется 2 моля АТФ и 2 моля восстановленного НАД (НАДН+ на 1 моль глюкозы.
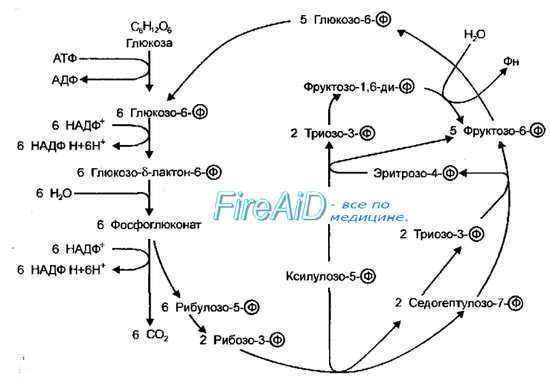 Рис. 4-9. Пентозофосфатный путь окисления. Схема Варбурга-Диккенса-Хореккера-Рэкера.
Рис. 4-9. Пентозофосфатный путь окисления. Схема Варбурга-Диккенса-Хореккера-Рэкера. Пентозофосфатный путь окисления. Схема Варбурга-Диккенса-Хореккера-Рэкера.
Пентозофосфатный путь (
схема Варбурга-Диккенса-Хореккера-Рэкера, фосфоглюконатный путь) включает не только образование пентозофосфатов, но и реакции превращения пентозофосфатов в триозо-3-фосфаты (рис. 4-9). В результате изомеризации фруктозо-6-фосфата в глюкозо-6-фосфат и конденсации двух молекул триозо-3-фосфата в гексозофосфат все перечисленные реакции замыкаются в цикл, при одном обороте которого из 3 молекул глюкозо-6-фосфата образуются 2 молекулы фруктозо-6-фосфата, одна молекула триозо-3-фосфата, 3 молекулы С02 и трижды по 2 восстановленных НАДФ (НАДФН+). Последовательность подобных превращений глюкозы у бактерий идентична таковой у высших организмов. Этот
путь катаболизма глюкозы следует рассматривать как второстепенный, но имеющий специальное назначение — источник пентоз для синтеза нуклеиновых кислот, а также источник восстановительных эквивалентов НАДФН+.
Катаболизм жиров и жирных кислот бактериями. Эндогенный энергетический метаболизм бактерий. Жиры (сложные эфиры глицерина и жирных кислот) и
воска (сложные эфиры жирных кислот и одноатомных спиртов) — восстановленные субстраты и доступны бактериям в качестве источников энергии. Первоначально эфиры жирных кислот гидролизуются до глицерина или одноатомного спирта и свободных жирных кислот (гидролиз катализируют внутри- и внеклеточные липазы). После фосфорилирования глицерин может включаться в гликолитический путь и утилизироваться с образованием АТФ.
Жирные кислоты метаболизируются через каскад окислительных реакций. Цель этих превращений — образование ацетил-КоА, вступающего в цикл Крёбса.
Эндогенный энергетический метаболизм
Большинство бактерий способно длительно выживать при отсутствии экзогенных
источников энергии. При этом бактерии нередко проявляют признаки активного метаболизма (например, сохраняют подвижность). Это связано со способностью бактерий продуцировать энергию
окислением внутриклеточных компонентов.
Основные
внутриклеточные эндогенные источники энергии — ЛПС, липиды и поли-В-масляная кислота. Они расщепляются деполимеризующими ферментами до мономеров, которые включаются в вышеперечисленные пути. Эффективность подобных превращений может быть выше традиционных. Например, при гликолизе внутриклеточного крахмала или гликогена на 1 моль глюкозы образуется 3 моля АТФ, а не 2, как при простом включении глюкозы в этот путь. Это объясняется тем, что в результате расщепления крахмала с помощью а-1,4-глюканфосфорилазы (фосфоролиза) образуется глюкозо-1-фосфат, превращающийся в глюкозо-6-фосфат ещё до вступления в путь Эмбдена-Мейерхофа-Парнаса. Следовательно, АТФ не затрачивается на его образование, и, значит, общий выход АТФ выше.
Конструктивный метаболизм ( пластический обмен ). Углеродные соединения для биосинтетических реакций бактерий. Биосинтез аминокислот и белков бактериями. Совокупность биосинтетических реакций включения низкомолекулярных соединений в клеточные полимеры составляет суть
конструктивного метаболизма. Комплекс этих реакций иногда называют
пластическим обменом.
Углеродные соединения для биосинтетических реакций бактерий Для
биосинтеза клеточных компонентов необходимы соответствующие низкомолекулярные соединения-предшественники (например, сахара или аминокислоты). При наличии таких предшественников в окружающей среде они непосредственно вовлекаются в различные биосинтети-че.ские пути. Однако гораздо чаще бактериям приходится предварительно синтезировать большую часть молекул-предшественников из доступных исходных продуктов. Огромное разнообразие субстратов, которые бактерии могут использовать в качестве источников питания, вытекает из широкого спектра их метаболических возможностей. Исходные продукты для биосинтеза образуются в ходе различных путей катаболизма, включая гликолиз, КДФГ-путь, пентозофос-фатный путь, окисление пирувата и ЦТК. Например, углеродные фрагменты из ЦТК — сукцинил-КоА и ацетил-КоА — используются соответственно для образования тетрапирролов и жирных кислот. Следует помнить, что подобное «изъятие» интермедиатов из ЦТК возможно лишь при постоянном восполнении их дефицита.
Биосинтез аминокислот и белков бактериями
Аминокислоты. Большинство свободно живущих бактерий способно синтезировать все необходимые им аминокислоты. Теоретически все 20 необходимых аминокислот могут находиться в окружающей среде и быть доступными для утилизации. Кроме того, бактерии способны получать аминокислоты из белковых молекул, расщепляя их бактериальными протеазами и пептидазами. Образующиеся при этом олигопептиды и аминокислоты транспортируются в клетку, где включаются в биосинтетические пути либо расщепляются на низкомолекулярные продукты. Паразитические бактерии потребляют готовые аминокислоты из организма хозяина. Бактериям, культивируемым на питательных средах, содержащих только неорганические источники азота или ограниченное количество аминокислот, приходится синтезировать некоторые из них (или даже все) из доступных азотсодержащих соединений. Основное назначение источников азота — поступление в бактериальную клетку «сырья» для формирования аминных (NH2) и иминных (NH) групп в молекулах аминокислот, нуклеотидов, гетероциклических оснований и других химических компонентов.
При этом азотсодержащие вещества, помимо сырья для
пластического обмена, могут включаться в энергетический метаболизм (например, у анаэробов некоторые аминокислоты могут образовывать окислительно-восстановительные системы). Наиболее доступные минеральные источники азота в природе — аммонийный ион (NH4+) и аммиак (NH3), легко проникающие в клетки и просто трансформирующиеся в амино- и иминогруппы, Основные исходные соединения для синтеза аминокислот — пируват (образуется в гликолитическом цикле), а-кетоглутарат и фумарат {образуются в ЦТК). При синтезе молекул аминокислот атом азота вводится на последних этапах биосинтеза путём переаминирования; лишь L-аланин, L-глутамат и аспартат образуются через прямое аминирование.
Пептиды и белки. Бактериальная клетка способна синтезировать несколько тысяч различных белков, каждый из которых содержит в среднем 200 аминокислотных остатков. Информация, направляющая синтез этих белков, закодирована в последовательности нуклеотидов ДНК. Синтез полипептидной цепи происходит в цитоплазме клетки на рибонуклеопротеидных частицах (рибосомах) в сочетании с молекулой мРНК или информационной РНК (иРНК), которая синтезируется на матрице ДНК в процессе транскрипции.
Бактериальная рибосома обладает массой 2,7*10
6 Д и состоит на 65% из рибосомной РНК (рРНК) и на 35% из белка (примерно 50 различных белков). Информация, содержащаяся в молекулах мРНК, транслируется в полипептидную цепь при участии особого класса молекул РНК, известных как тРНК. Многофункциональность тРНК позволяет им присоединяться к определённым аминокислотам, связываться с рибосомой и узнавать определённые последовательности из трёх нуклеотидов (кодон) в составе мРНК. Узнаваемый кодон соответствует конкретной аминокислоте; нужная аминокислота «подаётся» при помощи узнающей её молекулы тРНК к концу растущей полипептидной цепочки. Так растёт будущая молекула белка.
Пигменты бактерий.Многие микроорганизмы в процессе своей жизнедеятельности синтезируют пигменты, различающиеся по цвету, химическому составу и растворимости.
Если пигменты нерастворимы в воде, окрашивается только колонии микроба, растущая на питательной среде, а если растворимы - окрашивается и питательная среда.
Цвет пигмента используется в качестве теста для идентификации пигментообразующих бактерий.
Пигменты обеспечивают: