Известны два типа иммунокомплексных повреждений: 1) при поступлении в организм экзогенного антигена (чужеродный белок, бактерия, вирус) и 2) при образовании антител против собственных антигенов (эндогенные). Заболевания, развитие которых обусловлено иммунными комплексами, могут быть генерализованными, если иммунные комплексы образуются в крови и осе-Дают во многих органах, или местными, когда иммунные комплексы локализованы в отдельных органах, таких как почки (гломе-РУлонефрит), суставы (артрит) или мелкие кровеносные сосуды
к°Жи (местная реакция Артюса).
Схема 28. РеакциигиперчувствительностиIIIтипа— иммунокомплексныереакции Системнаяиместнаяиммунокомплексная болезньСистемная иммунокомплексная болезнь.
Системнаяиместнаяиммунокомплексная болезньСистемная иммунокомплексная болезнь. Одной из ее разновидностей является острая сывороточная болезнь, которая часто возникает в результате многократного введения большого количества чужеродной сыворотки крови, используемой для пассивной иммунизации.
Патогенез системной иммунокомплексной болезни складывается из трех фаз:
▲ образование в крови комплексов антиген — антитело;
▲ осаждение иммунных комплексов в различных тканях;
▲ воспалительная реакция в разных частях тела.
Первая фаза начинается с попадания антигена в кровь и его взаимодействия с иммунокомпетентными клетками, приводящего к образованию антител. Приблизительно через 5 дней после введения сыворотки вырабатываются антитела против ее компонентов, которые, еще находясь в кровотоке, образуют комплексы антиген — антитело. Во вторую фазу эти комплексы оседают в различных тканях. Дальнейшее течение болезни определяют два фактора: 1) размеры иммунных комплексов и 2) состояние системы моноцитарных фагоцитов (СМФ).
Очень крупные комплексы образуются при значительном избытке антител, быстро удаляются из кровотока клетками СМФ и относительно безвредны. Наиболее патогенны мелкие и средних размеров комплексы, которые образуются при незначительном избытке антител, дольше циркулируют и не так жадно захватываются фагоцитирующими клетками.
В связи с тем что СМФ в норме разрушает циркулирующие иммунные комплексы, ее перегрузка или существенная дисфункция увеличивает возможность персистенции иммунных комплексов в кровотоке и их осаждение в тканях.
Кроме того, такие факторы, как заряд иммунных комплексов (анионный или катионный полюс комплекса), валентность антигена, авидность антитела, аффинность антигена к компонентам различных тканей, трехмерная структура комплексов (решетка) и гемодинамические факторы, влияют на осаждение иммунных комплексов в тканях. Чаще всего иммунные комплексы оседают в почечных клубочках, а также в суставах, коже, сердце, серозных оболочках и мелких кровеносных сосудах.
Для того чтобы комплексы покинули систему кровообращения и осели в тканях, должна увеличиться проницаемость сосудистого русла. Во-первых, IgE-антитела, образовавшиеся вскоре после поступления в кровь антигена, связываются с циркулирующими базофилами, и происходит выброс гистамина и ФАТ. Эти медиаторы раздвигают эндотелиальные клетки, и иммунные комплексы проходят сквозь стенку сосудов. Как только иммунные комплексы оседают в тканях, они вызывают острую воспалительную реакцию. В эту фазу (приблизительно через 10 дней после введения антигена) наблюдаются клинические проявления болезни, такие как лихорадка, крапивница, артралгии, увеличение лимфатических узлов и протеинурия. Вслед за осаждением иммунных комплексов происходит активация системы комплемента с образованием его биологически активных компонентов.
Активация системы комплемента сопровождается провоспалительными эффектами: выбросом С3b-опсонина, способствующего фагоцитозу; образованием хемотаксических факторов, вызывающих миграцию полиморфно-ядерных лейкоцитов и моноцитов (С5, С5Ь67); выбросом анафилотоксинов (С3а и С5а), которые увеличивают проницаемость сосудов и вызывают сокращение гладких мышц; образованием мембраноатакующего комплекса (С5—9), вызывающего разрушение клеточных мембран и цитолиз.
Фагоцитоз комплексов антиген — антитело лейкоцитами приводит к выбросу или образованию различных дополнительных провоспалительных веществ, включая простагландины, сосудорасширяющие белки и хемотаксические вещества, например некоторые лизосомальные ферменты, в том числе протеазы, способные растворять базальную мембрану, коллаген, эластин и хрящ. Повреждение тканей опосредуется также свободными радикалами кислорода, продуцируемыми активированными нейтрофилами.
Иммунные комплексы вызывают агрегацию тромбоцитов и активацию фактора Хагемана, что приводит к усилению воспалительного процесса и образованию микротромбов. В результате развиваются васкулит, гломерулонефрит, артрит и т.п.
Все эти повреждения возникают при участии комплементсвязанных антител (IgG и IgM). Однако, так как IgA может активировать комплемент по альтернативному пути, IgA-содержащие комплексы также могут вызывать тканевые повреждения. Важная роль комплемента в патогенезе тканевых повреждений подтверждается наблюдением, что истощение комплемента в сыворотке крови (в эксперименте) обычно уменьшает выраженность повреждений.
В морфологической картине иммунокомплексного повреждения доминирует острый некротизирующий васкулит с образованием фибриноида и экссудацией нейтрофилов. Например, пораженные клубочки почки всегда увеличены вследствие набухания и пролиферации эндотелиальных и мезангиальных клеток, инфильтрации нейтрофилами и моноцитами. При иммунофлюоресцентной микроскопии иммунные комплексы видны в виде гранулярных депозитов иммуноглобулина и комплемента, а под электронным микроскопом — в виде электронно-плотных депозитов вдоль гломерулярной базальной мембраны. Если заболевание возникает после разовой массивной экспозиции антигена, например при остром постстрептококковом гломерулонефрите и острой сывороточной болезни, то все повреждения имеют тенденцию к разрешению благодаря катаболизму иммунных комплексов.
Для развития хронической иммунокомплексной болезни необходима постоянная антигенемия, так как иммунные комплексы чаще всего оседают в сосудистом русле. Это наблюдается при некоторых заболеваниях, таких, как системная красная волчанка, которая обусловлена персистенцией аутоантигенов. Часто, однако, несмотря на наличие характерных морфологических изменений и других признаков, свидетельствующих о развитии иммунокомплексной болезни, антиген остается неизвестным, например при ревматоидном артрите, узелковом периартериите, мембранозном гломерулонефрите и некоторых васкулитах.
Местная иммунокомплексная болезнь. Ее еще называют реакцией Артюса. Она заключается в местном некрозе ткани, возникающем вследствие острого иммунокомплексного васкулита. реакцию можно вызвать в эксперименте путем внутрикожного введения антигена иммунному животному, которое имеет циркулирующие антитела против антигена. Вследствие избытка антител, когда антиген проникает в стенки сосудов, образуются крупные иммунные комплексы, которые вызывают воспалительную реакцию. В отличие от IgE-опосредованных реакций гиперчувствительности I типа, которые возникают немедленно, реакция Артюса развивается в течение нескольких часов и достигает пика через
А—10 ч после инъекции. При иммунофлюоресцентном окрашивании удается выявить комплемент, иммуноглобулины и фибриноген, осажденные в стенках сосудов, обычно венул; при светооптическом исследовании — фибриноидный некроз сосудов. Разрыв сосудов приводит к возникновению кровоизлияний, но чаще наблюдается тромбоз, способствующий развитию местных ишемических повреждений.
РЕАКЦИИГИПЕРЧУВСТВИТЕЛЬНОСТИIVТИПАИММУНОКЛЕТОЧНЫЕРЕАКЦИИРеакции гиперчувствительности IV типа вызывают специфически сенсибилизированные Т-лимфоциты. К реакциям этого типа относятся классические замедленные реакции гиперчувствительности, вызываемые СD4
+Т-лимфоцитами, и прямая клеточная цитотоксичность, опосредованная СD8
+Т-лимфоцитами. Это основной тип иммунного ответа на различные внутриклеточные патогенные агенты, особенно микобактерии туберкулеза, а также на многие вирусы, грибы, простейшие и паразиты. Другими примерами являются контактная кожная чувствительность к химическим веществам и реакция отторжения. Описаны два варианта реакций гиперчувствительности IV типа.
Гиперчувствительность замедленного типа (схема 29). Хорошо известным примером такого варианта является реакция на введенный внутрикожно туберкулин — белково-липополисахаридный компонент микобактерии туберкулеза. У сенсибилизированного пациента через 8—12 ч возникают покраснение и уплотнение в месте введения, а пик реакции наступает через 24—72 ч. сильно сенсибилизированных больных в месте инъекции может развиться некроз. Гиперчувствительность замедленного типа (ГЗТ) характеризуется накоплением мононуклеарных клеток в дерме и подкожной основе (подкожно-жировая клетчатка). Наблюдается преимущественное накопление клеток вокруг мелких вен и венул с образованием характерных периваскулярных манжеток. Увеличение сосудистой проницаемости сопровождается образованием пор между эндотелиальными клетками. Выход белков плазмы за пределы сосудистого русла увеличивает отек дермы и сопровождается оседанием фибрина в интерстиции. С помощью иммунопероксидазного метода в участках повреждений обнаруживается преобладание СD4
+Т-лимфоцитов-хелпе-ров.
Схема 29. РеакциигиперчувствительностиIVтипа— гиперчувствительностьзамедленноготипа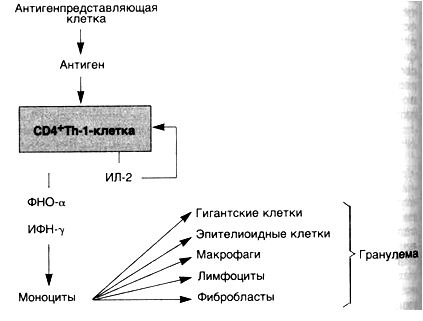
При персистенции антигена макрофаги часто трансформируются в эпителиоидные клетки, которые окружает вал из лимфоцитов — формируется гранулема. Такой тип воспаления характерен для реакций гиперчувствительности IV типа и называется
гранулематозным воспалением.Последовательность событий при ГЗТ можно рассмотреть на примере туберкулиновой реакции, которая начинается с первой встречи индивидуума с микобактериями туберкулеза. CD4
+T-лимфоциты распознают белки туберкулезной микобактерий, связанные с молекулами II класса на поверхности моноцитов или других антигенпредставляющих клеток. Эта первая встреча вызывает дифференцировку СD4
+Т-клеток в Th-1-клетки. Образование Th-1 -клеток является важным звеном в патогенезе ГЗТ,
так как ее дальнейшее развитие зависит от цитокинов, которые секретируются Th-1-клетками. У неиммунизированного хозяина микроорганизмы впервые подвергаются атаке макрофагами, что приводит в некоторых случаях к продукции ИЛ-12. Этот цитокин регулирует дифференцировку СD4
+Т-клеток в Th-1. Таким образом, развитие ГЗТ может быть связано с продукцией ИЛ-12. Сенсибилизированные Th-1-клетки поступают в кровоток и остаются там длительное время, иногда годами. В ответ на инъекцию туберкулина индивидууму, который имел раньше контакт с микобактериями туберкулеза, сенсибилизированные Th-1-клетки взаимодействуют с антигеном на поверхности антигенпредставляющих клеток и активируются, например подвергаются бласттрансформации и пролиферации. Эти изменения сопровождаются секрецией цитокинов, ответственных за ГЗТ.
ИФН-7 является наиболее важным медиатором ГЗТ и сильным активатором макрофагов. Активированные макрофаги обладают способностью к фагоцитозу и уничтожают микроорганизмы. На поверхности макрофагов имеются молекулы II класса, с помощью которых они способствуют представлению антигена. Возрастает их активность, направленная на элиминацию опухолевых клеток. Макрофаги секретируют некоторые полипептидные факторы роста, такие как тромбоцитарный фактор роста и трансформирующий фактор роста. Последний стимулирует пролиферацию фибробластов и усиливает синтез коллагена. Таким образом, активированные макрофаги обеспечивают элиминацию антигена, а если активация продолжается, то способствуют развитию фиброза и его отграничению.
ИЛ-2 вызывает аутокринную и паракринную пролиферацию Т-клеток, которые аккумулируются в местах развития ГЗТ, причем включение в инфильтрат антигенспецифических CD4+T-лимфоцитов активируется ИЛ-2.
ФНО-а и лимфотоксин являются цитокинами, оказывающими воздействие на эндотелиальные клетки. Повышенная секреция простациклина эндотелиальными клетками приводит к увеличению кровотока в результате вызываемого им расширения сосудов. Наблюдается усиление экспрессии адгезивной молекулы Е-селектина (ELAM-1), что способствует прикреплению пришлых лимфоцитов и моноцитов. Происходит усиление секреции низкомолекулярных хемотаксических факторов, например ИЛ-8. Все эти изменения в эндотелии способствуют выходу лимфоцитов и моноцитов за пределы сосудистого русла в места развития реакции ГЗТ. ФНО-а также играет важную роль в образовании гранулем.
Этот тип гиперчувствительности является главным механизмом защиты от различных внутриклеточных патогенных агентов, включая микобактерии, грибы и некоторых паразитов, а также может участвовать в отторжении трансплантата и опухолевом иммунитете.
Цитотоксичность, опосредованная Т-лимфоцитами. При данной цитотоксичности сенсибилизированные СD8
+Т-лимфоциты уничтожают клетки-мишени, которые являются носителями антигена. Такие эффекторные клетки называют цитотоксическими Т-лимфоцитами (ЦТЛ). Т-лимфоциты, направленные против антигенов гистосовместимости на поверхности клеток, играют важную роль в отторжении трансплантата. Они также участвуют в защите от вирусных инфекций. В клетках, пораженных вирусом, вирусные пептиды связываются с молекулами I класса и в виде комплексов транспортируются к поверхности клетки. Этот комплекс распознается CD8
+ЦТЛ. Лизис зараженных клеток завершается до репликации вируса, что приводит к уничтожению инфекции. Полагают, что многие опухолевые антигены также могут быть представлены на поверхности клеток, а ЦТЛ могут участвовать и в противоопухолевом иммунитете.
ОтторжениетрансплантатаВ отторжении трансплантата принимают участие некоторые реакции гиперчувствительности (схема 30). Реакция отторжения зависит от распознавания хозяином пересаженной ткани как чужеродной. Антигенами, ответственными за такое отторжение у человека, являются антигены главного комплекса гистосовместимости (HLA). Отторжение трансплантата — сложный процесс, во время которого имеют значение как клеточный иммунитет, так и циркулирующие антитела.
Схема 30. Отторжениетрансплантата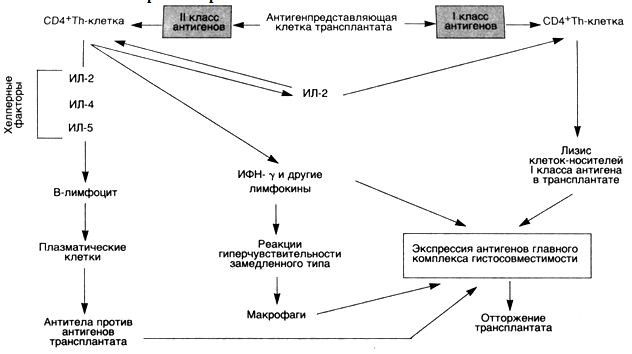 Реакции, обусловленные Т-лимфоцитами.
Реакции, обусловленные Т-лимфоцитами. Активированные СD4
+Т-хелперы участвуют в активации CD8+ ЦТЛ. Развитие реакций, опосредованных Т-лимфоцитами, происходит при встрече лимфоцитов реципиента с антигенами HLA донора. Полагают, что наиболее важными иммуногенами являются дендритические клетки в донорских органах. Т-клетки хозяина встречаются с дендритическими клетками в пересаженном органе, а затем мигрируют в регионарные лимфатические узлы. Предшественники СШ+ЦТЛ (прекиллеры Т-клеток), обладающие рецепторами к HLA-антигенам I класса, дифференцируются в зрелые ЦТЛ. Процесс дифференцировки сложен и не совсем понятен. В нем участвуют антигенпредставляющие клетки, Т-лимфоциты и цитокины ИЛ-2, ИЛ-4 и ИЛ-5. Зрелые ЦТЛ лизируют пересаженную ткань. Кроме специфических ЦТЛ, образуются лимфокинсекретирующие СО4
+Т-лимфоциты, которые играют исключительно важную роль в отторжении трансплантата. Как и при замедленной реакции гиперчувствительности, активированные СО4
+Т-лимфоциты выделяют цитокины, вызывающие повышение сосудистой проницаемости и местное скопление мононуклеарных клеток (лимфоцитов и макрофагов). Считают, что ГЗТ, проявляющаяся повреждением микрососудов, ишемией и деструкцией тканей, является наиболее важным механизмом деструкции трансплантата. Более вероятно, однако, что относительная важность цитотоксичности, связанной с СБ8
+Т-лимфоцитами, по сравнению с реакциями, обусловленными СО4
+Т-лимфоцитами, зависит от природы несоответствия HLA донора и HLA реципиента.
Реакции, обусловленные антителами. Эти реакции могут протекать в двух вариантах. Сверхострое отторжение развивается в том случае, если в крови реципиента имеются антитела против донора. Такие антитела могут встречаться у реципиента, у которого уже было отторжение трансплантата. Предшествующие переливания крови от HLA-неидентифицированных доноров также могут привести к сенсибилизации вследствие того, что тромбоциты и лейкоциты особенно богаты HLA-антигенами. В таких случаях отторжение развивается немедленно после трансплантации, так как циркулирующие антитела образуют иммунные комплексы, которые оседают в эндотелии сосудов пересаженного органа. Затем происходит фиксация комплемента и развивается реакция Артюса.
У реципиентов, которые не были предварительно сенсибилизированы к антигенам трансплантата, экспозиция донорских HLA-антигенов I и II класса сопровождается образованием антител. Антитела, образованные реципиентами, могут вызывать повреждение с помощью нескольких механизмов, в том числе комплементзависимой цитотоксичности, антителозависимого, обусловленного клетками цитолиза и выпадения комплексов антиген — антитело. Изначально мишенью для этих антител служат сосуды трансплантата, поэтому феномен антителозависимого отторжения (например, в почке) представлен васкулитом.