Лекция 16ВОСПАЛЕНИЕ, РЕГЕНЕРАЦИЯИДИСРЕГЕНЕРАЦИЯВзаимоотношения воспаления, регенерации и дисрегенерации изучаются на принципах системного анализа соединительной ткани [Серов В.В., Шехтер А.Б., 1981, 1991].
Системный анализ позволяет рассматривать соединительную ткань как саморегулирующуюся систему, функционирующую в норме и патологии на основе кооперативного взаимодействия клеток (фибробласты, макрофаги, тучные клетки, лимфоциты, эндотелий микрососудов) между собой, с межклеточным матриксом (коллаген, протеогликаны, фибронектин и др.), с клетками
крови и с паренхимой органов на основе обратных связей. Результаты этого анализа свидетельствуют о том, что в процессе репаративной регенерации проявляется единство воспаления, регенерации и фиброза, которые по существу являются неразрывными компонентами целостной тканевой реакции на повреждение. Эта реакция осуществляется с помощью
динамической саморегулирующейся системы со стереотипной кинетикой (схема 23), причем она принципиально не зависит от типа повреждающего фактора (механическая или термическая травма, инфекции, экзо- и эндотоксины, циркуляторные нарушения), хотя он и определяет некоторое своеобразие реакции.
Схема 23. Кинетикавоспалительно-репаративнойреакции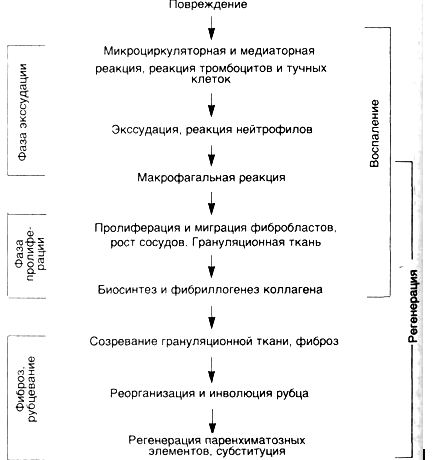
Каждая из фаз причинно-следственной цепи подготавливает и "запускает" следующую, определяя интенсивность и распространенность ее реализации. Непрерывно осуществляемая на каждом этапе ауторегуляции с помощью межклеточных взаимодействий обеспечивает в целом
адекватность воспаления —
повреждению, регенерации —
воспалению, фиброзного этапа регенерации—
ее пролиферативному этапу. Конечной целью этой "автоматической" реакции является ликвидация повреждения, т.е. максимальное анатомическое восстановление ткани с минимальными в данных условиях функциональными потерями.
Механизмы воспаления и репаративной регенерации эволюционно основаны на механизмах физиологического воспаления и физиологической регенерации.
Репаративная регенерация является регенерацией при патологических состояниях. В неосложненных случаях она остается
стереотипным, адекватным процессом защитно-приспособительного характера, т.е. адаптивной регенерацией, хотя и несет в себе элементы повреждения. Это распространяется на
заместительную регенерацию путем рубцевания (субституцию), за исключением случаев, когда рубец (например, в проводящей системе сердца) резко нарушает функцию органа.
АДАПТИВНАЯРЕГЕНЕРАЦИЯСледует отметить
неразрывное единство воспалительного и собственно репаративного компонента в целостной реакции: пролиферативная фаза воспаления одновременно является и фазой репаративной реакции. Воспаление и регенерация разделены лишь условно, все фазы процесса по времени накладываются друг на друга (см. схему 23): пролиферация фибробластов начинается уже в первые сутки после повреждения, а экссудация и инфильтрация, постепенно уменьшаясь, остаются практически до окончания заживления. Условно также разделение регенерации и фиброза, особенно при заместительной регенерации. В пространстве (в разных участках ткани и слоях раны) процессы экссудации, пролиферации и фиброза идут с разной скоростью, поэтому они могут протекать одновременно. При этом все компоненты взаимозависимы — пролонгация или хронизация воспаления тормозит регенерацию, несостоятельность регенерации или фиброза пролонгирует воспаление или придает ему хроническое течение. Воспаление, регенерация и фиброз находятся, по-видимому, в реципрокных отношениях.
В ранних фазах воспаления важнейшую роль в клеточном ансамбле играют тучные клетки, нейтрофилы и Макрофаги (МФ), которые взаимодействуют между собой не только через клеточные медиаторы (короткодистантное и отдаленное взаимодействие), но и посредством прямых межклеточных контактов, часто выявляющихся при ультраструктурном исследовании. Функциональная роль подобных контактов, видимо, неоднозначна: в одних случаях — это "предъявление" антигена (МФ-лимфоцит), в других — последовательный или сочетанный фагоцитоз (нейтрофил — МФ), в третьих — передача определенных экономно секретируемых факторов или специфическое воздействие на рецепторы клеточных мембран. Для тучных клеток такими факторами могут быть гистамин, гепарин, хондроитинсульфаты, протеазы и другие субстанции; для лимфоцитов — лимфокины; для нейтрофилов и МФ — лизосомные ферменты, лизоцим, простагландины, лейкотриены, интерлейкины, многочисленные монокины и др.
■ Клеточные взаимодействия оказывают модулирующее (индукция или ингибиция) влияние на хемотаксис, размножение и функцию клеток инфильтрата.
Гистохимически и ультраструктурно во время взаимодействия клеток, в том числе контактного, отмечаются признаки активации как секреторной (экзоцитоз гранул, клазматоз и др.), так и фагоцитарной функции клеток (активация кислой фосфатазы и эстеразы, фагосомы, лизосомы, пиноцитоз, остаточные тельца и др.).
В разные фазы воспаления и регенерации по мере выхода на "арену" новых клеточных популяций меняются типы клеточных взаимодействий, роль "дирижера клеточных ансамблей" переходит от одних клеточных популяций к другим.
В фазу микроциркуляторной реакции ведущую регуляторную роль играют, по-видимому, тучные клетки; они способны к активным взаимодействиям с сосудистыми элементами, эозинофилами и нейтрофилами, лимфоцитами, МФ, фибробластами (ФБ), межклеточным матриксом, свертывающей системой крови, иммунной системой и др. Важную роль играют и тромбоциты , генерирующие тромбоксаны, и фактор, активирующий тромбоциты, — ФАТ (на самом деле включающий целый класс фосфолипидных медиаторов), который воздействует на нейтрофилы, эозинофилы, МФ, активируя их хемотаксис, агрегацию, продукцию супероксидных анионов, лейкотриенов, монокинов и др., а также на эндотелий и гладкие мышцы сосудов, на сами тромбоциты. Источником ФАТ являются также тучные клетки и базофилы, нейтрофилы, моноциты-макрофаги, эндотелий, что свидетельствует об обратной связи всех этих клеток. Следует упомянуть, что тромбоциты продуцируют и ряд факторов, усиливающих пролиферацию и хемотаксис МФ к очагу повреждения. Учитывая, что и тучные клетки через гистамин и лейкотриен В4 влияют на ФБ, следует полагать, что
подготовка репаративной фазы процесса начинается с самых ранних стадий воспаления.В нейтрофильной фазе воспаления особое значение приобретают нейтрофилы
(иногда эозинофилы),
формирующие "авангардную линию защиты организма" в области первичного повреждения. С одной стороны, гранулоциты весьма чувствительны к активации различными гуморальными и клеточными факторами, с другой — продукты стимулированных нейтрофилов активируют систему комплемента, хемотаксис, взаимодействуют с иммуноглобулинами G и А, калликреин-кининовой системой и системами свертывания и фибринолиза, фактором Хагемана, производными арахидоновой кислоты.
Хорошо известны взаимодействия нейтрофилов с лимфоцитами: выработка последними факторов торможения миграции нейтрофилов, усиление их бактерицидности, стимуляция кислородного метаболизма, влияние ферментов нейтрофила на бласттрансформацию лимфоцитов и т.д. Нейтрофилы взаимодействуют с тучными клетками, вызывая их дегрануляцию, а также с тромбоцитами.
Взаимодействие нейтрофилов и МФ
в разные фазы и при разных типах воспаления значительно варьирует: преобладают то активирующие, то тормозящие влияния. Стимуляция нейтрофилами хемотаксиса моноцитов, вероятно, является одной из ведущих причин смены этих клеточных популяций на "поле" воспаления. Лизоцим и фактор иммобилизации нейтрофилов, выделяемые мононуклеарами, тормозят хемотаксис нейтрофилов. Очевидно, между этими клеточными популяциями существует обратная связь, регулирующая развитие воспаления; нарушение ее ведет к пролонгации и хронизации процесса.
Взаимодействия нейтрофилов и ФБ неоднозначны. С одной стороны, нейтрофилы продуцируют пептид, активирующий рост ФБ и лейкотриен В4, усиливающий их миграцию, с другой — фактор ингибиции миграции. Опыт морфологического исследования свидетельствует, что пролиферация ФБ тормозится как при избытке (при гнойном воспалении), так и недостатке (например, при лазерной обработке раны) нейтрофилов. На межклеточный матрикс нейтрофилы воздействуют путем секреции коллагеназы, эластазы, нейтральных протеиназ, катепсинов, кислых гидролаз. Коллаген и его пептиды в свою очередь влияют на хемотаксис МФ и ФБ. Таким образом, нейтрофилы, реактивные и способные к быстрой мобилизации клетки, являющиеся источниками разнообразных медиаторов, поддерживают каскад реакций воспалительно-репаративного процесса.
Начиная с
макрофагальной фазы воспаления, роль ключевой клетки —
"дирижера клеточного ансамбля" —
переходит к МФ. Взаимодействия его с другими клеточными популяциями и межклеточным матриксом реализуются благодаря большому числу секретируемых МФ медиаторов — монокинов (известно
более 40). Следует еще раз подчеркнуть важнейшую роль МФ в сопряжении экссудативной и пролиферативной фаз воспаления с клеточным и гуморальным иммунитетом, регенерацией и фиброзом. В кооперации с нейтрофилами МФ осуществляют бактерицидную функцию и функцию детоксикации, очищают ткань от продуктов распада клеток и межклеточного матрикса путем фагоцитоза и внеклеточного лизиса с помощью секреции ферментов: коллагеназы, эластазы, нейтральных протеиназ, кислых гидролаз и др. Макрофаги отграничивают очаг повреждения от окружающих тканей, последовательно формируя нейтрофильно-макрофагальный, макрофагальный и макрофагально-фибробластический барьеры, предшествующие образованию грануляционной ткани. Через монокины МФ влияют на дифференцировку из стволовых клеток, миграцию, пролиферацию и функцию моноцитов (предшественников МФ), нейтрофилов и лимфоцитов. В кооперации с Т- и В-лимфоцитами МФ участвуют в иммунном ответе организма, тесно связанным с воспалением.
Сопряжение воспаления, регенерации и фиброза реализуется благодаря макрофагалъно-фибробластическому взаимодействию, играющему ключевую роль в регуляции роста и инволюции соединительной ткани. Эта регуляция основана на обратной связи между распадом и продукцией коллагена. Продукты распада коллагена образуются при повреждении тканей протеазами, стимулируют хемотаксис МФ. Последние фагоцитируют продукты распада и, активируясь, секретируют факторы роста ФБ и синтеза коллагена, передавая их ФБ, в том числе и посредством прямых межклеточных контактов. Среди этих факторов следующие:
▲ индукторы пролиферации ФБ;
▲ индукторы хемотаксиса ФБ;
▲ индукторы синтеза коллагена;
▲ ингибитор синтеза коллагена;
▲ индукторы продукции коллагеназы.
■ Макрофагально-фибробластическое взаимодействие ведет к миграции и ускоренной пролиферации фибробластов, их дифференцировке, синтезу и секреции коллагена и других компонентов матрикса, активному фибриллогенезу.
Помимо МФ, в развитие фибробластической реакции значительный вклад вносят лимфоциты,
особенно активирующиеся при иммунном взаимодействии Т-клетки. У лимфоцитов обнаружены Т-клеточный фактор роста ФБ, фибробластактивирующий фактор, лимфоцитарный хемотаксический фактор для ФБ, коллагенпродуцирующий фактор, В-клеточный ингибитор продукции коллагена, фибробластингибирующий фактор, ингибиторный фактор роста ФБ, продукты лимфоцитов и интерфероны, тормозящие хемотаксис, пролиферацию ФБ и синтез коллагена. Эти данные свидетельствуют о
регуляторной роли иммунных лимфоцитов в процессе роста соединительной ткани, что осуществляется ими во взаимодействии с МФ; монокины активируют лимфоциты, а лимфокины — МФ, стимулируя выработку в обеих популяциях соответствующих факторов для ФБ. Регуляторная функция лимфоцитов соответствует современным представлениям о роли этих клеток в регенерации [Бабаева А.Г., 1985].
По мере накопления ФБ рост их тормозится в результате остановки деления зрелых клеток, перешедших к биосинтезу коллагена. Новые же клетки не образуются из предшественников вследствие истощения ростковых факторов (клеток инфильтрата становится значительно меньше), а также благодаря выработке самими ФБ при их контактном взаимодействии ингибиторов роста — кейлонов.
Следует подчеркнуть, что
взаимодействие ФБ с МФ и лимфоцитами не является односторонним: фибробласты сами секретируют ряд веществ (фиброкинов), оказывающих стимулирующее или ингибирующее влияние на другие клетки, особенно на МФ. Среди них: колонийстимулирующий фактор, фактор роста МФ, фактор, индуцирующий дифференцировку моноцитов, фактор угнетения миграции МФ, интерлейкин-6.
Известно, что продукция межклеточного матрикса (коллагенов I, Ш, V типов, гликозамингликанов, фибронектина и др.) является прерогативой ФБ, однако
эта функция осуществляется кооперативно. В частности, фибронектин вырабатывается МФ, коллагены I, III, IV, V, VI и VIII типов — эпителиальными клетками (печени, легких и других органов), коллагены IV и V типов — МФ, лимфоцитами, нейтрофилами.
Следующий тип ауторегуляции роста соединительной ткани заключается в том, что функционально избыточные коллагеновые волокна в фазе рубцевания тесно взаимодействуют с цитолеммой ФБ, ингибируя синтез и секрецию коллагена, приводя к деструкции мембран и разрушению большей части клеток, к превращению оставшейся части их в малоактивные фиброциты. Одновременно
усиливается феномен фиброклазии, т.е. резорбции ФБ коллагеновых волокон путем их фагоцитоза или секреции коллагеназы. Такое "контактное ингибирование" ведет к остановке роста соединительной ткани, затем к ее перестройке (ремоделяции), когда в одних участках продолжается накопление волокон, а в других (функционально инертных) — их лизис, а затем — частичная или неполная инволюция рубца. Помимо ФБ, в коллагенолизе принимают участие эозинофилы, продуцирующие коллагеназу, лимфоциты и тучные клетки, вырабатывающие факторы, которые стимулируют коллагенолиз. Большую роль играют также МФ, которые не только секретируют коллагеназу, но и выделяют факторы, стимулирующие ее продукцию в ФБ и усиливающие фагоцитоз фибрилл фиброкластами.
■ На последних этапах воспалительно-репаративного процесса важнейшую роль приобретает паренхиматозно-стромальное взаимодействие.
Известно, что эпителий продуцирует коллагеназу, а стромальные клетки (лимфоциты, МФ и ФБ) секретируют факторы индукции и ингибиции регенерации эпителия и мышц. Имеется обширная литература о влиянии на паренхиматозные элементы коллагенов, особенно I, III, IV, V, VI, VIII типов, протеогликанов и фибронектина, регулирующих рост и функцию и определяющих архитектонику эпителиальной и мышечной ткани в молочной и поджелудочной железе, печени, коже, нервной системе и других органах.
Ведущая роль в росте и инволюции соединительной ткани в стромально-паренхиматозном взаимодействии принадлежит фибробластам. К ним, начиная с фазы пролиферации, переходит роль "дирижера клеточного ансамбля". Они становятся не только основными эффекторными, но и главными регуляторными клетками.
В соответствии с влиянием микроокружения и гуморальными стимулами ФБ меняет соотношение между своими альтернативными функциями (синтез всех микромолекул и ферментов, регулирующих фибриллогенез; продукция коллагеназы, эластазы и глюкуронидаз), контролируя таким образом темпы роста, фиброзирования и инволюции соединительной ткани, стромально-паренхиматозные взаимоотношения. В соответствии с концепцией "биомеханического соответствия" ФБ определяет не только состав, но и "архитектуру" межклеточного матрикса. Из этого вытекает
необходимость участия в регенерации специализированных фибробластов данной ткани, так как "пришлые" клетки формируют неспециализированную рубцовую ткань.
На определенном этапе воспалительно-репаративного процесса формируется особая, богатая сосудами, молодая соединительная ткань, которую называют грануляционной тканью.
Под грануляционной тканью понимают не только ткань, заполняющую раневые и язвенные дефекты кожи, но и близкую по структуре ткань, образующуюся при повреждении слизистых оболочек, переломах костей, организации гематом, тромбов, некрозов и инфарктов, воспалительного экссудата, инородных тел и т.д., а также вследствие хронических воспалительных процессов.
•
Грануляционная ткань — это своеобразный "временный орган", создаваемый организмом в условиях патологии для реализации защитной (барьерной) и репаративной функции соединительной ткани.
При формировании грануляционной ткани воспалительная реакция обычно адекватна повреждению. Последовательно протекает нейтрофильная, макрофагальная и пролиферативная (фибробластическая) стадии воспаления. Тяжи фибробластов постепенно заполняют дефект или замещают экссудат. Наблюдаются многочисленные макрофагально-фибробластические контакты. МФ и ФБ имеют ультраструктурные и гистохимические признаки функциональной активации. При этом рост микрососудов в грануляционной ткани осуществляется синхронно с пролиферацией фибробластов и всегда в сопровождении последних. Этот давно известный факт находит теперь объяснение в том, что на рост эндотелия и фибробластов воздействуют одинаковые факторы, секретируемые тромбоцитами, МФ, Т-лимфоцитами и другими клетками.
Дифференцировка фибробластов, продукция гликозаминогликанов, биосинтез, фибриллогенез и фиброгенез коллагена, взаимодействие волокон с фибробластами, ведущее к прекращению пролиферации, разрушению клеток и к фиброклазии, — все это завершается созреванием и фиброзно-рубцовой трансформацией грануляционной ткани, начинающейся с ее глубоких слоев. Происходит "перекалибровка" сосудистой сети с образованием артериовенозных анастомозов и регрессией большинства капилляров. Одновременно осуществляются контракция (сокращение) и (в случае дефекта кожи или слизистых оболочек) эпителизация грануляционной ткани, причем рост эпителия и созревание грануляций тесно взаимосвязаны.
При заживлении ран вторичным натяжением в условиях большого и глубокого открытого дефекта, не защищенного струпом, активная микробная инвазия и мощная воспалительная реакция (нагноение) рассматриваются как биологически целесообразный процесс очищения раны с участием бактериальных протеаз. Саморегулирующаяся стереотипная динамика воспалительно-репаративного процесса в этих случаях принципиально не нарушается, но в соответствии с выраженным повреждением все остальные звенья цепи (т.е. фазы процесса) интенсифицируются и пролонгируются, заживление затягивается. Грануляционная ткань продолжительное время имеет выраженные признаки воспаления и многослойную структуру: поверхностный лейкоцитарно-некротический слой, слой сосудистых петель, слой вертикальных сосудов, созревающий слой, слой горизонтальных фибробластов, фиброзный слой. Из этого следует, что при условии нормальной реактивности организма
заживление вторичным натяжением следует считать адаптивной реакцией, не выходящей за рамки гомеостатической функции соединительной ткани.
ДИСРЕГЕНЕРАЦИЯ•
Дисрегенерацию следует рассматривать как результат срыва адаптивной воспалительно-репаративной реакции.
Опыт изучения разнообразных патологических ситуаций свидетельствует о том, что в определенных условиях адаптивная воспалительно-репаративная реакция может перейти в хронический патологический процесс. Полом гомеостатических механизмов на разных уровнях регуляции (межклеточные взаимодействия, гуморальный, иммунный, нейротрофический) ведет к нарушению и извращению стереотипной кинетики процесса, разобщению воспаления и регенерации, неадекватному фиброзу. Процесс теряет защитно-приспособительный характер. ■ В этих условиях есть все основания говорить, что понятие "дисрегенерация" близко понятию "патологическая регенерация" (гипо- или гиперрегенерация), но неидентично ему: оно шире понятия "патологическая регенерация", но главное — в нем сокрыто появление нового качества — атипии. Поэтому дисрегенерация, вероятно, причастна к формированию как тканевой диспла-зии, так и метаплазии.
Проявления дисрегенерации условно можно разделить на несколько групп:
▲ выраженное торможение репарации с возможным рецидивированием — длительно не заживающие кожные раны и трофические язвы, хроническая язва желудка и других слизистых оболочек, замедленное заживление инфарктов и других очагов некроза органов и тканей и т.д.;
▲ хронические воспалительные процессы;
▲ склеротические процессы, если они имеют неадекватный и прогрессирующий характер и ведут к нарушению функции органа (цирроз печени, пневмосклероз, кардиосклероз, нефросклероз и др.).
Важно, что компоненты повреждения, воспаление и склероз имеются во всех группах. Особую группу составляют так называемые фиброматозы (келоидные рубцы, контрактура Дюпюитре-на, узелковый фиброзит, десмоид и т.д.), которые относят к псевдоопухолевым процессам (в развитии их важное значение имеет наследственная дисплазия, провоцирующими моментами являются травма, воспаление, ишемия).
Причины "перехода" адаптивной регенерации в дисрегенерацию (как общие, так и местные) различны:
▲ изменение реактивности организма;
▲ врожденная или приобретенная неполноценность хемотаксиса, фагоцитоза и секреции нейтрофилов и МФ;
▲ иммунные дефициты, нарушения ГЗТ или антителогенеза;
▲ нарушение межклеточных и межтканевых корреляций;
▲ неполноценность сложных систем регуляции пролиферации и хемотаксиса ФБ, биосинтеза, фибриллогенеза и лизиса коллагена;
▲нарушения нейроэндокринной регуляции.
Нередки сочетания этих причинных факторов. Большое значение имеют как величина, так и перманентность действия повреждающих факторов, что вызывает истощение защитных механизмов. Не меньшее значение имеют и недостаточность сосудистой или нервной трофики, наличие авитаминоза, сахарного диабета, угнетение кроветворения, облучение и др.
Результаты изучения проявлений дисрегенерации позволяют наряду с патогенетическими и морфологическими особенностями выделить важные общие закономерности, связанные с нарушением межклеточных взаимодействий [Шехтер А.Б., 1987]. В большинстве случаев наблюдается ослабленный и незавершенный фагоцитоз микроорганизмов нейтрофилами, в случае инфекции — снижение в них уровня гликогена, слабая активность щелочной и кислой фосфатаз, интенсивный распад клеток. Это свидетельствует о расстройстве нейтрофильного звена реакции, хотя количество клеток может быть большим. Страдает и макрофагальное звено регуляции. Миграция моноцитов замедлена, а содержание МФ часто значительно снижено, по-видимому, в связи с расстройством медиаторного взаимодействия и хемотаксиса. Фагоцитарная функция МФ угнетена. Резко замедляется очищение ткани от продуктов распада. Значительно уменьшено содержание МФ секреторного типа, количество макрофагально-фибробластических и других межклеточных контактов. Это приводит к выраженному торможению пролиферативной фазы процесса. Практически отсутствуют митозы ФБ, замедлена их диф-ференцировка в зрелые формы, отсутствуют или слабо выражены признаки секреции коллагена и протеогликанов, фибрилло- и фиброгенеза, созревания коллагеновых волокон. Малочисленностью миофибробластов обусловлено торможение контракции. Регенерация эпителия или мышечной ткани замедлена вследствие воспалительной инфильтрации, незрелости или вторичных некротических изменений грануляционной ткани, нарушения стромально-паренхиматозных взаимоотношений.
В этих условиях
формируется неполноценная грануляционная ткань. Она бедна фибробластами и волокнами, резко отечна, инфильтрирована нейтрофилами, а часто и лимфоцитами с Цитотоксическими свойствами. Вероятно, меняется спектр секреции лимфокинов с преобладанием ингибирующих, а не индуцирующих факторов. В части случаев при хроническом воспалении отмечается избыточная и персистирующая макрофагальная инфильтрация (особенно при гранулематозных процессах). Но в этих условиях макрофаги часто не стимулируют, а тормозят рост
ФБ и коллагеногенез (по-видимому, меняя спектр секретируемых монокинов), к тому же макрофаги усиливают коллагеноли-зис, поддерживая воспаление. Макрофагально-фибробластическое взаимодействие нарушается. В связи с сохраняющимся гипо-ксическим градиентом постоянно продолжается рост сосудов (иногда это приводит к гипергрануляциям), но гипоксия не устраняется. Причина этого — в значительно более выраженных, чем при остром воспалении, изменениях сосудов, особенно микроциркуляторных.
Для неполноценной соединительной ткани характерна нестойкость к вторичным некрозам. Она объясняется, кроме сосудистых и метаболических (преобладание катаболизма) расстройств, дефектным фибриллогенезом, проявляющимся в образовании поперечно исчерченных филаментарных агрегатов, нестойких к протеазам — зебровидных телец, которые продуцируются не только ФБ, но и клетками воспалительного инфильтрата. В связи с нарушением регуляции созревания и инволюции ткани возникает неравномерный склероз и гиалиноз с последующими "волнами" вторичного некроза и воспаления, принимающего хронический характер. Часто присоединяются гиперергические реакции, проявляющиеся фибриноидным некрозом стенок сосудов и ткани.
Воспалительная реакция приобретает черты хронического иммунного воспаления.Чередование неполноценного склероза, повторного некроза и обострения воспаления резко меняет структуру грануляционной ткани: исчезают вертикальные сосуды, образуются ячейки плотно расположенных измененных сосудов, окруженных разрушающимися Рубцовыми полями. Нарушаются коррелятивные взаимосвязи грануляционной ткани и эпителия. Волнообразное склерозирование и разрушение грануляционной и рубцовой ткани ярко проявляется при многих инфекционных и неинфекционных хронических воспалительных процессах, трофических язвах, хронических язвах желудка и др.
Во всех этих ситуациях в связи с нарушением описанных выше ауторегуляторных механизмов заживления
извращаются связи между повреждением, воспалением, регенерацией и фиброзом: персистирующее повреждение (некроз) ведет к хроническому воспалению, последнее — к незавершенной регенерации (формированию персистирующей грануляционной ткани), которая, в свою очередь, ведет к прогрессирующему склерозу, неполноценной грануляционной и фиброзной ткани, склонным к вторичной деструкции. "Порочный круг" замыкается (схема 24),
формируется патологическая самоподдерживающаяся система, выходящая в известной мере из-под регулирующего влияния организма, ведущая себя иногда "агрессивно". С большей полнотой эта схема относится к хроническому воспалению, незажившим дефектам, поствоспалительному склерозу и в меньшей мере — к склерозу органов, в которых дистрофические изменения паренхимы превалируют над воспалением и не формируется грануляционная ткань. Однако и последние можно считать проявлением (исходом) дисрегенерации.
Схема 24. Механизмдисрегенерации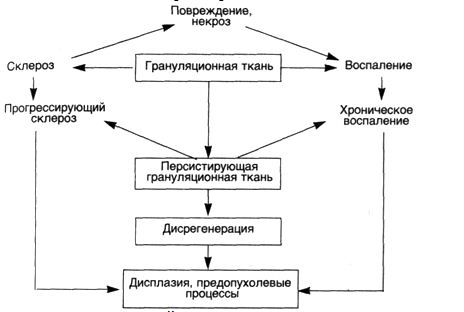 ПРОГРЕССИРУЮЩИЙСКЛЕРОЗ
ПРОГРЕССИРУЮЩИЙСКЛЕРОЗУсловия развития прогрессирующего склероза разнообразны; к ним относятся следующие:
▲ диффузное повреждение паренхимы, которое ведет к разрушению структурно-функциональных элементов (гистионов, или микрорайонов) и дезинтеграции паренхиматозно-стромального взаимодействия;
▲ длительное, постоянное или возобновляющееся действие внешних либо эндогенных факторов (персистирующая вирусная или бактериальная инфекция, токсины и др.), что приводит к перманентным дистрофическим процессам, изменению микрососудов, расстройству кровообращения, иногда хроническому воспалению;
▲ полом общих и локальных регуляторных систем;
▲ врожденные или приобретенные дефекты синтеза и метаболизма коллагена.
В конечном счете нарушается ауторегуляция роста соединительной ткани; индукция пролиферации клеток и коллагеногенеза начинает преобладать над ингибицией, а синтез коллагена — над его катаболизмом, что и приводит к прогрессированию склероза, завершающегося структурной перестройкой органа (цирроз). Подобная ситуация является
извращением морфогенетической функции соединительной ткани, которая как бы отмежевывается от паренхимы.В заключение следует подчеркнуть, что так же, как адекватная воспалительной репаративная реакция в основном сохраняет свою стереотипную динамику, несмотря на специфику повреждающих факторов, так и разные этиологические и патогенетические механизмы нарушения этой реакции ведут к принципиально близким морфогенетическим последствиям этого нарушения. Полом одного из звеньев последовательно ведет к изменениям всей цепи. Это необходимо учитывать при разработке комплекса лечебных мероприятий, которые должны включать как специфические методы, так и неспецифические воздействия на ключевые звенья воспалительно-репаративной реакции, усиливая ее гомеостатический характер или нормализуя патологические отклонения ее стереотипно.